22.Принцип Ле-Шателье. Влияние температуры, давления, концентрации веществ на смещение химического равновесия.
Принцип Ле-Шателье — внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется.
Увеличение давления смещает равновесие в сторону реакции, ведущей к уменьшению объема.
Повышение температуры смещает равновесие в сторону эндотермической реакции.
Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещают равновесие в строну прямой реакции.
Катализаторы не влияют на положение равновесия.
При известных ΔH реакции или при Δn ≠ 0 на химическое равновесие можно воздействовать изменением температуры или давления. Химическое равновесие может быть смещено изменением концентраций реагентов. Другими словами, равновесие можно сместить внешним воздействием, руководствуясь принципом Ле Шателье: если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону, противодействующую этому воздействию.
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем.
Влияние температуры. Для реакций, идущих с уменьшением энтальпии (экзотермических), повышение температуры будет препятствовать протеканию прямого процесса, то есть смещать реакцию в сторону исходных веществ. Эндотермические реакции при этом будут смещаться в сторону конечных продуктов. Например, при обычных условиях реакция N2 + O2 не идет (ΔH > 0), но повышение температуры может сделать эти реакцию осуществимой. Реакция CO + 1/2O2 = CO2, ΔH < 0 с повышением температуры будут смещаться в сторону исходных веществ.
Влияние давления
. Если реагируют газообразные вещества, то при неизменном числе молей начальных и конечных реагентов повышение общего давления не приведет к смещению равновесия. Если число молей при реакции меняется, то изменение общего давления приведет к смещению равновесия. В частности, реакция 2CO + O2 = 2CO2, протекающая с уменьшением Δn, при повышении общего давления сместится в сторону образования СO2. Влияние
концентраций.
В тех реакциях, в которых лучше оперировать
концентрациями (реакции в растворах),
увеличение концентраций исходных
веществ приводит к смещению равновесия
в сторону конечных продуктов и наоборот.
Так, в реакции этерификации (образование
сложного эфира) 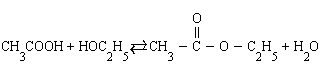
увеличение концентрации уксусной кислоты или этанола увеличивает выход этилацетата, а добавление в систему воды приводит к омылению, т. е. образованию исходных продуктов.
ВЫВОДЫ:
При повышении концентрации реагирующих веществ равновесие смещается в сторону образования продуктов;
При повышении концентрации продуктов реакции — в сторону образования исходных веществ;
При повышении давления — в сторону той реакции, при которой объем образующихся газообразных веществ меньше;
При повышении температуры — в сторону эндотермической реакции;
При понижении температуры — в сторону экзотермической реакции.
studfile.net
4.1.Влияние концентрации на смещение химического равновесия
Рассмотрим обратимую реакцию взаимодействия хлорида железа (III) (FeCl3) с роданидом аммония (NH4CNS)с образованием роданида железа (Fe(CNS)
3) и хлорида аммония (NH4Cl):FeCl3+3NH4CNS Fe (CNS) 3+3NH4Cl. (8)
Красное окрашивание роданида железа позволяет следить за сдвигом химического равновесия при изменении концентрации одного из реагентов или продуктов реакции.
Выполнениеопыта.
Налейте в пробирку 10 мл разбавленного раствора FeCl3 и добавьте 10 мл разбавленного раствораNH4CNS.
Разлейте раствор поровну в четыре пробирки. В первую добавьте несколько капель концентрированного раствора хлорида железа, во вторую ложечку сухого раствора роданида аммония, в третью насыпьте немного сухого хлорида аммония. Сравните окраску растворов в трех пробирках с окраской в четвертой контрольной пробирке и сделайте вывод о влиянии концентрации на смещение химического равновесия.
Таблица 1
Влияние концентрации веществ на смещение химического равновесия
№ пробирки | Добавление вещества | Изменение окраски роданида железа Fe(CNS) 3 | Смещение химического равновесия | ||
FeCl3 | NH4CNS | NH4Cl | |||
1 | FeCl3 конц. | — | — | Интенсивность окраски усиливается | вправо → |
2 | — | NH4CNS сухой | — | Интенсивность окраски усиливается | вправо → |
3 | — | — | NH4Cl Сухой | Интенсивность окраски ослабевает | влево ← |
4 | FeCl3 разбавл. | разбавл. | — | Раствор красного цвета | ↔ |
Вывод: При увеличении концентрации реагентов (FeCl3илиNH4CNS) химическое равновесие смещается в сторону образования продуктов реакции. Наблюдаем усиление интенсивности окраски раствора. При увеличении концентрации одного из продуктов реакции (NH4Cl) химическое равновесие смещается в сторону реагентов. Наблюдаем ослабление интенсивности окраски раствора.
4.2. Зависимость скорости реакции от концентрации реагирующих веществ
Изучим зависимость скорости разложения тиосерной кислоты от концентрации реагирующих веществ. Тиосульфат натрия Na2S2O3устойчив в кристаллическом состоянии и в не слишком кислотных растворах. В кислотных растворах образуется тиосерная кислота:
Na2S2O3+ H
2SO4= H2S2O3+ Na2S2O4,или
S2O32- + 2H+= H2S2O3. (9)
Эта реакция проходит быстро, но образующаяся тиосерная кислота неустойчива и самопроизвольно разлагается с образованием серы и сернистой кислоты:
H2S2O3=S+ H2SO3. (10)
Эта реакция проходит сравнительно медленно, за ее прохождением удобно следить по образованию суспензии серы. Скорость образования серы зависит от концентрации кислоты, температуры и других факторов.
Можно предположить, что образование серы проходит по реакции, описываемой уравнением, получаемым объединением уравнений (9) и (10):
S2O32- + 2H+
Если проходит именно такая реакция, то ее скорость будет определяться кинетическим уравнением
v=k СS2O32-С2H+, (12)
и при экспериментальном подтверждении можно предположить, что реакция проходит именно по уравнению (12).
Постановка эксперимента основывается на том, что по плотности суспензии серы судят о количестве разложившейся тиосерной кислоты.
Опыты проводятся в колбе, на стенке которой нанесена цветная (черная или синяя) полоска. В начале опыта эта полоска четко просматривается через прозрачный раствор Na2S2O3. После добавления в раствор серной кислоты начинается постепенное образование суспензии серы, раствор становится мутным и цветная полоска, которую рассматривают сквозь раствор, становится невидимой. При этом следует стараться отсчет времени продолжать каждый раз до одинаковой мутности раствора.
Выполнение. Опыты проводим с постоянной концентрацией серной кислоты и различной концентрацией тиосульфата натрия (табл.2).
1). В пробирку влить из бюретки 10 мл раствора H2SO4, а в колбу — 5 мл раствораNa2S2O3и 10 млH2O. Раствор серной кислоты быстро вылейте из пробирки в колбу с раствором тиосульфата натрия. Тотчас начните отсчет времени по секундомеру, одновременно осторожно перемешивайте раствор пробиркой-трубочкой, опустив ее 2-3 раза до дна колбы.
Продолжая отсчет времени, наблюдайте за цветной полоской через слой раствора в колбе. В тот момент, когда полоска перестает просматриваться через раствор, запишите время (Δτ) прохождения реакции. Вылейте раствор из колбы, промойте ее водой, протирая ершиком для удаления осадка серы со стенок колбы (предполагают, что сера катализирует разложение тиосерной кислоты).
2). Проведите опыты с большей концентрацией тиосульфата натрия. Сначала увеличьте концентрацию тиосульфата в 2 раза (10 мл раствора тиосульфата натрия и 5 мл воды), затем в 3 раза ( 15 мл раствора тиосульфата натрия) (табл.2).
3). Сведите все данные в таблицу (табл.2), записывая в нее объемы исходных растворов и дистиллированной воды, время прохождения реакции (Δτ) и скорость реакции, условно приняв ее равной обратному времени (1/ Δτ).
Таблица 2
Относительная концентрация Сотн | Объемы исходных растворов, мл | время прохождения реакции Δτ, с | Скорость реакции v (v=1/ Δτ), с-1 | ||
вливается в одну колбу | в пробирку | ||||
Na2S2O3 | H2O | H2SO4 | |||
1 | 5 | 10 | 10 | ||
2 | 10 | 5 | 10 | ||
3 | 15 | 0 | 10 | ||
4). Постройте график зависимости скорости прохождения реакции (1/Δτ) от относительной концентрации раствора (С). Для этого на лист миллиметровой бумаги нанесите две прямоугольные оси координат. По оси абсцисс (ось x) отложите независимую переменную С, т.е. величину, задаваемую самим экспериментатором. По оси ординат (осьy) отложите определяемую величину 1/Δτ.
На осях координат указывается символ величины, и рядом, после запятой, единица измерения, причем десятичный множитель относится к единице измерения (рис.). Числовые значения экспериментальных точек ни на оси координат, ни рядом с точкой не записываются.
 v∙10-4, с-1
v∙10-4, с-1

 3
3
 2
2



 1 …
1 …
1 2 3 Сотн
Рис. Пример зависимости скорости реакции от концентрации реагирующих веществ.
Масштабы на координатных осях следует выбирать так, чтобы координаты любой точки на графике определялись легко и быстро без ненужных расчетов. Наиболее удобно расстояние между двумя соседними делениями выбирать так, чтобы оно составляло одну, две, пять, десять единиц измеренной величины, или же равнялось тем же числам, умноженным на постоянный множитель 10±n, гдеn– целое число.
Масштаб должен быть таким, чтобы экспериментальные точки не сливались друг с другом и, по возможности, располагались по диагонали графика, т.е. таким образом, чтобы угол наклона кривых на графике был близок 450 (рис.).
5). Сделайте вывод о влиянии концентрации тиосульфата натрия на скорость реакции.
ЛИТЕРАТУРА
Зайцев О.С. Исследовательский практикум по общей химии. Учеб.пособие. М.: Изд-во МГУ, 1994, 480 с.
Глинка Н.Л. Общая химия:Учебное пособие для вузов./ Под ред. В.А.Рабиновича. Л.: Химия, 1983, 704 с.
Глинка Н.Л. Задачи и упражнения по общей химии. Учебное пособие для вузов./ Под ред. В.А.Рабиновича и Х.М.Рубиной. Л.: Химия, 1985, 264 с.
ОГЛАВЛЕНИЕ
1. Скорость химических реакций……..…………………………………………3
1.1. Зависимость скорости реакции от концентрации реагирующих веществ…………………………………………………………………….………3
1.2. Зависимость скорости реакции от температуры ……………………4
1.3 Влияние катализатора ………………………………………………..5
2. Химическое равновесие……….………………………………………………6
3. Смещение химического равновесия. Принцип Ле Шателье ………………..7
studfile.net
Условия смещения равновесия обратимых реакций
Сами по себе обратимые реакции редко представляют собой практический интерес, но в ряде случаев технологическая выгода или рентабельность производства требуют смещения равновесия той или иной обратимой реакции. Для смещения равновесия используют такие технологические приемы, как изменение концентрации реагентов, изменение давления, температуры.
Увеличение концентрации одного из реагирующих веществ (или обоих веществ) смещает равновесие в сторону образования продуктов реакции. Или наоборот, уменьшение концентрации продуктов реакции так же смещает равновесие в сторону их образования. Например для реакции :
H2+Cl2↔2HCl;
Увеличение концентрации H2 или Cl2 (а так же одновременно H2 и Cl2) или уменьшение концентрации НСl приведет к смещению данного равновесия слева направо, а для смещения равновесия справа налево необходимо или увеличить концентрацию НСl или уменьшить концентрации H2 , Cl2 или обоих веществ.
Влияние изменения давления на обратимую реакцию рассмотрим на примере реакции:
2N2 +Н2↔2NНз;
При увеличении давления на данную систему концентрации веществ увеличивается. В данном случае равновесие сместится в сторону меньших объемов. В левой части уравнения два объема азота реагируют с одним объемом водорода. В правой части уравнения имеется два объема аммиака ,т.е. количество объемов в правой части равновесной реакции меньше, чем в левой и, следовательно, при увеличении давления, равновесие реакции сместится вправо. Для реакции:
H2+Br2↔2HBr
Количество объемов в правой и в левой части уравнения равны (один объем водорода и один объем брома слева и два объема бромистого водорода справа) и увеличение давления не приведет к смещению равновесия ни слева направо, ни справа налево. Если дана равновесная реакция:
Cl2(r)+2HJ(r) ↔2HCl(r)+J2(TB)
Индексы (г) соответствуют газообразным веществам, а (тв)- веществу находящемуся в твердой фазе. Изменение давления на данную равновесную систему будет влиять на газообразные вещества (Сl2, HJ, НСl), а на вещества, находящиеся в твердом состоянии (J2) или в жидком (h30) давление не оказывает влияние. Поэтому для вышеуказанной реакции увеличение давления сместит равновесие в сторону меньших объемов, т.е. слева направо.
Повышение температуры увеличивает кинетическую энергию всех молекул, участвующих в реакции. Но молекулы вступающие в реакцию (эндотермическую) начинают взаимодействовать между собой быстрее. При повышении температуры равновесие смещается в сторону эндотермичесской реакции, при понижении температуры — в сторону экзометрической реакции. Рассмотрим равновесную реакцию:
+ Q СаСОз ↔CaO + CO2 -Q
в которой левая часть соответствует экзотермической реакции, а правая -эндотермической. При нагревании СаСОз происходит разложение этого вещества, следовательно, чем выше температура разложения СаСОз, тем концентрация СаО и СO2 становится большей, равновесие смещается к эндотермической части уравнения, то есть слева направо, и наоборот, при уменьшении температуры равновесие сместится в сторону экзотермической реакции, т.е. справа налево.
Изменения происходящие в равновесной системе в результате внешних воздействий, определяются принципом Ле Шателье
«Если на систему, находящуюся в химическом равновесии, оказывается внешнее воздействие, то оно приводит к смещению равновесия в сторону, противодействующей этому воздействию».
Введение в равновесную систему катализаторов не приводит к смещению равновесия.
Записаться на урок к Владимиру Павловичу
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
Лабораторная работа по теме «Химическое равновесие» 11 класс
Лабораторная работа по теме «Химическое равновесие».
Цель работы: Изучение химического равновесия на примере обратимых реакций, протекающих в водных растворах, а также экспериментальное подтверждение принципа Ле-Шателье.
Теория: Обратимые реакции одновременно протекают в двух взаимно противоположных направлениях. Обратимые реакции идут не до конца, а до установления химического равновесия. Химическое равновесие – это состояние системы, при котором скорость прямой реакции равно скорости обратной реакции.
Для любой равновесной системы: mA+nB ↔ pC+qD , где – константа равновесия; ,,, — равновесные концентрации реагентов.
Приведённое уравнение является математическим выражением закона действующих масс применительно к обратимым процессам. Величина K определяет глубину протекания процесса к моменту достижения равновесного состояния: чем больше K, тем больше степень превращения реагентов в продукты реакции. На состояние химического равновесия оказывают влияние концентрация реагирующих веществ, температура, а для газообразных веществ и давление в системе. При изменении одного из условий равновесие нарушается, и концентрации реагирующих веществ будут изменяться до тех пор, пока не установится новое положение равновесия (равновесные концентрации уже будут другими). Такой переход системы из одного равновесного состояния в другое называют смещением (или сдвигом) положения равновесия. Направление сдвига химического равновесия в результате изменения внешних условий определяется принципом подвижного равновесия, или
принципом Ле-Шателье: Если на систему, находящуюся в равновесии, производится какое-либо внешнее воздействие (изменяются концентрация, температура, давление), то это воздействие благоприятствует протеканию той из двух противоположных реакций, которая ослабляет произведённое воздействие.
Ход работы:
Опыт №1. Взаимодействие солей железа (III) с роданидом калия.
Внести в четыре пробирки по 6 капель сильно разбавленных растворов трихлорида железа (0.0025 H) и роданида калия и перемешать их содержимое стеклянной палочкой. Первая пробирка – эталон (ничего в неё не добавлять). Во вторую пробирку добавить 1 каплю насыщенного раствора трихлорида железа, в третью – 1 каплю насыщенного раствора роданида калия, в четвёртую – несколько кристалликов хлорида калия.
Обратимая реакция: FeCl3 + 3KCNS ↔ Fe(CNS)3 + 3KCl . Реакция сопровождается образованием роданида железа (III), окрашивающего раствор в тёмно-красный цвет. Изменение интенсивности окраски раствора свидетельствует о направлении смещения химического равновесия. Во второй пробирке я наблюдал потемнение содержимого по сравнению с эталоном. Это легко объясняется с помощью принципа Ле-Шателье: мы увеличили концентрацию тихлорида железа, а, значит, будет преобладать прямая реакция, при которой он расходуется, т.е. FeCl3 + 3KCNS → Fe(CNS)3 + 3KCl. Соответственно будет образовываться роданид железа (III), и раствор будет темнеть (тёмно- красный цвет). В третьей пробирке мы наблюдаем потемнение (более сильное, чем во второй) содержимого по сравнению с эталоном. Это тоже объясняется принципом Ле-Шателье: мы увеличили концентрацию роданида калия, а, значит, будет преобладать прямая реакция при которой он расходуется, т.е. FeCl3 + 3KCNS → Fe(CNS)3 + 3KCl. Соответственно будет образовываться роданид железа (III), и раствор будет темнеть. В четвёртой пробирке я наблюдал значительное посветление содержимого по сравнению с эталоном. Это также объясняется принципом Ле-Шателье: мы увеличили концентрацию хлорида калия, следовательно, будет преобладать обратная реакция, при которой он расходуется, т.е. FeCl3 + 3KCNS ← Fe(CNS)3 + 3KCl. Соответственно будет уменьшаться концентрация роданида железа (III), и раствор будет светлеть (Увеличение концентрации FeCl3 светло жёлтый цвет).
Опыт №2. Взаимодействие солей магния с раствором аммиака.
Внести в пробирку 4 капли раствора хлорида магния и по каплям добавлять раствор аммиака до появления белого осадка гидроксида магния. К полученному осадку добавлять по каплям концентрированный раствор хлорида аммония до растворения гидроксида магния. Затем по каплям к полученному добавлять раствор гидроксида натрия и наблюдаем образование осадка.
Обратимая реакция: MgCl2 + 2NH4OH ↔ Mg(OH)2 + 2NH4Cl Сначала у нас преобладала прямая реакция, в результате которой образовывался малорастворимый в воде гидроксид магния (концентрация гидроксида аммония увеличивалась – преобладала реакция, сопровождаемая его расходом), затем установилось химическое равновесие.
MgCl2 + 2NH4OH ↔ Mg(OH)2 + 2NH4Cl
К полученному мы добавляем концентрированный раствор хлорида аммония, смещая равновесие в сторону обратной реакции (мы увеличивали концентрацию хлорида аммония, следовательно, начала преобладать реакция, при которой он расходуется, т.е. обратная – по принципу Ле Шателье). А, значит, гидроксид магния растворялся по мере увеличения концентрации хлорида аммония. MgCl2 + 2NH4OH ← Mg(OH)2 + 2NH4Cl Затем к тому, что мы получили, нужно добавить гидроксид натрия. Так как гидроксид натрия гораздо «сильнее», чем гидроксид аммония, то в основном будет иметь место следующая реакция, аналогичная предыдущей. Причём в начале (по принципу Ле-Шателье) будет иметь место прямая реакция с образованием осадка гидроксида магния.
Опыт №3. Гидролиз трихлорида сурьмы.
В пробирку внесем 5 капель раствора тихлорида сурьмы и постепенно по каплям добавляем воду до образования белого осадка оксохлорида сурьмы. К образовавшемуся осадку добавляем по каплям соляную кислоту до его растворения. Обратимая реакция: SbCl3 + H2O ↔ SbOCl + 2HCl До установления химического равновесия, по принципу Ле-Шателье имела место прямая реакция (концентрация воды увеличивалась – преобладала реакция, сопровождаемая её расходом), которая сопровождалась образованием белого осадка оксохлорида сурьмы: SbCl3 + H2O → SbOCl + 2HCl
Затем к полученному мы добавляли по каплям соляную кислоту, смещая равновесие в сторону обратной реакции (т.к. мы увеличиваем концентрацию соляной кислоты). Соответственно начинает преобладать обратная реакция, и осадок оксохлорида сурьмы начинает растворяться: SbCl3 + H2O ← SbOCl + 2HCl .
Опыт № 4 Взаимодействие серной кислоты и гипосульфита натрия.
К пяти каплям гипосульфита натрия Na2S2O3 добавить такое же количество 2%-го раствора серной кислоты и обратить внимание на появляющееся через несколько секунд помутнение. С течением времени оно усиливается, так как возрастает концентрация выделяющейся серы.
Реакция протекает по следующему уравнению:
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + H2O + S↓
Полного помутнения при проведении реакции ждать не следует, поэтому определить через сколько секунд появится чёткая муть.
А. Зависимость скорости реакции от концентрации реагирующих веществ
Взять четыре пробирки и поместить в первую – 2, во вторую – 5, в третью – 10, в четвертую – 15 капель раствора гипосульфита натрия. Добавить в первую пробирку 13, во вторую – 10, в третью – 5 капель дистиллированной воды. Осторожно, но быстро, добавить в первую пробирку 5 капель 2%-го раствора серной кислоты и точно определить через сколько секунд после смешения реагентов появится муть. Эту операцию повторить со второй, третьей и четвертой пробирками, полученные данные занести в табл. 4.
Таблица 1
Данные опыта
Объём гипосульфита
натрия, капли
Объём воды,капли
Объём серной кислоты, капли
Время появления
мути, с
Скорость реакции 1/ t
На основании полученных данных сделать вывод о зависимости скорости реакции от концентрации реагирующих веществ.
Б. Зависимость скорости реакции от температуры
Поместить в пробирку 5 капель раствора гипосульфита натрия. Опустить её в химический стакан с водой, предварительно измерив температуру воды, а затем быстро, не вынимая пробирку с раствором гипосульфита натрия из стакана, добавить к нему 2 капли раствора серной кислоты и отметить через сколько секунд появится муть.
Эту же операцию повторить с тремя другими пробирками, повышая температуру воды в стакане каждый раз на 5 оС. Полученные результаты занести в табл. 2.
Таблица 2
Данные опыта
Номерпробирки
Объём гипосульфита натрия, капли
Объём серной кислоты, капли
Температура опыта, оС
Время
появления мути, с
Скорость реакции 1/ t
Исходя из полученных данных сделать вывод о влиянии температуры на скорость реакции.
Основные результаты:
На опытах был проверен принцип Ле- Шателье.
Выводы: Мы убедились , что с помощью изменения концентрации одного из реагирующих веществ, температуры можно управлять направлением химической реакции (по принципу Ле-Шателье).
infourok.ru
Химическое равновесие — это… Что такое Химическое равновесие?
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.[1]
А2 + В2 ⇄ 2AB
Смещение химического равновесия
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1885 году французским ученым Ле-Шателье.
Факторы влияющие на химическое равновесие:
1) температура
При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции.
CaCO3=CaO+CO2 -Q t↑ →, t↓ ←
N2+3H2↔2NH3 +Q t↑ ←, t↓ →
2) давление
При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
CaCO3=CaO+CO2 P↑ ←, P↓ →
1моль=1моль+1моль
3) концентрация исходных веществ и продуктов реакции
При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при понижении концентрации продуктов реакции-в сторону исходных веществ.
S2+2O2=2SO2 [S],[O]↑ →, [SO2]↑ ←
Катализаторы не влияют на смещение химического равновесия!
См. также
Примечания
Ссылки
dic.academic.ru
Влияние изменения внешних условий на состояние химического равновесия
После изменения внешних условий состояние химического равновесия нарушается, так как скорости прямой и обратной реакций в разной степени зависят от этих изменений. Происходит сдвиг равновесия в сторону прямой (вправо) или обратной (влево) реакции, после чего в системе установится новое состояние равновесия, при котором равновесные концентрации реагентов будут отличны от предыдущих.
В качественной форме направление смещения равновесия, можно определить, пользуясь принципом Ле Шателье: «Если на систему (реакцию), находящуюся в состоянии равновесия оказать какое-либо внешнее воздействие, то равновесие сместится в том направлении, при котором это воздействие уменьшается». Иными словами равновесная система стремится сохранить старое состояние равновесия и противодействует внешнему воздействию.
К наиболее очевидным факторам, способным повлиять на состояние химического равновесия, относятся температура и концентрация реагентов. Для реакций, протекающих с участием газов при постоянной температуре, дополнительным фактором является давление, т.к. его изменение приводит к изменению объема и, следовательно, к изменению концентрации газовых реагентов, причем в разной степени для исходных веществ и продуктов реакции. Рассмотрим влияние этих факторов на смещение равновесия в системе:
N2(г)+ 3H2(г) ⇄ 2NH3(г),Нх.р0 (I)
15
1. Влияние давления
При повышении давления равновесие в системе смещается в сторону меньшего количества молей газообразныхвеществ. В данной системе произойдет смещение равновесия вправо, т.е. в сторону прямой реакции.
И наоборот, при уменьшении давления равновесие в системе смещается в сторону большего количества молей газообразныхвеществ. В данной системе произойдет смещение равновесия влево, т.е. в сторону обратной реакции.
При изменении давления в системе не произойдет смещения равновесия, если количество моль газообразных веществ в ходе реакции не изменяется.
2. Влияние концентрации реагентов
Изменение концентрации одного или нескольких реагентов в равновесной смеси приведет к смещению равновесия, причем увеличение концентрации исходных веществ сдвигает равновесие вправо, что увеличивает выход продуктов. К такому же эффекту приводит отвод продуктов из равновесной смеси (например, сжижение аммиака и откачка его из реактора). Увеличение концентрации продуктов реакции или уменьшение концентрации исходных веществ вызывает смещение равновесия влево, т.е. в сторону исходных веществ.
3. Влияние температуры
По отношению к обратимым химическим процессам повышение температуры вызывает сдвиг равновесия в сторону реакции, протекающей с поглощением тепла (эндотерми-ческой реакции), понижение температуры – в сторону реакции, протекающей с выделением тепла (экзотермической реакции).
Константа равновесия реакции связана со стандартным изменением свободной энергии Гиббса соотношением
G0х.р = —RTlnKp, аG0х.р=Н0х.р—ТS0х.р.ТогдаlnKp=lnKp= .
16
Для реакции (I), протекающей с выделением тепла (Нх.р0), увеличение температуры приведет к уменьшениюКр. Это значит, что количество продуктов реакции уменьшится, а количество исходных веществ увеличится, т.е. равновесие сместится влево, так как обратная реакция протекает с поглощением тепла. И наоборот, для реакции, протекающей с поглощением тепла (Нх.р > 0), при увеличении температурыКрувеличится, т.е. равновесие сместится вправо (в сторону эндотермической реакции).
Таким образом, при увеличении температуры константа равновесия эндотермической реакции (Нх.р > 0) увеличивается, а зкзотермической реакции (Нх.р 0) – уменьшается.
studfile.net
Урок «Обратимость химических реакций. Химическое равновесие»
Обратимость химических реакций. Химическое равновесие.
11 класс

Тема урока : Обратимость химических реакций. Химическое равновесие.
Цель урока : Закрепить понятия «обратимость» и «необратимость» химических реакций; обобщить и углубить знания учащихся о химическом равновесии, константе равновесия, знать принцип Ле Шателье и уметь применять его для смещения химического равновесия; дать представление о значении знаний о химическом равновесии в производстве и в природе, развитие навыков в решении заданий ЕГЭ (часть А).
Тип урока: комбинированный урок.
Ход урока
I. Организационный момент.
II Актуализация знаний учащихся (Слайд 4).
1. Определение скорости химической реакции.
2. Формулы выражения скорости и единицы измерения скорости: а) гомогенной реакции; б) гетерогенной реакции.
3. Перечислите факторы, влияющие на скорость химической реакции.
4. Как зависит скорость химической реакции от концентрации?
5. Какие вещества называются катализаторами? Ингибиторами? В чем отличие их действия на скорость химической реакции? Значение катализаторов и ингибиторов на производстве, в жизни живых организмов.
6. Что нужно знать о химической реакции, чтобы определить ее скорость?
III. Изучение нового материала (Слайд 5).
План изложения.
1.Реакции обратимые и необратимые. Признаки необратимости.
2. Химическое равновесие. Константа химического равновесия.
3.Факторы, вызывающие смещение химического равновесия. Принцип Ле Шателье. Эксперимент.
4. Применение Принципа Ле Шателье.
5. Решение заданий ЕГЭ.
Все химические реакции делятся на обратимые и необратимые.
(Слайд 6).
Необратимые химические реакции – это реакции, протекающие в одном направлении до полного превращения реагирующих веществ в продукты реакции.
Например :
Na2SO4 + BaCl2 à BaSO4↓ + 2NaCl
Необратимая реакция заканчивается тогда, когда полностью расходуется хотя бы одно из исходных веществ. Необратимыми являются реакции горения; многие реакции термического разложения сложных веществ; большинство реакций, в результате которых образуются осадки или выделяются газообразные вещества, и др. (Слайд 7).
CuCl2 + 2KOH= Cu(OH)2↓ +2KOH – выпал осадок
Na2CO3 + 2HCl=2NaCl + h3O + CO2↑ – образовался слабый электролит, который разлагается на воду и углекислый газ.
h3SO4 + 2KOH = K2SO4 + 2h3O – образовалась вода – очень слабый электролит.
Обратимые химические реакции – это реакции, одновременно протекающие в прямом и обратном направлениях в одних и тех же условиях.
Например:
h3 + I2 ↔ 2HI (1)
CaCO3 ↔ CaO + CO2 (2)
Рассмотрим уравнение реакции синтеза йодоводорода из водорода и йода (Ур-е 1).
Через некоторое время после начала химической реакции в газовой смеси можно обнаружить не только конечные продукты реакции HI, но и исходные вещества – h3 и I2. Как бы долго не продолжалась химическая реакция, в реакционной смеси при 350°C всегда будет содержаться приблизительно 80% HI, 10% h3 и 10% I2. Если в качест — ве исходного вещества взять HI и нагреть его до той же температуры, то можно обнаружить, что через некоторое время соотношение между количествами всех трех веществ будет таким же. Таким образом, при образовании йодоводорода из водорода и йода одновременно осу — ществляются прямая и обратная реакции.
Если в качестве исходных веществ взяты водород и йод в концентрациях [h3] и [I2], то скорость прямой реакции в начальный момент времени была равна:
Vпр =kпр [h3] [I2]. Скорость обратной реакции
Vобр=kобр [HI] ² в начальный момент времени равна ну- лю, так как йодоводород в реакционной смеси отсутству-ет. Постепенно скорость прямой реакции уменьшается, т.к. водород и йод вступают в реакцию и их концентра — ции понижаются. При этом скорость обратной реакции увеличивается, потому что концентрация образующегося йодоводорода постепенно возрастает. Когда скорости прямой и обратной реакции станут одинаковыми, насту — пает химическое равновесие. В состоянии равновесия за определенный промежуток времени образуется столько же молекул HI , сколько их распадается на [h3] и [I2].
Состояние обратимого процесса, при котором скорости прямой и обратной реакций равны, называют химическим равновесием. (Слайд 8, 9).
Химическое равновесие является динамическим равнове — сием. В равновесном состоянии продолжают протекать и прямая, и обратная реакции, но т. к. скорости их равны, концентрации всех веществ в реакционной системе не изменяются. Эти концентрации называются равновесными концентрациями.
Состояние химического равновесия характеризуется особой величиной – константой равновесия. Для нашего примера константа равновесия имеет вид:
Кравн =[HI]²/[h3] [I2]
Константа равновесия k равна отношению констант скоростей прямой и обратной реакции, или отношению произведению равновесных концентраций продуктов и реагентов, возведенных в степени, равные коэффициентам в уравнении реакции. Величина константы равновесия определяется приро — дой реагирующих веществ, и зависит от температуры. (Слайд 10).
Величина константы равновесия характеризует полноту протекания обратимой реакции. Если Кравн<<1, числитель в выражении константы намного меньше зна-менателя, прямая реакция практически не протекает, равновесие смещено влево. Если для какого-либо обра- тимого процесса Кравн>>1, исходных реагентов в равно- весной системе практически не остается, равновесие смещено вправо. (Слайд 11).
Химическое равновесие является подвижным и может сохраняться долго при неизменных внешних условиях: температуры, концентрации исходных веществ или конечных продуктов, давления (если в реакции участвуют газы).
Если изменить эти условия, можно перевести систему из одного равновесного состояния в другое, отвечающее новым условиям.
Такой переход называется смещением или сдвигом равновесия. ( Слайд 12).
Управление смещения можно предсказать, пользуясь принципом Ле Шателье, 1884г.
Историческая справка.
Анри Луи Ле Шателье (1850- 1936), французский ученый — химик, занимался исследованиями процессов протекания химических реакций.
Принцип смещения равновесий — самое известное, но далеко не единственное научное достижение Ле Шателье.
Его научные исследования обеспечили ему широкую известность во всем мире. Он дожил до 86 лет. (Слайд13).
Известен всюду на Земле Анри Луи Де Шателье. Он не был королем и принцем, Зато открыл прекрасный принцип, Который химикам полезен Для сдвигов всяких равновесий.
Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменить давление, концентрацию ве-ществ или температуру), то равновесие сместится в сторону преимущественного протекания того процесса, который ослабляет произведенное воздействие.
Принцип Ле Шателье — это принцип «вредности», принцип «наоборот». (Слайд 14) .
Важнейшими внешними факторами, которые могут приводить к смещению химического равновесия, являются: а) концентрация реагирующих веществ;
б) температура;
в) давление.
Влияние концентрации реагирующих веществ.
Если в равновесную систему вводится какое – либо из участвующих в реакции веществ, то равновесие смещается в сторону той реакции, при протекании которой данное вещество расходуется. Если из равновесной системы выводится какое – либо вещество, то равновесие смещается в сторону той реакции, при протекании которой данное вещество образуется.
Например, рассмотрим, какие вещества следует вводить и какие выводить из равновесной системы для смещения обратимой реакции синтеза аммиака вправо:
N2(г) + H2(г)↔ 2 NH3(г)
Для смещения равновесия вправо (в сторону прямой реак — ции образования аммиака) необходимо в равновесную смесь вводить азот и водород (т. е. увеличить их концентрации) и выводить из равновесной смеси аммиак (т.е. уменьшить его концентрацию).
Выводы: (Слайд 15).
А) если увеличиваем концентрацию конечных продуктов, равновесие смещается в сторону образования исходных продуктов, т.е. преобладает обратная реакция.
Б) увеличиваем концентрацию исходных продуктов, равновесие смещается в сторону образования конечных продуктов, преобладает прямая реакция.
В) при уменьшении концентрации конечных продуктов реакция равновесия смещается в сторону их образования, преобладает прямая реакция.
Г) при уменьшении концентрации исходных продуктов реакции, преобладает обратная реакция.
( Эксперимент (видео опыт) «Влияние концентрации реагирующих веществ на смещение химического равновесия») (Слайд 16)).
Влияние температуры.
Прямая и обратная реакции имеют противоположные тепловые эффекты: если прямая реакция экзотермичес – кая, то обратная реакция эндотермическая (и наоборот).
При нагревании системы (т.е. повышении ее температуры) равновесие смещается в сторону эндотер — мической реакции; при охлаждении (понижении тем — пературы) равновесие смещается в сторону экзотерми — ческой реакции.
Например, реакция синтеза аммиака является экзотерми-ческой:
N2(г) + H2(г)→ 2 NH3(г) + 92 кДж ,
а реакция разложения аммиака является (обратная реакция) является эндотермической:
2 NH3(г) → N2(г) + H2(г) — 92 кДж. Поэтому повышение температуры смещает равновесие в сторону обратной реакции разложения аммиака.
Выводы: (Слайд 17).
А) при повышении температуры химическое равновесие смещается в сторону эндотермической реакции.
Б) при понижении температуры химическое равновесие смещается в сторону экзотермической реакции.
( Эксперимент (видео опыт) «Влияние температуры на смещение химического равновесия») (Слайд 19)).
Влияние давления.
Давление влияет на равновесие реакции, в которых принимают участие газообразные вещества. Если внешнее давление повышается, то равновесие смещается в сторону той реакции, при протекании которой число молекул газа уменьшается. И наоборот, равновесие смещается в сторону образования большего числа газообразных молекул при понижении внешнего давления. Если реакция протекает без изменения числа газообразных веществ, то давление не влияет на равновесие в данной системе.
Например: для увеличения выхода аммиака (смещение вправо) необходимо повышать давление в системе обратимой реакции
N2(г) + H2(г)↔ 2 NH3(г) , т.к. при протекании прямой реакции число газообразных молекул
уменьшается (из четырех молекул газов азота и водорода образуются две молекулы газа аммиака). Выводы: (Слайд 17).
А) при увеличения давления равновесие смещается в сторону той реакции, при которой объем образовавшихся газообразных продуктов уменьшается.
Б) при уменьшении давления равновесие смещается в сторону той реакции, при которой объем образовавшихся газообразных продуктов увеличивается.
Пример: 3h3 + N2 ↔ 2Nh4
в) если объемы газообразных продуктов одинаковы как в прямой, так и в обратной реакции — изменение давления не оказывает смещения равновесия.
Пример: Н2 + Cl2=2HCl
2V=2V
( Эксперимент (видео опыт) «Влияние давления на смещение химического равновесия») (Слайд 18)).
Принцип Ле Шателье применим не только к химическим реакциям, но и ко многим другим процессам: к испарению, конденсации, плавлению, кристаллизации и др. При производстве важнейших химических продуктов принцип Ле Шателье и расчеты, вытекающие из закона действующих масс, дают возможность находить такие условия для проведения химического процесса, которые обеспечивают максимальный выход желаемого вещества. (Слайд 20,21).
IV. Закрепление (Слайд 22).
Химик толкает реакцию в спину: «Давай-ка тебя я немного подвину!» Она отвечает: «Ты знаешь меня: Ни часа, ни дня не могу без огня! И чтобы улучшить мое настроение, Прошу, даже требую: выше давление! К тому же учти: я – такая реакция, Что мне реагентов важна концентрация». И химик подумал: «Теперь мне все ясно. Тепло поглощаешь – и это прекрасно! Как только под колбой зажгутся горелки, Ступай-ка, реакция, прямо по стрелке. Вот это цветочки, но будут и фрукты — Повысит давление выход продукта! Еще концентрация…Да, ты права: Побольше я выдам тебе вещества». Реакция стала работать послушно, Продукт образуя полезный и нужный. Такой вот привиделся химику сон. Какие же выводы сделает он?
V. Обобщение и выводы.
Таким образом, на данном уроке мы более углубленно изучили химическое равновесие — которое может возникнуть в обратимых химических реакциях, а также получили представление о факторах, вызывающих смещение химического равновесия в сторону прямой или обратной реакции, экспериментально убедились в этом.
VI. Решение заданий ЕГЭ (часть А). (Слайд 23,24).
1. Условие необратимости химического превращения.
а) образование слабого электролита
б) поглощение большого количества теплоты
в) взаимодействие слабого и сильного электролитов
г) ослабление окраски раствора.
2. Для смещения равновесия в системе
CaCO3(т) ↔ CaO(т) + CO2(т) – Q
в сторону продуктов реакции необходимо
а) увеличить давление б) увеличить температуру
в) ввести катализатор г) уменьшить температуру
3. При увеличении давления химическое равновесие не смещается в системе
а) 2h3S(г) + 3O2(г) = 2h3O(г) + 2SO2(г)
б) 2h3(г) + O2(г) = 2h3O (г)
в) h3(г) + I2(г) = 2HI (г)
г) SO2(г) + CL2(г) = SO2CL2(г)
4. Верны ли следующие суждения о смещении химического равновесия в системе
2CO(г) + O2(г) ↔ 2CO2(г) + Q ?
А. При понижении давления химическое равновесие в данной системе сместится в сторону продукта реакции.
Б. При увеличении концентрации углекислого газа химическое равновесие системы сместится в сторону продукта реакции.
а) верно только А в) верны оба суждения
б) верно только Б г) оба суждения неверны
5. В системе
2SO2(г) + O2(г) ↔ 2SO3(г) + Q
смещению химического равновесия в сторону исходных веществ будет способствовать
а) уменьшение давления
б) уменьшение температуры
в) увеличение концентрации SO2
г) уменьшение концентрацииSO3
6. Химическое равновесие в системе
C4h20 (г) ↔ C4H6(г) + 2h3(г) -Q
сторону обратной реакции, если
а) повысить температуру
б) уменьшить концентрацию h3
в) добавить катализатор
г) повысить давление
А теперь проверьте правильность своих ответов. (Слайд 25).
1 – а
2 – б
3 – в
4 – а
5 – а
6 – г
VII. § 14, упр. 1-8. (Слайд 26).
Используемая литература.
1.О.С.Габриелян, Г.Г.Лысова «Химия» — М.: «Дрофа», 2009.
2.О.С.Габриелян, И.Г.Остроумов «Общая химия» — Олма-учебник, 2008.
3. О.С.Габриелян, Г.Г.Лысова, А.Г.Введенская «Настольная книга учителя химии», ч.I, 11 кл. — М.: «Дрофа», 2009.
4.Т.П.Троегубов «Поурочные разработки по химии» — М.: «Вако», 2009.
5.А.С.Егоров «Репетитор по химии» — «Феникс», 2008.
6.С.А.Литвинова, Н.В.Манкевич «Неорганическая химия. Весь школьный курс в таблицах» — Минск: «Современная школа: Кузьма», 2009.
7.А.Н.Левкин, А.А.Карцова, С.Е.Домбровская, Е.Д.Крутецкая «Химия:ЕГЭ: Учебно-справочные материалы. (Серия «Итоговый контроль:ЕГЭ») – М.;СПб.:Просвещение, 2011.
8.Г.П.Хомченко «Пособие по химии для поступающих в ВУЗы» — М.: «Новая волна».,2004.
9.В.Н.Доронькин,А.Г.Бережная, Т.В.Сажнева, В.А.Февралева «Химия.Тематические тесты.Подготовка к ЕГЭ» — Ростов-на-Дону «Легион», 2010.
10.Д.М.Добротин,А.А.Каверина,М.Г.Снастина «ЕГЭ-2011 . Химия: типовые экзаменационные варианты: 30 вариантов.» — ФИПИ,М.; «Национальное образование». 2011.
infourok.ru