Кислоты: классификация и химические свойства
Кислотами называются сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться или обмениваться на атомы металла и кислотный остаток.
По наличию или отсутствию кислорода в молекуле кислоты делятся на кислородсодержащие (H2SO4 серная кислота, H2SO3 сернистая кислота, HNO3 азотная кислота, H3PO4 фосфорная кислота, H2CO3 угольная кислота, H2SiO3 кремниевая кислота) и бескислородные (HF фтороводородная кислота, HCl хлороводородная кислота (соляная кислота), HBr бромоводородная кислота, HI иодоводородная кислота, H2S сероводородная кислота).
В зависимости от числа атомов водорода в молекуле кислоты кислоты бывают одноосновные (с 1 атомом Н), двухосновные (с 2 атомами Н) и трехосновные (с 3 атомами Н).
| К И С Л О Т Ы |
|
Одноосновные | Двухосновные | Трехосновные |
HNO3 азотная HF фтороводородная HCl хлороводородная HBr бромоводородная HI иодоводородная | H2SO4 серная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая | H3PO4 фосфорная |
Неорганических соединений, содержащих четыре атома водорода, способных замещаться на металл, очень мало.
Часть молекулы кислоты без водорода называется кислотным остатком.
Кислотные остатки могут состоять из одного атома (-Cl, -Br, -I) – это простые кислотные остатки, а могут – из группы атомов (-SO3, -PO4, -SiO3) – это сложные остатки.
В водных растворах при реакциях обмена и замещения кислотные остатки не разрушаются:
H2SO4 + CuCl2 → CuSO4 + 2 HCl↑
Слово ангидрид означает безводный, то есть кислота без воды. Например,
H2SO4 – H2O → SO3. Бескислородные кислоты ангидридов не имеют.
Своё название кислоты получают от названия образующего кислоту элемента (кислотообразователя) с прибавлением окончаний «ная» и реже «вая»: H2SO4 – серная; H2SO3 – угольная; H2SiO3 – кремниевая и т.д.
Элемент может образовать несколько кислородных кислот.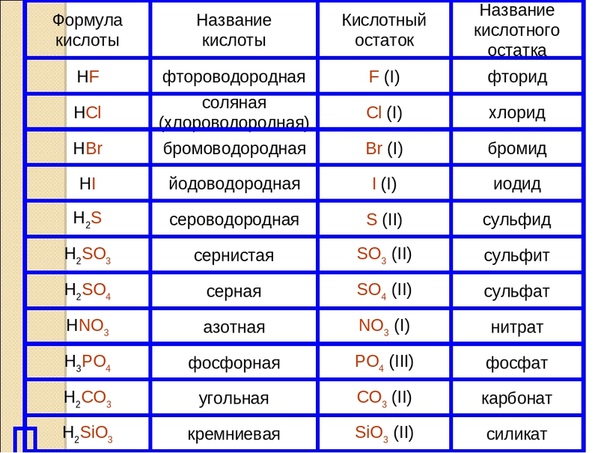 В таком случае указанные окончания в названии кислот будут тогда, когда элемент проявляет высшую валентность (в молекуле кислоты большое содержание атомов кислорода). Если элемент проявляет низшую валентность, окончание в названии кислоты будет «истая»: HNO3 – азотная, HNO2 – азотистая.
В таком случае указанные окончания в названии кислот будут тогда, когда элемент проявляет высшую валентность (в молекуле кислоты большое содержание атомов кислорода). Если элемент проявляет низшую валентность, окончание в названии кислоты будет «истая»: HNO3 – азотная, HNO2 – азотистая.
Кислоты можно получать растворением ангидридов в воде. В случае, если ангидриды в воде не растворимы, кислоту можно получить действием другой более сильной кислоты на соль необходимой кислоты. Этот способ характерен как для кислородных так и бескислородных кислот. Бескислородные кислоты получают так же прямым синтезом из водорода и неметалла с последующим растворением полученного соединения в воде:
H2 + Cl2 → 2 HCl;
H2 + S → H2S.
Растворы полученных газообразных веществ HCl и H2S и являются кислотами.
При обычных условиях кислоты бывают как в жидком, так и в твёрдом состоянии.
Химические свойства кислот
Растворыв кислот действуют на индикаторы. Все кислоты (кроме кремниевой) хорошо растворяются в воде. Специальные вещества – индикаторы позволяют определить присутствие кислоты.
Индикаторы – это вещества сложного строения. Они меняют свою окраску в зависимоти от взаимодействия с разными химическими веществами. В нейтральных растворах — они имеют одну окраску, в растворах оснований – другую. При взаимодействии с кислотой они меняют свою окраску: индикатор метиловый оранжевый окрашивается в красный цвет, индикатор лакмус – тоже в красный цвет.
Взаимодействуют с основаниями с образованием воды и соли, в которой содержится неизменный кислотный остаток (реакция нейтрализации):
H2SO4 + Ca(OH)2 → CaSO4 + 2 H2O.
Взаимодействуют с основанными оксидами с образованием воды и соли (реакция нейтрализации).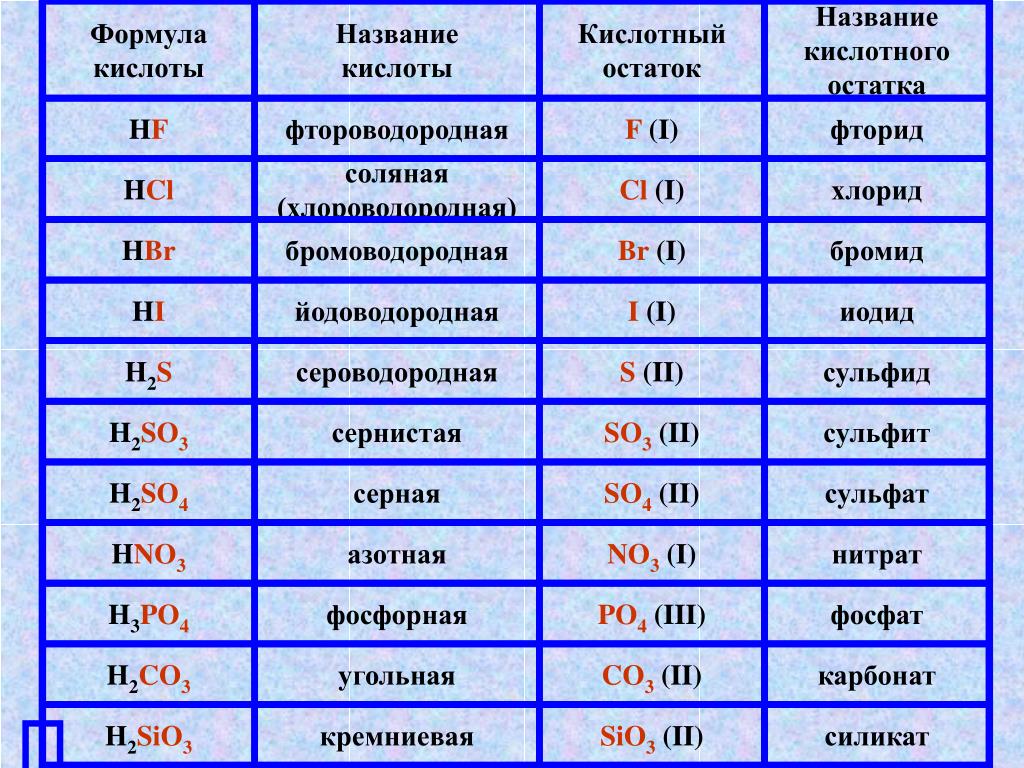 Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации:
Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации:
H3PO4 + Fe2O3 → 2 FePO4 + 3 H2O.
Взаимодействуют с металлами. Для взаимодействия кислот с металлами должны выполнятся некоторые условия:
1. металл должен быть достаточно активным по отношению к кислотам (в ряду активности металлов он должен располагаться до водорода). Чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами;
2. кислота должна быть достаточно сильной (то есть способной отдавать ионы водорода H+).
При протекании химических реакций кислоты с металлами образуется соль и выделяется водород (кроме взаимодействия металлов с азотной и концентрированной серной кислотами,):
Zn + 2HCl → ZnCl2 + H2↑;
Cu + 4HNO3 → CuNO3 + 2 NO2 + 2 H2O.
Остались вопросы? Хотите знать больше о кислотах?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Свойства кислот
Кислоты — это сложные вещества, состоящие из одного или нескольких атомов водорода и кислотного остатка. Общая формула кислот НnА, где А — кислотный остаток. Кислоты (с точки зрения электролитической диссоциации) представляют собой электролиты, диссоциирующие в водных растворах на катионы водорода Н+ и анионы кислотного остатка.
Классификация. По наличию
(отсутствию) кислорода в составе кислот они подразделяются на
кислородсодержащие (например,
H3PO4и
H2SO4) и
бескислородные (например,
HCl и
HBr).
Физические свойства. Кислоты бывают газообразные, жидкие и твердые. Некоторые имеют запах и цвет. Кислоты отличаются различной растворимостью в воде.
1) Диссоциация: HCl + nH2OH+×kH2O
+ Cl–×mH2O
(сокращенно: HClH+ + Cl–
).
Многоосновные кислоты диссоциируют по ступеням (в основном по первой):
H2SO4 H+ + НSO4– (1 ступень) и HSO4– H+ + SO42– (2 ступень).
2) Взаимодействие с индикаторами:
индикатор + Н+ (кислота
) окрашенное соединение.
Фиолетовый лакмус и оранжевый метилоранж окрашиваются в кислых средах в розовый цвет, бесцветный раствор фенолфталеина не меняет своей окраски.
3) Разложение. При разложении кислородсодержащих кислот получаются кислотный оксид и вода.
H2SiO3 SiO2
+ H2O.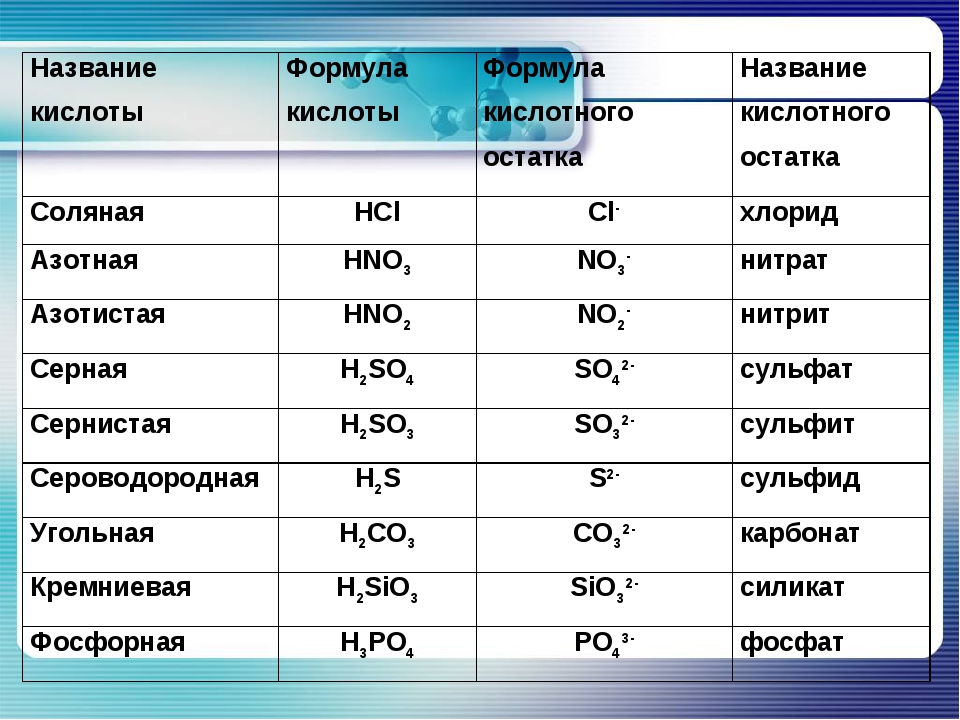
Бескислородные кислоты распадаются на простые вещества:
2HCl Cl2 + H2.
4НNO3 4NO2 + 2H2O + O2.
4) Взаимодействие с основаниями и амфотерными гидроксидами:
H2SO4+ Ca(OH)2 ® CaSO4¯ + 2H2O 2H+ + SO42–+ Ca2+ +2OH– ® CaSO4¯ + 2H2O
H2SO4+
Zn(OH)2
®
ZnSO4 + 2H2O 2H+
+ Zn(OH)2
®
Zn2+ + 2H2O.
5) Взаимодействие с основными и амфотерными оксидами:
H2SO4+ CaO ® CaSO4¯ + H2O 2H+ + SO42–+ CaO ® CaSO4¯ + H2O
H2SO4+ ZnO ® ZnSO4 + H2O 2H+ + ZnO ® Zn2+ + H2O.
6) Взаимодействие с металлами: а) кислоты-окислители по Н+ (HCl, HBr, HI, HClO4, H2SO4, H3PO4и др.).
В реакцию вступают металлы, расположенные в ряду активности до водорода:
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
2HCl + Fe
®
FeCl2 + H2
2H+ + Fe
®
Fe2+ + H2.
б) кислоты-окислители по аниону (концентрированная серная, азотная любой концентрации):
2Fe + 6H2SO4 (конц.) Fe2(SO4)3 + 3SO2 + 6H2O
2Fe + 12H++ 3SO42–® 2Fe3+ + 3SO2 + 6H2O.
7) Взаимодействие с солями. Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок:
2HCl + Na2CO3® 2NaCl + CO2 + H2O 2H+ + CO32–® CO2 + H2O
СaCl2 + H2SO4
® CaSO4¯
+ 2HCl
Сa2+
+ SO42-
® CaSO4¯.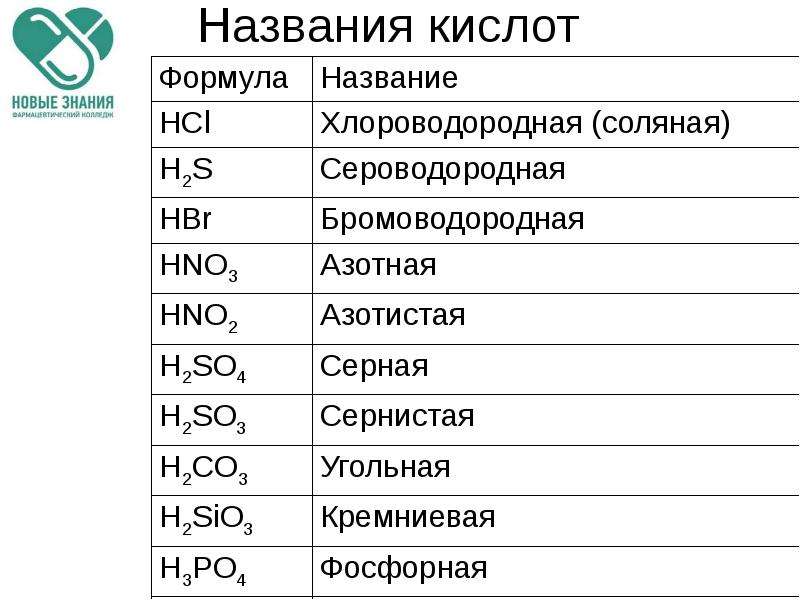
Получение. Бескислородные кислоты получают:
1) Из неметаллов и водорода с последующим растворением образовавшегося газа в воде:
Cl2 + H2 2HCl.
2) При действии сильных кислот на соли более слабых или летучих бескислородных кислот:
2HCl + Na2S ® 2NaCl + Н2S 2H+ + S2– ® Н2S.
Кислородсодержащие кислоты получают:
1) Взаимодействием
кислотного оксида и воды. Оксид кремния(IV)
SiO2с водой не реагирует!
Оксид кремния(IV)
SiO2с водой не реагирует!
SO2 + H2O H2SO3.
2) При действии сильных кислот на соли более слабых или летучих кислородсодержащих кислот:
2HCl + Na2CO3® 2NaCl + Н2СО3 2H+ + CO32– ® Н2СО3.
Л.А. Яковишин
О едком и не очень / Хабр
– Эти идиоты поместили фарфоровый контейнер со «студнем» в специальную камеру, предельно изолированную… То есть это они думали, что камера предельно изолирована, но когда они открыли контейнер манипуляторами, «студень» пошел через металл и пластик, как вода через промокашку, вырвался наружу, и все, с чем он соприкасался, превращалось опять же в «студень».Погибло тридцать пять человек, больше ста изувечено, а все здание лаборатории приведено в полную негодность. Вы там бывали когда-нибудь? Великолепное сооружение! А теперь «студень» стек в подвалы и нижние этажи… Вот вам и прелюдия к контакту.
— А. Стругацкий, Б. Стругацкий «Пикник на обочине»
Привет, %username%!
В том, что я всё ещё что-то пишу — вините вот этого человека. Он навеял идею.
Просто, немного поразмыслив, я решил, что небольшой экскурс по едким веществам получится относительно быстро. Может кому-то будет и интересно. А кому-то — и полезно.
Поехали.
Сразу определимся с понятиями.
Едкий — 1. Разъедающий химически. 2. Резкий, вызывающий раздражение, боль. 3. Язвительный, колкий.
Ожегов С.И. Словарь русского языка. — М.: Рус.яз., 1990. — 921 с.
Итак, отбрасываем сразу два последних значения слова. Также отбрасываем «едкие» лакриматоры — которые не столько едкие, сколько вызывают слезотечение, и стерниты — которые вызывают кашель. Да, ниже будут вещества, которые обладают и этими свойствами, но они — что главное! — действительно разъедают материалы, а иногда и плоть.
Да, ниже будут вещества, которые обладают и этими свойствами, но они — что главное! — действительно разъедают материалы, а иногда и плоть.
Мы не будем рассматривать вещества, едкие только для человека и подобных — в виду специфического разрушения мембран клеток. А потому иприты останутся не у дел.
Мы будем рассматривать соединения, которые в комнатных условиях — жидкости. Поэтому жидкий кислород и азот, а также газы типа фтора рассматривать не будем, хотя их можно считать едкими, да.
Как обычно, взгляд будет исключительно субъективным, основанным на собственном опыте. И да — вполне возможно, что кого-то я и не упомню — пиши комментарии, %username%, в течение трёх суток с момента публикации я буду дополнять статью тем, что забылось с самого начала!
И да — у меня нет времени и сил строить «хит-парад», поэтому будет сборная солянка. И со всеми исключениями — она вышла довольно короткой.
Едкие щелочи
А конкретно — гидроксиды щелочных металлов: лития, натрия, калия, рубидия, цезия, франция, гидроксид таллия (I) и гидроксид бария. Но:
Но:
- Литий, цезий, рубидий и барий отбрасываем — дорого и редко встретишь
- Если ты, %username%, встретишь гидроксид франция, то едкость тебя будет волновать в последнюю очередь — он жутко радиоактивный
- То же и с таллием — он ядовит до жути.
А потому остались натрий и калий. Но будем откровенны — свойства у всех едких щелочей очень схожие.
Гидроксид натрия известен всем как «каустическая сода» (не путать с пищевой, кальцинированной и другими содами, а также поташем). Гидроксид калия как пищевая добавка Е525 — тоже. По свойствам оба похожи: сильно гигроскопичны, то бишь тянут воду, на воздухе «расплываются». Хорошо растворяются в воде, при этом выделяется большое количество теплоты.
«Расплывание» на воздухе — по сути образование очень концентрированных растворов щелочей. А потому, если положить кусочек едкой щёлочи на бумагу, кожу, некоторые металлы (тот же алюминий) — то по прошествии времени обнаружится, что материал хорошо подъело! То, что показывали в «Бойцовском клубе» — очень похоже на правду: действительно, потные руки — да в щёлочь — будет больно! Лично мне показалось больнее, чем от соляной кислоты (о ней ниже).
Впрочем, если руки очень сухие — скорее всего в именно сухой щёлочи ничего и не почувствуешь.
Едкие щёлочи отлично разваливают жиры на глицерин и соли жирных кислот — так и варят мыло (привет, «Бойцовский клуб!») Чуть дольше, но так же действенно расщепляются белки — то есть в принципе щёлочи плоть растворяют, особенно крепкие растворы — да при нагревании. Недостатком в сравнении с той же хлорной кислотой (о ней тоже ниже) является то, что все щёлочи тянут углекислый газ из атмосферы, а потому сила будет постепенно снижаться. Кроме того, щёлочи реагируют и с компонентами стекла — стекло мутнеет, хотя, чтобы его растворить целиком — тут, конечно, надо постараться.
К едким щелочам иногда относят и тетраалкиламмоний гидроксиды, например
Гидроксид тетраметиламмония На самом деле в этих веществах объединились свойства катионных поверхностно-активных веществ (ну это как обычное мыло — только катионное: тут активная дифильная частица — с зарядом «+», а в мыле — с зарядом «-«) и относительно высокая основность. Если попадёт на руки — можно намылить в воде и помыть, как мылом, если в водном растворе погреть волосы, кожу или ногти — растворятся. «Едкость» на фоне гидроксидов натрия и калия — так себе.
Если попадёт на руки — можно намылить в воде и помыть, как мылом, если в водном растворе погреть волосы, кожу или ногти — растворятся. «Едкость» на фоне гидроксидов натрия и калия — так себе.
Серная кислота
H2SO4
Самая популярная, наверное, во всех историях. Не самая едкая, но достаточно неприятная: концентрированная серная кислота (которая 98%) — маслянистая жидкость, которая очень любит воду, а потому у всех её отнимает. Отнимая воду у целлюлозы и сахара, обугливает их. Точно так же она радостно отнимет воду и у тебя, %username%, особенно если налить её на нежную кожу лица или в глаза (ну в глаза на самом деле всё будет попадать с приключениями). Особо добрые люди мешают серную кислоту с маслом, чтобы труднее смывалась и лучше впитывалась в кожу.
Кстати, забирая воду, серная кислота здорово разогревается, что делает картину ещё больше сочной. А потому смывать её водой — очень плохая идея. Лучше — маслом (смывать, а не втирать — а потом уже смыть водой). Ну или большим потоком воды, чтобы сразу и охлаждать.
Ну или большим потоком воды, чтобы сразу и охлаждать.
«Сначала вода, а потом кислота — иначе случится большая беда!» — это именно про серную кислоту, хотя почему-то все считают, что про любую кислоту.
Будучи окислителем, серная кислота окисляет поверхность металлов до оксидов. А поскольку взаимодействие оксидов с кислотами проходит при участии воды как катализатора — а воду серная кислота не отдаёт — то происходит эффект, называемый пассивацией: плотная, нерастворимая и непроницаемая плёнка оксида металла защищает его от дальнейшего растворения.
По этому механизму концентрированную серную кислоту посылают в далёкие дали железо, алюминий. Примечательно, что если кислоту разбавить — появляется вода, и посылать не получается — металлы растворяются.
Кстати, оксид серы SO3 растворяется в серной кислоте и получается олеум — который иногда ошибочно пишут как H2S2O7, но это не совсем верно. У олеума тяга к воде ещё больше.
Собственные ощущения от попадания серной кислоты на руку: немного тепло, потом чуток печёт — смыл под краном, ничего страшного. Фильмам не верьте, но на лицо капать не советую.
Фильмам не верьте, но на лицо капать не советую.
Органики часто пользуются хромпиком или «хромовой смесью» — это бихромат калия, растворённый в серной кислоте. По сути это — раствор хромовой кислоты, он хорош для мытья посуды от остатков органики. При попадании на руку тоже жжётся, но по сути — серная кислота плюс токсичный шестивалентный хром. Дырок в руке не дождёшься, разве что на одежде.
Автор этих строк знаком с идиотом, который вместо бихромата калия использовал перманганат калия. При контакте с органикой немножко жахнуло. Присутствующие обделались отделались лёгким испугом.
Кстати, раз уж вспомнили хромпик — немного отвлечёмся от темы кислот и
Хлористый хромил
CrO2Cl2
По сути своей — лютое соединение шестивалентного хрома и соляной кислоты. Тёмно-красная жидкость, которая тянет воду, гидролизуется — и в итоге дымит этой самой соляной кислотой. Едкость — итог этого братского единения: хром — окисляет, соляная кислота — растворяет: воспламеняет некоторые органические растворители (спирт, скипидар), однако в некоторых растворяется (четыреххлористый углерод, дихлорметан, сероуглегод). Подъедает металлы, но не настолько хорошо, как кислоты — опять дело в пассивации. например, сталь при воздействии приобретает красивую тёмно-синию поверхность.
Подъедает металлы, но не настолько хорошо, как кислоты — опять дело в пассивации. например, сталь при воздействии приобретает красивую тёмно-синию поверхность.
Кожу — понятно — изъязвляет, при чём в этом сильнее хромпика, поскольку лучше проникает в кожу как в неполярную органическую ткань. Но дело даже не в этом, а в шестивалентном хроме, который вообще-то канцероген, а потому глубже проникнет — больше проблем. Ну и конечно надышаться куда опаснее.
Соляная кислота
HCl
Выше 38% в воде не бывает. Одна из самых популярных кислот для растворения — в этом она покруче остальных, потому что технологически может быть очень чистой, а кроме действия, как кислота, ещё и образует комплексные хлориды, которые повышают растворимость. Кстати, именно по этой причине нерастворимый хлорид серебра очень даже растворим в концентрированной соляной кислоте.
Эта при попадании на кожу жжётся чуток сильнее, субъективно — ещё и зудит, к тому же воняет: если в лаборатории с плохой вытяжкой работать много с концентрированной соляной кислотой — твой стоматолог скажет тебе «спасибо»: ты его озолотишь на пломбах. Кстати, помогает жвачка. Но не сильно. Лучше — вытяжка.
Кстати, помогает жвачка. Но не сильно. Лучше — вытяжка.
Поскольку не маслянистая и с водой сильно не разогревается, то едкость — только к металлам, и то не ко всем. Кстати, сталь в концентрированной соляной кислоте пассивируется и говорит ей «не-а!». Чем и пользуются при транспортировке.
Азотная кислота
HNO3
Тоже очень популярная, её тоже почему-то боятся — а зря. Концентрированная — это которая до 70% — она самая популярная, выше — это «дымящая», чаще всего никому не нужная. Есть ещё безводная — так та ещё и взрывается.
Будучи окислителем, пассивирует многие металлы, которые покрываются нерастворимой плёнкой и говорят: «до свидания» — это хром, железо, алюминий, кобальт, никель и другие.
С кожей моментально реагирует по принципу ксантопротеиновой реакции — будет жёлтое пятно, что означает, что ты, %username%, всё-таки состоишь из белка! Через какое-то время жёлтая кожа слезет, как при ожоге. При этом щиплет меньше соляной, хотя воняет не хуже — и на этот раз токсичнее: летящие окислы азота не очень хороши для организма.
В химии используют так называемую «нитрующую смесь» — самая популярная состоит из серной и азотной кислот. Используется в синтезах, в частности в получении весёлого вещества — пироксилина. По едкости — тот же хромпик плюс красивая жёлтая кожа.
Так же есть «царская водка» — это часть азотной кислоты на три части соляной. Используется для растворения некоторых металлов, в основном — драгоценных. На разном соотношении и добавлении воды основан капельный метод проверки пробы золотых изделий — кстати, специалистов по этому методу очень сложно надурить с подделкой. По едкости для кожи — та же «нитрующая смесь» плюс воняет отменно, запах не спутаешь ни с чем, он тоже довольно токсичный.
Есть ещё «обратная царская водка» — когда соотношение наоборот, но это редкая специфика.
Кстати, о той самой «дымящей», которая красная, злая и окислитель — цитирую рассказ хорошего друга, который мне вот прямо сейчас прислал.
Гнал я эту самую 98% азотку. То ли просто перегонял для очистки, то ли из меланжа, уже не помню.Нагнал литра два, снимаю приемник. Прошу лаборантку дать чистую колбу на 2 литра — перелить. Она мне и дала сухую, чистую, но из под спирта — и с закрытой пробкой. То есть пары были и накопились. Я туда воронку и переливаю. Я ее туда — а она обратно. Хорошо брызнула на руки, на рожу и ниже шеи. Ощущение — как орел в морду вцепился. Плюс руки, шея, под носом ну и т.д. по мелочи. В руках, напоминаю, два литра того же добра. Глаза закрыты, естественно. Понимаю, что бросить колбу нельзя, будет сразу сильно хуже. Аккуратно ставлю колбу на резиновую подставку, перемещаюсь к мойке, разворачиваю гусак себе в морду и включаю полный напор. Секунд за пять управился. До подкожной клетчатки не добралась. А то все было бы намного хуже. Видел у другого мужика, что бывает через 10-15 сек. Труднозаживающие багровые рубцы на половину руки. Потом понял, почему она такая злая. Мало того, что довольно сильная кислота и окислитель, она еще и чудесный растворитель. Неограниченно смешивается с водой, но неограниченно смешивается и с, например, дихлорэтаном.
Такая себе бифильная дрянь.
Фосфорная кислота
H3PO4
На самом деле я привёл формулу ортофосфорной кислоты — самой распространённой. А есть ещё метафосфорная, полифосфорные, ультрафосфорные — короче, хватает, но неважно.
Концентрированная ортофосфорная кислота (85%) — это такой сиропчик. Кислота она сама по себе средняя, её часто используют в пищевой промышленности, кстати — когда тебе ставят пломбы, то поверхность зуба предварительно протравливают фосфорной кислотой.
Коррозионность у неё так себе, но есть неприятный нюанс: этот сиропчик хорошо впитывается. Поэтому если капнет на вещи — впитается, а потом будет потихоньку разъедать. И если от азотной и соляной кислоты будет пятно или дырка — то от фосфорной вещь будет разлазиться, особенно это красочно на обуви, когда дырка как бы крошится, пока не получится насквозь.
Ну а вообще едкой её назвать сложно.
Плавиковая кислота
HF
Концентрированная плавиковая кислота — это примерно 38%, хотя и бывают странные исключения.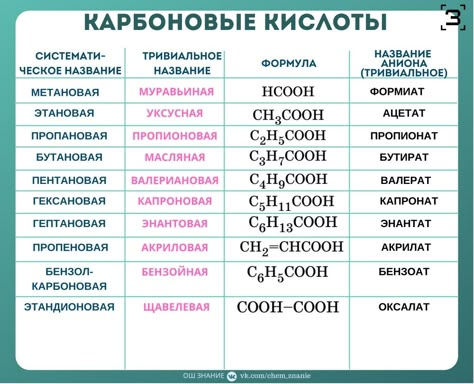
Слабенькая кислота, которая берёт яростной любовью фторид-ионов образовывать стойкие комплексы со всем, с кем можно. Поэтому на удивление растворяет то, что другие, более сильные подруги — не могут, а потому очень часто используется в разных смесях для растворения. При попадании на руку ощущения будут больше от других компонентов таких смесей, но есть нюанс.
Плавиковая кислота растворяет SiO2. То есть песок. То есть стекло. То есть кварц. Ну и так далее. Нет, если ты плеснёшь на окно этой кислотой — оно не растворится, но мутное пятно останется. Чтобы растворить — нужно долго держать, а ещё лучше — нагреть. При растворении выделяется SiF4, который так полезен для здоровья, что лучше это делать под вытяжкой.
Маленький, но приятный нюанс: кремний содержится у тебя, %username%, в ногтях. Так вот, если плавиковая кислота попадёт под ногти — ты ничего не заметишь. Но ночью спать не сможешь — болеть будет ТАК, что иногда возникает желание оторвать палец. Поверь, друг — я знаю.
Поверь, друг — я знаю.
И вообще плавиковая кислота токсична, канцерогенна, впитывается через кожу и масса всего — но мы-то сегодня про едкость, правда?
Помнишь, мы договаривались в самом начале, что фтора не будет? Его и не будет. Но будут…
Фториды инертных газов
На самом деле фтор — суровый парень, с ним особо не повыпендриваешься, а потому некоторые инертные газы образуют с ним фториды. Известны такие стабильные фториды: KrF
2, XeF
2, XeF
4, XeF
6. Всё это — кристаллы, которые на воздухе с разной скоростью и охотой разлагаются влагой до плавиковой кислоты. Едкость — соответствующая.
Иодоводородная кислота
HI
Самая сильная (по степени диссоциации в воде) бинарная кислота. Сильный восстановитель, чем пользуются химики-органики. На воздухе окисляется и становится бурой, чем и пачкает при контакте. Ощущения при контакте — как от соляной. Всё.
Хлорная кислота
HClO4
Одна из самых сильных (по степени диссоциации в воде) кислот вообще (с ней конкурируют суперкислоты — о них ниже) — функция кислотности Гаммета (численное выражение способности среды быть донором протонов по отношению к произвольному основанию, чем меньше — тем сильнее кислота) составляет -13. Безводная — сильный окислитель, любит взрываться, да и вообще неустойчива. Концентрированная (70%-72%) — окислитель не хуже, часто используют в разложении биологических объектов. Разложение интересно и захватывающе тем, что может взрываться в процессе: нужно следить, чтобы не было частиц угля, чтобы не кипело слишком бурно и т.д. Хлорная кислота к тому же довольно грязная — её невозможно очистить субперегонкой, взрывается зараза! Поэтому используют её нечасто.
Безводная — сильный окислитель, любит взрываться, да и вообще неустойчива. Концентрированная (70%-72%) — окислитель не хуже, часто используют в разложении биологических объектов. Разложение интересно и захватывающе тем, что может взрываться в процессе: нужно следить, чтобы не было частиц угля, чтобы не кипело слишком бурно и т.д. Хлорная кислота к тому же довольно грязная — её невозможно очистить субперегонкой, взрывается зараза! Поэтому используют её нечасто.
При попадании на кожу жжётся, ощущения как от соляной. Воняет. Когда видите в фильмах, что кто-то кинул труп в ёмкость с хлорной кислотой — и он растворился, то да, такое возможно — но долго или греть. Если греть — может рвануть (см. выше). Так что будьте критичны к кинематографу (я, кажется, видел это в «Кловерфилд, 10»).
Кстати, едкость оксида хлора (VII) Cl2O7 и оксида хлора (VI) Cl2O6 — это итог того, что с водой эти оксиды образуют хлорную кислоту.
А теперь представим, что мы решили в одном соединении объединить сильную кислотность — и едкость фтора: возьмём молекулу хлорной или серной кислоты — и заменим на ней все гидроксильные группы на фтор! Дрянь получится редкостная: она будет взаимодействовать с водой и подобными соединениями — и будет в месте реакции сразу получаться сильная кислота и плавиковая кислота. А?
А?
Фториды серы, брома и иода
Помните, мы договорились рассматривать только жидкости? По этой причине в нашу статью не попал
трифторид хлора ClF3, который кипит при +12 °C, хотя все страшилки о том, что он жутко токсичен, воспламеняет стекло, противогаз и при разливании 900 килограммов — проедает 30 см бетона и метр гравия — всё это правда. Но мы же договорились — жидкости.
Однако есть жёлтая жидкость — пентафторид иода IF5, бесцветная жидкость — трифторид брома BrF3, светло-жёлтая — пентафторид брома BrF5, которые не хуже. BrF5, к примеру, тоже растворяет стекло, металлы и бетон.
Аналогично — среди всех фторидов серы жидким является только декафторид дисеры (иногда её называют ещё пятифтористой серой) — бесцветная жидкость с формулой S2F10. Но это соединение при обычных температурах достаточно стабильно, не разлагается водой — а потому не особо и едко. Правда, в 4 раза токсичнее фосгена с аналогичным механизмом действия.
Правда, в 4 раза токсичнее фосгена с аналогичным механизмом действия.
Кстати, говорят, что пентафторид иода был «специальным газом» для заполнения атмосферы в спасательном шаттле в последних кадрах фильма «Чужой» 1979 года. Ну не помню, честно. Напомнился! Блин, там настолько круто, что я не удержался — и посвятил этому отдельную статью.
Суперкислоты
Термин «суперкислота» введён Джеймсом Конантом в 1927 году для классификации более сильных кислот, чем обычные минеральные кислоты. В некоторых источниках хлорную кислоту относят к суперкислоте, хотя это не так — она обычная минеральная.
Ряд суперкислот — это минеральные, к которым подцепили галоген: галоген тянет на себя электроны, все атомы очень сильно гневаются, а достаётся всё как обычно водороду: тот отваливается в виде Н+ — бабах: вот и кислота стала сильнее.
У фторсерной кислоты функция Гаммета -15,1, кстати, благодаря фтору, эта кислота постепенно растворяет пробирку, в которой хранится.
Потом кто-то из умных подумал: а давайте возьмём кислоту Льюиса (вещество, способное принять пару электронов другого вещества) и смешаем с кислотой Бренстеда (веществом, которое способно отдавать протон)! Смешали пентафторид сурьмы с плавиковой кислотой — получили гексафторсурьмяную кислоту HSbF6. В этой системе плавиковая кислота выделяет протон (H+), а сопряжённое основание (F−) изолируется координационной связью с пентафторидом сурьмы. Так образуется большой октаэдрический анион (SbF6−), являющийся очень слабым нуклеофилом и очень слабым основанием. Став «свободным», протон обусловливает сверхкислотность системы — функция Гаммета -28!
А потом пришли другие и сказали, а чего это кислоту Бернстеда взяли слабую — и придумали вот что.
— сама по себе уже суперкислота (функция Гаммета -14,1). Так вот, к ней добавили опять пентафторид сурьмы — получили снижение до -16,8! Такой же фокус с фторсерной кислотой дал снижение до -23.
А потом группа ученых с химической кафедры американского университета Калифорнии под управлением профессора Кристофера Рида затусила с коллегами из Института катализа СО РАН (Новосибирск) и придумали карборановую кислоту H(CHB11Cl11). Ну «карборановой» её назвали для обычных людей, а если хочешь почувствовать себя учёным — произнеси «2,3,4,5,6,7,8,9,10,11,12-ундекахлор-1-карба-клозо-додекаборан(12)» три раза и быстро.
Так выглядит эта красотка Это — сухой порошочек, который растворим в воде. Это и есть Самая Сильная Кислота на текущий момент. Карборановая кислота приблизительно в миллион раз сильнее концентрированной серной кислоты. В обычных шкалах измерить силу кислоты не удается, так как кислота протонирует все известные слабые основания и все растворители, в которых она растворяется, включая воду, бензол, фуллерен-60, диоксид серы.
Впоследствии Кристофер Рид в интервью службе новостей Nature сказал: «Идея синтеза карборановой кислоты родилась из фантазий «о молекулах, никогда прежде не создаваемых». Вместе с коллегами он хочет использовать карборановую кислоту для окисления атомов инертного газа ксенона — просто потому, что никто прежде этого не делал. Оригинально, что сказать.
Ну поскольку суперкислоты — это обычные кислоты, то и действуют они обычно, только немного сильнее. Ясно, что кожу будут жечь, но это не значит — что растворять. Фторсульфоновая — отдельный случай, но там всё благодаря фтору, как и в плавиковой.
Тригалогенуксусные кислоты
А конкретно — трифторуксусная и трихлоруксусная кислота
Милы и приятны сочетанием свойств органического полярного растворителя и достаточно сильной кислоты. Воняют — похоже на уксус.
Самая няшка — трифторуксусная кислота: 20%-ный раствор разрушает металлы, пробку, резину, бакелит, полиэтилен. На коже жжётся и образует сухие язвы, доходящие до мышечного слоя.
Трихлоруксусная в этом плане — младший брат, но тоже ничего. Кстати, аплодисменты слабому полу: в погоне за красотой, некоторые идут на так называемую процедуру ТСА-пилинга (ТСА — это TetraChloroAcetate) — когда этой самой трихлоруксусной кислотой растворяют верхний огрубевший слой кожи.
Уксусная кислота
СН3СООН
Скорее всего, у тебя на кухне есть эта кислота — и да, она используется как пищевая добавка Е260. Но также она бывает и покрепче — 70-80%-й водный раствор уксусной кислоты называют уксусной эссенцией, а если концентрация близка к 100% — ледяной уксусной кислотой (потому что она может замерзать и образовывать нечто похожее на лёд.
Уксусная кислота не так едка по отношению к металлам, как минеральные кислоты, но поскольку и не так полярна, а в какой-то степени даже дифильна (сочетание гидрофобной и гидрофильной части в одной молекуле — как в поверхностно-активных веществах) — то она здорово всасывается кожей. Опасными считаются растворы с концентрацией уксусной кислоты больше 30%. Особенность ожогов в том, что также инициируется развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины — если не смыть, то будут долго заживающие язвы и рубцы.
Опасными считаются растворы с концентрацией уксусной кислоты больше 30%. Особенность ожогов в том, что также инициируется развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины — если не смыть, то будут долго заживающие язвы и рубцы.
Ну и воняет она, конечно, знатно.
Муравьиная кислота
НСООН
Мы уже обсуждали,
что муравьиная кислота, образующаяся в организме после принятия метанола, — одна из основных причин его токсичности. Так вот, муравьиная кислота извне вовсе не так опасна, поскольку быстро метаболизируется и выводится организмом. Токсичность довольно низка — для крыс LD
50порядка 1,8 г/кг, а потому муравьиную кислоту тоже часто используют, в том числе и как пищевую добавку — и этого бояться не стоит.
»Едкость» муравьиной кислоты зависит от концентрации. Согласно классификации Европейского союза, концентрация до 10% обладает раздражающим эффектом, больше 10% — разъедающим. И речь опять не о металлах и стекле — а об организме. При контакте с кожей 100%-я жидкая муравьиная кислота вызывает сильные химические ожоги. Попадание даже небольшого её количества на кожу причиняет сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма. Кислота легко проникает через жировой слой кожи, поэтому промывание поражённого участка раствором соды необходимо произвести немедленно. Так что муравьи действительно что-то знают.
При контакте с кожей 100%-я жидкая муравьиная кислота вызывает сильные химические ожоги. Попадание даже небольшого её количества на кожу причиняет сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма. Кислота легко проникает через жировой слой кожи, поэтому промывание поражённого участка раствором соды необходимо произвести немедленно. Так что муравьи действительно что-то знают.
Бром
Br2
Тяжёлая едкая жидкость красно-бурого цвета с сильным неприятным запахом, отдалённо напоминающим запах одновременно иода и хлора. Кстати, название «бром» от греческого βρῶμος — «вонючка», «вонючий».
Бром — типичный галоген, по химической активности бром занимает промежуточное положение между хлором и иодом. То есть не такой прыткий, как фтор — но поживее скучного иода. И да, до хлора тоже не дотягивает.
Немного растворим в воде, хорошо — в некоторых органических растворителях.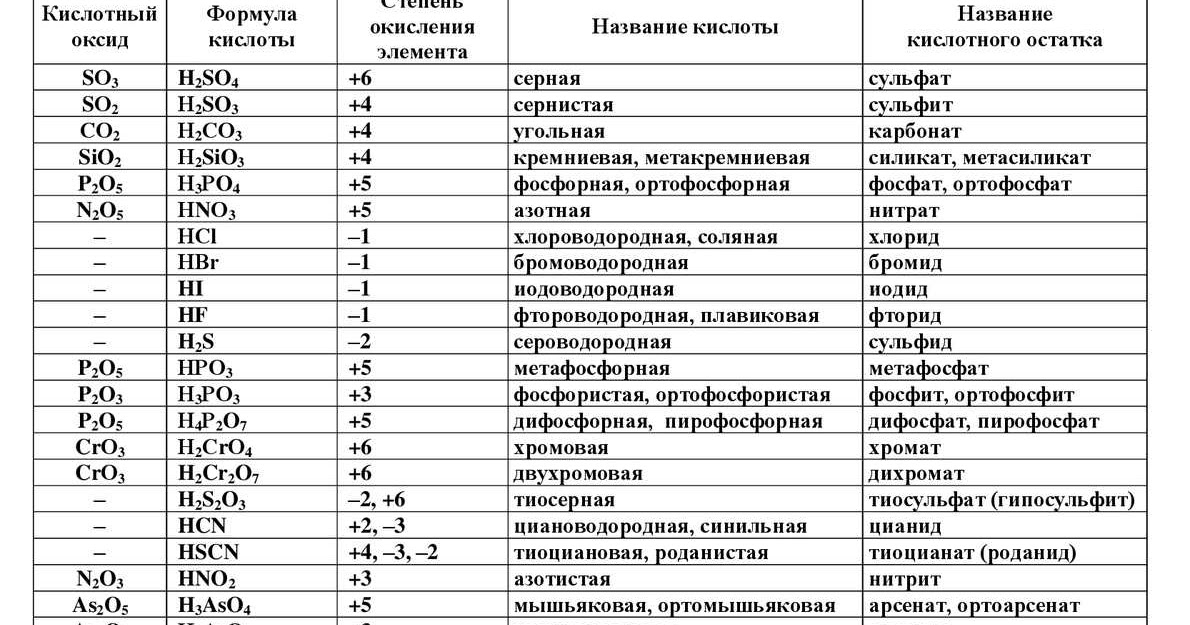 Бромная вода — реактив на непредельные углеводороды — воняет, но вполне себе мирная и ничего сильно не растворяет.
Бромная вода — реактив на непредельные углеводороды — воняет, но вполне себе мирная и ничего сильно не растворяет.
Чистый бром могуч, вонюч и волосат, а также токсичен. При попадании на кожу вызывает ожоги: неприятность в том, что молекулы брома неполярны, а потому хорошо проникают в гидрофобную человеческую кожу и плоть — а потому ожоги действительно болезненны, долго заживают, почти всегда оставляют на память шрам. Алюминий вспыхивает при контакте с бромом, остальные металлы более воздержаны, но в виде порошка — некоторые реагируют, например, железо.
Бетон и стекло к брому достаточно устойчивы. Органические соединения бромом — что? — правильно! — бромируются при наличии ненасыщенной связи. По этой причине устойчивость полимеров зависит от их типа, к примеру полиэтилен и полипропилен — плевать хотели на бром при комнатных условиях.
Пероксид водорода
H2O2
Нестабильное соединение, которое постоянно постепенно разваливается на кислород и воду.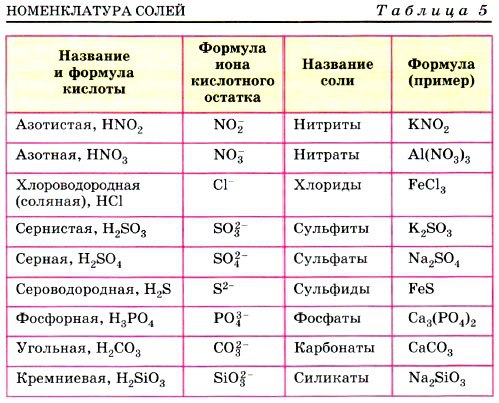 Чем выше концентрация — тем нестабильнее, что постепенно превращается во взрывоопасность. Для стабилизации технического пероксида водорода в него добавляют пирофосфат или станнат натрия; при хранении в алюминиевых емкостях используют ингибитор коррозии — нитрат аммония.
Чем выше концентрация — тем нестабильнее, что постепенно превращается во взрывоопасность. Для стабилизации технического пероксида водорода в него добавляют пирофосфат или станнат натрия; при хранении в алюминиевых емкостях используют ингибитор коррозии — нитрат аммония.
Пероксид водорода в лаборатории обычно представляет собой раствор 38%. При попадании на кожу оказывает химический ожог с характерным белым окрашиванием. Ожог болезненный, особенно на тонкой коже, побелевшая ороговевшая кожа потом часто трескается и зудит.
В медицине используют 3% пероксид водорода для очистки глубоких ран сложного профиля, гнойных затёков, флегмон и других гнойных ран, санация которых затруднена — так вещество обладает не только антисептическим эффектом, но и создаёт большое количество пены при взаимодействии с ферментом каталазой. Это в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые будут легко смыты последующим введением в полость раны антисептического раствора. Кстати, перекись водорода нежелательна в других случаях ран: обладая хорошими очищающими свойствами, это вещество на самом деле не ускоряет процесс заживления, поскольку повреждает прилегающие к ране клетки, равно как и молодые, новообразующиеся ткани — а это ещё и чревато образованием рубцов.
Кстати, перекись водорода нежелательна в других случаях ран: обладая хорошими очищающими свойствами, это вещество на самом деле не ускоряет процесс заживления, поскольку повреждает прилегающие к ране клетки, равно как и молодые, новообразующиеся ткани — а это ещё и чревато образованием рубцов.
Кроме как ожогов на коже — ничего не разъедает и не растворяет. Металлы, стекло и пластики устойчивы к пероксиду водорода.
А ещё пероксид водорода подарил миру много уникальных натуральных блондинок с чёрными корнями волос!
Близки к пероксиду водорода так называемые надкислоты — кислоты, в которых присутствуют пероксидные группы. Пример: надуксусная кислота СН3СОООН — вещество, напоминающее по свойствам пероксид водорода, а потому и использующееся точно в таких же сферах. Есть «первомур» или «С-4» (нет, это не тот С-4, о котором ты подумал) — это пермуравьиная кислота HCOOOН, которая ещё слабее надуксусной, а потому хирируги моют ей руки перед операцией. И наконец — трифторперуксусная кислота СF3СОООН — лютый, бешеный окислитель, на который с восхищением смотрят химики-органики за возможность окисления анилина до нитробензола, получения гипервалентного иода в органических соединениях, реакцию Байера-Виллигера и другие малопонятные нормальным людям вещи. По едкости — трифторуксусная кислота, смешанная с перекисью водорода, чем, собственно, и является, а потому для рук представляет особую опасность, да. В виду своей высокой окислительной способности, трифторперуксусная кислота не продаётся, а обычно получается восхищающимися химиками-органиками прямо там, где необходимо, взаимодействием трифторуксусного ангидрида с пероксидом водорода.
И наконец — трифторперуксусная кислота СF3СОООН — лютый, бешеный окислитель, на который с восхищением смотрят химики-органики за возможность окисления анилина до нитробензола, получения гипервалентного иода в органических соединениях, реакцию Байера-Виллигера и другие малопонятные нормальным людям вещи. По едкости — трифторуксусная кислота, смешанная с перекисью водорода, чем, собственно, и является, а потому для рук представляет особую опасность, да. В виду своей высокой окислительной способности, трифторперуксусная кислота не продаётся, а обычно получается восхищающимися химиками-органиками прямо там, где необходимо, взаимодействием трифторуксусного ангидрида с пероксидом водорода.
Ну вот примерно так, если говорить про жидкость и про едкость. Будут ещё дополнения?
Урок по теме «Кислоты». 8-й класс
“Просто знать – еще не все, знания нужно уметь использовать”
Гёте И.В.
Цели урока: формирование представления учащихся о кислотах.
Задачи урока:
- Образовательная: изучить состав, строение, классификацию и свойства кислот.
- Развивающие (формирование и развитие образовательных компетенций):
а) Учебно-познавательные: развитие навыков самостоятельной познавательной деятельности; учение добывать знания, выделять главное, обобщать, делать выводы и самопроверку с самооценкой.
б) Коммуникативные: навыки работы в группе, взаимодействия с другими людьми;
в) Информационные: выделять существенные признаки химических реакций, извлекать необходимую информацию из проводимого эксперимента, представлять и оформлять результаты своей работы - Воспитательные: воспитывать сознательное отношение к учебному труду, чувство ответственности, развитие интереса к предмету.
- Здоровьесберегающие: закрепить навыки обращения с реактивами, а так же с
кислотами, встречающимися в повседневной жизни.

Планируемые результаты урока:
Знать: определение кислот, их классификацию и свойства.
Уметь: составлять уравнения реакций, подтверждающих их свойства, распознавать кислоты, определять валентность кислотных остатков, слблюдать технику безопасности при обращении с кислотами.
Оборудование: соляная, уксусная и серная кислота, цинк, оксидмеди(П), метилоранж, лакмус, фенолфталеин, гиидроксид натрия, карбонат натрия, карточки для групповых и индивидуальных заданий.
Ход урока
Организационный момент.
1. Мотивация (методы и формы – анализ, фронтальная работа, средства – беседа с учителем).
– Дорогие ребята, давайте вспомним вкус фруктов? Чем объяснить их кисловатый вкус?
Овощи и фрукты содержат органические кислоты .Они играют определенную роль в
пищеварении, а следовательно, в нашей жизни. Мы же сегодня поговорим о
неорганических кислотах, с названиями и формулами которых мы уже знакомились
ранее.
2. Целеполагание. (Методы и средства-анализ, индукция, фронтальная работа, средства – беседа с учителем, создание наглядного материала.)
Давайте определимся с целями и планом сегодняшнего урока. На доске схема плана урока, попробуем ее заполнить.
(К доске вызываются учащиеся и заполняют ее, затем схема переносится в тетрадь, (Приложение 1) ответ: номенклатура, определение, классификация, применение, химические свойства и техника безопасности.) Учащиеся, которые покажут хорошую работу в течение урока при тестировании получат оценку на балл выше. У каждого из вас находится лист учета знаний со всеми необходимыми материалами для урока. К концу урока он должен быть полностью заполнен.
3. Изучение нового материала и совершенствование.
(Методы и средства-анализ, синтез, фронтальная работа, обобщение,
наблюдение, описание, средства – беседа с учителем, лабораторная работа,
групповая работа. )
)
А) Сначала мы вспомним названия и формулы кислот. На доске незаполненный филворд. Найдите названия кислот, спрятанные на поле. Буквы одного слова находятся в соседних по горизонтали или вертикали клетках, напишите формулу и название кислоты в табель на доске, а ваш сосед по парте напишет формулу кислотного остатка и его название. Все учащиеся заполняют такие же табели в тетради. (Приложение 2)
Б) Перед вами на доске формулы различных кислот, что общего между ними? Какое определение можно дать кислотам?
Кислоты – это сложные вещества, состоящие из ионов водорода и кислотных остатков.
Задание: прием “Кодирование”.
Описание: найдите формулы кислот. Разместите их в таком порядке, чтобы получилось внизу название индикатора. (Приложение 3)
В) Кислоты играют важную роль в нашей жизни. Это вы сейчас нам и докажите.
Ваш класс был заранее разделен на группы, каждая из которых приготовила
сообщение с наглядной иллюстрацией по применению и физическим свойствам заданной
кислоты, (пример такой иллюстрации см. Приложение 4).
Приложение 4).
Г) Давайте внимательно посмотрим на кислоты, написанные в карточке, какие отличия вы видите? Все кислоты делят на несколько групп.(Приложение 5)
Вам выданы бланки с незаполненными таблицами по классификации кислот, но заполним мы ее примерами во время игры для которой у вас на столах лежат комплекты дидактической игры.
Задание:
Прием “Химический светофор”.
Описание: учителем заранее готовятся наборы, состоящие из кружков плотной
бумаги одинакового диаметра, но разного цвета(какие цвета необходимы, указано в
инструктивной карточке, которая вывешивается на доске, в ней показаны параметры
классификации кислот и окраска каждого параметра).Работа проходит фактически
индивидуально. Каждому из учеников дается набор цветных карточек– характеристик
по 3 из 6 параметров, а соседу по парте – остальные 3 параметра. Учитель пишет
на доске формулу кислоты ,а каждый ученик должен быстро дать классификацию
кислоты по своим параметрам, подняв кружочек нужной окраски: “зажечь”
соответствующий свет и соединив свои три кружочка с кружочками соседа по парте,
поднимают все 6 кружочков.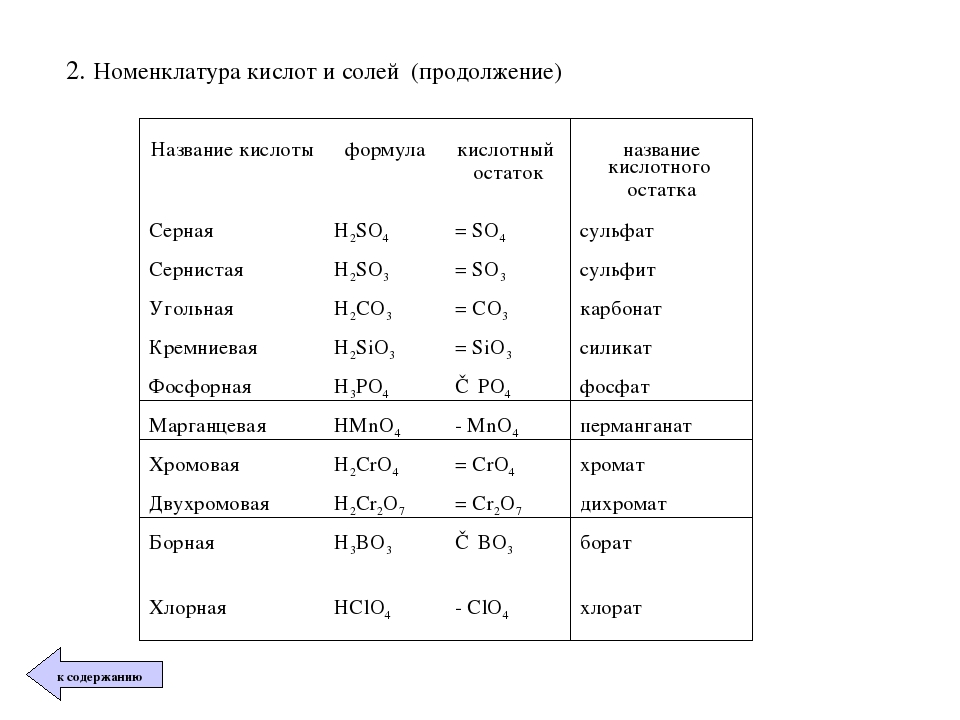 Если ученик допускает ошибку, то дает определение
данного параметра классификации или сосед объясняет ошибку своему товарищу.
После нескольких формул ученики меняются кружочками и параметрами.
Если ученик допускает ошибку, то дает определение
данного параметра классификации или сосед объясняет ошибку своему товарищу.
После нескольких формул ученики меняются кружочками и параметрами.
Инструктивная карточка:
Кислоты: соляная, серная, фосфорная, кремневая, угольная, сероводородная,
Д)А теперь перейдем к практическому изучению кислот.
Задание:
Работа проводится в группах по инструктивным карточкам, затем один человек из группы подходит к доске и вписывает результаты своей группы в таблицу. После того как будет заполнена вся таблица, каждый учащийся заполняет такую же в инструктивной карточке. (Приложение 7)
Но сначала вспомним правила техники безопасности (Приложение 6) и ответим на вопрос карточки.
При работе с кислотой
Не нужна тревога.
С осторожностью простой
Избежишь ожога!Настоящий лаборант
Вот как поступает:
Кислоты чуть-чуть прильет
В воду и мешает!
На выполнение работы у вас 7–9 минут.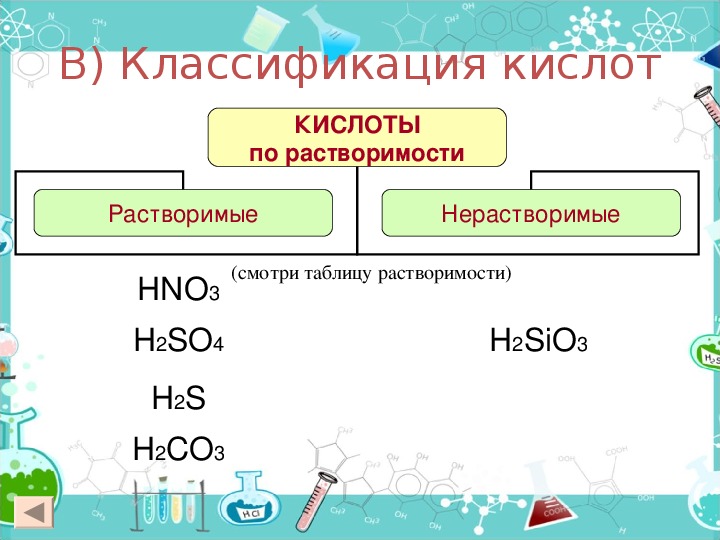
Лабораторная работа по группам. Каждая группа демонстрирует результаты опытов, делает выводы и составляет уравнения химических реакций.
- Группа. Влияние кислот (НС1, h3SO4) нa индикаторы.
- Группа. Взаимодействие НС1 с металлами (магний, цинк, железо, медь).
- Группа. Взаимодействие h3SO4 с солями (карбонатом натрия, хлоридом бария).
- Группа . Взаимодействие h3SO4 с гидроксидами (гидроксидом бария,
проверка среды
полученного раствора). - Демонстрация учителя взаимодействия соляной кислоты с оксидом меди(Н).
Представление результатов работы групп в сводную таблицу.
Давайте повторим свойства кислот.
Задание: вставьте пропущенную формулу с учетом коэффициентов.
(Приложение 8)
4. Контроль (методы и средства – индивидуальная работа ,обобщение, средства – конспект урока).
Задание.
Выполните задания по контролю знаний.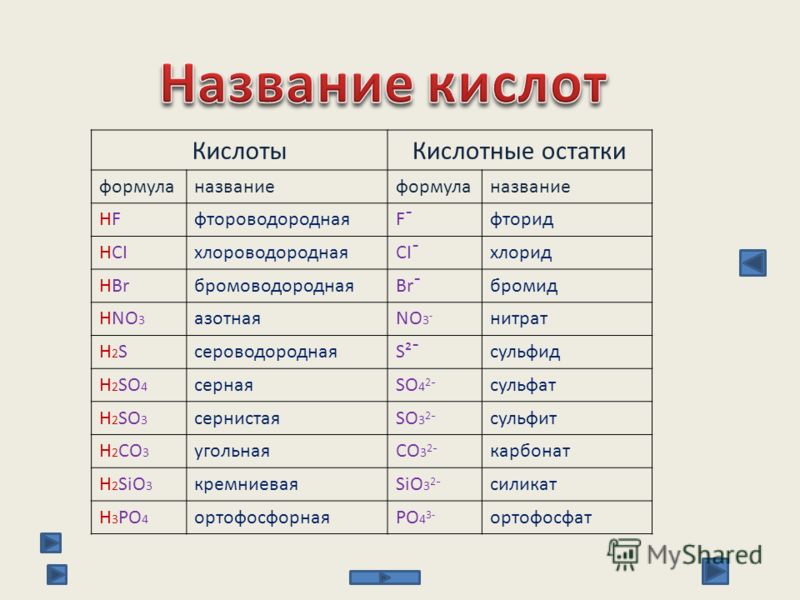 Через 5 минут мы проверим тест, будьте
готовы обосновать свои ответы. (Приложение 9)
Через 5 минут мы проверим тест, будьте
готовы обосновать свои ответы. (Приложение 9)
5. Подведение итогов. Обсуждение ответов тестового задания и
выставление оценок самым
активным ученикам.
6. Домашнее задание.
Конспект урока, параграф по теме “Кислоты”, создать “Шпаргалку” по кислотам(пример такой шпаргалки в Приложении 10 выполнить самостоятельную работу по карточке, которая дана на дом. (Приложение 11)
7. Список литературы.
- В.Г. Денисова “Химия. Поурочные планы по учебнику О.С. Габриеляна”, Волгоград 2009.
- Т.А. Боровских “Обучение химии в 8 кл. Методическое пособие.”, Москва 2007.
- C.В. Дендебер, О.В. Ключникова “Современные технологии в преподавании химии”, Москва 2007.
- Н.С. Павлова “Контрольные и самостоятельные работы по химии,8 кл.” Москва , 2009.
- Н.
 П. Троегубова “Контрольно-измерительные материалы,8 кл.”,
Москва 2010.
П. Троегубова “Контрольно-измерительные материалы,8 кл.”,
Москва 2010. - Е.И. Воронине Методическое пособие с электронным приложением “Повторение и контроль знаний,8 кл.”, Москва 2011.
- Морозов В.Е., Бузинова О.П. Методическое пособие с электронным приложением “Мастер-класс учителя химии”, Москва 2010.
Наконец-то все кислоты в одном… — Репетитор по химии ЕГЭ
Мой топ адских заданий ЕГЭ по химии (часть 1)
На что обратить особое внимание при подготовке и повторении?
Ставим сердечки ❤️❤️❤️ и поехали ⤵️⤵️
Идём по порядку:
📌 6 задание на реакции ионного обмена.
Есть там свои тонкости…
Формулировка: в пробирку с сульфатом меди (II) добавили раствор вещества Х. В результате выпал осадок. Определить что за вещество Х из предложенных вариантов.
Задание высокобальное — даётся 2 балла
📌 7 задание на соответствие 🤯
С этим заданием у ребят особая любовь 😅
Тут нужно продумать какой ряд веществ подходит в качественные реагентов. Требует достаточно много времени и, к сожалению, здесь часто допускаются ошибки.
Требует достаточно много времени и, к сожалению, здесь часто допускаются ошибки.
Но мы то с ребятами на курсе упорно их отрабатываем 😉
Задание высокобальное — даётся 2 балла
📌 8 задание
Аналогично 7 заданию. И тоже высокобальное — 2 балла.
📌 9 задание на неорганическую цепочку.
На мой взгляд чуть проще, решается быстрее. Но неорганику нужно знать отлично!
📌 простите, но дальше объединила почти все тестовые задания на химические свойства органических веществ: с 12 задания по 16 задание.
Особое внимание я бы уделила 13 заданию на амины. Этот класс изучается в самом конце обучения и многие недоучивают ❗️
В том году моей ученице попался КИМ, где было много заданий про амины, а также вторая часть, чего она не ожидала.
📌 17 задание — классификация реакций как неорганических, так и органических.
В последнее время усложнили это задание. Ещё и может быть разное количество правильных ответов: и 2 и 3 и 4 😳
📌 24 задание на качественные реакции
Здесь нужно выбрать реагент, с помощью которого можно различить два вещества.
В этом задании частенько ошибаются, потому что требуются знания свойств как по неорганике, так и по органике.
Задание высокобальное!
Смотрите примеры в карусели, пробуйте решить 🔜
И проложение про вторую часть следует 🙃Согласны с моим списком?? Делитесь ⤵️
Ответы | § 22. Понятие о кислотах — Химия, 7 класс
1. Атомы какого химического элемента обязательно входят в состав всех кислот?
В состав всех кислот обязательно входят атомы водорода.
2. Изготовьте из пластилина модели молекул кислот в соответствии с рисунком 86. Сделайте фото этих моделей.
3. В формулах кислот HCl, HNO3, h3SO4, h4PO4 подчеркните кислотные остатки и укажите валентность каждого из них.
4. Заполните в тетради таблицу.
| Название кислоты | Формула кислоты | Формула кислотного остатка | Название кислотного остатка |
| Азотная | HNO3 | NO3 | Нитрат |
| Серная | H2SO4 | SO4 | Сульфат |
| Угольная | H2CO3 | CO3 | Карбонат |
| Фосфорная | H3PO4 | PO4 | Фосфат |
5.
 Составьте формулы кислот, в состав которых входят кислотные остатки (в скобках указана их валентность): NO2(I), SO3(II), MnO4(I).
Составьте формулы кислот, в состав которых входят кислотные остатки (в скобках указана их валентность): NO2(I), SO3(II), MnO4(I).| Кислотный остаток (валентность) | Формула кислоты |
| NO2(I) | НNO2 |
| SO3(II) | НSO3 |
| MnO4(I) | НMnO4 |
6. В какой из кислот — HCl, h3СO3, h3SO4 — массовая доля водорода наибольшая? Выполните соответствующие расчеты.
7. Каковы меры предосторожности при работе с кислотами? Что нужно делать, если кислота попала на кожу или на одежду?
С кислотами следует обращаться крайне осторожно. Если кислота все же попала на кожу или одежду, нужно немедленно промыть пораженный участок большим количеством холодной воды, а затем раствором питьевой воды.
8.
 В состав некоторых газированных напитков входит одна из известных вам кислот. Общее число атомов в ее кислотном остатке равно 5, а число атомов водорода в молекуле на один меньше числа атомов кислорода. О какой кислоте идет речь?
В состав некоторых газированных напитков входит одна из известных вам кислот. Общее число атомов в ее кислотном остатке равно 5, а число атомов водорода в молекуле на один меньше числа атомов кислорода. О какой кислоте идет речь?Речь идет об угольной кислоте – H2CO3.
Присоединяйтесь к Telegram-группе @superresheba_7, делитесь своими решениями и пользуйтесь материалами, которые присылают другие участники группы!Свойства кислот в свете ТЭД
Она жжётся и кусается,
Если к нам на руки проливается.
Дырки в брюках оставляет
И бумагу прожигает.
Вот такая вот она –
Эта наша …!
Кислоты
– это электролиты, при диссоциации которых в водных
растворах в качестве катионов образуются ионы водорода. Именно наличие ионов
водорода обуславливает общие свойства всех кислот.
Рассмотрим свойства, характерные для всех кислот.
Все растворы кислот изменяют окраску индикаторов. Изменение окраски индикаторов связано с наличием у кислот ионов водорода, образующихся при диссоциации кислот.
HCl = H+ + Cl—
HNO3 = H+ + NO3—
HNO2⇆ H+ + NO2—
Если
мы в раствор кислоты добавим несколько капель лакмуса, то раствор
окрасится в красный цвет, т.е. в кислотах лакмус изменяет окраску с фиолетовой
на красную, если мы в раствор кислоты добавим несколько капель
метилового оранжевого, то раствор кислоты станет тоже красного цвета, т.е.
и метиловый оранжевый в кислотах изменяет свою окраску с оранжевой на красную. Фенолфталеин
не изменяет свою окраску в присутствии кислот.
Действие кислот на индикаторы
Кислоты реагируют с основаниями: как с растворимыми, так и с нерастворимыми. При этом образуется соль и вода. Этот тип реакций относится к реакциям обмена.
Кислота + основание = соль + вода
Например, если мы в пробирку с гидроксидом натрия добавим несколько капель фенолфталеина, то раствор щёлочи окрасится в малиновый цвет, а затем сюда же добавим раствор соляной кислоты, то малиновая окраска исчезает. Окраска исчезает, т.к. в результате этой реакции образуется соль и вода. Образование соли можно легко подтвердить: если мы на предметное стекло капнем несколько капель раствора и выпарим, то на стекле появятся кристаллы соли.
NaOH + HCl = NaCl + H2O
ОН— + Н+ = Н2О
Аналогично
кислоты реагируют с нерастворимыми основаниями. Получим, например,
нерастворимое основание – гидроксид железа (III).
Для этого, в раствор сульфата железа (III)
добавим несколько капель гидроксида калия, при этом образуется
осадок бурого цвета – это гидроксид железа (III).
К этому нерастворимому основанию добавим соляной кислоты, осадок растворяется,
т.к. образуется соль и вода. Если мы этот раствор соли поместим на предметное
стекло и выпарим, то на стекле появятся кристаллы жёлтого цвета – это кристаллы
соли хлорида железа (III).
Получим, например,
нерастворимое основание – гидроксид железа (III).
Для этого, в раствор сульфата железа (III)
добавим несколько капель гидроксида калия, при этом образуется
осадок бурого цвета – это гидроксид железа (III).
К этому нерастворимому основанию добавим соляной кислоты, осадок растворяется,
т.к. образуется соль и вода. Если мы этот раствор соли поместим на предметное
стекло и выпарим, то на стекле появятся кристаллы жёлтого цвета – это кристаллы
соли хлорида железа (III).
Fe2(SO4)3 + 6КOH = 2Fe(OH)3↓ + 3К2SO4
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
Кислоты также вступают в
реакцию обмена с оксидами металлов. В результате
реакции образуется соль и вода.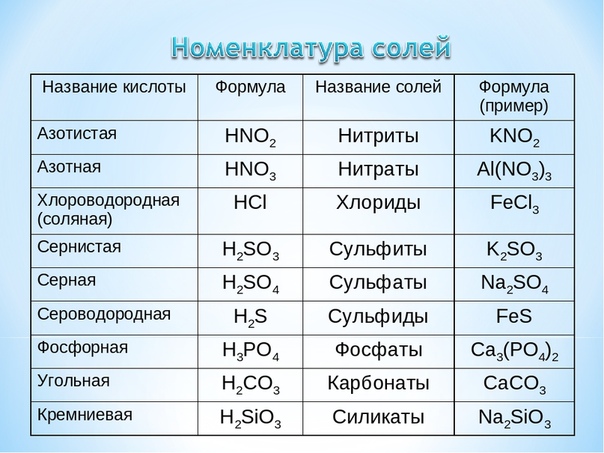
Кислота + оксид металла = соль + вода
Поместим в пробирку оксид металла – оксид меди (II), он чёрного цвета, нальём в эту же пробирку раствор серной кислоты и слегка нагреем содержимое пробирки. У нас протекает реакция, в результате которой образуется соль – сульфат меди (II) и вода. Доказать, что в реакции образовалась соль можно так же, как и в предыдущих опытах, для этого следует несколько капель раствора поместить на предметное стекло и выпарить.
CuO + H2SO4 = CuSO4 + H2O
CuO + 2H+ = Cu2+ + H2O
Кислоты реагируют с металлами, эти реакции относятся к реакциям замещения, при этом образуется соль и выделяется водород.
Кислота + металл = соль + водород
Для того чтобы реакция между кислотой и металлом прошла, необходимы следующие условия:
·
Металл
должен находиться в ряду напряжений до водорода.
· Должна получиться растворимая соль.
· Нерастворимые кислоты не вступают в реакцию с металлами.
· Концентрированный раствор серной и растворы азотной кислоты иначе реагируют с металлами.
Для этого подтверждения поместим в четыре пробирки металлы: в первую пробирку – цинк, во вторую – алюминий, в третью – свинец, четвёртую – медь. В первую и третью пробирку нальём раствора серной кислоты, во вторую и четвёртую – раствора соляной кислоты. Понаблюдаем за изменениями. В первой и второй пробирке наблюдается выделение водорода, в третьей и четвёртой – нет. В пробирке со свинцом и серной кислотой реакция не пошла, т.к. в результате образуется нерастворимая соль, которая покрывает всю поверхность металла защитной плёнкой. В четвёртой пробирке также изменений нет, т.к. медь стоит в ряду напряжений металлов после водорода.
Zn + H2SO4 = ZnSO4 + H2↑
Zn0 + 2H+ = Zn2+ + H20↑
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al0 + 6H+ = 2Al3+ + 3H20↑
Pb + H2SO4 ≠
Cu + HCl ≠
Реакция
кислот с солями относится к реакциям обмена, при этом
образуется новая кислота и новая соль. Эти реакции протекают в том случае, если
образуется осадок или газ.
Эти реакции протекают в том случае, если
образуется осадок или газ.
Кислота + соль = новая кислота + новая соль
Проведём опыт: для этого в первую пробирку нальём соляной кислоты и силиката натрия, во вторую – серной кислоты и карбоната калия, в третью – соляной кислоты и хлорида бария. Посмотрим за изменениями: в первой пробирке мы наблюдаем образование студенистого осадка, во второй – выделение газа, а в третьей – изменений нет. В двух пробирках реакции прошли, т.к. выполнялись следующие условия: в первой – образование осадка, во второй – выделение газа.
2HCl + Na2SiO3 = 2NaCl + H2SiO3↓
2H+ + SiO32- = H2SiO3↓
H2SO4 + K2CO3 = K2SO4 + CO2↑ + H2O
2H+ + CO32- = CO2↑ + H2O
HCl + BaCl2 ≠
Подведем
итог.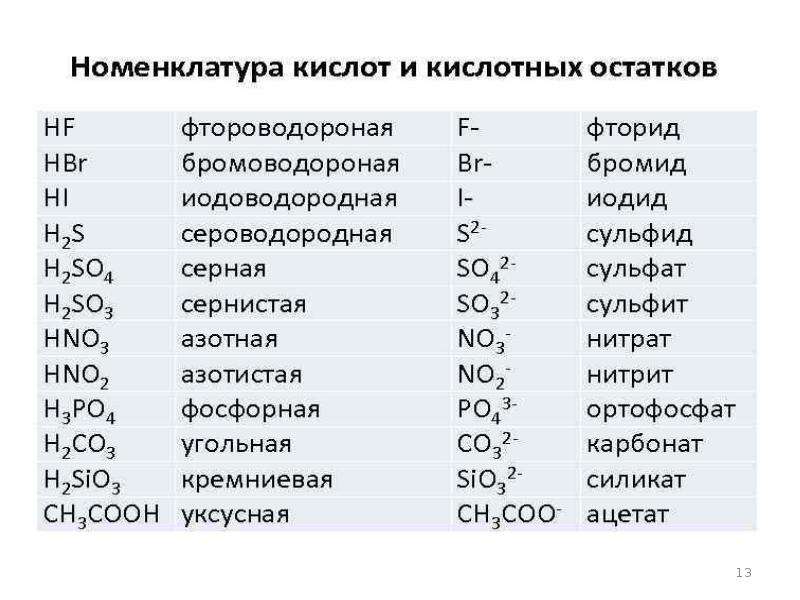 Кислоты изменяют окраску индикаторов, реагируют
с основаниями, оксидами металлов, при определённых условиях реагируют с
металлами и солями.
Кислоты изменяют окраску индикаторов, реагируют
с основаниями, оксидами металлов, при определённых условиях реагируют с
металлами и солями.
14.2: Кислоты: свойства и примеры
Цели обучения
- Изучить свойства кислот.
Многие любят пить кофе. Чашка первым делом с утра помогает начать день. Но содержать кофеварку в чистоте может быть проблемой. Известковые отложения накапливаются через некоторое время и замедляют процесс пивоварения. Лучшее лекарство от этого — налить в кастрюлю уксус (разбавленную уксусную кислоту) и запустить цикл заваривания. Уксус растворяет отложения и очищает кофеварку, что ускорит процесс заваривания до его первоначальной скорости.Просто не забудьте пропустить воду через процесс заваривания после уксуса, иначе вы получите действительно ужасный кофе.
Кислоты
Кислоты очень распространены в некоторых продуктах, которые мы едим. Цитрусовые, такие как апельсины и лимоны, содержат лимонную кислоту и аскорбиновую кислоту, более известную как витамин С. Газированные газированные напитки содержат фосфорную кислоту. Уксус содержит уксусную кислоту. Ваш собственный желудок использует соляную кислоту для переваривания пищи. Кислоты представляют собой отдельный класс соединений из-за свойств их водных растворов, как указано ниже:
Газированные газированные напитки содержат фосфорную кислоту. Уксус содержит уксусную кислоту. Ваш собственный желудок использует соляную кислоту для переваривания пищи. Кислоты представляют собой отдельный класс соединений из-за свойств их водных растворов, как указано ниже:
- Водные растворы кислот являются электролитами, то есть проводят электрический ток.Некоторые кислоты являются сильными электролитами, так как полностью ионизируются в воде, образуя большое количество ионов. Другие кислоты являются слабыми электролитами, существующими в основном в неионизированной форме при растворении в воде.
- Кислоты имеют кислый вкус. Лимоны, уксус и кислые леденцы содержат кислоты.
- Кислоты изменяют цвет некоторых кислотно-щелочных индикаторов. Двумя распространенными индикаторами являются лакмус и фенолфталеин. Синий лакмус в присутствии кислоты становится красным, а фенолфталеин обесцвечивается.
- Кислоты реагируют с активными металлами с образованием газообразного водорода.
 Напомним, что ряд активности — это список металлов в порядке убывания реакционной способности. Металлы, находящиеся выше водорода в ряду активности, заменят водород из кислоты в реакции с одним замещением, как показано ниже:
Напомним, что ряд активности — это список металлов в порядке убывания реакционной способности. Металлы, находящиеся выше водорода в ряду активности, заменят водород из кислоты в реакции с одним замещением, как показано ниже:
\[\ce{Zn} \left( s \right) + \ce{H_2SO_4} \left ( aq \right) \rightarrow \ce{ZnSO_4} \left( aq \right) + \ce{H_2} \left( g \right) \label{eq1}\] - Кислоты реагируют с основаниями с образованием соединения соли и воды.При соединении равных молей кислоты и основания кислота нейтрализуется основанием. Продуктами этой реакции являются ионное соединение, обозначаемое как соль, и вода.
Вам не составит труда назвать несколько распространенных кислот (но вы можете обнаружить, что список оснований немного сложнее). Ниже приведен неполный список некоторых распространенных кислот, а также некоторые химические формулы:
Имя химика | Общее имя | Использование |
|---|---|---|
соляная кислота, HCl | соляная кислота (используется в бассейнах) и желудочная кислота — HCl | .Применяется при очистке (рафинировании) металлов, при уходе за плавательными бассейнами и для бытовой уборки. |
серная кислота, H 2 SO 4 | Используется в автомобильных аккумуляторах и при производстве удобрений. | |
азотная кислота, HNO 3 | Используется в производстве удобрений, взрывчатых веществ и при добыче золота. | |
уксусная кислота, УВ 2 H 3 O 2 | уксус | Основной ингредиент уксуса. |
угольная кислота, H 2 CO 3 | отвечает за «шипение» в газированных напитках | В качестве ингредиента газированных напитков. |
лимонная кислота, C 6 H 8 O 7 | Используется в пищевых продуктах и пищевых добавках. Также добавляется в качестве подкислителя в кремы, гели, жидкости и лосьоны. | |
ацетилсалициловая кислота, C 6 H 4 (OCOCH 3 )CO 2 H | аспирин | Активный ингредиент аспирина. |
Что именно делает кислоту кислотой и что заставляет основание действовать как основание? Взгляните на формулы, приведенные в таблице выше, и сделайте предположение.
Соляная кислота
Соляная кислота — коррозионная, сильная минеральная кислота, находящая широкое применение в промышленности.{-} (водный) }\]
Таким образом,Соляная кислота может быть использована для получения хлористых солей. Соляная кислота является сильной кислотой, так как полностью диссоциирует в воде. Соляная кислота является предпочтительной кислотой при титровании для определения количества оснований.
Серная кислота
Серная кислота представляет собой сильно коррозионную сильную минеральную кислоту с молекулярной формулой \(\ce{h3SO4}\). Серная кислота представляет собой двухосновную кислоту и имеет широкий спектр применений, включая использование в бытовых кислотных очистителях канализации, [] в качестве электролита в свинцово-кислотных батареях и в различных чистящих средствах. Это также центральное вещество в химической промышленности.
Это также центральное вещество в химической промышленности.
Поскольку гидратация серной кислоты термодинамически выгодна (и сильно экзотермична) и ее сродство к воде достаточно велико, серная кислота является отличным дегидратирующим агентом. Концентрированная серная кислота обладает очень мощным обезвоживающим свойством, удаляя воду (\(\ce{h3O}\)) из других соединений, включая сахар и другие углеводы, и выделяя углерод, тепло, пар.Серная кислота ведет себя как обычная кислота при взаимодействии с большинством металлов с образованием газообразного водорода (уравнение \ref{Eq1}).
\[\ce{M + h3SO4 → M(SO4) + h3} \label{Eq1}\]
Азотная кислота
Азотная кислота (\(\ce{HNO3}\)) является очень коррозионной минеральной кислотой и также обычно используется в качестве сильного окислителя. Азотная кислота обычно считается сильной кислотой при температуре окружающей среды. Азотную кислоту можно получить путем взаимодействия диоксида азота (\(\ce{NO_2(g)}\)) с водой.
Азотная кислота обычно считается сильной кислотой при температуре окружающей среды. Азотную кислоту можно получить путем взаимодействия диоксида азота (\(\ce{NO_2(g)}\)) с водой.
\[\ce{3 NO2(г) + h3O(ж)→ 2 HNO3(г) + NO(г)}\]
Азотная кислота реагирует с большинством металлов, но подробности зависят от концентрации кислоты и природы металла. Разбавленная азотная кислота ведет себя как обычная кислота при взаимодействии с большинством металлов (например, азотная кислота с магнием, марганцем или цинком выделяет \(\ce{h3}\) газ):
\[\ce{Mg + 2 HNO3 → Mg(NO3)2 + h3 }\]
\[\ce{Mn + 2 HNO3 → Mn(NO3)2 + h3 }\]
\[\ce{Zn + 2 HNO3 → Zn(NO3)2 + h3 }\]
Азотная кислота является коррозионной кислотой и сильным окислителем.Главной опасностью, которую он представляет, является химический ожог, так как он осуществляет кислотный гидролиз белков (амид) и жиров (эфир), что приводит к разложению живой ткани (Рисунок \(\PageIndex{2}\)). Концентрированная азотная кислота окрашивает кожу человека в желтый цвет из-за реакции с кератином
. Рисунок \(\PageIndex{2}\): Ожог второй степени, вызванный азотной кислотой. (CC BY-SA 3.0; Алькаман).
Рисунок \(\PageIndex{2}\): Ожог второй степени, вызванный азотной кислотой. (CC BY-SA 3.0; Алькаман).Угольная кислота
Углекислота — это химическое соединение с химической формулой \(\ce{h3CO3}\), а также это название, которое иногда дается растворам диоксида углерода в воде (газированная вода), поскольку такие растворы содержат небольшое количество \(\ce {h3CO3(водн.)}\).Угольная кислота, которая является слабой кислотой, образует два вида солей: карбонаты и бикарбонаты. В геологии угольная кислота вызывает растворение известняка с образованием бикарбоната кальция, что приводит к появлению многих особенностей известняка, таких как сталактиты и сталагмиты. Угольная кислота является полипротонной кислотой, в частности, она является двухосновной, что означает, что она имеет два протона, которые могут диссоциировать от исходной молекулы.
Когда диоксид углерода растворяется в воде, он находится в химическом равновесии (обсуждается в главе 15), образуя угольную кислоту:
\[\ce{CO2 + h3O <=> h3CO3} \]
Реакцию можно подтолкнуть так, чтобы реагенты генерировали \(\ce{CO2(g)}\) из раствора, что является ключом к образованию пузырьков, наблюдаемых в газированных напитках (рис.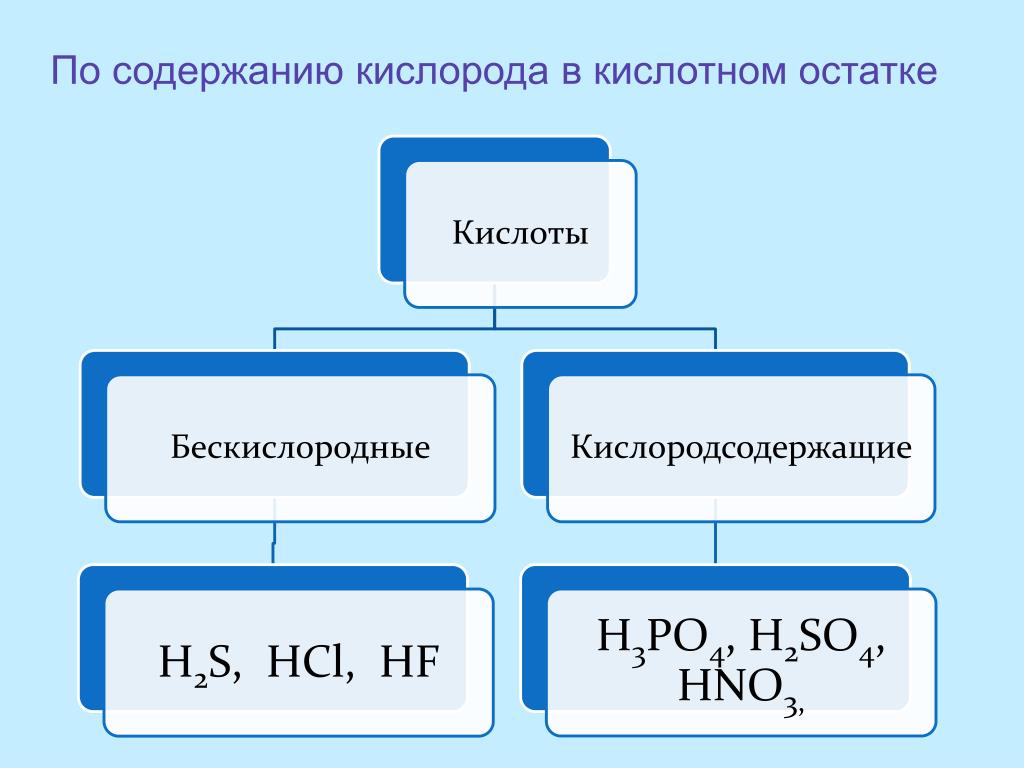 \(\PageIndex{3}\)).
\(\PageIndex{3}\)).
Муравьиная кислота
Муравьиная кислота (\(\ce{HCO2H}\)) представляет собой простейшую карбоновую кислоту и является важным промежуточным продуктом в химическом синтезе и встречается в природе, особенно у некоторых муравьев. Слово «муравьиный» происходит от латинского слова formica, обозначающего муравья, что указывает на его раннюю изоляцию путем перегонки тел муравьев. Муравьиная кислота широко встречается в природе в виде формиата сопряженного основания.
Лимонная кислота
Лимонная кислота (\(\ce{C6H8O7}\)) представляет собой слабую органическую трикарбоновую кислоту, которая естественным образом встречается в цитрусовых.Ион цитрата является промежуточным звеном в цикле ТСА (цикл Кребса), центральном метаболическом пути для животных, растений и бактерий. Поскольку это одна из самых сильных пищевых кислот, лимонная кислота в основном используется в качестве ароматизатора и консерванта в продуктах питания и напитках, особенно в безалкогольных напитках.
Ацетилсалициловая кислота
Ацетилсалициловая кислота (также известная как аспирин) — это лекарство, используемое для лечения боли, лихорадки и воспаления.Аспирин в виде листьев ивы использовался для улучшения здоровья в течение как минимум 2400 лет.
Рисунок \(\PageIndex{5}\): Шариковая модель молекулы аспирина. (Общественное достояние; Бен Миллс).Аспирин представляет собой белое кристаллическое слабокислотное вещество.
Резюме
Был дан краткий обзор ключевых аспектов некоторых кислот, с которыми обычно сталкиваются студенты. Кислоты представляют собой отдельный класс соединений из-за свойств их водных растворов.
Взносы и ссылки
Эта страница была создана на основе контента следующих авторов и отредактирована (тематически или подробно) командой разработчиков LibreTexts в соответствии со стилем, презентацией и качеством платформы:
Сильные кислоты и основания: Таблица и примеры — Видео и расшифровка урока
Сильные кислоты
Возможно, вы немного удивитесь, когда узнаете, что одна из самых сильных кислот находится внутри вашего тела! Соляная кислота или HCl представляет собой сложное вещество, состоящее из атомов водорода и хлора, которое имеет pKa -7. Теперь эта кислота не существует в полной силе в вашем организме. Его смешивают с другими соединениями, снижающими кислотность.
Теперь эта кислота не существует в полной силе в вашем организме. Его смешивают с другими соединениями, снижающими кислотность.
| Химическое название | Химическая формула | Ионизация |
|---|---|---|
| Соляная кислота | HCl | Н(+) + Cl(-) |
| Серная кислота | h3 SO4 | Н(+) + HSO4 |
| Азотная кислота | HNO3 | Н(+) + NO3 |
| Йодоводородная кислота | Привет | Н(+) + И(-) |
| Кислота бромистоводородная | HBr | Н(+) + Бр(-) |
| Хлорная кислота | HClO4 | Н(+) + HClO3 |
Если вы занимаетесь садоводством, то вы, вероятно, использовали удобрение, сделанное из серной кислоты , еще одной сильной кислоты.Серная кислота представляет собой кислоту, состоящую из водорода в сочетании с сульфатом, что дает химическую формулу h3 SO4 .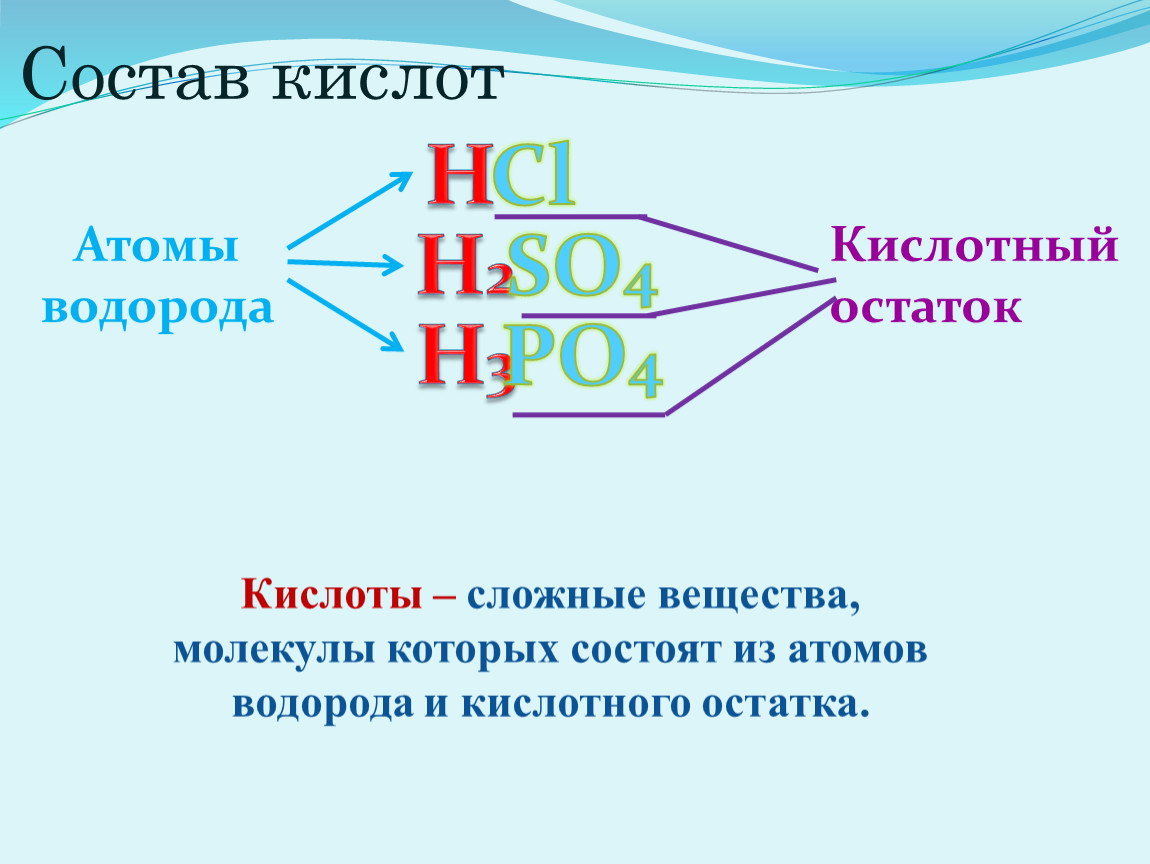 РКа серной кислоты составляет от -3 до 2 в зависимости от концентрации.
РКа серной кислоты составляет от -3 до 2 в зависимости от концентрации.
Или, возможно, вы использовали удобрение, изготовленное из азотной кислоты или HNO3 . Это сильная кислота, состоящая из водорода и нитрата, с pKa -1,3. Другие сильные кислоты включают йодистоводородную кислоту, хлорную кислоту, бромистоводородную кислоту и хлорную кислоту.
Сильные основания
Скорее всего, в вашем доме сейчас есть вещества, изготовленные из сильных оснований. NaOH или гидроксид натрия представляет собой основное вещество с pKb около 0,2, состоящее из атома натрия и молекулы гидроксида. Он обычно используется в производстве пластика и очистителей канализации.
| Химическое название | Химическая формула | Ионизация |
|---|---|---|
| Гидроксид натрия | NaOH | Na(+) + ОН(-) |
| Гидроксид калия | КОН | К(+) + ОН(-) |
| Гидроксид рубидия | РбОН | Rb(+) + ОН(-) |
| Гидроксид кальция | CaOH3 | Са(+) + 2ОН(-) |
| Гидроксид цезия | CsOH | Cs(+) + ОН(-) |
| Гидроксид лития | LiOH | Li(+) + ОН(-) |
Другим сильным основанием является гидроксид калия с химической формулой KOH . Это основное вещество с pKb 0,5. Это обычное основание в щелочных батареях и многих мылах и моющих средствах. Иногда вы будете встречать его под другим названием — едкий калий.
Это основное вещество с pKb 0,5. Это обычное основание в щелочных батареях и многих мылах и моющих средствах. Иногда вы будете встречать его под другим названием — едкий калий.
Есть около четырех других подставок, которые считаются сильными подставками, дополняющими шесть сильнейших подставок. Это гидроксид рубидия, гидроксид кальция, гидроксид цезия и гидроксид лития.
Резюме урока
Теория Аррениуса утверждает, что кислоты представляют собой заряженные молекулы или соединения, которые выделяют ионы водорода (H+) при диссоциации, а основания представляют собой заряженные молекулы или соединения, которые выделяют ионы гидроксида (OH-) при диссоциации. они диссоциируют.Базовый также называют щелочным .
Ka говорит о вероятности диссоциации кислоты, а Kb говорит о вероятности диссоциации основания. pKa — отрицательный логарифм Ka, а pKb — отрицательный логарифм Kb. Меньшие значения pKa указывают на сильную кислоту, а меньшие значения pKb указывают на сильное основание.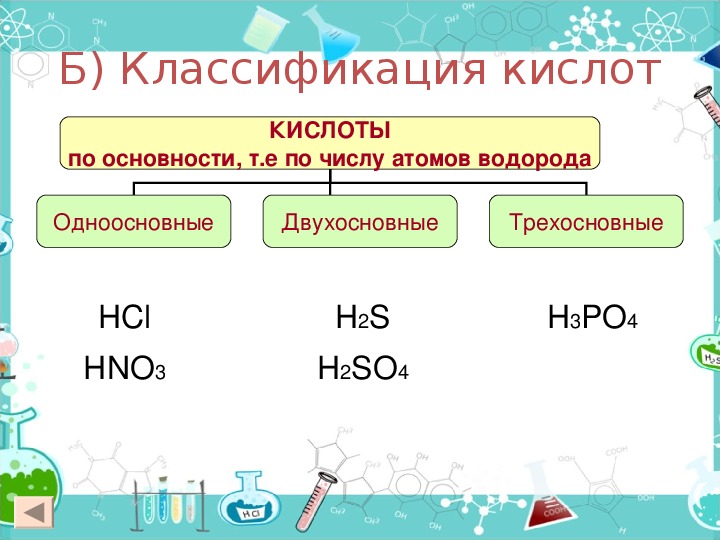
К сильным кислотам относятся:
- Соляная кислота (HCl) : pKa-7
- Серная кислота (h3 SO4 : pKa от -3 до -2
- Азотная кислота (HNO3) : pKa 1.3
- Кислота йодистоводородная
- Кислота хлорная
- Кислота бромистоводородная
- Хлорная кислота
К сильным основаниям относятся:
- Гидроксид натрия (NaOH) : pKb 0,2
- Гидроксид калия (KOH) , также называемый едким кали: pKb 0,5
- Гидроксид рубидия
- Гидроксид кальция
- Гидроксид цезия
- Гидроксид лития
7 сильных кислот
Если вы изучаете химию, вам, несомненно, необходимо знать 7 сильных кислот. Прочтите это руководство, чтобы узнать, что такое 7 сильных кислот, почему они важны и почему они не обязательно самые опасные кислоты, с которыми вы будете работать в лаборатории.
Что такое сильная кислота?
Когда кислота маркируется как сильная кислота, на самом деле это не имеет никакого отношения к тому, насколько она мощная или агрессивная. «Сила» кислоты просто относится к ее способности выделять ионы водорода в раствор. Сильные кислоты — это кислоты, полностью диссоциирующие на ионы в воде.Это означает, что в растворе все их молекулы распадаются. Сильные кислоты дают по крайней мере один катион водорода (H + ) на молекулу. Слабые кислоты, с другой стороны, будут диссоциировать менее чем на 1%, что означает, что очень немногие из их молекул расщепляются с выделением иона водорода.
«Сила» кислоты просто относится к ее способности выделять ионы водорода в раствор. Сильные кислоты — это кислоты, полностью диссоциирующие на ионы в воде.Это означает, что в растворе все их молекулы распадаются. Сильные кислоты дают по крайней мере один катион водорода (H + ) на молекулу. Слабые кислоты, с другой стороны, будут диссоциировать менее чем на 1%, что означает, что очень немногие из их молекул расщепляются с выделением иона водорода.
Почему это важно? Это связано с химическими реакциями. Вот реакция ионизации сильной кислоты, соляной кислоты:
HCl → H + + Cl —
Обратите внимание, что в продукте есть ион водорода.Весь реагент (HCl) был ионизирован во время реакции. Также обратите внимание, что реакция идет только в одном направлении. После ионизации сильной кислоты реакция останавливается и становится необратимой.
Вот реакция этановой кислоты, слабой кислоты:
CH 3 COOH + H 2 O ⇆ H 3 O+ + CH 3 COO —
Обратите внимание, что стрелка реакции указывает в обоих направлениях. Это означает, что реакция идет в обоих направлениях, чего нельзя сказать о сильных кислотах.Слабые кислоты только немного диссоциируют, и их ионы водорода будут продолжать перемещаться между частью слабой кислоты и частью воды. Эта реакция обратима и будет повторяться много раз, превращая кислоту.
Это означает, что реакция идет в обоих направлениях, чего нельзя сказать о сильных кислотах.Слабые кислоты только немного диссоциируют, и их ионы водорода будут продолжать перемещаться между частью слабой кислоты и частью воды. Эта реакция обратима и будет повторяться много раз, превращая кислоту.
В следующем разделе мы перечислим все 7 сильных кислот и рекомендуем вам запомнить их. Однако, если вы забыли, является ли кислота сильной или слабой, вы также можете посмотреть на ее константу равновесия/константу диссоциации кислоты (K a ). Сильные кислоты будут иметь большие значения для K и , в то время как слабые кислоты будут иметь очень маленькие значения для K и .
Список сильных кислот
Существует только 7 сильных кислот; все остальные кислоты слабые. Они перечислены ниже по названию и химическому составу.
Название кислоты | Химический состав |
Кислота хлорная | HClO 3 |
Кислота бромистоводородная | ХБр |
Кислота соляная | HCl |
Кислота йодистоводородная | Привет |
Азотная кислота | HNO 3 |
Хлорная кислота | HClO 4 |
Серная кислота | Н 2 SO 4 |
Сильные кислоты против концентрированных кислот
Важно понимать, что сильные/слабые кислоты — это не то же самое, что концентрированные/разбавленные кислоты. Эти термины часто неправильно используются и неправильно заменяют друг друга! Концентрация кислоты показывает, сколько в ней воды или растворителя. Концентрированная кислота содержит небольшое количество воды, в то время как разбавленная кислота содержит большое количество воды. Вы можете иметь разбавленную сильную кислоту, а также концентрированную слабую кислоту.
Эти термины часто неправильно используются и неправильно заменяют друг друга! Концентрация кислоты показывает, сколько в ней воды или растворителя. Концентрированная кислота содержит небольшое количество воды, в то время как разбавленная кислота содержит большое количество воды. Вы можете иметь разбавленную сильную кислоту, а также концентрированную слабую кислоту.
Стандартной концентрации, определяющей, является ли вещество концентрированным или разбавленным, не существует, но, как правило, концентрированные кислоты имеют рН около 3, а разбавленные кислоты имеют рН ближе к 7.
Сильные кислоты против агрессивных кислот
Тот факт, что кислота сильная, не означает, что она вызывает коррозию. Коррозионная активность относится к тому, насколько сильно вещество повреждает поверхность, с которой оно соприкасается. Живая ткань (например, кожа, глаза и т. д.) часто используется в качестве ориентира, поскольку люди хотят знать о любых потенциальных рисках веществ, с которыми они работают.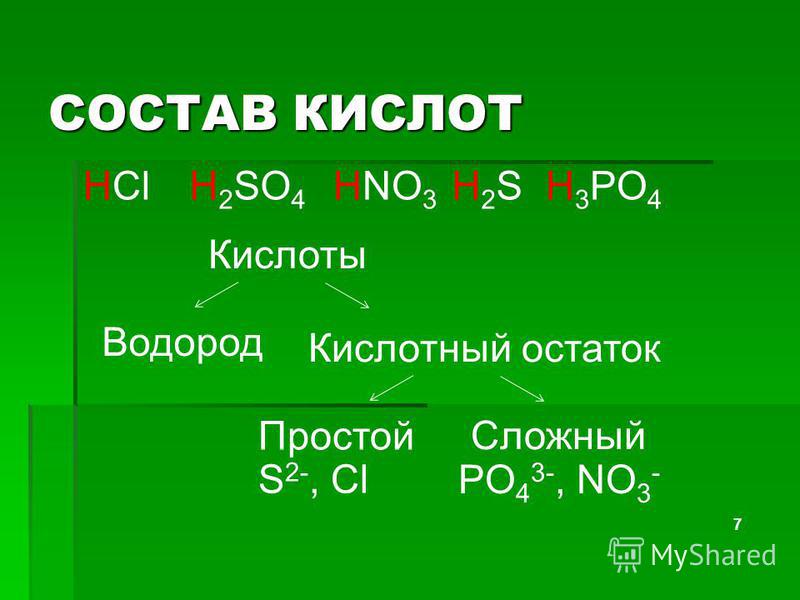
Некоторые химические вещества настолько агрессивны, что могут разъедать плоть и кости, но, опять же, сила кислоты не связана с ее агрессивностью.Эти два термина измеряют разные, не связанные друг с другом вещи. Некоторые сильные кислоты являются очень коррозионными, например, соляная кислота (которая может разъедать нержавеющую сталь) и серная кислота (которая обычно используется в качестве очистителя канализации). Однако слабые кислоты также могут вызывать коррозию, например фтористоводородная кислота, которая может декальцинировать кость.
Когда агрессивные кислоты разбавлены, они часто оказывают меньшее коррозионное воздействие из-за их низкой концентрации. В этом случае они могут действовать только как раздражитель и вызывать более легкие реакции, такие как зуд или покраснение кожи.
Кислоты, окислители и основания могут вызывать коррозию. Слово «едкий» иногда используется как синоним коррозионного вещества, но оно может относиться только к сильным основаниям, а не к любым кислотам.
Резюме: Список сильных кислот
Существует 7 сильных кислот: хлорная кислота, бромистоводородная кислота, соляная кислота, йодистоводородная кислота, азотная кислота, хлорная кислота и серная кислота. Однако принадлежность к списку сильных кислот не дает никаких указаний на то, насколько опасна или вредна кислота.К сильным кислотам и основаниям относятся те, которые полностью диссоциируют в воде.
Слабые кислоты (которыми являются все остальные кислоты) диссоциируют лишь в небольшом количестве. Коррозионная активность кислоты является мерой того, насколько она повреждает такие поверхности, как металл или кожа. Кислота может быть сильной, но довольно безопасной в обращении, если она имеет низкую коррозионную активность, но слабые кислоты также могут быть сильно коррозионными и очень опасными в работе, если не будут приняты надлежащие меры предосторожности.
Что дальше?
Что такое динамическое равновесие и какое оно имеет отношение к ржавым автомобилям? Узнайте, прочитав наше полное руководство по динамическому равновесию.
Ищете другие определения молекулярной химии и объяснения концепций? Читайте об электроотрицательности и гидратах здесь.
Не знаете, в чем разница между физическими и химическими изменениями? Ознакомьтесь с шестью подробными примерами физических и химических изменений, прочитав наше руководство.
Какие уроки естествознания самые важные в старшей школе? Ознакомьтесь с нашим руководством, чтобы узнать обо всех школьных предметах, которые вам следует посещать.
Кислоты – Введение в химию – 1-е канадское издание
Глава 3.Атомы, молекулы и ионы
- Дайте определение кислота.
- Назовите простую кислоту.
Есть еще одна важная для нас группа соединений — кислоты, и эти соединения обладают интересными химическими свойствами. Сначала мы определим кислоту как ионное соединение катиона H + , растворенное в воде. (Мы расширим это определение в главе 12 «Кислоты и основания». ) Чтобы указать, что что-то растворено в воде, мы будем использовать метку фазы (aq) рядом с химической формулой (где aq означает «водный», слово, описывающее что-то растворенное в воде).Если в формуле нет этой метки, то соединение рассматривается как молекулярное соединение, а не как кислота.
) Чтобы указать, что что-то растворено в воде, мы будем использовать метку фазы (aq) рядом с химической формулой (где aq означает «водный», слово, описывающее что-то растворенное в воде).Если в формуле нет этой метки, то соединение рассматривается как молекулярное соединение, а не как кислота.
Кислоты имеют собственную систему номенклатуры. Если кислота состоит только из водорода и еще одного элемента, ее название будет следующим: гидро- + основа другого элемента + -кислота . Например, соединение HCl (водн.) представляет собой соляную кислоту, а H 2 S (водн.) представляет собой сероводородную кислоту. (Если бы эти кислоты не растворялись в воде, соединения назывались бы соответственно хлороводородом и сероводородом.Оба этих вещества хорошо известны как молекулярные соединения; однако при растворении в воде они рассматриваются как кислоты.)
Если соединение состоит из ионов водорода и многоатомного аниона, то название кислоты происходит от основы названия многоатомного иона. Как правило, если название аниона оканчивается на -ate, название кислоты представляет собой основу названия аниона плюс -ic acid ; если название родственного аниона оканчивается на -ite, название соответствующей кислоты представляет собой основу названия аниона плюс -ous acid .В таблице 3.1 «Названия и формулы кислот» перечислены формулы и названия различных кислот, с которыми вы должны быть знакомы. Вы должны узнать большинство анионов в формулах кислот.
Как правило, если название аниона оканчивается на -ate, название кислоты представляет собой основу названия аниона плюс -ic acid ; если название родственного аниона оканчивается на -ite, название соответствующей кислоты представляет собой основу названия аниона плюс -ous acid .В таблице 3.1 «Названия и формулы кислот» перечислены формулы и названия различных кислот, с которыми вы должны быть знакомы. Вы должны узнать большинство анионов в формулах кислот.
| Формула | Имя |
|---|---|
| HC 2 H 3 O 2 | уксусная кислота |
| HClO 3 | хлористоводородная кислота |
| HCl | соляная кислота |
| HBr | бромистоводородная кислота |
| Привет | иодистоводородная кислота |
| ВЧ | фтористоводородная кислота |
| HNO 3 | азотная кислота |
| Н 2 С 2 О 4 | щавелевая кислота |
| HClO 4 | хлорная кислота |
| H 3 Заказ на покупку 4 | фосфорная кислота |
| H 2 SO 4 | серная кислота |
| H 2 SO 3 | сернистая кислота |
Назовите каждую кислоту, не обращаясь к таблице 3. 1 «Названия и формулы кислот».
1 «Названия и формулы кислот».
- HBr
- Н 2 SO 4
Решения
- Название бинарной кислоты: гидро- + основное название + -ic кислота. Поскольку эта кислота содержит атом брома, ее называют бромистоводородной кислотой.
- Поскольку эта кислота получена из сульфат-иона, название кислоты является основой названия аниона + -ic кислоты. Название этой кислоты – серная кислота.
Назовите каждую кислоту.
- ВЧ
- HNO 2
Ответы
- кислота плавиковая
- азотистая кислота
Все кислоты имеют схожие свойства. Например, кислоты имеют кислый вкус; на самом деле кислый вкус некоторых наших продуктов, таких как цитрусовые и уксус, вызван присутствием в пище кислот. Многие кислоты реагируют с некоторыми металлическими элементами с образованием ионов металлов и элементарного водорода. Кислоты заставляют некоторые пигменты растений менять цвет; действительно, созревание некоторых фруктов и овощей вызывается образованием или разрушением избытка кислоты в растении. В главе 12 «Кислоты и основания» мы исследуем химическое поведение кислот.
Кислоты заставляют некоторые пигменты растений менять цвет; действительно, созревание некоторых фруктов и овощей вызывается образованием или разрушением избытка кислоты в растении. В главе 12 «Кислоты и основания» мы исследуем химическое поведение кислот.
Кислоты очень распространены в окружающем нас мире. Мы уже упоминали, что цитрусовые содержат кислоту; среди прочих соединений они содержат лимонную кислоту, H 3 C 6 H 5 O 7 (водн.). Щавелевая кислота, H 2 C 2 O 4 (водн.), содержится в шпинате и других зеленых листовых овощах.Соляная кислота не только содержится в желудке (желудочная кислота), но ее также можно купить в хозяйственных магазинах в качестве чистящего средства для бетона и каменной кладки. Фосфорная кислота входит в состав некоторых безалкогольных напитков.
- Кислота представляет собой соединение иона H + , растворенного в воде.
- Кислоты имеют собственную систему наименования.

- Кислоты обладают определенными химическими свойствами, которые отличают их от других соединений.
- Приведите формулы каждой кислоты.
- хлорная кислота
- иодистоводородная кислота
- Назовите формулы каждой кислоты.
- сероводородная кислота
- фосфористая кислота
- Назовите каждую кислоту.
- HF(водн.)
- HNO 3 (водный)
- H 2 C 2 O 4 (водный)
- Назовите каждую кислоту.
- H 2 SO 4 (водный)
- H 3 ПО 4 (водный)
- HCl (водн.)
- Назовите кислоту, содержащуюся в пище.
- Назовите некоторые общие свойства кислот.
- HClO 4 (водный)
- HI (водн.)
- фтористоводородная кислота
- азотная кислота
- щавелевая кислота
- щавелевая кислота (ответы могут быть разными)
Список 7 лучших сильных кислот
Сильные кислоты: список 7 лучших сильных кислот Любой молодой ученик, изучающий химию в школе, знает, как важно знать и узнавать о кислотах и основаниях. Наш сегодняшний пост в блоге посвящен действительно важной части — сильным кислотам. Часто ли вы оказываетесь в неведении, когда кто-то спрашивает вас – что такое сильные кислоты ? Если да, то вам повезло. Читайте дальше и узнайте, какие сильные кислоты являются семью важными сильными кислотами, их значение, почему вы должны быть осторожны при их использовании в лаборатории и многое другое.
Наш сегодняшний пост в блоге посвящен действительно важной части — сильным кислотам. Часто ли вы оказываетесь в неведении, когда кто-то спрашивает вас – что такое сильные кислоты ? Если да, то вам повезло. Читайте дальше и узнайте, какие сильные кислоты являются семью важными сильными кислотами, их значение, почему вы должны быть осторожны при их использовании в лаборатории и многое другое.
Начать прокрутку.
Что такое сильные кислоты?Прежде чем перейти к списку сильных кислот , очень важно, чтобы вы знали, что такое сильные кислоты.На диалекте химии любая кислота, обозначенная как сильная, не обязательно является слишком мощной или коррозионно-активной. Вместо этого фактором, определяющим классификацию сильных кислот, является их способность выделять ионы водорода (H+) в данный раствор.
Проще говоря, при смешивании сильной кислоты с водой (h3O) она полностью диссоциирует на ионную форму – Н+ и анион. Если сказать еще проще, то в растворе распадаются все молекулы сильной кислоты. Любая кислота, которая не может этого сделать, попадает в список слабых кислот.Эти слабые кислоты диссоциируют менее 1% в формах раствора.
Любая кислота, которая не может этого сделать, попадает в список слабых кислот.Эти слабые кислоты диссоциируют менее 1% в формах раствора.
Это означает, что при растворении слабых кислот в воде не все их молекулы полностью распадаются. Только 1% их молекул распадается с выделением иона водорода. Таким образом, вы можете завершить свой ответ на вопрос, что такое сильные кислоты, сказав, что это те семь кислот, которые при растворении в воде полностью диссоциируют на ионы. Любая кислота, которая этого не делает, не является сильной кислотой.
Диссоциация сильных кислот и слабых кислотДиссоциация сильных кислот при растворении в воде связана с химической реакцией.Например, если вы посмотрите на реакцию ионизации соляной кислоты (HCl), одной из семи кислот в списке сильных кислот , она выглядит следующим образом:
HCl → H+ + Cl-
В реакции видно, что конечными продуктами являются ион водорода H+ и анион Cl-. Это означает, что HCl полностью ионизируется в ходе реакции.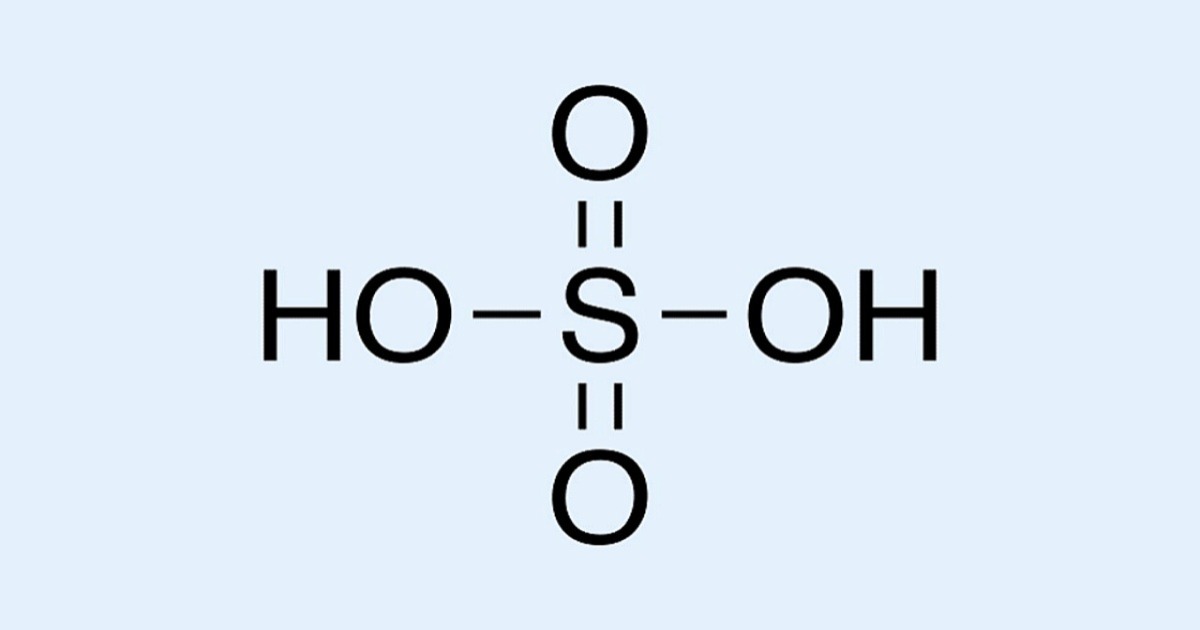 Другое значение этой диссоциации состоит в том, что она идет только в одном направлении. Он заключает, что как только вы ионизируете сильную кислоту, реакция тут же остановится.Также любая такая реакция необратима.
Другое значение этой диссоциации состоит в том, что она идет только в одном направлении. Он заключает, что как только вы ионизируете сильную кислоту, реакция тут же остановится.Также любая такая реакция необратима.
Теперь давайте посмотрим на аналогичную реакцию этановой кислоты, которая является слабой кислотой. Он выглядит следующим образом:
Ch4COOH + h3O ⇆ h4O+ + Ch4COO-
В приведенном выше уравнении вы можете заметить, что в отличие от реакции с сильной кислотой HCl стрелка указывает в обоих направлениях. Это означает, что эта реакция может протекать как в прямом, так и в обратном направлении. Это обратимая реакция. Это не относится к сильным кислотам. В их случае диссоциация, которая однажды произошла, не может быть обращена вспять.
Таким образом, те кислоты, которые лишь слегка диссоциируют (слабые кислоты), многократно восстанавливаются. Их ионы водорода продолжают двигаться и могут когда-то быть частью воды, а в следующий раз частью кислоты.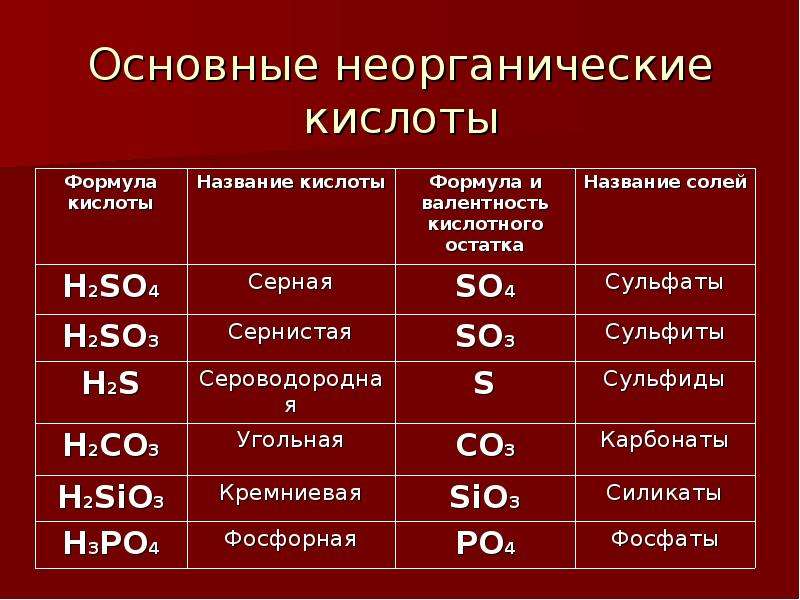 Такая обратимая реакция невозможна в случае сильных кислот, что делает сильные кислоты важными для химических уравнений. Поэтому крайне важно, чтобы студенты запомнили эти кислоты.
Такая обратимая реакция невозможна в случае сильных кислот, что делает сильные кислоты важными для химических уравнений. Поэтому крайне важно, чтобы студенты запомнили эти кислоты.
Теперь, поскольку существует всего семь распространенных сильных кислот, учащиеся могут легко выучить их названия.Все остальные кислоты, не входящие в список сильных кислот, образуют слабые кислоты. Вот краткий обзор всех 7 сильных кислот и их химических формул:
- Хлористоводородная кислота: HClO3
- Бромистоводородная кислота: HBr
- Соляная кислота: HCl
- Йодоводородная кислота: HI
- Азотная кислота: HNO3
- Хлорная кислота: HClO4
- Серная кислота: h3SO4
С приведенным выше списком теперь вы можете легко ответить на такие вопросы, как: является ли h3SO4 сильной кислотой ?
Подробный обзор семи сильных кислот
Итак, все семь кислот из списка сильных кислот полностью диссоциируют в растворах на свои ионы.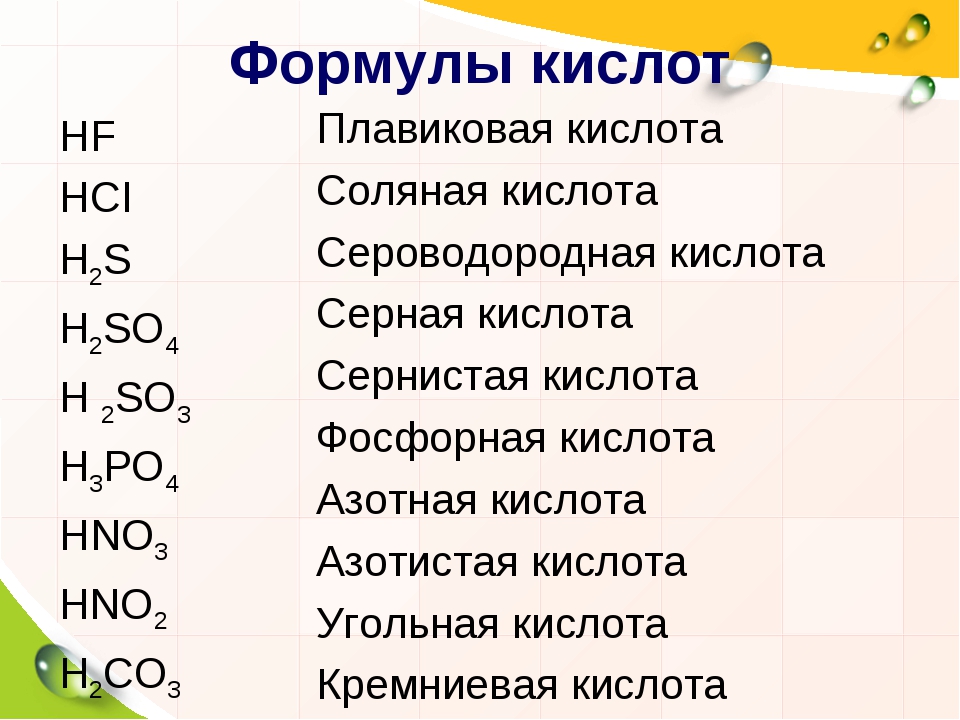 Таким образом, они могут давать один или несколько протонов (катионов H+) на молекулу. Теперь давайте поговорим обо всех этих кислотах немного подробнее.
Таким образом, они могут давать один или несколько протонов (катионов H+) на молекулу. Теперь давайте поговорим обо всех этих кислотах немного подробнее.
Химическое соединение, представляющее собой оксокислоту хлора и имеющее химическую формулу HClO3, представляет собой хлорную кислоту. Эта оксокислота хлора популярна как очень сильный окислитель и имеет очень кислую природу. Что касается молярной массы HClO3, то она составляет 84,45 грамма на моль. Еще одна важная вещь, которую студенты должны знать о хлорной кислоте, заключается в том, что она считается термодинамически нестабильной.
Причина этого в том, что это химическое соединение легко подвергается диспропорционированию. Это означает, что при нормальных условиях эта кислота одновременно окисляется и восстанавливается, давая два разных конечных продукта (Н+ и анион). Однако есть способ сделать эту кислоту более стабильной. Это может произойти в относительно холодных условиях или при помещении его в водный раствор с концентрацией не более 30%.
Пункты для запоминания:
- Химическая формула: HClO3.
- Молекулярная масса 84,45 г на моль.
- Термодинамически нестабилен при нормальных условиях.
- Считается стабильным в холодных условиях/ 30% водный раствор
Кислота, которая образуется при растворении бромистого водорода (двухатомная молекула) в воде, называется бромистоводородной кислотой. Эта твердая кислота имеет константу кислотной диссоциации pKa -9 и представлена химической формулой HBr. По сравнению с другими кислотами в списке — соляной кислотой и йодистоводородной кислотой, вот что вы можете наблюдать.
По сравнению с другими кислотами в списке — соляной кислотой и йодистоводородной кислотой, вот что вы можете наблюдать.
HBr прочнее первого. Однако кислотная сила аналогична последней. Кислота также популярна как одна из самых сильнодействующих известных минеральных кислот. Кроме того, он в основном используется для изготовления различных неорганических бромидов. Некоторые из них включают бромиды натрия, бромиды цинка и бромиды кальция.
Хотя HBr является отличным реагентом для обработки броморганических соединений, он также может делать гораздо больше.Эта сильная кислота может расщеплять несколько эфиров. Студенты также должны отметить, что кислота играет роль в добыче руд. Это происходит посредством реакций алкилирования, которые являются основной частью процесса добычи руды.
Пункты для запоминания:
- Химическая формула: HBr.
- Его константа кислотной диссоциации (pKa) имеет величину -9.
- Это очень твердая кислота.

- Это гораздо более сильная кислота, чем соляная кислота.
- Обладает той же кислотной силой, что и йодистоводородная кислота.
- Эта кислота является одной из самых сильнодействующих известных минеральных кислот.
- Эффективный реагент для переработки броморганических соединений.
- Также может расщеплять несколько эфиров.
- Может катализировать различные реакции алкилирования при добыче руд.
Бесцветная кислота, которая также известна как соляная кислота и имеет химическую формулу HCl, представляет собой соляную кислоту.Эта неорганическая кислота очень кислая по своей природе и имеет очень резкий запах. с ним следует обращаться осторожно, так как он может повредить кожу при контакте. Эта агрессивная кислота также имеет простейшую кислотную систему (содержит хлор и воду). Это не что иное, как раствор хлористого водорода в воде.
Химические соединения в этой системе включают ион хлорида и ион гидроксония. Кроме того, это одна из тех кислот, которые также имеют большое значение в биологии. HCl является естественным компонентом желудочной кислоты (кислоты, которая естественным образом образуется в пищеварительном тракте почти всех животных).На самом деле, даже пищеварительная система человека вырабатывает его естественным образом, поскольку он помогает переваривать пищу.
Кроме того, это одна из тех кислот, которые также имеют большое значение в биологии. HCl является естественным компонентом желудочной кислоты (кислоты, которая естественным образом образуется в пищеварительном тракте почти всех животных).На самом деле, даже пищеварительная система человека вырабатывает его естественным образом, поскольку он помогает переваривать пищу.
Пункты для запоминания:
- Химическая формула: HCl.
- Он также определяется как соляная кислота.
- Это бесцветное неорганическое соединение.
- Имеет очень резкий запах.
- Очень кислый по своей природе.
- Прямой контакт с ним может привести к повреждению кожи.
- Является естественным компонентом желудочной кислоты животных.
- Производится естественным образом в пищеварительной системе человека.
Иодистоводородная кислота или, как некоторые ее называют, йодистоводородная кислота, является второй по силе кислотой водорода и галогена после гидростатической кислоты.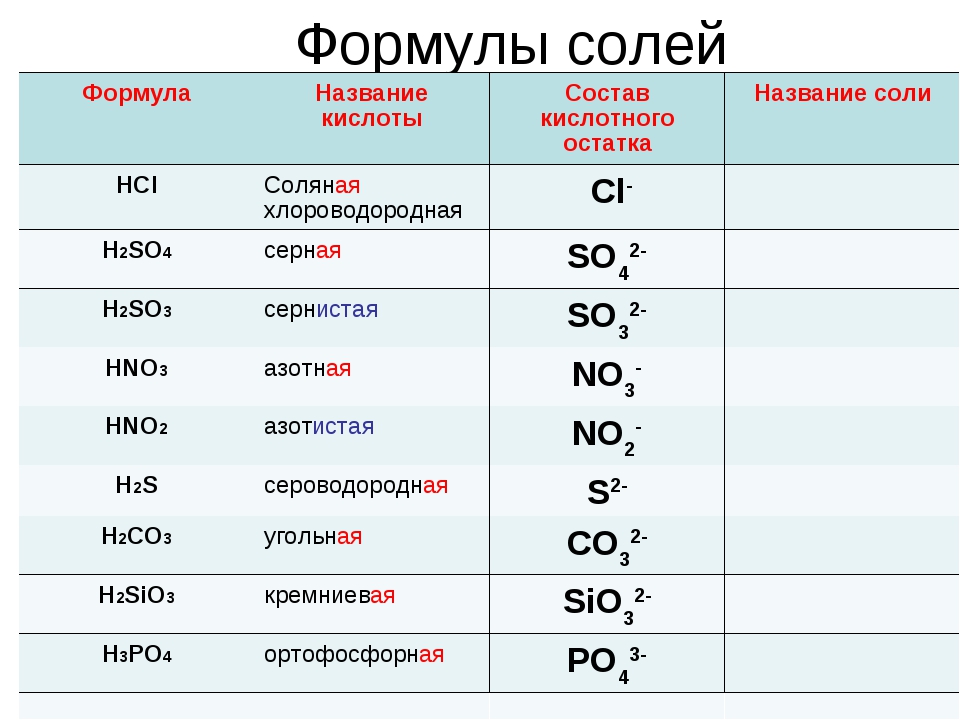 Он представлен формулой HI. Этот чрезвычайно кислый раствор йодистого водорода и воды является широко используемым химическим реагентом. Также при помещении в водный раствор он полностью ионизируется.
Он представлен формулой HI. Этот чрезвычайно кислый раствор йодистого водорода и воды является широко используемым химическим реагентом. Также при помещении в водный раствор он полностью ионизируется.
Хотя HBr представляет собой твердую кислоту, она существует в виде бесцветной жидкости при стандартных условиях температуры и давления.Известно, что в этом состоянии эта кислота имеет слегка едкий запах. Кроме того, он имеет температуру кипения 400 К (127 градусов Цельсия) и плотность в этих условиях почти 1,7 грамма на миллилитр.
Пункты для запоминания:
- Химическая формула HI.
- Он также известен как иодистоводородная кислота.
- Это вторая по силе кислота водорода и галогена.
- При стандартных условиях STP) представляет собой бесцветную жидкость.
- Имеет слегка кисловатый запах.
- Имеет плотность 1,7 грамма на миллилитр.
- Температура кипения 127 градусов Цельсия (400 градусов Кельвина).

Следующая сильная кислота представлена химической формулой HNO3 и часто называется aqua fortis или спиртом селитры. Молярная масса этой чрезвычайно агрессивной минеральной кислоты составляет 63,01 грамма на моль. Он широко используется в реакциях нитрования, так как является достаточно сильным окислителем.Таким образом, кислота значительно облегчает присоединение нитрогруппы к данному реагенту.
Кроме того, он существует в жидкой форме при стандартных условиях температуры и давления (STP) и имеет температуру плавления 231 Кельвин. С другой стороны, температура кипения кислоты составляет 394 Кельвина. Кроме того, при СТП он может быть бесцветным, желтовато-красным или желтым. Также он имеет крайне удушающий и едкий запах в состоянии.
Пункты для запоминания:
- Химическая формула: HNO3.
- Также известен как дух селитры/аква фортис.
- Это едкая минеральная кислота.

- Это сильный окислитель.
- Его молярная масса составляет 63,01 грамма на моль.
- В условиях STP существует в виде бесцветной, желтовато-красной или желтой жидкости.
- Имеет крайне удушающий едкий запах.
- Температура плавления 231 Кельвин.
- Температура кипения 394 Кельвина.
Следующая кислота в списке сильных кислот представлена химической формулой HClO4.Эта бесцветная минеральная кислота очень эффективна и используется в водном растворе. По сравнению с серной кислотой и азотной кислотой это более сильная кислота по сравнению с ними. Хотя в значительной степени он используется в жидкой форме, в сухой форме он действует как сильный окислитель.
Из-за мощных окислительных свойств этой кислоты к ней предъявляются многочисленные строгие требования, которым необходимо следовать при обращении с ней. Это может быть особенно верно, когда кислота используется в контакте с такими металлами, как алюминий (Al), органическими веществами, такими как дерево, а также с некоторыми видами пластмасс. Это потому, что кислота очень реакционноспособна в ее присутствии. На самом деле, любые исследования этой сильной кислоты необходимо проводить с помощью вытяжных шкафов.
Это потому, что кислота очень реакционноспособна в ее присутствии. На самом деле, любые исследования этой сильной кислоты необходимо проводить с помощью вытяжных шкафов.
Пункты для запоминания:
- Химическая формула: HClO4.
- Это очень мощная минеральная кислота.
- Это бесцветная кислота.
- Сильнее серной и азотной кислот.
- Это очень сильный окислитель в сухой форме.
- Обладает высокой реакционной способностью по отношению к металлам и органическим веществам.
Последней и седьмой кислотой в списке сильных кислот, представленной h3SO4, является серная кислота. Его также можно записать как «серный», и он широко известен как купоросное масло или купоросное масло. Эта минеральная кислота бесцветна, не имеет запаха и содержит кислород (O), серу (S) и водород (H). Кроме того, он очень вязкий по своей природе и растворим в воде. Кислота может быть синтезирована в сильно экзотермической реакции (для которой ΔH⚬ отрицательно).
Из-за сильной кислотной природы и окислительных свойств химического соединения оно обладает высокой коррозионной активностью. На самом деле, даже в низких концентрациях он очень опасен и при контакте может вызвать серьезные химические ожоги. В высоких концентрациях кислота может вызвать даже вторичные термические ожоги. Еще одна вещь, которую вы должны знать, это то, что эта сильная кислота гигроскопична по своей природе. Он даже обладает способностью легко поглощать водяные пары из воздуха.
Пункты для запоминания:
- Химическая формула: h3SO4.
- Он также известен как купоросное масло или масло купороса.
- Минеральная кислота не имеет цвета и запаха.
- Обладает высокой вязкостью.
- Водорастворим и гигроскопичен.
- Хорошо известен своими окисляющими свойствами.
- Имеет очень сильную кислотную природу.
- Опасно даже при низких концентрациях.
Существуют ли другие сильные кислоты?
Помимо семи кислот в списке сильных кислот, нет других сильных кислот, которые могут встречаться в повседневной жизни. Однако есть кислоты, которые производятся промышленным способом. Два примера этих кислот:
Однако есть кислоты, которые производятся промышленным способом. Два примера этих кислот:
Трифликовая кислота/трифторметансульфокислота (H[CF3SO3])
Эта сульфоновая кислота представляет собой бесцветную и слегка вязкую жидкость. Он гигроскопичен по своей природе и растворим в полярных растворителях. Кислота в основном используется в исследованиях этерификации в качестве катализатора.
Фторсурьмяная кислота (HSbF6])
В зависимости от ингредиентов эта суперкислота более чем в миллиард раз сильнее, чем даже 100% чистая серная кислота.Это бесцветная жидкость с молярной массой 236,76 грамма на моль.
Всегда ли сильные кислоты сильные?
Нет, сильная кислота не всегда может быть сильной. Все зависит от их концентрации. Как правило, чем более концентрированными становятся сильные кислоты, тем меньше они способны диссоциировать. Когда они не могут полностью диссоциировать, они не так сильны. Обычно сильная кислота может полностью (100%) диссоциировать в растворах с концентрацией 1,0 М и ниже.
Существуют ли слабые кислоты?
Как указывалось ранее, почти все те кислоты, которые не входят в список сильных кислот, могут быть классифицированы как слабые кислоты.Эти кислоты не могут полностью диссоциировать на свои ионы при смешивании с водой. Например, если вы смешаете HF с водой, он диссоциирует в ней ионы H+ и F-. Однако, если часть ионов HF остается в растворе, кислота не является сильной кислотой.
Поскольку основных сильных кислот всего семь, список слабых кислот намного длиннее, чем список сильных кислот. Как правило, большинство органических кислот относятся к категории слабых кислот. Ниже вы можете найти список некоторых слабых кислот, о которых вы должны знать:
- Щавелевая кислота (HO2C2O2H)
- Сернистая кислота (h3SO3)
- Ион сульфата водорода (HSO4-)
- Фосфорная кислота (h4PO4-)
- Азотистая кислота (HNO2-)
- Плавиковая кислота (HF)
- Метановая кислота (HCO2H)
- Бензойная кислота (C6H5COOH)
- Уксусная кислота (Ch4COOH)
- Муравьиная кислота (HCOOH)
Все перечисленные выше слабые кислоты упорядочены от самой сильной к самой слабой. Теперь позвольте дать вам краткое представление о том, почему эти кислоты являются слабыми кислотами. Для этого посмотрим на диссоциацию этановой кислоты в воде:
Теперь позвольте дать вам краткое представление о том, почему эти кислоты являются слабыми кислотами. Для этого посмотрим на диссоциацию этановой кислоты в воде:
Ch4COOH + h3O ⇆ h4O+ + Ch4COO-
Этановая кислота + вода ⇆ катионы гидрония + анионы этаноата
В приведенном выше уравнении ясно видно, что этановая кислота при смешивании с водой образует катионы гидроксония и анионы этаноата. Однако стрелка реакции (⇆) указывает в обоих направлениях. Это показывает, что только около 1% этановой кислоты превращается в ионы.Остальная кислота остается прежней.
Кроме того, поскольку эта реакция протекает в обоих направлениях, а обратная реакция более благоприятна, чем прямая, однажды образовавшиеся ионы могут легко превратиться обратно в кислоту. (В случае сильных кислот прямая реакция благоприятна, а обратной реакции нет.) Поскольку эти ионы перемещаются туда и обратно между кислотой и водой, это делает кислоту слабой кислотой.
В заключение… Список сильных кислот состоит из семи основных кислот – хлористоводородной, бромистоводородной, соляной, йодистоводородной, азотной, хлорной и серной кислот.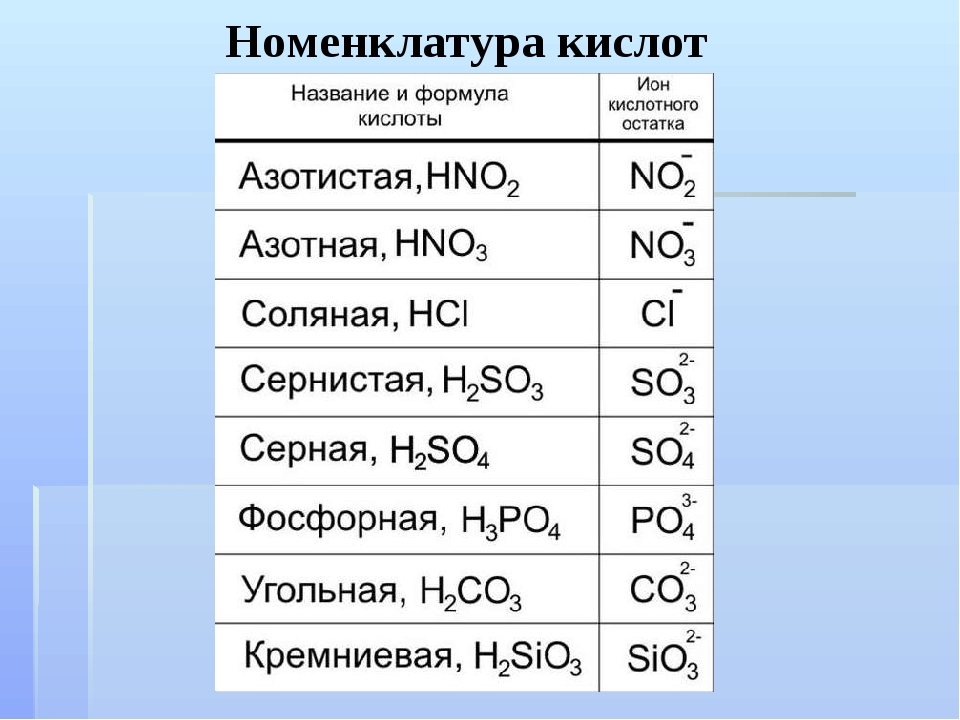 Они могут полностью диссоциировать в воде, что дает им название сильных кислот.
Они могут полностью диссоциировать в воде, что дает им название сильных кислот.
Обратите внимание, что термин «сильный» не имеет ничего общего с его кислотной силой. Для каждого из них он разный. На самом деле, даже сильная кислота может быть безопасной при использовании с осторожностью и в определенной концентрации. С другой стороны, некоторые слабые кислоты (они диссоциируют лишь в небольшом количестве) могут быть очень агрессивными и опасными при работе без мер предосторожности.
Кислоты и основания
Для наших целей в этом месте текста мы можем определить кислотное вещество с по крайней мере одним атомом водорода, которое может диссоциировать с образованием аниона и иона Н+ (протона) в водном растворе, тем самым образуя кислый раствор.как вещество, по крайней мере, с одним атомом водорода, которое может диссоциировать с образованием аниона и иона H + (протона) в водном растворе, таким образом образуя кислый раствор . Мы можем определить основания. Вещество, которое образует один или несколько гидроксид-ионов (ОН-) и катион при растворении в водном растворе, тем самым образуя основной раствор. как соединения, которые образуют гидроксид-ионы (OH — ) и катион при растворении в воде, таким образом образуя основной раствор . Растворы, которые не являются ни щелочными, ни кислыми, нейтральны .Мы обсудим химию кислот и оснований более подробно в главе 4 «Реакции в водном растворе», главе 8 «Ионные и ковалентные связи» и главе 16 «Водные кислотно-основные равновесия», но в этом разделе мы опишем номенклатуру распространенных кислот и определить некоторые важные основания, чтобы вы могли распознать их в будущих обсуждениях. В лаборатории обычно встречаются чистые кислоты и основания и их концентрированные водные растворы. Они обычно очень агрессивны, поэтому с ними нужно обращаться осторожно.
Вещество, которое образует один или несколько гидроксид-ионов (ОН-) и катион при растворении в водном растворе, тем самым образуя основной раствор. как соединения, которые образуют гидроксид-ионы (OH — ) и катион при растворении в воде, таким образом образуя основной раствор . Растворы, которые не являются ни щелочными, ни кислыми, нейтральны .Мы обсудим химию кислот и оснований более подробно в главе 4 «Реакции в водном растворе», главе 8 «Ионные и ковалентные связи» и главе 16 «Водные кислотно-основные равновесия», но в этом разделе мы опишем номенклатуру распространенных кислот и определить некоторые важные основания, чтобы вы могли распознать их в будущих обсуждениях. В лаборатории обычно встречаются чистые кислоты и основания и их концентрированные водные растворы. Они обычно очень агрессивны, поэтому с ними нужно обращаться осторожно.
Кислоты
В названиях кислот различают (1) кислоты, в которых ион Н + присоединен к атому кислорода многоатомного аниона (такие называются оксокислотами; кислота, в которой диссоциирующий ион Н+ присоединен к атому кислорода многоатомного анион. , или иногда оксикислоты ) и (2) кислоты, в которых ион Н + присоединен к какому-либо другому элементу. В последнем случае название кислоты начинается с hydro — и заканчивается — ic с корнем названия другого элемента или иона между ними.Напомним, что название аниона, полученного из этого вида кислоты, всегда оканчивается на — или . Таким образом, газообразный хлороводород (HCl) растворяется в воде с образованием соляной кислоты (которая содержит ионы H + и Cl — ), газообразный цианистый водород (HCN) образует синильную кислоту (которая содержит H + и CN — ). ионы) и т. д. (табл. 2.8 «Некоторые распространенные кислоты, не содержащие кислорода»). Примеры такого рода кислот часто встречаются и очень важны. Например, ваш желудок содержит разбавленный раствор соляной кислоты, помогающий переваривать пищу.Когда механизмы, препятствующие самоперевариванию желудка, дают сбой, кислота разрушает слизистую оболочку желудка и образуется язва.
, или иногда оксикислоты ) и (2) кислоты, в которых ион Н + присоединен к какому-либо другому элементу. В последнем случае название кислоты начинается с hydro — и заканчивается — ic с корнем названия другого элемента или иона между ними.Напомним, что название аниона, полученного из этого вида кислоты, всегда оканчивается на — или . Таким образом, газообразный хлороводород (HCl) растворяется в воде с образованием соляной кислоты (которая содержит ионы H + и Cl — ), газообразный цианистый водород (HCN) образует синильную кислоту (которая содержит H + и CN — ). ионы) и т. д. (табл. 2.8 «Некоторые распространенные кислоты, не содержащие кислорода»). Примеры такого рода кислот часто встречаются и очень важны. Например, ваш желудок содержит разбавленный раствор соляной кислоты, помогающий переваривать пищу.Когда механизмы, препятствующие самоперевариванию желудка, дают сбой, кислота разрушает слизистую оболочку желудка и образуется язва.
Обратите внимание на узор
Кислоты различаются тем, присоединен ли ион H + к атому кислорода многоатомного аниона или к какому-либо другому элементу.
Таблица 2.8 Некоторые распространенные кислоты, не содержащие кислорода
| Формула | Наименование в водном растворе | Название газообразного вещества |
|---|---|---|
| ВЧ | фтористоводородная кислота | фтористый водород |
| HCl | соляная кислота | хлористый водород |
| HBr | бромистоводородная кислота | бромистый водород |
| Привет | йодистоводородная кислота | йодистый водород |
| ХКН | синильная кислота | цианистый водород |
| В 2 Ю | сероводородная кислота | сероводород |
Если кислота содержит один или несколько ионов H + , связанных с кислородом, она является производным одного из обычных оксоанионов, например сульфата (SO 4 2− ) или нитрата (NO 3 − ). Эти кислоты содержат столько ионов H + , сколько необходимо для уравновешивания отрицательного заряда аниона, в результате чего образуются нейтральные частицы, такие как H 2 SO 4 и HNO 3 .
Эти кислоты содержат столько ионов H + , сколько необходимо для уравновешивания отрицательного заряда аниона, в результате чего образуются нейтральные частицы, такие как H 2 SO 4 и HNO 3 .
Названия кислот образованы от названий анионов по следующим правилам:
- Если название аниона оканчивается на — ели , то название кислоты оканчивается на — ic . Например, поскольку NO 3 − представляет собой нитрат-ион, HNO 3 представляет собой азотную кислоту.Точно так же ClO 4 — является ионом перхлората, поэтому HClO 4 является хлорной кислотой. Двумя важными кислотами являются серная кислота (H 2 SO 4 ) из иона сульфата (SO 4 2−) и фосфорная кислота (H 3 PO 4 ) из иона фосфата (64PO ).
 4 3− ). В этих двух названиях используется небольшой вариант корня названия аниона: sulf ate становится sulphur ic, а phosph ate становится фосфор ic.
4 3− ). В этих двух названиях используется небольшой вариант корня названия аниона: sulf ate становится sulphur ic, а phosph ate становится фосфор ic. - Если название аниона оканчивается на — ite , то название кислоты оканчивается на — ous . Например, OCl − представляет собой ион гипохлорита, а HOCl представляет собой хлорноватистую кислоту; NO 2 − — нитрит-ион, HNO 2 — азотистая кислота; SO 3 2− – сульфит-ион, H 2 SO 3 – сернистая кислота. Одни и те же корни используются независимо от того, оканчивается ли название кислоты на — ic или — ous ; таким образом, сульфит становится сернистым .
Связь между названиями оксокислот и исходных оксоанионов показана на рис.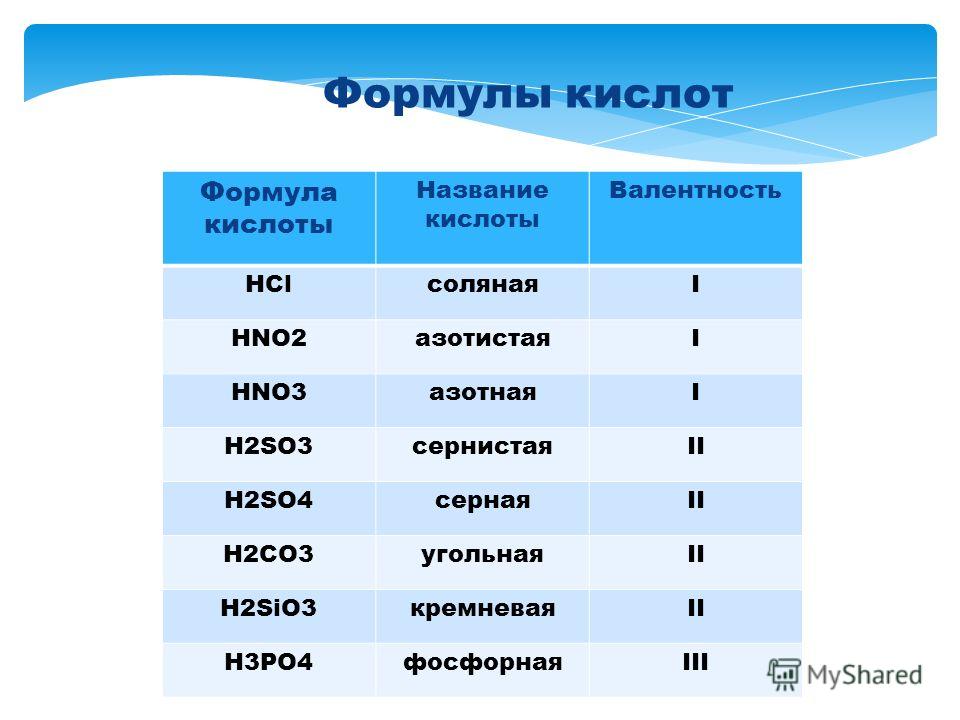 2.20 «Связь между названиями оксокислот и названиями исходных оксоанионов», а некоторые распространенные оксокислоты представлены в таблице 2.9 «Некоторые распространенные оксокислоты». .
2.20 «Связь между названиями оксокислот и названиями исходных оксоанионов», а некоторые распространенные оксокислоты представлены в таблице 2.9 «Некоторые распространенные оксокислоты». .
Рисунок 2.20 Связь между названиями оксокислот и названиями исходных оксоанионов
Таблица 2.9 Некоторые распространенные оксокислоты
| Формула | Имя |
|---|---|
| HNO 2 | азотистая кислота |
| HNO 3 | азотная кислота |
| H 2 SO 3 | сернистая кислота |
| H 2 SO 4 | серная кислота |
| H 3 Заказ на покупку 4 | фосфорная кислота |
| H 2 CO 3 | угольная кислота |
| HClO | хлорноватистая кислота |
| HClO 2 | хлорноватистая кислота |
| HClO 3 | хлористоводородная кислота |
| HClO 4 | хлорная кислота |
Пример 11
Назовите и дайте формулу каждой кислоты.
- кислота, образующаяся при присоединении протона к иону гипобромита (OBr − )
- кислота, образованная присоединением двух протонов к иону селената (SeO 4 2− )
Дано: анион
Запрашиваемый: исходная кислота
Стратегия:
См. Таблицу 2.8 «Некоторые распространенные кислоты, не содержащие кислорода» и Таблицу 2.9 «Some Common Oxoacids», чтобы найти название кислоты. Если кислоты нет в списке, используйте приведенные выше рекомендации.
Решение:
Ни один из видов не указан в таблице 2.8 «Некоторые распространенные кислоты, не содержащие кислорода» или в таблице 2.9 «Некоторые распространенные оксокислоты», поэтому мы должны использовать информацию, приведенную ранее, чтобы вывести название кислоты из названия многоатомного аниона.
- Название аниона, гипобромит , оканчивается на — или , поэтому название исходной кислоты оканчивается на — ous .Следовательно, кислота представляет собой бромноватистую кислоту (HOBr).
- Селенат оканчивается на — или , поэтому название исходной кислоты оканчивается на — ic . Таким образом, кислота представляет собой селеновую кислоту (H 2 SeO 4 ).
Упражнение
Назовите и дайте формулу каждой кислоты.
- кислота, образующаяся при присоединении протона к пербромат-иону (BrO 4 − )
- кислота, образующаяся при присоединении трех протонов к арсенит-иону (AsO 3 3− )
Ответ:
- пербромная кислота; HBrO 4
- мышьяковистая кислота; Н 3 АсО 3
Многие органические соединения содержат атом углерода карбонильной группыA, связанный двойной связью с атомом кислорода. Это характерная черта многих органических соединений, в том числе карбоновых кислот, в которых имеется двойная связь углерод-кислород. В карбоновых кислотах Органическое соединение, содержащее группу -ОН, ковалентно связанную с атомом углерода карбонильной группы. Общая формула карбоновой кислоты RCO2H. В воде карбоновая кислота диссоциирует с образованием кислого раствора, группа –ОН ковалентно связана с атомом углерода карбонильной группы. Их общая формула RCO 2 H, иногда пишется как RCOOH:
Это характерная черта многих органических соединений, в том числе карбоновых кислот, в которых имеется двойная связь углерод-кислород. В карбоновых кислотах Органическое соединение, содержащее группу -ОН, ковалентно связанную с атомом углерода карбонильной группы. Общая формула карбоновой кислоты RCO2H. В воде карбоновая кислота диссоциирует с образованием кислого раствора, группа –ОН ковалентно связана с атомом углерода карбонильной группы. Их общая формула RCO 2 H, иногда пишется как RCOOH:
, где R может быть алкильной группой, арильной группой или атомом водорода.Простейший пример, HCO 2 H, — это муравьиная кислота , названная так потому, что она содержится в выделениях жалящих муравьев (от латинского formica , что означает «муравей»). Другим примером является уксусная кислота (CH 3 CO 2 H), которая содержится в уксусе. Как и многие кислоты, карбоновые кислоты имеют резкий запах. Например, масляная кислота (СН 3 СН 2 СН 2 СО 2 Н), отвечает за запах прогорклого масла, а характерный запах кислого молока и рвотных масс обусловлен молочной кислотой [СН 3 CH(OH)CO 2 H].Некоторые распространенные карбоновые кислоты показаны на рис. 2.21 «Некоторые распространенные карбоновые кислоты».
Например, масляная кислота (СН 3 СН 2 СН 2 СО 2 Н), отвечает за запах прогорклого масла, а характерный запах кислого молока и рвотных масс обусловлен молочной кислотой [СН 3 CH(OH)CO 2 H].Некоторые распространенные карбоновые кислоты показаны на рис. 2.21 «Некоторые распространенные карбоновые кислоты».
Рисунок 2.21 Некоторые распространенные карбоновые кислоты
Хотя карбоновые кислоты являются ковалентными соединениями, при растворении в воде они диссоциируют с образованием ионов H + (как и любая другая кислота) и ионов RCO 2 − . Обратите внимание, что только водород, присоединенный к атому кислорода группы CO 2 , диссоциирует с образованием иона H + .Напротив, атом водорода, присоединенный к атому кислорода спирта , а не , диссоциирует с образованием иона Н + при растворении спирта в воде. Причины различий в поведении карбоновых кислот и спиртов будут обсуждаться в главе 8 «Ионная и ковалентная связи».
Причины различий в поведении карбоновых кислот и спиртов будут обсуждаться в главе 8 «Ионная и ковалентная связи».
Обратите внимание на узор
Только водород, присоединенный к атому кислорода группы CO 2 , диссоциирует с образованием иона H + .
Основания
Мы представим более полные определения оснований в последующих главах, но практически каждое основание, с которым вы столкнетесь, будет ионным соединением, таким как гидроксид натрия (NaOH) и гидроксид бария [Ba(OH) 2 ], которые содержат ион гидроксида и катион металла. Они имеют общую формулу M(OH) n . Важно понимать, что спирты с общей формулой ROH представляют собой ковалентные, а не ионные соединения; следовательно, они , а не , диссоциируют в воде с образованием основного раствора (содержащего ионы ОН — ).Когда основание реагирует с любой из кислот, которые мы обсуждали, оно принимает протон (H + ). Например, гидроксид-ион (OH — ) принимает протон с образованием H 2 O. Таким образом, основания также называют акцепторами протона .
Например, гидроксид-ион (OH — ) принимает протон с образованием H 2 O. Таким образом, основания также называют акцепторами протона .
Концентрированные водные растворы аммиака (NH 3 ) содержат значительное количество гидроксид-иона, даже несмотря на то, что растворенное вещество , а не в основном представляет собой гидроксид аммония (NH 4 OH), как часто указывается на этикетке.Таким образом, водный раствор аммиака также является обычным основанием. Замена атома водорода в NH 3 алкильной группой приводит к аминоорганическому соединению, которое имеет общую формулу RNh3, где R представляет собой алкильную группу. Амины, как и аммиак, являются основаниями. (RNH 2 ), что также является базой. Амины имеют резкий запах — например, метиламин (CH 3 NH 2 ) является одним из соединений, ответственных за неприятный запах, связанный с испорченной рыбой. На физиологическое значение аминов указывает слово витамин , которое происходит от фразы жизненно важные амины .Слово было придумано для описания пищевых веществ, которые были эффективны для предотвращения цинги, рахита и других заболеваний, поскольку предполагалось, что эти вещества являются аминами. Впоследствии было подтверждено, что некоторые витамины действительно являются аминами.
На физиологическое значение аминов указывает слово витамин , которое происходит от фразы жизненно важные амины .Слово было придумано для описания пищевых веществ, которые были эффективны для предотвращения цинги, рахита и других заболеваний, поскольку предполагалось, что эти вещества являются аминами. Впоследствии было подтверждено, что некоторые витамины действительно являются аминами.
Обратите внимание на узор
Гидроксиды металлов (MOH) дают ионы OH − и являются основаниями, спирты (ROH) не дают ионов OH − или H + и являются нейтральными, а карбоновые кислоты (RCO 2 H) дают H + ионов и являются кислотами.
Резюме
Общие кислоты и производные от них многоатомные анионы имеют свои названия и правила номенклатуры. В номенклатуре кислот различают оксокислоты , в которых ион Н + присоединен к атому кислорода многоатомного иона, и кислоты, в которых ион Н + присоединен к другому элементу.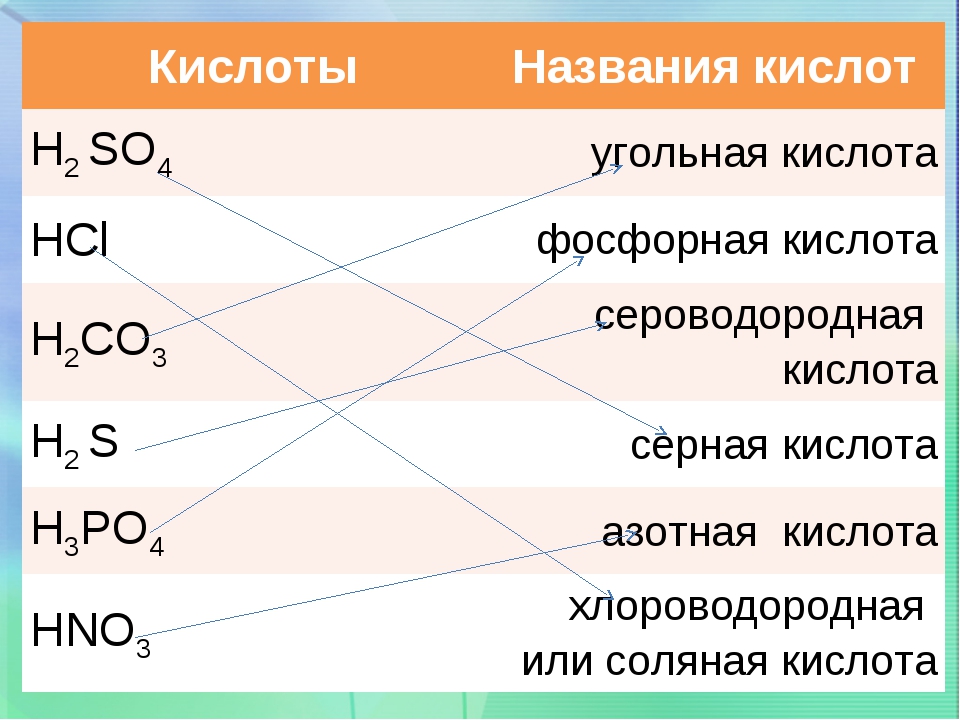 Карбоновые кислоты представляют собой важный класс органических кислот.Аммиак является важным основанием , как и его органические производные, амины .
Карбоновые кислоты представляют собой важный класс органических кислот.Аммиак является важным основанием , как и его органические производные, амины .
Ключ на вынос
- Обычные кислоты и производные от них многоатомные анионы имеют собственные названия и правила номенклатуры.
Концептуальные проблемы
Назовите каждую кислоту.
- HCl
- HBrO 3
- HNO 3
- Н 2 SO 4
- ХИО 3
Назовите каждую кислоту.

- HBr
- H 2 SO 3
- HClO 3
- ХКН
- Н 3 Заказ на покупку 4
Назовите водную кислоту, соответствующую каждому газообразному веществу.
- бромистый водород
- цианистый водород
- йодистый водород
Для каждой структурной формулы напишите сокращенную формулу и название соединения.
Для каждой структурной формулы напишите сокращенную формулу и название соединения.

При добавлении каждого соединения к воде получается кислый, нейтральный или щелочной раствор?
- CH 3 CH 2 ОН
- Мг(ОН) 2
- C 6 H 5 CO 2 H
- LiOH
- C 3 H 7 CO 2 H
- Н 2 SO 4
Нарисуйте структуру простейшего примера соединения каждого типа.

- алкан
- алкен
- алкин
- ароматический углеводород
- спирт
- карбоновая кислота
- амин
- циклоалкан
Определите класс органических соединений, представленных каждым соединением.
- CH 3 CH 2 OH
- HC≡CH
- C 3 H 7 NH 2
- CH 3 CH=CHCH 2 CH 3
Определите класс органических соединений, представленных каждым соединением.

- СН 3 С≡СН
Численные задачи
Напишите формулу каждого соединения.

- кислота хлорноватистая
- пербромная кислота
- бромистоводородная кислота
- сернистая кислота
- пербромат натрия
Напишите формулу каждого соединения.
- йодистоводородная кислота
- сероводород
- фосфористая кислота
- хлорная кислота
- гипобромит кальция
Назовите каждое соединение.
- HBr
- H 2 SO 3
- ХКН
- HClO 4
- NaHSO 4
Назовите каждое соединение.

- H 2 SO 4
- HNO 2
- К 2 ГПО 4
- H 3 Заказ на покупку 3
- Ca(H 2 PO 4 ) 2 ·H 2 O
СИЛЬНЫЕ И СЛАБЫЕ КИСЛОТЫ На этой странице объясняются термины «сильный» и «слабый» применительно к кислотам.Как часть этого, он определяет и объясняет, что подразумевается под pH, K a и pK a . Важно не путать слова сильный и слабый с терминами концентрированный и разбавленный . Как вы увидите ниже, сила кислоты зависит от ее доли, прореагировавшей с водой с образованием ионов. Вполне возможно иметь концентрированный раствор слабой кислоты или разбавленный раствор сильной кислоты. Читать дальше . . . Сильные кислоты Объяснение термина «сильная кислота» Мы собираемся использовать определение кислоты Бренстеда-Лоури. | |||||||||||||||||||
Примечание: Если вы не знаете, что такое теория кислот Бренстеда-Лоури, вам следует прочитать о теориях кислот и оснований на другой странице этого раздела.Вам не нужно тратить время на чтение о кислотах и основаниях Льюиса для целей данной страницы. Используйте кнопку НАЗАД в браузере, когда будете готовы вернуться на эту страницу. | |||||||||||||||||||
Когда кислота растворяется в воде, протон (ион водорода) переносится на молекулу воды с образованием иона гидроксония и отрицательного иона в зависимости от исходной кислоты. В общем случае . . . Все эти реакции обратимы, но в некоторых случаях кислота настолько хорошо отдает ионы водорода, что мы можем считать эту реакцию односторонней.Кислота практически на 100% ионизирована. Например, когда хлороводород растворяется в воде с образованием соляной кислоты, происходит так мало обратной реакции, что мы можем написать: В любой момент времени практически 100% хлористого водорода прореагирует с образованием ионов гидроксония и ионов хлора. Хлористый водород описывается как сильная кислота. Сильная кислота – это кислота, которая практически на 100% ионизирована в растворе. Другие распространенные сильные кислоты включают серную кислоту и азотную кислоту. Уравнение ионизации можно найти в упрощенной форме: Это показывает, что хлористый водород, растворенный в воде, расщепляется с образованием ионов водорода в растворе и ионов хлора в растворе. Эта версия часто используется в этой работе только для того, чтобы все выглядело проще. Если вы используете его, помните, что на самом деле участвует вода, и что когда вы пишете H + (водн.) , вы на самом деле имеете в виду ион гидроксония, H 3 O + . | |||||||||||||||||||
Примечание: Вы должны выяснить, что предпочитают ваши экзаменаторы. Вы вряд ли найдете это в своей программе, но вам следует просмотреть последние экзаменационные работы и схемы оценок. Если вы сдаете экзамен в Великобритании и у вас нет копий учебного плана и прошлых работ, вы должны их иметь! Перейдите по этой ссылке, чтобы узнать, как их получить. | |||||||||||||||||||
Сильные кислоты и рН рН является мерой концентрации ионов водорода в растворе.Сильные кислоты, такие как соляная кислота, в концентрациях, которые вы обычно используете в лаборатории, имеют pH от 0 до 1. Определение pH | |||||||||||||||||||
Примечание: Если вас попросят определить рН на экзамене, просто запишите выражение черным цветом. Никогда не пытайтесь определить его словами — это пустая трата времени, и вы можете что-то упустить (например, упомянуть, что концентрация должна быть в моль дм -3 ).В приведенном выше выражении квадратные скобки подразумевают это, поэтому вам не нужно упоминать об этом. | |||||||||||||||||||
Определение рН сильной кислоты Допустим, вам нужно было определить рН 0,1 моль дм -3 соляной кислоты. Все, что вам нужно сделать, это определить концентрацию ионов водорода в растворе, а затем использовать калькулятор, чтобы преобразовать ее в pH. С сильными кислотами это сделать легко. Соляная кислота — сильная кислота, практически на 100 % ионизированная. Значит, если концентрация кислоты 0,1 моль дм -3 , то концентрация ионов водорода также равна 0,1 моль дм -3 . Используйте свой калькулятор, чтобы преобразовать это в pH. Мой калькулятор хочет, чтобы я ввел 0,1, а затем нажал кнопку «журнал». Ваш может захотеть, чтобы вы сделали это в другом порядке.Вы должны узнать! log 10 [0,1] = -1 Но рН = — log 10 [0,1] — (-1) = 1 pH этой кислоты равен 1. | |||||||||||||||||||
Примечание: Если вам нужно больше примеров, чтобы посмотреть и попробовать себя (с полными готовыми решениями), вас может заинтересовать моя книга по химическим расчетам. Это также включает в себя немного более запутанную проблему преобразования pH обратно в концентрацию ионов водорода. | |||||||||||||||||||
Слабые кислоты Объяснение термина «слабая кислота» Слабая кислота — это кислота, которая не полностью ионизируется при растворении в воде. Этановая кислота является типичной слабой кислотой. Он реагирует с водой с образованием ионов гидроксония и ионов этаноата, но обратная реакция протекает более успешно, чем прямая. Ионы очень легко реагируют на преобразование кислоты и воды. В любой момент только около 1% молекул этановой кислоты превратились в ионы.Остальные остаются в виде простых молекул этановой кислоты. Большинство органических кислот являются слабыми. Фторид водорода (растворяющийся в воде с образованием плавиковой кислоты) — это слабая неорганическая кислота, которую вы можете встретить где угодно. | |||||||||||||||||||
Примечание: Если вы заинтересованы в дальнейшем изучении органических кислот, вы найдете их объяснение в другом месте на сайте. Тем не менее, было бы неплохо сначала прочитать остальную часть этой страницы. Если вы хотите узнать, почему фтористый водород является слабой кислотой, вы можете узнать, перейдя по этой ссылке. Эти страницы находятся в совершенно разных частях этого сайта. Если вы перейдете по любой из ссылок, используйте кнопку НАЗАД, чтобы вернуться на текущую страницу. | |||||||||||||||||||
Сравнение сил слабых кислот Положение равновесия реакции между кислотой и водой варьируется от одной слабой кислоты к другой. Чем левее она лежит, тем слабее кислота. | |||||||||||||||||||
Примечание: Если вы не понимаете, что такое положение равновесия, перейдите по этой ссылке, прежде чем двигаться дальше. Вам также необходимо знать о константах равновесия, K c для гомогенных равновесий. Нет смысла читать дальше эту страницу, если вы этого не сделаете! Если вы перейдете по любой из ссылок, используйте кнопку НАЗАД, чтобы вернуться на текущую страницу. | |||||||||||||||||||
Константа диссоциации кислоты, К a Вы можете получить меру положения равновесия, записав константу равновесия для реакции. Примером гомогенной реакции является диссоциация (ионизация) кислоты. Все присутствует в одной фазе — в данном случае в растворе в воде. Следовательно, вы можете написать простое выражение для константы равновесия K c . Вот снова равновесие: Вы могли бы ожидать, что константа равновесия будет записана как: Однако, если хорошенько подумать, в этом есть что-то странное. В конце выражения у вас есть термин для концентрации воды в растворе. Это не проблема, за исключением того, что число будет очень большим по сравнению со всеми остальными числами. В 1 дм 3 раствора будет около 55 молей воды. | |||||||||||||||||||
Примечание: 1 моль воды весит 18 г. 1 дм 3 раствора содержит примерно 1000 г воды. Разделите 1000 на 18, чтобы получить примерно 55.  | |||||||||||||||||||
Если бы у вас была слабая кислота с концентрацией около 1 моль дм -3 , и только около 1% ее прореагировало с водой, то количество молей воды уменьшится только примерно на 0,01. Другими словами, если кислота слабая, концентрация воды практически постоянна. В этом случае нет особого смысла включать его в выражение, как если бы это была переменная. Вместо этого определяется новая константа равновесия, которая не учитывается.Эта новая константа равновесия называется K a . Вы можете обнаружить, что выражение K a записано по-другому, если вы работаете с упрощенной версией равновесной реакции: Это может быть написано с символами состояния или без них. На самом деле это то же самое, что и предыдущее выражение для K a ! Помните, что хотя мы часто пишем H + для ионов водорода в растворе, на самом деле мы говорим о ионах гидроксония. Эта вторая версия выражения K a не так точна, как первая, но ваши экзаменаторы вполне могут с ней согласиться. Выяснить! Чтобы взять конкретный общий пример, равновесие диссоциации этановой кислоты правильно записывается как: Выражение K a : Если вы используете более простую версию равновесия. . . .. . выражение K a : | |||||||||||||||||||
Примечание: Поскольку вы, вероятно, столкнетесь с обеими этими версиями в зависимости от того, где вы прочитали о K a , было бы разумно привыкнуть к любой из них. Однако для целей экзамена используйте то, что, по-видимому, предпочитают ваши экзаменаторы. | |||||||||||||||||||
В таблице приведены некоторые значения K a для некоторых простых кислот:
Это все слабые кислоты, потому что значения K и очень малы. Они перечислены в порядке убывания силы кислоты — значения K и становятся меньше по мере продвижения вниз по таблице. Однако, если вы не очень довольны числами, это не сразу очевидно.Поскольку числа состоят из двух частей, слишком многое нужно быстро обдумать! Чтобы избежать этого, числа часто преобразуются в новую, более простую форму, называемую pK a . Знакомство с ПК a pK a имеет такое же отношение к K a , как pH относится к концентрации ионов водорода: Если вы используете свой калькулятор для всех значений K и в таблице выше и преобразуете их в значения pK и , вы получите:
| |||||||||||||||||||
Примечание: Обратите внимание, что в отличие от K a , pK a не имеет единиц измерения. | |||||||||||||||||||
Обратите внимание, что чем слабее кислота, тем больше значение pK a .Теперь легко увидеть тенденцию к более слабым кислотам по мере продвижения вниз по таблице. Запомни это:
| |||||||||||||||||||
Примечание: Если вам нужно знать о K a и pK a , вам, скорее всего, потребуется уметь выполнять с ними вычисления.  | |||||||||||||||||||
 Погибло тридцать пять человек, больше ста изувечено, а все здание лаборатории приведено в полную негодность. Вы там бывали когда-нибудь? Великолепное сооружение! А теперь «студень» стек в подвалы и нижние этажи… Вот вам и прелюдия к контакту.
Погибло тридцать пять человек, больше ста изувечено, а все здание лаборатории приведено в полную негодность. Вы там бывали когда-нибудь? Великолепное сооружение! А теперь «студень» стек в подвалы и нижние этажи… Вот вам и прелюдия к контакту. Нагнал литра два, снимаю приемник. Прошу лаборантку дать чистую колбу на 2 литра — перелить. Она мне и дала сухую, чистую, но из под спирта — и с закрытой пробкой. То есть пары были и накопились. Я туда воронку и переливаю. Я ее туда — а она обратно. Хорошо брызнула на руки, на рожу и ниже шеи. Ощущение — как орел в морду вцепился. Плюс руки, шея, под носом ну и т.д. по мелочи. В руках, напоминаю, два литра того же добра. Глаза закрыты, естественно. Понимаю, что бросить колбу нельзя, будет сразу сильно хуже. Аккуратно ставлю колбу на резиновую подставку, перемещаюсь к мойке, разворачиваю гусак себе в морду и включаю полный напор. Секунд за пять управился. До подкожной клетчатки не добралась. А то все было бы намного хуже. Видел у другого мужика, что бывает через 10-15 сек. Труднозаживающие багровые рубцы на половину руки. Потом понял, почему она такая злая. Мало того, что довольно сильная кислота и окислитель, она еще и чудесный растворитель. Неограниченно смешивается с водой, но неограниченно смешивается и с, например, дихлорэтаном.
Нагнал литра два, снимаю приемник. Прошу лаборантку дать чистую колбу на 2 литра — перелить. Она мне и дала сухую, чистую, но из под спирта — и с закрытой пробкой. То есть пары были и накопились. Я туда воронку и переливаю. Я ее туда — а она обратно. Хорошо брызнула на руки, на рожу и ниже шеи. Ощущение — как орел в морду вцепился. Плюс руки, шея, под носом ну и т.д. по мелочи. В руках, напоминаю, два литра того же добра. Глаза закрыты, естественно. Понимаю, что бросить колбу нельзя, будет сразу сильно хуже. Аккуратно ставлю колбу на резиновую подставку, перемещаюсь к мойке, разворачиваю гусак себе в морду и включаю полный напор. Секунд за пять управился. До подкожной клетчатки не добралась. А то все было бы намного хуже. Видел у другого мужика, что бывает через 10-15 сек. Труднозаживающие багровые рубцы на половину руки. Потом понял, почему она такая злая. Мало того, что довольно сильная кислота и окислитель, она еще и чудесный растворитель. Неограниченно смешивается с водой, но неограниченно смешивается и с, например, дихлорэтаном. Такая себе бифильная дрянь.
Такая себе бифильная дрянь.
 П. Троегубова “Контрольно-измерительные материалы,8 кл.”,
Москва 2010.
П. Троегубова “Контрольно-измерительные материалы,8 кл.”,
Москва 2010. Напомним, что ряд активности — это список металлов в порядке убывания реакционной способности. Металлы, находящиеся выше водорода в ряду активности, заменят водород из кислоты в реакции с одним замещением, как показано ниже:
Напомним, что ряд активности — это список металлов в порядке убывания реакционной способности. Металлы, находящиеся выше водорода в ряду активности, заменят водород из кислоты в реакции с одним замещением, как показано ниже: 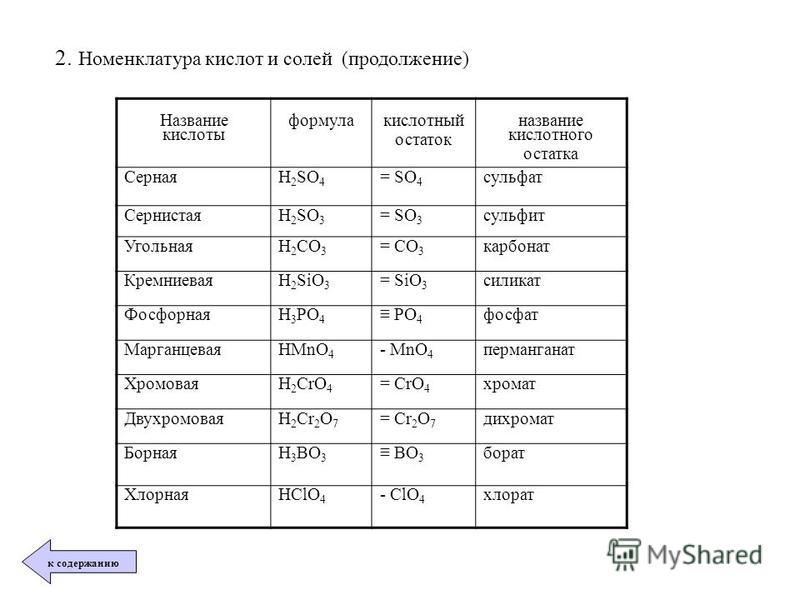



 4 3− ). В этих двух названиях используется небольшой вариант корня названия аниона: sulf ate становится sulphur ic, а phosph ate становится фосфор ic.
4 3− ). В этих двух названиях используется небольшой вариант корня названия аниона: sulf ate становится sulphur ic, а phosph ate становится фосфор ic.
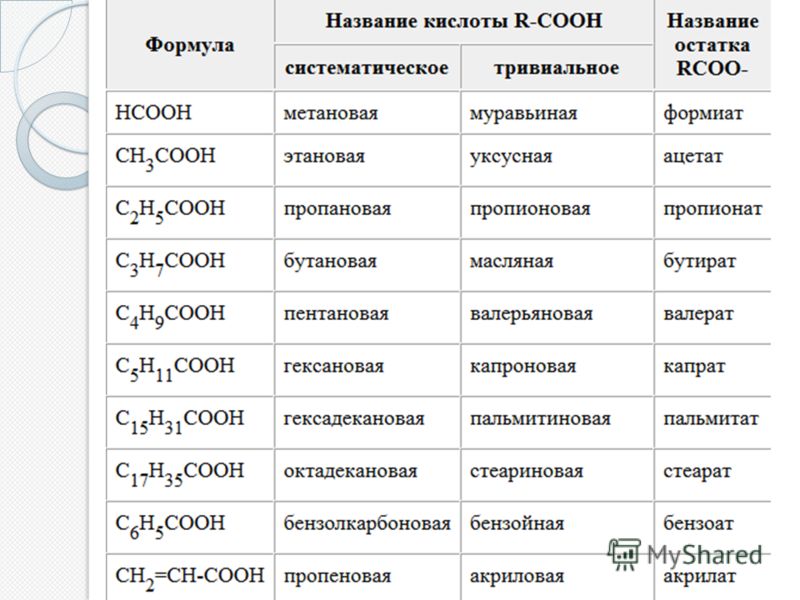



_20-1200x800.jpg)
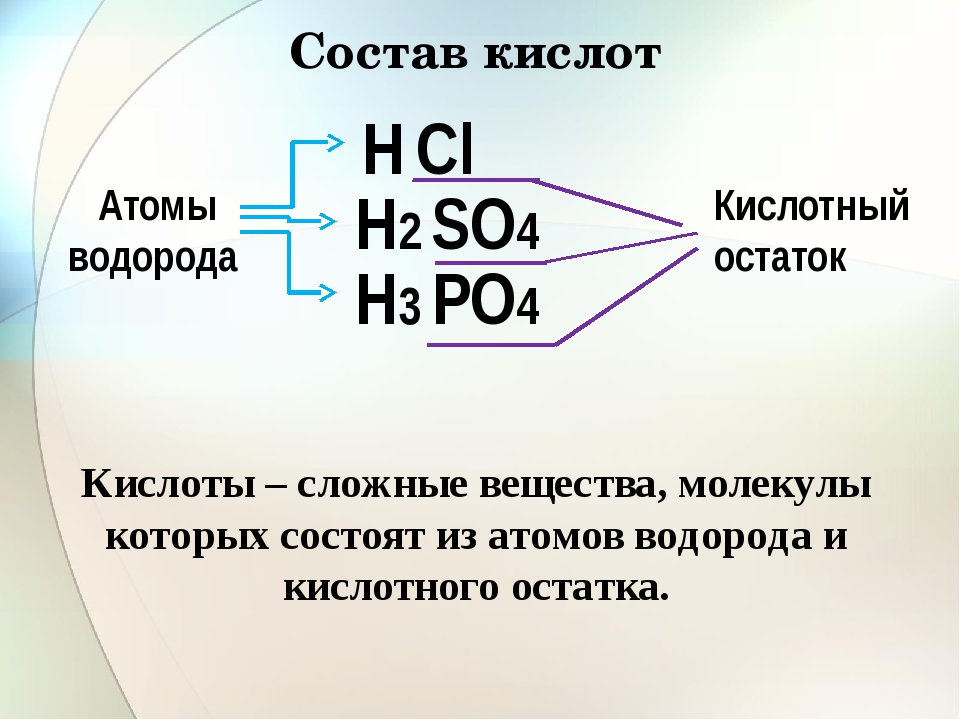 Концентрация говорит вам о том, сколько исходной кислоты растворено в растворе.
Концентрация говорит вам о том, сколько исходной кислоты растворено в растворе.

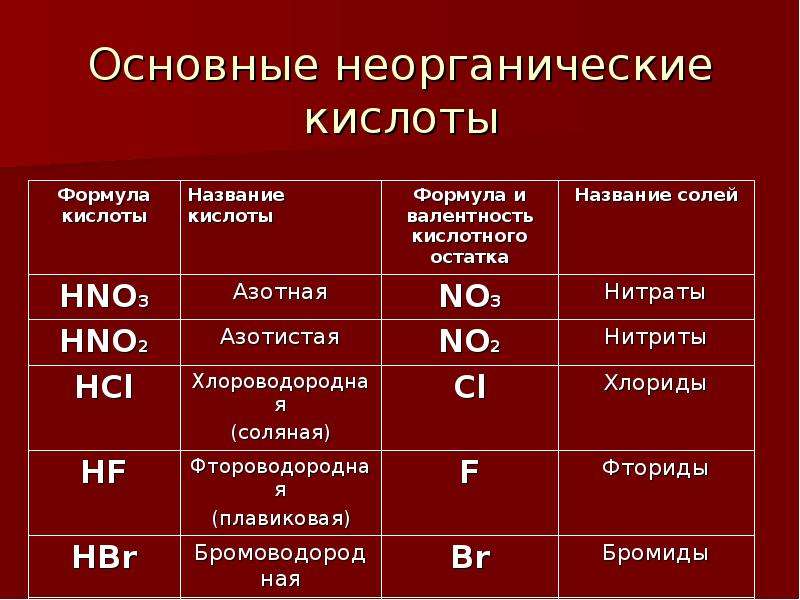 Чем ниже pH, тем выше концентрация ионов водорода в растворе.
Чем ниже pH, тем выше концентрация ионов водорода в растворе. Каждый моль HCl реагирует с водой, давая 1 моль ионов водорода и 1 моль ионов хлора
Каждый моль HCl реагирует с водой, давая 1 моль ионов водорода и 1 моль ионов хлора
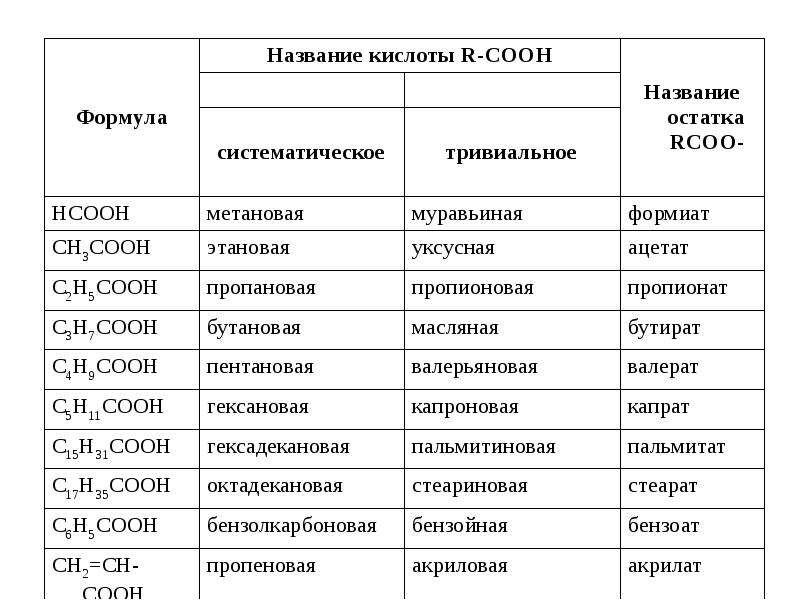
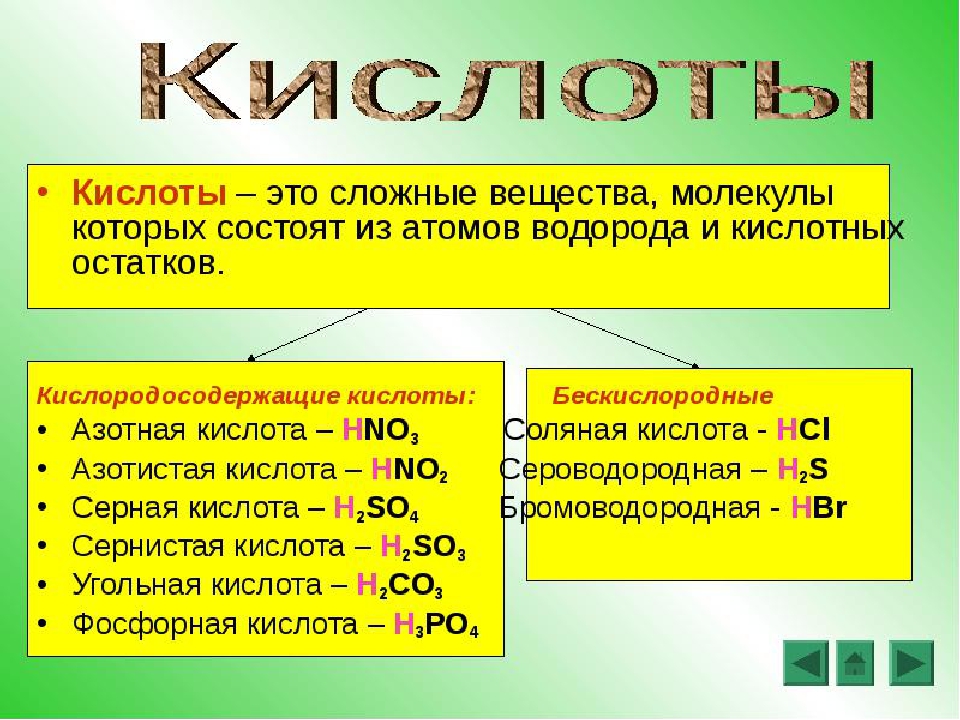 Чем ниже значение константы, тем больше положение равновесия смещено влево.
Чем ниже значение константы, тем больше положение равновесия смещено влево.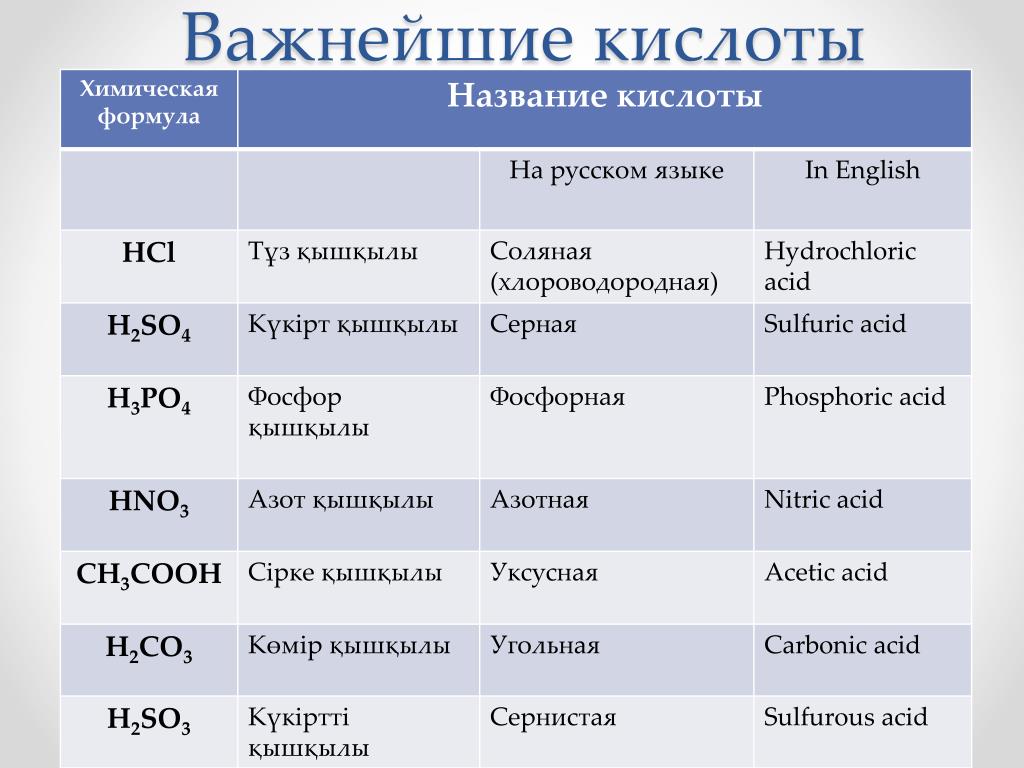
 6 x 10 -4
6 x 10 -4  3
3