Классы органических соединений — Справочник химика 21
Ароматические углеводороды представляют собой бесцветные жидкости с характерным запахом, применяются в качестве растворителей для перекристаллизации, извлечения (экстракции), проведения реакций. Обладают более высокой (по сравнению с алифатическими углеводородами) растворяющей способностью по отношению ко многим классам органических соединений. Некоторые свойства ароматических углеводородов приведены в табл. 3. [c.55]При замещении в,углеводородах того или иного гомологического ряда одного или нескольких атомов водорода отдельными атомами или группами (например, галогенами, группами —NO2. —ОН, —NHa и т. д.) образуются гомологические ряды, соответственно, галогенпроизводных, нитросоединений, спиртов, аминов и т. д. Таким образом, все другие классы органических соединений того или иного ряда являются производными углеводородов. [c.270]
Углеводы — это обширный класс органических соединений с эмпирической формулой С (Н, 0) , образование которых связано с процессом фотосинтеза. Углеводы в растениях находятся в виде моносахаридов (глюкоза — С Н О ), олигосахаридов (крахмал) и полисахаридов (целлюлоза — (С Н О ) , где п > 10000. Целлюлоза — основной строительный материал растительных тканей. Она выполняет в растениях опорные функции и придает им механическую прочность. По распространенности органических веществ на земном шаре она занимает первое место.
Среди всех классов органических соединений гетероциклические соединения обладают наибольшим разнообразием структурных типов, и поэтому наиболее сложной номенклатурой. Ниже приведен общий обзор принципов номенклатуры этих соединений. [c.112]
Структурно витамины относятся к самым различным классам органических соединений. Их биологическая активность, пожалуй, лучше всего ассоциируется со старыми буквенными обозначениями говорят, например, А-витаминная активность.
Решение более общих задач исследования смесей также зависит от количества имеющихся спектроскопических данных. Для интерпретации спектра в первом приближении используются таблицы характеристических частот колебаний отдельных структур и связей [79, 80, 82, 149, 187, 189, 150 и др. ]. При углубленном анализе материала привлекаются уже более подробные данные, которые также имеются по всем классам органических соединений [79, 81, 197, 158, 151, 189, 207]. [c.117]
В настоящей главе рассматриваются главным образом комплексы с углеводородами, хотя известны комплексы со многими классами органических соединений.
Органические растворители представляют собой жидкие продукты, относящиеся к различным классам органических соединений — углеводородам, простым и сложным эфирам, спиртам и др. Ниже рассмотрены некоторые из наиболее часто используемых представителей этих классов. [c.54]
К настоящему времени получены константы скорости реакции 1-го порядка практически для всех классов органических соединений значения для некоторых из них приведены в табл. VI-4, а для наиболее изученных — фенолов — в табл. VI-5 и VI-6. Существенно, что эта простая модель (по которой скорость трансформации вещества линейно зависит от его концентрации) формально согласуется с экспериментальными данными, даже когда скорость трансформации органического вещества в действительности не зависит от его концентрации, а определяется скоростью развития микроорганизмов. Однако это формальное соответствие характерно только для экспоненциальной фазы роста микроорганизмов в период лаг-фазы и стационарной фазы их развития модель даже чисто формально не соответствует экспериментально наблюдаемой картине.
Продолжается и непрерывно углубляется процесс химизации нефтепереработки, в ходе которого в нефтехимическую промышленность вовлекаются новые классы органических соединений. Она все теснее и полнее сливается с промышленностью органической химии, становясь промышленностью нефтехимического синтеза, т. е. органического синтеза на базе нефтяного и нефтегазового сырья.
Описаны и другие упрощенные методы. Все они едва ли имеют большое значение для определения теплот образования или теплот, сгорания алканов при наличии более точных и не слишком слож- ных методов расчета. Однако при переходе к непредельным угле- водородам и другим классам органических соединений более точные методы сильно усложняются и требуют большего числа исходных данных. Несмотря на отдельные более или менее успешные разработки путей расчета свойств некоторых групп непредельных углеводородов и нормальных первичных спиртов, распространение этих методов на другие классы соединений до сих пор встречает серьезные затруднения. Это объясняется не только увеличением числа видов связи, но и влиянием кратных и полярных связей с кислородным атомом на соседние связи, вследствие чего учет состояния только ближнего окружения становится недостаточным, в этих условиях приобретает практическое значение разработка упрощенных методов. [c.255]
Применение Н ЯМР-спектроскопии к анализу нефтяных фракций не получило столь широкого развития, как газо-жидкостной хроматографии или масс-сПектрометрии, что связано со спецификой метода. Так, в сложных смесях,— учитывая и без того небольшой интервал значений характеристических величин, в данном случае химических сдвигов (всего 20 м. д. для протонов из всех возможных классов органических соединений) — близкие по структуре соединения дают лишь уширение сигналов. Дальнейшее усложнение спектров происходит за счет спин-спинового взаимодействия Н-атомов. Применение ПМР-спектров для количественной оценки тех или иных групп обычно затруднено. Так, определить интенсивности сигналов протонов различных алифатических групп трудно в виду их перекрывания. Определение интегральных интен-
Так, в сложных смесях,— учитывая и без того небольшой интервал значений характеристических величин, в данном случае химических сдвигов (всего 20 м. д. для протонов из всех возможных классов органических соединений) — близкие по структуре соединения дают лишь уширение сигналов. Дальнейшее усложнение спектров происходит за счет спин-спинового взаимодействия Н-атомов. Применение ПМР-спектров для количественной оценки тех или иных групп обычно затруднено. Так, определить интенсивности сигналов протонов различных алифатических групп трудно в виду их перекрывания. Определение интегральных интен-
Сравнительные методы расчета недостающих значений наиболее полно разработаны для алканов (нормальных и изомерных). Для нормальных алканов в табл. VII, 28 приведены инкременты группы СНг для ЛЯ , ода и различных Д5 (отсюда легко рассчитать соответствующие инкременты других параметров). Данные, приведенные в табл. IV, 4, показывают, что для АЯо, гэа указанные инкременты группы СНг относятся не только к алканам. По-видимому, и для других рядов углеводородов и других классов органических соединений характерна подобная закономерность, причем даже для спиртов значение этого инкремента почти не изменяется. [c.306]
Анализ мировой литературы за последние 30 лет показывает, что в процессе создания эффективных присадок к смазочным маслам исследовалась возможность использования для этой цели многочисленных органических соединений. Без преувеличения можно сказать, что в качестве присадок исследованы почти все классы органических соединений, содержащих различные функциональные группы и элементы. Однако, анализируя состав внедренных в промышленность присадок, можно отметить, что в качестве присадок используют лишь немногие органические соединения, которые содержат небольшое количество элементов и функциональных групп. [c.8]
Сочетание этих трех признаков классификации и дает представление о многообразии классов органических соединений. Отдельные представители каждого из классов органических соединений, отличающиеся числом углеродных атомов в молекуле, называются гомологами по составу гомологи отличаются друг от друга на так называемую гомологическую разность СНо. Совокупность гомологов, относящихся к одному и тому же классу, называется гомологическим рядом.
Отдельные представители каждого из классов органических соединений, отличающиеся числом углеродных атомов в молекуле, называются гомологами по составу гомологи отличаются друг от друга на так называемую гомологическую разность СНо. Совокупность гомологов, относящихся к одному и тому же классу, называется гомологическим рядом.
Ранее было показано, что и нефтяные углеводороды могут рассматриваться как производные этих двух важнейших классов органических соединений. [c.180]
Жирные кислоты являются одним из важнейших классов органических соединений — источников углеводородов нефтей. Большие работы в этом направлении были выполнены в Советском Союзе под руководством А. И. Богомолова. [c.195]
При этом для удобства, они объединены в соответствующие классы органических соединений. [c.238]
После открытия Панетом и сотр. свободных метильных и этильных радикалов Ф. О. Райс 1358] развил радикально-цепную теорию распада различных классов органических соединений и, в частности, радикально-цепную теорию крекинга алканов. Суть этой новой теории состоит в том, что крекинг представляется в виде сложного многостадийного процесса, идущего с участием активных промежуточных частиц — свободных радикалов. Этот сложный процесс развивается по единой радикально-цепной схеме взаимно связанных реакций, которая принципиально способна дать количественное описание всего многообразия продуктов глубокого крекинга. [c.215]
Центральная роль в теории НДС отводится представлениям о существовании дисперсных частиц, или структурных единиц, различного типа. Особенностью последних, в отличие от дисперсных частиц классических дисперсных систем, является то, что они формируются в нефтяных системах, состоящих из большого числа компонентов, в том числе гомологов, относящихся к различным классам органических соединений с мало различающимися потенциалами межмолеку-лярного взаимодействия. Поэтому существование совокупности молекул с близкими потенциалами меж-молекулярного взаимодействия как единого целого в виде структурных единиц находится в сильной зависимости от внешних условий (температуры, давления, изменения состава дисперсионной среды и т. д.). Внутреннее строение структурных единиц, состоящих из ядра и примыкающего к нему адсорбционно-сольватного слоя, также имеет свои особенности, заключающиеся в условности границ раздела между ядром, адсорбционно-сольватным слоем и дисперсионной средой. Под влиянием внешних условий происходит экстремальное изменение размеров ядра и адсорбционно-сольватного слоя структурных единиц НДС, что проявляется через соответствующее экстремальное изменение макросвойств НДС и, несомненно, влияет на результаты их технологической переработки. Отметим, что в отличие от принятой в настоящее время технологии предлагаемая физико-химическая технология, обеспечивающая интенсификацию как недеструктивных, так и деструктивных технологичес-
Поэтому существование совокупности молекул с близкими потенциалами меж-молекулярного взаимодействия как единого целого в виде структурных единиц находится в сильной зависимости от внешних условий (температуры, давления, изменения состава дисперсионной среды и т. д.). Внутреннее строение структурных единиц, состоящих из ядра и примыкающего к нему адсорбционно-сольватного слоя, также имеет свои особенности, заключающиеся в условности границ раздела между ядром, адсорбционно-сольватным слоем и дисперсионной средой. Под влиянием внешних условий происходит экстремальное изменение размеров ядра и адсорбционно-сольватного слоя структурных единиц НДС, что проявляется через соответствующее экстремальное изменение макросвойств НДС и, несомненно, влияет на результаты их технологической переработки. Отметим, что в отличие от принятой в настоящее время технологии предлагаемая физико-химическая технология, обеспечивающая интенсификацию как недеструктивных, так и деструктивных технологичес-
Каталитические реакции с водородом чрезвычайно разнообразны и многочисленны. В дальнейшем изложении приводятся лишь наиболее характерные случаи гидрирования различных классов органических соединений. [c.350]
Лебедевым, проявляются и при гидрировании различных классов органических соединений с кратными связями (см. ниже.). [c.351]
Богомопов С. Г. Инфракрасные спектры поглощения и строение молекул некоторых классов органических соединений. Автореферат кандидатской диссертации. [c.156]
В последние годы быстрое развитие и промышленное значение получили эпоксидные смолы, полимеры которых обладают рядом замечательных качеств. Простейшим эпоксисоединением является окись этилена, давно нашедшая разнообразное применение в химической промышленности. Благодаря нестойкости трехчленного кольца в окиси этилена на ее основе путем конденсаций с аминами, спиртами, фенолами, кислотами и другими классами органических соединений можно легко получать производные, обладающие высокой эмульгирующей и флотационной способностью, моющими и экстрагирующими свойствами. [c.492]
[c.492]
Из приведенных данных следует, что фракции кубовых остатков и компоненты асфальта деасфальтизации содержат классы органических соединений с развитой системой сопряженных атомов углерода в состоянии -гибридизации, Это означает повышенное сродство этих фракций по отношению друг к другу. [c.24]
В пособии приведены данные, касающиеся методов получения, областей применения и химических свойств основных классов органических соединений. При этом автор стремился подойти к систематическому освещению сущности внутренней природы описываемых явлений. [c.9]
Эта книга будет второй книгой известного американского ученого, писате- ля-фантаста и популяризатора науки, которую издательство Химия предлагает своему читателю. В книге Мир азота , являющейся продолжением книги Мир углерода , автор в такой же занимательной форме рассказывает о новых классах органических соединений— о веществах, в состав которых кроме углерода, водорода и кислорода обязательно входит и азот. Таких веществ очень много — от аминокислот до витаминов и красителей. Читатель получит представление о их роли в жизненных процессах, использовании в медицине, быту и промыилленно-сти. [c.208]
Многие классы органических соединений образуют комплеАсы, например гомологические ряды кетонов, кислот, эфиров, галоидуглеводородов, меркаптанов и сложных эфиров. Насыщенные и ненасыщенные структуры будут образовывать комплексы при наличии достаточно длинной цепи. [c.206]
Сопременнои органической химии известны многие классы органических соединений и многие сотни тысяч наименований этих соединений. [c.203]
Одним из преимуществ азонитрильных инициаторов, по сравнению с инициаторами, относящимися к другим классам органических соединенней, является то, что разложение их протекает по реакции первого порядка, а скорость разложения зависит только от температуры и не зависит от среды.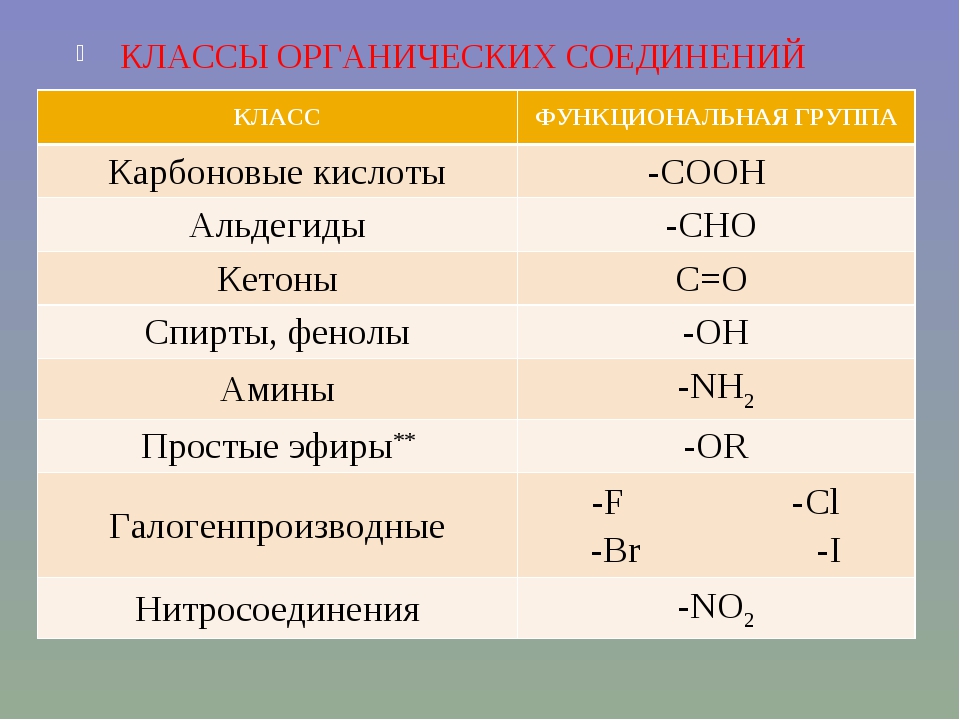 [c.421]
[c.421]
Атомы или группы атомов, замещающие водород в углеводо- одной основе, образуют функциональные или характе-истические г р у п п ы, обусловливающие общие химиче-кие свойства неществ, принадлежащих к одному и тому же лассу производных углеводородов. Ниже приведены общие фор- улы н пазвання некоторых классов органических соединений, в скобках — формулы и названия функциональных групп). [c.465]
Тривиальные и полутривиальные названия кетонов встречаются реже, чем в других классах органических соединений, [c.140]
Как и во всех классах органических соединений, пространственные особенности, подразумеваемые в родоначальном соединении, могут быть модифицированы соответствующими указаниями в префиксе. Например, 5а,Юа-андростан имеет метильную группу в положении 10 с ориентацией а символ в префиксе 5а,10 -андростана показывает, что ориентация метильной группы в положении 10 в этом случае не установлена. 255-Ге-когенин имеет по сравнению с указанной в формуле (49) про- [c.172]
Метод диссоциативной экстракции может успешно применяться для разделения целого класса органических соединений, сходных по своим физико-химическим свойствам и поэтому трудно разделимых обычными методами [1—3]. Диссоциативная экстракция может быть отнесена к экстракционным системам типа неэлектролит—электролит, но в отличие от других систем подобного класса экстрагент должен быть в стехиометрическом дефиците по отношению к общему содержанию компонентов, поскольку именно при таком условии в наибольшей степени будут проявляться его селективные свойства. При этом химическая реакция для конкурирующих реагентов является определяюпщм фактором процесса диссоциативной экстракции. Она создает основу для полного разделения смесей, которого нельзя достигнуть такими традиционными методами, как фракционная дистилляция, экстракция органическими или водными растворителями, кристаллизация и т. п. [c.79]
Рассмотрим особенности строения молекул и электронной структуры некоторых родоначальников важнейших классов органических соединений. При этом будем пользоваться методом локализованных МО, который позволяет приписать связи пару электронов на ЛМО. В мнвгоатомных органических молекулах принято подразделять орбитали (и связи) на ст и л. Первые обладают цилиндрической симметрией относительно оси связи. Если в молекуле есть плоскость симметрии, общая или локальная (у фрагмента), то о-орбитали симметричны, а 1х-орбитали антисимметричны относительно операции симметрии в плоскости. Разделение электронной плотности в молекулах на независимые сг- и л-составляющие, которое предложено Хюккелем, приближенное, так как все электроны взаимодействуют. Этан. Нежесткие молекулы. СгН — первый после метана член [c.105]
При этом будем пользоваться методом локализованных МО, который позволяет приписать связи пару электронов на ЛМО. В мнвгоатомных органических молекулах принято подразделять орбитали (и связи) на ст и л. Первые обладают цилиндрической симметрией относительно оси связи. Если в молекуле есть плоскость симметрии, общая или локальная (у фрагмента), то о-орбитали симметричны, а 1х-орбитали антисимметричны относительно операции симметрии в плоскости. Разделение электронной плотности в молекулах на независимые сг- и л-составляющие, которое предложено Хюккелем, приближенное, так как все электроны взаимодействуют. Этан. Нежесткие молекулы. СгН — первый после метана член [c.105]
Указанные выше основные классы органических соединений, в свою очередь, подразделяются иа более дробные классы. Так, алифатические соединения подразделяются на карбоцепн/ие, у которых цепи образованы только углеродными атомами, и гетероцеп-ные, у которых в состав цепей кроме углеродных входят атомы других многовалентных элементов — кислорода, серы, азота, фосфора, кремния. Карбоциклические соединения подразделяются на алициклические, скелетом которых являются замрснутые циклы нз разного числа (начиная с трех) углеродных атомов, и ароматические, в основе которых лежит особая циклическая группировка нз шести углеродных атомов,— так называемое бензольное кольио. Углеводороды подразделяются на следующие группы алифатические предельные, называемые также алканами, нли парафинами общая формула С На +2 [c.142]
Неотъемлемым компонентом каждого занятия является лабораторный практикум, в процессе которого обучаемый приобретает основные навыки и приемы работы химической лаборатории, овладевает техникой эксперимента, учится собирать лабораторные установки и работать на них. На малом практикуме студенты выполняют качественные реакции на функциональные группы, получают отдельные представители различных классов органических соединений, проводет с ними характерные реакции. Кроме малого практикума студенты фармацевтического факультета овладевают физико-химическими методами выделения, очистки и идентификации органических соединений, а также проводят синтез заданного соединения. При завершении семестра студент сдает зачет по практическим навыкам и защищает реферат по синтезированным соединениям. Контроль знаний, позволяющий судить о степени усвоения материала, осуществляется путем выполнения контрольных работ, сдачи коллоквиумов, решения ситуационных задач, программированного контроля, контроля с помощью тестов Отдельные занятия контроля по тестам проводятся в компьютерном классе Итоговый контроль завершается сдачей переводного экзамена по всему курсу. [c.27]
Кроме малого практикума студенты фармацевтического факультета овладевают физико-химическими методами выделения, очистки и идентификации органических соединений, а также проводят синтез заданного соединения. При завершении семестра студент сдает зачет по практическим навыкам и защищает реферат по синтезированным соединениям. Контроль знаний, позволяющий судить о степени усвоения материала, осуществляется путем выполнения контрольных работ, сдачи коллоквиумов, решения ситуационных задач, программированного контроля, контроля с помощью тестов Отдельные занятия контроля по тестам проводятся в компьютерном классе Итоговый контроль завершается сдачей переводного экзамена по всему курсу. [c.27]
Одним из путей для получения основ синтетических сназочньа иатериалов является полимеризация непредельных соединений. Хотя число полимеризационноспособньос ионоиеров с ненасыщенными связями весьма велико и охватывает практически все классы органических соединений, для получения основ синтетических смазочных масел, отвечающих современным требованиям, пригодными оказались пока только JL -олефины определенного строения олигомеры с высоюш индексом вязкости и низкой температурой застывания могут быть получены лишь из линейных олефинов с числом углеродных атомов от 6 до 10 [I]. [c.35]
В высококипящих фракциях нефтей содержатся в значите 1ьных количествах высокомолекулярные гетероатомные соединения гибридной структуры, включающие в состав молекулы азот, серу, кислород, а также некоторые металлы. Выделить их в виде индивидуальных соединений и идентифицировать современными методами не удается. Поэтому их относят суммарно к группе смолисто-асфальтеновых веществ (САВ). Они не представляют собой определенный класс органических соединений. Содержание их в нефтях колеблется в значительных пределах от десятых долей процента (марковская нефть) до 50 % масс. Резкой границы в составе и свойствах при переходе от высокомолекулярных полициклических углеводородов к САВ не существует. [c.14]
[c.14]
Ингибиторы атмосферной коррозии представляю собой химические соединения, способные предотвра щать или тормозить коррозию металлов и их сплавов при непосредственном контакте с металлами (контактные ингибиторы) или в парофазном состоянии (летучие ингибиторы). В настоящее время насчитывается свыше сотни летучих ингибиторов, относящихся к различным классам органических соединений, но промыш ленное применение находят лишь немногие ннгибито ры, обладающие комплексом необходимых эксилуата ционных свойств, к летучим ингибиторам относятся следующие. [c.191]
Ароматические углеводороды нефти могут иметь различное происхождение. Во-нервых, ароматические группировки содержатся уже и самом сапропелитовом материале на более или менее глубоких стадиях его изменения. В керогене эстонских сланцев X. Т. Раудсепн нашел до 26% ароматических систем конечно еще ие углеводородного характера, а так как ароматические кольца не уничтожаются, они переходят из одного класса органических соединений в какой-то другой класс и в конце концов в ароматические углеводороды. Постоянное содержание кислорода (часто и серы) в ароматических углеводородах, выделенных из нефти физическими методами, является возможно признаком, унаследованным от исходного материала. Последний мог содер-н ать ароматические системы лигнина водяных растений. Попадавшие в сапропелевые илы в виде растительного детрита остатки наземной флоры также могли повысить ресурсы ароматических структур. Значительное содержание ароматических углеродных атомов в гумусовых углях, несмотря на то что клетчатка их не содержит, иллюстрирует возможность значительного содержания ароматических систем и в исходном материале нефти. Во всяком случае речь мол ет идти только о полициклических ароматических системах, а, следовательно, и об углеводородах этого ряда. С этой точки зрения содержание кислорода именно в высших членах ароматического ряда, выделенных из нефти, показательно в том отношении, что эти углеводороды ближе к иачальному веществу нефти, чем углеводороды прочих рядов, особенно среднего и низкого молекулярного веса. Вместе с тем подкрепляется положение, что во всех нефтях близость группового состава характерна именно для выспщх фракций высокого молекулярного веса. Различные типы нефти в основном зависят от позднейших ее превращений. Разукрупнение высших гибридных углеводородов [c.124]
Вместе с тем подкрепляется положение, что во всех нефтях близость группового состава характерна именно для выспщх фракций высокого молекулярного веса. Различные типы нефти в основном зависят от позднейших ее превращений. Разукрупнение высших гибридных углеводородов [c.124]
Если в углеводороде за.менить атомы водорода иа другие атомы или группы — функционалыше группы (X), образуются иные классы органических соединений, которые определяют характер функциональных 1рупп в соединениях Я-Х. [c.16]
§3. Классификация органических соединений — ЗФТШ, МФТИ
Все органические соединения в зависимости от природы углеродного скелета можно разделить на ациклические и циклические.
называют также алифатическими. Они могут быть насыщенными (алканы и их производные) и ненасыщенными (алкены, алкадиены, алкины и их производные). Ациклические скелеты бывают неразветвленными (например, в н-гексане) и разветвленными (например, в `2,4`-диметилгексане):
| н-гексан | 2,4-диметилгексан |
Рассмотренную классификацию органических соединений можно представить в виде краткой схемы:
В самих углеродных скелетах полезно классифицировать отдельные атомы углерода по числу химически связанных с ними атомов углерода. Если данный атом углерода связан с одним атомом углерода, то его называют первичным, с двумя — вторичным, тремя -третичным и четырьмя — четвертичным. Ниже показаны различные атомы углерода в разветвленном насыщенном углеводороде (алкане).
Обозначения: первичный (п), вторичный (в), третичный (т), четвертичный (ч) атомы углерода.
В состав многих органических соединений кроме углерода и водорода входят и другие элементы, причём в виде функциональных групп – групп атомов, определяющих химические свойства данного класса соединений. Некоторые наиболее характерные функциональные группы и соответствующие им классы соединений приведены в таблице:
Некоторые наиболее характерные функциональные группы и соответствующие им классы соединений приведены в таблице:
|
Функциональная группа |
Название группы |
Классы соединений |
Примеры |
|
`-«F»`, `-«Cl»`, `-«Br»`, `-«I»` |
Галогены |
Галоген- производные |
`»CH»_3″Cl»` — хлорметан |
|
`-«OH»` |
Гидроксил |
Спирты |
`»C»_2″H»_5″OH»` — этиловый спирт |
|
Фенолы |
фенол |
||
|
Карбонил |
Альдегиды |
уксусный альдегид |
|
|
Кетоны |
ацетон |
||
|
Карбоксил |
Карбоновые кислоты |
уксусная кислота |
|
|
Аминогруппа |
Амины |
`»C»_2″H»_5″NH»_2`- этиламин |
|
|
`»CH»_3″NHCH»_3`- диметиламин |
|||
|
`-«NO»_2` |
Нитрогруппа |
Нитро- соединения |
`»CH»_3″NO»_2`- нитрометан |
Остановимся более подробно на некоторых из перечисленных классов органических соединений.
можно представить как продукты замещения атомов водорода в молекуле углеводорода гидроксильными группами `–»OH»`. Количество гидроксильных групп в молекуле определяет принадлежность спиртов к одноатомным, двухатомным, трехатомным и многоатомным.
Общая формула гомологического ряда предельных одноатомных спиртов — `»C»_n»H»_(2n+1)»OH»`.
называются продукты замещения в углеводородах атома водорода на группу, а кетоны содержат карбонильную группу , связанную с двумя углеводородными радикалами `»R»`.
Общая формула альдегидов и кетонов `»C»_n»H»_(2n)»O»`.
вещества с общей формулой
Здесь `»R»` — атом `»H»` или углеводородный радикал: `»CH»_3`, `»C»_2″H»_5`, `»C»_3″H»_7` и т. п. Функциональная группа карбоновых кислот — карбоксильная группа:
Карбоновые кислоты с одной группой `»COOH»` в молекуле — одноосновные, с двумя группами `»COOH»` — двухосновные и т. д. В зависимости от природы радикала `»R»` различают предельные, непредельные и ароматические карбоновые кислоты.
Классификация органических соединений.
Органическая химия
Классификация органических соединений.
Ряды органических соединенийОрганические соединения принято делить на две большие группы: соединения с открытой цепью атомов и циклические соединения, т.е. соединения, замкнутые в круговую, циклическую структуру.
1. Соединения с открытой цепью атомов углерода.
Соединения с открытой цепью атомов углерода также называют ациклическими или алифатическими, или соединениями жирного ряда.
В зависимости от характера связей между атомами углерода, эти соединения подразделяют на:
— Предельные (или насыщенные), содержащие в молекулах только простые связи.
— Непредельные (или ненасыщенные), в молекулах которых имеются кратные (двойные, тройные) связи между атомами углерода.
2. Циклические соединения.
Циклические соединения делятся на карбоциклические и гетероциклические.
Циклы карбоциклических соединений состоят только из атомов углерода, в то время как в циклах гетероциклических соединений имеются атомы других элементов (кислорода, азота, серы и др.).
Карбоциклические соединения, в свою очередь, подразделяются на:
— Соединения ароматического ряда. Они характеризуются наличием в молекулах особой циклической группировки из шести атомов углерода – бензольного ароматического ядра. Эта группировка отличается характером связей между атомами углерода и придаёт содержащим её соединениям особые химические свойства, называемые ароматическими свойствами.
— Алициклические соединения – все остальные карбоциклические соединения, за исключением ароматических. Они различаются по числу атомов углерода в цикле и, в зависимости от характера связей между этими атомами, могут быть предельными и непредельными.
Классы органических соединенийСоединения каждого из указанных выше рядов подразделяется на классы.
В рядах ациклических (жирных) и карбоциклических соединений простейшими являются углеводороды, молекулы которых состоят только из углерода и водорода.
Все остальные соединения этих рядов рассматриваются как производные углеводородов, образованные замещением одного, двух или нескольких атомов водорода в углеводородной молекуле другими атомами или группами атомов.
Остатки углеводородов, образующиеся при отнятии от их молекул одного, двух или нескольких атомов водорода называют углеводородными радикалами.
В зависимости от валентности радикала существуют различные его графические обозначения:
Валентность радикала | Обозначение радикала |
|---|---|
| Одновалентные радикалы | |
| Двухвалентные радикалы | |
| Трёхвалентные радикалы |
Атомы или группы атомов, замещающие водород в углеводородной основе, образуют функциональные группы, обуславливающие общие химические свойства веществ, принадлежащие к одному и тому же классу производных углеводородов.
Ниже приведена таблица с общими формулами и названиями некоторых классов органических соединений.
Класс веществ | Общая формула | Функциональная группа |
|---|---|---|
| Спирты и фенолы | ||
| Простые эфиры | ||
| Альдегиды | ||
| Кетоны | ||
| Карбоновые кислоты | ||
| Сложные эфиры |
24,5 Общие классы органических соединений
Цели обучения
- Для понимания общих свойств функциональных групп и различий в их реакционной способности.
Общие свойства и реакционная способность каждого класса органических соединений в значительной степени определяется его функциональными группами. В этом разделе мы описываем взаимосвязь между структурой, физическими свойствами и реакционной способностью для основных классов органических соединений. Мы также покажем вам, как применить эти отношения, чтобы понять некоторые общие реакции, которые химики используют для синтеза органических соединений.
Алканы, алкены и алкины
Температура кипения алканов плавно увеличивается с увеличением молекулярной массы. Они похожи на соответствующие алкены и алкины из-за сходства по молекулярной массе между аналогичными структурами (Таблица \ (\ PageIndex {1} \)). Напротив, точки плавления алканов, алкенов и алкинов с аналогичными молекулярными массами демонстрируют гораздо более широкий разброс, потому что точка плавления сильно зависит от того, как молекулы складываются в твердом состоянии.Следовательно, он чувствителен к относительно небольшим различиям в структуре, таким как расположение двойной связи и то, является ли молекула цис или транс.
| Длина углеродной цепи | |||
|---|---|---|---|
| Класс | Два атома углерода | Три атома углерода | Четыре атома углерода |
| алкан | −88. 6 6 | −42,1 | -0,5 |
| алкен | −103,8 | −47,7 | −6,3 |
| алкин | −84,7 | −23,2 | 8,1 |
Поскольку алканы содержат только связи C – C и C – H, которые являются прочными и не очень полярными (электроотрицательности C и H аналогичны), они нелегко атакуются нуклеофилами или электрофилами.Следовательно, их реакционная способность ограничена, и часто их реакции происходят только в экстремальных условиях. Например, каталитический крекинг можно использовать для превращения алканов с прямой цепью в сильно разветвленные алканы, которые являются лучшим топливом для двигателей внутреннего сгорания. Каталитический крекинг является одним из примеров реакции пиролиза (от греческого pyros, что означает «огонь» и лизиса, что означает «разрыхление»), в которой алканы нагреваются до достаточно высокой температуры, чтобы вызвать разрыв самых слабых связей: C– C одинарные связи.В результате получается смесь радикалов, образованных по существу в результате случайного разрыва различных связей C – C в цепи. Например, пиролиз н-пентана неспецифичен и может давать следующие четыре радикала:
\ [\ mathrm {2CH_3CH_2CH_2CH_2CH_3 \ xrightarrow {\ Delta} CH_3 \ cdot + CH_2CH_2CH_2 \ cdot + CH_3CH_2 \ cdot + CH_3CH_2CH_2 \ cdot} \ tag {24.5.1} \]
Рекомбинация этих радикалов (стадия обрыва) может давать этан, пропан, бутан, н-пентан, н-гексан, н-гептан и н-октан.Радикалы, которые образуются в середине цепи в результате разрыва связи C – H, имеют тенденцию к образованию разветвленных углеводородов. При каталитическом крекинге более легкие алканы удаляются из смеси перегонкой.
Радикалы также образуются при сжигании алканов, конечными продуктами которых являются CO 2 и H 2 O. Радикалы стабилизируются наличием нескольких углеродных заместителей, которые могут передавать электронную плотность электронодефицитному углероду. Химическое объяснение октанового числа частично основывается на стабильности радикалов, образующихся из различных углеводородных топлив.Напомним, что н-гептан, который не горит плавно, имеет октановое число 0, а 2,2,4-триметилпентан («изооктан»), который горит довольно гладко, имеет рейтинг 100. Изооктан имеет разветвленную структуру и способен образовывать сравнительно стабильные третичные радикалы.
Химическое объяснение октанового числа частично основывается на стабильности радикалов, образующихся из различных углеводородных топлив.Напомним, что н-гептан, который не горит плавно, имеет октановое число 0, а 2,2,4-триметилпентан («изооктан»), который горит довольно гладко, имеет рейтинг 100. Изооктан имеет разветвленную структуру и способен образовывать сравнительно стабильные третичные радикалы.
Напротив, радикалы, образующиеся при сгорании н-гептана, будь то первичный или вторичный, менее стабильны и, следовательно, более реактивны, что частично объясняет, почему горение н-гептана вызывает преждевременное воспламенение и детонацию двигателя.
В Разделе 24.2 мы объяснили, что вращение вокруг кратных углерод-углеродных связей алкенов и алкинов не может происходить без разрыва π-связи, которая, следовательно, представляет собой большой энергетический барьер для вращения (Рисунок \ (\ PageIndex {1} \)). Следовательно, цис- и транс-изомеры алкенов обычно ведут себя как отдельные соединения с разными химическими и физическими свойствами. Четырехуглеродный алкен имеет четыре возможных изомерных формы: три структурных изомера, которые различаются связностью, плюс пара геометрических изомеров из одного структурного изомера (2-бутена).Эти два геометрических изомера представляют собой цис-2-бутен и транс-2-бутен. Четыре изомера имеют существенно разные физические свойства.
Рисунок \ (\ PageIndex {1} \): углерод-углеродная связь в алкенах и взаимное превращение цис- и транс-изомеров
В бутане существует лишь небольшой энергетический барьер для вращения вокруг σ-связи C2 – C3. При образовании цис- или транс-2-бутена из бутана p-орбитали на C2 и C3 перекрываются, образуя π-связь. Чтобы превратить цис-2-бутен в транс-2-бутен или наоборот посредством вращения вокруг двойной связи, π-связь должна быть разорвана.Поскольку это взаимное превращение энергетически невыгодно, цис- и транс-изомеры представляют собой разные соединения, которые обычно имеют разные физические и химические свойства.
Алкины, в которых тройная связь расположена на одном конце углеродной цепи, называются концевыми алкинами и содержат атом водорода, присоединенный непосредственно к трехсвязному углероду: R – C≡C – H. Терминальные алкины необычны тем, что атом водорода может быть удален относительно легко, как H + , образуя ион ацетилида (R – C≡C — ).Ионы ацетилида являются сильнодействующими нуклеофилами, которые являются особенно полезными реагентами для образования более длинных углеродных цепей посредством реакции нуклеофильного замещения. Как и в предыдущих примерах таких реакций, нуклеофил атакует частично положительно заряженный атом в полярной связи, который в следующей реакции является углеродом связи Br – C:
Алкены и алкины чаще всего получают реакциями элиминирования. Типичным примером является получение 2-метил-1-пропена, производное которого 3-хлор-2-метил-1-пропен используется в качестве фумиганта и инсектицида.Исходное соединение может быть получено либо из 2-гидрокси-2-метилпропана, либо из 2-бром-2-метилпропана:
Реакция слева протекает путем удаления элементов воды (H + плюс OH — ), так что это реакция дегидратации. Если алкан содержит две правильно расположенные функциональные группы, такие как –OH или –X, обе они могут быть удалены как H 2 O или HX с образованием тройной связи углерод-углерод:
Алкены и алкины чаще всего получают реакциями элиминирования.
Арены
Большинство аренов, содержащих одно шестичленное кольцо, представляют собой летучие жидкости, такие как бензол и ксилолы, хотя некоторые арены с заместителями в кольце являются твердыми веществами при комнатной температуре. В газовой фазе дипольный момент бензола равен нулю, но присутствие электроотрицательных или электроположительных заместителей может привести к суммарному дипольному моменту, который увеличивает силы межмолекулярного притяжения и повышает температуры плавления и кипения. Например, 1,4-дихлорбензол, соединение, используемое в качестве альтернативы нафталину при производстве нафталиновых шариков, имеет температуру плавления 52.7 ° C, что значительно выше температуры плавления бензола (5,5 ° C).
Например, 1,4-дихлорбензол, соединение, используемое в качестве альтернативы нафталину при производстве нафталиновых шариков, имеет температуру плавления 52.7 ° C, что значительно выше температуры плавления бензола (5,5 ° C).
Некоторые ароматические углеводороды, такие как бензол и бенз [a] пирен, являются сильнодействующими токсинами и канцерогенами для печени. В 1775 году британский врач Персиваль Потт описал высокую заболеваемость раком мошонки среди маленьких мальчиков, которых использовали в качестве трубочистов, и объяснил это воздействием сажи. Его выводы были правильными: бенз [a] пирен, компонент дымовой сажи, мяса, приготовленного на углях, и сигаретного дыма, был первым химическим канцерогеном, который был идентифицирован.
Хотя арены обычно рисуются с тремя связями C = C, бензол примерно на 150 кДж / моль более стабилен, чем можно было бы ожидать, если бы он содержал три двойные связи. Эта повышенная стабильность обусловлена делокализацией электронной плотности π по всем атомам кольца. По сравнению с алкенами арены — плохие нуклеофилы. Следовательно, они не подвергаются реакциям присоединения, как алкены; вместо этого они подвергаются различным реакциям электрофильного ароматического замещения, которые включают замену –H на арене группой –E, такой как –NO 2 , –SO 3 H, галогеном или алкильной группой, в двухэтапном процессе.Первый этап включает добавление электрофила (E) к π-системе бензола с образованием карбокатиона. На втором этапе протон теряется из соседнего углерода на кольце:
Карбокатион, образованный на первом этапе, стабилизируется за счет резонанса.
Арены претерпевают реакции замещения, а не отщепления из-за повышенной стабильности, возникающей в результате делокализации их π-электронной плотности.
Многие замещенные арены обладают сильной биологической активностью.Некоторые примеры включают распространенные лекарства и антибиотики, такие как аспирин и ибупрофен, запрещенные наркотики, такие как амфетамины и пейот, аминокислота фенилаланин и гормоны, такие как адреналин (Рисунок \ (\ PageIndex {2} \)).
Аспирин (жаропонижающее действие), ибупрофен (жаропонижающее и противовоспалительное действие) и амфетамин (стимулятор) обладают фармакологическим действием. Фенилаланин — это аминокислота. Адреналин — это гормон, вызывающий реакцию «бей или беги» на стресс.Хиральные центры отмечены звездочкой.
Спирты и эфиры
Как спирты, так и простые эфиры можно рассматривать как производные воды, в которых по крайней мере один атом водорода замещен органической группой, как показано здесь. Из-за электроотрицательного атома кислорода отдельные диполи связи O – H в спиртах не могут компенсировать друг друга, что приводит к значительному дипольному моменту, который позволяет спиртам образовывать водородные связи.
Следовательно, спирты имеют значительно более высокие температуры кипения, чем алканы или алкены сравнимой молекулярной массы, тогда как простые эфиры без полярной связи O – H имеют промежуточные точки кипения из-за наличия небольшого дипольного момента (Таблица \ (\ PageIndex {2}) \)).Однако чем больше алкильная группа в молекуле, тем более «алканоподобный» спирт по своим свойствам. Из-за своей полярной природы спирты и простые эфиры, как правило, являются хорошими растворителями для широкого спектра органических соединений.
| Имя | Формула | Молекулярная масса (а.е.м.) | Температура кипения (° C) | |
|---|---|---|---|---|
| алкан | пропан | C 3 H 8 | 44 | −42. 1 1 |
| н-пентан | С 5 В 12 | 72 | 36,1 | |
| н-гептан | С 7 В 16 | 100 | 98,4 | |
| эфир | диметиловый эфир | (CH 3 ) 2 O | 46 | −24.5,1 |
| диэтиловый эфир | (CH 3 CH 2 ) 2 O | 74 | 34,5 | |
| ди-н-пропиловый эфир | (канал 3 канал 2 канал 2 ) 2 O | 102 | 90,1 | |
| спирт | этанол | СН 3 СН 2 ОН | 46 | 78.3 |
| н-бутанол | CH 3 (CH 2 ) 3 OH | 74 | 117,7 | |
| н-гексанол | CH 3 (CH 2 ) 5 OH | 102 | 157,6 |
Спирты обычно получают путем добавления воды через двойную углерод-углеродную связь или путем реакции нуклеофильного замещения алкилгалогенида с использованием гидроксида, сильного нуклеофила (рисунок \ (\ PageIndex {1} \)).Спирты также могут быть получены восстановлением соединений, содержащих карбонильную функциональную группу (C = O; часть (a) на рисунке 24.5.7). Спирты классифицируются как первичные, вторичные или третичные, в зависимости от того, связана ли группа –ОН с первичным, вторичным или третичным углеродом. Например, соединение 5-метил-3-гексанол представляет собой вторичный спирт.
Например, соединение 5-метил-3-гексанол представляет собой вторичный спирт.
Простые эфиры, особенно с двумя разными алкильными группами (ROR ‘), могут быть получены реакцией замещения, в которой нуклеофильный алкоксид-ион (RO —) атакует частично положительно заряженный атом углерода полярной связи C – X соединения алкилгалогенид (R′X):
Хотя и спирты, и фенолы имеют функциональную группу –ОН, фенолы на 10 6 –10 8 более кислые, чем спирты.Это в значительной степени связано с тем, что простые спирты имеют -ОН-звено, присоединенное к sp 3 гибридизированному углероду, тогда как фенолы имеют sp 2 гибридизированный атом углерода, связанный с атомом кислорода. Таким образом, отрицательный заряд иона феноксида может взаимодействовать с π-электронами в кольце, тем самым делокализуя и стабилизируя отрицательный заряд через резонанс. Напротив, отрицательный заряд на ионе алкоксида не может быть стабилизирован этими типами взаимодействий.
Спирты подвергаются двум основным типам реакций: реакциям с разрывом связи O – H и реакциям с разрывом связи C – O.- \ tag {24.5.1} \]
Спирты подвергаются двум основным типам реакций: разрыв связи O – H и разрыв связи C – O.
В спиртах разрыв связи C – O происходит в кислой среде. Сначала протонируется –OH, и следует нуклеофильное замещение:
Однако в отсутствие нуклеофила может происходить отщепление с образованием алкена (рис. 24.5.6). В эфирах отсутствует -ОН-звено, которое играет центральную роль в реакционной способности спиртов, поэтому они сравнительно инертны.Их низкая реакционная способность делает их очень подходящими в качестве растворителей для проведения органических реакций.
Альдегиды и кетоны
Ароматические альдегиды, обладающие интенсивным и характерным вкусом и ароматом, являются основными компонентами таких хорошо известных ароматизаторов, как ваниль и корица (рис. 24.5.3). Многие кетоны, такие как камфора и жасмин, также обладают интенсивным ароматом. Кетоны содержатся во многих гормонах, ответственных за дифференциацию пола у людей, таких как прогестерон и тестостерон.
24.5.3). Многие кетоны, такие как камфора и жасмин, также обладают интенсивным ароматом. Кетоны содержатся во многих гормонах, ответственных за дифференциацию пола у людей, таких как прогестерон и тестостерон.
В соединениях, содержащих карбонильную группу, нуклеофильная атака может происходить по атому углерода карбонила, тогда как электрофильная атака происходит по кислороду.
Альдегиды и кетоны содержат карбонильную функциональную группу, которая имеет заметный дипольный момент из-за полярной связи C = O. Присутствие карбонильной группы приводит к сильным межмолекулярным взаимодействиям, в результате которых альдегиды и кетоны имеют более высокие температуры кипения, чем алканы или алкены сравнимой молекулярной массы (Таблица 24.5.3). По мере увеличения массы молекулы карбонильная группа становится менее важной для общих свойств соединения, и точки кипения приближаются к температурам кипения соответствующих алканов.
| Имя | Формула | Молекулярная масса (а.е.м.) | Температура кипения (° C) | |
|---|---|---|---|---|
| алкан | н-бутан | C 4 H 10 | 58 | −0.5 |
| н-пентан | С 5 В 12 | 72 | 36,1 | |
| альдегид | пропиональдегид (пропаналь) | C 3 H 6 O | 58 | 48,0 |
| бутиральдегид (бутаналь) | C 4 H 8 O | 72 | 74. 8 8 | |
| кетон | ацетон (2-пропанон) | C 3 H 6 O | 58 | 56,1 |
| метилэтилкетон (2-бутанон) | C 4 H 8 O | 72 | 79,6 |
Альдегиды и кетоны обычно получают окислением спиртов (часть (а) на рисунке 24.5.7). В их реакциях частично положительно заряженный атом углерода карбонильной группы является электрофилом, который подвергается нуклеофильной атаке. И наоборот, неподеленные пары электронов на атоме кислорода карбонильной группы допускают электрофильную атаку. Следовательно, альдегиды и кетоны могут подвергаться как нуклеофильной атаке (по атому углерода), так и электрофильной атаке (по атому кислорода).
Нуклеофильная атака происходит на частично положительно заряженном атоме углерода карбонильной функциональной группы.Электрофильная атака происходит по неподеленным парам электронов на атоме кислорода.
Альдегиды и кетоны реагируют со многими металлоорганическими соединениями, содержащими стабилизированные карбанионы. Одним из наиболее важных классов таких соединений являются реактивы Гриньяра, магнийорганические соединения с формулой RMgX (X представляет собой Cl, Br или I), которые настолько сильно поляризованы, что их можно рассматривать как содержащие R — и MgX +. . Эти реагенты названы в честь французского химика Виктора Гриньяра (1871–1935), получившего Нобелевскую премию по химии в 1912 году за их разработку.В реакции Гриньяра карбонильная функциональная группа превращается в спирт, и углеродная цепь карбонильного соединения удлиняется путем добавления группы R из реактива Гриньяра. Одним из примеров является взаимодействие хлорида циклогексилмагния, реактива Гриньяра, с формальдегидом:
Нуклеофильный карбанион циклогексильного кольца атакует электрофильный атом углерода карбонильной группы.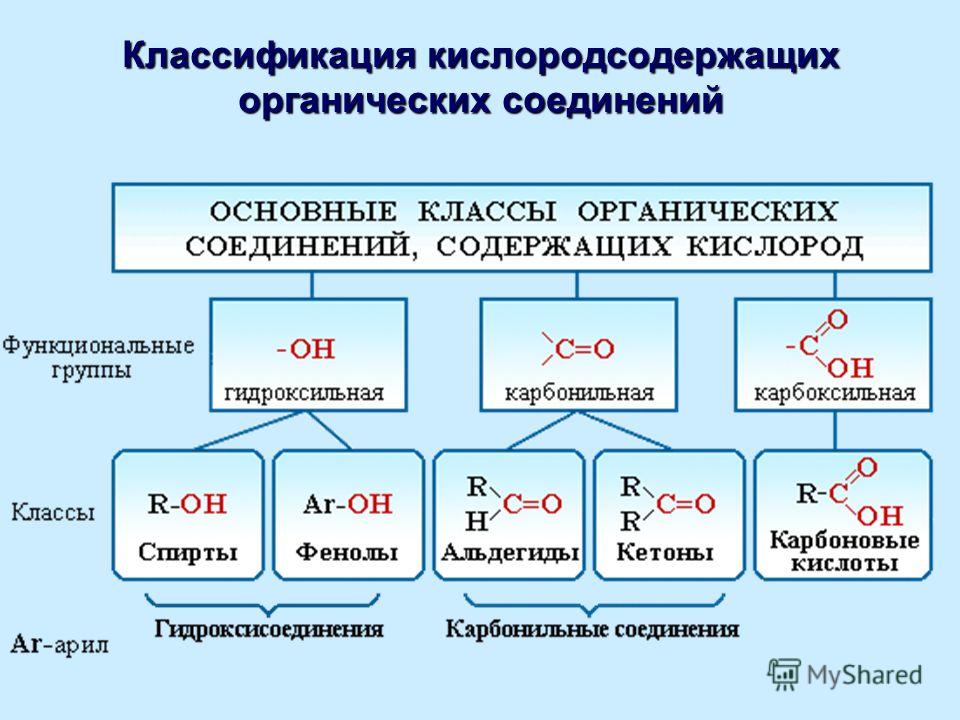 Подкисление раствора приводит к протонированию промежуточного продукта с образованием спирта.Альдегиды также могут быть получены путем восстановления группы карбоновой кислоты (–CO 2 H) (часть (a) на рисунке 24.5.7), а кетоны могут быть получены путем взаимодействия производного карбоновой кислоты с реактивом Гриньяра. Первая реакция требует мощного восстановителя, такого как гидрид металла.
Подкисление раствора приводит к протонированию промежуточного продукта с образованием спирта.Альдегиды также могут быть получены путем восстановления группы карбоновой кислоты (–CO 2 H) (часть (a) на рисунке 24.5.7), а кетоны могут быть получены путем взаимодействия производного карбоновой кислоты с реактивом Гриньяра. Первая реакция требует мощного восстановителя, такого как гидрид металла.
\ (\ PageIndex {1} \)
Объясните, как каждая реакция протекает с образованием указанного продукта.
Дано : химическая реакция
Спрошено : как формируются продукты
Стратегия:
- Определите функциональную группу и классифицируйте реакцию.
- Используйте описанные механизмы, чтобы предложить начальные шаги в реакции.
Решение:
- A Один из реагентов — спирт, который подвергается реакции замещения.
B В продукте бромидная группа замещена гидроксильной группой. Следовательно, первой стадией этой реакции должно быть протонирование группы –ОН спирта H + HBr с последующим отщеплением воды с образованием карбокатиона:
Ион бромида является хорошим нуклеофилом, который может реагировать с карбокатионом с образованием алкилбромида:
- A Один реагент представляет собой реактив Гриньяра, а другой содержит карбонильную функциональную группу.Карбонильные соединения действуют как электрофилы, подвергаясь нуклеофильной атаке карбонильного углерода.
B Нуклеофилом является фенилкарбанион реактива Гриньяра:
Продукт — бензиловый спирт.
Упражнение \ (\ PageIndex {1} \)
Предскажите продукт каждой реакции.
Ответ:
Карбоновые кислоты
Резкий запах многих карбоновых кислот является причиной запахов, которые мы ассоциируем с такими разнообразными источниками, как швейцарский сыр, прогорклое масло, навоз, козье молоко и простокваша. Точки кипения карбоновых кислот обычно несколько выше, чем можно было бы ожидать, исходя из их молекулярных масс, из-за сильных водородных связей между молекулами. Фактически, большинство простых карбоновых кислот образуют димеры в жидкости и даже в паровой фазе. Четыре легчайшие карбоновые кислоты полностью смешиваются с водой, но по мере удлинения алкильной цепи они становятся более «алканоподобными», поэтому их растворимость в воде снижается.
Точки кипения карбоновых кислот обычно несколько выше, чем можно было бы ожидать, исходя из их молекулярных масс, из-за сильных водородных связей между молекулами. Фактически, большинство простых карбоновых кислот образуют димеры в жидкости и даже в паровой фазе. Четыре легчайшие карбоновые кислоты полностью смешиваются с водой, но по мере удлинения алкильной цепи они становятся более «алканоподобными», поэтому их растворимость в воде снижается.
Соединения, содержащие карбоксильную функциональную группу, являются кислотными, потому что карбоновые кислоты могут легко потерять протон: отрицательный заряд в карбоксилат-ионе (RCO 2 — ) стабилизируется делокализацией π-электронов:
В результате карбоновые кислоты примерно в 10 10 раз более кислые, чем соответствующие простые спирты, анионы которых (RO — ) не стабилизируются посредством резонанса.- + H_2O} \ tag {24.5.2} \]
Начальная стадия реакции — нуклеофильная атака группой R — реактива Гриньяра на электрофильный углерод CO 2 :
Делокализация π-связи по трем атомам (O – C – O) делает карбоновые кислоты и их производные менее восприимчивыми к нуклеофильной атаке, чем альдегиды и кетоны с их одинарной π-связью. В реакциях карбоновых кислот доминируют два фактора: их полярная группа –CO 2 H и их кислотность.+ + H_2O \ tag {24.5.3} \]
, где R — это CH 3 (CH 2 ) 16 . Как вы узнали ранее, длинноцепочечные карбоксилатные соли используются в качестве мыла.
Делокализация π-связи по трем атомам делает карбоновые кислоты и их производные менее восприимчивыми к нуклеофильной атаке по сравнению с альдегидами и кетонами.
Производные карбоновых кислот
Замена –OH в карбоновой кислоте группами, которые имеют различную тенденцию к участию в резонансе с функциональной группой C = O, дает производные с довольно разными свойствами. Резонансные структуры оказывают значительное влияние на реакционную способность производных карбоновых кислот, но их влияние существенно варьируется, наименее важно для галогенидов и наиболее важно для азота амидов. В этом разделе мы кратко рассмотрим химию двух наиболее известных и важных производных карбоновых кислот: сложных эфиров и амидов.
Резонансные структуры оказывают значительное влияние на реакционную способность производных карбоновых кислот, но их влияние существенно варьируется, наименее важно для галогенидов и наиболее важно для азота амидов. В этом разделе мы кратко рассмотрим химию двух наиболее известных и важных производных карбоновых кислот: сложных эфиров и амидов.
Сложные эфиры
Сложные эфиры имеют общую формулу RCO 2 R ‘, где R и R’ могут означать практически любую алкильную или арильную группу.Сложные эфиры часто получают реакцией спирта (R’OH) с карбоновой кислотой (RCO 2 H) в присутствии каталитического количества сильной кислоты. Назначение кислоты (электрофила) состоит в том, чтобы протонировать атом кислорода с двойной связью карбоновой кислоты (нуклеофил), чтобы получить вид, который является более электрофильным, чем исходная карбоновая кислота.
Нуклеофильный атом кислорода спирта атакует электрофильный атом углерода протонированной карбоновой кислоты с образованием новой связи C – O.Общую реакцию можно записать так:
Рисунок \ (\ PageIndex {4} \)Поскольку вода удаляется, это реакция дегидратации. Если нагреть водный раствор сложного эфира и сильной кислоты или основания, обратная реакция будет происходить с образованием исходного спирта R’OH и либо карбоновой кислоты RCO 2 H (в сильнокислых условиях), либо карбоксилатного аниона RCO . 2 — (на базовых условиях).
Как указывалось ранее, сложные эфиры знакомы большинству из нас как ароматизаторы, такие как банан и ананас.Другие сложные эфиры с интенсивным ароматом действуют как сексуальные аттрактанты или феромоны, такие как феромон восточной плодовой мушки. Исследования по использованию синтетических феромонов насекомых в качестве более безопасной альтернативы инсектицидам для борьбы с популяциями насекомых, таких как тараканы, являются быстрорастущей областью органической химии.
Амиды
В общем составе амида,
, два заместителя у амидного азота могут быть атомами водорода, алкильными группами, арильными группами или любой комбинацией этих разновидностей. + \ tag {24.5.4} \]
+ \ tag {24.5.4} \]
Амиды поэтому обычно получают нуклеофильной реакцией аминов с более электрофильными производными карбоновых кислот, такими как сложные эфиры.
Рисунок \ (\ PageIndex {5} \): Электронная структура амида. (а) Негибридизированная 2pz-орбиталь на азоте, содержащая неподеленную электронную пару электронов, может взаимодействовать с π-орбиталью карбонильной группы, образуя трехцентровую четырехэлектронную связь. Это взаимодействие снижает реакционную способность амида, делая амиды наименее реакционноспособными из производных карбоновой кислоты.(b) Сравнение карт электростатического потенциала ацетальдегида и формамида показывает, что отрицательный заряд (обозначенный синим цветом) более локализован на атоме кислорода ацетальдегида, чем в формамиде. Поэтому формамид менее реакционноспособен.Неподеленная пара электронов на атоме азота амида может участвовать в π-связывании с карбонильной группой, тем самым снижая реакционную способность амида (рис. 24.5.5) и препятствуя свободному вращению вокруг связи C – N. Следовательно, амиды наименее реакционноспособны из производных карбоновых кислот.Стабильность амидной связи критически важна в биологии, потому что амидные связи образуют основы пептидов и белков. Амидная связь также обнаруживается во многих других биологически активных и коммерчески важных молекулах, включая пенициллин; мочевина, которая используется как удобрение; сахарин, заменитель сахара; и валиум, мощный транквилизатор.
Амиды являются наименее реакционно-способными из производных карбоновой кислоты, поскольку амиды участвуют в π-связывании с карбонильной группой.
Амины
Амины представляют собой производные аммиака, в которых один или несколько атомов водорода заменены алкильными или арильными группами. Поэтому они аналогичны спиртам и эфирам. Как и спирты, амины подразделяются на первичные, вторичные или третичные, но в этом случае обозначение относится к количеству алкильных групп, связанных с атомом азота, а не к количеству соседних атомов углерода. В первичных аминах азот связан с двумя атомами водорода и одной алкильной группой; во вторичных аминах азот связан с одним водородом и двумя алкильными группами; а в третичных аминах азот связан с тремя алкильными группами.С одной неподеленной парой электронов и связями C – N, которые менее полярны, чем связи C – O, аммиак и простые амины имеют гораздо более низкие температуры кипения, чем вода или спирты с аналогичными молекулярными массами. Первичные амины обычно имеют промежуточные температуры кипения между соответствующими спиртом и алканом. Более того, вторичные и третичные амины имеют более низкие температуры кипения, чем первичные амины сравнимой молекулярной массы.
В первичных аминах азот связан с двумя атомами водорода и одной алкильной группой; во вторичных аминах азот связан с одним водородом и двумя алкильными группами; а в третичных аминах азот связан с тремя алкильными группами.С одной неподеленной парой электронов и связями C – N, которые менее полярны, чем связи C – O, аммиак и простые амины имеют гораздо более низкие температуры кипения, чем вода или спирты с аналогичными молекулярными массами. Первичные амины обычно имеют промежуточные температуры кипения между соответствующими спиртом и алканом. Более того, вторичные и третичные амины имеют более низкие температуры кипения, чем первичные амины сравнимой молекулярной массы.
Третичные амины образуют катионы, аналогичные иону аммония (NH 4 + ), в котором все четыре атома H замещены алкильными группами.Такие вещества, называемые солями четвертичного аммония, могут быть хиральными, если все четыре заместителя различны. (Амины с тремя разными заместителями также являются хиральными, поскольку неподеленная пара электронов представляет четвертый заместитель.)
Алкиламины могут быть получены реакциями нуклеофильного замещения алкилгалогенидов аммиаком или другими аминами:
\ [RCl + NH_3 \ rightarrow RNH_2 + HCl \ tag {24.5.5} \]
\ [RCl + R′NH_2 \ rightarrow RR′NH + HCl \ tag {24.5.6} \]
\ [RCl + R′R ″ NH \ rightarrow RR′R ″ N + HCl \ tag {24.5.7} \]
Первичный амин, образованный в первой реакции (уравнение 24.5.5), может реагировать с большим количеством алкилгалогенида с образованием вторичного амина (уравнение 24.5.6), который, в свою очередь, может реагировать с образованием третичного амина (уравнение 24.5.7). Следовательно, реальная реакционная смесь содержит первичные, вторичные и третичные амины и даже соли четвертичного аммония.
В реакциях аминов преобладают два свойства: их способность действовать как слабые основания и их склонность действовать как нуклеофилы, оба из которых обусловлены присутствием неподеленной пары электронов на атоме азота. −_ {(вод)} \ tag {24.5.8} \]
−_ {(вод)} \ tag {24.5.8} \]
, который дает хлорид триэтиламмония. Амины могут реагировать практически с любым электрофилом, включая карбонильный углерод альдегида, кетона или сложного эфира. Ариламины, такие как анилин (C 6 H 5 NH 2 ), являются гораздо более слабыми основаниями, чем алкиламины, потому что неподеленная пара электронов на азоте взаимодействует с π-связями ароматического кольца, делокализуя неподеленную пару через резонанс ( Рисунок 24.5.6).
Примечание
В реакциях аминов преобладают их способность действовать как слабые основания и их склонность действовать как нуклеофилы.
Рисунок \ (\ PageIndex {6} \): Структуры и основность анилина и циклогексиламинаДелокализация неподеленной электронной пары на N над бензольным кольцом снижает основность ариламинов, таких как анилин, по сравнению с основностью алкиламинов, таких как циклогексиламин. Эти карты электростатического потенциала показывают, что электронная плотность на N циклогексиламина более локализована, чем в анилине, что делает циклогексиламин более сильным основанием.
Пример \ (\ PageIndex {2} \)
Предскажите продукты, образующиеся в каждой реакции, и покажите начальный участок атаки и, для части (b), конечные продукты.
- C 6 H 5 CH 2 CO 2 H + KOH →
Дано : реагенты
Запрошено : продукты и механизм реакции
Стратегия :
Используйте стратегию, описанную в Примере 7.
Решение :
- Протон функциональной группы карбоновой кислоты является кислым. Таким образом, реакция карбоновой кислоты с сильным основанием представляет собой кислотно-щелочную реакцию, продуктами которой являются соли — в данном случае C 6 H 5 CH 2 CO 2 — K + — и вода.

- Азот циклогексиламина содержит неподеленную пару электронов, что делает его отличным нуклеофилом, тогда как карбонильный углерод этилацетата является хорошим электрофилом. Поэтому мы ожидаем реакции, в которой нуклеофильная атака на карбонильный углерод сложного эфира дает амид и этанол. Первоначальный очаг атаки и продукты реакции следующие:
Упражнение \ (\ PageIndex {2} \)
Предскажите продукты каждой реакции. Укажите первоначальный сайт атаки.
- уксусная кислота с пропанолом-1
- анилин (C 6 H 5 NH 2 ) с пропилацетатом [CH 3 C (= O) OCH 2 CH 2 CH 3 ]
Ответ :
- Начальная атака происходит при протонировании кислорода карбонила. Товаров:
- Первоначальная атака происходит у углерода карбонильной группы. Товаров:
Реакции, подобные тем, которые мы обсуждали в этом разделе, используются для синтеза широкого спектра органических соединений.Однако, когда химики планируют синтез органической молекулы, они должны принимать во внимание различные факторы, такие как доступность и стоимость реагентов, необходимость минимизировать образование нежелательных продуктов и правильную последовательность реакций для максимального увеличения выхода молекулы-мишени и сводят к минимуму образование нежелательных продуктов. Поскольку синтез многих органических молекул требует нескольких этапов, при разработке схемы синтеза таких молекул химики часто должны работать в обратном направлении от желаемого продукта в процессе, называемом ретросинтезом.Используя этот процесс, они могут определить стадии реакции, необходимые для синтеза желаемого продукта из доступных реагентов.
Сводка
- Физические свойства и реакционная способность соединений, содержащих общие функциональные группы, тесно связаны с их структурой.

Между структурой, физическими свойствами и реакционной способностью соединений, содержащих основные функциональные группы, существуют сильные связи. Углеводороды, представляющие собой алканы, подвергаются каталитическому крекингу, который может превращать алканы с прямой цепью в алканы с высокой степенью разветвления.Каталитический крекинг является одним из примеров реакции пиролиза, в которой самая слабая связь разрывается при высокой температуре с образованием смеси радикалов. Кратная связь алкена дает геометрические изомеры (цис и транс). Терминальные алкины содержат атом водорода, непосредственно связанный с трехсвязанным углеродом. При удалении водорода образуется ацетилид-ион, мощный нуклеофил, используемый для образования более длинных углеродных цепей. Арены подвергаются замещению, а не устранению из-за повышенной стабильности из-за делокализации их π-электронной плотности.Спирт часто получают добавлением элементов воды через двойную связь или реакцией замещения. Спирты претерпевают два основных типа реакций: реакции с разрывом связи O – H и реакции с разрывом связи C – O. Фенолы являются кислыми из-за π-взаимодействий между атомом кислорода и кольцом. Эфиры сравнительно инертны. Альдегиды и кетоны обычно получают окислением спиртов. Их химия характеризуется нуклеофильной атакой по атому углерода карбонильной функциональной группы и электрофильной атакой по атому кислорода.Реагенты Гриньяра (RMgX, где X представляет собой Cl, Br или I) превращают карбонильную функциональную группу в спирт и удлиняют углеродную цепь. Соединения, которые содержат карбоксильную функциональную группу, являются слабокислотными из-за делокализации π-электронов, которая заставляет их легко терять протон и образовывать карбоксилат-анион. Карбоновые кислоты обычно получают окислением спиртов и альдегидов или взаимодействием реактива Гриньяра с CO 2 . Производные карбоновых кислот включают сложные эфиры, полученные взаимодействием карбоновой кислоты и спирта, и амиды, полученные нуклеофильной реакцией аминов с более электрофильными производными карбоновой кислоты, такими как сложные эфиры. Амиды относительно инертны из-за π-связывающих взаимодействий между неподеленной парой азота и карбонильной группой. Амины также могут быть первичными, вторичными или третичными, в зависимости от количества алкильных групп, связанных с амином. Соли четвертичного аммония имеют четыре заместителя, присоединенные к азоту, и могут быть хиральными. Амины часто получают реакцией нуклеофильного замещения между полярным галогенидом алкила и аммиаком или другими аминами. Они являются нуклеофилами, но их основная сила зависит от их заместителей.
Амиды относительно инертны из-за π-связывающих взаимодействий между неподеленной парой азота и карбонильной группой. Амины также могут быть первичными, вторичными или третичными, в зависимости от количества алкильных групп, связанных с амином. Соли четвертичного аммония имеют четыре заместителя, присоединенные к азоту, и могут быть хиральными. Амины часто получают реакцией нуклеофильного замещения между полярным галогенидом алкила и аммиаком или другими аминами. Они являются нуклеофилами, но их основная сила зависит от их заместителей.
Концептуальные проблемы
- Почему алканы с разветвленной цепью имеют более низкие температуры плавления, чем алканы с прямой цепью сопоставимой молекулярной массы?
- Опишите алканы с точки зрения их орбитальной гибридизации, полярности и реакционной способности. Какова геометрия каждого атома углерода линейного алкана?
- Почему алкены образуют цис- и транс-изомеры, а алканы — нет? Образуют ли алкины цис- и транс-изомеры? Почему или почему нет?
- Какие соединения могут существовать в виде цис- и транс-изомеров?
- 2,3-диметил-1-бутен
- 3-метил-1-бутен
- 2-метил-2-пентен
- 2-пентен
- Какие соединения могут существовать в виде цис- и транс-изомеров?
- 3-этил-3-гексен
- 1,1-дихлор-1-пропен
- 1-хлор-2-пентен
- 3-октен
- Какие соединения имеют чистый дипольный момент?
- о-нитротолуол
- п-бромнитробензол
- п-дибромбензол
- Почему точка кипения спирта намного выше, чем у алкана сопоставимой молекулярной массы? Почему низкомолекулярные спирты являются достаточно хорошими растворителями для некоторых ионных соединений, а алканы — нет?
- Алкоголь — это нуклеофил или электрофил? От чего зависит реакционная способность алкоголя? Чем реакционная способность спирта отличается от реакционной способности ионного соединения, содержащего ОН, такого как КОН?
- Какова реакционная способность эфиров по сравнению со спиртами? Почему? Эфиры могут расщепляться в сильнокислой среде.
 Объясните, как это может происходить.
Объясните, как это может происходить. - Какая функциональная группа является общей для альдегидов, кетонов, карбоновых кислот и сложных эфиров? Эта функциональная группа может реагировать как с нуклеофилами, так и с электрофилами. Где происходит нуклеофильная атака на эту функциональную группу? Где происходит электрофильная атака?
- Какая ключевая особенность реактива Гриньяра позволяет ему проводить нуклеофильную атаку на карбонильный углерод?
- Ожидаете ли вы, что карбоновые кислоты будут более или менее растворимы в воде, чем кетоны сопоставимой молекулярной массы? Почему?
- Поскольку амиды формально являются производными кислоты и амина, почему их нельзя получить реакцией кислоты с амином? Как они вообще готовятся?
- Подвержен ли амид нуклеофильной атаке, электрофильной атаке или обоим? Укажите, где происходит атака.
- Какие факторы определяют реакционную способность аминов?
Ответы
- (в) и (г)
- Наличие нуклеофильного C δ- в результате высокополярного взаимодействия с электроположительным Mg
- Их способность действовать как слабые основания и их склонность действовать как нуклеофилы
Структура и реакционная способность
- Какой продукт реакции 2-бутина с избытком HBr?
- Какой продукт реакции 3-гексина с избытком HCl?
- Какие элементы удаляются при дегидрогалогенировании алкилгалогенида? Какие продукты вы ожидаете от дегидрогалогенирования 2-хлор-1-пентена?
- Какие элементы удаляются при обезвоживании спирта? Какие продукты вы ожидаете от обезвоживания этанола?
- Предскажите продукты каждой реакции.
- феноксид натрия с этилхлоридом
- 1-хлорпропан с NaOH
- Покажите механизм и предскажите органический продукт каждой реакции.

- 2-пропанол + HCl
- циклогексанол + H 2 SO 4
- Реагент Гриньяра может использоваться для образования карбоновой кислоты. Покажите механизм первой стадии этой реакции, используя CH 3 CH 2 MgBr в качестве реактива Гриньяра.Какова геометрия углерода -CH 2 промежуточных частиц, образовавшихся на этом первом этапе?
- Изобразите молекулярную орбитальную картину, показывающую связывание в амиде. Какая орбиталь используется для неподеленной пары электронов азота?
- Какой продукт реакции
- уксусная кислота с аммиаком?
- метилацетата с этиламином с последующим нагреванием?
- Разработайте синтетическую схему для генерации
- 1,1-дихлорэтан из 1,1-дибромэтана.
- 2-бром-1-гептен из 1-бромпентана.
Ответы
- 2,2-дибромбутан
- C 6 H 5 OC 2 H 5 + NaCl
- 1-пропанол + NaCl
- CH 3 CO 2 — NH 4 + (кислотно-щелочная реакция)
- CH 3 CONHC 2 H 5 + CH 3 OH
24.1. Функциональные группы и классы органических соединений
Цели обучения
- Знать основные классы органических соединений и определять важные функциональные группы.
Ранее вы познакомились с несколькими структурными единицами, которые химики используют для классификации органических соединений и прогнозирования их реакционной способности. Эти функциональные группы, которые определяют химическую реакционную способность молекулы при заданном наборе условий, могут состоять из одного атома (например, Cl) или группы атомов (например, CO 2 H). Основные семейства органических соединений характеризуются своими функциональными группами. Рисунок \ (\ PageIndex {1} \) суммирует пять семейств, представленных в предыдущих главах, дает примеры соединений, которые содержат каждую функциональную группу, и перечисляет суффикс или префикс, используемый в систематической номенклатуре соединений, содержащих каждую функциональную группу.
Основные семейства органических соединений характеризуются своими функциональными группами. Рисунок \ (\ PageIndex {1} \) суммирует пять семейств, представленных в предыдущих главах, дает примеры соединений, которые содержат каждую функциональную группу, и перечисляет суффикс или префикс, используемый в систематической номенклатуре соединений, содержащих каждую функциональную группу.
Рисунок \ (\ PageIndex {1} \): основные классы органических соединений
Первое семейство, указанное на рисунке \ (\ PageIndex {1} \), — это углеводороды.К ним относятся алканы с общей молекулярной формулой C n H 2n +2 , где n — целое число; алкены, представленные C n H 2n ; алкины, представленные C n H 2n − 2 ; и арены. Галогензамещенные алканы, алкены и арены образуют второе основное семейство органических соединений, которое включает алкилгалогениды и арилгалогениды. Кислородсодержащие органические соединения, третье семейство, можно разделить на два основных типа: те, которые содержат по крайней мере одну связь C – O, которые включают спирты, фенолы (производные бензола) и простые эфиры, и те, которые содержат карбонильную группу. (C = O), которые включают альдегиды, кетоны и карбоновые кислоты.Производные карбоновых кислот, четвертое перечисленное семейство, представляют собой соединения, в которых ОН функциональной группы –CO 2 H заменен либо на алкоксигруппу (–OR) с образованием сложного эфира, либо на амидо (–NRR ‘, где R и R ‘могут быть H и / или алкильными группами), образуя амид. Пятое семейство азотсодержащих органических соединений включает амины; нитрилы, которые имеют связь C≡N; и нитросоединения, содержащие группу –NO 2 .
Систематическая номенклатура органических соединений указывает положения заместителей с использованием наименьших цифр, возможных для идентификации их положений в углеродной цепи исходного соединения. Если два соединения имеют одинаковое систематическое название, то это одно и то же соединение. Хотя систематические названия предпочтительны, поскольку они однозначны, многие органические соединения известны под своими общими названиями, а не систематическими названиями. В общей номенклатуре используется префиксная форма — для соединения, которое не содержит атомов углерода, кроме атомов в функциональной группе, и ацет — для тех, которые имеют один дополнительный атом углерода [два в случае ацетона, (CH 3 ) 2 C = O]. Таким образом, метаналь и этаналь, соответственно, являются систематическими названиями формальдегида и ацетальдегида.
Если два соединения имеют одинаковое систематическое название, то это одно и то же соединение. Хотя систематические названия предпочтительны, поскольку они однозначны, многие органические соединения известны под своими общими названиями, а не систематическими названиями. В общей номенклатуре используется префиксная форма — для соединения, которое не содержит атомов углерода, кроме атомов в функциональной группе, и ацет — для тех, которые имеют один дополнительный атом углерода [два в случае ацетона, (CH 3 ) 2 C = O]. Таким образом, метаналь и этаналь, соответственно, являются систематическими названиями формальдегида и ацетальдегида.
Напомним, что в систематической номенклатуре ароматических соединений положения групп, присоединенных к ароматическому кольцу, обозначены числами, начиная с 1 и продолжаясь по кольцу в направлении, дающем наименьшие возможные числа. Например, положение первой группы CH 3 в диметилбензоле обозначено цифрой 1, но вторая группа CH 3 , которая может быть помещена в любое из трех положений, дает 1,2-диметилбензол, 1 , 3-диметилбензол или 1,4-диметилбензол (Рисунок \ (\ PageIndex {2} \)).Напротив, в общей номенклатуре префиксы орто-, мета- и пара- используются для описания относительного положения групп, присоединенных к ароматическому кольцу. Если группы CH 3 в диметилбензоле, обычное название которого — ксилол, соседствуют друг с другом, это соединение обычно называют орто-ксилолом, сокращенно о-ксилолом. Если они расположены напротив друг друга на кольце, соединение обычно называют пара-ксилолом или п-ксилолом. Когда расположение является промежуточным между орто- и пара-соединениями, название — мета-ксилол или м-ксилол.
Рисунок \ (\ PageIndex {2} \): Общая номенклатура для замен ароматических колец
Мы начинаем обсуждение структуры и реакционной способности органических соединений с изучения структурных вариаций простых насыщенных углеводородов, известных как алканы. Эти соединения служат каркасом, к которому наиболее часто присоединяются различные функциональные группы.
Эти соединения служат каркасом, к которому наиболее часто присоединяются различные функциональные группы.
Сводка
Функциональные группы определяют химическую реакционную способность органической молекулы.Функциональные группы — это структурные единицы, которые определяют химическую реакционную способность молекулы при заданном наборе условий. Органические соединения подразделяются на несколько основных категорий в зависимости от содержащихся в них функциональных групп. В систематических названиях органических соединений числа указывают положения функциональных групп в основной углеводородной структуре. Многие органические соединения также имеют общие названия, в которых используется префиксная форма — для соединения, которое не содержит углеродов, кроме атомов углерода в функциональной группе и ацетате, — для тех, которые имеют один дополнительный атом углерода.
Концептуальные проблемы
- Могут ли два вещества иметь одно и то же систематическое название и быть разными соединениями?
- Считается ли кратная связь углерод-углерод функциональной группой?
классов органических соединений | Безграничная химия
Органические молекулы и функциональные группы
Функциональные группы — это группы молекул, присоединенные к органическим молекулам и придающие им определенные свойства или функции.
Цели обучения
Опишите важность функциональных групп для органических молекул
Основные выводы
Ключевые моменты
- Функциональные группы — это совокупности атомов, которые прикрепляют углеродный скелет органической молекулы и придают определенные свойства.
- Каждый тип органической молекулы имеет свой особый тип функциональной группы.
- Функциональные группы в биологических молекулах играют важную роль в образовании таких молекул, как ДНК, белки, углеводы и липиды.
- Функциональные группы включают: гидроксил, метил, карбонил, карбоксил, амино, фосфат и сульфгидрил.

Ключевые термины
- гидрофобный : не имеет сродства к воде; не может впитаться или намокать водой
- гидрофильный : имеющий сродство к воде; может впитывать или намокать водой
Расположение функциональных групп
Функциональные группы — это группы атомов, которые встречаются в органических молекулах и придают этим молекулам определенные химические свойства.Когда показаны функциональные группы, органическая молекула иногда обозначается как «R». Функциональные группы находятся вдоль «углеродного скелета» макромолекул, который образован цепями и / или кольцами атомов углерода с периодическим замещением таким элементом, как азот или кислород. Молекулы с другими элементами в углеродной основе являются замещенными углеводородами. Каждый из четырех типов макромолекул — белков, липидов, углеводов и нуклеиновых кислот — имеет свой собственный характерный набор функциональных групп, который в значительной степени способствует его различным химическим свойствам и функциям в живых организмах.
Свойства функциональных групп
Функциональная группа может участвовать в определенных химических реакциях. Некоторые из важных функциональных групп в биологических молекулах включают: гидроксильные, метильные, карбонильные, карбоксильные, амино, фосфатные и сульфгидрильные группы. Эти группы играют важную роль в образовании таких молекул, как ДНК, белки, углеводы и липиды.
Классификация функциональных групп
Функциональные группы обычно классифицируются как гидрофобные или гидрофильные в зависимости от их заряда или полярности.Примером гидрофобной группы является неполярная молекула метана. Среди гидрофильных функциональных групп есть карбоксильная группа, содержащаяся в аминокислотах, некоторых боковых цепях аминокислот и головках жирных кислот, которые образуют триглицериды и фосфолипиды. Эта карбоксильная группа ионизируется, высвобождая ионы водорода (H + ) из группы COOH, в результате чего образуется отрицательно заряженная группа COO —; это способствует гидрофильности любой молекулы, на которой он находится. Другие функциональные группы, такие как карбонильная группа, имеют частично отрицательно заряженный атом кислорода, который может образовывать водородные связи с молекулами воды, снова делая молекулу более гидрофильной.
Другие функциональные группы, такие как карбонильная группа, имеют частично отрицательно заряженный атом кислорода, который может образовывать водородные связи с молекулами воды, снова делая молекулу более гидрофильной.
Примеры функциональных групп : Показанные здесь функциональные группы встречаются во многих различных биологических молекулах, где «R» — это органическая молекула.
Водородные связи между функциональными группами
Водородные связи между функциональными группами (внутри одной и той же молекулы или между разными молекулами) важны для функции многих макромолекул и помогают им правильно складываться и сохранять соответствующую форму, необходимую для правильного функционирования. Водородные связи также участвуют в различных процессах распознавания, таких как спаривание комплементарных оснований ДНК и связывание фермента с его субстратом.
Водородные связи в ДНК : Водородные связи соединяют две цепи ДНК вместе, создавая структуру двойной спирали.
Химическая основа жизни
Углерод — самый важный элемент для живых существ, потому что он может образовывать множество различных видов связей и образовывать важные соединения.
Цели обучения
Объясните свойства углерода, которые позволяют ему служить строительным блоком для биомолекул
Основные выводы
Ключевые моменты
- Все живые существа содержат углерод в той или иной форме.
- Углерод является основным компонентом макромолекул, включая белки, липиды, нуклеиновые кислоты и углеводы. Молекулярная структура
- углерода позволяет ему связываться множеством различных способов и со многими различными элементами.
- Углеродный цикл показывает, как углерод перемещается через живые и неживые части окружающей среды.
Ключевые термины
- правило октетов : Правило, согласно которому атомы теряют, приобретают или делятся электронами, чтобы иметь полную валентную оболочку из 8 электронов (есть некоторые исключения).

- углеродный цикл : физический цикл углерода в биосфере, геосфере, гидросфере и атмосфере Земли; включает такие процессы, как фотосинтез, разложение, дыхание и карбонизация
- макромолекула : очень большая молекула, особенно используемая в отношении крупных биологических полимеров (например, нуклеиновых кислот и белков)
Углерод — четвертый по распространенности элемент во Вселенной и строительный блок жизни на Земле.На Земле углерод циркулирует по суше, океану и атмосфере, создавая так называемый углеродный цикл. Этот глобальный углеродный цикл можно разделить на два отдельных цикла: геологические углеродные циклы протекают в течение миллионов лет, а биологический или физический углеродный цикл — от дней до тысяч лет. В неживой окружающей среде углерод может существовать в виде двуокиси углерода (CO 2 ), карбонатных пород, угля, нефти, природного газа и мертвого органического вещества.Растения и водоросли превращают углекислый газ в органическое вещество в процессе фотосинтеза, энергии света.
Углерод присутствует во всем живом. : Все живые существа содержат углерод в той или иной форме, и углерод является основным компонентом макромолекул, включая белки, липиды, нуклеиновые кислоты и углеводы. В этом листе углерод присутствует во многих формах, в том числе в целлюлозе, формирующей структуру листа, и в хлорофилле, пигменте, который делает лист зеленым.
Углерод важен для жизни
В процессе метаболизма пищи и дыхания животное потребляет глюкозу (C 6 H 12 O 6 ), которая соединяется с кислородом (O 2 ) с образованием диоксида углерода (CO 2 ), воды. (H 2 O) и энергия, которая выделяется в виде тепла.Животное не нуждается в углекислом газе и выбрасывает его в атмосферу. С другой стороны, растение использует реакцию, противоположную реакции животного, посредством фотосинтеза. Он потребляет углекислый газ, воду и энергию солнечного света для производства собственной глюкозы и газообразного кислорода. Глюкоза используется для получения химической энергии, которую растение метаболизирует аналогично животному. Затем растение выбрасывает оставшийся кислород в окружающую среду.
Он потребляет углекислый газ, воду и энергию солнечного света для производства собственной глюкозы и газообразного кислорода. Глюкоза используется для получения химической энергии, которую растение метаболизирует аналогично животному. Затем растение выбрасывает оставшийся кислород в окружающую среду.
Клетки состоят из множества сложных молекул, называемых макромолекулами, которые включают белки, нуклеиновые кислоты (РНК и ДНК), углеводы и липиды.Макромолекулы — это подмножество органических молекул (любой углеродсодержащей жидкости, твердого вещества или газа), которые особенно важны для жизни. Основным компонентом всех этих макромолекул является углерод. Атом углерода обладает уникальными свойствами, которые позволяют ему образовывать ковалентные связи с четырьмя различными атомами, что делает этот универсальный элемент идеальным для использования в качестве основного структурного компонента или «скелета» макромолекул.
Структура углерода
Отдельные атомы углерода имеют неполную внешнюю электронную оболочку.С атомным номером 6 (шесть электронов и шесть протонов) первые два электрона заполняют внутреннюю оболочку, оставляя четыре во второй оболочке. Следовательно, атомы углерода могут образовывать четыре ковалентные связи с другими атомами, чтобы удовлетворить правилу октетов. Например, молекула метана имеет химическую формулу CH 4 . Каждый из четырех его атомов водорода образует одну ковалентную связь с атомом углерода, разделяя пару электронов. Это приводит к заполнению самой внешней оболочки.
Структура метана : Метан имеет тетраэдрическую геометрию, в которой каждый из четырех атомов водорода расположен на расстоянии 109.5 ° друг от друга.
Типы органических соединений в химии и биологии
Органические соединения называются «органическими», потому что они связаны с живыми организмами. Эти молекулы составляют основу жизни и очень подробно изучаются в химических дисциплинах органической химии и биохимии.
Существует четыре основных типа или класса органических соединений, обнаруженных во всем живом: углеводы, липиды, белки и нуклеиновые кислоты. Кроме того, существуют и другие органические соединения, которые могут быть обнаружены в некоторых организмах или продуцированы ими.Все органические соединения содержат углерод, обычно связанный с водородом (также могут присутствовать другие элементы). Давайте подробнее рассмотрим ключевые типы органических соединений и рассмотрим примеры этих важных молекул.
Углеводы — органические соединения
Масанянка / Getty Images
Углеводы — это органические соединения, состоящие из элементов углерода, водорода и кислорода. Отношение атомов водорода к атомам кислорода в молекулах углеводов составляет 2: 1. Организмы используют углеводы в качестве источников энергии, структурных единиц и для других целей.Углеводы — это самый большой класс органических соединений, содержащихся в организмах.
Углеводы классифицируются по количеству содержащихся в них субъединиц. Простые углеводы называются сахарами. Сахар, состоящий из одной единицы, является моносахаридом. Если две единицы соединить вместе, образуется дисахарид. Более сложные структуры образуются, когда эти более мелкие единицы соединяются друг с другом с образованием полимеров. Примеры этих более крупных углеводных соединений включают крахмал и хитин.
Примеры углеводов:
- Глюкоза
- Фруктоза
- Сахароза (столовый сахар)
- Хитин
- Целлюлоза
- Глюкоза
Липиды — органические соединения
дулезидар / Getty Images
Липиды состоят из атомов углерода, водорода и кислорода.Липиды имеют более высокое отношение водорода к кислороду, чем углеводы. Три основные группы липидов — это триглицериды (жиры, масла, воски), стероиды и фосфолипиды. Триглицериды состоят из трех жирных кислот, соединенных с молекулой глицерина. Каждый стероид имеет основу из четырех углеродных колец, соединенных друг с другом. Фосфолипиды напоминают триглицериды, за исключением того, что вместо одной из цепей жирных кислот есть фосфатная группа.
Каждый стероид имеет основу из четырех углеродных колец, соединенных друг с другом. Фосфолипиды напоминают триглицериды, за исключением того, что вместо одной из цепей жирных кислот есть фосфатная группа.
Липиды используются для хранения энергии, построения структур и в качестве сигнальных молекул, помогающих клеткам общаться друг с другом.
Примеры липидов:
- Холестерин
- Парафин
- Оливковое масло
- Маргарин
- Кортизол
- Эстроген
- Двухслойный фосфолипид, образующий клеточную мембрану
Белки — органические соединения
Максимилиан Сток Лтд. / Getty Images
Белки состоят из цепочек аминокислот, называемых пептидами. Белок может быть получен из одной полипептидной цепи или может иметь более сложную структуру, в которой полипептидные субъединицы упаковываются вместе, образуя единицу.Белки состоят из атомов водорода, кислорода, углерода и азота. Некоторые белки содержат другие атомы, такие как сера, фосфор, железо, медь или магний.
Белки выполняют в клетках множество функций. Они используются для создания структуры, катализатора биохимических реакций, иммунного ответа, упаковки и транспортировки материалов, а также для воспроизведения генетического материала.
Примеры белков:
- Ферменты
- Коллаген
- Кератин
- Альбумин
- Гемоглобин
- Миоглобин
- Фибрин
Нуклеиновые кислоты — органические соединения
Stocktrek Images / Getty Images
Нуклеиновая кислота — это тип биологического полимера, состоящего из цепочек нуклеотидных мономеров.Нуклеотиды, в свою очередь, состоят из азотистого основания, молекулы сахара и фосфатной группы. Клетки используют нуклеиновые кислоты для кодирования генетической информации организма.
Примеры нуклеиновых кислот:
- ДНК (дезоксирибонуклеиновая кислота)
- РНК (рибонуклеиновая кислота)
Другие виды органических соединений
Ирина Имаго / Getty Images
В дополнение к четырем основным видам органических молекул, обнаруженных в организмах, существует множество других органических соединений. К ним относятся растворители, лекарства, витамины, красители, искусственные ароматизаторы, токсины и молекулы, используемые в качестве предшественников биохимических соединений. Вот некоторые примеры:
К ним относятся растворители, лекарства, витамины, красители, искусственные ароматизаторы, токсины и молекулы, используемые в качестве предшественников биохимических соединений. Вот некоторые примеры:
- Ацетальдегид
- Ацетаминофен
- Ацетон
- Ацетилен
- Бензальдегид
- Биотин
- Бромфеноловый синий
- Кофеин
- Фулл
- Тетрахлорид углерода
- Тетрахлорид углерода
Органические соединения
Химические соединения живых существ известны как органических соединений из-за их связи с организмами и потому, что они являются углеродсодержащими соединениями.Органические соединения, которые представляют собой соединения, связанные с жизненными процессами, являются предметом органической химии. Среди многочисленных типов органических соединений во всем живом есть четыре основные категории: углеводы, липиды, белки и нуклеиновые кислоты.Углеводы
Почти все организмы используют углеводов в качестве источников энергии. Кроме того, некоторые углеводы служат конструкционными материалами. Углеводы — это молекулы, состоящие из углерода, водорода и кислорода; отношение атомов водорода к атомам кислорода и углерода составляет 2: 1.
Простые углеводы, обычно называемые сахарами, могут быть моносахаридами, , если они состоят из одиночных молекул, или дисахаридами, , если они состоят из двух молекул. Наиболее важным моносахаридом является глюкоза, углевод с молекулярной формулой C 6 H 12 O 6 . Глюкоза — это основная форма топлива для живых существ. В многоклеточных организмах он растворим и транспортируется жидкостями организма ко всем клеткам, где метаболизируется, чтобы высвободить свою энергию.Глюкоза является исходным материалом для клеточного дыхания и основным продуктом фотосинтеза (см. Главы 5 и 6).
Главы 5 и 6).
Три важных дисахарида также содержатся в живых организмах: мальтоза, сахароза и лактоза. Мальтоза представляет собой комбинацию двух ковалентно связанных единиц глюкозы. Сахароза столового сахара образуется путем связывания глюкозы с другим моносахаридом, называемым фруктозой. (Рисунок 2-2 показывает, что при синтезе сахарозы образуется молекула воды. Поэтому процесс называется реакцией дегидратации . Обратный процесс — гидролиз, процесс, в котором молекула расщепляется и добавляется вода.) Лактоза состоит из единиц глюкозы и галактозы.
Рисунок 2-2 Молекулы глюкозы и фруктозы объединяются, образуя дисахарид сахарозу.
Сложные углеводы известны как полисахаридов. Полисахариды образуются путем связывания бесчисленных моносахаридов. Среди наиболее важных полисахаридов — крахмал, который состоит из сотен или тысяч единиц глюкозы, связанных друг с другом.Крахмал служит формой хранения углеводов. Большая часть населения мира удовлетворяет свои потребности в энергии с помощью крахмала в виде риса, пшеницы, кукурузы и картофеля.
Два других важных полисахарида — это гликоген и целлюлоза. Гликоген также состоит из тысяч единиц глюкозы, но эти единицы связаны другим образом, чем в крахмале. Гликоген — это форма, в которой глюкоза хранится в печени человека. Целлюлоза используется в основном как структурный углевод.Он также состоит из единиц глюкозы, но единицы не могут высвобождаться одна из другой, за исключением нескольких видов организмов. Древесина состоит в основном из целлюлозы, как и стенки растительных клеток. Хлопчатобумажная ткань и бумага — это товарные целлюлозные продукты.
Липиды
Липиды представляют собой органические молекулы, состоящие из атомов углерода, водорода и кислорода. Отношение атомов водорода к атомам кислорода в липидах намного выше, чем в углеводах. Липиды включают стероиды (материал, из которого состоят многие гормоны), воски и жиров.
Молекулы жира состоят из молекулы глицерина и одной, двух или трех молекул жирных кислот (см. Рис. 2-3). Молекула глицерина содержит три гидроксильные (–ОН) группы. Жирная кислота представляет собой длинную цепочку атомов углерода (от 4 до 24) с карбоксильной (–COOH) группой на одном конце. Все жирные кислоты в жире могут быть одинаковыми или разными. Они связаны с молекулой глицерина в процессе удаления воды.
Некоторые жирные кислоты имеют в своих молекулах одну или несколько двойных связей.Жиры, содержащие эти молекулы, представляют собой ненасыщенных жиров. Другие жирные кислоты не имеют двойных связей. Жиры, в состав которых входят эти жирные кислоты, представляют собой насыщенных жиров. В большинстве случаев, связанных со здоровьем человека, потребление ненасыщенных жиров предпочтительнее насыщенных жиров.
Жиры, хранящиеся в клетках, обычно образуют прозрачные масляные капли, называемые глобулами , потому что жиры не растворяются в воде. Растения часто хранят жиры в своих семенах, а животные — в больших прозрачных шариках в клетках жировой ткани.Жиры в жировой ткани содержат много концентрированной энергии. Следовательно, они служат резервным источником энергии для организма. Фермент липаза расщепляет жиры на жирные кислоты и глицерин в пищеварительной системе человека.
Рис. 2-3 Молекула жира создается путем объединения молекулы глицерина с тремя молекулами жирных кислот. (Две насыщенные жирные кислоты и одна ненасыщенная жирная кислота показаны для сравнения.) Сконструированная молекула находится внизу.
Белки
Белки, среди самых сложных из всех органических соединений, состоят из аминокислот, (см. Рис. 2-4), которые содержат атомы углерода, водорода, кислорода и азота.Некоторые аминокислоты также содержат атомы серы, фосфора или других микроэлементов, таких как железо или медь.
Рисунок 2-4 Структура и химический состав аминокислот.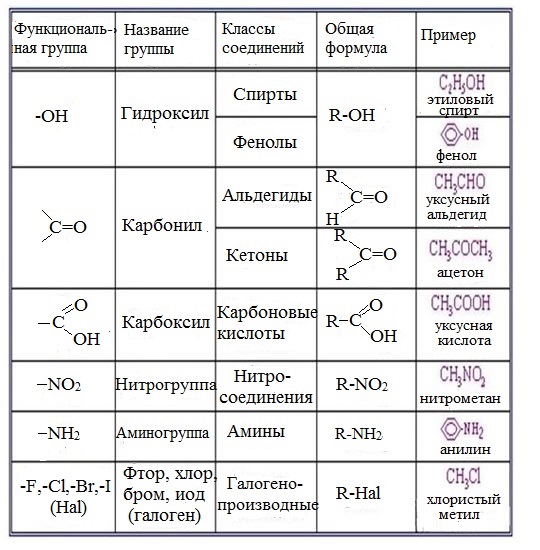 Когда две аминокислоты соединяются в дипептид, –OH одной аминокислоты удаляется, а –H второй удаляется. Итак, вода удалена. Дипептидная связь (справа) образует соединение аминокислот вместе.
Когда две аминокислоты соединяются в дипептид, –OH одной аминокислоты удаляется, а –H второй удаляется. Итак, вода удалена. Дипептидная связь (справа) образует соединение аминокислот вместе.
Многие белки огромны и чрезвычайно сложны. Однако все белки состоят из длинных цепочек относительно простых аминокислот.Есть 20 видов аминокислот. Каждая аминокислота (см. Левую иллюстрацию на рис. 2-4) имеет амино (–NH 2 ) группу, карбоксильную (–COOH) группу и группу атомов, называемую –R группой (где R обозначает радикал ). Аминокислоты различаются в зависимости от природы группы –R, как показано на средней иллюстрации рисунка 2-4. Примерами аминокислот являются аланин, валин, глутаминовая кислота, триптофан, тирозин и гистидин.
Удаление молекул воды связывает аминокислоты с образованием белка.Процесс называется дегидратационным синтезом , и побочным продуктом синтеза является вода. Связи между аминокислотами составляют пептидных связей, и небольшие белки часто называют пептидами.
Все живое зависит от белков. Белки — это основные молекулы, из которых построены живые существа. Некоторые белки растворены или взвешены в водянистом веществе клеток, а другие включены в различные структуры клеток.Белки также являются поддерживающими и укрепляющими материалами в тканях вне клеток. Кости, хрящи, сухожилия и связки состоят из белков.
Одна из важнейших функций белков — это фермент. Ферменты катализируют химические реакции, происходящие в клетках. Они не расходуются в реакции; скорее, они остаются доступными для катализа последующих реакций.
Каждый вид производит белки, уникальные для этого вида. Информация для синтеза уникальных белков находится в ядре клетки.Так называемый генетический код определяет аминокислотную последовательность в белках. Следовательно, генетический код регулирует химию, происходящую внутри клетки. Белки также могут служить резервным источником энергии для клетки. Когда аминогруппа удаляется из аминокислоты, полученное соединение богато энергией.
Когда аминогруппа удаляется из аминокислоты, полученное соединение богато энергией.
Нуклеиновые кислоты
Как и белки, нуклеиновых кислот — очень большие молекулы. Нуклеиновые кислоты состоят из более мелких единиц, называемых нуклеотидами. Каждый нуклеотид содержит молекулу углевода (сахар), фосфатную группу и азотсодержащую молекулу, которая в силу своих свойств представляет собой азотистое основание .
У живых организмов есть две важные нуклеиновые кислоты. Один тип — это дезоксирибонуклеиновая кислота, или ДНК. Другой — это рибонуклеиновая кислота, или РНК. ДНК находится в основном в ядре клетки, в то время как РНК обнаруживается как в ядре, так и в цитоплазме , — полужидкое вещество, составляющее объем клетки (см. Главу 3).
ДНК и РНКотличаются друг от друга по своим компонентам. ДНК содержит углевод дезоксирибозу, а РНК — рибозу. Кроме того, ДНК содержит тимин, а РНК — урацил. Структура ДНК и ее значение в жизни клеток рассматриваются в главе 10.
органических соединений | BioNinja
Понимание:
• Атомы углерода могут образовывать четыре ковалентные связи, позволяя существовать разнообразным стабильным соединениям
Органические соединения
Органическое соединение — это соединение, которое содержит углерода и содержится в живых организмах
- Исключения включают карбиды (например, карбиды).грамм. CaC 2 ), карбонаты (CO 3 2–), оксиды углерода (CO, CO 2 ) и цианиды (CN –)
Углерод
Углерод составляет основу органическая жизнь благодаря своей способности образовывать большие и сложные молекулы посредством ковалентных связей
Атомы углерода могут образовывать четыре ковалентных связи, причем связи между атомами углерода особенно стабильны (катенация)
- Эти свойства позволяют углероду образовывать самые разные органических соединений, которые являются химически стабильными
Схема атома углерода
Понимание:
• Жизнь основана на углеродных соединениях, включая углеводы, липиды, белки и нуклеиновые кислоты
Основные классы соединений углерода
Существуют четыре основные группы органических соединений, которые во многом определяют структуру и функции клетки
Углеводы
- Наиболее распространенные органические соединения, встречающиеся в природе, состоит в основном из атомов C, H и O в общем соотношении — (CH 2 O) n
- Принципиально функционирует как источник энергии (и как вариант кратковременного накопления энергии)
- Также важно как молекула узнавания (например,грамм.
 гликопротеины) и как структурный компонент (часть ДНК / РНК)
гликопротеины) и как структурный компонент (часть ДНК / РНК)
Липиды
- Неполярные гидрофобные молекулы, которые могут иметь различные формы (простые, сложные или производные)
- Липиды служат в качестве основного компонента клеточных мембран (фосфолипиды и холестерин)
- Они могут использоваться как молекулы длительного хранения энергии (жиры и масла)
- Также могут действовать как сигнальные молекулы (стероиды)
Нуклеиновые кислоты
- Генетический материал всех клеток и определяет унаследованные особенности организма
- ДНК функционирует как главный код для сборки белка, в то время как РНК играет активную роль в производстве белков
Белки
- Составляет более 50% сухой массы клеток; состоят из атомов C, H, O и N (некоторые могут включать S)
- Основные регуляторные молекулы, участвующие в катализе (все ферменты являются белками)
- Могут также функционировать как структурные молекулы или играть роль в передаче сигналов в клетках (пути трансдукции)
Основные классы органических соединений в клетках
Алгоритм определения функциональных групп в органических молекулах | Journal of Cheminformatics
Идентификация и выделение функциональных групп
Большинство ФГ содержат гетероатомы.Поэтому наш подход основан на обработке гетероатомов и их окружения с добавлением некоторых других функций, таких как множественные углерод-углеродные связи.
Алгоритм представлен ниже:
- 1.
обозначает все гетероатомы в молекуле, включая галогены
- 2.
отметьте также следующие атомы углерода:
атома, соединенных неароматической двойной или тройной связью с любым гетероатомом
атома в неароматических двойных или тройных связях углерод – углерод
ацетальных углеродов, т.
 е.е. атомы углерода sp3, связанные с двумя или более атомами кислорода, азота или серы; эти атомы O, N или S должны иметь только одинарные связи
е.е. атомы углерода sp3, связанные с двумя или более атомами кислорода, азота или серы; эти атомы O, N или S должны иметь только одинарные связивсех атомов в оксирановых, азиридиновых и тирановых кольцах (такие кольца традиционно считаются функциональными группами из-за их высокой реакционной способности).
- 3.
объединить все связанные отмеченные атомы в один FG
- 4.
извлекают FG также с присоединенными немаркированными атомами углерода, эти атомы углерода не являются частью самого FG, но образуют его окружение.
Алгоритм, описанный выше, повторяется только через неароматические атомы.Ароматические гетероатомы собираются как отдельные атомы, а не как часть более крупной системы. Они распространяются на более крупный FG только тогда, когда имеется связанная алифатическая функциональная группа (например, ацильная группа, связанная с азотом пиррола). Гетероатомы в гетероциклах традиционно не считаются «классическими» ФГ сами по себе, а просто являются частью всего гетероциклического кольца. Обоснование такого обращения — огромное разнообразие гетероциклических систем. Например, в нашем предыдущем исследовании [12] было перечислено около 600 000 различных гетероциклов, состоящих из 1-3 конденсированных 5- и 6-членных колец.
После маркировки всех атомов, которые являются частью FG, как описано выше, идентифицированные FG извлекаются вместе с их окружением, т.е. связанные атомы углерода, когда также сохраняется тип углерода (алифатический или ароматический).
Мы не утверждаем, что этот алгоритм дает окончательное определение FG. Каждый медицинский химик, вероятно, имеет несколько иное представление о том, что такое ФГ. В частности, определенное обсуждение может вызвать определение активированных атомов углерода sp3.В данном алгоритме мы ограничили наше определение только классическими ацетальными, тиоацетальными или аминальными центрами (т.е. sp3-атомами углерода, имеющими по крайней мере 2 атома кислорода, серы или азота в качестве соседей) и не рассматривали другие подобные системы, то есть альфа-замещенные карбонилы или атомы углерода, связанные с S = O или аналогичные связи. На этапе разработки программы были протестированы различные такие варианты, и это «строгое» определение дало наиболее удовлетворительные результаты. Расширение FG также на альфа-замещенные карбонилы (т.е.е. гетероатом или галоген в альфа-положении по отношению к карбонилу) и подобные системы более чем в три раза превышают количество идентифицированных FG, генерируя множество больших и редких FG. Поскольку нас больше всего интересовало сравнение различных наборов молекулярных данных, а не оценка реакционной способности, мы применили это строгое определение ацетальных углеродов. Для оценки возможной реакционной способности молекул доступны различные фильтры подструктур, например, уже упомянутые PAINS [9] или правила Эли Лилли [10].
Каждый медицинский химик, вероятно, имеет несколько иное представление о том, что такое ФГ. В частности, определенное обсуждение может вызвать определение активированных атомов углерода sp3.В данном алгоритме мы ограничили наше определение только классическими ацетальными, тиоацетальными или аминальными центрами (т.е. sp3-атомами углерода, имеющими по крайней мере 2 атома кислорода, серы или азота в качестве соседей) и не рассматривали другие подобные системы, то есть альфа-замещенные карбонилы или атомы углерода, связанные с S = O или аналогичные связи. На этапе разработки программы были протестированы различные такие варианты, и это «строгое» определение дало наиболее удовлетворительные результаты. Расширение FG также на альфа-замещенные карбонилы (т.е.е. гетероатом или галоген в альфа-положении по отношению к карбонилу) и подобные системы более чем в три раза превышают количество идентифицированных FG, генерируя множество больших и редких FG. Поскольку нас больше всего интересовало сравнение различных наборов молекулярных данных, а не оценка реакционной способности, мы применили это строгое определение ацетальных углеродов. Для оценки возможной реакционной способности молекул доступны различные фильтры подструктур, например, уже упомянутые PAINS [9] или правила Эли Лилли [10].
Для лучшей иллюстрации алгоритма на рис.1.
Рис. 1Пример идентифицированных функциональных групп. Группы имеют цветовую маркировку в соответствии с их типом
Обобщение функциональных групп
FG, особенно с несколькими точками соединения, могут присутствовать во многих формах, различающихся вариациями в их окружении. Точки присоединения могут быть незамещенными (т.е. валентности заполнены атомами водорода) или связаны с алифатическими или ароматическими атомами углерода с большим количеством возможных комбинаций.Простая амидная группа с 3 точками соединения может образовывать 18 таких вариаций (две связи по азоту здесь считаются симметричными). В качестве другого примера список из 20 мочевин с различными средами, извлеченных из базы данных ChEMBL (см. Ниже), показан на рис. 2. Для более сложных групп количество возможных вариантов даже значительно больше.
В качестве другого примера список из 20 мочевин с различными средами, извлеченных из базы данных ChEMBL (см. Ниже), показан на рис. 2. Для более сложных групп количество возможных вариантов даже значительно больше.
Различные формы функциональности мочевины, различающиеся по типу окружающей среды. Число , число в углу указывает количество молекул в ChEMBL, в которых присутствует данная конкретная группа, и процентное соотношение
.Однако в большинстве случаев нет необходимости вдаваться в подробности.При изучении статистики частот ФГ в химических базах данных обычно интересует процентное содержание молекул, например, с функциональностью мочевины или сульфонамида, а не детали окружающей среды. Поэтому было бы желательно объединить FG на основе важного «центрального» фрагмента. Однако здесь нужно быть осторожным. В некоторых особых случаях, особенно для небольших ГП, различия в окружающей среде очень важны, например, чтобы различать спирты и фенолы или амины и анилины.Для рассмотрения этих различных сценариев была разработана схема обобщения, описанная ниже:
- 1.
окружения на атомах углерода удаляются, единственным исключением являются заместители на карбониле, которые сохраняются (чтобы различать альдегиды и кетоны)
- 2.
все свободные валентности гетероатомов заполнены «атомами R» (этот атом может представлять водород или углерод), за исключением:
атома водорода в группе –ОН
атомов водорода на простых аминах и тиолах (т.е.е. ФГ с одним центральным атомом азота или серы) не заменяются, это позволяет различать вторичные и третичные амины, а также тиолы и сульфиды.



 Объясните, как это может происходить.
Объясните, как это может происходить.


 гликопротеины) и как структурный компонент (часть ДНК / РНК)
гликопротеины) и как структурный компонент (часть ДНК / РНК) е.е. атомы углерода sp3, связанные с двумя или более атомами кислорода, азота или серы; эти атомы O, N или S должны иметь только одинарные связи
е.е. атомы углерода sp3, связанные с двумя или более атомами кислорода, азота или серы; эти атомы O, N или S должны иметь только одинарные связи