Биология — 10
Выделение листьями
- Какую функцию выполняет каждый орган выделительной системы в отдельности?
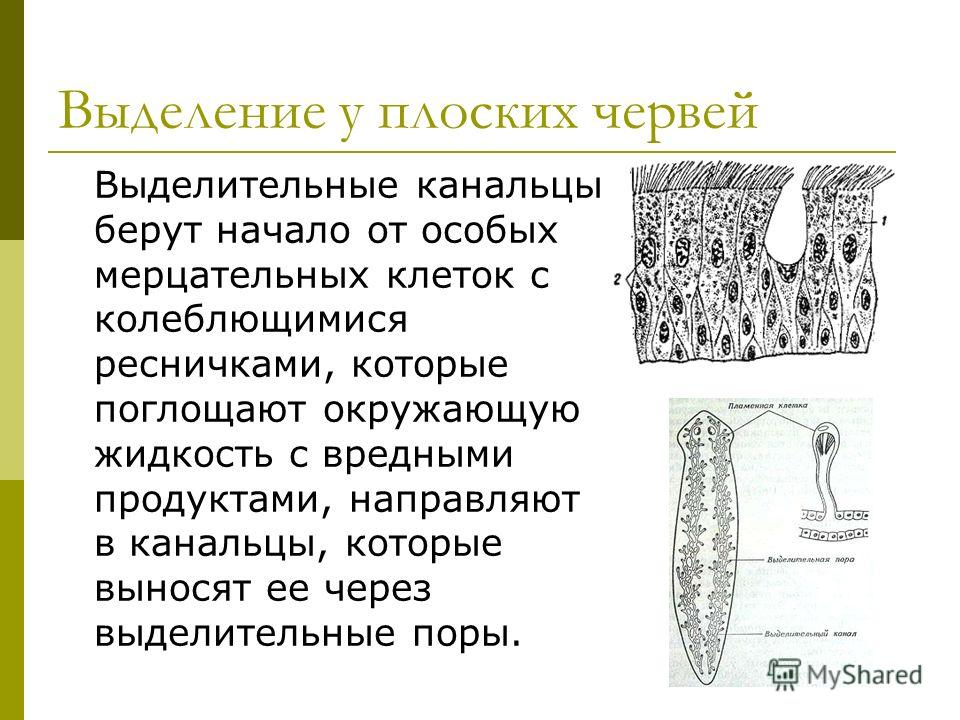
Удаление конечных продуктов обмена веществ из организма называется выделением. Живые организмы имеют разные органы выделения.
Выделение у растений. У растений нет специальных органов выделения. Большинство растений удаляет газообразные продукты выделения через устьица. Вы знаете, что выделение паров воды через устьица называется транспирацией. У таких растений, как земляника и пшеница происходит гуттация — выделение капелек воды. Вместе с водой у этих растений удаляются соли и другие вещества.
Нектар и эфирные масла, синтезируемые растениями, также являются продуктами выделения. Некоторые вредные вещества накапливаются у растений в клеточном соке вакуолей, а удаляются вместе с листьями во время листопада.
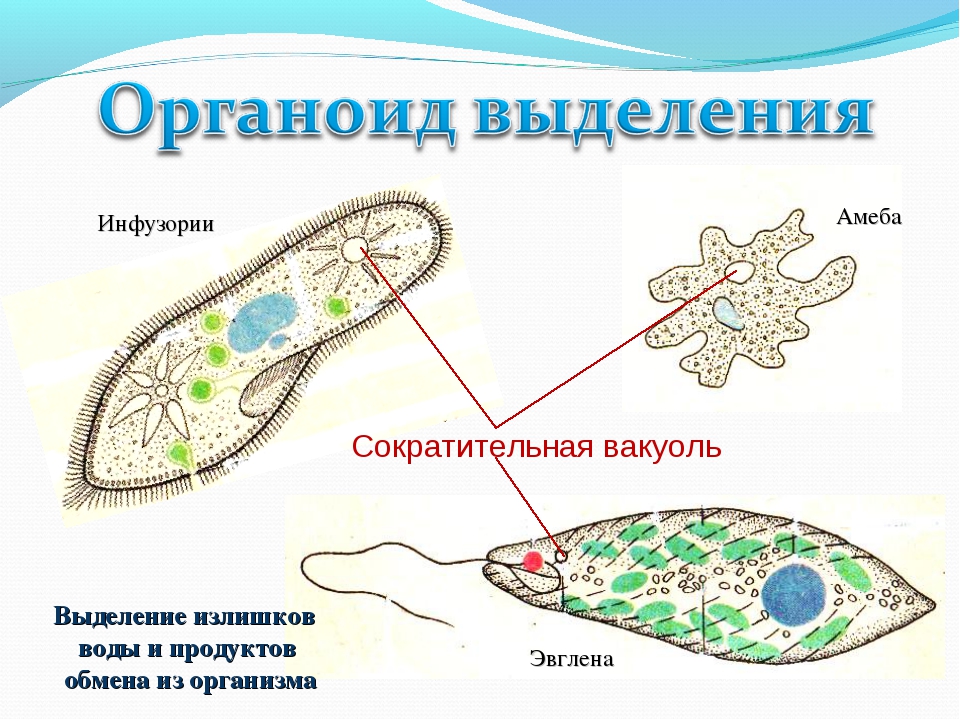
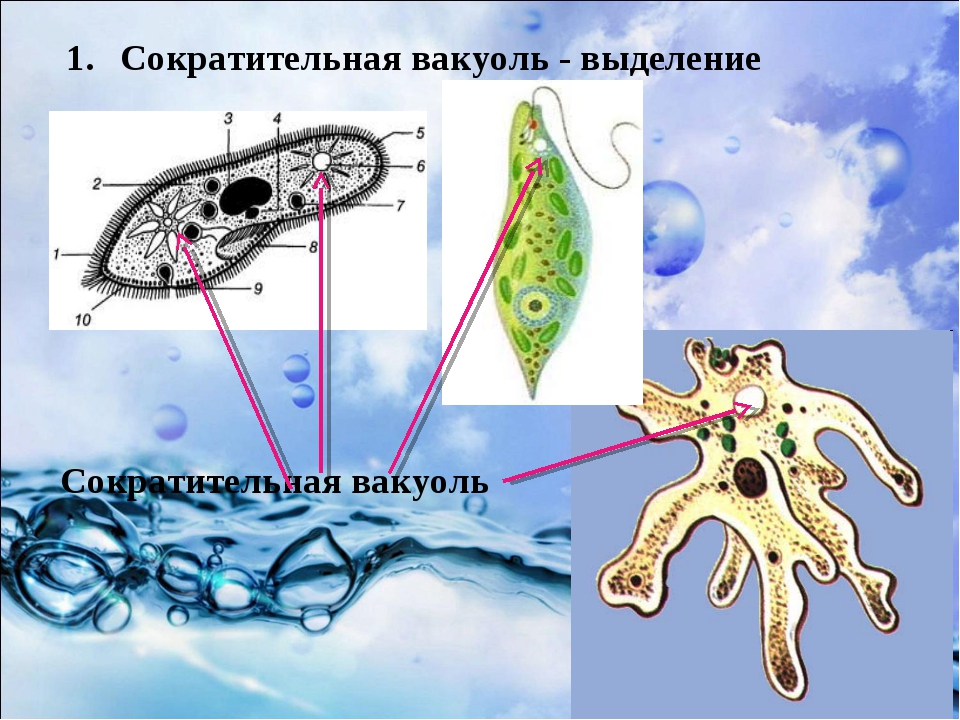
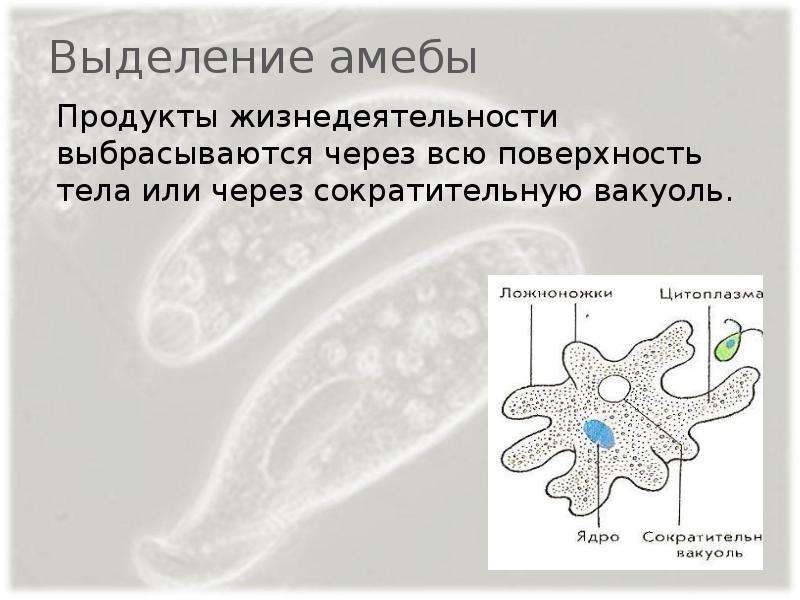
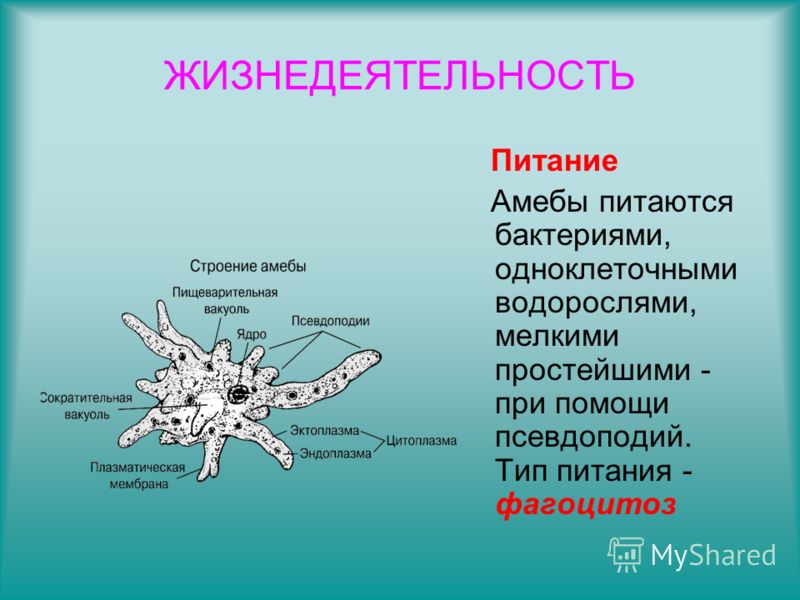
Выделение у простейших животных. Обитающие в пресных водах такие одноклеточные, как обыкновенная амеба, зеленая эвглена и инфузория-туфелька содержат в клетках сократительные вакуоли. Эти вакуоли собирают продукты выделения. Сократительные вакуоли периодически лопаются, и излишки воды с растворенными в ней вредными веществами удаляются наружу через мембрану клетки. Таким образом, выделение у простейших связано с регуляцией осмотического давления и диффузией.
Выделение у инфузории-туфельки
Многоклеточные беспозвоночные. Губки и кишечнополостные не имеют специальных органов выделения. Они удаляют продукты выделения через поверхность тела путем диффузии.
Инфекции, передаваемые половым путем Medical On Group Хабаровск
Инфекции , передаваемые половым путем (ИППП) — это группа заболеваний , которые передаются преимущественно во время полового контакта. ИППП чрезвычайно распространены во всем мире. Эксперты ВОЗ (Всемирной организации здравоохранения ) подсчитали: каждый шестой житель земного шара страдает какой-либо из болезней, передаваемых половым путем.
ИППП чрезвычайно распространены во всем мире. Эксперты ВОЗ (Всемирной организации здравоохранения ) подсчитали: каждый шестой житель земного шара страдает какой-либо из болезней, передаваемых половым путем.
Все ИППП вызываются болезнетворными микроорганизмами ( бактериями, вирусами, простейшими, паразитами) и передаются преимущественно при половом контакте и через кровь (в основном через шприцы или инструменты). Но некоторые инфекции, например, сифилис, герпетическая, цитомегаловирусная и папилломавирусные инфекции могут передаваться посредством контакта («кожа к коже») и через поцелуи.
Вирусные ИППП, такие как ВИЧ-инфекция, гепатит, генитальный герпес и аногенитальные бородавки, вызываемые вирусом папилломы человека, полностью не излечиваются, и лишь в части случаев течение заболевания и его проявления удается контролировать с помощью различных средств и методов. Излечиваемыми на сегодняшний день являются ИППП, вызываемые бактериями, простейшими и паразитами: сифилис, гонорея, хламидии, трихомониаз и некоторые другие. Однако, в любом случае раннее обращение к врачу и начало лечения не только послужит скорейшему выздоровлению, но и позволит снизить риск развития многочисленных осложнений.
Однако, в любом случае раннее обращение к врачу и начало лечения не только послужит скорейшему выздоровлению, но и позволит снизить риск развития многочисленных осложнений.
Для мужчин!
ИППП может заразиться абсолютно любой из мужчин, который занимается незащищенным и беспорядочным сексом. Заболеть очень просто, а лечиться — гораздо сложнее. Мужчины, помните, что причины заражения любой из инфекций, передаваемых половым путем, — халатное отношение к своему здоровью!
Коварство инфекций, которые передаются половым путем, заключается в том, что для заразившихся мужчин болезнь может протекать без ярко выраженных симптомов или совсем незаметно в течение определенного времени. Отсутствие мужского внимания на появление у себя некоторых признаков и симптомов начинающейся болезни, а также несвоевременное или неправильное лечение способствуют тому, что заболевание приобретает скрытый или хронический характер. Заболевание у мужчин со скрытым характером опасно тем, что болезнь достаточно быстро приобретает хроническую форму, которую значительно тяжелее лечить, а порой даже уже и невозможно.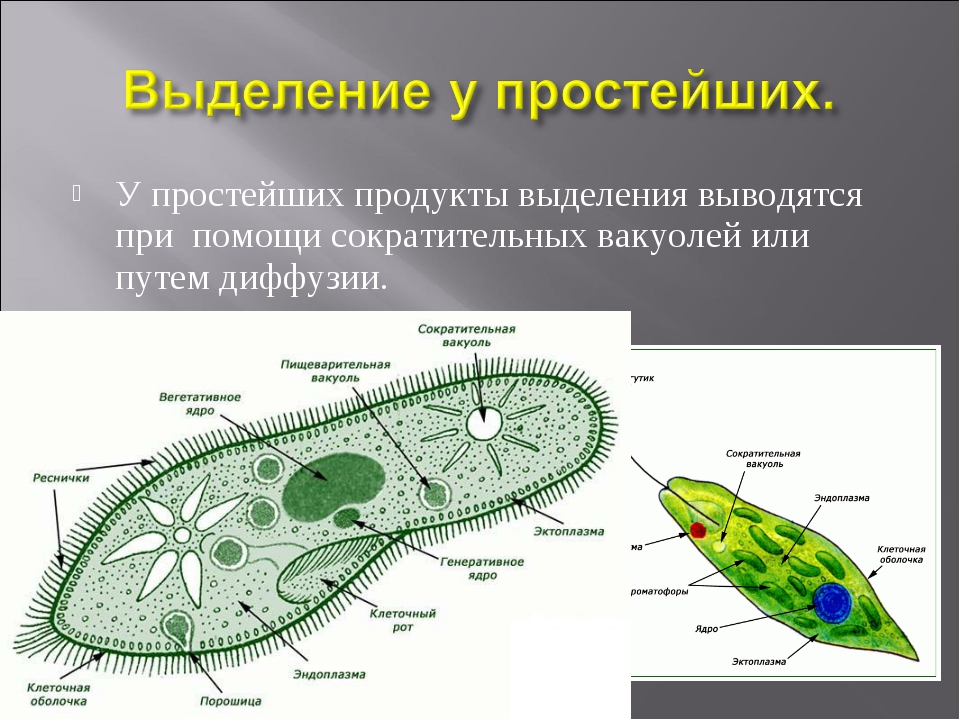 Хронический характер заболевания, вызванный ИППП, может способствовать тому, что у мужчин начинается воспаление мочеполовой системы, приводящее к ослаблению эрекции, преждевременной эякуляции, простатиту, аденоме, импотенции, бесплодию и другим серьезным заболеваниям мужской половой системы. Если в мужском организме болезнь приобрела хроническую форму, то проявляться симптомами ей уже необязательно, ведь симптомы — это показатель активной борьбы организма с проникновением инфекции.
Хронический характер заболевания, вызванный ИППП, может способствовать тому, что у мужчин начинается воспаление мочеполовой системы, приводящее к ослаблению эрекции, преждевременной эякуляции, простатиту, аденоме, импотенции, бесплодию и другим серьезным заболеваниям мужской половой системы. Если в мужском организме болезнь приобрела хроническую форму, то проявляться симптомами ей уже необязательно, ведь симптомы — это показатель активной борьбы организма с проникновением инфекции.
Какие симптомы должны Вас насторожить ?!
-
Необычные выделения белого или желтого цвета из полового члена, часто с неприятным запахом.
-
Сильный зуд, жжение, болезненное мочеиспускание, частые позывы на мочеиспускание.
-
Розовая или красная сыпь, покраснение, пятна на разных участках тела, например, на ногах (подошвы), на руках (ладони).
-
Резкие или тянущие болевые ощущения в районе низа живота и яичек.

-
Увеличение лимфатических узлов, особенно в паховой зоне.
-
Мелкие пузырьки, эрозии, бородавки, язвы в районе рта, губ и ануса.
-
Аномальное разрастание тканей в районе заднего прохода и непосредственно на половом члене.
При заражении ИППП у мужчин могут возникать и другие симптомы, которые встречаются гораздо реже, например, болезненные ощущения во время близости, нарушение семяизвержения или повышение температуры тела.
Чаще всего у мужчин встречаются следующие ИППП: хламидиоз, трихомониаз, микоплазмоз, уреаплазмоз, гарднереллез, гонорея и сифилис.
Для женщин!
Наиболее частные симптомы ИППП у женщин. Что должно насторожить ?
-
Неприятный запах из влагалища.
-
Увеличение количества выделений из половых путей, изменение их цвета и структуры.

-
Появление болевых ощущений при мочеиспускании.
-
Сильный зуд в области гениталий.
-
Неприятные ощущения во время секса.
-
Легкое недомогание, головная боль, вялость, сонливость.
-
Задержка менструации или кровотечение в середине цикла.
Проявления могут быть различными в зависимости от заболевания:
-
При генитальном герпесе на внешней поверхности половых органов возникают пузырьки, которые сильно чешутся, через несколько дней они лопаются и превращаются в язвочки. Заразиться таким герпесом легко, а вот вылечить эту болезнь сложно, можно лишь уменьшить количество рецидивов.
-
Сифилис — это очень коварное заболевание, первые симптомы возникают спустя несколько недель.
 На половых органах появляется небольшая язва. Примерно через 2 недели она увеличивается в размерах, наблюдается уплотнение лимфоузлов. Проявления сифилиса одинаковы у мужчин и у женщин. Первичная язва (сифилитический шанкр) может возникать и не в области половых органов. В зависимости от способа заражения, шанкры могут появляться в любой точке кожного покрова или слизистой. Инфицирование сифилисом может происходить и неполовым путем (например, при переливании крови), в таких случаях первичный шанкр отсутствует и для обнаружения заболевания может потребоваться больше времени.
На половых органах появляется небольшая язва. Примерно через 2 недели она увеличивается в размерах, наблюдается уплотнение лимфоузлов. Проявления сифилиса одинаковы у мужчин и у женщин. Первичная язва (сифилитический шанкр) может возникать и не в области половых органов. В зависимости от способа заражения, шанкры могут появляться в любой точке кожного покрова или слизистой. Инфицирование сифилисом может происходить и неполовым путем (например, при переливании крови), в таких случаях первичный шанкр отсутствует и для обнаружения заболевания может потребоваться больше времени.
-
При трихомониазе наблюдается изменение цвета влагалищных выделений. Они становятся желтыми или зеленоватыми, имеющими неприятный запах.
-
Хламидиоз — это болезнь, которая может передаваться не только при половом контакте, но и бытовым путем. Первые признаки возникают через неделю. Характерны частые и болезненные мочеиспускания, маточные кровотечения, боли внизу живота и в области спины.

-
Гонорея (триппер) может долгое время протекать без каких-либо симптомов. В большинстве случаев больные жалуются на желтые или зеленые гнойные выделения с неприятным запахом, резкие боли внизу живота. Частое и болезненное мочеиспускание как у мужчин, так и у женщин.
!!!!Самолечением в такой ситуации заниматься опасно. Из острой формы инфекция может перейти в хроническую, тогда первичные симптомы исчезнут, но опасность для здоровья увеличится. Возрастает и риск заражения полового партнера.
Важно помнить ,что многие ИППП протекают без всяких симптомов ! Если ваш партнер заражен ,то и вы можете быть заражены , даже если пока симптомы заболевания не дают о себе знать!
Помните, что ИППП вызывают неприятные последствия как для женщин (бесплодие, эктопическую беременность, осложнения родов и послеродового периода и др.), так и для мужчин (простатит, и как следствие импотенция) .
Поэтому крайне важно не заниматься поиском лечебных методов в интернете, а обратиться за квалифицированной диагностикой и своевременным лечением к врачу! Именно врач подберет те диагностические и лечебные программы, которые помогут вовремя выявить заболевание и своевременно с ним справиться!
Анализ кала на яйцеглист – Сдать анализ на яйца гельминтов в лаборатории KDL
Исследования кала на простейших и яйца гельминтов – рутинный диагностический тест, много лет применяющийся в лабораторной диагностике. Гельминты широко распространены во всех климатических зонах, заражению больше всего подвержены дети, владельцы домашних животных и люди, работающие с животными или работающие на земле. Выявление яиц гельминтов проводится методом микроскопии препарата кала пациента. Так как у гельминтов есть определенные циклы размножения, то по объективным причинам не всегда можно выявить яйца паразитов в кале при наличии инвазии.
В каких случаях обычно назначают исследование кала на яйца гельминтов?
Обычно анализы на яйца глист обязательно назначаются всем детям перед посещением школы, детского сада, бассейна, спортивных секций и т.д. Это обязательное исследование при диспансеризации здоровых школьников.
Целесообразно исследовать кал на простейших и гельминтов при наличии признаков возможного паразитарного заболевания. Жалобы на периодические боли в животе, неустойчивый стул, аллергические проявления, кожные высыпания, утомляемость могут быть симптомами глистной инвазии. Если в клиническом (общем) анализе крови есть снижение гемоглобина и повышенное число эозинофилов, то это тоже повод сдать анализ на яйца гельминтов.
Важно: при заражении острицами – энтеробиозе, исследование кала на яйца гельминтов может быть неинформативным, так как эти паразиты откладывают яйца на коже перианальной области и лучшим методом диагностики служит соскоб на энтеробиоз.
Что именно определяется в процессе анализа?
В процессе анализа врач просматривает препараты кала пациента под микроскопом, визуально определяя наличие яиц и частей тел паразитов.
Что означают результаты теста?
Положительный результат анализа — «обнаружено» выдается, когда выявлены яйца гельминтов, цисты простейших или непосредственно сами паразиты.
Результат «не обнаружено» не исключает наличия паразитарного заболевания, так как выделение яиц гельминтов зависит от фазы их размножения. При наличии симптомов и отрицательном результате теста нужно сделать повторное исследование. При небольшом количестве яиц паразитов в кале более информативным может быть тест нового поколения – исследование кала на простейшие и яйца гельминтов методом обогащения (PARASEP).
Обычный срок выполнения теста
Обычно результат анализа на гельминтов и простейших можно получить в течение 1-2 дней.
Нужна ли специальная подготовка к анализу?
Для выявления простейших кал должен быть свежим, собран непосредственно перед сдачей материала в лабораторию. Яйца гельминтов стабильны, сохраняются в кале долгое время.
Яйца гельминтов стабильны, сохраняются в кале долгое время.
Браунодин® мазь
Антимикробный эффект Браунодина связан с выделением свободного йода при контакте с кожей, слизистой оболочкой и поверхностью раны, и зависит не от концентрации раствора повидон-йода, а от концентрации свободного йода, со держание которого в Браунодине 22 мг/л,что гораздо больше чем у аналогичных препаратов повидон-йода. Браунодин — антибактериальное средство, к которому отсутствует резистентность болезнетворных микроорганизмов от вирусов до простейших: даже в разведении 1/2000 он разрушает все вегетативные формы бактерий. Среднее время антимикробного воздействия повидон-йода на микроорганизмы: грамположительные и грамотрицательные бактерии — 15–30 секунд; вирусы — 15 секунд; грибы — 15–30 секунд; простейшие (трихомонады) — 30–60 секунд.
Браунодин представляет собой депо йода. За счет постепенного высвобождения йода из комплекса повидон-йод действует длительно. Благодаря большому размеру комплексной молекулы, он не проникает через биологические барьеры, поэтому системное действие йода отсутствует. Браунодин за счет своего осмотического действия снимает отеки и уменьшает воспаление тканей. Проведение ирригации раневой полости водным раствором повидон-йода во время хирургической операции и перед наложением швов на операционную рану является одной из рекомендаций ВОЗ по профилактике инфекции в области хирургического вмешательства. Эти свойства делают Браунодин незаменимым местным антисептиком в неотложной хирургии.
Браунодин за счет своего осмотического действия снимает отеки и уменьшает воспаление тканей. Проведение ирригации раневой полости водным раствором повидон-йода во время хирургической операции и перед наложением швов на операционную рану является одной из рекомендаций ВОЗ по профилактике инфекции в области хирургического вмешательства. Эти свойства делают Браунодин незаменимым местным антисептиком в неотложной хирургии.
Выпускается в форме тубы объемом 20, 100и 250 мг.
Преимущества
Широкий спектр действия: антибактериальный, противовирусный, противогрибковый, а также антипротозойный
- Активен против спор бактерий
- Отсутствие резистентности к препаратуу микроорганизмов
- Максимальная эффективность достигается в течении 15 секунд
- Не обладает раздражающим действием при применении на слизистые и раны
- Эффективен при значении pH от 2 до 7
Показания
Обработка кожи операционного поля и слизистых до и после операции.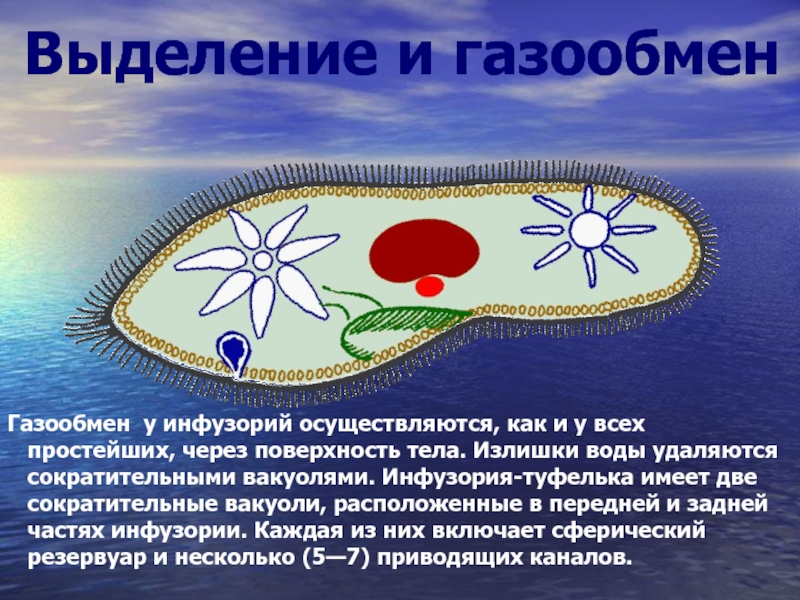
- Лечение ожогов и донорских ран
- Лечение инфицированных ран, в том числе посттравматических и послеоперационных ран
- Трофические язвы различного происхождения
- Гнойно-некротические раны и пролежней
- Инфекции кожи различной этиологии: инфекционный дерматит и экзема, рожистое воспаление, абсцесс кожи, фурункул и карбункул, флегмона, пиодермия
- Микозы и кандидозы кистей, стоп, кожи туловища
Общая характеристика простейших — урок. Биология, Животные (7 класс).
Царство Животные делится на два подцарства: Одноклеточные и Многоклеточные.
Одноклеточные животные состоят из одной клетки. Поэтому другое их название — Простейшие.
Поскольку клетка очень мала, простейших сложно увидеть невооружённым глазом, но их очень много. Насчитывается около \(70\) тыс. видов одноклеточных животных (или простейших). К ним относятся амёба, инфузория-туфелька, радиолярия и др.
Единственная клетка простейшего живёт как целостный организм.
В ней осуществляются все жизненно важные функции животного: движение, питание, дыхание, выделение, обмен веществ, раздражимость, размножение.
Рассмотрим строение и функции такой клетки на примере амёбы обыкновенной.
Для амёбы характерны все признаки животной клетки: клеточная мембрана, внутри которой находится цитоплазма с ядром, органеллами и включениями.
Обрати внимание!
Наличие в клетке ядра свидетельствует о том, что амёба относится к эукариотам.
Клетка амёбы не имеет постоянной формы.Полужидкая цитоплазма внутри клетки может перетекать и приводить к выпячиванию клеточной мембраны наружу (рисунок \(1\)).
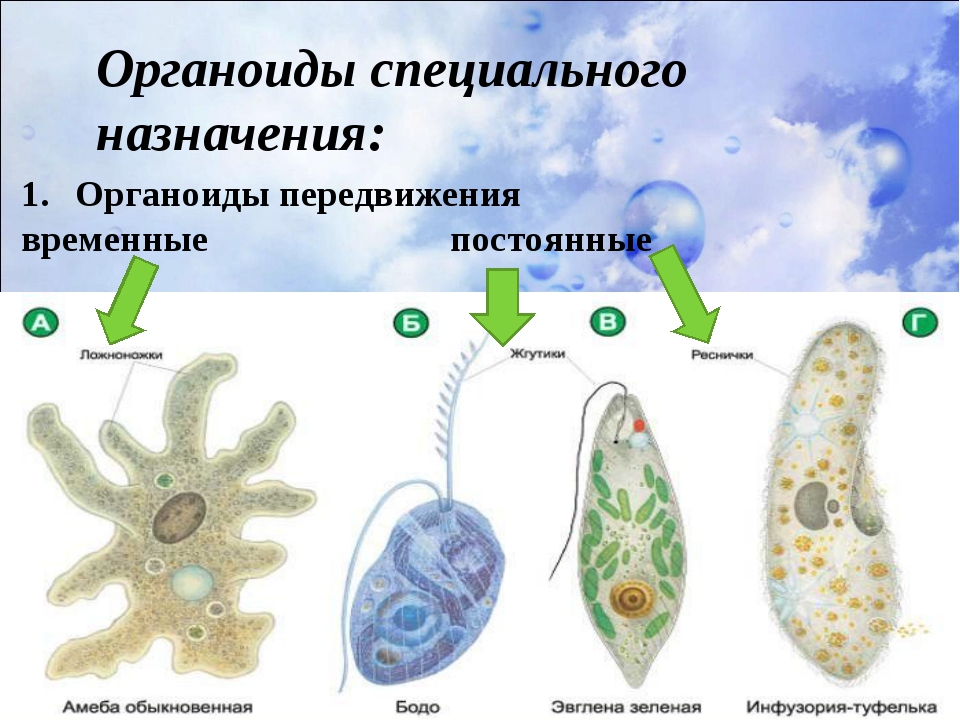
Так образуются ложноножки, или псевдоподии, с помощью которых амёба передвигается.
У некоторых других простейших имеются реснички и жгутики для более быстрого передвижения.
С помощью псевдоподий амёба может захватывать мельчайшие частички пищи (других одноклеточных). Окружая пищу, псевдоподии сближаются и плотно обхватывают её. Так внутри клетки образуется пищеварительная вакуоль (рисунок \(1\)), в которой происходит переваривание захваченной пищи.
Так внутри клетки образуется пищеварительная вакуоль (рисунок \(1\)), в которой происходит переваривание захваченной пищи.
Обрати внимание!
Как и большинство животных, амёба питается готовыми органическими веществами, поэтому относится к гетеротрофам.
Рис. \(1\). Вакуоли
Обрати внимание!
Псевдоподии обеспечивают передвижение и захват пищи.
В клетке амёбы есть сократительные вакуоли (рисунок \(1\)). Они помогаюторганизму простейших выводить избыток воды, ненужные и вредные вещества.
Вакуоль — это полость в цитоплазме клетки, имеющая мембрану и жидкость с растворёнными веществами.
Обрати внимание!
Амёбе свойственна раздражимость — способность реагировать на изменения окружающей среды. Реакции в виде движения по направлению к источнику раздражения или в противоположную сторону называют таксисами. Движение к раздражителю — положительный таксис, от раздражителя — отрицательный таксис.
Амёбе характерно бесполое размножение.
Рис. \(2\). Процесс деления клетки надвое
У других простейших бывает деление клетки на две или больше клеток (множественное деление, или шизогония). Деление может быть поперечным (например, у инфузории-туфельки) или продольным (например, у эвглены зелёной).
У некоторых простейших есть половое размножение.
Амёба приспособлена к жизни в жидкой среде. В неблагоприятных обстоятельствах (высыхании, резком изменении температур) на поверхности простейших образуется
плотная оболочка, и они превращаются в особую форму — цисту (рисунок \(3\) А).
Образование цисты — способ выживания в неблагоприятных условиях.
Рис. \(3\). Циста амёбы
При наступлении благоприятных условий (рисунок \(3\) Б) амёба покидает защитную оболочку цисты и продолжает свою жизнедеятельность.
Источники:
Рис. 1. Вакуоли. © ЯКласс.
Рис. 2. Процесс деления клетки надвое. © ЯКласс.
Рис. 3. Циста амёбы. © ЯКласс.
Биология клетки — Департамент физической культуры и спорта
В. Н. Селуянов, В. А. Рыбаков, М. П. Шестаков
Глава 1. Модели систем организма
1.1.1. Биология клетки
Клетка — основная структурная единица всех живых организмов, элементарная живая целостная система, которая обладает рядом свойств: воспроизведение, синтез (анаболизм), катаболизм, производство энергии, поглощение, выделение, специфические функции.
Она представляет собой протоплазму, окруженную мембраной. В протоплазме расположено ядро, в котором содержится гены (наследственная информация) в виде молекул ДНК. В протоплазме имеются следующие структурные образования, их еще называют органеллами или органоидами:
— рибосомы (полирибосомы) — с помощью РНК производится строительство белка, иными словами, разворачиваются анаболические процессы;
— митохондрии — энергетические станции клетки, в них с помощью кислорода идет превращение жиров или глюкозы в углекислый газ (СО2), воду и энергию, заключенную в молекулах АТФ;
— эндоплазматическая сеть — или саркоплазматический ретикулум является органеллой, состоящей из мембран и ферментативных систем, прикрепленных к ней;
— комплекс Гольджи — система мембран, образующих совокупность мешочков и пузырьков, служит для синтеза и выделения веществ из клетки;
— лизосомы — органеллы в форме пузырьков, содержат ферменты, разрушающие белки до простейших составляющих аминокислот, эти органеллы еще называют пищеварительным аппаратом клетки;
— глобулы гликогена — источник углеводов в клетке;
— капельки жира — источник жиров в клетке;
— специализированные органеллы — структурные компоненты клетки, присущие определенным видам клеток, например, миофибриллы мышечным волокнам.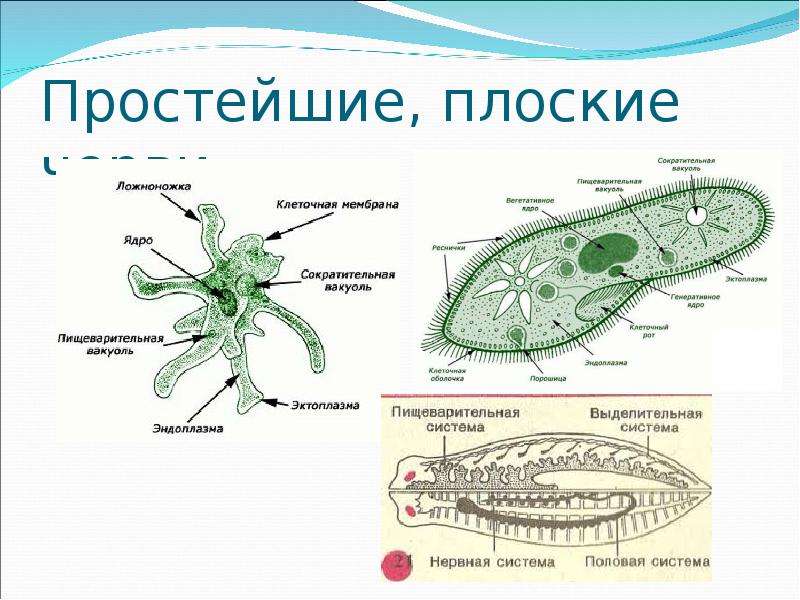
В клетке разрешается главное противоречие — основа жизнедеятельности, динамическое равновесие между процессами анаболизма и катаболизма. Анаболизм связан с функционированием наследственного аппарата клетки, который управляет синтезем новых органелл, а лизосомы отвечают за катаболизм — разрушение органелл клетки, который существенно усиливается при повышении концентрации ионов водорода в цитоплазме.
Важно заметить, что все процессы анаболизма предопределяются стероидными гормонами. Они соединяются с рецепторами на мембранах клетки, образуют ансамбль «гормон-рецептор», который проникает в ядро и вызывает транскрипцию (расшифровку и считывание) наследственной информации. Так происходит управление анаболизмом. Катаболизм в клетке связан с активностью лизосом, лизосомы усиливают активность с ростом концентрации ионов водорода. В ходе физических упражнений образуется молочная кислота, именно она является ускорителем катаболизма в клетках.
(PDF) ЖИЗНЕСПОСОБНЫЕ ПРОСТЕЙШИЕ В ВЕЧНОЙ МЕРЗЛОТЕ АРКТИКИ VIABLE PROTISTS IN ARCTIC PERMAFROST
77
ЖИЗНЕСПОСОБНЫЕ ПРОСТЕЙШИЕ В ВЕЧНОЙ МЕРЗЛОТЕ АРКТИКИ
Условия погребения цист простейших и ре-
жим их криоконсервации, по нашему мнению, яв-
ляются важнейшими факторами, от которых за-
висит биоразнообразие и численность “живых
ископаемых” простейших.
Авторы выражают благодарность А.П. Мыль-
никову (Институт биологии внутренних вод РАН,
Борок) за помощь в подготовке работы.
Литература
Бобров А.А., Зигерт К., Ширмейстер Л., Андреев А.А.
Раковинные амебы (Protozoa: Testacea) в четвертичных от-
ложениях полуострова Быковский, арктическая Якутия //
Изв. РАН. Сер. биол., 2003, № 2, с. 236–253.
Вишнивецкая Т.А., Ерохина Л.Г., Гиличинский Д.А.,
Воробьева Е.А. Синезеленые и зеленые водоросли из веч-
номерзлых осадочных пород Арктики // Криосфера Земли,
1997, т. I, № 2, с. 71–76.
Гиличинский Д.А., Хлебникова Г.М., Звягинцев Д.Г. и др.
Микробиологические характеристики при изучении оса-
дочных пород криолитозоны // Изв. АН СССР. Сер. геол.,
1989, № 6, с. 103–115.
Губин С.В. Позднеплейстоценовое почвообразование на
Приморских низменностях севера Якутии // Почвоведение,
1994, № 8, с. 5–14.
Губин С.В. Педогенез – составная часть механизма фор-
мирования отложений позднеплейстоценового ледового
комплекса // Криосфера Земли, 2002, т. VI, № 3, с. 82–91.
VI, № 3, с. 82–91.
Губин С.В., Занина О.Г., Максимович С.В. и др. Рекон-
струкция условий формирования отложений ледового ком-
плекса по результатам изучения позднеплейстоценовых нор
грызунов // Криосфера Земли, 2003, т. VII, № 3, с. 13–22.
Дмитриев В.В., Гиличинский Д.А., Файзутдинова Р.Н.
и др. Дрожжи в вечномерзлых отложениях Сибири позд-
неплейстоценового–раннеплейстоценового возраста //
Криосфера Земли, 1997, т. I, № 2, с. 67–70.
Жуков Б.Ф. Атлас пресноводных гетеротрофных жгутико-
носцев (биология, экология, систематика). Рыбинск, Ин-т
биологии внутр. вод РАН, 1993, 160 с.
Занина О.Г. Ископаемые норы грызунов из мерзлых отло-
жений Колымской низменности // Зоол. журн., 2005, т. 6,
вып. 85, с. 728–736.
Звягинцев Д.Г., Гиличинский Д.А., Благодатский С.А. и др.
Длительность сохранения жизнеспособных микроорганиз-
мов в постоянно мерзлых осадочных породах и погребенных
почвах // Микробиология, 1985, т. 54, с. 153–163.
54, с. 153–163.
Каптерев П.Н. Об анабиозе в условиях вечной мерзлоты //
Изв. АН СССР. Сер. биол., 1936, № 6, с. 1073–1088.
Каптерев П.Н. Новые материалы по оживлению организ-
мов из вечной мерзлоты // Докл. АН СССР, 1938, вып. 20,
№ 4, с. 315.
Кочкина Г.А., Иванушкина Н.Е., Карасев С.Г. и др. Выжи-
вание микромицетов и актинобактерий в условиях длитель-
ной природной криоконсервации // Микробиология, 2001,
т. 70, № 3, с. 412–420.
Лозина-Лозинский Л.К. Очерки по криобиологии (адапта-
ция и устойчивость организмов и клеток к низким и сверх-
низким температурам). Л., Наука, 1972, 288 с.
Микрюков К.А. Центрохелидные солнечники (Centrohelio-
zoa). М., КМК, 2002, 136 с.
Полянский Ю.И., Суханова К.М., Карпов С.А. Основные
характеристики протистов // Протисты: Рук-во по зооло-
гии / Ред. А.Ф. Алимов. СПб., Наука, 2000, ч. 1, с. 145–184.
Ривкина Е.М., Краев Г.Н., Кривушин К.В. и др. Метан в
вечномерзлых отложениях северо-восточного сектора Арк-
тики // Криосфера Земли, 2006, т.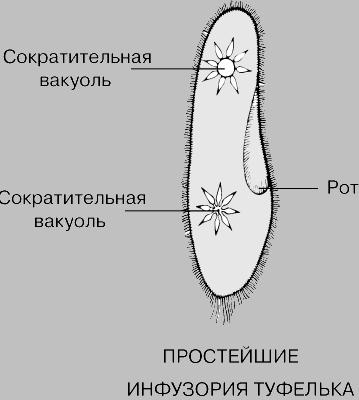 X, № 3, с. 23–41.
X, № 3, с. 23–41.
Спирина Е.В., Федоров-Давыдов Д.Г. Микробиологичес-
кая характеристика мерзлотных почв Колымской низмен-
ности // Почвоведение, 1998, № 12, с. 1462–1475.
Суханова К.М. Температурные адаптации у простейших.
Л., Наука, 1968, 267 с.
Томирдиаро С.В. Лёссово-ледовая формация Восточной
Сибири в позднем плейстоцене и голоцене. М., Наука, 1980,
183 с.
Хлебникова Г.М., Гиличинский Д.А., Федоров-Давы-
дов Д.Г., Воробьева Е.А. Количественная оценка микро-
организмов в мерзлых осадках и погребенных почвах //
Микробиология, 1990, т. 59, с. 148–155.
Шатилович А.В., Мыльников А.П., Ступин Д.В. Фауна и
морфология гетеротрофных жгутиконосцев и солнечников
позднеплейстоценовых ископаемых нор сусликов (Колым-
ская низменность) // Зоол. журн., 2010 (в печати).
Шатилович А.В., Шмакова Л.А., Гудков А.В. и др. Жизне-
способные Protozoa из вечномерзлых отложений и погребен-
ных почв // Докл. РАН, 2005, т. 401, № 5, с. 715–717.
РАН, 2005, т. 401, № 5, с. 715–717.
Яшина С.Г., Губин С.В., Шабаева Э.В. и др. Жизнеспо-
собность семян высших растений позднеплейстоценового
возраста из вечномерзлых отложений // Докл. РАН, 2002,
т. 383, № 5, с. 714–717.
Auer B., Arndt H. Taxonomic composition and biomass of
heterotrophic flagellates in relation to lake trophy and season //
Freshwater Biol., 2001, vol. 46, p. 959–972.
Chavez-Munguia B., Omana-Molina M., Gonzalez-Lazaro M.
et al. Ultrastructural stady of encystations and excyatation
in Acanthamoeba castellanii // J. Eukaryot. Microbiol., 2005,
vol. 52, No. 2, p. 1–6.
Clegg J.S. Cryptobiosis – a peculiar state of biological organiza-
tion // Comp. Biochem. Physiol., 2001, No. 128, p. 613–624.
De Jonckheere J. Isolation and molecular identification of free-
living amoebae of the genus Naegleria from Arctic and sub-An-
tarctic regions // Europ. J. Protistol., 2006, No. 42, p. 115–123.
42, p. 115–123.
Ekelund F., Patterson D.J. Some heterotrophic flagellates from
a cultivated garden soil in Australia // Arch. Protistenkd., 1997,
vol. 148, p. 461–478.
Faizutdinova R., Suzina N., Duda V. et al. Yeasts Isolated from
Ancient Permafrost // Life in Ancient Ice. Princeton, Princeton
Univ. Press, 2005, ch. 8, p. 118–126.
Foissner W. Basic light and scanning electron microscopic
methods for taxonomic studies of ciliated protozoa // Europ. J.
Protistol., 1991, No. 27, p. 313–330.
Foissner W. Estimating the species richness of soil protozoa
using the “non-flooded petri dish method” // Protocols in
Protozoology. Kansas, Allen Press Lawrence, 1992, p. B-
10.1–B-10.2.
Foissner W. Copodea (Ciliophora) // Protozoenfauna.
Stuttgart, Jena, N.Y., Gustav Fischer Verlag, 1993, 777 p.
Foissner W. Faunistics, taxonomy and ecology of moss and soil
ciliates (Protozoa, Ciliophora) from Antarctica, with description
of new species, including Pleuroplitoides smithi gen. n., sp.n. //
n., sp.n. //
Acta Protozoologica, 1996, No. 35, p. 95–123.
Gilichinsky D. Permafrost model of extraterrestrial habitat //
Astrobiology. Berlin, Springer-Verlag, 2002, p. 271–295.
Выделение простейших из воды, связанное со вспышкой легионеллеза, и демонстрация внутриклеточного размножения Legionella pneumophila.
Appl Environ Microbiol. 1986 г., февраль; 51(2): 422–424.
Эта статья была процитирована другими статьями в PMC.Реферат
На месте вспышки легионеллеза амебы и две инфузории Tetrahymena sp. и Cyclidium sp., были выделены из воды градирни, содержащей Legionella pneumophila. Tetrahymena sp.и амебы неоднократно демонстрировали способность поддерживать внутриклеточное размножение L. pneumophila. Оба были изолированы от градирен, которые были конкретно замешаны в распространении легионеллеза. Эти простейшие могут быть резервуарами, поддерживающими выживание и размножение вирулентных легионелл в воде градирни.
Полный текст
Полный текст доступен в виде отсканированной копии оригинальной печатной версии. Получите копию для печати (файл PDF) полной статьи (713K) или щелкните изображение страницы ниже, чтобы просмотреть страницу за страницей.Ссылки на PubMed также доступны для Selected References .
Получите копию для печати (файл PDF) полной статьи (713K) или щелкните изображение страницы ниже, чтобы просмотреть страницу за страницей.Ссылки на PubMed также доступны для Selected References .
Изображения в этой статье
Нажмите на изображение, чтобы увеличить его.
Избранные ссылки
Эти ссылки находятся в PubMed. Возможно, это не полный список литературы из этой статьи.
- Ананд К.М., Скиннер А.Р., Малик А., Курц Д.Б. Взаимодействие L. pneumophilia и свободноживущей амебы (Acanthamoebapalestinensis). J Hyg (Лондон), 1983, октябрь; 91 (2): 167–178.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Bopp CA, Sumner JW, Morris GK, Wells JG. Выделение Legionella spp. из проб воды из окружающей среды путем обработки с низким уровнем pH и использования селективной среды. Дж. Клин Микробиол. 1981 г., апрель; 13 (4): 714–719. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- England AC, 3rd, Fraser DW, Mallison GF, Mackel DC, Skaliy P, Gorman GW.
 Неспособность предсказать чувствительность Legionella pneumophila к культуре возникает из-за обработанных дезинфицирующим средством градирен кондиционирования воздуха.Appl Environ Microbiol. 1982 г., январь; 43 (1): 240–244. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Неспособность предсказать чувствительность Legionella pneumophila к культуре возникает из-за обработанных дезинфицирующим средством градирен кондиционирования воздуха.Appl Environ Microbiol. 1982 г., январь; 43 (1): 240–244. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Fields BS, Shotts EB, Jr, Feeley JC, Gorman GW, Martin WT. Пролиферация Legionella pneumophila как внутриклеточного паразита реснитчатого простейшего Tetrahymena pyriformis. Appl Environ Microbiol. 1984 г., март; 47 (3): 467–471. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Garbe PL, Davis BJ, Weisfeld JS, Markowitz L, Miner P, Garrity F, Barbaree JM, Reingold AL. Внутрибольничная болезнь легионеров.Эпидемиологическая демонстрация градирен как источника. ДЖАМА. 1985 г., 26 июля; 254 (4): 521–524. [PubMed] [Google Scholar]
- GIMENEZ DF. ОКРАШИВАНИЕ РИККЕТСИЙ В ЖЕЛТОЧНЫХ КУЛЬТУРАХ. Технология окрашивания. 1964 г., май; 39: 135–140. [PubMed] [Google Scholar]
- Грейс Р.Д., Дьюар Н.
 Е., Барнс В.Г., Ходжес Г.Р. Чувствительность Legionella pneumophila к трем микробицидам градирен. Appl Environ Microbiol. 1981 г., январь; 41 (1): 233–236. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Е., Барнс В.Г., Ходжес Г.Р. Чувствительность Legionella pneumophila к трем микробицидам градирен. Appl Environ Microbiol. 1981 г., январь; 41 (1): 233–236. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Паскулль А.В., Фили Дж.С., Гибсон Р.Дж., Кордес Л.Г., Майеровиц Р.Л., Паттон К.М., Горман Г.В., Кармак К.Л., Эззелл Д.В., Доулинг Д.Н.Возбудитель питтсбургской пневмонии: прямое выделение из ткани легких человека. J заразить Dis. 1980 г., июнь; 141 (6): 727–732. [PubMed] [Google Scholar]
- Rowbotham TJ. Предварительный отчет о патогенности Legionella pneumophila для пресноводных и почвенных амеб. Джей Клин Патол. 1980 декабрь; 33 (12): 1179–1183. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Soracco RJ, Gill HK, Fliermans CB, Pope DH. Восприимчивость водорослей и Legionella pneumophila к биоцидам градирен. Appl Environ Microbiol.1983 г., апрель; 45 (4): 1254–1260. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- WHEATLEY WB. Процедура быстрого окрашивания кишечных амеб и жгутиконосцев.
 Ам Джей Клин Патол. 1951 г.; 21 (10) октября: 990–991. [PubMed] [Google Scholar]
Ам Джей Клин Патол. 1951 г.; 21 (10) октября: 990–991. [PubMed] [Google Scholar]
Здесь представлены статьи по прикладной и экологической микробиологии, любезно предоставленные Американским обществом микробиологии (ASM)
Оптимизация и валидация методов выделения и ПЦР-идентификации ооцист простейших в реальном времени на листовых зеленых овощах и ягодных фруктах
Листовые зеленые овощи и ягодные фрукты имеют совершенно разные физические и биохимические характеристики, обычно употребляются в сыром виде с минимальным мытьем и являются потенциальными переносчиками болезней пищевого происхождения, вызываемых простейшими паразитами, такими как Cryptosporidium , Циклоспора и Токсоплазма .Валидация общего метода выделения и обнаружения ооцист, применимого к каждому виду листовой зелени и ягод, необходима для обеспечения надежной лабораторной поддержки программ эпиднадзора и, при необходимости, для расследований вспышек заболеваний. Целями настоящего исследования были оптимизация и проверка эффективности этих методов для выделения ооцист простейших из нескольких видов листовой зелени и ягод. Ооцисты Eimeria papillata использовались в качестве заменителя кокцидий, представляющих опасность для общественного здравоохранения, для внесения в пробы продукции.Использовали искусственный стостер или орбитальный шейкер с последующим центрифугированием для выделения и концентрирования ооцист, соответственно, а для обнаружения и идентификации использовали анализ кривой плавления qPCR (qPCR MCA). Методы обработки, промывочные буферы и условия хранения были оценены и оптимизированы для пяти видов ягод (ежевика, черника, клюква, малина и клубника), пяти видов трав (кинза, укроп, мята, петрушка, тимьян) и зеленого лука. Ежевика, клюква, малина и земляника наиболее эффективно промывались при орбитальном встряхивании с элюирующим раствором, тогда как глициновый буфер был более эффективен для черники.Желудок с глициновым буфером был оптимальным для извлечения ооцист у листовых трав с мягкими стеблями, в то время как ароматические травы с древесными стеблями, такие как тимьян, требовали орбитального встряхивания, чтобы свести к минимуму высвобождение ингибиторов ПЦР.
Целями настоящего исследования были оптимизация и проверка эффективности этих методов для выделения ооцист простейших из нескольких видов листовой зелени и ягод. Ооцисты Eimeria papillata использовались в качестве заменителя кокцидий, представляющих опасность для общественного здравоохранения, для внесения в пробы продукции.Использовали искусственный стостер или орбитальный шейкер с последующим центрифугированием для выделения и концентрирования ооцист, соответственно, а для обнаружения и идентификации использовали анализ кривой плавления qPCR (qPCR MCA). Методы обработки, промывочные буферы и условия хранения были оценены и оптимизированы для пяти видов ягод (ежевика, черника, клюква, малина и клубника), пяти видов трав (кинза, укроп, мята, петрушка, тимьян) и зеленого лука. Ежевика, клюква, малина и земляника наиболее эффективно промывались при орбитальном встряхивании с элюирующим раствором, тогда как глициновый буфер был более эффективен для черники.Желудок с глициновым буфером был оптимальным для извлечения ооцист у листовых трав с мягкими стеблями, в то время как ароматические травы с древесными стеблями, такие как тимьян, требовали орбитального встряхивания, чтобы свести к минимуму высвобождение ингибиторов ПЦР. Извлечение ооцист из зеленого лука было самым высоким при обработке путем орбитального встряхивания с раствором для элюирования. Показатели извлечения ооцист варьировали от 4,1–12% для ягод и 5,1–15,5% для трав и зеленого лука. Всего 3 ооцисты на грамм фруктов или 5 ооцист на грамм трав или зеленого лука можно надежно обнаружить с помощью оптимизированных методов выделения и количественной ПЦР MCA.
Извлечение ооцист из зеленого лука было самым высоким при обработке путем орбитального встряхивания с раствором для элюирования. Показатели извлечения ооцист варьировали от 4,1–12% для ягод и 5,1–15,5% для трав и зеленого лука. Всего 3 ооцисты на грамм фруктов или 5 ооцист на грамм трав или зеленого лука можно надежно обнаружить с помощью оптимизированных методов выделения и количественной ПЦР MCA.
Прогресс 01.05.01 по 30.04.05 Были исследованы два протокола промывки. Буфер для элюирования (0,1 М трис, рН 7,4, 1 мМ ЭДТА, 0,01% лаурет 12 и пеногаситель А) оказался более эффективным при удалении паразитов из экспериментально добавленных продуктов, чем промывание продуктов водой. Идентификация паразитов более эффективно определялась с помощью ПЦР, чем с помощью обычной микроскопии.Это особенно верно в отношении Cryptosporidium, поскольку в свежих продуктах присутствуют различные виды. Традиционное наблюдение овощных смывов с помощью флуоресцентной или фазово-контрастной микроскопии занимает много времени и требует наличия опытного микроскописта. Воздействия Публикации
| |
Прогресс | Прогресс 01/01/04 по 12/31/04 Выходы Воздействие Публикации
|
Прогресс 01/01/03 до 12/31/03 Выходы Воздействие Публикации
| |
Прогресс | Прогресс 01/01/02 по 12/31/02 Выходы Воздействие Публикации
|
Прогресс 01/01/01 по 12/31/01 Выходы Воздействие Публикации
|

 На половых органах появляется небольшая язва. Примерно через 2 недели она увеличивается в размерах, наблюдается уплотнение лимфоузлов. Проявления сифилиса одинаковы у мужчин и у женщин. Первичная язва (сифилитический шанкр) может возникать и не в области половых органов. В зависимости от способа заражения, шанкры могут появляться в любой точке кожного покрова или слизистой. Инфицирование сифилисом может происходить и неполовым путем (например, при переливании крови), в таких случаях первичный шанкр отсутствует и для обнаружения заболевания может потребоваться больше времени.
На половых органах появляется небольшая язва. Примерно через 2 недели она увеличивается в размерах, наблюдается уплотнение лимфоузлов. Проявления сифилиса одинаковы у мужчин и у женщин. Первичная язва (сифилитический шанкр) может возникать и не в области половых органов. В зависимости от способа заражения, шанкры могут появляться в любой точке кожного покрова или слизистой. Инфицирование сифилисом может происходить и неполовым путем (например, при переливании крови), в таких случаях первичный шанкр отсутствует и для обнаружения заболевания может потребоваться больше времени.
 Неспособность предсказать чувствительность Legionella pneumophila к культуре возникает из-за обработанных дезинфицирующим средством градирен кондиционирования воздуха.Appl Environ Microbiol. 1982 г., январь; 43 (1): 240–244. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Неспособность предсказать чувствительность Legionella pneumophila к культуре возникает из-за обработанных дезинфицирующим средством градирен кондиционирования воздуха.Appl Environ Microbiol. 1982 г., январь; 43 (1): 240–244. [Бесплатная статья PMC] [PubMed] [Google Scholar] Е., Барнс В.Г., Ходжес Г.Р. Чувствительность Legionella pneumophila к трем микробицидам градирен. Appl Environ Microbiol. 1981 г., январь; 41 (1): 233–236. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Е., Барнс В.Г., Ходжес Г.Р. Чувствительность Legionella pneumophila к трем микробицидам градирен. Appl Environ Microbiol. 1981 г., январь; 41 (1): 233–236. [Бесплатная статья PMC] [PubMed] [Google Scholar] Ам Джей Клин Патол. 1951 г.; 21 (10) октября: 990–991. [PubMed] [Google Scholar]
Ам Джей Клин Патол. 1951 г.; 21 (10) октября: 990–991. [PubMed] [Google Scholar] Экстракция ДНК паразитов очень эффективна с использованием набора для быстрой экстракции ДНК, а обнаружение положительных результатов происходит быстрее и точнее, особенно в случае Cryptosporidium. Этот набор также снижает количество ложноположительных результатов на Cyclospora.Использование молекулярных инструментов является предпочтительным, поскольку
количество паразитов, присутствующих в продуктах, невелико и не может быть обогащено бактериальными загрязнителями. ОТ-ПЦР была успешно разработана для определения жизнеспособности Cryptosporidium. RT-PCR с использованием мРНК b-тубулина использовали в качестве индикатора жизнеспособности ооцист Cryptosporidium parvum. Обычные методы оценки жизнеспособности Cyclospora cayetanensis, такие как витальные окрашивания и клеточные культуры, пока недоступны. Хотя ооцисты Cyclospora были зарегистрированы у животных (утка, куры, собаки и нечеловекообразные приматы), попытки установить экспериментальную инфекцию с целью разработки модели на животных не увенчались успехом.
Экстракция ДНК паразитов очень эффективна с использованием набора для быстрой экстракции ДНК, а обнаружение положительных результатов происходит быстрее и точнее, особенно в случае Cryptosporidium. Этот набор также снижает количество ложноположительных результатов на Cyclospora.Использование молекулярных инструментов является предпочтительным, поскольку
количество паразитов, присутствующих в продуктах, невелико и не может быть обогащено бактериальными загрязнителями. ОТ-ПЦР была успешно разработана для определения жизнеспособности Cryptosporidium. RT-PCR с использованием мРНК b-тубулина использовали в качестве индикатора жизнеспособности ооцист Cryptosporidium parvum. Обычные методы оценки жизнеспособности Cyclospora cayetanensis, такие как витальные окрашивания и клеточные культуры, пока недоступны. Хотя ооцисты Cyclospora были зарегистрированы у животных (утка, куры, собаки и нечеловекообразные приматы), попытки установить экспериментальную инфекцию с целью разработки модели на животных не увенчались успехом. Споруляция ооцист обеспечивает средство для определения жизнеспособности, но для этого требуется 2 или более недель, а споруляция обычно достигается с 40-80% ооцист, поэтому существует потребность в быстрых и чувствительных анализах жизнеспособности, которые будут работать на уровне одного организма. . Частичные последовательности гена b-тубулина Cyclospora были секвенированы, чтобы использовать их для ОТ-ПЦР. Эта ОТ-ПЦР
метод обеспечит дополнительное обнаружение и анализ жизнеспособности для использования в пробах окружающей среды.
Споруляция ооцист обеспечивает средство для определения жизнеспособности, но для этого требуется 2 или более недель, а споруляция обычно достигается с 40-80% ооцист, поэтому существует потребность в быстрых и чувствительных анализах жизнеспособности, которые будут работать на уровне одного организма. . Частичные последовательности гена b-тубулина Cyclospora были секвенированы, чтобы использовать их для ОТ-ПЦР. Эта ОТ-ПЦР
метод обеспечит дополнительное обнаружение и анализ жизнеспособности для использования в пробах окружающей среды. при выделении из свежих продуктов использовали промывочный буфер для элюции (0,1 М Трис, рН 7,4, 1 мМ ЭДТА, 0,01% Лаурет 12 и Antifoam A) вместо дистиллированной воды. Эффективность идентификации паразитов выше при использовании ПЦР по сравнению с обычной микроскопией.Традиционное наблюдение овощных смывов с помощью флуоресцентной или фазово-контрастной микроскопии занимает много времени и требует наличия опытного микроскописта. Экстракция ДНК паразитов очень эффективна с использованием комплекта для быстрой экстракции ДНК, а обнаружение положительных продуктов происходит быстрее и точнее, особенно в случае Cryptosporidium, и снижает количество ложноположительных результатов для Cyclospora. Поскольку количество паразитов, присутствующих в продуктах, невелико и не может быть обогащено, как это произошло бы с бактериальными загрязнителями, предпочтение отдается использованию молекулярных инструментов.Кроме того, Cryptosporidium можно захватить с помощью анализа на основе антител (выход 60-84%), а затем
метят с помощью прямого флуоресцентного анализа.
при выделении из свежих продуктов использовали промывочный буфер для элюции (0,1 М Трис, рН 7,4, 1 мМ ЭДТА, 0,01% Лаурет 12 и Antifoam A) вместо дистиллированной воды. Эффективность идентификации паразитов выше при использовании ПЦР по сравнению с обычной микроскопией.Традиционное наблюдение овощных смывов с помощью флуоресцентной или фазово-контрастной микроскопии занимает много времени и требует наличия опытного микроскописта. Экстракция ДНК паразитов очень эффективна с использованием комплекта для быстрой экстракции ДНК, а обнаружение положительных продуктов происходит быстрее и точнее, особенно в случае Cryptosporidium, и снижает количество ложноположительных результатов для Cyclospora. Поскольку количество паразитов, присутствующих в продуктах, невелико и не может быть обогащено, как это произошло бы с бактериальными загрязнителями, предпочтение отдается использованию молекулярных инструментов.Кроме того, Cryptosporidium можно захватить с помощью анализа на основе антител (выход 60-84%), а затем
метят с помощью прямого флуоресцентного анализа. Однако жизнеспособность изолированных ооцист недоступна, если в протокол не включено использование витальных красителей, культивирования in vitro или животных моделей. Тем не менее, эти методы требуют большого количества ооцист, которые обычно не извлекаются из продуктов.
Однако жизнеспособность изолированных ооцист недоступна, если в протокол не включено использование витальных красителей, культивирования in vitro или животных моделей. Тем не менее, эти методы требуют большого количества ооцист, которые обычно не извлекаются из продуктов. Свежие продукты, экспериментально зараженные цистами и ооцистами, были обработаны с использованием воды или буфера для элюирования, второй из которых более эффективен для восстановления паразитов. Необходимо учитывать пищевую матрицу. При сравнении базилика, салата и малины наименьшее извлечение было достигнуто при использовании малины. Исследование лямблий и криптоспоридий методом иммунофлуоресценции требует много времени и не обладает специфичностью для идентификации видов паразитов. Восстановление ДНК из пищевых продуктов оценивали с использованием хелатирующих агентов, замораживания-оттаивания и набора для выделения FastaDNA.БСА и молоко были включены в анализ ПЦР для изучения влияния ингибиторов на
усиление желаемого продукта. Набор FastaDNA оказался чувствительным, а молоко или БСА эффективно блокировали ингибиторы.
Свежие продукты, экспериментально зараженные цистами и ооцистами, были обработаны с использованием воды или буфера для элюирования, второй из которых более эффективен для восстановления паразитов. Необходимо учитывать пищевую матрицу. При сравнении базилика, салата и малины наименьшее извлечение было достигнуто при использовании малины. Исследование лямблий и криптоспоридий методом иммунофлуоресценции требует много времени и не обладает специфичностью для идентификации видов паразитов. Восстановление ДНК из пищевых продуктов оценивали с использованием хелатирующих агентов, замораживания-оттаивания и набора для выделения FastaDNA.БСА и молоко были включены в анализ ПЦР для изучения влияния ингибиторов на
усиление желаемого продукта. Набор FastaDNA оказался чувствительным, а молоко или БСА эффективно блокировали ингибиторы.
 В случае с Cryptosporidium вместо
непосредственно мечя ооцисты, их концентрировали из растительных смывов с помощью иммуномагнитной сепарации (Dynal) с последующим мечением ИФА. Извлечение Cryptosporidium составило 60-84% от инокулята из 100 ооцист.Cyclospora оценивали по той же методике. Показатели восстановления увеличились до 30-56%. Когда в этом эксперименте использовали базилик, выход Cyclospora составил 14-21%.
В случае с Cryptosporidium вместо
непосредственно мечя ооцисты, их концентрировали из растительных смывов с помощью иммуномагнитной сепарации (Dynal) с последующим мечением ИФА. Извлечение Cryptosporidium составило 60-84% от инокулята из 100 ооцист.Cyclospora оценивали по той же методике. Показатели восстановления увеличились до 30-56%. Когда в этом эксперименте использовали базилик, выход Cyclospora составил 14-21%. Были сопоставлены различные методы очистки для улучшения извлечения простейших паразитов (Cryptosporidium и Cyclospora) из пищевых матриц. Воду и трис-буфер с детергентом и без него сравнивали для определения эффективности извлечения. При промывках дистиллированной водой выход ооцист составлял 15-30%, тогда как при промывках трис-буфером, содержащим детергент, выход ооцист из различных видов продукции был лучше (40-70%). Эффективность восстановления зависела от времени между инокуляцией и подготовкой образца.До 90% ооцист извлекалось, когда обработка начиналась сразу после помещения паразитов в продукцию. Это восстановление было снижено после 1 часа инкубации перед обработкой образцов (40-70%). Листья салата (25 г) помещали в мешочки для кормления и замачивали в течение 30 минут в шейкере. Смывы салата помещали в пробирки и центрифугировали при 1500 g в течение 20 минут. Пеллеты были
наблюдали (с использованием возбуждающего фильтра 365 DM) под УФ-эпифлуоресцентной микроскопией для определения присутствия Cyclospora.
Были сопоставлены различные методы очистки для улучшения извлечения простейших паразитов (Cryptosporidium и Cyclospora) из пищевых матриц. Воду и трис-буфер с детергентом и без него сравнивали для определения эффективности извлечения. При промывках дистиллированной водой выход ооцист составлял 15-30%, тогда как при промывках трис-буфером, содержащим детергент, выход ооцист из различных видов продукции был лучше (40-70%). Эффективность восстановления зависела от времени между инокуляцией и подготовкой образца.До 90% ооцист извлекалось, когда обработка начиналась сразу после помещения паразитов в продукцию. Это восстановление было снижено после 1 часа инкубации перед обработкой образцов (40-70%). Листья салата (25 г) помещали в мешочки для кормления и замачивали в течение 30 минут в шейкере. Смывы салата помещали в пробирки и центрифугировали при 1500 g в течение 20 минут. Пеллеты были
наблюдали (с использованием возбуждающего фильтра 365 DM) под УФ-эпифлуоресцентной микроскопией для определения присутствия Cyclospora.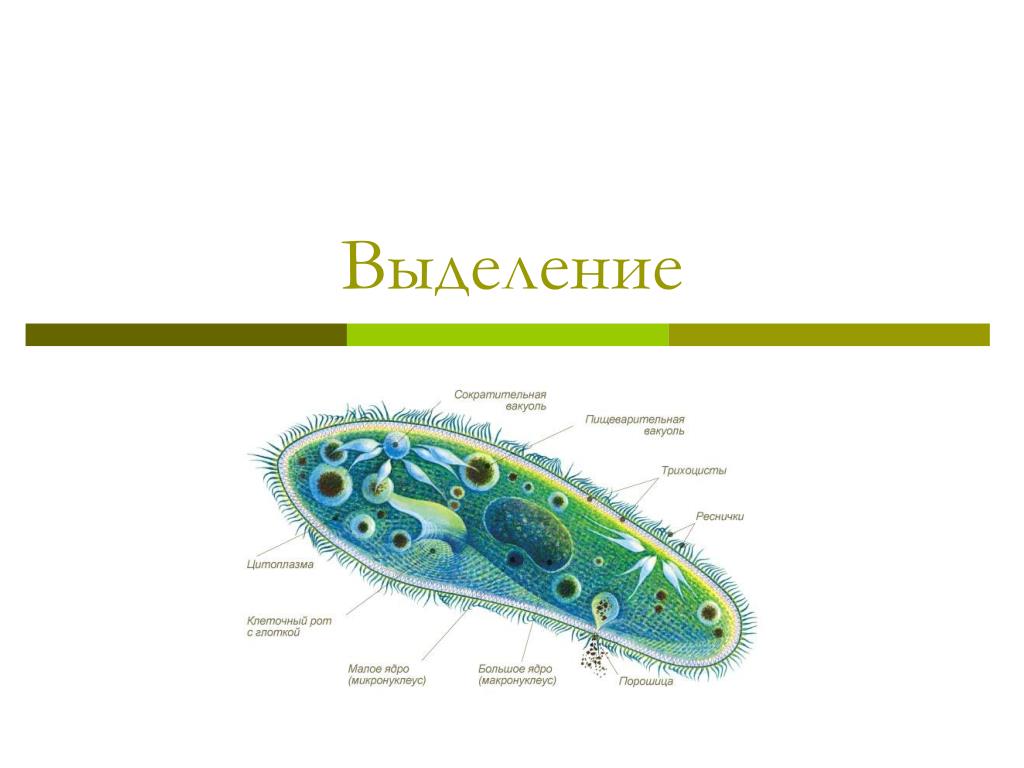 Ооцисты Cryptosporidium дополнительно извлекали с помощью иммуномагнитного разделения Dynabeadsr anti-Cryptosporidium (Dynal Biotech, Inc. Lake Success, NY) с последующей идентификацией с использованием прямого флуоресцентного анализа, Merifluor DFA (Meridian Diagnostics, Inc., Цинциннати, Огайо).
Ооцисты Cryptosporidium дополнительно извлекали с помощью иммуномагнитного разделения Dynabeadsr anti-Cryptosporidium (Dynal Biotech, Inc. Lake Success, NY) с последующей идентификацией с использованием прямого флуоресцентного анализа, Merifluor DFA (Meridian Diagnostics, Inc., Цинциннати, Огайо). Питательная добавка из соснового биоугля для использования в качестве носителя бактериального инокулята
Питательная добавка из соснового биоугля для использования в качестве носителя бактериального инокулята Снижение выживаемости штамма Sinorhizobium meliloti с дефицитом RecA в стерильной и нестерильной почве при тепловом стрессе
Снижение выживаемости штамма Sinorhizobium meliloti с дефицитом RecA в стерильной и нестерильной почве при тепловом стрессе Примечания по простейшим в сельскохозяйственных почвах с акцентом на гетеротрофных жгутиконосцах и голых амебах и их экологии
Примечания по простейшим в сельскохозяйственных почвах с акцентом на гетеротрофных жгутиконосцах и голых амебах и их экологии Регулирование
Фузариоз оксиспорум
популяция, интродуцированная в почву: гипотеза амебного хищничества
Регулирование
Фузариоз оксиспорум
популяция, интродуцированная в почву: гипотеза амебного хищничества Исследование 33 бактериофагов
Rhizobium meliloti
Исследование 33 бактериофагов
Rhizobium meliloti Взаимодействие
ризобий
сп. с токсин-продуцирующим грибком в культуральной среде и в тропической почве
Взаимодействие
ризобий
сп. с токсин-продуцирующим грибком в культуральной среде и в тропической почве Роль простейшей в питательном велосипеде и потоке энергии
Роль простейшей в питательном велосипеде и потоке энергии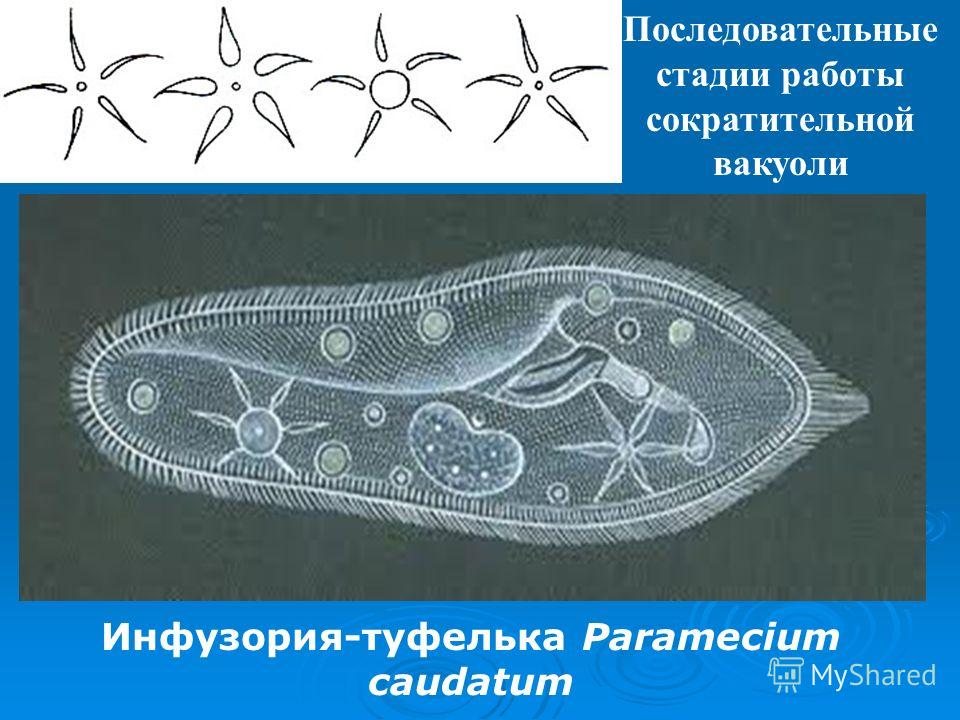 В Иране было проведено несколько исследований
В Иране было проведено несколько исследований Кроме того, мы обнаружили Blastocystis spp в шести образцах из 44 (13,63%). Отсутствовала информация о заражении
Кроме того, мы обнаружили Blastocystis spp в шести образцах из 44 (13,63%). Отсутствовала информация о заражении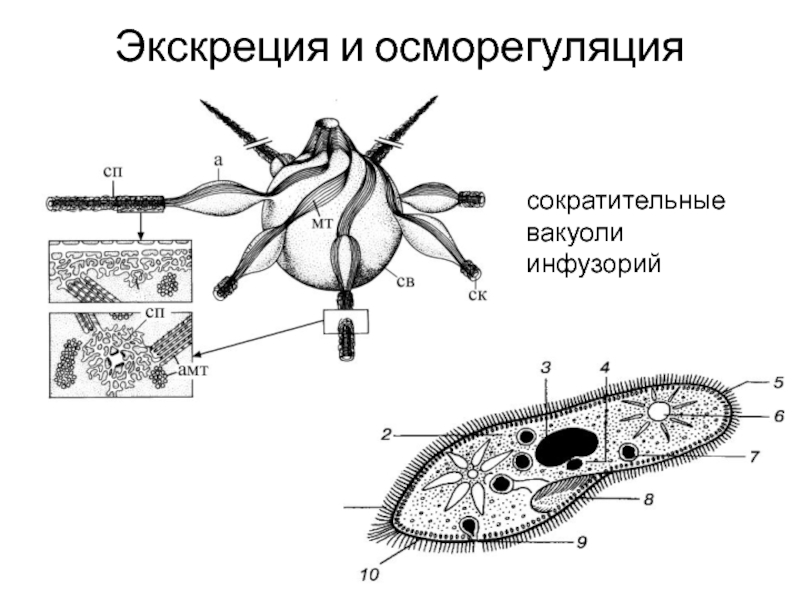 Трофозоиты
Трофозоиты
 Установлено, что
Установлено, что
 Вет Паразитол. 2004 г.; 126 (1-2): 195–217.
Вет Паразитол. 2004 г.; 126 (1-2): 195–217.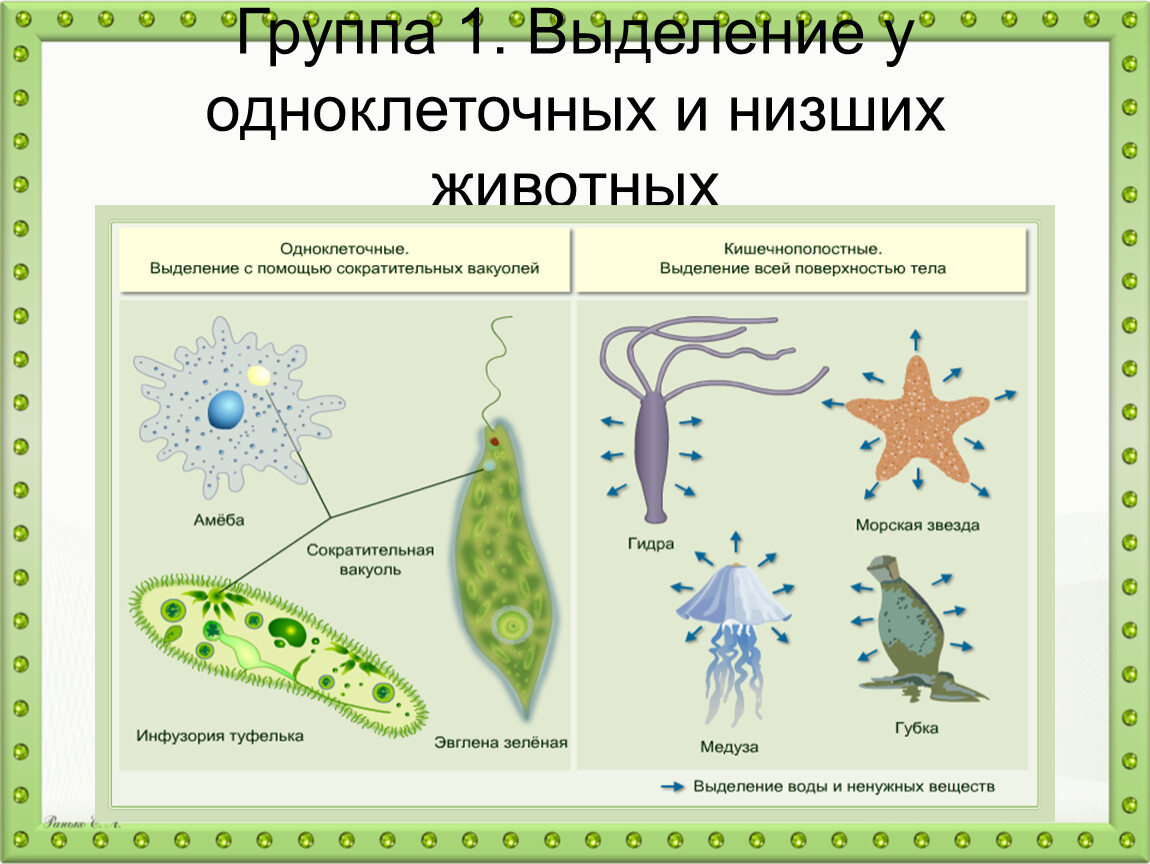 Этот протокол может быть полезен для лучшего изучения роли микроглии и астроцитов во многих контекстах и заболеваниях центральной нервной системы, таких как болезнь Альцгеймера, Паркинсона и инфекции, например, простейшие паразиты или вирусы.
Этот протокол может быть полезен для лучшего изучения роли микроглии и астроцитов во многих контекстах и заболеваниях центральной нервной системы, таких как болезнь Альцгеймера, Паркинсона и инфекции, например, простейшие паразиты или вирусы.
 После декантации осторожно удалите супернатант. Повторите промывку HBSS плюс 10% FBS еще три раза.
После декантации осторожно удалите супернатант. Повторите промывку HBSS плюс 10% FBS еще три раза. Удалите супернатант и ресуспендируйте осадок с четырьмя миллилитрами HBSS плюс 10% FBS для каждой пробирки.
Удалите супернатант и ресуспендируйте осадок с четырьмя миллилитрами HBSS плюс 10% FBS для каждой пробирки. Поместите их в напольный орбитальный шейкер при 200 об/мин и 37 градусах Цельсия на ночь, чтобы механически отделить микроглию от астроцитов.
Поместите их в напольный орбитальный шейкер при 200 об/мин и 37 градусах Цельсия на ночь, чтобы механически отделить микроглию от астроцитов.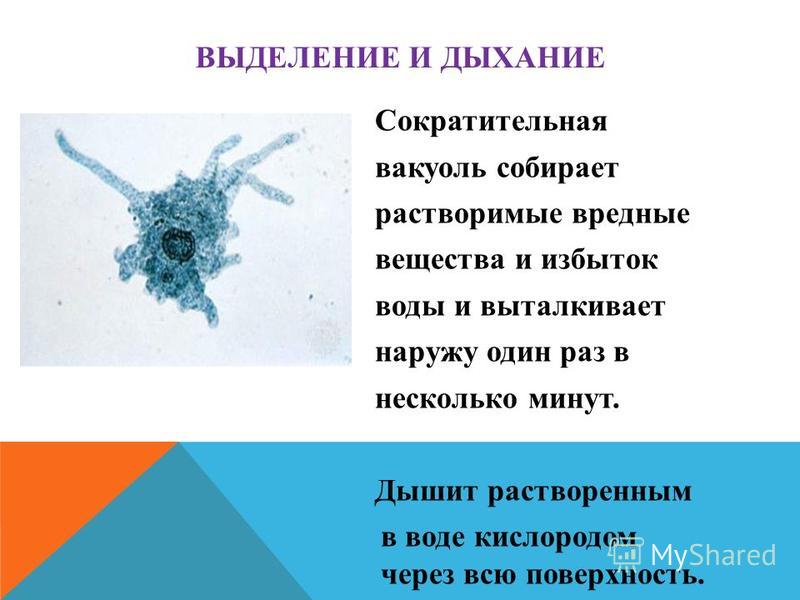 Приступайте к подсчету клеток в камере Нейбауэра или автоматическом счетчике клеток.
Приступайте к подсчету клеток в камере Нейбауэра или автоматическом счетчике клеток. gondii RH, конститутивно экспрессирующий YFP, и штамм T.cruzi Y, окрашенный некоммерческим моноклональным антителом 2C2 к белку SSP4. Важно тщательно промыть клетки, чтобы не потерять агрегаты клеток.
gondii RH, конститутивно экспрессирующий YFP, и штамм T.cruzi Y, окрашенный некоммерческим моноклональным антителом 2C2 к белку SSP4. Важно тщательно промыть клетки, чтобы не потерять агрегаты клеток.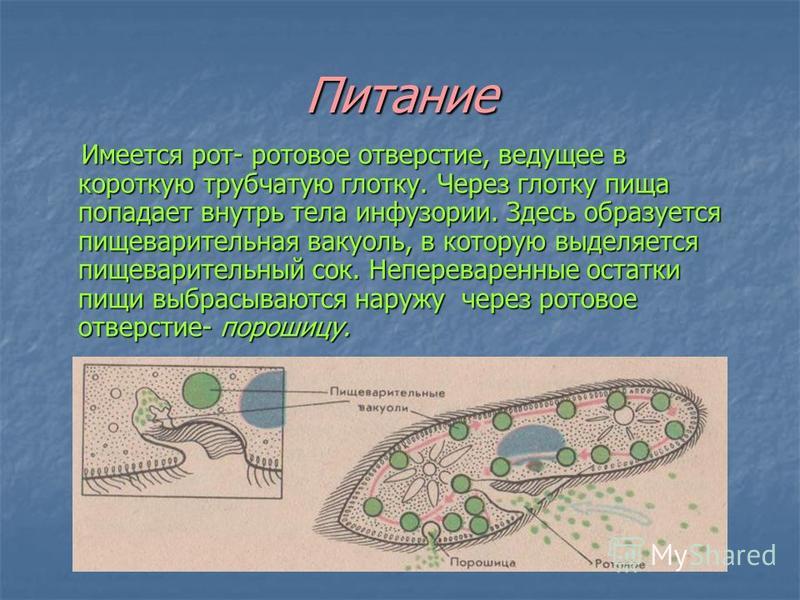 , 2012). Хотя гигантские вирусы фагоцитирующих протистов могут инфицировать самых разных хозяев, каждый вид, по-видимому, обладает специфичностью в отношении хозяина (Colson et al., 2012). Поскольку они были выделены из ограниченного числа простейших, используемых для совместного культивирования, для большинства из них естественный хозяин обычно неизвестен (Colson et al., 2012). Члены двух недавно созданных семейств Mimiviridae и Marseilleviridae были обнаружены и выделены из самых разных сред, включая образцы человека (La Scola et al., 2003, 2008; Бойер и др., 2009 г.; Арслан и др., 2011; Boughalmi et al., 2013a,b,c; Нгунга и др., 2013 г.; Саади и др., 2013a,b; Кампос и др., 2014 г.; Дорнас и др., 2014а; Шейд и др., 2014; Андраде и др., 2015; Ассис и др., 2015; Reteno et al., 2015), и на сегодняшний день с учетом протистических хозяев эти вирусы размножаются только в Acanthamoeba sp. (Ла Скола и др., 2003; Рауль и др., 2004; Колсон и др., 2013). Совсем недавно новый член Megavirales, родственный asfarviridae Faustovirus, был выделен с использованием Vermamoeba vermiformis (VV) для поддержки культуры, демонстрирующей возможное высокое разнообразие между протистами и гигантскими вирусами (Reteno et al.
, 2012). Хотя гигантские вирусы фагоцитирующих протистов могут инфицировать самых разных хозяев, каждый вид, по-видимому, обладает специфичностью в отношении хозяина (Colson et al., 2012). Поскольку они были выделены из ограниченного числа простейших, используемых для совместного культивирования, для большинства из них естественный хозяин обычно неизвестен (Colson et al., 2012). Члены двух недавно созданных семейств Mimiviridae и Marseilleviridae были обнаружены и выделены из самых разных сред, включая образцы человека (La Scola et al., 2003, 2008; Бойер и др., 2009 г.; Арслан и др., 2011; Boughalmi et al., 2013a,b,c; Нгунга и др., 2013 г.; Саади и др., 2013a,b; Кампос и др., 2014 г.; Дорнас и др., 2014а; Шейд и др., 2014; Андраде и др., 2015; Ассис и др., 2015; Reteno et al., 2015), и на сегодняшний день с учетом протистических хозяев эти вирусы размножаются только в Acanthamoeba sp. (Ла Скола и др., 2003; Рауль и др., 2004; Колсон и др., 2013). Совсем недавно новый член Megavirales, родственный asfarviridae Faustovirus, был выделен с использованием Vermamoeba vermiformis (VV) для поддержки культуры, демонстрирующей возможное высокое разнообразие между протистами и гигантскими вирусами (Reteno et al. , 2015).
, 2015).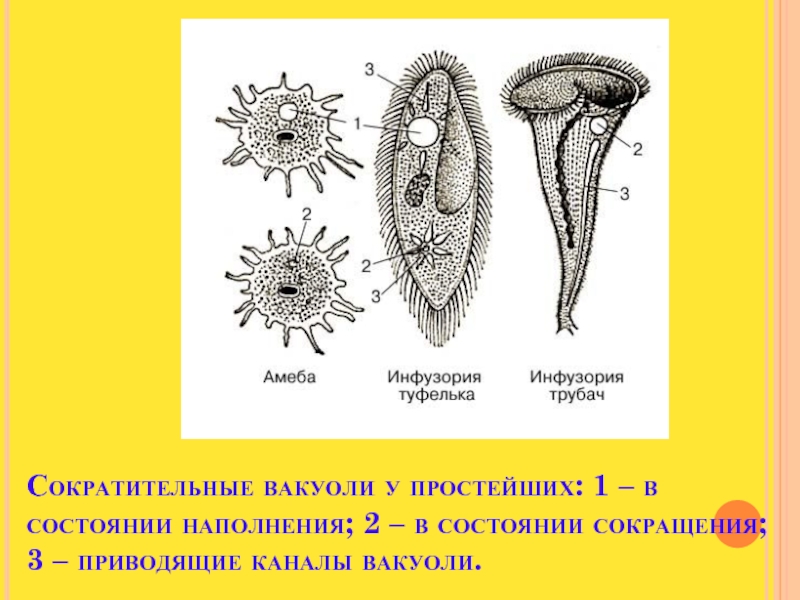 , 2003; Филипп и др., 2013 г.; Кампос и др., 2014 г.; Ла Скола, 2014; Шайд, 2014; Scheid et al., 2014), но до настоящего времени не сообщалось о сравнении различных амебных носителей. Кроме того, в бразильских образцах на сегодняшний день были выделены только мимивирусы линии А (Campos et al., 2014; Andrade et al., 2015; Assis et al., 2015). Таким образом, целью этой работы было сравнить различные сокультуры с AC, AP , Acanthamoeba griffinii (AG) и VV в качестве клеточной поддержки для поиска новых линий Mimiviridae и других гигантских вирусов в Бразилии. пробы окружающей среды.
, 2003; Филипп и др., 2013 г.; Кампос и др., 2014 г.; Ла Скола, 2014; Шайд, 2014; Scheid et al., 2014), но до настоящего времени не сообщалось о сравнении различных амебных носителей. Кроме того, в бразильских образцах на сегодняшний день были выделены только мимивирусы линии А (Campos et al., 2014; Andrade et al., 2015; Assis et al., 2015). Таким образом, целью этой работы было сравнить различные сокультуры с AC, AP , Acanthamoeba griffinii (AG) и VV в качестве клеточной поддержки для поиска новых линий Mimiviridae и других гигантских вирусов в Бразилии. пробы окружающей среды. В Участке 2 пробы отбирались там, где вода поступает после химической обработки. Третий район (Зона 3) был выбран из-за его удаленности от станции очистки сточных вод. Зона 3 представляет собой изолированную часть лагуны, которая богата органическим веществом и получает только дождевую воду. В этом районе почва находилась на краю озера, снята с самой глубокой части озера (рис. 1).
В Участке 2 пробы отбирались там, где вода поступает после химической обработки. Третий район (Зона 3) был выбран из-за его удаленности от станции очистки сточных вод. Зона 3 представляет собой изолированную часть лагуны, которая богата органическим веществом и получает только дождевую воду. В этом районе почва находилась на краю озера, снята с самой глубокой части озера (рис. 1).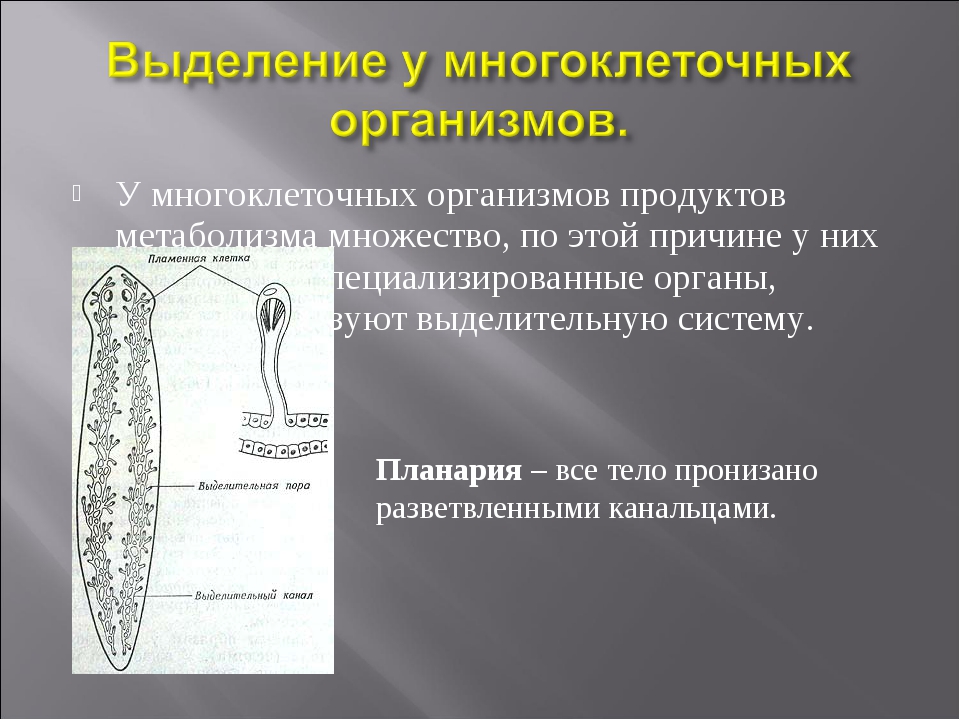 Образцы хранили при 4°C до процедур инокуляции.
Образцы хранили при 4°C до процедур инокуляции. I., Clairay, Франция), 10 мкл ванкомицина (4 мкг/мл; Mylan, Saint-Priest, Франция), 10 мкл колимицина (500 МЕ/мл; Sanofi Aventis, Париж, Франция), 10 мкл рифампицина ( 4 мкг/мл; Sanofi Aventis) и 10 мкл фунгизона (100 мкг/мл; Bristol-Myers Squibb, Rueil-Malmaison, France). Затем суспензию распределяли по 0,5 мл в лунки 24-луночного планшета с концентрацией клеток в суспензии в диапазоне 1,10 6 – 5,10 5 /мл. Каждая проба объемом 100 мкл засевалась в лунки и инкубировалась с учетом температурной специфичности роста амеб во влажной камере.Эти совместные культуры инкубировали в течение 4 дней, а затем дважды субкультивировали на свежих амебах в разведении в одну десятую, как описано выше. Через 3 дня лунки наблюдали под оптической микроскопией на третьем пассаже, а лунки с лизисом амеб дополнительно анализировали как положительные на наличие гигантских вирусов. В каждом микропланшете использовали отрицательный амебный контроль без каких-либо инокулированных образцов.
I., Clairay, Франция), 10 мкл ванкомицина (4 мкг/мл; Mylan, Saint-Priest, Франция), 10 мкл колимицина (500 МЕ/мл; Sanofi Aventis, Париж, Франция), 10 мкл рифампицина ( 4 мкг/мл; Sanofi Aventis) и 10 мкл фунгизона (100 мкг/мл; Bristol-Myers Squibb, Rueil-Malmaison, France). Затем суспензию распределяли по 0,5 мл в лунки 24-луночного планшета с концентрацией клеток в суспензии в диапазоне 1,10 6 – 5,10 5 /мл. Каждая проба объемом 100 мкл засевалась в лунки и инкубировалась с учетом температурной специфичности роста амеб во влажной камере.Эти совместные культуры инкубировали в течение 4 дней, а затем дважды субкультивировали на свежих амебах в разведении в одну десятую, как описано выше. Через 3 дня лунки наблюдали под оптической микроскопией на третьем пассаже, а лунки с лизисом амеб дополнительно анализировали как положительные на наличие гигантских вирусов. В каждом микропланшете использовали отрицательный амебный контроль без каких-либо инокулированных образцов.
 Качество и концентрацию ДНК проверяли с помощью спектрофотометра с нанокаплями (Thermo Scientific, Уолтем, Массачусетс, США). ПЦР в реальном времени для идентификации линий марсельвирусов и мимивирусов на основе зондов гидролиза проводили, как описано Ngounga et al. (2013). Вкратце, тесты проводились с использованием набора для ПЦР QuantiTec Probe (Qiagen).Анализы ПЦР выполняли с использованием 5 мкл экстрагированной ДНК (~50 нанограммов) в реакционной смеси для амплификации, содержащей 12,5 мкл 2X QuantiTec Probe PCR Master Mix, 0,5 мкл зонда с концентрацией 1 пмоль/мкл и 0,5 мкл (0,2 мкМ) прямой и обратные праймеры для анализов мимивирусов линии В и марсельвирусов или 1 мкл (0,4 мкМ) прямых и обратных праймеров для анализов мимивирусов линий А и С. Анализы ПЦР доводили до конечного объема 25 мкл добавлением воды, не содержащей РНКазы/ДНКазы. ПЦР проводили на приборе системы реального времени CFX96TM (Bio-Rad, Hercules, CA, USA).Протокол ПЦР-амплификации был следующим: 15 мин при 95°С, затем 45 циклов денатурации при 95°С в течение 30 с и отжиг/удлинение при 60°С в течение 1 мин.
Качество и концентрацию ДНК проверяли с помощью спектрофотометра с нанокаплями (Thermo Scientific, Уолтем, Массачусетс, США). ПЦР в реальном времени для идентификации линий марсельвирусов и мимивирусов на основе зондов гидролиза проводили, как описано Ngounga et al. (2013). Вкратце, тесты проводились с использованием набора для ПЦР QuantiTec Probe (Qiagen).Анализы ПЦР выполняли с использованием 5 мкл экстрагированной ДНК (~50 нанограммов) в реакционной смеси для амплификации, содержащей 12,5 мкл 2X QuantiTec Probe PCR Master Mix, 0,5 мкл зонда с концентрацией 1 пмоль/мкл и 0,5 мкл (0,2 мкМ) прямой и обратные праймеры для анализов мимивирусов линии В и марсельвирусов или 1 мкл (0,4 мкМ) прямых и обратных праймеров для анализов мимивирусов линий А и С. Анализы ПЦР доводили до конечного объема 25 мкл добавлением воды, не содержащей РНКазы/ДНКазы. ПЦР проводили на приборе системы реального времени CFX96TM (Bio-Rad, Hercules, CA, USA).Протокол ПЦР-амплификации был следующим: 15 мин при 95°С, затем 45 циклов денатурации при 95°С в течение 30 с и отжиг/удлинение при 60°С в течение 1 мин.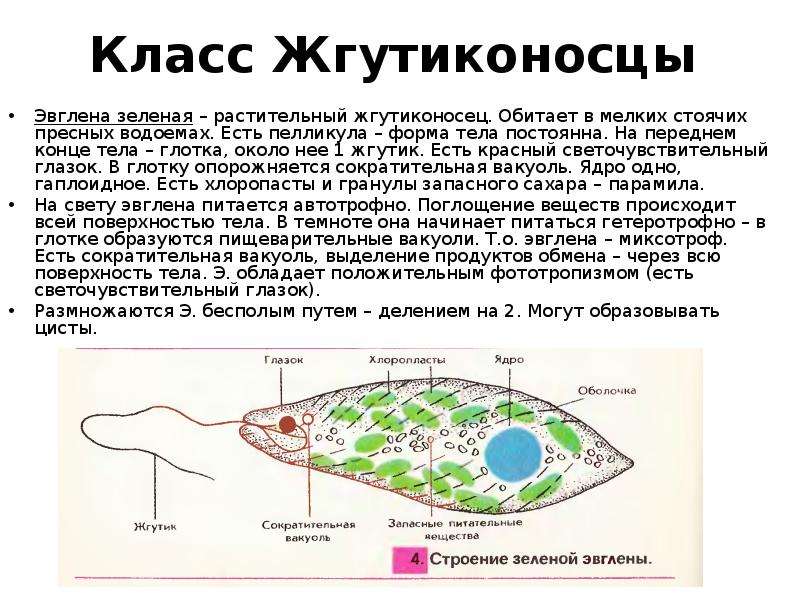 Мимивирус известной линии A, B и C и марсельвирус использовали в качестве положительных контролей.
Мимивирус известной линии A, B и C и марсельвирус использовали в качестве положительных контролей. Положительным контролем ДНК были штаммы мимивирусов линий A, B и C, регулярно поддерживаемые в лаборатории. Затем эти образцы очищали с использованием планшетов NucleoFast (Macherey-Nagel GmbH & Co. KG, Дюрен, Германия), а затем секвенировали с использованием праймеров для ПЦР, используемых в стандартном ПЦР-анализе, с использованием набора для секвенирования цикла ABI PRISM BigDye Terminator v3.1 (Applied Biosystems). , Фостер-Сити, Калифорния, США) в соответствии с инструкциями производителя. Последовательности собирали, анализировали с помощью программного обеспечения Chromaspro (Technelysium) и сравнивали с последовательностями в базе данных GenBank с использованием программного обеспечения BLAST
Положительным контролем ДНК были штаммы мимивирусов линий A, B и C, регулярно поддерживаемые в лаборатории. Затем эти образцы очищали с использованием планшетов NucleoFast (Macherey-Nagel GmbH & Co. KG, Дюрен, Германия), а затем секвенировали с использованием праймеров для ПЦР, используемых в стандартном ПЦР-анализе, с использованием набора для секвенирования цикла ABI PRISM BigDye Terminator v3.1 (Applied Biosystems). , Фостер-Сити, Калифорния, США) в соответствии с инструкциями производителя. Последовательности собирали, анализировали с помощью программного обеспечения Chromaspro (Technelysium) и сравнивали с последовательностями в базе данных GenBank с использованием программного обеспечения BLAST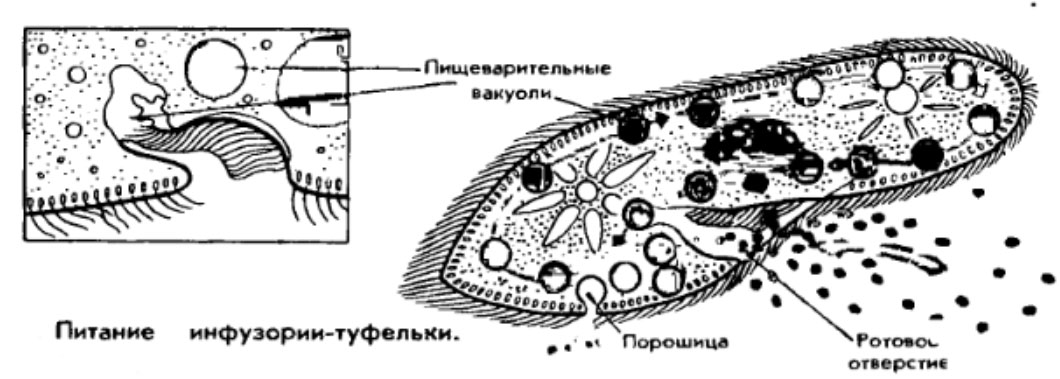
 В сетки после тлеющего разряда добавляли супернатант положительных образцов (20–40 мкл) на 10 мин для прилипания к сеткам. Образцы промывали, фиксировали и контрастировали 5% раствором молибдата аммония, повторно промывали и сушили перед электронно-микроскопическим анализом.Образцы наблюдались с помощью Morgagni 268 D (Philips), работающего при 100–60 кэВ, и Tecnai G2, работающего при 200 кэВ (дополнительный рисунок S3).
В сетки после тлеющего разряда добавляли супернатант положительных образцов (20–40 мкл) на 10 мин для прилипания к сеткам. Образцы промывали, фиксировали и контрастировали 5% раствором молибдата аммония, повторно промывали и сушили перед электронно-микроскопическим анализом.Образцы наблюдались с помощью Morgagni 268 D (Philips), работающего при 100–60 кэВ, и Tecnai G2, работающего при 200 кэВ (дополнительный рисунок S3). Вирусы происходят от одного и того же вида, и линии, обнаруженные с помощью ПЦР, представлены одним цветом. Пересечение круга показывает, что изоляты вирусов происходят из одних и тех же образцов окружающей среды на разных платформах выделения.Вся небольшая графика внутри круга представляет вид и родословную, обнаруженные с помощью ПЦР. Мимивирусы, которые не были обнаружены с помощью ПЦР, также представлены. Также указано количество и процент выделенных вирусов.
Вирусы происходят от одного и того же вида, и линии, обнаруженные с помощью ПЦР, представлены одним цветом. Пересечение круга показывает, что изоляты вирусов происходят из одних и тех же образцов окружающей среды на разных платформах выделения.Вся небольшая графика внутри круга представляет вид и родословную, обнаруженные с помощью ПЦР. Мимивирусы, которые не были обнаружены с помощью ПЦР, также представлены. Также указано количество и процент выделенных вирусов. Самый высокий процент изоляции был в AP (46,38%), за которым следуют AC (39,13%) и AG (14,49%). В ВВ вирус не был выделен. Среди всех выделенных вирусов наиболее распространенным был мимивирус линии А (79,73%), за которым следовали мимивирусы линии С (4,35%) и мимивирусы линии В (1,45%). Необнаруженные линии мимивирусов представлены 10.15% изолятов. Также были выделены один марсельвирус (1,45%) и один пандоравирус (1,45%). В AG Mimivirus была выделена только линия A, в то время как AP позволил выделить все линии мимивирусов, а AC продемонстрировал возможную изоляцию различных видов гигантских вирусов Marseillevirus и Pandoravirus. (Таблица 1; Рисунок 2).
Самый высокий процент изоляции был в AP (46,38%), за которым следуют AC (39,13%) и AG (14,49%). В ВВ вирус не был выделен. Среди всех выделенных вирусов наиболее распространенным был мимивирус линии А (79,73%), за которым следовали мимивирусы линии С (4,35%) и мимивирусы линии В (1,45%). Необнаруженные линии мимивирусов представлены 10.15% изолятов. Также были выделены один марсельвирус (1,45%) и один пандоравирус (1,45%). В AG Mimivirus была выделена только линия A, в то время как AP позволил выделить все линии мимивирусов, а AC продемонстрировал возможную изоляцию различных видов гигантских вирусов Marseillevirus и Pandoravirus. (Таблица 1; Рисунок 2).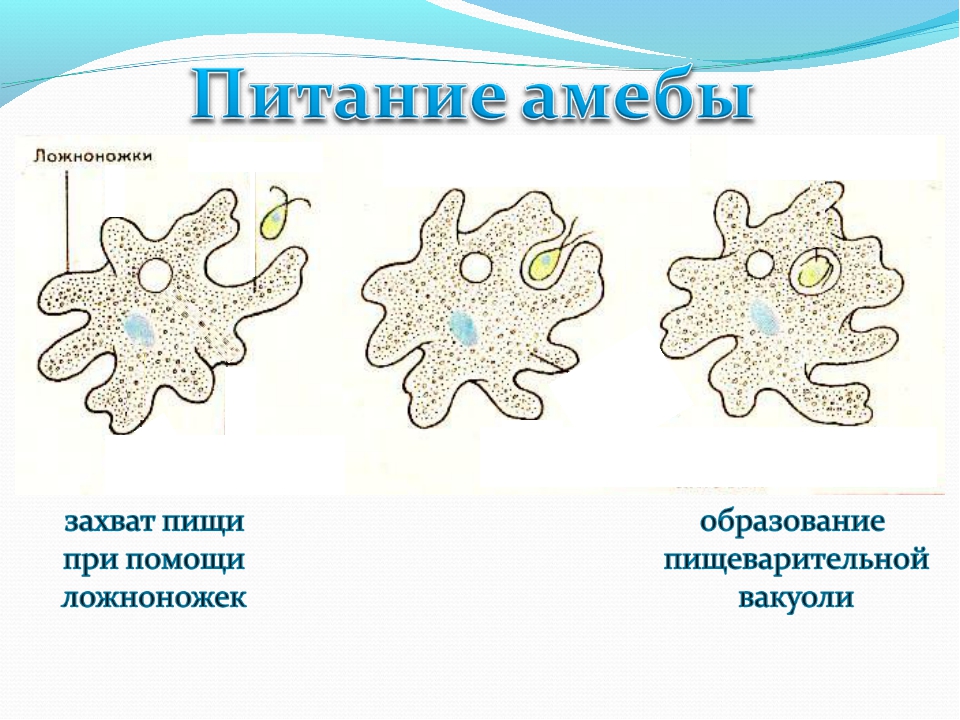 (Таблица 1; Рисунок 2).
(Таблица 1; Рисунок 2).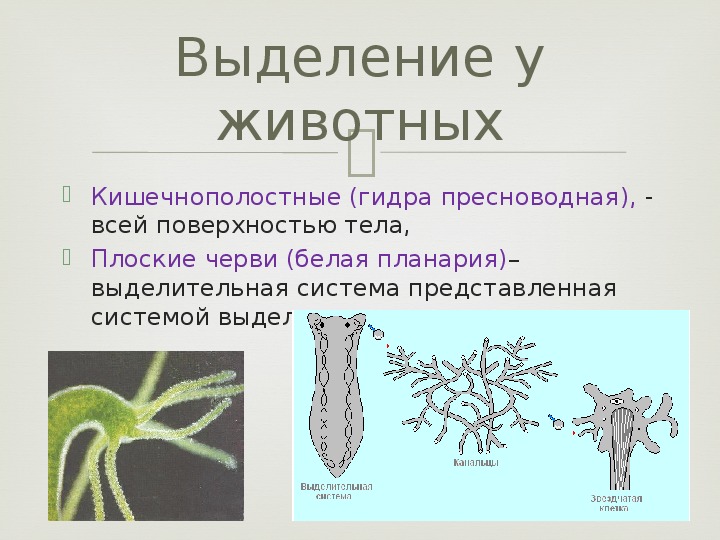 94%) и 15 из Зоны 3 (21,74%) были выделены в АС. В АГ были выделены два гигантских вируса (2,9%) из зоны 1, шесть вирусов из зоны 2 (8,7%) и два вируса из зоны 3 (2,9%).
94%) и 15 из Зоны 3 (21,74%) были выделены в АС. В АГ были выделены два гигантских вируса (2,9%) из зоны 1, шесть вирусов из зоны 2 (8,7%) и два вируса из зоны 3 (2,9%).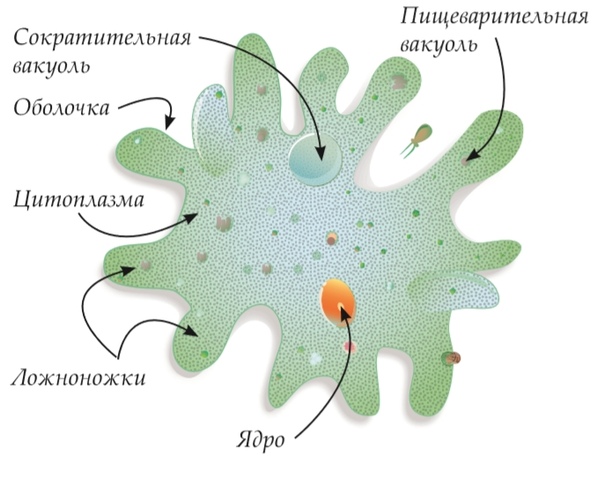 , 2003) многие гигантские вирусы были обнаружены и выделены из различных сред и даже у людей (La Scola et al., 2003, 2008; Арслан и др., 2011; Саади и др., 2013a,b; Кампос и др., 2014 г.; Дорнас и др., 2014а; Шейд и др., 2014; Андраде и др., 2015; Ассис и др., 2015; Ретено и др., 2015). Выделение и обнаружение происходили с разной частотой в разных исследованных образцах, с низким уровнем положительных результатов обнаружения и выделения в бронхоальвеолярном лаваже и фекалиях (Saadi et al., 2013a,b) и более сильными положительными результатами в почве, воде и сточных водах (Pagnier et al. al., 2013; Campos et al., 2014; Dornas et al., 2014a,b; Assis et al., 2015; Ретено и др., 2015). Выбранные здесь образцы окружающей среды ранее были описаны как источники для выделения многочисленных гигантских вирусов (Gaze et al., 2011; Pagnier et al., 2013; Philippe et al., 2013; Assis et al., 2015; Reteno et al., 2015) и представляют собой хороший набор образцов для сравнения различных амеб по их способности выделять гигантские вирусы.
, 2003) многие гигантские вирусы были обнаружены и выделены из различных сред и даже у людей (La Scola et al., 2003, 2008; Арслан и др., 2011; Саади и др., 2013a,b; Кампос и др., 2014 г.; Дорнас и др., 2014а; Шейд и др., 2014; Андраде и др., 2015; Ассис и др., 2015; Ретено и др., 2015). Выделение и обнаружение происходили с разной частотой в разных исследованных образцах, с низким уровнем положительных результатов обнаружения и выделения в бронхоальвеолярном лаваже и фекалиях (Saadi et al., 2013a,b) и более сильными положительными результатами в почве, воде и сточных водах (Pagnier et al. al., 2013; Campos et al., 2014; Dornas et al., 2014a,b; Assis et al., 2015; Ретено и др., 2015). Выбранные здесь образцы окружающей среды ранее были описаны как источники для выделения многочисленных гигантских вирусов (Gaze et al., 2011; Pagnier et al., 2013; Philippe et al., 2013; Assis et al., 2015; Reteno et al., 2015) и представляют собой хороший набор образцов для сравнения различных амеб по их способности выделять гигантские вирусы.
 , 2014; Andrade et al., 2015; Assis et al., 2015). Хотя этот метод позволяет изолировать мимивирусы линии А, предыдущий метод продемонстрировал низкий уровень положительных результатов (1,2%), что позволяет предположить, что прямая инокуляция, выбранная для этого проекта, более чувствительна, чем методы, о которых сообщалось ранее (Arslan et al., 2011; Дорнас и др., 2014b).
, 2014; Andrade et al., 2015; Assis et al., 2015). Хотя этот метод позволяет изолировать мимивирусы линии А, предыдущий метод продемонстрировал низкий уровень положительных результатов (1,2%), что позволяет предположить, что прямая инокуляция, выбранная для этого проекта, более чувствительна, чем методы, о которых сообщалось ранее (Arslan et al., 2011; Дорнас и др., 2014b). , 2013b) и пиявки вида Eristalis tenax (Boughalmi et al., 2013с). Виды сначала дезинфицировали спиртом (Slimani et al., 2013), затем части органов мацерировали отдельно, а затем инокулировали в кокультуре амеб на чашках с агаром (Boughalmi et al., 2013а).
, 2013b) и пиявки вида Eristalis tenax (Boughalmi et al., 2013с). Виды сначала дезинфицировали спиртом (Slimani et al., 2013), затем части органов мацерировали отдельно, а затем инокулировали в кокультуре амеб на чашках с агаром (Boughalmi et al., 2013а). , Pandoravirus sp. и Faustovirus sp. (La Scola et al., 2010; Boughalmi et al., 2013a; Ngounga et al., 2013; Pagnier et al., 2013; Philippe et al., 2013). Однако высокое генетическое разнообразие может объяснить трудности в амплификации некоторых сохранившихся специфичных для линии участков, что описывается генетическим полиморфизмом (Dornas et al., 2014а; Андраде и др., 2015; Сантос Силва и др., 2015). Примечательно, что в этой работе тщательно проанализирована причина ПЦР-негативных гигантских вирусов, обнаруженных ранее путем лизиса амеб и наблюдаемых с помощью оптической микроскопии в пятнах.
, Pandoravirus sp. и Faustovirus sp. (La Scola et al., 2010; Boughalmi et al., 2013a; Ngounga et al., 2013; Pagnier et al., 2013; Philippe et al., 2013). Однако высокое генетическое разнообразие может объяснить трудности в амплификации некоторых сохранившихся специфичных для линии участков, что описывается генетическим полиморфизмом (Dornas et al., 2014а; Андраде и др., 2015; Сантос Силва и др., 2015). Примечательно, что в этой работе тщательно проанализирована причина ПЦР-негативных гигантских вирусов, обнаруженных ранее путем лизиса амеб и наблюдаемых с помощью оптической микроскопии в пятнах. В настоящем исследовании АГ впервые использовали в качестве амебной подложки для выделения гигантских вирусов. По-видимому, он обладает меньшей чувствительностью к изоляции и специфичностью, чем другие носители клеток, хотя все еще невозможно сделать вывод, связано ли это с этой конкретной амебой или с температурой инкубации, используемой для этого вида, которая могла иметь ограниченную первичную изоляцию гигантских вирусов.
В настоящем исследовании АГ впервые использовали в качестве амебной подложки для выделения гигантских вирусов. По-видимому, он обладает меньшей чувствительностью к изоляции и специфичностью, чем другие носители клеток, хотя все еще невозможно сделать вывод, связано ли это с этой конкретной амебой или с температурой инкубации, используемой для этого вида, которая могла иметь ограниченную первичную изоляцию гигантских вирусов.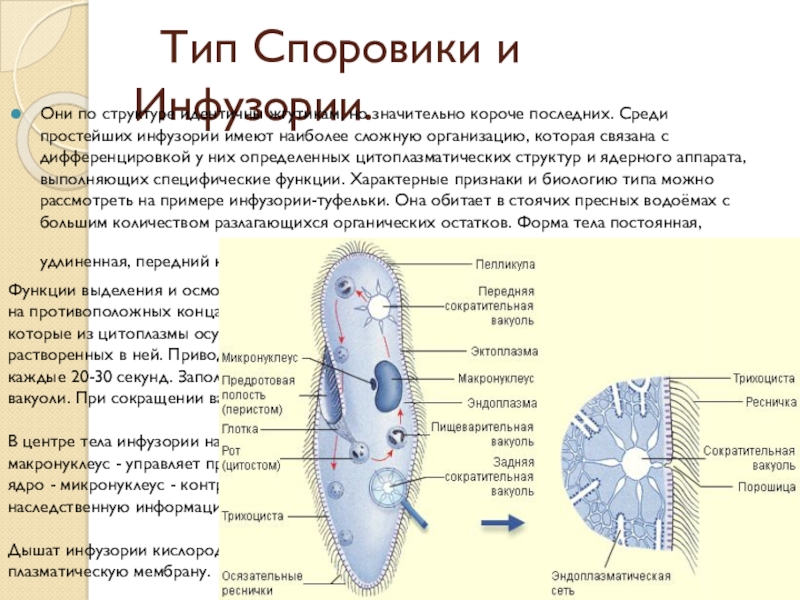 Возможными объяснениями могут быть генетическое разнообразие, такое как гены, участвующие в трансляции РНК, процесс трансляции генов, а также факторы, участвующие в размножении вирусов. Более того, этот тропизм может свидетельствовать о том, что гигантские вирусы эволюционировали вместе со своим хозяином.
Возможными объяснениями могут быть генетическое разнообразие, такое как гены, участвующие в трансляции РНК, процесс трансляции генов, а также факторы, участвующие в размножении вирусов. Более того, этот тропизм может свидетельствовать о том, что гигантские вирусы эволюционировали вместе со своим хозяином. Марсельвирус был выделен выше по течению от химической очистки сточных вод, а пандоравирус — из изолированного участка лагуны.Для редких гигантских вирусов, выделенных из сточных вод, будет трудно сопоставить их с изолятами, полученными при очистке сточных вод. Другими словами, тот факт, что мы выделили только один марсельвирус из сточных вод, не может позволить нам установить связь между химически обработанными сточными водами и удаленными сточными водами, потому что разнообразие имеет большое значение для корреляции между средами. В этой работе мы можем выдвинуть гипотезу, чтобы попытаться понять, как эти вирусы циркулируют в природе. Благодаря этим результатам мы можем предположить, что некоторые виды гигантских вирусов могут проявлять специфичность к хозяину Acanthamoeba .Кроме того, с бразильскими образцами окружающей среды мы подтвердили высокую частоту мимивирусов линии А, а также различия в сродстве вирусов к разным амебам, используемым в качестве платформ для процедуры выделения.
Марсельвирус был выделен выше по течению от химической очистки сточных вод, а пандоравирус — из изолированного участка лагуны.Для редких гигантских вирусов, выделенных из сточных вод, будет трудно сопоставить их с изолятами, полученными при очистке сточных вод. Другими словами, тот факт, что мы выделили только один марсельвирус из сточных вод, не может позволить нам установить связь между химически обработанными сточными водами и удаленными сточными водами, потому что разнообразие имеет большое значение для корреляции между средами. В этой работе мы можем выдвинуть гипотезу, чтобы попытаться понять, как эти вирусы циркулируют в природе. Благодаря этим результатам мы можем предположить, что некоторые виды гигантских вирусов могут проявлять специфичность к хозяину Acanthamoeba .Кроме того, с бразильскими образцами окружающей среды мы подтвердили высокую частоту мимивирусов линии А, а также различия в сродстве вирусов к разным амебам, используемым в качестве платформ для процедуры выделения.
 (G) показывают частицу вируса Пандоры. Оригинальное увеличение ×1000. (A) Отрицательный контроль Acanthamoeba castellanii ; (B) AC BZ 01 Марсельвирус; (C) AC BZ 16 Мимивирус; (D) AC BZ 24 Мимивирус; (E) AP BZ 04 Мимивирус; (F) AP BZ 87 Мимивирус; (G) AC BZ 81 Пандоравирус.
(G) показывают частицу вируса Пандоры. Оригинальное увеличение ×1000. (A) Отрицательный контроль Acanthamoeba castellanii ; (B) AC BZ 01 Марсельвирус; (C) AC BZ 16 Мимивирус; (D) AC BZ 24 Мимивирус; (E) AP BZ 04 Мимивирус; (F) AP BZ 87 Мимивирус; (G) AC BZ 81 Пандоравирус.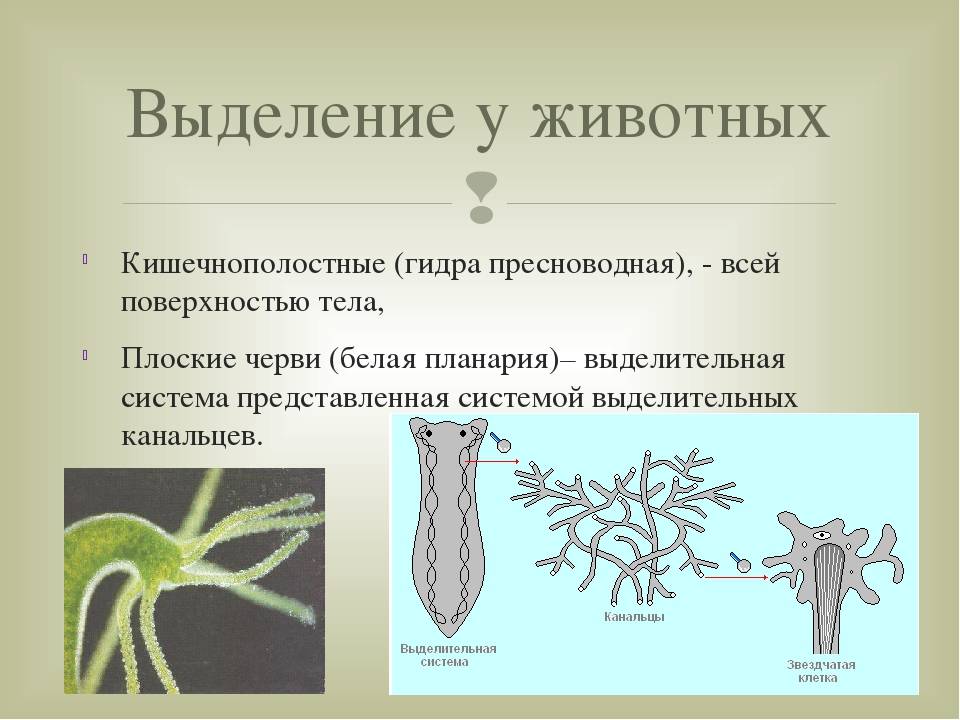
 дои: 10.3390/v7072782
дои: 10.3390/v7072782 дои: 10.1159/000354560
дои: 10.1159/000354560 Вирол. J. 11, 95. doi: 10.1186/1743-422X-11-95
Вирол. J. 11, 95. doi: 10.1186/1743-422X-11-95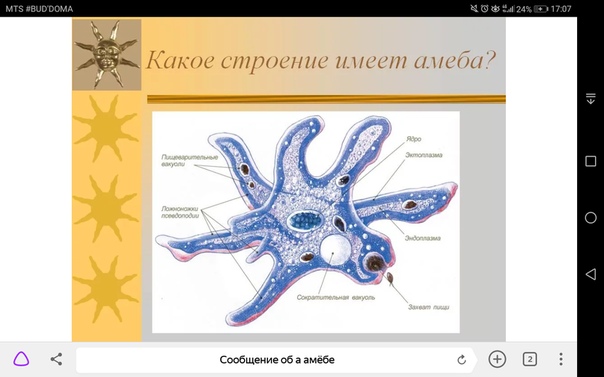 20, 469–472.doi: 10.3201/eid2003.131050
20, 469–472.doi: 10.3201/eid2003.131050 Экстренный. Заразить. Дис. 17, 1127–1129.дои: 10.3201/eid1706.101282
Экстренный. Заразить. Дис. 17, 1127–1129.дои: 10.3201/eid1706.101282 , Desnues, C., Pagnier, I., Robert, C., Barrassi, L., Fournous, G., et al. (2008). Вирофаг как уникальный паразит гигантского мимивируса. Природа 455, 100–104. doi: 10.1038/nature07218
, Desnues, C., Pagnier, I., Robert, C., Barrassi, L., Fournous, G., et al. (2008). Вирофаг как уникальный паразит гигантского мимивируса. Природа 455, 100–104. doi: 10.1038/nature07218 Наука 341, 281. doi: 10.1126/science.1239181
Наука 341, 281. doi: 10.1126/science.1239181 , Ретено, Д.Г., Колсон, П., Ахерфи, С., Минодье, П., Панье, И., и соавт. (2013б). Вирус Шан: новый мимивирус, выделенный из стула тунисского пациента с пневмонией. Интервирусология 56, 424–429. дои: 10.1159/000354564
, Ретено, Д.Г., Колсон, П., Ахерфи, С., Минодье, П., Панье, И., и соавт. (2013б). Вирус Шан: новый мимивирус, выделенный из стула тунисского пациента с пневмонией. Интервирусология 56, 424–429. дои: 10.1159/000354564 , Панье, И., Бугалми, М., Рауль, Д., и Ла Скола, Б. (2013). Процедура спиртовой дезинфекции для выделения гигантских вирусов из зараженных образцов. Интервирусология 56, 434–440. дои: 10.1159/000354566
, Панье, И., Бугалми, М., Рауль, Д., и Ла Скола, Б. (2013). Процедура спиртовой дезинфекции для выделения гигантских вирусов из зараженных образцов. Интервирусология 56, 434–440. дои: 10.1159/000354566