Валентность хрома (Cr), формулы и примеры
Общие сведения о валентности хрома
Хром в виде простого вещества – серовато-белый блестящий металл. Имеет структуру объемно-центрированной кубической решетки.Плотность – 7,2 г/см3. Температуры плавления и кипения равны 1890oС и 2680oС, соответственно.
Валентность хрома в соединениях
Хром находится в четвертом периоде в VIB группе Периодической таблицы Д.И. Менделеева. Порядковый номер равен 24. В ядре атома хрома содержится 24 протона и 28 нейтронов (массовое число равно 52). В атоме хрома есть четыре энергетических уровня, на которых находятся 24 электрона (рис. 1).
Рис. 1. Строения атома хрома.
Электронная формула атома хрома в основном состоянии имеет следующий вид:
1s22s22p63s23p63d54s1.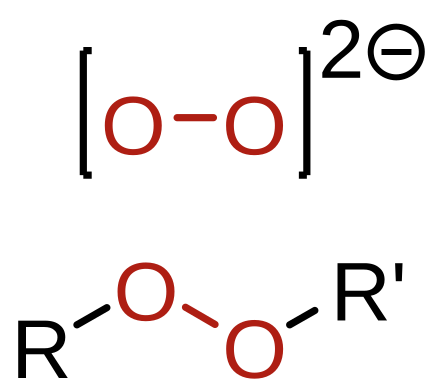
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие шести неспаренных электронов свидетельствует о том, что хром в своих соединениях может проявлять валентность IV (CrVIO3, CrVICl6, CrIVO2Cl6, K2CrVI2O7 и т.д.).
Известно, что для хрома также характерны валентности II (CrIIO, CrII(OH)2, CrIICl2) и III(CrIII2O3, CrIII(OH)3, KCrIIIO2, CrIIICl3).
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
а) запишите полную электронную формулу, б) запишите формулу валентных электронов, в) изобразите графическую формулу валентных [Решение №18557]
Напишите мне в whatsapp, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
Закажите у меня новую работу, просто написав мне в whatsapp! |
Описание заказа и 38% решения ( + фото):
Для молибдена и селена: а) запишите полную электронную формулу, б) запишите формулу валентных электронов, в) изобразите графическую формулу валентных электронов, в) укажите количество неспаренных электронов, г) укажите валентные возможности атома, д) охарактеризуйте валентные электроны с помощью квантовых чисел, е) укажите суммарный спин системы.
Ответ:
Молибден Мо является элементом периода группы Периодической системы, имеет порядковый номер . Поэтому атом молибдена содержит электрона, которые находятся на энергетических уровнях. а) Полная электронная формула: б) Валентные электроны: в) Графическая формула валентных электронов: в) Количество неспаренных электронов равно . г) Валентные возможности определяются количеством неспаренных электронов. Максимальная валентность молибдена равна . д) Квантовые числа валентных электронов: е) Суммарный спин системы равен: Селен является элементом периода группы Периодической системы, имеет порядковый номер . Поэтому атом селена содержит электрона, которые находятся на энергетических уровнях. На последнем энергетическом уровне находится электронов. а) Полная электронная формула: б) Валентные электроны: в) Графическая формула валентных электронов: в) В основном состоянии количество неспаренных электронов равно . При сообщении атому селена дополнительной энергии он может переходить в возбужденное состояние с переходом одного электрона с подуровень: В этом состоянии количество неспаренных электронов равно .
Похожие готовые решения по химии:
- На примере оксидов элементов третьего периода покажите закономерность изменения основных свойств. Приведите уравнения реакций
- Для бария и ртути: а) запишите полную электронную формулу, б) запишите формулу валентных электронов, в) изобразите графическую формулу валентных
- Для платины и селена: а) запишите полную электронную формулу, б) запишите формулу валентных электронов, в) изобразите графическую формулу валентных
- Как определить положение элемента в периодической системе по его электронной формуле? Электронная формула валентных электронов атома некоторого
- Для реакций HCl + CrO3 Cl2 + CrCl3 + h3O ; Cd + KMnO4 + h3SO4 CdSO4 + MnSO4 + K2SO4 + h3O а) составьте баланс степеней окисления и укажите, какой процесс — окисление
- Вычислите количество цис-дихлорэтилена в равновесной смеси ClHC=CHCl → ClHC=CHCl транс цис при Т=500 К и Р = 1,01325∙105 Па, если в исходном состоянии присутствует
- Определите, в каком направлении пойдет реакция CO + Cl2 = COCl2 при 500 К и Р = 101.
 325∙105 Па
325∙105 Па - Рассчитайте массовую долю кислоты аскорбиновой в «Solutio Acidi ascorbinicipro injectionibus», если на 5 мл раствора пошло 5,9 мл 0,5 н раствора йодата калия. Плотность
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Как вы работаете?
Вам нужно написать сообщение в WhatsApp . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения.
Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас.
Теперь напишите мне в Whatsapp или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/Clc1txB_PxE» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/7Oesl-SOw2I» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/TDbubCz4IMs» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Что такое CrCl3 в химии? — Ответы на все
Что такое CrCl3 в химии?
Хлорид хрома (III) (также называемый хлоридом хрома) описывает любое из нескольких соединений с формулой CrCl3 • xh3O, где x может принимать значения 0, 5 и 6. Безводное соединение с формулой CrCl3 представляет собой фиолетовое твердое вещество.
Безводное соединение с формулой CrCl3 представляет собой фиолетовое твердое вещество.
Для чего используется хлорид хрома?
Трихлорид хрома (3+) представляет собой хлорид хрома с катионом хрома в степени окисления +3. Он играет роль кислоты Льюиса и сенсибилизатора.Хлорид хрома для инъекций представляет собой стерильный апирогенный раствор, предназначенный для использования в качестве добавки к растворам для полного парентерального питания (ППП).
Является ли CrCl3 кислотным или основным?
ионов хрома (III) являются кислыми из-за высокой плотности заряда иона. Это означает, что образующийся в водном растворе гексаакваион может отдавать ионы Н+ в раствор.
Как называется CrCl6?
Хлорид хрома
Является ли crcl3 диамагнитным?
Ответ.. Поскольку у него нет неспаренных электронов, он диамагнитен.
Как узнать, является ли предмет диамагнетиком или парамагнетиком?
Магнитные свойства вещества можно определить, изучив его электронную конфигурацию: если в нем есть неспаренные электроны, то вещество парамагнитно, а если все электроны спарены, то вещество диамагнитно.
Что вызывает парамагнетизм?
Парамагнетизм обусловлен наличием в материале неспаренных электронов, поэтому большинство атомов с не полностью заполненными атомными орбиталями являются парамагнитными, хотя существуют исключения, такие как медь.Внешнее магнитное поле заставляет спины электронов ориентироваться параллельно полю, вызывая чистое притяжение.
Что такое парамагнетизм и диамагнетизм?
Всякий раз, когда два электрона образуют пару на одной орбитали или их общий спин равен 0, они являются диамагнитными электронами. Атомы со всеми диамагнитными электронами называются диамагнитными атомами. Парамагнитный электрон — это неспаренный электрон. Атом считается парамагнитным, если хотя бы одна орбиталь имеет чистый спин.
В чем разница между парамагнетизмом, диамагнетизмом и ферромагнетизмом?
Суммарный магнитный момент диамагнетика равен нулю в отсутствие внешнего магнитного поля.Суммарный магнитный момент ферромагнитного вещества равен нулю, поскольку в отсутствие внешнего магнитного поля магнитные моменты доменов располагаются случайным образом.
Что означает диамагнетизм?
: имеющий магнитную проницаемость меньше, чем у вакуума : слегка отталкивается магнитом.
В чем разница между парамагнетизмом, диамагнетизмом и ферромагнетизмом?
Материал является диамагнитным, если значение χ маленькое и отрицательное, парамагнитным, если значение χ малое и положительное, и ферромагнитным, если значение большое и положительное.В этом разделе мы узнаем больше об этих веществах и о том, как они классифицируются на основе их восприимчивости.
Как узнать, является ли вещество ферромагнитным?
Ферромагнитные материалы — это материалы, которые проявляют спонтанную результирующую намагниченность на атомном уровне даже в отсутствие внешнего магнитного поля. При помещении во внешнее магнитное поле ферромагнитные материалы сильно намагничиваются в направлении поля.
Какое вещество лучше подходит для постоянных магнитов?
Ферромагнитные вещества
Какой элемент обладает самыми высокими ферромагнитными свойствами?
Кобальт
Какие 3 ферромагнитных материала?
Наиболее распространены железо, кобальт, никель и большинство их сплавов, а также некоторые соединения редкоземельных металлов.
Какие три металла являются ферромагнитными?
Список магнитных металлов
- Железо. Железо — чрезвычайно известный ферромагнитный металл.
- Никель. Никель — еще один популярный магнитный металл с ферромагнитными свойствами.
- Кобальт. Кобальт является важным ферромагнитным металлом.
- Сталь.
- Нержавеющая сталь.
- Редкоземельные металлы.
- Алюминий.
- Золото.
Является ли золото ферромагнитным?
Чистое золото не является ферромагнитным.Но некоторые сплавы золота могут быть слегка ферромагнитными из-за присутствия в сплаве других атомов. Золото диамагнитно, как медь и пиролитический графит. Однако диамагнетизм намного слабее магнетизма и ферромагнетизма.
Можно ли найти золото с помощью магнита?
Золото НЕ притягивается к магниту. Чистое золото не притягивается к магнитным полям, но если к золоту приложить огромное магнитное поле, золото слегка сдвинется, а затем слегка оттолкнет его. Однако это лишь незначительно, и поэтому нет, его нельзя найти с помощью магнитов.
Однако это лишь незначительно, и поэтому нет, его нельзя найти с помощью магнитов.
Что подберет золото?
Железо. В случае большей части золота, которое вы притягиваете магнитом, именно из-за содержания железа его можно поднять. Железо обладает магнитными свойствами, и, помимо стали, это будет один из самых распространенных металлов, с которыми вы столкнетесь, когда будете ловить рыбу с помощью магнита.
Металлоискатели обнаруживают золото?
Например, все металлодетекторы находят золото, но есть разные типы, более чувствительные к золоту и специально для него.Итак, если вы заинтересованы исключительно в поиске золотых украшений, вам нужно выбрать детектор, созданный специально для этой цели. Некоторые металлоискатели водонепроницаемы.
Поднимет ли магнит украшения?
Эти крошечные детали могут проявлять слабый магнетизм. В этих случаях магнит, используемый, например, для магнитной рыбалки, может собирать украшения, такие как цепочки, браслеты и серьги. Так что, если ваше «чистое золото» магнитится, то, возможно, внутри есть железо.
Так что, если ваше «чистое золото» магнитится, то, возможно, внутри есть железо.
хромоцен | 1271-24-5-Молбасе
Раздел 1 — Химический продукт Название MSDS: Паспорт безопасности материала Chromocene. Синоним: Dicyclopentadienylchromium
.
Фразы риска: 36/37/38
Раздел 3 – ИДЕНТИФИКАЦИЯ ОПАСНОСТЕЙ
ОБЗОР АВАРИЙНЫХ ПОЛОЖЕНИЙ
Раздражает глаза, дыхательные пути и кожу.Токсикологические свойства этого материала полностью не исследованы.
Потенциальное воздействие на здоровье
Глаза:
Вызывает раздражение глаз. Может вызвать химический конъюнктивит.
Кожа:
Вызывает раздражение кожи.
Проглатывание:
Может вызывать раздражение желудочно-кишечного тракта с тошнотой, рвотой и диареей.
 Токсикологические свойства этого вещества полностью не исследованы.
Токсикологические свойства этого вещества полностью не исследованы. Вдыхание:
Вызывает раздражение дыхательных путей. Токсикологические свойства этого вещества полностью не исследованы.Может вызвать отсроченный отек легких.
Хронический:
Эффекты могут быть отсрочены. Было показано, что хроническое воздействие нерастворимых в воде соединений шестивалентного хрома связано с раком легких и опухолями желудочно-кишечного тракта.
Раздел 4 — МЕРЫ ПЕРВОЙ ПОМОЩИ
Глаза: немедленно промойте глаза большим количеством воды в течение не менее 15 минут, время от времени приподнимая верхние и нижние веки. Получить медицинскую помощь.
Кожа:
Получить медицинскую помощь. Промойте кожу большим количеством воды в течение не менее 15 минут, сняв загрязненную одежду и обувь.Стирайте одежду перед повторным использованием.
Проглатывание:
Никогда ничего не давайте в рот человеку, находящемуся без сознания. Получить медицинскую помощь.
 Не вызывает рвоту. Если человек в сознании и насторожен, прополощите рот и выпейте 2–4 стакана молока или воды.
Не вызывает рвоту. Если человек в сознании и насторожен, прополощите рот и выпейте 2–4 стакана молока или воды. При вдыхании:
Немедленно удалить из зоны воздействия и вывести на свежий воздух. Если человек не дышит, сделайте ему искусственно дыхание. Если дыхание затруднено, дайте кислород. Получить медицинскую помощь.
Примечания для врача:
Симптоматическое и поддерживающее лечение.
Раздел 5 — ПРОТИВОПОЖАРНЫЕ МЕРЫ
Общая информация:
Как и при любом пожаре, надевайте автономный дыхательный аппарат в условиях потребности под давлением, одобренный MSHA/NIOSH (утвержденный или эквивалентный), и полное защитное снаряжение.Во время пожара в результате термического разложения или горения могут образовываться раздражающие и высокотоксичные газы.
Средства пожаротушения:
Используйте средство, наиболее подходящее для тушения пожара. Используйте распыление воды, сухой химикат, двуокись углерода или соответствующую пену.
Раздел 6 – МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Общая информация: Используйте надлежащие средства индивидуальной защиты, как указано в Разделе 8.
Разливы/утечки:
Пропылесосить или подмести материал и поместить в подходящий контейнер для утилизации.Избегайте стока в ливневую канализацию и канавы, ведущие к водотокам. Немедленно убирайте разливы, соблюдая меры предосторожности, описанные в разделе «Средства защиты». Избегайте создания пыльных условий.
Обеспечить вентиляцию.
Раздел 7 – ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение:
Тщательно вымыть после обработки. Снять загрязненную одежду и выстирать перед повторным использованием. Используйте при достаточной вентиляции. Сведите к минимуму образование и накопление пыли. Избегайте попадания в глаза, на кожу и одежду.Держите контейнер плотно закрытым. Избегать проглатывания и вдыхания.
Хранение:
Хранить в плотно закрытой таре. Хранить в прохладном, сухом, хорошо проветриваемом помещении вдали от несовместимых веществ.
Раздел 8 – КОНТРОЛЬ ВОЗДЕЙСТВИЯ, ИНДИВИДУАЛЬНАЯ ЗАЩИТА
Технические средства контроля:
Помещения для хранения или использования этого материала должны быть оборудованы устройством для промывания глаз и аварийным душем. Используйте адекватную вентиляцию, чтобы поддерживать низкие концентрации в воздухе.
Пределы воздействия CAS# 1271-24-5: Великобритания, WEL — TWA: (перечислены как соединения хрома (vi)): 0 мг/м3 TWA (как Cr) Великобритания, WEL — STEL: (перечислены как соединения хрома (vi) ) соединения): мг/м3 STEL (как Cr) Франция — VME: (перечислены как соединения хрома (vi)): 0.05 мг/м3 VME Cr) Германия: (перечислены как соединения хрома (vi)): 0,05 мг/м3 VME (как Япония: (перечислены как соединения хрома (vi)) 0,05 мг/м3 OEL (как Cr 0,01 мг/м3 OEL (некоторые соединения, такие как Cr) Средства индивидуальной защиты Глаза: Носите соответствующие защитные очки или очки химической безопасности, как описано в правилах OSHA по защите глаз и лица в 29 CFR 1910.
 133 или европейском стандарте EN 166.
133 или европейском стандарте EN 166. Кожа:
Носите соответствующие защитные перчатки для предотвращения попадания на кожу
Одежда:
Носить соответствующую защитную одежду для предотвращения воздействия на кожу.
Респираторы:
Программа защиты органов дыхания, соответствующая требованиям OSHA 29 CFR 1910.134 и ANSI Z88.2 или европейскому стандарту EN 149, должна соблюдаться всякий раз, когда условия на рабочем месте требуют использования респиратора.
Раздел 9 – ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Физическое состояние: Твердое
Цвет: бордовый
Запах: не сообщалось
pH: Недоступно.
Давление паров: недоступно.
Вязкость: Недоступно.
Точка кипения: нет в наличии.
Температура замерзания/плавления: недоступно.
Температура самовоспламенения: Неприменимо.
Температура вспышки: Неприменимо.
Пределы взрываемости, нижние: Недоступно.
Пределы взрываемости, верхние: нет в наличии.

Температура разложения:
Растворимость в воде:
Удельный вес/плотность:
Молекулярная формула: C10h20Cr
Молекулярная масса: 182,19 Химическая стабильность:
Стабилен при комнатной температуре в закрытых контейнерах при нормальных условиях хранения и обращения.
Условия, которых следует избегать:
Несовместимые материалы, образование пыли, избыточное тепло, сильные окислители.
Несовместимость с другими материалами:
Окислители.
Опасные продукты разложения:
Окись углерода, раздражающие и токсичные пары и газы, двуокись углерода, двуокись хрома.
Опасная полимеризация: не сообщалось
Раздел 11 – ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
RTECS#:
CAS# 1271-24-5: GB7600000 LD50/LC50:
Недоступно.
Канцерогенность:
Хромоцен — Калифорния: канцероген, начальная дата 27.02.87 (перечислен как Хром (VI) NTP: Известный канцероген (перечислен как соединения Хрома (VI)). ) соединения).

Раздел 13 – РЕКОМЕНДАЦИИ ПО УТИЛИЗАЦИИ
Утилизируйте в соответствии с федеральными, государственными и местными нормами.
Раздел 14 — ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
IATA
Не считается опасным материалом.
IMO
Не считается опасным материалом.
RID/ADR
Не считается опасным материалом.
Раздел 15 — НОРМАТИВНАЯ ИНФОРМАЦИЯ
Европейские/международные правила
Европейская маркировка в соответствии с директивами ЕС
Символы опасности: XI
Фразы риска:
R 36/37/38 Раздражает глаза, дыхательную систему
и кожу.
Фразы безопасности:
S 26 При попадании в глаза немедленно промойте
большим количеством воды и обратитесь к врачу.
S 28A При попадании на кожу немедленно промыть
большим количеством воды.
S 37 Носите подходящие перчатки.
S 37/39 Носите подходящие перчатки и средства защиты глаз/лица
.

S 45 В случае несчастного случая или плохого самочувствия немедленно обратитесь за
медицинской помощью (покажите этикетку, где это возможно).
WGK (водоопасность/защита)
CAS# 1271-24-5: информация отсутствует.
Канада
CAS # 1271-24-5 включен в список DSL Канады.
CAS # 1271-24-5 не указан в Канадском списке раскрытия информации об ингредиентах.
US FEDERAL
TSCA
CAS# 1271-24-5 указан в перечне TSCA.
РАЗДЕЛ 16 – ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Н/Д
(PDF) Замена общего источника хрома CrCl3(thf)3 на точно определенные молекулы [CrCl2(μ-Cl)(thf)2]2
2021 ,26,116710из11
4.Песня, T.; Дао, X.; Тун, X.; Liu, N.; Gao, W.; Mu, X.; Mu, Y.Синтез. ихарактеристикакомплексовхрома2‐
Me4CpC6h5Ch3(R)NHCrCl2иихкаталитическихсвойстввэтиленгомоисополимеризации.DaltonTrans.2019, 48,
4912–4920, doi:10.1039/C9DT00448C.
5. Сидора, OL; AE;Benmore,CJAгомолептическийхром(iii)карбоксилат.
Сидора, OL; AE;Benmore,CJAгомолептическийхром(iii)карбоксилат.
DaltonTrans.2018,47,4790–4793,doi:10.1039/C8DT00029H.
6. Олафсен, BE; Крещенцо, GV; Moisey, LP; Patrick, BO; Комплексы. ,S.Разработанный на молекулярном уровнеАлкоксидлитий–хромдляселективногосинтезаLiCrO2и
Li2CrO4Наноматериалы. .
8. Фёрстер,C.; Дорн, М.; Рейтер, Т.; Отто, С.; Даварчи, Г.; Heinze,K.DdpdasExpandedTer‐
пиридин:драматическиеэффектысимметриииэлектронныесвойствавпервомрядепереход2неметаллическиекомплексы1. ,6,
86,doi:10.3390/неорганические вещества 6030086.
9. Чжао,R.;Ma,J.;Zhang,H.;Huang,J.Синтез иХарактеристикаограниченнойгеометриикислородисерафункция-
ализированныхциклопентадиенилхромовыхкомплексовиихиспользованиевкатализедляолефиновполимеризации.Molecules2017,22,856,
doi:10.3390/molecules22050856.
10. Pei,L.;Tang,Y. ;Gao,H.andHomo СополимеризацияэтиленаинорборненасАнилидо-иминхромомкатализаторами.
;Gao,H.andHomo СополимеризацияэтиленаинорборненасАнилидо-иминхромомкатализаторами.
Полимеры2016,8,69,doi:10.3390/polym8030069, 9.0004.Herwig 9.0004. ;Zeiss,H.Примечания:ТрихлоридхромаТетрагидрофуранат.J.Org.Chem.1958,23,1404–1404,
doi:10.1021/jo01103a627.0.0 Масталир, М.; Глатц, М.; Стёгер, Б.;;Allmaier,G.;Kirchner,K.Синтез,характеристикаиреакционная способность
ванадия,хромаимарганцаПНПклещевыекомплексы.Неорг.Хим. Acta2017,455,707–714,
doi:10.1016/j.ica.2016.02.064.
13. Köhn,RD;Coxon,AGN;Hawkins,CR; Smith,D.;Mihan,S.;Schuhen,K.;Schiendorfer,M.;Kociok-Köhn,G.Selectivetri‐
, Этилен:Галогенированныехромтриазациклогексановыекомплексыкакзондынавнутренний’галоген-
генэффект’.Polyhedron2014,84,3–13,doi:10.1016/j.poly.2014.05.050.
14. Heisig,GB;Hedin,H.БезводныйХром(III) Хлорид.Неорг.Синт.1946,2,193–196,doi:10.1002/9780470132333. ch59.
ch59.
15. Вавулис,A.;Остин,TE;S.Y .; Tyree, J. Безводный Хром (III) Хлорид. Шамир, J.Новыйсинтезтрихлоридхроматетрагидрофураната.Inorg.Chim.Acta1989,156,163–164,doi:10.1016/S0020-
1693(00)83491-X.
org/10.1002/9780470132364.ch53.
18. House, DA; (nPrNh3)4]BF4∙h3Oидругие-
malиHg2+-высвобождениехлоридакинетикаизнекоторыхтранс-[CrCl2(N)4]+комплексов.Inorg Хим.Так, JH; Inorg.Chem.1990,29,1592–1593,doi:10.1021/ic00333a032.
20. Jeon,JY;Park,JH;Park,DS;Park, SY;Lee,CS;Go,MJ;Lee,J.;Lee,BYОтносительнопрекурсорахромаCrCl3(thf)3.
Inorg.Chem. Комм.2014,44,148–150,doi:10.1016/j.inoche.2014.03.023.
21.Sydora, OL; A; Neveling,A.;Otto,
S.;etal.ЭтиленТетрамеризация: AНовыйПутькПроизводить1-октенвИсключительноВысокаяселективность.J .Am.Chem.Soc.2004,
126,14712–14713,doi:10.1021/ja045602n.
23. Overett,M.Дж. ; Бланн, К.; Боллманн, А.; Диксон, Дж. Т.; Хаасбрук, Д.; Morgan,DH
; Бланн, К.; Боллманн, А.; Диксон, Дж. Т.; Хаасбрук, Д.; Morgan,DH
МеханизмИсследованияреакциитетрамеризацииэтилена.J.Am.Chem.Soc.2005,127,10723–10730,
4 doi:
4 10.1021/ja052327b. 24. Кульманн,С.;Бланн,К.;Боллманн,А.;Диксон,Дж.Т.;Киллиан,Э.;Маумела,MC;Маумела ,H.;Morgan,DH;Prétorius,M.;Tac‐
cardi,N.;etal.N-замещенныедифосфиноамины:На пути к рациональному дизайну лиганда дляэффективнойтетрамеризацииэтилена.
J.Catal.2007,245,279–284,doi:10.1016/j.jcat.2006.10.020.
25. Boelter,SD;Davies,DR;Margl ,P.;Milbrandt,KA;Mort,D.;Vanchura,BA;Wilson,DR;Wiltzius,M.;Rosen,MS;Klosin,
J .Лигандына основе фосфоланадлякатализируемойэтиленатри-итетрамеризацииэтилена.Металлоорганические соединения2020,39,976–987,
doi:10.1021.acs.organomet
26. Hirscher, NA; КомпонентЭтиленТетрамеризацияПредварительный катализатор.J.Am.Chem.Soc. 2019,141,6022–6029,doi:10.1021/jacs.9b01387.
2019,141,6022–6029,doi:10.1021/jacs.9b01387.
олигомерныйсилсесквиоксан-конъюгированныйбис(дифенилфосфино)аминлиганддляхрома(III)
, катализируемыйэтилентримеризациейитетрамеризацией.Прил. 560,21–27,doi:10.1016/j.apcata.2018.04.030.
28. Newland,RJ;Smith,A.;Smith,DM;Fey,N.; Hanton,MJ;Металлоорганические соединения2018,37,1062–1073,
doi:10.1021/acs.organomet.8b00063.
24.4: Изомерия в координационных комплексах
- Последнее обновление
- Сохранить как PDF
- Класс I: Структурные Изомеры
- Ионизация Изомерия
- Координация Изомерия
- Рычажный Изомерия
- Класс 2: Геометрические изомеры
- Planar Изомеры
- Октаэдрические Изомеры
- Резюме
- Ссылки
- Авторы и атрибуции
Цели обучения
- Объясните различия структурной и геометрической изомеризации в координационных комплексах или комплексных ионах.

- Дайте определение ионизации, связыванию и координационной изомеризации (классы структурных изомеров)
- Дайте определение цис/транс и mer/fac изомеризации (классы геометрических изомеров)
Наличие координационных соединений с одинаковой формулой, но разным расположением лигандов имело решающее значение в развитии координационной химии. Два или более соединений с одинаковой формулой, но разным расположением атомов называются изомерами . Поскольку изомеры обычно имеют разные физические и химические свойства, важно знать, с каким изомером мы имеем дело, если возможно более одного изомера.Как мы увидим, координационные соединения имеют те же типы изомеров, что и органические соединения, а также несколько уникальных видов изомеров. Изомеры — это соединения с одинаковой молекулярной формулой, но разными структурными формулами, которые не обязательно обладают сходными свойствами. Существует множество различных классов изомеров, таких как стереоизомеры, энантиомеры и геометрические изомеры. Различают две основные формы изомерии: структурная изомерия и стереоизомерия (пространственная изомерия).
Различают две основные формы изомерии: структурная изомерия и стереоизомерия (пространственная изомерия).
Класс I: структурные изомеры
Изомеры, которые содержат одинаковое количество атомов каждого вида, но различаются тем, как атомы связаны друг с другом, называются структурными изомерами, которые различаются по структуре или типу связи. Для неорганических комплексов существует три типа структурных изомеров: ионизация , координация и связь . Структурные изомеры, как следует из их названия, отличаются своей структурой или связыванием, которые отделены от стереоизомеров, отличающихся пространственным расположением присоединяемых лигандов, но все же обладающих связывающими свойствами.Различные химические формулы структурных изомеров вызваны либо различием в том, какие лиганды связаны с центральными атомами, либо тем, как отдельные лиганды связаны с центральными атомами. При определении структурного изомера вы смотрите на (1) лиганды, которые связаны с центральным металлом, и (2) какой атом лиганда связан с центральным металлом.
Изомерия ионизации
Изомеры ионизации возникают, когда лиганд, связанный с металлическим центром, меняется местами с анионом или нейтральной молекулой, которая изначально находилась вне координационного комплекса.Геометрия центрального иона металла и идентичность других лигандов идентичны. Например, октаэдрический изомер будет иметь пять одинаковых лигандов, но шестой будет отличаться. Несоответствующий лиганд в одном соединении будет находиться вне координационной сферы другого соединения. Поскольку анион или молекула вне координационной сферы различны, химические свойства этих изомеров различны. Изомер гидрата представляет собой особый вид изомера ионизации, в котором молекула воды является одной из молекул, которые меняются местами.
Рисунок \(\PageIndex{1}\): Изомерия ионизации. Два изомера различаются только тем, какие лиганды связаны с центральным металлом, а какие являются противоионами во второй координационной сфере. (слева) Ион хлорида связан с кобальтом в качестве хлор-лиганда с ионом брома в качестве противоиона. (справа) В другом изомере ионизации бромид действует как бром-лиганд кобальта, а хлорид действует как противоион. Эти два изомера называются бромидом пентаамминхлоркобальта (II) (слева) и хлоридом пентаамминбромкобальта (II) (справа).{-} (водн.)}\]
(справа) В другом изомере ионизации бромид действует как бром-лиганд кобальта, а хлорид действует как противоион. Эти два изомера называются бромидом пентаамминхлоркобальта (II) (слева) и хлоридом пентаамминбромкобальта (II) (справа).{-} (водн.)}\] Обратите внимание, что оба аниона необходимы для балансировки заряда комплекса, и что они отличаются тем, что один ион непосредственно связан с центральным металлом, а другой нет.
Сольватная и гидратная изомерия: особый тип изомеров ионизации
Очень похожий тип изомерии возникает в результате замены координированной группы молекулой растворителя ( Сольватная изомерия ), которая в случае воды называется Гидратная изомерия .Самый известный пример этого происходит для хлорида хрома (\(\ce{CrCl_3\cdot 6H_2O}\)), который может содержать 4, 5 или 6 координированных молекул воды (при условии, что координационное число равно 6). Точка здесь используется в основном как выражение невежества, чтобы указать, что, хотя части молекулы, разделенные точкой, каким-то образом связаны друг с другом, точные структурные детали этого взаимодействия не полностью выражены в результирующей формуле. {-}}\) в растворе соответственно.
{-}}\) в растворе соответственно.
При кристаллизации из воды многие соединения включают молекулы воды в свои кристаллические структуры. Эти «кристаллизационные воды» относятся к воде, которая находится в кристаллическом каркасе комплекса металла или соли, которая 90–106 не связана напрямую 90–107 с катионом металла. В первых двух изомерах гидратов присутствуют молекулы воды, которые являются артефактами кристаллизации и находятся внутри кристаллов. Эти кристаллизационные воды вносят вклад в общую массу воды в веществе и чаще всего присутствуют в определенном (стехиометрическом) соотношении.
Рисунок \(\PageIndex{2}\): Гидрат иосомерисим. Гидратный изомер \(\ce{[Cr(H_2O)_6]Cl_3}\) (слева) окрашен в фиолетовый цвет, а гидратный изомер \(\ce{[CrCl(H_2O)_5]Cl_2 \cdot H_2O}\) — в зеленый. -серого цвета. Что такое «Воды кристаллизации»?
Соединение с ассоциированной кристаллизационной водой известно как гидрат. Структура гидратов может быть весьма сложной из-за существования водородных связей, определяющих полимерные структуры. Например, рассмотрим аквакомплекс \(\ce{NiCl_2 \cdot 6H_2O}\), состоящий из разделенных транс -[NiCl 2 (H 2 O) 4 ] молекул, более слабо связанных с соседней водой молекулы.Только четыре из шести молекул воды в формуле связаны с катионом никеля (II), а оставшиеся две представляют собой воды кристаллизации по мере разрешения кристаллической структуры (рис. \(\PageIndex{3}\)).
Например, рассмотрим аквакомплекс \(\ce{NiCl_2 \cdot 6H_2O}\), состоящий из разделенных транс -[NiCl 2 (H 2 O) 4 ] молекул, более слабо связанных с соседней водой молекулы.Только четыре из шести молекул воды в формуле связаны с катионом никеля (II), а оставшиеся две представляют собой воды кристаллизации по мере разрешения кристаллической структуры (рис. \(\PageIndex{3}\)).
Рисунок \(\PageIndex{3}\): Вода гидратации. (слева) Изображение соли \(\ce{NiCl_2 \cdot 6H_2O}\) (общественное достояние; Benjah-bmm27 из Википедии). (справа) Кристаллическая структура \(\ce{NiCl_2 \cdot 6H_2O}\) с указанием атомов хлора (зеленый), молекул воды (красный) и металлов Ni (синий). Обратите внимание, что только четыре воды связаны в качестве лигандов с ионами никеля, а две находятся вне координационной сферы.(CC BY-SA 4.0; Smokefoot). Вода является особенно распространенным растворителем в кристаллах, потому что она мала и полярна. Но все растворители можно найти в некоторых кристаллах-хозяевах. Вода заслуживает внимания, потому что она реакционноспособна, тогда как другие растворители, такие как бензол, считаются химически безвредными.
Вода заслуживает внимания, потому что она реакционноспособна, тогда как другие растворители, такие как бензол, считаются химически безвредными.
Координационная изомерия
Координационная изомерия возникает в соединениях, содержащих сложные анионные и сложные катионные части, и может рассматриваться как обмен некоторыми лигандами с катиона на анион.Следовательно, есть два сложных соединения, связанных вместе, одно с отрицательным зарядом, а другое с положительным зарядом. В координационных изомерах анионные и катионные комплексы координационного соединения обмениваются одним или несколькими лигандами. Например, соединения \(\ce{[Zn(Nh4)4] [Cu(Cl4)]}\) и \(\ce{[Cu(Nh4)4] [Zn(Cl4)]}\) являются координационными изомеры (рис. \(\PageIndex{4}\)).
Рисунок \(\PageIndex{4}\): Координационная изомерия. (CC BY-NC; Юмит Кая) Пример \(\PageIndex{2}\): координационные изомеры
Какой координационный изомер у соединения \(\ce{[Co(Nh4)6] [Cr(CN)6]}\)?
Раствор
Координационная изомерия включает переключение металлов между катионной и анионной сферами. {-}}\)) ион – это лиганд , который может связываться с центральным атомом через атом азота или кислорода, но не может связываться с центральным атомом одновременно с кислородом и азотом, и в этом случае он будет называться полидентатный лиганд , а не амбидентатный лиганд .
{-}}\)) ион – это лиганд , который может связываться с центральным атомом через атом азота или кислорода, но не может связываться с центральным атомом одновременно с кислородом и азотом, и в этом случае он будет называться полидентатный лиганд , а не амбидентатный лиганд .
Рисунок \(\PageIndex{5}\): Изомерия сцепления в лиганде \(\ce{NO2}\). Это происходит, когда конкретный лиганд способен координироваться с металлом двумя разными способами. от Анхеля С. де Диоса.{-}}\) ион называется нитро , когда он связывается с атомом \(\ce{N}\), и называется нитрито , когда он связывается с атомом \(\ce{O}\). Пример \(\PageIndex{3}\): Изомеризация связи
Катионный комплекс кобальта [Co(NH 3 ) 5 (NO 2 )]Cl 2 существует в виде двух изомеров с разделяемой связью комплексного иона: (NH 3 ) 5 5 2 )] 2+ .
Рисунок \(\PageIndex{6}\): Изомеризация связей. (слева) нитро-изомер (Co-NO2) и (справа) нитрито-изомер (Co-ONO)
(слева) нитро-изомер (Co-NO2) и (справа) нитрито-изомер (Co-ONO). один кислород к металлическому центру, комплекс известен как нитрито — комплекс. Альтернативная структура формулы, подчеркивающая разную координационную ковалентную связь для двух изомеров
- \(\ce{[Co(ONO)(NH_3)_5]Cl}\): присоединенный изомер нитрито -O
- \(\ce{[Co(NO_2)(NH_3)_5]Cl}\): нитроизомер — N присоединен.{3–}}\) комплексные ионы связывают изомеры друг друга?
- Ответить
Здесь разница заключается в том, как лиганд связывается с металлом. В первом изомере лиганд связывается с металлом через пару электронов на атоме азота. Во втором изомере лиганд связывается с металлом через электронную пару на одном из атомов кислорода. Это проще увидеть:
Класс 2: геометрические изомеры
Наличие координационных соединений с одинаковой формулой, но разным расположением лигандов имело решающее значение в развитии координационной химии. Два или более соединений с одинаковой формулой, но разным расположением атомов называются изомерами . Поскольку изомеры обычно имеют разные физические и химические свойства, важно знать, с каким изомером мы имеем дело, если возможно более одного изомера. Напомним, что во многих случаях органические соединения с одной и той же молекулярной формулой могут иметь более одной структуры; рассмотренные ранее примеры включают н-бутан по сравнению с изобутаном и цис-2-бутен по сравнению с транс-2-бутеном.Как мы увидим, координационные соединения имеют те же типы изомеров, что и органические соединения, а также несколько уникальных видов изомеров.
Два или более соединений с одинаковой формулой, но разным расположением атомов называются изомерами . Поскольку изомеры обычно имеют разные физические и химические свойства, важно знать, с каким изомером мы имеем дело, если возможно более одного изомера. Напомним, что во многих случаях органические соединения с одной и той же молекулярной формулой могут иметь более одной структуры; рассмотренные ранее примеры включают н-бутан по сравнению с изобутаном и цис-2-бутен по сравнению с транс-2-бутеном.Как мы увидим, координационные соединения имеют те же типы изомеров, что и органические соединения, а также несколько уникальных видов изомеров.
Плоские изомеры
Комплексы металлов, отличающиеся только тем, что лиганды расположены рядом друг с другом ( цис ) или прямо напротив друг друга ( транс ) в координационной сфере металла, называются геометрическими изомерами. Они наиболее важны для квадратных плоских и октаэдрических комплексов.
Поскольку все вершины квадрата эквивалентны, не имеет значения, какую вершину занимает лиганд B в квадратно-плоском комплексе MA 3 B; следовательно, в этом случае возможен только один геометрический изомер (и в аналогичном случае MAB 3 ).Все четыре показанные здесь структуры химически идентичны, поскольку их можно наложить друг на друга, просто вращая комплекс в пространстве:
Для комплекса MA 2 B 2 возможны два изомера: либо лиганды A могут быть смежными друг с другом (цис), и в этом случае лиганды B также должны быть цис, либо лиганды A могут быть напротив друг друга (транс), и в этом случае лиганды B также должны быть транс. Несмотря на то, что цис-изомер можно изобразить четырьмя различными способами, а транс-изомер — двумя различными способами, все члены каждого набора химически эквивалентны:
Поскольку нет способа преобразовать цис-структуру в транс-поворот молекулы в пространстве или перевернуть ее, это принципиально разные расположения атомов в пространстве. Вероятно, наиболее известными примерами цис- и транс-изомеров квадратно-плоского комплекса MA 2 B 2 являются цис-Pt(NH 3 ) 2 Cl 2 , также известный как цисплатин, и транс- Pt(NH 3 ) 2 Cl 2 , который на самом деле скорее токсичен, чем терапевтичен.
Вероятно, наиболее известными примерами цис- и транс-изомеров квадратно-плоского комплекса MA 2 B 2 являются цис-Pt(NH 3 ) 2 Cl 2 , также известный как цисплатин, и транс- Pt(NH 3 ) 2 Cl 2 , который на самом деле скорее токсичен, чем терапевтичен.
Противораковый препарат цисплатин и его неактивный транс-изомер. Цисплатин особенно эффективен при опухолях репродуктивных органов, которые в основном поражают людей в возрасте 20 лет и, как известно, трудноизлечимы.Например, после того, как в 1991 году у Лэнса Армстронга был диагностирован метастазирующий рак яичка и шансы на выживание составляли всего 50%, Лэнс Армстронг вылечился с помощью лечения цисплатином.
Квадратные плоские комплексы, содержащие симметричные бидентатные лиганды, такие как [Pt(en) 2 ] 2+ , имеют только одну возможную структуру, в которой изогнутые линии, соединяющие два атома N, указывают на этилендиаминовые лиганды:
Упражнение \(\PageIndex{4}\)
Нарисуйте цис- и транс-изомеры следующих соединений:
- (NH 3 ) 2 IrCl(CO)
- (H 3 P) 2 PtHBr
- (AsH 3 ) 2 PtH(CO)
Упражнение \(\PageIndex{5}\)
Возможен только один изомер (tmeda)PtCl 2 [tmeda = (CH 3 ) 2 NCH 2 CH 2 N(CH 3 6 ) 2905; оба атома азота соединяются с платиной]. Нарисуйте этот изомер и объясните, почему другой изомер невозможен.
Нарисуйте этот изомер и объясните, почему другой изомер невозможен.
Октаэдрические изомеры
Октаэдрические комплексы также имеют цис- и транс-изомеры. Как и для квадратных плоских комплексов, для октаэдрических комплексов возможна только одна структура, в которой только один лиганд отличается от остальных пяти (MA 5 B). Хотя мы обычно изображаем октаэдр таким образом, который предполагает, что четыре «плоскостных» лиганда отличаются от двух «осевых» лигандов, на самом деле все шесть вершин октаэдра эквивалентны.Следовательно, как бы мы ни рисовали структуру MA 5 B, ее можно наложить на любое другое представление, просто вращая молекулу в пространстве. Две из многих возможных ориентаций структуры MA 5 B следующие:
Если два лиганда в октаэдрическом комплексе отличаются от четырех других, что дает комплекс MA 4 B 2 , возможны два изомера. Два лиганда B могут быть цис- или транс-. Цис- и транс-[Co(NH 3 ) 4 Cl 2 ]Cl являются примерами этого типа системы:
Замена другого лиганда A на B дает комплекс MA 3 B 3 , для которого также существуют два возможных изомера. В одном три лиганда каждого вида занимают противоположные треугольные грани октаэдра; это называется изомером fac (для лица). В другом случае три лиганда каждого вида лежат на меридиане, если рассматривать комплекс как сферу; это называется меризомером (для меридионального):
В одном три лиганда каждого вида занимают противоположные треугольные грани октаэдра; это называется изомером fac (для лица). В другом случае три лиганда каждого вида лежат на меридиане, если рассматривать комплекс как сферу; это называется меризомером (для меридионального):
Пример \(\PageIndex{4}\)
Изобразите все возможные геометрические изомеры комплекса [Co(H 2 O) 2 (ox)BrCl] − , где ox − O 2 CCO 2 , который обозначает оксалат.
Раствор
Дано : формула комплекса
Запрашиваемый : структуры геометрических изомеров
Этот комплекс содержит один бидентатный лиганд (оксалат), который может занимать только соседние (цис) положения, и четыре монодентатных лиганда, два из которых идентичны (H 2 O). Самый простой способ решить эту проблему — систематически просматривать различные комбинации лигандов, чтобы определить, какие лиганды могут быть транс. Таким образом, либо водные лиганды могут трансформироваться друг к другу, либо два галогенидных лиганда могут трансформироваться друг к другу, давая два показанных здесь геометрических изомера:
Таким образом, либо водные лиганды могут трансформироваться друг к другу, либо два галогенидных лиганда могут трансформироваться друг к другу, давая два показанных здесь геометрических изомера:
Кроме того, возможны две структуры, в которых один из галогенидов находится в транс к водному лиганду. В первом хлоридный лиганд находится в той же плоскости, что и оксалатный лиганд, и находится в транс-положении к одному из оксалатных атомов кислорода. Обмен хлоридного и бромидного лигандов дает другой, в котором бромидный лиганд находится в той же плоскости, что и оксалатный лиганд, и находится в транс-положении к одному из оксалатных атомов кислорода:
Таким образом, этот комплекс может существовать в виде четырех различных геометрических изомеров.
Упражнение \(\PageIndex{6}\)
Изобразите все возможные геометрические изомеры комплекса [Cr(en) 2 (CN) 2 ] + .
- Ответить
Возможны два геометрических изомера: транс и цис .
Резюме
Наличие координационных соединений с одинаковой формулой, но разным расположением лигандов имело решающее значение в развитии координационной химии.Два или более соединений с одинаковой формулой, но разным расположением атомов называются изомерами . Многие комплексы металлов образуют изомеры, которые представляют собой два или более соединений с одинаковой формулой, но разным расположением атомов. Структурные изомеры отличаются тем, что атомы связаны друг с другом, в то время как геометрические изомеры отличаются только расположением лигандов вокруг иона металла. Лиганды, соседние друг с другом, являются цис, а лиганды, расположенные напротив друг друга, являются транс.
Таблица \(\PageIndex{1}\) подчеркивает ключевые различия трех классов структурных изомеров, обсуждаемых ниже.Выделенные ионы — это ионы, которые каким-то образом переключаются или изменяются, образуя тот тип структурного изомера, которым он является.
Таблица \(\PageIndex{1}\): Обзор классов структурных изомеров Структурный изомер Примеры Ионизация [CoBr(H 2 O) 5 ] + Cl — и [CoCl(H 2 O) 5 ] + 10 Br Координация [ZN (NH 3 ) 4 ] 4 ] + [CUCL 4 ] 2- и [CU (NH 3 ) 4 ] + [ZNCL 4 ] 2 — Рычажный механизм [Co(NO 2 ) 6 ] 3- и [Co(ONO) 6 ] 3-
Каталожные номера
- Петруччи, Харвуд, Херринг и Мадура.
 Общая химия: принципы и современные приложения: девятое издание. Нью-Джерси: Пирсон, 2007.
Общая химия: принципы и современные приложения: девятое издание. Нью-Джерси: Пирсон, 2007. - Аткинс, Питер и Лоретта Джонс. Химические принципы: В поисках понимания: четвертое издание . WH Freeman and Company, 2008. Печать.
Авторы и авторство
молекул | Бесплатный полнотекстовый | Замена обычного источника хрома CrCl3(thf)3 на точно определенный [CrCl2(μ-Cl)(thf)2]2
1.Введение
CrCl 3 (thf) 3 широко используется в качестве исходного материала для синтеза металлоорганических и координационных соединений Cr [1,2,3,4,5,6,7,8,9,10 ]. О способе его приготовления было сообщено 60 лет назад; безводный CrCl 3 , нерастворимый в органических растворителях, а также в воде, экстрагировали ТГФ с помощью цинковой пыли на аппарате Сокслета [11,12,13]. Однако безводный CrCl 3 получают опасным и непростым процессом (обработка Cr 2 O 3 ·xH 2 O CCl 4 при 630 °C приводит к образованию чрезвычайно токсичного фосгена). газ) и, следовательно, дорого [14,15].Сообщалось о другом методе, в котором CrCl 3 · 6H 2 O подвергали взаимодействию с избытком тионилхлорида (S(O)Cl 2 ) с образованием безводного CrCl 3 . В этом процессе была получена другая форма гигроскопичного CrCl 3 , из которого можно было сразу после добавления ТГФ получить CrCl 3 (thf) 3 [16,17,18]. Наиболее привлекательным и удобным методом является взаимодействие CrCl 3 ·6H 2 O с избытком Me 3 SiCl в ТГФ, приводящее к осаждению CrCl 3 (thf) 3 наряду с образованием побочных продуктов, HCl и Me 3 Siosime 3 (CRCL 3 · 6H 2 O + 12 Me 3 SICL → CRCL 3 (THF) 3 + 12 HCL + 6 ME 3 SIOSIME 3 ) [19].Необходимо добавить избыток Me 3 SiCl (~60 экв/Cr) для получения полностью безводной формы CrCl 3 (thf) 3 [20].
газ) и, следовательно, дорого [14,15].Сообщалось о другом методе, в котором CrCl 3 · 6H 2 O подвергали взаимодействию с избытком тионилхлорида (S(O)Cl 2 ) с образованием безводного CrCl 3 . В этом процессе была получена другая форма гигроскопичного CrCl 3 , из которого можно было сразу после добавления ТГФ получить CrCl 3 (thf) 3 [16,17,18]. Наиболее привлекательным и удобным методом является взаимодействие CrCl 3 ·6H 2 O с избытком Me 3 SiCl в ТГФ, приводящее к осаждению CrCl 3 (thf) 3 наряду с образованием побочных продуктов, HCl и Me 3 Siosime 3 (CRCL 3 · 6H 2 O + 12 Me 3 SICL → CRCL 3 (THF) 3 + 12 HCL + 6 ME 3 SIOSIME 3 ) [19].Необходимо добавить избыток Me 3 SiCl (~60 экв/Cr) для получения полностью безводной формы CrCl 3 (thf) 3 [20]. В противном случае (например, при добавлении 25 экв. Me 3 SiCl/Cr согласно литературным данным) получается гидратированный CrCl 3 (thf) 2 (H 2 O), который ошибочно продавался как CrCl 3 (thf) 3 в прошлом [20, 21]. Sasol описал каталитическую систему, состоящую из источника Cr, лиганда iPrN(PPh 2 ) 2 и метилалюмоксана (МАО), который производит в основном 1-октен за счет тетрамеризации этилена [22,23,24].CrCl 3 (thf) 3 активно используется в качестве компонента каталитической системы тетрамеризации этилена [25, 26, 27, 28, 29, 30, 31, 32, 33, 34]. Мы также разработали очень эффективный катализатор тетрамеризации этилена (схема 1) [35,36,37]. Катализатор демонстрирует чрезвычайно высокую активность (~5000 кг/г Cr/ч) и имеет преимущество перед другими описанными системами, поскольку он работает с недорогим активатором, iBu 3 Al, что позволяет избежать чрезмерного использования дорогого МАО (A1/ Кр = 300–500) [38,39,40,41,42,43].
В противном случае (например, при добавлении 25 экв. Me 3 SiCl/Cr согласно литературным данным) получается гидратированный CrCl 3 (thf) 2 (H 2 O), который ошибочно продавался как CrCl 3 (thf) 3 в прошлом [20, 21]. Sasol описал каталитическую систему, состоящую из источника Cr, лиганда iPrN(PPh 2 ) 2 и метилалюмоксана (МАО), который производит в основном 1-октен за счет тетрамеризации этилена [22,23,24].CrCl 3 (thf) 3 активно используется в качестве компонента каталитической системы тетрамеризации этилена [25, 26, 27, 28, 29, 30, 31, 32, 33, 34]. Мы также разработали очень эффективный катализатор тетрамеризации этилена (схема 1) [35,36,37]. Катализатор демонстрирует чрезвычайно высокую активность (~5000 кг/г Cr/ч) и имеет преимущество перед другими описанными системами, поскольку он работает с недорогим активатором, iBu 3 Al, что позволяет избежать чрезмерного использования дорогого МАО (A1/ Кр = 300–500) [38,39,40,41,42,43]. В ходе исследований у нас возникла проблема с воспроизведением столь чрезвычайно высокой активности, и в итоге мы обнаружили, что причиной этой проблемы был источник Cr CrCl 3 (thf) 3 , использованный в препарате. Хотя структура CrCl 3 (thf) 3 была выявлена с помощью рентгеновской кристаллографии, с использованием монокристалла, отобранного из партии в процессе экстракции по Сокслету, он не переосаждается в виде кристаллов хорошего качества при повторном растворении в CH . 2 Cl 2 [44,45].Структура, выясненная с помощью рентгеновской кристаллографии, не гарантирует чистоты объема, и мы поставили под сомнение чистоту обычного источника Cr CrCl 3 (thf) 3 . На самом деле, о нем сообщалось как о «фиолетовом твердом веществе неправильной формы», что может означать, что это не чистый CrCl 3 (thf) 3 , а смесь, содержащая другие формы аддукта ТГФ CrCl 3 (например, μ2 -Cl-мостиковые многоядерные соединения) [46].
В ходе исследований у нас возникла проблема с воспроизведением столь чрезвычайно высокой активности, и в итоге мы обнаружили, что причиной этой проблемы был источник Cr CrCl 3 (thf) 3 , использованный в препарате. Хотя структура CrCl 3 (thf) 3 была выявлена с помощью рентгеновской кристаллографии, с использованием монокристалла, отобранного из партии в процессе экстракции по Сокслету, он не переосаждается в виде кристаллов хорошего качества при повторном растворении в CH . 2 Cl 2 [44,45].Структура, выясненная с помощью рентгеновской кристаллографии, не гарантирует чистоты объема, и мы поставили под сомнение чистоту обычного источника Cr CrCl 3 (thf) 3 . На самом деле, о нем сообщалось как о «фиолетовом твердом веществе неправильной формы», что может означать, что это не чистый CrCl 3 (thf) 3 , а смесь, содержащая другие формы аддукта ТГФ CrCl 3 (например, μ2 -Cl-мостиковые многоядерные соединения) [46]. Данные элементного анализа (ЭА) для Cr и Cl были опубликованы, но общие данные по углероду и водороду отсутствовали.CrCl 3 (thf) 3 является парамагнитным; таким образом, его нельзя подвергнуть структурному анализу с использованием спектроскопии ЯМР 1 H и 13 C ЯМР. Ранее мы также обнаружили, что состав (а также структура) коммерческого источника (2-этилгексаноата) 3 Cr, другого типа важного парамагнитного комплекса Cr(III), который коммерчески используется в качестве компонента в этиленовом катализатор тримеризации [47]. ошибочно [21,48]. Путем корректировки структуры на (2-этилгексаноат) 2 CrOH каталитические характеристики были постоянными и, кроме того, значительно улучшились.
Данные элементного анализа (ЭА) для Cr и Cl были опубликованы, но общие данные по углероду и водороду отсутствовали.CrCl 3 (thf) 3 является парамагнитным; таким образом, его нельзя подвергнуть структурному анализу с использованием спектроскопии ЯМР 1 H и 13 C ЯМР. Ранее мы также обнаружили, что состав (а также структура) коммерческого источника (2-этилгексаноата) 3 Cr, другого типа важного парамагнитного комплекса Cr(III), который коммерчески используется в качестве компонента в этиленовом катализатор тримеризации [47]. ошибочно [21,48]. Путем корректировки структуры на (2-этилгексаноат) 2 CrOH каталитические характеристики были постоянными и, кроме того, значительно улучшились. 2. Результаты и обсуждение.
O с избытком Me 3 SiCl (60 экв.) [20]. Мы модифицировали методику следующим образом: CrCl 3 ·6H 2 O вакуумировали в течение ~6 ч перед обработкой Me 3 SiCl. Катализатор [IPRN {P (C 6 H 4 -P-Si (NBU) 3 ) 2 ) 2 } 2 CRCL 2 ] + ] + [B (C 6 F 5 ) 4 ] − , приготовленный по схеме 1 с использованием CrCl 3 (thf) 3 , полученный на стадии вакуумирования, обеспечил чрезвычайно высокую активность (~5000 кг/г-Cr/ч ).Напротив, катализатор, приготовленный с использованием коммерческого источника CrCl 3 (thf) 3 или катализатор, приготовленный в соответствии с описанным способом без стадии вакуумирования, не проявлял такой высокой активности (~3000 кг/г-Cr). /h), а при взаимодействии лиганда iPrN{P(C 6 H 4 -p-Si(nBu) 3 ) 2 } 2 с [ (CH 3 CN) 4 CrCl 2 ] + [B(C 6 F 5 ) 4 ]
Катализатор [IPRN {P (C 6 H 4 -P-Si (NBU) 3 ) 2 ) 2 } 2 CRCL 2 ] + ] + [B (C 6 F 5 ) 4 ] − , приготовленный по схеме 1 с использованием CrCl 3 (thf) 3 , полученный на стадии вакуумирования, обеспечил чрезвычайно высокую активность (~5000 кг/г-Cr/ч ).Напротив, катализатор, приготовленный с использованием коммерческого источника CrCl 3 (thf) 3 или катализатор, приготовленный в соответствии с описанным способом без стадии вакуумирования, не проявлял такой высокой активности (~3000 кг/г-Cr). /h), а при взаимодействии лиганда iPrN{P(C 6 H 4 -p-Si(nBu) 3 ) 2 } 2 с [ (CH 3 CN) 4 CrCl 2 ] + [B(C 6 F 5 ) 4 ]9 —
9 — .0Нерастворимой фракцией можно пренебречь, когда в качестве исходного материала используют CrCl 3 (thf) 3 , который получают на стадии вакуумирования. Мы исследовали, что происходит на этапе вакуумирования. Когда кристаллическую форму CrCl 3 ·6H 2 O (10 г, 37,5 ммоль) вакуумировали при 100 °C, цвет постепенно менялся от темно-зеленого до светло-зеленого, светло-серого и, наконец, светло-фиолетового с постепенным исчезновением. веса. Наконец, был получен аморфный порошок, а потеря массы приблизилась к 36% (6,5%).осталось 39 г). Дальнейшее снижение веса было минимальным при увеличении времени эвакуации. Лакмусовой бумажкой было подтверждено, что удаленный летучий компонент представляет собой не чистую воду, а кислую, предположительно содержащую HCl. На основании этих наблюдений оставшееся соединение Cr предварительно рассматривалось как CrCl 2 (OH) (H 2 O) 2 ; При превращении CrCl 3 ·6H 2 O в CrCl 2 (OH)(H 2 O) 2 ожидается потеря массы 34% (схема 2).Сообщается, что структура CrCl 3 · 6H 2 O представляет собой [CrCl 2 (H 2 O) 4 ]Cl·2H 2 O, и воздействие тепла в вакууме может высвободить внешняя сфера Cl — (в виде HCl с протоном в воде внутренней сферы) и три молекулы воды (две из внешней сферы и одна из внутренней сферы), в результате чего остается CrCl 2 (OH) (H 2 O) 2 (возможно, [CrCl 2 (H 2 O) 2 (μ-OH)] 2 с октаэдрической структурой) в реакционном сосуде.
Мы исследовали, что происходит на этапе вакуумирования. Когда кристаллическую форму CrCl 3 ·6H 2 O (10 г, 37,5 ммоль) вакуумировали при 100 °C, цвет постепенно менялся от темно-зеленого до светло-зеленого, светло-серого и, наконец, светло-фиолетового с постепенным исчезновением. веса. Наконец, был получен аморфный порошок, а потеря массы приблизилась к 36% (6,5%).осталось 39 г). Дальнейшее снижение веса было минимальным при увеличении времени эвакуации. Лакмусовой бумажкой было подтверждено, что удаленный летучий компонент представляет собой не чистую воду, а кислую, предположительно содержащую HCl. На основании этих наблюдений оставшееся соединение Cr предварительно рассматривалось как CrCl 2 (OH) (H 2 O) 2 ; При превращении CrCl 3 ·6H 2 O в CrCl 2 (OH)(H 2 O) 2 ожидается потеря массы 34% (схема 2).Сообщается, что структура CrCl 3 · 6H 2 O представляет собой [CrCl 2 (H 2 O) 4 ]Cl·2H 2 O, и воздействие тепла в вакууме может высвободить внешняя сфера Cl — (в виде HCl с протоном в воде внутренней сферы) и три молекулы воды (две из внешней сферы и одна из внутренней сферы), в результате чего остается CrCl 2 (OH) (H 2 O) 2 (возможно, [CrCl 2 (H 2 O) 2 (μ-OH)] 2 с октаэдрической структурой) в реакционном сосуде. Обработка CrCl 2 (OH)(H 2 O) 2 после растворения в ТГФ Me 3 SiCl привела к осаждению фиолетового твердого вещества, которое, как было подтверждено инфракрасной спектроскопией, было полностью безводным. . Поскольку большая часть H 2 O в CrCl 3 · 6H 2 O была удалена на этапе вакуумирования, 6,0 экв. Me 3 SiCl (эквивалентное количество, необходимое для превращения CrCl 2 (OH)(H 2 O) 2 в CrCl 3 (thf) x , схема 2) вместо 60 экв./Cr, и, соответственно, количество ТГФ можно было минимизировать (36 мл/10 г — CrCl 3 · 6H 2 O). Цвет и форма осажденного твердого вещества (неправильного фиолетового твердого вещества) были почти идентичны таковым у коммерческого источника CrCl 3 (thf) 3 и у полученного без этапа вакуумирования. Однако, как упоминалось выше, характеристики катализатора были значительно лучше при использовании CrCl 3 (thf) 3 , приготовленного на стадии вакуумирования.
Обработка CrCl 2 (OH)(H 2 O) 2 после растворения в ТГФ Me 3 SiCl привела к осаждению фиолетового твердого вещества, которое, как было подтверждено инфракрасной спектроскопией, было полностью безводным. . Поскольку большая часть H 2 O в CrCl 3 · 6H 2 O была удалена на этапе вакуумирования, 6,0 экв. Me 3 SiCl (эквивалентное количество, необходимое для превращения CrCl 2 (OH)(H 2 O) 2 в CrCl 3 (thf) x , схема 2) вместо 60 экв./Cr, и, соответственно, количество ТГФ можно было минимизировать (36 мл/10 г — CrCl 3 · 6H 2 O). Цвет и форма осажденного твердого вещества (неправильного фиолетового твердого вещества) были почти идентичны таковым у коммерческого источника CrCl 3 (thf) 3 и у полученного без этапа вакуумирования. Однако, как упоминалось выше, характеристики катализатора были значительно лучше при использовании CrCl 3 (thf) 3 , приготовленного на стадии вакуумирования. Продукт реакции между [(CH 3 CN) 4 Ag] + [B(C 6 F 5 ) 4 ] — и 45 4 CrCl 309f 3 (т.e., [(CH 3 CN) 4 CRCL 2 ] 2 ] + ] +
Продукт реакции между [(CH 3 CN) 4 Ag] + [B(C 6 F 5 ) 4 ] — и 45 4 CrCl 309f 3 (т.e., [(CH 3 CN) 4 CRCL 2 ] 2 ] + ] +
0 [B (C 6 F 5 ) 4 ] — ) отличались в зависимости от источника CRCL 3 (тф) 3 . Хотя [(CH 3 CN) 4 CRCL 2 ] + ] + [B (C 6 F 5 ) 4 ] — ] — ] — было выделено осаждением в CH 3 CN в -30 °С, осадок не состоял из кристаллов хорошего качества; таким образом, рентгеновская кристаллография не может быть использована для характеристики.Мы перепроверили предварительно установленную структуру [(CH 3 CN) 4 CrCl 2 ] + [B(C 6 F 5 ) 4 числа 9] CH 3 молекул CN на каждый атом Cr посредством анализа значений интегрирования в спектрах H-ЯМР 1 , записанных с использованием THF-d 8 с 9-метилантраценом в качестве внутреннего стандарта. Для продукта, полученного с использованием CrCl 3 (thf) 3 , приготовленного на этапе вакуумирования, количество CH 3 CN на Cr хорошо соответствовало ожидаемому значению 4 (4.1, 3.8 или 4.0). Напротив, число отклонялось от 4 (6,5, 6,1, 5,3 или 6,2), когда использовался либо коммерческий источник CrCl 3 (thf) 3 , либо источник, приготовленный без этапа вакуумирования. двух образцов было то, что кристаллы хорошего качества осаждались в растворе CH 2 Cl 2 CrCl 3 (thf) 3 , приготовленном на стадии вакуумирования, в то время как твердое вещество неправильной формы осаждалось либо при коммерческий источник CrCl 3 (thf) 3 или приготовленный без этапа вакуумирования растворяли в CH 2 Cl 2 (рис. 1).Рентгеноструктурные исследования показали, что осажденные кристаллы представляли собой биядерный комплекс с Cl-мостиком [CrCl 2 (μ-Cl)(thf) 2 ] 2 (рис.
Для продукта, полученного с использованием CrCl 3 (thf) 3 , приготовленного на этапе вакуумирования, количество CH 3 CN на Cr хорошо соответствовало ожидаемому значению 4 (4.1, 3.8 или 4.0). Напротив, число отклонялось от 4 (6,5, 6,1, 5,3 или 6,2), когда использовался либо коммерческий источник CrCl 3 (thf) 3 , либо источник, приготовленный без этапа вакуумирования. двух образцов было то, что кристаллы хорошего качества осаждались в растворе CH 2 Cl 2 CrCl 3 (thf) 3 , приготовленном на стадии вакуумирования, в то время как твердое вещество неправильной формы осаждалось либо при коммерческий источник CrCl 3 (thf) 3 или приготовленный без этапа вакуумирования растворяли в CH 2 Cl 2 (рис. 1).Рентгеноструктурные исследования показали, что осажденные кристаллы представляли собой биядерный комплекс с Cl-мостиком [CrCl 2 (μ-Cl)(thf) 2 ] 2 (рис. 2). Атом Cr принял октаэдрическую структуру с двумя ТГФ в цис-положении. Расстояния связи между Cr и концевым Cl (2,277 и 2,289 Å) были короче, чем расстояния между Cr и мостиковым Cl (2,362 Å), а также расстояния Cr–Cl (3,299, 3,318 и 3,352 Å), наблюдаемые для мер- CrCl 3 (thf) 3 , структура которого была ранее выявлена с использованием монокристалла, полученного из реакционной емкости Cr(CH 2 SiMe 3 ) 4 и HCl в ТГФ (CCDC # 983659) [20].Расстояние между Cr и O THF , расположенным транс к терминальному Cl, было больше, чем между Cr и O THF , расположенным транс к мостику-Cl (2,045 против 2,018 Å). Атом O THF , расположенный транс к терминальному Cl, принял совершенную тригональную плоскую геометрию (сумма валентного угла вокруг атома O1, 360,0 °), что указывает на π-донорство от O к Cr посредством принятия sp 2 -гибридизации. Другой атом O THF , расположенный транс к мостику-Cl, отклонился от идеальной тригональной планарной геометрии (сумма валентного угла вокруг атома O1, 352.
2). Атом Cr принял октаэдрическую структуру с двумя ТГФ в цис-положении. Расстояния связи между Cr и концевым Cl (2,277 и 2,289 Å) были короче, чем расстояния между Cr и мостиковым Cl (2,362 Å), а также расстояния Cr–Cl (3,299, 3,318 и 3,352 Å), наблюдаемые для мер- CrCl 3 (thf) 3 , структура которого была ранее выявлена с использованием монокристалла, полученного из реакционной емкости Cr(CH 2 SiMe 3 ) 4 и HCl в ТГФ (CCDC # 983659) [20].Расстояние между Cr и O THF , расположенным транс к терминальному Cl, было больше, чем между Cr и O THF , расположенным транс к мостику-Cl (2,045 против 2,018 Å). Атом O THF , расположенный транс к терминальному Cl, принял совершенную тригональную плоскую геометрию (сумма валентного угла вокруг атома O1, 360,0 °), что указывает на π-донорство от O к Cr посредством принятия sp 2 -гибридизации. Другой атом O THF , расположенный транс к мостику-Cl, отклонился от идеальной тригональной планарной геометрии (сумма валентного угла вокруг атома O1, 352. 8°). Данные рентгеновской кристаллографии
8°). Данные рентгеновской кристаллографии не гарантируют чистоту массы. Данные ЭА C примерно соответствовали рассчитанным значениям для выявленной структуры [CrCl 2 (μ-Cl)(thf) 2 ] 2 (31,8%), хотя измеренные значения не всегда находились в пределах требуемый диапазон 31,8% ± 0,4% (30,7%, 30,9%, 30,4%, 31,0%, 30,5%, 30,2%, 30,4%, 30,9% и 31,2%). Напротив, данные ЭА C, измеренные либо для коммерческого источника CrCl 3 (thf) 3 , либо для источника, приготовленного без этапа вакуумирования, существенно отклонялись от значения, рассчитанного для CrCl 3 (thf) 3 (38.5%). Данные сильно колебались в зависимости от точек отбора проб (32,4%, 26,5%, 34,1%, 38,1% и 33,8% для бутылки купленного образца; 34,2%, 36,7%, 37,1%, 35,3% и 34,1% для другой бутылки). купленного образца; 31,3 %, 30,5 %, 37,0 %, 33,6 % и 33,9 % для образца, приготовленного без этапа вакуумирования). Перед перекристаллизацией в образце, приготовленном на этапе вакуумирования, также наблюдалось колебание содержания С при изменении точки отбора, причем содержание С не соответствовало ни структуре CrCl 3 (thf) 3 , ни структуре [CrCl 2 (μ-Cl)(thf) 2 ] 2 (35. 3%, 34,3%, 32,5%, 34,2% и 32,4%). Хотя содержание углерода и рентгенограмма не соответствуют формуле коммерческого источника CrCl 3 (ТГФ) 3 , содержание Cr, измеренное с помощью ICP-OES (оптико-эмиссионная спектроскопия с индуктивно связанной плазмой), и содержание Cl, измеренное с помощью гравиметрический анализ после обработки AgNO 3 водным раствором CrCl 3 (ТГФ) 3 не сильно отклонялся от значений, рассчитанных для формулы CrCl 3 (ТГФ) 3 (Расч.Кр 13,88, Кл 28,38. Найдено: Cr 14,04, Cl 29,09%). Содержание Cr, измеренное для приготовленного [CrCl 2 (μ-Cl)(thf) 2 ] 2 , точно совпало с расчетным значением, в то время как измеренное содержание Cl было немного отклонено (Расч. Cr 17,19, Cl 35,15. Найдено: Cr 17,18, Cl 34,58%).
3%, 34,3%, 32,5%, 34,2% и 32,4%). Хотя содержание углерода и рентгенограмма не соответствуют формуле коммерческого источника CrCl 3 (ТГФ) 3 , содержание Cr, измеренное с помощью ICP-OES (оптико-эмиссионная спектроскопия с индуктивно связанной плазмой), и содержание Cl, измеренное с помощью гравиметрический анализ после обработки AgNO 3 водным раствором CrCl 3 (ТГФ) 3 не сильно отклонялся от значений, рассчитанных для формулы CrCl 3 (ТГФ) 3 (Расч.Кр 13,88, Кл 28,38. Найдено: Cr 14,04, Cl 29,09%). Содержание Cr, измеренное для приготовленного [CrCl 2 (μ-Cl)(thf) 2 ] 2 , точно совпало с расчетным значением, в то время как измеренное содержание Cl было немного отклонено (Расч. Cr 17,19, Cl 35,15. Найдено: Cr 17,18, Cl 34,58%).
Порошковая рентгенограмма (XRD), наблюдаемая для объемного [CrCl 2 (μ-Cl)(thf) 2 ] 2 , выделенного с помощью процедуры перекристаллизации, хорошо согласуется с данными рентгеновской кристаллографии монокристалла (файл cif) (рис. 3а по сравнению сРисунок 3b), что указывает на то, что большая часть осажденного твердого вещества имеет структуру [CrCl 2 (μ-Cl)(thf) 2 ] 2 . Напротив, рентгенограмма приобретенного CrCl 3 (thf) 3 или полученного описанным способом без стадии вакуумирования не согласуется с данными рентгеноструктурного анализа монокристалла mer-CrCl 3 (thf) 3 (рис. 3c по сравнению с рис. 3e,f). Это наблюдение, наряду с несоответствием данных ЭА, создает неопределенность в отношении структуры и состава закупленного CrCl 3 (thf) 3 , а также полученного описанным способом.Твердое вещество, осажденное в реакционном сосуде CrCl 2 (OH)(H 2 O) 2 и Me 3 SiCl (6 экв.), показало сильный сигнал при 2θ = 11,6° вместе с сигналами, наблюдаемыми для образцы CrCl 3 (thf) 3 (рис. 3d). Спектр электронного парамагнитного резонанса (ЭПР) [CrCl 2 (μ-Cl)(thf) 2 ] 2 показал сильный сигнал при g = 1,98, тогда как для CrCl 3 наблюдались относительно слабые сигналы.
3а по сравнению сРисунок 3b), что указывает на то, что большая часть осажденного твердого вещества имеет структуру [CrCl 2 (μ-Cl)(thf) 2 ] 2 . Напротив, рентгенограмма приобретенного CrCl 3 (thf) 3 или полученного описанным способом без стадии вакуумирования не согласуется с данными рентгеноструктурного анализа монокристалла mer-CrCl 3 (thf) 3 (рис. 3c по сравнению с рис. 3e,f). Это наблюдение, наряду с несоответствием данных ЭА, создает неопределенность в отношении структуры и состава закупленного CrCl 3 (thf) 3 , а также полученного описанным способом.Твердое вещество, осажденное в реакционном сосуде CrCl 2 (OH)(H 2 O) 2 и Me 3 SiCl (6 экв.), показало сильный сигнал при 2θ = 11,6° вместе с сигналами, наблюдаемыми для образцы CrCl 3 (thf) 3 (рис. 3d). Спектр электронного парамагнитного резонанса (ЭПР) [CrCl 2 (μ-Cl)(thf) 2 ] 2 показал сильный сигнал при g = 1,98, тогда как для CrCl 3 наблюдались относительно слабые сигналы. (thf) 3 проб; кроме того, характер сигнала для двух образцов был совершенно разным (рис. 4).При термогравиметрическом анализе (ТГА) CrCl 3 (thf) 3 наблюдалось примерно четыре стадии потери веса (30%, 50%, 60% и 84% при 170°С, 215°С, 300°С). °С и 1000 °С соответственно), тогда как для [CrCl 2 (μ-Cl)(thf) 2 ] 2 (35%, 53% и 73% при 220°C, 310°C и 1000°C соответственно). Многочисленные попытки выращивания монокристаллов [(CH 3 CN) 4 CrCl 2 ] + [B(C 6 F 5 F 5 ) 4 ] — ] — ] — были неудачными, когда [(CH 3 CN) 4 AG] + [B (C 6 F 5 ) 4 ] − реагировал с покупным CrCl 3 (thf) 3 или полученным по реакции CrCl 3 ·6H 2 O и избытком Me 3 SiCl (60 экв.
(thf) 3 проб; кроме того, характер сигнала для двух образцов был совершенно разным (рис. 4).При термогравиметрическом анализе (ТГА) CrCl 3 (thf) 3 наблюдалось примерно четыре стадии потери веса (30%, 50%, 60% и 84% при 170°С, 215°С, 300°С). °С и 1000 °С соответственно), тогда как для [CrCl 2 (μ-Cl)(thf) 2 ] 2 (35%, 53% и 73% при 220°C, 310°C и 1000°C соответственно). Многочисленные попытки выращивания монокристаллов [(CH 3 CN) 4 CrCl 2 ] + [B(C 6 F 5 F 5 ) 4 ] — ] — ] — были неудачными, когда [(CH 3 CN) 4 AG] + [B (C 6 F 5 ) 4 ] − реагировал с покупным CrCl 3 (thf) 3 или полученным по реакции CrCl 3 ·6H 2 O и избытком Me 3 SiCl (60 экв. ) без вакуумирования шаг (схема 1) [38].Однако монокристаллы, подходящие для рентгеновской кристаллографии, могут быть получены при взаимодействии [CrCl 2 (μ-Cl)(thf) 2 ] 2 с [(CH 3 CN) 4 Ag] + [B(C 6 F 5 ) 4 ] − . Структура, определенная с помощью рентгеновской кристаллографии, показана на рис. 5. При взаимодействии четко определенных [(CH 3 CN) 4 CrCl 2 ] + [B(C 6 F 5 ) 4 ] − с лигандом iPrN{P(C 6 H 4 -p-Si(nBu) 3 ) 2 [37], высококачественный комплекс Cr [iPrN{P (C 6 H 4 H 4 -P-SI (NBU) 3 ) 2 } 2 } 2 CRCL 2 ] + [B (C 6 F 5 ) 4 ] — , который показал чрезвычайно высокую активность в реакции тетрамеризации этилена (активность: 6600 кг/г-Cr/ч; селективность: 1-октен — 74.
) без вакуумирования шаг (схема 1) [38].Однако монокристаллы, подходящие для рентгеновской кристаллографии, могут быть получены при взаимодействии [CrCl 2 (μ-Cl)(thf) 2 ] 2 с [(CH 3 CN) 4 Ag] + [B(C 6 F 5 ) 4 ] − . Структура, определенная с помощью рентгеновской кристаллографии, показана на рис. 5. При взаимодействии четко определенных [(CH 3 CN) 4 CrCl 2 ] + [B(C 6 F 5 ) 4 ] − с лигандом iPrN{P(C 6 H 4 -p-Si(nBu) 3 ) 2 [37], высококачественный комплекс Cr [iPrN{P (C 6 H 4 H 4 -P-SI (NBU) 3 ) 2 } 2 } 2 CRCL 2 ] + [B (C 6 F 5 ) 4 ] — , который показал чрезвычайно высокую активность в реакции тетрамеризации этилена (активность: 6600 кг/г-Cr/ч; селективность: 1-октен — 74. 7 %, 1-гексен — 7,5 %, циклический С6 — 3,8 %, С10+ — 13,8 %, ПЭ — 0,2 %; условия реакции: этилен 34 бар, 235 мл метилциклогексана, 0,45 ммоль катализатора Cr, 90 ммоль (iBu) 3 Al, 40 °C, 30 мин). Комплекс Cr [iPrN{P(C 6 H 4 -p-Si(nBu) 3 ) 2 } 2 CrCl 2 ] 904 6 F 5 ) 4 ] − хорошо растворим в метилциклогексане, что выгодно при проведении реакции тетрамеризации, и нет возможности очистки, что требует высококачественного прекурсора Cr [(CH 3 CN ) 4 CRCL 2 ] 2 ] + [B (C 6 F 5 ) 4 ] 4 ] — , а также высококачественный лиганд IPRN {P (C 6 H 4 -p-Si(nBu) 3 ) 2 } 2 для обеспечения неизменно высокой активности.В предыдущих исследованиях мы столкнулись с аналогичной проблемой, возможно, вызванной использованием нечистого CrCl 3 (thf) 3 .
7 %, 1-гексен — 7,5 %, циклический С6 — 3,8 %, С10+ — 13,8 %, ПЭ — 0,2 %; условия реакции: этилен 34 бар, 235 мл метилциклогексана, 0,45 ммоль катализатора Cr, 90 ммоль (iBu) 3 Al, 40 °C, 30 мин). Комплекс Cr [iPrN{P(C 6 H 4 -p-Si(nBu) 3 ) 2 } 2 CrCl 2 ] 904 6 F 5 ) 4 ] − хорошо растворим в метилциклогексане, что выгодно при проведении реакции тетрамеризации, и нет возможности очистки, что требует высококачественного прекурсора Cr [(CH 3 CN ) 4 CRCL 2 ] 2 ] + [B (C 6 F 5 ) 4 ] 4 ] — , а также высококачественный лиганд IPRN {P (C 6 H 4 -p-Si(nBu) 3 ) 2 } 2 для обеспечения неизменно высокой активности.В предыдущих исследованиях мы столкнулись с аналогичной проблемой, возможно, вызванной использованием нечистого CrCl 3 (thf) 3 . В реакции Li + [Et 2 Al(N(iPr) 2 ) 2 ] — и CrCl 3 (thf) 3 были выделены твердые вещества. однако их структуру не удалось определить с помощью рентгеновской кристаллографии. Предварительно считается, что продукт представляет собой [Et 2 Al(N(iPr) 2 ) 2 ]CrCl 2 [48].Однако монокристаллы были получены, когда четко определенные [CrCl 2 (μ-Cl) (thf) 2 ] 2 заменили нечистый CrCl 3 (thf) 3 , что позволило определить структуру X- лучевая кристаллография. Комплекс, выделенный из реакции Li + [Et 2 Al(N(iPr) 2 ) 2 ] — и CrCl 3 (thf) 3 не был ) комплекс [Et 2 Al(N(iPr) 2 ) 2 ]CrCl 2 но комплекс Cr(II) [{Et(Cl)Al(N(iPr) 2 ) 2 }Cr(μ-Cl)] 2 (рис. 6).
В реакции Li + [Et 2 Al(N(iPr) 2 ) 2 ] — и CrCl 3 (thf) 3 были выделены твердые вещества. однако их структуру не удалось определить с помощью рентгеновской кристаллографии. Предварительно считается, что продукт представляет собой [Et 2 Al(N(iPr) 2 ) 2 ]CrCl 2 [48].Однако монокристаллы были получены, когда четко определенные [CrCl 2 (μ-Cl) (thf) 2 ] 2 заменили нечистый CrCl 3 (thf) 3 , что позволило определить структуру X- лучевая кристаллография. Комплекс, выделенный из реакции Li + [Et 2 Al(N(iPr) 2 ) 2 ] — и CrCl 3 (thf) 3 не был ) комплекс [Et 2 Al(N(iPr) 2 ) 2 ]CrCl 2 но комплекс Cr(II) [{Et(Cl)Al(N(iPr) 2 ) 2 }Cr(μ-Cl)] 2 (рис. 6). 3. Материалы и методы
3.1. Общие замечания
Все манипуляции проводились в инертной атмосфере с использованием стандартного перчаточного бокса и техники Шленка. CH 2 Cl 2 и CH 3 CN перемешивали над CaH 2 и переносили в резервуар под вакуумом. Толуол, гексан и ТГФ перегоняли из бензофенонкетила. ЭА проводились в Аналитическом центре Университета Аджу. Непрерывные спектры ЭПР Х-диапазона были собраны при комнатной температуре на спектрометре EMX plus 6/1 (Bruker, Billerica, MA, USA) с экспериментальными параметрами: микроволновая мощность 1 мВт, амплитуда модуляции 10 Гс и 3 сканирования в KBSI Western Seoul Center. Корея.Данные HP-XRD были получены на D/max-2500V/PC (Rigaku, Akishima, Japan), оснащенном источником излучения Cu Kα (λ = 0,15418 нм).
3.2. [CrCl
2 (μ-Cl)(thf) 2 ] 2 Колбу Шленка, содержащую кристаллический твердый CrCl 3 ·6H 2 O (10,0 г, 37,5 мм) погружали в масло и баню при температуре 40°С, а затем вакуумировали в течение 1 часа под полным вакуумом. При вакуумировании температуру бани повышали до 100°С в течение часа, а затем поддерживали на уровне 100°С в течение 4 часов.По мере удаления летучих веществ кристаллическое твердое вещество превращалось в аморфный порошок, а цвет твердого вещества постепенно менялся от темно-зеленого до светло-зеленого, светло-серого и, наконец, светло-фиолетового. Масса уменьшилась с 10,0 до 6,39 г за счет удаления летучих веществ. Добавляли холодный ТГФ (32 г, -30°С) для растворения оставшегося твердого вещества. При растворении выделялось тепло, и получали темно-фиолетовый раствор. Часть нерастворимой части отфильтровывали, а затем к фильтрату добавляли Me 3 SiCl (24,5 г, 225 ммоль).Перемешивание раствора в течение ночи приводило к осаждению фиолетового твердого вещества. Твердое вещество выделяют фильтрованием и промывают ТГФ (10 мл) и гексаном (10 мл). Выделенное твердое вещество (6,60 г) помещали в большой флакон (объем ~70 мл) и добавляли CH 2 Cl 2 (53 г) для растворения твердого вещества. Когда флакон помещали в закрытую камеру (объем ~250 мл), содержащую метилциклогексан (~15 мл), CH 2 Cl 2 медленно испарялся, и в течение 24 ч выпадали пурпурные кристаллы, которые выделяли декантацией (4 .55 г, 69%).
3.3. [(CH
3 CN) 4 CRCL 2 ] + ] + [B (C 6 F 5 ) 4 ] — Решение [(CH 3 CN ) 4 Ag] + [B(C 6 F 5 ) 4 ] — (7,789 г, 8,189 ммоль) в ацетонитриле (7,789 г, 8,189 ммоль) добавляли к суспензии [a5Cr]4Cl (17,3 г) 2 (μ-Cl)(thf) 2 ] 2 (2,478 г, 8,189 ммоль) в ацетонитриле (22.6 г). После перемешивания в течение ночи при 60°С выпавший в осадок AgCl удаляли фильтрованием и получали раствор оливково-зеленого цвета. Растворитель удаляли с помощью вакуумной линии с получением твердого вещества оливково-зеленого цвета (7,71 г). Выделенное твердое вещество (20,0 мг) и 9-метилантрацен (20,0 мг) растворяли в ТГФ-d 8 и записывали спектр ЯМР 1 Н раствора для подсчета количества молекул СН 3 CN на на каждый атом Cr, что составляло 4,1. Выход составил 97% по формуле [(CH 3 CN) 4.1 CrCl 2 ] + [B(C 6 F 5 ) 4 ] − . Монокристаллы, пригодные для рентгеноструктурного анализа, были выращены в CH 2 Cl 2 ; Содержащий флакон [(CH 3 CN) 4 CRCL 2 ] + ] +
0 [B (C 6 F 5 ) 4 ] — (100 мг) в CH 2 Cl 2 (1,0 г) помещали в закрытую камеру, содержащую метилциклогексан, для осаждения кристаллов. 3.4. [IPRN {P (C
6 H 4 —SI (НБУ) 3 ) 2 } 2 CRCL 2 ] 2 ] + [B (C 6 F 5 ) 4 ] — ] — ] — Решение IPRN {P (C 6 H 4 -P-Si (НБУ) 3 ) 2 } 2 (9,50 г, 7,78 ммоль) в CH 2 Cl 2 (120 г) добавляли по каплям к раствору [(CH 3 CN) 4.1 CrCl 2 ] + [B(C 5 905 F 6 9 ) 4 ] − (7.55 г, 7,781 ммоль) в CH 2 Cl 2 (46 г). При добавлении цвет раствора сразу изменился с оливково-зеленого на голубовато-зеленый. После перемешивания в течение 2,5 ч растворитель полностью удаляли с помощью вакуумной линии. Остаток растворяли в минимальном количестве метилциклогексана (~5 мл) и удаляли растворитель с помощью вакуумной линии. Эту процедуру повторяли еще раз, чтобы полностью удалить любые остатки CH 3 CN и CH 2 Cl 2 . Остаток (15.7 г, 100%) растворяли в метилциклогексане (141,3 г) с получением 10 мас.% раствора, который использовали для тетрамеризации этилена.
3.5. [{Et(Cl)Al(N(iPr)
2 ) 2 }Cr(μ-Cl)] 2 [CrCl 2 (μ-Cl)(thf) 2 ] 2 (0,312 г, 1,03 ммоль) добавляли к раствору Li + [Et 2 Al(N(iPr) 2 ) 2 ] — (0,302 г, 1,03 ммоль) в толуоле. (4,5 мл) при -30 °С. Смесь перемешивали в течение 8 ч при комнатной температуре.Цвет раствора изменился с темно-коричневого на темно-зеленовато-синий, выпал осадок LiCl. Растворитель удаляли с помощью вакуумной линии, а остаток растворяли в гексане (30 мл). После удаления LiCl фильтрованием фильтрат концентрировали до ~10 мл и выдерживали при -30°C в течение 2 дней. Осаждены голубые кристаллы (0,178 г, 45%). Вторую порцию голубых кристаллов получали из маточного раствора (0,028 г, 7%).
3.6. Рентгеновская кристаллография
Образцы подходящего качества и размера отбирали, монтировали и центрировали в рентгеновском луче с помощью видеокамеры.Данные отражения были собраны при 100 K на площадном дифрактометре APEX II CCD (Bruker, Billerica, MA, USA) с использованием монохроматизированного графитом излучения Mo K–α (λ = 0,7107 Ǻ). Полусфера данных отражения была собрана в виде кадров сканирования φ и ω при 0,5 ° на кадр и времени экспозиции 10 с на кадр. Параметры ячейки определяли и уточняли с помощью программы SMART. Обработку данных проводили с помощью программного обеспечения SAINT. Данные были скорректированы на эффекты Лоренца и поляризации. Эмпирическая поправка на поглощение применялась с помощью программы SADABS.Структура расшифрована прямыми методами и уточнена полноматричным методом наименьших квадратов с использованием пакета SHELXTL и программы olex2 с анизотропными тепловыми параметрами для всех неводородных атомов.
Кристаллографические данные для [CrCl 2 (μ-Cl)(thf) 2 ] 2 (CCDC# 2044805), которые использовались во всех расчетах, следующие: C 8 H 15,5 Cl 9054 3 CrO 2 , М = 302,05, триклинная, а = 6,8070(8), б = 9,3170(11), в = 10.3192(13) Å, α = 108,070(5)°, β = 96,448(5)°, γ = 94,719(5), V = 613,47(13) Å 3 , пр. гр. P-1, Z = 2, и 2285 уникальных (R(int) = 0,0505). Окончательное значение wR 2 составило 0,1251 (I > 2σ(I)).
Кристаллографические данные для [(CH 3 CN) 4 CRCL 2 ] + ] + [B (C 6 F 5 ) 4 ] — · 2 (CH 2 Cl 2 ) (CCDC # 2044806), которые использовались во всех расчетах, следующие: C 34.5 H 17 BCl 7 CrF 20 N 4 , M = 1178,48, моноклинная, a = 12,9472(4), b = 8,2694(3), c = 21,7555, c = 99(8) 3 β (18)°, V = 2294,91(14) Å 3 , пространственная группа P2/c, Z = 2 и 4409 уникальных (R(int) = 0,0285). Окончательное значение wR 2 составило 0,1594 (I > 2σ(I)).
Кристаллографические данные для [{Et(Cl)Al(N(iPr) 2 ) 2 }Cr(μ-Cl)] 2 (CCDC # 2044807), которые использовались во всех расчетах, следующие: C 28 H 66 Al 2 Cl 4 Cr 2 N 4 , M = 758.60, моноклинная, a = 10,2937(2), b = 12,8707(3), c = 14,7815(3) Å, β = 96,5009(18)°, V = 1945,77(7) Å 3 , пр. группа P2 1 /n, Z = 2 и 3675 уникальных (R(int) = 0,1527). Окончательное значение wR 2 составило 0,0909 (I > 2σ(I)).
С точки зрения формул, почему crcl3 и crcl3.6h…
Итак, в этом вопросе, чем отличаются коэффициенты в химическом уравнении от нижнего индекса в химических формулах. Итак, давайте предположим сбалансированное химическое уравнение.Итак, это дворцовое уравнение для железа без трех или двух, которое будет составлять каждые два или три. Потому что в прямой внутренней части для атома железа есть и в стороне продукта, то же самое для атомов железа есть и в разрушенной внутренней части шесть атомов кислорода, а в стороне продукта всего шесть атомов кислорода. Итак, это сбалансированное уравнение, поэтому мы можем видеть, что оно рассматривается таким образом. Так что это пример каждые два или три. Сделаем так это железо и это железо и кислород. Таким образом, это представляет символы элемента символа элемента.Итак, что говорит то, что может сказать элемент в молекуле элемент в молекуле. Нет. Теперь учтите, что это касается каждых двух или трех. Итак, это для обозначения двух и трех. Таким образом, эти два представляют собой индекс нижнего индекса, который говорит о том, что может сказать номер. Нет моделей атомов с каждого элемента при прыжках с каждого элемента в молекуле, действительно, молекулы. А теперь давайте рассмотрим пятое усилие или три. Так что это репрезентативный коэффициент коэффициента, который может определить количество беременных молекул, количество присутствующих молекул.Итак, теперь давайте рассмотрим эту ситуацию, когда четыре F-файла три или два образуют два или три Эффи. Таким образом, в этой ситуации, как мы знаем, это случай баланса, потому что число, которое выходит из железа и кислорода на доске, равно четырем железам слева и четырем элементам справа, неправильному направлению и шести атомам. кислород и шесть атомов. Кислород на теле оттенил направление. Итак, теперь эти четыре, Так что мы можем написать красным, это означает, что четыре молекулы из железа, три молекулы из железа, три молекулы из двух или две и две молекулы души через каждые два или три.Итак, этот случай представляет вот так. Итак, в основном эти четыре. Итак, четыре, три и два. Таким образом, это представляет эффективную Стокгольмскую метрику. Таким образом, они представляют собой стандартные элементарные коэффициенты, или мы можем сказать коэффициенты и нижний индекс, что означает два атома от кислорода в одной молекуле от комы, два и три атома до и три атома от железа и кислорода в атоме. Прочь через каждые два или три. Итак, теперь мы можем это видеть. Итак, эта четверка видит это 43 и два. Таким образом, это представляет собой в основном коэффициент.И это к тому два атома кислорода в одной молекуле, одна молекула кислорода и два и три атома железа и кислорода в атоме, Каждые два или три. По сути, этот красный цвет представляет собой вот такой коэффициент, а этот зеленый вот такой. Так что это может представлять так это может представлять нижний индекс, как мы объясняем для этой реакции.
Молекулярная масса CrCl3
Молярная масса CrCl3 = 158,3551 г/моль
Это соединение также известно как хлорид хрома (III).
Перевести граммы CrCl3 в моли или моли CrCl3 в граммы
Расчет молекулярной массы:
51,9961 + 35,453*3
Элемент Символ Атомная масса Количество атомов Процент по массе Хлор Кл 35.453 3 67,165% Хром Кр 51.9961 1 32,835%
В химии формульный вес представляет собой величину, вычисляемую путем умножения атомного веса (в атомных единицах массы) каждого элемента в химической формуле на число атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные массы и рассчитать молекулярную массу вещества.
Нахождение молярной массы начинается с граммов на моль (г/моль). При расчете молекулярной массы химического соединения она сообщает нам, сколько граммов содержится в одном моле этого вещества. Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
Атомные веса, используемые на этом сайте, получены из NIST, Национального института стандартов и технологий. Мы используем самые распространенные изотопы. Вот как можно рассчитать молярную массу (среднюю молекулярную массу), основанную на изотропно взвешенных средних.Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов. Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Обычный запрос на этом сайте — конвертировать граммы в моли. Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать. Причина в том, что на конверсию влияет молярная масса вещества. Этот сайт объясняет, как найти молярную массу.
Если формула, используемая для расчета молекулярной массы, является молекулярной формулой, вычисляемая формула веса является молекулярной массой. Весовой процент любого атома или группы атомов в соединении можно рассчитать, разделив общий вес атома (или группы атомов) в формуле на вес формулы и умножив на 100.
 2019,141,6022–6029,doi:10.1021/jacs.9b01387.
2019,141,6022–6029,doi:10.1021/jacs.9b01387.- Последнее обновление
- Ионизация Изомерия
- Координация Изомерия
- Рычажный Изомерия
- Planar Изомеры
- Октаэдрические Изомеры
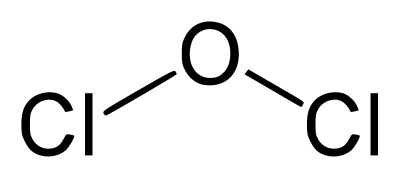
 Различают две основные формы изомерии: структурная изомерия и стереоизомерия (пространственная изомерия).
Различают две основные формы изомерии: структурная изомерия и стереоизомерия (пространственная изомерия).
 {-}}\) в растворе соответственно.
{-}}\) в растворе соответственно. Например, рассмотрим аквакомплекс \(\ce{NiCl_2 \cdot 6H_2O}\), состоящий из разделенных транс -[NiCl 2 (H 2 O) 4 ] молекул, более слабо связанных с соседней водой молекулы.Только четыре из шести молекул воды в формуле связаны с катионом никеля (II), а оставшиеся две представляют собой воды кристаллизации по мере разрешения кристаллической структуры (рис. \(\PageIndex{3}\)).
Например, рассмотрим аквакомплекс \(\ce{NiCl_2 \cdot 6H_2O}\), состоящий из разделенных транс -[NiCl 2 (H 2 O) 4 ] молекул, более слабо связанных с соседней водой молекулы.Только четыре из шести молекул воды в формуле связаны с катионом никеля (II), а оставшиеся две представляют собой воды кристаллизации по мере разрешения кристаллической структуры (рис. \(\PageIndex{3}\)). Вода заслуживает внимания, потому что она реакционноспособна, тогда как другие растворители, такие как бензол, считаются химически безвредными.
Вода заслуживает внимания, потому что она реакционноспособна, тогда как другие растворители, такие как бензол, считаются химически безвредными. {-}}\)) ион – это лиганд , который может связываться с центральным атомом через атом азота или кислорода, но не может связываться с центральным атомом одновременно с кислородом и азотом, и в этом случае он будет называться полидентатный лиганд , а не амбидентатный лиганд .
{-}}\)) ион – это лиганд , который может связываться с центральным атомом через атом азота или кислорода, но не может связываться с центральным атомом одновременно с кислородом и азотом, и в этом случае он будет называться полидентатный лиганд , а не амбидентатный лиганд .- Ответить
Здесь разница заключается в том, как лиганд связывается с металлом. В первом изомере лиганд связывается с металлом через пару электронов на атоме азота. Во втором изомере лиганд связывается с металлом через электронную пару на одном из атомов кислорода. Это проще увидеть:
Класс 2: геометрические изомеры
Наличие координационных соединений с одинаковой формулой, но разным расположением лигандов имело решающее значение в развитии координационной химии. Два или более соединений с одинаковой формулой, но разным расположением атомов называются изомерами . Поскольку изомеры обычно имеют разные физические и химические свойства, важно знать, с каким изомером мы имеем дело, если возможно более одного изомера. Напомним, что во многих случаях органические соединения с одной и той же молекулярной формулой могут иметь более одной структуры; рассмотренные ранее примеры включают н-бутан по сравнению с изобутаном и цис-2-бутен по сравнению с транс-2-бутеном.Как мы увидим, координационные соединения имеют те же типы изомеров, что и органические соединения, а также несколько уникальных видов изомеров.
Два или более соединений с одинаковой формулой, но разным расположением атомов называются изомерами . Поскольку изомеры обычно имеют разные физические и химические свойства, важно знать, с каким изомером мы имеем дело, если возможно более одного изомера. Напомним, что во многих случаях органические соединения с одной и той же молекулярной формулой могут иметь более одной структуры; рассмотренные ранее примеры включают н-бутан по сравнению с изобутаном и цис-2-бутен по сравнению с транс-2-бутеном.Как мы увидим, координационные соединения имеют те же типы изомеров, что и органические соединения, а также несколько уникальных видов изомеров.
Плоские изомеры
Комплексы металлов, отличающиеся только тем, что лиганды расположены рядом друг с другом ( цис ) или прямо напротив друг друга ( транс ) в координационной сфере металла, называются геометрическими изомерами. Они наиболее важны для квадратных плоских и октаэдрических комплексов.
Поскольку все вершины квадрата эквивалентны, не имеет значения, какую вершину занимает лиганд B в квадратно-плоском комплексе MA 3 B; следовательно, в этом случае возможен только один геометрический изомер (и в аналогичном случае MAB 3 ).Все четыре показанные здесь структуры химически идентичны, поскольку их можно наложить друг на друга, просто вращая комплекс в пространстве:
Для комплекса MA 2 B 2 возможны два изомера: либо лиганды A могут быть смежными друг с другом (цис), и в этом случае лиганды B также должны быть цис, либо лиганды A могут быть напротив друг друга (транс), и в этом случае лиганды B также должны быть транс. Несмотря на то, что цис-изомер можно изобразить четырьмя различными способами, а транс-изомер — двумя различными способами, все члены каждого набора химически эквивалентны:
Поскольку нет способа преобразовать цис-структуру в транс-поворот молекулы в пространстве или перевернуть ее, это принципиально разные расположения атомов в пространстве. Вероятно, наиболее известными примерами цис- и транс-изомеров квадратно-плоского комплекса MA 2 B 2 являются цис-Pt(NH 3 ) 2 Cl 2 , также известный как цисплатин, и транс- Pt(NH 3 ) 2 Cl 2 , который на самом деле скорее токсичен, чем терапевтичен.
Вероятно, наиболее известными примерами цис- и транс-изомеров квадратно-плоского комплекса MA 2 B 2 являются цис-Pt(NH 3 ) 2 Cl 2 , также известный как цисплатин, и транс- Pt(NH 3 ) 2 Cl 2 , который на самом деле скорее токсичен, чем терапевтичен.
Противораковый препарат цисплатин и его неактивный транс-изомер. Цисплатин особенно эффективен при опухолях репродуктивных органов, которые в основном поражают людей в возрасте 20 лет и, как известно, трудноизлечимы.Например, после того, как в 1991 году у Лэнса Армстронга был диагностирован метастазирующий рак яичка и шансы на выживание составляли всего 50%, Лэнс Армстронг вылечился с помощью лечения цисплатином.
Квадратные плоские комплексы, содержащие симметричные бидентатные лиганды, такие как [Pt(en) 2 ] 2+ , имеют только одну возможную структуру, в которой изогнутые линии, соединяющие два атома N, указывают на этилендиаминовые лиганды:
Упражнение \(\PageIndex{4}\)
Нарисуйте цис- и транс-изомеры следующих соединений:
- (NH 3 ) 2 IrCl(CO)
- (H 3 P) 2 PtHBr
- (AsH 3 ) 2 PtH(CO)
Упражнение \(\PageIndex{5}\)
Возможен только один изомер (tmeda)PtCl 2 [tmeda = (CH 3 ) 2 NCH 2 CH 2 N(CH 3 6 ) 2905; оба атома азота соединяются с платиной]. Нарисуйте этот изомер и объясните, почему другой изомер невозможен.
Нарисуйте этот изомер и объясните, почему другой изомер невозможен.
Октаэдрические изомеры
Октаэдрические комплексытакже имеют цис- и транс-изомеры. Как и для квадратных плоских комплексов, для октаэдрических комплексов возможна только одна структура, в которой только один лиганд отличается от остальных пяти (MA 5 B). Хотя мы обычно изображаем октаэдр таким образом, который предполагает, что четыре «плоскостных» лиганда отличаются от двух «осевых» лигандов, на самом деле все шесть вершин октаэдра эквивалентны.Следовательно, как бы мы ни рисовали структуру MA 5 B, ее можно наложить на любое другое представление, просто вращая молекулу в пространстве. Две из многих возможных ориентаций структуры MA 5 B следующие:
Если два лиганда в октаэдрическом комплексе отличаются от четырех других, что дает комплекс MA 4 B 2 , возможны два изомера. Два лиганда B могут быть цис- или транс-. Цис- и транс-[Co(NH 3 ) 4 Cl 2 ]Cl являются примерами этого типа системы:
Замена другого лиганда A на B дает комплекс MA 3 B 3 , для которого также существуют два возможных изомера. В одном три лиганда каждого вида занимают противоположные треугольные грани октаэдра; это называется изомером fac (для лица). В другом случае три лиганда каждого вида лежат на меридиане, если рассматривать комплекс как сферу; это называется меризомером (для меридионального):
В одном три лиганда каждого вида занимают противоположные треугольные грани октаэдра; это называется изомером fac (для лица). В другом случае три лиганда каждого вида лежат на меридиане, если рассматривать комплекс как сферу; это называется меризомером (для меридионального):
Пример \(\PageIndex{4}\)
Изобразите все возможные геометрические изомеры комплекса [Co(H 2 O) 2 (ox)BrCl] − , где ox − O 2 CCO 2 , который обозначает оксалат.
Раствор
Дано : формула комплекса
Запрашиваемый : структуры геометрических изомеров
Этот комплекс содержит один бидентатный лиганд (оксалат), который может занимать только соседние (цис) положения, и четыре монодентатных лиганда, два из которых идентичны (H 2 O). Самый простой способ решить эту проблему — систематически просматривать различные комбинации лигандов, чтобы определить, какие лиганды могут быть транс. Таким образом, либо водные лиганды могут трансформироваться друг к другу, либо два галогенидных лиганда могут трансформироваться друг к другу, давая два показанных здесь геометрических изомера:
Таким образом, либо водные лиганды могут трансформироваться друг к другу, либо два галогенидных лиганда могут трансформироваться друг к другу, давая два показанных здесь геометрических изомера:
Кроме того, возможны две структуры, в которых один из галогенидов находится в транс к водному лиганду. В первом хлоридный лиганд находится в той же плоскости, что и оксалатный лиганд, и находится в транс-положении к одному из оксалатных атомов кислорода. Обмен хлоридного и бромидного лигандов дает другой, в котором бромидный лиганд находится в той же плоскости, что и оксалатный лиганд, и находится в транс-положении к одному из оксалатных атомов кислорода:
Таким образом, этот комплекс может существовать в виде четырех различных геометрических изомеров.
Упражнение \(\PageIndex{6}\)
Изобразите все возможные геометрические изомеры комплекса [Cr(en) 2 (CN) 2 ] + .
- Ответить
Возможны два геометрических изомера: транс и цис .

Резюме
Наличие координационных соединений с одинаковой формулой, но разным расположением лигандов имело решающее значение в развитии координационной химии.Два или более соединений с одинаковой формулой, но разным расположением атомов называются изомерами . Многие комплексы металлов образуют изомеры, которые представляют собой два или более соединений с одинаковой формулой, но разным расположением атомов. Структурные изомеры отличаются тем, что атомы связаны друг с другом, в то время как геометрические изомеры отличаются только расположением лигандов вокруг иона металла. Лиганды, соседние друг с другом, являются цис, а лиганды, расположенные напротив друг друга, являются транс.
Таблица \(\PageIndex{1}\) подчеркивает ключевые различия трех классов структурных изомеров, обсуждаемых ниже.Выделенные ионы — это ионы, которые каким-то образом переключаются или изменяются, образуя тот тип структурного изомера, которым он является.
| Структурный изомер | Примеры |
|---|---|
| Ионизация | [CoBr(H 2 O) 5 ] + Cl — и [CoCl(H 2 O) 5 ] + 10 Br |
| Координация | [ZN (NH 3 ) 4 ] 4 ] + [CUCL 4 ] 2- и [CU (NH 3 ) 4 ] + [ZNCL 4 ] 2 — |
| Рычажный механизм | [Co(NO 2 ) 6 ] 3- и [Co(ONO) 6 ] 3- |
Каталожные номера
- Петруччи, Харвуд, Херринг и Мадура.
 Общая химия: принципы и современные приложения: девятое издание. Нью-Джерси: Пирсон, 2007.
Общая химия: принципы и современные приложения: девятое издание. Нью-Джерси: Пирсон, 2007. - Аткинс, Питер и Лоретта Джонс. Химические принципы: В поисках понимания: четвертое издание . WH Freeman and Company, 2008. Печать.
Авторы и авторство
молекул | Бесплатный полнотекстовый | Замена обычного источника хрома CrCl3(thf)3 на точно определенный [CrCl2(μ-Cl)(thf)2]2
1.Введение
CrCl 3 (thf) 3 широко используется в качестве исходного материала для синтеза металлоорганических и координационных соединений Cr [1,2,3,4,5,6,7,8,9,10 ]. О способе его приготовления было сообщено 60 лет назад; безводный CrCl 3 , нерастворимый в органических растворителях, а также в воде, экстрагировали ТГФ с помощью цинковой пыли на аппарате Сокслета [11,12,13]. Однако безводный CrCl 3 получают опасным и непростым процессом (обработка Cr 2 O 3 ·xH 2 O CCl 4 при 630 °C приводит к образованию чрезвычайно токсичного фосгена). газ) и, следовательно, дорого [14,15].Сообщалось о другом методе, в котором CrCl 3 · 6H 2 O подвергали взаимодействию с избытком тионилхлорида (S(O)Cl 2 ) с образованием безводного CrCl 3 . В этом процессе была получена другая форма гигроскопичного CrCl 3 , из которого можно было сразу после добавления ТГФ получить CrCl 3 (thf) 3 [16,17,18]. Наиболее привлекательным и удобным методом является взаимодействие CrCl 3 ·6H 2 O с избытком Me 3 SiCl в ТГФ, приводящее к осаждению CrCl 3 (thf) 3 наряду с образованием побочных продуктов, HCl и Me 3 Siosime 3 (CRCL 3 · 6H 2 O + 12 Me 3 SICL → CRCL 3 (THF) 3 + 12 HCL + 6 ME 3 SIOSIME 3 ) [19].Необходимо добавить избыток Me 3 SiCl (~60 экв/Cr) для получения полностью безводной формы CrCl 3 (thf) 3 [20].
газ) и, следовательно, дорого [14,15].Сообщалось о другом методе, в котором CrCl 3 · 6H 2 O подвергали взаимодействию с избытком тионилхлорида (S(O)Cl 2 ) с образованием безводного CrCl 3 . В этом процессе была получена другая форма гигроскопичного CrCl 3 , из которого можно было сразу после добавления ТГФ получить CrCl 3 (thf) 3 [16,17,18]. Наиболее привлекательным и удобным методом является взаимодействие CrCl 3 ·6H 2 O с избытком Me 3 SiCl в ТГФ, приводящее к осаждению CrCl 3 (thf) 3 наряду с образованием побочных продуктов, HCl и Me 3 Siosime 3 (CRCL 3 · 6H 2 O + 12 Me 3 SICL → CRCL 3 (THF) 3 + 12 HCL + 6 ME 3 SIOSIME 3 ) [19].Необходимо добавить избыток Me 3 SiCl (~60 экв/Cr) для получения полностью безводной формы CrCl 3 (thf) 3 [20]. В противном случае (например, при добавлении 25 экв. Me 3 SiCl/Cr согласно литературным данным) получается гидратированный CrCl 3 (thf) 2 (H 2 O), который ошибочно продавался как CrCl 3 (thf) 3 в прошлом [20, 21]. Sasol описал каталитическую систему, состоящую из источника Cr, лиганда iPrN(PPh 2 ) 2 и метилалюмоксана (МАО), который производит в основном 1-октен за счет тетрамеризации этилена [22,23,24].CrCl 3 (thf) 3 активно используется в качестве компонента каталитической системы тетрамеризации этилена [25, 26, 27, 28, 29, 30, 31, 32, 33, 34]. Мы также разработали очень эффективный катализатор тетрамеризации этилена (схема 1) [35,36,37]. Катализатор демонстрирует чрезвычайно высокую активность (~5000 кг/г Cr/ч) и имеет преимущество перед другими описанными системами, поскольку он работает с недорогим активатором, iBu 3 Al, что позволяет избежать чрезмерного использования дорогого МАО (A1/ Кр = 300–500) [38,39,40,41,42,43].
В противном случае (например, при добавлении 25 экв. Me 3 SiCl/Cr согласно литературным данным) получается гидратированный CrCl 3 (thf) 2 (H 2 O), который ошибочно продавался как CrCl 3 (thf) 3 в прошлом [20, 21]. Sasol описал каталитическую систему, состоящую из источника Cr, лиганда iPrN(PPh 2 ) 2 и метилалюмоксана (МАО), который производит в основном 1-октен за счет тетрамеризации этилена [22,23,24].CrCl 3 (thf) 3 активно используется в качестве компонента каталитической системы тетрамеризации этилена [25, 26, 27, 28, 29, 30, 31, 32, 33, 34]. Мы также разработали очень эффективный катализатор тетрамеризации этилена (схема 1) [35,36,37]. Катализатор демонстрирует чрезвычайно высокую активность (~5000 кг/г Cr/ч) и имеет преимущество перед другими описанными системами, поскольку он работает с недорогим активатором, iBu 3 Al, что позволяет избежать чрезмерного использования дорогого МАО (A1/ Кр = 300–500) [38,39,40,41,42,43]. В ходе исследований у нас возникла проблема с воспроизведением столь чрезвычайно высокой активности, и в итоге мы обнаружили, что причиной этой проблемы был источник Cr CrCl 3 (thf) 3 , использованный в препарате. Хотя структура CrCl 3 (thf) 3 была выявлена с помощью рентгеновской кристаллографии, с использованием монокристалла, отобранного из партии в процессе экстракции по Сокслету, он не переосаждается в виде кристаллов хорошего качества при повторном растворении в CH . 2 Cl 2 [44,45].Структура, выясненная с помощью рентгеновской кристаллографии, не гарантирует чистоты объема, и мы поставили под сомнение чистоту обычного источника Cr CrCl 3 (thf) 3 . На самом деле, о нем сообщалось как о «фиолетовом твердом веществе неправильной формы», что может означать, что это не чистый CrCl 3 (thf) 3 , а смесь, содержащая другие формы аддукта ТГФ CrCl 3 (например, μ2 -Cl-мостиковые многоядерные соединения) [46].
В ходе исследований у нас возникла проблема с воспроизведением столь чрезвычайно высокой активности, и в итоге мы обнаружили, что причиной этой проблемы был источник Cr CrCl 3 (thf) 3 , использованный в препарате. Хотя структура CrCl 3 (thf) 3 была выявлена с помощью рентгеновской кристаллографии, с использованием монокристалла, отобранного из партии в процессе экстракции по Сокслету, он не переосаждается в виде кристаллов хорошего качества при повторном растворении в CH . 2 Cl 2 [44,45].Структура, выясненная с помощью рентгеновской кристаллографии, не гарантирует чистоты объема, и мы поставили под сомнение чистоту обычного источника Cr CrCl 3 (thf) 3 . На самом деле, о нем сообщалось как о «фиолетовом твердом веществе неправильной формы», что может означать, что это не чистый CrCl 3 (thf) 3 , а смесь, содержащая другие формы аддукта ТГФ CrCl 3 (например, μ2 -Cl-мостиковые многоядерные соединения) [46]. Данные элементного анализа (ЭА) для Cr и Cl были опубликованы, но общие данные по углероду и водороду отсутствовали.CrCl 3 (thf) 3 является парамагнитным; таким образом, его нельзя подвергнуть структурному анализу с использованием спектроскопии ЯМР 1 H и 13 C ЯМР. Ранее мы также обнаружили, что состав (а также структура) коммерческого источника (2-этилгексаноата) 3 Cr, другого типа важного парамагнитного комплекса Cr(III), который коммерчески используется в качестве компонента в этиленовом катализатор тримеризации [47]. ошибочно [21,48]. Путем корректировки структуры на (2-этилгексаноат) 2 CrOH каталитические характеристики были постоянными и, кроме того, значительно улучшились.
Данные элементного анализа (ЭА) для Cr и Cl были опубликованы, но общие данные по углероду и водороду отсутствовали.CrCl 3 (thf) 3 является парамагнитным; таким образом, его нельзя подвергнуть структурному анализу с использованием спектроскопии ЯМР 1 H и 13 C ЯМР. Ранее мы также обнаружили, что состав (а также структура) коммерческого источника (2-этилгексаноата) 3 Cr, другого типа важного парамагнитного комплекса Cr(III), который коммерчески используется в качестве компонента в этиленовом катализатор тримеризации [47]. ошибочно [21,48]. Путем корректировки структуры на (2-этилгексаноат) 2 CrOH каталитические характеристики были постоянными и, кроме того, значительно улучшились.2. Результаты и обсуждение.
O с избытком Me 3 SiCl (60 экв.) [20]. Мы модифицировали методику следующим образом: CrCl 3 ·6H 2 O вакуумировали в течение ~6 ч перед обработкой Me 3 SiCl. Катализатор [IPRN {P (C 6 H 4 -P-Si (NBU) 3 ) 2 ) 2 } 2 CRCL 2 ] + ] + [B (C 6 F 5 ) 4 ] − , приготовленный по схеме 1 с использованием CrCl 3 (thf) 3 , полученный на стадии вакуумирования, обеспечил чрезвычайно высокую активность (~5000 кг/г-Cr/ч ).Напротив, катализатор, приготовленный с использованием коммерческого источника CrCl 3 (thf) 3 или катализатор, приготовленный в соответствии с описанным способом без стадии вакуумирования, не проявлял такой высокой активности (~3000 кг/г-Cr). /h), а при взаимодействии лиганда iPrN{P(C 6 H 4 -p-Si(nBu) 3 ) 2 } 2 с [ (CH 3 CN) 4 CrCl 2 ] + [B(C 6 F 5 ) 4 ]
Катализатор [IPRN {P (C 6 H 4 -P-Si (NBU) 3 ) 2 ) 2 } 2 CRCL 2 ] + ] + [B (C 6 F 5 ) 4 ] − , приготовленный по схеме 1 с использованием CrCl 3 (thf) 3 , полученный на стадии вакуумирования, обеспечил чрезвычайно высокую активность (~5000 кг/г-Cr/ч ).Напротив, катализатор, приготовленный с использованием коммерческого источника CrCl 3 (thf) 3 или катализатор, приготовленный в соответствии с описанным способом без стадии вакуумирования, не проявлял такой высокой активности (~3000 кг/г-Cr). /h), а при взаимодействии лиганда iPrN{P(C 6 H 4 -p-Si(nBu) 3 ) 2 } 2 с [ (CH 3 CN) 4 CrCl 2 ] + [B(C 6 F 5 ) 4 ]9 —
9 — .0Нерастворимой фракцией можно пренебречь, когда в качестве исходного материала используют CrCl 3 (thf) 3 , который получают на стадии вакуумирования.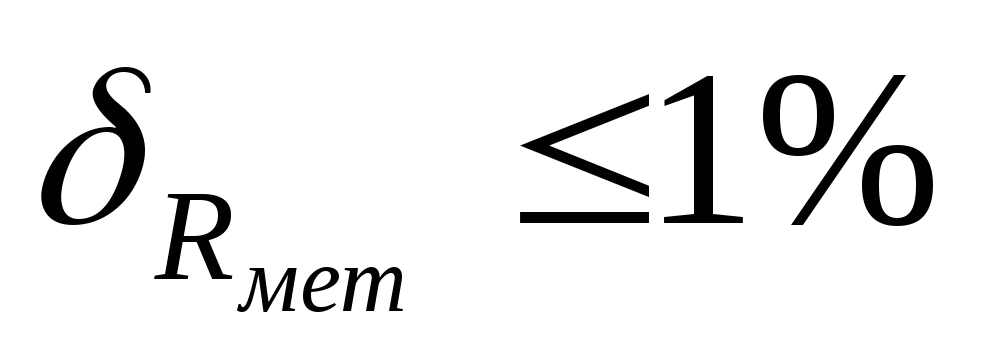 Мы исследовали, что происходит на этапе вакуумирования. Когда кристаллическую форму CrCl 3 ·6H 2 O (10 г, 37,5 ммоль) вакуумировали при 100 °C, цвет постепенно менялся от темно-зеленого до светло-зеленого, светло-серого и, наконец, светло-фиолетового с постепенным исчезновением. веса. Наконец, был получен аморфный порошок, а потеря массы приблизилась к 36% (6,5%).осталось 39 г). Дальнейшее снижение веса было минимальным при увеличении времени эвакуации. Лакмусовой бумажкой было подтверждено, что удаленный летучий компонент представляет собой не чистую воду, а кислую, предположительно содержащую HCl. На основании этих наблюдений оставшееся соединение Cr предварительно рассматривалось как CrCl 2 (OH) (H 2 O) 2 ; При превращении CrCl 3 ·6H 2 O в CrCl 2 (OH)(H 2 O) 2 ожидается потеря массы 34% (схема 2).Сообщается, что структура CrCl 3 · 6H 2 O представляет собой [CrCl 2 (H 2 O) 4 ]Cl·2H 2 O, и воздействие тепла в вакууме может высвободить внешняя сфера Cl — (в виде HCl с протоном в воде внутренней сферы) и три молекулы воды (две из внешней сферы и одна из внутренней сферы), в результате чего остается CrCl 2 (OH) (H 2 O) 2 (возможно, [CrCl 2 (H 2 O) 2 (μ-OH)] 2 с октаэдрической структурой) в реакционном сосуде.
Мы исследовали, что происходит на этапе вакуумирования. Когда кристаллическую форму CrCl 3 ·6H 2 O (10 г, 37,5 ммоль) вакуумировали при 100 °C, цвет постепенно менялся от темно-зеленого до светло-зеленого, светло-серого и, наконец, светло-фиолетового с постепенным исчезновением. веса. Наконец, был получен аморфный порошок, а потеря массы приблизилась к 36% (6,5%).осталось 39 г). Дальнейшее снижение веса было минимальным при увеличении времени эвакуации. Лакмусовой бумажкой было подтверждено, что удаленный летучий компонент представляет собой не чистую воду, а кислую, предположительно содержащую HCl. На основании этих наблюдений оставшееся соединение Cr предварительно рассматривалось как CrCl 2 (OH) (H 2 O) 2 ; При превращении CrCl 3 ·6H 2 O в CrCl 2 (OH)(H 2 O) 2 ожидается потеря массы 34% (схема 2).Сообщается, что структура CrCl 3 · 6H 2 O представляет собой [CrCl 2 (H 2 O) 4 ]Cl·2H 2 O, и воздействие тепла в вакууме может высвободить внешняя сфера Cl — (в виде HCl с протоном в воде внутренней сферы) и три молекулы воды (две из внешней сферы и одна из внутренней сферы), в результате чего остается CrCl 2 (OH) (H 2 O) 2 (возможно, [CrCl 2 (H 2 O) 2 (μ-OH)] 2 с октаэдрической структурой) в реакционном сосуде. Обработка CrCl 2 (OH)(H 2 O) 2 после растворения в ТГФ Me 3 SiCl привела к осаждению фиолетового твердого вещества, которое, как было подтверждено инфракрасной спектроскопией, было полностью безводным. . Поскольку большая часть H 2 O в CrCl 3 · 6H 2 O была удалена на этапе вакуумирования, 6,0 экв. Me 3 SiCl (эквивалентное количество, необходимое для превращения CrCl 2 (OH)(H 2 O) 2 в CrCl 3 (thf) x , схема 2) вместо 60 экв./Cr, и, соответственно, количество ТГФ можно было минимизировать (36 мл/10 г — CrCl 3 · 6H 2 O). Цвет и форма осажденного твердого вещества (неправильного фиолетового твердого вещества) были почти идентичны таковым у коммерческого источника CrCl 3 (thf) 3 и у полученного без этапа вакуумирования. Однако, как упоминалось выше, характеристики катализатора были значительно лучше при использовании CrCl 3 (thf) 3 , приготовленного на стадии вакуумирования.
Обработка CrCl 2 (OH)(H 2 O) 2 после растворения в ТГФ Me 3 SiCl привела к осаждению фиолетового твердого вещества, которое, как было подтверждено инфракрасной спектроскопией, было полностью безводным. . Поскольку большая часть H 2 O в CrCl 3 · 6H 2 O была удалена на этапе вакуумирования, 6,0 экв. Me 3 SiCl (эквивалентное количество, необходимое для превращения CrCl 2 (OH)(H 2 O) 2 в CrCl 3 (thf) x , схема 2) вместо 60 экв./Cr, и, соответственно, количество ТГФ можно было минимизировать (36 мл/10 г — CrCl 3 · 6H 2 O). Цвет и форма осажденного твердого вещества (неправильного фиолетового твердого вещества) были почти идентичны таковым у коммерческого источника CrCl 3 (thf) 3 и у полученного без этапа вакуумирования. Однако, как упоминалось выше, характеристики катализатора были значительно лучше при использовании CrCl 3 (thf) 3 , приготовленного на стадии вакуумирования. Продукт реакции между [(CH 3 CN) 4 Ag] + [B(C 6 F 5 ) 4 ] — и 45 4 CrCl 309f 3 (т.e., [(CH 3 CN) 4 CRCL 2 ] 2 ] + ] +
Продукт реакции между [(CH 3 CN) 4 Ag] + [B(C 6 F 5 ) 4 ] — и 45 4 CrCl 309f 3 (т.e., [(CH 3 CN) 4 CRCL 2 ] 2 ] + ] +
 Для продукта, полученного с использованием CrCl 3 (thf) 3 , приготовленного на этапе вакуумирования, количество CH 3 CN на Cr хорошо соответствовало ожидаемому значению 4 (4.1, 3.8 или 4.0). Напротив, число отклонялось от 4 (6,5, 6,1, 5,3 или 6,2), когда использовался либо коммерческий источник CrCl 3 (thf) 3 , либо источник, приготовленный без этапа вакуумирования. двух образцов было то, что кристаллы хорошего качества осаждались в растворе CH 2 Cl 2 CrCl 3 (thf) 3 , приготовленном на стадии вакуумирования, в то время как твердое вещество неправильной формы осаждалось либо при коммерческий источник CrCl 3 (thf) 3 или приготовленный без этапа вакуумирования растворяли в CH 2 Cl 2 (рис. 1).Рентгеноструктурные исследования показали, что осажденные кристаллы представляли собой биядерный комплекс с Cl-мостиком [CrCl 2 (μ-Cl)(thf) 2 ] 2 (рис.
Для продукта, полученного с использованием CrCl 3 (thf) 3 , приготовленного на этапе вакуумирования, количество CH 3 CN на Cr хорошо соответствовало ожидаемому значению 4 (4.1, 3.8 или 4.0). Напротив, число отклонялось от 4 (6,5, 6,1, 5,3 или 6,2), когда использовался либо коммерческий источник CrCl 3 (thf) 3 , либо источник, приготовленный без этапа вакуумирования. двух образцов было то, что кристаллы хорошего качества осаждались в растворе CH 2 Cl 2 CrCl 3 (thf) 3 , приготовленном на стадии вакуумирования, в то время как твердое вещество неправильной формы осаждалось либо при коммерческий источник CrCl 3 (thf) 3 или приготовленный без этапа вакуумирования растворяли в CH 2 Cl 2 (рис. 1).Рентгеноструктурные исследования показали, что осажденные кристаллы представляли собой биядерный комплекс с Cl-мостиком [CrCl 2 (μ-Cl)(thf) 2 ] 2 (рис. 2). Атом Cr принял октаэдрическую структуру с двумя ТГФ в цис-положении. Расстояния связи между Cr и концевым Cl (2,277 и 2,289 Å) были короче, чем расстояния между Cr и мостиковым Cl (2,362 Å), а также расстояния Cr–Cl (3,299, 3,318 и 3,352 Å), наблюдаемые для мер- CrCl 3 (thf) 3 , структура которого была ранее выявлена с использованием монокристалла, полученного из реакционной емкости Cr(CH 2 SiMe 3 ) 4 и HCl в ТГФ (CCDC # 983659) [20].Расстояние между Cr и O THF , расположенным транс к терминальному Cl, было больше, чем между Cr и O THF , расположенным транс к мостику-Cl (2,045 против 2,018 Å). Атом O THF , расположенный транс к терминальному Cl, принял совершенную тригональную плоскую геометрию (сумма валентного угла вокруг атома O1, 360,0 °), что указывает на π-донорство от O к Cr посредством принятия sp 2 -гибридизации. Другой атом O THF , расположенный транс к мостику-Cl, отклонился от идеальной тригональной планарной геометрии (сумма валентного угла вокруг атома O1, 352.
2). Атом Cr принял октаэдрическую структуру с двумя ТГФ в цис-положении. Расстояния связи между Cr и концевым Cl (2,277 и 2,289 Å) были короче, чем расстояния между Cr и мостиковым Cl (2,362 Å), а также расстояния Cr–Cl (3,299, 3,318 и 3,352 Å), наблюдаемые для мер- CrCl 3 (thf) 3 , структура которого была ранее выявлена с использованием монокристалла, полученного из реакционной емкости Cr(CH 2 SiMe 3 ) 4 и HCl в ТГФ (CCDC # 983659) [20].Расстояние между Cr и O THF , расположенным транс к терминальному Cl, было больше, чем между Cr и O THF , расположенным транс к мостику-Cl (2,045 против 2,018 Å). Атом O THF , расположенный транс к терминальному Cl, принял совершенную тригональную плоскую геометрию (сумма валентного угла вокруг атома O1, 360,0 °), что указывает на π-донорство от O к Cr посредством принятия sp 2 -гибридизации. Другой атом O THF , расположенный транс к мостику-Cl, отклонился от идеальной тригональной планарной геометрии (сумма валентного угла вокруг атома O1, 352. 8°). Данные рентгеновской кристаллографии
8°). Данные рентгеновской кристаллографии не гарантируют чистоту массы. Данные ЭА C примерно соответствовали рассчитанным значениям для выявленной структуры [CrCl 2 (μ-Cl)(thf) 2 ] 2 (31,8%), хотя измеренные значения не всегда находились в пределах требуемый диапазон 31,8% ± 0,4% (30,7%, 30,9%, 30,4%, 31,0%, 30,5%, 30,2%, 30,4%, 30,9% и 31,2%). Напротив, данные ЭА C, измеренные либо для коммерческого источника CrCl 3 (thf) 3 , либо для источника, приготовленного без этапа вакуумирования, существенно отклонялись от значения, рассчитанного для CrCl 3 (thf) 3 (38.5%). Данные сильно колебались в зависимости от точек отбора проб (32,4%, 26,5%, 34,1%, 38,1% и 33,8% для бутылки купленного образца; 34,2%, 36,7%, 37,1%, 35,3% и 34,1% для другой бутылки). купленного образца; 31,3 %, 30,5 %, 37,0 %, 33,6 % и 33,9 % для образца, приготовленного без этапа вакуумирования). Перед перекристаллизацией в образце, приготовленном на этапе вакуумирования, также наблюдалось колебание содержания С при изменении точки отбора, причем содержание С не соответствовало ни структуре CrCl 3 (thf) 3 , ни структуре [CrCl 2 (μ-Cl)(thf) 2 ] 2 (35. 3%, 34,3%, 32,5%, 34,2% и 32,4%). Хотя содержание углерода и рентгенограмма не соответствуют формуле коммерческого источника CrCl 3 (ТГФ) 3 , содержание Cr, измеренное с помощью ICP-OES (оптико-эмиссионная спектроскопия с индуктивно связанной плазмой), и содержание Cl, измеренное с помощью гравиметрический анализ после обработки AgNO 3 водным раствором CrCl 3 (ТГФ) 3 не сильно отклонялся от значений, рассчитанных для формулы CrCl 3 (ТГФ) 3 (Расч.Кр 13,88, Кл 28,38. Найдено: Cr 14,04, Cl 29,09%). Содержание Cr, измеренное для приготовленного [CrCl 2 (μ-Cl)(thf) 2 ] 2 , точно совпало с расчетным значением, в то время как измеренное содержание Cl было немного отклонено (Расч. Cr 17,19, Cl 35,15. Найдено: Cr 17,18, Cl 34,58%).
3%, 34,3%, 32,5%, 34,2% и 32,4%). Хотя содержание углерода и рентгенограмма не соответствуют формуле коммерческого источника CrCl 3 (ТГФ) 3 , содержание Cr, измеренное с помощью ICP-OES (оптико-эмиссионная спектроскопия с индуктивно связанной плазмой), и содержание Cl, измеренное с помощью гравиметрический анализ после обработки AgNO 3 водным раствором CrCl 3 (ТГФ) 3 не сильно отклонялся от значений, рассчитанных для формулы CrCl 3 (ТГФ) 3 (Расч.Кр 13,88, Кл 28,38. Найдено: Cr 14,04, Cl 29,09%). Содержание Cr, измеренное для приготовленного [CrCl 2 (μ-Cl)(thf) 2 ] 2 , точно совпало с расчетным значением, в то время как измеренное содержание Cl было немного отклонено (Расч. Cr 17,19, Cl 35,15. Найдено: Cr 17,18, Cl 34,58%).
 3а по сравнению сРисунок 3b), что указывает на то, что большая часть осажденного твердого вещества имеет структуру [CrCl 2 (μ-Cl)(thf) 2 ] 2 . Напротив, рентгенограмма приобретенного CrCl 3 (thf) 3 или полученного описанным способом без стадии вакуумирования не согласуется с данными рентгеноструктурного анализа монокристалла mer-CrCl 3 (thf) 3 (рис. 3c по сравнению с рис. 3e,f). Это наблюдение, наряду с несоответствием данных ЭА, создает неопределенность в отношении структуры и состава закупленного CrCl 3 (thf) 3 , а также полученного описанным способом.Твердое вещество, осажденное в реакционном сосуде CrCl 2 (OH)(H 2 O) 2 и Me 3 SiCl (6 экв.), показало сильный сигнал при 2θ = 11,6° вместе с сигналами, наблюдаемыми для образцы CrCl 3 (thf) 3 (рис. 3d). Спектр электронного парамагнитного резонанса (ЭПР) [CrCl 2 (μ-Cl)(thf) 2 ] 2 показал сильный сигнал при g = 1,98, тогда как для CrCl 3 наблюдались относительно слабые сигналы.
3а по сравнению сРисунок 3b), что указывает на то, что большая часть осажденного твердого вещества имеет структуру [CrCl 2 (μ-Cl)(thf) 2 ] 2 . Напротив, рентгенограмма приобретенного CrCl 3 (thf) 3 или полученного описанным способом без стадии вакуумирования не согласуется с данными рентгеноструктурного анализа монокристалла mer-CrCl 3 (thf) 3 (рис. 3c по сравнению с рис. 3e,f). Это наблюдение, наряду с несоответствием данных ЭА, создает неопределенность в отношении структуры и состава закупленного CrCl 3 (thf) 3 , а также полученного описанным способом.Твердое вещество, осажденное в реакционном сосуде CrCl 2 (OH)(H 2 O) 2 и Me 3 SiCl (6 экв.), показало сильный сигнал при 2θ = 11,6° вместе с сигналами, наблюдаемыми для образцы CrCl 3 (thf) 3 (рис. 3d). Спектр электронного парамагнитного резонанса (ЭПР) [CrCl 2 (μ-Cl)(thf) 2 ] 2 показал сильный сигнал при g = 1,98, тогда как для CrCl 3 наблюдались относительно слабые сигналы. (thf) 3 проб; кроме того, характер сигнала для двух образцов был совершенно разным (рис. 4).При термогравиметрическом анализе (ТГА) CrCl 3 (thf) 3 наблюдалось примерно четыре стадии потери веса (30%, 50%, 60% и 84% при 170°С, 215°С, 300°С). °С и 1000 °С соответственно), тогда как для [CrCl 2 (μ-Cl)(thf) 2 ] 2 (35%, 53% и 73% при 220°C, 310°C и 1000°C соответственно). Многочисленные попытки выращивания монокристаллов [(CH 3 CN) 4 CrCl 2 ] + [B(C 6 F 5 F 5 ) 4 ] — ] — ] — были неудачными, когда [(CH 3 CN) 4 AG] + [B (C 6 F 5 ) 4 ] − реагировал с покупным CrCl 3 (thf) 3 или полученным по реакции CrCl 3 ·6H 2 O и избытком Me 3 SiCl (60 экв.
(thf) 3 проб; кроме того, характер сигнала для двух образцов был совершенно разным (рис. 4).При термогравиметрическом анализе (ТГА) CrCl 3 (thf) 3 наблюдалось примерно четыре стадии потери веса (30%, 50%, 60% и 84% при 170°С, 215°С, 300°С). °С и 1000 °С соответственно), тогда как для [CrCl 2 (μ-Cl)(thf) 2 ] 2 (35%, 53% и 73% при 220°C, 310°C и 1000°C соответственно). Многочисленные попытки выращивания монокристаллов [(CH 3 CN) 4 CrCl 2 ] + [B(C 6 F 5 F 5 ) 4 ] — ] — ] — были неудачными, когда [(CH 3 CN) 4 AG] + [B (C 6 F 5 ) 4 ] − реагировал с покупным CrCl 3 (thf) 3 или полученным по реакции CrCl 3 ·6H 2 O и избытком Me 3 SiCl (60 экв. ) без вакуумирования шаг (схема 1) [38].Однако монокристаллы, подходящие для рентгеновской кристаллографии, могут быть получены при взаимодействии [CrCl 2 (μ-Cl)(thf) 2 ] 2 с [(CH 3 CN) 4 Ag] + [B(C 6 F 5 ) 4 ] − . Структура, определенная с помощью рентгеновской кристаллографии, показана на рис. 5. При взаимодействии четко определенных [(CH 3 CN) 4 CrCl 2 ] + [B(C 6 F 5 ) 4 ] − с лигандом iPrN{P(C 6 H 4 -p-Si(nBu) 3 ) 2 [37], высококачественный комплекс Cr [iPrN{P (C 6 H 4 H 4 -P-SI (NBU) 3 ) 2 } 2 } 2 CRCL 2 ] + [B (C 6 F 5 ) 4 ] — , который показал чрезвычайно высокую активность в реакции тетрамеризации этилена (активность: 6600 кг/г-Cr/ч; селективность: 1-октен — 74.
) без вакуумирования шаг (схема 1) [38].Однако монокристаллы, подходящие для рентгеновской кристаллографии, могут быть получены при взаимодействии [CrCl 2 (μ-Cl)(thf) 2 ] 2 с [(CH 3 CN) 4 Ag] + [B(C 6 F 5 ) 4 ] − . Структура, определенная с помощью рентгеновской кристаллографии, показана на рис. 5. При взаимодействии четко определенных [(CH 3 CN) 4 CrCl 2 ] + [B(C 6 F 5 ) 4 ] − с лигандом iPrN{P(C 6 H 4 -p-Si(nBu) 3 ) 2 [37], высококачественный комплекс Cr [iPrN{P (C 6 H 4 H 4 -P-SI (NBU) 3 ) 2 } 2 } 2 CRCL 2 ] + [B (C 6 F 5 ) 4 ] — , который показал чрезвычайно высокую активность в реакции тетрамеризации этилена (активность: 6600 кг/г-Cr/ч; селективность: 1-октен — 74. 7 %, 1-гексен — 7,5 %, циклический С6 — 3,8 %, С10+ — 13,8 %, ПЭ — 0,2 %; условия реакции: этилен 34 бар, 235 мл метилциклогексана, 0,45 ммоль катализатора Cr, 90 ммоль (iBu) 3 Al, 40 °C, 30 мин). Комплекс Cr [iPrN{P(C 6 H 4 -p-Si(nBu) 3 ) 2 } 2 CrCl 2 ] 904 6 F 5 ) 4 ] − хорошо растворим в метилциклогексане, что выгодно при проведении реакции тетрамеризации, и нет возможности очистки, что требует высококачественного прекурсора Cr [(CH 3 CN ) 4 CRCL 2 ] 2 ] + [B (C 6 F 5 ) 4 ] 4 ] — , а также высококачественный лиганд IPRN {P (C 6 H 4 -p-Si(nBu) 3 ) 2 } 2 для обеспечения неизменно высокой активности.В предыдущих исследованиях мы столкнулись с аналогичной проблемой, возможно, вызванной использованием нечистого CrCl 3 (thf) 3 .
7 %, 1-гексен — 7,5 %, циклический С6 — 3,8 %, С10+ — 13,8 %, ПЭ — 0,2 %; условия реакции: этилен 34 бар, 235 мл метилциклогексана, 0,45 ммоль катализатора Cr, 90 ммоль (iBu) 3 Al, 40 °C, 30 мин). Комплекс Cr [iPrN{P(C 6 H 4 -p-Si(nBu) 3 ) 2 } 2 CrCl 2 ] 904 6 F 5 ) 4 ] − хорошо растворим в метилциклогексане, что выгодно при проведении реакции тетрамеризации, и нет возможности очистки, что требует высококачественного прекурсора Cr [(CH 3 CN ) 4 CRCL 2 ] 2 ] + [B (C 6 F 5 ) 4 ] 4 ] — , а также высококачественный лиганд IPRN {P (C 6 H 4 -p-Si(nBu) 3 ) 2 } 2 для обеспечения неизменно высокой активности.В предыдущих исследованиях мы столкнулись с аналогичной проблемой, возможно, вызванной использованием нечистого CrCl 3 (thf) 3 . В реакции Li + [Et 2 Al(N(iPr) 2 ) 2 ] — и CrCl 3 (thf) 3 были выделены твердые вещества. однако их структуру не удалось определить с помощью рентгеновской кристаллографии. Предварительно считается, что продукт представляет собой [Et 2 Al(N(iPr) 2 ) 2 ]CrCl 2 [48].Однако монокристаллы были получены, когда четко определенные [CrCl 2 (μ-Cl) (thf) 2 ] 2 заменили нечистый CrCl 3 (thf) 3 , что позволило определить структуру X- лучевая кристаллография. Комплекс, выделенный из реакции Li + [Et 2 Al(N(iPr) 2 ) 2 ] — и CrCl 3 (thf) 3 не был ) комплекс [Et 2 Al(N(iPr) 2 ) 2 ]CrCl 2 но комплекс Cr(II) [{Et(Cl)Al(N(iPr) 2 ) 2 }Cr(μ-Cl)] 2 (рис. 6).
В реакции Li + [Et 2 Al(N(iPr) 2 ) 2 ] — и CrCl 3 (thf) 3 были выделены твердые вещества. однако их структуру не удалось определить с помощью рентгеновской кристаллографии. Предварительно считается, что продукт представляет собой [Et 2 Al(N(iPr) 2 ) 2 ]CrCl 2 [48].Однако монокристаллы были получены, когда четко определенные [CrCl 2 (μ-Cl) (thf) 2 ] 2 заменили нечистый CrCl 3 (thf) 3 , что позволило определить структуру X- лучевая кристаллография. Комплекс, выделенный из реакции Li + [Et 2 Al(N(iPr) 2 ) 2 ] — и CrCl 3 (thf) 3 не был ) комплекс [Et 2 Al(N(iPr) 2 ) 2 ]CrCl 2 но комплекс Cr(II) [{Et(Cl)Al(N(iPr) 2 ) 2 }Cr(μ-Cl)] 2 (рис. 6).3. Материалы и методы
3.1. Общие замечания
Все манипуляции проводились в инертной атмосфере с использованием стандартного перчаточного бокса и техники Шленка. CH 2 Cl 2 и CH 3 CN перемешивали над CaH 2 и переносили в резервуар под вакуумом. Толуол, гексан и ТГФ перегоняли из бензофенонкетила. ЭА проводились в Аналитическом центре Университета Аджу. Непрерывные спектры ЭПР Х-диапазона были собраны при комнатной температуре на спектрометре EMX plus 6/1 (Bruker, Billerica, MA, USA) с экспериментальными параметрами: микроволновая мощность 1 мВт, амплитуда модуляции 10 Гс и 3 сканирования в KBSI Western Seoul Center. Корея.Данные HP-XRD были получены на D/max-2500V/PC (Rigaku, Akishima, Japan), оснащенном источником излучения Cu Kα (λ = 0,15418 нм).
3.2. [CrCl
2 (μ-Cl)(thf) 2 ] 2Колбу Шленка, содержащую кристаллический твердый CrCl 3 ·6H 2 O (10,0 г, 37,5 мм) погружали в масло и баню при температуре 40°С, а затем вакуумировали в течение 1 часа под полным вакуумом. При вакуумировании температуру бани повышали до 100°С в течение часа, а затем поддерживали на уровне 100°С в течение 4 часов.По мере удаления летучих веществ кристаллическое твердое вещество превращалось в аморфный порошок, а цвет твердого вещества постепенно менялся от темно-зеленого до светло-зеленого, светло-серого и, наконец, светло-фиолетового. Масса уменьшилась с 10,0 до 6,39 г за счет удаления летучих веществ. Добавляли холодный ТГФ (32 г, -30°С) для растворения оставшегося твердого вещества. При растворении выделялось тепло, и получали темно-фиолетовый раствор. Часть нерастворимой части отфильтровывали, а затем к фильтрату добавляли Me 3 SiCl (24,5 г, 225 ммоль).Перемешивание раствора в течение ночи приводило к осаждению фиолетового твердого вещества. Твердое вещество выделяют фильтрованием и промывают ТГФ (10 мл) и гексаном (10 мл). Выделенное твердое вещество (6,60 г) помещали в большой флакон (объем ~70 мл) и добавляли CH 2 Cl 2 (53 г) для растворения твердого вещества. Когда флакон помещали в закрытую камеру (объем ~250 мл), содержащую метилциклогексан (~15 мл), CH 2 Cl 2 медленно испарялся, и в течение 24 ч выпадали пурпурные кристаллы, которые выделяли декантацией (4 .55 г, 69%).
3.3. [(CH
3 CN) 4 CRCL 2 ] + ] + [B (C 6 F 5 ) 4 ] —Решение [(CH 3 CN ) 4 Ag] + [B(C 6 F 5 ) 4 ] — (7,789 г, 8,189 ммоль) в ацетонитриле (7,789 г, 8,189 ммоль) добавляли к суспензии [a5Cr]4Cl (17,3 г) 2 (μ-Cl)(thf) 2 ] 2 (2,478 г, 8,189 ммоль) в ацетонитриле (22.6 г). После перемешивания в течение ночи при 60°С выпавший в осадок AgCl удаляли фильтрованием и получали раствор оливково-зеленого цвета. Растворитель удаляли с помощью вакуумной линии с получением твердого вещества оливково-зеленого цвета (7,71 г). Выделенное твердое вещество (20,0 мг) и 9-метилантрацен (20,0 мг) растворяли в ТГФ-d 8 и записывали спектр ЯМР 1 Н раствора для подсчета количества молекул СН 3 CN на на каждый атом Cr, что составляло 4,1. Выход составил 97% по формуле [(CH 3 CN) 4.1 CrCl 2 ] + [B(C 6 F 5 ) 4 ] − . Монокристаллы, пригодные для рентгеноструктурного анализа, были выращены в CH 2 Cl 2 ; Содержащий флакон [(CH 3 CN) 4 CRCL 2 ] + ] +
0 [B (C 6 F 5 ) 4 ] — (100 мг) в CH 2 Cl 2 (1,0 г) помещали в закрытую камеру, содержащую метилциклогексан, для осаждения кристаллов.3.4. [IPRN {P (C
6 H 4 —SI (НБУ) 3 ) 2 } 2 CRCL 2 ] 2 ] + [B (C 6 F 5 ) 4 ] — ] — ] —Решение IPRN {P (C 6 H 4 -P-Si (НБУ) 3 ) 2 } 2 (9,50 г, 7,78 ммоль) в CH 2 Cl 2 (120 г) добавляли по каплям к раствору [(CH 3 CN) 4.1 CrCl 2 ] + [B(C 5 905 F 6 9 ) 4 ] − (7.55 г, 7,781 ммоль) в CH 2 Cl 2 (46 г). При добавлении цвет раствора сразу изменился с оливково-зеленого на голубовато-зеленый. После перемешивания в течение 2,5 ч растворитель полностью удаляли с помощью вакуумной линии. Остаток растворяли в минимальном количестве метилциклогексана (~5 мл) и удаляли растворитель с помощью вакуумной линии. Эту процедуру повторяли еще раз, чтобы полностью удалить любые остатки CH 3 CN и CH 2 Cl 2 . Остаток (15.7 г, 100%) растворяли в метилциклогексане (141,3 г) с получением 10 мас.% раствора, который использовали для тетрамеризации этилена.
3.5. [{Et(Cl)Al(N(iPr)
2 ) 2 }Cr(μ-Cl)] 2[CrCl 2 (μ-Cl)(thf) 2 ] 2 (0,312 г, 1,03 ммоль) добавляли к раствору Li + [Et 2 Al(N(iPr) 2 ) 2 ] — (0,302 г, 1,03 ммоль) в толуоле. (4,5 мл) при -30 °С. Смесь перемешивали в течение 8 ч при комнатной температуре.Цвет раствора изменился с темно-коричневого на темно-зеленовато-синий, выпал осадок LiCl. Растворитель удаляли с помощью вакуумной линии, а остаток растворяли в гексане (30 мл). После удаления LiCl фильтрованием фильтрат концентрировали до ~10 мл и выдерживали при -30°C в течение 2 дней. Осаждены голубые кристаллы (0,178 г, 45%). Вторую порцию голубых кристаллов получали из маточного раствора (0,028 г, 7%).
3.6. Рентгеновская кристаллография
Образцы подходящего качества и размера отбирали, монтировали и центрировали в рентгеновском луче с помощью видеокамеры.Данные отражения были собраны при 100 K на площадном дифрактометре APEX II CCD (Bruker, Billerica, MA, USA) с использованием монохроматизированного графитом излучения Mo K–α (λ = 0,7107 Ǻ). Полусфера данных отражения была собрана в виде кадров сканирования φ и ω при 0,5 ° на кадр и времени экспозиции 10 с на кадр. Параметры ячейки определяли и уточняли с помощью программы SMART. Обработку данных проводили с помощью программного обеспечения SAINT. Данные были скорректированы на эффекты Лоренца и поляризации. Эмпирическая поправка на поглощение применялась с помощью программы SADABS.Структура расшифрована прямыми методами и уточнена полноматричным методом наименьших квадратов с использованием пакета SHELXTL и программы olex2 с анизотропными тепловыми параметрами для всех неводородных атомов.
Кристаллографические данные для [CrCl 2 (μ-Cl)(thf) 2 ] 2 (CCDC# 2044805), которые использовались во всех расчетах, следующие: C 8 H 15,5 Cl 9054 3 CrO 2 , М = 302,05, триклинная, а = 6,8070(8), б = 9,3170(11), в = 10.3192(13) Å, α = 108,070(5)°, β = 96,448(5)°, γ = 94,719(5), V = 613,47(13) Å 3 , пр. гр. P-1, Z = 2, и 2285 уникальных (R(int) = 0,0505). Окончательное значение wR 2 составило 0,1251 (I > 2σ(I)).
Кристаллографические данные для [(CH 3 CN) 4 CRCL 2 ] + ] + [B (C 6 F 5 ) 4 ] — · 2 (CH 2 Cl 2 ) (CCDC # 2044806), которые использовались во всех расчетах, следующие: C 34.5 H 17 BCl 7 CrF 20 N 4 , M = 1178,48, моноклинная, a = 12,9472(4), b = 8,2694(3), c = 21,7555, c = 99(8) 3 β (18)°, V = 2294,91(14) Å 3 , пространственная группа P2/c, Z = 2 и 4409 уникальных (R(int) = 0,0285). Окончательное значение wR 2 составило 0,1594 (I > 2σ(I)).
Кристаллографические данные для [{Et(Cl)Al(N(iPr) 2 ) 2 }Cr(μ-Cl)] 2 (CCDC # 2044807), которые использовались во всех расчетах, следующие: C 28 H 66 Al 2 Cl 4 Cr 2 N 4 , M = 758.60, моноклинная, a = 10,2937(2), b = 12,8707(3), c = 14,7815(3) Å, β = 96,5009(18)°, V = 1945,77(7) Å 3 , пр. группа P2 1 /n, Z = 2 и 3675 уникальных (R(int) = 0,1527). Окончательное значение wR 2 составило 0,0909 (I > 2σ(I)).
С точки зрения формул, почему crcl3 и crcl3.6h…
Итак, в этом вопросе, чем отличаются коэффициенты в химическом уравнении от нижнего индекса в химических формулах. Итак, давайте предположим сбалансированное химическое уравнение.Итак, это дворцовое уравнение для железа без трех или двух, которое будет составлять каждые два или три. Потому что в прямой внутренней части для атома железа есть и в стороне продукта, то же самое для атомов железа есть и в разрушенной внутренней части шесть атомов кислорода, а в стороне продукта всего шесть атомов кислорода. Итак, это сбалансированное уравнение, поэтому мы можем видеть, что оно рассматривается таким образом. Так что это пример каждые два или три. Сделаем так это железо и это железо и кислород. Таким образом, это представляет символы элемента символа элемента.Итак, что говорит то, что может сказать элемент в молекуле элемент в молекуле. Нет. Теперь учтите, что это касается каждых двух или трех. Итак, это для обозначения двух и трех. Таким образом, эти два представляют собой индекс нижнего индекса, который говорит о том, что может сказать номер. Нет моделей атомов с каждого элемента при прыжках с каждого элемента в молекуле, действительно, молекулы. А теперь давайте рассмотрим пятое усилие или три. Так что это репрезентативный коэффициент коэффициента, который может определить количество беременных молекул, количество присутствующих молекул.Итак, теперь давайте рассмотрим эту ситуацию, когда четыре F-файла три или два образуют два или три Эффи. Таким образом, в этой ситуации, как мы знаем, это случай баланса, потому что число, которое выходит из железа и кислорода на доске, равно четырем железам слева и четырем элементам справа, неправильному направлению и шести атомам. кислород и шесть атомов. Кислород на теле оттенил направление. Итак, теперь эти четыре, Так что мы можем написать красным, это означает, что четыре молекулы из железа, три молекулы из железа, три молекулы из двух или две и две молекулы души через каждые два или три.Итак, этот случай представляет вот так. Итак, в основном эти четыре. Итак, четыре, три и два. Таким образом, это представляет эффективную Стокгольмскую метрику. Таким образом, они представляют собой стандартные элементарные коэффициенты, или мы можем сказать коэффициенты и нижний индекс, что означает два атома от кислорода в одной молекуле от комы, два и три атома до и три атома от железа и кислорода в атоме. Прочь через каждые два или три. Итак, теперь мы можем это видеть. Итак, эта четверка видит это 43 и два. Таким образом, это представляет собой в основном коэффициент.И это к тому два атома кислорода в одной молекуле, одна молекула кислорода и два и три атома железа и кислорода в атоме, Каждые два или три. По сути, этот красный цвет представляет собой вот такой коэффициент, а этот зеленый вот такой. Так что это может представлять так это может представлять нижний индекс, как мы объясняем для этой реакции.
Молекулярная масса CrCl3
Молярная масса CrCl3 = 158,3551 г/моль
Это соединение также известно как хлорид хрома (III).
Перевести граммы CrCl3 в моли или моли CrCl3 в граммы
Расчет молекулярной массы:
51,9961 + 35,453*3
| Элемент | Символ | Атомная масса | Количество атомов | Процент по массе |
| Хлор | Кл | 35.453 | 3 | 67,165% |
| Хром | Кр | 51.9961 | 1 | 32,835% |
В химии формульный вес представляет собой величину, вычисляемую путем умножения атомного веса (в атомных единицах массы) каждого элемента в химической формуле на число атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные массы и рассчитать молекулярную массу вещества.
Нахождение молярной массы начинается с граммов на моль (г/моль). При расчете молекулярной массы химического соединения она сообщает нам, сколько граммов содержится в одном моле этого вещества. Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
Атомные веса, используемые на этом сайте, получены из NIST, Национального института стандартов и технологий. Мы используем самые распространенные изотопы. Вот как можно рассчитать молярную массу (среднюю молекулярную массу), основанную на изотропно взвешенных средних.Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов. Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Обычный запрос на этом сайте — конвертировать граммы в моли. Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать. Причина в том, что на конверсию влияет молярная масса вещества. Этот сайт объясняет, как найти молярную массу.
Если формула, используемая для расчета молекулярной массы, является молекулярной формулой, вычисляемая формула веса является молекулярной массой. Весовой процент любого атома или группы атомов в соединении можно рассчитать, разделив общий вес атома (или группы атомов) в формуле на вес формулы и умножив на 100.
 325∙105 Па
325∙105 Па (справа) В другом изомере ионизации бромид действует как бром-лиганд кобальта, а хлорид действует как противоион. Эти два изомера называются бромидом пентаамминхлоркобальта (II) (слева) и хлоридом пентаамминбромкобальта (II) (справа).{-} (водн.)}\]
(справа) В другом изомере ионизации бромид действует как бром-лиганд кобальта, а хлорид действует как противоион. Эти два изомера называются бромидом пентаамминхлоркобальта (II) (слева) и хлоридом пентаамминбромкобальта (II) (справа).{-} (водн.)}\] (слева) нитро-изомер (Co-NO2) и (справа) нитрито-изомер (Co-ONO)
(слева) нитро-изомер (Co-NO2) и (справа) нитрито-изомер (Co-ONO)
 Общая химия: принципы и современные приложения: девятое издание. Нью-Джерси: Пирсон, 2007.
Общая химия: принципы и современные приложения: девятое издание. Нью-Джерси: Пирсон, 2007.