1.2. Строение и характеристики атомов
Атомы различных химических элементов отличаются прежде всего по их массе, и атомная масса в какой-то мере определяет периодичность повторения химических свойств различных атомов, однако массовое число A не является однозначной характеристикой атомов любых веществ.
Действительной характеристикой, определяющей физико-химическую индивидуальность атома вещества, является его атомный номер (z) в открытой Д. И. Менделеевым Периодической Системе элементов. Называя атомный номер элемента z, мы фактически называем сам этот элемент, об атомах которого идет речь.
Например, если z = 6, нам ясно, что речь идет об углероде (С), а если z = 92, это равносильно тому, что элемент назван ураном (U), и т.д.
Поэтому атомный номер элемента z — характеристика,
Итак, массовое число A и атомный номер z элемента — пара характеристик, полностью определяющих физико-химическую индивидуальность атомов любого вещества.
Атомная теория раскрывает физический смысл этих характеристик в следующих основных положениях:
а) Все атомы состоят из положительно заряженного ядра и обращающихся вокруг него отрицательно заряженных частиц — электронов.
б) Электрический заряд электрона qe = — 1.6022 .10-19 Кл — наименьший электрический заряд, обнаруженный экспериментально, и это дало повод назвать его элементарным зарядом, а заряды других частиц и структур на микроуровне — измерять в элементарных зарядах.
в) Атомный номер элемента z — есть не что иное, как суммарное количество электронов в атоме.
г) Поскольку устойчивый атом любого химического элемента электронейтрален, отрицательный заряд электронных оболочек в атоме нейтрализуется равным по величине положительным зарядом ядра. Поэтому другое представление об атомном номере состоит в том, что атомный номер химического элемента — это положительный заряд ядра его атома, выраженный в величинах элементарных электрических зарядов (то есть в зарядах электрона).
д) Масса
покоя одиночного электрона mе =
9.1095.10-28 г,
что соответствует приблизительно
5.486.10-4 а.е.м. Разница в порядках величин масс
всего атома (от единицы до сотен а.е.м.)
и электронов в нём (от 5.486.10-4 до величин порядка 10
е) Размеры атомов, найденные в экспериментах, выполненных по различным методикам, имеют порядок 10-8 см, тогда как размеры их ядер — величины порядка 10-13 см. Эти цифры свидетельствуют о том, что ядро занимает ничтожную часть объёма атома.
Если под объёмом ядра понимать сферу, в пределах которой эффективно действуют ядерные силы, радиус этой сферы можно оценить по полуэмпирической формуле:
Rя » 1.21.10-13 А1/3, см, . (1.4)
где А, а.е.м. — атомная масса элемента.
1.3. Строение ядер и свойства ядерных сил
1.3.1. Ядро любого атома имеет сложную структуру и состоит из частиц, называемых нуклонами. Известно два типа нуклонов — протоны и нейтроны.Протоны — нуклоны массой 1 а.е.м. с положительным зарядом, равным единице, то есть элементарному заряду электрона.
Нейтроны — электронейтральные нуклоны массой 1 а.е.м.
*) Строго говоря, массы покоя протонов и нейтронов несколько отличаются: mр= 1.6726 .10-24г mn= 1.67439 .10-24г. Об этом различии речь впереди.
1.3.2. Так как масса ядра практически равна A, заряд ядра — z, а массы протона и нейтрона практически равны, при таких представлениях следует принять как должное, что ядро электронейтрального устойчивого атома состоит из
1.3.3. Наличие в ядре протонов (частиц с электрическим зарядом одного знака) вследствие кулоновских сил отталкивания между ними должно было бы привести к разлёту нуклонов. В реальности этого не происходит. Существование в природе множества устойчивых ядер приводит к выводу о существовании между нуклонами ядра более мощных, чем кулоновы, ядерных сил притяжения, которые, преодолевая кулоновское отталкивание протонов, стягивают нуклоны в устойчивую структуру — ядро.
1.3.4. Размеры ядер атомов, определенные по формуле (1.4), есть величины порядка 10 -13см. Отсюда первое свойство ядерных сил (в отличие от кулоновых, гравитационных и других) — короткодействие: ядерные силы действуют только на малых расстояниях, сравнимых по величине с размерами самих нуклонов.
Даже не зная точно, что за материальное образование представляет собой протон или нейтрон, можно оценить их эффективные размеры как диаметр сферы, на поверхности которой ядерное притяжение двух соседних протонов уравновешивается их кулоновским отталкиванием. Эксперименты на ускорителях по рассеянию ядрами электронов позволили оценить эффективный радиус нуклона Rн » 1.21 .10-13см.
1.3.5. Из короткодействия ядерных сил вытекает второе их свойство, кратко именуемое насыщением. Это означает, что любой нуклон ядра взаимодействует не со всеми другими нуклонами, а лишь с ограниченным числом нуклонов, являющихся его непосредственными соседями.
1.3.6. Третье свойство ядерных сил — их равнодействие. Поскольку предполагается, что силы взаимодействия между нуклонами обоих видов являются силами одной природы, предполагается, что на расстояниях порядка 10-13 см два протона, два нейтрона или протон с нейтроном взаимодействуют одинаково.
1.3.7. Протон в свободном состоянии (то есть вне атомных ядер) стабилен. Нейтрон в свободном состоянии длительно существовать не может: он претерпевает распад на протон, электрон и антинейтрино с периодом полураспада T1/2 = 11.2 мин. по схеме:
on1®1p1 + —1e + n
*) Антинейтрино (n) — электронейтральная частица материи с нулевой массой покоя.
1.3.8. Итак, любое ядро считается полностью индивидуализированным, если известны две его основные характеристики — число протонов z и массовое число A, поскольку разница (A — z) определяет число нейтронов в ядре. Индивидуализированные ядра атомов принято в общем случае называть нуклидами.
Среди множества нуклидов (а их в настоящее время известно около 2000 — естественных и искусственных) есть такие, у которых одна из двух упомянутых характеристик одинакова, а другая – отличается по величине.
Нуклиды с одинаковым z (числом протонов) называют изотопами. Поскольку атомный номер определяет в соответствии с Периодическим Законом Д.И.Менделеева индивидуальность только химических свойств атома элемента, об изотопах всегда говорят со ссылкой на соответствующий химический элемент в Периодической Системе.
Изотопы любого химического элемента, как видим, имеют равное число протонов, но различные числа нейтронов.
Нуклиды равной массы (A), но с различными зарядами z называют изобарами. Изобары, в отличие от изотопов, — нуклиды различных химических элементов.
Примеры. 11В5 и 11С4 — изобары нуклидов бора и углерода; 7Li3 и 7Ве4 — изобары нуклидов лития и бериллия; 135J53, 135Xe54 и 135Cs55 — также являются изобарами йода, ксенона и цезия соответственно.
1.3.9. Из формулы (1.4) можно оценить плотность нуклонов в ядрах и массовую плотность ядерного вещества. Считая ядро сферой с радиусом R и с количеством нуклонов в ее объёме, равным A, число нуклонов в единице объёма ядра найдём как:
Nн = A/Vя = 3А/4pR3 = 3А/4p(1.21 .10-13A 1/3)3 = 1.348 .1038 нукл/см3,
а, так как масса одного нуклона равна 1 а.е.м. = 1.66056.10-24г, то плотность ядерного вещества найдётся как:
gяв= Nmн= 1.348 .1038 .1.66056 .10-24 » 2.238 .1014г/см3.= 223 800 000 т/см3
Порядок приведенного расчёта свидетельствует о том, что
Объём. приходящийся на 1 нуклон в ядре,
Vя/A = 1/N = 1/1.348 .1038 = 7.421 .10-39см3
также одинаков для всех ядер, поэтому среднее расстояние между центрами соседних нуклонов в любом ядре (которое можно условно назвать средним диаметром нуклона) будет равно
Dн = (Vя)1/3 = (7.421 .10-39)1/3 = 1.951 .10-13см.
1.3.10. О плотности расположения протонов и нейтронов в ядре атома до настоящего времени мало что известно. Поскольку протоны, в отличие от нейтронов, подвержены действию не только ядерного и гравитационного притяжения, но и кулоновского отталкивания, можно предположить, что протонный заряд ядра более или менее равномерно распределен по его поверхности.
1.4. Энергия связи и устойчивость атомов
1.4.1. Масса (m) и энергия (Е) — две формы существования материи, пропорционально взаимосвязанные между собой соотношением А.Эйнштейна
Е = mc2, (1.5)
где с — скорость света в вакууме (с = 2.997924 .108м/с)
studfile.net
Строение атома, химическая связь, валентность и строение молекул
(Конспект лекций)
Строение атома. Введение.
Объектом изучения в химии являются химические элементы и их соединения. Химическим элементом называют совокупность атомов с одинаковым положительным зарядом. Атом – это наименьшая частица химического элемента, сохраняющая его химические свойства. Связываясь, друг с другом, атомы одного или разных элементов образуют более сложные частицы – молекулы. Совокупность атомов или молекул образуют химические вещества. Каждое индивидуальное химическое вещество характеризуется набором индивидуальных физических свойств, такими как температуры кипения и плавления, плотностью, электро- и теплопроводностью и т.п.
1. Строение атома и Периодическая система элементов
Д.И. Менделеева.
Знание и понимание закономерностей порядка заполнения Периодической системы элементов Д.И. Менделеева позволяет понять следующее:
1.физическую суть существования в природе определенных элементов,
2.природу химической валентности элемента,
3.способность и «лёгкость» элемента отдавать или принимать электроны при взаимодействии с другим элементом,
4.природу химических связей, которые может образовать данный элемент при взаимодействии с другими элементами, пространственное строение простых и сложных молекул и пр., пр.
Строение атома.
Атом представляет собой сложную микросистему находящихся в движении и взаимодействующих друг с другом элементарных частиц.
В конце 19 и начале 20 веков было установлено, что атомы состоят из более мелких частиц: нейтронов, протонов и электронов, Последние две частицы являются заряженными частицами, протон несет на себе положительный заряд, электрон — отрицательный. Поскольку атомы элемента в основном состоянии электронейтральны, то это означает, что число протонов в атоме любого элемента равно числу электронов. Масса атомов определяется суммой массы протонов и нейтронов, количество которых равна разности массы атомов и его порядкового номера в периодической системе Д.И. Менделеева.
В 1926 г Шрёдингер предложил описывать движение микрочастиц в атоме элемента при помощи выведенного им волнового уравнения. При решении волнового уравнения Шрёдингера для атома водорода появляются три целочисленных квантовых числа: n, ℓ и mℓ, которые характеризуют состояние электрона в трёхмерном пространстве в центральном поле ядра. Квантовые числа n, ℓ и mℓ принимают целочисленные значения. Волновая функция, определяемая тремя квантовыми числами n, ℓ и mℓ и получаемая в результате решения уравнения Шрёдингера, называется орбиталью. Орбиталь — это область пространства, в котором наиболее вероятно нахождение электрона, принадлежащего атому химического элемента. Таким образом, решение уравнения Шредингера для атома водорода приводит к появлению трёх квантовых чисел, физический смысл которых состоит в том, что они характеризуют три разного вида орбиталей, которые может иметь атом. Рассмотрим более подробно каждое квантовое число.
Главное квантовое число n может принимать любые положительные целочисленные значения: n = 1,2,3,4,5,6,7…Оно характеризует энергию электронного уровня и размер электронного ″облака″. Характерно, что номер главного квантового числа совпадает с номером периода, в котором находится данный элемент.
Азимутальное или орбитальное квантовое число ℓ может принимать целочисленные значения от ℓ = 0….до n – 1 и определяет момент движения электронов, т.е. форму орбитали. Для различных численных значений ℓ используют следующие обозначения: ℓ = 0, 1, 2, 3, и обозначаются символами s, p, d, f, соответственно для ℓ = 0, 1, 2 и 3. В периодической системе элементов нет элементов со спиновым числом ℓ = 4.
Магнитное квантовое число mℓ характеризует пространственное расположение электронных орбиталей и, следовательно, электромагнитные свойства электрона. Оно может принимать значения от – ℓ до + ℓ, включая нуль.
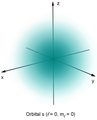
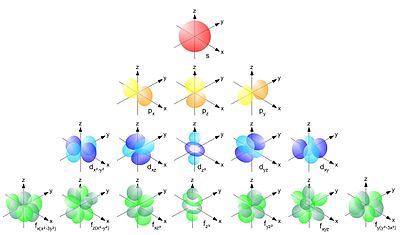
Форма или, точнее, свойства симметрии атомных орбиталей зависят от квантовых чисел ℓ и mℓ. «Электронное облако», соответствующее s — орбитали имеет, имеет форму шара (при этом ℓ= 0).
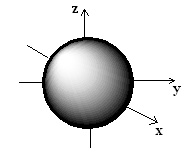
Рис.1. 1s-орбиталь
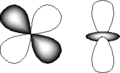
Орбитали, определяемые квантовыми числами ℓ = 1 и mℓ = -1, 0 и +1, называются р-орбиталями. Поскольку mℓ при этом имеет три разных значений, то атом при этом имеет три энергетически эквивалентные р-орбитали (главное квантовое число для них одно и тоже и может иметь значение n =2,3,4,5,6 или 7). р-Орбитали обладают осевой симметрией и имеют вид объёмных восьмёрок, во внешнем поле ориентированных по осям x, y и z (рис.1.2). Отсюда и происхождение символики px, py и pz.
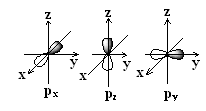
Рис.2. рx, py и pz-орбитали
Кроме того, имеются d- и f- атомные орбитали, для первых ℓ = 2 и mℓ = -2, -1, 0, +1 и +2, т.е. пять АО, для вторых ℓ = 3 и mℓ = -3, -2, -1, 0, +1, +2 и +3, т.е. 7 АО.
Четвёртое квантовое ms называется спиновым квантовым числом, было введено для объяснения некоторых тонких эффектов в спектре атома водорода Гаудсмитом и Уленбеком в 1925г. Спин электрона — это угловой момент заряженной элементарной частицы электрона, ориентация которого квантована, т.е. строго ограничена определёнными углами. Эта ориентация определяется значением спинового магнитного квантового числа (s), которое для электрона равно ½, поэтому для электрона согласно правилам квантования ms = ± ½. В связи с этим к набору из трёх квантовых чисел следует добавить квантовое число ms. Подчеркнём еще раз, что четыре квантовых числа определяют порядок построения периодической таблицы элементов Менделеева и объясняют, почему в первом периоде только два элемента, во втором и в третьём – по восемь, — в четвёртом – 18 и т д. Однако, чтобы объяснить строение многоэлектронных атомов, порядок заполнения электронных уровней по мере увеличения положительного заряда атома недостаточно иметь представления о четырёх квантовых числах, «управляющих» поведением электронов при заполнении электронных орбиталей, но необходимо знать ещё некоторые простые правила, а именно, принцип Паули, правило Гунда и правила Клечковского.
Согласно принципа Паули в одном и том же квантовом состоянии, характеризуемом определенными значениями четырёх квантовых чисел, не может находиться более одного электрона. Это означает, что один электрон можно в принципе поместить на любую атомную орбиталь. Два электрона могут находиться на одной атомной орбитали только в том случае, если они отличаются спиновыми квантовыми числами.
При заполнении электронами трёх р-АО, пяти d-AO и семи f-AO следует руководствоваться кроме принципа Паули ещё и правилом Гунда: Заполнение орбиталей одной подоболочки в основном состоянии происходит электронами с одинаковыми спинами.
При заполнении подоболочек (p, d, f)абсолютное значение суммы спинов должно быть максимальной.
Правило Клечковского. Согласно правилу Клечковского при заполнении d и f орбиталией электронами должен соблюдаться принцип минимальной энергии. Согласно этому принципу электроны в основном состоянии заполняют орбитали с минимальными уровнями энергии. Энергию подуровня определяют сумма квантовых чисел n + ℓ = Е.
Первое правило Клечковского: сначала заполняются те подуровни, для которых n + ℓ = Е минимальна.
Второе правило Клечковского: в случае равенства n + ℓ для нескольких подуровней идёт заполнение того подуровня, для которого n минимальна.
В настоящее время известно 109 элементов.
2. Энергия ионизации, сродство к электрону и электроотрицательность.
Важнейшими характеристиками электронной конфигурации атома являются энергия ионизации (ЭИ) или потенциал ионизации (ПИ) и сродство атома к электрону (СЭ). Энергией ионизации называют изменение энергии в процессе отрыва электрона от свободного атома при 0 К: А =+ + ē .Зависимость энергии ионизации от порядкового номера Z элемента, размера атомного радиуса имеет ярко выраженный периодический характер.
Сродство к электрону (СЭ), представляет собой изменение энергии, которым сопровождается присоединение электрона к изолированному атому с образованием отрицательного иона при 0 К: А + ē = А— (атом и ион находятся в своих основных состояниях). При этом электрон занимает низшую свободную атомную орбиталь (НСАО), если ВЗАО занята двумя электронами. СЭ сильно зависит от их орбитальной электронной конфигурации.
Изменения ЭИ и СЭ коррелируют с изменением многих свойств элементов и их соединений, что используется для предсказания этих свойств по значениям ЭИ и СЭ. Наиболее высоким по абсолютной величине сродством к электрону обладают галогены. В каждой группе периодической таблице элементов потенциал ионизации или ЭИ уменьшается с увеличением номера элемента, что связано с увеличением атомного радиуса и с увеличением количества электронных слоев и что хорошо коррелирует с увеличением восстановительной способности элемента.
В таблице 1 Периодической системы элементов приведены значения ЭИ и СЭ в эВ/на атом. Отметим, что точные значения СЭ известны лишь для немногих атомов, их величины подчёркнуты в таблице 1.
Таблица 1
Первая энергия ионизации (ЭИ), сродство к электрону (СЭ) и электроотрицательность χ) атомов в периодической системе.
ЭИ СЭ χ r | 1 H 13.60 0.747 2.10 0,37 | 2 He 24.58 0.077 — 1,22 | ||||||||||||||||
ЭИ СЭ χ r | 3 Li 5.39 0.54 0.98 1.55 | 4 Be 9.32 -0.3 1.57 1.13 | 5 B 8.30 0.2 2.04 0.91 | 6 C 11.26 1.25 2.55 0.77 | 7 N 14.54 -0.1 3.04 0,55 | 8 O 13.62 1.47 3.44 0.59 | 9 F 17.42 3.45 3.98 0.64 | 10 Ne 21.56 — 1,60 | ||||||||||
ЭИ СЭ χ r | 11 Na 5.14 0.74 0.93 1.89 | 12 Mg 7.64 -0.3 1.31 1.60 | 13 Al 5.98 0.6 1.61 1.43 | 14 Si 8.15 1.63 1.90 1.34 | 15 P 10.55 0.7 1.90 1.13 | 16 S 10.36 2.07 2.19 1.04 | 17 Cl 13.01 3.61 3.16 0.99 | 18 Ar 15.76 — 1,92 | ||||||||||
ЭИ СЭ χ r | 19 K 4.34 0.502 0.82 2.36 | 20 Ca 6.11 —0.6 1.00 1.97 | 21 Sc 6.54 -0.4 1.36 1.64 | 22 Ti 6.82 0.08 1.54 1.46 | 23 V 6.74 0.53 1.66 1.34 | 24 Cr 6.76 0.67 1.66 1.27 | 25 Mn 7.43 -1.2 1.55 1.30 | 26 Fe 7.90 0.15 1.8 1.26(α) | 27 Co 7.86 0.66 1.88 1.25 | 28 Ni 7.63 1.16 1.91 1.24 | 29 Cu 7.72 1.23 1.90 1.28 | 30 Zn 9.39 -0.9 1.65 1.39 | 31 Ga 6./00 0.18 1.81 1,39 | 32 Ge 7.88 1.2 2.011 1,39 | 33 As 9.81 0.6 2.18 1,48 | 34 Se 9.75 2.07 2.55 1,60 | 35 Br 11.84 3.36 2.96 1.14 | 36 Kr 14.00 — 1,98 |
ЭИ СЭ χ r | 37 Rb 4.18 0.4859 0.82 2.48 | 38 Sr 5.69 -0.5 0.95 2.15 | 39 Y 6.38 0.31 1.22 1.81 | 40 Zr 6.84 0.43 1.33 1.60 | 41 Nb 6.88 0.89 1.6 1.45 | 42 Mo 7.10 0.75 2.16 1.39 | 43 Tc 7.28 0.6 1.9 1.36 | 44 Ru 7.36 1.1 2.28 1.33 | 45 Rh 7.46 1.14 2.2 1.34 | 46 Pd 8.33 0.56 2.20 1.38 | 47 Ag 7.574 1.30 1.93 1.44 | 48 Cd 8.99 -0.6 1.69 1.56 | 49 In 5.79 0.2 1.78 1.66 | 50 Sn 7.34 1.11 1.96 1.58 | 51 Sb 8.64 1.1 2.05 1.61 | 52 Te 9.01 2.2 2.1 1.70 | 53 I 10.45 3.06 2.66 1.33 | 54 Xe 12.13 — 2,18 |
ЭИ СЭ χ r | 55 Cs 3.89 0.4716 0.79 2.67 | 56 Ba 5.21 0.89 2,21 | 57 La 5.58 0.5 1.10 1,87 | 72 Hf 7.5 1.3 1,59 | 73 Ta 7.89 0.32 1.5 1.46 | 74 W 7.98 0.82 2.36 1.40 | 75 Re 7.88 0.15 1.9 1.37 | 76 Оs 8.73 1.4 2.2 1.35 | 77 Ir 9.05 1.57 2.2 1.36 | 78 Pt 8.96 2.13 2.28 1.38 | 79 Au 9.23 2.31 2.54 1.44 | 80 Hg 10.44 2.00 1,60 | 81 Tl 6.11 0.3 2.04 1,71 | 82 Pb 7.42 0.37 2.33 1.75 | 83 Bi 12.25 0.95 2.02 1,82 | 84 Po 8.42 1.9 2.0 1.67 | 85 At 9.0 2.9 2.2 | 86 Rn 1038 |
χ – электроотрицательность по Полингу
r— атомный радиус, (из «Лабораторные и семинарские занятия по общей и неорганической химии» , Н.С. Ахметов, М.К. Азизова, Л.И. Бадыгина)
studfile.net
Основные сведения о строении атома: характеристики, особенности и формула
Атом – это мельчайшая частица химического вещества, которая способна сохранять его свойства. Слово «атом» происходит от древнегреческого «atomos», что означает «неделимый». В зависимости о того, сколько и каких частиц находится в атоме, можно определить химический элемент.
Кратко о строении атома
Как можно вкратце перечислить основные сведения о строении атома? Атом является частицей с одним ядром, которое заряжено положительно. Вокруг этого ядра расположено отрицательно заряженное облако из электронов. Каждый атом в своем обычном состоянии является нейтральным. Размер этой частицы полностью может быть определен размером электронного облака, которое окружает ядро.
Само ядро, в свою очередь, тоже состоит из более мелких частиц – протонов и нейтронов. Протоны являются положительно заряженными. Нейтроны не несут в себе никакого заряда. Однако протоны вместе с нейтронами объединяются в одну категорию и носят название нуклонов. Если необходимы основные сведения о строении атома кратко, то эта информация может быть ограничена перечисленными данными.

Первые сведения об атоме
О том же, что материя может состоять из мелких частиц, подозревали еще древние греки. Они полагали, что все существующее и состоит из атомов. Однако такое воззрение носило чисто философский характер и не может быть трактовано научно.
Первым основные сведения о строении атома получил английский ученый Джон Дальтон. Именно этот исследователь сумел обнаружить, что два химических элемента могут вступать в различные соотношения, и при этом каждая такая комбинация будет представлять собой новое вещество. Например, восемь частей элемента кислорода порождают собой углекислый газ. Четыре части кислорода – угарный газ.
В 1803 году Дальтон открыл так называемый закон кратных отношений в химии. При помощи косвенных измерений (так как ни один атом тогда не мог быть рассмотрен под тогдашними микроскопами) Дальтон сделал вывод об относительном весе атомов.

Исследования Резерфорда
Почти столетие спустя основные сведения о строении атомов были подтверждены еще одним английским химиком — Эрнестом Резерфордом. Ученый предложил модель электронной оболочки мельчайших частиц.
На тот момент названная Резерфордом «Планетарная модель атома» была одним из важнейших шагов, которые могла сделать химия. Основные сведения о строении атома свидетельствовали о том, что он похож на Солнечную систему: вокруг ядра по строго определенным орбитам вращаются частицы-электроны, подобно тому, как это делают планеты.
Электронная оболочка атомов и формулы атомов химических элементов
Электронная оболочка каждого из атомов содержит ровно столько электронов, сколько находится в его ядре протонов. Именно поэтому атом является нейтральным. В 1913 году еще один ученый получил основные сведения о строении атома. Формула Нильса Бора была похожа на ту, что получил Резерфорд. Согласно его концепции, электроны также вращаются вокруг ядра, расположенного в центре. Бор доработал теорию Резерфорда, внес стройность в ее факты.
Уже тогда были составлены формулы некоторых химических веществ. Например, схематически строение атома азота обозначается как 1s22s22p3, строение атома натрия выражается формулой 1s22s22p63s1. Через эти формулы можно увидеть, какое количество электронов движется по каждой из орбиталей того или иного химического вещества.

Модель Шредингера
Однако затем и эта атомная модель устарела. Основные сведения о строении атома, известные науке сегодня, во многом стали доступны благодаря исследованиям австрийского физика Э. Шредингера.
Он предложил новую модель его строения – волновую. К этому времени ученые уже доказали, что электрон наделен не только природой частицы, но обладает свойствами волны.
Однако у модели Шредингера и Резерфорда имеются и общие положения. Их теории сходны в том, что электроны существуют на определенных уровнях.
Такие уровни также называются электронными слоями. При помощи номера уровня может быть охарактеризована энергия электрона. Чем выше слой, тем большей энергией он обладает. Все уровни считаются снизу вверх, таким образом, номер уровня соответствует его энергии. Каждый из слоев в электронной оболочке атома имеет свои подуровни. При этом у первого уровня может быть один подуровень, у второго – два, у третьего – три и так далее (см. приведенные выше электронные формулы азота и натрия).
Еще более мелкие частицы
На данный момент, конечно, открыты еще более мелкие частицы, нежели электрон, протон и нейтрон. Известно, что протон состоит из кварков. Существуют и еще более мелкие частицы мироздания – например, нейтрино, который по своим размерам в сто раз меньше кварка и в миллиард раз меньше протона.
Нейтрино – это настолько мелкая частица, что она в 10 септиллионов раз меньше, чем, к примеру, тираннозавр. Сам тираннозавр во столько же раз меньших размеров, чем вся обозримая Вселенная.
Основные сведения о строении атома: радиоактивность
Всегда было известно, что ни одна химическая реакция не может превратить один элемент в другой. Но в процессе радиоактивного излучения это происходит самопроизвольно.
Радиоактивностью называют способность ядер атомов превращаться в другие ядра – более устойчивые. Когда люди получили основные сведения о строении атомов, изотопы в определенной мере могли служить воплощением мечтаний средневековых алхимиков.
В процессе распада изотопов испускается радиоактивное излучение. Впервые такое явление было обнаружено Беккерелем. Главный вид радиоактивного излучения – это альфа-распад. При нем происходит выброс альфа-частицы. Также существует бета-распад, при котором из ядра атома выбрасывается, соответственно, бета-частица.
Природные и искусственные изотопы
В настоящее время известно порядка 40 природных изотопов. Их большая часть расположена в трех категориях: урана-радия, тория и актиния. Все эти изотопы можно встретить в природе – в горных породах, почве, воздухе. Но помимо них, известно также порядка тысячи искусственно выведенных изотопов, которые получают в ядерных реакторах. Многие их таких изотопов используются в медицине, особенно в диагностике.

Пропорции внутри атома
Если представить себе атом, размеры которого будут сопоставимы с размерами международного спортивного стадиона, тогда можно визуально получить следующие пропорции. Электроны атома на таком «стадионе» будут располагаться на самом верху трибун. Каждый из них будет иметь размеры меньше, чем булавочная головка. Тогда ядро будет расположено в центре этого поля, а его размер будет не больше, чем размер горошины.
Иногда люди задают вопрос, как в действительности выглядит атом. На самом деле он в буквальном смысле слова не выглядит никак – не по той причине, что в науке используются недостаточно хорошие микроскопы. Размеры атома находятся в тех областях, где понятие «видимости» просто не существует.
Атомы обладают очень малыми размерами. Но насколько малы в действительности эти размеры? Факт состоит в том, что самая маленькая, едва различимая человеческим глазом крупица соли содержит в себе порядка одного квинтиллиона атомов.
Если же представить себе атом такого размера, который мог бы уместиться в человеческую руку, то тогда рядом с ним находились бы вирусы 300-метровой длины. Бактерии имели бы длину 3 км, а толщина человеческого волоса стала бы равна 150 км. В лежачем положении он смог бы выходить за границы земной атмосферы. А если бы такие пропорции были действительны, то человеческий волос в длину смог бы достигать Луны. Вот такой он непростой и интересный атом, изучением которого ученые продолжают заниматься и по сей день.
fb.ru
Состав атомного ядра. Число протонов — урок. Химия, 8–9 класс.
Предложенная Э. Резерфордом в \(1911\) году ядерная (планетарная) модель строения атома сводится к следующим положениям:
- атом состоит из положительно заряженного ядра и движущихся вокруг него электронов;
- более \(99,96\) % массы атома сосредоточено в его ядре;
- диаметр ядра примерно в сто тысяч раз меньше диаметра самого атома.
Согласно этой модели можно дать следующее определение атома:
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Ядро атома состоит из элементарных частиц: протонов и нейтронов. Протоны и нейтроны имеют общее название нуклоны (ядерные частицы).
Протон (\(p\)) — частица, имеющая заряд \(+1\) и относительную массу, равную \(1\).
Нейтрон (\(n\)) — частица без заряда с относительной массой \(1\).
К элементарным частицам относятся также электроны (\(e\)), которые образуют электронную оболочку атома.
Протоны и нейтроны имеют одинаковую массу. Масса электрона составляет 11840 массы протона и нейтрона. Поэтому основная масса атома сосредоточена в его ядре.
Протон имеет положительный заряд \(+1\). Заряд электрона — отрицательный и по величине равен заряду протона: \(–\)\(1\).
Частицы | Обозначения | Относительная масса | Относительный заряд |
| Протон | \(p\) | \(1\) | \(+1\) |
| Нейтрон | \(n\) | \(1\) | \(0\) |
| Электрон | \(e\) | \(1/1840\) | \(–1\) |
Установлено, что число протонов в ядре равно порядковому номеру элемента в Периодической таблице.
Заряд ядра определяется числом протонов в нём. Значит, заряд ядра тоже равен порядковому номеру элемента.
Атом — электронейтральная частица, поэтому число электронов в нём равно числу протонов.
Обрати внимание!
Порядковый номер элемента \(=\) заряд ядра атома \(=\) число протонов в ядре \(=\) число электронов в атоме.
Водород — элемент № \(1\). Заряд ядра его атома равен \(+1\). В ядре находится один протон, а в электронной оболочке — один электрон.
Углерод — элемент № \(6\). Заряд ядра его атома равен \(+6\), в нём — \(6\) протонов. В атоме содержится \(6\) электронов с общим зарядом \(–\)\(6\).
Обрати внимание!
Заряд ядра — главная характеристика атома.
Изучение строения атомных ядер привело к уточнению формулировки периодического закона. Современная формулировка звучит следующим образом:
cвойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величин зарядов ядер их атомов.
www.yaklass.ru
Строение атома — Викиверситет
Строение атома
Атом (от греческого atomos — неделимый) — одноядерная, неделимая химическим путем частица химического элемента, носитель свойств вещества. Вещества состоят из атомов. Сам атом состоит из положительно заряженного ядра и отрицательно заряженного электронного облака. В целом атом электронейтрален. Размер атома полностью определяется размером его электронного облака, поскольку размер ядра ничтожно мал по сравнению с размером электронного облака. Ядро состоит из Z положительно заряженных протонов (заряд протона соответствует +1 в условных единицах) и N нейтронов, которые не несут на себе заряда (количество нейтронов может быть равно или чуть больше или меньше, чем протонов). Протоны и нейтроны называют нуклонами, то есть частицами ядра. Таким образом, заряд ядра определятся только количеством протонов и равен порядковому номеру элемента в таблице Менделеева. Положительный заряд ядра компенсируется отрицательно заряженными электронами (заряд электрона -1 в условных единицах), которые формируют электронное облако. Количество электронов равно количеству протонов. Массы протонов и нейтронов равны (соответственно 1 и 1 а.е.м.). Масса атома в основном определяется массой его ядра, поскольку масса электрона примерно в 1836 раз меньше массы протона и нейтрона и в расчётах редко учитывается. Точное количество нейтронов можно узнать по разности между массой атома и количеством протонов (N=A—Z). Вид атомов какого-либо химического элемента с ядром, состоящим из строго определённого числа протонов (Z) и нейтронов (N), называется нуклидом (это могут быть как разные элементы с одинаковым общим количеством нуклонов (изобары) или нейтронов (изотоны), так и один химический элемент — одно количество протонов, но разное количество нейтронов (изомеры)).
| элементарная частица | заряд (условные единицы) | заряд (Кл) | масса (а.е.м.) | масса (г) |
|---|---|---|---|---|
| протон | +1 | 1,6·10×10-19 | 1 | 1,7·10×10-24 |
| нейтрон | 0 | 0 | 1 | 1,7·10×10-24 |
| электрон | -1 | -1,6·10×10-19 | 0 | 9,1·10×10-28 |
Поскольку в ядре атома сосредоточена практически вся масса, но его размеры ничтожно малы по сравнению с общим объёмом атома, то ядро условно принимается материальной точкой, покоящейся в центре атома, а сам атом рассматривается как система электронов. При химической реакции ядро атома не затрагивается (кроме ядерных реакций), как и внутренние электронные уровни, а участвуют только электроны внешней электронной оболочки. По этой причине необходимо знать свойства электрона и правила формирования электронных оболочек атомов.
Свойства электрона
Перед изучением свойств электрона и правил формирования электронных уровней необходимо затронуть историю формирования представлений о строении атома. Мы не будем рассматривать полную историю становления атомарного строения, а остановимся лишь на самых актуальных и наиболее «верных» представлениях, способных наиболее наглядно показать как располагаются электроны в атоме. Первыми наличие атомов как элементарных составляющих вещества предположили еще древнегреческие философы (если какое-либо тело начать делить пополам, половинку ещё пополам и так далее, то этот процесс не сможет происходить до бесконечности; мы остановимся на частичке, которую уже не сможем поделить, — это и будет атом). После чего история строения атома прошла сложный путь и разные представления, такие как неделимость атома, Томсоновская модель атома и другие. Наиболее близкой оказалась модель атома, предложенная Эрнестом Резерфордом в 1911 году. Он сравнил атом с солнечной системой, где в роли солнца выступало ядро атома, а электроны двигались вокруг него подобно планетам. Размещение электронов на стационарных орбитах было очень важным шагом в понимании строения атома. Однако такая планетарная модель строения атома шла в противоречие с классической механикой. Дело в том, что при движении электрона по орбите он должен был терять потенциальную энергию и в конце концов «упасть» на ядро, и атом должен был прекратить свое существование. Такой парадокс был устранен введением постулатов Нильсом Бором. Согласно этим постулатам, электрон двигался по стационарным орбитам вокруг ядра и при нормальных условиях не поглощал и не испускал энергию. Постулаты показывают, что для описания атома законы классической механики не подходят. Такая модель атома называется моделью Бора-Резерфорда. Продолжением планетарного строения атома является квантово-механическая модель атома, согласно которой мы и будем рассматривать электрон.
Электрон является квазичастицей, проявляя корпускулярно-волновой дуализм: он одновременно является и частицей (корпускула), и волной. К свойствам частицы можно отнести массу электрона и его заряд, а к волновым свойствам — способность к дифракции и интерференции. Связь между волновыми и корпускулярными свойствами электрона отражены в уравнении де Бройля:
- λ=hmv,{\displaystyle \lambda ={\frac {h}{mv}},}
где λ{\displaystyle \lambda } — длина волны, m{\displaystyle m} — масса частицы, v{\displaystyle v} — скорость частицы, h{\displaystyle h} — постоянная Планка = 6,63·10-34 Дж·с.
Для электрона невозможно рассчитать траекторию его движения, можно говорить только о вероятности нахождения электрона в том или ином месте вокруг ядра. По этой причине говорят не об орбитах движения электрона вокруг ядра, а об орбиталях — пространстве вокруг ядра, в котором вероятность нахождения электрона превышает 95%. Для электрона невозможно одновременно точно измерить и координату, и скорость (принцип неопределённости Гейзенберга).
- Δx∗m∗Δv>ℏ2{\displaystyle \Delta x*m*\Delta v>{\frac {\hbar }{2}}}
где Δx{\displaystyle \Delta x} — неопределённость координаты электрона, Δv{\displaystyle \Delta v} -погрешность измерения скорости, ħ=h/2π=1.05·10-34 Дж·с
Чем точнее мы измеряем координату электрона, тем больше погрешность в измерении его скорости, и наоборот: чем точнее мы знаем скорость электрона, тем больше неопределённость в его координате.
Наличие волновых свойств у электрона позволяет применить к нему волновое уравнение Шредингера.
∂2Ψ∂x2+∂2Ψ∂y2+∂2Ψ∂z2+8π2mh(E−V)Ψ=0{\displaystyle {\frac {{\partial }^{2}\Psi }{\partial x^{2}}}+{\frac {{\partial }^{2}\Psi }{\partial y^{2}}}+{\frac {{\partial }^{2}\Psi }{\partial z^{2}}}+{\frac {8{\pi ^{2}}m}{h}}\left(E-V\right)\Psi =0}
где E{\displaystyle E} — полная энергия электрона, V{\displaystyle V} потенциальная энергия электрона, физический смысл функции Ψ{\displaystyle \Psi } — квадратный корень от вероятности нахождения электрона в пространстве с координатами x, y и z (ядро считается началом координат).
Представленное уравнение написано для одноэлектронной системы. Для систем, содержащих более одного электрона, принцип описания остаётся прежним, но уравнение принимает более сложный вид. Графическим решением уравнения Шредингера является геометрия атомных орбиталей. Так, s-орбиталь имеет форму шара, p-орбиталь — форму восьмерки с «узлом» в начале координат (на ядре, где вероятность обнаружения электрона стремится к нулю).
В рамках современной квантово-механической теории электрон описывается набором квантовых чисел: n, l, ml, s и ms. Согласно принципу Паули в одном атоме не может быть двух электронов с полностью идентичным набором всех квантовых чисел.
Главное квантовое число n определяет энергетический уровень электрона, то есть на каком электронном уровне расположен данный электрон. Главное квантовое число может принимать только целочисленные значения больше 0: n=1;2;3… Максимальное значение n для конкретного атома элемента соответствует номеру периода, в котором расположен элемент в периодической таблице Д. И. Менделеева.
Орбитальное (дополнительное) квантовое число l определяет геометрию электронного облака. Может принимать целочисленные значения от 0 до n-1. Для значений дополнительного квантового числа l применяют буквенное обозначение:
| значение l | 0 | 1 | 2 | 3 | 4 |
|---|---|---|---|---|---|
| буквенное обозначение | s | p | d | f | g |
S-орбиталь имеет форму шара, p-орбиталь — форму восьмерки. Остальные орбитали имеют очень сложную структуру, как, например, представленная на рисунке d-орбиталь.
-

-

-

-

вид орбиталей на разных энергетических уровнях (при разных n)
Электроны по уровням и орбиталям располагаются не хаотично, а по правилу Клечковского, согласно которому заполнение электронов происходит по принципу наименьшей энергии, то есть в порядке возрастания суммы главного и орбитального квантовых чисел n+l. В случае, когда сумма для двух вариантов заполнения одинакова, первоначально заполняется наименьший энергетический уровень (например: при n=3 а l=2 и n=4 а l=1 первоначально заполняться будет уровень 3). Магнитное квантовое число ml определяет расположение орбитали в пространстве и может принимать целочисленное значение от -l до +l, включая 0. Для s-орбитали возможно только одно значение ml=0. Для p-орбитали — уже три значения -1, 0 и +1, то есть p-орбиталь может располагаться по трём осям координат x, y и z.
 расположение орбиталей в зависимости от значения ml
расположение орбиталей в зависимости от значения mlЭлектрон обладает собственным моментом импульса — спином, обозначающимся квантовым числом s. Спин электрона — величина постоянная и равная 1/2. Явление спина можно условно представить как движение вокруг собственной оси. Первоначально спин электрона приравнивали к движению планеты вокруг собственной оси, однако такое сравнение ошибочно. Спин — чисто квантовое явление, не имеющее аналогов в классической механике.
ru.wikiversity.org
Особенности строения атома водорода :: SYL.ru
Самый распространенный элемент в космосе, состоящий из самых легких атомов, — это водород. Он открыт еще в 14 столетии великим алхимиком Парацельсом. Ученого по праву считают основоположником не только медицины, но и химии. Строение атома водорода было в дальнейшем детально рассмотрено Нильсом Бором. Элемент был затем обнаружен астрономами в составе Солнца и других планет, а также в газовых звездных туманностях. В них происходит процесс превращения атомов водорода в атомы гелия, иными словами, наблюдается ядерная реакция. В нашей статье мы изучим не только строение атома водорода, но и рассмотрим характерные особенности свойств этого химического элемента.
Место элемента в периодической системе Менделеева
Водород – единственный химический элемент, находящийся сразу в двух группах периодической системы: 1 и 7. Объяснить следующий факт можно так: он проявляет двойственные химические свойства. Особое строение атома водорода позволяет ему отдавать свой единственный электрон атомам, например, активных элементов – неметаллов. Это прежде всего галогены: агрессивные по своим свойствам фтор, хлор, бром и йод. Легко взаимодействует H2 и с халькогенами: серой, кислородом, селеном. В этом случае атомы водорода превращаются в катионы – положительно заряженные частицы.
Благодаря этой особенности элемент занимает место в первой группе периодической системы. Иначе выглядит механизм реакции между металлами и водородом. Согласно теории строения атома водорода по Н. Бору, элемент имеет один неспаренный электрон. Атом H принимает электроны от атомов активных щелочных или щелочноземельных металлов. Таким образом, его электронная конфигурация становится похожей на частицу инертного газа гелия. Единственный энергетический слой теперь полностью завершен. В данных процессах строение атома водорода изменяется и он переходит в форму аниона. Именно по этой причине элемент одновременно располагается в периодической системе еще и в ее 7 группе.

Все в сравнении
Продолжая изучать особенности строения водородных частиц, давайте посмотрим, насколько их внутренняя структура влияет на поведение элемента в реакциях. Для этого обратим внимание на его ближайших соседей по периодической системе и определим, каково строение атомов водорода, гелия и лития. С частицами инертного газа водород объединяет одинаковое количество энергетических уровней, с литием – похожее строение внешнего энергетического слоя, на котором расположен один электрон. Однако свойства водорода сильно отличаются как от инертного газа, так и от щелочного металла. Этот факт доказывает, что все характеристики химического элемента полостью определяются строением атома и молекулы водорода, то есть количеством энергетических уровней и распределением электронов на них.
Рождающий воду
Название элемента говорит о том, что соединение его атомов с частицами кислорода приводит к появлению такого уникального и важного для Земли вещества, как вода. В обычных условиях эта реакция не происходит, температура горения газовой смеси достигает 2800 °C. В лаборатории взаимодействие между H2 и O2 в соотношении 2:1 приводит к взрыву. Сама смесь получила название гремучего газа, а процесс, протекающий в ней, идет по свободно-радикальному механизму. Если его не контролировать, то реакция заканчивается серьезной проблемой – мощным взрывом. По этой причине, несмотря на его исключительную легкость, от водорода отказались как от наполнителя для воздушных летательных аппаратов. Печальным поводом послужило крушение в 1937 году дирижабля «Гинденбург», направлявшегося в Америку. Посмотрим теперь, как строение атома водорода влияет на физические признаки газа.

Водород, дейтерий, тритий
Пусть вас не удивляет приведенный выше перечень терминов. Речь идет все об одном и том же химическом элементе водороде, заряд ядра атома которого равен +1. Второе и третье названия – это имена изотопов. Причина их различий заключается в количестве нейтронов в ядре, тогда как протонное число всех трех видов частиц одинаково. У дейтерия два нейтрона, у трития – 3, сам же водород имеет 1 нейтрон в составе своего ядра. Вода, содержащая в составе своих молекул дейтерий, называется тяжелой. Ее можно обнаружить в прудах-охладителях атомных станций, а также в составе цитоплазмы клеток, имеющих нарушения нормального метаболизма.
Электронное строение атома водорода
Схема, приведенная ниже, поможет нам понять специфику поведения простого вещества H2 в различных химических взаимодействиях.

Наличие единственного электрона, занявшего s-орбиталь первого энергетического уровня, обеспечивает постоянную валентность водорода, равную 1. В большинстве случаев этот электрон покидает пространство атома и переходит во владение более электроотрицательных элементов. Лишь реакции с металлами позволяют водороду притянуть в сферу влияния собственного ядра электрон от атомов активных щелочных или щелочноземельных элементов, образуя белые кристаллические соединения — их гидриды.
Активный и агрессивный
Атомарный водород, так сказать, легок на подъем. Его быстроте в восстановлении металлов из их оксидов могут позавидовать другие восстановители вроде углерода или его окислов. Так же активно атомы H соединяются с частицами серы, кислорода, фосфора. А пламя горелки с атомарным водородом дает разогрев выше 4000 °C. По этой причине такими приборами легко обрабатывать поверхности металлов: резать или сваривать их.

Атомарный водород хорошо зарекомендовал себя в качестве восстановителя чистых металлов — вольфрама, молибдена — из их руд, представленных в основном оксидами. Встречаясь с такими же атомами, как и он сам, водород образует устойчивую и пассивную структуру – молекулу. Оба атома H держатся друг за друга с помощью общей электронной пары, являясь образцом стабильной ковалентной неполярной связи. Она прочная и обеспечивает устойчивость молекул H2 как в условиях земного существования, так и на просторах космоса. Не обошлась без водорода и пищевая промышленность, в которой его применяют для гидрогенизации масел и получения модных в современной диетологии низкокалорийных спредов.

В нашей статье мы рассмотрели, каково строение атома водорода, и выяснили, как оно влияет на свойства простого вещества
www.syl.ru