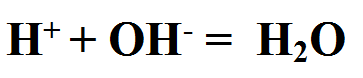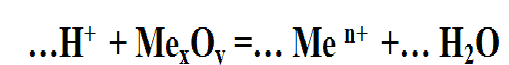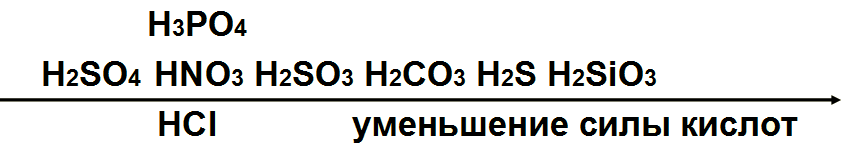Свойства оснований, кислот, солей и оксидов
Кислоты в свете ТЭД
Химические свойства кислот.
Кислота Р., Н. + Ме(ОН)х Р., Н. = соль + вода (р. Обмена, р. Нейтрализации, если Ме(ОН)х— щелочь)

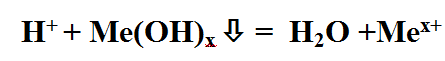
Кислота Р.+ МехОу (степень окисления Ме от +1до +4) = сольР. + вода (р. Обмена,)

Кислота Р.+ соль Р. иногда Н.= новая кислота + новая соль (р. Обмена, ↓, ↑-СО2, SO2, Н2S, кислота сильнее новой кислоты)

Кислота + Ме = соль + Н2↑ (р. Замещения, происходит если: а) Ме стоит в ЭХРН до Н2, б) Соль — р., в) Кислота – р., г) Кислота не HNO3 и не конц. Н2SO4)
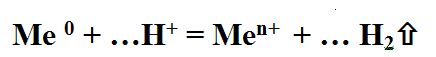
Способы получения
Кислотный оксид + вода = кислота (кислородсодержащие кислоты)
НеМе + Н2= НхнеМе (бескислородные кислоты)
Соль + кислота = новая кислота + новая соль↓
Основания в свете ТЭД
Химические свойства оснований.
Кислота Р., Н. + Ме(ОН)х Р., Н. = соль + вода (р. Обмена, р. Нейтрализации, если Ме(ОН)х— щелочь)


Основание Р.+ МехОу (степень окисления Ме от +5 до +7) = соль + вода
Основание Р.+ неМехОу = соль + вода (р. Обмена)
Основание Р.+ соль Р.= новое основание + новая соль (р. Обмена, ↓, ↑-NH3)
Нерастворимое основание t= неМехОу + Н2О↑ (р. Разложения)
Способы получения
Оксид Ме + вода = щелочь (Li2O, Na2O, K2O, Rb2O, Cs2O, CaO, BaO, SrO)
Щелочной 2Ме + 2Н2О= 2МеОН Р + Н2↑ (щелочь) ( Li, Na, K, Rb, Cs)
Щелочноземельный Ме + 2Н2О= Ме(ОН) Р (щелочь) + Н2↑ (Ca, Ba, Sr)
Соль р + основание р = новое основание↓+ новая соль
Соли, их классификация, свойства в свете ТЭД
Соли
Свойства солей
1. Соль + кислота = другая соль + другая кислота (↓ или ↑ CO2, SO2, H2S)
2. Соль (р) + щелочь = другая соль + другое основание (↓ или ↑ NH3)
3. Соль1 (р) + соль2 (р) = соль3 + соль4 (↓ )
4. Соль (р) + металл (более активный, но не
5. Некоторые соли могут разлагаться при прокаливании.
СаСО3 = СаО + СО2
(CuOH)2 СО3 CuO + CO2 + H2O
2NaHCO3Na2CO3 + CO2 + H2O
MeNO3 —
Оксиды, их классификация, свойства в свете ТЭД
Оксиды
Несолеобразующие Солеобразующие
CO, N2O, NO, SiO,
Основные Амфотерные Кислотные
Ме+1,+2xOy Ме+3,+4 xOy Ме>+4xOy
НЕМеxOy
Химические свойства основных оксидов
1. О.О + кислота = соль + вода
2. O.O+ вода = щелочь!!!
3. О.О + К.О = соль
4. О.О + А.О = соль
Химические свойства кислотных оксидов
1. К.О + основание = соль + вода
2. К.O+ вода = кислота (искл. SiO2)
3. О.О + К.О = соль
4. K.О + А.О = соль
5. K.O + соль летучих К.О= новая соль + летучий К.О↑
Химические свойства амфотерных оксидов
1. А.О + щелочь = соль + вода
А.О + кислота = соль + вода
2. А.O+ вода = реакция не идет
3. А.О + К.О = соль
4. А.О + О.О = соль
5. А.O + соль летучих К.О= новая соль + летучий К.О↑
infourok.ru
Практическая работа №8. Свойства кислот, оснований, оксидов
Задание 1
Вариант 1. Химические свойства соляной кислоты.Взаимодействие с металлами.
| Mg + 2HCl ⟶ MgCl2 + H2↑ Mg + 2H+ + 2Cl— ⟶ Mg2+ + 2Cl— + H2↑ Mg + 2H+ ⟶ Mg2+ + H2↑ |
||
| H+1 + 2ē ⟶ H20 | 1 | окислитель (восстановление) |
| Mg0 — 2ē ⟶ Mg +2 | 1 | восстановитель (окисление) |
Взаимодействие с основными оксидами.
MgO + HCl ⟶ MgCl2 + H2O
MgO + 2H+ + 2Cl— ⟶ Mg2+ + 2Cl+ + H2O
MgO + 2H+ ⟶ Mg2+ + H2O
Взаимодействие с щелочами.
NaOH + HCl ⟶ NaCl + H2O
Na+ + OH— + H+ + Cl— ⟶ Na+ + Cl— + H2O
H+ + OH— ⟶ H2O
Взаимодействие с нерастворимыми основаниями.
Fe(OH)3 + 3HCl ⟶ FeCl3 + 3H2O
Fe(OH)3 + 3H+ + 3Cl— ⟶ Fe3+ + 3Cl— + 3H2O
Fe(OH)3 + 3H+ ⟶ Fe3+ + 3H
Взаимодействие с солями, если выпадает осадок или выделяется газ.
AgNO3 + HCl ⟶ HNO3 + AgCl↓
Ag+ + NO3— + H+ + Cl— ⟶ H+ + NO3— + AgCl↓
Ag+ + Cl— ⟶ AgCl↓
Сильные кислоты вытесняют более слабые из их солей.
KNO2 + HCl ⟶ KCl + HNO2
K+ + NO2— + H+ + Cl+ ⟶ K+ + Cl— + HNO2
H+ + NO2— ⟶ HNO2
Взаимодействие с металлами.
| 2Al + 3H2SO4 ⟶ Al2(SO4)3 + 3H2↑ 2Al + 6H+ + 3SO42- ⟶ 2Al 3+ + 3SO42- + 3H2↑ 2Al + 6H+ ⟶ 2Al3+ + 3H2↑ |
||
| H+1 + 2ē ⟶ H20 | 3 | окислитель (восстановление) |
| Al0 — 3ē ⟶ Al+3 | 2 | восстановитель (окисление) |
Взаимодействие с основными оксидами.
CuO + H2SO4 ⟶ CuSO4 + H2O
CuO + 2H+ + SO42- ⟶ Cu2+ + SO42- + H2O
CuO + 2H+ ⟶ Cu2+ + H2O
Взаимодействие с основаниями.
Cu(OH)2 + H2SO4 ⟶ CuSO4 + 2H2O
Cu(OH)2 + 2H+ + SO4
Cu(OH)2 + 2H+ ⟶ Cu2+ + 2H2O
Взаимодействие с солями, если выпадает осадок или выделяется газ.
BaCl2 + H2SO4 ⟶ 2HCl + BaSO4↓
Ba2+ + 2Cl— + 2H+ + SO42- ⟶ 2H+ + 2Cl— + BaSO4↓
Ba2+ + SO42- ⟶ BaSO4↓
Сильные кислоты вытесняют более слабые из их солей.
2NaNO2 + H2SO4 ⟶ Na2SO4 + 2HNO2
2Na+ + 2NO2— + 2H+ + SO42- ⟶ 2Na+ + SO42- + 2HNO2
H+ + NO2— ⟶ HNO2
Задание 2
Вариант 1. Химические свойства раствора гидроксида натрия.Взаимодействие с кислотными оксидами
SO2 + 2NaOH ⟶ Na2SO3 + H2O
SO2 + 2Na+ + 2OH— ⟶ 2Na+ + SO32- + H2O
SO2 + 2OH— ⟶ SO32- + H2O
Взаимодействие с кислотами
HCl + NaOH ⟶ NaCl + H2O
H+ + Cl— + Na+ + OH— ⟶ Na+ + Cl— + H2O
H+ + OH— ⟶ H2O
Взаимодействие с растворами солей, если выпадает осадок или выделяется газ.
FeCl3 + 3NaOH ⟶ NaCl + Fe(OH)3↓
Fe3+ + 3Cl— + 3Na+ + 3OH— ⟶ 3Na+ + 3Cl— + Fe(OH)3↓
Fe3+ + 3OH— ⟶ Fe(OH)3↓
Получение гидроксида железа (III).
FeCl3 + 3NaOH ⟶ NaCl + Fe(OH)3↓
Fe3+ + 3Cl— + 3Na+ + 3OH— ⟶ 3Na+ + 3Cl— + Fe(OH)3↓
Fe3+ + 3OH— ⟶ Fe(OH)3↓
Разложение гидроксида железа (III).
2Fe(OH)3 t ⟶ Fe2O3 + 3H2O
Взаимодействие с кислотами
Fe(OH)3 + 3HCl ⟶ FeCl3 + 3H2O
Fe(OH)3 + 3H+ + 3Cl— ⟶ Fe3+ + 3Cl— + 3H2O
Fe(OH)3 + 3H+ ⟶ Fe3+ + 3H2O
Задание 3
Вариант 1. Оксид серы (IV).Получение оксида серы (IV).
S + O2 ⟶ SO2
Взаимодействует с водой.
H2O + SO2 ⇄ H2SO3
Взаимодействует с основными оксидами.
K2O + SO2 ⟶ K2SO3
Взаимодействует с щелочами.
2NaOH + SO2 ⟶ Na2SO3 + H2O
2Na+ + 2OH— + SO2 ⟶ 2Na+ + SO32- + H2O
2OH— + SO2 ⟶ SO32- + H2O
Взаимодействует с водой.
CaO + H2O ⟶ Ca(OH)2
Взаимодействует с кислотными оксидами.
CaO + CO2 ⟶ CaCO3
Взаимодействует с кислотами.
CaO + 2HCl ⟶ CaCl2 + H2O
CaO + 2H+ + 2Cl— ⟶ Ca2+ + 2Cl— + H2O
CaO + 2H+ ⟶ Ca2+ + H2O
Задание 4
Вариант 1. Химические свойства хлорида железа (II).Взаимодействует с металлами, стоящими в электрохимическом ряду напряжений металлов левее железа.
| Mg + FeCl2 t ⟶ MgCl2 + Fe↓ | ||
| Fe+2 + 2ē ⟶ Fe0 | 1 | окислитель (восстановление) |
| Mg0 — 2ē ⟶ Mg+2 | 1 | восстановитель (окисление) |
Взаимодействует с щелочами.
FeCl2 + 2NaOH ⟶ 2NaCl + Fe(OH)2↓
Fe2+ + 2Cl+ + 2Na+ + 2OH— ⟶ 2Na+ + 2Cl— + Fe(OH)2↓
Fe2+ + 2OH— ⟶ Fe(OH)2↓
Взаимодействие с растворами солей, если выпадает осадок или выделяется газ.
FeCl2 + Na2S ⟶ 2NaCl + FeS↓
Fe2+ + 2Cl— + 2Na+ + S2- ⟶ 2Na+ + 2Cl— + FeS↓
Fe2+ + S2- ⟶ FeS↓
Взаимодействует с металлами, стоящими в электрохимическом ряду напряжений металлов левее меди.
| Fe + CuCl2 t ⟶ FeCl2 + Cu↓ | ||
| Cu+2 + 2ē ⟶ Cu0 | 1 | окислитель (восстановление) |
| Fe0 — 2ē ⟶ Fe+2 | 1 | восстановитель (окисление) |
Взаимодействует с щелочами.
CuCl2 + 2NaOH ⟶ 2NaCl + Cu(OH)2↓
Fe2+ + 2Cl+ + 2Na+ + 2OH— ⟶ 2Na+ + 2Cl— + Cu(OH)2↓
Cu2+ + 2OH— ⟶ Cu(OH)2↓
Взаимодействие с растворами солей, если выпадает осадок или выделяется газ.
CuCl2 + Na2S ⟶ 2NaCl + CuS↓
Cu2+ + 2Cl— + 2Na+ + S2- ⟶ 2Na+ + 2Cl— + CuS↓
Cu2+ + S2- ⟶ CuS↓
gomolog.ru
Свойства оксидов, кислот, оснований и солей в свете ТЭД и процессов окисления-восстановления
Свойства оксидов, кислот, оснований и солей в свете теории электролитической диссоциации и процессов окисления-восстановления.
Сегодня мы с вами повторим химические свойства оксидов, кислот, оснований и солей.
Оксиды.
Оксиды всегда состоят из двух элементов, один из которых – обязательно кислород. В состав оксида может входить как металл, так и неметалл. Если в состав оксида входит неметалл, то тогда он чаще всего является кислотным, если в составе оксида металл с валентностью меньше четырёх, то тогда оксид считается основным. А вот если валентность металла высокая, то тогда этот оксид будет не основным, а кислотным.


А амфотерные оксиды могут быть и кислотным и основным, в зависимости от того, с чем они вступает в реакцию. Если они вступает в реакцию с кислотой или кислотным оксидом, то тогда проявляют основные свойства, а если они реагирует с основными оксидами или основаниями, то тогда проявляют кислотные свойства.

У амфотерных, кислотных и основных оксидов много общего, ведь они являются солеобразующими оксидами. А вот такие оксиды, как оксид углерода (II) – CO, оксид азота (I) – N2O, оксид азота (II) – NO и оксид кремния (II) – SiO являются несолеобразующими, они не взаимодействуют ни с кислотами, ни с основаниями и не образуют солей.

Основным оксидам соответствуют основания. Они вступают в реакции обмена с кислотами. При этом образуется соль и вода.

Например, если поместить в пробирку немного порошка оксида меди (II), он чёрного цвета, и в эту пробирку налить раствора серной кислоты и слегка нагреть, то постепенно проходит реакция, т.к. порошок начинает растворяться. Чтобы убедиться в том, что в результате реакции образуется соль, несколько капель содержимого пробирки поместим на предметное стекло и выпарим, после чего на стекле появляются кристаллы соли.
CuO + H2SO4 = CuSO4 + H2O
CuO + 2H+ = Cu2+ + H2O

Кроме этого, они вступают в реакции соединения с кислотными оксидами, при этом образуются соли.

Например, при взаимодействии оксида натрия (Na2O) с оксидом фосфора (V) (P2O5) образуется соль – фосфат натрия (Na3PO4), в результате взаимодействия оксида магния (MgO) с оксидом серы (VI) (SO3) образуется соль – сульфат магния (MgSO4), а при взаимодействии оксида кальция (CaO) с оксидом углерода (IV) (CO2) образуется соль – карбонат кальция (CaCO3).
3Na2O + P2O5 = 2Na3PO4
MgO + SO3 = MgSO4
CaO + CO2 = CaCO3
Они вступают в реакции соединения с водой с образованием щелочей. Если образуется нерастворимое основание, то такая реакция не идёт.

Например, если мы нальём в две пробирки воды и капнем туда несколько капель лакмуса, а затем поместим в первую пробирку оксид кальция (CaO), а в другую оксид меди (II) (CuO), то реакция у нас идёт только в первой пробирке. Так как образовалась щёлочь и лакмус изменил свою окраску на синюю, во второй пробирке изменений нет, т.к. оксид меди (II) не реагирует с водой, ведь Cu(OH)2 – нерастворимое в воде основание.
CaO + H2O = Ca(OH)2
CaO + H2O = Ca2+ + 2OH—
CuO + H2O ≠

Кислотным оксидам соответствуют кислоты.

Они вступают в реакции обмена с основаниями, при этом образуется соль и вода.
Если через пробирку с известковой водой (Ca(OH)2) пропустить углекислый газ (CO2) , то известковая вода мутнеет, следствие образования соли – карбоната кальция (CaCO3).

А также они реагируют с основными оксидами, при этом образуются соли. Например, в результате взаимодействия оксида серы (IV) (SO2) и оксида калия (K2O) образуется соль – сульфит калия (K2SO3), в результате взаимодействия оксида кремния (IV) (SiO2 ) с оксидом натрия (Na2O) при нагревании, образуется соль – силикат натрия (Na2SiO3), при взаимодействии оксида азота (V) (N2O5) с оксидом бария (BaO), образуется соль – нитрат бария (Ba(NO3)2).
SO2 + K2O = K2SO3
SiO2 + Na2O = Na2SiO3
N2O5 + BaO = Ba(NO3)2
Кроме этого, они вступают в реакции соединения с водой, при этом образуются кислоты, однако эти реакции возможные, если оксиды растворимы в воде. Для этого подтверждения, нальём в одну пробирку дистиллированной воды, а в другую – раствор углекислого газа (СО2) (газированной воды). В первую пробирку добавим оксида кремния (IV) (SiO2). А затем в каждую из пробирок добавим несколько капель лакмуса. В первой пробирке изменений нет, а во второй лакмус окрасился в красный цвет, значит во второй пробирке кислота. В первой пробирке кислоты не образовалось, потому что оксид кремния (IV) (SiO2) не растворим в воде.

А вот оксид цинка (ZnO) реагирует и с кислотами и с основаниями. Например, в реакции с соляной кислотой (HCl) он образует соль – хлорид цинка (ZnCl2), а в реакции с раствором гидроксида натрия (NaOH) образую комплексную соль – тетрагидроксоцинкат натрия (Na2[Zn(OH)4]), а при сплавлении с гидроксидом натрия он образует цинкат натрия (Na2ZnO2). Но с водой он не реагирует. Зато, он реагирую и с основными оксидами и с кислотными оксидами и образует при этом соли. Например, в реакции с оксидом калия (K2O), он проявляет кислотные свойства т.е. свойства кислотного оксида, в результате реакции образуется соль – цинкат калия (K2ZnO2), а в реакции с оксидом серы (VI) (SO3), он проявляет свойства основного оксида, в результате образуется соль – сульфат цинка (ZnSO4).
ZnO + 2HCl = ZnCl2 + H2O;
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
ZnO + 2NaOH = Na2ZnO2 + H2O
ZnO + K2O = K2ZnO2
ZnO + SO3 = ZnSO4
Кислоты.
Кислоты всегда начинается с водорода, окрашивают лакмус и метиловый оранжевый в красный цвет, ведь в их составе есть ион водорода (H+), который всегда образуется при диссоциации.

Так, при диссоциации соляной кислоты (HCl), образуется ион водорода и хлорид-ион (Cl—), при диссоциации азотной кислоты (HNO3), тоже ион водорода и нитрат-ион (NO3—), при диссоциации азотистой кислоты (HNO2) – ион водорода и нитрит-ион (NO2—).
HCl = H+ + Cl—
HNO3 = H+ + NO3—
HNO2 ⇆ H+ + NO2—
Именно поэтому, кислоты окрашивают лакмус и метиловый оранжевый в красный цвет.
Они реагируют с основаниями: как с растворимыми, так и с нерастворимыми. При этом образуется соль и вода. Этот тип реакций относится к реакциям обмена.
Кислота + основание = соль + вода
Например, если мы в пробирку с гидроксидом натрия (NaOH) добавим несколько капель фенолфталеина, то раствор щёлочи окрасится в малиновый цвет, а затем сюда же добавим раствор соляной кислоты (HCl), то малиновая окраска исчезает. Окраска исчезает, т.к. в результате этой реакции образуется соль и вода. Образование соли можно легко подтвердить: если мы на предметное стекло капнем несколько капель раствора и выпарим, то на стекле появятся кристаллы соли.

Аналогично они реагируют с нерастворимыми основаниями. Но для этого, сначала необходимо его получить, например, получим нерастворимое основание – гидроксид железа (III) (Fe(OH)3). Для этого, в раствор сульфата железа (III) (Fe2(SO4)3) добавим несколько капель гидроксида калия (КOH), при этом образуется осадок бурого цвета – это гидроксид железа (III). К этому нерастворимому основанию добавим соляной кислоты (HCl), осадок растворяется, т.к. образуется соль и вода. Если мы этот раствор соли поместим на предметное стекло и выпарим, то на стекле появятся кристаллы жёлтого цвета – это кристаллы соли хлорида железа (III) (FeCl3).

Кислоты также вступают в реакции обмена с оксидами металлов. В результате реакции образуется соль и вода. Эта реакция вам уже знакома, наверняка оксиды, вам уже всё рассказали об этом.
Кислота + оксид металла = соль + вода
Кислоты реагируют с металлами, эти реакции относятся к реакциям замещения, при этом образуется соль и выделяется водород.
Кислота + металл = соль + водород
Для протекания данных реакций необходимо выполнение ряда условий:
· металл находиться в ряду напряжений до водорода
· должна получиться растворимая соль
· если кислота нерастворимая, то она не может вступить в реакцию с металлами.
Давайте, попробуем проверить. Поместим в четыре пробирки металлы: в первую пробирку – цинк, во вторую – алюминий, в третью – свинец, четвёртую – медь. В первую и третью пробирку нальём раствора серной кислоты (H2SO4), во вторую и четвёртую – раствора соляной кислоты (HCl). Понаблюдаем за изменениями. В первой и второй пробирке наблюдается выделение водорода, в третьей и четвёртой – нет. В пробирке со свинцом и серной кислотой реакция не пошла, т.к. в результате образуется нерастворимая соль, которая покрывает всю поверхность металла защитной плёнкой. В четвёртой пробирке также изменений нет, т.к. медь стоит в ряду напряжений металлов после водорода.
Zn + H2SO4 = ZnSO4 + H2↑
Zn0 + 2H+ = Zn2+ + H20↑
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al0 + 6H+ = 2Al3+ + 3H20↑
Pb + H2SO4 ≠
Cu + HCl ≠

Кислоты вступаем в реакции обмена с солями, при этом образуется новая кислота и новая соль. Эти реакции протекают в том случае, если образуется осадок или газ.
Кислота + соль = новая кислота + новая соль
Соляна (HCl) и серная кислоты (H2SO4), вам покажут это: в первой пробирке будет соляная кислота и силикат натрия (Na2SiO3), во второй – серная кислота и карбоната калия (K2CO3), в третьей – опять соляной кислоты и хлорида бария (BaCl2). Посмотрим за изменениями. В первой пробирке мы наблюдаем образование студенистого осадка (H2SiO3), во второй – выделение газа (CO2), а в третьей – изменений нет. В двух пробирках реакции прошли, т.к. выполнялись следующие условия: в первой – образование осадка, во второй – выделение газа.

Основания.
В составе оснований всегда есть гидроксигруппа (ОН—), лакмус окрашивают они в синий цвет, метиловый оранжевый – в жёлтый, а фенолфталеин – в малиновый. При диссоциации оснований образуется катион металла (Меn+) и анион гидроксогруппы (ОН—).
Ме(ОН)n = Меn+ + nОН—
Щёлочи — растворимые в воде основания, реагируют с кислотами, об этой реакции нейтрализации вы уже знаете. А также реагируют с кислотными и амфотерными оксидами. При этом образуются соли. Отличительной их особенностью является то, что они реагируем и с амфотерными основаниями, но тогда они ведут себя, как кислоты. Например, реакция гидроксида натрия (NaOH) и гидроксида цинка (Zn(OH)2).
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
В этой реакции образуется комплексная соль – тетрагидроксоцинкат натрия (Na2[Zn(OH)4]), а если эта реакция идёт при нагревании, то тогда образуется цинкат натрия (Na2ZnO2).
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Щёлочи вступаем в реакцию обмена с солями, при этом образуется новая соль и новое основание, но для этого нужно, чтобы образовался осадок или слабый электролит. Если в одну пробирку с гидроксида натрия добавить хлорида аммония (NH4Cl), во вторую – с гидроксидом калия (КОН) добавить сульфат железа (III) (Fe2(SO4)3), а в третью – с гидроксидом натрия добавить хлорид бария (BaCl2) и содержимое первой пробирки нагреем, то в результате появляется резкий запах аммиака (NH3). Во второй пробирке образуется осадок бурого цвета, а в третьей пробирке изменений не произошло.

Все нерастворимые основания при нагревании разлагаются на оксид металла и воду. Щёлочи этой способностью не обладают. Нальём в пробирку раствора сульфата меди (II) (CuSO4), затем сюда же добавим несколько капель гидроксида натрия. Образуется осадок голубого цвета. Это гидроксид меди (II) (Cu(OH)2).
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Cu2+ + 2OH— = Cu(OH)2↓

Нагреем пробирку с гидроксидом меди (II). В результате образуется вещество черного цвета – это оксид меди (II) (CuO).
Cu(OH)2 = CuO + H2O

Соли.
А вот соли – особый класс. Они тоже диссоциируют, но при этом образуют катион металла (Меn+) и анион кислотного остатка (Кисл.ост.n—).
МеКисл.ост. = Меn+ + Кисл.ост.n—
В реакциях солей с солями образуются новые соли, в реакциях с кислотой – образуется новая кислота, в реакциях с основаниями образуется новая соль и новое основание.

Они вступают в реакции замещения с металлами. Но нужно быть внимательным и обязательно пользоваться рядом активности металлов. Каждый металл вытесняет из раствора соли металлы, расположенные правее его в этом ряду.

При этом должны соблюдаться условия:
· обе соли (и реагирующая, и образующаяся) должны быть растворимыми
· металлы не должны реагировать с водой (т.е. щелочные и щелочноземельные металлы, которые реагируют с водой с образованием щелочей).
Посмотрим, как это происходит: в первую пробирку поместим железный гвоздь, во вторую – свинцовую пластину, а в третью – медную пластину. В первые две пробирки нальём раствора сульфата меди (II) (CuSO4), а в третью – раствор сульфата железа (II) (FeSO4). Через некоторое время мы можем наблюдать, что на железном гвозде осела медь, а во второй и третьей пробирке нет никаких изменений. Следовательно, в первой пробирке находился более активный металл, который вытеснил медь из раствора, во второй пробирке реакция не пошла, т.к. образующая соль (сульфат свинца (II)) является нерастворимой, в третьей пробирке реакция не прошла, т.к. медь стоит правее железа в ряду напряжений и не может вытеснить его из раствора соли.
Fe + CuSO4 = FeSO4 + Cu↓
Fe0 + Cu2+ = Fe2+ + Cu0↓
Pb + CuSO4 ≠
Cu + FeSO4 ≠

А теперь, вам несложно будет отгадать,
о каком классе соединений идёт речь.
Известны ли вам дети
Какие есть оксиды на планете?
У оксидов пристрастия разные
То кислоты им нравятся праздные
То к воде их душа склоняется –
скажите, как они называются? (Основные оксиды)
А эти спешат к основаниям,
Растворимые, очень желанные,
Но с водой дружбу водят не все
Уж поверь…
Назовите оксиды теперь. (Кислотные оксиды.)
Мы состоим из двух частей:
Во-первых, водород, о’кей!
Во-вторых, остаток наш.
Ну, вот и весь наш экипаж!
Окрасим лакмус в красный цвет,
Без нас и удобрений нет. (Кислоты)
Мы – жители непростые,
Нас очень много на Земле!
Особым даром обладая,
Мы растворяемся в воде.
А как на кожу попадём,
Мы тут же сильно обожжем.
Окрасим лакмус в синий цвет,
Без нас нейтрализации нет.
Без нас не обойдётесь тут!
Скажите, как же нас зовут? (Щёлочи)
Хоть мы разные на цвет,
Но важней нас в мире нет!
И нитраты, и сульфаты,
Карбонаты и фосфаты!
Все важны и все нужны!
Догадались, кто же мы? (Соли)
videouroki.net
взаимодействие c металлами, основными оксидами, основаниями, солями
Билет № 11
1. Кислоты в свете представлений об электролитической диссоциации. Химические свойства кислот: взаимодействие c металлами, основными оксидами, основаниями, солями (на примере хлороводородной кислоты)
С точки зрения теории электролитической диссоциации кислотами называются вещества, диссоциирующие в растворах с образованием ионов водорода:
HCl → H+ + Cl−
Более строгая формулировка: отщепляющие в качестве катионов (положительных ионов) только ионы водорода.
Под ионом водорода подразумевают гидратированный протон (т. е. протон, присоединивший воду). Если хотят показать состав иона водорода, его обычно изображают H3O+
Далее ответ совпадает со 2-м вопросом билета № 1:
- Кислоты окрашивают растворы индикаторов лакмуса и метилового оранжевого в красный цвет
- Взаимодействуют с металлами, находящимися в ряду напряжений левее водорода, например, с цинком, с образованием соли (хлорида цинка) и газообразного водорода:
Zn + 2HCl = ZnCl2 + H2↑ - Взаимодействуют с основными оксидами с образованием соли и воды:
CuO + 2HCl = CuCl2 + H2O
(при проведении реакции с оксидом меди (II), пробирку желательно слегка подогреть) получается хлорид меди(II) - Взаимодействуют с основаниями с образованием соли и воды:
NaOH + HCl = NaCl + H2O - Вытесняют слабые кислоты из растворов их солей, например, карбоната натрия:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ - Реакция с солями может протекать с образованием осадка:
AgNO3 + HCl = HNO3 + AgCl↓
2. Опыт. Выделение поваренной соли из ее смеси с речным песком
- Добавить к смеси немного воды, перемешать. Соль растворится, песок осядет на дно.
- Профильтровать полученную смесь. Если нет фильтра, дать отстояться и слить верхнюю часть воды с растворенной солью.
(Здесь мы используем различную растворимость соли и песка в воде)
- Выпарить соль из раствора в фарфоровой чашке.
Прекратить выпаривание при появлении кристаллов соли, иначе чашка может треснуть. С горячей чашкой обращаться осторожно!!! Спиртовку тушить, накрывая колпачком. Спички чиркать «от себя».
автор: Владимир Соколов
staminaon.com