Пищевая соль — это… Что такое Пищевая соль?
Поваренная соль (NaCl) — пищевой продукт. Производится и используется после промышленной очистки минерала Галит (вещество — хлорид натрия), известного также под названием «каменная соль».

Кристаллы поваренной соли
Виды поваренной соли

Существует и применяется в разных видах: очищенная и неочищенная (каменная соль), крупного и мелкого помола, чистая и йодированная, и т. п. В молотом виде представляет собой мелкие кристаллы белого, розоватого или светло-серого цвета. Добывается из морской воды (выпариванием) или из залежей (обычно на месте высохших морей). Поваренную соль часто называют также «столовая соль», «каменная соль» или просто «соль». Основным компонентом соли является хлорид натрия, но поваренная соль природного происхождения всегда имеет примеси других минеральных солей. Эти примеси могут придавать ей оттенки разных цветов (как правило, сероватый цвет).
Биологическая роль
Соль жизненно необходима человеку, как и всем прочим живым существам. Соль участвует в поддержании и регулировании водного баланса в организме. При хронической нехватке соли в организме возможен смертельный исход.
При недостатке в организме хлорида натрия или других необходимых минеральных веществ (так называемых «микроэлементов») может возникать тяга к повышенному употреблению соли. Чрезмерное или просто повышенное потребление соли увеличивает риск сердечно-сосудистых заболеваний, может приводить к повышенному артериальному давлению и болезням почек, нарушению обмена кальция. Наряду с другими солями натрия, поваренная соль может стать причиной заболеваний глаз и отёку век. К отёку век также приводит чрезмерное увлечение солёной пищей — как известно, соль задерживает в организме воду, большой объём которой «хранит» в себе жировая ткань. В том числе внутри глазницы.
Известный американский натуропат Пол Брэгг полагал, что человеческий организм абсолютно не нуждается в поваренной соли, и называл её ядом. Ошибочность подобных взглядов в настоящее время считается полностью доказанной.
Пищевой продукт
В приготовлении пищи поваренная соль употребляется как важнейшая приправа. Соль имеет хорошо знакомый каждому человеку характерный вкус, без которого пища кажется пресной. Такая особенность соли обусловлена физиологией человека, но люди зачастую потребляют соли больше, чем необходимо для физиологических процессов.[1] Соль также выполняет функцию консерванта. Высокая концентрация соли в воде губительна для живущих в этой воде организмов.
Этимология
Соль очень сильно сказалась на разных языках. Наибольшее влияние произошло в языках, взаимодействующих с романскими и греческими цивилизациями, пока соль была в цене. Римским солдатам выдавали разрешение на покупку соли (на латыни: sal), salarium argentum, от которого произошло английское слово salary (заработная плата). Римляне также предпочитали солить зелень, в результате чего латинское слово, обозначающее соль, вошло в состав нового слова salad (салат). На варварской латыни salata обозначало «солёный».
Известные месторождения

Пищевая соль «Экстра» производства ЗАО «Предприятие МС», г. Москва
Экономика
На начало 2006 года российский рынок соли оценивается в 3,6 млн тонн в год[4], по другим данным — 4,5 млн тонн[2], из которых 0,56 млн тонн — пищевые расходы, а 4 млн тонн — использование соли в промышленных целях, в основном — химических. Из иностранных поставщиков основными являются украинские и белорусские.
| Поставщик | Объём поставок на российский рынок, млн. тонн в год |
|---|---|
| ОАО «Бассоль», Астрахань | 1,3 |
| ОАО «Сильвинит», Соликамск | 1,0 |
| ОАО «Илецксоль», Оренбург | 0,5 |
| ФГУП «Тыретский солерудник», Тыреть | 0,3 |
| «Астрасоль», Астрахань | 0,3 |
| Всего (Российские производители) | 3,2-3,5 |
| ГПО «Артёмсоль», Украина | 1,0 |
| ПО «Беларуськалий», Беларусь | 0,5 |
| ОАО «Мозырьсоль», Беларусь | 0,1 |
| Всего (внешние поставщики) | 1-1,6 |
| Всего | 4,8-5,1 |
Интересные факты

- Обычная пищевая соль служит сильнейшим ядом. С одной стороны, без соли невозможно жить, с другой стороны, доза в 100 раз превышающая суточную норму потребления, является смертельной. Летальная доза составляет 3 грамма на 1 килограмм массы тела. Иными словами, для человека весом 80 кг смертельной дозой является четверть килограммовой пачки.
- В странах с холодным климатом требуемая организму ежедневная норма значительно ниже, чем в странах с жарким климатом, виной тому различная потливость. Средняя ежедневная норма потребления для взрослого человека: 3-5 граммов соли в холодных странах и до 20 граммов в жарких.
- В магазинах соль состоит до 97 % из NaCl, остальная доля приходится на различные примеси. Чаще всего добавляют йодиды и карбонаты, в последние годы всё чаще добавляют фториды. Для профилактики зубных заболеваний употребляют соль с фторидом. С 1950-х годов добавлять фторид в соль стали в Швейцарии, и благодаря положительным результатам в борьбе с кариесом в 1980-х годах фторид стали добавлять в соль во Франции и в Германии. До 60 % продаваемой соли в Германии и до 80 % в Швейцарии — это соль с фторидами.
- Иногда в поваренную соль добавляют другие вспомогательные вещества, например ферроцианид калия (E536 в европейской системе кодирования пищевых добавок; неядовитая комплексная соль) в качестве антислёживающего агента.
- Систематический приём избыточного по сравнению с физиологической нормой количества соли приводит к увеличению кровяного давления. Чрезмерное потребление соли вызывает болезни сердца и почек.
- В России в XVII веке произошёл Соляной бунт, вызванный непомерно высокими ценами на соль. Тысячелетия назад соль была настолько дорога, что из-за неё устраивали войны. Сейчас соль является самой дешёвой из всех известных пищевых добавок, если не считать воду.
Сорта и цены
Соль классифицируют в зависимости от помола, чистоты, а также наличия специальных добавок.
- Экстра
- Йодированная соль
Также в продаже имеется морская соль различного помола, каменная соль, черная соль.
Смотри также
Примечания
- ↑ Study suggests salt might be «nature’s antidepressant» (рус.)
- ↑ 1
- ↑ http://ruzgd.ru/elton.shtml/ Эльтон
- ↑ http://www.rbcdaily.ru/news/comments/index.shtml?2006/02/26/215066
Ссылки
Wikimedia Foundation. 2010.
Морская соль — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 февраля 2014; проверки требуют 18 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 февраля 2014; проверки требуют 18 правок. Состав ионов морской воды по массе Морская соль в Дакаре
Морская соль в ДакареМорская соль — соль, добываемая из моря, как правило естественным путём (испарением воды под воздействием Солнца) или выпариванием [1]. Каменная соль (галит) добывается из древних морских отложений и отличается только свежестью органических остатков[источник не указан 69 дней].
В натуральной морской соли содержится небольшое количество йода[2]. При исследовании натуральных морских солей из 21 страны мира содержание йода в образцах было в среднем менее 0,7 мг/кг, в то время как в йодированной соли содержание йода (40±15) мг/кг[3].
Вкус морской соли не отличается от обычной поваренной соли, особенно в растворённом виде в приемлемых для еды концентрациях[4].
Люди добывают соль из морской воды уже более 4000 лет.
Первыми добывать соль из морской воды начали обитатели сухих и тёплых стран Средиземноморья (Франции, Италии, Испании) и Восточной Азии (Японии, Индии, Китая). Большие мелководные пруды (которые называются выпарными прудами) заливают морской водой. Вода испаряется, соль остаётся на дне. Морская вода содержит и другие минералы, но они выделяются первыми. Перегоняя воду из пруда в пруд, их полностью удаляют и получают чистую соль. Мировая добыча соли из морской воды составляет более 6 млн тонн в год.
В странах с более холодным климатом, таких как Англия, соль добывали путём «вываривания» морской воды.
В воде открытого океана независимо от абсолютной концентрации количественные соотношения между концентрациями главных ионов всегда одинаковы. Постоянство солевого состава получило название закона Дитмара, по имени английского химика, доказавшего это важное свойство морской воды в 1884 г. Постоянство солевого состава не соблюдается в устьевых областях крупных рек, а также в континентальных морях, имеющих слабый водообмен с океаном и потому заметно опресненных (как Азовское, Чёрное и Балтийское)[5].
Минеральный состав морской соли существенно зависит от технологии её получения. Поэтому в литературе обычно приводится исходный минеральный состав океанической воды при нормальной солёности.
Ионный состав морской соли, содержащейся в океанической воде при солёности 35 ‰:[6]
| Ион | Доля в солёности, % | Массовая часть в морской воде, мг/кг |
|---|---|---|
| Хлориды (Cl—) | 55,03 | 19385 |
| Натрий (Na+) | 30,59 | 10752 |
| Сульфаты (SO42-) | 7,68 | 2701 |
| Магний (Mg2+) | 3,68 | 1295 |
| Кальций (Ca2+) | 1,18 | 416 |
| Калий (K+) | 1,11 | 390 |
| Гидрокарбонаты (HCO3—) | 0,41 | 145 |
| Бром (Br—) | 0,19 | 66 |
| Бораты (BO33-) | 0,08 | 27 |
| Стронций (Sr2+) | 0,04 | 13 |
| Фтор | 1 | |
| Остальные | 0,004 | <1 |
Какова формула сахара, соли, воды, спирта, уксуса и прочих веществ?
Химические формулы распространённых в быту веществ полезно знать не только как часть школьного курса химии, но и просто для общей эрудиции. Формулу воды или поваренной соли знают практически все, однако насчёт спирта, сахара или уксуса — немногие смогут сразу попасть в точку. Давайте пойдём от простого к сложному.

Какова формула воды?
Эту жидкость, благодаря которой на планете Земля появилась удивительная живая природа, знают и пьют все. Более того, она составляет около 70% нашего с вами тела. Вода является простейшим соединением атома кислорода с двумя атомами водорода.
Химическая формула воды: H2O
Какова формула поваренной соли?
Поваренная соль является не только незаменимым кулинарным блюдом, но и одной из главных составляющих морской соли, запасы которой в Мировом Океане составляют миллионы тонн. Формула поваренной соли проста и легка для запоминания: 1 атом натрия и 1 атом хлора.
Химическая формула поваренной соли: NaCl
Какова формула сахара?
Сахар — белый кристаллический порошок, без которого ни один сладкоежка в мире не сможет прожить и дня. Сахар является сложным органическим соединением, формулу которого сразу не запомнишь: 12 атомов углерода, 22 атома водорода и 11 атомов кислорода образуют сладкую и сложную структуру.
Химическая формула сахара: C12H22O11
Какова формула уксуса?
Уксус — раствор уксусной кислоты, который используют в пищу, а также для очистки металлов от налёта. Молекула уксусной кислоты имеет сложную структуру, состоящую из двух атомов углерода, к одному из которых крепятся три атома водорода, а к другому — два атома кислорода, один из которых прихватил себе ещё один водород.
Химическая формула уксусной кислоты: CH3COOH
Какова формула спирта?
Начнём с того, что спирты бывают разные. Тот спирт, что используется для приготовления вин, водки и коньяков, называется по-научному этанол. Помимо этанола есть ещё куча спиртов, которые используются в медицине, автомобилестроении и авиации.
Химическая формула этанола: C2H5OH
Какова формула пищевой соды?
Пищевая сода называется по-научному гидрокарбонатом натрия. Из этого названия любой начинающий химик поймёт, что в молекуле соды есть натрий, углерод, кислород и водород.
Химическая формула пищевой соды: NaHCO3
Сегодня 11 января 2020 года. А вы знаете, какой сегодня праздник?
Расскажите Какова формула сахара, соли, воды, спирта, уксуса и прочих веществ друзьям в социальных сетях:
| Оцените качество ответа: |
Рекомендуем также почитать:
Карбонат натрия — Википедия
| Карбонат натрия | |||
|---|---|---|---|
| |||
({{{изображение}}}) | |||
| Систематическое наименование | Карбонат натрия | ||
| Традиционные названия | кальцинированная сода, углекислый натрий | ||
| Хим. формула | Na2CO3 | ||
| Молярная масса | 105,99 г/моль | ||
| Плотность | 2,53 г/см³ | ||
| Температура | |||
| • плавления | 854 °C | ||
| • разложения | 1000 °C | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 10,33 | ||
| Растворимость | |||
| • в воде при 20 °C | 21,8 г/100 мл | ||
| Рег. номер CAS | 497-19-8 | ||
| PubChem | 10340 | ||
| Рег. номер EINECS | 207-838-8 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E500(i) | ||
| RTECS | VZ4050000 | ||
| ChEBI | 29377 | ||
| ChemSpider | 9916 | ||
| ЛД50 | 4 г/кг (крысы, орально) | ||
| Пиктограммы СГС |  | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Карбона́т на́трия (кальцинированная сода) — неорганическое соединение, натриевая соль угольной кислоты с химической формулой Na2CO3. Бесцветные кристаллы или белый порошок, хорошо растворимый в воде. В промышленности в основном получают из хлорида натрия по методу Солвэ. Применяют при изготовлении стекла, для производства моющих средств, используют в процессе получения алюминия из бокситов и при очистке нефти.
Имеет вид бесцветных кристаллов или белого порошка. Существует в нескольких разных модификациях: α-модификация с моноклинной кристаллической решеткой образуется при температуре до 350 °C, затем, при нагреве выше этой температуры и до 479 °C осуществляется переход в β-модификацию, также имеющую моноклинную кристаллическую решетку. При увеличении температуры выше 479 °C соединение переходит γ-модификацию с гексагональной решеткой. Плавится при 854 °C, при нагреве выше 1000 °C разлагается с образованием оксида натрия и диоксида углерода[1][2].
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O. В интервале 100—120 °C моногидрат теряет воду.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 854 °C | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, малорастворим в этаноле, хорошо растворим в глицерине и воде | |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
- CO32−+h3O⇄HCO3−+OH−{\displaystyle {\mathsf {CO_{3}^{2-}+H_{2}O\rightleftarrows HCO_{3}^{-}+OH^{-}}}}
Первая константа диссоциации угольной кислоты равна 4,5⋅10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
- Na2CO3+h3SO4→Na2SO4+h3O+CO2↑{\displaystyle {\mathsf {Na_{2}CO_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+H_{2}O+CO_{2}\uparrow }}}
В природе сода встречается в золе некоторых морских водорослей, а также в виде минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии[3][неавторитетный источник?]. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей, прибрежных и солончаковых растений путём перекристаллизации относительно малорастворимого NaHCO3 из щёлока.
Способ Леблана[править | править код]
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
- Na2SO4+2C→Na2S+2CO2{\displaystyle {\mathsf {Na_{2}SO_{4}+2C\rightarrow Na_{2}S+2CO_{2}}}}
Сульфид натрия реагирует с карбонатом кальция:
- Na2S+CaCO3→Na2CO3+CaS{\displaystyle {\mathsf {Na_{2}S+CaCO_{3}\rightarrow Na_{2}CO_{3}+CaS}}}
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2NaCl+h3SO4→Na2SO4+2HCl{\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2HCl}}}
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана, закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)[править | править код]
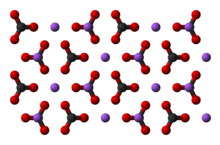 Карбонат натрия
Карбонат натрияВ 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
- Nh4+CO2+h3O+NaCl→NaHCO3+Nh5Cl{\displaystyle {\mathsf {NH_{3}+CO_{2}+H_{2}O+NaCl\rightarrow NaHCO_{3}+NH_{4}Cl}}}
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2NaHCO3→otNa2CO3+h3O+CO2↑{\displaystyle {\mathsf {2NaHCO_{3}{\xrightarrow[{}]{^{o}t}}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow }}}
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2Nh5Cl+Ca(OH)2→CaCl2+2Nh4+2h3O{\displaystyle {\mathsf {2NH_{4}Cl+Ca(OH)_{2}\rightarrow CaCl_{2}+2NH_{3}+2H_{2}O}}}
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).[источник не указан 2870 дней]
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу[править | править код]
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов[править | править код]
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год)[4].
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах[5].
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью.
В фотографии используется в составе проявителей как ускоряющее средство[6].
Самостоятельно добавляется в моторное масло для предотвращения полимеризации. Концентрация 2 г на 1 л масла.[источник не указан 77 дней]
Предельно допустимая концентрация аэрозоли кальцинированной соды в воздухе производственных помещений — 2 мг/м3[1]. Кальцинированная сода относится к веществам 3-го класса опасности. Аэрозоль кальцинированной соды при попадании на влажную кожу и слизистые оболочки глаз и носа может вызвать раздражение, а при длительном воздействии ее — дерматит.
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый, бикарбонат натрия
«Сода» в европейских языках происходит, вероятно, от арабского «suwwad» — общего названия различных видов солянок, растений, из золы которых её добывали в средние века; существуют и другие версии[7]. Кальцинированная сода (карбонат натрия) называется так потому, что для получения её из бикарбоната последний «кальцинируют» (лат. calcinatio, от calx, по сходству с процессом обжига извести), то есть прокаливают.
Химическая формула соды: пищевой, питьевой, кристаллической, технической
Автор Антонина На чтение 5 мин. Опубликовано
Словом «сода» называют несколько сложных химических веществ. Пищевая, питьевая, гидрокарбонат натрия, химическая формула NaHCO3, кислая натриевая соль угольной кислоты. Кальцинированная, бельевая, карбонат натрия, химическая формула Na2CO3, натриевая соль угольной кислоты.

Каустическая, гидроксид натрия, химическая формула NaOH. Есть еще некоторые технические виды соды – кристаллогидраты, содержащие карбонат натрия, и различные марки каустика. Вышеперечисленные соединения имеют различные свойства и химические формулы. Но все они хорошо растворяются в воде, а их растворы имеют более или менее выраженную щелочную реакцию. Рассмотрим их подробнее.
Формула пищевой соды
Гидрокарбонат натрия – химическое название белого кристаллического порошка белого цвета со средним размером кристаллов 0,05 — 0,20 мм. Синонимы, часто встречающиеся в научно-популярной литературе и в быту, — пищевая сода, чайная, питьевая, натрий двууглекислый, бикарбонат натрия.
Двууглекислый натрий (бикарбонат) – широко востребованное вещество в разных сферах жизни. Он применяется в химической промышленности и медицине, в легкой, пищевой отраслях, в металлургии. В пищевой промышленности сода включена в состав добавки E500.
Формула питьевой соды в химии NaHCO3 говорит о том, что это кислая натриевая соль угольной кислоты. Ее химические свойства как у соли сильного основания и слабой кислоты.

Гидрокарбонат натрия активно вступает в реакцию с кислотами. В результате образуется соль соответствующей кислоты, угольная кислота, которая в свою очередь распадается на углекислый газ и воду. Сильное образование пузырьков — это углекислый газ, высвобождающийся в процессе реакции.
Вот как происходит реакция с соляной кислотой:
NaHCO3 + HCl → NaCl + h3CO3
h3CO3 → h3O + CO2↑.
Реакция соды пищевой с уксусной кислотой:
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
В результате взаимодействия соды NaHCO3 с уксусной кислотой Ch4COOH образуются: Ch4COONa – ацетат натрия, вода h3O и углекислый газ CO2.
Многими, наверное, замечено, что если залить пищевую соду кипятком, она так же начинает гаситься, что выражается в обильном образовании пузырьков. Это происходит реакция термического разложения.
Гидракарбонат натрия термически малоустойчив. При нагревании порошок соды пищевой разлагается с образованием карбоната натрия (соды кальцинированной) и выделением диоксида углерода, а также воды в газовую фазу.
2NaHCO3↔ Na2CO3 + CO2 + h3O
Аналогично разлагаются и водные растворы бикарбоната натрия.
Растворяется ли пищевая сода в воде?
Есть 2 важные момента в растворении натрия гидрокарбоната в воде. Если мы растворяем соду притемпературе до 50 °С, происходит реакция гидролиза соли. Это обратимое взаимодействие соли с водой. Приводит к образованию слабого электролита.
А если растворяем соду в горячей воде, то уже образуется карбонат натрия, и в этом случае, водный раствор имеет сильнощелочную реакцию. Отсюда вывод: растворимость гидрокарбоната натрия в воде невелика, но при повышении температуры и она повышается.

При взаимодействии с водой двууглекислый натрий распадается на гидроксид натрия NaOH , который придает щелочность воде, угольную кислоту h3CO3, которая, в свою очередь, сразу же распадается на воду и углекислый газ h3O + CO2.
Химическая формула растворения соды в воде:
NaHCO3 + h3O ↔ h3CO3 (h3O + CO2) + NaOH
Водный раствор соды пищевой на растительные и животные ткани практически не действует.
Кальцинированная сода и ее кристаллогидраты
Карбонат натрия, или соду кальцинированную, натриевая соль угольной кислоты, не следует путать с содой пищевой. Химическая формула соды кальцинированной Na2CO3. Еще ее называют содой бельевой, потому что применяют в изготовлении моющих и чистящих средств бытовой химии. Добывается из природных кристаллогидратов путем термического разложения. Кальцинированная сода, безводный карбонат натрия, представляет собой бесцветный порошок.

Различные кристаллогидраты кальцинированной соды имеют свои названия:
- Натрит, натрон – декагидрат карбоната натрия. Химическая формула: Na2CO3 • 10h3O
- Термонатрит – моногидрат карбоната натрия. Химическая формула: Na2CO3 • h3O
Эти кристаллогидраты еще называют кристаллической содой, технической содой.
Каустическая сода, гидроксид натрия, химическая формула: NaOH. Ее еще называют едким натром, каустиком, едкой щелочью. Сильное основание, молекулы полностью диссоциируют в воде. Даже на воздухе то вещество начинает активно впитывать воду и «расплывается».
Опасная едкая щелочь может оставлять на коже сильные ожоги. Поэтому при работе с каустической содой необходимо соблюдать технику безопасности.

Применяется в быту, в химической, целлюлозно-бумажной промышленности, для производства мыла и био-дизельного топлива.
В России производится несколько видов технической соды – натра едкого:
- РД — раствор диафрагменный, бесцветная или окрашенная жидкость с массовой долей NaOH 44,0 % — 46,0 %;
- РХ — раствор химический с массовой долей NaOH 45,5 %, допускается небольшой осадок;
- РР — раствор ртутный, прозрачная жидкость с массовой долей NaOH 42,0 %;
- ТД — твердый диафрагменный, плавленая масса белого цвета с массовой долей NaOH 94,0 %;
- ТР — твёрдый ртутный, чешуированная масса белого цвета, с массовой долей NaOH 98,5 %.
Как видите, сода соде рознь. Принимать внутрь можно только пищевую, остальные виды — технические. Особенно осторожно необходимо обращаться с каустической содой. Это едкое агрессивное вещество оставляет долго незаживающие ожоги на коже. Поэтому, работать с растворами каустика нужно в защитной одежде, маске и резиновых перчатках.
Сегнетова соль — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 марта 2015; проверки требуют 9 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 марта 2015; проверки требуют 9 правок.| Сегнетова соль | |
|---|---|
 ( {{{картинка}}}) | |
| Систематическое наименование | Калия-натрия тартрата тетрагидрат |
| Традиционные названия | Сегнетова соль |
| Хим. формула | C4H4KNaO6 |
| Рац. формула | KNaC4H4O6·4H2O |
| Молярная масса | 282,1 г/моль |
| Плотность | ≈1,790 (при 20 °C) |
| Температура | |
| • плавления | 70—80 °C |
| • разложения | 130—140 °C |
| Растворимость | |
| • в воде | 63[1] |
| Рег. номер CAS | 304-59-6 |
| PubChem | 9855836 |
| Рег. номер EINECS | 206-156-8 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E337 |
| ChEBI | 63019 |
| ChemSpider | 8031536 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
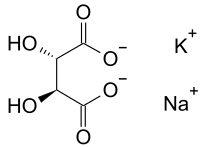
Сегне́това соль — тетрагидрат двойной натриево-калиевой соли винной кислоты KNaC4h5O6⋅4h3O{\displaystyle {\ce {KNaC4h5O6*4h3O}}} (тартрат натрия-калия). Названа по имени французского аптекаря Пьера Сеньета (фр. Pierre Seignette), 1660—1719 (в других источниках указывается имя аптекаря Эли Сенье[2] (1632—1698), а также годы получения соли — 1672[3] и 1675).
Физические свойства и применение в технике[править | править код]
Окраска кристаллов сегнетовой соли — от бесцветной до голубоватой. Разлагаться вещество начинает уже при 55,6 °C[4] (вероятно, имеется в виду частичная или полная потеря кристаллизационной воды). Построение кристалла соответствует ромбической системе (обычно вещество кристаллизуется в ромбовидные кристаллы с 12 гранями, 2 из которых — пинакоиды; углы между двумя боковыми гранями равны 163° un 40°[5]).
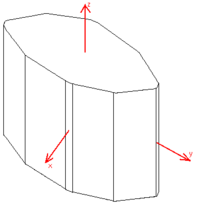
У сегнетовой соли впервые (1920; по другим данным, в 1894[6] г.) были обнаружены своеобразные электрические свойства — самопроизвольная поляризация в определённом интервале температур, причём эта поляризация поддаётся изменению под воздействием достаточно сильного внешнего электрического поля. Позже вещества с такими свойствами стали называть по имени сегнетовой соли сегнетоэлектриками.
Кроме того, тетрагидрат тартрата калия-натрия является одним из первых веществ, у которых были обнаружены пьезоэлектрические свойства (Пьер и Жак Кюри, 1880). Позднее эти свойства нашли применение в технике: сначала в межвоенный период в США (патент фирмы BRUSH № 2483647[7]), а затем и в других странах (в СССР в 1941—1942[8] гг.) сегнетову соль стали применять в звукоснимателях электрофонов, микрофонах, телефонных трубках и других подобных устройствах (например, в слуховых аппаратах). Особенно широко это вещество нашло применение во время повышенного спроса на электротехнику в послевоенные годы. По сравнению с другими преобразователями выходное напряжение сегнетовой соли весьма велико (даже в три тысячи раз больше[8][9]). Однако изготовленные из неё преобразователи не могут храниться во влажном месте, поскольку соль из-за своей гигроскопичности постепенно расплывается.
Так как тартрат натрия-калия — соль винной кислоты, ему соответствуют несколько оптических изомеров. В природе встречается только L-(+)-винная кислота[источник не указан 2288 дней].
Тетрагидрат растворим в воде хорошо (54 г/100 г h3O{\displaystyle {\ce {h3O}}}) при 15 °C, при 30 °C 1390 г/л[2]), к тому же соль гигроскопична. Однако соль как таковая, очевидно, малорастворима, поскольку в реакции получения выпадает в осадок.
Тартрат натрия-калия является компонентом Фелинговой жидкости, в составе которой он используется для обнаружения сахаров. Также сегнетову соль используют в серебрении зеркал по методу Генрихсона[10]. Кроме того, эта соль используется в органическом синтезе как деэмульгатор в водных растворах, обычно в реакциях с применением гидрида алюминия. Наконец, в растворе для определения белков биуретовым методом также содержится тартрат калия-натрия.
В лаборатории эту соль получают осаждением в мелкокристаллическом виде из горячего раствора кислого тартрата калия добавлением стехиометрического количества Na2CO3.
 Сравнительно большой кристалл, выращенный на станции «Скайлэб»
Сравнительно большой кристалл, выращенный на станции «Скайлэб»Кристаллы большего размера выращены в космосе в условиях слабого тяготения и конвекции, например, на американской орбитальной станции «Скайлэб». Выращивают кристаллы нужного размера и в промышленности[11].
Тартрат калия-натрия используется в пищевой промышленности в качестве добавки E337 (антиоксиданта). Он обладает солёным, холодящим вкусом. Используется эта соль и в пекарских порошках[12]. Вещество нашло применение и в медицине — в качестве слабительного (якобы аптекарь Сеньет употреблял эту соль для помощи при желудочных расстройствах[5]). В этих целях сегнетову соль часто применяют в составе порошка Сейдлица[13], ранее она использовалась в составе «венского питья».
 (
(