Гидроксид-ион — Википедия
Материал из Википедии — свободной энциклопедии
Гидроксид-ион (гидроксид-анион, гидроксильный ион) — отрицательно заряженный ион гидроксида OH−.
Гидроксид-ион изолированно существует в газовой фазе, находится в кристаллической решётке гидроксидов и основных солей, образуется в водных растворах в результате электролитической диссоциации воды или/и растворённых гидроксидов.
Наличие в водном растворе иона OH− в концентрациях, превышающих 10−7моль/литр приводит к щелочной реакции раствора.
В реакциях комплексообразования гидроксид-ион может выступать в роли лиганда[1].
Рыхлая слоистая кристаллическая структура гидроксидов является следствием высокой поляризуемости и большого ионного радиуса гидроксид-аниона.
В газовой фазе имеет место равновесная реакция, характеризующая термическую устойчивость гидроксид-иона
- OH−→OH+e−{\displaystyle {\mathsf {OH^{-}\rightarrow OH+e^{-}}}}
Зависимость константы равновесия (Kp) от абсолютной температуры (T)[2]:
| Т,к | 1000 | 2000 | 3000 | 4000 | 5000 | 6000 |
|---|---|---|---|---|---|---|
| Кр | 1,66 · 10−7 | 2,34 · 10−2 | 1,94 | 2,23 · 10 | 1,11 · 102 | 3,56 · 102 |
Электролитическая диссоциация оснований[править | править код]
При электролитической диссоциации оснований образуются катионы металла и общие для всех оснований ионы гидроксида:
- NaOH⇄Na++OH−{\displaystyle {\mathsf {NaOH\rightleftarrows Na^{+}+OH^{-}}}}
- Ba(OH)2⇄Ba2++2OH−{\displaystyle {\mathsf {Ba(OH)_{2}\rightleftarrows Ba^{2+}+2OH^{-}}}}
Таким образом, основания можно определить как химические соединения, дающие в водном растворе гидроксид-ионы.
Электролитическая диссоциация оснований характеризуется константой диссоциации в водных растворах КB[3]:
| Основание | LiOH | NaOH | Ca(OH)2 | Sr(OH)2 | Ba(OH)2 | NH4OH |
|---|---|---|---|---|---|---|
| КB, при 25 °C | 6,75 · 10−1 | 5,9 | 4,3 · 10−2 | 1,5 · 10−1 | 2,3 · 10−1 | 1,79 · 10−5 |
Основной реакцией, в которой принимает участие гидроксид-ион, является реакция нейтрализации кислот и оснований:
- NaOH+HCl→NaCl+h3O{\displaystyle {\mathsf {NaOH+HCl\rightarrow NaCl+H_{2}O}}}
или в ионном виде:
- OH−+H+→h3O{\displaystyle {\mathsf {OH^{-}+H^{+}\rightarrow H_{2}O}}}
Последнее выражение представляет собой общее уравнение реакций нейтрализации и показывает, что во всех случаях, когда ионы H+ встречаются с ионами гидроксида OH—, они соединяются в почти недиссоциированные молекулы воды. В реакции гидроксид-ион проявляет свойства нуклеофила — электроизбыточного химического реагента, способного взаимодействовать с электрофилами (электронодефицитными соединениями) по донорно-акцепторному механизму, приводящему к образованию ковалентной химической связи.
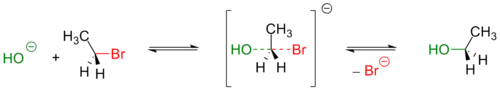
Гидроксид-ион принимает участие в реакциях бимолекулярного нуклеофильного замещения. Например, атом кислорода гидроксид-иона донирует пару электронов на связывание с атомом углерода в молекуле бромэтана:
Типичные реакции нуклеофильного замещения:
- Образование спиртов из галогенуглеводородов:
- C2H5Br+OH−→C2H5OH+Br−{\displaystyle {\mathsf {C_{2}H_{5}Br+OH^{-}\rightarrow C_{2}H_{5}OH+Br^{-}}}}
- Образование кетонов:
- Ch4CBr2Ch4+2OH−→(Ch4)2O+2Br−+h3O{\displaystyle {\mathsf {CH_{3}CBr_{2}CH_{3}+2OH^{-}\rightarrow (CH_{3})_{2}O+2Br^{-}+H_{2}O}}}
- Образование карбоновых кислот:
- Ch4CCl3+3OH−→Ch4COOH+3Cl−+h3O{\displaystyle {\mathsf {CH_{3}CCl_{3}+3OH^{-}\rightarrow CH_{3}COOH+3Cl^{-}+H_{2}O}}}
- Омыление сложных эфиров:
- Ch4COOC2H5+OH−→Ch4COO−+C2H5OH{\displaystyle {\mathsf {CH_{3}COOC_{2}H_{5}+OH^{-}\rightarrow CH_{3}COO^{-}+C_{2}H_{5}OH}}}
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Константы неорганических веществ: справочник. — М: Дрофа, 2006. — С. 595-596.
- ↑ Справочник химика. — 2-е изд., перераб. и доп.. — М.-Л.: «Химия», 1964. — Т. 3. — С. 75. — 1008 с.
- ↑ Справочник химика. — 2-е изд., перераб. и доп.. — М.-Л.: «Химия», 1964. — Т. 3. — С. 81. — 1008 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
Гидроксид висмута — Википедия
Материал из Википедии — свободной энциклопедии
Гидроксид висмута — неорганическое соединение, гидроксид металла висмута с формулой Bi(OH)3, белый аморфный порошок, не растворимый в воде.
- Действие разбавленной щелочи на растворимую соль трёхвалентного висмута:
- BiCl3+3NaOH → Bi(OH)3↓+3NaCl{\displaystyle {\mathsf {BiCl_{3}+3NaOH\ {\xrightarrow {}}\ Bi(OH)_{3}\downarrow +3NaCl}}}
- Гидратированная форма оксид висмута при длительном хранении под раствором медленно теряет кислород:
- Bi2O5⋅nh3O → 2Bi(OH)3↓+O2↑+(n−3)h3O{\displaystyle {\mathsf {Bi_{2}O_{5}\cdot nH_{2}O\ {\xrightarrow {}}\ 2Bi(OH)_{3}\downarrow +O_{2}\uparrow +(n-3)H_{2}O}}}
Гидроксид висмута — белый аморфный порошок, разлагается при нагревании.
Нерастворим в воде, p ПР = 35,52.
- При нагревании разлагается:
- Bi(OH)3 →100oC BiO(OH)+h3O{\displaystyle {\mathsf {Bi(OH)_{3}\ {\xrightarrow {100^{o}C}}\ BiO(OH)+H_{2}O}}}
- Реагирует с концентрированными горячими кислотами:
- Bi(OH)3+3HCl →70−80oC BiCl3+3h3O{\displaystyle {\mathsf {Bi(OH)_{3}+3HCl\ {\xrightarrow {70-80^{o}C}}\ BiCl_{3}+3H_{2}O}}}
- Bi(OH)3+HF → BiOF↓+2h3O{\displaystyle {\mathsf {Bi(OH)_{3}+HF\ {\xrightarrow {}}\ BiOF\downarrow +2H_{2}O}}}
- Под действием окислителей в щелочной среде образуются висмутаты:
- Bi(OH)3+3NaOH+Cl2 → NaBiO3+2NaCl+3h3O{\displaystyle {\mathsf {Bi(OH)_{3}+3NaOH+Cl_{2}\ {\xrightarrow {}}\ NaBiO_{3}+2NaCl+3H_{2}O}}}
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
Гидроксид галлия — Википедия
Материал из Википедии — свободной энциклопедии
Гидроксид галлия — неорганическое соединение, гидроксид металла галлия с формулой Ga(OH)3, белое аморфное вещество, не растворяется в воде.
- Взаимодействием металлического галлия с горячей водой:
- 2Ga+6h3O →T 2Ga(OH)3↓+3h3↑{\displaystyle {\mathsf {2Ga+6H_{2}O\ {\xrightarrow {T}}\ 2Ga(OH)_{3}\downarrow +3H_{2}\uparrow }}}
- Осаждение щёлочью растворимой соли галлия:
- Ga(NO3)3+3NaOH → Ga(OH)3↓+3NaNO3{\displaystyle {\mathsf {Ga(NO_{3})_{3}+3NaOH\ {\xrightarrow {}}\ Ga(OH)_{3}\downarrow +3NaNO_{3}}}}
Гидроксид галлия — белое аморфное вещество, нерастворимое в воде, при нагревании разлагается.
- При нагревании ступенчато разлагается:
- Ga(OH)3 →−h3O80−400oC GaO(OH) → Ga2O3⋅h3O →−h3O540−600oC Ga2O3{\displaystyle {\mathsf {Ga(OH)_{3}\ {\xrightarrow[{-H_{2}O}]{80-400^{o}C}}\ GaO(OH)\ {\xrightarrow {}}\ Ga_{2}O_{3}\cdot H_{2}O\ {\xrightarrow[{-H_{2}O}]{540-600^{o}C}}\ Ga_{2}O_{3}}}}
- Реагирует с кислотами:
- Ga(OH)3+3HCl → GaCl3+3h3O{\displaystyle {\mathsf {Ga(OH)_{3}+3HCl\ {\xrightarrow {}}\ GaCl_{3}+3H_{2}O}}}
- Ga(OH)3+NaOH → Na[Ga(OH)4]{\displaystyle {\mathsf {Ga(OH)_{3}+NaOH\ {\xrightarrow {}}\ Na[Ga(OH)_{4}]}}}
- Ga(OH)3+NaOH →250oC NaGaO2+2h3O{\displaystyle {\mathsf {Ga(OH)_{3}+NaOH\ {\xrightarrow {250^{o}C}}\ NaGaO_{2}+2H_{2}O}}}
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
Гидроксид натрия, характеристика, свойства и получение, химические реакции
Гидроксид натрия, характеристика, свойства и получение, химические реакции.
Гидроксид натрия – неорганическое вещество, имеет химическую формулу NaOH.
Краткая характеристика гидроксида натрия
Модификации гидроксида натрия
Физические свойства гидроксида натрия
Получение гидроксида натрия
Химические свойства гидроксида натрия
Химические реакции гидроксида натрия
Применение и использование гидроксида натрия
Краткая характеристика гидроксида натрия:
Гидроксид натрия – неорганическое вещество белого цвета.
Химическая формула гидроксида натрия NaOН.
Обладает высокой гигроскопичностью. На воздухе «расплывается», активно поглощая пары воды из воздуха.
Хорошо растворяется в воде, при этом выделяя большое количество тепловой энергии. Раствор едкого натра мылок на ощупь.
Гидроксид натрия – самая распространённая щёлочь. В год в мире производится и потребляется около 57 миллионов тонн едкого натра.
Гидроксид натрия – едкое, токсическое и коррозионно-активное вещество. Оно относится к веществам второго класса опасности. Поэтому при работе с ним требуется соблюдать осторожность. При попадании на кожу, слизистые оболочки и в глаза образуются серьёзные химические ожоги.
Модификации гидроксида натрия:
До 299 оС гидроксид натрия имеет устойчивую ромбическую модификацию (a = 0,33994 нм, c = 1,1377 нм), выше 299 оС – моноклинную.
Физические свойства гидроксида натрия:
| Наименование параметра: | Значение: |
| Химическая формула | NaOН |
| Синонимы и названия иностранном языке | sodium hydroxide (англ.) едкий натр (рус.) натрия гидроокись (рус.) сода каустическая (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные ромбические кристаллы |
| Цвет | белый, бесцветный |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2130 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,13 |
| Температура кипения, °C | 1403 |
| Температура плавления, °C | 323 |
| Гигроскопичность | высокая гигроскопичность |
| Молярная масса, г/моль | 39,997 |
* Примечание:
— нет данных.
Получение гидроксида натрия:
Гидроксид натрия получается в результате следующих химических реакций:
- 1. из оксида натрия (т.н. пиролитический метод):
Пиролитический метод получения гидроксида натрия является наиболее древним и начинается с получения оксида натрия Na2О путём прокаливания карбоната натрия при температуре 1000 °C либо нагревании до 200 °C гидрокарбонат натрия в целях получения карбоната натрия:
Na2CO3 → Na2O + CO2 (t = 1000 oC),
2NaHCO3 → Na2CO3 + CO2 + H2O (t = 200 oC), после чего проводят первую химическую реакцию.
Полученный оксид натрия охлаждают и очень осторожно (реакция происходит с выделением большого количества тепла) добавляют в воду:
Na2O + H2O → 2NaOH.
- 2. путем взаимодействия раствора соды с гашеной известью (т.н. известковый метод, каустификация соды):
Na2CO3 + Ca(OH)2 → CaCO3 + 2NaOH (t = 80 oC).
Карбонат кальция отделяется от раствора фильтрацией, затем раствор упаривается до получения расплавленного продукта, содержащего около 92 % масс. NaOH.
- 3. ферритным методом:
Fe2O3 + Na2CO3 → 2NaFeO2 + CO2 (t = 1100-1200 oC).
Реакционную смесь спекают.
2NaFeO2 + (n+1)H2O → Fe2O3•nH2O + 2NaOH.
Реакция протекает медленно.
Fe2O3•nH
- 4. электролизом:
2NaCl + 2H2O → 2Na2O + H2 + Cl2.
Одновременно получаются также водород и хлор.
Гидроксид натрия, водород и хлор вырабатываются тремя электрохимическими методами. Два из них – электролиз с твёрдым катодом (диафрагменный и мембранный методы), третий – электролиз с жидким ртутным катодом (ртутный метод).
Химические свойства гидроксида натрия. Химические реакции гидроксида натрия:
Гидроксид натрия – химически активное вещество, сильное химическое основание.
Водные растворы NaOH имеют сильную щелочную реакцию (pH 1%-раствора = 13,4).
Химические свойства гидроксида натрия аналогичны свойствам гидроксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида натрия с серой:
3S + 6NaOH → 2Na2S + Na2
SO3 + 3H2O (t = 50-60 °C).В результате реакции образуются сульфид натрия, сульфит натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
2. реакция гидроксида натрия с хлором:
2NaOH + Cl2 → NaCl + NaClO + H2O.
В результате реакции образуются хлорид натрия, гипохлорит натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется в виде холодного разбавленного раствора.
Аналогично проходят реакции гидроксида натрия и с другими галогенами.
3. реакция гидроксида натрия с алюминием:
2Al + 6NaOH → 2NaAlO2 + 3H2 + 2Na2O (t = 450 °C).
В результате реакции образуются алюминат натрия, водород и оксид натрия.
4. реакция гидроксида натрия с алюминием и водой:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)
В результате реакции образуются тетрагидроксоалюминат натрия и водород. При этом гидроксид натрия в качестве исходного вещества используется в виде концентрированного раствора.
Эта реакция использовалась в первой половине XX века в воздухоплавании: для заполнения водородом аэростатов и дирижаблей в полевых условиях, так как данная реакция не требует источников электроэнергии, а исходные реагенты для неё могут легко транспортироваться.
5. реакция гидроксида натрия с цинком:
Zn + 2NaOH → Na2ZnO2 + H2 (t = 550 °C).
В результате реакции образуются цинкат натрия и водород.
6. реакция гидроксида натрия с цинком и водой:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2.
В результате реакции образуются тетрагидроксоцинкат натрия и водород. При этом гидроксид натрия в качестве исходного вещества используется в виде концентрированного раствора.
7. реакция гидроксида натрия с ортофосфорной кислотой:
H3PO4 + NaOH → NaH2PO4 + H2O.
В результате реакции образуются дигидроортофосфат натрия и вода. При этом в качестве исходных веществ используются: фосфорная кислота в виде концентрированного раствора, гидроксид натрия в виде разбавленного раствора.
8. реакция гидроксида натрия с азотной кислотой:
NaOH + HNO3 → NaNO3 + H2O.
В результате реакции образуются нитрат натрия и вода. При этом азотная кислота в качестве исходного вещества используется в виде разбавленного раствора.
9. реакция гидроксида натрия с азотной кислотой:
NaOH + HNO3 → NaNO3 + H2O.
В результате реакции образуются нитрат натрия и вода. При этом азотная кислота в качестве исходного вещества используется в виде разбавленного раствора.
Аналогично проходят реакции гидроксида натрия и с другими кислотами.
10. реакция гидроксида натрия с сероводородом:
H2S + 2NaOH → Na2S + 2H2O,
H2S + NaOH → NaHS + H2O.
В результате реакции образуются в первом случае – сульфид натрия и вода, во втором – гидросульфид натрия и вода. При этом гидроксид натрия в первом случае в качестве исходного вещества используется в виде концентрированного раствора, во втором случае – в виде разбавленного раствора.
11. реакция гидроксида натрия с фтороводородом:
HF + NaOH → NaF + H2O,
2HF + NaOH → NaHF2 + H2O.
В результате реакции образуются в первом случае – фторид натрия и вода, во втором – гидрофторид натрия и вода. При этом гидроксид натрия и фтороводород в первом случае в качестве исходного вещества используются в виде разбавленного раствора, во втором случае фтороводород используется в виде в виде концентрированного раствора.
12. реакция гидроксида натрия с бромоводородом:
HBr + NaOH → NaBr + H2O.
В результате реакции образуются бромид натрия и вода. При этом гидроксид натрия и бромоводород в качестве исходного вещества используются в виде разбавленного раствора.
13. реакция гидроксида натрия с йодоводородом:
HI + NaOH → NaI + H2O.
В результате реакции образуются йодид натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
14. реакция гидроксида натрия с оксидом цинка:
ZnO + 2NaOH → Na2ZnO2 + H2O (t = 500-600 °C).
Оксид цинка является амфотерным оксидом. В результате реакции образуются цинкат натрия и вода.15. реакция гидроксида натрия с оксидом цинка и водой:
ZnO + NaOH + H2O → Na[Zn(OH)3] (t = 100 °C),
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (t = 90 °C).
Оксид цинка является амфотерным оксидом. В результате реакции образуется в первом случае – тригидроксоцинкат натрия и вода, во втором случае – тетрагидроксоцинкат натрия. При этом гидроксид натрия в качестве исходного вещества используется в первом случае в виде 40 % разбавленного раствора, во втором – в виде 60 % разбавленного раствора.
16. реакция гидроксида натрия с оксидом алюминия:
Al2O3 + 2NaOH → 2NaAlO2 + H2O (t = 900-1100 °C).
Оксид алюминия является амфотерным оксидом. В результате реакции образуются алюминат натрия и вода.17. реакция гидроксида натрия с оксидом алюминия и водой:
Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6],
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4].
Оксид алюминия является амфотерным оксидом. В результате реакции образуется в первом случае – гексагидроксоалюминат натрия, во втором случае – тетрагидроксоалюминат натрия. При этом гидроксид натрия в качестве исходного вещества используется во втором случае в виде концентрированного горячего раствора.18. реакция гидроксида натрия с оксидом железа:
Fe2O3 + 2NaOH → 2NaFeO2 + H2O (t = 600 °C, р).
Оксид железа является амфотерным оксидом. В результате реакции образуются феррит натрия и вода. Реакция происходит при сплавлении исходных веществ.Аналогично проходят реакции гидроксида натрия и с другими амфотерными оксидами.
19. реакция гидроксида натрия с оксидом углерода (углекислым газом):
NaOH + CO2 → NaHCO3.
В результате реакции образуется гидрокарбонат натрия.
20. реакция гидроксида натрия с оксидом серы:
SO2 + NaOH → NaHSO3.
В результате реакции образуется гидросульфит натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
21. реакция гидроксида натрия с оксидом кремния:
2NaOH + SiO2 → Na2SiO3 + H2O (t = 900-1000 °C),
4NaOH + SiO2 → Na4SiO4 + 2H2O.
В результате реакции образуется в первом случае – силикат натрия и вода, во втором случае – ортосиликат натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется во втором случае в виде концентрированного раствора.
22. реакция гидроксида натрия с гидроксидом алюминия:
Al(OH)3 + NaOH → NaAlO2 + 2H2O (t = 1000 °C),
Al(OH)3 + NaOH → Na[Al(OH)4].
Гидроксид алюминия является амфотерным основанием. В результате реакции образуются в первом случае – алюминат натрия и вода, во втором случае – тетрагидроксоалюминат натрия. При этом гидроксид натрия в качестве исходного вещества используется во втором случае в виде концентрированного раствора.
23. реакция гидроксида натрия с гидроксидом цинка:
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4].
Гидроксид цинка является амфотерным основанием. В результате реакции образуется тетрагидроксоцинкат натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде концентрированного раствора.
24. реакция гидроксида натрия с гидроксидом железа:
Fe(OH)3 + 3NaOH ⇄ Na3[Fe(OH)6].
Гидроксид железа является амфотерным основанием. В результате реакции образуется гексагидроксоферрат натрия.
Аналогично проходят реакции гидроксида натрия и с другими амфотерными гидроксидами.
25. реакция гидроксида натрия с сульфатом железа:
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4 (kat = N2).
В результате реакции образуются гидроксид железа и сульфат натрия.
26. реакция гидроксида натрия с хлоридом меди:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl.
В результате реакции образуются гидроксид меди и хлорид натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
27. реакция гидроксида натрия с нитратом свинца:
Pb(NO3)2 + 2NaOH → Pb(OH)2 + 2NaNO3.
В результате реакции образуются гидроксид свинца и нитрат натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
28. реакция гидроксида натрия с хлоридом алюминия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl.
В результате реакции образуются гидроксид алюминия и хлорид натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
Аналогично проходят реакции гидроксида натрия и с другими солями.
Применение и использование гидроксида натрия:
Гидроксид натрия используется во множестве отраслей промышленности и для бытовых нужд:
– в целлюлозно-бумажной промышленности для делигнификации(сульфатный процесс) целлюлозы, в производстве бумаги, картона, искусственных волокон, древесно-волоконных плит;
– для омыления жиров при производстве мыла, шампуня и других моющих средств;
– в химических отраслях промышленности – для нейтрализации кислот и кислотных оксидов, как реагент или катализатор в химических реакциях, в химическом анализе для титрования, для травления алюминия и в производстве чистых металлов, в нефтепереработке – для производства масел;
– для изготовления биодизельного топлива – получаемого из растительных масел и используемого для замены обычного дизельного топлива.
Для получения биодизеля к девяти массовым единицам растительного масла добавляется одна массовая единица спирта (то есть соблюдается соотношение 9:1), а также щелочной катализатор (NaOH). Полученный эфир (главным образом линолевой кислоты) отличается хорошей воспламеняемостью, обеспечиваемой высоким цетановым числом. Цетановое число – условная количественная характеристика самовоспламеняемости дизельныхтоплив в цилиндре двигателя (аналог октанового числа для бензинов). Если для минерального дизтоплива характерен показатель в 50-52 %, то метиловый эфир уже изначально соответствует 56-58 % цетана. Сырьём для производства биодизеля могут быть различные растительные масла: рапсовое, соевое и другие, кроме тех, в составе которых высокое содержание пальмитиновой кислоты (пальмовое масло). При его производстве в процессе этерификации также образуется глицерин который используется в пищевой, косметической и бумажной промышленности;
– в качестве агента для растворения засоров канализационных труб, в виде сухих гранул или в составе гелей. Гидроксид натрия дезагрегирует засор и способствует лёгкому продвижению его далее по трубе;
– в текстильной промышленности – для мерсеризации хлопка и шерсти. При кратковременной обработке едким натром с последующей промывкой волокно приобретает прочность и шелковистый блеск;
– в приготовлении пищи: для мытья и очистки фруктов и овощей от кожицы, в производстве шоколада и какао, напитков, мороженого, окрашивания карамели, для размягчения маслин и придания им чёрной окраски, при производстве хлебобулочных изделий. Зарегистрирован в качестве пищевой добавки E-524;
– в фотографии – как ускоряющее вещество в проявителях для высокоскоростной обработки фотографических материалов.
Примечание: © Фото //www.pexels.com, //pixabay.com




карта сайта
гидроксид натрия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие гидроксида натрия
реакции с оксидом натрия колледж пермь
Коэффициент востребованности 1 949
Гидроксид стронция — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 2 января 2015; проверки требуют 2 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 2 января 2015; проверки требуют 2 правки.Гидроксид стронция — неорганическое основание (щёлочь), состоящее из одного иона стронция и двух гидроксид-ионов, имеющее химическую формулу Sr(OH)2.
Бесцветные гигроскопичные кристаллы тетрагональной сингонии. Малорастворим в воде (0,41 грамма/100 мл при 0 °C). Растворимость повышается в присутствии NH4Cl.
Образует кристаллогидраты Sr(OH)2•H2O и Sr(OH)2•8H2O.
- Sr(NO3)2+2NaOH→Sr(OH)2+2NaNO3{\displaystyle {\mathsf {Sr(NO_{3})_{2}+2NaOH\rightarrow Sr(OH)_{2}+2NaNO_{3}}}}
- В промышленности: реакцией SrO c водой:
- SrO+h3O→Sr(OH)2{\displaystyle {\mathsf {SrO+H_{2}O\rightarrow Sr(OH)_{2}}}}
- основание сильно реагирует с кислотами и кислотными оксидами с образованием соответствующих солей.
- При нагревании свыше 700 °C разлагается:
- Sr(OH)2→SrO+h3O{\displaystyle {\mathsf {Sr(OH)_{2}\rightarrow SrO+H_{2}O}}}
- При действии на кристаллический Sr(OH)2 концентрированной H2O2 образует пероксид стронция SrO2•8H2O.
Гидроксид стронция используется в основном для очистки свекловичного сахара, а также в качестве стабилизатора для производства пластмасс. Может использоваться как источник ионов стронция, когда нежелательно присутствие ионов хлора. Промежуточный продукт для получения карбоната стронция.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4 (Пол-Три). — 639 с. — ISBN 5-82270-092-4.
Гидроксид рубидия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 января 2018; проверки требует 1 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 января 2018; проверки требует 1 правка.Гидроксид рубидия (RbOH) — соединение, состоящее из одного иона рубидия и гидроксильной группы. Вещество является одним из наиболее сильных оснований (сильнее его только гидроксид цезия и гидроксид франция). Имеет два кристаллогидрата RbOН·2Н2О и RbOН·Н2О. Химические свойства гидроксида рубидия совпадают с химическими свойствами всех гидроксидов щелочных металлов.
Гидроксид рубидия обычно получают реакцией оксида рубидия с водой:
Rb2O+h3O→ 2RbOH{\displaystyle {\mathsf {Rb_{2}O+H_{2}O{\xrightarrow {\ }}2RbOH}}}
Или взаимодействием чистого рубидия с водой (реакция протекает со взрывом из-за самовоспламенения рубидия, а потом водорода):
2Rb+2h3O→ 2RbOH+h3{\displaystyle {\mathsf {2Rb+2H_{2}O{\xrightarrow {\ }}2RbOH+H_{2}}}}
Или взаимодействием гидроксида бария с сульфатом или карбонатом рубидия:
Rb2SO4+Ba(OH)2→ 2RbOH+BaSO4↓{\displaystyle {\mathsf {Rb_{2}SO_{4}+Ba(OH)_{2}{\xrightarrow {\ }}2RbOH+BaSO_{4}\downarrow }}}
Гидроксид рубидия применяется редко, ввиду своей высокой химической активности. Общие химические свойства гидроксида рубидия подобны химическим свойствам гидроксида калия и гидроксида натрия, однако реакции эти с гидроксидом рубидия протекают гораздо быстрее. Также рубидий — намного более дорогостоящий щелочной металл, чем натрий или калий.
В небольших количествах гидроксид рубидия используется в научных исследованиях.
Гидроксид рубидия — очень едкое вещество. При попадании на кожу раствор гидроксида рубидия вызывает колликвационные (мокрые) ожоги.
В лаборатории при работе с гидроксидом рубидия применяют защитную одежду, перчатки и надевают маску из материалов, устойчивых к воздействию этого вещества.
Реакции гидроксида рубидия сильно экзотермичны, следовательно, раствор может закипеть, поэтому их проводят медленно или постепенно.
- http://www.webelements.com/webelements/compounds/text/Rb/O1Rb2-18088114.html :Rubidium oxide on WebElements. Accessed in August 2005.
- http://www.chemexper.com/chemicals/supplier/cas/1310-82-3.html :Rubidium hydroxide on ChemExper. Accessed in September 2005.
- http://onx.distant.ru/elements/37-Rb_soed.html :Важнейшие соединения рубидия.
Гидроксид скандия — Википедия
Материал из Википедии — свободной энциклопедии
Гидроксид скандия — неорганическое соединение, гидроксид металла скандия с формулой Sc(OH)3, белое аморфное вещество, не растворимое в воде.
- Действие горячей воды на металлический скандий:
- 2Sc+6h3O →90oC 2Sc(OH)3↓+3h3↑{\displaystyle {\mathsf {2Sc+6H_{2}O\ {\xrightarrow {90^{o}C}}\ 2Sc(OH)_{3}\downarrow +3H_{2}\uparrow }}}
- 4Sc+3O2+6h3O → 4Sc(OH)3↓{\displaystyle {\mathsf {4Sc+3O_{2}+6H_{2}O\ {\xrightarrow {}}\ 4Sc(OH)_{3}\downarrow }}}
- Действие щелочей на растворимую соль скандия:
- Sc(NO3)3+3NaOH → 4Sc(OH)3↓+3NaNO3{\displaystyle {\mathsf {Sc(NO_{3})_{3}+3NaOH\ {\xrightarrow {}}\ 4Sc(OH)_{3}\downarrow +3NaNO_{3}}}}
Гидроксид скандия — белое аморфное вещество, свежеосаждённое имеет состав Sc(OH)3•n H2O, на воздухе постепенно обезвоживается.
Кристаллический гидроксид получен гидротермальным методом, принадлежит к кубической сингонии, пространственная группа I m3, параметры ячейки a = 0,7888 нм, Z = 8.
Не растворяется в воде, p ПР = 27,06.
- Разлагается при нагревании:
- Sc(OH)3 →250−280oC ScO(OH)+h3O{\displaystyle {\mathsf {Sc(OH)_{3}\ {\xrightarrow {250-280^{o}C}}\ ScO(OH)+H_{2}O}}}
- 2Sc(OH)3 →250−280oC Sc2O3+3h3O{\displaystyle {\mathsf {2Sc(OH)_{3}\ {\xrightarrow {250-280^{o}C}}\ Sc_{2}O_{3}+3H_{2}O}}}
- Sc(OH)3+3HCl → ScCl3+3h3O{\displaystyle {\mathsf {Sc(OH)_{3}+3HCl\ {\xrightarrow {}}\ ScCl_{3}+3H_{2}O}}}
- Реагирует с щелочами:
- Sc(OH)3+3NaOH → Na3[Sc(OH)6]{\displaystyle {\mathsf {Sc(OH)_{3}+3NaOH\ {\xrightarrow {}}\ Na_{3}[Sc(OH)_{6}]}}}
- Sc(OH)3+NaOH →120−180oC Na[Sc(OH)4]{\displaystyle {\mathsf {Sc(OH)_{3}+NaOH\ {\xrightarrow {120-180^{o}C}}\ Na[Sc(OH)_{4}]}}}
- Sc(OH)3+NaOH →300−500oC NaScO2+2h3O{\displaystyle {\mathsf {Sc(OH)_{3}+NaOH\ {\xrightarrow {300-500^{o}C}}\ NaScO_{2}+2H_{2}O}}}
- Sc(OH)3+CO2 → ScCO3(OH)+h3O{\displaystyle {\mathsf {Sc(OH)_{3}+CO_{2}\ {\xrightarrow {}}\ ScCO_{3}(OH)+H_{2}O}}}
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.