8. Химические свойства оснований, классификация, номенклатура, получение. Амфотерные гидроксиды и оксиды
Основания — Это химическое соединение, способное образовывать ковалентную связь с протоном (основание Бренстеда) либо с вакантной орбиталью другого химического соединения (основание Льюиса)
Химические свойства оснований
Щелочи | Нерастворимые основания |
Изменение окраски индикторов | |
фенолфталеин — малиновый метилоранж — оранжевый лакмус- синий универсальный индикатор — от синего до фиолетового | не меняют |
Взаимодействие с кислотами (реакция нейтрализации) | |
2NaOH+h3SO4=Na2SO4+2h3O2NaOH+h3SO4=Na2SO4+2h3O | Cu(OH)2+2HNO3=Cu(NO3)2+2h3OCu(OH)2+2HNO3=Cu(NO3)2+2h3O |
Взаимодействие с кислотными оксидами | |
SO2+2KOH=K2SO3+h3O4SO2+2KOH=K2SO3+h3O4 | −− |
Взаимодействие с амфотерными оксидами | |
Al2O3+6NaOH+3h3O=2Na3[Al(OH)6]Al2O3+6NaOH+3h3O=2Na3[Al(OH)6] в растворе Al2O3+2NaOH=2NaAlO2+h3OAl2O3+2NaOH=2NaAlO2+h3O в расплаве | −− |
Взаимодействие с солями | |
средними (правило Бертолле): 2NaOH+MgSO4=Mg(OH)2↓+Na2SO42NaOH+MgSO4=Mg(OH)2↓+Na2SO4 кислыми: NaHCO3+NaOH=Na2CO3+h3ONaHCO3+NaOH=Na2CO3+h3O | −− |
Разложение при нагревании | |
не разлагаются, кроме LiOH: 2LiOH−→−−−−−800∘C,h3Li2O+h3O2LiOH→800∘C,h3Li2O+h3O | Cu(OH)2=CuO+h3OCu(OH)2=CuO+h3O |
Взаимодействие с неметаллами | |
2NaOH(конц., хол.)+Cl2=NaClO+NaCl+h3O2NaOH(конц., хол.)+Cl2=NaClO+NaCl+h3O 6NaOH(конц., гор.)+3Cl2=NaClO3+5NaCl+3h3O6NaOH(конц., гор.)+3Cl2=NaClO3+5NaCl+3h3O | −− |
Методы получения оснований
1. электролиз водных растворов солей активных металлов:
2NaCl+2h3O=2NaOH+h3↑+Cl2↑2NaCl+2h3O=2NaOH+h3↑+Cl2↑
В ходе электролиза солей металлов, стоящих в ряду напряжения до алюминия, на катоде происходит восстановление воды с выделением газообразного водорода и гидроксид-ионов. Катионы металла, образованные в ходе диссоциации соли, образуют с полученными гидроксид-ионами основания.
2. взаимодействие металлов с водой: 2Na+2h3O=2NaOH+h3↑2Na+2h3O=2NaOH+h3↑ Этот метод не находит практического применения ни в лаборатории, ни в промышленности
3. взаимодействие оксидов с водой: CaO+h3O=Ca(OH)2CaO+h3O=Ca(OH)2
4. обменные реакции (можно получать и растворимые и нерастворимые основания): Ba(OH)2+K2SO4=2KOH+BaSO4↓Ba(OH)2+K2SO4=2KOH+BaSO4↓ CuCl2+2NaOH=Cu(OH)2↓+2NaNO3
Амфотерные соединения – это вещества, которые в зависимости от условий реакций проявляют кислотные или основные свойства.
Амфотерные гидроксиды – нерастворимые в воде вещества, и при нагревании они разлагаются на оксид металла и воду:
Zn(OH)2 = ZnO + H2O
2Fe(OH)3 = Fe2O3 + 3H2O
2Al(OH)3 = Al2O3 + 3H2O
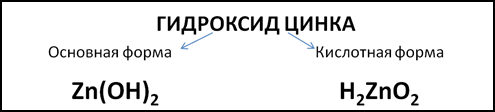
Примером амфотерного гидроксида может служить гидроксид цинка. Формула этого гидроксида в основной форме – Zn(OH)2. Но можно записать формулу гидроксида цинка в кислотной форме, поставив на первое место атомы водорода, как в формулах неорганических кислот: H2ZnO2 (Рис. 1). Тогда ZnO22- будет кислотным остатком с зарядом 2-.
Особенностью амфотерного гидроксида является то, что в нем мало различаются по прочности связи О-Н и Zn-O. Отсюда и двойственность свойств. В реакциях с кислотами, готовыми отдать катионы водорода, гидроксиду цинка выгодно разрывать связь Zn-O, отдавая ОН-группу и выступая в роли основания. В результате таких реакций образуются соли, в которых цинк является катионом, поэтому их называют солями катионного типа:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
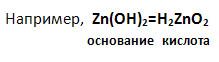
Амфотерные оксиды — солеобразующие оксиды, проявляющие в зависимости от условий либо осно́вные, либо кислотные свойства (то есть проявляющие амфотерность). Образуются переходными металлами. Металлы в амфотерных оксидах обычно проявляют степень окисления от III до IV, за исключением ZnO, BeO, SnO, PbO.
Амфотерные оксиды обладают двойственной природой: они могут взаимодействовать с кислотами и с основаниями (щелочами):
Al2O3 + 6HCl = 2AlCl3 + 3 H2O,
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4].
Типичные амфотерные оксиды: H2O, BeO, Al2O3, Cr2O3, Fe2O3 и др.
9. Химическая термодинамика. Понятия системы, энтропия, энтальпия, тепловой эффект химической реакции, закон Гесса и его следствие. Эндотерм и Экзотерм реакции, 1 и 2 законы термодинамики, Скорость химической реакции (факторы влияющие), правило Вант- Гоффа, уравнение Вант- Гоффа.
Химическая термодинамика – наука, изучающая условия устойчивости систем и законы.
Термодинамика – наука о макросистемах.
Термодинамическая система – макроскопическая часть окружающего мира, в которой протекают различные физические и химические процессы.
Дисперсной системой называется гетерогенная система, в которой мелкие частицы одной фазы равномерно распределены в объеме другой фазы.
Энтропия (От греческого entropia) — поворот, превращение. Понятие энтропии впервые было введено в термодинамике для определения меры необратимого рассеяния энергии. Энтропия широко применяется и в других областях науки: в статистической физике как мера вероятности осуществления какого — либо макроскопического состояния; в теории информации — мера неопределенности какого-либо опыта (испытания), который может иметь разные исходы. Все эти трактовки энтропии имеют глубокую внутреннюю связь.
Энтальпия (тепловая функция, теплосодержание) — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении.
Тепловые эффекты принято указывать в термохимических уравнениях химических реакций, используя значения энтальпии (теплосодержания) системы ΔН.
Если ΔН < 0, то теплота выделяется, т.е. реакция является экзотермической.
Для эндотермических реакций ΔН > 0.
Тепловой эффект химической реакции — это выделенная или поглощенная теплота при данных количествах реагирующих веществ.
Тепловой эффект реакции зависит от состояния веществ.
Рассмотрим термохимическое уравнение реакции водорода с кислородом:
2H2(г)+ O2(г)= 2H2 O(г), ΔH=−483.6 кДж |
Эта запись означает, что при взаимодействии 2 моль водорода с 1 моль кислорода образуются 2 моль воды в газообразном состоянии. При этом выделяется 483.6(кДж) теплоты.
Закон Гесса — Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Следствия из закона Гесса:
Тепловой эффект обратной реакции равен тепловому эффекту прямой реакции с обратным знаком, т.е. для реакций
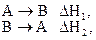
отвечающие
им тепловые эффекты 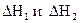
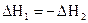 .
.
2. Если в результате ряда последовательных химических реакций система приходит в состояние, полностью совпадающее с исходным (круговой процесс), то сумма тепловых эффектов этих реакций равна нулю, т.е. для ряда реакций
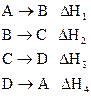
сумма их тепловых эффектов
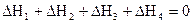 .
.
Под
энтальпией образования понимают тепловой
эффект реакции образования 1 моля
вещества из простых веществ. Обычно
используют стандартные энтальпии
образования. Их обозначают 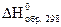 или
или 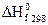 (часто
один из индексов опускают; f – от англ.
formation).
(часто
один из индексов опускают; f – от англ.
formation).
Первое начало термодинамики — Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе
Согласно первому началу термодинамики, работа может совершаться только за счет теплоты или какой-либо другой формы энергии. Следовательно, работу и количество теплоты измеряют в одних единицах —джоулях (как и энергию).
ΔU = A + Q,
где ΔU — изменение внутренней энергии, A — работа внешних сил, Q — количество теплоты, переданной системе.
Второе начало термодинамики — Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему
Правило Вант-Гоффа гласит, что при повышении температуры на каждые 10о скорость химической реакции увеличивается в 2-4 раза.
Уравнение, которое описывает это правило, следующее:{\displaystyle ~V_{2}=V_{1}\cdot \gamma ^{\frac {T_{2}-T_{1}}{10}}}
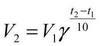
где V2 – скорость протекания реакции при температуре t2, а V1 – скорость протекания реакции при температуре t1;
ɣ — температурный коэффициент скорости реакции. (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
Эндотерми́ческие реа́кции — химические реакции, сопровождающиеся поглощением теплоты. Для эндотермических реакций изменение энтальпии и внутренней энергии имеют положительные значения{\displaystyle \Delta H>0}{\displaystyle \Delta U>0}, таким образом, продукты реакции содержат больше энергии, чем исходные компоненты.
К эндотермическим реакциям относятся:
реакции восстановления металлов из оксидов,
электролиза (поглощается электрическая энергия),
электролитической диссоциации (например, растворение солей в воде),
ионизации,
взрыв воды-подводимое к малому количеству воды большое количество тепла тратится на мгновенный нагрев и фазовый переход жидкости в перегретый пар,при этом внутреняя энергия увеличивается и проявляется в виде двух энергий пара-внутримолекулярной тепловой и межмолекулярной потенциальной.
фотосинтеза.
Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты. Противоположна эндотермической реакции.
studfile.net
Тест на химические свойства оснований и амфотерных гидроксидов.
Задание №1
Из приведенного списка соединений выберите основные гидроксиды. Число верных ответов может быть любым.
- 1. Be(OH)2
- 2. Al(OH)3
- 3. Sr(OH)2
- 4. Zn(OH)2
- 5. Cr(OH)3
Задание №2
Из приведенного списка соединений выберите амфотерные гидроксиды. Число верных ответов может быть любым.
- 1. Cr(OH)2
- 2. Cr(OH)3
- 3. Be(OH)2
- 4. Fe(OH)3
- 5. Fe(OH)2
Задание №3
Из приведенного списка соединений выберите щелочи. Число верных ответов может быть любым.
- 1. Zn(OH)2
- 2. RbOH
- 3. CsOH
- 4. Sr(OH)2
- 5. KOH
Задание №4
Из приведенного списка соединений выберите основные гидроксиды. Число верных ответов может быть любым.
- 1. Mg(OH)2
- 2. Be(OH)2
- 3. Cu(OH)2
- 4. Pb(OH)2
- 5. Sr(OH)2
Задание №5
Из приведенного списка соединений выберите амфотерные гидроксиды. Число верных ответов может быть любым.
- 1. CrO2(OH)2
- 2. Fe(OH)2
- 3. Cr(OH)3
- 4. Al(OH)3
- 5. Ca(OH)2
Задание №6
Из приведенного списка соединений выберите щелочи. Число верных ответов может быть любым.
- 1. Pb(OH)2
- 2. Mn(OH)2
- 3. Ca(OH)2
- 4. Fe(OH)2
- 5. Sr(OH)2
Задание №7
Из приведенного списка соединений выберите основные гидроксиды. Число верных ответов может быть любым.
- 1. NaOH
- 2. CsOH
- 3. Cr(OH)2
- 4. Zn(OH)2
- 5. Cu(OH)2
Задание №8
Из приведенного списка гидроксидов выберите два таких, которые разлагаются при нагревании
- 1. RbOH
- 2. Sr(OH)2
- 3. Cr(OH)2
- 4. Ba(OH)2
- 5. Cu(OH)2
Задание №9
Из приведенного списка гидроксидов выберите два таких, которые не разлагаются при нагревании
- 1. Fe(OH)2
- 2. Be(OH)2
- 3. RbOH
- 4. CsOH
- 5. Zn(OH)2
Задание №10
Из приведенного списка гидроксидов выберите два таких, которые разлагаются при нагревании
- 1. NaOH
- 2. Cr(OH)3
- 3. Sr(OH)2
- 4. Ba(OH)2
- 5. Al(OH)3
Задание №11
Из приведенного списка гидроксидов выберите два таких, которые не разлагаются при нагревании
- 1. Zn(OH)2
- 2. Ba(OH)2
- 3. Mn(OH)2
- 4. Sr(OH)2
- 5. Be(OH)2
Задание №12
Из приведенного списка гидроксидов выберите два таких, которые разлагаются при нагревании
- 1. NaOH
- 2. Fe(OH)2
- 3. Ba(OH)2
- 4. Mg(OH)2
- 5. Sr(OH)2
Задание №13
Из приведенного списка гидроксидов выберите два таких, которые не разлагаются при нагревании
- 1. KOH
- 2. Cr(OH)2
- 3. Ba(OH)2
- 4. Cu(OH)2
- 5. Fe(OH)3
Задание №14
Из приведенного списка гидроксидов выберите два таких, которые разлагаются при нагревании
- 1. Sr(OH)2
- 2. Ba(OH)2
- 3. Al(OH)3
- 4. CsOH
- 5. Fe(OH)3
Задание №15
Из приведенного списка гидроксидов выберите такой, который разлагается при нагревании
- 1. RbOH
- 2. Ba(OH)2
- 3. CsOH
- 4. Sr(OH)2
- 5. Zn(OH)2
В поле ответа введите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: Zn(OH)2 = ZnO + H2O
Задание №16
Из приведенного списка гидроксидов выберите такой, который разлагается при нагревании
- 1. CsOH
- 2. Ba(OH)2
- 3. KOH
- 4. Sr(OH)2
- 5. Al(OH)3
В поле ответа введите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2Al(OH)3 = Al2O3 + 3H2O
Задание №17
Из приведенного списка солей выберите две таких, с которыми будет взаимодействовать гидроксид лития.
1) нитрат свинца
2) бромид калия
3) фосфат натрия
4) хлорид натрия
5) йодид рубидия
РешениеЗадание №18
Из приведенного списка солей выберите две таких, с которыми будет взаимодействовать гидроксид натрия.
1) фторид калия
2) сульфат цинка
3) нитрат аммония
4) сульфат бария
5) хлорид серебра
РешениеЗадание №19
Из приведенного списка солей выберите две таких, с которыми будет взаимодействовать гидроксид кальция.
1) карбонат цезия
2) нитрат бария
3) бромид натрия
4) сульфат аммония
5) йодид свинца
РешениеЗадание №20
Из приведенного списка солей выберите две таких, с которыми будет взаимодействовать гидроксид бария.
1) хлорид аммония
2) карбонат калия
3) сульфат стронция
4) нитрат калия
5) бромид лития
РешениеЗадание №21
Из приведенного списка солей выберите две таких, с которыми будет взаимодействовать гидроксид цезия.
1) нитрат железа(II)
2) хлорид рубидия
3) карбонат калия
4) карбонат аммония
5) нитрат натрия
РешениеЗадание №22
Из приведенного списка солей выберите две таких, с которыми не будет взаимодействовать гидроксид рубидия.
1) нитрат калия
2) нитрат бария
3) нитрат магния
4) нитрат аммония
5) нитрат свинца
РешениеЗадание №23
Из приведенного списка солей выберите две таких, с которыми не будет взаимодействовать гидроксид стронция.
1) сульфат натрия
2) фосфат калия
3) фторид натрия
4) хлорид натрия
5) йодид цезия
РешениеЗадание №24
Из приведенного списка солей выберите две таких, с которыми не будет взаимодействовать гидроксид натрия.
1) бромид аммония
2) фторид кальция
3) нитрат аммония
4) силикат цинка
5) хлорид магния
РешениеЗадание №25
Из приведенного списка солей выберите две таких, с которыми не будет взаимодействовать гидроксид бария.
1) сульфат меди
2) карбонат свинца
3) сульфат аммония
4) карбонат натрия
5) сульфат стронция
РешениеЗадание №26
Из приведенного списка солей выберите две такие, с которыми не будет взаимодействовать гидроксид калия.
1) силикат натрия
2) сульфид железа(II)
3) сульфид аммония
4) нитрат свинца
5) нитрат цинка
РешениеЗадание №27
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с углекислым газом.
1) едкий натр
2) гидроксид железа(III)
3) гидроксид алюминия(III)
4) гашеная известь
5) гидроксид хрома(III)
РешениеЗадание №28
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом натрия.
1) гидроксид лития
2) едкое кали
3) гидроксид алюминия
4) гидроксид стронция
5) гидроксид цинка
РешениеЗадание №29
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом алюминия.
1) гидроксид цезия
2) гидроксид бериллия
3) гидроксид свинца
4) гидроксид бария
5) гидроксид цинка
РешениеЗадание №30
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с оксидом кремния.
1) гидроксид железа (II)
2) гидроксид рубидия
3) едкий натр
4) гидроксид хрома(III)
5) гашеная известь
РешениеЗадание №31
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом кальция.
1) гидроксид хрома(II)
2) гидроксид хрома(III)
3) гидроксид железа(II)
4) гидроксид железа(III)
5) гидроксид натрия
РешениеЗадание №32
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом цинка.
- 1. NaOH
- 2. Pb(OH)2
- 3. RbOH
- 4. Mn(OH)2
- 5. Cu(OH)2
Задание №33
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом углерода (IV).
- 1. NaOH
- 2. CsOH
- 3. Cr(OH)3
- 4. Al(OH)3
- 5. Fe(OH)3
Задание №34
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом бария.
- 1. Ba(OH)2
- 2. Al(OH)3
- 3. Sr(OH)2
- 4. Mn(OH)2
- 5. Cr(OH)3
Задание №35
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом хрома(III).
- 1. Fe(OH)2
- 2. Be(OH)2
- 3. RbOH
- 4. CsOH
- 5. Zn(OH)2
Задание №36
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с оксидом кремния.
- 1. Ca(OH)2
- 2. Cr(OH)2
- 3. Sr(OH)2
- 4. Be(OH)2
- 5. Cu(OH)2
Задание №37
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с едким кали.
- 1. Pb(OH)2
- 2. KOH
- 3. Cr(OH)3
- 4. Ca(OH)2
- 5. Sr(OH)2
Задание №38
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с едким натром.
- 1. Cr(OH)2
- 2. Fe(OH)2
- 3. Cr(OH)3
- 4. Al(OH)3
- 5. Be(OH)2
Задание №39
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с гашеной известью.
- 1. Cr(OH)2
- 2. Cr(OH)3
- 3. Be(OH)2
- 4. Cu(OH)2
- 5. Fe(OH)2
Задание №40
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с гидроксидом стронция.
- 1. Be(OH)2
- 2. Al(OH)3
- 3. Sr(OH)2
- 4. Zn(OH)2
- 5. Cr(OH)2
Задание №41
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с гидроксидом рубидия.
- 1. Pb(OH)2
- 2. Mn(OH)2
- 3. Ca(OH)2
- 4. Fe(OH)3
- 5. Sr(OH)2
Задание №42
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с гидроксидом алюминия.
- 1. Mn(OH)2
- 2. Be(OH)2
- 3. Ca(OH)2
- 4. Ba(OH)2
- 5. Sr(OH)2
Задание №43
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с гидроксидом цинка.
- 1. Zn(OH)2
- 2. Be(OH)2
- 3. CsOH
- 4. Pb(OH)2
- 5. KOH
Задание №44
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с гидроксидом хрома(III).
- 1. Fe(OH)2
- 2. KOH
- 3. Cr(OH)3
- 4. Ca(OH)2
- 5. Sr(OH)2
Задание №45
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с гидроксидом железа(III).
- 1. Pb(OH)2
- 2. Mn(OH)2
- 3. Ca(OH)2
- 4. Fe(OH)2
- 5. Sr(OH)2
Задание №46
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с гидроксидом свинца.
- 1. Cr(OH)2
- 2. Ca(OH)2
- 3. Ba(OH)2
- 4. Al(OH)3
- 5. LiOH
Задание №47
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с кремниевой кислотой.
- 1. LiOH
- 2. Sr(OH)2
- 3. Cr(OH)2
- 4. Ba(OH)2
- 5. Cu(OH)2
Задание №48
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с сернистой кислотой.
- 1. Fe(OH)2
- 2. Be(OH)2
- 3. RbOH
- 4. CsOH
- 5. Zn(OH)2
Задание №49
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с кремниевой кислотой.
- 1. LiOH
- 2. Cr(OH)3
- 3. Sr(OH)2
- 4. Be(OH)2
- 5. Al(OH)3
Задание №50
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с сероводородной кислотой.
- 1. NaOH
- 2. Al(OH)3
- 3. Ba(OH)2
- 4. Cr(OH)3
- 5. Sr(OH)2
Задание №51
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с кремнием.
- 1. Sr(OH)2
- 2. Be(OH)2
- 3. Al(OH)3
- 4. CsOH
- 5. Fe(OH)3
Задание №52
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с серой.
- 1. NaOH
- 2. Mn(OH)2
- 3. RbOH
- 4. Cr(OH)3
- 5. Ca(OH)2
Задание №53
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с кремнием.
- 1. RbOH
- 2. Ba(OH)2
- 3. Be(OH)2
- 4. Sr(OH)2
- 5. Zn(OH)2
Задание №54
Из приведенного списка гидроксидов выберите два таких, которые взаимодействуют с фосфором.
- 1. Mg(OH)2
- 2. Ba(OH)2
- 3. Cu(OH)2
- 4. Sr(OH)2
- 5. Be(OH)2
Задание №55
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с фосфором.
- 1. Ca(OH)2
- 2. Cu(OH)2
- 3. Ba(OH)2
- 4. Al(OH)3
- 5. LiOH
Задание №56
Из приведенного перечня выберите две пары реагентов, между которыми возможна реакция
- 1. Cr + NaOH
- 2. Si + CsOH
- 3. Fe + NaOH
- 4. I2 + Ba(OH)2
- 5. C + KOH
Задание №57
Из приведенного списка гидроксидов выберите два таких, которые не взаимодействуют с йодом.
- 1. NaOH
- 2. Pb(OH)2
- 3. RbOH
- 4. Fe(OH)3
- 5. CsOH
Задание №58
Из предложенного перечня выберите две пары реагентов, между которыми возможна реакция
- 1. Al + Zn(OH)2
- 2. Cl2 + Al(OH)3
- 3. P + NaOH
- 4. S + Ba(OH)2
- 5. Br2 + Cu(OH)2
Задание №59
Из приведенного перечня простых веществ выберите два таких, которые могут реагировать с концентрированным водным раствором гидроксида бария:
- 1. H2
- 2. Cl2
- 3. N2
- 4. O2
- 5. I2
Задание №60
Из приведенного перечня простых веществ выберите два таких, которые могут реагировать с концентрированным водным раствором гидроксида калия:
- 1. Al
- 2. Cu
- 3. P
- 4. Cr
- 5. C
Задание №61
Из приведенного перечня простых веществ выберите два таких, которые могут реагировать с концентрированным водным раствором гидроксида натрия:
- 1. Fe
- 2. Cu
- 3. S
- 4. C
- 5. Zn
Задание №62
Из предложенного перечня выберите две пары реагентов, между которыми возможна реакция:
- 1. Cu + NaOH
- 2. Cl2 + Cu(OH)2
- 3. C + KOH
- 4. Si + Ba(OH)2
- 5. Zn + Sr(OH)2
Задание №63
Из предложенного перечня выберите две пары реагентов, между которыми возможна реакция:
- 1. Al + Fe(OH)2
- 2. I2 + RbOH
- 3. Cr + NaOH
- 4. N2 + KOH
- 5. P + CsOH
Задание №64
Из приведенного списка гидроксидов выберите такой, который взаимодействует с цинком.
- 1. NaOH
- 2. Fe(OH)2
- 3. Cr(OH)2
- 4. Zn(OH)2
- 5. Cu(OH)2
В поле ответа введите уравнение реакции водного раствора данного гидроксида с цинком. В качестве разделителя левой и правой частей используйте знак равенства (=).
РешениеОтвет: Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Задание №65
Установите соответствие между формулой/названием гидроксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ГИДРОКСИД | РЕАГЕНТЫ |
А) гидроксид цинка Б) едкий натр В) гидроксид хрома(III) | 1) алюминий, хлор, серная кислота 2) гидроксид цезия, соляная кислота, оксид натрия 3) вода, кислород, сера 4) азотная кислота, оксид серы(VI), вода |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №66
Установите соответствие между формулой гидроксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ГИДРОКСИД | РЕАГЕНТЫ |
А) KOH Б) Al(OH)3 В) Ba(OH)2 | 1) Na2CO3, Br2, H2O 2) HNO3, P, HI 3) NaOH, HBr, K2O 4) HNO3, Fe(OH)2, KOH |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №67
Установите соответствие между формулой гидроксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ГИДРОКСИД | РЕАГЕНТЫ |
А) гидроксид меди Б) гашеная известь В) гидроксид цинка | 1) сульфат бария, нитрат аммония, карбонат свинца 2) серная кислота, сера, хлорид натрия 3) вода, кислород, кремний 4) азотная кислота, соляная кислота, оксид серы(VI) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №68
Установите соответствие между формулой гидроксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ГИДРОКСИД | РЕАГЕНТЫ |
А) LiOH Б) Al(OH)3 В) Fe(OH)3 | 1) фторид натрия, бром, кремний 2) гидроксид натрия, гашеная известь, вода 3) оксид бария, гидроксид калия, серная кислота 4) цинк, фосфор, нитрат калия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №69
Цинк сплавили со гидроксидом натрия. Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: Zn + 2NaOH = Na2ZnO2 + H2
Задание №70
Хлор пропустили через холодный раствор гидроксида калия. В случае если реакция протекает впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-).
РешениеОтвет: Cl2 + 2NaOH = NaClO + NaCl + H2O
Задание №71
Серу подвергли совместному нагреванию с избытком концентрированного водного раствора гидроксида натрия. В случае если реакция протекает впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-).
РешениеОтвет: 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
Задание №72
Кремний растворили в водном растворе гидроксида натрия. В случае если реакция протекает впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-).
РешениеОтвет: Si + 2NaOH + H2O = 2H2 + Na2SiO3
Задание №73
Алюминий растворили при нагревании в растворе гидроксида рубидия. Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2Al + 2RbOH + 6H2O = 2Rb[Al(OH)4] + 3H2
Задание №74
Хлор пропустили через горячий раствор гидроксида натрия. В случае если реакция протекает впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-).
РешениеОтвет: 3Cl2 + 6NaOH = NaClO3 + 5NaCl + 3H2O
Задание №75
Через известковую воду пропустили углекислый газ в результате чего наблюдали ее помутнение. Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: Ca(OH)2 + CO2 = CaCO3 + H2O
Задание №76
Через известковую воду пропустили некоторое количество углекислого газа, в результате чего был получен прозрачный раствор. Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: Ca(OH)2 + 2CO2 = Ca(HCO3)2
Задание №77
Определите, протекает ли между данными веществами обменная реакция. Если нет, то запишите в ответ символ (-), если да, то целое уравнение с коэффициентами. Сульфат калия + гидроксид бария
РешениеОтвет: K2SO4 + Ba(OH)2 = BaSO4 + 2KOH
Задание №78
Определите, протекает ли между данными веществами обменная реакция. Если нет, то запишите в ответ символ (-), если да, то целое уравнение с коэффициентами. Гидроксид свинца + кремниевая кислота
РешениеЗадание №79
Определите, протекает ли между данными веществами обменная реакция. Если нет, то запишите в ответ символ (-), если да, то целое уравнение с коэффициентами. Гидроксид натрия + нитрат железа(III)
РешениеОтвет: 3NaOH + Fe(NO3)3 = Fe(OH)3 + 3NaNO3
Задание №80
К смеси порошкообразных гидроксида бария и хлорида аммония добавили каплю воды. Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: Ba(OH)2 + 2NH4Cl = BaCl2 + 2NH3 + 2H2O
Задание №81
Оксид алюминия прокалили совместно с твердым гидроксидом натрия. Если реакция протекает, впишите ее в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-)
РешениеОтвет: 2NaOH + Al2O3 = 2NaAlO2 + H2O
Задание №82
Оксид алюминия поместили в концентрированный водный раствор гидроксида калия и подвергли нагреванию. Если реакция протекает, впишите ее в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-)
РешениеОтвет: 2KOH + Al2O3 + 3H2O = 2K[Al(OH)4]
Задание №83
Твердый гидроксид калия сплавили с гидроксидом цинка. Если реакция протекает впишите ее уравнение в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-)
РешениеОтвет: 2KOH + Zn(OH)2 = K2ZnO2 + 2H2O
Задание №84
Сероводород пропустили через водную взвесь гидроксида алюминия. Если реакция протекает впишите ее уравнение в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-)
РешениеЗадание №85
Углекислый газ пропустили через водную взвесь гидроксида алюминия. Если реакция протекает впишите ее уравнение в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает введите в поле ответа знак минус (-)
РешениеЗадание №86
Вычислите массу осадка, полученную при взаимодействии избытка серной кислоты и 30 мл 10% раствора гидроксида бария (плотность 1,1 г/мл). Ответ укажите в граммах и округлите с точностью до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №87
Рассчитайте объем 5% раствора соляной кислоты (плотность 1,05 г/см3), необходимый для полной нейтрализации 14 г едкого кали. Ответ укажите в миллилитрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №88
Определите массу воды, полученную при термическом разложении смеси 1,5 моль гидроксида алюминия и 49 г гидроксида меди. Ответ укажите в граммах округлите с точностью до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №89
Вычислите массу твердого остатка, полученного при прокаливании 214 г гидроксида железа(III). Ответ укажите в граммах и округлите с точностью до целых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №90
Рассчитайте массовую долю бромата калия в растворе, полученном при полном растворении 8 г брома в 92 г горячего концентрированного раствора гидроксида калия. Ответ укажите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №91
Навеску порошка кремния массой 3,5 г растворили при нагревании в избытке гидроксида натрия. Определите массу осадка, который можно получить при подкислении данного раствора соляной кислотой. Ответ укажите в граммах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №92
Смесь гидроксидов алюминия и магния имеет массу 100 г. Определите массовую долю гидроксида магния в исходной смеси, если для растворения гидроксида алюминия потребовалось 140 г 10% раствора гидроксида калия. Ответ укажите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №93
Навеску гидроксида магния прокалили до постоянной массы. Определите массу азотной кислоты, необходимой для растворения твердого остатка, если при прокаливании выделилось 4,5 г паров воды. Ответ укажите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №94
При растворении навески кремния в избытке гидроксида натрия выделился водород. Определите массу исходной навески, если выделившимся газом можно восстановить 20 г оксида меди(II). Ответ укажите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №95
Рассчитайте объем хлора, который может поглотить горячий раствор, содержащий 10 г гидроксида натрия и 7 г гидроксида калия. Ответ укажите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №96
Вычислите массу хлорида аммония, необходимую для получения 112 л аммиака по реакции с гидроксидом бария. Ответ укажите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №97
Определите массу осадка, оставшегося после реакции 39 г гидроксида алюминия и 100 мл 10% раствора гидроксида натрия (плотность 1,1 г/мл). Ответ укажите в граммах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №98
Рассчитайте объем углекислого газа, необходимого для полного осаждения карбоната бария из 0,2 л 15% раствора его гидроксида (плотность 1,12 г/см3). Ответ укажите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №99
Какую массу воды можно получить при прокаливании образца гидроксида железа(III) массой 59,5 г, содержащего 10% песка. Ответ укажите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
РешениеЗадание №100
При полном растворении навески серы массой 9,6 г в избытке раствора гидроксида калия получено 100 г раствора. Рассчитайте массовую долю сульфида калия в получившемся растворе. Ответ укажите в процентах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решениеscienceforyou.ru
Применение и получение амфотерных гидроксидов — урок. Химия, 8–9 класс.
Применение амфотерных гидроксидов
Из всех амфотерных гидроксидов наибольшее применение находит гидроксид алюминия:- лекарственные препараты, приготовленные на основе гидроксида алюминия, врач назначает при нарушении кислотно-щелочного баланса в пищеварительном тракте;
- в качестве антипирена (средства для подавления способности гореть) вещество вводят в состав пластмасс и красок;
- путём разложения гидроксида алюминия в металлургии получают оксид алюминия (глинозём) — сырьё для получения металлического алюминия.


Товары, в производстве которых используется гидроксид алюминия: лекарственный препарат «Алмагель» и металлургический глинозём
Гидроксид цинка в промышленности служит сырьём для получения различных соединений этого металла, в основном — солей.
Получение амфотерных гидроксидов
1. Амфотерные гидроксиды получают так же, как нерастворимые в воде основания, то есть путём смешивания раствора соли соответствующего металлического элемента с раствором щёлочи.
Например, чтобы получить гидроксид цинка, следует раствор сульфата цинка смешать с раствором гидроксида натрия:
ZnSO4+2NaOH→Zn(OH)2+Na2SO4.
Видеофрагмент:
Получение и химические свойства гидроксида цинка |
Чтобы получить гидроксид алюминия, можно к раствору сульфата алюминия добавить раствор гидроксида калия:
Al2(SO4)3+6KOH→2Al(OH)3↓+3K2SO4.
2. Осадок гидроксида трёхвалентного металла (алюминия, хрома) образуется также при смешивании раствора соли этого металла с раствором карбоната:
2AlCl3+3Na2CO3+3h3O→2Al(OH)3↓+6NaCl+3CO2↑.
www.yaklass.ru
физические и химические свойства, получение, применение :: SYL.ru
Существует три основных класса неорганических химических соединений: оксиды, гидроксиды и соли. Первые делятся на две группы: несолеобразующие (к ним относятся угарный газ, закись азота, монооксид азота и т. д.) и солеобразующие, которые, в свою очередь, бывают основными, кислотными и амфотерными. Гидроксиды делятся на кислоты, основания и амфотерные. Соли существуют основные, кислые, средние и двойные. Ниже будут более подробно описаны амфотерные оксиды и гидроксиды.

Что такое амфотерность?
Это способность неорганического химического вещества проявлять как кислотные, так и основные свойства, в зависимости от условий реакции. К веществам, которые обладают такого рода особенностью, могут относиться оксиды и гидроксиды. Среди первых можно назвать оксид и диоксид олова, бериллия, марганца, цинка, железа (ІІ), (ІІІ). Амфотерные гидроксиды представлены такими веществами: гидроксид бериллия, алюминия, железа (ІІ), метагидроксид железа, алюминия, дигидроксид-оксид титана. Самыми распространенными и часто используемыми из перечисленных выше соединений являются оксид железа и алюминия, а также гидроксиды этих металлов.
Химические свойства амфотерных оксидов
Амфотерные оксиды имеют одновременно как свойства кислотных, так и основных соединений. Как кислотные, они могут взаимодействовать со щелочами. При такого типа реакциях образуются соль и вода. Также они вступают в химическую реакцию с основными оксидами. Проявляя свои основные свойства, они вступают во взаимодействие с кислотами, вследствие чего образуются соль и вода, а также с кислотными оксидами, благодаря чему можно получить соль.
Примеры уравнений реакций, в которых участвуют амфотерные оксиды
АІ2О3 + 2КОН = 2КАІО2 + Н2О — данная реакция показывает кислотные свойства амфотерных оксидов. 2АІ2О3 + 6НСІ = 4АІСІ3 + 3Н2О; АІ2О3 + 3СО2 = АІ2(СО3)3 — эти уравнения служат примером основных химических свойств таких оксидов.
Химические свойства амфотерных гидроксидов
Они способны вступать в химическое взаимодействие как с сильными кислотами, так и со щелочами, а некоторые из них реагируют также со слабыми кислотами. Все они при воздействии высоких температур распадаются на оксид и воду. При реакции амфотерного гидроксида с кислотой образуются соль и вода. Все такие гидроксиды нерастворимы в воде, поэтому могут реагировать только с растворами определенных соединений, но не с сухими веществами.
Физические свойства амфотерных оксидов, способы их получения и применение
Оксид ферума (ІІ) — пожалуй, самый распространенный амфотерный оксид. Способов его получения существует довольно много. Он широко используется в промышленности. Другие амфотерные оксиды также применяются во многих отраслях: от металлургии до пищевой промышленности.
Внешний вид, получение и использование ферум (ІІ) оксида
Он представляет собой твердое вещество черного цвета. Его кристаллическая решетка схожа с решеткой пищевой соли. В природе его можно найти в виде минерала вюстита.
Данное химическое соединение получают четырьмя различными способами. Первый — восстановление оксида железа (ІІІ) с использованием угарного газа. При этом, смешав одинаковое количество этих двух веществ, можно получить две части оксида железа (ІІ) и одну — углекислого газа. Второй метод получения — взаимодействие железа с его оксидами, к примеру, ферум (ІІІ) оксидом, при этом не образуется никаких побочных продуктов.
 Однако для такой реакции необходимо создать условия в виде высокой температуры — 900-1000 градусов по Цельсию. Третий способ — реакция между железом и кислородом, в этом случае образуется только оксид железа (ІІ). Для осуществления данного процесса также понадобится нагревание исходных веществ. Четвертым методом получения является оксалата двухвалентного железа. Для такой реакции необходима высокая температура, а также вакуум. В результате образуются ферум (ІІ) оксид, углекислый и угарный газ в соотношении 1:1:1. Из написанного выше можно сделать вывод, что самым простым и не требующим специальных условий является первый способ получения данного вещества. Применяют оксид железа (ІІ) для выплавки чугуна, также он является одной из составляющих некоторых красителей, используется в процессе чернения стали.
Однако для такой реакции необходимо создать условия в виде высокой температуры — 900-1000 градусов по Цельсию. Третий способ — реакция между железом и кислородом, в этом случае образуется только оксид железа (ІІ). Для осуществления данного процесса также понадобится нагревание исходных веществ. Четвертым методом получения является оксалата двухвалентного железа. Для такой реакции необходима высокая температура, а также вакуум. В результате образуются ферум (ІІ) оксид, углекислый и угарный газ в соотношении 1:1:1. Из написанного выше можно сделать вывод, что самым простым и не требующим специальных условий является первый способ получения данного вещества. Применяют оксид железа (ІІ) для выплавки чугуна, также он является одной из составляющих некоторых красителей, используется в процессе чернения стали.Оксид железа (ІІІ)
Это не менее распространенный амфотерный оксид, чем описанный выше. При нормальных условиях он представляет собой твердое вещество, имеющее красно-коричневый цвет. В природе может встретиться в виде минерала гематита, который используется в изготовлении украшений. В промышленности данное вещество получило широкое применение: его используют для окрашивания некоторых строительных материалов, таких как кирпич, тротуарная плитка и т. д., в изготовлении красок, в том числе полиграфических, и эмалей. Также рассматриваемое вещество служит пищевым красителем под названием Е172. В химической отрасли его применяют при производстве аммиака в качестве катализатора.

Оксид алюминия
Амфотерные оксиды также включают в свой список и оксид алюминия. Данное вещество при нормальных условиях имеет твердое состояние. Цвет этого оксида белый. В природе его часть можно встретить в виде глинозема, а также сапфира и рубина. Используется в основном в химической промышленности в качестве катализатора. Но также его применяют и в изготовлении керамики.

Оксид цинка
Это химическое соединение также обладает амфотерностью. Это твердое вещество, не имеющее цвета, в воде не растворяется. Получают его в основном посредством разложения различных соединений цинка. К примеру, его нитрата. При этом выделяется оксид цинка, диоксид азота и кислород. Также можно добыть данное вещество посредством разложения карбоната цинка. При такой реакции, кроме нужного соединения, выделяется еще и углекислый газ. Также возможен распад гидроксида цинка на его оксид и воду. Для того чтобы осуществить все три выше перечисленных процесса, требуется воздействие высокой температуры. Применяют оксид цинка в различных отраслях промышленности, например, в химической (в качестве катализатора) для изготовления стекла, в медицине для лечения кожных дефектов.
Оксид бериллия
Получают его в основном путем термического разложения гидроксида данного элемента. При этом также образуется вода. Он имеет вид твердого бесцветного вещества. Применение свое данный оксид находит в различных отраслях промышленности в качестве термостойкого материала.

Оксид олова
Имеет темный цвет, обладает твердым состоянием при нормальных условиях. Получить его возможно, как и многие другие амфотерные оксиды, посредством разложения его гидроксида. В результате образуется рассматриваемое вещество и вода. Для этого также нужно воздействие высокой температуры. Используется данное соединение в химической промышленности в качестве восстановителя в окислительно-восстановительных реакциях, реже применяется как катализатор.
Свойства, получение и применение амфотерных гидроксидов
Амфотерные гидроксиды используются не менее широко, нежели оксиды. Благодаря своему разностороннему химическому поведению, они в основном применяются для получения всевозможных соединений. Кроме того, гидроксид железа (бесцветное твердое вещество) используется в изготовлении аккумуляторов; гидроксид алюминия — для очистки воды; гидроксид бериллия — для получения оксида.
www.syl.ru
Основные гидроксиды и их химические свойства
К основным классам неорганических веществ, кроме оксидов, кислот и солей, относится группа соединений, называемых основаниями или гидроксидами. Все они имеют единый план строения молекулы: обязательно содержат в ее составе одну или несколько гидроксильных групп, соединенных с ионом металла. Основные гидроксиды генетически связаны с оксидами металлов и солями, это обуславливает не только их химические свойства, но и способы получения в лаборатории и промышленности.

Существует несколько форм классификации оснований, которые базируются как на характеристике металла, входящего в состав молекулы, так и на способности вещества растворяться в воде. В нашей статье мы рассмотрим эти особенности гидроксидов, а также ознакомимся с их химическими свойствами, от которых зависит применение оснований в промышленности и быту.
Физические свойства
Все основания, образованные активными или типичными металлами, представляют собой твердые вещества, обладающие широким диапазоном температур плавления. По отношению к воде они делятся на хорошо растворимые – щелочи и нерастворимые в воде. Например, основные гидроксиды, содержащие в качестве катионов элементы IA группы, легко растворяются в воде и являются сильными электролитами. Они мыльные на ощупь, разъедают ткань, кожу и называются щелочами. При их диссоциации в растворе обнаруживаются ионы ОН—, определяемые с помощью индикаторов. Например, бесцветный фенолфталеин в щелочной среде становится малиновым. Как растворы, так и расплавы гидроксидов натрия, калия, бария, кальция являются электролитами, т.е. проводят электрический ток и считаются проводниками второго рода. К растворимым основаниям, наиболее часто используемым в промышленности, относится около 11 соединений, например, таких, как основные гидроксиды натрия, калия, аммония и др.

Строение молекулы основания
Между катионом металла и анионами гидроксильных групп в молекуле вещества образуется ионная связь. Она достаточно прочная у нерастворимых в воде гидроксидов, поэтому полярные молекулы воды не способны разрушить кристаллическую решетку такого соединения. Щелочи являются веществами стойкими и практически не образуют при нагревании оксид и воду. Так, основные гидроксиды калия и натрия кипят при температуре более 1000 °С, при этом они не разлагаются. В графических формулах всех оснований хорошо видно, что атом кислорода гидроксильной группы связывается одной ковалентной связью с атомом металла, а другой – с атомом водорода. Строение молекулы и тип химической связи обуславливают не только физические, но и все химические характеристики веществ. Остановимся на них подробнее.
Кальций и магний и особенности свойств их соединений
Оба элемента являются типичными представителями активных металлов и могут взаимодействовать с кислородом и водой. Продуктом первой реакции является основный оксид. Гидроксид образуется вследствие экзотермического процесса, идущего с выделением большого количества теплоты. Основания кальция и магния представляют собой малорастворимые белые порошковидные вещества. Для соединения кальция часто применяют следующие названия: известковое молоко (если это суспензия в воде) и известковая вода. Будучи типичным основным гидроксидом, Са(ОН)2 взаимодействует с кислотными и амфотерными оксидами, кислотами и амфотерными основаниями, например, с гидроксидами алюминия и цинка. В отличие от типичных щелочей, устойчивых к нагреванию, соединения магния и кальция под действием температуры разлагаются на оксид и воду. Оба основания, особенно Са(ОН)2, широко используются в промышленности, сельском хозяйстве и в бытовых нуждах. Рассмотрим их применение далее.

Области применения соединений кальция и магния
Хорошо известно, что в строительстве применяют химический материал, называемый пушенкой или гашеной известью. Это — основание кальция. Чаше всего его получают реакцией воды с основным оксидом кальция. Химические свойства основных гидроксидов позволяют широко использовать их в различных отраслях народного хозяйства. Напимер, для очистки примесей в производстве сахара-сырца, для получения хлорной извести, в отбеливании хлопчатобумажной и льняной пряжи. До изобретения ионообменников – катионитов, основания кальция и магния применяли в технологиях умягчения воды, что позволяло избавиться от гидрокарбонатов, ухудшающих ее качество. Для этого воду кипятили с небольшим количеством кальцинированной соды или гашеной извести. Водную суспензию гидроксида магния можно применять в качестве лечебного средства больным гастритом для снижения кислотности желудочного сока.

Свойства основных оксидов и гидроксидов
Наиболее важными для веществ это группы являются реакции с кислотными оксидами, кислотами, амфотерными основаниями и солями. Интересно, что нерастворимые основания, например, такие как гидроксиды меди, железа или никеля нельзя получить прямой реакцией оксида с водой. В этом случае в лаборатории пользуются реакцией между соответствующей солью и щелочью. В результате образуются основания, которые выпадают в осадок. Например, так получают голубой осадок гидроксида меди, зеленый осадок основания двухвалентного железа. В дальнейшем их выпаривают до твердых порошковидных веществ, относящихся к нерастворимым в воде гидроксидам. Отличительная особенность этих соединений заключается в том, что при действии высоких температур они разлагаются на соответствующий оксид и воду, чего нельзя сказать о щелочах. Ведь растворимые в воде основания являются термически стойкими.

Способность к электролизу
Продолжая изучать основные свойства гидроксидов, остановимся еще на одной черте, по которой можно отличить основания щелочных и щелочно-земельных металлов от нерастворимых в воде соединений. Это невозможность последних диссоциировать на ионы под действием электрического тока. Напротив, расплавы и растворы гидроксидов калия, натрия, бария, стронция легко подвергаются электролизу и являются проводниками второго рода.
Получение оснований
Говоря о свойствах этого класса неорганических веществ, мы частично перечислили химические реакции, лежащие в основе их получения в лабораторных и промышленных условиях. Наиболее доступным и экономически выгодным можно считать способ термического разложения природного известняка, в результате которого получить негашеную известь. Если провести реакцию с водой, то она образует гидроксид основного характера – Са(ОН)2. Смесь этого вещества с песком и водой называют строительным раствором. Его продолжают использовать для оштукатуривания стен, для связки кирпичей и в других видах строительных работ. Щелочи также можно получить реакцией соответствующих оксидов водой. Например: К2О + Н2О = 2КОН. Процесс является экзотермическим идет с выделением большого количества теплоты.

Взаимодействие щелочей с кислотными и амфотерными оксидами
К характерным химическим свойствам растворимых в воде оснований можно отнести их способность образовывать соли в реакциях с оксидами, содержащими в молекулах атомы неметаллов, например, такими, как углекислый газ, диоксид серы или оксид кремния. В частности, гидроксид кальция используют для осушения газов, а гидроксиды натрия и калия для получения соответствующих карбонатов. Оксиды цинка и алюминия, относящиеся к амфотерным веществам, могут взаимодействовать как с кислотами, так и со щелочами. В последнем случае могут образовываться комплексные соединения, например, такие, как гидроксоцинкат натрия.
Реакция нейтрализации
Одним из наиболее важных свойств оснований, как нерастворимых в воде, так и щелочей, является их способность реагировать с неорганическими или органическими кислотами. Данная реакция сводится к взаимодействию между собой двух видов ионов: водорода и гидроксильных групп. Оно приводит к образованию молекул воды: HCI + КОН = KCI + Н2О . С точки зрения теории электролитической диссоциации вся реакция сводится к образованию слабого малодиссоциированного электролита – воды.

В приведенном примере образовалась средняя соль – хлорид калия. Если же для реакции взяты гидроксиды основного характера в количестве меньшем, чем нужно для полной нейтрализации многоосновной кислоты, то при выпаривании образовавшегося продукта обнаруживаются кристаллы кислой соли. Реакция нейтрализации играет важную роль в метаболических процессах, протекающих в живых системах – клетках и позволяет им с помощью собственных буферных комплексов нейтрализовать избыточное количество ионов водорода, накапливающихся в реакциях диссимиляции.
fb.ru