Кремниевая кислота и её соли — урок. Химия, 8–9 класс.
Кремниевая кислота h3SiO3 — очень слабая, нерастворимая в воде кислота. Её получают в виде студенистого осадка при действии сильных кислот на растворы силикатов:
Na2SiO3+2HCl=h3SiO3↓+2NaCl.
Кремниевая кислота настолько слабая, что её можно вытеснить из солей даже угольной кислотой:
Na2SiO3+h3O+CO2=h3SiO3↓+Na2CO3.

Силикат натрия + соляная кислота
Гелеобразный осадок кремниевой кислоты через некоторое время загустевает и заполняет весь объём сосуда.
Загустевший осадок кремниевой кислоты
Особенности свойств кремниевой кислоты объясняются её строением. Кремниевая кислота не имеет постоянного состава, поэтому вместо формулы h3SiO3 иногда используют запись SiO2⋅nh3O. Кислота имеет полимерное строение:
Кремниевая кислота неустойчивая и при длительном хранении или повышенной температуре разлагается на воду и оксид кремния(\(IV\)):
h3SiO3=h3O+SiO2.
Oксид кремния(\(IV\)) образуется в виде пористого твёрдого вещества — силикагеля.
Кремниевая кислота не растворяется в воде, не диссоциирует, не изменяет окраску индикаторов. Как все кислоты, она реагирует с основными и амфотерными оксидами и гидроксидами. В результате реакций образуются соли силикаты (Na2SiO3, CaSiO3).
Из силикатов растворимы только соли щелочных металлов, и их называют растворимым или жидким стеклом. Силикаты натрия и калия входят в состав силикатного клея.
Концентрированные растворы этих солей используются для пропитки деревянных изделий и тканей с целью придания им огнеупорных свойств. При высыхании силикаты образуют стеклоподобный слой, который не пропускает воду, поэтому применяются и в качестве водоотталкивающих покрытий.

В природе встречаются силикаты и алюмосиликаты. К ним относятся гранит, слюда, асбест, глина. Это доступное сырьё давно освоено человеком и широко используется в строительстве.
Глина легко формуется, при спекании становится твёрдой, поэтому она нашла применение для изготовления керамических изделий.
Глиняная посуда

Фарфоровая посуда

Кирпич керамический
При нагревании глины с известняком получают важнейший строительный материал — цемент.

Цемент
www.yaklass.ru
Химические свойства кремниевой кислоты и силикатов
Тема: Основные металлы и неметаллы
Урок: Кремний. Благородные газы
1. Нахождение кремния в природе
Кремний – один из самых распространённых химических элементов земной коры. Его содержание составляет почти 30%. В природе он в основном встречается в виде различных форм диоксида кремния, силикатов и алюмосиликатов.
Почти во всех своих соединениях кремний четырехвалентен. При этом атомы кремния находятся в возбужденном состоянии. Рис. 1.
Рис. 1
Для перехода в такое состояние один из 3s-электронов занимает вакантное место на 3р-орбитали. При этом вместо 2-х неспаренных электронов в основном состоянии, у атома кремния в возбуждённом состоянии будет 4 неспаренных электрона. Он сможет образовывать 4 ковалентные связи по обменному механизму.

Рис. 2
Рис. 3
Атомы кремния не склонны к образованию кратных связей, но образуют соединения с одинарными связями -Si-O-. Кремнию, в отличие от углерода, несвойственна аллотропия.
Одной из аллотропных модификаций является кристаллический кремний, в котором каждый атом кремния находится в sp3-гибридизации. Рис. 2, 3. Кристаллический кремний – это твердое, тугоплавкое и прочное кристаллическое вещество темно-серого цвета с металлическим блеском. При обычных условиях – полупроводник. Иногда в качестве еще одной аллотропной модификации кремния выделяют аморфный кремний. Это темно-коричневый порошок, химически более активный, чем кристаллический кремний. Является ли он аллотропной модификацией – вопрос спорный.
2. Химические свойства кремния как простого вещества
Химические свойства кремния
1. Взаимодействие с галогенами
Si + 2F2 → SiF4
2. При нагревании кремний сгорает в кислороде, образуется оксид кремния (IV).
Si + О2 → SiО2
3. При высоких температурах кремний взаимодействует с азотом или углеродом.
3Si + 2N2 → Si3N4
Si + C → SiC
4. С водными растворами кислот кремний не реагирует. Но растворяется в щелочах.
Si + 2NaOH + H2O → Na2SiO3+ 2H2↑
5. При сплавлении кремния с металлами, образуются силициды.
Si + 2Mg → Mg2Si
6. Кремний непосредственно с водородом не взаимодействует, но водородные соединения кремния можно получить при взаимодействии силицидов с водой.
Mg2Si + 4H2O → 2Mg(OH)2 + SiH4↑ (силан)
Силаны по строению подобны алканам, но значительно реакционно способны. Самый стабильный моносилан воспламеняется на воздухе.
SiH4↑ +2 О2 → SiО2 + 2H2О
Получение кремния
Кремний получают восстановлением из оксида кремния (IV)
SiО2 + 2Mg → Si + 2MgO
Одна из задач – это получение высокочистого кремния. Для этого технический кремний переводят в тетрахлорид кремния. Получившийся тетрахлорид восстанавливают до силана, а силан разлагается при нагревании на кремний и водород.
3. Оксиды кремния
Кремний способен образовывать два оксида: SiО2 – оксид кремния (IV) и SiО – оксид кремния (II).

Рис. 4
SiО – оксид кремния (II) – это аморфное темно-коричневое вещество, которое образуется при взаимодействии кремния с оксидом кремния (IV)
Si + SiO2 → 2SiO.
Несмотря на стабильность, это вещество почти не используется.
SiО2 — оксид кремния (IV)

Рис. 5

Рис. 6
На долю этого вещества приходится 12% земной коры. Рис. 4. Он представлен такими минералами, как горный хрусталь, кварц, аметист, цитрин, яшма, халцедон. Рис. 5.
SiО2 – оксид кремния (IV) – вещество немолекулярного строения.
Его кристаллическая решетка – атомная. Рис. 6. Кристаллы SiО2 имеют форму тетраэдра, которые связаны между собой атомами кислорода. Более правильной была бы формула молекулы (SiО2)n. Так как SiО2 образует вещество атомного строения, а СО
Химические свойства SiО2
1. Оксид кремния (IV) SiО2 – это кислотный оксид. Он не реагирует с водой. Кремниевую кислоту нельзя получить гидратацией SiО2. Её соли – силикаты – можно получить при взаимодействии SiО2 с горячими растворами щелочей.
SiО2 + 2NaOH Na2SiO3 + H2O
2. Реагирует с карбонатами щелочных и щелочноземельных металлов.
CaCO3 + SiО2 CaSiO3 + CO2↑
3. Взаимодействует с металлами.
SiО2 + 2Mg → Si + 2MgO
4. Реакция с плавиковой кислотой.
SiО2 + 4HF → SiF 4 + 2H2O
SiF4 + 2HF →H2[SiF6]
4. Химические свойства кремниевой кислоты и применение её солей
Химические свойства кремниевой кислоты и силикатов
Получение кремниевой кислоты
Na2SiO3 + 2HCl → H2SiO3↓ + 2NaCl
Кремниевая кислота осаждается в виде полимерного соединения. Формулы для кремниевой кислоты –
H2SiO3 (мета форма) и H4SiO4 (орто форма) – отражают соотношение элементов, но не истинный состав. Условно на плоскости состав кремниевой кислоты изображается как Рис. 7.

Рис. 7
Для кремниевой кислоты всегда используется формула H2SiO3.
1. H2
H2SiO3 H2O + SiO2 (силикагель)
2. Взаимодействует с растворами щелочей
H2SiО3 + 2NaOH Na2SiO3 + 2H2O
Соли кремниевой кислоты – силикаты – относятся к ионным соединениям. Это твердые бесцветные вещества. В воде растворимы только силикаты щелочных металлов, кроме лития.
1. Растворимые силикаты подвергаются гидролизу по аниону
Na2SiО3 + H2O ⇆ NaHSiО3 + NaОH
2. Растворимые силикаты взаимодействуют с сильными кислотами
Na2SiO3 + 2HCl → H2SiO3↓ + 2NaCl
Рис. 8
stydopedia.ru
Химия кремния | CHEMEGE.RU
1. Положение кремния в периодической системе химических элементов
2. Электронное строение кремния
3. Физические свойства и нахождение в природе кремния
4. Качественные реакции на силикаты
5. Основные соединения кремния
6. Способы получения кремния
7. Химические свойства кремния
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и углеродом
7.1.3. Взаимодействие с водородом
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с активными металлами
7.1.6. Горение
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с щелочами
7.2.2. Взаимодействие с кислотами
7.2.3. Взаимодействие с азотной кислотой
Бинарные соединения кремния — силициды, силан и др.
Оксид кремния (IV)
1. Физические свойства и нахождение в природе
2. Химические свойства
2.1. Взаимодействие с щелочами и основными оксидами
2.2. Взаимодействие с водой
2.3. Взаимодействие с карбонатами
2.4. Взаимодействие с кислотами
2.5. Взаимодействие с металлами
2.6. Взаимодействие с неметаллами
Кремниевая кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
Силикаты
Кремний
Положение в периодической системе химических элементов
Кремний расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кремния
Электронная конфигурация кремния в основном состоянии:
+14Si 1s22s22p63s23p2
Электронная конфигурация кремния в возбужденном состоянии:
+14Si* 1s22s22p63s13p3
Атом кремния содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома кремния — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства, способы получения и нахождение в природе кремния
Кремний — второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.
Простое вещество кремний – атомный кристалл темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см3. Полупроводник.
Качественные реакции
Качественная реакция на силикат-ионы SiO32- — взаимодействие солей-силикатов с сильными кислотами. Кремниевая кислота – слабая. Она легко выделяется из растворов солей кремниевой кислоты при действии на них более сильными кислотами.
Например, если к раствору силиката натрия прилить сильно разбавленный раствор соляной кислоты, то кремниевая кислота выделится не в виде осадка, а в виде геля. Раствор помутнеет и «застынет».
Na2SiO3 + 2HCl = H2SiO3 + 2 NaCl
Видеоопыт взаимодействия силиката натрия с соляной кислоты (получение кремниевой кислоты) можно посмотреть здесь.
Соединения кремния
Основные степени окисления кремния +4, 0 и -4.
Наиболее типичные соединения кремния:
| Степень окисления | Типичные соединения |
| +4 | оксид кремния (IV) SiO2 кремниевая кислота H2SiO3 силикаты MeSiO3 бинарные соединения с неметаллами (карбид кремния SiC) |
| -4 | силан SiH4 силициды металлов (силицид натрия Na4Si) |
Способы получения кремния
В свободном состоянии кремний был получен Берцелиусом в 1822 г. Его латинское название «силиций» произошло от латинского слова «sileх», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
Еще один способ получения кремния в лаборатории — восстановление из оксида алюминием:
3SiO2 + 4Al → 3Si + 2Al2O3
В промышленности использовать дорогие алюминий и магний неэффективно, поэтому используют другие, более дешевые способы:
1. Восстановление из оксида коксом в электрических печах:
SiO2 + 2C → Si + 2CO
Однако в таком процессе процессе образующийся кремний загрязнен примесями карбидов кремния, и для производства, например, микросхем уже не подходит.
2. Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С:
SiCl4 +2H2 → Si + 4HCl
или цинком:
SiCl4 + 2Zn → Si + 2ZnCl2
3. Также чистый кремний получается при разложении силана:
SiH4 → Si + 2H2
Химические свойства
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (при взаимодействии с элементами, расположенными выше и правее). Поэтому кремний реагирует и с металлами, и с неметаллами.
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
Si + 2F2 → SiF4
При нагревании кремний реагирует с хлором, бромом, йодом:
Si + 2Cl2 → SiCl4
Si + 2Br2 → SiBr4
1.2. При сильном нагревании (около 2000оС) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.3. Кремний не взаимодействет с водородом.
1.4. С азотом кремний реагирует в очень жестких условиях:
3Si + 2N2 → Si3N4
1.5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом:
Si + O2 → SiO2
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
Si + 2NaOH + H2O → Na2SiO3 + 2H2
2.2. Кремний не взаимодействует с водными растворами кислот, но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты:
Si + 6HF → H2[SiF6] + 2H2
При обработке кремния безводным фтороводородом комплекс не образуется:
Si(тв.) + 4HF(г.) = SiF4 + 2H2
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот:
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Бинарные соединения кремния
Силициды металлов
Силициды – это бинарные соединения кремния с металлами, в которых кремний имеет степень окисления -4. Химическая связь в силицидах металлов — ионная.
Силициды, как правило, легко гидролизуются в воде или в кислой среде.
Например, силицид магния разлагается водой на гидроксид магния и силан:
Mg2Si + 4H2O → 2Mg(OH)2 + SiH4
Соляная кислота легко разлагает силицид магния:
Mg2Si + 4HCl → 2MgCl2 + SiH4
Получают силициды сплавлением простых веществ или восстановлением смеси оксидов коксом в электропечах:
2Mg + Si → Mg2Si
2MgO + SiO2 + 4C → Mg2Si + 4CO
Силан
Силан – это бинарное соединение кремния с водородом SiH4, ядовитый бесцветный газ.
Если поместить порошок силицида магния в очень слабый раствор соляной кислоты, то на поверхности раствора образуются пузырьки газа. Они лопаются и загораются на воздухе. Это горит силан. Он образуется при взаимодействии кислоты с силицидом магния:
Mg2Si + 4HCl → 2MgCl2 + SiH4
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
На воздухе силан горит с образованием SiO2 и H2O:
SiH4 + 2O2 → SiO2 + 2H2O
Видеоопыт сгорания силана можно посмотреть здесь.
Силан разлагается водой разлагается с выделением водорода:
SiH4 + 2H2O → SiO2 + 4H2
Силан разлагается (окисляется) щелочами:
SiH4 + 2NaOH + H2O → Na2SiO3 + 4H2
Силан при нагревании разлагается:
SiH4 → Si + 2H2
Карбид кремния
В соединениях кремния с неметаллами — ковалентная связь.
Рассмотрим карбид кремния – карборунд Si+4C-4. Это вещество с атомной кристаллической решеткой. Он имеет структуру, подобную структуре алмаза и характеризуется высокой твердостью и температурой плавления, а также высокой химической устойчивостью.
Карборунд окисляется кислородом при высокой температуре:
SiC +2O2 → SiO2 + CO2
Карборунд окисляется кислородом в расплаве щелочи:
SiC + 2O2 + 4NaOH → Na2SiO3 + Na2CO3 + 2H2O
Галогениды кремния
Хлорид и фторид кремния – галогенангидриды кремниевой кислоты.
SiCl4.
Получают галогениды кремния действием хлора на сплав оксида кремния с углем:
SiO2 + C + Cl2 → SiCl4 + CO
Галогениды кремния разлагаются водой до кремниевой кислоты и хлороводорода:
SiCl4 + 3H2O → H2SiO3↓ + 4HCl
Хлорид кремния (IV) восстанавливается водородом:
SiCl4 + 2H2 → Si + 4HCl
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Оксид кремния (IV) – типичный кислотный оксид. За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами. При этом образуются силикаты.
Например, диоксид кремния взаимодействует с гидроксидом калия:
SiO2 + 2KOH → K2SiO3 + H2O
Еще пример: диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой, т.к. кремниевая кислота нерастворима.
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов. При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например, оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
SiO2 + K2CO3 → K2SiO3 + CO2
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом:
SiO2 + 6HF(г) = SiF4 + H2O
SiO2 + 6HF(р-р) → H2[SiF6] + 2H2O
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например, оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например, оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
SiO2 + 2Н2 → Si + 2Н2O
Еще пример: оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
3SiO2 + Ca3(PO4)2 + 5C → 3CaSiO3 + 5CO + 2P
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует колоидный раствор в воде.
Метакремниевая H2SiO3 существует в растворе в виде полимера:
Способы получения
Кремниевая кислота образуется при действии сильных кислот на растворимые силикаты (силикаты щелочных металлов).
Например, при действии соляной кислоты на силикат натрия:
Na2SiO3 + 2HCl → H2SiO3 + 2 NaCl
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Na2SiO3 + 2Н2O + 2CO2 → 2NaHCO3 + H2SiO3
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами:
Например, кремниевая кислота реагирует с концентрированным гидркосидом калия:
H2SiO3 +4KOH → K2SiO3 + 4H2O
2. При нагревании кремниевая кислота разлагается на оксид и воду:
H2SiO3 → SiO2 + H2O
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
1. Растворение кремния, кремниевой кислоты или оксида в щелочи:
H2SiO3 + 2KOH → K2SiO3 + 2H2O
Si + 2NaOH + H2O → Na2SiO3 + H2
SiO2 + 2KOH → K2SiO3 + H2O
2. Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
K2SiO3 + CaCl2 → CaSiO3 + 2KCl
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
6SiO2 + Na2CO3 + CaCO3 → Na2O·CaO·6SiO2 + 2CO2
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb2+ – хрусталь; Cr3+ – имеет зеленую окраску, Fe3+ – коричневое бутылочное стекло, Co2+ – дает синий цвет, Mn2+ – красновато-лиловый.
Поделиться ссылкой:
chemege.ru
Кремний. Видеоурок. Химия 11 Класс
Тема: Основные металлы и неметаллыУрок: Кремний. Благородные газы
Кремний – один из самых распространённых химических элементов земной коры. Его содержание составляет почти 30%. В природе он в основном встречается в виде различных форм диоксида кремния, силикатов и алюмосиликатов.
Почти во всех своих соединениях кремний четырехвалентен. При этом атомы кремния находятся в возбужденном состоянии. Рис. 1.
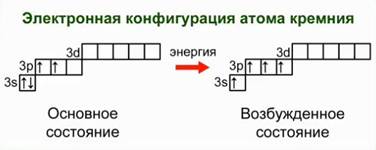
Рис. 1
Для перехода в такое состояние один из 3s-электронов занимает вакантное место на 3р-орбитали. При этом вместо 2-х неспаренных электронов в основном состоянии, у атома кремния в возбуждённом состоянии будет 4 неспаренных электрона. Он сможет образовывать 4 ковалентные связи по обменному механизму.

Рис. 2

Рис. 3
Атомы кремния не склонны к образованию кратных связей, но образуют соединения с одинарными связями -Si-O-. Кремнию, в отличие от углерода, несвойственна аллотропия.
Одной из аллотропных модификаций является кристаллический кремний, в котором каждый атом кремния находится в sp3-гибридизации. Рис. 2, 3. Кристаллический кремний – это твердое, тугоплавкое и прочное кристаллическое вещество темно-серого цвета с металлическим блеском. При обычных условиях – полупроводник. Иногда в качестве еще одной аллотропной модификации кремния выделяют аморфный кремний. Это темно-коричневый порошок, химически более активный, чем кристаллический кремний. Является ли он аллотропной модификацией – вопрос спорный.
Химические свойства кремния
1. Взаимодействие с галогенами
Si + 2F2 → SiF4
2. При нагревании кремний сгорает в кислороде, образуется оксид кремния (IV).
Si + О2 → SiО2
3. При высоких температурах кремний взаимодействует с азотом или углеродом.
3Si + 2N2 → Si3N4
Si + C → SiC
4. С водными растворами кислот кремний не реагирует. Но растворяется в щелочах.
Si + 2NaOH + H2O → Na2SiO3+ 2H2↑
5. При сплавлении кремния с металлами, образуются силициды.
Si + 2Mg → Mg2Si
6. Кремний непосредственно с водородом не взаимодействует, но водородные соединения кремния можно получить при взаимодействии силицидов с водой.
Mg2Si + 4H2O → 2Mg(OH)2 + SiH4↑ (силан)
Силаны по строению подобны алканам, но значительно реакционно способны. Самый стабильный моносилан воспламеняется на воздухе.
SiH4↑ +2 О2 → SiО2 + 2H2О
Получение кремния
Кремний получают восстановлением из оксида кремния (IV)
SiО2 + 2Mg → Si + 2MgO
Одна из задач – это получение высокочистого кремния. Для этого технический кремний переводят в тетрахлорид кремния. Получившийся тетрахлорид восстанавливают до силана, а силан разлагается при нагревании на кремний и водород.
Кремний способен образовывать два оксида: SiО2 – оксид кремния (IV) и SiО – оксид кремния (II).
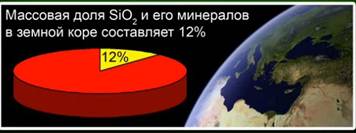
Рис. 4
SiО – оксид кремния (II) – это аморфное темно-коричневое вещество, которое образуется при взаимодействии кремния с оксидом кремния (IV)
Si + SiO2 → 2SiO.
Несмотря на стабильность, это вещество почти не используется.
SiО2 — оксид кремния (IV)

Рис. 5

Рис. 6
На долю этого вещества приходится 12% земной коры. Рис. 4. Он представлен такими минералами, как горный хрусталь, кварц, аметист, цитрин, яшма, халцедон. Рис. 5.
SiО2 – оксид кремния (IV) – вещество немолекулярного строения.
Его кристаллическая решетка – атомная. Рис. 6. Кристаллы SiО2 имеют форму тетраэдра, которые связаны между собой атомами кислорода. Более правильной была бы формула молекулы (SiО2)n. Так как SiО2 образует вещество атомного строения, а СО2 – молекулярного строения, то очевидна разница в их свойствах. СО2 – это газ, а SiО2 – твердое прозрачное кристаллическое вещество, нерастворимое в воде и тугоплавкое.
Химические свойства SiО2
1. Оксид кремния (IV) SiО2 – это кислотный оксид. Он не реагирует с водой. Кремниевую кислоту нельзя получить гидратацией SiО2. Её соли – силикаты – можно получить при взаимодействии SiО2 с горячими растворами щелочей.
SiО2 + 2NaOH  Na2SiO3 + H2O
Na2SiO3 + H2O
2. Реагирует с карбонатами щелочных и щелочноземельных металлов.
CaCO3 + SiО2  CaSiO3 + CO2↑
CaSiO3 + CO2↑
3. Взаимодействует с металлами.
SiО2 + 2Mg → Si + 2MgO
4. Реакция с плавиковой кислотой.
SiО2 + 4HF → SiF4 + 2H2O
SiF4 + 2HF →H2[SiF6]
Химические свойства кремниевой кислоты и силикатов
Получение кремниевой кислоты
Na2SiO3 + 2HCl → H2SiO3↓ + 2NaCl
Кремниевая кислота осаждается в виде полимерного соединения. Формулы для кремниевой кислоты –
H2SiO3 (мета форма) и H4SiO4 (орто форма) – отражают соотношение элементов, но не истинный состав. Условно на плоскости состав кремниевой кислоты изображается как Рис. 7.
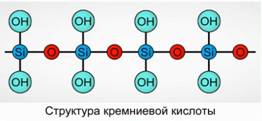
Рис. 7
Для кремниевой кислоты всегда используется формула H2SiO3.
1. H2SiO3 при нагревании разлагается
H2SiO3 H2O + SiO2 (силикагель)
H2O + SiO2 (силикагель)
2. Взаимодействует с растворами щелочей
H2SiО3 + 2NaOH  Na2SiO3 + 2H2O
Na2SiO3 + 2H2O
Соли кремниевой кислоты – силикаты – относятся к ионным соединениям. Это твердые бесцветные вещества. В воде растворимы только силикаты щелочных металлов, кроме лития.
1. Растворимые силикаты подвергаются гидролизу по аниону
Na2SiО3 + H2O ⇆ NaHSiО3 + NaОH
2. Растворимые силикаты взаимодействуют с сильными кислотами
Na2SiO3 + 2HCl → H2SiO3↓ + 2NaCl
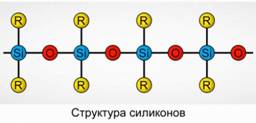
Рис. 8
Полиорганосилоксаны (силиконы)
Полиорганосилоксаны (силиконы) – это кислородсодержащие высокомолекулярные кремнийорганические соединения.
R2[SiO]n
R – органическая группа (метильная, этильная или фенильная). В основе строения силоксанов лежит цепочка из чередующихся атомов кремния и кислорода. Рис.8. Варьируя длину цепочки и органические группы, можно получить силиконы с различными свойствами. Изменяя условия полимеризации, можно получать молекулы разной длины.

Рис. 9

Рис. 10
Полимеры с короткой цепочкой – это жидкости, более длинные – ценные смазочные материалы. Рис. 9, которые сохраняют свои свойства в огромном интервале температур от
– 1000С до + 3000С. Более длинные молекулы образуют каучуки, которые не теряют своей эластичности при низких температурах. Обладают высокой стойкостью к истиранию, химически инертны. Рис. 10. Это обуславливает различные варианты их применения. Они могут использоваться для создания аппаратов искусственного сердца или почки, а могут применяться как подошвы для ботинок. Силоксановые полимеры используются в медицине для создания различных имплантов мягких тканей, поскольку такие полимеры химически инертны и не отторгаются организмом. Они не смачиваются водой. Это используется в кремах. При нанесении такого крема на руки, он заменят собой резиновые перчатки.
Неорганический сад
В прозрачный стакан, заполненный силикатом натрия, опускаем кристаллы окрашенных солей, например, медного купороса. Через некоторое время можно увидеть, что из кристаллов образовались тонкие полые трубки, которые состоят из нерастворимых силикатов. Рис. 11.

Рис. 11
Получение «дурацкой» замазки
Смешиваются равные объёмы силиката натрия и медицинского спирта. Выпавший осадок отфильтровывается и отжимается, чтобы не капал спирт. Это и есть замазка. Рис. 12. Она названа так, потому что планировалось использовать ее как замазку для окон. Но оказалось, что она обладает такими свойствами, что использовать ее по назначению не получилось. Если скатать шарик и бросить на пол, то он отскочит, как каучуковый мячик. Если положить на стол, то растечется, как жидкость. Если ударить твердым предметом, то разлетится, как твёрдое тело. Через некоторое время, когда высохнет спирт, эта замазка просто рассыплется.

Рис. 12
Подведение итога урока
На этом уроке вы изучили тему «Кремний». Рассмотрели сведения о кремнии: его электронное строение, где в природе находится кремний, изучили аллотропию кремния, объяснили его физические и химические свойства. Узнали о том, где в промышленности и других сферах применяется кремний, как его получают. Вы познакомились с диоксидами кремния, кремниевой кислотой и ее солями – силикатами.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Попель П.П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П.П. Попель, Л.С.Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
3. Габриелян О.С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Internerurok.ru (Источник).
2. Hemi.nsu.ru (Источник).
3. Chemport.ru (Источник).
4. Химик.ру (Источник).
Домашнее задание
1. №№2-4 (с. 138) Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Назовите области применения полиорганосилоксанов.
3. Сравните свойства аллотропных модификаций кремния.
interneturok.ru
Кремний химические свойства — Знаешь как
Содержание статьи
Химический знак кремния Si, атомный вес 28,086, заряд ядра +14. Кремний, как и углерод, располагается в главной подгруппе IV группы, в третьем периоде. Это аналог углерода. Электронная конфигурация электронных слоев атома кремния ls22s22p63s23p2. Строение внешнего электронного слоя

Структура внешнего электронного слоя аналогична структуре атома углерода.
Кремний встречается в виде двух аллотропных видоизменений — аморфного и кристаллического.
Аморфный кремний — порошок буроватого цвета, обладающий несколько большей химической активностью, чем кристаллический. При обычной температуре реагирует с фтором:
Si + 2F2 = SiF4 при 400° — с кислородом
Si + O2 = SiO2
в расплавах — с металлами:
2Mg + Si = Mg2Si
Кремний это
Кристаллический кремний — твердое хрупкое вещество с металлическим блеском. Он обладает хорошей тепло- и электропроводностью, легко растворяется в расплавленных металлах, образуя сплавы. Сплав кремния с алюминием называется силумином, сплав кремния с железом — ферросилицием. Плотность кремния 2,4. Температура плавления 1415°, температура кипения 2360°. Кристаллический кремний — вещество довольно инертное и в химические реакции вступает с трудом. С кислотами, несмотря на хорошо заметные металлические свойства, кремний не реагирует, а со щелочами вступает в реакцию, образуя соли кремниевой кислоты и водород:
Si + 2КОН + Н2О = K2SiO2 + 2h3
■ 36. В чем сходство и в чем различие электронных структур атомов кремния и углерода?
37. Как объяснить с точки зрения электронной структуры атома кремния, почему металлические свойства более характерны для кремния, чем для углерода?
38. Перечислите химические свойства кремния. (См. Ответ)
Кремний в природе. Двуокись кремния
В природе кремний распространен очень широко. Примерно 25% земной коры приходится на кремний. Значительная часть природного кремния представлена двуокисью кремния SiO2. В очень чистом кристаллическом состоянии двуокись кремния встречается в виде минерала, называемого горным хрусталем. Двуокись кремния и двуокись углерода по химическому составу являются аналогами, однако двуокись углерода — это газ, а двуокись кремния — твердое вещество. В отличие от молекулярной кристаллической решетки СO2 двуокись кремния SiO2 кристаллизуется в виде атомной кристаллической решетки, каждая ячейка которой представляет собой тетраэдр с атомом кремния в центре и атомами кислорода по углам. Это объясняется тем, что атом кремния имеет больший радиус, чем атом углерода, и вокруг него могут разместиться не 2, а 4 кислородных атома. Различием в строении кристаллической решетки объясняется различие свойств этих веществ. На рис. 69 показаны внешний вид кристалла природного кварца, состоящего из чистой двуокиси кремния, и ее структурная формула.

Рис. 60. Структурная формула двуокиси кремния (а) и кристаллы природного кварца (б)
Кристаллическая двуокись кремния наиболее часто встречается в виде песка, который имеет белый цвет, если не загрязнен глинистыми примесями желтого цвета. Помимо песка, двуокись кремния часто встречается в виде очень твердого минерала — кремния (гидратированная двуокись кремния). Кристаллическая двуокись кремния, окрашенная в различные примеси, образует драгоценные и полудрагоценные камни — агат, аметист, яшму. Почти чистая двуокись кремния встречается также в виде кварца и кварцита. Свободной двуокиси кремния в земной коре 12%, в составе различных горных пород — около 43%. В общей сложности более 50% земной коры состоит из двуокиси кремния.
Кремний входит в состав самых различных горных пород и минералов — глины, гранитов, сиенитов, слюд, полевых шпатов и пр.
Твердая двуокись углерода, не плавясь, возгоняется при —78,5°. Температура плавления двуокиси кремния около 1.713°. Она весьма тугоплавка. Плотность 2,65. Коэффициент расширения двуокиси кремния очень мал. Это имеет очень большое значение при применении посуды из кварцевого стекла. В воде двуокись кремния не растворяется и с ней не реагирует, несмотря на то, что это кислотный окисел и ему соответствует кремниевая кислота h3SiO3. Двуокись углерода в воде, как известно, растворима. С кислотами, кроме плавиковой кислоты HF, двуокись кремния не реагирует, со щелочами дает соли.

Кристаллы природного кварца
Рис. 69. Структурная формула двуокиси кремния (а) и кристаллы природного кварца (б).
При накаливании двуокиси кремния с углем происходит восстановление кремния, а затем его соединение с углеродом и образование карборунда по уравнению:
SiO2 + 2С = SiC + СО2. Карборунд обладает высокой твердостью, к кислотам устойчив, а щелочами разрушается.
■ 39. По каким свойствам двуокиси кремния можно судить о ее кристаллической решетке? (См. Ответ)
40. В виде каких минералов двуокись кремния встречается в природе?
41. Что такое карборунд? (См. Ответ)
Кремниевая кислота. Силикаты
Кремниевая кислота h3SiO3 является кислотой очень слабой и малоустойчивой. При нагревании она постепенно разлагается на воду и двуокись кремния:
h3SiO3 = h3O + SiO2
В воде кремниевая кислота практически нерастворима, но может легко давать коллоидные растворы.
Кремниевая кислота образует соли, которые называются силикатами. Силикаты широко встречаются в природе. Природные силикаты — это довольно сложные вещества. Состав их обычно изображается как соединение нескольких окислов. Если в состав природных силикатов входит окись алюминия, они называются алюмосиликатами. Таковы белая глина, (каолин) Al2O3 · 2SiO2 · 2h3O, полевой шпат К2O · Al2O3 · 6SiO2, слюда
К2O · Al2O3 · 6SiO2 · 2Н2O. Многие природные силикаты в чистом виде являются драгоценными камнями, например аквамарин,топаз, изумруд и др.
Из искусственных силикатов следует отметить силикат натрия Na2SiO3 — один из немногих растворимых в воде силикатов. Его называют растворимым стеклом, а раствор — жидким стеклом.
Силикаты широко применяются в технике. Растворимым стеклом пропитывают ткани и древесину для предохранения их от воспламенения. Жидкое стекло входит в состав огнеупорных замазок для склеивания стекла, фарфора, камня. Силикаты и алюмосиликаты являются основой в производстве стекла, фарфора, фаянса, цемента, бетона, кирпича и различных керамических изделий. В растворе силикаты легко гидролизуются.
■ 42. Что такое алюмосиликаты? Чем они отличаются от силикатов?
43. Что такое жидкое стекло и для каких целей оно применяется? (См. Ответ)
Стекло
Сырьем для производства стекла являются сода Na2CO3, известняк СаСO3 и песок SiO2. Все составные части стеклянной шихты тщательно очищают, смешивают и сплавляют при температуре около 1400°. В процессе сплавления протекают следующие реакции:
Na2CO3 + SiO2= Na2SiO3 + CO2↑
CaCO3 + SiO2 = CaSiO 3+ CO2↑
Фактически в состав стекла входят силикаты натрия и кальция, а также избыток SO2, поэтому состав обычного оконного стекла: Na2O · CaO · 6SiO2. Стеклянную шихту нагревают при температуре 1500° до тех пор, пока полностью не удалится двуокись углерода. Затем стекло охлаждают до температуры 1200°, при которой оно становится вязким. Как всякое аморфное вещество, стекло размягчается и затвердевает постепенно, поэтому оно является хорошим пластическим материалом. Вязкую стеклянную массу пропускают через щель, в результате чего образуется стеклянный лист. Горячий стеклянный лист вытягивают валками, доводя до определенных размеров и постепенно охлаждая током воздуха. Затем его обрезают по краям и разрезают на листы определенного формата.
■ 44. Приведите уравнения реакций, протекающих при получении стекла, и состав оконного стекла. (См. Ответ)
Стекло — вещество аморфное, прозрачное, в воде практически нерастворимо, но если измельчить его в мелкую пыль и смешать с небольшим количеством воды, то в полученной смеси с помощью фенолфталеина можно обнаружить щелочь. При длительном хранении щелочей в стеклянной посуде избыток SiO2 в стекле очень медленно реагирует со щелочью и стекло постепенно утрачивает прозрачность.
Стекло стало известно людям более чем за 3000 лет до нашей эры. В древности получали стекла почти такого же состава, как и в настоящее время, но древние мастера руководствовались лишь собственной интуицией. В 1750 г. М. В. Ломоносов сумел разработать научные основы получения стекла. За 4 года М. В. Ломоносов собрал много рецептов изготовления разных стекол, особенно цветных. На построенной им стекольной фабрике было изготовлено большое количество образцов стекла, которые сохранились до наших дней. В настоящее время используются стекла разного состава, обладающие различными свойствами.
Кварцевое стекло состоит из почти чистой двуокиси кремния и выплавляется из горного хрусталя. Его очень важной особенностью является то, что коэффициент расширения у него незначительный, почти в 15 раз меньше, чем у обычного стекла. Посуду из такого стекла можно раскалить докрасна в пламени горелки и после этого опустить в холодную воду; при этом никаких изменений со стеклом не произойдет. Кварцевое стекло не задерживает ультрафиолетовых лучей, а если окрасить его никелевыми солями в черный цвет, то оно будет задерживать все видимые лучи спектра, но для ультрафиолетовых лучей останется прозрачным.
На кварцевое стекло не действуют кислоты и вода, но щелочи его заметно разъедают. Кварцевое стекло более хрупко, чем обычное. Лабораторное стекло содержит около 70% SiО2, 9% Na2О, 5% К2О 8% СаО, 5% Аl2O3, 3% В2O3 (состав стекол приводится не для запоминания).
В промышленности находят применение стекла иен-ское и пирекс. Иенское стекло содержит около 65% Si02, 15% В2O3, 12% ВаО, 4% ZnO, 4% Аl2O3. Оно прочно, устойчиво к механическим воздействиям, имеет малый коэффициент расширения, устойчиво к щелочам.
Стекло пирекс содержит 81% SiO2, 12% В2O3, 4% Na2O, 2% Аl2O3, 0,5% As2O3, 0,2% К2O, 0,3% СаО. Оно обладает такими же свойствами, как иенское стекло, но в еще большей степени, особенно после закалки, зато менее устойчиво к щелочам. Из стекла пирекс изготовляют предметы домашнего обихода, подвергающиеся нагреванию, а также детали некоторых промышленных установок, работающие при низких и высоких температурах.
Разные качества стеклу придают некоторые добавки. Например, примеси окислов ванадия дают стекло, полностью задерживающее ультрафиолетовые лучи.
Получают также и стекло, окрашенное в различные цвета. Еще М. В. Ломоносов изготовил несколько тысяч образцов цветного стекла разной окраски и оттенков для своих мозаичных картин. В настоящее время методы окраски стекла детально разработаны. Соединения марганца окрашивают стекло в фиолетовый цвет, кобальта — в синий. Золото, распыленное в массе стекла в виде коллоидных частиц, придает ему рубиновую окраску и т. д. Свинцовые соединения придают стеклу блеск, подобный блеску горного хрусталя, поэтому оно называется хрустальным. Такое стекло легко поддается обработке, огранке. Изделия из него очень красиво преломляют свет. При окраске этого стекла различными добавками получается цветное хрустальное стекло.
Если расплавленное стекло смешать с веществами, которые при разложении образуют большое количество газов, то последние, выделяясь, вспенивают стекло, образуя пеностекло. Такое стекло очень легкое, хорошо обрабатывается, является прекрасным электро- и тепло-изолятором. Оно было впервые получено проф. И. И. Китайгородским.
Вытягивая из стекла нити, можно получить так называемое стекловолокно. Если пропитать уложенное слоями стекловолокно синтетическими смолами, то получается очень прочный, не поддающийся гниению, прекрасно обрабатывающийся строительный материал, так называемый стеклотекстолит. Интересно, что чем тоньше стекловолокно, тем выше его прочность. Стекловолокно также применяется для изготовления спецодежды.
Стеклянная вата является ценным материалом, через который можно фильтровать сильные кислоты и щелочи, не фильтрующиеся через бумагу. Кроме того, стеклянная вата является хорошим теплоизолирующим веществом.
■ 44. От чего зависят свойства стекол разных видов? (См. Ответ)
Керамика
Из алюмосиликатов особенно важна белая глина — каолин, являющаяся основой для получения фарфора и фаянса. Производство фарфора — чрезвычайно древняя отрасль хозяйства. Родина фарфора — Китай. В России фарфор был получен впервые в XVIIIв. Д, И. Виноградовым.
Сырьем для получения фарфора и фаянса, помимо каолина, служат песок и вода. Смесь каолина, песка и воды подвергают тщательному тонкому размолу в шаровых мельницах, затем отфильтровывают избыток воды и хорошо вымешанную пластичную массу направляют на формовку изделий. После формовки изделия подвергают сушке и обжигу в туннельных печах непрерывного действия, где их сначала разогревают, затем обжигают и, наконец, охлаждают. После этого изделия проходят дальнейшую обработку — покрытие глазурью, нанесение рисунка керамическими красками. После каждой стадии изделия обжигают. В результате фарфор получается белым, гладким и блестящим. В тонких слоях он просвечивает. Фаянс порист и не просвечивает.
Из красной глины формуют кирпичи, черепицу, глиняную посуду, керамические кольца для насадки в поглотительных и промывных башнях разных химических производств, цветочные горшки. Их также обжигают, чтобы они не размягчались водой, стали механически прочными.
Цемент. Бетон
Соединения кремния служат основой для получения цемента — вяжущего материала, незаменимого в строительстве. Сырьем для получения цемента являются глина и известняк. Эту смесь обжигают в огромной наклонной трубчатой вращающейся печи, куда непрерывно загружают сырье. После обжига при 1200—1300° из отверстия, расположенного на другом конце печи, непрерывно выходит спекшаяся масса — клинкер. После размола клинкер превращается в цемент. В состав цемента входят главным образом силикаты. Если цемент смешать с водой до образования густой кашицы, а затем оставить на некоторое время на воздухе, то вода вступит в реакцию с веществами цемента, образуя кристаллогидраты и другие твердые соединения, что приводит к затвердеванию («схватыванию») цемента. Такой цемент уже не переводится в прежнее состояние, поэтому до употребления цемент стараются беречь от воды. Процесс твердения цемента является длительным, и настоящую прочность он приобретает лишь через месяц. Правда, существуют разные сорта цемента. Рассмотренный нами обычный цемент называется силикатным, или портландцементом. Из глинозема, известняка и двуокиси кремния изготовляют быстро твердеющий глиноземистый цемент.
Если смешать цемент со щебнем или гравием, то получается бетон, являющийся уже самостоятельным строительным материалом. Щебень и гравий называются наполнителями. Бетон обладает высокой прочностью и выдерживает большие нагрузки. Он водостоек, огнестоек. При нагревании почти не теряет прочности, так как теплопроводность его очень мала. Бетон морозостоек, ослабляет радиоактивные излучения, поэтому его используют как строительный материал для гидротехнических сооружений, для защитных оболочек ядерных реакторов. Бетоном обмуровывают котлы. Если смешать цемент с пенообразователем, то образуется пронизанный множеством ячеек пенобетон. Такой бетон является хорошим звукоизолятором и еще меньше, чем обычный бетон, проводит тепло.
Если бетоном залить стальной каркас, то получится железобетон. Каркас называется арматурой. Из железобетона изготовляют блоки и панели для домостроения, трубы, мосты, перекрытия, шпалы.
■ 46. Составьте и заполните следующую таблицу. (См. Ответ)
Статья на тему Кремний химические свойства
znaesh-kak.com
Кремний, подготовка к ЕГЭ по химии
Кремний — неметаллический элемент IVa группы периодической таблицы Д.И. Менделеева. Второй после кислород элемент по распространенности в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема — SiO2 — песок, песчаник, кварц, глина.

Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем вы думаете: внутри гаджета, которым вы пользуетесь 😉

Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.

Природные соединения
В природе кремний встречается в виде следующих соединений:
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe3+ — цитрин
- SiO2 с примесью Fe2+ и Fe3+ — аметист

Получение
В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
SiO2 + C → (t) Si + CO2↑
SiO2 + Al → (t) Si+ Al2O3
В лабораторных условиях мелкий белый песок прокаливают с магнием:
SiO2 + Mg → (t) MgO + Si
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Реакция с щелочами
При обычных условиях без нагревания кремний реагирует только со фтором.
Si + F2 → SiF4
При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний с кислородом образует оксид кремния II — несолеобразующий оксид.
Si + Cl2 → (t) SiCl4
Si + C → (t) SiC
Si + O2 → (t) SiO2
Si + O2 → (t = 1200 °C) SiO

В подобных реакциях кремния проявляет свои окислительные способности.
Ca + Si → Ca2Si (силицид кальция)
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи.
KOH + Si → K2SiO3 + H2↑
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре +1730 °C градусов.
Получение
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
Si + O2 → SiO2
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2, который выпадает в осадок, и воду.
Na2SiO3 + CH3COOH → CH3COONa + H2SiO3↓
H2SiO3 → SiO2 + H2O

Химические свойства
- Реакции с кислотами
- Реакции с основными оксидами и щелочами
- С карбонатами
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью).
SiO2 + HF → SiF4 + H2O
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли данной кислоты — силикаты.
MgO + SiO2 → MgSiO3
NaOH + SiO2 → Na2SiO3 + H2O

Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами.
K2CO3 + SiO2 → K2SiO3 + CO2↑
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название — силикаты.
Получение
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии через ее соли — силикаты.
LiOH + SiO2 → Li2SiO3 + H2O
Li2SiO3 + HCl → LiCl + H2SiO3↓
Химические свойства
Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
H2SiO3 → H2O + SiO2

©Беллевич Юрий Сергеевич
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
studarium.ru
Кремниевая кислота и её соли » HimEge.ru
Кремниевые кислоты – соединения оксида кремния с водой, очень слабые нерастворимые кислоты. Соотношение оксида кремния и воды различно, общая формула nSiO2·mH2O, кислоты легко переходят друг в друга.
В водных растворах доказано существование ортокремниевой H4SiO4, пирокремниевой H6Si2O7, метакремниевой H2SiO3 и дикремниевой H2Si2O5 кислот.
H2SiO3 — очень слабая (слабее угольной), непрочная, в воде малорастворима (образует коллоидный раствор).
Получение кремниевой кислоты:
Na2SiO3 + 2HCl → 2NaCl + H2SiO3
При нагревании разлагается:
H2SiO3 –t°→ H2O + SiO2
Соли кремниевой кислоты – силикаты. Обычно они нерастворимы в воде, исключения составляют силикаты натрия и калия, их называют «жидким стеклом». Силикаты широко распространены в природе. Свойства силикатов различны в зависимости от их состава и строения, очень часто они имеют красивую окраску, некоторые из них используются в ювелирном деле (гранат, топаз, изумруд).
Гранат — общая формула: R2+3 R3+2 [SiO4]3, где R2+ — Mg, Fe, Mn, Ca; R3+ — Al, Fe, Cr
Топаз — Al2[SiO4](F, OH)2 + примеси Fe2+, Fe3+, Ti, Cr, V и др
Изумруд — Be3Al2Si6O18 + примеси Fe2O3, V2O3, Cr2O3
Состав обычного оконного стекла: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
6SiO2 + Na2CO3 + CaCO3 → Na2O·CaO·6SiO2 + 2CO2
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы:
Pb2+ – хрусталь;
Cr3+ – имеет зеленую окраску,
Fe3+ – коричневое бутылочное стекло,
Co2+ – дает синий цвет,
Mn2+ – красновато–лиловый
himege.ru