Реакции, взаимодействие натрия. Уравнения реакции натрия с веществами
Реакции, взаимодействие натрия. Уравнения реакции натрия с веществами.
Натрий реагирует, взаимодействует с неметаллами, металлами, полуметаллами, оксидами, кислотами, гидроксидами, солями, органическими соединениями и пр. веществами.
Реакции, взаимодействие натрия с неметаллами
Реакции, взаимодействие натрия с металлами и полуметаллами
Реакции, взаимодействие натрия с оксидами
Реакции, взаимодействие натрия с гидроксидами
Реакции, взаимодействие натрия с солями
Реакции, взаимодействие натрия с кислотами
Реакции, взаимодействие натрия с водородосодержащими соединениями
Реакции, взаимодействие натрия с органическими соединениями
Реакции, взаимодействие натрия с неметаллами. Уравнения реакции:
1. Реакция взаимодействия натрия и кислорода:
2Na + O2 → Na2O2 (t = 250-400 °C).
Реакция взаимодействия натрия и кислорода происходит с образованием пероксида натрия. Реакция представляет собой сжигание натрия на воздухе. В ходе реакции также образуется примесь – оксид натрия Na
2. Реакция взаимодействия натрия и селена:
2Na + Se → Na2Se (t > 130 °C).
Реакция взаимодействия натрия и селена происходит с образованием селенида натрия.
3. Реакция взаимодействия натрия и углерода:
2Na + 2C → Na2C2 (t = 150-200 °C).
Реакция взаимодействия натрия и углерода происходит с образованием ацетиленида натрия.
4. Реакция взаимодействия натрия и кремния:
Si + Na → NaSi (t°).
Реакция взаимодействия кремния и натрия происходит с образованием силицида натрия. Реакция протекает при сплавлении реакционной смеси.
5. Реакция взаимодействия натрия и красного фосфора:
3Na + P → Na3P (t = 200 °C).
Реакция взаимодействия натрия и красного фосфора происходит с образованием фосфида тринатрия. Реакция протекает в атмосфере аргона.
6. Реакция взаимодействия натрия и хлора:
2Na + Cl2 → 2NaCl.
Реакция взаимодействия натрия и хлора происходит с образованием хлорида натрия. Реакция протекает при комнатной температуре.
7. Реакция взаимодействия натрия и водорода:
2Na + H2 → 2NaH (t = 300 °C).
Реакция взаимодействия натрия и водорода происходит с образованием гидрида натрия.
8. Реакция взаимодействия натрия и брома:
2Na + Br2 → 2NaBr (t = 150-250 °C).
Реакция взаимодействия натрия и брома происходит с образованием бромида натрия.
9. Реакция взаимодействия натрия и иода:
I2 + 2Na → 2NaI (t = 100 °C).
Реакция взаимодействия йода и натрия происходит с образованием иодида натрия.
10. Реакция взаимодействия натрия и фтора:
F2
Реакция взаимодействия фтора и натрия происходит с образованием фторида натрия. Реакция протекает при комнатной температуре.
11. Реакция взаимодействия натрия, кислорода и воды:
4Na + O2 + 2H2O → 4NaOH.
Реакция взаимодействия натрия, кислорода и воды происходит с образованием гидроксида натрия.
12. Реакция взаимодействия натрия, бора и водорода:
Na + B + 2H2 → Na[BH4] (t°).
Реакция взаимодействия натрия, бора и водорода происходит с образованием тетрагидридобората (III) водорода. Реакция протекает при кипении в диоксане.
Аналогичным образом натрий вступает в реакции и с другими неметаллами: мышьяком, серой, азотом.
Реакции, взаимодействие натрия с металлами и полуметаллами. Уравнения реакции:
1. Реакция взаимодействия натрия и свинца:
4Na + 9Pb → Na4Pb9.
Реакция взаимодействия натрия и свинца происходит с образованием металлида натрия/свинца. Реакция протекает в жидком аммиаке.
2. Реакция взаимодействия натрия и сурьмы:
3Na + 7Sb → Na3Sb7.
Реакция взаимодействия натрия и сурьмы происходит с образованием металлида натрия/сурьмы. Реакция протекает в жидком аммиаке.
3. Реакция взаимодействия натрия и висмута:
3Na + 7Bi → Na3Bi7.
Реакция взаимодействия натрия и висмута происходит с образованием металлида натрия/висмута. Реакция протекает в жидком аммиаке.
4. Реакция взаимодействия натрия и теллура:
2Na + Te → Na2Te (t = 130°C).
Реакция взаимодействия натрия и теллура происходит с образованием теллурида натрия.
5. Реакция взаимодействия натрия, алюминия и водорода:
Na + Al + 2H2 → Na[AlH4] (t = 140 °C, p = 350 атм.).
Реакция взаимодействия натрия, алюминия и водорода происходит с образованием тетрагидридоалюмината (III) натрия. Реакцию проводят в тетрагидрофуранена на протяжении 3-х часов. Данная реакция представляет собой метод промышленного многотоннажного производства тетрагидридоалюмината (III) натрия.
6. Взаимодействие натрия и ртути:
Натрий с ртутью образует амальгаму натрия.
7. Взаимодействие натрия и калия:
При сплавлении натрия и калия образуется жидкий натрий-калиевый сплав – NaK.
Реакции, взаимодействие натрия с оксидами. Уравнения реакции:
1. Реакция взаимодействия натрия и оксида азота (IV):
2NO2 + Na → NO + NaNO3
Реакция взаимодействия оксида азота (IV) и натрия происходит с образованием оксида азота (II) и нитрата натрия. В ходе реакции используется жидкий оксид азота (IV).
2. Реакция взаимодействия натрия и оксида азота (V):
N2O5 + Na → NaNO3 + NO2.
Реакция взаимодействия натрия и оксида азота (V) происходит с образованием нитрата натрия и оксида азота.
3. Реакция взаимодействия натрия и воды:
2Na + 2H2O → 2NaOH + H2.
Реакция взаимодействия натрия и воды происходит с образованием гидроксида натрия и водорода. Реакция протекает бурно.
4. Реакция взаимодействия натрия и оксида фосфора (V):
3P4O10 + 16Na → 10NaPO3 + 2Na3P (t = 300-400 °C).
Реакция взаимодействия оксида фосфора (V) и натрия происходит с образованием метафосфата натрия и фосфида натрия.
5. Реакция взаимодействия натрия, оксида бора и водорода:
2Na + B2O3 + 7H2 → 2Na[BH4] + 3H2O (t = 250-300 °C).
Реакция взаимодействия натрия, оксида бора и водорода происходит с образованием тетрагидридобората (III) водорода и воды.
Реакции, взаимодействие натрия с гидроксидами. Уравнения реакции:
1. Реакция взаимодействия натрия и гидроксида калия:
KOH + Na → NaOH + K (t = 380-450 °C).
Реакция взаимодействия гидроксида калия и натрия происходит с образованием гидроксида натрия и калия.
2. Реакция взаимодействия натрия и гидроксида натрия:
2Na + 2NaOH → 2Na2O + H2 (t = 600 °C).
Реакция взаимодействия натрия и гидроксида натрия происходит с образованием оксида натрия и водорода.
Реакции, взаимодействие натрия с солями. Уравнения реакции:
1. Реакция взаимодействия натрия и хлорида калия:
KCl + Na → K + NaCl (t = 760-890 °C).
Реакция взаимодействия хлорида калия и натрия происходит с образованием калия и хлорида натрия. В ходе реакции газообразным натрием воздействуют на расплав хлорида калия.
2. Реакция взаимодействия хлорида циркония (IV) и натрия:
ZrCl4 + 4Na → Zr + 4NaCl (t = 500 °C).
Реакция взаимодействия хлорида циркония (IV) и натрия происходит с образованием циркония и хлорида натрия. Реакция протекает в вакууме.
3. Реакция взаимодействия хлорида титана (IV) и натрия:
TiCl4 + 4Na → Ti + 4NaCl (t°).
Реакция взаимодействия хлорида титана (IV) и натрия происходит с образованием титана и хлорида натрия.
4. Реакция взаимодействия натрия и додекакарбонилтрижелеза:
[Fe3(CO)12] + 6Na → 3Na2[Fe(CO)4] (t = -40°C).
Реакция взаимодействия додекакарбонилтрижелеза и натрия происходит с образованием тетракарбонилферрата натрия. Реакция протекает в жидком аммиаке.
5. Реакция взаимодействия натрия и фторида кремния (IV):
SiF4 + 4Na → Si + 4NaF (t = 500°C).
Реакция взаимодействия фторида кремния (IV) и натрия происходит с образованием кремния и фторида натрия.
Реакции, взаимодействие натрия с кислотами. Уравнения реакции:
1. Реакция взаимодействия натрия и ортофосфорной кислоты:
6Na + 2H₃PO₄ → 2Na₃PO₄ + 3H₂
Реакция взаимодействия натрия и ортофосфорной кислоты происходит с образованием ортофосфата натрия и водорода.
2. Реакция взаимодействия натрия и азотной кислоты:
11Na + 14HNO3 → 11NaNO3 + NO + N2O + 7H2O.
Реакция взаимодействия натрия и азотной кислоты происходит с образованием нитрата натрия, оксида азота (II), оксида азота (I) и воды. В ходе реакции используется 20%-й раствор азотной кислоты.
Аналогичные реакции протекают и с другими минеральными кислотами.
Реакции, взаимодействие натрия с водородосодержащими соединениями. Уравнения реакции:
1. Реакция взаимодействия натрия и сероводорода:
2Na + 2H2S → 2NaHS + H2.
Реакция взаимодействия натрия и сероводорода происходит с образованием гидросульфида натрия и водорода. Реакция протекает в бензоле.
Аналогичные реакции протекают и с другими водородосодержащими соединениями: хлороводородом, селеноводородом.
Реакции, взаимодействие натрия с органическими соединениями. Уравнения реакции:
1. Реакция взаимодействия натрия и этанола:
2Na + 2C2H5OH → C2H5ONa + H2.
Реакция взаимодействия натрия и этанола происходит с образованием этанолята натрия и водорода. Реакция протекает при комнатной температуре.
2. Реакция взаимодействия натрия с другими органическими соединениями:
Натрий реагирует также со спиртами, фенолами, карбоновыми кислотами с образованием солей.
Примечание: © Фото https://www.pexels.com, https://pixabay.com




карта сайта
Коэффициент востребованности 757
Натрий » HimEge.ru
Натрий — элемент 3-го периода и IA-группы Периодической системы, порядковый номер 11. Электронная формула атома [10Ne]3s1, степени окисления +1 и 0. Имеет малую электроотрицательность (0,93), проявляет только металлические (основные) свойства. Образует (как катион) многочисленные соли и бинарные соединения. Почти все соли натрия хорошо растворимы в воде.
В природе — пятый по химической распространенности элемент (второй среди
металлов), встречается только в виде соединений. Жизненно важный элемент для всех организмов.
Натрий, катион натрия и его соединения окрашивают пламя газовой горелки в ярко-желтый цвет (качественное обнаружение).
Натрий Na. Серебристо-белый металл, легкий, мягкий (режется ножом), низкоплавкий. Хранят натрий в керосине. С ртутью образует жидкий сплав — амальгаму (до 0,2 % Na).
Весьма реакционноспособный, во влажном воздухе натрий медленно покрывается гидроксидной пленкой и теряет блеск (тускнеет):
Натрий химически активен, сильный восстановитель. Воспламеняется на воздухе при умеренном нагревании (>250 °С), реагирует с неметаллами:
2Na + O2 = Na2O2 2Na + h3 = 2NaH
2Na + CI2 = 2NaCl 2Na + S = Na2S
6Na + N2 = 2Na3N 2Na + 2C = Na2C2
Очень бурно и с большим экзо-эффектом натрий реагирует с водой:
2Na + 2h3O = 2NaOH + Н2^ + 368 кДж
От теплоты реакции кусочки натрия расплавляются в шарики, которые начинают беспорядочно двигаться из-за выделения Н2. Реакция сопровождается резкими щелчками вследствие взрывов гремучего газа (Н2 + O2). Раствор окрашивается фенолфталеином в малиновый цвет (щелочная среда).
В ряду напряжений натрий стоит значительно левее водорода, из разбавленных кислот НС1 и H2SO4 вытесняет водород (за счет Н20 и Н ).
Получение натрия в промышленности:
(см. также ниже получение NaOH).
Натрий применяется для получения Na2O2, NaOH, NaH, а также в органическом синтезе. Расплавленный натрий служит теплоносителем в ядерных реакторах, а газообразный — используется как наполнитель желтосветных ламп наружного освещения.
Оксид натрия Na2O. Основный оксид. Белый, имеет ионное строение (Na+)2O2-. Термически устойчивый, при прокаливании медленно разлагается, плавится под избыточным давлением пара Na. Чувствителен к влаге и углекислому газу в воздухе. Энергично реагирует с водой (образуется сильнощелочной раствор), кислотами, кислотными и амфотерными оксидами, кислородом (под давлением). Применяется для синтеза солей натрия. Не образуется при сжигании натрия на воздухе.
Уравнения важнейших реакций:
Получение: термическое разложение Na2O2 (см.), а также сплавление Na и NaOH, Na и Na2O2:
2Na + 2NaOH = 2NaаO + h3 (600 °C)
2Na + Na2O2 = 2NaаO (130-200 °C)
Пероксид натрия Na2O2. Бинарное соединение. Белый, гигроскопичный. Имеет ионное строение (Na+)2O22-. При нагревании разлагается, плавится под избыточным давлением О2. Поглощает углекислый газ из воздуха. Полностью разлагается водой, кислотами (выделение О2 при кипячении — качественная реакция на пероксиды). Сильный окислитель, слабый восстановитель. Применяется для регенерации кислорода в изолирующих дыхательных приборах (реакция с СО2), как компонент отбеливателей ткани и бумаги. Уравнения важнейших реакций:
Получение: сжигание Na на воздухе.
Гидроксид натрия NaOH. Основный гидроксид, щелочь, техническое название едкий натр. Белые кристаллы с ионным строением (Na+)(OH—). Расплывается на воздухе, поглощая влагу и углекислый газ (образуется NaHCО3). Плавится и кипит без разложения. Вызывает тяжелые ожоги кожи и глаз.
Хорошо растворим в воде (с экзо-эффектом, +56 кДж). Реагирует с кислотными оксидами, нейтрализует кислоты, вызывает кислотную функцию у амфотерных оксидов и гидроксидов:
Раствор NaOH разъедает стекло (образуется NaSiО3), корродирует поверхность алюминия (образуются Na[Al(OH)4] и Н2).
Получение NaOH в промышленности:
а) электролиз раствора NaCl на инертном катоде
б) электролиз раствора NaCl на ртутном катоде (амальгамный способ):
(освобождающуюся ртуть возвращают в электролизер).
Едкий натр — важнейшее сырье химической промышленности. Используется для получения солей натрия, целлюлозы, мыла, красителей и искусственного волокна; как осушитель газов; реагент в извлечении из вторичного сырья и очистке олова и цинка; при переработке руд алюминия (бокситов).
Химические свойства натрия: взаимодействие с неметаллами, водой
Билет № 22
1. Натрий: положение этого химического элемента в периодической системе, строение его атома, физические свойства. Химические свойства натрия: взаимодействие с неметаллами, водой
Положение в периодической системе: натрий находится в 3 периоде, I группе, главной (А) подгруппе.
Атомный номер натрия 11, следовательно, заряд атома натрия равен + 11, число электронов 11. Три электронных уровня (равно периоду), на внешнем уровне 1 электрон (равно номеру группы для главных подгрупп).
Схема расположения электронов по уровням:
11Na ) ) )
2 8 1
Ядро атома натрия 23Na содержит 11 протонов (равно заряду ядра) и 12 нейтронов (атомная масса минус число протонов: 23 − 11 = 12).
Простое вещество натрий — металл серебристо-белого цвета, легкий (плотность 0,97 г/см3 — легче воды), мягкий (легко режется ножом), легкоплавкий (температура плавления 98° C).
Натрий, как и все щелочные металлы, — сильный восстановитель. Он энергично реагирует с неметаллами:
- При нагревании до 180° С в умеренном количестве кислорода образуется оксид натрия:
4Na + O2 = 2Na2O - Натрий горит на воздухе с образованием пероксида натрия:
2Na + O2 = Na2O2
Натрий хранят под слоем керосина. - Расплавленный натрий в хлоре сгорает с ослепительной вспышкой (можно говорить проще — реагирует с хлором при нагревании), на стенках сосуда образуется белый налет хлорида натрия:
2Na + Cl2 = 2NaClНатрий может взрываться при растирании с порошком серы (образуется сульфид натрия):
2Na + S = Na2SНатрий при нагревании восстанавливает водород, образуется гидрид натрия:
2Na + H2 = 2NaH
Если небольшой кусочек натрия поместить в воду, он бурно реагирует с водой. Металл плавится от выделяющейся теплоты и «бегает» по поверхности воды. Образуется раствор гидроксида натрия:
2Na + 2HOH = 2NaOH + H2↑
Натрий в природе содержится в различных минералах, в виде соли в морской воде. В человеческом организме соли натрия входят в состав плазмы крови, лимфу.
Применяется в атомной энергетике (в качестве теплоносителя) и в виде соединений (поваренной соли NaCl, соды Na2CO3 и др.)
2. Опыт. Осуществление превращения: соль → нерастворимое основание → оксид металла
Для получения нерастворимого основания, к раствору соли добавляем гидроксид натрия. Полученный осадок нагреваем на спиртовке, он разлагается с образованием оксида.
Лучше взять сульфат или хлорид меди (II):
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Выпадает синий осадок гидроксида меди (II). При нагревании осадок чернеет в результате образования черного оксида меди (II):
Cu(OH)2 = CuO + H2O
автор: Владимир Соколов
Гидроксид натрия — Википедия
Гидрокси́д на́трия (лат. Nátrii hydroxídum; другие названия — каустическая сода, едкий натр) — самая распространённая щёлочь, химическая формула NaOH. В год в мире производится и потребляется около 57 миллионов тонн едкого натра.
Интересна история тривиальных названий как гидроксида натрия, так и других щелочей. Название «едкая щёлочь» обусловлено свойством разъедать кожу (вызывая сильные ожоги), бумагу и другие органические вещества. До XVII века щёлочью (фр. alkali) называли также карбонаты натрия и калия. В 1736 году французский учёный Анри Дюамель дю Монсо впервые различил эти вещества: гидроксид натрия стали называть каустической содой, карбонат натрия — кальцинированной содой, а карбонат калия — поташом. В настоящее время содой принято называть натриевые соли угольной кислоты. В английском и французском языках слово sodium означает натрий, potassium — калий.
Гидроксид натрия — белое твёрдое вещество. Сильно гигроскопичен, на воздухе «расплывается», активно поглощая пары воды из воздуха. Хорошо растворяется в воде, при этом выделяется большое количество теплоты. Раствор едкого натра мылок на ощупь.
Термодинамика растворов
ΔH0 растворения для бесконечно разбавленного водного раствора −44,45 кДж/моль.
Из водных растворов при +12,3…+61,8 °C кристаллизуется моногидрат (ромбическая сингония), температура плавления +65,1 °C; плотность 1,829 г/см³; ΔH0обр −425,6 кДж/моль), в интервале от −28 до −24 °C — гептагидрат, от −24 до −17,7 °C — пентагидрат, от −17,7 до −5,4 °C — тетрагидрат (α-модификация). Растворимость в метаноле 23,6 г/л (t = +28 °C), в этаноле 14,7 г/л (t = +28 °C). NaOH·3,5Н2О (температура плавления +15,5 °C).
Гидроксид натрия (едкая щёлочь) — сильное химическое основание (к сильным основаниям относят гидроксиды, молекулы которых полностью диссоциируют в воде), к ним относят гидроксиды щелочных и щёлочноземельных металлов подгрупп Iа и IIа периодической системы Д. И. Менделеева, KOH (едкое кали), Ba(OH)2 (едкий барит), LiOH, RbOH, CsOH, а также гидроксид одновалентного таллия TlOH. Щёлочность (основность) определяется валентностью металла, радиусом внешней электронной оболочки и электрохимической активностью: чем больше радиус электронной оболочки (увеличивается с порядковым номером), тем легче металл отдаёт электроны, и тем выше его электрохимическая активность и тем левее располагается элемент в электрохимическом ряду активности металлов, в котором за ноль принята активность водорода.

Водные растворы NaOH имеют сильную щелочную реакцию (pH 1%-раствора = 13,4). Основными методами определения щелочей в растворах являются реакции на гидроксид-ион (OH−), (c фенолфталеином — малиновое окрашивание и метиловым оранжевым (метилоранжем) — жёлтое окрашивание). Чем больше гидроксид-ионов находится в растворе, тем сильнее щёлочь и тем интенсивнее окраска индикатора.
Гидроксид натрия вступает в следующие реакции:
- с кислотами, амфотерными оксидами и гидроксидами
- NaOH+HCl→NaCl+h3O{\displaystyle {\mathsf {NaOH+HCl\rightarrow NaCl+H_{2}O}}}
- NaOH+h3S→NaHS+h3O{\displaystyle {\mathsf {NaOH+H_{2}S\rightarrow NaHS+H_{2}O}}} (кислая соль, при отношении 1:1)
- 2NaOH+h3S→Na2S+2h3O{\displaystyle {\mathsf {2NaOH+H_{2}S\rightarrow Na_{2}S+2H_{2}O}}} (в избытке NaOH)
Общая реакция в ионном виде:
- OH−+H+→h3O{\displaystyle {\mathsf {OH^{-}+H^{+}\rightarrow H_{2}O}}}
- с амфотерными оксидами которые обладают как основными, так и кислотными свойствами, и способностью реагировать с щелочами, как с твёрдыми при сплавлении:
- 2NaOH+ZnO →500−600oC Na2ZnO2+h3O{\displaystyle {\mathsf {2NaOH+ZnO\ {\xrightarrow[{}]{500-600^{o}C}}\ Na_{2}ZnO_{2}+H_{2}O}}}
- 2NaOH+ZnO+h3O→Na2[Zn(OH)4]{\displaystyle {\mathsf {2NaOH+ZnO+H_{2}O\rightarrow Na_{2}[Zn(OH)_{4}]}}} — в растворе
- с амфотерными гидроксидами
- NaOH+Al(OH)3 →1000oC NaAlO2+2h3O{\displaystyle {\mathsf {NaOH+Al(OH)_{3}\ {\xrightarrow {1000^{o}C}}\ NaAlO_{2}+2H_{2}O}}} — при сплавлении
- 3NaOH+Al(OH)3→Na3[Al(OH)6]{\displaystyle {\mathsf {3NaOH+Al(OH)_{3}\rightarrow Na_{3}[Al(OH)_{6}]}}} — в растворе
- с солями в растворе:
- 2NaOH+CuSO4→Cu(OH)2↓+Na2SO4{\displaystyle {\mathsf {2NaOH+CuSO_{4}\rightarrow Cu(OH)_{2}\!\downarrow +Na_{2}SO_{4}}}}
Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия, действуя гидроксидом натрия на сульфат алюминия в водном растворе, при этом избегая избытка щёлочи и растворения осадка. Его и используют, в частности, для очистки воды от мелких взвесей.
- c неметаллами:
например, с фосфором — с образованием гипофосфита натрия:
- 4P+3NaOH+3h3O→Ph4↑+3Nah3PO2{\displaystyle {\mathsf {4P+3NaOH+3H_{2}O\rightarrow PH_{3}\!\uparrow +3NaH_{2}PO_{2}}}}
с серой:
- 3S+6NaOH→2Na2S+Na2SO3+3h3O{\displaystyle {\mathsf {3S+6NaOH\rightarrow 2Na_{2}S+Na_{2}SO_{3}+3H_{2}O}}}
- с галогенами
- 2NaOH+Cl2→NaClO+NaCl+h3O{\displaystyle {\mathsf {2NaOH+Cl_{2}\rightarrow NaClO+NaCl+H_{2}O}}} (дисмутация хлора в разбавленном растворе при комнатной температуре)
- 6NaOH+3Cl2→NaClO3+5NaCl+3h3O{\displaystyle {\mathsf {6NaOH+3Cl_{2}\rightarrow NaClO_{3}+5NaCl+3H_{2}O}}} (дисмутация хлора при нагревании в концентрированном растворе)
- с металлами
Гидроксид натрия вступает в реакцию с алюминием, цинком, титаном. Он не реагирует с железом и медью (металлами, которые имеют низкий электрохимический потенциал). Алюминий легко растворяется в едкой щёлочи с образованием хорошо растворимого комплекса — тетрагидроксоалюмината натрия и водорода:
- 2Al+2NaOH+6h3O→2Na[Al(OH)4]+3h3↑{\displaystyle {\mathsf {2Al+2NaOH+6H_{2}O\rightarrow 2Na[Al(OH)_{4}]+3H_{2}\!\uparrow }}}
Эта реакция использовалась в первой половине XX века в воздухоплавании: для заполнения водородом аэростатов и дирижаблей в полевых (в том числе боевых) условиях, так как данная реакция не требует источников электроэнергии, а исходные реагенты для неё могут легко транспортироваться.
- с эфирами, амидами и алкилгалогенидами (гидролиз):
с жирами (омыление) такая реакция необратима, так как получающаяся кислота со щёлочью образует мыло и глицерин. Глицерин впоследствии извлекается из подмыльных щёлоков путём вакуум-выпарки и дополнительной дистилляционной очистки полученных продуктов. Этот способ получения мыла был известен на Ближнем Востоке с VII века.
В результате взаимодействия жиров с гидроксидом натрия получают твёрдые мыла (они используются для производства кускового мыла), а с гидроксидом калия либо твёрдые, либо жидкие мыла в зависимости от состава жира.
- с многоатомными спиртами — с образованием алкоголятов:
- HOCh3Ch3OH+2NaOH→NaOCh3Ch3ONa+2h3O{\displaystyle {\mathsf {HOCH_{2}CH_{2}OH+2NaOH\rightarrow NaOCH_{2}CH_{2}ONa+2H_{2}O}}}
Качественное определение ионов натрия[править | править код]
 Атомы натрия придают пламени жёлтое свечение.
Атомы натрия придают пламени жёлтое свечение.- По цвету пламени горелки — атомы натрия придают пламени жёлтую окраску
- С использованием специфических реакций на ионы натрия
| Реагент | Фторид аммония | Нитрит цезия-калия-висмута | Ацетат магния | Ацетат цинка | Пикро- лоновая кислота | Диокси- винная кислота | Бромбензол- сульфокислота | Ацетат уранила-цинка |
|---|---|---|---|---|---|---|---|---|
| Цвет осадка | белый | бледно-жёлтый | жёлто-зелёный | жёлто-зелёный | белый | белый | бледно-жёлтый | зеленовато-жёлтый |
Гидроксид натрия может получаться в промышленности химическими и электрохимическими методами.
Химические методы получения гидроксида натрия[править | править код]
К химическим методам получения гидроксида натрия относятся пиролитический, известковый и ферритный.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество энергоносителей, получаемый едкий натр сильно загрязнён примесями.
В настоящее время эти методы почти полностью вытеснены электрохимическими методами производства.
Пиролитический метод[править | править код]
Пиролитический метод получения гидроксида натрия является наиболее древним и начинается с получения оксида натрия Na2О путём прокаливания карбоната натрия (например, в муфельной печи). В качестве сырья может быть использован и гидрокарбонат натрия, разлагающийся при нагревании на карбонат натрия, углекислый газ и воду:
- 2NaHCO3 →250oC Na2CO3+CO2↑+ h3O{\displaystyle {\mathsf {2NaHCO_{3}\ {\xrightarrow {250^{o}C}}\ Na_{2}CO_{3}+CO_{2}\!\uparrow +\ H_{2}O}}}
- Na2CO3 →1000oC Na2O+CO2↑{\displaystyle {\mathsf {Na_{2}CO_{3}\ {\xrightarrow {1000^{o}C}}\ Na_{2}O+CO_{2}\!\uparrow }}}
Полученный оксид натрия охлаждают и очень осторожно (реакция происходит с выделением большого количества тепла) добавляют в воду:
- Na2O+h3O→2NaOH{\displaystyle {\mathsf {Na_{2}O+H_{2}O\rightarrow 2NaOH}}}
Известковый метод[править | править код]
Известковый метод получения гидроксида натрия заключается во взаимодействии раствора соды с гашеной известью при температуре около 80 °С. Этот процесс называется каустификацией и проходит по реакции:
- Na2CO3+Ca(OH)2→2NaOH+CaCO3↓{\displaystyle {\mathsf {Na_{2}CO_{3}+Ca(OH)_{2}\rightarrow 2NaOH+CaCO_{3}\!\downarrow }}}
В результате реакции получается раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора фильтрацией, затем раствор упаривается до получения расплавленного продукта, содержащего около 92 % масс. NaOH. Затем NaOH плавят и разливают в железные барабаны, где он кристаллизуется.
Ферритный метод[править | править код]
Ферритный метод получения гидроксида натрия состоит из двух этапов:
- Na2CO3+Fe2O3→850oC2NaFeO2+CO2↑{\displaystyle {\mathsf {Na_{2}CO_{3}+Fe_{2}O_{3}{\xrightarrow {850^{o}C}}2NaFeO_{2}+CO_{2}\!\uparrow }}}
- 2NaFeO2+2h3O →H+ 2NaOH+Fe2O3⋅h3O↓{\displaystyle {\mathsf {2NaFeO_{2}+2H_{2}O\ {\xrightarrow {H^{+}}}\ 2NaOH+Fe_{2}O_{3}\cdot H_{2}O\!\downarrow }}}
Первая реакция представляет собой процесс спекания кальцинированной соды с окисью железа при температуре 800 – 900°С. При этом образуется спек — феррит натрия и выделяется двуокись углерода. Далее спёк обрабатывают (выщелачивают) водой по второй реакции; получается раствор гидроксида натрия и осадок Fe2O3⋅{\displaystyle \cdot }nH2О, который после отделения его от раствора возвращается в процесс. Получаемый раствор щёлочи содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % масс. NaOH, а затем получают твёрдый продукт в виде гранул или хлопьев.
Электрохимические методы получения гидроксида натрия[править | править код]
Способ основан на электролизе растворов галита (минерала, состоящего в основном из поваренной соли NaCl) с одновременным получением водорода и хлора. Этот процесс можно представить суммарной формулой:
- 2NaCl+2h3O→h3↑+Cl2↑+2NaOH{\displaystyle {\mathsf {2NaCl+2H_{2}O\rightarrow H_{2}\!\uparrow +Cl_{2}\!\uparrow +2NaOH}}}
Едкая щёлочь и хлор вырабатываются тремя электрохимическими методами. Два из них — электролиз с твёрдым катодом (диафрагменный и мембранный методы), третий — электролиз с жидким ртутным катодом (ртутный метод).
В мировой производственной практике используются все три метода получения хлора и каустика с явной тенденцией к увеличению доли мембранного электролиза.
| Показатель на 1 тонну NaOH | Ртутный метод | Диафрагменный метод | Мембранный метод |
|---|---|---|---|
| Выход хлора, % | 99 | 96 | 98,5 |
| Электроэнергия, кВт·ч | 3150 | 3260 | 2520 |
| Концентрация NaOH, % | 50 | 12 | 35 |
| Чистота хлора, % | 99,2 | 98 | 99,3 |
| Чистота водорода, % | 99,9 | 99,9 | 99,9 |
| Массовая доля O2 в хлоре, % | 0,1 | 1—2 | 0,3 |
| Массовая доля Cl− в NaOH, % | 0,003 | 1—1,2 | 0,005 |
В России приблизительно 35 % от всего выпускаемого каустика вырабатывается электролизом с ртутным катодом и 65 % — электролизом с твёрдым катодом.
Диафрагменный метод[править | править код]
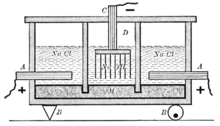 Схема старинного диафрагменного электролизера для получения хлора и щёлоков: А — анод, В — изоляторы, С — катод, D — пространство заполненное газами (над анодом — хлор, над катодом — водород), М — диафрагма
Схема старинного диафрагменного электролизера для получения хлора и щёлоков: А — анод, В — изоляторы, С — катод, D — пространство заполненное газами (над анодом — хлор, над катодом — водород), М — диафрагмаНаиболее простым из электрохимических методов в плане организации процесса и конструкционных материалов для электролизера является диафрагменный метод получения гидроксида натрия.
Раствор соли в диафрагменном электролизере непрерывно подаётся в анодное пространство и протекает через, как правило, нанесённую на стальную катодную сетку асбестовую диафрагму, в которую иногда добавляют небольшое количество полимерных волокон.
Во многих конструкциях электролизеров катод полностью погружен под слой анолита (электролита из анодного пространства), а выделяющийся на катодной сетке водород отводится из под катода при помощи газоотводных труб, не проникая через диафрагму в анодное пространство благодаря противотоку.
Противоток — очень важная особенность устройства диафрагменного электролизера. Именно благодаря противоточному потоку, направленному из анодного пространства в катодное через пористую диафрагму, становится возможным раздельное получение щёлоков и хлора. Противоточный поток рассчитывается так, чтобы противодействовать диффузии и миграции OH— ионов в анодное пространство. Если величина противотока недостаточна, тогда в анодном пространстве в больших количествах начинает образовываться гипохлорит-ион (ClO—), который затем может окисляться на аноде до хлорат-иона ClO3—. Образование хлорат-иона серьёзно снижает выход по току хлора и является основным побочным процессом в этом методе получения гидроксида натрия. Также вредит и выделение кислорода, которое, к тому же, ведёт к разрушению анодов и, если они из углеродных материалов, попаданию в хлор примесей фосгена.
- Анод:
- 2Cl−→Cl2+2e−{\displaystyle {\mathsf {2Cl^{-}\!\rightarrow Cl_{2}\!+2e^{-}}}} — основной процесс
- 2h3O→O2+4H++4e−{\displaystyle {\mathsf {2H_{2}O\rightarrow O_{2}+4H^{+}\!+4e^{-}}}}
- 6ClO3−+3h3O→2ClO3−+4Cl−+1.5O2↑+ 6H++6e−{\displaystyle {\mathsf {6ClO_{3}^{-}\!+3H_{2}O\rightarrow 2ClO_{3}^{-}+4Cl^{-}\!+1.5O_{2}\!\uparrow \!+\ 6H^{+}\!+6e^{-}}}}
- Катод:
- 2h3O+2e−→h3↑+2OH−{\displaystyle {\mathsf {2H_{2}O+2e^{-}\!\rightarrow H_{2}\!\uparrow +2OH^{-}}}} — основной процесс
- ClO−+h3O+2e−→Cl−+2OH−{\displaystyle {\mathsf {ClO^{-}+H_{2}O+2e^{-}\!\rightarrow Cl^{-}+2OH^{-}}}}
- ClO3−+3h3O+6e−→Cl−+6OH−{\displaystyle {\mathsf {ClO_{3}^{-}+3H_{2}O+6e^{-}\!\rightarrow Cl^{-}+6OH^{-}}}}
В качестве анода в диафрагменных электролизерах может использоваться графитовый или угольный электроды. На сегодня их, в основном, заменили титановые аноды с окисно-рутениево-титановым покрытием (аноды ОРТА) или другие малорасходуемые.
На следующей стадии электролитический щёлок упаривают и доводят содержание в нём NaOH до товарной концентрации 42—50 % масс. в соответствии со стандартом.
Поваренная соль, сульфат натрия и другие примеси при повышении их концентрации в растворе выше их предела растворимости выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или продолжают стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией.
Обратную, то есть кристаллизовавшуюся в осадок, поваренную соль возвращают назад в процесс, приготавливая из неё так называемый обратный рассол. От неё, во избежание накапливания примесей в растворах, перед приготовлением обратного рассола отделяют примеси.
Убыль анолита восполняют добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов, минеральных рассолов типа бишофита, предварительно очищенного от примесей или растворением галита. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния.
Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Благодаря относительной простоте и дешевизне диафрагменный метод получения гидроксида натрия до сих пор широко используется в промышленности.
Мембранный метод[править | править код]
Мембранный метод производства гидроксида натрия наиболее энергоэффективен, однако сложен в организации и эксплуатации.
С точки зрения электрохимических процессов мембранный метод подобен диафрагменному, но анодное и катодное пространства полностью разделены непроницаемой для анионов катионообменной мембраной. Благодаря этому свойству становится возможным получение более чистых, чем в случае с диафрагменного метода, щелоков. Поэтому в мембранном электролизере, в отличие от диафрагменного, не один поток, а два.
В анодное пространство поступает, как и в диафрагменном методе, поток раствора соли. А в катодное — деионизированная вода. Из анодного пространства вытекает поток обеднённого анолита, содержащего также примеси гипохлорит- и хлорат-ионов и хлор, а из катодного — щёлока и водород, практически не содержащие примесей и близкие к товарной концентрации, что уменьшает затраты энергии на их упаривание и очистку.
Щёлочь, получаемая с помощью мембранного электролиза, практически не уступает по качеству получаемой при помощи метода с использованием ртутного катода и постепенно заменяет щёлочь, получаемую ртутным методом.
Однако, питающий раствор соли (как свежий, так и оборотный) и вода предварительно максимально очищается от любых примесей. Такая тщательная очистка объясняется высокой стоимостью полимерных катионообменных мембран и их уязвимостью к примесям в питающем растворе.
Кроме того, ограниченная геометрическая форма а также низкая механическая прочность и термическая стойкость ионообменных мембран во многом определяют сравнительно сложные конструкции установок мембранного электролиза. По той же причине мембранные установки требуют наиболее сложных систем автоматического контроля и управления.
- Схема мембранного электролизера.
Ртутный метод с жидким катодом[править | править код]
В ряду электрохим
Оксид натрия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 8 января 2019; проверки требуют 3 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 8 января 2019; проверки требуют 3 правки.Окси́д на́трия — бинарное неорганическое вещество, имеющее формулу Na2O и относящееся к классу основных оксидов.
Оксид натрия представляет собой бесцветные кристаллы кубической сингонии[1]. Хранить оксид натрия Na2O лучше всего в безводном бензоле.
1. Взаимодействие металлического натрия с кислородом:
- 4Na+O2⟶2Na2O{\displaystyle {\mathsf {4Na+O_{2}\longrightarrow 2Na_{2}O}}}
Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия:
- 6Na+2 O2⟶2Na2O+Na2O2{\displaystyle {\mathsf {6Na+2\ O_{2}\longrightarrow 2Na_{2}O+Na_{2}O_{2}}}}
2. Взаимодействие металлического натрия с нитратом натрия:
- 10Na+2NaNO3⟶6Na2O+N2{\displaystyle {\mathsf {10Na+2NaNO_{3}\longrightarrow 6Na_{2}O+N_{2}}}}
3. Прокаливание пероксида натрия с избытком натрия:
- Na2O2+2 Na⟶2 Na2O{\displaystyle {\mathsf {Na_{2}O_{2}+2\ Na\longrightarrow 2\ Na_{2}O}}}
4. Прокаливанием карбоната натрия при 1000 °C, получаемого в свою очередь прокаливанием гидрокарбоната натрия при 200 °C.
NaHCO3→h3O+CO2T=200Na2CO3→CO2T=1000Na2O{\displaystyle {\ce {NaHCO_{3}->[{T=200}][{H_{2}O+CO_{2}}]Na_{2}CO3->[{T=1000}][{CO_{2}}]Na_{2}O}}}
1. Взаимодействие с водой с образованием щёлочи:
- Na2O+h3O⟶2 NaOH{\displaystyle {\mathsf {Na_{2}O+H_{2}O\longrightarrow 2\ NaOH}}}
2. Взаимодействие с кислотными оксидами с образованием соли:
- Na2O+CO2⟶Na2CO3{\displaystyle {\mathsf {Na_{2}O+CO_{2}\longrightarrow Na_{2}CO_{3}}}}
3. Взаимодействие с кислотами с образованием соли и воды:
- Na2O+2 HCl⟶2 NaCl+h3O{\displaystyle {\mathsf {Na_{2}O+2\ HCl\longrightarrow 2\ NaCl+H_{2}O}}}
Оксид натрия применяется, в основном, в качестве реактива для различных синтезов, для приготовления гидроксида натрия и других веществ[1].
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3 (Мед-Пол). — 639 с. — ISBN 5-82270-039-8.
Оксид натрия, характеристика, свойства и получение, химические реакции
Оксид натрия, характеристика, свойства и получение, химические реакции.
Оксид натрия – неорганическое вещество, имеет химическую формулу Na2O.
Краткая характеристика оксида натрия
Физические свойства оксида натрия
Получение оксида натрия
Химические свойства оксида натрия
Химические реакции оксида натрия
Применение и использование оксида натрия
Краткая характеристика оксида натрия:
Оксид натрия – неорганическое вещество бесцветного либо белого цвета.
Так как валентность натрия равна одному, то оксид натрия содержит один атом кислорода и два атома натрия.
Химическая формула оксида натрия Na2O.
В воде не растворяется, а вступает в реакцию с ней.
Физические свойства оксида натрия:
| Наименование параметра: | Значение: |
| Химическая формула | Na2O |
| Синонимы и названия иностранном языке | sodium oxide (англ.) окись натрия (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные (иногда белые) кубические кристаллы |
| Цвет | бесцветный, иногда – белый |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2270 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,27 |
| Температура кипения, °C | 1950 |
| Температура плавления, °C | 1132 |
| Температура возгонки (сублимации), °C | 1275 |
| Температура разложения, °C | 1132 |
| Молярная масса, г/моль | 61,979 |
* Примечание:
— нет данных.
Получение оксида натрия:
Оксид натрия получается в результате следующих химических реакций:
- 1. из пероксида натрия:
При реакции натрия с кислородом образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия.
6Na + 2О2 → Na2О2 + 2Na2О.
Затем пероксид натрия обогащают натрием.
Na2О2 + 2Na → 2Na2О.
- 2. путем нагревания нитрата (нитрита) натрия с металлическим натрием:
2NaNО3 + 10Na → 6Na2О + N2;
2NaNO2 + 6Na → 4Na2O + N2.
- 3. путем взаимодействия гидроксида натрия с металлическим натрием:
2NaOH + 2Na → 2Na2O + H2.
- 4. путем прокаливания карбоната натрия:
2Na2СO3 → Na2O + СО2 (t = 851 oC).
Химические свойства оксида натрия. Химические реакции оксида натрия:
Химически активное вещество.
Химические свойства оксида натрия аналогичны свойствам оксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
- 1. реакция оксида натрия с кислородом:
2Na2O + O2 → 2Na2O2 (t = 250-350 oC, p).
В результате реакции образуется пероксид натрия.
- 2. реакция оксида натрия с водой:
Na2О + Н2О → 2NaОН.
Оксид натрия бурно реагирует с водой, образуя гидроксид натрия.
- 3. реакция оксида натрия с оксидом углерода (углекислым газом):
Na2О + СО2 → Na2СО3 (t = 450-550°C).
Оксид натрия реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат натрия.
- 4. реакция оксида натрия с оксидом серы:
Na2О + SО2 → Na2SО3;
Na2О + SО3 → Na2SО4.
Оксид серы также является кислотным оксидом. В результате реакции образуется соответственно соль – в первом случае – сульфит натрия, во втором случае – сульфат натрия.
- 5. реакция оксида натрия с оксидом кремния:
Na2О + SiО2 → Na2SiО3 (tо).
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – силикат натрия.
- 6. реакция оксида натрия с оксидом фосфора:
3Na2O + P2O5 → 2Na3PO4.
Оксид фосфора также является кислотным оксидом. В результате реакции образуется соль – ортофосфат натрия.
Аналогично проходят реакции оксида натрия и с другими кислотными оксидами.
- 7. реакция оксида натрия с оксидом алюминия:
Na2О + Al2O3 → 2NaAlО2 (t = 2000 °C).
Оксид алюминия является амфотерным оксидом. Это значит, что как амфотерный оксид оксид алюминия проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соль – алюминат натрия.
Аналогично проходят реакции оксида натрия и с другими амфотерными оксидами.
- 8. реакция оксида натрия с оксидом меди:
Na2О + CuO → 2Na2CuО2 (t = 800-1000 °C, O2).
В результате реакции образуется соль – купрат натрия.
- 9. реакция оксида натрия с оксидом железа:
5Na2О + Fe2O3 → 2Na5FeО4 (t = 450-500 °C).
В результате реакции образуется соль – феррат натрия.
- 10. реакция оксида натрия с оксидом свинца:
Na2О + PbO → 2Na2PbО2 (tо).
В результате реакции образуется соль – плюмбит натрия.
Аналогично проходят реакции оксида натрия и с другими оксидами.
- 11. реакция оксида натрия с оксидом азота (II) и оксидом азота (IV):
Na2О + NО + NО2 → NaNO3 + 2NaNO2 (t = 250 °C).
В результате реакции образуются соль нитрит натрия.
- 12. реакция оксида натрия с плавиковой кислотой:
Na2O + 2HF → 2NaF + H2O.
В результате химической реакции получается соль – фторид натрия и вода.
- 13. реакция оксида натрия с азотной кислотой:
Na2O + 2HNO3 → 2NaNO3 + H2O.
В результате химической реакции получается соль – нитрат натрия и вода.
Аналогично проходят реакции оксида натрия и с другими кислотами.
- 14. реакция оксида натрия с бромистым водородом (бромоводородом):
Na2O + 2HBr → 2NaBr + H2O.
В результате химической реакции получается соль – бромид натрия и вода.
- 15. реакция оксида натрия с йодоводородом:
Na2O + 2HI → 2NaI + H2O.
В результате химической реакции получается соль – йодид натрия и вода.
- 16. реакция оксида натрия с жидким аммиаком:
Na2O + NH3 → NaОН + NaNH2 (t = -50 oC).
В результате химической реакции получается гидроксид натрия и амид натрия.
- 17. реакция термического разложения оксида натрия:
2Na2O → Na2O2 + 2Na (t > 700 oC).
Оксид натрия в результате термического разложения разлагается на пероксид натрия и натрий.
Применение и использование оксида натрия:
Оксид натрия используется в качестве реактива для различных синтезов, для приготовления гидроксида натрия и других веществ.
Примечание: © Фото //www.pexels.com, //pixabay.com




карта сайта
оксид натрия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида натрия
реакции с оксидом натрия
Коэффициент востребованности 1 206
Тиосульфат натрия — Википедия
Материал из Википедии — свободной энциклопедии
| Тиосульфат натрия | |||
|---|---|---|---|
 ( ({{{картинка малая}}}) | |||
 ( ({{{изображение}}}) | |||
| Систематическое наименование | тиосульфат натрия | ||
| Традиционные названия | гипосульфит | ||
| Хим. формула | Na2S2O3, Na2S2O3·5H2O (кристаллогидрат) | ||
| Молярная масса | 158,11 г/моль | ||
| Плотность | 2,345 г/см³ | ||
| Температура | |||
| • плавления | 48,5 °С (пентагидрат) | ||
| • разложения | 300 °C[1] | ||
| Растворимость | |||
| • в воде | 70,120; 22980 г/100 мл | ||
| Рег. номер CAS | 7772-98-7 | ||
| PubChem | 24477 | ||
| Рег. номер EINECS | 231-867-5 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E539 | ||
| RTECS | XN6476000 | ||
| ChEBI | 132112 | ||
| ChemSpider | 22885 | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Тиосульфа́т на́трия (антихлор, гипосульфит, сульфидотриоксосульфат натрия, натрий серноватистокислый) — неорганическое соединение, соль натрия и тиосерной кислоты c химической формулой Na2S2O3 или Na2SO3S, образует кристаллогидрат состава Na2S2O3·5H2O. Применяется в медицине, фотографии и других отраслях промышленности.
- окислением полисульфидов Na;
- кипячение избытка серы с Na2SO3:
- Na2SO3+S→Na2S2O3{\displaystyle {\mathsf {Na_{2}SO_{3}+S\rightarrow Na_{2}S_{2}O_{3}}}}
- взаимодействием H2S и SO2 с NaOH (побочный продукт в производстве NaHSO3, сернистых красителей, при очистке промышленных газов от S):
- 4SO2+2h3S+6NaOH→3Na2S2O3+5h3O{\displaystyle {\mathsf {4SO_{2}+2H_{2}S+6NaOH\rightarrow 3Na_{2}S_{2}O_{3}+5H_{2}O}}}
- кипячение избытка серы с гидроксидом натрия:
- 4S+6NaOH→2Na2S+Na2S2O3+3h3O{\displaystyle {\mathsf {4S+6NaOH\rightarrow 2Na_{2}S+Na_{2}S_{2}O_{3}+3H_{2}O}}}
затем по приведённой выше реакции сульфит натрия присоединяет серу, образуя тиосульфат натрия.
Одновременно в ходе этой реакции образуются полисульфиды натрия (они придают раствору жёлтый цвет). Для их разрушения в раствор пропускают SO2.
- чистый безводный тиосульфат натрия можно получить реакцией серы с нитритом натрия в формамиде. Эта реакция количественно протекает (при 80 °C за 30 минут) по уравнению:
- 2NaNO2+2S→Na2S2O3+N2O{\displaystyle {\mathsf {2NaNO_{2}+2S\rightarrow Na_{2}S_{2}O_{3}+N_{2}O}}}
- 2Na2S+2O2+h3O→Na2S2O3+2NaOH{\displaystyle {\mathsf {2Na_{2}S+2O_{2}+H_{2}O\rightarrow Na_{2}S_{2}O_{3}+2NaOH}}}
Имеет вид бесцветных кристаллов. Образует три модификации: моноклинную α (a = 0,8513, b = 0,8158, c = 0,6425, β = 97,08°, z = 4, пространственная группа P21/c), а также β и γ. α-модификация переходит в β при температуре 330 °C, β переходит в γ при 380 °C. Плотность α-модификации 2,345 г/моль[2].
Растворим в воде (50,1 г/100 мл (0 °C), 70,2 г/100 мл (20 °C), 231,8 г/100 мл (80 °C))[2].
Молярная масса 248,17 г/моль (пентагидрат). При 48,5 °C кристаллогидрат растворяется в своей кристаллизационной воде, образуя перенасыщенный раствор; обезвоживается около 100оС.
При нагревании до 220 °C распадается по схеме:
- 4Na2S2O3→3Na2SO4+Na2S+4S{\displaystyle {\mathsf {4Na_{2}S_{2}O_{3}\rightarrow 3Na_{2}SO_{4}+Na_{2}S+4S}}}
Тиосульфат натрия — сильный восстановитель:
С сильными окислителями, например, свободным хлором, окисляется до сульфатов или серной кислоты:
- Na2S2O3+4Cl2+5h3O→2h3SO4+2NaCl+6HCl{\displaystyle {\mathsf {Na_{2}S_{2}O_{3}+4Cl_{2}+5H_{2}O\rightarrow 2H_{2}SO_{4}+2NaCl+6HCl}}}
Более слабыми или медленно действующими окислителями, например, иодом, переводится в соли тетратионовой кислоты:
- 2Na2S2O3+I2→Na2S4O6+2NaI{\displaystyle {\mathsf {2Na_{2}S_{2}O_{3}+I_{2}\rightarrow Na_{2}S_{4}O_{6}+2NaI}}}
Приведённая реакция очень важна, так как служит основой иодометрии. Следует отметить, что в щелочной среде окисление тиосульфата натрия иодом может идти до сульфата.
Выделить тиосерную кислоту (тиосульфат водорода) реакцией тиосульфата натрия с сильной кислотой невозможно, так как она неустойчива и тут же разлагается на воду, серу и диоксид серы:
- Na2S2O3+h3SO4→Na2SO4+h3O+S+SO2{\displaystyle {\mathsf {Na_{2}S_{2}O_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+H_{2}O+S+SO_{2}}}}
Расплавленный кристаллогидрат Na2S2O3·5H2O очень склонен к переохлаждению.
 (
(