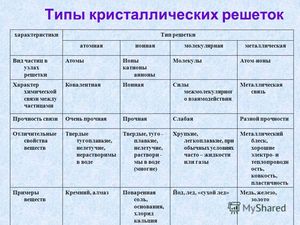
Кристаллические решетки
Вещество может существовать в трех агрегатных состояниях: газообразном, жидком, твёрдом. Например, кислород, является газом, но при температуре -194 0С он превращается в голубую жидкость, а при температуре -218,8 0С – затвердевает в снегообразную массу, состоящую из кристаллов синего цвета.

Твёрдые вещества делят на кристаллические и аморфные. Аморфные вещества не имеют четкой температуры плавления, при нагревании размягчаются и переходят в текучее состояние. К аморфным веществам относятся пластмассы, воск, шоколад, пластилин, жевательные резинки.

Кристаллические вещества состоят из частиц, которые имеют четкое расположение в определенных точках пространства. Если соединить эти частицы, то получится своеобразный каркас, который называется кристаллической решеткой. А точки, где находятся частицы – узлами кристаллической решетки. В узлах кристаллической решетки могут находиться ионы, атомы, молекулы. Эти частицы совершают колебательные движения. При повышении температуры размах этих колебаний увеличивается, что приводит к тепловому расширению тел.
Кристаллическая решётка

В зависимости от типа частиц в кристаллической решетки и характера связи между ними, различают ионные, атомные, молекулярные и металлические кристаллические решётки.

Ионные кристаллические решётки

Ионными, называются кристаллические решётки, в узлах которых находятся ионы. Их образуют вещества с ионным типом связи. Это соли, основания, некоторые оксиды. Например, кристалл хлорида натрия, построен из чередующихся ионов Na+ и Cl—. Они образуют решётку в виде куба. Связи в этом кристалле очень прочные, поэтому вещества с ионным типом связи имеют высокую твердость и прочность, они нелетучи и тугоплавки.
Атомные кристаллические решётки

Атомными называют кристаллические решётки,
Кроме алмаза атомную кристаллическую решётку имеют и такие простые вещества, как бор, кремний, германий, и сложные: кремнезём, кварц, песок, горный хрусталь, в состав которых входит SiO2. Вещества с атомной кристаллической решеткой имеют высокие температуры плавления, они прочные и твёрдые, практически нерастворимые.
Молекулярные кристаллические решётки

Молекулярная кристаллическая решётка – это кристаллическая решетка, в узлах которой находятся молекулы
. Связи у веществ с молекулярной кристаллической решёткой могут быть ковалентными полярными, как в молекулах HCl, H2O, и ковалентными неполярными, как в молекулах O2, O3, N2, H2 и др. Атомы внутри молекулы связаны прочно, а вот связи между самими молекулами непрочные. Поэтому вещества с молекулярной кристаллической решеткой имеют малую твердость, низкие температуры плавления и кипения, летучи. К веществам с молекулярной кристаллической решеткой относятся: лед (вода в твердом агрегатном состоянии), который уже при температуре выше 0 0С переходит в жидкое состояние, его кристаллическая структура разрушается; твердый оксид углерода (IV) – «сухой лед», который возгоняется при увеличении температуры, т.е. превращается в газ, твёрдые хлороводород и сероводород, твёрдые простые вещества. Такие как, одноатомные благородные газы, двухатомные молекулы (OМеталлические кристаллические решётки

Металлическую кристаллическую решётку имеют вещества с металлическим типом связи. В узлах этой кристаллической решетки находятся ионы металла и свободные электроны. Поэтому вещества с этим типом связи обладают ковкостью, пластичностью, имеют металлический блеск, электро- и теплопроводны.
Для веществ молекулярного строения справедлив закон французского химика Ж. Л. Пруста – закон постоянства состава:
молекулярные химические соединения независимо от способа их получения имеют постоянный состав и свойства. Закон Пруста – основной из законов химии, однако он несправедлив для веществ немолекулярного строения.
videouroki.net
Кристаллические решетки — Знаешь как
Содержание статьи
 Кристаллические решетки классифицируют по типу частиц, образующих правильную структуру твердого тела. Если в узлах решетки находятся ионы, связанные между собой прочными кулоновскими силами, ее называют ионной. Атомы, соединенные при помощи ковалентных связей, образуют атомную кристаллическую решетку. Молекулярная решетка состоит из отдельных молекул, связанных между собой слабыми силами Ван-дер-Ваальса. И
Кристаллические решетки классифицируют по типу частиц, образующих правильную структуру твердого тела. Если в узлах решетки находятся ионы, связанные между собой прочными кулоновскими силами, ее называют ионной. Атомы, соединенные при помощи ковалентных связей, образуют атомную кристаллическую решетку. Молекулярная решетка состоит из отдельных молекул, связанных между собой слабыми силами Ван-дер-Ваальса. ИРис. кристаллическая решетка хлорида натрия
Ионные кристаллические решетки
Электрическое поле иона равномерно распределено в пространстве, поэтому ионная связь характеризуется отсутствием направленности и насыщаемости. Энергетически наиболее выгодно, чтобы каждый ион был окружен наибольшим числом ионов противоположного знака. Но одноименно заряженные ионы отталкиваются, поэтому устойчивыми будут только такие кристаллические решетки, для которых выполняются следующие два условия: разноименные ионы максимально сближены; одинаково заряженные ионы максимально удалены друг от друга.
Радиусы ионов играют основную роль при образовании тех или иных кристаллических форм. Так, если отношение радиуса катиона (rк) к радиусу аниона (rа) превышает 0,73, геометрически легко показать, что каждый ион может быть окружен восемью ионами противоположного знака. При чк: ча=0,41÷0,73 наблюдается октаэдрическая координация: вокруг каждого иона располагаются шесть противоположно заряженных ионов. И наконец, при чк: ча<0,41 окружение составляют только четыре иона. В таблице 8 приведены численные значения радиусов ионов некоторых щелочных металлов и галогенов. В случае хлорида натрия отношение чк : ча равно 0,52, поэтому катион Na+ в кристалле NaCl окружен шестью ионами хлора, а каждый анион Сl—— шестью ионами натрия. За счет равномерного распределения электронной плотности в пространстве все шесть связей оказываются совершенно равноценными. В кристалле хлорида натрия нельзя выделить отдельных ионных молекул Na
Таблица 8 Ионные радиусы галогенов и щелочных металлов
| Катион | Радиус, нм | Анион | Радиус, нм |
| Li+ | 0,078 | F— | 0,133 |
| Na+ | 0,095 | Сl— | 0,181 |
| К+ | 0,133 | Вr— | 0,196 |
| Cs+ | 0,165 | I— | 0,220 |
Для хлорида цезия отношение чк:ча равно 0,91. Восемь катионов Cs+ занимают вершины куба, в центре которого находится ион хлора.
 При обычных условиях ионные соединения представляют собой хрупкие твердые вещества с высокими температурами плавления. Их переход в жидкое состояние происходит обычно с увеличением объема.
При обычных условиях ионные соединения представляют собой хрупкие твердые вещества с высокими температурами плавления. Их переход в жидкое состояние происходит обычно с увеличением объема.
Рис.2. Структура алмаза
Ионные кристаллы, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например, в воде. Расположенные на поверхности ионы окружаются молекулами растворителя, отрываются от кристалла и переходят в раствор. Для одного и того же ионного соединения растворимость возрастает с увеличением взаимодействия между молекулами растворителя и соответствующими ионами кристалла, т. е. с увеличением полярности растворителя (табл.9).
Таблица 9
Растворимость кристаллических ионных соединений в различных полярных растворителях
(температура 25°С; растворимость выражена в граммах растворенного вещества на 100 грастворителя; е — диэлектрическая проницаемость)
| Соединение | Растворимость в спиртах | ||
| метиловом (ε = 33) | этиловом (ε= 24) | пропиловом (ε= 20) | |
| KI | 90 | 46 | 28 |
| NaCl | 0,53 | 0,02 | 0,00 |
| Sr(NO3)2 | 1,26 | 0,02 | — |
Атомные кристаллические решетки
Атомные кристаллические решетки сформированы за счет ковалентных связей. Взаимная ориентация атомов определяется пространственным строением их электронных подуровней. Например, каждый атом углерода может образовать четыре ковалентные связи, направленные из центра правильного тетраэдра к его вершинам. С этим центральным атомом соединяются четыре атома углерода, находящихся в том же валентном состоянии. У каждого из этих атомов остается по три неспаренных электрона, занимающих три гибридных sр3-подуровня, поэтому они образуют связи с тремя другими атомами углерода. Так строится трехмерная кристаллическая решетка алмаза (рис. 2). Чтобы такой кристалл расплавился, необходимо разорвать большую часть ковалентных углерод-углеродных связей, обладающих высокой энергией. Поэтому алмаз плавится при очень высокой температуре (>3500°С) и его невозможно растворить в какой-либо жидкости.
Атомные кристаллы с ковалентными связями являются в большинстве случаев изоляторами, поскольку в них отсутствует как ионная , так и электронная проводимость.
Молекулярные кристаллические решетки
В узлах молекулярной кристаллической решетки находятся молекулы, связанные между собой силами Ван-дер-Ваальса. Такие решетки образуют водород, хлор, азот, оксид углерода (IV) и многие органические соедини. Вследствие небольшой энергии взаимодействия частиц молекулярные кристаллы плавятся при низких температурах и легко растворяются в различных жидкостях (табл. 10).
Молекулы, имеющие разветвленное строение, образует более компактную кристаллическую структуру. Силы Взаимодействия между ними оказываются при этом гораздо выше, чем для не разветвленных молекул. Поэтому соединения с близкой молекулярной массой, но неодинаковым строением имеют различные температуры плавления (сравним, например, «-гептан и 2, 2, 3-триметилбутан в таблице 10).
Взаимодействие между молекулами усиливается также с усложнением строения их электронных оболочек и увеличением полярности. Температуры плавления полярных веществ существенно выше температур плавления неполярных соединений. От полярности молекул сильно зависит растворимость молекулярных кристаллов. Большое значение при этом играет соотношение между размерами полярной и неполярной части молекул. Например, уксусная кислота Н3С—СООН смешивается с водой в любых отношениях, в то время как растворимость стеариновой кислоты составляет при 25°С всего лишь 0,03 г на 100 г Н2О.
Для соединений, молекулы которых имеют полярные группы О—Н, N—Н, S—Н, структура кристаллов определяется в основном энергией водородных связей и характером их расположения в пространстве. Наличием большого числа водородных связей

объясняется, в частности, своеобразная структура льда.
Поскольку каждая молекула воды имеет два атома водорода и две не поделенные пары электронов, она может образовать четыре водородные связи:

В изолированной молекуле воды расстояние между ядрами атомов водорода и кислорода составляет примерно 0, 096 нм, а угол между направлениями связей О — Н равен 105°. В твердом и жидком состояниях параметры молекул Н2О незначительно изменяются. В кристаллической решетке льда вследствие образования водородных связей угол НОН приближается к тетраэдрическому (109,5°), а расстояние между ядрами атомов водорода и кислорода увеличивается до 0,099 нм.
Кристаллы льда принадлежат к гексагональной системе. Каждая молекула воды связана водородными связями с четырьмя другими молекулами. Вследствие относительно большой длины этих связей упаковка молекул Н2О оказывается очень неплотной, в структуре льда на каждые 46 молекул воды приходится шесть пустот диаметром 0,59 нм и две пустоты диаметром 0,52 нм.
За счет включения в полости кристалла молекул хлора, аргона, ксенона и некоторых других газов возникают так называемые клатратные соединения или соединения включения. Их образование с последующим разрушением применяется для разделения углеводородов и некоторых других веществ. Клатраты используют также как удобную форму хранения газов.
Если внедряющиеся молекулы газа сравнительно невелики (Аr, Хе, СН4, СO2), то они занимают все восемь пустот. Образующиеся при этом клатраты имеют состав X•5,75Н2О (8:46= 1:5,75). Более крупные частицы занимает только шесть пустот. Предельное отношение числа внедренных молекул к числу молекул воды составляет в этом случае 6:46=1:7,67. Например, при охлаждении Хлорной воды выпадают кристаллы гидрата хлора, имеющие состав Сl2•8Н2O.
При атмосферном давлении лед плавится при 0°С. С точки зрения молекулярно-кинетической теории плавление льда происходит при такой температуре, когда энергия теплового движения молекул оказывается достаточной для разрыва большинства водородных связей. Тетраэдрическая структура льда разрушается, и вода переходит в жидкое состояние. В жидкой воде существует подвижное равновесие: действие водородных связей воссоздает в каждый момент времени в каждом элементе объема тетраэдрическую структуру льда, а тепловое движение молекул эту структуру разрушает.
Плавление льда сопровождается поглощением тепловой энергии в количестве 6,01 кдж/моль. Большая часть ее расходуется на разрыв водородных связей.
Решетка металлов
 Общее число валентных электронов атома металла недостаточно для образования обычных двухэлектронных связей со всеми ближайшими соседями в кристалле. Следовательно, связь атомов металла в кристаллической решетке имеет иную природу, чем ионная или ковалентная. С точки зрения современных представлений металл — это сложная система, состоящая из нейтральных атомов и положительно заряженных ионов, занимающих узлы кристаллической решетки, и «электронного газа», заполняющего межатомное пространство. В одних местах кристалла катионы захватывают электроны из окружающего пространства, превращаясь в нейтральные атомы, в других — атомы металла отдают свои валентные электроны и превращаются в катионы.
Общее число валентных электронов атома металла недостаточно для образования обычных двухэлектронных связей со всеми ближайшими соседями в кристалле. Следовательно, связь атомов металла в кристаллической решетке имеет иную природу, чем ионная или ковалентная. С точки зрения современных представлений металл — это сложная система, состоящая из нейтральных атомов и положительно заряженных ионов, занимающих узлы кристаллической решетки, и «электронного газа», заполняющего межатомное пространство. В одних местах кристалла катионы захватывают электроны из окружающего пространства, превращаясь в нейтральные атомы, в других — атомы металла отдают свои валентные электроны и превращаются в катионы.
Рис. 5 . Изменение электропроводности металлов вблизи абсолютного нуля
Наличие «свободных» электронов в кристаллической решетке металла было подтверждено экспериментально опытами советских ученых Л. И. Мандельштама и Н. Д. Папалекси, которые наблюдали появление электрического тока при резком торможении вращающегося с большой скоростью куска металла. Ток возникает также при резком ускорении движения металлического тела (эффект Толмена). В последнем случае свободные электроны отбрасываются по инерции к противоположному по движению концу металла.
Одним из важнейших свойств металлов является их электропроводность. При одной и той же температуре одни металлы проводят электрический ток очень хорошо, другие — плохо. Величина электропроводности зависит от общего числа валентных электронов в атоме, степени заполнения отдельных энергетических подуровней и от типа кристаллической решетки:
Относительные значения электропроводности некоторых металлов
| Ag 59,0 | Na 20,8 | К 13,6 | Pt 9,7 | Be 5,2 | V 3,7 |
| Cu 56,9 | Ir 20,6 | Cd 12,6 | Pd 8,7 | Cr 5,1 | Hf 3,2 |
| Au 39,6 | Mo 20,0 | Ru 12,4 | Sn 8,3 | Cs 4,8 | Zr 2,3 |
| Al 36,1 | W 17,5 | Li 11,2 | Rb 7,7 | Nb 4,8 | Ti 2,2 |
| Ca 1,9 | Zn 16,0 | In 10,6 | Tl 6,3 | Pb 4,6 | Ba 1,9 |
| Rh 21,9 | Co 15,3 | Os 10,1 | Та 6,2 | Re 4,5 | Ce 1,2 |
| Mg 21,8 | Ni 13,9 | Fe 9,8 | Th 5,3 | Sr 4,2 | Hg 1,0 |
Для всех металлов характерно более или менее быстрое понижение электропроводности с увеличением температуры. Это объясняется усилением колебательного движения катионов и нейтральных атомов в узлах кристаллической решетки, что приводит к замедлению направленного перемещения свободных электронов под действием внешнего электрического поля. Очень интересным оказывается поведение металлов при низких температурах — вблизи абсолютного нуля (-273,16°С). Последовательно увеличиваясь с понижением температуры, электропроводность некоторых металлов, например свинца , олова, ртути, неожиданно возрастает практически до бесконечности (Рис. 5).
Это явление получило название сверхпроводимости. Оно характерно также для ряда сплавов и соединений металлов: карбидов, нитридов и т. д.
Статья на тему Кристаллические решетки
znaesh-kak.com
ХИМИЯ. как определить тип кристаллической решетки?
В зависимости от вида частиц и от характера связи между ними различают четыре типа кристаллических решеток: ионные, молекулярные, атомные и металлические. Ионные кристаллические решетки Виды частиц в узлах решетки: ионы Для веществ с ионной химической связью будет характерна ионная решетка. Ионы-это частицы, имеющие положительный или отрицательный заряд. Напрмер NaCl, Соли, галогениды (IA,IIA),оксиды и гидроксиды типичных металлов. Физ. свойства: Твердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в воде, расплавы проводят электрический ток Атомные кристаллические решетки В узлах атомной кристаллической решетки находятся отдельные атомы. Ковалентная химическая связь. В данных решетках молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Примером веществ с таким типом кристаллических решеток могут служить аллотропные модификации углерода: алмаз, графит; а также бор, кремний, красный фосфор, германий. Простые по составу. Атомные кристаллические решетки имеют не только простые, но и сложные. Например, оксид алюминия, оксид кремния. Все эти вещества имеют очень высокие температуры плавления (у алмаза свыше 35000С) , прочны и тверды, нелетучи, практически нерастворимы в жидкостях. Металлические кристаллические решетки Металлическая связь. Связь в металлах между положительными ионами посредством обобществленных электронов. общие физические свойства для металлов характерны: блеск, электропроводность, теплопроводность, пластичность. Вещества с металлической связью имеют металлические кристаллические решетки В узлах таких решеток находятся атомы и положительные ионы металлов, а в объеме кристалла свободно перемещаются валентные электроны. Электроны электростатически притягивают положительные ионы металлов. Этим объясняется стабильность решетки. Молекулярные кристаллические решетки Эти вещества являются неметаллами. Простые по составу. Химическая связь внутри молекул ковалентная неполярная. Летучие, легкоплавкие, малорастворимые в воде. в узлах решетки нах. молекулы. молекулярную кристаллическую решетку могут иметь не только твердые простые вещества: благородные газы, h3,O2,N2, I2, O3, белый фосфор Р4, но и сложные: твердая вода, твердые хлороводород и сероводород. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар) . В узлах решеток находятся неполярные или полярные молекулы. Несмотря на то, что атомы внутри молекул связаны прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного взаимодействия.
ИОННЫЕ Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью. Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов. Связи между ионами в кристалле очень прочные и устойчивые. Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи. АТОМНЫЕ Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень прочными ковалентными связями. В природе встречается немного веществ с атомной кристаллической решёткой. К ним относятся бор, кремний, германий, кварц, алмаз. Вещества с АКР имеют высокие температуры плавления, обладают повышенной твёрдостью. Алмаз-самый твёрдый природный материал. МОЛЕКУЛЯРНЫЕ Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в них ковалентные, как полярные, так и неполярные. Связи в молекулах прочные, но между молекулами связи не прочные. Вещества с МКР имеют малую твёрдость, плавятся при низкой температуре, летучие, при обычных условиях находятся в газообразном или жидком состоянии МЕТАЛЛИЧЕСКИЕ Металлическими называют решётки, в узлах которых находятся атомы и ионы металла. Для металлов характерны физические свойства: пластичность, ковкость, металлический блеск, высокая электро- и теплопроводность
молекулярная кристаллическая решетка, в узлах которой распологаются молекулы, например Cl2,I2,h3, Br2 и т. д атомная кристаллическая решетка, в узлах которой находятся отдельные атомы, которые соединены очень прочными ковалентными связями, например алмаз металлическая кристаллическая решетка, в узлах которой распологаются атомы и ионы металла, ну это все металлы Na, K, Mg, Ca и другие ионная кристаллическая решетка в узлах которой находятся ионы, их образуют вещества с ионной связью. это соли, некоторые оксиды и гидроксиды металлов, самый простой пример NaCl, KI
я в химии не спец
проще в ПТУ пойти
<img src=»//otvet.imgsmail.ru/download/875a8375f91de049494d6073098e8a2f_04320ff2a7f6d0af76e63c0cbe7c2dc8.jpg» data-lsrc=»//otvet.imgsmail.ru/download/70045111_bb96a72841176dec8691b3ea7f621dad_120x120.jpg»>
В зависимости от вида частиц и от характера связи между ними различают четыре типа кристаллических решеток: ионные, молекулярные, атомные и металлические. Ионные кристаллические решетки Виды частиц в узлах решетки: ионы Для веществ с ионной химической связью будет характерна ионная решетка. Ионы-это частицы, имеющие положительный или отрицательный заряд. Напрмер NaCl, Соли, галогениды (IA,IIA),оксиды и гидроксиды типичных металлов. Физ. свойства: Твердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в воде, расплавы проводят электрический ток Атомные кристаллические решетки В узлах атомной кристаллической решетки находятся отдельные атомы. Ковалентная химическая связь. В данных решетках молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Примером веществ с таким типом кристаллических решеток могут служить аллотропные модификации углерода: алмаз, графит; а также бор, кремний, красный фосфор, германий. Простые по составу. Атомные кристаллические решетки имеют не только простые, но и сложные. Например, оксид алюминия, оксид кремния. Все эти вещества имеют очень высокие температуры плавления (у алмаза свыше 35000С) , прочны и тверды, нелетучи, практически нерастворимы в жидкостях. Металлические кристаллические решетки Металлическая связь. Связь в металлах между положительными ионами посредством обобществленных электронов. общие физические свойства для металлов характерны: блеск, электропроводность, теплопроводность, пластичность. Вещества с металлической связью имеют металлические кристаллические решетки В узлах таких решеток находятся атомы и положительные ионы металлов, а в объеме кристалла свободно перемещаются валентные электроны. Электроны электростатически притягивают положительные ионы металлов. Этим объясняется стабильность решетки. Молекулярные кристаллические решетки Эти вещества являются неметаллами. Простые по составу. Химическая связь внутри молекул ковалентная неполярная. Летучие, легкоплавкие, малорастворимые в воде. в узлах решетки нах. молекулы. молекулярную кристаллическую решетку могут иметь не только твердые простые вещества: благородные газы, h3,O2,N2, I2, O3, белый фосфор Р4, но и сложные: твердая вода, твердые хлороводород и сероводород. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар) . В узлах решеток находятся неполярные или полярные молекулы. Несмотря на то, что атомы внутри молекул связаны прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного взаимодействия.
в узлах атомных кристаллических решеток находятся отдельные атомы.
В зависимости от вида частиц и от характера связи между ними различают четыре типа кристаллических решеток: ионные, молекулярные, атомные и металлические. Ионные кристаллические решетки Виды частиц в узлах решетки: ионы Для веществ с ионной химической связью будет характерна ионная решетка. Ионы-это частицы, имеющие положительный или отрицательный заряд. Напрмер NaCl, Соли, галогениды (IA,IIA),оксиды и гидроксиды типичных металлов. Физ. свойства: Твердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в воде, расплавы проводят электрический ток Атомные кристаллические решетки В узлах атомной кристаллической решетки находятся отдельные атомы. Ковалентная химическая связь. В данных решетках молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Примером веществ с таким типом кристаллических решеток могут служить аллотропные модификации углерода: алмаз, графит; а также бор, кремний, красный фосфор, германий. Простые по составу. Атомные кристаллические решетки имеют не только простые, но и сложные. Например, оксид алюминия, оксид кремния. Все эти вещества имеют очень высокие температуры плавления (у алмаза свыше 35000С) , прочны и тверды, нелетучи, практически нерастворимы в жидкостях. Металлические кристаллические решетки Металлическая связь. Связь в металлах между положительными ионами посредством обобществленных электронов. общие физические свойства для металлов характерны: блеск, электропроводность, теплопроводность, пластичность. Вещества с металлической связью имеют металлические кристаллические решетки В узлах таких решеток находятся атомы и положительные ионы металлов, а в объеме кристалла свободно перемещаются валентные электроны. Электроны электростатически притягивают положительные ионы металлов. Этим объясняется стабильность решетки. Молекулярные кристаллические решетки Эти вещества являются неметаллами. Простые по составу. Химическая связь внутри молекул ковалентная неполярная. Летучие, легкоплавкие, малорастворимые в воде. в узлах решетки нах. молекулы. молекулярную кристаллическую решетку могут иметь не только твердые простые вещества: благородные газы, h3,O2,N2, I2, O3, белый фосфор Р4, но и сложные: твердая вода, твердые хлороводород и сероводород. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар) . В узлах решеток находятся неполярные или полярные молекулы. Несмотря на то, что атомы внутри молекул связаны прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного взаимодействияв узлах атомных кристаллических решеток находятся отдельные атомы
В зависимости от вида частиц и от характера связи между ними различают четыре типа кристаллических решеток: ионные, молекулярные, атомные и металлические. Ионные кристаллические решетки Виды частиц в узлах решетки: ионы Для веществ с ионной химической связью будет характерна ионная решетка. Ионы-это частицы, имеющие положительный или отрицательный заряд. Напрмер NaCl, Соли, галогениды (IA,IIA),оксиды и гидроксиды типичных металлов. Физ. свойства: Твердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в воде, расплавы проводят электрический ток Атомные кристаллические решетки В узлах атомной кристаллической решетки находятся отдельные атомы. Ковалентная химическая связь. В данных решетках молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Примером веществ с таким типом кристаллических решеток могут служить аллотропные модификации углерода: алмаз, графит; а также бор, кремний, красный фосфор, германий. Простые по составу. Атомные кристаллические решетки имеют не только простые, но и сложные. Например, оксид алюминия, оксид кремния. Все эти вещества имеют очень высокие температуры плавления (у алмаза свыше 35000С) , прочны и тверды, нелетучи, практически нерастворимы в жидкостях. Металлические кристаллические решетки Металлическая связь. Связь в металлах между положительными ионами посредством обобществленных электронов. общие физические свойства для металлов характерны: блеск, электропроводность, теплопроводность, пластичность. Вещества с металлической связью имеют металлические кристаллические решетки В узлах таких решеток находятся атомы и положительные ионы металлов, а в объеме кристалла свободно перемещаются валентные электроны. Электроны электростатически притягивают положительные ионы металлов. Этим объясняется стабильность решетки. Молекулярные кристаллические решетки Эти вещества являются неметаллами. Простые по составу. Химическая связь внутри молекул ковалентная неполярная. Летучие, легкоплавкие, малорастворимые в воде. в узлах решетки нах. молекулы. молекулярную кристаллическую решетку могут иметь не только твердые простые вещества: благородные газы, h3,O2,N2, I2, O3, белый фосфор Р4, но и сложные: твердая вода, твердые хлороводород и сероводород. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар) . В узлах решеток находятся неполярные или полярные молекулы. Несмотря на то, что атомы внутри молекул связаны прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного взаимодействия.
кристаллические решетки: ионные, молекулярные, атомные и металлические.
Ионные кристаллические решетки Данные типы кристаллических решеток присутствуют в соединениях с ионным типом связи. В этом случае узлы решетки содержат ионы, обладающие противоположным электрическим зарядом. Благодаря электромагнитному полю, силы межионного взаимодействия оказываются достаточно сильными, и это обуславливает физические свойства вещества. Обычными характеристиками являются тугоплавкость, плотность, твердость и возможность проводить электрический ток. Ионные типы кристаллических решеток имеются у таких веществ, как поваренная соль, нитрат калия и прочие. физические типы кристаллических решеток Атомные кристаллические решетки Этот тип строения вещества присущ элементам, структуру которых определяет ковалентная химическая связь. Типы кристаллических решеток подобного рода содержат в узлах отдельные атомы, связанные между собой крепкими ковалентными связями. Подобный тип связи возникает тогда, когда два одинаковых атома «делятся» электронами, тем самым образуют общую пару электронов для соседних атомов. Благодаря такому взаимодействию ковалентные связи равномерно и сильно связывают атомы в определенном порядке. Химические элементы, которые содержат атомные типы кристаллических решеток, обладают твердостью, высокой температурой плавления, плохо проводят электрический ток и химически неактивны. Классическими примерами элементов с подобным внутренним строением можно назвать алмаз, кремний, германий, бор. ЧТО ДЕЛАТЬ В СЛУЧАЕ ОХРИПЛОСТИ ИЛИ ПОТЕРИ ГОЛОСА? Голос человека – настоящее сокровище, которое многие не берегут. Важнейшим фактором, который влияет на голос, является состояние ЛОР-органов. Поэтому ларингит сопровождается охриплостью и даже полной потерей голоса. В случае потери голоса следует… Читать далее… SlickJump® Есть противопоказания. Посоветуйтесь с врачом. Молекулярные кристаллические решетки Вещества, имеющие молекулярный тип кристаллической решетки, представляют собой систему устойчивых, взаимодействующих, плотноупакованных между собой молекул, которые расположены в узлах кристаллической решетки. В подобных соединениях молекулы сохраняют свое пространственное положение в газообразной, жидкой и твердой фазе. В узлах кристалла молекулы удерживаются слабыми ван-дер-ваальсовыми силами, которые в десятки раз слабее сил ионного взаимодействия. молекулярный тип кристаллической решетки Образующие кристалл молекулы могут быть как полярными, так и неполярными. Из-за спонтанного движения электронов и колебания ядер в молекулах электрическое равновесие может смещаться – так возникает мгновенный электрический момент диполя. Соответствующим образом ориентированные диполи создают силы притяжения в решетке. Двуокись углерода и парафин являются типичными примерами элементов с молекуляной кристаллической решеткой. Женская грудь требует особого внимания и заботы… Не секрет, что мастопатия — это широко распространенное заболевание, от которого страдают многие женщины. Но не все знают, что его развитие может быть фоном для возникновения более серьезных… Читать далее… SlickJump® Металлические кристаллические решетки Металлическая связь гибче и пластичней ионной, хотя может показаться, что обе они базируются на одном и том же принципе. Типы кристаллических решеток металлов объясняют их типичные свойства – такие, например, как механическая прочность, тепло- и электропроводность, плавкость. Отличительной особенностью металлической кристаллической решетки является наличие положительно заряженных ионов металла (катионов) в узлах этой решетки. Между узлами находятся электроны, которые непосредственно участвуют в создании электрического поля вокруг решетки. Количество электронов, перемещающихся внутри этой кристаллической решетки, называется электронным газом. типы кри
touch.otvet.mail.ru
Таблица типов кристаллических решёток: йода, алмаза, графита, натрия

 Химия — удивительная наука. Столько невероятного можно обнаружить в, казалось бы, обычных вещах.
Химия — удивительная наука. Столько невероятного можно обнаружить в, казалось бы, обычных вещах.Всё материальное, что окружают нас повсюду, существует в нескольких агрегатных состояниях: газы, жидкости и твёрдые тела. Учёные выделили ещё и 4-е — плазму. При определённой температуре какое-либо вещество может переходить из одного состояние в другое. Например, вода: при нагревании свыше 100, из жидкой формы, превращается в пар. При температуре ниже 0 переходит в следующее агрегатную структуру — лёд.
…
Вконтакте
Google+
Мой мир
Весь материальный мир имеет в своём составе массу одинаковых частиц, которые между собой связаны. Эти мельчайшие элементы строго выстраиваются в пространстве и образуют так называемый пространственный каркас.
Это интересно: анионы и катионы в химии, таблица растворимости.
Определение

 Кристаллическая решётка — особая структура твёрдого вещества, при которой частицы стоят в геометрически строгом порядке в пространстве. В ней можно обнаружить узлы — места, где расположены элементы: атомы, ионы и молекулы и межузловое пространство.
Кристаллическая решётка — особая структура твёрдого вещества, при которой частицы стоят в геометрически строгом порядке в пространстве. В ней можно обнаружить узлы — места, где расположены элементы: атомы, ионы и молекулы и межузловое пространство.Твёрдые вещества, в зависимости от диапазона высоких и низких температур, являются кристаллическими или аморфными — они характеризуются отсутствием определённой температуры плавления. При воздействии повышенных температур они размягчаются и постепенно переходят в жидкую форму. К такого рода веществам относятся: смола, пластилин.
Это интересно: водородная связь — примеры, механизм образования.
В связи с этим можно поделить на несколько видов:
- атомную;
- ионную;
- молекулярную;
- металлическую.
Но при различных температурах одно вещество может иметь различные формы и проявлять многообразные свойства. Это явление называется аллотропной модификацией.
Это интересно: металлы и неметаллы в периодической таблице Менделеева.
Атомный тип
В этом типе в узлах расположены атомы того или иного вещества, которые связаны ковалентными связями. Этот вид связи образован парой электронов двух соседних атомов. Благодаря этому они связываются равномерно и в строгом порядке.
Вещества с атомной кристаллической решёткой характеризуются следующими свойствами: прочность и большая температура плавления. Такой тип связи представлен у алмаза, кремния и бора.
Ионный тип
Противоположно заряженные ионы находятся на узлах, которые создают электромагнитное поле, характеризующее физические свойства вещества. К таковым будут относиться: электропроводность, тугоплавкость, плотность и твёрдость. Поваренная соль и нитрат калия характеризуются наличием ионной кристаллической решётки.
Не пропустите: механизм образования металлической связи, конкретные примеры.
Молекулярный тип
В узлах такого типа находятся ионы, связанные между собой ван-дер-ваальсовыми силами. Благодаря слабым межмолекулярным связям такие вещества, например, лёд, двуокись углерода и парафин, характеризуются пластичностью, электро- и теплопроводностью.
Металлический тип
 В своём строении напоминает молекулярную, но имеет всё же более прочные связи. Отличие данного типа в том, что на её узлах находятся положительно заряженные катионы. Электроны, которые находятся в межузловом пространстве, участвуют в образовании электрического поля. Они ещё носят название электрического газа.
В своём строении напоминает молекулярную, но имеет всё же более прочные связи. Отличие данного типа в том, что на её узлах находятся положительно заряженные катионы. Электроны, которые находятся в межузловом пространстве, участвуют в образовании электрического поля. Они ещё носят название электрического газа.Простые металлы и сплавы, характеризуются металлическим типом решётки. Для них характерно наличие металлического блеска, пластичность, тепло- и электропроводность. Они могут плавиться при различных температурах.
| Виды | Вещества | Свойства |
| Атомная | Алмаз, графит, кремний, бор | Твёрдые, тугоплавкие, не растворяются в воде |
| Молекулярная | Йод, сера, белый фосфор, органические вещества | Нетвёрдые, легко плавятся, летучие |
| Ионная | Соли, оксиды и гидроксиды тяжёлых металлов | Твёрдые, хрупкие, легкоплавкие, электропроводны |
| Металлическая | Металлы и сплавы | Блестящие, ковкие, тепло- и электропроводны. |
Различные вещества

 Алмаз. Минерал обладает высокой ценностью и после огранки используется в ювелирных украшениях. Так в чём же заключается секрет популярности этого камня? Атомы углерода составляют основу всей решётки. Между атомами минерала существует прочная ковалентная связь. Для кристаллической решётки алмаза характерно плотное содержание атомов в виде куба. Другими словами, узлами считаются атомы углерода, а своеобразными гранями куба являются прочные ковалентные связи. Такой минерал считается самым прочным на планете, и неизвестно, сколько таких своеобразных кубов включает в себя цельный алмаз.
Алмаз. Минерал обладает высокой ценностью и после огранки используется в ювелирных украшениях. Так в чём же заключается секрет популярности этого камня? Атомы углерода составляют основу всей решётки. Между атомами минерала существует прочная ковалентная связь. Для кристаллической решётки алмаза характерно плотное содержание атомов в виде куба. Другими словами, узлами считаются атомы углерода, а своеобразными гранями куба являются прочные ковалентные связи. Такой минерал считается самым прочным на планете, и неизвестно, сколько таких своеобразных кубов включает в себя цельный алмаз.- Графит. Углерод также может быть и в другой кристаллической модификации. Атомная решётка данного элемента включает в себя только атомы углерода, ей присуща слоистая структура. В графите каждый атом связан тремя атомами углерода. Из-за этого он обладает металлическим блеском, высокой теплопроводностью.
- Кристаллическая решётка йода имеет молекулярный тип. Атомы молекул соединяются ковалентными связями, но молекулы химического элемента имеют слабые силы притяжения. Это характеризует йод тем, что он имеет малую твёрдость, низкую температуру плавления.
- Натрий. Представитель металлической кристаллической решётки. Между катионами, расположенными в узлах решётки, двигаются электроны. Они, присоединяясь к катионам, нейтрализуют их заряд, в свою очередь, нейтральные атомы отпускают часть электронов, преобразуясь в катионы. Такой тип кристаллической решётки наделяет металл пластичностью, электро- и теплопроводностью.
- Сухой лёд. Или оксид углерода в затвердевшем виде. Имеет молекулярную кристаллическую решётку в форме куба. Молекулы удерживаются между собой слабыми связями.
Это интересно: как определить валентность по таблице Менделеева?
obrazovanie.guru
Классификация кристаллических решеток — это… Что такое Классификация кристаллических решеток?
Кристалли́ческая решётка — пространственное периодическое расположение атомов или ионов в кристалле. Для описания кристаллической решётки достаточно знать расположение частиц в элементарной ячейке кристалла, повторением которой образуется вся кристаллическая решётка.
Общая характеристика
Существует огромное количество кристаллических структур. Их объединяет главное свойство кристаллического состояния вещества — закономерное положение атомов в кристаллической решётке. Одно и то же вещество может кристаллизоваться в разных кристаллических решётках и обладать весьма различными свойствами (классический пример графит — алмаз). В случае простых веществ это явление называется аллотропией, в общем случае любых химических соединенй — полиморфизмом. В то же время, разные вещества могут образовывать однотипные, или изоморфные, решётки, как, например, решётки многих металлов: меди, алюминия, серебра, золота. Иногда происходит замещение атомов в кристаллической решётке на атомы другого химического элемента с образованием твёрдого раствора.
В зависимости от пространственной симметрии, все кристаллические решётки подразделяются на семь кристаллических систем. По форме элементарной ячейки они могут быть разбиты на шесть сингоний. Все возможные сочетания имеющихся в кристаллической решётке поворотных осей симметрии и зеркальных плоскостей симметрии приводят к делению кристаллов на 32 класса симметрии, а с учётом винтовых осей симметрии и скользящих плоскостей симметрии на 230 пространственных групп.
Помимо основных трансляций, на которых строится элементарная ячейка, в кристаллической решётке могут присутствовать дополнительные трансляции, называемые решётками Браве. В трёхмерных решётках бывают гранецентрированная (F), объёмноцентрированная (I), базоцентрированная (A, B или C), примитивная (P) и ромбоэдрическая (трансляций состоит из множества векторов (a, b, c), во все остальные входят одна или несколько дополнительных трансляций. Так, в объёмноцентрированную систему трансляций Браве входит четыре вектора (a, b, c, ½(a+b+c)), в гранецентрированную — шесть (a, b, c, ½(a+b), ½(b+c), ½(a+c)). Базоцентрированные системы трансляций содержат по четыре вектора: A включает вектора (a, b, c, ½(b+c)), B — вектора (a, b, c, ½(a+c)), а C — (a, b, c, ½(a+b)), центрируя одну из граней элементарного объёма. В системе трансляций Браве R дополнительные трансляции возникают только при выборе гексагональной элементарной ячейки и в этом случае в систему трансляций R входят вектора (a, b, c, 1/3(a+b+c), —1/3(a+b+c)).
Решетки Браве
 Гранецентрированная F |  Объёмноцентрированная I | 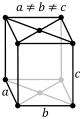 Базоцентрированная C | 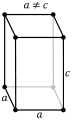 |
Простейшие кристаллические решётки
Плотнейшая кубическая упаковка
Плотнейшая гексагональная упаковка
Плотнейшую гексагональную упаковку имеет более 30 чистых элементов, например: бериллий, кадмий, титан и др. Особенно она характерна для металлов.
Решётка алмаза
Решётка алмаза представляет собой две кубические гранецентрированые решётки Браве, сдвинутые на четверть длины пространственной диагонали куба. Кроме алмаза этой решёткой обладают такие химические элементы как кремний, германий, а также одна из аллотропных модификаций олова, так называемое серое олово.
Литература
Ссылки
Wikimedia Foundation. 2010.
dic.academic.ru
Тема №5 «Вещества молекулярного и немолекулярного строения. Зависимость свойств веществ от особенностей их кристаллической решетки»
Оглавление
- Молекулярное и немолекулярное строение веществ
- Твердые вещества: аморфные и кристаллические
- Атомные кристаллические решетки
- Молекулярные кристаллические решетки
- Металлические кристаллические решетки
- Шпаргалки
- Задания для самопроверки

Молекулярное и немолекулярное строение веществ. Строение вещества

В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. По типу связи различают вещества молекулярного и немолекулярного строения. Вещества, состоящие из молекул, называются молекулярными веществами. Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы. К молекулярным веществам относятся вещества с атомной структурой (C, Si, Li, Na, K, Cu, Fe, W), среди них есть металлы и неметаллы. К веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли (NaCl, K2SO4), некоторые гидриды (LiH) и оксиды (CaO, MgO, FeO), основания (NaOH, KOH). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
 Молекулярные и немолекулярные вещества
Молекулярные и немолекулярные вещества
Твердые вещества: аморфные и кристаллические
Твердые вещества делятся на кристаллические и аморфные.
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки. В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними, различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl—, так и сложные SO42- , OH—. Следовательно, ионными кристаллическими решетками обладают соли, некоторые оксиды и гидроксиды металлов. Например, кристалл хлорида натрия построен из чередующихся положительных ионов Na+ и отрицательных Cl—, образующих решетку в форме куба. Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Кристаллическая решетка — а) и аморфная решетка — б).
 Кристаллическая решетка — а) и аморфная решетка — б).
Кристаллическая решетка — а) и аморфная решетка — б).Атомные кристаллические решетки
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями. Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода. Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она свыше 3500 °С), они прочны и тверды, практически нерастворимы.
 Атомная решетка алмаза
Атомная решетка алмаза Атомная решетка графита
Атомная решетка графита
Молекулярные кристаллические решетки
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и полярными (HCl, H2O), и неполярными (N2, O2). Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
 Молекулярная кристаллическая решетка(углекислый газ)
Молекулярная кристаллическая решетка(углекислый газ)
Металлические кристаллические решетки
Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
 Металлическая кристаллическая решетка
Металлическая кристаллическая решетка Шпаргалки
Шпаргалки


 Взаимосвязь между типом кристаллической решетки и типом связи в веществе
Взаимосвязь между типом кристаллической решетки и типом связи в веществе


Справочный материал для прохождения тестирования:
 Таблица Менделеева
Таблица Менделеева  Таблица растворимости
Таблица растворимостиwww.chem-mind.com


 Шпаргалки
Шпаргалки