Массовая доля вещества в растворе. Видеоурок. Химия 8 Класс
Данный урок посвящен изучению темы «Массовая доля вещества в растворе». С помощью материалов урока Вы научитесь количественно оценивать содержание растворенного вещества в растворе, а также определять состав раствора по данным о массовой доле растворенного вещества.
Тема: Классы неорганических веществ
Урок: Массовая доля вещества в растворе
Масса раствора складывается из масс растворителя и растворенного вещества:
m(р)=m(в)+m(р-ля)
Массовая доля вещества в растворе равна отношению массы растворенного вещества к массе всего раствора:

Решим несколько задач с использованием приведенных формул.
Вычислите массовую долю (в %) сахарозы в растворе, содержащем воду массой 250 г и сахарозу массой 50 г.
Массовую долю сахарозы в растворе можно вычислить по известной формуле: 
Подставляем числовые значения и находим массовую долю сахарозы в растворе. Получили в ответе 16,7%.
Преобразуя формулу для вычисления массовой доли вещества в растворе, вы можете находить значения массы растворенного вещества по известной массе раствора и массовой доли вещества в растворе; или массу растворителя по массе растворенного вещества и массовой доли вещества в растворе.
Рассмотрим решение задачи, в которой изменяется массовая доля растворенного вещества при разбавлении раствора.
К 120 г раствора с массовой долей соли 7% прилили 30 г воды. Определите массовую долю соли в образовавшемся растворе.
Проанализируем условие задачи. В процессе разбавления раствора масса растворенного вещества не меняется, а увеличивается масса растворителя, а значит, увеличивается масса раствора и, наоборот, уменьшается массовая доля вещества в растворе.
Во-первых, определим массу растворенного вещества, зная массу начального раствора и массовую долю соли в этом растворе. Масса растворенного вещества равна произведению массы раствора и массовой доли вещества в растворе.
Мы уже выяснили, что масса растворенного вещества при разбавлении раствора не изменяется. Значит, вычислив массу полученного раствора, можно найти массовую долю соли в образовавшемся растворе.
Масса полученного раствора равна сумме масс исходного раствора и добавленной воды. Массовая доля соли в образовавшемся растворе равна отношению массы растворенного вещества и массы образовавшегося раствора. Таким образом, получили массовую долю соли в образовавшемся растворе равную 5,6%.
Список рекомендованной литературы
1. Сборник задач и упражнений по химии: 8-й кл.: к учеб. П.А. Оржековского и др. «Химия. 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с.111-116)
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под.ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.111-115)
3. Химия. 8 класс. Учеб.для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.:Астрель, 2013. (§35)
4. Химия: 8-й класс: учеб.для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005. (§41)
5. Рудзитис Г.Е., Фельдман Ф.Г. Химия: неорг. химия: учеб. для 8 кл. общеобразоват. учреждений. М.: Просвещение. 2018. § 33.
6. Энциклопедия для детей. Том 17. Химия / Глав.ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Растворы (Источник).
2. Растворы. Растворимость(Источник).
3. Взаимодействие веществ с водой (Источник).
Домашнее задание
1. с. 113-114 №№ 9,10 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под.ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
2. с.197 №№ 1,2 из учебника П.А. Оржековского, Л.М. Мещеряковой, М.М. Шалашовой «Химия: 8кл.», 2013 г.
interneturok.ru
1-й раствор | 2-й раствор | 3-й раствор | |
mр.в. | |||
mр-ра | |||
ωр.в. |
1-й раствор | 2-й раствор | 3-й раствор | |
mр.в. | |||
mр-ра | 150 г | 100 г | |
ωр.в. | 15% | 20% | искомая величина |
Нам следует вспомнить следующие формулы, необходимые для расчетов:
ωр.в. = 100% ∙ mр.в./mр-ра , mр.в. = mр-ра ∙ ωр.в./100% , mр-ра = 100% ∙ mр.в. /ωр.в.
Начинаем заполнять таблицу.
Если в строчке или столбце отсутствует только одно значение, то его можно посчитать. Исключение — строчка с ωр.в., зная значения в двух ее ячейках, значение в третьей рассчитать нельзя.
В первом столбце отсутствует значение только в одной ячейке. Значит мы можем рассчитать его:
m(1)р.в. = m(1)р-ра ∙ ω(1)р.в. /100% = 150 г ∙ 15%/100% = 22,5 г
Аналогично у нас известны значения в двух ячейках второго столбца, значит:
m(2)р.в. = m(2)р-ра ∙ ω(2)р.в. /100% = 100 г ∙ 20%/100% = 20 г
Внесем рассчитанные значения в таблицу:
1-й раствор | 2-й раствор | 3-й раствор | |
mр.в. | 22,5 г | 20 г | |
mр-ра | 150 г | 100 г | |
ωр.в. | 15% | 20% | искомая величина |
Теперь у нас стали известны два значения в первой строке и два значения во второй строке. Значит мы можем рассчитать недостающие значения (m(3)р.в. и m(3)р-ра):
m(3)р.в. = m(1)р.в. + m(2)р.в. = 22,5 г + 20 г = 42,5 г
m(3)р-ра = m(1)р-ра + m(2)р-ра = 150 г + 100 г = 250 г.
Внесем рассчитанные значения в таблицу, получим:
1-й раствор | 2-й раствор | 3-й раствор | |
mр.в. | 22,5 г | 20 г | 42,5 г |
mр-ра | 150 г | 100 г | 250 г |
ωр.в. | 15% | 20% | искомая величина |
Вот теперь мы вплотную подобрались к расчету искомой величины ω(3)р.в.. В столбце, где она расположена, известно содержимое двух других ячеек, значит мы можем ее рассчитать:
ω(3)р.в. = 100% ∙ m(3)р.в./m(3)р-ра = 100% ∙ 42,5 г/250 г = 17%
Пример 4
К 200 г 15%-ного раствора хлорида натрия добавили 50 мл воды. Какова массовая доля соли в полученном растворе. Ответ укажите с точностью до сотых _______%
Решение:
Прежде всего следует обратить внимание на то, что вместо массы добавленной воды, нам дан ее объем. Рассчитаем ее массу, зная, что плотность воды равна 1 г/мл:
mдоб.(H2O) = Vдоб.(H2O) ∙ ρ(H2O) = 50 мл ∙ 1 г/мл = 50 г
Если рассматривать воду как 0%-ный раствор хлорида натрия, содержащий соответственно 0 г хлорида натрия, задачу можно решить с помощью такой же таблицы, как в примере выше. Начертим такую таблицу и вставим известные нам значения в нее:
1-й раствор | 2-й раствор | 3-й раствор | |
mр.в. | 0 г | ||
mр-ра | 200 г | 50 г | |
ωр.в. | 15% | 0% | искомая величина |
В первом столбце известны два значения, значит можем посчитать третье:
m(1)р.в. = m(1)р-ра ∙ ω(1)р.в./100% = 200 г ∙ 15%/100% = 30 г,
Во второй строчке тоже известны два значения, значит можем рассчитать третье:
m(3)р-ра = m(1)р-ра + m(2)р-ра = 200 г + 50 г = 250 г,
Внесем рассчитанные значения в соответствующие ячейки:
1-й раствор | 2-й раствор | 3-й раствор | |
mр.в. | 30 г | 0 г | |
mр-ра | 200 г | 50 г | 250 г |
ωр.в. | 15% | 0% | искомая величина |
Теперь стали известны два значения в первой строке, значит можем посчитать значение m(3)р.в. в третьей ячейке:
m(3)р.в. = m(1)р.в. + m(2)р.в. = 30 г + 0 г = 30 г
1-й раствор | 2-й раствор | 3-й раствор | |
mр.в. | 30 г | 0 г | 30 г |
mр-ра | 200 г | 50 г | 250 г |
ωр.в. | 15% | 0% | искомая величина |
Теперь можем рассчитать массовую долю в третьем растворе:
ω(3)р.в. = 30/250 ∙ 100% = 12%.
scienceforyou.ru
Вычисление массовой доли элемента или вещества
Как вычислить массовую долю элемента в веществе
Массовая доля элемента ω(Э) % — это отношение массы данного элемента m (Э) во взятой молекуле вещества к молекулярной массе этого вещества Mr (в-ва).
Массовую долю элемента выражают в долях от единицы или в процентах:
ω(Э) = m (Э) / Мr(в-ва) (1)
ω% (Э) = m(Э) · 100%/Мr(в-ва)
Сумма массовых долей всех элементов вещества равна 1 или 100%.
Так, для вещества АxВy в долях от единицы:
ω(A) = Ar(Э) · Х / Мr(в-ва) (2)
Из пропорции (2) выведем расчетную формулу для определения индексов (х, y) в химической формуле вещества, если известны массовые доли обоих элементов и молярная масса вещества:
Х = ω%(A) · Mr(в-ва) / Аr(Э) · 100% (3)
Разделив ω% (A) на ω% (В) , т.е. преобразовав формулу (2), получим:
ω(A) / ω(В) = Х · Ar(А) / У · Ar(В) (4)
Расчетную формулу (4) можно преобразовать следующим образом:
Х : У = ω%(A) / Ar(А) : ω%(В) / Ar(В) = X(А) : У(В) (5)
Расчетные формулы (3) и (5) используют для определения формулы вещества.
Если известны число атомов в молекуле вещества для одного из элементов и его массовая доля, можно определить молярную массу вещества:
Mr(в-ва) = Ar(Э) · Х / W(A)
Примеры решения задач на вычисление массовых долей химических элементов в сложном веществе
Пример 1. Определите массовые доли химических элементов в серной кислоте H2SO4 и выразите их в процентах.
1. Вычисляем относительную молекулярную массу серной кислоты:
Mr (H2SO4) = 1 · 2 + 32 + 16 · 4 = 98
2. Вычисляем массовые доли элементов.
Для этого численное значение массы элемента (с учетом индекса) делят на молярную массу вещества:
Учитывая это и обозначая массовую долю элемента буквой ω, вычисления массовых долей проводят так:
ω(Н) = 2 : 98 = 0,0204, или 2,04%;
ω(S) = 32 : 98 = 0,3265, или 32,65%;
ω(О) = 64 : 98 =0,6531, или 65,31%
Пример 2. Определите массовые доли химических элементов в оксиде алюминия Al2O3 и выразите их в процентах.
1. Вычисляем относительную молекулярную массу оксида алюминия:
Mr( Al2O3
2. Вычисляем массовые доли элементов:
ω(Al) = 54 : 102 = 0,53 = 53%
ω(O) = 48 : 102 = 0,47 = 47%
Как вычислить массовую долю вещества в кристаллогидрате
Массовая доля вещества — отношение массы данного вещества в системе к массе всей системы, т.е. ω(Х) = m(Х) / m,
где ω(X) — массовая доля вещества Х,
m(X) — масса вещества Х,
m — масса всей системы
Массовая доля — безразмерная величина. Её выражают в долях от единицы или в процентах.
Пример 1. Определите массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2·2H2O.
Молярная масса BaCl2·2H2O составляет:
М(BaCl2·2H2O) = 137+ 2 · 35,5 + 2 · 18 = 244 г/моль
Из формулы BaCl2·2H2O следует, что 1 моль дигидрата хлорида бария содержит 2 моль H2O. Отсюда можно определить массу воды, содержащейся в BaCl2·2H2O:
m(h3O) = 2 · 18 = 36 г.
Находим массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2·2H2O.
ω(H2O) = m(H2O)/m(BaCl2 · 2H2O) = 36 / 244 = 0,1475 = 14,75%.
Пример 2. Из образца горной породы массой 25 г, содержащей минерал аргентит Ag2S, выделено серебро массой 5,4 г. Определите массовую долю аргентита в образце.
Дано: m(Ag )=5,4 г m = 25 г | Решение Определяем количество вещества серебра, находящегося в аргентите: n(Ag ) = m(Ag) / M(Ag) = 5,4 / 108 = 0,05 моль. Из формулы Ag2S следует, что количество вещества аргентита в два раза меньше количества вещества серебра. Определяем количество вещества аргентита: n(Ag2S) = 0,5 · n(Ag) = 0,5 · 0,05 = 0,025 моль Рассчитываем массу аргентита: m(Ag2S) = n(Ag2S) · М(Ag2S) = 0,025 · 248 = 6,2 г . Теперь определяем массовую долю аргентита в образце горной породы, массой 25 г. ω(Ag2S) = m(Ag2S) / m = 6,2/25 = 0,248 = 24,8%. |
Найти: ω(Ag2S) = ? |
examchemistry.com
Массовая доля химического вещества онлайн
| Формула химического вещества |
| Молярная масса вещества (Грамм/Моль) |
| Процентное содержание элементов в заданном веществе |
| Массовое содержание элементов в веществе |
Массовая доля элемента
Что же такое массовая доля? Например, массовая доля химического элемента — это отношении массы элемента к массе всего вещества. Массовая доля может выражаться как в процентах, так и долях.
Где же может применятся массовая доля?
Вот одни из направлений:
— определение элементарного состава сложного химического вещества
— содержание массовых долей элементов
— нахождение массы элемента по массе сложного вещества
Для расчетов используется калькулятор Молярная масса вещества онлайн с расширенными данными которые можно увидеть если пользоватся XMPP запросом.
Расчет подобных задач, что указаны выше, при примении этой страницы становятся еще проще, удобнее и точнее. Кстати про точность. В школьных учебниках почему то молярные массы элементов округлены до целых значений, что для решения школьных задач это вполне пригодится, хотя на самом деле молярные массы каждого химического элемента периодически предаются корректировке.
Наш калькулятор не стремится показать высокую точность (выше 5-ти знаков после запятой), хотя в этом нет ничего сложного. В большинстве своем, те атомные массы элементов, которые используют калькулятор, достаточны для решения поставленных задач на определение массовых долей элементов
Но для тех педантов 🙂 , которым важна точность, хотелось бы порекомендовать ссылку Atomic Weights and Isotopic Compositions for All Elements в которой отображены все химические элементы, их относительные атомные массы, а также массы всех изотопов каждого из элемента.
Вот и все, что хотелось бы сказать. Теперь будем рассматривать конкретные задачи и как их решать. Заметьте что несмотря на то, что они все разнородны, они в своей сути опираются на молярную массу вещества и массовые доли элементов в этом веществе
На начало осени 2017 года, я добавил еще один калькульятор Мольные доли вещества и количество атомов, который поможет решать задачи на массу чистого вещества в сложном веществе, количество моль в веществе и в каждом элементе, а также количество атомов/молекул в веществе.
Примеры
Вычислит массовую долю элементов в меди сульфате CuSO4
Запрос очень простой, просто пишем формулу и получаем результат который и будет нашим ответом
| Формула химического вещества |
| Молярная масса вещества (Грамм/Моль) |
|
159.6036 |
| Процентное содержание элементов в заданном веществе |
|
|
| Массовое содержание элементов в веществе |
|
|
Как уже сказано в школьных учебниках идет достаточно угрубленные значения, поэтому не удивляйтесь если в ответах бумажных книг Вы увидите Cu = 40% ,O = 40%, S = 20%. Это скажем так «побочные эффекты» упрощения школьного материала, для учеников. Для реальных задач наш ответ (ответ бота) естественно более точен.
Если речь шла о том , что бы выразить в долях а не процентах, то делим проценты каждого из элементов на 100 и получаем ответ в долях.
Сколько натрия содержится в 10 тоннах криолина Na3[AlF6]?
Введем формулу криолина и получим следующие данные
| Формула химического вещества |
| Молярная масса вещества (Грамм/Моль) |
|
209.94125 |
| Процентное содержание элементов в заданном веществе |
|
|
| Массовое содержание элементов в веществе |
|
|
Из полученных данных мы видим, что в 209,9412 количестве вещества содержится 68,96931 количества натрия.
В граммах ли мы будем это измерять, в килограммах или тоннах для соотношения это ничего не меняется.
Теперь осталось построить другое соответствие где у нас есть 10 тон исходного вещества и неизвестное количество натрия
Это получилась типичная пропорция. Можно конечно воспользоваться ботом Расчет пропорций и соотношений но данная пропорция настолько проста, что сделаем это ручками.
209,9412 относится к 10(тоннам) как 68,96391 к неизвестному числу.
Таким образом количество натрия (в тоннах) в криолине составит 68.96391*10/209.9412=3.2849154906231 тонны натрия.
Опять же для школы иногда придется округлять до целого числа массовое содержание элементов в веществе, но ответ фактически не сильно отличается от предыдущего
69*10/210=3.285714
Точность до сотых долей совпадает.
Вычислить сколько кислорода содержится в 50 тоннах фосфата кальция Ca3(PO4)2 ?
Массовые доли заданного вещества следующие
| Формула химического вещества |
| Молярная масса вещества (Грамм/Моль) |
|
310.18272 |
| Процентное содержание элементов в заданном веществе |
|
|
| Массовое содержание элементов в веществе |
|
|
Та же самая пропорция что и в предыдущей задаче 310.18272 относится к 50 (тоннам) так же как и 127.9952 к неизвестной величине
ответ 20,63 тонны кислорода находится в заданной массе вещества.
Если же мы добавим к формуле служебный символ восклицательный знак, говорящий нам о том что задача школьная(используются грубые округления атомных масс до целых чисел), то ответ получим следующий:
| Формула химического вещества |
| Молярная масса вещества (Грамм/Моль) |
|
310 |
| Процентное содержание элементов в заданном веществе |
|
|
| Массовое содержание элементов в веществе |
|
|
Пропорция будет уже вот такой
310 относится к 50 (тоннам) так же как и 128 к неизвестной величине. И ответ
20,64 тонны
Как то так 🙂
Удачи в расчетах!!
- Металлы и неметаллы >>
abakbot.ru
Конспект «Решение задач с долей вещества в смеси»
Решение задач с долей вещества в смеси, в соединении
Ключевые слова конспекта: массовая доля вещества в смеси или растворе, молярная доля вещества, объемная доля вещества, массовая доля элемента в соединении, масса элемента, массовая доля элемента.
Массовую долю вещества в смеси или растворе вычисляют как отношение массы вещества, входящего в состав смеси, к массе всей смеси. Массовую долю часто выражают в процентах. Для этого отношение массы вещества к массе смеси умножают на 100%:

Аналогично объемную долю вещества вычисляют как отношение объема вещества к объему смеси, а молярную долю вещества — как отношение количества вещества одного из компонентов смеси к сумме количеств веществ всех компонентов смеси:

Массовую долю элемента в соединении вычисляют как отношение массы элемента, входящего в состав данного соединения, к массе всего соединения:

Зная молекулярную формулу соединения, массу элемента, входящего в его состав, вычисляют как произведение молярной массы элемента на число атомов этого элемента в соединении.
В этом случае массовую долю элемента в соединении рассчитывают как отношение этой величины к молярной массе всего соединения:

Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
25 г оксида магния смешали с 35 г оксида алюминия. Определите массовую долю оксида магния в данной смеси.
Ответ. ω(MgO) = 0,417, или 41,7%.
Задача № 2. Вычислите объемную долю азота в смеси газов, содержащей 32 л азота, 48 л углекислого газа, 36 л гелия и 14 л водорода.
Посмотреть РЕШЕНИЕ


Ответ. φ(N2) = 0,246, или 24,6%.
Задача № 3. Вычислите молярную и массовую долю (в %) оксида углерода (II) в смеси, содержащей 16,8 л (н. у.) оксида углерода (II) и 13,44 л (н. у.) оксида углерода (IV).
Посмотреть РЕШЕНИЕ


Ответ. χ(СО) = 55,56%, ω(СО) = 44,3%.
Задача № 4. В воде растворили 15 г хлорида натрия. Вычислите массу полученного раствора, если массовая доля соли в нем равна 5%.
Посмотреть РЕШЕНИЕ


Ответ: m(р-ра) = 300 г.
Задача № 5. Образец сплава меди с цинком имеет массу 75 г. Массовая доля меди в этом сплаве равна 64%. Определите массу цинка в данном образце.
Посмотреть РЕШЕНИЕ


Ответ. m(Zn) = 27 г.
[highlight]Задача № 6.[/highlight] Объемная доля аммиака в смеси с кислородом равна 40%. Вычислите плотность данной смеси по воздуху.
Посмотреть РЕШЕНИЕ


Ответ. Dвозд(смеси) = 0,896.
Задача № 7. Найдите массовую долю кислорода в фосфате натрия.
Посмотреть РЕШЕНИЕ


Ответ. ω (O) = 39%.
[highlight]Задача № 8.[/highlight] Определите массовую долю фосфора в смеси, содержащей 55 г фосфата натрия и 70 г дигидрофосфата натрия.
Посмотреть РЕШЕНИЕ


Ответ. ω(Р) = 22,77%
[highlight]Задача № 9.[/highlight] Массовая доля серы в техническом сульфате натрия равна 20,48%. Рассчитайте массовую долю примесей в данном продукте (в %).
Посмотреть РЕШЕНИЕ


Ответ. ω (примесей) = 9,12%.
Задача № 10. Плотность смеси оксида азота (II) и оксида азота (IV) по водороду равна 17,8. Найдите массовую долю оксида азота (IV) в данной смеси.
Посмотреть РЕШЕНИЕ


Ответ. ω(NO2) = 45,2%.
Решение задач с долей вещества в смеси, в соединении. Выберите дальнейшие действия:
uchitel.pro
Конспект «Массовая доля элемента в соединении»
«Массовая доля элемента в соединении»
Ключевые слова конспекта: массовая доля элемента в соединении, вычисления по химическим формулам.
Относительная атомная масса элемента (Аr) показывает, во сколько раз масса его атома больше 1/12 массы атома углерода, масса которого равна 12 а.е.м. Относительная молекулярная масса (Мr) вещества показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода. Она складывается из относительных атомных масс элементов, составляющих молекулу:

Массовая доля химического элемента (ω) в сложном веществе показывает, какая доля от всей массы сложного вещества приходится на массу этого элемента.

Массовая доля элемента в соединении равна отношению его массы в данном веществе к относительной молекулярной массе этого вещества
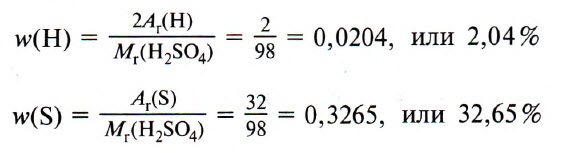

Вывод химических формул,
если известны массовые доли химических элементов,
входящих в состав данного вещества
Задача. Известно, что массовые доли натрия, серы и кислорода в данном веществе соответственно составляют 29,1 %, 40,51 % и 30,38 %. Вычислите индексы в химической формуле вещества NaxSyOz
Решение. Прежде всего из условия задачи следует, что в 100 единицах массы вещества: 29,1 единицы натрия, 40,51 единицы серы и 30,38 единицы кислорода. Если каждое из этих чисел разделить на относительные атомные массы соответствующих элементов; то в таком случае находим число атомов каждого элемента в 100 единицах вещества:
29,1 : 23 = 1,265 атома Na
40,51 : 32 = 1,266 атома S
30,38 : 16 = 1,899 атома О
В результате можно определить соотношение чисел атомов в формуле вещества:
х : у : z = 1,265 : 1,266 : 1,899
Чтобы получить соотношения целых чисел; разделим все числа атомов на наименьшее из них (на 1,265):
1 : 1 : 1,5
Для того чтобы количество атомов кислорода было выражено целым числом; полученные числа атомов умножаем на два:
х : у : z = (1 • 2) : (1 • 2) : (1,5 • 2) = 2 : 2 : 3
Эти числа принимаются в качестве индексов в простейшей формуле данного вещества — Na2S203.
Конспект урока «Массовая доля элемента в соединении».
Следующая тема: «».
uchitel.pro
Молекула. Молекулярная масса. Массовая доля элемента.
На данный момент известно около 120 разных химических элементов, из которых в природе можно обнаружить не более 90. Многообразие же различных химических веществ вокруг нас несоизмеримо больше этого числа.
Связано это с тем, что крайне редко химические вещества состоят из отдельных, не связанных между собой атомов химических элементов. Таким строением в обычных условиях обладает лишь небольшой ряд газов называемых благородными — гелий, неон, аргон, криптон, ксенон и радон. Чаще же всего, химические вещества состоят не из разрозненных атомов, а из их объединений в различные группировки.
То есть атомы большинства химических элементов способны связываться друг с другом. Чаще всего в результате этого получаются молекулы – частицы, представляющие собой группировки из двух или более атомов. Например, химическое вещество водород состоит из молекул водорода, которые образуются из атомов следующим образом:

Рисунок 3. Образование молекулы водорода
Образовывать связи друг с другом могут и атомы разных химических элементов, так, например, при взаимодействии атома кислорода с двумя атомами водорода образуется молекула воды:
Рисунок 4. Образование молекулы воды
Поскольку каждый раз рисовать атомы химических элементов и подписывать их неудобно, для отражения состава молекул были придуманы химические формулы. Так, например, формула молекулярного водорода записывается как Н2, где число 2, написанное подстрочным шрифтом справа от символа атома водорода, означает количество атомов данного типа в молекуле. Таким образом, формулу воды можно записать как H2O. Единица, которая должна показывать количество атомов кислорода в молекуле, согласно принятым в химии правилам, не пишется. Числа, обозначающие количества атомов в составе одной молекулы называют индексами.
Рассмотрим еще несколько примеров химических формул веществ. Так, формула аммиака записывается как NH3, что говорит о том, что каждая молекула аммиака состоит из одного атома азота и трех атомов водорода.
Нередко встречаются молекулы, в которых можно насчитать несколько одинаковых групп атомов. Например, из формулы сульфата алюминия Al2(SO4)3, можно сделать вывод о том, что в составе молекулы данного вещества находятся две группы атомов SO4.
Таким образом, химические формулы веществ однозначно характеризуют как их качественный, так и количественный состав.
Из всего вышесказанного логично вытекает закон постоянства состава вещества, установленный еще в 1808 году французским ученым Жозефом Луи Прустом, и звучит он следующим образом:
Любое чистое химическое вещество имеет постоянный качественный и количественный состав, не зависящий от способа получения этого вещества.
Поскольку любое химическое вещество является совокупностью молекул одинакового состава, это приводит к тому, что пропорции между атомами химических элементов в любой порции вещества такие же, как и в одной молекуле данного вещества. Все различия в химических свойствах веществ зависят от количественного и качественного состава молекул и кроме того, от порядка связей атомов между собой, если таковое возможно.
Таким образом, можно дать следующее определение термина молекула:
Молекула – это наименьшая частица какого-либо химического вещества обладающая его химическими свойствами.
Аналогично относительной атомной массе, существует также и такое понятие как относительная молекулярная масса Mr:
Относительная молекулярная масса (Mr) вещества это отношение массы одной молекулы этого вещества к одной двенадцатой массы одного атома углерода (1 атомной единице массы).
Таким образом, очевидно, что относительная молекулярная масса складывается из относительных атомных масс элементов, каждая из которых помножена на количество атомов данного конкретного типа в одной молекуле. Так, например, относительная молекулярная масса молекулы азотной кислоты HNO3 складывается из относительной атомной массы водорода, относительной атомной массы азота и трех относительных атомных масс кислорода:
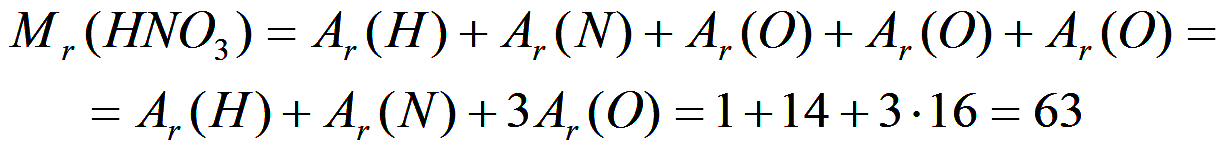
Для описания качественного и количественного состава вещества используют такое понятие как массовая доля химического элемента w(X):
Массовая доля (ω) химического элемента в веществе — это отношение относительной атомной массы Ar(X) данного элемента, помноженной на число его атомов в молекуле, к относительной молекулярной массе Ar(X) данного вещества.
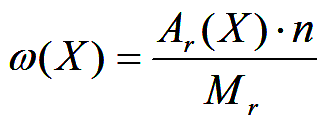
где ω(Х) — массовая доля элемента X; Аr(Х) — его относительная атомная масса; n — число атомов X в одной молекуле вещества; Мr — относительная молекулярная масса химического вещества.
Чаще всего, массовую долю химического элемента выражают в процентах, в этом случае формульное выражение массовой доли в процентах ω%(Х) будет иметь вид:
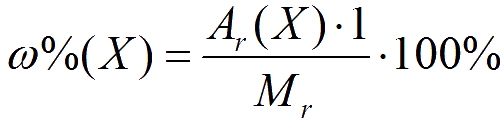
Рассчитаем в качестве примера массовые доли водорода, азота и кислорода в молекуле азотной кислоты (НNO3):
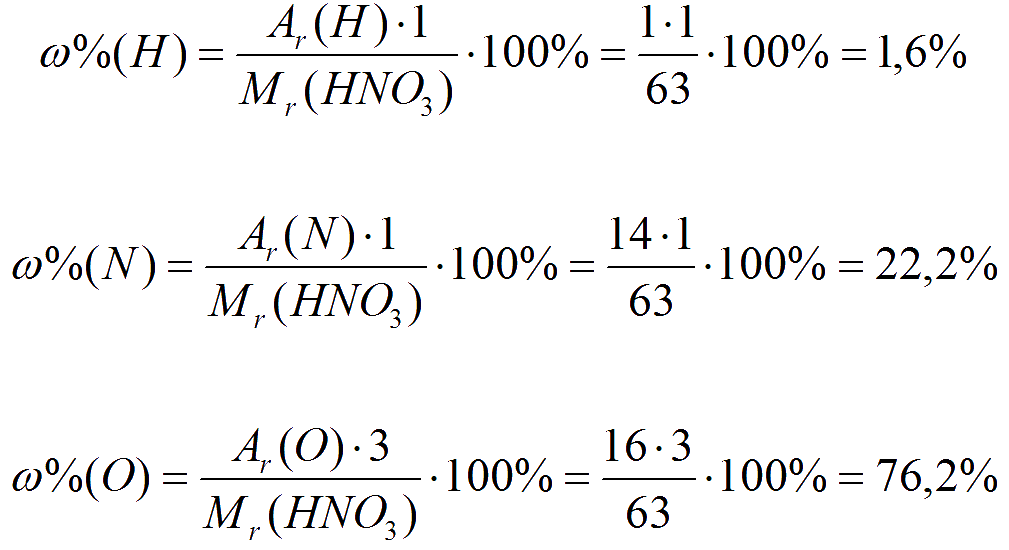
scienceforyou.ru
