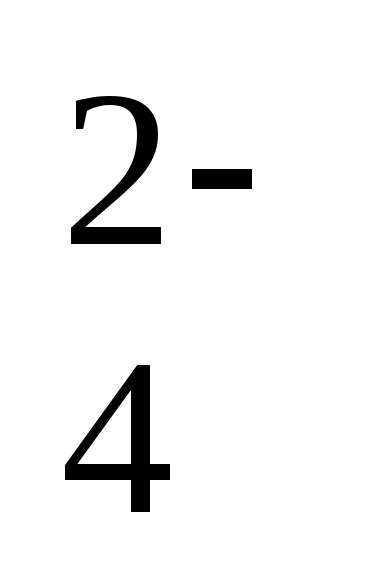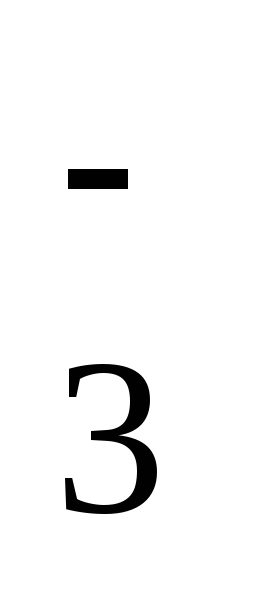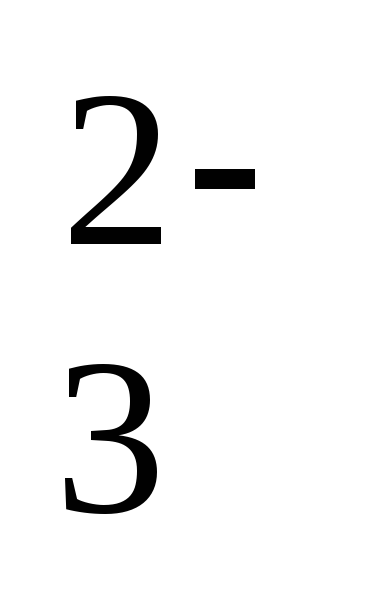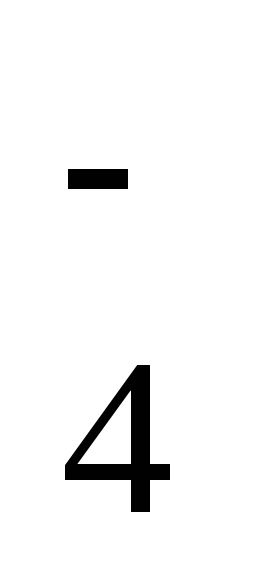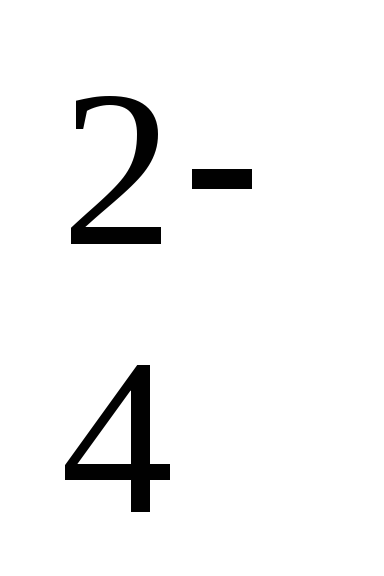список кислот
Названия наиболее часто встречающихся на практике кислот и соответствующих им кислотных остатков
Кислота | Кислотный остаток | ||
Формула | Название | Формула | Название |
HF | Фтороводородная (плавиковая) | F— | Фторид |
HCl | Хлороводородная (соляная) | Cl— | Хлорид |
HBr | Бромоводородная | Br— | Бромид |
HI | Иодоводородная | I— | Иодид |
HCN | Циановодородная (синильная) | CN— | Цианид |
HClO4 | Хлорная | ClO | Перхлорат |
HClO3 | Хлорноватая | ClO | Хлорат |
HClO2 | Хлористая | ClO | Хлорит |
HClO | Хлорноватистая | ClO— | Гипохлорит |
HMnO4 | Марганцевая | MnO | Перманганат |
H2MnO4 | Марганцовистая | MnO | Манганат |
H2S | Сероводородная | HS— S2- | Гидросульфид Сульфид |
H2SO4 | Серная | HSO SO | Гидросульфат Сульфат |
H | Сернистая | HSO SO | Гидросульфит Сульфит |
H2CrO4 | Хромовая | HCrO CrO42- | Гидрохромат Хромат |
H2Cr2O 7 | Двухромовая (дихромовая) | HCr2O7— Cr2O72- | Гидродихромат Дихромат |
HNO3 | Азотная | NO3— | Нитрат |
HNO2 | Азотистая | NO2— | Нитрит |
НРО3 | Метафосфорная | РО3– | Метафосфат |
Н3РО4 | Ортофосфорная (фосфорная) | Н2РО4– НРО РО43– | Дигидрофосфат Гидрофосфат Ортофосфат (фосфат) |
Н4Р2О7 | Дифосфорная (пирофосфорная) | Н3Р2О Н2Р2О72– НР2О Р2О74- | Тригидродифосфат Дигидродифосфат Гидродифосфат Дифосфат (пирофосфат) |
Н3РО3 | Фосфористая | НРО32- | Фосфит |
Н2СО3 | Угольная | НСО3– СО32– | Гидрокарбонат Карбонат |
H2SiO3 | Метакремниевая (кремниевая) | HsiO3– SiO32– | Гидросиликат Силикат |
H4SiO4 | Ортокремниевая | SiO44– | Ортосиликат |
H2SnO3 | Оловянная | SnO | Станнат |
HAlO2 | – | AlO2– | Метаалюминат (алюминат) |
H2ZnO2 | – | ZnO22– | Цинкат |
H2BeO2 | – | BeO22– | Бериллат |
H2FeO4 | – | FeO42– | Феррат |
HFeO2 | – | FeO2– | Метаферрит (феррит) |
НСООН | Метановая (муравьиная) | НСОО— | Формиат |
СН3СООН | Этановая (уксусная) | СН3СОО— | Ацетат |
studfile.net
Кислоты
Слово «кислота» каждый слышал в повседневной жизни. Каждый знает, что в лимонах – лимонная кислота, в яблоках – яблочная кислота, в листьях щавеля – щавелевая кислота. Кроме этого, такая муравьиная кислота присутствует в пчелином яде, а также помогает муравьям защищаться от врагов. При скисании виноградного сока образуется уксусная кислота, при скисании молока или квашении капусты – молочная кислота. Многие кислоты человек использует в своей жизни, например, уксусную кислоту, а такие кислоты, как соляная и серная широко используются в народном хозяйстве.

Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка. Атом водорода в кислотах всегда стоит на первом месте, все, что после водорода – кислотные остатки. Например, в HNO3, NO3 – кислотный остаток.

По содержанию кислорода в кислотах, кислоты делятся на кислородсодержащие, т.е. в этих кислотах присутствует кислород. Например, HNO3, H2SO4. Кислоты, в которых отсутствует кислород, называются бескислородными. К таким кислотам относятся HCl, H2S.

По растворимости в воде, кислоты делятся на растворимые в воде, к ним относится большинство кислот и нерастворимые в воде, к ним относится H2SiO3.

К летучим относятся такие кислоты, как H2S, HCl, к нелетучим – большинство кислородсодержащих кислоты.

По числу атомов водорода в кислоте, кислоты делят на: одноосновные, в которых 1 атом водорода, например, HCl, двухосновные, в которых 2 атома водорода, например, H2SO4. Трехосновные кислоты – это кислоты, в которых 3 атома водорода, например, H3PO4.

Заряд атома водорода в кислотах всегда (+), а заряд кислотного остатка всегда отрицателен и численно равен числу атомов водорода в кислоте.
Для того чтобы написать структурные формулы кислородсодержащих кислот нужно помнить, что сначала нужно записать все гидроксид-ионы. А затем все остальные атомы кислорода связать с кислотообразующим элементом. Так, например, в серной кислоте – H2SO4 – 2 гидроксид-иона, а остальные 2 атома кислорода связываем с кислотообразующим элементом –серой – двумя черточками.

Давайте рассмотрим некоторые ионы. В кислоте H2SO4 заряд кислотного остатка – SO4 равен (2-), т.к. в этой кислоте 2 атома водорода. Кроме того, этот ион SO42- является сложным. В кислоте HCl заряд кислотного остатка – Cl, равен (-), т.к. в этой кислоте 1 атом водорода. Этот ион называется простым.

Серная кислота – H2SO4, бесцветная, маслянистая жидкость, не имеет запаха, вдвое тяжелее воды. Серная кислота поглощает влагу из воздуха и других газов, поэтому ее используют для осушения газов.
При разбавлении серной кислоты, следует кислоту вливать в воду, а не наоборот, т.к. при смешивании воды с кислотой, происходит сильное разогревание раствора, и вода, не успев смешаться с кислотой, может закипеть и выбросить брызги вверх. Поэтому кислоту следует вливать в воду тонкой струей и перемешивать.

Серная кислота обугливает древесину, ткани, кожу. Если в пробирку с серной кислотой поместить лучинку или сахар, то они обугливаются.
Ее применяют в производстве удобрений и красителей, взрывчатых веществ, медикаментов, моющих средств, очистке керосина, нефтяных масел. Она является электролитом в аккумуляторах.
Угольная и сернистые кислоты – H2CO3, H2SO3 – в свободном виде не существуют, т.к. они разлагаются на воду и оксид.

Кислоты, как и основания можно различить с помощью индикаторов. Посмотрим таблицу и сравним, как изменяют свою окраску индикаторы в присутствии кислот. Лакмус становится красным, метиловый оранжевый тоже, а вот фенолфталеин окраску не изменяет. Поэтому лакмус и метиловый оранжевый – основные индикаторы, которые используют для распознавания кислот.
Окраска индикаторов в кислотах

Но наиболее удобный и безопасный способ – это использование универсальной индикаторной бумаги, на которую нанесена смесь индикаторов. По изменению цвета полоски бумаги можно судить о характере среды: кислая она, щелочная или нейтральная. Кроме того, по интенсивности изменения окраски можно судить и о значительности кислотности или щёлочности, которая оценивается по специальной шкале. Эта шкала нанесена на упаковку полосок универсальной индикаторной бумаги. Она называется шкалой рН. Если рН = 7, то среда считается нейтральной, как в дистиллированной воде, если рН < 7, то среда кислая, чем меньше эта величина, тем выше кислотность раствора, если рН > 7, то среда щелочная и чем больше эта величина, тем выше щёлочность раствора. Посмотрите на рисунок, как изменяется интенсивность окраски, чем среда более кислая, тем окраска более красная на универсальной индикаторной бумаге, чем среда более щелочная, тем окраска становится более синей.

Определение степени окисления атомов по формуле кислоты
По формулам кислот попробуем определить степени окисления атомов химических элементов, входящих в состав кислоты. Например, в кислоте H2S степень окисления водорода (+1), это постоянно, а серы (-2), т.к. сумма степеней окисления должна ровняться 0. У водорода суммарная степень окисления – (+2), значит, у серы будет (-2), т.к. в составе кислоты 1 атом серы.
Давайте определим степени окисления всех элементов в сернистой кислоте – H2SO3. Как известно, степени окисления водорода и кислорода постоянны и соответственно равны (+1) и (-2). Найдем степень окисления серы, для этого составим уравнение, где х – это неизвестная степень окисления серы. (+1) · 2 + х + (-2) × 3 = 0. Ноль – суммарная степень окисления атомов всех элементов в соединении. Х = +4. Следовательно степень окисления серы в кислоте – (+4).

Зная степень окисления элемента-неметалла в кислоте, нетрудно определить, какой оксид ей соответствует. В нашей кислоте – это оксид SO2, т.е. оксид серы (IV), потому что в этом оксиде степень окисления серы тоже (+4).
Все кислоты имеют соответствующее название и формулу, а также кислотный остаток, который тоже имеет свое название. В таблице приведены некоторые из кислот.

videouroki.net
Ответы@Mail.Ru: Кто знает химию.. Помогите!
Задание 1 HCl — хлороводородная = соляная кислота h3SO4 — серная кислота h4PO4 — фосфорная кислота h3S — сероводородная кислота Кислотный остаток — это то, что записано после водорода (т. е. то, что остаётся после отщепления от кислоты всех катионов водорода) . Его валентность равна числу атомов водорода в формуле кислоты. Задание 2 KCl — хлорид калия K2SO4 — сульфат калия KNO3 — нитрат калия K2CO3 — карбонат калия K2S — сульфид калия K3PO4 — ортофосфат калия K2SiO3 — метасиликат калия KBr — бромид калия При образовании солей атомы водорода кислоты замещаются атомами металла, остальное — кислотный остаток. Задание 3 сульфат алюминия — Al2(SO4)3 сульфит натрия — Na2SO4 нитрат бария — Ba(NO3)2 нитрат железа (III) — Fe(NO3)3 йодид магния — MgI2 сульфат свинца (II) — PbSO4 силикат натрия — Na2SiO3 Задание 4 Химические свойства кислот-неокислителей (т. е. свойства за счет катионов водорода) : 1) Изменение окраски индикаторов: фиолетовый лакмус -> красный, метиловый оранжевый -> розовый 2) Реакции замещения с металлами, стоящими в ряду напряжений до водорода (образуются соль и молекулярный водород) 3) Обменные реакции с основными и амфотерными оксидами (образуются соль и вода) 4) Обменные реакции с основаниями и амфотерными гидроксидами = реакции нейтрализации (образуются соль и вода) 5) Обменные реакции с солями: образуются другая соль и другая кислота. Условие: выпадение осадка соли или кислоты (кремниевой) или выделение газа (например, сероводорода или углекислого газа, образовавшегося при разложении нестойкой угольной кислоты) 6) Многоосновные кислоты реагируют со своими средними солями с образованием кислых солей. Примеры подберите в учебнике сами. Задание 5 а) Zn + h3SO4 = ZnSO4 + h3 — сульфат цинка и водород б) Mg + h3SO4 = MgSO4 + h3 — сульфат магния и водород в) Cu + HCl — реакция не идёт, т. к. медь стоит в ряду напряжений после водорода г) Ca + 2HCl = CaCl2 + h3 — хлорид кальция и водород д) Zn + 2HBr = ZnBr2 + h3 — бромид цинка и водород е) Hg + HCl — реакция не идёт, т. к. ртуть стоит в ряду напряжений после водорода Задание 6 а) 3Na2O + 2h4PO4 = 2Na3PO4 + 3h3O — ортофосфат натрия б) FeO + h3SO4 = FeSO4 + h3O — сульфат железа (II) в) BaO + 2HNO3 = Ba(NO3)2 + h3O — нитрат бария г) HgO + 2HCl = HgCl2 + h3O — хлорид ртути (II) д) Fe2O3 + 3h3SO4 = Fe2(SO4)3 + 3h3O — сульфат железа (III) е) CaO + 2HCl = CaCl2 + h3O — хлорид кальция (в Вашем задачнике опечатка: нет кислоты с формулой h3Cl, это либо соляная кислот HCl, либо сероводородная кислота h3S) ж) Ag2O + 2HNO3 = 2AgNO3 + h3O — нитрат серебра з) Al2O3 + 3h3SO4 = Al2(SO4)3 + 3h3O — сульфат алюминия (пишу только название соли; кроме соли, в каждой реакции образуется вода) Задание 7 а) хлорид натрия — NaCl, сульфат натрия — Na2SO4, фосфат натрия — Na3PO4 б) хлорид кальция — CaCl2, сульфат кальция — CaSO4, фосфат кальция — Ca3(PO4)2 в) хлорид алюминия — AlCl3, сульфат алюминия — Al2(SO4)3, фосфат алюминия — AlPO4 Задание 8 Mg -> MgO -> Mg(OH)2 -> MgCl2 2Mg + O2 = 2MgO MgO + h3O = Mg(OH)2 Mg(OH)2 + 2HCl = MgCl2 + 2h3O P -> P2O5 -> h4PO4 -> Na3PO4 4P + 5O2 = 2P2O5 P2O5 + 3h3O = 2h4PO4 3NaOH + h4PO4 = Na3PO4 + 3h3O SO3 -> h3SO4 -> Fe2(SO4)3 SO3 + h3O = h3SO4 3h3SO4 + Fe2O3 = Fe2(SO4)3 + 3h3O Ba -> BaO -> Ba(OH)2 -> BaCl2 Ba + O2 = BaO2 (в вашем задачнике опять ошибка: при взаимодействии с кислородом образуется не оксид, а пероксид бария; оксид бария можно получить при термическом разложении его карбоната: ВаСО3 = ВаО + СО2) BaO + h3O = Ba(OH)2 Ba(OH)2 + 2HCl = BaCl2 + 2h3O
и сколько это будет стоить?
Чувак, тебе лет 20, а я это год назад проходила! Подумай головой
1. HCL- хлорид. кислотный остаток CL. h3SO4 — сульфат. кислотны остаток SO4 h4PO4 — фосфат. кислотный остаток PO4 h3S — сульфид. кислотный остаток S 2.короче последние слоги это кислот. остатки) всё знаю) но много писать)
touch.otvet.mail.ru