Неметаллы — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 24 апреля 2018; проверки требуют 14 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 24 апреля 2018; проверки требуют 14 правок.Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее:
| Группа | I | III | IV | V | VI | VII | VIII |
|---|---|---|---|---|---|---|---|
| 1-й период | H | He | |||||
| 2-й период | B | C | N | O | F | Ne | |
| 3-й период | Si | P | S | Cl | Ar | ||
| 4-й период | As | Se | Br | Kr | |||
| 5-й период | Te | I | Xe | ||||
| 6-й период | At | Rn | |||||
| 7-й период | Og |
В отличие от металлов неметаллов гораздо меньше, всего их насчитывается 23 элемента.
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Благодаря высоким значениям энергии ионизации неметаллов, их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, инертные газы, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром.
У некоторых неметаллов наблюдается проявление аллотропии. Так, для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода множество форм — алмаз, астралены, графен, графит, карбин, лонсдейлит, фуллерены, стеклоуглерод, диуглерод, углеродные наноструктуры (нанопена, наноконусы, нанотрубки, нановолокна) и аморфный углерод уже открыты, а ещё возможны и другие модификации, например, чаоит и металлический углерод.
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод теллур
Неметаллы — это… Что такое Неметаллы?
Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее:
| Группа | III | IV | V | VI | VII | VIII |
| 2-й период | B | C | N | O | F | Ne |
| 3-й период | Si | P | S | Cl | Ar | |
| 4-й период | As | Se | Br | Kr | ||
| 5-й период | Te | I | Xe | |||
| 6-й период | At | Rn |
Кроме того, к неметаллам относят также водород[источник?] и гелий.
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Благодаря высоким значениям энергии ионизации неметаллов, их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, инертные газы, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром.
У некоторых неметаллов наблюдается проявление аллотропии. Так, для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода множество форм — алмаз, астралены, графен, графан, графит, карбин, лонсдейлит, фуллерены, стеклоуглерод, диуглерод, углеродные наноструктуры (нанопена, наноконусы, нанотрубки, нановолокна) и аморфный углерод уже открыты, а ещё возможны и другие модификации, например, чаоит и металлический углерод.
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод.
См. также
Металлы и различные неметаллы в периодической таблице Менделеева: признаки и свойства

 Природа имеет некую цикличность и повторяемость в своих проявлениях. На это обращали внимание и древнегреческие ученые, когда пытались разложить природу вещей на составляющие: стихии, геометрические фигуры и даже атомы. На признаки повторяемости также обращают внимание и ученые современности. Например, Карл Линней на основе фенотипичного сходства смог выстроить систему живых существ.
Природа имеет некую цикличность и повторяемость в своих проявлениях. На это обращали внимание и древнегреческие ученые, когда пытались разложить природу вещей на составляющие: стихии, геометрические фигуры и даже атомы. На признаки повторяемости также обращают внимание и ученые современности. Например, Карл Линней на основе фенотипичного сходства смог выстроить систему живых существ.Вконтакте
Google+
Мой мир
Долгое время химия как наука оставалась без системы, которая могла бы упорядочить великое множество открытых веществ. Знания древних алхимиков дали богатейший материал для построения такой системы. Многие учёные предпринимали попытки выстроить гармоничную схему, но все попытки оказались тщетными. Так было вплоть до 1869 года, когда великий русский химик Дмитрий Иванович Менделеев представил миру своё детище — периодическую таблицу химических элементов. Говорят, что таблица приснилась учёному. Во сне он увидел, как таблица выстроилась в виде змеи и обвилась вокруг его ног. Достоверность этого факта сомнительна, но как бы то ни было, это был настоящий прорыв в науке.
Менделеев расположил элементы по мере возрастания их атомной массы. Этот принцип актуален и сейчас, правда, сейчас в основе лежит количество протонов и нейтронов в ядре.
Это интересно: анионы и катионы в химии, таблица растворимости.
Металлы и их отличительные свойства
Все химические элементы можно довольно условно поделить на металлы и неметаллы. Что же их отличает друг от друга? Как отличить металл от неметалла?
Из 118 открытых веществ 94 относят к группе металлов. Группа представлена разнообразными подгруппами:


- Щелочноземельные
- Переходные металлы
- Легкие
- Полуметаллы
- Лантаноиды
- Актиноиды
- Неопределенные — Бериллий и Магний.
Какие же признаки являются общими для всех металлов?
- Все металлы при комнатной температуре являют твёрдыми веществами. Это справедливо для всех элементов, кроме ртути, которая тверда до минус 39 градусов Цельсия. В комнатных условиях ртуть — это жидкость.
- Большинство из элементов этой группы имеют довольно высокую температуру плавления. Например, Вольфрам плавится при температуре 3410 градусов Цельсия. По этой причине его используют для изготовления нити в лампах накаливания.
- Все металлы пластичны. Это проявляется в том, что кристаллическая решетка металла позволяет атомам смещаться. В результате металлы могут гнуться без физической деформации, поддаются ковке. Особой пластичностью обладают медь, золото и серебро. Именно поэтому исторически они были первыми металлами, которые обрабатывал человек. Далее он научился обрабатывать железо.
- Все металлы очень хорошо проводят электричество, что опять же связано со строением металлической кристаллической решетки, имеющей подвижные электроны. Кроме всего прочего, эти элементы очень легко проводят тепло.
- Ну и, наконец, все металлы имеют характерный, ни с чем не сравнимый металлический блеск. Цвет чаще всего сероватой с голубым отливом. Au, Cu или Cs имеют желтый и красный оттенки.
Не пропустите: механизм образования металлической связи, конкретные примеры.
Неметаллы
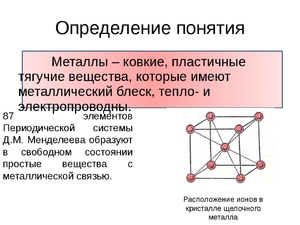

Основное отличие от металлов заключается в строении кристаллической решетки. Если у металлов кристаллическая решетка металлическая, то у неметаллов она может быть атомной или молекулярной. Молекулярной решеткой обладают некоторые газы — кислород, хлор, сера, азот. Вещества с атомной решеткой имеют твёрдое агрегатное состояние, относительно высокую температуру плавления.
Это интересно: водородная связь — примеры, механизм образования.
Физические свойства неметаллов довольно разнообразны, неметаллы могут быть твердыми (йод, углерод, сера, фосфор), жидкими (только бром), газообразными (фтор, хлор, азот, кислород, водород) веществами с абсолютно разнообразным цветом. Агрегатное состояние может меняться под действием температуры.
С химической точки зрения, неметаллы могут выступать в роли окислителей и восстановителей. Неметаллы могут взаимодействовать между собой и с металлами. Кислород, к примеру, со всеми веществами выступает в роли окислителя, а вот с фтором выступает в роли восстановителя.
Аллотропия
Еще одно удивительное свойство неметаллов заключается в явлении, которое назвали аллотропией — видоизменение веществ, приводящее к различным аллотропным модификациям одного и того же химического элемента. С греческого можно перевести слово «аллотропия» как «другое свойство». Так оно и есть.
Это интересно: типы кристаллических решеток — таблица различных материалов.
Рассмотрим более подробно на примере списка некоторых простых веществ:

 Водород — при различной температуре это вещество может быть в виде орто-водорода и пара-водорода.
Водород — при различной температуре это вещество может быть в виде орто-водорода и пара-водорода.- Углерод имеет огромное множество аллотропных модификаций — алмаз, графит, графен, карбин. Строение кристаллических решеток этих веществ различается.
- Фосфор — встречается более 11 модификаций этого вещества. Интересен тот факт, что при модификации цвет вещества также меняется. Наиболее известны белый, черный и красный фосфор. Белый фосфор наиболее реакционный — он может самовоспламеняться, светится в темноте. Необходимо помнить, что белый фосфор очень ядовит для человеческого организма. В связи с этим не рекомендуется держать в доме различные предметы с фосфором. В советские годы очень популярны были статуэтки оленей или птиц, выполненные с применением белого фосфора. Они, конечно, очень красивы, но при этом ядовиты.
- Кислород может существовать в виде формы О2 — это стандартный кислород, которым мы дышим, и О3 — озон. Озон — это не очень устойчивая форма. В стратосфере озон формирует озоновый экран, защищающий атмосферу от проникновения вредного солнечного ультрафиолета. Озон имеет особый запах, который мы ассоциируем с запахом свежести после грозы. По этому запаху можно определить озон. Дело в том, что под действием электрический разрядов в атмосфере образуются молекулы озона.
Это интересно: как определить валентность по таблице Менделеева?
 Модификации имеют и другие вещества — сера, селен, бор, мышьяк, бор, кремний, сурьма. При различных температурах многие металлы также обладают этими свойствами.
Модификации имеют и другие вещества — сера, селен, бор, мышьяк, бор, кремний, сурьма. При различных температурах многие металлы также обладают этими свойствами.Конечно, деление всех простых веществ на группы металлов и неметаллов довольно условно. Это деление облегчает понимание свойств химических веществ, создает иллюзию их разделения на обособленные вещества. Как и все в мире, это деление относительное и зависит от внешних факторов окружающей среды — давления, температуры, света и т.д.
| 1. |
Распознавание знаков неметаллов
Сложность: лёгкое |
1 |
| 2. |
Способы получения неметаллов
Сложность: лёгкое |
1 |
| 3. |
Распространение неметаллов в природе
Сложность: среднее |
1 |
| 4. |
Химические свойства неметаллов
Сложность: среднее |
3 |
| 5. |
Уравнения реакций, характеризующих химические свойства неметаллов
Сложность: среднее |
4 |
| 6. |
Вычисление объёма прореагировавшего неметалла
Сложность: сложное |
4 |
| 7. |
Pаспознавание неметаллов по описанию
Сложность: сложное |
3 |

