Металлы и неметаллы
Все металлы, кроме ртути, в обычных условиях твердые вещества, характеризующиеся «металлическим» блеском, хорошей тепло- и электропроводимостью, пластичностью. Типичными металлами являются щелочные (литий, натрий, калий, рубидий, цезий) и щелочноземельные (кальций, стронций, барий, магний) металлы.
Неметаллы в обычных условиях находятся в твердом (фосфор, сера, селен, углерод и др.), жидком (бром) и газообразном (кислород, водород, азот и др.) состояниях. Твердые неметаллы отличаются хрупкостью и, как правило, обладают плохой тепло- и электропроводимостью.
Типичными неметаллами являются галогены (фтор, хлор, бром, иод), сера, селен, теллур, азот, фосфор, углерод.
Резкой границы между металлами и неметаллами не существует. Некоторые элементы одновременно совмещают свойства металлов и неметаллов, причем и те и другие свойства у них выражены недостаточно резко. Например, цинк, бериллий, алюминий, хром, олово, свинец в кислой среде проявляют свойства металлов, а в щелочной — неметаллов.
Все наиболее распространенные металлы и неметаллы как твердые, так и жидкие и газообразные, входят в ассортимент химических реактивов. Большинство металлов поступает в продажу в виде порошка, небольших слитков или кусков. Для облегчения работы с ними некоторые металлы переплавляют и выпускают в виде палочек (висмут, кадмий, олово, свинец), гранул (кадмий,, свинец, цинк), губки (олово), пыли (цинк, алюминий), листа или ленты (золото, медь), проволоки (алюминий, железо), стружки (железо) и т. п.
Некоторые металлы и неметаллы чрезвычайно легко окисляются на воздухе и поэтому их хранят в определенных условиях. Так, натрий и калий хранят под слоем керосина или другого углеводорода, а белый фосфор — под слоем воды.
Применение. Чистые металлы и неметаллы используют в неорганическом и органическом синтезе для получения химических реактивов и препаратов. Окислением некоторых металлов получают непосредственно окислы этих металлов реактивной чистоты, а растворением их в кислотах — соответствующие соли.
В органическом синтезе металлы находят применение в качестве катализаторов (алюминий, медь, никель, палладий, платина, серебро и др.), при получении металлоорганических соединений и т. д.
Белый фосфор, сера и другие неметаллы служат исходным сырьем для получения чистых кислот и других химических соединений. Бром, хлор, иод используются в органическом синтезе для получения галогенорганических производных, а также для получения некоторых галогенсодержащих кислот и их солей.
Металлы и неметаллы играют известную роль и в аналитической химии. Большая группа металлов — алюминий, железо, цинк, магний, олово, никель — применяются в качестве восстановителей. Натрий используют для определения хлора в органических веществах, при восстановлении и гидрировании многих органических соединений, для глубокой осушки органических жидкостей, для приготовления амальгам и т. д. Бром служит окислителем при аналитических определениях марганца, никеля, хрома, висмута, железа, цианидов, роданидов, мочевины, муравьиной кислоты.
Чистые элементы, такие, как сера, свинец, алюминий, кобальт, медь, никель, олово, палладий, сурьма, цинк, характеризующиеся четкой температурой плавления, используются в термометрии для калибровки термометров и пирометров.
abakbot.ru
Физические свойства неметаллов — урок. Химия, 8–9 класс.
Из \(118\) известных на данный момент химических элементов \(22\) элемента образуют простые вещества, обладающие неметаллическими свойствами. Неметаллических простых веществ намного больше, чем самих неметаллических химических элементов. Причиной тому служит существование явления, называемого аллотропией.
Аллотропия — это способность атомов данного химического элемента образовывать несколько простых веществ, называемых аллотропными видоизменениями, или аллотропными модификациями.
Например, химический элемент кислород \(O\) образует простое вещество кислород O2, молекула которого состоит из двух атомов, и простое вещество озон O3, молекула которого состоит из трёх атомов данного элемента.
Химический элемент фосфор \(P\) образует множество аллотропных видоизменений, важнейшими из которых являются красный фосфор и белый фосфор.
Химический элемент углерод \(C\) образует встречающиеся в природе модификации — алмаз и графит.
Аллотропные видоизменения, образуемые одним и тем же химическим элементом, существенно отличаются между собой как по строению, так и по свойствам.
Аллотропия присуща не всем неметаллических химическим элементам.
Например, водород, азот, элементы \(VII\)A и \(VIII\)A групп не имеют аллотропных модификаций, т. е. каждый из упомянутых элементов образует только одно простое вещество.
Кристаллическая решетка неметаллов
Причина большого разнообразия физических свойств неметаллов кроется в различном строении кристаллических решёток этих веществ.
Часть неметаллов имеет атомную кристаллическую решетку. Кристаллы таких веществ состоят из атомов, соединённых между собой прочными ковалентными связями. Такие неметаллы находятся в твёрдом агрегатном состоянии и являются нелетучими. Примерами таких веществ служат алмаз, графит, красный фосфор и кремний.


Модели кристаллических решёток алмаза (слева) и графита. Кристаллы этих аллотропных видоизменений состоят из атомов углерода, соединённых между собой ковалентными связями. Кристаллы графита, в отличие от кристаллов алмаза, сложены из отдельных слоёв, которые располагаются друг по отношению к другу подобно тому, как листы бумаги — в книге
Другая часть неметаллов имеет молекулярную кристаллическую решетку. В этом случае в каждой молекуле атомы соединены достаточно прочно ковалентной связью, а вот отдельные молекулы друг с другом в кристаллах вещества связаны очень слабо. Поэтому вещества молекулярного строения при обычных условиях могут быть газами, жидкостями или легкоплавкими твёрдыми веществами.
Кислород O2, озон O3, азот N2, водород h3, фтор F2, хлор Cl2, бром Br2, иод I2, белый фосфор P4, кристаллическая сера S8 и инертные газы — это всё вещества, кристаллы которых состоят из отдельных молекул (а в случае инертных газов — из отдельных атомов, как бы выполняющих роль молекул).


Модель молекулы серы (слева) и кристалл серы. Кристалл серы состоит из отдельных молекул \(S_8\)
Физические свойства неметаллов
Свойства неметаллических простых веществ отличаются большим разнообразием. Собственно говоря, их объединяет только то, что они, как правило, не обладают теми физическими свойствами, которые типичны для металлов, т. е. не обладают характерным металлическим блеском, ковкостью, пластичностью, высокой тепло- и электропроводностью.
Агрегатное состояние
Неметаллы при обычных условиях могут быть газообразными, жидкими и твёрдыми веществами.
Газообразными неметаллами являются гелий \(He\), неон \(Ne\), аргон \(Ar\), криптон \(Kr\), ксенон \(Xe\) и радон \(Rn\). Их называют инертными (или благородными) газами. Каждая «молекула» инертного газа состоит только из одного атома.
Такие химические элементы, как водород \(H\), кислород \(O\), азот \(N\), хлор \(Cl\), фтор \(F\) образуют газообразные вещества, состоящие из двухатомных молекул, соответственно — h3, O2, N2, Cl2, F2.
Из неметаллических простых веществ при обычных условиях жидкостью является только бром, молекулы которого двухатомны — Br2.
Остальные неметаллические химические элементы при обычных условиях находятся в твёрдом агрегатном состоянии. Например, химический элемент углерод образует такие твёрдые вещества, как алмаз и графит. Твёрдыми являются кристаллическая сера S8, фосфор красный и фосфор белый P4, кристаллический иод I2.
Цвет и блеск
Только некоторые неметаллы в отличие от металлов имеют блеск. Например, кристаллический иод, кремний и графит не похожи на остальные неметаллы — они имеют блеск, несколько напоминающий блеск металлов.
Если для подавляющего большинства металлов характерны серебристо-серый или серебристо-белый цвета, то окраска неметаллов очень разнообразна. Белый цвет имеет белый фосфор, красный — красный фосфор, жёлтый — сера и фтор, красно-бурый — жидкий бром, жёлто-зелёный — хлор, фиолетовый цвет имеют пары иода, синий — жидкий кислород, серый — графит и кремний. Бесцветным является алмаз, окраски не имеют также инертные газы, азот, кислород и водород.
 | |
Красный фосфор
| Белый фосфор
|
 |  |
Бром
| Хлор
|
 | |
Иод | Алмаз |
Неметаллы могут находиться в твёрдом, жидком и газообразном агрегатных состояниях.
Запах
Некоторые неметаллы имеют запах. Например, резкий удушливый запах имеют озон O3, фтор F2 (при попадании в органы дыхания практически моментально разрушает ткани), хлор Cl2, бром Br2 и иод I2.
Пластичность
Неметаллы в твёрдом агрегатном состоянии не обладают пластичностью. Они являются хрупкими.
Электро- и теплопроводность
Неметаллы, за исключением графита, плохо проводят тепло и практически не проводят электрический ток (являются диэлектриками).
www.yaklass.ru
Получение и применение неметаллов — урок. Химия, 8–9 класс.
Выбор способа получения вещества зависит от того, в каком виде встречается в природе химический элемент, который образует данное вещество. Это в полной мере относится и к выбору способа получения неметаллических простых веществ.
Некоторые неметаллы встречаются в природе в свободном виде. Такие неметаллы, как кислород \(O_2\), азот \(N_2\), инертные газы — \(He\) и др., серу \(S\), алмаз \(C\) и графит \(C\), можно выделить из смесей или очистить от примесей, используя физические методы.
Химически активные неметаллы встречаются в природе только в виде соединений. В первую очередь это относится к галогенам: фтору, хлору, брому и иоду.
Минералы, образованные галогенами, — флюорит \(CaF_2\) (слева) и галит \(NaCl\)
Химически менее активные неметаллы в природе встречаются как в самородном виде, так и в составе химических соединений.
Например, серу можно найти как в самородном состоянии, так и в виде соединений — сульфидов и сульфатов.
Распространение серы природе. Слева направо: самородная сера \(S\), пирит \(FeS_2\) и гипс CaSO4⋅2h3O
Из химических соединений неметаллические простые вещества получают химическими методами в ходе различных химических превращений.
Физические методы получения неметаллов
В качестве сырья для получения ряда неметаллов в промышленности используют воздух.
Сначала при пониженной температуре и повышенном давлении воздух сжижают. Затем, используя перегонку (дистилляцию), из жидкого воздуха получают азот N2, кислород O2 и аргон Ar. В ходе перегонки первым испаряется азот (при температуре \(–196\) °C), потом — аргон (при \(–186\) °C) и последним — кислород (при температуре \(–183\) °C).

Промышленная установка для разделения воздуха методом перегонки
Аналогично от нелетучих примесей отделяют встречающуюся в природе самородную серу. Для этого руду нагревают выше \(+450\) °C, и пары кипящей серы \(S\) конденсируют.
Химические методы получения неметаллов
Химические методы получения неметаллов связаны с проведением окислительно-восстановительных реакций, в ходе которых неметаллические химические элементы могут как повышать, так и понижать степень окисления.
Например, хлор \(Cl_2\) в промышленности получают путём электролиза раствора хлорида натрия \(NaCl\). При пропускании постоянного электрического тока через раствор этого вещества протекает химическая реакция:
2NaCl−1+2h3O⟶эл. ток2NaOH+h3↑+Cl02↑.
Для того чтобы получить кремний \(Si\), в промышленности в электрических печах прокаливают смесь песка \(SiO_2\) с коксом \(C\). При этом протекает химическая реакция:
Si+4O2+2C⟶t°CSi0+2CO↑.
Лабораторные способы получения неметаллов также связаны с проведением окислительно-восстановительных реакций. Чаще всего это либо реакции разложения, либо реакции замещения.
Например, кислород \(O_2\) в лабораторных условиях можно получить путём разложения пероксида водорода \(H_2O_2\). Протекает реакция разложения:
2h3O2−1⟶катализатор2h3O+O20↑.
Водород \(H_2\) в лаборатории можно получить, используя цинк \(Zn\) и соляную кислоту \(HCl\). Протекает реакция замещения:
Zn+2H+1Cl→ZnCl2+H02↑.
Применение неметаллов
Поскольку свойства неметаллов чрезвычайно разнообразны, эти вещества находят широкое применение в различных отраслях народного хозяйства.
Таблица. Применение неметаллов
Область применения | Примеры |
| Промышленность | Такие неметаллы, как сера \(S\), азот \(N_2\), фосфор \(P\) и хлор \(Cl_2\), используются в качестве сырья для получения кислот и другой продукции. Сера \(S\) используется в качестве сырья в производстве резин. Сажа \(C\) служит пигментом в производстве лаков и красок, а также пигментом и наполнителем в производстве пластмасс и резин |
| Транспорт | Водород \(H_2\) используется в качестве топлива. Важно, что продукт сгорания этого топлива не загрязняет среду |
| Сельское хозяйство | Сера \(S\) используется как эффективное средство борьбы с вредителями и болезнями растений |
| Медицина | Кислород \(O_2\) применяют в тех случаях, когда у больного затруднено дыхание. Активированный уголь \(C\) есть почти в каждой домашней аптечке. Точно так же, как иодная тинктура — спиртовой раствор иода \(I_2\). Мази, в состав которых входит сера \(S\), используются при лечении кожных заболеваний. Жидкий азот \(N_2\) используют не только для хранения биологического материала, но и в косметической медицине |
| Подготовка воды | Для дезинфекции воды используют хлор \(Cl_2\) и озон \(O_3\). |
| Получение высоких температур | В металлургии и металлообработке для того, чтобы, сжигая горючее вещество, создать среду с высокой температурой, используют кислород \(O_2\) |
| Пиротехника | В производстве спичек и другой пиротехнической продукции используют серу \(S\), фосфор \(P\) и уголь \(C\) |
| Пищевая промышленность | Для продления срока годности пищевых продуктов и для создания инертной атмосферы в упаковку закачивается азот \(N_2\) |
www.yaklass.ru
Химические свойства неметаллов — урок. Химия, 8–9 класс.
В химических реакциях неметаллы могут проявить себя и как восстановители, и как окислители. Из общих химических свойств неметаллов отметим их способность взаимодействовать с металлами, с водородом и кислородом.
Взаимодействие неметаллов с металлами
В реакциях с металлами неметаллы проявляют себя как окислители.
А. Особенно активно с металлами взаимодействуют галогены. В результате реакций соединения образуются соли — галогениды.
Например, при взаимодействии алюминия с иодом образуется иодид алюминия AlI3 :
2Al0+3I20⟶h3O2Al+3I3−1.
Вода в этой химической реакции является катализатором.
Видеофрагмент:
Взаимодействие алюминия с иодом |
Железо активно реагирует с хлором, образуя хлорид железа(\(III\)) FeCl3:
2Fe0+3Cl20⟶to2Fe+3Cl3−1.
Видеофрагмент:
Взаимодействие железа с хлором |
Б. Металлы реагируют с серой, образуя сульфиды.
Реакция соединения алюминия с серой начинается после того, как смесь веществ нагрели. Продуктом реакции является сульфид алюминия AlS32:
2Al0+3S0⟶toAl2+3S3−2.
Видеофрагмент:
Взаимодействие алюминия с серой |
Химическое взаимодействие между натрием и серой протекает при простом механическом смешивании. В результате образуется сульфид натрия NaS2:
2Na0+S0→Na2+1S−2.
Видеофрагмент:
Взаимодействие натрия с серой |
Взаимодействие неметаллов с водородом
По сравнению с другими неметаллами водород имеет невысокую электроотрицательность. В силу этой причины в реакциях с другими неметаллами, как правило, данный химический элемент будет восстановителем, а другие неметаллы — окислителями.
В таких реакциях образуются летучие водородные соединения, состав молекул которых отвечает общей формуле RHx, где \(R\) — неметалл, а \(х\) — индекс, указывающий число атомов водорода в молекуле образовавшегося вещества. Этот индекс численно совпадает с валентностью неметалла, с которым водород соединяется.
Например, в реакции соединения водорода с хлором образуется газ хлороводород \(HCl\):
h30+Cl20⟶to2H+1Cl−1.
Видеофрагмент:
Взаимодействие водорода с хлором |
Взаимодействие водорода с азотом происходит при выcокой температуре и давлении. В промышленности для ускорения данного процесса используют катализатор. Продуктом взаимодействия этих двух неметаллических веществ является газ аммиак Nh4:
N20+3h30⇄to,p2N−3h4+1.
Взаимодействие неметаллов с кислородом
Кислород имеет высокую электроотрицательность, поэтому в реакциях с другими неметаллами он является окислителем, а другие неметаллы — восстановителями.В результате соединения кислорода с другими неметаллами образуются оксиды.
Например, сера сгорает в кислороде, образуя сернистый газ или оксид серы(\(IV\)) SO2:
S0+O20→S+4O2−2.
Видеофрагмент:
Горение серы в кислороде |
Фосфор энергично cгорает в кислороде ярким пламенем. В ходе реакции образуются белые клубы оксида фосфора(\(V\)) PO52:
4P0+5O20→2P2+5O5−2.
Видеофрагмент:
Горение фосфора в кислороде |
В то же самое время взаимодействие кислорода с химически малоактивным азотом протекает медленно и начинается только при очень высокой температуре. Продуктом реакции является газообразный оксид азота(\(II\)) NO:
N20+O20⟶to2N+2O−2.
Такая химическая реакция протекает в атмосфере при разряде молнии, а также в цилиндрах двигателей при сгорании топлива.
www.yaklass.ru
Неметаллы: простые вещества — свойства неметаллов, история открытия — химия 9 класс
Положение неметаллов в периодической системе
Как же определить, относится вещество к металлам или к неметаллам?
Если внимательно посмотреть на Периодическую систему Д.И. Менделеева (подробно с классификацией элементов знакомимся в параграфе 42 учебника по химии для 8 класса под редакцией Еремина В.В.) и провести условную диагональ от водорода через бор до астата и неоткрытого пока элемента № 118, таблица неметаллов займет правый верхний угол.
Каждый горизонтальный период таблицы заканчивается элементом с завершенным внешним энергетическим уровнем. Эта группа элементов носит название благородные газы и имеет особые свойства, с которыми можно познакомиться в параграфе 18 учебника «Химия» для 8 класса под редакцией Еремина В.В.
При рассмотрении электронного строения неметаллов можно заметить, что энергетические уровни атома заполнены электронами больше чем на 50% (исключение – бор), и у элементов, расположенных в таблице справа налево количество электронов на внешнем уровне увеличивается. Поэтому в химических реакциях эта группа веществ может быть как акцептором электронов с окислительными свойствами, так и донором электронов с восстановительными свойствами.
Вещества, образующие диагональ бор-кремний-германий-мышьяк-теллур, являются уникальными, и в зависимости от реакции и реагента могут проявлять как металлические, так и неметаллические свойства. Их называют металлоиды. В химических реакциях они проявляют преимущественно восстановительные свойства.

Химия. Базовый уровень. 10 класс. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова. Простота и доступность изложения курса органической химии , большое количество иллюстраций , а также разнообразные вопросы упражнения и задачи способствуют успешному усвоению учебного материала. Учебник соответствует Федеральному государственному образовательному стандарту среднего общего образования.
КупитьФизические свойства неметаллов. Аллотропия
Если смотреть на металлы, то невооруженным глазом можно заметить общие свойства — металлический блеск, твердое агрегатное состояние (исключение — жидкая ртуть), тепло- и электропроводность.С неметаллами все намного сложнее. Они могут иметь молекулярное и немолекулярное строение. Благодаря различиям в строении, простые вещества неметаллы существуют в трех агрегатных состояниях:
- Молекулярные:
- Летучие, газообразные, бесцветные кислород, водород.
- Газообразные, окрашенные хлор, азот, фтор.
- Единственный жидкий представитель — темно-красный бром.
- Твердые, но хрупкие вещества с невысокой температурой плавления — кристаллы йода, серы, белого фосфора.
- Немолекулярные:
- Твердые вещества с высокой температурой плавления — кремний, графит, алмаз и красный фосфор.
Большинство из неметаллических веществ плохо проводят электричество и тепло.
Исключением является графит — разновидность углерода.
Аллотропия — уникальная способность неметаллического элемента образовывать несколько простых веществ. В естественной среде существуют аллотропные модификации элементов, которые отличаются физическими и химическими свойствами. К ним относятся озон и кислород, графит и алмаз. Подробнее о физических свойствах неметаллов вы можете узнать в учебнике «Химия. 9 класс».
Химические свойства неметаллов
Как мы разобрали выше, группа неметаллов довольно полиморфна и в зависимости от типа реакций, в которых они участвуют, могут проявлять и окислительные, и восстановительные свойства. Фтор — исключение в этом ряду. Он всегда окислитель.
В ряду F,O,N,CL,Br,I,S,C,Se,P,As,Si,H окислительные свойства уменьшаются. Восстановительные свойства кислород может проявлять только в отношении фтора.
- Реакции с металлами.
В этом типе реакций проявляются окислительные свойства и неметаллы принимают электроны с образованием отрицательно заряженных частиц.
Са + Сl2 = СаСl2
Са + O2 = СаO2
Na + Сl2 = Na+Сl2
- Реакции с водородом
Практически все неметаллы реагируют с водородом. Лишь благородные газы составляют исключение для реакций данного типа. Продуктом реакции являются летучие водородные соединения:
Cl2 + H2 = 2HCl
С + 2Н2 = СН4
- Реакции с кислородом.
S + O2 = SO2
P + 5O2 = 2P2O5
4. Взаимодействие с водой и кислотами для неметаллов не характерно.
Что ещё почитать?
ОГЭ по химии — 2019: расписание, критерии оценивания, типы заданий
Биография Д.И. Менделеева. Интересные факты из жизни великого химика
Карбоновые кислоты
Массовая доля вещества
История открытия неметаллов
Медная посуда, железные орудия труда, золотые украшения — издавна человек замечал, что у всех этих веществ есть определенные общие свойства:
- они проводят тепло и электрический ток;
- для них характерен металлический блеск;
- благодаря пластичности и ковкости им можно придать любую форму;
- для всех веществ характерна металлическая кристаллическая решетка.
В противовес металлам были и другие вещества, не обладающие металлическими свойствами, и названные соответственно неметаллами. Практически до конца XVII века ученым-алхимикам было известно всего лишь два вещества-неметалла — углерод и сера.
В 1669 году Бранд в поисках «философского камня» открыл белый фосфор. И за короткий период с 1748 по 1798 годы было открыто около 15 новых металлов и 5 неметаллов.
Попытки открытия фтора стоили исследователям не только здоровья, но и жизни. Деви, братья Кнокс, Гей-Люссак — это неполный список жертв науки, что потеряли здоровье в попытках выделить фтор из плавикового шпата. Лишь в 1886 году Муассан решил сложную задачу способом электролиза. И получил первый галоген, а ещё – ядовитый хлор. Во времена Первой мировой войны его использовали как оружие массового поражения.
В настоящее время открыто 22 неметаллических элемента.
#ADVERTISING_INSERT#
rosuchebnik.ru
Общая характеристика элементов неметаллов — урок. Химия, 8–9 класс.
Неметаллы в природе
Из \(118\) известных на данный момент химических элементов \(96\) являются металлическими, и только \(22\) химических элемента относятся к неметаллическим.
Неметаллические химические элементы широко распространены в земной коре.
Кислород и кремний составляют около \(76\) % (практически три четверти) от массы земной коры (\(O_2\) — \(49,4\) %, \(Si\) — \(25,8\) %).
Алюминий \(Al\) — \(7,5\) %.
Железо \(Fe\) — \(4,7\) %.
Кальций \(Ca\) — \(3,4\) %.
Натрий \(Na\) — \(2,6\) %.
Калий \(K\) — \(2,4\) %.
Магний \(Mg\) — \(1,9\) %.
Водород \(H\) — \(0,9\) %.
Титан \(Ti\) — \(0,9\) %.

Состав земной коры
Такие химические элементы, как углерод \(C\), водород \(H\), кислород \(O\), азот \(N\), фосфор \(P\) и сера \(S\), составляют \(98,5\) % от массы растений и \(97,6\) % от массы тела человека.

На долю неметаллических химических элементов приходится большая часть массы живых организмов
В состав земной атмосферы входят как простые, так и сложные вещества, образованные элементами-неметаллами.
В объёмных долях на азот N2 приходится \(78\) %, на кислород O2 — \(21\) %, а инертные газы составляют \(0,96\) % от объёма воздуха. В состав земной атмосферы также постоянно входит углекислый газ CO2, доля которого (по разным оценкам) составляет около \(0,04\) % от состава чистого воздуха.
Следует иметь в виду, что в воздухе постоянно содержится водяной пар h3O и другие соединения неметаллов, доля которых не является постоянной.

Неметаллические химические элементы образуют большую часть веществ, входящих в состав воздуха
Главный химический элемент Вселенной — это водород. Из него образованы Солнце и другие звёзды, газовые облака и т. д. И на нашей планете из каждых \(100\) атомов \(17\) — это атомы водорода.
Положение элементов неметаллов в Периодической системе, особенности строения и свойств их атомов
В Периодической системе химических элементов неметаллы занимают правый верхний угол и находятся только в главных (А) группах.
Положение неметаллов в периодической системе. Знаки неметаллических химических элементов выделены красным цветом
В электронной оболочке атомов неметаллов на внешнем энергетическом уровне, как правило, содержится от \(4\) до \(8\) электронов. Исключение составляют только водород \(H\), у которого в электронной оболочке атома вообще только один электрон, гелий \(He\) с двумя электронами и бор \(B\), у которого на наружном энергетическом уровне имеются три электрона.
Радиусы атомов неметаллов меньше, чем у металлов того же периода, поэтому в силу близости положительно заряженного ядра атома неметаллы хорошо удерживают свои валентные электроны (электроны внешнего энергетического уровня).

Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов неметаллов существенно меньше, чем радиусы атомов металлов, находящихся в том же периоде
Главное отличительное свойство неметаллов — это их высокая электроотрицательность, т. е. способность в химических соединениях притягивать электроны.

Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО неметаллических химических элементов (выделены красным цветом) превосходит соответствующую величину металлических химических элементов
Атомы неметаллов способны как принимать, так и отдавать электроны, а значит, химические вещества, содержащие такие атомы, в ходе превращений могут выступать как в роли окислителей, так и в роли восстановителей.
www.yaklass.ru
общая характеристика. Свойства, получение и применение.
Неметаллы – это химические элементы, которые образуют в свободном состоянии простые вещества, не обладающие физическими и химическими свойствам металлов.
Это 22 элемента Переодической системы: бор B, углерод C, кремний Si, азот N, фосфор P, мышьяк As, кислород O, сера S, селен Se, теллур Te, водород H, фтор F, хлор Cl, бром Br, йод I, астат At; а так же благородные газы: гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe, радон Rn.
Физические свойства
Элементы-неметаллы образуют простые вещества, которые при обычных условиях существуют в разных агрегатных состояниях:
газы (благородные газы: He, Ne, Ar, Kr, Xe, Rn;водород h3, кислород O2, азот N2, фтор F2, хлор Cl2.),
жидкость (бром Br2) ,
твердые вещества ( йод I2, углерод C, кремний Si, сера S, фосфор P и др. ) .
Атомы неметаллов образуют менее плотно упакованную структуру чем металлы, в которой между атомами существуют ковалентные связи. В кристаллической решетке неметаллов, как правило, нет свободных электронов. В связи с этим твердые вещества-неметаллы в отличие от металлов плохо проводят тепло и электричество, не обладают пластичностью.
Получение неметаллов
Способы получения неметаллов отличаются многообразием и специфичностью, общих подходов не существует. Рассмотрим основные способы получения некоторых неметаллов.
Получение галогенов. Самые активные галогены – фтор и хлор – получают электролизом. Фтор – электролизом расплава KHF2, хлор – электролизом расплава или раствора хлорида натрия:
2Г— — 2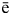 = Г2.
= Г2.
Другие галогены можно также получить электролизом или вытеснением из их солей в растворе с помощью более активного галогена:
Cl2 + 2NaI = 2NaCl + I2.
Получение водорода. Основной промышленный способ получения водорода – конверсия метана (каталитический процесс):
CH4 + H2O = CO + 3H2.
Получение кремния. Кремний получают восстановлением коксом из кремнезема:
SiO2 + 2C = Si + 2CO.
Получение фосфора. Фосфор получают восстановлением из фосфата кальция, который входит в состав апатита и фосфорита:
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO.
Кислород и азот получают фракционной перегонкой жидкого воздуха.
Сера и углерод встречаются в природе в самородном виде.
Селен и теллур получают из отходов производства серной кислоты, так как эти элементы встречаются в природе вместе с соединениями серы.
Мышьяк получают из мышьяковистого колчедана по сложной схеме превращений, включающей стадии получения оксида и восстановления из оксида углеродом.
Бор получают восстановлением оксида бора магнием.
Химические свойства
1. Окислительные свойства неметаллов проявляются при взаимодействии с металлами
4Al + 3C = Al4C3
2. Неметаллы играют роль окислителя при взаимодействии с водородом
h3 + F2 = 2HF
3 Любой неметалл выступает в роли окислителя в реакциях с теми металлами, которые имеют низкую ЭО
2P + 5S = P2S5
4. Окислительные свойства проявляются в реакциях с некоторыми сложными веществами
Ch5 + 2O2 = CO2 + 2h3O
5. Неметаллы могут играть роль окислителя в реакциях со сложными веществами
2FeCl2 + Cl2 = 2FeCl3
6. Все неметаллы выступают в роли восстановителей при взаимодействии с кислородом
4P + 5O2 = 2P2O5
7. Многие неметаллы выступают в роли восстановителей в реакциях со сложными веществами-окислителями
S + 6HNO3 = h3SO4 + 6NO2 + 2h3O
8. Наиболее сильные восстановительные свойства имеют углерод и водород
ZnO + C = Zn + CO;
CuO + h3 = Cu + h3O
9. Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления-самовосстановления (диспропорционирования)
Cl2 + h3O =HCl + HClO
Применение неметаллов
Водород используется в химической промышленности для синтеза аммиака, хлороводорода и метанола, применяется для гидрогенизации жиров. Используется в качестве восстановителя при производстве многих металлов, например, молибдена и вольфрама, из их соединений.
Хлор применяют для производства соляной кислоты, винилхлорида, каучука и многих органических веществ и пластмасс, в текстильной и бумажной промышленности используют в качестве отбеливающего средства, в быту – для обеззараживания питьевой воды.
Бром и йод используют в синтезе полимерных материалов, для приготовления лекарственных препаратов и др.
Кислород применяется при сжигании топлива, при выплавке чугуна и стали, для сварки металлов, необходим для жизнедеятельности организмов.
Сера используется для производства серной кислоты, изготовления спичек, пороха, для борьбы с вредителями сельского хозяйства и лечения некоторых болезней, в производстве красителей, взрывчатых веществ, люминофоров.
Азот и фосфор применяются при производстве минеральных удобрений, азот применяется при синтезе аммиака, для создания инертной атмосферы в лампах, используется в медицине. Фосфор применяется при производстве фосфорной кислоты.
Алмаз используется при обработке твердых изделий, в буровых работах и ювелирном деле, графит – для изготовления электродов, тиглей для выплавки металлов, в производстве карандашей, резины и др.
infourok.ru