Основные классы неорганических соединений
В химии все многообразие неорганических веществ: принято разделять на две группы – простые и сложные. Простые вещества подразделяются на металлы и неметаллы. А сложные – на производные от простых, образованные путем их взаимодействия с кислородом, водой и между собой. Эту классификацию неорганических веществ в виде схемы изображают следующим образом:
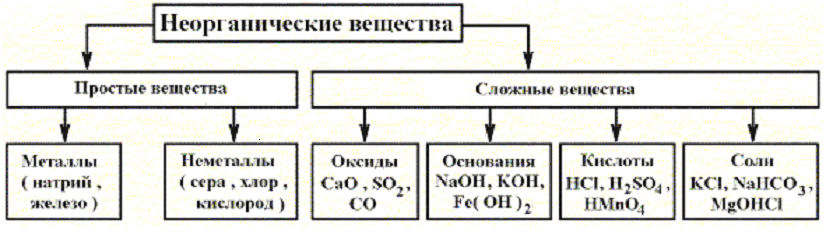
Рис. 2.1. Классификация неорганических соединений.
Классификация реакций в неорганической химии. В неорганической химии различают реакции: 1)соединения, 2)разложения (и те и другие могут быть окислительно-восстановительными реакциями, а могут и не быть таковыми), 3)обмена, 4)замещения, которые всегда являются окислительно-восстановительными. Схемы реакций и примеры даны в таблице 2.1.
Таблица 2.1
Классификация реакций
Тип реакции | Схема реакции | Примеры реакций |
Соединение | А +В = АВ | 1) Ca0 + Cl20= Ca2+Cl2— (ОВР) 2) CaO + CO2 = CaCO3 |
Разложение | АВ = А + В | 1) 2Ag2O = 4Ag +O2 (ОВР) 2) Cu(OH)2 = CuO + H2O |
Обмен | AB +CD=AD + CB | BaCl2 + Na2 SO4 = BaSO4↓ +2NaCl |
Замещение | AB + C = CB + A | Zn + Pb(NO3)2 = Pb + Zn(NO3)2 (ОВР) |
Рассмотрим получение и свойства наиболее важных классов неорганических соединений.
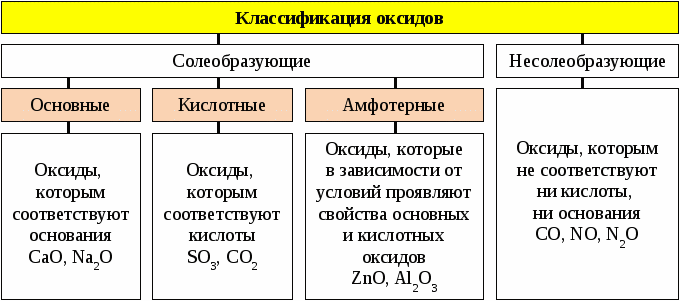
ОКСИДЫ (окислы) — сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления, равной -2. Общая формула любого оксида — ЭхОу-2. Различают солеобразующие (основные: Li2O, CaO, MgO ,FeO; амфотерные: ZnO, Al2O3, SnO2, Cr2O3, Fe2O3; кислотные: B2O3 , SO3 , CO2, P2O5 Mn2O7) и несолеобразующие: N2
По современной международной номенклатуре названия оксидов составляют следующим образом: слово «оксид», далее русское название элемента в родительном падеже, степень окисления элемента (если она переменна). Например: FeO – оксид железа (II), P2O5 – оксид фосфора (V).
Основные оксиды это те, которым соответствуют гидроксиды – основания. Основными называют оксиды, взаимодействующие с кислотами с образованием соли и воды. Основные оксиды образуются только металлами в степени окисления +1,+2 (иногда +3), например: BaO, SrO, FeO, MnO, CrO, Li2O, Bi2O3, Ag2O.
Получение основных оксидов:1) Окисление металлов при нагревании в атмосфере кислорода:
2Mg+O2=2MgO;
2Cu+O2=2CuO.
Этот метод практически неприменим для щелочных металлов, которые при окислении обычно дают пероксиды, поэтому оксиды Na2O, K2O крайне труднодоступны.
2) Обжиг сульфидов:
2СuS+3O2=2CuO+2SO2;
4FeS2+11O2=2Fe2O3+8SO2.
3) Разложение гидроксидов:
Cu(OH)2=CuO+H2O.
Этим методом нельзя получить оксиды щелочных металлов.
4) Разложение солей некоторых кислородсодержащих кислот:
t
BaCO3=BaO+CO2,
t
2Pb(NO
Свойства основных оксидов. Большинство основных оксидов представляет собой твердые кристаллические вещества ионного характера; в узлах кристаллической решетки расположены ионы металлов, достаточно прочно связанные с ионами O2-, поэтому оксиды типичных металлов обладают высокими температурами плавления и кипения.
Отметим одну характерную для оксидов особенность. Близость ионных радиусов многих ионов металлов приводит к тому, что в кристаллической решетке оксидов часть ионов одного металла может быть заменена на ионы другого металла. Это приводит к тому, что для оксидов часто не выполняется закон постоянства состава, и могут существовать смешанные оксиды переменного состава.
1) Отношение к воде.
Процесс присоединения воды называется гидратацией, а образующееся вещество – гидроксидом. Из основных оксидов с водой взаимодействуют только оксиды щелочных (Li, Na, K, Rb, Cs, Fr) и щелочноземельных металлов (Ca, Sr, Ba, Ra).
Li2O+H2O=2LiOH;
BaO+H2O=Ba(OH)2.
Большинство же основных оксидов в воде не растворяются и не взаимодействуют с ней. Соответствующие их гидроксиды получают косвенным путем – действием щелочей на соли (см. ниже).
2) Отношение к кислотам.
CaO+H2SO4=CaSO4+H2O;
FeO+2HCl=FeCl2+H2O.
3) Отношение к кислотным и амфотерным оксидам.
Основные оксиды щелочных и щелочноземельных металлов при сплавлении взаимодействуют с твердыми кислотными и амфотерными оксидами, а также с газообразными кислотными оксидами при обычных условиях.
CaO+CO2=CaCO3;
сплавление
Li2O+Al2O3=2LiAlO2.
сплавление
Основные оксиды менее активных металлов взаимодействуют только с твердыми кислотными оксидами при сплавлении.
Кислотные оксиды — оксиды, которые при взаимодействии с основаниями образуют соль и воду. Кислотным оксидам соответствуют гидроксиды – кислоты. Кислотные оксиды – это оксиды неметаллов в различных степенях окисления, либо оксиды металлов в высокой степени окисления (+4 и выше). Примеры: SO2, SO3, Cl2O7, Mn2O7, CrO3.
Химическая связь в кислотных оксидах – ковалентная полярная. При обычных условиях кислотные оксиды неметаллов могут быть газообразными (CO 2, SO2), жидкими (N2O3, Cl2O7), твердыми (P2O5, SiO2).
Получение кислотных оксидов.
1) Окисление неметаллов:
S+O2=SO2
2) Окисление сульфидов:
2ZnS+3O2=2ZnO+2SO2
3) Вытеснение непрочных слабых кислот из их солей:
CaCO3+2HCl=CaCl2+CO2 +H2O.
Свойства кислотных оксидов.
1) Отношение к воде.
Большинство кислотных оксидов растворяются в воде, вступая с ней в химическое взаимодействие и образуя кислоты:
SO3+H2O=H2SO4,
CO2+H2O=H2CO
2) Отношение к основаниям.
Кислотные оксиды взаимодействуют с растворимыми основаниями – щелочами, образуя соль и воду.
SO2+2NaOH=Na2SO3+H2O;
P2O5+6NaOH=2Na3PO4+3H2O
сплавление
3) Отношение к основным и амфотерным оксидам.
Твердые кислотные оксиды взаимодействуют с основными и амфотерными оксидами при сплавлении. Жидкие и газообразные оксиды взаимодействуют с оксидами щелочных и щелочноземельных металлов при обычных условиях.
P2O5+3CuO=Cu3(PO4)2;
сплавление
3SiO2+Al2O3=Al2(SiO3)3
сплавление
Амфотерные оксиды взаимодействуют и с кислотами и со щелочами, проявляя свойства кислотных и основных оксидов. Им соответствуют амфотерные гидроксиды. Все они твердые вещества, нерастворимые в воде. Примеры амфотерных оксидов: ZnO, BeO, SnO, PbO, Al2O3, Cr2O3, Sb2O3, MnO2.
Свойства амфотерных оксидов.
Амфотерные оксиды реагируют с кислотами как основные:
Al2O3+6HCl=2AlCl3+3H2O,
а со щелочами – как кислотные. Состав продуктов реакции зависит от условий. При сплавлении:
ZnO+2NaOH=Na2ZnO2+H2O;
Цинкат натрия
В растворе щелочи образуется растворимая комплексная соль, содержащая гидроксокомплексный ион:
ZnO+2NaOH+H2O=Na2[Zn(OH)4]
Тетрагидроксоцинкат натрия
Несолеобразующие оксиды – это оксиды неметаллов, которым не соответствуют гидроксиды и соли. Примеры: CO, N2O, NO, SiO.
Оксиды широко распространены в природе. Так вода – самый распространенный оксид покрывает 71% поверхности планеты. Оксид кремния (IV) в виде 400 разновидностей кварца составляет 12% от массы земной коры. Оксид углерода (IV) (углекислый газ) содержится в атмосфере — 0,03% по объему, а также в природных водах. Важнейшие руды: гематит, магнетит, бурый железняк состоят из различных оксидов железа. Бокситы содержат оксид алюминия, и т.д.
ОСНОВАНИЯ – сложные вещества, в которых на атом металла приходится одна или несколько гидроксогрупп ОН—. Степень окисления атомов металла обычно +1, +2 (реже +3). Общая формула оснований Ме(ОН)х, где х – число гидроксогрупп – кислотность основания. (МеОН – однокислотное, Ме(ОН)2 – двухкислотное , Ме(ОН)3 – трехкислотное основание).
Названия основаниям дают следующим образом: «гидроксид», затем русское название металла в родительном падеже, а в скобках римскими цифрами – степень окисления, если она переменная. Например: KOH –гидроксид калия, Ni(OH)2 – гидроксид никеля(II).
При обычных условиях основания – твердые вещества, кроме гидроксида аммония – водного раствора аммиака NH4OH (NH4+ — ион аммония, входящий в состав солей аммония).
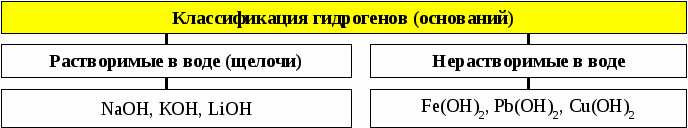
Классификация оснований. В зависимости от отношения к воде основания делятся на растворимые (щелочи) и нерастворимые. К растворимым основаниям — щелочам относятся только гидроксиды щелочных и щелочноземельных металлов (LiOH, NaOH, KOH, CsOH, RbOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2, Ra(OH)2) а также водный раствор аммиака. Все остальные основания практически нерастворимы в воде.
С точки зрения теории электролитической диссоциации основания – электролиты, диссоциирующие в водном растворе с образованием в качестве анионов только гидроксид-ионов:
Ме(ОН)х Мех+ + хОН—.
Наличие в растворе ионов гидроксида определяют с помощью индикаторов: лакмуса (синий), фенолфталеина (малиновый), метилоранжа (желтый). Нерастворимые основания не меняют окраски индикаторов.
studfile.net
Основные классы неорганических соединений :: SYL.ru
К неорганическим соединениям относят все сочетания химических элементов, которые не содержат углерод. Большинство известных соединений являются органическими, однако известно около 20 миллионов тех, которые принадлежат к классу неорганических. Огромное количество вызывает необходимость их классификации, то есть деления на группы.
Каждое из этих веществ обладает своими характеристиками, и поэтому можно выделить основные классы неорганических соединений. Для любого из них характерны различные способности взаимодействия с другими веществами, свои свойства. Химия, классы неорганических соединений в которой занимают важное место, рассматривает их классификацию с нескольких точек зрения.

Классификация неорганических веществ
Можно выделить несколько категорий, по которым подразделяются классы неорганических соединений. В соответствии со своим строением они могут быть простого и сложного состава. Простые вещества состоят из атомов одного вида. Они могут быть металлами и неметаллами. В некоторых источниках можно встретить информацию, что к простым веществам относят также благородные газы и амфотерные простые вещества.
Характеристика металлов
Атомы металлических соединений связаны между собой при помощи особой металлической связи, образуя кристаллическую сеть. Ионы металлов связываются между собой, образуя электронное облако.
Кристаллическая сеть создается всеми металлами, и этим обусловлены общие свойства большинства этих простых неорганических веществ. Например, такими свойствами являются высокая теплопроводность, пластичность, прочность, непрозрачность, высокая электропроводность.
Неметаллы
Неорганические соединения неметаллической природы отличаются большим многообразием. В этой группе можно встретить вещества в твердом, жидком и газообразном состоянии. Примером твердого неметалла может служить сера, фосфор и т. д.; газообразного – водород, хлор; жидкого – бром.

Газообразные неметаллы обычно существуют в природе в виде двухатомных молекул, кроме благородных газов, которые существуют в виде одноатомных. Жидкие неметаллы также часто имеют молекулярное строение. Твердые вещества чаще всего образуют кристаллическую сеть, то есть обладают немолекулярным строением.
Сложные неорганические вещества
Чаще всего можно встретить классификацию сложных веществ по строению. Поэтому важнейшие классы неорганических соединений выглядят следующим образом:
1. Оксиды.
2. Гидроксиды:
- кислоты;
- основания;
- амфотерные гидроксиды.
3. Соли.
Некоторые источники выделяют кислоты, основания и амфотерные гидроксиды как самостоятельные пункты классификации, однако в связи с тем, что и первые, и вторые, и третьи являются результатом взаимодействия оксидов с водой, все эти категории относят к гидроксидам.
Оксиды
Оксиды являются веществами, которые имеют в своем составе 2 элемента (или более), причем один из них — это обязательно кислород. Общая формула оксидов имеет вид ЭхОу.

В зависимости от того, как взаимодействуют оксиды с другими веществами, их подразделяют на 3 категории: амфотерные, кислотные и основные.
Свойства классов неорганических соединений имеют значение при определении возможных реакций с их участием. Так, амфотерными являются те оксиды, которые при вступлении в реакцию с кислотами и основаниями образуют соли и воду. При вступлении в реакцию с водой данные соединения могут обладать кислотными и основными свойствами, то есть образовывать как кислоты, так и основания. К амфотерным относят соединения алюминия, хрома III, бериллия, железа III, цинка. Кислотные оксиды вступают в реакцию с водой и образуют кислоту, а при взаимодействии с основаниями — соли. Основные оксиды в реакции с водой образуют основания, а с основаниями – тоже соли.

В соответствии с другой классификацией, оксиды также делят по способности образовывать соли на солеобразующие и несолеобразующие. Несолетворные оксиды образуют кислоты, и для них невозможны реакции с образованием солей.
Гидроксиды
Эти соединения получают путем присоединения воды к оксидам либо косвенно в процессе ряда реакций. Те гидроксиды, что образованы основными оксидами, называют основаниями, а те, что образуются из амфотерных оксидов, – амфотерными гидроксидами.
Кислоты
Эти сложные вещества входят в основные классы неорганических соединений, состоят из водорода и кислотного остатка. Наименование последнего позволяет дать название той или иной кислоте.
Кислоты как классы неорганических соединений могут быть одно-, двух- и трехосновными, что зависит от количества атомов водорода в их составе. Примером одноосновной кислоты служит соляная кислота (HCl), двухосновной – серная (H2SO4), а трехосновной – фосфорная (H3PO4).
Кислотные остатки также имеют свою классификацию, могут быть кислородсодержащими и бескислородными.
Атомы металлов способны замещать водород в кислотах, в таком случае получаются соли.
Понятие о солях
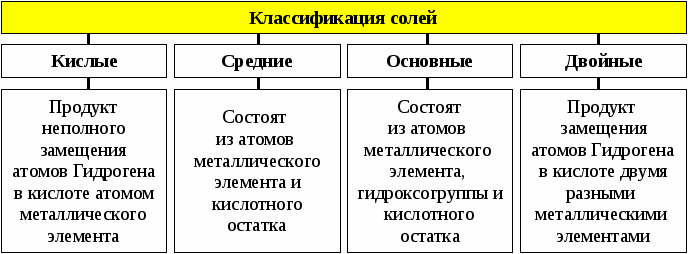
В основные классы неорганических соединений входят также соли. Это продукт замещения атомами металла водорода в кислотах или гидроксильных групп оснований на кислотные остатки. Соли образуются тогда, когда различные классы неорганических соединений взаимодействуют между собой.
В зависимости от степени замещения атомов различают средние, кислые и основные соли. Если происходит полное замещение атомов, то образовавшаяся соль средняя, если частичное, то, соответственно, кислая или основная. В том случае, когда состава реагентов достаточно для полного замещения, образуется средняя соль.
Когда при взаимодействии не хватает кислоты для получения средней соли, говорят о получении основной соли.
При вступлении в реакцию металлов с неметаллами образуется бескислородная соль, а когда в реакцию вступает кислотный и основный оксид, получают кислородсодержащую соль.
Понятие о связи между классами неорганических соединений
Выше мы упоминали о том, что некоторые вещества получают только косвенным путем, посредством нескольких реакций. Существует связь между классами неорганических соединений, о которой можно говорить в связи с тем, что различные сложные элементы вступают в реакции между собой, образуя новые вещества. Например, соль образуется при взаимодействии кислот с основаниями. Это так называемая генетическая связь классов неорганических соединений, суть которой в том, что взаимодействие происходит между разными классами неорганических веществ. Так, в реакции вступают основные и кислотные оксиды, основания и кислоты, металлы и неметаллы и т. д. Основные классы неорганических соединений, взаимодействуя, обеспечивают химические свойства этих групп веществ.
Вот некоторые из примеров, подтверждающих генетическую связь между разными классами соединений:
- Металлы при взаимодействии с неметаллами образуют соли.
- Металлы при взаимодействии с кислородом образуют оксиды.
- Неметаллы, соответственно, образуют в реакции с кислородом оксиды неметаллов.
- Основные и амфотерные оксиды, вступая в реакцию с кислотами или кислотными оксидами, образуют соли.
- Кислотные оксиды образуют соли при реакции с основаниями или основными оксидами.
- Кислотные оксиды вступают в реакцию с водой и образуют кислоты.
- Основания, вступая в реакцию с амфотерными гидроксидами, образуют соли.
Таким образом, деление на классы неорганических соединений позволяет сгруппировать их огромное количество и определить принципы их взаимодействия между собой и другими веществами. Кроме того, подобная группировка способствует более легкому усвоению и запоминанию свойств различных неорганических соединений.
www.syl.ru
Классы неорганических соединений | Дистанционные уроки
04-Окт-2012 | комментариев 10 | Лолита Окольнова
Это очень важная тема в неорганической химии и в учебниках, и в интернете, но здесь я хочу показать именно практическое применение классификации. Так что, давайте разбираться!
Основные классы неорганических соединений:
простые вещества;
сложные вещества:
- оксиды;
- основания;
- кислоты;
- соли

Давайте сразу разберем эту схему на примерах:
У нас есть простые вещества:
- металлы: Na, например
- неметаллы: S
При взаимодействии с кислородом (O2) образуются оксиды:
- из металлов образуются основные оксиды: 4Na + O2 = 2Na2O
- из переходных элементов (диагональ о Be к At) — амфотерные оксиды — Al2O3
- из неметаллов образуются кислотные оксиды — SO2
- также из неметаллов образуются несолеобразующие оксиды: 2С + O2 = 2CO
Названия оксидов очень логичны — из основных оксидов образуются основания — соединения с- OH — группой:
Na2O + h3O = NaOH
( Me(OH)x — общая формула. Х= степени окисления металла. Заряд группы -OH= -1)
Систематическое названия — гидроксиды;
Растворимые основания называются щелочи.
Кислотные оксиды при взаимодействии с водой дают кислоты — соединения, у которых в начале молекулы стоит Н — водород: SO2 + h3O = h3SO3
(Когда пишите уравнения взаимодействия, то просто складываете атомы: сначала H, потом неметалл, потом кислород)
Кислоты и основания при взаимодействии друг с другом дают соли: 2NaOH + h3SO3 = Na2SO3 + 2h3O
Эта реакция называется реакцией нейтрализации, т.к. кислота и щелочь дают соль и воду — «нейтрализуется» действие каждого из реагентов.
Амфотерные оксиды и несолеобразующие лучше разобрать отдельно… у них своя запутанная история 🙂
Есть еще одна довольно удобная табличка по взаимодействиям основных классов неорганических соединений:

Правый столбец — все, что относится к металлам и их соединениям.
Левый столбец — неметаллы и их соединения.
ВНУТРИ СТОЛБЦА РЕАКЦИИ НЕ ИДУТ!
(есть некоторые исключения — например, реакции оксидов и металлов d-элементов)
Т.е. основной оксид с основанием взаимодействовать не будет: Na2O + NaOH —> реакция не идет
кислота с кислотным оксидом взаимодействовать не будут: SO2 + h3SO3 —> реакция не идет
ВЕЩЕСТВА ИЗ РАЗНЫХ СТОЛБЦОВ РЕАГИРУЮТ МЕЖДУ СОБОЙ
Давайте эти реакции разберем подробнее…
1. Идем по синим стрелочкам
1. Металл + неметалл = соль:
2Na+ Cl2 = 2NaCl — хлорид натрия
2Na + S = Na2S — сульфид натрия
2. металл + кислотный оксид = оксид металла + неметалл/несолеобразующий оксид:
2Na + CO2 = Na2O + CO
Na + SO2 = Na2O + S
здесь суть в том, что металл окисляется кислородом кислотного оксида, а оксид, соответственно, восстанавливается металлом.
3. металл + кислота = соль + …
Здесь нам понадобится ряд активности металлов.
- Если металл стоит ДО ВОДОРОДА Н, то он вытесняет водород из кислот: 2Na + 2HCl =2 NaCl + h3
- Если металл стоит ПОСЛЕ ВОДОРОДА, то реакция идет без выделения h3: Сu + 4HNO3 = Cu(NO3)2 + NO2 +2 h3O
4. металл + соль = другая соль + другой металл
И опят нам нужен ряд активности металлов. Только предыдущий металл может вытеснить последующий из его соли:
2Na + MgCl2 = 2NaCl + Mg
Na + CaCl2 —> реакция не идет!
2. Идем по зеленым стрелочкам
1. Основной оксид + неметалл = металл/ оксид с меньшей степенью окисления + кислотный оксид/ несолеобразующий оксид
Na2O + S = 2Na + SO2
Fe2O3 + C = 2FeO + CO
здесь идет окислительно-восстановительный процесс — неметалл восстанавливает основной оксид, сам при этом окисляется
2. Основной оксид + кислотный оксид = соль
Na2O + SO2 = Na2SO3 — сульфит натрия (просто «складываем» количество атомов 🙂 )
3. Основной оксид + соль —> реакция не идет
3. Идем по желтым стрелочкам
1. основание + неметалл =…
Обычно такие реакции не идут. Исключение составляет NaOH и Cl2:

2. основание + кислотный оксид = соль
2NaOH + SO2 = Na2SO3 + h3O
3. основание + кислота = соль — РЕАКЦИЯ НЕЙТРАЛИЗАЦИИ
NaOH + HCl = NaCl + h3O
4. основание + соль —> реакция идет, если образуется газ, осадок или малодиссоциирующее вещество
Как видите, в большинстве случаев реакции между веществами из двух столбцов приводят к образованию соли. Ну а исключения надо отдельно все разобрать, а некоторые выучить.

в ЕГЭ это задания:
- А7 — классификация органических и неорганических веществ.
- А8 — свойства простых веществ.
- А9 — химические свойства оксидов.
- А10 — свойства оснований и кислот.
- А11 — химические свойства солей.
- А12 — взаимосвязь неорганических соединений.
в ГИА (ОГЭ) по химии:
- А9 — Химические свойства простых веществ: металлов и неметаллов
- А10 — Химические свойства оксидов: основных, амфотерных, кислотных
- А11 — Свойства оснований и кислот
- А12 — Химические свойства солей (средних)
Категории: |
Обсуждение: «Классы неорганических соединений»
(Правила комментирования)distant-lessons.ru
Классификация неорганических веществ
Простые вещества.
Молекулы состоят из атомов одного вида (атомов одного элемента). В
химических реакциях не могут разлагаться с образованием других веществ.
Сложные вещества (или химические соединения).
Молекулы состоят из атомов разного вида (атомов различных химических
элементов). В химических реакциях разлагаются с образованием нескольких
других веществ.
| Неорганические вещества | |
| Простые | Металлы |
| Неметаллы | |
| Сложные | Оксиды |
| Основания | |
| Кислоты | |
| Соли | |
Резкой границы между металлами и неметаллами нет, т.к. есть простые вещества, проявляющие двойственные свойства.
Аллотропия
Аллотропия — способность некоторых химических элементов образовывать несколько простых веществ, различающихся по строению и свойствам.
С — алмаз, графит, карбин.
O — кислород, озон.
S — ромбическая, моноклинная, пластическая.
P — белый, красный, чёрный.
Явление аллотропии вызывается двумя причинами:
1) различным числом атомов в молекуле, например кислород O2 и озон O3
2) образованием различных кристаллических форм, например алмаз и графит.
ОСНОВАНИЯ
Основания
— сложные вещества, в которых атомы металлов соединены с одной или
несколькими гидроксильными группами (с точки зрения теории
электролитической диссоциации, основания — сложные вещества, при
диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид — анионы OH—).
Классификация. Растворимые в воде (щёлочи) и нерастворимые. Амфотерные основания проявляют также свойства слабых кислот.
Получение
1. Реакции активных металлов ( щелочных и щелочноземельных металлов) с водой:
2Na + 2H2O ® 2NaOH + H2
Ca + 2H2O ® Ca(OH)2 + H2
2. Взаимодействие оксидов активных металлов с водой:
BaO + H2O ® Ba(OH)2
3. Электролиз водных растворов солей
2NaCl + 2H2O ® 2NaOH + H2 + Cl2
Химические свойства
| Щёлочи | Нерастворимые основания |
| 1. Действие на индикаторы. | |
| лакмус — синий метилоранж — жёлтый фенолфталеин — малиновый |
— |
| 2. Взаимодействие с кислотными оксидами. | |
| 2KOH + CO2 ® K2CO3 + H2O KOH + CO2 ® KHCO3 |
— |
| 3. Взаимодействие с кислотами (реакция нейтрализации) | |
| NaOH + HNO3 ® NaNO3 + H2O | Cu(OH)2 + 2HCl ® CuCl2 + 2H2O |
| 4. Обменная реакция с солями | |
| Ba(OH)2 + K2SO4 ® 2KOH + BaSO4¯ 3KOH+Fe(NO3)3 ® Fe(OH)3¯ + 3KNO3 |
— |
| 5. Термический распад. | |
| — | Cu(OH)2 —t°® CuO + H2O |
ОКСИДЫ
Классификация
Оксиды — это сложные вещества, состоящие из двух элементов, один из которых кислород.
| ОКСИДЫ | |
| Несолеобразующие | CO, N2O, NO |
| Солеобразующие | Основные -это оксиды металлов, в которых последние проявляют небольшую степень окисления +1, +2 Na2O; MgO; CuO |
| |
Амфотерные (обычно для металлов со степенью окисления +3, +4). В качестве гидратов им соответствуют амфотерные гидроксиды ZnO; Al2O3; Cr2O3; SnO2 |
| |
Кислотные -это оксиды неметаллов и металлов со степенью окисления от +5 до +7 SO2; SO3; P2O5; Mn2O7; CrO3 |
| |
Основным оксидам соответствуют основания, кислотным — кислоты, амфотерным — и те и другие |
Получение
1. Взаимодействие простых и сложных веществ с кислородом:
2Mg + O2 ® 2MgO
4P + 5O2 ® 2P2O5
S + O2 ® SO2
2CO + O2 ® 2CO2
2CuS + 3O2 ® 2CuO + 2SO2
CH4 + 2O2 ® CO2 + 2H2O
4NH3 + 5O2 —кат.® 4NO + 6H2O
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Cu(OH)2 —t°® CuO + H2O
(CuOH)2CO3 —t°® 2CuO + CO2 + H2O
2Pb(NO3)2 —t°® 2PbO + 4NO2 + O2
2HMnO4 —t°;H2SO4(конц.)® Mn2O7 + H2O
Химические свойства
| Основные оксиды | Кислотные оксиды |
| 1. Взаимодействие с водой | |
| Образуется основание: Na2O + H2O ® 2NaOH CaO + H2O ® Ca(OH)2 |
Образуется кислота: SO3 + H2O ® H2SO4 P2O5 + 3H2O ® 2H3PO4 |
| 2. Взаимодействие с кислотой или основанием: | |
| При реакции с кислотой образуется соль и вода MgO + H2SO4 —t°® MgSO4 + H2O CuO + 2HCl —t°® CuCl2 + H2O |
При реакции с основанием образуется соль и вода CO2 + Ba(OH)2 ® BaCO3 + H2O SO2 + 2NaOH ® Na2SO3 + H2O |
| Амфотерные оксиды взаимодействуют | |
| с кислотами как основные: ZnO + H2SO4 ® ZnSO4 + H2O |
с основаниями как кислотные: ZnO + 2NaOH ® Na2ZnO2 + H2O (ZnO + 2NaOH + H2O ® Na2[Zn(OH)4]) |
| 3. Взаимодействие основных и кислотных оксидов между собой приводит к солям. | |
| Na2O + CO2 ® Na2CO3 | |
| 4. Восстановление до простых веществ: | |
| 3CuO + 2NH3 ® 3Cu + N2 + 3H2O P2O5 + 5C ® 2P + 5CO |
|
www.examen.ru
Лекция по химии на тему «Основные классы неорганических соединений»для студентов СПО.
Гризодуб Наталья Викторовна- преподаватель химии и биологии Донецкого индустриально- педагогического техникума.
Лекция № 1
Тема. Основные классы неорганических соединений.
План
Оксиды.
Кислоты.
Основания.
Соли.
Оксиды
Оксиды – это сложные вещества, состоящие из атомов двух химических элементов, один из которых Оксиген.
Номенклатура оксидов
Валентность элемента, образующего оксид
Правило составления
названия оксида
Пример
Постоянная
Название химического
элемента + слово «оксид»
CaO – кальций оксид
ZnO – цинк оксид
Переменная
Название химического
элемента + валентность
(в скобках) + слово «оксид»
CO2 – карбон (IV) оксид
N2O – нитроген (I) оксид
SO3 – сульфур (VI) оксид
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
Химические свойства основных оксидов
CaO + H2O = Ca(OH)2
CaO + H2SO4 = CaSO4 + H2O
CaO + CO2 = CaCO3
Химические свойства амфотерных оксидов
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2NaOH = Na2ZnO2 + H2O
ZnO + СO2 = ZnСO3
ZnO + СaO = CaZnO2
Химические свойства кислотных оксидов
SO2 + H2O = H2SO3 (исключение: SiO2 + H2O ≠)
SO2 + Ca(OH)2 = CaSO3 + H2O
СaO + SO3 = CaSO4
ПОЛУЧЕНИЕ ОКСИДОВ
2Mg + O2 = 2MgO
CH4 + 2O2 = CO2↑ + 2H2O
Fe(OH)2  FeO + H2O
FeO + H2O
4HNO3  4NO2↑ + 2H2O + O2↑
4NO2↑ + 2H2O + O2↑
CaCO3  CaO + CO2↑
CaO + CO2↑
2Pb(NO3)2 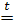 2PbO + 4NO2 + O2↑
2PbO + 4NO2 + O2↑
4CrO3 = 2Cr2O3 + 3O2↑
2CO + O2 = 2CO2↑
Na2CO3 + SiO2 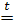 Na2SiO3 + CO2↑
Na2SiO3 + CO2↑
3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O
S + H2SO4 (конц.) = 3SO2↑ + 2H2O
Кислоты
Кислоты – это сложные вещества, содержащие атомы Гидрогена, которые могут замещаться атомами металлических элементов, и кислотные остатки.
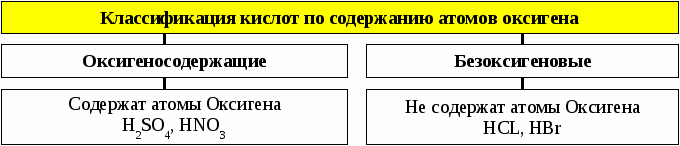
Классификация кислот по основности (числу атомов гидрогена)



Одноосновные
Трехосновные
Двухосновные
Содержат три атома
Гидрогена
H3PO4
Содержат один атом
Гидрогена
HCN
Содержат два атома
Гидрогена
H2SiO3
Ряд активности кислот
HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > HClO3 > H3PO3 >
сильные кислоты
h3SO3 > H3PO2 > HClO2 > H3PO4 > H3AsO4 > HF > HNO2 >
кислоты средней силы
CH3COOH > H2CO3 > H2S > HClO > H3BO3 > H2SiO3 > HIO
слабые кислоты
Ряд активности металлов
Li K Ca Na Mg Al Mn Zn Fe Ni Sn Pb
(H2)
Cu Hg Ag Pt Au

направление уменьшения активности металлов
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
Кислота + лакмус (фиолетовый) → красный
Кислота + метиловый оранжевый → розовый
NaOH + HCl = NaCl + H2O
CuO + 2HCl = CuCl2 + H2O
2HCl + Zn = ZnCl2 + H2↑ исключения: HNO3, H2SO4 (конц.)
Взаимодействуют с солями (если образуется осадок ↓ или газ ↑, соль более слабой или летучей кислоты) с образованием новой соли и новой кислоты
2
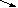 HCl + K2CO3 = 2KCl + H2CO3
HCl + K2CO3 = 2KCl + H2CO3 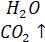
ПОЛУЧЕНИЕ КИСЛОТ
SO3 + H2O = H2SO4
Взаимодействие солей с кислотами (кислота, вступающая в реакцию, должна быть более сильной, чем та, которая образуется)
Na2SiO3 + H2SO4 = H2SiO3↓ + Na2SO4
5HNO3 (разб.) + 3P + 2H2O = 5NO↑ + 3H3PO4
H2 + Cl2 = 2HCl
Основания
Основания – это сложные вещества, содержащие атомы металлического элемента (Ме) и одну или несколько гидроксогрупп (ОН).
Общая формула оснований:
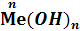 ,
,
где n – валентность металлического элемента.
Номенклатура оксидов
Валентность элемента
Правило составления
названия основания
Пример
Постоянная
Название металлического элемента + слово «гидроксид»
NaOH – натрий гидроксид
Ca(OH)2 – кальций гидроксид
Переменная
Название металлического элемента + значение валентности металлического элемента (в скобках) + слово «гидроксид»
Cu(OH)2 – купрум (II)
гидроксид
Fe(OH)2 – феррум (II)
гидроксид
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
Растворимые основания (щелочи)
NaOH + лакмус (фиолетовый) → синий
NaOH + метиловый оранжевый → желтый
NaOH + фенолфталеин (бесцветный) → малиновый
2NaOH + H2SO4 = Na2SO4 + 2Н2O
2NaOH + SO3 = Na2SO4 + Н2O
2NaOH + ZnO 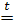 Na2ZnO2 + Н2O
Na2ZnO2 + Н2O
а) с образованием соли: Zn(OH)2 + 2NaOH 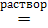 Na2[Zn(OH)4]
Na2[Zn(OH)4]
б) с образованием соли и воды: Zn(OH)2 + 2NaOH 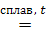 Na2ZnO2+2H2O
Na2ZnO2+2H2O
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
Нерастворимые в воде
Не изменяют цвет индикаторов
Взаимодействуют с кислотами (реакция нейтрализации) с образованием соли и воды
Cu(OH)2 + H2SO4 = CuSO4 + 2Н2O
Mg (ОН)2 + SiO2 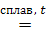 MgSiOg + Н2O
MgSiOg + Н2O
Не взаимодействуют с амфотерными оксидами, амфотерными гидроксидами и растворами солей
Разлагаются при нагревании с образованием оксида и воды
Cu(OH)2 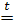 СuО + Н2O
СuО + Н2O
ПОЛУЧЕНИЕ РАСТВОРИМЫХ ОСНОВАНИЙ (ЩЕЛОЧЕЙ)
2Na + 2Н2O = 2NaOH + Н2↑
ВаО + Н2O = Ва(ОН)2
Na2SO4 + Ва (ОН)2 – BaSO4↓+2NaOH
2NaCl + 2Н2O 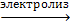 Н2↑ + Cl2↑ + 2NaOH
Н2↑ + Cl2↑ + 2NaOH
ПОЛУЧЕНИЕ НЕРАСТВОРИМЫХ ОСНОВАНИЙ
CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4
MgCl2 + 2KOH = Mg(OH)2↓ + 2KC1
Pb(NO3)2 + 2NaOH = Pb(OH)2↓ +2NaNO3
Соли
Соли – это сложные вещества, содержащие ионы металлических элементов и кислотные остатки.
Номенклатура кислых солей
Правило составления названий
кислых солей
Пример
Название металлического элемента + слово «гидроген» («дигидроген») + название кислотного остатка
NaHSO4 – натрий гидроген сульфат
NaH2PO4 – натрий дигидроген ортофосфат
Номенклатура средних солей
Валентность элемента
Правило составления
названия основания
Пример
Постоянная
Название металлического элемента + название кислотного остатка
K2SO3 – калий сульфит
Переменная
Название металлического элемента + валентность металлического элемента (в скобках) + название кислотного остатка
CuSO4 – купрум (II) сульфат
Номенклатура основных солей
Правило составления названий
кислых солей
Пример
Название металлического элемента + слово «гидроксид» + название кислотного остатка
Mg(OH)Cl – магний гидроксид хлорид
Номенклатура двойных солей
Правило составления названий
кислых солей
Пример
Название металлического элементов (по алфавиту) + название кислотного остатка
KAl(SO4)2 – алюминий калий дисульфат
ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
реагирующий металл активнее металла, который образовал соль;
соль растворима в воде
CuSO4 + Fe = FeSO4 + Сu, FeSO4 + Сu ≠
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Na2SO4 + ВаСl2 = BaSO4↓ + 2NaCl
реагирующая кислота сильнее, чем та, которая образовала соль;
образуется газ ↑ или осадок ↓
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
C aCO3 + 2НСl = СаСl2 + H2CO3
aCO3 + 2НСl = СаСl2 + H2CO3 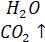 .
.
СаСO3 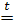 СаО + СO2↑
СаО + СO2↑
Са(НСO3)2 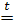 CaCO3 +CO2↑+H2O
CaCO3 +CO2↑+H2O
NH4NO2 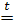 N2 + 2H2O
N2 + 2H2O
2KClO3 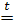 2KCl + 3O2↑
2KCl + 3O2↑
ПОЛУЧЕНИЕ СРЕДНИХ СОЛЕЙ
Mg + 2НС1 = MgCl2 + Н2↑
CuO + H2SO4 = CuSO4 + Н2O
NaOH + НС1 = NaCl + Н2O
СаСO3 + 2HNO3 = Ca(NO3)2 + Н2O + СO2↑
СаО + СO2 = СаСО3
2NaOH + СO2 = Na2CO3 + Н2O
СаСO3 + SiO2 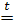 CaSiO3 + СO2↑
CaSiO3 + СO2↑
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
ВаСl2 + Na2SO4 = BaSO4↓+2NaCl
Рb + Hg(NO3)2 = Hg + Pb(NO3)2
2Fe + ЗСl2 = 2FeCl3
Сl2 + 2KI = 2КСl +I2
2KNO3 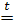 2KNO2 + O2↑
2KNO2 + O2↑
ПОЛУЧЕНИЕ КИСЛЫХ СОЛЕЙ
NaOH + H2SO4 = NaHSO4 + Н2O
СаО + 2H2SO4 Са (HSO4)2 + Н2O
СаСO3 + Н2O + СO2 = Са(НСO3)2
Ва(ОН)2 +2СO2 = Ва(НСO3)2
Задания для закрепления:
Укажите кислоту, которая может образовывать кислые соли:
А) карбонатная кислота
Б) нитратная кислота
В)уксусная кислота
Г)хлоридная кислота
Укажите ряд кислот, в которых приведены только оксигенсодержащие кислоты:
А) сульфатная, нитратная, хлоридная
Б) флуоридная, сульфидная, бромидная
В)сульфитная, ортофосфатная, силикатная
Г)нитратная, сульфидная, фосфитная
Обозначьте классы веществ с которыми взаимодействуют кислоты:
А) кислотные оксиды
Б) основные оксиды
В)неметаллы
Г)металлы
Д) основания
Е) соли
Вычислите и обозначьте степень окисления Сульфура в алюминий сульфате Al2(SO4)3:
А) -2
Б) +6
В)+4
Г)+3
Укажите продукты реакции взаимодействия нитратной кислоты с кальций карбонатом:
А) кальций гидроген карбонат
Б) кальций нитрат, карбон(4) оксид и вода
В)карбоновая кислота и кальций гидрогенкарбонат
Г)кальций нитрат и натрий нитрат
Укажите вещества при взаимодействии которых образуется желтый осадок:
А) нитроген (2) оксид и кислород
Б) натрий йодид и аргентум нитрат
В)кальций силикат и нитратная кислота
Г)натрий сульфат и калий нитрат
Обозначьте ионы, которые обуславливают превращение окраски фенолфталеина в розовую:
А) гидроксид -ионы
Б) сульфат ионы
В) ионы гидрогена
Г) ионы кальция
Обозначьте вещество с которым реагирует натрий гидроксида:
А) кальций оксид
Б) калий сульфат
В)этанол
Г)кальций гидроксид
Укажите название элемента, образующего кислотные оксиды:
А) калий
Б) алюминий
В)сульфур
Г)магний
Обозначьте вещества, взаимодейсвующие с карбон(4) оксидом:
А) калий оксид
Б) калий нитрат
В)кальций нитрат
Г)кальций хлорид
Д) кислород
Е) калий хлорид
Ж) вода
Домашнее задание:
№1. В какой группе все вещества являются оксидами?
А ) NaOH, P2O5, h3CO3
Б ) CO2, Na2O, FeO
В ) Na2SO4,CaO, SO2
Г ) Li2O, SiO2, h3SO3
№2. В какой группе все вещества являются основными оксидами?
А ) KOH, Ca(OH)2, CaO
В ) Na2O, Fe2O3,CrO
Г ) Na2O, CaO, MnO
Д ) P2O5,NaOH, HNO3
№3. Установите соответствие между химической формулой кислоты и её названием:
1. HNO3
а) Серная
2. h3SO3
б) Соляная
3. h4PO4
в) Сернистая
4. h3SO4
г) Азотная
5. HCl
д) Ортофосфорная
№4.
Установите соответствие между химической формулой и классом соединений:
1. CaO
А) Амфотерный оксид
2. N 2 O 5
В) Основной оксид
3. CO
Г) Кислотный оксид
4. ZnO
Д) Безразличный оксид
№5. Из перечня формул выберите те, которые относятся к классу солей:
А) KCl
Б) SiO2
В) HNO3
Г) Na2SO4
Д) Fe(OH)2
Е) HCl
№6. Установите соответствие между схемой реакции и её типом
1. 2HgO = 2Hg + O2
а) соединение
2. 2Fe + 3Cl2 = 2FeCl3
б) разложение
3. 2NaOH + h3SO4 = Na2SO4 + 2h3O
в) замещение
4. Al2O3 + 3Mg = 3MgO + 2Al
г) обмен
№7. Осуществите превращения по схеме, укажите типы реакций, назовите вещества
P→P2O5→h4PO4→Na3PO4→Ca3(PO4)2
Zn→ZnCl2→Zn(OH)2→ZnO→Zn(NO3)2
Al→Al2O3→AlCl3→Al(OH)3→Al2O3
№8. Какие из предложенных веществ будут вступать в реакцию с гидроксидом калия запишите возможные УХР, назовите вещества, укажите типы реакций:
CaO, NaOH, ZnCl2, SiO2, HCl, Zn(OH)2, NO
№9. Какие из предложенных веществ будут вступать в реакцию с серной кислотой запишите возможные УХР, назовите вещества, укажите типы реакций:
CO2, Na2O, Ba(OH)2, Au, Na2CO3, N2O, CrO3
№10. Какие из предложенных веществ будут вступать в реакцию с солянойкислотой запишите возможные УХР, назовите вещества, укажите типы реакций:
Mg, ZnO, h4PO4, CaCO3, SO3, CO, Cu
№11. Классифицируйте вещества по классам
CaO, NaOH, CO2, h3SO3, CaCl2, FeCl3, Zn(OH)2, N2O5, Al2O3, Ca(OH)2, N2O, FeO, SO3, Na2SO4, ZnO, CaCO3, Mn2O7, CuO, KOH, CO, Fe(OH)3, Na2O, Ba(OH)2, SiO2, HCl, Al(OH)3, NO, MnO, Cr2O3, CrO3
Оксид
основной
Оксид
ксилотный
Оксид
амфотерный
Оксид
безразлич
Соль
Кислота
Щёлочь
Основание
нерастворим
infourok.ru
Классификация и номенклатура неорганических веществ. Видеоурок. Химия 11 Класс
Химия изучает превращения химических веществ, которых на сегодняшний день известно более 20 миллионов. Поэтому важна классификация химических соединений, т. е. объединение их в группы или классы, обладающие сходными свойствами. Данный урок поможет изучить современную классификацию неорганических веществ и познакомит с правилами составления их названий по химическим формулам.
Тема: Основные классы соединений, их свойства и типичные реакции
Урок: Классификация и номенклатура неорганических веществ
Неорганические вещества по составу принято делить на две группы: немногочисленную группу простых веществ (их насчитывается около 400) и очень многочисленную группу сложных веществ. Простые вещества состоят из одного химического элемента, а сложные – из нескольких.
Все простые вещества можно разделить на металлы и неметаллы, поскольку их свойства существенно отличаются. Металлы обладают металлическим блеском, высокой тепло- и электропроводностью, пластичны, проявляют восстановительные свойства. Неметаллы обладают очень разными физическими и химическими свойствами, но, как правило, в твердом состоянии хрупкие, плохо проводят электрический ток и тепло.
Граница между металлами и неметаллами условна. Существуют вещества, обладающие свойствами как металлов, так и неметаллов. Например, серый мышьяк имеет металлический блеск и электрическую проводимость (рис. 1), а другая аллотропная модификация – желтый мышьяк – имеет чисто неметаллические свойства.

Рис. 1. Серый мышьяк
Сложные вещества обычно делят на классы: оксиды, кислоты, основания, амфотерные гидроксиды и соли (Рис. 2). Данная классификация несовершенна, т. к. в ней нет места для аммиака, соединений металлов с фосфором, азотом, углеродом и т. д.
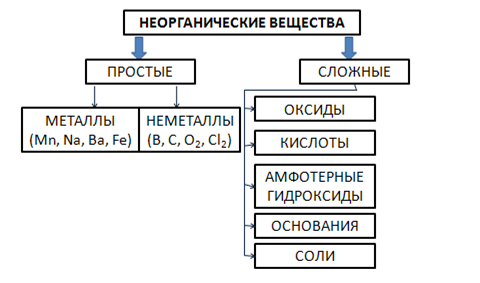
Рис. 2. Классификация неорганических веществ
Оксиды могут быть солеобразующими и несолеобразующими. Солеобразующим оксидам соответствуют гидроксиды и соли с элементом в той же степени окисления, что и в оксиде. Несолеобразующие оксиды не имеют соответствующих гидроксидов и солей. Таких оксидов немного: N2O, NO, SiO, CO.
Солеобразующие оксиды в зависимости от кислотно-основного характера делятся на кислотные, амфотерные и основные.
Основные оксиды образованы металлами с небольшими степенями окисления +1, +2. Амфотерные оксиды образованы переходными металлами со степенями окисления +3, +4, а также Be, Zn, Sn, Pb. Кислотные оксиды образованы неметаллами, а также металлами со степенью окисления больше, чем +4. Рис. 3.
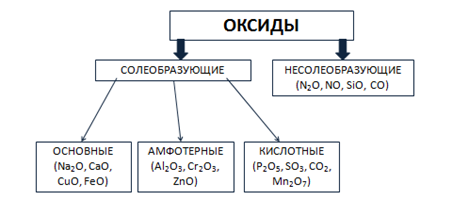
Рис. 3. Классификация оксидов
Кислоты – это сложные вещества, состоящие из атомов водорода, способных замещаться на металлы, и кислотных остатков. Кислоты можно разделить на группы по содержанию кислорода: кислородосодержащие (например, HNO3, H2SO4, H3PO4) и бескислородные (HI, H2S). Рис. 4.
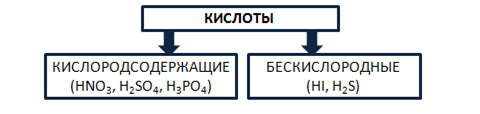
Рис. 4. Классификация кислот
Основания – это сложные вещества, состоящие из катионов металла и одного или нескольких гидроксид-анионов. В основу классификации оснований могут быть положены разные признаки. Например, их отношение к воде. По данному признаку основания делят на растворимые в воде (щелочи) и нерастворимые в воде. Рис. 5.
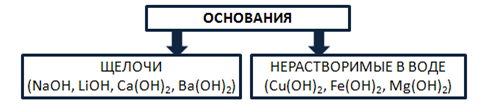
Рис. 5. Классификация оснований
Амфотерные гидроксиды – это сложные вещества, которые имеют свойства и кислот, и оснований, и потому их формулы можно записывать в разных формах:
Zn(OH)2 = H2ZnO2
форма основания форма кислоты
Существует несколько видов солей (рис. 6).
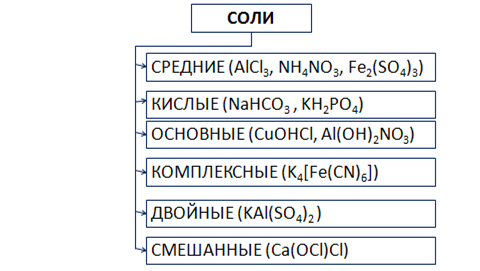
Рис. 6. Виды солей
Средние соли состоят из катионов металла (или аммония) и анионов кислотных остатков. Кислые соли, кроме катионов металла, содержат катионы водорода и анион кислотного остатка. Основные соли в своем составе содержат гидроксид-анионы.
Если соль образована двумя видами катионов металлов и одним анионом, то ее называют двойной. Например, сульфат алюминия-калия KAl(SO4)2.
Соли с двумя разными анионами и одним катионом называют смешанными. Например, Са(OCl)Cl – хлорид-гипохлорит кальция.
В комплексных солях содержится сложный ион, который принято заключать в квадратные скобки.
Список литературы
- Кузнецова Н.Е., Литвинова Т.Н., Лёвкин А.Н. Химия: 11 класс: учебник для учащихся общеобраз. учрежд. (профильный уровень): в 2-х ч. Ч.2. – М.: Вентана-Граф, 2008. (§55)
- Радецкий А.М. Химия. Дидактический материал. 10-11 классы. – М.: Просвещение, 2011.
- Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 27–30)
- Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003. (с. 156–159)
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Chemnet (Источник).
- Школьный Cектор Ассоциации RELARN (Источник).
- Km.ru (Источник).
Домашнее задание
- с. 27–29 №№ 5.1, 5.15, 5.25 из Сборника задач и упражнений по химии для средней школы (Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008).
- Распределите вещества по соответствующим столбцам
CuSO4, KOH, NaCl, NaHCO3, SO2, Mg(OH)2, CaO, SiO2, Ba(OH)2, H2S, H2SO4, KHSO4, CuOHNO3, ZnO, HNO3, Na2HPO4
| ОКСИДЫ | КИСЛОТЫ | ОСНОВАНИЯ | СОЛИ | ||||||
| основные | кислотные | амфотерные |
кислородо- содержащие |
бескислородные | щелочи | нераств. в воде | кислые | средние | основные |
interneturok.ru
Основные классы неорганических соединений: примеры соединений, различие в их составе
Билет № 2
1. Простые и сложные вещества: различие в их составе. Основные классы неорганических соединений: примеры соединений, различие в их составе
Простые вещества состоят из одного химического элемента. К ним относятся металлы и неметаллы.
Сложные вещества состоят из двух или более химических элементов. Сложные вещества, или соединения, подразделяют на классы:
- оксиды
- кислоты
- основания
- соли
Оксидами называют вещества, состоящие из двух элементов, один из которых кислород (в степени окисления −2). Оксиды делят на осно́вные, кислотные, амфотерные, безразличные (несолеобразующие).
Осно́вным оксидам соответствуют основания. Это оксиды металлов, например натрия Na2O, кальция CaO. Основные оксиды реагируют с кислотами с образованием соли и воды.
Кислотным оксидам соответствуют кислоты. Это оксиды неметаллов, например, серы SO2, фосфора P2O5, или металлов в высшей степени окисления, например, оксид хрома (VI) CrO3. Кислотные оксиды реагируют со щелочами с образованием соли и воды
Амфотерные оксиды реагируют и с кислотами, и со щелочами. Примером могут служить оксиды цинка и алюминия.
Несолеобразующие оксиды не реагируют ни с кислотами, ни со щелочами. К ним относятся некоторые оксиды неметаллов, например, оксид азота (II) NO.
Кислоты — это сложные вещества, состоящие из одного или нескольких атомов водорода и кислотного остатка.
Кислоты могут быть бескислородными, как соляная HCl, сероводородная H2S, или кислородсодержащими: азотная HNO3, серная H2SO4.
В зависимости от числа атомов водорода, кислоты делят на одноосно́вные, например, азотная HNO3, двухосно́вные — серная H2SO4, трехсно́вные — ортофосфорная (часто называют просто фосфорная) H3PO4.
С точки зрения теории электролитической диссоциации кислотами называются вещества, диссоциирующие в растворах с образованием ионов водорода:
HCl → H+ + Cl−
Основания — это сложные вещества, состоящие из металла и одной или нескольких гидроксогрупп (OH). Основания могут быть растворимыми в воде — щелочи: гидроксид натрия NaOH, гидроксид кальция Ca(OH)2, или нерастворимыми, как гидроксид меди (II) Cu(OH)2.
С точки зрения теории электролитической диссоциации основаниями являются вещества, диссоциирующие в растворах с образованием гидроксид-ионов, т. е. осно́вные гидроксиды:
NaOH → Na+ + OH−
С точки зрения протонной теории к основаниям относятся вещества, способные присоединять ионы водорода, например аммиак:
NH3 + HOH = NH4+ + OH−
Соли — это сложные вещества, в составе которых имеется металл (или сложный положительный ион) и кислотный остаток. Соли бывают:
• средние — в составе нет ионов водорода и гидроксогрупп, например, хлорид натрия NaCl, карбонат натрия Na2CO3
• кислые — содержат в своем составе ионы водорода, например, гидрокарбонат натрия NaHCO3, дигидрофосфат натрия NaH2PO4
• осно́вные — содержат в своем составе гидроксогруппы, например, основный карбонат меди (II) (CuOH)2CO3
2. Задача. Вычисление массовой доли вещества, находящегося в растворе.
Формулу для вычисления массовой доли в общем виде можно записать так:
ω = масса компонента / масса целого,
где ω — массовая доля
Для растворенного вещества формула расчета массовой доли будет иметь следующий вид:
ω = m растворенного вещества / m раствора ,
где ω — массовая доля,
m раствора = mрастворенного вещества + m растворителя
Пример:
Рассчитайте массовую долю растворенного вещества, если при выпаривании 20 г раствора было получено 4 г соли.
Решение:
m растворенного вещества = 4 г
m раствора = 20 г
ω = 4 г / 20 г = 0,2 = 20 %
Ответ: 0,2 или 20 %.
автор: Владимир Соколов
staminaon.com