Закон постоянства состава
Уже к началу XIX в. накопилось много данных о составе отдельных веществ и их изменениях. Развитие техники количественных измерений и методов химического анализа позволило определять соотношения элементов в соединениях. Французский химик Ж. Пруст (1754–1826) после тщательнейших экспериментов с рядом веществ установил закон постоянства состава– один из основных законов химии.
Согласно закону постоянства состава, всякое чистое вещество, независимо от способов его получения и нахождения в природе, имеет постоянный качественный и количественный состав.
Это означает, что все соединения содержат элементы в строго определенных весовых пропорциях, независимо от способа получения, Так, например, сернистый газ, полученный сжиганием серы, или действием кислот на сульфиты, или любым другим способом, всегда содержит одну весовую часть серы и одну весовую часть кислорода.
Закон постоянства состава веществ был установлен в результате семилетнего спора между Прустом и его оппонентом, французским химиком К. Бертолле (1748–1822), утверждавшим, что состав соединений зависит от способа их получения.
Бертолле в результате анализа растворов, которые он считал химическими соединениями, сделал общий вывод о существовании химических соединений переменного состава. Получалось, что два элемента могут образовать непрерывный ряд соединений с изменяющимися свойствами и составом.
Пруст утверждал, что состав чистого вещества всегда один и тот же, любое химическое вещество имеет всегда одни и те же свойства, одинаковую температуру плавления, кипения, удельный вес. Пруст заявлял, что природа даже через посредство людей никогда не производит соединений иначе, как только по весу и мере. Одни и те же соединения имеют всегда тождественный состав. Внешний их вид может быть различен, но свойства – никогда. Нет разницы между окисью железа из южного полушария и из северного, хлористое серебро из Перу совершенно тождественно хлористому серебру из Сибири; во всем мире имеется только один хлористый натрий, одна селитра и т.д. Проделав в течение 1799–1887 гг. массу анализов, Пруст доказал справедливость своих выводов.
Дальнейшее развитие химии показало, что закон постоянства состава характеризует соединения с молекулярной структурой, состав же соединений с немолекулярной структурой (атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
В начале XX в. русский химик Курнаков, изучая сплавы металлов, открыл соединения переменного состава. В дальнейшем было выяснено, что соединения переменного состава встречаются также среди оксидов, соединений металлов с серой, азотом, углеродом, водородом а также – среди других неорганических веществ, имеющих кристаллическую структуру. Вещества переменного состава были названы
Таблица 4.1
ДАЛЬТОНИДЫ
(вещества постоянного состава)
примеры соединений
БЕРТОЛЛИДЫ
(вещества переменного состава)
примеры соединений
H2O
H Cl
C Cl4
CO2
Ti O1,9 – 2,0
V O0,9 –1,3
Таким образом, закон постоянства состава, в отличие от закона сохранения массы вещества, не является столь всеобщим. Однако для своего времени закон постоянства состава имел фундаментальное значение. Он привел к мысли о существовании молекул и подтвердил неделимость атомов. В самом деле, почему в сернистом газе весовое отношение серы и кислорода всегда 1:1, а не1,1:0,9или0,95:1.05? Этот результат легко объяснить, если предположить, что атомы серы соединяются с определенным числом атомов кислорода и образуют частицы сернистого газа (эти частицы впоследствии были названы молекулами).
studfile.net
формулировка Ж. Пруста и современная — урок. Химия, 8–9 класс.
Пример:
углекислый газ может быть получен в результате сгорания угля, метана или при разложении известняка. Но в любом случае в порции углекислого газа число атомов кислорода будет в два раза больше числа атомов углерода, а массовые доли углерода и кислорода всегда равны \(27,29\) % и \(72,71\) %.
Развитие химии внесло дополнения в закон постоянства состава. Оказалось, что этот закон строго выполняется только для веществ молекулярного строения. Так, в любой молекуле углекислого газа содержится один атом углерода и два атома кислорода, и состав этого вещества изменяться не может.
Молекула углекислого газа
Молекулярное строение имеют все газообразные и жидкие вещества, а также твёрдые вещества с низкими температурами плавления. Постоянный состав имеют: вода, сернистый газ, сероводород, метан, аммиак, кислоты, спирт, сахар, глюкоза и т. д.
Количественный состав веществ немолекулярного строения может несколько изменяться в зависимости от способа получения.
Поваренная соль состоит из атомов натрия и хлора, расположенных в определённом порядке. Этот порядок может нарушаться, поэтому состав разных образцов соли несколько отличается. В поваренной соли, полученной разными способами, на \(1\) атом натрия может приходиться от \(0,99\) до \(1,01\) атомов хлора. Однако условно для простоты обычно указывают округлённые целые числа.
Кристалл поваренной соли
Немолекулярное строение имеют и другие соединения (питьевая сода, мел, оксиды металлов, их соли), песок и некоторые другие вещества. Для этих веществ закон постоянства состава выполняется только приблизительно.
Современная формулировка закона постоянства состава:
Всякое чистое вещество молекулярного строения независимо от места нахождения и способа получения имеет постоянный качественный и количественный состав.
Из закона постоянства состава следует, что при образовании сложного вещества химические элементы соединяются в определённых численных и массовых соотношениях.
www.yaklass.ru
Конспект «Закон постоянства состава веществ»
«Закон постоянства состава веществ»
Ключевые слова конспекта: Закон постоянства состава веществ
В молекуле воды на 2 атома водорода приходится 1 атом кислорода. Учитывая это и значения относительных атомных масс, можно легко вычислить соотношение масс водорода и кислорода в молекуле воды:
2Аr(Н) : Аr(O) = (2 • 1) : (1 • 16) = 1 : 8
То есть для получения воды нужно смешать водород и кислород в массовом соотношении 1 : 8. Если же их смешать в другом соотношении масс, например, 3 г водорода смешать с 8 г кислорода, то химическая реакция произойдёт, но 2 г водорода в реакцию не вступят. Нетрудно понять, что таким же должно быть соотношение масс водорода и кислорода в любом количестве воды, т. е. состав воды всегда постоянен. Постоянным составом обладает большое число химических соединений.
Закон постоянства состава веществ был открыт французским учёным Ж. Прустом в 1799—1806 гг. Закон был сформулирован так: Каждое химически чистое вещество независимо от места нахождения и способа получения имеет один и тот же постоянный состав.

- Тем не менее Закон постоянства состава веществ не является всеобщим. Он справедлив только для веществ, имеющих молекулярное строение. Состав веществ немолекулярного строения часто зависит от способа их получения.
На основе закона постоянства состава можно производить различные расчёты.
Задача. Определите массу серы, реагирующей без остатка с 5 г медных опилок, если медь и сера в данном случае соединяются в соотношении масс 2 : 1.
Решение.
- 2 г меди соединяются с 1 г серы
- 5 г меди соединяются с х г серы
2 г : 5 г = 1 г : х г
х = (5 • 1) : 2 = 2,5 г серы
Конспект урока «Закон постоянства состава веществ».
Следующая тема: «Химическая формула».
uchitel.pro
Постоянство состава вещества. Видеоурок. Химия 8 Класс
Тема: Первоначальные химические представления
Урок: Постоянство состава вещества
Ученые XVII-XVIII вв. проводили множество количественных измерений, в т.ч. по определению массовой доли элемента в веществе. Но результаты их опытов были неточными, и как следствие, не совпадали.
Французский химик Клод Луи Бертолле пытался доказать, что состав веществ зависит от пропорций, в которых находятся реагирующие вещества.

Рис. 1. Клод Луи Бертолле
В отличие от него другой французский химик Жозеф Луи Пруст провел много экспериментов по исследованию состава различных веществ и сделал вывод о постоянстве состава вещества.

Рис. 2. Жозеф Луи Пруст
В 1808 г. Пруст сформулировал закон постоянства состава веществ: «Вещества имеют постоянный состав независимо от способа и места их получения».
В своей работе «Исследование меди» в 1799 г. Пруст показал, что природный карбонат меди и карбонат меди, полученный химиками в лаборатории, имеют один и тот же состав.
Ничем не различаются вода, текущая из нашего крана, вода из родника, или вода, полученная синтетическим путем (имеется в виду состав чистого вещества – воды, а не состав смеси). Вода всегда будет содержать по массе 11,1 % водорода и 88,9 % кислорода.
Но природа гораздо разнообразнее, чем любая теория, созданная человеком. И из закона постоянства состава веществ есть исключения. В XX веке было обнаружено, что некоторые соединения не имеют постоянного состава.
Таким образом, нельзя сказать, что Клод Бертолле был абсолютно неправ. Закон постоянства состава веществ имеет ограничения.
Вещества, имеющие переменный состав существуют, их назвали в честь Бертолле – бертоллидами.
Бертоллиды — соединения переменного состава, не подчиняющиеся законам постоянных и кратных отношений. Бертоллиды являются нестехиометрическими бинарными соединениями переменного состава, который зависит от способа получения. Многочисленные случаи образования бертоллидов открыты в металлических системах, а также среди оксидов, сульфидов, карбидов, гидридов и др. Например, оксид ванадия(II) может иметь в зависимости от условий получения, состав от V 0,9 до V1,3.
Список рекомендованной литературы
1. Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с. 25-28)
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.21-23)
3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§9)
4. Химия: неорг. химия: учеб. для 8 кл. общеобр. учреждений / Г.Е. Рудзитис, ФюГю Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§§10,14)
5. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов (Источник).
2. Электронная версия журнала «Химия и жизнь» (Источник).
3. Тесты по химии (онлайн) (Источник).
Домашнее задание
с. 22-23 №№ 3,7 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
interneturok.ru
Закон постоянства состава — это… Что такое Закон постоянства состава?
- Закон постоянства состава
Закон постоянства состава (Ж.Л. Пруст, 1801—1808гг.) — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами. Это один из основных законов химии.
Закон постоянства состава не выполняется для бертоллидов (соединений переменного состава). Однако условно для простоты состав многих бертоллидов записывают как постоянный. Например, состав оксида железа(II) записывают в виде FeO (вместо более точной формулы Fe1-xO).
См. также
Категории:- Основные законы в химии
- Стехиометрия
- Количество вещества
Wikimedia Foundation. 2010.
- Порфирины
- Потенциометрия
Смотреть что такое «Закон постоянства состава» в других словарях:
ЗАКОН ПОСТОЯНСТВА СОСТАВА — один из основных законов химии, открытый в 1799 г. Ж. Л. Прустом; согласно этому закону определённое химически чистое соединение независимо от способа его получения состоит из одних и тех же хим. элементов, имеющих постоянные состав и свойства,… … Большая политехническая энциклопедия
закон постоянства состава — pastoviųjų santykių dėsnis statusas T sritis fizika atitikmenys: angl. law of constant proportions; law of definite composition vok. Gesetz der konstanten Gewichtsverhältnisse, n; Gesetz der konstanten Proportionen, n; Gesetz der konstanten… … Fizikos terminų žodynas
закон постоянства состава — закон паёв … Cловарь химических синонимов I
ПОСТОЯНСТВА СОСТАВА ЗАКОН — ПОСТОЯНСТВА СОСТАВА ЗАКОН: каждое химическое соединение независимо от способа его получения, состоит из одних и тех же элементов, причем отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллических… … Большой Энциклопедический словарь
ПОСТОЯНСТВА СОСТАВА ЗАКОН — ПОСТОЯНСТВА СОСТАВА ЗАКОН: каждое химическое соединение, независимо от способа его получения, состоит из одних и тех же элементов, причем отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллических… … Энциклопедический словарь
ПОСТОЯНСТВА СОСТАВА ЗАКОН — в каждом определенном хим. соед., независимо от способа его получения, соотношения масс составляющих элементов постоянны. Сформулирован в нач. 19 в. Ж. Прустом: Соединение есть привилегированный продукт, которому природа дала постоянный состав.… … Химическая энциклопедия
Постоянства состава закон — один из основных законов химии: каждое определённое химическое соединение, независимо от способа его получения, состоит из одних и тех же элементов, причём отношения их масс постоянны, а относительные количества их атомов выражаются… … Большая советская энциклопедия
ПОСТОЯНСТВА СОСТАВА ЗАКОН — один из осн. законов химии, заключающийся в том, что каждое хим. соединение, независимо от способа его получения, состоит из одних и тех же хим. элементов, соединённых друг с другом в одних и тех же отношениях (по массе). П. с. з. был установлен… … Большой энциклопедический политехнический словарь
постоянства состава закон{:} — каждое химическое соединение, независимо от способа его получения, состоит из одних и тех же элементов, причём отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллических соединений может быть и… … Энциклопедический словарь
ПОСТОЯНСТВА СОСТАВА 3AKОH — каждое хим. соединение, независимо от способа его получения, состоит из одних и тех же элементов, причём отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллич. соед. может быть и неременным (см.… … Естествознание. Энциклопедический словарь
dic.academic.ru
Закон постоянства состава вещества ℹ️ формула и формулировка, основа, какой ученый открыл, практическое значение, примеры задач
Учебник по химии за 8 класс содержит в себе тему, посвящённую неизменяемости веществ по своему составу, где чётко сформулирован закон постоянства состава вещества, дано его краткое описание.В рамках данной темы рассматриваются примеры соединений изменяемого и неизменяемого состава, а также даются определения веществ, отвечающих различным требованиям.
Формулировка закона постоянства состава вещества
Закон полностью вписывается в учение о молекулах и атомах, объясняющее константность массового состава веществ постоянством массы атомов, в них входящих.
Данный закон можно считать одним из основополагающих в химии. Его первоначальная формулировка такова:

Смысл данного утверждения в том, что одни и те же соединения всегда будут иметь одинаковый состав и характеристики, несмотря на возможные внешние различия.
Так, окись железа из одной точки земного шара ничем не отличается от окиси железа из любого другого места; существует только одно хлористое серебро, одна селитра.

Развитие науки и проведение многочисленных исследований позволили установить, что помимо неизменяемых соединений существуют вещества переменного состава. В связи с этим определение закона претерпело изменения.
В настоящее время его формулировка звучит следующим образом:


Кто открыл закон
Авторство в отношении упомянутого закона принадлежит Жозефу Луи Прусту. Этот французский учёный, открывший закон в период с 1797 по 1809 гг., происходил из семьи аптекарей, увлекался исследованиями в области фармацевтики и химии.

Его опыты и разработки были интересны многим европейским университетам того времени, а с 1785 г. финансировались королём Испании. Пруст в результате своей деятельности значительно расширил имеющиеся сведения о ряде металлов и их солях.
Сам закон был выведен в результате многолетнего научного спора между Ж. Л. Прустом и его соотечественником К. Л. Бертолле, завершившегося в 1808 г. В ходе исследований свойств различных металлов учёный установил и смог доказать, что многие его современники допускали неточности при определении состава оксидов металлов, относя к этой группе гидроксиды.
Пруст сумел продемонстрировать, что различные оксиды одного и того же металла обладают определённым составом.
Однако, данный закон не носит всеобщий характер, в отличие от закона сохранения массы вещества, а справедлив исключительно для веществ с молекулярным строением. Вещества, имеющие немолекулярное строение, могут различаться по составу в зависимости от того, каким путём они получены.
Данный факт был установлен много позже русским физикохимиком Николаем Семёновичем Курнаковым, подтвердившим существование соединений переменного состава в ходе собственных исследований.
Дальнейшие эксперименты показали, что изменяемым химсоставом могут обладать оксиды и различные неорганические вещества с кристаллической структурой, в том числе соединения металлов с серой, углеродом, азотом.

Была создана классификация веществ, состав которых изменяем («бертоллидов») и соединений с постоянным химсоставом («дальтонидов»).
Количество веществ в изменяемых соединениях может колебаться в определённых установленных границах. Так, в диоксиде титана на единицу массы титана может приходиться от 0,65 до 0,67 единиц массы кислорода.
|
Дальтониды Примеры соединений |
Бертоллиды Примеры соединений |
||||
|
H2O |
H Cl |
C Cl4 |
CO2 |
Ti O1,9 – 2,0 |
V O0,9 –1,3 |
Открытие вышеупомянутого закона имело огромное значение для развития науки. Его следствием можно считать выдвижение постулата о существовании молекул и подтверждение неделимости атомов.
Практическое значение закона
Основываясь на законе постоянства состава, можно осуществлять различные расчёты, решать задачи, связанные с химическими реакциями.
Зная данный закон и имея информацию о химических элементах, вступивших в реакцию, можно с уверенностью сказать, какими будут химические соединения, являющиеся продуктами реакции.
По сути, масса веществ, вступивших в реакцию, определяет массу продуктов реакции в закрытых условиях и будет полностью ей соответствовать. Таким образом, вычисляется практический выход любых химических процессов.
nauka.club
Химическая формула. Валентность. Закон постоянства состава вещества.
Тема урока: Химическая формула. Валентность. Закон постоянства состава вещества. Тематическое и поурочное планирование по биологии. 7 класс
Цель урока: сформировать у учащихся знания о валентности, сотавлении химических формул по валентности, познакомить с законом постоянства сотава вещества
Задачи урока:
-дать понятие о валентности химических элементов, научить учащихся определять валентность элементов в формуле вещества и сотавлять формулы веществ по валентности, познакомить с законом постоянства вещества
-формировать интерес к изучению химии, понимание важности закона постоянства состава вещества как для химии, так и для других наук
-развивать мышление, умение составлять химические формулы, определять валентность химических элементов
Вид урока: комбинированный
Методы урока: словесные, частично-поисковые, наглядные
Ход урока:
I.Организационный момент
II. Актуализация опорных знаний
Химический диктант: записать формулу химического элемента, его относительную атомную массу:
Натрий, барий, углерод, азот, хлор, бор, кальций, калий, литий, фтор
— Что означают записи (по карточкам): 2СО2; 3Н2О; Н2; 4Н; 5Fe ?
— Какую информацию несёт химическая формула:
а) состав: качественный и количественный;
б) вещество: простое или сложное
в) соотношение атомов и т.д.?
III. Новая тема
Валентность – это способность атомов присоединять к себе определенное число других атомов.
С одним атомом одновалентного элемента соединяется один атом другого одновалентного элемента (HF, NaCl). С атомом двухвалентного элемента соединяются два атома одновалентного (H2O) или один атом двухвалентного (CaO). Значит, валентность элемента можно представить как число, которое показывает, со сколькими атомами одновалентного элемента может соединяться атом данного элемента.
Правила определения валентности
элементов в соединениях
Валентность водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н2О к одному атому кислорода присоединено два атома водорода.
Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО2 (углекислый газ) имеет валентность IV.
Учитель. Как определить валентность элемента, исходя из таблицы Д.И.Менделеева?
У металлов, находящихся в группах а, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая (схема).
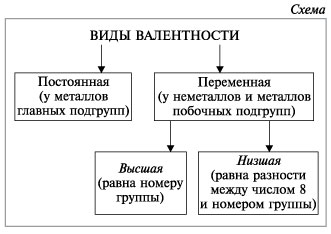
Высшая валентность равна номеру группы.
Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
Валентность может быть постоянной (у элементов главных подгрупп таблицы Д.И.Менделеева) или переменной (у элементов побочных подгрупп в таблице), но с этим явлением вы познакомитесь чуть позже, а если интересуетесь, то почитайте учебник 9-го класса.
Валентность элементов необходимо знать, чтобы составлять химические формулы соединений. Для этого удобно воспользоваться следующей таблицей.
Таблица
Алгоритм составления формулы соединения Р и О
P : О = 2 : 5
5. Записать индексы при символах элементов
Р2 О5
6. Формула соединения (оксида)
Р2О5
— Запомните еще два правила для составления химических формул соединений неметаллов между собой.
1) Низшую валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже.(Демонстрация таблицы Д.И.Менделеева.)
Например, в соединении с кислородом сера проявляет высшую валентность VI, а кислород – низшую II. Таким образом, формула оксида серы будет SO3.
В соединении кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую IV. Значит, формула – SiC. Это карбид кремния, основа огнеупорных и абразивных материалов.
2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид».
Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца.
Теперь вы сами можете написать формулы любых соединений металлов с неметаллами.
Закон постоянства состава веществ был открыт французским ученым Прустом в 1808 г. Вот как этот закон звучал в его изложении: «От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь».
Современная формулировка закона: каждое химически чистое вещество с молекулярным строением независимо от места нахождения и способа получения имеет один и тот же постоянный качественный и количественный состав.
IV. Закрепление:
Самостоятельная работа
Задание 1. Проверьте, правильно ли написаны формулы следующих соединений: Na2S, KBr, Al2O3, Mg3N2, MgO.
Задание 2. Напишите формулы соединений металлов с неметаллами: кальция с кислородом, алюминия с хлором, натрия с фосфором. Назовите эти соединения.
После выполнения работы ученики обмениваются тетрадями, происходит взаимопроверка. Учитель может выборочно проверить некоторые тетради, похвалить тех учащихся, которые справились быстрее всех и сделали меньше всего ошибок.
Беседа с учащимися по вопросам
1) Что такое валентность?
2) Почему валентность иногда называют атомностью элемента?
3) Чему равны валентности водорода и кислорода?
4) Какие два значения валентности могут проявлять неметаллы?
5) Как определить низшую и высшую валентности неметаллов?
6) Как найти наименьшее общее кратное между численными значениями валентностей?
7) Могут ли атомы в соединении иметь свободные валентности?
8) Какой из двух неметаллов в химической формуле их соединения занимает 1-е место, а какой – 2-е? Поясните на примере оксида NO2, используя таблицу Д.И.Менделеева.
Творческая работа в группах
Задание. Используя наборы для составления моделей молекул различных веществ, составьте формулы и модели молекул для следующих соединений:
1-я группа – меди и кислорода,
2-я группа – цинка и хлора,
3-я группа – калия и йода,
4-я группа – магния и серы.
После окончания работы один учащийся из группы отчитывается о выполненном задании и вместе с классом приводит анализ ошибок.
V. Домашнее задание: Тематическое и поурочное планирование по биологии. 7 класс
повторить §12-14, стр.33 №7, 10, стр.34 № 5
infourok.ru