Кристаллы
Валерия Сирота
«Квантик» №1, 2019
Нужно признаться, что в 10-м номере «Квантика» за 2018 год я вас немножко обманула. Не всех, а только тех, кто слепил из пластилина молекулы поваренной соли (NaCl) и оксида железа (Fe2O3). Дело в том, что таких молекул нет. Соль не состоит из молекул!
Если «посмотреть» на неё в очень сильный электронный микроскоп (в обычный оптический такие мелкие детали не разглядеть), окажется, что вместо того, чтобы попарно разделиться на молекулы — каждому атому натрия свой атом хлора, — все атомы построены, как солдаты на плацу! Да ещё и не на плоскости, а в пространстве. На одинаковых расстояниях друг от друга чередуются Na — Cl — Na — Cl —… Если этот строй и слепился из молекул, уже не различить, где какая, и не понять, с каким атомом хлора мог быть сцеплен этот атом натрия: все соседние атомы Cl находятся от него на равных расстояниях.
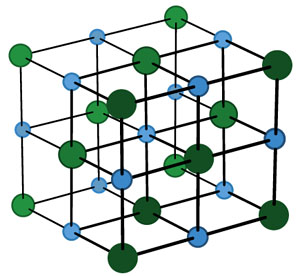
Это — ионный кристалл (рис. 1). Помните, что такое ионная связь? Атом хлора «отбирает» у атома натрия электрон, и оба атома становятся ионами — «дефектными» атомами с числом электронов, не равным числу протонов, и оттого заряженными: натрий положительным, а хлор отрицательным. Теперь они притягивают друг друга. Но если рядом много других таких же ионов, то ведь все отрицательные притягиваются ко всем положительным! Правда, от всех других отрицательных при этом отталкиваются. Получается, что им удобно расположиться в таком вот шахматном порядке. И хотя каждый отдельный хлор отобрал электрон у какого-то одного натрия, притягивается он ко всем своим соседям-натриям. Так что число связей-«ручек» оказывается намного больше.
Это соединение получается очень твёрдым и прочным. В магазинах в основном продают мелко помолотую соль, а если взять соль крупного помола или вообще «каменную» — необработанную, то раздробить её можно разве что молотком.
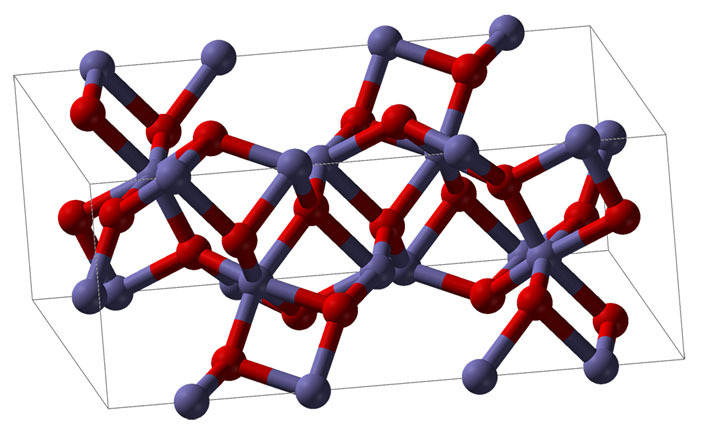
Оксид железа — тоже кристаллическое вещество, но ионы железа и кислорода выстраиваются иначе — кристаллическая решётка другая (рис. 2).
Кристаллы возникают не только у веществ с ионной связью между атомами. Они могут составляться и из таких атомов, которые делятся электронами друг с другом, а не отдают «насовсем» — это называется ковалентной связью. Так, углерод может образовывать даже несколько разных видов кристаллов, «под настроение» — смотря какие условия вокруг. И в зависимости от того, как построились атомы — одни и те же атомы углерода! — получаются совсем разные вещества. (А если атомы никак не построились, а «валяются» как попало — получается сажа.)
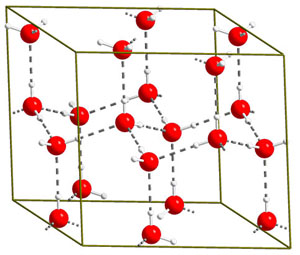
А бывает, что в кристаллы строятся не отдельные атомы, а целые молекулы. Например, лёд: это тоже кристаллическое вещество, но решётку образуют молекулы воды (рис. 4). В каждой молекуле воды кислород хоть и «делится» своими электронами с атомами водорода, но при этом «оттягивает» все общие электроны от ядер водорода — поближе к себе. Так что каждый электрон вроде бы вертится вокруг обоих ядер, но вокруг кислорода — больше. Получается, что кислород немножко заряжен отрицательно, а водород — положительно. И вот в результате кислородный «конец» одной молекулы притягивается к водородному «концу» другой. Это притяжение и удерживает их в решётке.
Но совсем особый вид связи, который бывает только в кристалле, придумали себе металлы. Это такие атомы, у которых по одному-два электрона на внешнем уровне-этаже, и им их отдать вовсе не жалко. Такие атомы «делятся» своими электронами не просто с ближайшим соседом, а со всеми остальными атомами кристалла! То есть все эти «лишние» электроны становятся общими и летают по всему кристаллу. А ионы — ядра с оставшимися электронами — стоят «в строю» и образуют кристаллическую решётку.
Большая свобода электронов обеспечивает одно из главных свойств металлов — способность проводить электрический ток. Ток — это упорядоченное (дружное, в одну сторону) движение заряженных частиц. Если присоединить кусок металла к батарейке, ионы решётки стоят неподвижно, а электроны бегут (точнее, дрейфуют — бегая туда-сюда, постепенно сдвигаются) все в одну сторону, к «плюсу» батарейки. Это не значит, что их в металле становится меньше: ведь ток течёт, только когда металлический провод подсоединён к батарейке. И вместо электронов, «убегающих» в батарейку на одном конце провода, из батарейки приходят новые электроны на другой конец. Провод при этом всегда остаётся незаряженным. Но если батарейку присоединить к куску пластмассы, резины или даже к сухой деревяшке — ток не потечёт: нет свободных электронов, все привязаны к своим молекулам, некому бежать.
Ещё металлы хорошо проводят тепло: попробуешь нагреть один конец — нагревается весь кусок металла. Это тоже из-за свободных электронов: летая между холодным и горячим концами, они переносят тепло и уравнивают температуру.
Кристаллическое или аморфное?
Вообще-то все «по-настоящему твёрдые» вещества, хорошо сохраняющие свою форму, — кристаллические. Хотя вот пластилин или глина например, когда засохнут, — вполне твёрдые, а вовсе не имеют кристаллической структуры. Такие вещества называются аморфными (не имеющими формы): молекулы (или атомы) в них не построены в строгом порядке, а «набросаны» более-менее как попало. Часто бывает, что одни и те же молекулы могут образовывать и кристаллическое вещество, и аморфное (вспомните алмаз, графит, уголь и сажу). Чтобы атомы успели «построиться» в кристалл, расплавленное вещество должно остывать достаточно медленно. Если остужать его быстрее — получится аморфное тело.
У кристаллических веществ есть определённая температура плавления, у каждого своя; если нагреть их до этой температуры, они резко меняют свои свойства и плавятся, превращаются в жидкость: кристалл разваливается на отдельные молекулы. У аморфных тел никакой определённой температуры плавления нет — при нагревании они плавно становятся всё более текучими. Молекулы (или атомы) в них и так уже расположены как в жидкости.
Элементарная ячейка и виды решёток
Мы говорили в № 10 «Квантика» за 2018 год, что молекула — «минимальный кусочек» вещества, который ещё определяет его химические свойства: взяв много таких кусочков, получим сколько угодно этого вещества. У кристаллического вещества «минимальное количество», которое его всё ещё полностью определяет, — не молекула, а элементарная ячейка. Это самый маленький кусочек решётки, из копий которого можно составить всю решётку.
Например, кристаллическая решётка поваренной соли получается многократным повторением такого кусочка: Na — Cl. Это и есть элементарная ячейка соли, в ней два атома. А в элементарной ячейке полония — всего один атом (рис. 5). Такая кристаллическая решётка называется простой кубической: весь кристалл можно составить из одинаковых кубиков, в каждом — один атом (на рисунке один из этих кубиков выделен синим). Это и есть элементарная ячейка.
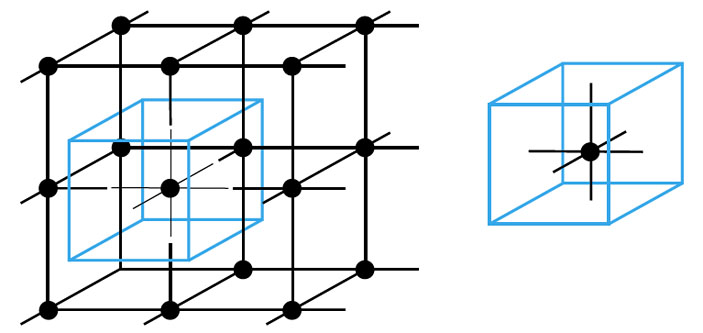
Обратите внимание! Чёрные линии, которыми на этом и следующих рисунках изображены связи между ионами, тоже образуют кубики. Но «разрезать» (даже мысленно) кристалл на ячейки удобнее не по ним — а то атомы попадут на границы разрезов, и мы легко запутаемся, разбираясь, «считается» ли этот атом внутри того или этого кубика. Лучше просто сдвинуть нашу воображаемую (синюю) сетку из элементарных ячеек.
Следующий по сложности тип решётки — такой, в котором атомы расположены не только по вершинам кубиков, нарисованных чёрными палочками-связями, но и в центре каждого кубика (рис. 6, слева). Так устроены, например, кристаллы железа. А другие атомы — например, меди и золота — предпочитают строиться в гранецентрированные решётки, у которых атомы стоят в вершинах кубов и в центрах их граней (рис. 6, справа).
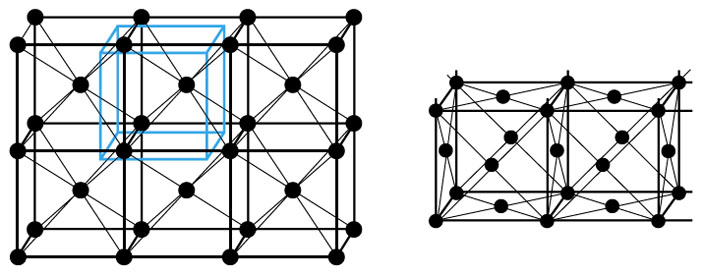
Как мы видели на примере углерода, бывают и некубические решётки: у графита, например, элементарная ячейка имеет форму шестиугольной призмы.
Художник Мария Усеинова
Или побольше, но у атомов с очень большим количеством электронов, так что на верхних этажах «электронного дома» до ядра уже очень далеко и внешние электроны держатся совсем непрочно. Из-за этого в нижних строках таблицы Менделеева почти все элементы — металлы.
Можете проверить это, нагревая один конец вилки или ложки над плитой или опуская их в горячую воду. Только не обожгитесь.
Имеются в виду «чистые» вещества, из одинаковых молекул. Смеси разных веществ (как воздух или дерево) мы сейчас не обсуждаем.
Самые маленькие — потому что две соседние элементарные ячейки, например, тоже можно копировать, и получится то же самое. Интересно найти самый маленький из всех возможных «кирпичиков». Но всё-таки такой, который «сохраняет симметрии решётки»: если вся решётка симметрична, например переходит сама в себя при повороте на 90°, то и элементарная ячейка должна быть так же симметрична. В частности, если решётка состоит из кубов, то и элементарная ячейка должна иметь форму куба.
elementy.ruМасса молекулы поваренной соли. Физические свойства поваренной соли
Государственное образовательное учреждение
Высшего профессионального образования
«Пермская государственная фармацевтическая академия
Федерального агентства по здравоохранению и социальному развитию
Российской Федерации»
кафедра аналитической химии
Курсовая работа:
Хлорид натрия.
Выполнил:
студент 21 группы
Сенников Антон
Проверил:
Колотова
Нина Васильевна
Пермь, 2010
Аналитические реакции катиона натрия 5
Аналитические реакции хлорид-иона 5
Аргентометрия 6
Комплексонометрия 6
Общие сведения 3
Получение 4
Качественный анализ 5
Количественный анализ 6
Применение 7
Список использованной литературы 8
Общие сведения.
Хлори ́ д на ́ трия — химическое соединение NaCl , натриевая соль соляной кислоты , хлористый натрий.
Хлорид натрия известен в быту под названием поваренной соли , основным компонентом которой он является. Хлорид натрия в значительном количестве содержится в морской воде, создавая её солёный вкус. Встречается в природе в виде минерала галита (каменная соль).
Чистый хлорид натрия имеет вид бесцветных кристаллов. Но с различными примесями его цвет может принимать: голубой, фиолетовый, розовый, жёлтый или серый оттенок.
Хлорид натрия образует кристаллы с кубической симметрией. Более крупные ионы хлора образуют плотную кубическую упаковку, в свободных узлах которой (в вершинах правильного октаэдра ) расположены ионы натрия.
Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в г на 100 г воды) равен 35,9 при 21° С и 38,1 при 80° С. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей — хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена.
Систематическое наименование: хлорид натрия / Sodium chloride
Химическая формула: NaCl
Молярная масса : 58.44277 г/моль
Физические свойства:
Плотность : 2.165 г/см 3
Термические свойства:
Температура плавления 800,8 °C
Температура кипения 1465 °C
Химические свойства:
Растворимость в воде 35.9 г/100 мл
Получение.
Первым способом получения натрия стала реакция восстановления карбоната натрия углем при нагревании тесной смеси этих веществ в железной ёмкости до 1000°C:
Na 2 CO 3 +2C=2Na+3CO
Затем появился другой способ получения натрия — электролиз расплава едкого натра или хлорида натрия .
3.1. Аналитические реакции на катион натрия.
Качественный анализ.
1) С ацетатом диоксоуран (VI) цинка с образованием жёлтого кристаллического осадка или жёлтых кристаллов татра- и октаэдрической формы:
NaCl + Zn(UO 2) 3 (CH 3 COO) 8 + CH 3 COOH + 9H 2 O ↔
↔ NaZn(UO 2) 3 (CH 3 COO) 9 x 9H 2 O↓ + HCl
2) Окрашивание бесцветного пламени горелки в жёлтый цвет;
3) Реакция с гексагидроксостибатом (V) калия с образованием белого кристаллического осадка, растворимого в щелочах:
NaCl + K ↔ Na↓ + KCl
В кислой среде реагент разрушается с образованием белого аморфного осадка метасурьмяной кислоты HSbO 3:
K +HCl ↔ KCl + H 3 SbO 4 + 2H 2 O
H 3 SbO 4 ↔ HSbO 3 ↓ + H 2 O
3.2. Аналитические реакции на хлорид-ион.
С групповым реагентом – раствором AgNO 3:
Методика: К 2 каплям раствора, содержащего хлорид-ионы, прибавляют 1 каплю разбавленной HNO 3 и 3 капли раствора AgNO 3 . Наблюдаемый белый творожистый осадок растворим в NH 4 OH и насыщенном растворе (NH 4) 2 CO 3 .
Раствор Cl делят на 2 части: к одной добавляют концентрированную HNO 3 до кислой реакции среды, к другой – концентрированный раствор KJ. Наблюдают выпадение осадков или помутнение раствора:
Cl + 2HNO 3 ↔ AgCl↓ + 2 NH 4 NO 3
Cl + KJ + 2H 2 O ↔ AgJ↓ + KCl + 2NH 4 OH
Количественный анализ.
4.1. Аргентометрия.
Стандартизация 0,05 М раствора нитрата серебра по стандартному раствору хлорида натрия (способ пипетирования).
NaCl + AgNO 3 → AgCl↓ + NaNO 3
в конечной точке титрования: K 2 CrO 4 + 2AgNO 3 → Ag 2 CrO 4 ↓ + 2KNO 3
М(NaCl) = 58,44 г/моль
М(AgNO 3) = 169,87 г/моль
Методика: Аликвотную часть приготовленного стандартного раствора хлорида натрия помещают в колбу для титрования, разбавляют дистиллированной водой вдвое, прибавляют две капли раствора хромата калия и титруют раствором нитрата серебра до оранжево-жёлтого окрашивания осадка.
4.2. Комплексонометрия.
Стандартизация 0,01 М раствора перхлората ртути по стандартному раствору хлорида натрия (способ пипетирования)
2NaCl + Hg(ClO 4) 2 ↔ HgCl 2 + 2 NaClO 4
M (NaCl) = 58,44 г/моль
Методика: Точный объём стандартного раствора хлорида натрия помещают в колбу для титрования, прибавляют 4 капли разведённой азотной кислоты (1:4), 4 капли 4 капли спиртового насыщенного раствора дифенилкарбазона и титруют 0,01 М
arenastem.ru
Молекулы соли: flavorchemist — LiveJournal
Бактерии являются причиной ожирения.
Показалось интересно, но не было отсылки на оригинальный источник, лишь ссылка на кулинарный портал. На котором нам предлагают узнать «Всю правду о соли»
Мелкая соль класса «Экстра» – это продукт термической и химической обработки. Такая соль не только теряет свою первоначальную структуру и все полезные свойства, но и обладает канцерогенными свойствами и является причиной повышения артериального давления. Перед тем, как попасть на наш стол, соль высушивается в огромных печах при температуре свыше 650°С! При такой сумасшедшей температуре молекулы соли просто лопаются и меняют свою структуру (КАК???). Затем в соль добавляют химические испарители влаги, чтобы соль была сухой и не слипалась в неаппетитный комок. Вместо природных солей йода, которые удаляются в процессе обработки, в соль добавляется йодид калия, который может быть токсичным, если его «переесть»
(спасибо clavinessa за картинку)
В итоге соль становится чужеродной нашему телу.
Согласно теории кислотно-щелочного баланса, почти все хронические болезни – это результат закисления крови, лимфы и всех тканей нашего организма. А настоящая морская соль является одним из щелочных элементов, необходимых нашему организму.
Морская соль содержит почти всю таблицу Менделеева, кроме газов (а как же хлор?), а это 84 элемента, и около 200 химических соединений! Состав кристалла морской соли настолько сложен, что человек до сих пор не сумел его создать искусственно.
Ну там еще много чего интересного. Может быть об этом говорил Баранов?
Дорогая Лариса Шуфтайкина, автор сего опуса. Продолжайте писать про рецепты, но не более того. Прежде чем писать про «лопающиеся молекулы», повторите школьную программу по химии.
Пошел дальше искать про бактерии и ожирение.
flavorchemist.livejournal.com
Урок 9. Ионы в водном растворе – HIMI4KA
В уроке 9 «Ионы в водном растворе» из курса «Химия для чайников» рассмотрим растворение соли в воде, а также электролиз растворов и расплавов солей; познакомимся с законами Фарадея для электролиза и научимся находить продукты электролиза. Базой знаний для данного урока послужит материал из урока 8 «строение солей».


Растворение соли в воде
Из прошлого урока нам известно, что соли трудно расплавить и еще сложнее довести ее до кипения, однако, полярные жидкости, такие как вода, способны растворять соли без особых усилий, поскольку неполные положительные и отрицательные заряды на атомах полярных молекул воды в какой-то мере заменяют собой положительные и отрицательные ионы в кристаллической решетке соли. Другими словами, молекулы воды помогают разрушить кристалл соли.


Из рисунка видно, что происходит с положительными и отрицательными ионами при растворении в воде кристалла поваренной соли NaCl. Каждый ион Na+ окружается молекулами воды, которые обращены к нему отрицательно заряженными атомами кислорода. То же самое происходит с ионами Cl—, которые окружаются молекулами воды, обращенными к нему своими положительно заряженными атомами водорода. Ионы из кристалла соли оказываются гидратированными, а сам процесс присоединения молекул воды к ионам получил название — гидратация. Если в результате процесса гидратации устойчивость ионов, переходящих в раствор, становится больше их устойчивости в кристаллической решетке, то происходит растворение соли в воде. Хлорид натрия является отличным примером растворимой соли. И, наоборот, если энергия гидратации слишком мала, то кристалл является более устойчивой формой и не растворяется в воде. Примером таких нерастворимых солей является сульфат бария (BaSO4) и хлорид серебра (AgCl). Когда кристалл растворяется, он не просто распадается на ионы, а разъединяется на ионы молекулами жидкости, в которой происходит растворение. Неполярные жидкости (например, бензин С8H18) НЕ способны разъединять ионы в кристаллической решетке солей.
Электролиз растворов и расплавов солей
Металлы хорошо проводят ток — это знает каждый школьник. Электропроводность в металлах вызвана перемещением электронов в них, но ионы металла остаются неподвижными. Хотя кристаллы солей не проводят ток, зато растворы и расплавы солей это умеют и практикуют, так как анионы (отрицательные ионы) и катионы (положительные ионы) могут направленно перемещаться в противоположные направления, если приложить напряжение. Подвижность ионов соли оказывается еще большей, если она подверглась процессу гидратации.
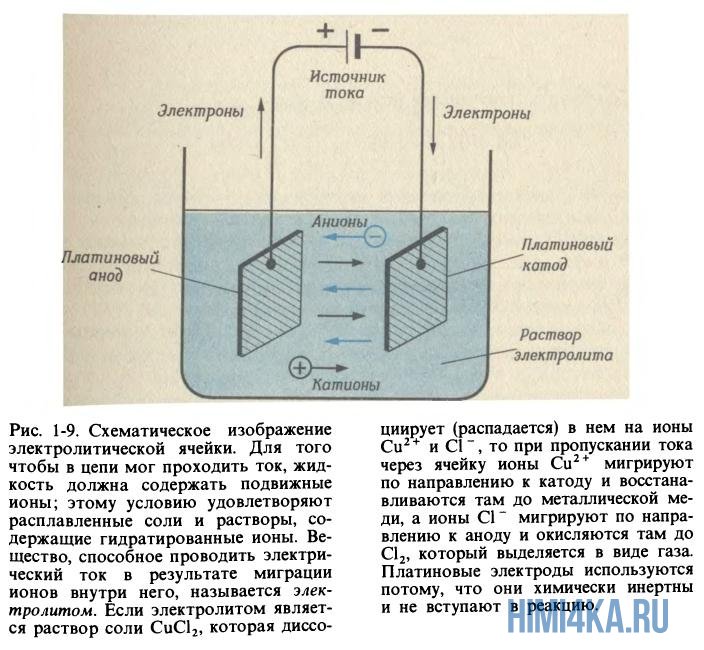

Давным-давно английский ученый Майкл Фарадей расплавил соль (нагрев ее выше 801ºС), затем погрузил в расплав два электрода (катод и анод), а после взял и пропустил электрический ток через расплавленную соль. После этих манипуляций он обратил внимание что на электродах начали протекать химические реакции: ионы натрия начали мигрировать к катоду (где электроны поступают в расплав) и восстанавливаться там до металлического натрия
- Na+ + e— (с катода) → Na
Хлорид-ионы мигрируют в другом направлении-в сторону анода, отдают ему свои избыточные электроны и окисляются до газообразного хлора
Все это можно изобразить с помощью полной реакции, которая представляет собой разделение NaCl на составляющие его элементы:
- Na+ + Cl— → Na + ½Cl2
Весь процесс получил название электролиз, что означает «разрыв на части при помощи электричества». Для электролиза не обязательно расплавлять соль, можно также использовать обычный водный раствор соли, ведь подвижность ионов оказывается еще большей, если соль подверглась процессу гидратации. Но тогда полная реакция будет выглядеть иначе, и на катоде будет выделяться не металлический натрий, а газообразный водород:
- Na+ + Cl— + H2O → Na+ + ½Cl2 + ½H2 + OH—
Надеюсь, что вам стало интересно, почему продуктом электролиза водного раствора является не Na (как это было в расплавленной соли), а ½H2. Объясняется просто: часть молекул H2O диссоциируют на ионы H+ и OH—. Поскольку ион H+ обладает большим сродством к электрону (то есть сильнее его притягивает), нежели ион Na+, то ионы H+ первыми достигают катода, где незамедлительно восстанавливают недостающий электрон и превращаются из иона в полноценный газ H2, а ионы Na+ так и остаются в растворе.
Вот вам плюшка с продуктами электролиза водного раствора солей, может пригодится — может нет, но лучше законспектируйте:


А Фарадей тем временем не сидел без дела, а наблюдал, проводил опыты, использовал другие электролиты, увеличивал-уменьшал заряд и опять наблюдал. В конце концов он заметил взаимосвязь между количеством подаваемого электричества и количеством получаемых веществ. Установленные им закономерности называются законы Фарадея для электролиза. Сформулируем их:
- Пропускание одного и того же электрического заряда через электролитическую ячейку всегда приводит к количественно одинаковому химическому превращению в данной реакции. Масса элемента, выделяемого на электроде, пропорциональна количеству заряда, пропущенному через электролитическую ячейку.
- Для выделения на электроде 1 моля вещества, которое в процессе электрохимической реакции приобретает или теряет 1 электрон, необходимо пропустить через ячейку 96485 кулонов (Кл) электричества. Если в реакции принимает участие N электронов, для выделения моля продукта необходимо N·96485 Кл электричества.
Количество электричества, равное 96485 Кл, получило название 1 фарадей и обозначается символом F. Законы Фарадея становятся очевидными, если принять во внимание, что 1 F — это просто заряд 1 моля электронов, т.е. 6,022 1023 электронов. Множитель 6,022-1023, позволяющий переходить от индивидуальных молекул к молям вещества, одновременно позволяет перейти и от 1 электронного заряда к 1 F электрического заряда. Разумеется, в свое время Фарадей ничего не знал ни о числе Авогадро, ни о заряде электрона. Однако из проведенных экспериментов он смог сделать вывод, что заряды на ионах кратны некоторой элементарной единице заряда, так что 96485 Кл электричества соответствуют 1 молю таких единиц. Термин электрон впервые появился в 1881 г.; его ввел английский физик Дж.Стоней для обозначения элементарной единицы ионного заряда. Применять термин «электрон» к реальной отрицательно заряженной частице начали спустя еще 10 лет.
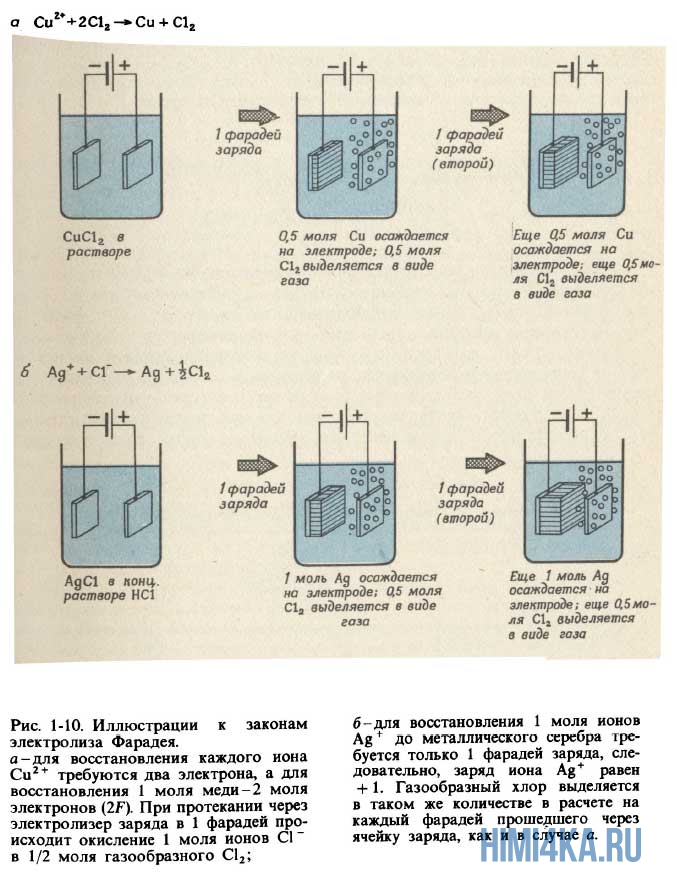

1 пример. Запишите уравнения реакций, протекающих при пропускании электрического тока через расплавленную соль NaCl. Сколько граммов натрия и хлора выделится при пропускании 1 F электричества через электролитическую ячейку?
Решение: Уравнение реакции, протекающей на катоде: Na+ + е— → Na, а уравнение 1 анодной реакции: Сl— → Cl2 + е—. Когда через расплавленную соль NaCl проходит 1 моль электронов (1 F), каждый электрон восстанавливает 1 ион натрия, в результате чего образуется 1 моль атомов натрия. Следовательно, на катоде выделяется 22,990 г Na. На аноде происходит удаление 1 моля электронов от 1 моля хлорид-ионов, после чего остается 1 моль атомов хлора, которые попарно соединяются, образуя 1/2 моля молекул Сl2. Следовательно, масса газообразного хлора, выделяющегося на аноде, должна быть равна 35,453 г (что равно атомной массе Сl, или половине молекулярной массы Сl).
Пример 2. Сколько граммов металлического магния и газообразного хлора выделяется при пропускании 1 F электричества через электролитическую ячейку с расплавленным хлоридом магния, MgCl2?
Решение: На катоде происходит реакция Mg2+ + 2е— → Mg, а на аноде — реакция 2Сl— → Сl2 + 2е—. Поскольку для восстановления каждого иона Mg2+ необходимо 2 электрона, 1 моля электронов хватит только для восстановления половины моля ионов магния, таким образом на катоде должно выделиться 12,153 г магния. (Атомная масса магния равна 24,305 г/моль.) Как и в примере 1, на аноде окислится 1 моль ионов Сl— и выделится половина моля, т.е. 35,453 г, газообразного Сl2.
Пример 3. Основным промышленным способом получения металлического алюминия является электролиз расплавленных солей, содержащих ионы Аl3 +. Определите величину электрического заряда, в фарадеях и кулонах, который должен быть пропущен через расплав для получения 1 кг металла.
Решение: 1 кг алюминия содержит 1000 г / 26,98 г·моль-1 = 37,06 моля атомов. Поскольку на выделение каждого атома алюминия необходимо 3 электрона, на 37,06 моля атомов потребуется 3·37,06 = 111,2 моля электронов. Это количество электричества эквивалентно 111,2F, или 10 730 000 Кл.


Надеюсь урок 9 «Ионы в водном растворе» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к уроку 10 «Ионы в газе».
himi4ka.ru