Структура, свойства, виды использования и риски хлорида хрома (CrCl3) / химия | Thpanorama
Хлорид хрома (CrCl3) неорганическая соль, состоящая из катионов Cr3+ и Cl-анионы— в соотношении 1: 3; то есть для каждого Cr3+ Есть три Cl—. Как будет видно позже, их взаимодействия не являются ионными. Эта соль может быть представлена в двух формах: безводная и гексагидратированная.
Безводная форма характеризуется красновато-фиолетовой окраской; в то время как гексагидрат, CrCl3.6H2Или темно-зеленый. Включение молекул воды изменяет физические свойства указанных кристаллов; как его точки кипения и плавления, плотность и т. д..
Хлорид хрома (III) (согласно номенклатуре сырья) разлагается при высоких температурах, превращаясь в хлорид хрома (II), CrCl2. Он вызывает коррозию металлов, хотя и используется при хромировании: процесс, в котором металлы покрываются тонким слоем хрома..
Кр3+, от его соответствующего хлорида, использовался для лечения диабета, особенно у пациентов с полным парентеральным питанием (TPN), которые не принимают необходимое количество хрома. Однако результаты намного лучше (и более надежны), если поставляются в виде пиколината..
индекс
- 1 структура хлорида хрома
- 1.1 Кристаллические слои безводного
- 2 свойства
- 2.1 Имена
- 2.2 Химическая формула
- 2.3 Молекулярный вес
- 2.4 Физическое описание
- 2.5 Точка плавления
- 2.6 Точка кипения
- 2.7 Растворимость в воде
- 2.8 Растворимость в органических растворителях
- 2.9 Плотность
- 2.10 Температура хранения
- 2.11 Разложение
- 2.12 Коррозия
- 2.13 Реакции
- 2,14 рН
- 3 Резюме
- 4 использования
- 4.1 Промышленный
- 4.2 Терапия
- 5 рисков
- 6 Ссылки
Структура хлорида хрома
CrCl3 несмотря на то, что они являются солью, природа их взаимодействий не является чисто ионной; имеют определенный ковалентный характер, продукт координации между Cr3+ и Cl—, которые дают деформированный октаэдр (верхнее изображение). Хром находится в центре октаэдра, а хлор в его вершинах.
CrCl октаэдр6 может, на первый взгляд, противоречить формуле CrCl3; однако этот полный октаэдр определяет не элементарную ячейку кристалла, а куб (также деформированный), который разрезает зеленые сферы или анионы хлора пополам.
Кристаллические безводные слои
Таким образом, унитарная ячейка с этим октаэдром все еще поддерживает соотношение 1: 3. Воспроизводя указанные деформированные кубы в пространстве, получается кристалл CrCl3, который представлен на верхнем изображении с трехмерной моделью заполнения и моделью сфер и стержней.
Этот кристаллический слой является одним из многих, которые составляют фиолетово-красноватые и чешуйчатые кристаллы CrCl3 (не путайте цвет кристалла, правда, с цветом зеленых сфер).
Как видно, анионы Cl— Они занимают поверхность, поэтому их отрицательные заряды отталкивают другие кристаллические слои. Следовательно, кристаллы становятся чешуйчатыми и хрупкими; но яркий, из-за хрома.
Если эти же слои визуализируются с боковой точки зрения, вместо октаэдров будут наблюдаться искаженные тетраэдры:
Здесь понимание того, почему слои отталкиваются друг от друга при присоединении анионов Cl, становится еще проще.— его поверхностей.
свойства
имена
-Хлорид хрома (III)
-Трихлорид хрома (III)
-Хлорид хрома (III) безводный.
Химическая формула
-Циклический3 (Безводный).
-Циклический3.6H2О (гексагидрат).
Молекулярный вес
-158,36 г / моль (безводный).
-266,43 г / моль (гексагидрат).
Физическое описание
-Твердые и фиолетово-красноватые кристаллы (безводные).
-Темно-зеленый кристаллический порошок (гексагидрат, нижнее изображение). В этом гидрате видно, как вода подавляет яркость, металлическую характеристику хрома.
Точка плавления
-1152 ° C (2 106 ° F, 1425 K) (безводный)
-83 ° C (гексагидрат).
Точка кипения
1300 ºC (2 370ºF, 1570) (безводный).
Растворимость в воде
-Слабо растворимый (безводный).
-585 г / л (гексагидрат).
Верхнее изображение показывает серию пробирок, заполненных водным раствором CrCl3. Обратите внимание, что чем больше концентрация, тем интенсивнее цвет комплекса [Cr (OH).2)6]3+, ответственность за зеленый цвет.
Растворимость в органических растворителях
Растворим в этаноле, но нерастворим в эфире (безводный).
плотность
-2,87 г / см3 (Безводный).
-2,76 г / см3 (Гексагидрат).
Температура хранения
разложение
При нагревании до разложения хлорид хрома (III) выделяет токсичные пары хлорсодержащих соединений. Эти соединения также высвобождаются, когда хлорид хрома (III) вступает в контакт с сильными кислотами..
коррозия
Это очень коррозийно и может атаковать определенные стали.
реакции
Это несовместимо с сильными окислителями. Он также сильно реагирует с литием и азотом.
При нагревании в присутствии водорода он восстанавливается до хлорида хрома (II) с образованием хлористого водорода.
2 CrCl3 + H2 => 2 CrCl2 + 2 HCl
pH
В водном растворе и с концентрацией 0,2 М: 2,4.
синтез
Гексагидрат хлорида хрома (III) получают взаимодействием гидроксида хрома с соляной кислотой и водой.
Cr (OH)3 + 3 HCl + 3 H2O => CrCl3.6H2О
Затем для получения безводной соли CrCl нагревают3.6H2Или в присутствии тионилхлорида, SOCl2, соляная кислота и тепло:
[Cr (H2O)6] Cl3 + 6SOCl2 + Δ → CrCl3 + 12 HCl + 6SO2
Альтернативно, CrCl3
ru.thpanorama.com
Хлорид хрома(III) — Википедия
Материал из Википедии — свободной энциклопедии
| Хлорид хрома | |
| Общие | |
|---|---|
| Систематическое наименование | Хлорид хрома(III) |
| Хим. формула | CrCl3 |
| Физические свойства | |
| Состояние | (ангидрит) фиолетовый (гексагидрат) темно-зеленый |
| Молярная масса | 158,36 г/моль (ангидрат) (гексагидрат) 266,48 г/моль |
| Плотность | (ангидрит) 2,87 г/см³ (гексагидрат) 1,760 г/см³ |
| Термические свойства | |
| Т. плав. | 1152 °C (безводный) (гексагидрат) 83 °C |
| Т. кип. | 1300 °C |
| Т. всп. | негорюч °C |
| Химические свойства | |
| Растворимость в воде | в присутствии восстановителей (Cr2+ слабо растворим (безводный) (гексагидрат) 58,5 г/100 мл |
| Растворимость в | этаноле, нерастворим в диэтиловом эфире, ацетоне |
| Классификация | |
| Рег. номер CAS | 10025-73-7 10060-12-5 (гексагидрат) |
| PubChem | 24808 |
| Рег. номер EINECS | 233-038-3 |
| SMILES | |
| InChI | |
| RTECS | GB5425000 |
| ChEBI | 53351 |
| ChemSpider | 23193 и 4954736 |
| Безопасность | |
| ЛД50 | 440 мг/кг |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Хлори́д хро́ма(III) — неорганическое бинарное соединение хрома и хлора с формулой CrCl
3, хромовая соль соляной кислоты.Свойства
Безводный хлорид хрома(III) представляет собой фиолетовые кристаллы. При 600 °C возгоняется в токе хлора и разлагается в его отсутствие на хлор и CrCl2. В воде растворим в присутствии восстановителей (Cr2+, Fe2+).
Гексагидрат хлорида хрома(III) CrCl3·6H2O представляет собой зелёные кристаллы.
Получение
В технике получают высокотемпературным хлорированием хрома, феррохрома, а также хромовой руды в присутствии угля с раздельной конденсацией образующихся в двух последних случаях хлоридов хрома и железа. Безводный хлорид хрома(III) может быть получен хлорированием из металлического хрома прямо или косвенно, путём хлорирования оксида хрома(III) в присутствии углерода при температуре 800 °C, окись углерода в данном случае будет являться побочным продуктом реакции:
- Cr2O3+3C+3Cl2⟶ 2CrCl3+3CO{\displaystyle {\mathsf {Cr_{2}O_{3}+3C+3Cl_{2}\longrightarrow \ 2CrCl_{3}+3CO}}}
Применение
Применяют при электролитическом и металлотермическом получении хрома.
Меры предосторожности
Хоть и считается, что трёхвалентный хром гораздо менее ядовит, чем шестивалентный, однако все хромовые соли более или менее токсичны.
См. также
Другие хлориды хрома
Другие галогениды хрома(III)
Литература
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5. — 783 с. — ISBN 5-85270-310-9.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
wikipedia.green
XuMuK.ru — Хрома хлориды — Большая Советская Энциклопедия
|
|
Хрома хлориды, соединения хрома с хлором: CrCl2, CrCl3, CrCl4. Хлорид хрома (II), CrCl2, белые гигроскопичные кристаллы; плотность 2,75 г/см3; tпл 824 °С. Водные растворы голубого цвета. Образует комплексы с аммиаком, гидразином, дипиридилом и др. соединениями. Получают восстановлением CrCl3водородом при 700 °С или взаимодействием хлористого водорода с металлом при 600—700 °С. Применяют в хроматометрии. Хлорид хрома (III), CrCl3, фиолетовые кристаллы; плотность 2,76 г/см3; tпл 1152 °С. При 600 °С возгоняется в токе хлора и разлагается в его отсутствие на хлор и CrCl2. В воде растворим в присутствии восстановителей (Cr2+, Fe2+). В технике получают высокотемпературным хлорированием хрома, феррохрома, а также хромовой руды в присутствии угля с раздельной конденсацией образующихся в двух последних случаях хлоридов хрома и железа. Применяют при электролитическом и металлотермическом получении хрома. Хлорид хрома (IV), CrCl4, неустойчив в твёрдом состоянии. Образуется в газовой фазе при нагревании CrCl3 в избытке хлора. Из соединений хрома с хлором и кислородом наиболее важен хлористый хромил, CrO2Cl2. Это тёмно-красная жидкость; плотность 1,911 г/см3, tпл — 96,5 °С; tkип 117 °С. Окисляет большинство органических веществ. Образуется при действии сухого HCl на CrO3. Применяется в качестве окислителя в органическом синтезе (получение ализарина, сахарина, антрахиноновых красителей).
Лит. см. при ст. Хром. А. Б. Сучков.
|
www.xumuk.ru
Хлорид хрома(III) — Википедия. Что такое Хлорид хрома(III)
Материал из Википедии — свободной энциклопедии| Хлорид хрома | |
|---|---|
| Общие | |
| Систематическое наименование | Хлорид хрома(III) |
| Хим. формула | CrCl3 |
| Физические свойства | |
| Состояние | (ангидрит) фиолетовый (гексагидрат) темно-зеленый |
| Молярная масса | 158,36 г/моль (ангидрат) (гексагидрат) 266,48 г/моль |
| Плотность | (ангидрит) 2,87 г/см³ (гексагидрат) 1,760 г/см³ |
| Термические свойства | |
| Т. плав. | 1152 °C (безводный) |
| Т. кип. | 1300 °C |
| Т. всп. | негорюч °C |
| Химические свойства | |
| Растворимость в воде | в присутствии восстановителей (Cr2+, Fe2+) слабо растворим (безводный) (гексагидрат) 58,5 г/100 мл |
| Растворимость в | этаноле, нерастворим в диэтиловом эфире, ацетоне |
| Классификация | |
| Рег. номер CAS | 10025-73-7 10060-12-5 (гексагидрат) |
| PubChem | 24808 |
| Рег. номер EINECS | 233-038-3 |
| SMILES | |
| InChI | |
| RTECS | GB5425000 |
| ChEBI | 53351 |
| ChemSpider | 23193 и 4954736 |
| Безопасность | |
| ЛД50 | 440 мг/кг |
| NFPA 704 |  |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Хлори́д хро́ма(III) — неорганическое бинарное соединение хрома и хлора с формулой CrCl3, хромовая соль соляной кислоты.
Свойства
Безводный хлорид хрома(III) представляет собой фиолетовые кристаллы. При 600 °C возгоняется в токе хлора и разлагается в его отсутствие на хлор и CrCl2. В воде растворим в присутствии восстановителей (Cr2+, Fe2+).
Гексагидрат хлорида хрома(III) CrCl3·6H2O представляет собой зелёные кристаллы.
Получение
В технике получают высокотемпературным хлорированием хрома, феррохрома, а также хромовой руды в присутствии угля с раздельной конденсацией образующихся в двух последних случаях хлоридов хрома и железа. Безводный хлорид хрома(III) может быть получен хлорированием из металлического хрома прямо или косвенно, путём хлорирования оксида хрома(III) в присутствии углерода при температуре 800 °C, окись углерода в данном случае будет являться побочным продуктом реакции:
- Cr2O3+3C+3Cl2⟶ 2CrCl3+3CO{\displaystyle {\mathsf {Cr_{2}O_{3}+3C+3Cl_{2}\longrightarrow \ 2CrCl_{3}+3CO}}}
Применение
Применяют при электролитическом и металлотермическом получении хрома.
Меры предосторожности
Хоть и считается, что трёхвалентный хром гораздо менее ядовит, чем шестивалентный, однако все хромовые соли более или менее токсичны.
См. также
Другие хлориды хрома
Другие галогениды хрома(III)
Литература
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5. — 783 с. — ISBN 5-85270-310-9.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
wiki.sc
Хрома хлориды — это… Что такое Хрома хлориды?
- Хрома хлориды
соединения хрома с хлором: CrCl2, CrCl3, CrCl4.
Хлорид хрома (II), CrCl2, белые гигроскопичные кристаллы; плотность 2,75 г/см3; tпл 824 °С. Водные растворы голубого цвета. Образует комплексы с аммиаком, гидразином, дипиридилом и др. соединениями. Получают восстановлением CrCl3 водородом при 700 °С или взаимодействием хлористого водорода с металлом при 600—700 °С. Применяют в хроматометрии.
Хлорид хрома (III), CrCl3, фиолетовые кристаллы; плотность 2,76 г/см3; tпл 1152 °С. При 600 °С возгоняется в токе хлора и разлагается в его отсутствие на хлор и CrCl2. В воде растворим в присутствии восстановителей (Cr2+, Fe2+). В технике получают высокотемпературным хлорированием хрома, феррохрома, а также хромовой руды в присутствии угля с раздельной конденсацией образующихся в двух последних случаях хлоридов хрома и железа. Применяют при электролитическом и металлотермическом получении Хрома.Хлорид хрома (IV), CrCl4, неустойчив в твёрдом состоянии. Образуется в газовой фазе при нагревании CrCl3 в избытке хлора.
Из соединений хрома с хлором и кислородом наиболее важен хлористый хромил, CrO2Cl2. Это тёмно-красная жидкость; плотность 1,911 г/см3, tпл — 96,5 °С; tkип 117 °С. Окисляет большинство органических веществ. Образуется при действии сухого HCl на CrO3. Применяется в качестве окислителя в органическом синтезе (получение ализарина, сахарина, антрахиноновых красителей (См. Антрахиноновые красители)).
Лит. см. при ст. Хром.А. Б. Сучков.
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
- Хрома окислы
- Хромаль
Смотреть что такое «Хрома хлориды» в других словарях:
Хрома хлориды — Существуют следующие хлориды хрома: Название Формула Температура плавления Температура кипения Цвет Хлорид хрома(II) CrCl2 815 °C 1302 °C белый Хлорид хрома(III) CrCl3 1150 °C (в запаяной ампуле) 945 °C возгоняется розово… … Википедия
ХРОМА ХЛОРИДЫ — см. Хрома галогениды … Химическая энциклопедия
Хрома оксиды — Существуют следующие хлориды хрома: Название Формула Температура плавления Температура кипения Цвет Оксид хрома(II) CrO черный Оксид хрома(III) Cr2O3 2440 °C 3000 °C зеленый Оксид хрома(IV) CrO2 … Википедия
Хлорид хрома(III) — Хлорид хрома(III) … Википедия
Хлорид хрома(II) — Дихлорид хрома Общие Систематическо … Википедия
Хлорид хрома(IV) — Общие Систематическое наименование Хлорид хрома(IV) Традиционные названия Хлористый хром Химическая формула CrCl4 Физические свойства Состояние … Википедия
Хлорид гексаамминхрома(III) — Общие Систематическое наименование Хлорид гексаамминхрома(III) Традиционные названия гексамминхромихлорид Химическая формула [Сr(Nh4)6]Cl3 Физические свойства … Википедия
ХРОМ — см. ХРОМ (Сг). Соединения хрома встречаются в сточных водах многих промышленных предприятий, производящих хромовые соли, ацетилен, дубильные вещества, анилин, линолеум, бумагу, краски, пестициды, пластмассы и др. В воде встречаются трехвалентные… … Болезни рыб: Справочник
НДПИ — (severance tax) НДПИ это налог на добытые полезные ископаемые, изымаемый с пользователей недр Информация о НДПИ , расчет и порядок уплаты налога в соответствии с налоговой ставкой на определенный вид полезного ископаемого Содержание >>>>>>>> … Энциклопедия инвестора
Гексафторосиликат(IV) калия — Общие Систематическое наименование Гексафторосиликат(IV) калия Химическая формула K2[SiF6] Физические свойства Состояние (ст. … Википедия
dic.academic.ru
Хром (III), хлорид — Chromium(III) chloride
безводный | |
 гексагидрат | |
| имена | |
|---|---|
| имена IUPAC Хром (III) , хлорид | |
| Другие имена хлорид хромовый | |
| Идентификаторы | |
| 3D модель ( JSmol ) | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ИКГВ InfoCard | 100.030.023 |
| номер RTECS | GB5425000 |
| UNII | |
| |
| |
| свойства | |
| циклическое 3 | |
| Молярная масса | 158,36 г / моль (безводный) 266,45 г / моль (гексагидрат) |
| Внешность | фиолетовый, когда безводный, темно-зеленый, когда Гексагидрад |
| плотность | 2,87 г / см 3 (безводный) 1,760 г / см 3 (гексагидрат) |
| Температура плавления | Тысяча сто пятьдесят-две ° С (2106 ° F, 1 425 К) (безводный) 83 ° С (гексагидрат) |
| Точка кипения | 1 300 ° С (2370 ° F; 1570 К) разлагается |
| слабо растворим (безводный) 585 г / л (гексагидрат) | |
| Растворимость | нерастворим в этаноле не растворим в эфир , ацетон |
| Кислотность (р К ) | 2,4 (0,2 М раствор) |
| + 6890,0 · 10 -6 см 3 / моль | |
| Состав | |
| YCl 3 Структура | |
| восьмигранный | |
| опасности | |
| Паспорт безопасности | КМГС 1316 (безводный) ICSC 1532 ( динамика гексагидрат) |
| Нет в списке | |
| NFPA 704 |  |
| точка возгорания | Негорючий |
| Смертельная доза или концентрация ( LD , LC ): | |
| 1870 мг / кг (перорально, крыса) | |
| Пределы воздействия здоровья США ( NIOSH ): | |
| PEL (допустимый) | TWA 1 мг / м 3 |
| REL (рекомендуется) | TWA 0,5 мг / м 3 |
| IDLH (Непосредственная опасность) | 250 мг / м 3 |
| Родственные соединения | |
| Хром (III) , фторид хрома (III) , бромид хрома (III) , иодид | |
| Молибден (III) , хлорид вольфрама (III) , хлорид | |
Родственные соединения | Хром (II) , хлорид хрома (IV) , хлорид |
| За исключением случаев, когда указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
 N проверить ( что ?) N проверить ( что ?)  Y Y N N | |
| ссылки Infobox | |
Хром (III) хлорид (также называемый хромовой хлорид ) описывает любого из нескольких соединений с формулой циклической 3 · х H 2 O , где х может быть 0, 5 и 6. Безводного соединения с формулой циклических 3 фиолетовые твердое вещество. Наиболее распространенная форма трихлорида является темно — зеленый «гексагидрат», циклическая 3 · 6 Н 2 О . Хлорид хрома находит использование в качестве катализаторов и в качестве предшественников красителей для шерсти.
Состав
Безводный хрома (III) , хлорид принимает YCl 3 структуру, с Cr 3+ занимающих одну трети октаэдрических междоузлий в чередующихся слоев псевдо кубической плотноупакованной решетке Cl — ионов. Отсутствие катионов в чередующихся слоев приводит к слабой связи между соседними слоями. По этой причине, кристаллы циклического 3 расщепляют легко вдоль плоскости между слоями, что приводит к слоеному ( слюдистому ) появлению образцов хрома (III) , хлорид.
Хром (III) хлорид гидраты
Хром (III) хлориды отобразить несколько необычным свойством существующих в ряде различных химических формах (изомеры), которые различаются с точки зрения количества анионов хлора, которые координированной Cr (III) и кристаллизационной воды . Различные формы существуют как в виде твердых, так и в водных растворах. Некоторые члены известны из серии [Циклическое 3- п (Н 2 О) п ] г + . Основной гексагидрат может быть более точно описан как [Циклические 2 (H 2 O) 4 ] Cl 2 · H 2 O . Она состоит из катиона транс- [циклических 2 (Н 2 O) 4 ] + и дополнительные молекулы воды и аниона хлора в решетке. Две другие гидраты известны, бледно — зеленый [циклическое (H 2 O) 5 ] Cl 2 · H 2 O и фиолетовый [Cr (H 2 O) 6 ] Cl 3 . Подобное поведение наблюдается с другим хромом (III) соединениями.
подготовка
Безводный хлорид хрома (III) , могут быть получены путем хлорирования из хрома металла непосредственно или косвенно путем карботермического хлорирования оксида хрома (III) при 650-800 ° С
- Cr 2 O 3 + 3 С + 3 Cl 2 → 2 циклическое 3 + 3 CO
Обезвоживание с триметилсилилхлоридом в ТГФЕ дает сольвато:
- Циклическая 3 · 6 Н 2 О + 12 Me 3 SiCl → циклические 3 (ТГФ) 3 + 6 (Me 3 Si) 2 O + 12 HCl
Он также может быть получен путем обработки гексагидрата с тионилхлоридом :
- Циклическая 3 · 6 Н 2 О + 6 SOCl 2 → циклических 3 +-SO 2 + 12 HCl
Эти гидратированные хлориды получают путем обработки хромата с соляной кислотой и метанолом. В лаборатории гидраты обычно получают путем растворения хрома металл или оксид хрома (III) в соляной кислоте .
Реакции
Медленные скорости реакций являются общими с хромом (III) комплексами. Низкая реакционная способность д 3 Cr 3+ иона можно объяснить с помощью теории кристаллического поля . Один из способов открытия CrCl 3 до замещения в растворе является снижение даже следовые количества , чтобы циклическое 2 , например , с использованием цинка в соляной кислоте . Этот хром (II) , соединение претерпевает замещение легко, и он может обмениваться электронами с циклическими 3 через хлорид мост, что позволяет всем циклические 3 , чтобы быстро реагировать.
При наличии некоторого хрома (II), тем не менее, твердые циклический 3 быстро растворяется в воде. Аналогичным образом , лиганд реакция замещения решений [Циклические 2 (Н 2 O) 4 ] + ускоряется хромом (II) , катализаторы.
С расплавленными щелочными металлами хлоридами , такими как хлорид калия , циклический 3 дает соль типа М 3 циклического 6 и К 3 Cr 2 Cl 9 , который также октаэдрический , но где два Хромов соединены с помощью три хлоридных мостиков.
Комплексы с органическими лигандами
Циклическое 3 представляет собой кислоту Льюиса , классифицируется как «жесткий» в соответствии с теорией Hard-Soft кислотно-щелочной . Он образует множество аддуктов типа [циклическое 3 L 3 ] г , где L представляет собой основание Льюиса. Например, он реагирует с пиридином ( C
5 Н
5 Н) с образованием аддукта:
- Циклический 3 + 3 C 5 H 5 N → циклических 3 (С 5 Н 5 N) , 3
Лечение триметилсилилхлоридом в ТГФ дает безводного ТГФ комплекс:
- Циклическое 3 . (Н 2 О) 6 + 12 (СН 3 ) 3 SiCl + 3 ТГФ → циклическое 3 (ТГФ) 3 + 6 ((СН 3 ) 3 Si) 2 O + 12 HCl
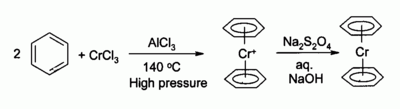
Предшественник для organochromium комплексов
Хром хлорид (III) используют в качестве предшественника многих organochromium соединений , например , бис (бензол) хрома , аналог ферроцена :
Фосфин комплексы , полученные из циклических 3 катализировать тримеризацию этилена в 1-гексно .
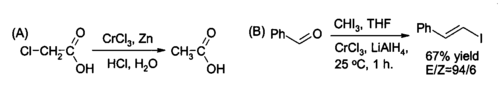
Использование в органическом синтезе
Одно из применений ниши циклических 3 в органическом синтезе является для на месте получения хрома хлорида (II) , реагент для уменьшения алкилгалогенидов и для синтеза ( Е ) -алкенила галогениды. Реакцию обычно осуществляют с использованием двух молей из циклических 3 на моль гидриде лития и алюминий , хотя , если водные кислые условия являются подходящим цинк и соляная кислота могут быть достаточными.
Хром хлорид (III) , также был использован в качестве кислоты Льюиса в органических реакций, например , чтобы катализировать нитрозогруппу реакцию Дильса-Альдера .
Красители
Ряд хромсодержащих красителей используются коммерчески для шерсти. Типичные красители триарилметаны , состоящие из производных орто-hydroxylbenzoic кислоты.
Меры предосторожности
Хотя трехвалентного хрома является гораздо менее ядовит , чем шестивалентного, соли хрома , как правило , считаются токсичными.
Рекомендации
дальнейшее чтение
- Справочник по химии и физике , 71 -е издание, CRC Press, Анн — Арбор, штат Мичиган, 1990.
- Merck Index , 7 — е издание, Merck & Co, Rahway, Нью — Джерси, США, 1960.
- J. March, Advanced Organic Chemistry , 4 — е изд., Стр. 723, Wiley, New York, 1992.
- К. Takai, в Справочнике Реагенты для органического синтеза, Том 1: Реагенты, вспомогательные и катализаторах для формирования CC Bond (. Р. Коутс, С. Е. Дания, ред), С. 206-211, Wiley, New York, 1999..
внешняя ссылка
ru.qwertyu.wiki
Хрома хлориды — Большая советская энциклопедия
Хро́ма хлориды
Соединения хрома с хлором: CrCl2, CrCl3, CrCl4.
Хлорид хрома (II), CrCl2, белые гигроскопичные кристаллы; плотность 2,75 г/см3; tпл 824 °С. Водные растворы голубого цвета. Образует комплексы с аммиаком, гидразином, дипиридилом и др. соединениями. Получают восстановлением CrCl3 водородом при 700 °С или взаимодействием хлористого водорода с металлом при 600—700 °С. Применяют в хроматометрии.
Хлорид хрома (III), CrCl3, фиолетовые кристаллы; плотность 2,76 г/см3; tпл 1152 °С. При 600 °С возгоняется в токе хлора и разлагается в его отсутствие на хлор и CrCl2. В воде растворим в присутствии восстановителей (Cr2+, Fe2+). В технике получают высокотемпературным хлорированием хрома, феррохрома, а также хромовой руды в присутствии угля с раздельной конденсацией образующихся в двух последних случаях хлоридов хрома и железа. Применяют при электролитическом и металлотермическом получении Хрома.
Хлорид хрома (IV), CrCl4, неустойчив в твёрдом состоянии. Образуется в газовой фазе при нагревании CrCl3 в избытке хлора.
Из соединений хрома с хлором и кислородом наиболее важен хлористый хромил, CrO2Cl2. Это тёмно-красная жидкость; плотность 1,911 г/см3, tпл — 96,5 °С; tkип 117 °С. Окисляет большинство органических веществ. Образуется при действии сухого HCl на CrO3. Применяется в качестве окислителя в органическом синтезе (получение ализарина, сахарина, антрахиноновых красителей (См. Антрахиноновые красители)).
Лит. см. при ст. Хром.
А. Б. Сучков.
Источник: Большая советская энциклопедия на Gufo.me
Значения в других словарях
- хрома хлориды — ХРОМА ХЛОРИДЫ, см. хрома галогениды. Химическая энциклопедия

gufo.me