Ковалентная связь
Как образуется ковалентная связь
Ковалентная химическая связь образуется между атомами с близкими или равными значениями электроотрицательностей.
Предположим, что хлор и водород стремятся отнять друг у друга электроны и принять структуру ближайшего благородного газа. Но ни один из них не отдаст электрон другому, т.к. значения их электроотрицательностей близки.
Каким же способом они все таки соединяются? Все просто – они поделятся электронами друг с другом, образуется общая электронная пара.
При взаимодействии атомов с равными значениями электроотрицательности образуется ковалентная неполярная связь.
В этом случае общая электронная пара будет находится на одинаковом расстоянии от обоих атомов и в равной степени принадлежать обоим атомам. Такая связь не имеет полярности , т.е электронная плотность распределяется симметрично. Ковалентная неполярная связь реализуется, например, в простых веществах-неметаллах: H2, О2, N2, Cl2 и др. Связи могут быть как одинарными, так и двойными, тройными.
Связи могут быть как одинарными, так и двойными, тройными.
Механизм образования ковалентной неполярной связи
ковалентная неполярная связьПри взаимодействии атомов, с различными значениями электроотрицательностей образуется ковалентная полярная связь
Если электроотрицательности атомов различаются, то при их соединении электронная плотность распределяется между атомами неравномерно. Электронная пара смещается в сторону атома, имеющего большее значение электроотрицательности. Образуется ковалентная полярная связь (HCl, H2O, CO), кратность которой также может быть различной.
Механизм образования ковалентной полярной связи
ковалентная полярная химическая связьПри образовании данного типа связи, более электроотрицательный атом приобретает частичный отрицательный заряд, а атом с меньшей электроотрицательностью – частичный положительный заряд (δ- и δ+). Образуется электрический диполь, в котором заряды, противоположные по знаку, расположены на неком расстоянии друг от друга. В качестве меры полярности связи используют дипольный момент:
Образуется электрический диполь, в котором заряды, противоположные по знаку, расположены на неком расстоянии друг от друга. В качестве меры полярности связи используют дипольный момент:
где, δ — величина заряда, l – расстояние между центрами положительного и отрицательного зарядов.
Полярность соединения тем более выражена, чем больше дипольный момент. Молекулы будут иметь неполярный характер, если дипольный момент равен нулю.
Теперь рассмотрим отличительные черты ковалентной связи.
Характеристики ковалентной связи
- В отличие от ионных соединений, молекулы ковалентных соединений удерживаются вместе за счет «межмолекулярных сил», которые намного слабее химических связей. В связи с этим, ковалентной связи характерна насыщаемость – образование ограниченного числа связей.
- Известно, что атомные орбитали ориентированы в пространстве определенным образом, поэтому при образовании связи, перекрывание электронных облаков происходит в определенном направлении.
 Т.е. реализуется такое свойство ковалентной связи как направленность.
Т.е. реализуется такое свойство ковалентной связи как направленность.
- Для ковалентной связи характерна полярность, которая возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью.
- Электрическое поле частиц, образуемых ковалентную связь способно смещать электроны и характеризуется понятием поляризуемости связи. При удалении электрона от ядра, т.е. с увеличением длины связи ослабевает его притяжение к ядру и он становится более подвижен. Чем больше длина связи, тем более поляризуема связь.
Физические свойства соединений с ковалентной связью
В связи с вышеперечисленными особенностями, можно заключить, что:
- Ковалентные соединения летучи
- Имеют низкие температуры плавления и кипения.
- Электрический ток не может проходить через эти соединения, следовательно, они плохие проводники и хорошие изоляторы.

- При подводе тепла, многие соединения с ковалентной связью, загораются. В большей части это углеводороды, а также оксиды, сульфиды, галогениды неметаллов и переходных металлов.
Связь ионная ковалентная полярная — Справочник химика 21
Приведите примеры, когда один и тот же элемент может образовывать различные виды химической связи ионную, ковалентную полярную и ковалентную неполярную, [c.45]Лекция э. Гибридизация волновых функций. Донорно-акцепторный и дативный механизм образования ковалентной связи. Образование кратких связей. Сигма-и пи-связи, их особенности. Делокализвванные пи-связи. Лекция 6. Полярная и неполярная ковалентная связь. Э(М)вктивные заряды атомов в молекулах. Ионная связь как крайний случай поляризации ковалентной связи. Свойства ионной связи. Поляризуемость ионов и их взаимное поляризующее действие. Влияние системы поляризации ионов на свойства веществ. [c.179]
При прямом взаимодействии азота и фосфора со многими металлами и неметаллами образуются нитриды и фосфиды.
 В зависимости от полярности связи Е—X можно наблюдать переходы от связей ионного типа к ковалентным или к металлическому типу связи (X=N, Р). При этом происходят переходы между тремя основными типами соединений меняются также химические свойства соединений.
В зависимости от полярности связи Е—X можно наблюдать переходы от связей ионного типа к ковалентным или к металлическому типу связи (X=N, Р). При этом происходят переходы между тремя основными типами соединений меняются также химические свойства соединений. Выпишите в три столбика формулы веществ с ионной, ковалентной полярной и ковалентной неполярной связью гидроксид калия, фосфорная кислота, бром, серная кислота, водород, иодоводород, хлорид железа (III), сера, сульфат алюминия. [c.50]
Второй тип активированного комплекса представляет подготовку к распаду на ионы. В этом случае преобладают ионные или полярные связи, т. е. электроны более тесно связаны с какими-либо одними из соединенных атомов. Пределом является диссоциация на ионы, так же как и в растворах. Реально существуют все степени перехода от ковалентной связи к чисто электровалентной, что в различной мере облегчает реакции. В случае органических соединений допускают и ионный механизм реакции в результате деформирующего действия катализатора и поляризации молекул.
Образование химической связи может происходить различными путями и по этому признаку химическую связь подразделяют на ряд видов. Основными видами химической связи являются а) ковалентная неполярная связь, б) ковалентная полярная связь, в) ионная связь. Кроме того, существует еще много различных форм взаимодействия, но уже требующих или готовых молекул или ионов (донорно-акцепторная связь, водородная связь, межмолекулярное взаимодействие). Несколько обособлено взаимодействие атомов металлов — металлическая связь. [c.67]
Р неполярная ковалентная связь Н Р полярная ковалентная связь Ма р ионная связь [c.12]
Выпишите ц три столбика формулы веществ с ионной, ковалентной полярной и ковалентной неполярной связью гидроксид кальция, хлороводород, азот, угольная кислота, нитрат цинка, фосфор, азотная кислота, бромид медн (II), иод.
НОСТИ возникают в связи с проблемой природы ионной пары. В простейшем случае одновалентных ионов А и В , образующих ионную пару, возможно существование различных типов ионных пар, от таких, в которых расстояние между зарядами равно сумме ионных радиусов А и В, и до молекулы, в которой АиВ образуют ковалентную связь, не обязательно полярную. [c.454]
В простейшем случае одновалентных ионов А и В , образующих ионную пару, возможно существование различных типов ионных пар, от таких, в которых расстояние между зарядами равно сумме ионных радиусов А и В, и до молекулы, в которой АиВ образуют ковалентную связь, не обязательно полярную. [c.454]
Проведенное выше рассмотрение характера связи в HF показывает, что не сушествует чисто ионных, как и чисто ковалентных связей. Не существует и принципиального различия между этими двумя типами связи-они лишь являются предельными случаями непрерывного ряда связей с различной полярностью. В рамках теории молекулярных орбиталей гораздо большее значение, чем оценка ионного характера связи, имеет близость энергетических уровней взаимодействующих орбиталей двух атомов. Эта степень близости уровней связана с электроотрицательностью атомов. [c.537]
Между атомами могут возникать различные взаимодействия в зависимости от их физико-химических характеристик, а главным образом от значений электроотрицательности (ЭО), определяющей ориентировку электронов относительно атомов, уже вошедших в состав молекулы.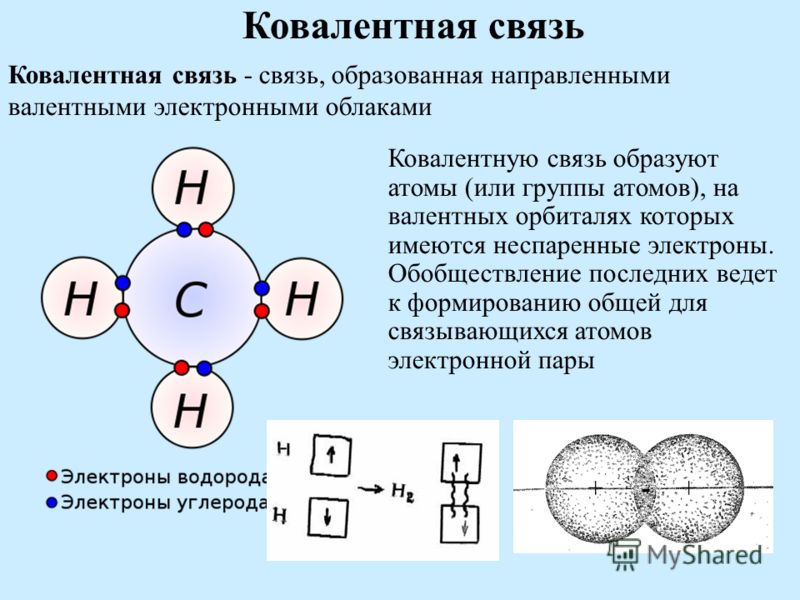 Основными видами связи можно считать связи, устанавливающиеся между атомами, вступающими в соединение между собой а) ковалентная неполярная связь б) ковалентная полярная и в) ионная связь. К основным видам связи следует отнести и металлическую связь, однако она характерна не для замкнутых молекул, а для кристаллов металлического типа. Вообще говоря, ионная связь также характерна для кристаллического состояния веществ. [c.70]
Основными видами связи можно считать связи, устанавливающиеся между атомами, вступающими в соединение между собой а) ковалентная неполярная связь б) ковалентная полярная и в) ионная связь. К основным видам связи следует отнести и металлическую связь, однако она характерна не для замкнутых молекул, а для кристаллов металлического типа. Вообще говоря, ионная связь также характерна для кристаллического состояния веществ. [c.70]
Для -металлов VH группы, особенно для марганца, характерен широкий диапазон изменения степеней окисления, рению более свойственны соединения высшей степени окисления. Изменение степени окисления сопровождается изменением характера химических связей (от ковалентно-полярных в соединениях высшей степени окисления до ионной связи в соединениях низшей степени окисления) и характера самого химического соединения. Металлообразных соединений -металлы VH группы не дают и электрическая проводимость возникает только за счет кислородных вакансий (широта области гомогенности) и имеет полупроводниковый характер.
Связи этого типа являются наиболее типичными как для органических, так и неорганических молекул В зависимости от степени смещения общей электронной пары в промежутке между двумя атомами связи этого типа подразделяют по физическим и химическим свойствам на ионные, ковалентные полярные и ковалентные неполярные Типичные ионные связи (осевое перекрывание, смещение настолько сильное, что образуются заряженные частицы и химическая связь осуществляется за счет электростатического кулоновского взаимодействия) [c.52]
Изменение степени окисления также сопровождается изменением характера химических связей (от ковалентно-полярных в соединениях высшей степени окисления до ионной связи в соединениях низшей степени окисления) и характера самого химического соединения. [c.354]
Выпишите отдельно в три столбика вещества с ионной, ковалентной полярной и ковалентной неполярной связью МВг — бромоводород, СЬ — хлор, НМОз — азотная кислота, К аОН — гидроксид натрия, — сульфат калня, Ог — кислород. [c.50]
[c.50]
НОВ и обладает наиболее высоким потенциальным барьером, что проявляется в высокой энергии активации большинства органических реакций. Однако всякое смеш,ение электронов в сторону одного или другого атома поляризует атом и тем самым снижает величину энергии активации. В пределе такой деформации ковалентной связи образуется истинно полярная, или ионная, связь, при которой энергия активации становится равной нулю, и реакции протекают моментально.
Учащимся предлагают выполнить задания после краткого напоминания учителем, какие существуют виды химической связи (ионная, ковалентная полярная, ковалентная неполярная, металлическая), какого типа кристаллические решетки (ионная, атомная, молекулярная, металлическая) образуют вещества при затвердевании. Чтобы возбудить интерес учащихся к выполнению работы, учитель предлагает учащимся попытаться самостоятельно определить, какие виды связи имеются между химическими элементами в тех или ииых указанных веществах, какого типа кристаллические решетки имеют указ.
Заметим, что чисто ионных соединений не бывает, что АЛ = О только у атомов одного и того же элемента. Если А и Б — атомы различных элементов, то всегда АА 0. Напомним, что резких границ между типами связи (ионной, ковалентно-полярной и ковалентно-неполярной) нет. (Еще об электронофильностн — см. гл. 13, 2.) [c.123]
Из курса химии VIII класса вам известно, что атомы могут соединяться друг с другом с образованием как простых, так и сложных веществ. При этом возникают различного рода химические связи ионная, ковалентная (неполярная и полярная), металлическая и водородная. Вспомним, что один из существенных показателей, определяющих, какая связь образуется между атомами — ионная или ковалентная,— это электроотрицательность, т. е. способность атомов притягивать к себе электроны от других атомов. При этом следует учесть, что электроотрицательности атомов злементов изменяются постепенно. В периодах периодической системы слева направо численные значения электроотрицательностей возрастают, а в группах сверху вниз — уменьшаются.
В этом случае обьршо образуются заряженные частицы — ионы. Ионный тап разрьгаа связи характерен для л-связей и ковалентных полярных а-связей. [c.94]
Проявление свободными металлами только восстановительных свойств объясняется способностью их атомов терять полностью или частично валентные электроны. При этом образуются ионные связи или ковалентные полярные связи в соединениях, где атомы металлов имеют положительные значения о. ч. Восстановительная активность металлов проявляется по-разному. Мера ее для свободных атомов металлов — потенциал ионизации / (гл.
Лиганд Ь образует с металлом-комплексообразователем М координационную связь различной химической природы (ионная, ковалентная, полярная по происхождению — донорно-акцепторная, датшная). Координационная связь может быть ординарной (одинарной), двойной, тройной. [c.181]
Таким образом, переход от ионных связей к ковалентно-полярным сопровождается уменьшением энергии связи. В частности, в отличие от Si02 рутил Т10г по отношению к металлам является более сильным окислителем (шлаки, сварочные флюсы). По химическому характеру Т10г представляет собой оксид со слабо выраженными кислотными свойствами. Соли титановой кислоты, полученные при высокой температуре (сплавление), устойчивы (например, природное
Наряду с взаимодействиями, которые существуют в металлах, выделяют два основных типа химической связи ионную (гетеро-полярную) и атомную (гомеополярную или ковалентную).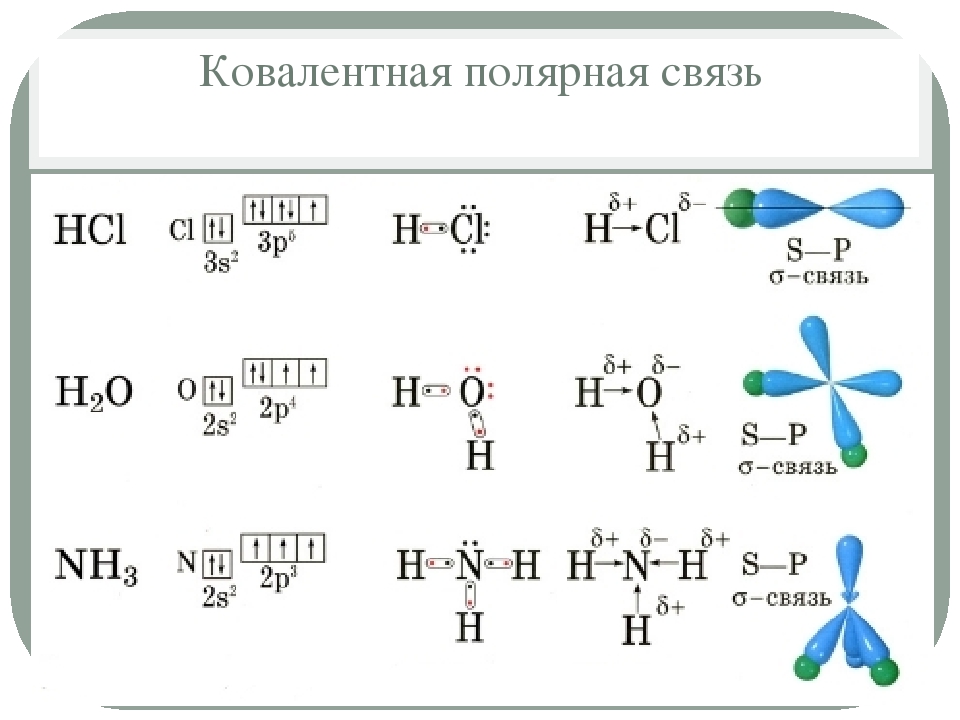 И в том и в другом случае обоими партнерами, образующими связь, достигается стабильная восьмиэлектронная оболочка (правило окте- [c.196]
И в том и в другом случае обоими партнерами, образующими связь, достигается стабильная восьмиэлектронная оболочка (правило окте- [c.196]
Само понятие химической связи было сформулировано уже в работах А М Бутлерова и оказалось чрезвычайно плодотворным для химии, хотя природа химической связи и оставалась неясной до появления квантовой механики и ее применения к изучению молекулярных систем Позднейшие исследования — как экспериментальные, так и теоретические — позволили понять некоторые особенности образования химической связи в различных рядах соединений и привели к введению в химию терминов ионная, ковалентная, полярная, координационная, донорно-акцепторная, многоцентровая связи и другие, с помощью которых принято характеризовать различные типы химической связи Число таких терминов довольно велико, и есть все основания ожидать, что дальнейший прогресс в химии приведет к необходимости ввести еще более обширную классификацию При этом большинство таких терминов являются по сути классификационными и не отражают ни общей для всех рядов соединений природы химической связи, ни конкретных особенностей химической связи в соединениях определенных классов В наибольшей степени сказанное относится к термину координационная связь В самом деле, совершенно разные по характеру связи в хелатах металлов, полисоединениях, ме-таллоценах итд называются координационными, в то же время в ионе [c. 107]
107]
Образование устойчивой электронной конфигурации может происходить многими способами и приводить к молекулам различного строения, поэтому различают несколько типов химической связи. Таковы ионная, ковалентная полярная и неполярная), металлическая, водородная и ван-дер-ваалъсова связи. [c.29]
Таким образом, переход от ионных связей к ковалентно-полярным сопровождается уменьшением энергии связи. В частности, в отличие от SIO2 рутил TIO2 по отношению к металлам является более сильным окислителем (шлаки, сварочные флюсы). [c.329]
Теория промежуточных соединений объясняет главным образом механизм гомогенного катализа. В гетерогенном катализе ускорение А реакции в большинстве случаев связано со снижением энергии активации реакции в присутствии катализатора. Это обусловли- вается промежуточным взаимодействием реагирующих веществ с катализатором. Однако промежуточное соединение, возникающее при гетерогенном катализе, не образует самостоятельную фазу, а представляет собой поверхностное соединение. Это поверхностное соединение, образованное в результате адсорбции молекул реаги- рующего вещества поверхностными молекулами твердого катализатора, нельзя отделить от поверхности твердого тела, так как между молекулами катализатора и молекулами превращаемого вещества возникает химическая связь (ионная, ковалентная или полярная). [c.306]
Это поверхностное соединение, образованное в результате адсорбции молекул реаги- рующего вещества поверхностными молекулами твердого катализатора, нельзя отделить от поверхности твердого тела, так как между молекулами катализатора и молекулами превращаемого вещества возникает химическая связь (ионная, ковалентная или полярная). [c.306]
Ответ. КС1 — ионная связь НС1 — ковалентная полярная связь О2 — ковалентная неполярная связь aHgOH — ковалентные связи развой полярности в самой молекуле и водородные связи между молекулами. [c.150]
Промежуточное положение между ионными и ковалентными фторидами занимают фториды с пысокой степенью полярности связи, которые можно назвать ионно-ковалентными соединениями, К последним, например, можно отнести кристаллические 2пр2, МпР , СоР , Nip2, в которых эффективные заряды электроположительных атомов составляют 1,56 1,63 1,46 1,40 соответственно. [c.282]
Неообходимо отметить, что образование чисто ионных связей осуществляется в сравнительно ограниченном числе случаен. Подавляющее большинство молекул химических соединений содержит связи, имеющие промежуточный характер и называемые ковалентно-полярными или просто полярными. [c.48]
Подавляющее большинство молекул химических соединений содержит связи, имеющие промежуточный характер и называемые ковалентно-полярными или просто полярными. [c.48]
Зная динольный момеит, можно сделать заключение о характере химической связи (ионная, полярная или ковалентная) и о геометрической структуре молекулы. [c.72]
Нередко проявляется и подобное же влияние воды на соль гидратация соли — сопровождается усилением полярности связи в ней. Так, безводный А1С1з не содержит ионов А1 +, так как отделение трех электронов от атома требует затраты слишком большого количества энергии. В безводном А1С1з связи ковалентные полярные, но при гидратации его степень ионности связей сильно возрастает за счет энергии процесса гидратации. Поэтому соединение [А1(Н20)б]С1з можно считать содержащим ионы [А1(Н20)бР [c.142]
Координационными или комплексными называют соединения, содержащие центральный атом или ион и группу молекул или ионов, его окружающих и связанных с ним (лигандов). Число лигандов, связанных с центральным атомом (ионом), называют координационным числом иона. Оно зависит как от электронной структуры, так и от соотношения между радиусами центрального атома (иона) и лигандов. Координационное число центрального атома (иона) обычно превышает его валентность, понимаемую как формальный положительный заряд на атоме. Высокая устойчивость многих комплексных соединений указываает, что химическая связь в них не отличается по своей природе от химической связи в обычных ионных или ковалентных соединениях. В большинстве координационных соединений центром является ион переходного металла (Т , Со , Сг » и др.), а лигандами — ионы или полярные молекулы (обладающие к тому же неподеленной парой электронов.) Именно поэтому электростатические представления легли в основу теории комплексных соединений, так называемой теории кристаллического поля, учитывающей также квантовомеханические особенности строения электронной оболочки центрального иона (Бете, Ван Флек). [c.
Число лигандов, связанных с центральным атомом (ионом), называют координационным числом иона. Оно зависит как от электронной структуры, так и от соотношения между радиусами центрального атома (иона) и лигандов. Координационное число центрального атома (иона) обычно превышает его валентность, понимаемую как формальный положительный заряд на атоме. Высокая устойчивость многих комплексных соединений указываает, что химическая связь в них не отличается по своей природе от химической связи в обычных ионных или ковалентных соединениях. В большинстве координационных соединений центром является ион переходного металла (Т , Со , Сг » и др.), а лигандами — ионы или полярные молекулы (обладающие к тому же неподеленной парой электронов.) Именно поэтому электростатические представления легли в основу теории комплексных соединений, так называемой теории кристаллического поля, учитывающей также квантовомеханические особенности строения электронной оболочки центрального иона (Бете, Ван Флек). [c. 120]
120]
Занятие 2. Химическая связь. Валентность. Ковалентная связь, ее сво -ства. Неполярная и полярная связь. Ионная связь. Определение дипольных моментов. Геометрическая /Тюрмула молекул. Расчет э г ективныу зарядов. Занятие 3. Донорно-акцепторняя, водородная связь. Межмолекулярное взаимодействие. Метоп МО. [c.181]
Известно несколько видов химической связи. Например, в кристаллах МаС1 связь ионная. В растворе кристаллы разрушаются и появляются свободные ионы На+ и С1 . Следовательно, под влиянием полярных молекул воды происходит разрыв ионной связи. Ковалентная связь [Возникает за счет обших электронных пар. Каждый из соединяющихся атомов для образования одной общей пары предоставляет один электрон, например [c.81]
Задание 1
Атомы могут соединяться друг с другом с образованием как простых, так и сложных веществ. При этом образуются различного типа химические связи: ионная, ковалентная (неполярная и полярная), металлическая.
Одно из наиболее существенных свойств атомов элементов, определяющих, какая связь образуется между ними — это электроотрицательность, т.е. способность атомов в соединении притягивать к себе электроны.
Чем сильнее атом притягивает к себе электроны, тем выше его электроотрицательность. Электоотрицательность зависит от размеров атома и заряда его ядра. Размеры атомов элементов одного периода уменьшаются с увеличением заряда ядра. Это происходит потому, что заряд ядра атома от элемента к элементу увеличивается, а число электронных слоев остается одинаковым. При этом атом становится более компактным, размер атома уменьшается к концу периода, а сила притяжения электронов ядром увеличивается. Поэтому электроотрицательность элементов в периоде возрастает.
У элементов главных подгрупп с увеличением зарядов ядер возрастает и число электронных слоев, следовательно увеличивается размер атомов. Притяжение внешних электронов уменьшается. Поэтому электроотрицательность элементов в группе уменьшается.

Наибольшей электроотрицательностью обладают элементы-неметаллы: фтор, кислород, азот и другие. Элементы-металлы обладают меньшей электроотрицательностью. Самая низкая электроотрицательность у таких элементов, как калий, натрий, кальций. По убыванию электроотрицательности элементы можно расположить в ряд:
F, O, N, Cl, Br, S, I, C, Se, P, H, B, Si, Cu. Fe, Zn. Al, Mg, Li, Ca, Na, K
Электроотрицательность фтора условно принята за 4,0; электроотрицательность калия равна 0,8.
Тип химической связи зависит от того, насколько велика разность значений электроотрицательностей соединяющихся атомов элементов. Чем больше отличаются по электроотрицательности атомы элементов, образующих связь, тем химическая связь полярнее.
1. Ионная связь образуется при взаимодействии атомов, которые резко отличаются друг от друга по электроотрицательности. Например, типичные металлы литий(Li), натрий (Na), калий (K), кальций (Ca), стронций (Sr), барий (Ba) образуют ионную связь с типичными неметаллами.
 При этом образует ион металла с положительных зарядом и ион неметалла с отрицательным зарядом.
При этом образует ион металла с положительных зарядом и ион неметалла с отрицательным зарядом.2. Ковалентная – это связь между атомами неметаллов, в результате которой образуются общие электронные пары.
Различают неполярную и полярную ковалентную связь.
При взаимодействии атомов с одинаковой электроотрицательностью образуются молекулы с ковалентной неполярной связью. Такая связь существует в молекулах простых веществ: водород, кислород, азот, хлор и т.д. Химические связи в этих образованы посредством общих электронных пар, т.е. при перекрывании соответствующих электронных облаков, обусловленном электронно-ядерным взаимодействием при сближении атомов.
При взаимодействии атомов, значение электроотрицательностей которых отличаются, но не резко, происходит смещение общей электронной пары к более электроотрицательному атому и образуется ковалентная полярная связь. При этом образуются частичные заряды. Это наиболее распространенный тип химической связи, которой встречается как в неорганических, так и органических соединениях.

3. Металлическая – это связь, которая образуется в результате взаимодействия относительно свободных электронов с ионами металлов. Этот тип связи характерен для простых веществ- металлов и их сплавов. Сущность процесса образования металлической связи состоит в следующем: атомы металлов легко отдают валентные электроны и превращаются в положительные заряженные ионы. Относительно свободные электроны, оторвавшиеся от атома, перемещаются между положительными ионами металлов. Между ними возникает металлическая связь.
Провести резкую границу между типами химических связей нельзя. В большинстве соединений тип химической связи оказывается промежуточным; например, сильнополярная ковалентная химическая связь близка к ионной связи. В зависимости от того, к какому из предельных случаев ближе по своему характеру химическая связь, ее относят либо к ионной, либо к ковалентной полярной связи.
Химия — 8
Ковалентная связь, образованная между атомами с одинаковой электроотрицательностью (атомами неметаллов одного вида) за счет образования общих электронных пар, называется неполярной ковалентной связью. Неполярная ковалентная связь в основном образуется а многоатомных простых веществах.
Неполярная ковалентная связь в основном образуется а многоатомных простых веществах.
| Простые вещества | H2,N2,O2,O3,F2,Cl2 | Br2 | I2, P4, S8 |
| Агрегатное состояние В н.у. | Газ | Жидкость | Твердое вещество |
В органических соединениях неполярная ковалентная связь в основном образуется между атомами углерода.
Полярная ковалентная связь. При различных электроотрицательностях атомов, образующих связь, т.е. при соединении атомов различных элементов электронные пары размещаются несимметрично — они смещаются в сторону атома с большей электроотрицательностью. Например:
где δ+ и δ- (читается «дельта»)—относительные заряды. Абсолютное их значение меньше. В таком случае центры положительных и отрицательных зарядов не совпадают.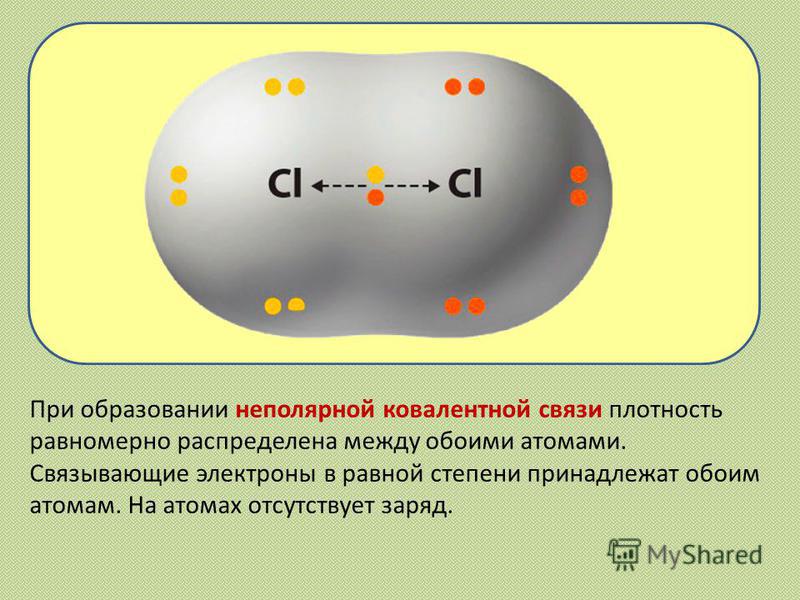 У образованной в результате этого молекулы в той части, где расположен атом элемента с большей электроотрицательностью, создается избыток отрицательного заряда, там же, где находится атом элемента с меньшей электроотрицательностью, — избыток положительного заряда.
У образованной в результате этого молекулы в той части, где расположен атом элемента с большей электроотрицательностью, создается избыток отрицательного заряда, там же, где находится атом элемента с меньшей электроотрицательностью, — избыток положительного заряда.
Ковалентная связь, образованная смещением связывающей общей электронной пары в сторону одного из атомов, называется полярной ковалентной связью. Иными словами, связь, образованная между атомами с различными электроотрицательностями за счет электронных пар, называется полярной ковалентной связью.
Например: HF, HCl, HBr, HI, CO, SO2, SO3, NO, NO2, N2O5, P2O3, P2O5, HNO2, H2SO3, H2CO3, HPO3, H3PO4, H4P2O7, SiO2, SiC, CS2, CH3Cl, CHCl3, CH2Cl2, CCl4, CH4, CF4 и др. , являются соединениями, образованными посредством полярно-ковалентной связи.
, являются соединениями, образованными посредством полярно-ковалентной связи.
В молекулах таких бинарных (двухэлементных) соединений, как HF, HCl, HBr, H2O, SO2, H2S, NH3 электронные пары размещены в связи несимметрично. Электронные пары размещаются в связи несимметрично. В таких случаях создается диполь (поляризация в молекуле). Т.е. один полюс молекулы бывает положительно заряженным, а другой полюс — отрицательно заряженным.
Во всех углеводородах Cx Hy число полярных ковалентных связей равно числу атомов водородом:
Ковалентная химическая связь образуется. §2 Химическая связь
Ковалентной
связью называется связывание атомов
с помощью общих (поделенных между ними)
электронных пар.В
слове «ковалентная» приставка
«ко-» означает «совместное
участие». А «валента» в переводе
на русский – сила, способность. В данном
случае имеется в виду способность
атомов связываться с другими атомами.
В данном
случае имеется в виду способность
атомов связываться с другими атомами.
При образовании ковалентной связи атомы объединяют свои электроны как бы в общую «копилку» – молекулярную орбиталь, которая формируется из атомных оболочек отдельных атомов. Эта новая оболочка содержит по возможности завершенное число электронов и заменяет атомам их собственные незавершенные атомные оболочки.
Представления о механизме образования молекулы водорода были распространены на более сложные молекулы. Разработанная на этой основе теория химической связи получила название метода валентных связей (метод ВС). В основе метода ВС лежат следующие положения:
1) Ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
2) Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака.
Комбинации двухэлектронных двухцентровых связей,
отражающие электронную структуру
молекулы, получили название валентных
схем. Примеры построения валентных
схем:
Примеры построения валентных
схем:
В валентных схемах наиболее наглядно воплощены представления Льюиса об образовании химической связи путем обобществления электронов с формированием электронной оболочки благородного газа: для водорода – из двух электронов (оболочка He ), для азота – из восьми электронов (оболочка Ne ).
29.Неполярная и полярная ковалентная связь.
Если двухатомная молекула состоит из атомов одного элемента, то электронное облако распределяется в пространстве симметрично относительно ядер атомов. Такая ковалентная связь называется неполярной. Если ковалентная связь образуется между атомами различных элементов, то общее электронное облако смещено в сторону одного из атомов. В этом случае ковалентная связь является полярной.
В
результате образования полярной
ковалентной связи более электроотрицательный
атом приобретает частичный отрицательный
заряд, а атом с меньшей электроотрицательностью
– частичный положительный заряд. Эти
заряды принято называть эффективными
зарядами атомов в молекуле. Они могут
иметь дробную величину.
Эти
заряды принято называть эффективными
зарядами атомов в молекуле. Они могут
иметь дробную величину.
30.Способы выражения ковалентной связи.
Существуют два главных способа образования ковалентной связи * .
1)
Электронная пара, образующая связь,
может образоваться за
счет неспаренных электронов ,
имеющихся в невозбужденныхатомах .
Увеличение
числа создаваемых ковалентных связей
сопровождается выделением большего
количества энергии, чем затрачивается
на возбуждение атома. Поскольку валентность атома
зависит от числа неспаренных электронов,
возбуждение приводит к повышению
валентности. У
атомов азота, кислорода, фтора количество неспаренных электронов
не увеличивается, т.к. в пределах второго
уровня нет свободных орбиталей *,
а перемещение электронов на третий квантовый
уровень требует
значительно большей энергии, чем та,
которая выделилась бы при образовании
дополнительных связей. Таким образом, при
возбуждении атома переходы электронов
на свободные орбитали возможны
только в пределах одного энергетического
уровня .
2) Ковалентные связи могут образовываться за счет спаренных электронов, имеющихся на внешнем электронном слое атома. В этом случае второй атом должен иметь на внешнем слое свободную орбиталь. Атом, предоставляющий свою электронную пару для образования ковалентной связи *, называется донором, а атом, предоставляющий пустую орбиталь, – акцептором. Ковалентная связь, образованная таким способом, называется донорно-акцепторной связью. В катионе аммония эта связь по своим свойствам абсолютно идентична трем другим ковалентным связям, образованным первым способом, поэтому термин “донорно-акцепторная” обозначает не какой-то особый вид связи, а лишь способ ее образования.
Ковалентная связь (от латинского «со» совместно и «vales» имеющий силу) осуществляется за счет электронной пары, принадлежащей обоим атомам. Образуется между атомами неметаллов.
Электроотрицательность неметаллов довольно велика, так что при химическом взаимодействии двух атомов неметаллов полный перенос электронов от одного к другому (как в случае ) невозможен. В этом случае для выполнения необходимо объединение электронов.
В этом случае для выполнения необходимо объединение электронов.
В качестве примера обсудим взаимодействие атомов водорода и хлора:
H 1s 1 — один электрон
Cl 1s 2 2s 2 2 p 6 3 s 2 3 p 5 — семь электронов на внешнем уровне
Каждому из двух атомов недостает по одному электрону для того, чтобы иметь завершенную внешнюю электронную оболочку. И каждый из атомов выделяет „в общее пользование” по одному электрону. Тем самым правило октета оказывается выполненным. Лучше всего изображать это с помощью формул Льюиса:
Образование ковалентной связи
Обобществленные электроны принадлежат теперь обоим атомам. Атом водорода имеет два электрона (свой собственный и обобществленный электрон атома хлора), а атом хлора — восемь электронов (свои плюс обобществленный электрон атома водорода). Эти два обобществленных электрона образуют ковалентную связь между атомами водорода и хлора. Образовавшаяся при связывании двух атомов частица называется молекулой.
Неполярная ковалентная связь
Ковалентная связь может образоваться и между двумя одинаковыми атомами. Например:
Эта схема объясняет, почему водород и хлор существуют в виде двухатомных молекул. Благодаря спариванию и обобществлению двух электронов удается выполнить правило октета для обоих атомов.
Помимо одинарных связей может образовываться двойная или тройная ковалентная связь, как, например, в молекулах кислорода О 2 или азота N 2 . Атомы азота имеют по пять валентных электронов, следовательно, для завершения оболочки требуется еще по три электрона. Это достигается обобществлением трех пар электронов, как показано ниже:
Ковалентные соединения — обычно газы, жидкости или сравнительно низкоплавкие твердые вещества. Одним из редких исключений является алмаз, который плавится выше 3 500 °С. Это объясняется строением алмаза, который представляет собой сплошную решетку ковалентно связанных атомов углерода, а не совокупность отдельных молекул. Фактически любой кристалл алмаза, независимо от его размера, представляет собой одну огромную молекулу.
Фактически любой кристалл алмаза, независимо от его размера, представляет собой одну огромную молекулу.
Ковалентная связь возникает при объединении электронов двух атомов неметаллов. Возникшая при этом структура называется молекулой.
Полярная ковалентная связь
В большинстве случаев два ковалентно связанных атома имеют разную электроотрицательность и обобществленные электроны не принадлежат двум атомам в равной степени. Большую часть времени они находятся ближе к одному атому, чем к другому. В молекуле хлороводорода, например, электроны, образующие ковалентную связь, располагаются ближе к атому хлора, поскольку его электроотрицательность выше, чем у водорода. Однако разница в способности притягивать электроны не столь велика, чтобы произошел полный перенос электрона с атома водорода на атом хлора. Поэтому связь между атомами водорода и хлора можно рассматривать как нечто среднее между ионной связью (полный перенос электрона) и неполярной ковалентной связью (симметричное расположение пары электронов между двумя атомами). Частичный заряд на атомах обозначается греческой буквой δ. Такая связь называется полярной ковалентной связью, а о молекуле хлороводорода говорят, что она полярна, т. е. имеет положительно заряженный конец (атом водорода) и отрицательно заряженный конец (атом хлора).
Частичный заряд на атомах обозначается греческой буквой δ. Такая связь называется полярной ковалентной связью, а о молекуле хлороводорода говорят, что она полярна, т. е. имеет положительно заряженный конец (атом водорода) и отрицательно заряженный конец (атом хлора).
В таблице ниже перечислены основные типы связей и примеры веществ:
Обменный и донорно-акцепторный механизм образования ковалентной связи
1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару.
2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.
Ни для кого не секрет, что химия — наука довольно сложная и к тому же разнообразная. Множество различных реакций, реагентов, химикатов и прочих сложных и непонятных терминов — все они взаимодействуют друг с другом. Но главное, что с химией мы имеем дело каждый день, неважно, слушаем ли мы учителя на уроке и усваиваем новый материал или же завариваем чай, который в целом тоже представляет собой химический процесс.
Можно сделать вывод, что химию знать просто необходимо , разбираться в ней и знать, как устроен наш мир или какие-то отдельные его части — интересно, и, более того, полезно.
Сейчас нам предстоит разобраться с таким термином, как ковалентная связь, которая, кстати говоря, может быть как полярной, так и неполярной. Кстати говоря, само слово «ковалентная», образуется от латинского «co» — совместно и «vales» — имеющий силу.
Появления термина
Начнём с того, что сам термин «ковалентная» впервые ввёл в 1919 году Ирвинг Ленгмюр — лауреат Нобелевской премии. Понятие «ковалентной» предполагает химическую связь, при которой оба атома обладают электронами, что называется совместным обладанием. Таким образом, она, к примеру, отличается от металлической, в которой электроны свободны, или же от ионной, где и вовсе один отдаёт электроны другому. Нужно заметить, что образуется она между неметаллами.
Исходя из вышесказанного, можно сделать небольшой вывод о том, что из себя представляет этот процесс. Она возникает между атомами за счёт образования общих электронных пар, причём пары эти возникают на внешних и предвнешних подуровнях электронов.
Она возникает между атомами за счёт образования общих электронных пар, причём пары эти возникают на внешних и предвнешних подуровнях электронов.
Примеры, вещества с полярной:
Виды ковалентной связи
Также различаются два вида — это полярная, и, соответственно, неполярная связи. Особенности каждой из них мы разберём отдельно.
Ковалентная полярная — образование
Что из себя представляет термин «полярная»?
Обычно происходит так, что два атома имеют разную электроотрицательность, следовательно, общие электроны не принадлежат им в равной степени, а находятся они всегда ближе к одному, чем к другому. К примеру, молекула хлороводорода, в ней электроны ковалентной связи располагаются ближе к атому хлора, так как его электроотрицательность выше чем у водорода. Однако, на самом деле, разница в притяжении электронов невелика настолько, чтобы произошёл полный перенос электрона от водорода к хлору.
В итоге при полярной электронная плотность смещается к более электроотрицательному, на нём же возникает частичный отрицательный заряд. В свою очередь, у того ядра, чья электроотрицательность ниже, возникает, соответственно, частичный положительный заряд.
В свою очередь, у того ядра, чья электроотрицательность ниже, возникает, соответственно, частичный положительный заряд.
Делаем вывод: полярная возникает между различными неметаллами, которые отличаются по значению электроотрицательности, а электроны располагаются ближе к ядру с большей электроотрицательностью.
Электроотрицательность – способность одних атомов притягивать к себе электроны других, тем самым образуя химическую реакцию.
Примеры ковалентной полярной , вещества с ковалентной полярной связью:
Формула вещества с ковалентной полярной связью
Ковалентная неполярная, разница между полярной и неполярной
И наконец, неполярная, скоро мы узнаем что же она из себя представляет.
Основное отличие неполярной от полярной — это симметрия. Если в случае с полярной электроны располагались ближе к одному атому, то при неполярной связи, электроны располагаются симметрично, то есть в равной степени по отношению к обоим.
Примечательно, что неполярная возникает между атомами неметалла одного химического элемента.
К примеру, вещества с неполярной ковалентной связью:
Также совокупность электронов зачастую называют просто электронным облаком, исходя из этого делаем вывод, что электронное облако связи, которое образует общая пара электронов, распределяется в пространстве симметрично, или же равномерно по отношению к ядрам обоих.
Примеры ковалентной неполярной связи и схема образования ковалентной неполярной связи
Но Также полезно знать, как же различать ковалентную полярную и неполярную.
Ковалентная неполярная — это всегда атомы одного и того же вещества. h3. CL2.
На этом статья подошла к концу, теперь мы знаем, что из себя представляет этот химический процесс, умеем определять его и его разновидности, знаем формулы образования веществ, и в целом чуточку больше о нашем сложном мире, успехов в химии и образовании новых формул.
Ковалентная, ионная и металлическая – три основных типа химических связей.
Познакомимся подробнее с ковалентной химической связью . Рассмотрим механизм ее возникновения. В качестве примера возьмем образование молекулы водорода:
Рассмотрим механизм ее возникновения. В качестве примера возьмем образование молекулы водорода:
Сферически симметричное облако, образованное 1s-электроном, окружает ядро свободного атома водорода. Когда атомы сближаются до определенного расстояния, происходит частичное перекрывание их орбиталей (см. рис.), в результате чего появляется молекулярное двухэлектронное облако между центрами обоих ядер, которое обладает максимальной электронной плотностью в пространстве между ядрами. При увеличении же плотности отрицательного заряда происходит сильное возрастание сил притяжения между молекулярным облаком и ядрами.
Итак, мы видим, что ковалентная связь образуется путем перекрывания электронных облаков атомов, которое сопровождается выделением энергии. Если расстояние между ядрами у сблизившихся до касания атомов составляет 0,106 нм, тогда после перекрывания электронных облаков оно составит 0,074 нм. Чем больше перекрывание электронных орбиталей, тем прочнее химическая связь.
Ковалентной называется химическая связь, осуществляемая электронными парами .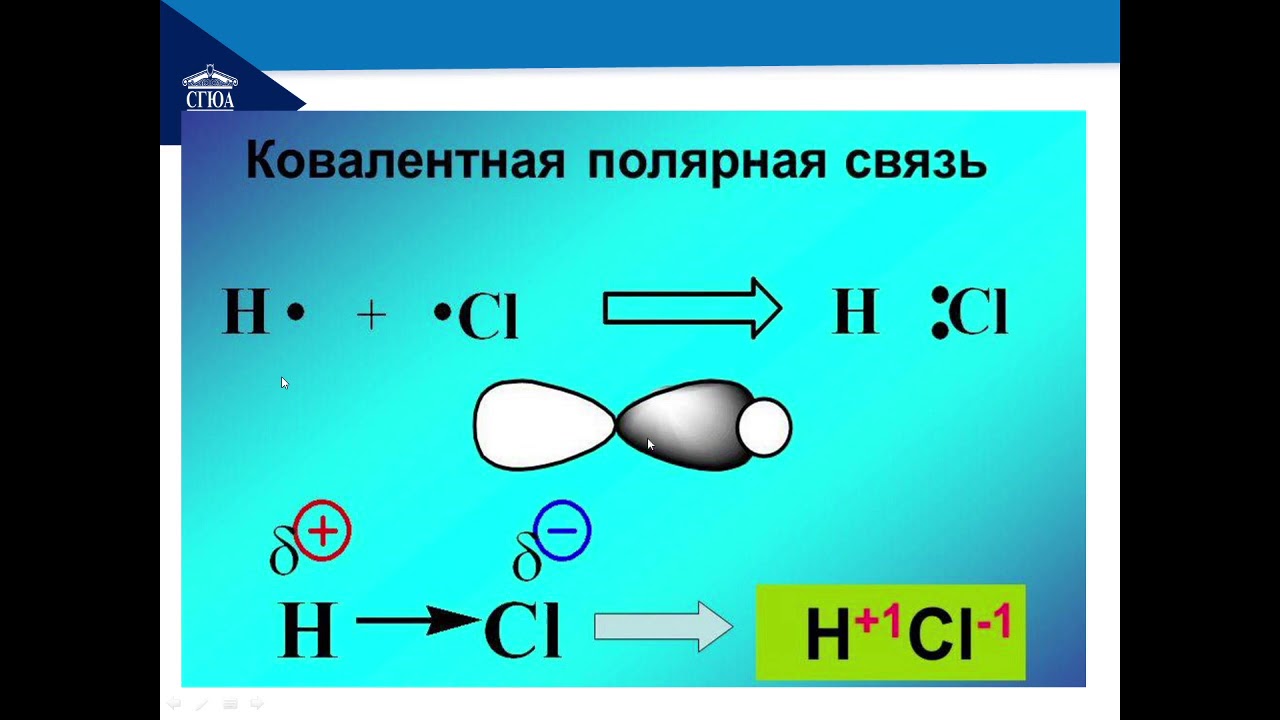 Соединения с ковалентной связью называют гомеополярными или атомными .
Соединения с ковалентной связью называют гомеополярными или атомными .
Существуют две разновидности ковалентной связи : полярная и неполярная .
При неполярной ковалентной связи образованное общей парой электронов электронное облако распределяется симметрично относительно ядер обоих атомов. В качестве примера могут выступать двухатомне молекулы, которые состоят из одного элемента: Cl 2 , N 2 , H 2 , F 2 , O 2 и другие, электронная пара в которых в принадлежит обоим атомам в одинаковой мере.
При полярной ковалентной связи электронное облако смещено к атому с большей относительной электроотрицательностью. Например молекулы летучих неорганических соединений таких как H 2 S, HCl, H 2 O и другие.
Образование молекулы HCl можно представить в следущем виде:
Т.к. относительная электроотрицательность атома хлора (2,83) больше, чем атома водорода (2,1), электронная пара смещается к атому хлора.
Помимо обменного механизма образования ковалентной связи – за счет перекрывания, также существует донорно-акцепторный механизм ее образования. Это механизм, при котором образование ковалентной связи происходит за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора). Давайте рассмотрим пример механизма образования аммония NH 4 + .В молекуле аммиака у атома азота есть двухэлектронное облако:
Ион водорода имеет свободную 1s-орбиталь, обозначим это как .
В процессе образования иона аммония двухэлектронное облако азота становится общим для атомов азота и водорода, это значит оно преобразуется в молекулярное электронное облако. Следовательно, появляется четвертая ковалентная связь. Можно представить процесс образования аммония такой схемой:
Заряд иона водорода рассредоточен между всеми атомами, а двухэлектронное облако, которое принадлежит азоту, становится общим с водородом.
Остались вопросы? Не знаете, как сделать домашнее задание?
Чтобы получить помощь репетитора – зарегистрируйтесь .
Первый урок – бесплатно!
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Сам термин «ковалентная связь» происходит от двух латинских слов: «со» — совместно и «vales» — имеющий силу, так как это связь происходящая за счет пары электронов, принадлежащей одновременно обоим (или говоря более простым языком, связь между атомами за счет пары электронов, являющихся общими для них). Образование ковалентной связи происходит исключительно среди атомов неметаллов, причем появляться она может как в атомах молекул, так и кристаллов.
Впервые ковалентная была обнаружена в далеком 1916 году американских химиком Дж. Льюисом и некоторое время существовала в виде гипотезы, идеи, лишь затем была подтверждена экспериментально. Что же выяснили химики по ее поводу? А то, что электроотрицательность неметаллов бывает довольно большой и при химическом взаимодействии двух атомов перенос электронов от одного к другому может быть невозможным, именно в этот момент и происходит объединение электронов обоих атомов, между ними возникает самая настоящая ковалентная связь атомов.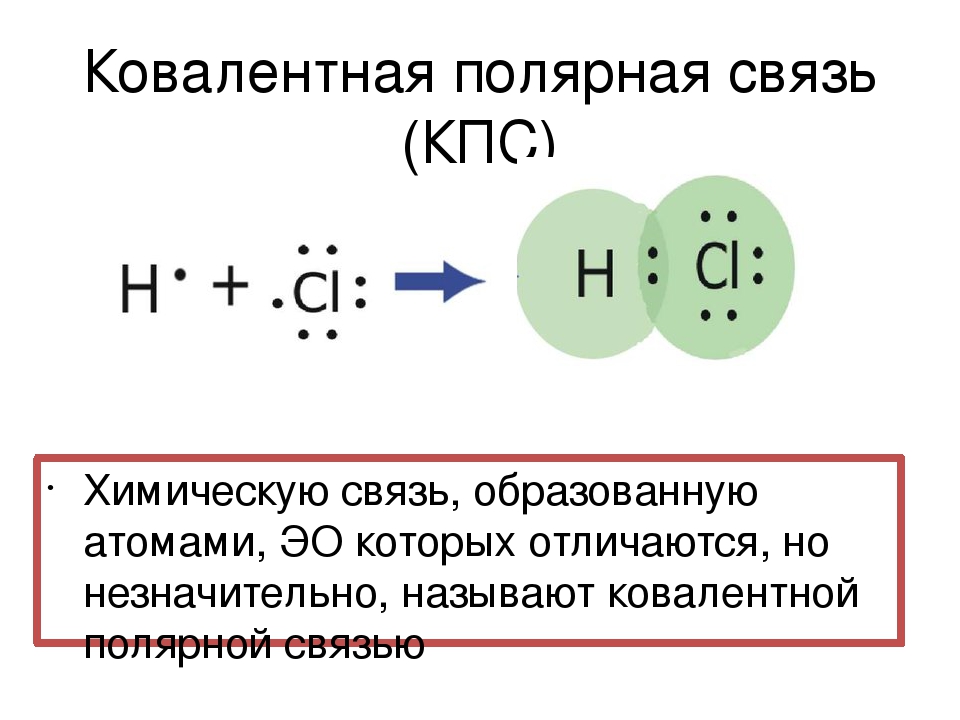
Типы ковалентной связи
В целом есть два типа ковалентной связи:
- обменный,
- донорно-акцептный.
При обменном типе ковалентной связи между атомами каждый из соединяющихся атомов представляет на образование электронной связи по одному неспареному электрону. При этом электроны эти должны иметь противоположные заряды (спины).
Примером подобной ковалентной связи могут быть связи происходящие молекуле водорода. Когда атомы водорода сближаются, в их электронные облака проникают друг в друга, в науке это называется перекрыванием электронных облаков. Как следствие, электронная плотность между ядрами увеличивается, сами они притягиваются друг к другу, а энергия системы уменьшается. Тем не менее, при слишком близком приближении ядра начинают отталкиваться, и таким образом возникает некое оптимально расстояние между ними.
Более наглядно это показано на картинке.
Что же касается донорно-акцепторного типа ковалентной связи, то он происходит когда одна частица, в данном случае донор, представляет для связи свою электронную пару, а вторая, акцептор — свободную орбиталь.
Также говоря о типах ковалентной связи можно выделить неполярную и полярную ковалентные связи, более подробно о них мы напишем ниже.
Ковалентная неполярная связь
Определение ковалентной неполярной связи просто, это связь, которая образуется между двумя одинаковыми атомами. Пример образование неполярной ковалентной связи смотрите ниже на схеме.
Схема ковалентной неполярной связи.
В молекулах при ковалентной неполярной связи общие электронные пары располагаются на равных расстояниях от ядер атомов. Например, в молекуле (на схеме выше), атомы приобретают восьми электронную конфигурацию, при этом они имеют четыре общие пары электронов.
Веществами с ковалентной неполярной связью обычно являются газы, жидкости или сравнительно низкоплавные тверды вещества.
Ковалентная полярная связь
Теперь же ответим на вопрос какая связь ковалентная полярная. Итак, ковалентная полярная связь образуется, когда ковалентно связанные атомы имеют разную электроотрицательность, и общественные электроны не принадлежат в равной степени двум атомам.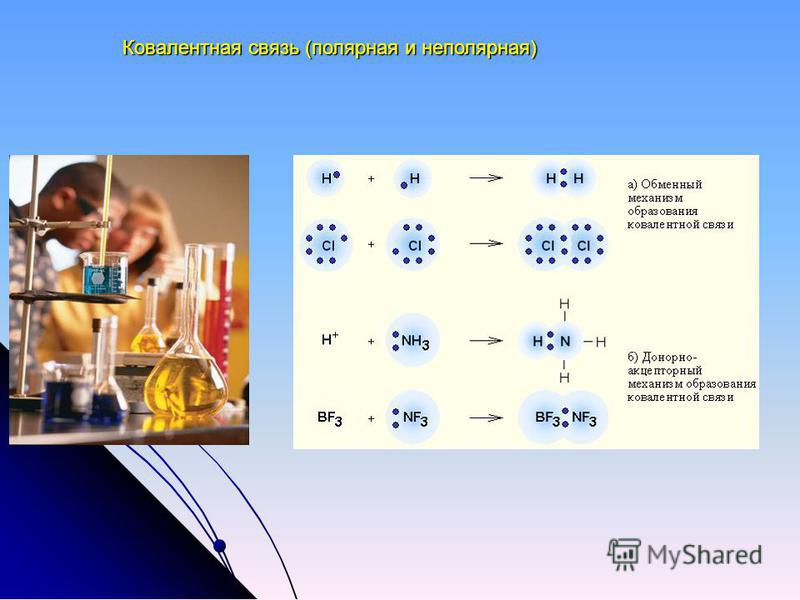 Большую часть времени общественные электроны находятся ближе к одному атому, чем к другому. Примером ковалентной полярной связи могут служить связи, возникающие в молекуле хлороводорода, там общественные электроны, ответственные за образование ковалентной связи располагаются ближе к атому хлора, нежели водорода. А все дело в том, что электроотрицательность у хлора больше чем у водорода.
Большую часть времени общественные электроны находятся ближе к одному атому, чем к другому. Примером ковалентной полярной связи могут служить связи, возникающие в молекуле хлороводорода, там общественные электроны, ответственные за образование ковалентной связи располагаются ближе к атому хлора, нежели водорода. А все дело в том, что электроотрицательность у хлора больше чем у водорода.
Так выглядит схема ковалентной полярной связи.
Ярким примером вещества с полярной ковалентной связью является вода.
Как определить ковалентную связь
Что же, теперь вы знаете ответ на вопрос как определить ковалентную полярную связь, и как неполярную, для этого достаточно знать свойства и химическую формулу молекул, если эта молекула состоит из атомов разных элементов, то связь будет полярной, если из одного элемента, то неполярной. Также важно помнить, что ковалентные связи в целом могут возникать только среди неметаллов, это обусловлено самим механизмом ковалентных связей, описанным выше.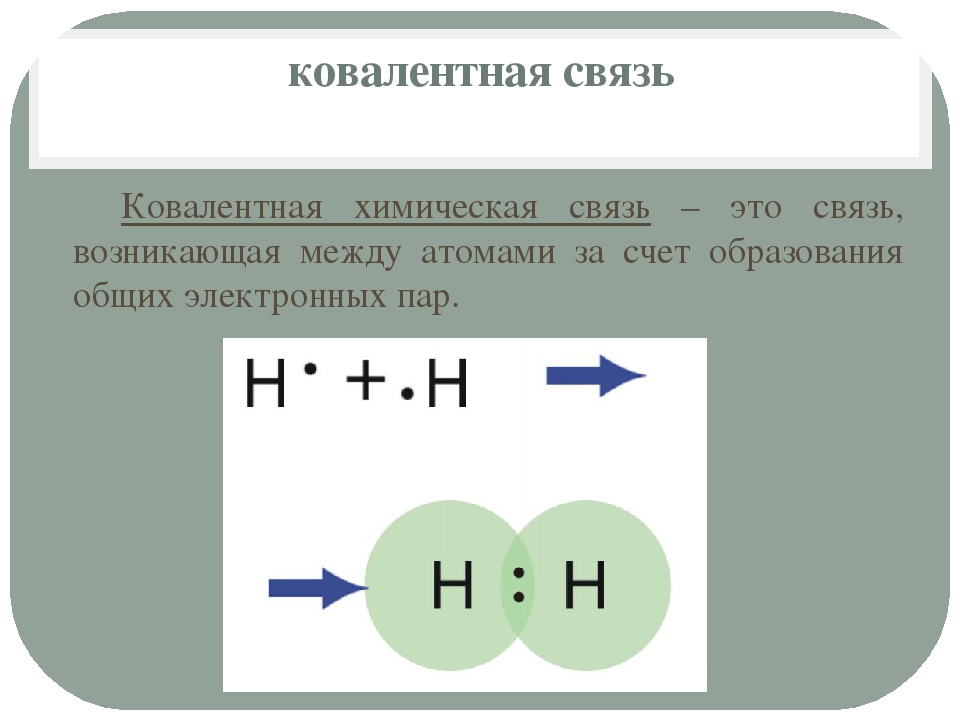
Ковалентная связь, видео
И в завершение видео лекция о теме нашей статьи, ковалентной связи.
Ковалентная связь полярная и: 404
Ковалентные неполярные и полярные связи — урок. Химия, 8–9 класс.
Общие электронные пары, образующиеся в простых веществах h4,O2,Cl2,F2,N2, в одинаковой степени принадлежат обоим атомам. Такая ковалентная связь называется неполярной.
Ковалентная неполярная связь соединяет атомы в простых веществах-неметаллах.
Если ковалентная связь образуется между разными атомами, то общая электронная пара смещается к тому из них, который имеет более высокую электроотрицательность (ЭО). Он получает частичный отрицательный заряд. Атом, имеющий меньшую ЭО, становится заряжённым положительно. В этом случае образуется полярная ковалентная связь.
Ковалентная полярная связь образуется между атомами неметаллов в сложных веществах.
Рассмотрим образование ковалентных связей в сложных веществах.
1. Образование молекулы хлороводорода.
У атома водорода на внешнем уровне — один электрон. У хлора на внешнем уровне — семь электронов, один из которых неспаренный.
Образуется одна общая электронная пара, которая смещена к атому хлора. В результате
появляются частичные заряды: на атоме хлора — отрицательный, а на атоме водорода — положительный. Сдвиг электронной плотности принято обозначать греческой буквой дельта δ:
Структурная формула хлороводорода H−Cl
Подобным образом соединяются атомы в молекулах других галогеноводородов:
H−F,H−Br,H−I.
2. Образование молекулы воды.
На внешнем уровне атома кислорода — шесть электронов, два из которых неспаренные.
Атом кислорода образует две общие электронные пары с двумя атомами водорода.
Электронная плотность этих общих пар сдвинута к более электроотрицательному кислороду. Атом кислорода имеет отрицательный заряд, а атомы водорода — положительный.
Сходное строение имеет молекула сероводорода. Структурные формулы воды и сероводорода:
H−OH−S||HH
3.Образование молекулы аммиака.
У атома азота — пять внешних электронов, три из которых неспаренные.
Атом азота присоединяет к себе три атома водорода.
Азот — более электроотрицательный элемент, поэтому на его атоме будет отрицательный заряд, а на атомах водорода — положительные заряды.
Структурная формула аммиака:
H−N−H|H
Для того чтобы определить знаки частичных зарядов на атомах в веществе, надо сравнить ЭО неметаллов.
Пример:
определим частичные заряды атомов в соединении CCl4.
Вспомним положение углерода и хлора в ряду ЭО:
По положению элементов в этом ряду видно, что более электроотрицательный элемент в этой паре — хлор. Его атом оттягивает к себе общие электронные пары от атома углерода. Значит, на атоме хлора будет частичный отрицательный заряд, а на атоме углерода — частичный положительный:
Его атом оттягивает к себе общие электронные пары от атома углерода. Значит, на атоме хлора будет частичный отрицательный заряд, а на атоме углерода — частичный положительный:
C+δCl4−δ.
Полярную ковалентную связь часто изображают стрелкой: H→Cl. Стрелка показывает направление смещения общей электронной плотности.
Ковалентная связь. Полярная и неполярная ковалентная связь : Farmf
Ковалентная связь.
Глава 4. Химическая связь и строение молекул
Ковалентная связь – химическая связь, осуществляемая за счет перекрывания электронных облаков взаимодействующих атомов
4.3.1. Неполярная ковалентная связь. Механизм возникновения ковалентной связи рассмотрим на примере образования молекулы водорода.
– Образование молекулы Н2. Ядро свободного атома водорода окружено сферически симметричным электронным облаком. При сближении атомов до определенного расстояния происходит перекрывание их электронных облаков с образованием молекулярного облака, обладающего максимальной электронной плотностью в пространстве между ядрами. Если у сблизившихся до касания атомов водорода расстояние между ядрами составляет 0,106 нм, то после перекрывания (образования молекулы Н2) это расстояние сокращается до 0,074 нм (рис. 7). Увеличение плотности отрицательно заряженного электронного облака между положительно заряженными ядрами приводит к тому, что ядра как бы стягиваются этим облаком и возникает химическая связь.
При сближении атомов до определенного расстояния происходит перекрывание их электронных облаков с образованием молекулярного облака, обладающего максимальной электронной плотностью в пространстве между ядрами. Если у сблизившихся до касания атомов водорода расстояние между ядрами составляет 0,106 нм, то после перекрывания (образования молекулы Н2) это расстояние сокращается до 0,074 нм (рис. 7). Увеличение плотности отрицательно заряженного электронного облака между положительно заряженными ядрами приводит к тому, что ядра как бы стягиваются этим облаком и возникает химическая связь.
Таким образом, ковалентная связь обеспечивается силами электростатического притяжения между сосредоточенной электронной плотностью в межъядерном пространстве, возникшей в результате перекрывания электронных облаков, и положительными зарядами ядер. Ковалентная связь тем прочнее, чем вше степень перекрывания электронных облаков. В результате возникновения связи между атомами водорода каждый атом достигает электронной конфигурации инертного элемента гелия:
< Н ∙ + ∙ Н → Н : Н или Н2
– Образование молекулы хлора С12. В молекуле хлора ковалентная связь осуществляется с помощью двух общих электронов или электронной пары. Из семи валентных электронов каждый атом хлора имеет по одному неспаренному. Образование химической связи происходит за счет неспаренных электронов каждого атома. В результате образуется общая электронная пара, которая в равной мере принадлежит обоим атомам и, благодаря чему, каждый атом хлора завершает свой энергетический уровень, достигая конфигурации инертного элемента Рис. 7. Схема перекрывания электронных орбиталей аргона:
В молекуле хлора ковалентная связь осуществляется с помощью двух общих электронов или электронной пары. Из семи валентных электронов каждый атом хлора имеет по одному неспаренному. Образование химической связи происходит за счет неспаренных электронов каждого атома. В результате образуется общая электронная пара, которая в равной мере принадлежит обоим атомам и, благодаря чему, каждый атом хлора завершает свой энергетический уровень, достигая конфигурации инертного элемента Рис. 7. Схема перекрывания электронных орбиталей аргона:
при образовании молекулы водорода.
Или, с точки зрения строения атома, это можно представить так:
электронная формула атома хлора Is22s22p63s23Sp5
При образовании молекулы происходит перекрывание р-орбиталей (рис. 8).
с точки зрения строения атома электронная формула атома азота выглядит так:
В молекуле азота связь осуществляется за счет перекрывания трех р-облаков, расположенных по оси х, у, z. Между атомами азота образуется одна сигма (σ) -связь и две пи – связи (π).
Между атомами азота образуется одна сигма (σ) -связь и две пи – связи (π).
Связь, образованная при перекрывании электронных облаков вдоль линии, соединяющей центры взаимодействующих атомов, называется сигма (σ) – связью. Связь, образованная за счет перекрывания орбиталей по обе стороны от линии, соединяющей центры – атомов, называется пи – связью.
Наглядно это представлено на рисунке 9.
Рис. 9.Схема образования химической связи в молекуле азота.
Мы рассмотрели неполярную или гомеополярную ковалентную связь. При неполярной связи вероятность присутствия электронной плотности между ядрами одинакова. Центры тяжести положительных и отрицательных зарядов совпадают. Центром положительного заряда считают середину расстояния между ядрами. В молекулах простых газообразных веществ Н2, CI2, O2, N2 – в газообразной фазе наблюдается гомеополярная (неполярная) связь.
Вещества с неполярной ковалентной связью обладают низкими температурами кипения и плавления, в воде не диссоциируют, не проводят электрический ток.
4.3.2. Полярная ковалентная связь. Образование молекулы из атомов различных элементов происходит при помощи гетерополярной (полярной) ковалентной связи. Простейший случай гетерополярной связи — это образование молекулы хлорводорода. Образование молекулы НС1 можно представить схемой:
Здесь происходит перекрывание s-облака атома водорода и р-облака атома хлора (рис. 10).
Рис. 10. Схема образования химической связи в молекуле хлороводорода.
Но в данном случае хлор обладает большей относительной электроотрицательностью. Поэтому происходит оттягивание электронной плотности к атому хлора. В молекуле возникает положительный и отрицательный полюсы. Химическая связь, в которой электронная плотность смещена к одному из партнеров, называется гетерополярной или полярной ковалентной связью. Критерием способности атома притягивать электрон может служить электроотрицательность. Чем выше ЭО у атома, тем более вероятно смещение электронной пары в сторону ядра данного атома. Поэтому разность электроотрицательности атомов характеризует полярность связи.
Поэтому разность электроотрицательности атомов характеризует полярность связи.
Вследствие смещения электронной пары к одному из ядер повышается плотность отрицательного заряда у данного атома и соответственно атом получает заряд, называемый эффективным зарядом атома δ -. У второго атома повышается плотность положительного заряда δ +. Вследствие этого возникает диполь, представляющий собой электрически нейтральную систему с двумя одинаковыми по величине положительным и отрицательным зарядами, находящимися на определенном расстоянии (длина диполя) lд друг от друга. Мерой полярности связи служит электрический момент диполя равный произведению эффективного заряда на длину диполя lд
μСВ = δ lд
Электрический момент диполя имеет единицу измерения кулон на
метр (Кл∙м). В качестве единицы измерения используют также внесистемную единицу измерения дебай D, равную 3,3-10–30 Кл∙м
Полярную ковалентную связь с δ, приближающемуся к 1, можно считать ионной связью. Однако, даже у ионных соединений δ ниже единицы. Поэтому любая ионная связь имеет определенную долю ковалентности.
Однако, даже у ионных соединений δ ниже единицы. Поэтому любая ионная связь имеет определенную долю ковалентности.
Химическая связь в большинстве химических соединений сочетает свойства ковалентной и ионной связи. Поэтому ее можно считать ковалентной с определенной долей ионности. Степень ионности характеризуется эффективным зарядом атомов и возрастает с увеличением разности электроотрицательностей.
Рассмотренный выше механизм образования ковалентной связи (неполярной и полярной) называется обменным. Возможен и другой механизм образования ковалентной связи — донорно-акцепторной. В этом случае химическая связь возникает за счет двухэлектронного облака одного атома и свободной орбитали другого. В качестве примера рассмотрим механизм образования иона аммония NH+:
NH3 + H+ → [NH4]+
В молекуле аммиака азот имеет неподеленную пару электронов (двухэлектронное облако). У иона водорода свободна ls-орбиталь. При сближении двухэлектронное облако азота становится общим как для атома азота, так и для атома водорода, т. е. оно превратилось в молекулярное электронное облако. А значит, возникла четвертая ковалентная связь. Процесс образования иона аммония можно представить схемой:
При сближении двухэлектронное облако азота становится общим как для атома азота, так и для атома водорода, т. е. оно превратилось в молекулярное электронное облако. А значит, возникла четвертая ковалентная связь. Процесс образования иона аммония можно представить схемой:
Атом, предоставляющий неподеленную электронную пару, называется донором, а атом, принимающий ее (т. е. предоставляющий свободную орбиталь), называется акцептором. Механизм образования ковалентной связи за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным.
Таким образом, в катионе аммония четыре равноценные ковалентные связи: три образованные по обменному механизму и одна – по донорно-акцепторному.
Вещества с полярной ковалентной связью занимают по свойствам промежуточное положение между веществами с ионной связью и неполярной ковалентной связью. Ковалентному типу связи характерны атомные и молекулярные кристаллические решетки.
Провести границу между ионной и полярной ковалентными связями не всегда возможно. В соединениях, образованных тремя и более элементами, между атомами могут быть различные типы химической связи.
4.3.3. Свойства ковалентной связи. Ковалентная связь обычно характеризуется длиной связи, энергией связи, насыщаемостью и направленностью.
Длиной связи называется межъядерное расстояние между химически связанными атомами, когда силы притяжения уравновешены силами отталкивания и энергия системы минимальна. Химическая связь тем прочнее, чем меньше ее длина. Однако количественной мерой прочности связи является ее энергия.
Энергия связи равна той энергии, которая необходима для разрыва имеющихся в молекуле связей. Обычно она измеряется в килоджоулях, отнесенных к 1 моль вещества, т. е. к 6,02 • 1023 связям. Так, согласно опытным данным, длины связи молекул водорода, хлора и азота соответственно составляют 0,074, 0,198 и 0,109 нм (нанометра), а энергии связи соответственно равны 436, 242 и 946 кДж/моль.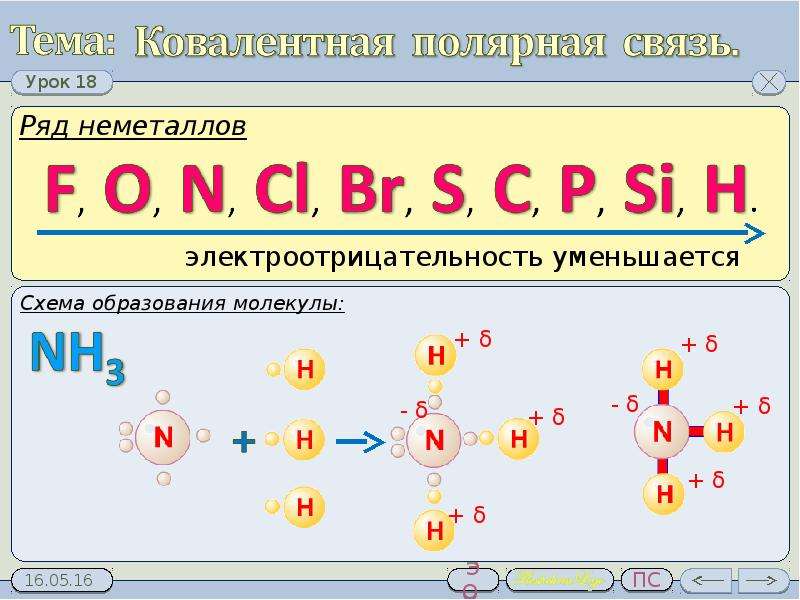 С увеличением кратности связи энергия связи увеличивается, а длина уменьшается.
С увеличением кратности связи энергия связи увеличивается, а длина уменьшается.
Насыщаемость — это полное использование атомом валентных орбиталей. В результате он становится неспособным к установлению дополнительных связей. Например, нельзя присоединить еще атом водорода к молекулам Н2 или СН4. В этих молекулах связи насыщены. Благодаря насыщаемости связей молекулы имеют определенный состав: Н2, Н2О, НСl и т. д.
Направленность ковалентной связи обусловливает пространственную структуру молекул, т. е. их геометрию (форму). Ковалентная связь возникает в направлении максимального перекрывания электронных облаков (орбиталей) вдоль линии соединения атомов. При образовании молекулы НС1 происходит перекрывание s-орбитали атома водорода с р-орбиталью атома хлора. Молекула имеет линейную форму. Химические связи в молекуле воды направлены под углом 104,5°.
Ковалентные связи, образуемые многовалентными атомами, всегда имеют пространственную направленность. Углы между связями называются валентными.
Углы между связями называются валентными.
Виды химической связи: ковалентная (полярная и неполярная), ионная
Билет № 6
1. Виды химической связи: ковалентная (полярная и неполярная), ионная; их сходство и различие. Типы кристаллических решеток. Примеры веществ с различными типами решеток
Ковалентной связью называется химическая связь между двумя атомами за счет образования общей электронной пары. Ковалентная связь может быть неполярной — между двумя атомами с одинаковой электроотрицательностью, т. е. в простых веществах, и полярной — между атомами, электроотрицательность которых различается, т. е. в сложных веществах.
Рассмотреть образование ковалентной неполярной связи удобно на примере молекулы водорода, образующейся при соединении двух атомов водорода, каждый из которых имеет по одному неспаренному электрону:
H• + •H → H : H
При этом внешняя электронная оболочка получает недостающий электрон, становится завершенной.
Такое состояние характеризуется меньшей энергией, более устойчиво. Вот почему для разрыва ковалентной связи требуется затратить
энергию (такое же количество энергии выделяется при ее образовании).
В структурных формулах ковалентная связь изображается черточкой, тогда молекула водорода будет выглядеть так: H–H
Еще раз обращаем Ваше внимание, что ковалентной называется двухэлектронная двухцентровая связь, когда два
электрона находятся на общей орбитали двух атомов. Поэтому к ней, строго говоря, не относятся случаи, когда электроны находятся на орбиталях трех или более атомов или когда общая связь образована более чем двумя электронами (в 10–11 классах будет изучаться бензол, в молекуле которого 6 электронов образуют одну общую связь).
Ковалентная полярная связь образуется в молекуле хлороводорода:
.. ..
H· + ·Cl: → H :Cl:
·· ··
Хлор как более электроотрицательный элемент смещает к себе общую электронную пару, в результате на нем образуется частичный отрицательный заряд, а на водороде — частичный положительный:
Hδ+—Clδ−
Ковалентная связь может возникать не только при объединении двух орбиталей, содержащих по одному неспаренному электрону. Один атом может предоставить электронную пару, а второй — свободную орбиталь. Такая ковалентная связь называется донорно-акцепторной.
Один атом может предоставить электронную пару, а второй — свободную орбиталь. Такая ковалентная связь называется донорно-акцепторной.
Например, в ионе аммония протон присоединяется к молекуле аммиака за счет образования донорно-акцепторной связи. Азот выступает донором, а протон (водород) — акцептором электронной пары:
H+ + :NH3 → NH4+
Хотя по способу образования донорно-акцепторная связь отличается от остальных, но по свойствам, в том числе по длине связи, все четыре связи одинаковы.
Чтобы подчеркнуть способ образования, донорно-акцепторную связь могут обозначать в структурных формулах стрелкой:
H
|
[H — N → H ]+
|
H
Стрелку используют и чтобы изобразить смещение общей электронной пары в полярной связи (H→Cl), поэтому эти два случая не следует
путать.
Ионную связь можно рассматривать как крайний случай ковалентной полярной связи, когда электроны практически полностью переходят от одних атомов к другим с образованием ионов.
Таким образом, ионная связь образуется за счет сил электростатического притяжения между ионами (притягиваются противоположные заряды).
Примером ионной связи будет хлорид натрия:
..
Na+ [:Cl:]−
··
Ионная связь характерна для соединений элементов, электроотрицательности которых различаются очень сильно, например щелочных металлов с галогенами.
Сходство с ковалентной связью заключается в том, что сложно провести резкую грань между ковалентной полярной и ионной связью, мнения разных авторов на этот счет могут различаться.
Различие ионной и ковалентной связи в том, что ионная сильнее поляризована, вплоть до полного перехода электронной пары к более электроотрицательному элементу.
Типы кристаллических решеток
- Ионная — в узлах кристаллической решетки расположены положительные и отрицательные ионы. Характерна для веществ с ионной связью: соединений галогенов с щелочными металлами (NaCl), щелочей (NaOH) и солей кислородсодержащих кислот (Na2SO4).

- Атомная — в узлах кристаллической решетки атомы, связанные ковалентными связями: алмаз, кремний.
Вещества с ионными и атомными кристаллическими решетками обладают высокими твердостью и температурой плавления.
- Молекулярная кристаллическая решетка образована молекулами, связанными слабыми межмолекулярными взаимодействиями, поэтому такие вещества непрочные, легкоплавкие (лёд, сера), зачастую возгоняются, т. е. при нагревании испаряются, минуя жидкую фазу, как сухой лёд CO2, йод I2
- Металлическая кристаллическая решетка характерна для металлов, например, Fe
2. Опыт. Получение и собирание аммиака
Для получения и собирания аммиака в лаборатории насыпаем в пробирку хлорид или сульфат аммония, смешанный с известью Ca(OH)2, затыкаем пробкой с газоотводной трубкой. Трубку вставляем в колбу, перевернутую вверх дном, — аммиак легче воздуха. Отверстие
колбы закрываем куском ваты.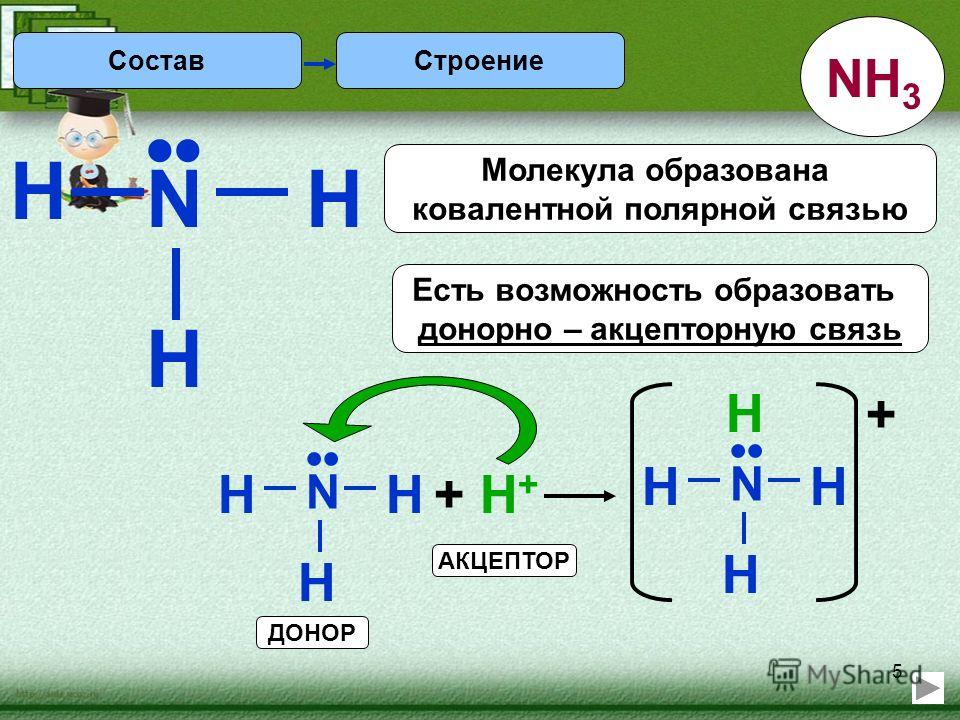
Осторожно нагреваем пробирку на спиртовке. Уравнение реакции:
2NH4Cl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3↑
Аммиак обнаруживаем по характерному резкому запаху (нюхать осторожно!) или поднеся к трубке бумажку, смоченную раствором фенолфталеина (ф-ф). Бумажка розовеет вследствие образования гидроксид-ионов:
NH3 + HOH NH4+ + OH−
автор: Владимир Соколов
Полярная и неполярная связь. Свойства ковалентной связи
☰
Если молекула образована одинаковыми атомами (O2, H2, Cl2), то между ними образуется неполярная ковалентная связь. В таком случае валентные электроны притягиваются атомами с равной силой, поэтому общее электронное облако расположено симметрично относительно обоих атомов. Электронная пара, образующая связь, в равной степени принадлежит обоим атомам.
Если ковалентную связь в молекуле образуют атомы разных элементов, то она будет полярной. В полярной ковалентной связи электронная пара смещена к атому с большей электроотрицательностью, то есть к тому, который сильнее притягивает электроны. Поскольку электроотрицательность у каждого химического элемента своя, то смещение в полярных связях может быть разное. Чем больше разница между электроотрицательностями, тем больше будет полярность связи. В полярной связи электронное облако смещено к тому элементу, который притягивает к себе электроны. Так в молекуле HF по сравнению с HI полярность связи больше, т. к. фтор более электроотрицательный элемент.
В полярной ковалентной связи электронная пара смещена к атому с большей электроотрицательностью, то есть к тому, который сильнее притягивает электроны. Поскольку электроотрицательность у каждого химического элемента своя, то смещение в полярных связях может быть разное. Чем больше разница между электроотрицательностями, тем больше будет полярность связи. В полярной связи электронное облако смещено к тому элементу, который притягивает к себе электроны. Так в молекуле HF по сравнению с HI полярность связи больше, т. к. фтор более электроотрицательный элемент.
В молекулах с полярными ковалентными связями из-за того, что электронное облако смещено, молекула приобретает отрицательный и положительный заряд в разных своих точках. То есть молекула становится полярной — диполем. Так происходит в молекуле воды, где электроны водорода смещаются к атому кислорода, в результате у водородов больше положительный заряд, а у кислорода отрицательный.
Небольшой отрицательный заряд (δ-) у атома, к которому смещены электроны, равен положительному заряду (δ+) на атоме, от которого оттягиваются атомы. (Если рассматривать двухатомные молекулы).
(Если рассматривать двухатомные молекулы).
Однако бывают молекулы с полярной связью, которые неполярны, т. е. не являются диполями. Так молекула углекислого газа CO2 неполярна. Хотя 4 внешних электрона углерода оттянуты по 2 к атомам кислорода, но из-за того, что углерод расположен в центре молекулы, она в целом неполярна.
Полярная ковалентная связь также характеризуется длинной связи (расстоянием между ядрами атомов). Ядра находятся друг от друга на таком расстоянии, на котором энергия молекулы минимальна. Это состояние достигается, когда электронные облака максимально перекрываются. Обычно чем больше размеры атомов, тем больше в них длина связи. Так в молекуле водорода (H2) длина связи самая маленькая.
Когда атом образует несколько полярных связей, то связи образуют определенный угол между собой — валентный угол (от 90° до 180°). Так в CO2 угол между связями равен 180°. Валентные углы определяют геометрическую форму молекулы.
|
Периодическое изменение свойств химических элементов и их соединений при увеличении заряда ядра атома объясняется тем, что периодически повторяется строение внешнего электронного слоя в атомах элементов. | ||
Ковалентная связь в химии: | ||
| ||
| ||
|
При образовании общих электронных пар происходит перекрывание электронных орбиталей. | ||
| ||
| ||
| ||
| ||
Ковалентная неполярная связь: | ||
|
| ||
Ковалентная полярная связь: | ||
| ||
| ||
Характеристики ковалентной связи: | ||
| ||
Механизмы образования ковалентной связи: | ||
| ||
| ||
Ионная связь в химии: | ||
| ||
| ||
| ||
| ||
Степень окисления. Окисление. Восстановление. Степень окисления : | ||
| ||
| ||
Металлическая связь в химии: | ||
| ||
Водородная связь в химии: | ||
| ||
Ковалентная полярная и неполярная связи, что это такое и как различать связь
Ни для кого не секрет, что химия — наука довольно сложная и к тому же разнообразная. Множество различных реакций, реагентов, химикатов и прочих сложных и непонятных терминов — все они взаимодействуют друг с другом. Но главное, что с химией мы имеем дело каждый день, неважно, слушаем ли мы учителя на уроке и усваиваем новый материал или же завариваем чай, который в целом тоже представляет собой химический процесс.
…
Вконтакте
Google+
Мой мир
Можно сделать вывод, что химию знать просто необходимо, разбираться в ней и знать, как устроен наш мир или какие-то отдельные его части — интересно, и, более того, полезно.
Сейчас нам предстоит разобраться с таким термином, как ковалентная связь, которая, кстати говоря, может быть как полярной, так и неполярной. Кстати говоря, само слово «ковалентная», образуется от латинского «co» — совместно и «vales» — имеющий силу.
Кстати говоря, само слово «ковалентная», образуется от латинского «co» — совместно и «vales» — имеющий силу.
Это интересно: механизм образования металлической химической связи, примеры.
Появления термина
Начнём с того, что сам термин «ковалентная» впервые ввёл в 1919 году Ирвинг Ленгмюр — лауреат Нобелевской премии. Понятие «ковалентной» предполагает химическую связь, при которой оба атома обладают электронами, что называется совместным обладанием. Таким образом, она, к примеру, отличается от металлической, в которой электроны свободны, или же от ионной, где и вовсе один отдаёт электроны другому. Нужно заметить, что образуется она между неметаллами.
Исходя из вышесказанного, можно сделать небольшой вывод о том, что из себя представляет этот процесс. Она возникает между атомами за счёт образования общих электронных пар, причём пары эти возникают на внешних и предвнешних подуровнях электронов.
Примеры, вещества с полярной:
- h4.

- HCl.
- h4O.
- O2.
Это интересно: водородная связь образуется между молекулами, химический механизм.
Виды ковалентной связи
Также различаются два вида — это полярная, и, соответственно, неполярная связи. Особенности каждой из них мы разберём отдельно.
Ковалентная полярная — образование
Что из себя представляет термин «полярная»?
Обычно происходит так, что два атома имеют разную электроотрицательность, следовательно, общие электроны не принадлежат им в равной степени, а находятся они всегда ближе к одному, чем к другому. К примеру, молекула хлороводорода, в ней электроны ковалентной связи располагаются ближе к атому хлора, так как его электроотрицательность выше чем у водорода. Однако, на самом деле, разница в притяжении электронов невелика настолько, чтобы произошёл полный перенос электрона от водорода к хлору.
В итоге при полярной электронная плотность смещается к более электроотрицательному, на нём же возникает частичный отрицательный заряд. В свою очередь, у того ядра, чья электроотрицательность ниже, возникает, соответственно, частичный положительный заряд.
В свою очередь, у того ядра, чья электроотрицательность ниже, возникает, соответственно, частичный положительный заряд.
Делаем вывод: полярная возникает между различными неметаллами, которые отличаются по значению электроотрицательности, а электроны располагаются ближе к ядру с большей электроотрицательностью.
Электроотрицательность — способность одних атомов притягивать к себе электроны других, тем самым образуя химическую реакцию.
Примеры ковалентной полярной, вещества с ковалентной полярной связью:
- HCl.
- h4O.
Формула вещества с ковалентной полярной связью
Ковалентная неполярная, разница между полярной и неполярной
И наконец, неполярная, скоро мы узнаем что же она из себя представляет.
Основное отличие неполярной от полярной — это симметрия. Если в случае с полярной электроны располагались ближе к одному атому, то при неполярной связи, электроны располагаются симметрично, то есть в равной степени по отношению к обоим.
Примечательно, что неполярная возникает между атомами неметалла одного химического элемента.
К примеру, вещества с неполярной ковалентной связью:
Также совокупность электронов зачастую называют просто электронным облаком, исходя из этого делаем вывод, что электронное облако связи, которое образует общая пара электронов, распределяется в пространстве симметрично, или же равномерно по отношению к ядрам обоих.
Примеры ковалентной неполярной связи и схема образования ковалентной неполярной связи
Свойства связи
- Длина — расстояние между ядрами атомов, которые её образуют.
- Энергия — количество энергии, необходимой для её разрыва.
- Насыщаемость — способность атомов н-ное определённое количество связей.
Но Также полезно знать, как же различать ковалентную полярную и неполярную.
Ковалентная неполярная — это всегда атомы одного и того же вещества. h4. CL2.
В остальных случаях можно считать полярной.
На этом статья подошла к концу, теперь мы знаем, что из себя представляет этот химический процесс, умеем определять его и его разновидности, знаем формулы образования веществ, и в целом чуточку больше о нашем сложном мире, успехов в химии и образовании новых формул.
ковалентная (полярная и неполярная), ионная, металлическая – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
Химическая связь — электростатическое взаимодействие между электронами и ядрами, приводящее к образованию молекул.
Химическую связь образуют валентные электроны. У s- и p-элементов валентными являются электроны внешнего слоя, у d-элементов — s-электроны внешнего слоя и d-электроны предвнешнего слоя. При образовании химической связи атомы достраивают свою внешнюю электронную оболочку до оболочки соответствующего благородного газа.
Длина связи — среднее расстояние между ядрами двух химически связанных между собой атомов.
Энергия химической связи — количество энергии, необходимое для того, чтобы разорвать связь и отбросить фрагменты молекулы на бесконечно большое расстояние.
Валентный угол — угол между линиями, соединяющими химически связанные атомы.
Известны следующие основные типы химической связи: ковалентная (полярная и неполярная), ионная, металлическая и водородная.
Ковалентной называют химическую связь, образованную за счёт образования общей электронной пары.
Если связь образует пара общих электронов, в равной мере принадлежащая обоим соединяющимся атомам, то её называют ковалентной неполярной связью. Эта связь существует, например, в молекулах H2, N2, O2, F2, Cl2, Br2, I2. Ковалентная неполярная связь возникает между одинаковыми атомами, а связующее их электронное облако равномерно распределено между ними.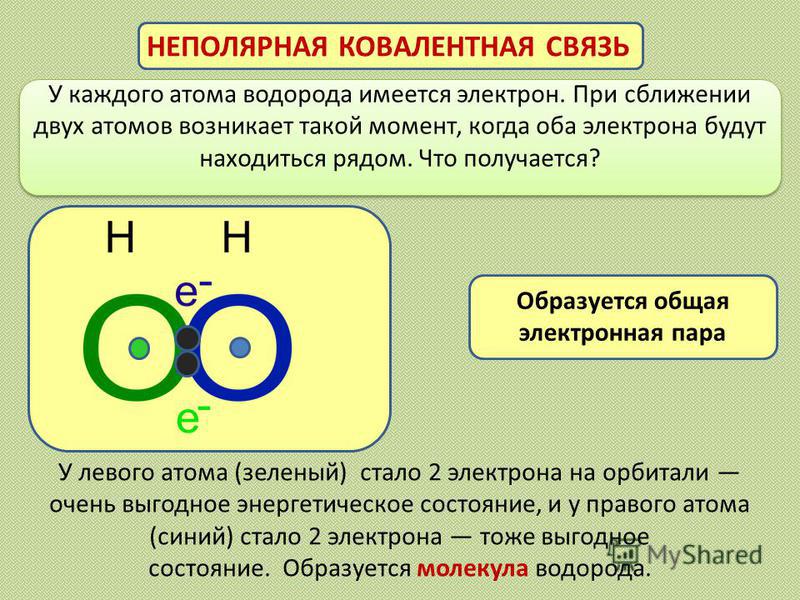
В молекулах между двумя атомами может формироваться различное число ковалентных связей (например, одна в молекулах галогенов F2, Cl2, Br2, I2, три — в молекуле азота N2).
Ковалентная полярная связь возникает между атомами с разной электроотрицательностью. Образующая её электронная пара смещается в сторону более электроотрицательного атома, но остаётся связанной с обоими ядрами. Примеры соединений с ковалентной полярной связью: HBr, HI, H2S, N2O и т. д.
Ионной называют предельный случай полярной связи, при которой электронная пара полностью переходит от одного атома к другому и связанные частицы превращаются в ионы.
Строго говоря, к соединениям с ионной связью можно отнести лишь соединения, для которых разность в электроотрицательности больше 3, но таких соединений известно очень мало. К ним относят фториды щелочных и щёлочноземельных металлов. Условно считают, что ионная связь возникает между атомами элементов, разность электроотрицательности которых составляет величину больше 1,7 по шкале Полинга. Примеры соединений с ионной связью: NaCl, KBr, Na2O. Подробнее о шкале Полинга будет рассказано в следующем уроке.
Примеры соединений с ионной связью: NaCl, KBr, Na2O. Подробнее о шкале Полинга будет рассказано в следующем уроке.
Металлической называют химическую связь между положительными ионами в кристаллах металлов, которая осуществляется в результате притяжения электронов, свободно перемещающихся по кристаллу металла.
Атомы металлов превращаются в катионы, формируя металлическую кристаллическую решётку. В этой решётке их удерживают общие для всего металла электроны (электронный газ).
Тренировочные задания
1. Ковалентной неполярной связью образовано каждое из веществ, формулы которых
1) O2, H2, N2
2) Al, O3, H2SO4
3) Na, H2, NaBr
4) H2O, O3, Li2SO4
2. Ковалентной полярной связью образовано каждое из веществ, формулы которых
1) O2, H2SO4, N2
2) H2SO4, H2O, HNO3
3) NaBr, H3PO4, HCl
4) H2O, O3, Li2SO4
3. Только ионной связью образовано каждое из веществ, формулы которых
Только ионной связью образовано каждое из веществ, формулы которых
1) CaO, H2SO4, N2
2) BaSO4, BaCl2, BaNO3
3) NaBr, K3PO4, HCl
4) RbCl, Na2S, LiF
4. Металлическая связь характерна для элементов списка
1) Ba, Rb, Se
2) Cr, Ba, Si
3) Na, P, Mg
4) Rb, Na, Cs
5. Соединениями только с ионной и только с ковалентной полярной связью являются соответственно
1) HCl и Na2S
2) Cr и Al(OH)3
3) NaBr и P2O5
4) P2O5 и CO2
6. Ионная связь образуется между элементами
1) хлором и бромом
2) бромом и серой
3) цезием и бромом
4) фосфором и кислородом
7. Ковалентная полярная связь образуется между элементами
1) кислородом и калием
2) серой и фтором
3) бромом и кальцием
4) рубидием и хлором
8. В летучих водородных соединениях элементов VA группы 3-го периода химическая связь
В летучих водородных соединениях элементов VA группы 3-го периода химическая связь
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) металлическая
9. В высших оксидах элементов 3-го периода вид химической связи с увеличением порядкового номера элемента изменяется
1) от ионной связи к ковалентной полярной связи
2) от металлической к ковалентной неполярной
3) от ковалентной полярной связи до ионной связи
4) от ковалентной полярной связи до металлической связи
10. Длина химической связи Э–Н увеличивается в ряду веществ
1) HI – PH3 – HCl
2) PH3 – HCl – H2S
3) HI – HCl – H2S
4) HCl – H2S – PH3
11. Длина химической связи Э–Н уменьшается в ряду веществ
1) NH3 – H2O – HF
2) PH3 – HCl – H2S
3) HF – H2O – HCl
4) HCl – H2S – HBr
12.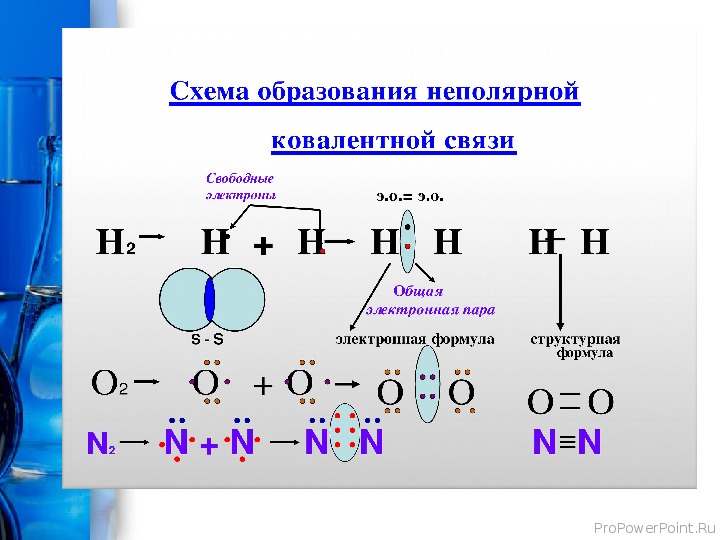 Число электронов, которые участвуют в образовании химических связей в молекуле хлороводорода, —
Число электронов, которые участвуют в образовании химических связей в молекуле хлороводорода, —
1) 4
2) 2
3) 6
4) 8
13. Число электронов, которые участвуют в образовании химических связей в молекуле P2O5, —
1) 4
2) 20
3) 6
4) 12
14. В хлориде фосфора (V) химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
15. Наиболее полярная химическая связь в молекуле
1) фтороводорода
2) хлороводорода
3) воды
4) сероводорода
16. Наименее полярная химическая связь в молекуле
1) хлороводорода
2) бромоводорода
3) воды
4) сероводорода
17. За счёт общей электронной пары образована связь в веществе
1) Mg
2) H2
3) NaCl
4) CaCl2
18. Ковалентная связь образуется между элементами, порядковые номера которых
1) 3 и 9
2) 11 и 35
3) 16 и 17
4) 20 и 9
19. Ионная связь образуется между элементами, порядковые номера которых
Ионная связь образуется между элементами, порядковые номера которых
1) 13 и 9
2) 18 и 8
3) 6 и 8
4) 7 и 17
20. В перечне веществ, формулы которых соединения только с ионной связью, это
1) NaF, CaF2
2) NaNO3, N2
3) O2, SO3
4) Ca(NO3)2, AlCl3
Ответы
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Полярная ковалентная связь — обзор
9.35.5.2.4 Ковалентные твердые вещества
В хорошем первом приближении и с правдоподобными результатами соединения, образующие полярные ковалентные связи, часто можно успешно описать с помощью ионного эмпирического потенциала. Это особенно верно до тех пор, пока локальные координационные полиэдры анионов, которые окружают отдельные катионы, высокосимметричны, а общее распределение заряда в твердом теле приблизительно изотропно. В таком случае ковалентные и ионные модели во многих случаях создают один и тот же набор кандидатов в низкоэнергетические структуры, только с некоторыми разными ранжированием энергии в более высоких минимумах и, возможно, разными энергетическими барьерами между минимумами.Однако это не относится к системам, в которых важные локальные минимумы демонстрируют различные виды анизотропных связей, например, sp 2 — и sp 3 -гибридизированные атомы углерода, и затем необходимо выполнить глобальную оптимизацию на ab initio энергетический ландшафт.
В таком случае ковалентные и ионные модели во многих случаях создают один и тот же набор кандидатов в низкоэнергетические структуры, только с некоторыми разными ранжированием энергии в более высоких минимумах и, возможно, разными энергетическими барьерами между минимумами.Однако это не относится к системам, в которых важные локальные минимумы демонстрируют различные виды анизотропных связей, например, sp 2 — и sp 3 -гибридизированные атомы углерода, и затем необходимо выполнить глобальную оптимизацию на ab initio энергетический ландшафт.
Например, в нитриде бора присутствует несколько видов, в основном ковалентных, вкладов в общую энергию, и глобальный поиск должен выполняться на уровне ab initio. Система BN особенно интересна как тестовая система, потому что экспериментально наблюдаемые модификации включают как слоистые структуры (гексагональный BN), так и трехмерные сети (типа вюрцита и сфалерита).При глобальной оптимизации, использующей как функционалы Хартри – Фока, так и функционалы плотности, 247 действительно были обнаружены все экспериментально наблюдаемые типы структур. Кроме того, было предсказано несколько новых модификаций, таких как слоистые структуры, но с порядком наложения, отличным от экспериментально наблюдаемой структуры h-BN. Сила общего ландшафтного подхода была впечатляюще продемонстрирована открытием двух замечательных новых каркасных структур с низкими энергиями, демонстрирующих структуру β-BeO и частичную структуру Al в SrAl 2 соответственно.
Кроме того, было предсказано несколько новых модификаций, таких как слоистые структуры, но с порядком наложения, отличным от экспериментально наблюдаемой структуры h-BN. Сила общего ландшафтного подхода была впечатляюще продемонстрирована открытием двух замечательных новых каркасных структур с низкими энергиями, демонстрирующих структуру β-BeO и частичную структуру Al в SrAl 2 соответственно.
В другом недавнем исследовании использовалось сочетание интеллектуального анализа данных, создания сетей и локальной оптимизации с ab initio расчетами энергии (DFT) для предсказания кристаллических структур нитридов и фосфидов группы 14. 384 Важным шагом было создание новых кандидатов путем разумной замены атомов разных типов в известных базовых сетях, что привело к появлению множества интересных структур. Эта процедура в некоторой степени похожа на один из подходов, используемых для поиска кандидатов в кристаллы в системе Si 3 B 3 N 7 . 55
55
4.4: Полярные и неполярные ковалентные связи
Электроотрицательность и полярность связи
Хотя мы определили ковалентную связь как разделение электронов, электроны в ковалентной связи не всегда одинаково распределяются между двумя связанными атомами. Если связь не соединяет два атома одного и того же элемента, всегда будет один атом, который притягивает электроны в связи сильнее, чем другой атом, как показано на рисунке \ (\ PageIndex {1} \). Когда возникает такой дисбаланс, возникает накопление некоторого отрицательного заряда (называемого частичным отрицательным зарядом и обозначается δ−) на одной стороне связи и некоторого положительного заряда (обозначается δ +) на другой стороне связи.Ковалентная связь с неравномерным распределением электронов, как показано в части (b) рисунка \ (\ PageIndex {1} \), называется полярной ковалентной связью. Ковалентная связь с равным распределением электронов (часть (а) на рисунке \ (\ PageIndex {1} \)) называется неполярной ковалентной связью.
Рисунок \ (\ PageIndex {1} \) Полярные и неполярные ковалентные связи. (а) Электроны в ковалентной связи одинаково разделяются обоими атомами водорода. Это неполярная ковалентная связь. (б) Атом фтора притягивает электроны в связи больше, чем атом водорода, что приводит к дисбалансу в распределении электронов.Это полярная ковалентная связь.
Любая ковалентная связь между атомами разных элементов является полярной связью, но степень полярности сильно различается. Некоторые связи между различными элементами только минимально полярны, в то время как другие сильно полярны. Ионные связи можно считать предельной полярностью, когда электроны передаются, а не разделяются. Чтобы судить об относительной полярности ковалентной связи, химики используют электроотрицательность, которая является относительной мерой того, насколько сильно атом притягивает электроны, когда он образует ковалентную связь.Существуют различные числовые шкалы для оценки электроотрицательности. На рисунке \ (\ PageIndex {2} \) показана одна из самых популярных — шкала Полинга. О полярности ковалентной связи можно судить, определив разницу в электроотрицательностях двух атомов, образующих связь. Чем больше разница в электроотрицательностях, тем больше дисбаланс в распределении электронов в связи. Хотя нет никаких жестких правил, общее правило состоит в том, что разница в электроотрицательностях меньше примерно 0.4 связь считается неполярной; если разница больше 0,4, связь считается полярной. Если разница в электроотрицательностях достаточно велика (обычно больше примерно 1,8), полученное соединение считается ионным, а не ковалентным. Разность электроотрицательностей, равная нулю, конечно же, указывает на неполярную ковалентную связь.
На рисунке \ (\ PageIndex {2} \) показана одна из самых популярных — шкала Полинга. О полярности ковалентной связи можно судить, определив разницу в электроотрицательностях двух атомов, образующих связь. Чем больше разница в электроотрицательностях, тем больше дисбаланс в распределении электронов в связи. Хотя нет никаких жестких правил, общее правило состоит в том, что разница в электроотрицательностях меньше примерно 0.4 связь считается неполярной; если разница больше 0,4, связь считается полярной. Если разница в электроотрицательностях достаточно велика (обычно больше примерно 1,8), полученное соединение считается ионным, а не ковалентным. Разность электроотрицательностей, равная нулю, конечно же, указывает на неполярную ковалентную связь.
Рисунок \ (\ PageIndex {2} \) Электроотрицательности различных элементов. Популярная шкала электроотрицательностей имеет значение для атомов фтора, равное 4.0, максимальное значение.
Пример \ (\ PageIndex {1} \)
Опишите разницу в электроотрицательности между каждой парой атомов и результирующую полярность (или тип связи).
- C и H
- H и H
- Na и Cl
- O и H
Решение
- Углерод имеет электроотрицательность 2,5, а водород — 2,1. Разница составляет 0,4, что довольно мало. Поэтому связь C – H считается неполярной.
- Оба атома водорода имеют одинаковое значение электроотрицательности — 2,1. Разница равна нулю, значит связь неполярная.
- Электроотрицательность натрия составляет 0,9, а хлора — 3,0. Разница составляет 2,1, что довольно велико, поэтому натрий и хлор образуют ионное соединение.
- При 2,1 для водорода и 3,5 для кислорода разница электроотрицательностей составляет 1,4. Мы ожидаем очень полярной связи, но не настолько полярной, чтобы связь O – H считалась ионной.
Упражнение
Опишите разницу в электроотрицательности между каждой парой атомов и результирующую полярность (или тип связи).
- C и O
- N и H
- N и N
- C и F
Когда связи молекулы полярны, молекула в целом может демонстрировать неравномерное распределение заряда в зависимости от того, как ориентированы отдельные связи. Например, ориентация двух связей O – H в молекуле воды (рис. \ (\ PageIndex {3} \)) изогнута: один конец молекулы имеет частично положительный заряд, а другой конец — частично отрицательный. заряжать. Короче говоря, сама молекула полярна.Полярность воды оказывает огромное влияние на ее физические и химические свойства. (Например, температура кипения воды [100 ° C] высока для такой маленькой молекулы и связана с тем, что полярные молекулы сильно притягиваются друг к другу.) Напротив, в то время как две связи C = O в диоксиде углерода являются полярные, они лежат прямо напротив друг друга и, таким образом, нейтрализуют эффекты друг друга. Таким образом, молекулы углекислого газа в целом неполярны. Отсутствие полярности влияет на некоторые свойства углекислого газа.(Например, углекислый газ превращается в газ при -77 ° C, что почти на 200 ° ниже, чем температура, при которой закипает вода.)
Например, ориентация двух связей O – H в молекуле воды (рис. \ (\ PageIndex {3} \)) изогнута: один конец молекулы имеет частично положительный заряд, а другой конец — частично отрицательный. заряжать. Короче говоря, сама молекула полярна.Полярность воды оказывает огромное влияние на ее физические и химические свойства. (Например, температура кипения воды [100 ° C] высока для такой маленькой молекулы и связана с тем, что полярные молекулы сильно притягиваются друг к другу.) Напротив, в то время как две связи C = O в диоксиде углерода являются полярные, они лежат прямо напротив друг друга и, таким образом, нейтрализуют эффекты друг друга. Таким образом, молекулы углекислого газа в целом неполярны. Отсутствие полярности влияет на некоторые свойства углекислого газа.(Например, углекислый газ превращается в газ при -77 ° C, что почти на 200 ° ниже, чем температура, при которой закипает вода.)
Рисунок \ (\ PageIndex {3} \) Физические свойства и полярность. На физические свойства воды и углекислого газа влияет их полярность.
Упражнения по обзору концепции
На что указывает электроотрицательность атома?
Какой тип связи образуется между двумя атомами, если разница в электроотрицательности мала? Середина? Большой?
ответов
Электроотрицательность — это качественная мера того, насколько атом притягивает электроны ковалентной связью.
Основные выводы
- Ковалентные связи между разными атомами имеют разную длину связи.
- Ковалентные связи могут быть полярными или неполярными, в зависимости от разницы электроотрицательностей между задействованными атомами.
Авторы и авторство
Полярность связи | Химия для неосновных
Цели обучения
- Определите электроотрицательность.
- Используйте значения электроотрицательности для определения типа связи.
Что заставляет людей делиться?
Вы когда-нибудь проводили время с тем, кто вам действительно не нравился? Вы не имели с ними ничего общего и не хотели иметь с ними ничего общего.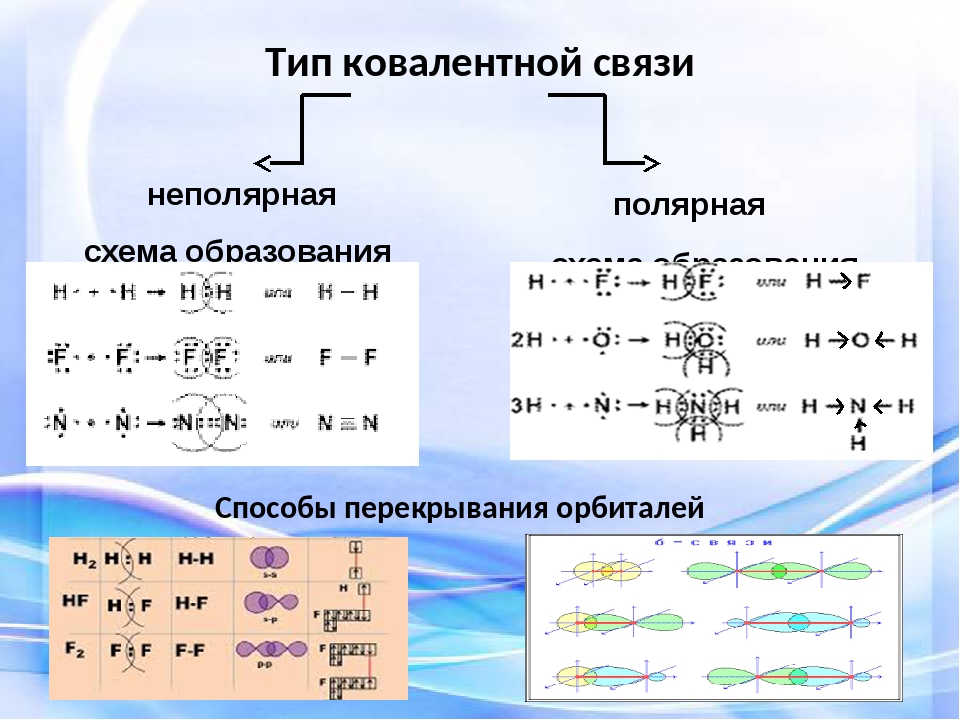 С другой стороны, есть люди, с которыми вам нравится быть. У вас много общего, и вы любите с ними делиться. Атомы работают точно так же. Если есть сильные различия в их притяжении электронов, один атом получает электроны, а другой атом теряет их.Если они похожи, они разделяют электроны, образуя ковалентную связь.
С другой стороны, есть люди, с которыми вам нравится быть. У вас много общего, и вы любите с ними делиться. Атомы работают точно так же. Если есть сильные различия в их притяжении электронов, один атом получает электроны, а другой атом теряет их.Если они похожи, они разделяют электроны, образуя ковалентную связь.
Электроотрицательность определяется как способность атома притягивать электроны, когда атомы находятся в соединении. Электроотрицательность элементов показана в таблице Менделеева ниже.
Рисунок 1. Электроотрицательность элементов.
Рис. 2. Тип связи основан на разнице в электроотрицательности двух элементов, участвующих в связи.
Степень, в которой данная связь является ионной или ковалентной, определяется путем вычисления разницы в электроотрицательности между двумя атомами, участвующими в связи.
В качестве примера рассмотрим связь, которая возникает между атомом калия и атомом фтора. По таблице разница электроотрицательностей равна 4,0 — 0,8 = 3,2.
Поскольку разница в электроотрицательности относительно велика, связь между двумя атомами является ионной. Поскольку атом фтора имеет гораздо большее притяжение для электронов, чем атом калия, валентный электрон от атома калия полностью передается атому фтора.На приведенной ниже диаграмме показано, как разница в электроотрицательности связана с ионным или ковалентным характером химической связи.
Неполярные ковалентные связи
Связь, в которой разница электроотрицательностей меньше 1,7, считается в основном ковалентной по характеру. Однако на этом этапе нам нужно различать два общих типа ковалентных связей.
Неполярная ковалентная связь представляет собой ковалентную связь, в которой связывающие электроны распределяются поровну между двумя атомами.В неполярной ковалентной связи распределение электрического заряда между двумя атомами сбалансировано.
Рис. 3. Неполярная ковалентная связь — это связь, в которой распределение электронной плотности между двумя атомами одинаково.
Два атома хлора в равной степени разделяют пару электронов в одинарной ковалентной связи, а электронная плотность, окружающая молекулу Cl 2 , является симметричной. Также обратите внимание, что молекулы, в которых разница электроотрицательностей очень мала (
Полярные ковалентные связи
Рис. 4. В полярной ковалентной связи HF электронная плотность распределена неравномерно. У атома фтора более высокая плотность (красный), а у атома водорода — более низкая (синий).
Связь, в которой разница электроотрицательностей между атомами составляет от 0,4 до 1,7, называется полярной ковалентной связью.
Полярная ковалентная связь — это ковалентная связь, в которой атомы имеют неодинаковое притяжение для электронов, и поэтому их совместное использование неодинаково.В полярной ковалентной связи, которую иногда называют просто полярной связью, распределение электронов вокруг молекулы больше не симметрично.
Простой способ проиллюстрировать неравномерное распределение электронов в полярной ковалентной связи — использовать греческую букву дельта ( δ ).
Рис. 5. Использование δ для обозначения частичного заряда.
Атом с большей электроотрицательностью приобретает частичный отрицательный заряд, а атом с меньшей электроотрицательностью приобретает частичный положительный заряд.Символ дельты используется для обозначения того, что количество заряда меньше единицы. Перекрещенная стрелка также может использоваться для обозначения направления большей электронной плотности.
Рис. 6. Перекрещенная стрелка указывает полярность.
Сводка
- Электроотрицательность атома определяет, насколько сильно он притягивает к себе электроны.
- На полярность связи влияют значения электроотрицательности двух атомов, входящих в эту связь.
Практика
Пройдите тест в правой части страницы:
http: // www.sophia.org/determining-bond-polarity/determining-bond-polarity-tutorial
Обзор
- Какой тип облигации у облигации с разницей 1,9?
- Какой будет тип облигации для BH 2 ?
- Ваш друг говорит вам, что связь LiF ковалентна.
 Что ты говоришь?
Что ты говоришь?
Глоссарий
- электроотрицательность: Способность атома притягивать электроны, когда атомы находятся в составе.
- неполярная ковалентная связь: Ковалентная связь, в которой связывающие электроны распределяются поровну между двумя атомами.
- полярная ковалентная связь: Ковалентная связь, в которой атомы имеют неодинаковое притяжение для электронов, и поэтому их совместное использование является неравным.
полярное и неполярное
полярное и неполярное
В зависимости от относительной электроотрицательности двух атомов, разделяющих электроны, может происходить частичный перенос электронной плотности от одного атома к другому. Когда электроотрицательности не равны, электроны не распределяются поровну и возникают частичные ионные заряды.
Чем больше разница электроотрицательностей, тем более ионная связь. Частично ионные связи называются полярными ковалентными связями .
Неполярные ковалентные связи с равным распределением электронов связи возникают, когда электроотрицательности двух атомов равны.
Полярные и неполярные ковалентные связи
Неполярный ковалентный
Связь
- Связь между двумя атомами неметалла, имеющими одинаковые
электроотрицательность и, следовательно, равное распределение связывающего электрона
пара - Пример: в H-H каждый атом H имеет электроотрицательность.
значение 2.1, поэтому ковалентная связь между ними считается неполярной
Полярная ковалентная связь
- Связь между двумя атомами неметалла, имеющими разные
электроотрицательности и, следовательно, неравномерное распределение связывающего электрона
пара - Пример: в H-Cl электроотрицательность Cl
атома 3,0, а атома H 2,1 - В результате получается связь, в которой электронная пара смещается.
к более электроотрицательному атому.Тогда этот атом получает частично отрицательный
заряд, в то время как менее электроотрицательный атом имеет частично положительный заряд.
разделение заряда или диполь связи можно проиллюстрировать с помощью
стрелка, острие которой направлено в сторону более электроотрицательного атома.
Греческая буква дельта означает «частично».
- Внутри молекулы каждая полярная связь имеет диполь связи
- Полярная молекула всегда содержит полярные связи, но
некоторые молекулы с полярными связями неполярны.
Полярный
Молекула
- Молекула, в которой присутствующие диполи связей не
компенсируют друг друга и, таким образом, получают молекулярный диполь . (см.
ниже) . Отмена зависит от формы молекулы или стереохимии.
и ориентация полярных связей.
Молекулярный диполь
- Результат диполей связи в молекуле.
- Связанные диполи могут или не могут аннулировать, тем самым производя
либо неполярные молекулы, если они сокращаются, либо полярные, если они
не отменить - Примеры:
- CO 2 представляет собой линейную молекулу с 2
равные и противоположно направленные диполи связи, поэтому связь
полярности отменяются, и молекула неполярна.
- HCN представляет собой линейную молекулу с двумя диполями связей, расположенными в одном направлении.
и не равны, поэтому полярности связей не сокращаются, и молекула
полярный
- Больше примеров можно найти в Таблице: Стереохимия.
некоторых общих молекул
* ПРИМЕЧАНИЕ:
- Для фигурных диаграмм:
- Сплошные линии представляют облигации, которые находятся в и той же
самолет как у страницы - Пунктирными линиями обозначены связи, которые направлены с на .
самолет страницы - Клин указывает связи, которые направлены на наружу.
самолет страницы - При определении формы молекул электронные пары кратного
облигации считаются группой, поскольку все сформированные облигации имеют одинаковое направление
НАЗАД НА ГЛАВНУЮ СТРАНИЦУ
Полярные и неполярные ковалентные связи: определения и примеры — видео и стенограмма урока
Полярные ковалентные связи
Вы когда-нибудь видели, как двое детей играют, и один ребенок ведет себя как хулиган по отношению к другому ребенку? Ребенок-хулиган, кажется, проводит больше времени, играя с игрушкой, чем другой ребенок. Они не одинаково делятся игрушками.
Они не одинаково делятся игрушками.
Это неравное разделение также происходит с типом связи, называемым полярной ковалентной связью. Полярная ковалентная связь — это тип химической связи, при которой пара электронов неравномерно распределяется между двумя атомами. В полярной ковалентной связи электроны не распределяются поровну, потому что один атом проводит с электронами больше времени, чем другой. В полярных ковалентных связях один атом имеет более сильное притяжение, чем другой атом, и притягивает электроны.Помните, как электроны несут отрицательный заряд? Что ж, когда электроны проводят больше времени с одним атомом, это заставляет этот атом нести частичный отрицательный заряд. Атом, который не проводит столько времени с электронами, несет частичный положительный заряд. Чтобы вспомнить полярную ковалентную связь, вместо этого скажите «ковалентный пуллер» и помните, что один атом «притягивает» электроны больше, чем другой.
На самом деле ваша жизнь зависит от полярных ковалентных связей. Вы ведь пьете воду? Молекула воды, сокращенно h4O, является примером полярной ковалентной связи. Электроны распределяются неравномерно: атом кислорода проводит с электронами больше времени, чем атомы водорода. Поскольку электроны проводят больше времени с атомом кислорода, он несет частично отрицательный заряд.
Другой пример полярной ковалентной связи — между водородом и атомом хлора.В этой связи атом хлора проводит с электронами больше времени, чем атом водорода. Из-за этого неравного распределения электронов атом хлора несет частичный отрицательный заряд, а атом водорода несет частичный положительный заряд.
Как предсказать тип связи с помощью электроотрицательности
Вам может быть интересно: как узнать, какой тип связи будет возникать между атомами? Вы можете предсказать, какой тип связи образуется, глядя на электроотрицательность каждого атома, участвующего в связи. Электроотрицательность — это то, насколько сильно атом будет притягивать электроны от другого атома в химической связи. Некоторые атомы имеют более высокую электроотрицательность, а другие — более низкую. Электроотрицательность похожа на перетягивание каната между двумя атомами. Если у вас есть один человек на стороне веревки, которая сильнее другого, то этот более сильный человек будет тянуть сильнее, таща другого человека в своем направлении. С другой стороны, если бы у вас было два человека равной силы, тогда веревка не сместилась бы ни в одном направлении и оставалась бы в одном месте.
Электроотрицательность — это то, насколько сильно атом будет притягивать электроны от другого атома в химической связи. Некоторые атомы имеют более высокую электроотрицательность, а другие — более низкую. Электроотрицательность похожа на перетягивание каната между двумя атомами. Если у вас есть один человек на стороне веревки, которая сильнее другого, то этот более сильный человек будет тянуть сильнее, таща другого человека в своем направлении. С другой стороны, если бы у вас было два человека равной силы, тогда веревка не сместилась бы ни в одном направлении и оставалась бы в одном месте.
Как в перетягивании каната, если у вас есть более сильный атом с более высокой электроотрицательностью, он сможет тянуть электроны в своем направлении. Поскольку атомы имеют разную электроотрицательность, электроны распределяются неравномерно. С другой стороны, если у вас есть два атома с одинаковой силой или с одинаковой электроотрицательностью, то электроны не будут тянуться в каком-либо одном направлении и останутся посередине двух атомов.Поскольку притяжения нет, электроны распределяются между двумя атомами поровну.
С другой стороны, если у вас есть два атома с одинаковой силой или с одинаковой электроотрицательностью, то электроны не будут тянуться в каком-либо одном направлении и останутся посередине двух атомов.Поскольку притяжения нет, электроны распределяются между двумя атомами поровну.
Помните, что периодическая таблица Менделеева похожа на дорожную карту, которая может рассказать вам свойства каждого элемента? Дополнительная тенденция, которую может определить таблица Менделеева, — это электроотрицательность элемента. Прежде чем я опишу эту тенденцию, сначала вспомните, что водород считается неметаллом и перемещается в крайнее правое положение вместе с другими неметаллами. Тенденция электроотрицательности, которую я собираюсь описать, не включает благородные газы и большинство переходных металлов.Помните, благородные газы расположены в последнем столбце периодической таблицы, а переходные металлы расположены в группах с 3 по 12 периодической таблицы. Теперь, когда вы знаете исключения, основная тенденция заключается в том, что при движении слева направо электроотрицательность увеличивается, а при движении снизу вверх электроотрицательность увеличивается.
Используя эту тенденцию, вы можете увидеть, что в правом верхнем углу находятся наиболее электроотрицательные элементы, такие как кислород, хлор и фтор. И наименее электроотрицательные элементы находятся в нижнем левом углу, такие как франций, цезий, барий и радий.
Теперь, когда вы знаете тенденции электроотрицательности периодической таблицы, вы можете определить тип связи, которая будет образовываться в молекуле. Если электроотрицательность между двумя атомами в основном одинакова, образуется неполярная ковалентная связь . Например, два атома фтора имеют одинаковую электроотрицательность. Поскольку между двумя атомами нет разницы в электроотрицательности, они в равной степени будут разделять электроны, образуя неполярную ковалентную связь.
Если атомы расположены близко друг к другу в периодической таблице, они будут иметь немного другую электроотрицательность.Если разница в электроотрицательности между двумя атомами небольшая, то образуется полярная ковалентная связь .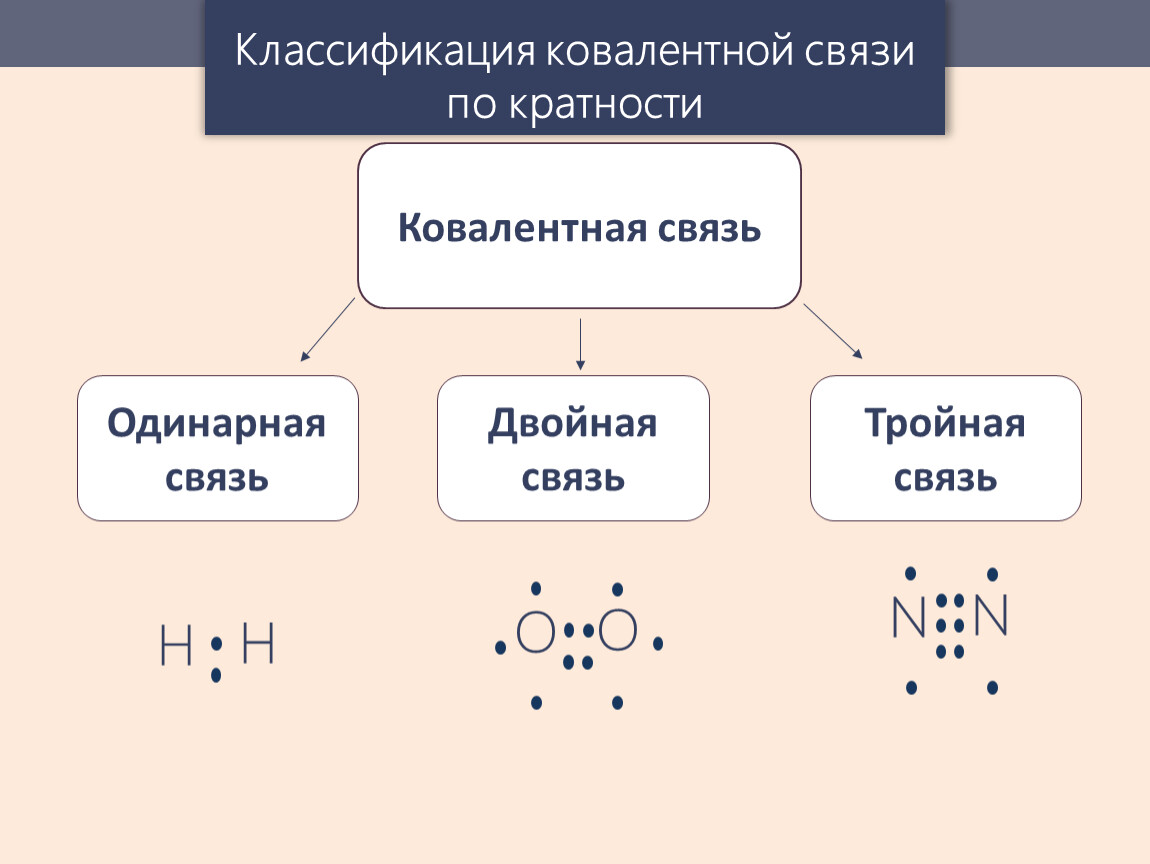 Эта небольшая разница в электроотрицательности заставляет один атом иметь более сильное притяжение электронов, чем другой атом. Это более сильное притяжение заставляет электроны распределяться неравномерно и проводить больше времени рядом с атомом с более высокой электроотрицательностью. Например, глядя на атомы, входящие в состав молекулы воды, можно увидеть, что атомы водорода и кислорода расположены довольно близко в периодической таблице.Поскольку они расположены довольно близко друг к другу, разница в электроотрицательности будет незначительной. Атом кислорода имеет более высокую электроотрицательность, чем атомы водорода, поэтому электроны проводят больше времени вокруг кислорода.
Эта небольшая разница в электроотрицательности заставляет один атом иметь более сильное притяжение электронов, чем другой атом. Это более сильное притяжение заставляет электроны распределяться неравномерно и проводить больше времени рядом с атомом с более высокой электроотрицательностью. Например, глядя на атомы, входящие в состав молекулы воды, можно увидеть, что атомы водорода и кислорода расположены довольно близко в периодической таблице.Поскольку они расположены довольно близко друг к другу, разница в электроотрицательности будет незначительной. Атом кислорода имеет более высокую электроотрицательность, чем атомы водорода, поэтому электроны проводят больше времени вокруг кислорода.
Краткое содержание урока
В этом уроке вы узнали о двух типах связей: неполярной ковалентной и полярной ковалентной. Неполярные ковалентные связи — это тип химической связи, при которой два атома разделяют пару электронов друг с другом. Полярная ковалентная связь — это тип химической связи, при которой пара электронов неравномерно распределяется между двумя атомами. Вы также узнали, как можно посмотреть на тенденции электроотрицательности периодической таблицы, чтобы предсказать тип связи, которая будет образовываться. Электроотрицательность — это то, насколько сильно атом будет притягивать электроны от другого атома в химической связи.
Вы также узнали, как можно посмотреть на тенденции электроотрицательности периодической таблицы, чтобы предсказать тип связи, которая будет образовываться. Электроотрицательность — это то, насколько сильно атом будет притягивать электроны от другого атома в химической связи.
Глядя на таблицу Менделеева, при движении слева направо электроотрицательность увеличивается, а при движении снизу вверх электроотрицательность увеличивается. Используя эту тенденцию, вы можете увидеть, что в правом верхнем углу находятся наиболее электроотрицательные элементы, такие как кислород, хлор и фтор.И наименее электроотрицательные элементы находятся в нижнем левом углу, такие как франций, цезий, барий и радий. Если электроотрицательность двух атомов в основном одинакова, образуется неполярная ковалентная связь, а если электроотрицательность немного отличается, образуется полярная ковалентная связь.
Результаты обучения
После этого урока вы сможете:
- различать неполярные и полярные ковалентные связи
- Приведите примеры каждого типа облигаций
- Объясните, что такое пептидная связь.

- Определить электроотрицательность
- Объясните, как предсказать, образуется ли неполярная ковалентная связь или полярная ковалентная связь, используя тенденции электроотрицательности периодической таблицы.
Определение и примеры полярной связи
Химические связи можно разделить на полярные и неполярные.Разница в том, как расположены электроны в связи.
Ключевые выводы: что такое полярная связь в химии?
- Полярная связь — это тип ковалентной связи, в которой электроны, образующие связь, распределены неравномерно. Другими словами, электроны проводят больше времени на одной стороне связи, чем на другой.
- Полярные связи занимают промежуточное положение между чистыми ковалентными связями и ионными связями. Они образуются, когда разница в электроотрицательности аниона и катиона составляет 0.4 и 1.7.
- Примеры молекул с полярными связями включают воду, фтороводород, диоксид серы и аммиак.
Определение полярной связи
Полярная связь — это ковалентная связь между двумя атомами, в которой электроны, образующие связь, распределены неравномерно. Это вызывает у молекулы небольшой электрический дипольный момент, когда один конец слегка положительный, а другой — слегка отрицательный. Заряд электрических диполей меньше полного заряда единицы, поэтому они считаются частичными зарядами и обозначаются дельта плюс (δ +) и дельта минус (δ-).Поскольку положительные и отрицательные заряды разделены в связи, молекулы с полярными ковалентными связями взаимодействуют с диполями в других молекулах. Это создает диполь-дипольные межмолекулярные силы между молекулами.
Это вызывает у молекулы небольшой электрический дипольный момент, когда один конец слегка положительный, а другой — слегка отрицательный. Заряд электрических диполей меньше полного заряда единицы, поэтому они считаются частичными зарядами и обозначаются дельта плюс (δ +) и дельта минус (δ-).Поскольку положительные и отрицательные заряды разделены в связи, молекулы с полярными ковалентными связями взаимодействуют с диполями в других молекулах. Это создает диполь-дипольные межмолекулярные силы между молекулами.
Полярные связи — это разделительная линия между чистой ковалентной связью и чистой ионной связью. Чистые ковалентные связи (неполярные ковалентные связи) разделяют электронные пары между атомами поровну. Технически неполярная связь возникает только тогда, когда атомы идентичны друг другу (например,, H 2 газ), но химики считают любую связь между атомами с разницей в электроотрицательности менее 0,4 неполярной ковалентной связью. Углекислый газ (CO 2 ) и метан (CH 4 ) являются неполярными молекулами.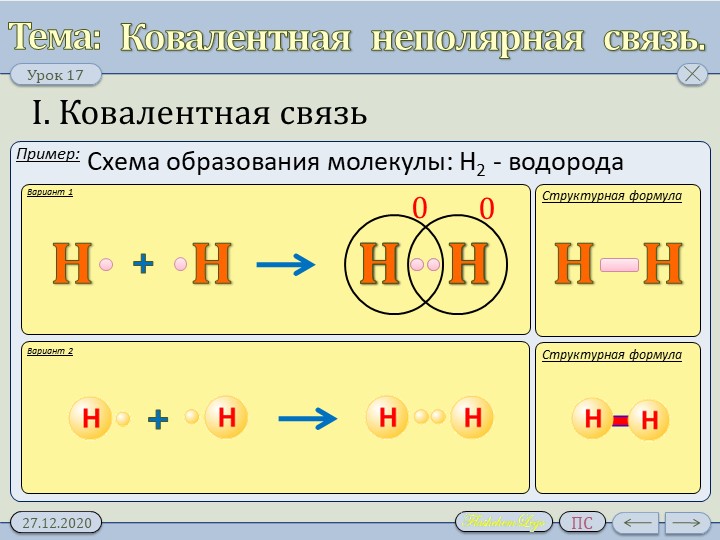
Но разве ионные связи не полярны?
В ионных связях электроны в связи по существу передаются одному атому другим (например, NaCl). Ионные связи образуются между атомами, когда разница электроотрицательностей между ними больше 1.7. Технически ионные связи являются полностью полярными связями, поэтому терминология может сбивать с толку.
Просто помните, что полярная связь относится к типу ковалентной связи, в которой электроны распределяются неравномерно, а значения электроотрицательности немного отличаются. Между атомами образуются полярные ковалентные связи с разностью электроотрицательностей от 0,4 до 1,7.
Примеры молекул с полярными ковалентными связями
Вода (H 2 O) представляет собой молекулу с полярными связями. Значение электроотрицательности кислорода равно 3.44, а электроотрицательность водорода 2,20. Неравенство в распределении электронов объясняет изогнутую форму молекулы. Кислородная «сторона» молекулы имеет чистый отрицательный заряд, в то время как два атома водорода (на другой «стороне») имеют чистый положительный заряд.
Фтористый водород (HF) — еще один пример молекулы, имеющей полярную ковалентную связь. Фтор — более электроотрицательный атом, поэтому электроны в связи более тесно связаны с атомом фтора, чем с атомом водорода.Формируется диполь со стороной фтора, имеющей чистый отрицательный заряд, и стороной водорода, имеющей чистый положительный заряд. Фтористый водород — линейная молекула, потому что здесь всего два атома, поэтому никакая другая геометрия невозможна.
Молекула аммиака (NH 3 ) имеет полярные ковалентные связи между атомами азота и водорода. Диполь таков, что атом азота заряжен более отрицательно, а все три атома водорода находятся на одной стороне от атома азота с положительным зарядом.
Какие элементы образуют полярные связи?
Полярные ковалентные связи образуются между двумя атомами неметалла, которые имеют достаточно разные электроотрицательности друг от друга. Поскольку значения электроотрицательности немного отличаются, связующая электронная пара не одинаково распределяется между атомами. Например, полярные ковалентные связи обычно образуются между водородом и любым другим неметаллом.
Например, полярные ковалентные связи обычно образуются между водородом и любым другим неметаллом.
Значение электроотрицательности между металлами и неметаллами велико, поэтому они образуют ионные связи друг с другом.Обычно водород действует как неметалл, а не как металл.
Источники
- Ingold, C.K .; Ингольд, Э. Х. (1926). «Природа чередующегося эффекта в углеродных цепях. Часть V. Обсуждение ароматического замещения с особым упором на соответствующие роли полярной и неполярной диссоциации; и дальнейшее исследование относительной директивной эффективности кислорода и азота». J. Chem. Soc .: 1310–1328. DOI: 10.1039 / jr9262
- 0
- Полинг, Л.(1960). Природа химической связи (3-е изд.). Издательство Оксфордского университета. С. 98–100. ISBN 0801403332.
- Зиай-Моайед, Марьям; Гудман, Эдвард; Уильямс, Питер (ноябрь 1,2000). «Электрическое отклонение полярных жидких потоков: непонятая демонстрация».
 Журнал химического образования . 77 (11): 1520. DOI: 10.1021 / ed077p1520
Журнал химического образования . 77 (11): 1520. DOI: 10.1021 / ed077p1520
Типы ковалентных связей: полярные и неполярные
Электроны по-разному распределяются между ионными и ковалентными связями.Ковалентные связи могут быть неполярными или полярными и реагировать на электростатические заряды.
Ионные связи , как и в поваренной соли (NaCl), возникают из-за электростатических сил притяжения между положительными (Na +) и отрицательно заряженными (Cl-) ионами. Во втором блоке мы сравнили атомы со щенками и электроны с костями, аналогично тому, как работает связь. При ионной связи каждый щенок начинается с электронной кости, но один щенок действует как вор и крадет кость другого щенка (см. Рис. 3-1a).Теперь у одного щенка две электронные кости, а у одного — нет. Поскольку электронные кости в нашей аналогии имеют отрицательный заряд, щенок-вор получает отрицательный заряд из-за дополнительной кости. Щенок, потерявший электронную кость, заряжается положительно. Поскольку у щенка, потерявшего свою кость, заряд противоположен щенку-воришке, щенки удерживаются вместе за счет электростатических сил, как ионы натрия и хлора!
Поскольку у щенка, потерявшего свою кость, заряд противоположен щенку-воришке, щенки удерживаются вместе за счет электростатических сил, как ионы натрия и хлора!
В ковалентных связях , как и в случае газообразного хлора (Cl2), оба атома разделяют и прочно удерживают электроны друг друга.В нашей аналогии каждый щенок снова начинается с электронной кости. Однако вместо того, чтобы один щенок украл кость у другого, оба щенка держатся за обе кости (см. Рис. 3-1b).
Некоторые ковалентно связанные молекулы, такие как газообразный хлор (Cl2), в равной степени разделяют свои электроны (как два одинаково сильных щенка, каждый из которых держит обе кости). Другие ковалентно связанные молекулы, такие как газообразный фтористый водород (HF), не разделяют электроны поровну. Атом фтора действует как немного более сильный щенок, который немного сильнее притягивает общие электроны (см.рис.3-1в). Несмотря на то, что электроны во фтористом водороде являются общими, фторсодержащая сторона молекулы воды сильнее притягивает отрицательно заряженные общие электроны и становится отрицательно заряженной. Атом водорода имеет небольшой положительный заряд, потому что он не может так крепко держаться за отрицательные электронные кости. Ковалентные молекулы с таким типом неравномерного распределения заряда имеют полярность и . Молекулы с полярными ковалентными связями имеют положительную и отрицательную стороны.
Атом водорода имеет небольшой положительный заряд, потому что он не может так крепко держаться за отрицательные электронные кости. Ковалентные молекулы с таким типом неравномерного распределения заряда имеют полярность и . Молекулы с полярными ковалентными связями имеют положительную и отрицательную стороны.
Фиг.3-1: Связь на примере щенка. В этой аналогии каждый щенок представляет собой атом, а каждая кость представляет собой электрон.
Вода — полярная ковалентная молекула
Вода (h4O), как и фтористый водород (HF), представляет собой полярную ковалентную молекулу. Если вы посмотрите на диаграмму воды (см. Рис. 3-2), вы увидите, что два атома водорода неравномерно распределены вокруг атома кислорода. Неравномерное распределение электронов между атомами и несимметричная форма молекулы означает, что молекула воды имеет два полюса — положительный заряд на водородном полюсе (сбоку) и отрицательный заряд на кислородном полюсе (сбоку). Мы говорим, что молекула воды электрически полярна.
Мы говорим, что молекула воды электрически полярна.
Рис. 3-2: Различные способы представления полярного распределения электронов в молекуле воды. Каждая диаграмма показывает несимметричную форму молекулы воды. На (a) и (b) полярные ковалентные связи показаны линиями. В части (c) полярные ковалентные связи показаны в виде электронных точек, общих для атомов кислорода и водорода. В части (d) диаграмма показывает относительный размер атомов, а связи представлены касанием атомов.
Деятельность
Полярная ковалентная связь водорода и кислорода в воде приводит к интересному поведению, su
Ориентация молекулы
Вода притягивается положительными и отрицательными электростатическими силами, потому что жидкие полярные молекулы ковалентной воды могут перемещаться, чтобы они могли ориентироваться в присутствии электростатической силы. (см. рис. 3-4).
Эти силы можно увидеть на следующем видео:
youtube.com/embed/WJe7tZwwq3E»/>
Хотя мы не можем видеть отдельные молекулы, мы можем сделать вывод из наших наблюдений, что в присутствии отрицательного заряда молекулы воды поворачиваются так, что их положительные полюса водорода обращены к отрицательно заряженному объекту.То же самое было бы верно в присутствии положительно заряженного объекта; молекулы воды поворачиваются так, что отрицательные полюса кислорода обращены к положительному объекту. См. Рис. 3-5 для интерпретации художника.
Симметрия и асимметрия
Помните, что в полярной молекуле притяжение одного атома сильнее, чем другого. Полярные ковалентные молекулы существуют всякий раз, когда существует асимметрия , или неравномерное распределение электронов в молекуле. Один или несколько из этих асимметричных атомов притягивают электроны сильнее, чем другие атомы.Например, полярный метиловый спирт имеет отрицательный полюс, состоящий из углерода и водорода, и положительный полюс, состоящий из кислорода и водорода (см. Рис. 3-6).
Рис. 3-6).
Однако, когда молекулы симметричны , атомы одинаково притягивают электроны и распределение заряда однородно. Симметричные молекулы неполярны. Поскольку неполярные молекулы равномерно разделяют свои заряды, они не реагируют на электростатические заряды, как вода. Ковалентные молекулы, состоящие только из одного типа атомов, такие как газообразный водород (h4), неполярны, потому что атомы водорода делят свои электроны поровну.Молекулы, состоящие из более чем одного типа ковалентно связанных неметаллических атомов, такие как газообразный диоксид углерода (CO2), остаются неполярными, если они симметричны или если их атомы имеют относительно одинаковое притяжение. Даже большие соединения, такие как гексан бензин (С6х24), симметричны и неполярны. Похоже, что электростатические заряды не оказывают большого влияния на неполярные соединения. См. Рис. 3-6 для примеров полярных и неполярных молекул.
.
7.2 Ковалентное связывание — химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Описывать образование ковалентных связей
- Определить электроотрицательность и оценить полярность ковалентных связей
Ионная связь возникает в результате электростатического притяжения противоположно заряженных ионов, которое обычно возникает при переносе электронов между металлическими и неметаллическими атомами. Другой тип связи возникает в результате взаимного притяжения атомов к «общей» паре электронов.Такие связи называются ковалентными связями. Ковалентные связи образуются между двумя атомами, когда оба имеют схожие тенденции притягивать электроны к себе (то есть, когда оба атома имеют одинаковые или довольно похожие энергии ионизации и сродство к электрону). Например, два атома водорода ковалентно связаны с образованием молекулы H 2 ; у каждого атома водорода в молекуле H 2 есть два стабилизирующих его электрона, что дает каждому атому такое же количество валентных электронов, что и благородный газ He.
Другой тип связи возникает в результате взаимного притяжения атомов к «общей» паре электронов.Такие связи называются ковалентными связями. Ковалентные связи образуются между двумя атомами, когда оба имеют схожие тенденции притягивать электроны к себе (то есть, когда оба атома имеют одинаковые или довольно похожие энергии ионизации и сродство к электрону). Например, два атома водорода ковалентно связаны с образованием молекулы H 2 ; у каждого атома водорода в молекуле H 2 есть два стабилизирующих его электрона, что дает каждому атому такое же количество валентных электронов, что и благородный газ He.
Соединения, содержащие ковалентные связи, обладают физическими свойствами, отличными от ионных соединений.Поскольку притяжение между молекулами, которые являются электрически нейтральными, слабее, чем притяжение между электрически заряженными ионами, ковалентные соединения обычно имеют гораздо более низкие температуры плавления и кипения, чем ионные соединения. Фактически, многие ковалентные соединения представляют собой жидкости или газы при комнатной температуре, и в своем твердом состоянии они обычно намного мягче, чем ионные твердые вещества. Кроме того, в то время как ионные соединения являются хорошими проводниками электричества при растворении в воде, большинство ковалентных соединений нерастворимы в воде; поскольку они электрически нейтральны, они плохо проводят электричество в любом состоянии.
Фактически, многие ковалентные соединения представляют собой жидкости или газы при комнатной температуре, и в своем твердом состоянии они обычно намного мягче, чем ионные твердые вещества. Кроме того, в то время как ионные соединения являются хорошими проводниками электричества при растворении в воде, большинство ковалентных соединений нерастворимы в воде; поскольку они электрически нейтральны, они плохо проводят электричество в любом состоянии.
Формирование ковалентных облигаций
Атомы неметалла часто образуют ковалентные связи с другими атомами неметалла. Например, молекула водорода H 2 содержит ковалентную связь между двумя атомами водорода. На рисунке 7.4 показано, почему образуется эта связь. Начиная с крайнего правого угла, у нас есть два отдельных атома водорода с определенной потенциальной энергией, обозначенные красной линией. По оси x — расстояние между двумя атомами. Когда два атома приближаются друг к другу (движутся влево по оси x ), их валентные орбитали (1 s ) начинают перекрываться. Отдельные электроны на каждом атоме водорода затем взаимодействуют с обоими атомными ядрами, занимая пространство вокруг обоих атомов. Сильное притяжение каждого общего электрона к обоим ядрам стабилизирует систему, а потенциальная энергия уменьшается с уменьшением расстояния связи. Если атомы продолжают приближаться друг к другу, положительные заряды в двух ядрах начинают отталкиваться друг от друга, и потенциальная энергия увеличивается. Длина связи определяется расстоянием, на котором достигается самая низкая потенциальная энергия.
Отдельные электроны на каждом атоме водорода затем взаимодействуют с обоими атомными ядрами, занимая пространство вокруг обоих атомов. Сильное притяжение каждого общего электрона к обоим ядрам стабилизирует систему, а потенциальная энергия уменьшается с уменьшением расстояния связи. Если атомы продолжают приближаться друг к другу, положительные заряды в двух ядрах начинают отталкиваться друг от друга, и потенциальная энергия увеличивается. Длина связи определяется расстоянием, на котором достигается самая низкая потенциальная энергия.
Фигура 7,4 Потенциальная энергия двух отдельных атомов водорода (справа) уменьшается по мере их приближения друг к другу, и отдельные электроны на каждом атоме разделяются, образуя ковалентную связь. Длина связи — это межъядерное расстояние, при котором достигается самая низкая потенциальная энергия.
Важно помнить, что для разрыва химических связей необходимо добавлять энергию (эндотермический процесс), тогда как при образовании химических связей выделяется энергия (экзотермический процесс). В случае H 2 ковалентная связь очень прочная; необходимо добавить большое количество энергии, 436 кДж, чтобы разорвать связи в одном моль молекул водорода и вызвать разделение атомов:
В случае H 2 ковалентная связь очень прочная; необходимо добавить большое количество энергии, 436 кДж, чтобы разорвать связи в одном моль молекул водорода и вызвать разделение атомов:
И наоборот, такое же количество энергии выделяется, когда один моль молекул H 2 образуется из двух молей атомов H:
2H (г) ⟶h3 (г) ΔH = −436кДж2H (г) ⟶h3 (г) ΔH = −436кДжЧистые и полярные ковалентные связи
Если атомы, образующие ковалентную связь, идентичны, как в H 2 , Cl 2 , и других двухатомных молекулах, то электроны в связи должны быть разделены поровну.Мы называем это чистой ковалентной связью. Электроны, связанные чистыми ковалентными связями, имеют равную вероятность нахождения рядом с каждым ядром.
В случае Cl 2 каждый атом начинается с семи валентных электронов, и каждый Cl разделяет один электрон с другим, образуя одну ковалентную связь:
Общее количество электронов вокруг каждого отдельного атома состоит из шести несвязывающих электронов и двух общих (т.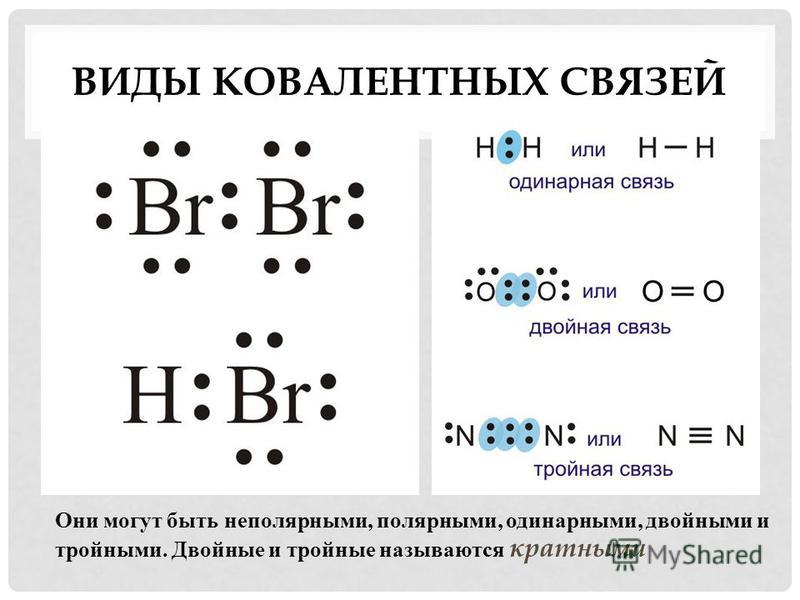 Е. Связывающих) электронов для восьми полных электронов, что соответствует количеству валентных электронов в благородном газе аргоне.Поскольку связывающие атомы идентичны, Cl 2 также имеет чистую ковалентную связь.
Е. Связывающих) электронов для восьми полных электронов, что соответствует количеству валентных электронов в благородном газе аргоне.Поскольку связывающие атомы идентичны, Cl 2 также имеет чистую ковалентную связь.
Когда атомы, связанные ковалентной связью, различны, связывающие электроны разделяются, но уже не поровну. Вместо этого связывающие электроны больше притягиваются к одному атому, чем к другому, что приводит к смещению электронной плотности в сторону этого атома. Это неравномерное распределение электронов известно как полярная ковалентная связь, характеризующаяся частичным положительным зарядом на одном атоме и частичным отрицательным зарядом на другом.Атом, который сильнее притягивает электроны, приобретает частичный отрицательный заряд и наоборот. Например, электроны в связи H – Cl в молекуле хлористого водорода проводят больше времени около атома хлора, чем около атома водорода. Таким образом, в молекуле HCl атом хлора несет частичный отрицательный заряд, а атом водорода имеет частичный положительный заряд. На рис. 7.5 показано распределение электронов в связи H – Cl. Обратите внимание, что заштрихованная область вокруг Cl намного больше, чем вокруг H.Сравните это с рисунком 7.4, на котором показано равномерное распределение электронов в неполярной связи H 2 .
На рис. 7.5 показано распределение электронов в связи H – Cl. Обратите внимание, что заштрихованная область вокруг Cl намного больше, чем вокруг H.Сравните это с рисунком 7.4, на котором показано равномерное распределение электронов в неполярной связи H 2 .
Иногда мы обозначаем положительные и отрицательные атомы в полярной ковалентной связи, используя строчную греческую букву «дельта», δ, со знаком плюс или минус, чтобы указать, имеет ли атом частичный положительный заряд (δ +) или частично отрицательный. заряд (δ–). Этот символизм показан для молекулы H – Cl на рис. 7.5.
Фигура 7,5 (а) Распределение электронной плотности в молекуле HCl неравномерно.Электронная плотность больше вокруг ядра хлора. Маленькие черные точки указывают расположение ядер водорода и хлора в молекуле. (б) Символы δ + и δ– указывают полярность связи H – Cl.
Электроотрицательность
Является ли связь неполярной или полярной ковалентной, определяется свойством связывающих атомов, называемым электроотрицательностью. Электроотрицательность — это мера тенденции атома притягивать электроны (или электронную плотность) к себе.Он определяет, как общие электроны распределяются между двумя атомами в связи. Чем сильнее атом притягивает электроны в своих связях, тем больше его электроотрицательность. Электроны в полярной ковалентной связи смещены в сторону более электроотрицательного атома; таким образом, более электроотрицательный атом имеет частичный отрицательный заряд. Чем больше разница в электроотрицательности, тем более поляризовано распределение электронов и больше парциальные заряды атомов.
Электроотрицательность — это мера тенденции атома притягивать электроны (или электронную плотность) к себе.Он определяет, как общие электроны распределяются между двумя атомами в связи. Чем сильнее атом притягивает электроны в своих связях, тем больше его электроотрицательность. Электроны в полярной ковалентной связи смещены в сторону более электроотрицательного атома; таким образом, более электроотрицательный атом имеет частичный отрицательный заряд. Чем больше разница в электроотрицательности, тем более поляризовано распределение электронов и больше парциальные заряды атомов.
Рисунок 7.6 показаны значения электроотрицательности элементов, предложенные одним из самых известных химиков двадцатого века: Линусом Полингом (рис. 7.7). В общем, электроотрицательность увеличивается слева направо за период в периодической таблице и уменьшается вниз по группе. Таким образом, неметаллы, которые расположены в правом верхнем углу, имеют тенденцию иметь самые высокие электроотрицательность, а фтор — самый электроотрицательный элемент из всех (EN = 4,0). Металлы имеют тенденцию быть менее электроотрицательными элементами, а металлы группы 1 имеют самые низкие электроотрицательность.Обратите внимание, что благородные газы исключены из этого рисунка, потому что эти атомы обычно не разделяют электроны с другими атомами, поскольку они имеют полную валентную оболочку. (Хотя соединения благородных газов, такие как XeO 2 , действительно существуют, они могут образовываться только в экстремальных условиях, и поэтому они не полностью вписываются в общую модель электроотрицательности.)
Металлы имеют тенденцию быть менее электроотрицательными элементами, а металлы группы 1 имеют самые низкие электроотрицательность.Обратите внимание, что благородные газы исключены из этого рисунка, потому что эти атомы обычно не разделяют электроны с другими атомами, поскольку они имеют полную валентную оболочку. (Хотя соединения благородных газов, такие как XeO 2 , действительно существуют, они могут образовываться только в экстремальных условиях, и поэтому они не полностью вписываются в общую модель электроотрицательности.)
Фигура 7,6 Значения электроотрицательности, полученные Полингом, следуют предсказуемым периодическим тенденциям с более высокими значениями электроотрицательности в верхнем правом углу таблицы Менделеева.
Зависимость электроотрицательности от сродства к электрону
Мы должны быть осторожны, чтобы не путать электроотрицательность и сродство к электрону. Сродство элемента к электрону — это измеримая физическая величина, а именно энергия, выделяемая или поглощаемая, когда изолированный атом газовой фазы приобретает электрон, измеряется в кДж / моль. Электроотрицательность, с другой стороны, описывает, насколько сильно атом притягивает электроны в связи. Это безразмерная величина, которая рассчитывается, а не измеряется. Полинг получил первые значения электроотрицательности, сравнив количество энергии, необходимое для разрыва различных типов связей.Он выбрал произвольную относительную шкалу от 0 до 4.
Электроотрицательность, с другой стороны, описывает, насколько сильно атом притягивает электроны в связи. Это безразмерная величина, которая рассчитывается, а не измеряется. Полинг получил первые значения электроотрицательности, сравнив количество энергии, необходимое для разрыва различных типов связей.Он выбрал произвольную относительную шкалу от 0 до 4.
Портрет химика
Линус Полинг
Линус Полинг, показанный на рис. 7.7, — единственный человек, получивший две неразделенные (индивидуальные) Нобелевские премии: одну по химии в 1954 году за работу о природе химических связей и одну за мир в 1962 году за его противодействие оружию химического оружия. массовое уничтожение. Он разработал многие теории и концепции, лежащие в основе нашего нынешнего понимания химии, включая электроотрицательность и резонансные структуры.
Фигура
7,7
Линус Полинг (1901–1994) внес важный вклад в область химии. Он также был известным активистом, освещающим вопросы, связанные со здоровьем и ядерным оружием.
Полинг также внес вклад во многие другие области помимо химии. Его исследование серповидно-клеточной анемии выявило причину заболевания — наличие генетически унаследованного аномального белка в крови — и проложило путь для молекулярной генетики.Его работа также сыграла решающую роль в сдерживании испытаний ядерного оружия; он доказал, что радиоактивные осадки в результате ядерных испытаний представляют опасность для здоровья населения.
Электроотрицательность и тип связи
Абсолютное значение разницы в электроотрицательности (ΔEN) двух связанных атомов дает приблизительную меру ожидаемой полярности в связи и, следовательно, типа связи. Когда разница очень мала или равна нулю, связь ковалентная и неполярная. Когда он большой, связь полярная ковалентная или ионная.Абсолютные значения разности электроотрицательностей между атомами в связях H – H, H – Cl и Na – Cl равны 0 (неполярный), 0.9 (полярный ковалентный) и 2.1 (ионный) соответственно. Степень, в которой электроны распределяются между атомами, варьируется от полностью равных (чистая ковалентная связь) до нулевой (ионная связь). На рис. 7.8 показана взаимосвязь между разностью электроотрицательностей и типом связи.
Степень, в которой электроны распределяются между атомами, варьируется от полностью равных (чистая ковалентная связь) до нулевой (ионная связь). На рис. 7.8 показана взаимосвязь между разностью электроотрицательностей и типом связи.
Фигура 7,8 По мере увеличения разницы электроотрицательностей между двумя атомами связь становится более ионной.
Грубое приближение различий электроотрицательности, связанных с ковалентными, полярными ковалентными и ионными связями, показано на рисунке 7.8. Однако эта таблица является лишь общим руководством, за многими исключениями. Например, атомы H и F в HF имеют разность электроотрицательностей 1,9, а атомы N и H в NH 3 разность 0,9, однако оба этих соединения образуют связи, которые считаются полярными ковалентными. Аналогично, атомы Na и Cl в NaCl имеют разность электроотрицательностей 2.1, а атомы Mn и I в MnI 2 имеют разность 1,0, но оба эти вещества образуют ионные соединения.
Лучшим руководством к ковалентному или ионному характеру связи является рассмотрение типов задействованных атомов и их относительного положения в периодической таблице. Связи между двумя неметаллами обычно ковалентны; связь между металлом и неметаллом часто ионная.
Связи между двумя неметаллами обычно ковалентны; связь между металлом и неметаллом часто ионная.
Некоторые соединения содержат как ковалентные, так и ионные связи. Атомы в многоатомных ионах, таких как OH — , NO3-, NO3- и Nh5 +, Nh5 +, удерживаются вместе полярными ковалентными связями.Однако эти многоатомные ионы образуют ионные соединения, соединяясь с ионами противоположного заряда. Например, нитрат калия, KNO 3 , содержит катион K + и многоатомный анион NO3-NO3-. Таким образом, связь в нитрате калия является ионной, возникающей в результате электростатического притяжения между ионами K + и NO3-, NO3-, а также ковалентного между атомами азота и кислорода в NO3-.NO3-.
Пример 7.3
Электроотрицательность и полярность связи
Полярность связей играет важную роль в определении структуры белков.Используя значения электроотрицательности на рис. 7.6, расположите следующие ковалентные связи — все они обычно встречаются в аминокислотах — в порядке возрастания полярности. Затем обозначьте положительный и отрицательный атомы символами δ + и δ–:
Затем обозначьте положительный и отрицательный атомы символами δ + и δ–:C – H, C – N, C – O, N – H, O – H, S – H
Решение
Полярность этих связей увеличивается с увеличением абсолютного значения разности электроотрицательностей. Атом с обозначением δ– является более электроотрицательным из двух. В таблице 7.1 эти связи показаны в порядке возрастания полярности.Полярность связи и разница электроотрицательностей
| Облигация | ΔEN | Полярность |
|---|---|---|
| C – H | 0,4 | Cδ −− Hδ + Cδ −− Hδ + |
| S – H | 0,4 | Sδ −− Hδ + Sδ −− Hδ + |
| C – N | 0,5 | Cδ + −Nδ − Cδ + −Nδ− |
| N – H | 0,9 | Nδ −− Hδ + Nδ −− Hδ + |
| C – O | 1. 0 0 | Cδ + −Oδ − Cδ + −Oδ− |
| O – H | 1,4 | Oδ −− Hδ + Oδ −− Hδ + |
Таблица 7.1
Проверьте свои знания
Силиконы — это полимерные соединения, содержащие, среди прочего, следующие типы ковалентных связей: Si – O, Si – C, C – H и C – C. Используя значения электроотрицательности на рисунке 7.6, расположите связи в порядке возрастания полярности и обозначьте положительные и отрицательные атомы, используя символы δ + и δ–.Отвечать:
| Облигация | Разница электроотрицательностей | Полярность |
|---|---|---|
| C – C | 0,0 | неполярный |
| C – H | 0,4 | Cδ −− Hδ + Cδ −− Hδ + |
| Si – C | 0,7 | Siδ + −Cδ − Siδ + −Cδ− |
| Si – O | 1,7 | Siδ + −Oδ − Siδ + −Oδ− |
Водородная связь
Водородная связь Водородная связь Водородная связь — это особый тип диполь-дипольного притяжения между
молекулы, а не ковалентная связь с атомом водорода. Это результат
сила притяжения между атомом водорода, ковалентно связанным с
очень электроотрицательный атом, такой как атом N, O или F, и еще один очень
электроотрицательный атом. Прочность водородной связи колеблется от 4 кДж до
50 кДж на моль водородных связей.
Это результат
сила притяжения между атомом водорода, ковалентно связанным с
очень электроотрицательный атом, такой как атом N, O или F, и еще один очень
электроотрицательный атом. Прочность водородной связи колеблется от 4 кДж до
50 кДж на моль водородных связей.
- В молекулах, содержащих связи N-H, O-H или F-H, большая разница в электроотрицательность между атомом H и атомом N, O или F приводит к высокополярная ковалентная связь (т. е. дипольная связь). Электроотрицательности перечислены ниже.
| элемент | значение электроотрицательности |
| H | 2,1 |
| N | 3,0 |
| O | 3,5 |
| Ф | 4,1 |
- Из-за разницы в электроотрицательности атом H имеет большую
частичный положительный заряд, а атом N, O или F несет большой частичный отрицательный заряд.
 обвинение.
обвинение.
- Атом H в одной молекуле электростатически притягивается к N, O или Атом F в другой молекуле.
| = O = № = H | ||
| Водородная связь между двумя молекулами воды (H 2 O). Обратите внимание, что атом O в одной молекуле притягивается к атому H во второй молекуле. | Водородная связь между молекулой воды и молекулой аммиака (NH 3 ). Обратите внимание, что атом N в молекуле NH 3 притягивается к атому H в молекуле H 2 O.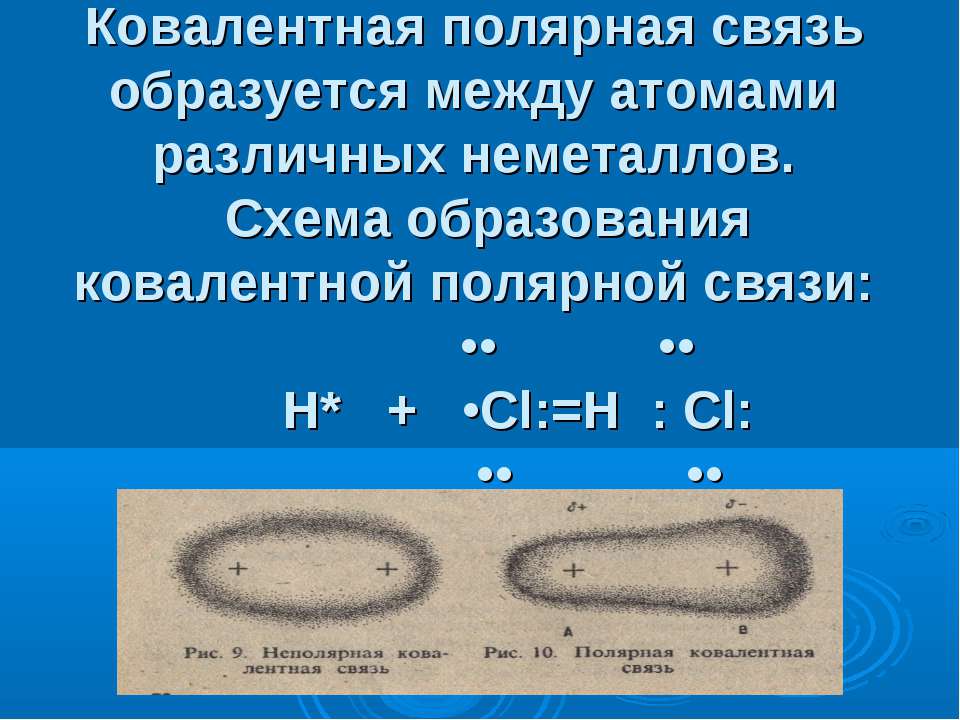 |
Физические последствия водородной связи
- При температуре 25 90-105 o 90-106 C фторид нитрозила (ONF) представляет собой газ, тогда как вода представляет собой жидкость. Почему?
- ОНФ и вода имеют примерно одинаковую форму.
- ONF имеет более высокую молекулярную массу (49 а.е.м.), чем вода (18 а.е.м.).
- Заключение: лондонские рассеивающие силы не несут ответственности для разницы между этими двумя соединениями.
- ОНФ и вода имеют одинаковый дипольный момент.
- Вывод: диполь-дипольные силы не ответственны для разницы между этими двумя соединениями.
- ONF не может образовывать водородные связи; вода может образовывать водородные связи.
ЭЛЕКТРОНЕГАТИВНОСТЬ На этой странице объясняется, что такое электроотрицательность, а также как и почему она изменяется в зависимости от Периодической таблицы. Если вас интересует электроотрицательность в контексте органической химии, вы найдете ссылку внизу этой страницы. Что такое электроотрицательность Определение Электроотрицательность — это мера тенденции атома притягивать связывающую пару электронов. Чаще всего используется шкала Полинга. Фтору (наиболее электроотрицательному элементу) присваивается значение 4,0, а значения варьируются до цезия и франция, которые являются наименее электроотрицательными при 0,7. Что произойдет, если соединятся два атома с одинаковой электроотрицательностью? Рассмотрим связь между двумя атомами, A и B.Каждый атом может образовывать другие связи, кроме показанной, но они не имеют отношения к аргументу. Если атомы одинаково электроотрицательны, оба имеют одинаковую тенденцию притягивать связывающую пару электронов, и поэтому будет найдено в среднем на полпути между двумя атомами. | ||
Примечание: Важно понимать, что это среднее изображение . Электроны на самом деле находятся на молекулярной орбитали и все время перемещаются по этой орбитали. | ||
Связь такого типа можно рассматривать как «чистую» ковалентную связь, при которой электроны равномерно распределяются между двумя атомами. Что произойдет, если B немного более электроотрицателен, чем A? B будет притягивать электронную пару больше, чем A. Это означает, что конец B связи имеет более чем справедливую долю электронной плотности и поэтому становится немного отрицательным. В то же время конец A (довольно короткий от электронов) становится слегка положительным. Определение полярных связей Это описывается как полярная связь . Полярная связь — это ковалентная связь, в которой существует разделение зарядов между одним концом и другим — другими словами, в которой один конец является слегка положительным, а другой — слегка отрицательным.Примеры включают большинство ковалентных связей. Связь водород-хлор в HCl или связи водород-кислород в воде являются типичными. Что произойдет, если B будет намного более электроотрицательным, чем A? В этом случае электронная пара перетаскивается прямо на конец связи B. Фактически, A потерял контроль над своим электроном, а B имеет полный контроль над обоими электронами. Ионы образовались. «Спектр» облигаций Смысл всего этого в том, что нет четкого разделения между ковалентными и ионными связями. Как далеко должно пройти это перетаскивание, прежде чем связь будет считаться ионной? На это нет настоящего ответа. Обычно вы думаете о хлориде натрия как о типично ионном твердом веществе, но даже здесь натрий не полностью потерял контроль над своим электроном. Однако из-за свойств хлорида натрия мы склонны считать его чисто ионным. | ||
Примечание: Не беспокойтесь о точной точке отсечения между полярными ковалентными связями и ионными связями. На A’level примеры будут стремиться избегать серых областей — они будут явно ковалентными или явно ионными. Однако ожидается, что вы поймете, что эти серые зоны существуют. | ||
Иодид лития, с другой стороны, можно охарактеризовать как «ионный с некоторым ковалентным характером». Сводка
Полярные связи и полярные молекулы В простой молекуле, такой как HCl, если связь полярна, то же самое происходит и со всей молекулой. А как насчет более сложных молекул? В CCl 4 каждая связь полярна. | ||
Примечание. Обычные линии обозначают связи в плоскости экрана или бумаги. Пунктирные линии представляют собой связи, уходящие от вас в экран или бумагу.  Клиновидные линии представляют собой облигации, выходящие из экрана или бумаги по направлению к вам. Клиновидные линии представляют собой облигации, выходящие из экрана или бумаги по направлению к вам. | ||
Молекула в целом, однако, не полярна — в том смысле, что у нее нет конца (или стороны), который был бы слегка отрицательным, и тем, который был бы слегка положительным. Вся внешняя часть молекулы несколько отрицательна, но нет общего разделения заряда сверху вниз или слева направо. Напротив, CHCl 3 является полярным. Водород в верхней части молекулы менее электроотрицателен, чем углерод, и поэтому немного положителен. Это означает, что молекула теперь имеет слегка положительный «верх» и слегка отрицательный «низ», и поэтому в целом молекула является полярной. Полярная молекула должна быть каким-то образом «односторонней». Паттерны электроотрицательности в Периодической таблице Самый электроотрицательный элемент — фтор. | ||
Примечание: Это упрощение игнорирует благородные газы. Исторически это связано с тем, что считалось, что они не образуют связей — и если они не образуют связи, у них не может быть значения электроотрицательности. Даже сейчас, когда мы знаем, что некоторые из них действительно образуют связи, источники данных по-прежнему не указывают для них значения электроотрицательности. | ||
Тенденции электроотрицательности за период По мере прохождения периода электроотрицательность возрастает. График показывает электроотрицательность от натрия до хлора — аргон не учитывается. У него нет электроотрицательности, потому что он не образует связей. Тенденции изменения электроотрицательности в группе По мере того, как вы спускаетесь по группе, электроотрицательность уменьшается. Объяснение закономерностей в электроотрицательности Притяжение, которое связывающая пара электронов испытывает к определенному ядру, зависит от:
| ||
Примечание: Если вас не устраивает концепция экранирования или экранирования , то перед продолжением будет полезно прочитать страницу об энергиях ионизации. Факторы, влияющие на энергии ионизации, такие же, как и факторы, влияющие на электроотрицательность. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Почему электроотрицательность увеличивается за период? Рассмотрим натрий в начале периода 3 и хлор в конце (без учета благородного газа, аргона). И натрий, и хлор имеют свои связывающие электроны на 3-м уровне. Электронная пара экранирована от обоих ядер 1s, 2s и 2p-электронами, но в ядре хлора есть еще 6 протонов. Неудивительно, что электронная пара увлекается настолько далеко к хлору, что образуются ионы. Электроотрицательность увеличивается с течением времени, потому что количество зарядов на ядре увеличивается.Это сильнее притягивает связывающую пару электронов. Почему электроотрицательность падает при уменьшении группы? Подумайте о фтороводороде и хлористом водороде. Связующая пара защищена от ядра фтора только 1s 2 электронами. В случае хлора он экранирован всеми 1s 2 2s 2 2p 6 электронами. В каждом случае чистое притяжение от центра фтора или хлора +7.Но фтор имеет пару связей на 2-м уровне, а не на 3-м уровне, как в хлоре. По мере того, как вы спускаетесь по группе, электроотрицательность уменьшается, потому что связывающая пара электронов все больше отдаляется от притяжения ядра. Диагональные отношения в Периодической таблице Что такое диагональное соотношение? В начале периодов 2 и 3 Периодической таблицы есть несколько случаев, когда элемент в верхней части одной группы имеет некоторое сходство с элементом в следующей группе. На схеме ниже показаны три примера. Обратите внимание, что сходство проявляется в элементах, которые расположены по диагонали друг к другу, а не бок о бок. Например, бор — неметалл с некоторыми свойствами, похожими на кремний. В отличие от остальной части группы 2, бериллий имеет некоторые свойства, напоминающие алюминий. А литий имеет некоторые свойства, которые отличаются от других элементов в группе 1, и в некоторых отношениях напоминает магний. Говорят, что между этими элементами существует диагональное соотношение . Для этого есть несколько причин, но каждая зависит от того, как атомные свойства, такие как электроотрицательность, изменяются в Периодической таблице. Итак, мы быстро рассмотрим это в отношении электроотрицательности — что, вероятно, проще всего объяснить. Объяснение диагонального соотношения относительно электроотрицательности Электроотрицательность увеличивается по Периодической таблице. Так, например, электроотрицательности бериллия и бора составляют: Электроотрицательность падает по мере того, как вы спускаетесь по Периодической таблице.Так, например, электроотрицательности бора и алюминия: Итак, сравнивая Be и Al, вы обнаруживаете, что значения (случайно) точно такие же. Повышение из группы 2 в группу 3 компенсируется падением по мере перехода от бора к алюминию в группе 3. Нечто подобное происходит с литием (1,0) с магнием (1,2) и с бором (2,0) с кремнием (1,8). В этих случаях электроотрицательности не точно такие же, как , но очень близки. Сходная электроотрицательность между членами этих диагональных пар означает, что они могут образовывать схожие типы связей, и это повлияет на их химию. Вы можете встретить такие примеры позже в своем курсе.
| ||
Внимание! Насколько мне известно, ни одна из британских программ уровня A (или эквивалентных) больше не требует следующего бита.  Раньше он входил в программу AQA, но был удален из их новой программы. Однако на момент написания он все еще присутствует по крайней мере в одной зарубежной программе уровня A (Мальта, но могут быть и другие, о которых я не знаю).Если сомневаетесь, проверьте свой учебный план. Раньше он входил в программу AQA, но был удален из их новой программы. Однако на момент написания он все еще присутствует по крайней мере в одной зарубежной программе уровня A (Мальта, но могут быть и другие, о которых я не знаю).Если сомневаетесь, проверьте свой учебный план. В противном случае игнорируйте остальную часть этой страницы. Это альтернативный (и, на мой взгляд, более неудобный) способ взглянуть на формирование полярной связи. Чтение этого без надобности может сбить вас с толку. | ||
Поляризующая способность положительных ионов Что мы подразумеваем под «поляризационной способностью»? В ходе обсуждения мы рассмотрели образование полярных связей с точки зрения искажений, которые происходят в ковалентной связи, если один атом более электроотрицателен, чем другой.Но вы также можете посмотреть на образование полярных ковалентных связей, представив, что вы начинаете с ионов. Твердый хлорид алюминия ковалентен. Вместо этого представьте, что он был ионным. Он будет содержать ионы Al 3+ и Cl —. Ион алюминия очень мал и имеет три положительных заряда, поэтому «плотность заряда» очень высока. Это окажет значительное влияние на ближайшие электроны. Мы говорим, что ионы алюминия поляризуют ионы хлорида. В случае хлорида алюминия электронные пары притягиваются к алюминию до такой степени, что связи становятся ковалентными. Но поскольку хлор более электроотрицателен, чем алюминий, электронные пары не будут протягиваться на полпути между двумя атомами, и поэтому образующаяся связь будет полярной. Факторы, влияющие на поляризационную способность Положительные ионы могут поляризовать (электрически искажать) соседние отрицательные ионы.Поляризующая способность зависит от плотности заряда положительного иона. Поляризационная способность увеличивается по мере уменьшения размера положительного иона и увеличения количества зарядов. Чем больше размер отрицательного иона, тем легче его поляризовать. Например, в иодид-ионе I — внешние электроны находятся на 5-м уровне — относительно далеко от ядра. Положительный ион будет более эффективным в привлечении пары электронов от иодид-иона, чем соответствующие электроны, скажем, во фторид-ионе, где они намного ближе к ядру. Иодид алюминия ковалентен, потому что электронная пара легко уносится от иона иодида. С другой стороны, фторид алюминия является ионным, потому что ион алюминия не может поляризовать небольшой ион фтора в достаточной степени для образования ковалентной связи.
© Джим Кларк 2000 (последнее изменение в марте 2013 г. | ||
Полярная ковалентная связь: определение и примеры
Ковалентная связь образуется, когда два атома разделяют электроны между собой. Ковалентная связь, вероятно, будет полярной, когда электроны распределены неравномерно. Асимметрия возникает из-за разницы в электроотрицательности двух атомов.Электроотрицательность — это мера тенденции атома притягивать связывающую пару электронов. Он измеряется с использованием шкалы, известной как шкала Полинга, и варьируется от 0,7 до 4. В следующей таблице поясняется тип химической связи, образующейся из-за разницы в электроотрицательности [1-10] .
| Тип химической связи | Разница в электроотрицательности |
|---|---|
| Неполярный ковалентный | 0 |
| 48 908 Слегка полярный ковалентный 9087От 1 до 0,4 | |
| Полярный ковалентный | 0,5 до 2 |
| Ионный | > 2 |
 Следовательно, полярные ковалентные связи имеют промежуточную прочность связи. Полярная ковалентная связь
Следовательно, полярные ковалентные связи имеют промежуточную прочность связи. Полярная ковалентная связьСвойства полярных ковалентных связей
Вот некоторые факты о полярных ковалентных связях.
- Имеет место между двумя неметаллами или между неметаллом и металлоидом
- Неравное распределение электронов в соединении
- Разница в электроотрицательности между атомами составляет от 0,1 до 2
- Один конец связи заряжен положительно, а другой конец отрицательно заряженный
- Полярные соединения растворяются в полярном растворителе
Примеры полярных ковалентных связей
Вот несколько примеров полярной ковалентной связи с разностью электроотрицательности между двумя связывающими атомами [1-6] :
| Название соединения | Молекулярная формула | Связь | Разница электроотрицательности [11] | 90 | OH | 1. |
|---|---|---|---|---|---|---|
| Фтористый водород | HF | HF | 1,9 | |||
| Хлороводород | HCl | H-Cl | 0,9 | H-Br | 0,7 | |
Аммиак | NH 3 | NH | 0.9 | |||
Диоксид серы | SO 2 | S = O | 1 | |||
| Сероводород | H 2 S | HS | HS | 903 CH 3 OHOH | 1,4 |
Ниже приводится объяснение полярной ковалентной связи в некоторых соединениях.
1. Вода (H
2 O) Вода — полярный растворитель.Полярная ковалентная связь создается, когда атом кислорода (O), будучи более электроотрицательным, чем водород, притягивает общие электроны к себе. В результате атом кислорода имеет связанный с ним частичный отрицательный заряд. С другой стороны, атомы водорода (H) по существу являются протонами и имеют связанный с ними частичный положительный заряд.
В результате атом кислорода имеет связанный с ним частичный отрицательный заряд. С другой стороны, атомы водорода (H) по существу являются протонами и имеют связанный с ними частичный положительный заряд.
2. Хлористый водород (HCl)
Хлороводород — полярное ковалентное соединение, поскольку атом хлора (Cl) более электроотрицателен, чем атом водорода (H).Итак, хлор несет частичный отрицательный заряд, а водород — частичный положительный заряд.
3. Аммиак (NH
3 )Аммиак — полярная молекула. Центральный атом азота (N) связан с тремя атомами водорода (H). Поскольку N более электроотрицателен, чем H, электроны будут стремиться держаться вокруг атома N.
4. Бромистый водород (HBr)
Разница в электроотрицательности водорода (H) и брома (Br) не слишком велика.Следовательно, газ HBr имеет поляризованную ковалентную связь, атом водорода имеет небольшой положительный заряд, а бром имеет небольшой отрицательный заряд. В результате электронная пара притягивается к брому.
В результате электронная пара притягивается к брому.
Разница между полярными и неполярными ковалентными связями
[3]В следующей таблице сравниваются полярные и неполярные ковалентные связи.
Полярная ковалентная связь по сравнению с неполярной ковалентной связью | ||
| Полярный | Неполярный | |
|---|---|---|
Между двумя неметаллами с одинаковой электроотрицательностью | ||
Разница электроотрицательностей | 0.1–2 | 0 |
Распределение электронов | Асимметричный. Неравное разделение. | Симметричный. |
Смещение общих электронов | В сторону более электроотрицательного атома, что делает эту часть отрицательной | Нет смещения. Электрически нейтральны. |
Дипольный момент | Ненулевое значение | ноль |
Наличие других типов связей в соединениях | Водородная связь | Бонд Ван-дер-Ваальса |
Близость к воде | гидрофильный | Гидрофобный |
Физические свойства соединений | Высокие температуры плавления и кипения | Низкие температуры плавления и кипения |
Летучесть жидкостей | Низкая волатильность | Высокая волатильность |
Растворимость соединений | Растворим в полярных растворителях | Растворим в неполярных растворителях |
Примеры | Вода (H 2 O), аммиак (NH 3 ) и хлористый водород (HCl) | Водород (H 2 ), кислород (O 2 ) и азот (N 2 ) |
Список литературы
- Chem.
 libretexts.org
libretexts.org - Bbc.co.uk
- Stlcc.edu
- Saylordotorg.github.io
- Chem.ucla.edu
- Csus.edu
- Chemistry.elmhurst.edu
- fo Chem
- fo Chem cm.utexas.edu
- Chemguide.co.uk
- Perrylocal.org
Примеры ковалентной связи полярной ковалентной связи неполярной ковалентной связи. | KAKALI GHOSH, Педагог, блогер. Магистр химии.
Если ковалентная связь образована разделением электрона между двумя разными или разными атомами, то эта ковалентная связь называется полярной ковалентной связью .
Потому что в этом случае один атом между ними более электроотрицателен, чем другой.
Более того, электроотрицательный атом имеет тенденцию притягивать связанную электронную пару к себе.
В результате общий электрон частично переместился в сторону более электроотрицательного атома.
Из-за такого несимметричного распределения заряда, более электроотрицательный элемент получает частичный отрицательный заряд, а менее электроотрицательный элемент получает частичный положительный заряд.
Таким образом, ковалентная связь превращается в полярную ковалентную связь , и молекула становится полярной молекулой.
Например, молекулы Hᵟ + — Fᵟ-, Hᵟ + — Clᵟ-, Hᵟ + — Brᵟ- и т. Д. Содержат полярную ковалентную связь.
Полярная ковалентная связь равна, , следовательно, имеет частичный ионный характер .
Два противоположных заряда на концах называются электрическими полюсами , а молекулы называются дипольными молекулами.
Ковалентная связь образована разделением электрона между двумя похожими или разными атомами.
Существует два типа ковалентной связи , а именно неполярная ковалентная связь и полярная ковалентная связь .
Ковалентная связь образована разделением электрона между двумя идентичными или подобными атомами, считается неполярной ковалентной связью .
В этом типе ковалентной связи общая электронная пара одинаково притягивается обоими атомами и находится точно посередине между ними.
Полученное ковалентное соединение называется неполярной молекулой .
Например, молекула водорода, хлора, брома, кислорода, азота и т. Д. Содержит неполярную ковалентную связь.
Если ковалентная связь образована разделением электрона между двумя идентичными или
аналогичными атомами, тогда ковалентная связь называется неполярной ковалентной связью и образующимся ковалентным соединением — это , называемая неполярной молекулой.
Например, молекула водорода, хлора, брома, кислорода, азота и т. Д. Содержит неполярную ковалентную связь .
Д. Содержит неполярную ковалентную связь .
С другой стороны, если ковалентная связь образована разделением электрона между
двумя разными или разными атомами, то эта ковалентная связь называется полярной ковалентной связью , и полученное ковалентное соединение называется полярная молекула .
В молекулах этого типа полярность возникает из-за разницы в электроотрицательности двух разнородных атомов.
Например, молекул Hᵟ + — Fᵟ-, Hᵟ + — Clᵟ-, Hᵟ + — Brᵟ- и т. Д. Являются полярными ковалентными молекулами.
Резюме:
- Что такое полярная ковалентная связь ?
- Что такое неполярная ковалентная связь ?
- Что такое полярных и неполярных молекул ?
Разница между ковалентными и водородными связями
Основное различие — ковалентные и водородные связи
Химические связи — это связи, возникающие между атомами. Эти химические связи помогают удерживать атомы вместе, чтобы образовывать молекулы и сложные соединения. Химические связи образуются либо из-за обмена электронами между атомами, либо из-за притяжения между атомами, ионами или молекулами. Ковалентная связь и водородная связь — это два типа химических связей, которые можно найти среди ковалентных соединений. Ковалентная связь образуется из-за разделения электронов между атомами. Водородная связь образуется из-за притяжения между двумя атомами двух разных молекул.Основное различие между ковалентными и водородными связями состоит в том, что ковалентных связей представляют собой внутримолекулярные притяжения, тогда как водородные связи являются межмолекулярными притяжениями.
Эти химические связи помогают удерживать атомы вместе, чтобы образовывать молекулы и сложные соединения. Химические связи образуются либо из-за обмена электронами между атомами, либо из-за притяжения между атомами, ионами или молекулами. Ковалентная связь и водородная связь — это два типа химических связей, которые можно найти среди ковалентных соединений. Ковалентная связь образуется из-за разделения электронов между атомами. Водородная связь образуется из-за притяжения между двумя атомами двух разных молекул.Основное различие между ковалентными и водородными связями состоит в том, что ковалентных связей представляют собой внутримолекулярные притяжения, тогда как водородные связи являются межмолекулярными притяжениями.
Основные зоны покрытия
1. Что такое ковалентные связи
— Определение, образование связи с примерами
2. Что такое водородные связи
— Определение, образование связи с примерами
3. Каковы сходства между ковалентными и водородные связи
Каковы сходства между ковалентными и водородные связи
— Обзор общих характеристик
4.В чем разница между ковалентными и водородными связями
— Сравнение основных различий
Ключевые термины: атомы, сила притяжения, ковалентная связь, водородная связь, межмолекулярное притяжение, внутримолекулярное притяжение, ионы, молекулы
Что такое ковалентные связи
Ковалентные связи — это химические связи, которые образуются из-за разделения электронов между атомами. Поэтому ее называют силой межмолекулярного притяжения.Связь образуется между двумя атомами, которые содержат неспаренные электроны. Эти неспаренные электроны соединяются с неспаренными электронами другого атома с образованием ковалентной связи.
Атомы могут иметь ковалентные связи в виде одинарных, двойных или тройных связей между атомами. Одна ковалентная связь включает одну электронную пару связи; когда один неспаренный электрон связан с другим неспаренным электроном другого атома, образуется ковалентная связь, и эти два электрона называются парой электронов связи или парой связей. Следовательно, в двойной связи 4 электрона разделяются между двумя атомами, потому что есть 2 ковалентные связи, имеющие две пары связей.
Следовательно, в двойной связи 4 электрона разделяются между двумя атомами, потому что есть 2 ковалентные связи, имеющие две пары связей.
Основная цель образования ковалентной связи — заполнение крайних орбиталей атомов для стабилизации. Ковалентная связь встречается среди неметаллов и металлоидов. Ковалентные связи очень сильно притягивают друг друга, а сила ковалентной связи колеблется от 100 до 1100 кДж / моль.
Рисунок 1: Точечно-крестообразная структура фтористого водорода
На изображении выше показана ковалентная связь между атомом водорода (H) и атомом фтора (F).Здесь крестик указывает на неспаренный электрон в атоме водорода, а точечные знаки показывают электроны на внешней орбитали фтора.
Есть два основных типа ковалентных связей: полярные ковалентные связи и неполярные ковалентные связи. Эти две связи названы в соответствии с полярностью ковалентной связи. Полярность связи зависит от значений электроотрицательности двух атомов, которые вносят вклад в ковалентную связь. Если разница между этими значениями электроотрицательности меньше 0.4, это неполярная ковалентная связь. Если это значение находится между 0,4 и 1,7, это полярная ковалентная связь. В приведенном выше примере электроотрицательность водорода составляет 2,2, а электроотрицательность фтора — 4,0. Следовательно, разница составляет (4,0-2,2) = 1,8. Следовательно, это высокополярная ковалентная связь.
Если разница между этими значениями электроотрицательности меньше 0.4, это неполярная ковалентная связь. Если это значение находится между 0,4 и 1,7, это полярная ковалентная связь. В приведенном выше примере электроотрицательность водорода составляет 2,2, а электроотрицательность фтора — 4,0. Следовательно, разница составляет (4,0-2,2) = 1,8. Следовательно, это высокополярная ковалентная связь.
Что такое водородные связи
Водородные связи — это силы притяжения, возникающие между двумя атомами двух разных молекул. Следовательно, это внутримолекулярное притяжение. Это слабая сила притяжения.Но по сравнению с другими типами внутримолекулярных сил, такими как полярно-полярные взаимодействия, неполярно-неполярные взаимодействия, такие как силы Вандера-Ваала, водородная связь сильнее.
Водородная связь возникает между полярными ковалентными соединениями. Эти соединения (или молекулы) состоят из полярных ковалентных связей. Полярная ковалентная связь возникает из-за разницы в значениях электроотрицательности атомов, находящихся в ковалентной связи.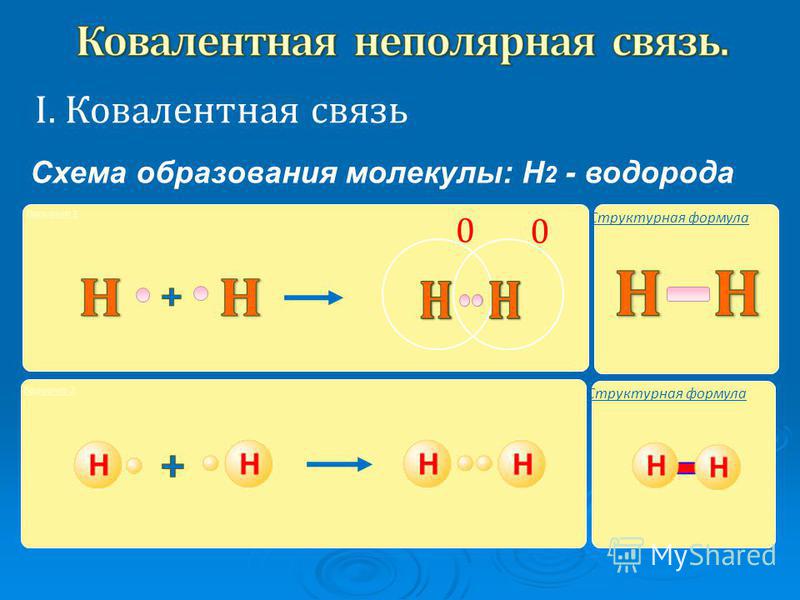 Если эта разница велика, сильно электроотрицательный атом стремится притягивать электроны связи к себе.Это создает дипольный момент, когда этот сильно электроотрицательный атом получает частичный отрицательный заряд, тогда как другой атом получает частичный положительный заряд. Тогда связь становится полярной ковалентной связью. Когда эта молекула встречает другую молекулу с таким дипольным моментом, отрицательный и положительный заряды имеют тенденцию притягиваться друг к другу. Эта сила притяжения называется водородной связью.
Если эта разница велика, сильно электроотрицательный атом стремится притягивать электроны связи к себе.Это создает дипольный момент, когда этот сильно электроотрицательный атом получает частичный отрицательный заряд, тогда как другой атом получает частичный положительный заряд. Тогда связь становится полярной ковалентной связью. Когда эта молекула встречает другую молекулу с таким дипольным моментом, отрицательный и положительный заряды имеют тенденцию притягиваться друг к другу. Эта сила притяжения называется водородной связью.
Водородная связь возникает между сильно электроотрицательными атомами и менее электроотрицательными атомами. Водородные связи существуют, когда у нас есть O, N и F в одной молекуле и положительно заряженный H в другой молекуле.Это связано с тем, что F, N и O являются наиболее электроотрицательными атомами, способными образовывать водородные связи. Сила водородной связи может варьироваться от 5 до 50 кДж / моль. Наиболее прочная водородная связь возникает между атомами HF.
Рисунок 2: Водородные связи между молекулами воды
Вода является наиболее распространенным примером соединения, имеющего водородные связи. Здесь атом кислорода одной молекулы воды может притягивать атом водорода другой молекулы из-за разделения зарядов в этой молекуле.
Сходства между ковалентными и водородными связями
- Ковалентные и водородные связи — это типы химических связей.
- Между двумя атомами возникают связи обоих типов.
- Оба типа связей действуют как клей между двумя атомами.
Разница между ковалентными и водородными связями
Определение
Ковалентные связи: Ковалентные связи — это химические связи, которые образуются из-за разделения электронов между атомами.
Водородные связи: Водородные связи — это силы притяжения, возникающие между двумя атомами двух разных молекул.
Характер облигации
Ковалентные связи: Ковалентные связи представляют собой межмолекулярные химические связи.
Водородные связи: Водородные связи — это внутримолекулярные химические связи.
Химические вещества
Ковалентные связи: Ковалентные связи образуются между двумя атомами.
Водородные связи: Водородные связи образуются между двумя атомами двух разных молекул.
Прочность связи
Ковалентные связи: Прочность ковалентной связи может варьироваться от 100 до 1100 кДж / моль.
Водородные связи: Прочность водородной связи может варьироваться от 5 до 50 кДж / моль.
Заключение
Как ковалентные связи, так и водородные связи являются химическими связями. Ковалентные связи сильнее водородных. Это связано с тем, что ковалентная связь образуется из-за разделения электронов между двумя атомами, тогда как водородная связь образуется из-за притяжения между двумя молекулами.Основное различие между ковалентными и водородными связями состоит в том, что ковалентные связи представляют собой внутримолекулярные притяжения, тогда как водородные связи являются межмолекулярными притяжениями.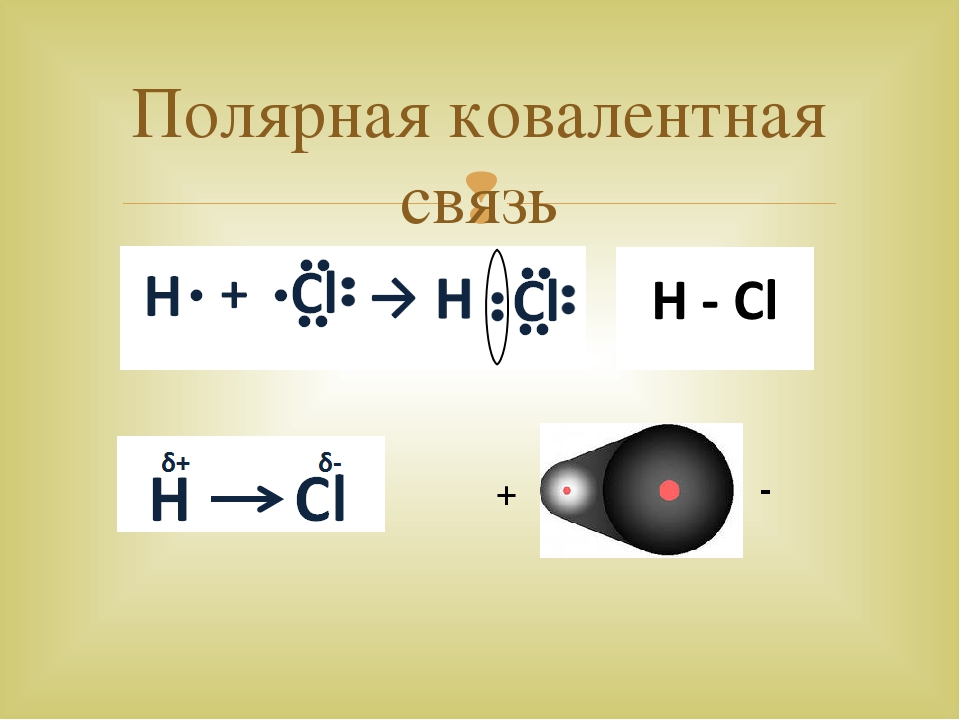
Артикул:
1. Либретексты. «Водородная связь.» Chemistry LibreTexts, доступно здесь. 17 января 2017 г. По состоянию на 16 августа 2017 г.
2. «Ковалентное связывание». BBC, доступно здесь. По состоянию на 16 августа 2017 г.
Изображение предоставлено:
1. «Фтористый водород-2D-точка-крест» Автор Benjah-bmm27 — собственная работа (общественное достояние) через Commons Wikimedia
2.«Водородная связь-в-воде-2D» (общественное достояние) через Commons Wikimedia
Ковалентное связывание и электроотрицательность
Ковалентное связывание и электроотрицательность
Ковалентные связи образуются, когда атомы разделяют электроны. Это совместное использование позволяет каждому атому достичь своего октета электронов и большей стабильности. Метан, CH 4 , простейшее органическое соединение, содержит ковалентные связи. Углерод имеет четыре валентных электрона, а водород — один валентный электрон. Разделяя электроны внешней оболочки, углерод и водород завершают свои валентные оболочки и становятся более стабильными. Дуэт электронов на водороде изоэлектронен гелию и образует законченную оболочку.
Разделяя электроны внешней оболочки, углерод и водород завершают свои валентные оболочки и становятся более стабильными. Дуэт электронов на водороде изоэлектронен гелию и образует законченную оболочку.
Полярность облигаций. В чистой ковалентной связи общие электроны в равной степени доступны каждому из атомов. Такое расположение происходит только тогда, когда два атома одного и того же элемента связаны друг с другом. Таким образом, молекула водорода H 2 содержит хороший пример чистой ковалентной связи.
В большинстве случаев электроны в ковалентных связях не распределяются поровну. Обычно один атом притягивает связывающие электроны сильнее, чем другой. Это неравномерное притяжение приводит к тому, что эти электроны перемещаются ближе к атому с большей силой притяжения. Получающееся в результате асимметричное распределение электронов делает один конец молекулы более богатым электронами, и он приобретает частичный отрицательный заряд, в то время как конец, менее богатый электронами, приобретает частичный положительный заряд. Эта разница в электронной плотности заставляет молекулу становиться полярной , то есть иметь отрицательный и положительный конец.
Эта разница в электронной плотности заставляет молекулу становиться полярной , то есть иметь отрицательный и положительный конец.
Способность атома притягивать электроны в химической связи называется электроотрицательностью атома. Электроотрицательность атома связана с его сродством к электрону и энергией ионизации. Сродство к электрону — это энергия, выделяемая атомом газа, когда к нему присоединяется электрон. Энергия ионизации — это минимальное количество энергии, необходимое для удаления наиболее слабосвязанного электрона из газового атома.
Уровень электроотрицательности обычно измеряется по шкале, созданной Линусом Полингом. В этом масштабе наиболее электроотрицательными элементами являются галогены, кислород, азот и сера. Фтор, галоген, является наиболее электроотрицательным со значением 4,0, которое является наивысшим значением на шкале. Менее электроотрицательными элементами являются щелочные и щелочноземельные металлы. Из них цезий и франций наименее электроотрицательны при значениях 0,7.
Из них цезий и франций наименее электроотрицательны при значениях 0,7.
Элементы с большой разницей в электроотрицательности имеют тенденцию к образованию ионных связей.Атомы элементов с подобной электроотрицательностью имеют тенденцию образовывать ковалентные связи. (Чистые ковалентные связи образуются, когда два атома имеют одну и ту же связь электроотрицательности.) Промежуточные различия в электроотрицательности между ковалентно связанными атомами приводят к полярности связи. Как правило, разница электроотрицательностей в 2 и более по шкале Полинга между атомами приводит к образованию ионной связи. Разница менее 2 между атомами приводит к образованию ковалентной связи. Чем ближе разница в электроотрицательности между атомами к нулю, тем чище становится ковалентная связь и тем меньше у нее полярности.
Углерод с электроотрицательностью 2,5 образует ковалентные связи как с низкой, так и с высокой полярностью. Значения электроотрицательности элементов, обычно встречающихся в органических молекулах, приведены в таблице.
 Т.е. реализуется такое свойство ковалентной связи как направленность.
Т.е. реализуется такое свойство ковалентной связи как направленность.

 Ковалентная связь — полярная, неполярная. Характеристики, механизмы образования и виды ковалентной связи. Ионная связь. Степень окисления. Металлическая связь. Водородная связь.
Ковалентная связь — полярная, неполярная. Характеристики, механизмы образования и виды ковалентной связи. Ионная связь. Степень окисления. Металлическая связь. Водородная связь.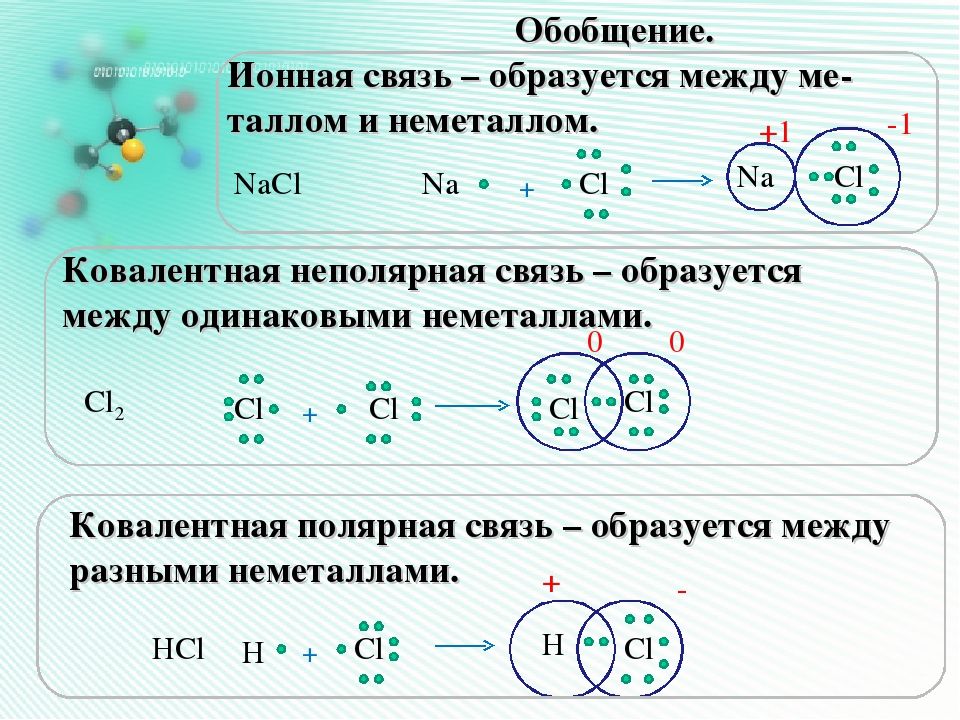



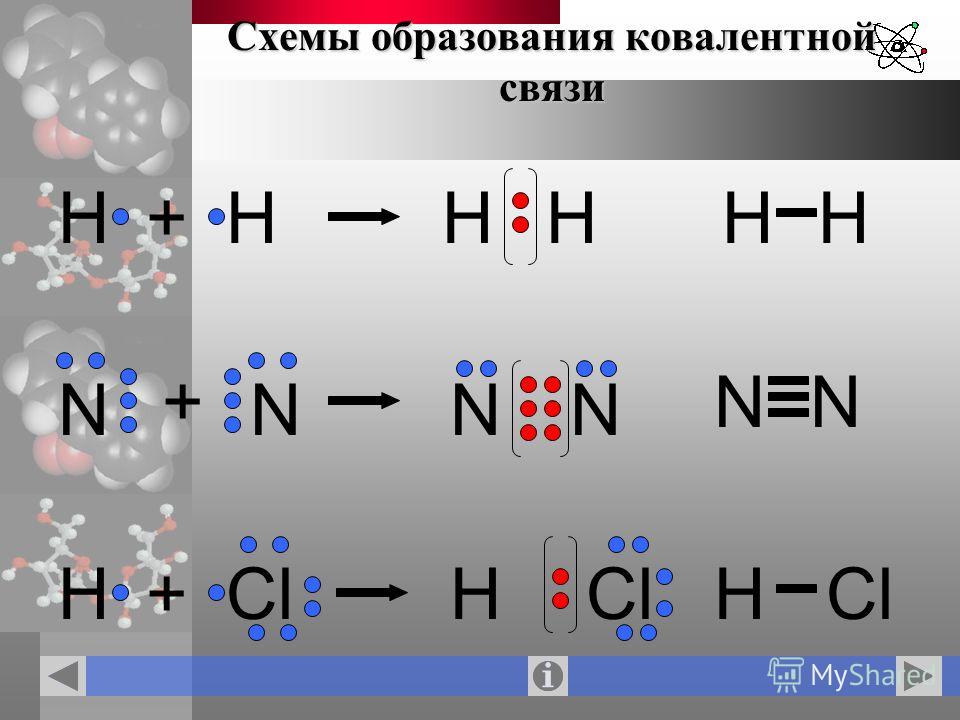 Может быть внутримолекулярная водородная связь и межмолекулярная водородная связь.
Может быть внутримолекулярная водородная связь и межмолекулярная водородная связь.
 Что ты говоришь?
Что ты говоришь?



 Журнал химического образования . 77 (11): 1520. DOI: 10.1021 / ed077p1520
Журнал химического образования . 77 (11): 1520. DOI: 10.1021 / ed077p1520  обвинение.
обвинение. Он рассматривает то, как различия электроотрицательности влияют на тип связи, и объясняет, что подразумевается под полярными связями и полярными молекулами.
Он рассматривает то, как различия электроотрицательности влияют на тип связи, и объясняет, что подразумевается под полярными связями и полярными молекулами. Чтобы получить такую связь, обычно А и В должны быть одним и тем же атомом. Вы найдете такую связь, например, в молекулах H 2 или Cl 2 .
Чтобы получить такую связь, обычно А и В должны быть одним и тем же атомом. Вы найдете такую связь, например, в молекулах H 2 или Cl 2 . На диаграмме «» (читается как «дельта») означает «слегка», поэтому + означает «слегка положительный».
На диаграмме «» (читается как «дельта») означает «слегка», поэтому + означает «слегка положительный». В чистой ковалентной связи электроны удерживаются в среднем ровно на полпути между атомами. В полярной связи электроны слегка притягиваются к одному концу.
В чистой ковалентной связи электроны удерживаются в среднем ровно на полпути между атомами. В полярной связи электроны слегка притягиваются к одному концу. В этом случае пара электронов не переместилась полностью на йодный конец связи. Например, йодид лития растворяется в органических растворителях, таких как этанол, а ионные вещества не растворяются.
В этом случае пара электронов не переместилась полностью на йодный конец связи. Например, йодид лития растворяется в органических растворителях, таких как этанол, а ионные вещества не растворяются. Если вы помните этот факт, все становится легко, потому что электроотрицательность всегда должна возрастать по отношению к фтору в Периодической таблице.
Если вы помните этот факт, все становится легко, потому что электроотрицательность всегда должна возрастать по отношению к фтору в Периодической таблице. (Если он увеличивается до фтора, он должен уменьшаться по мере снижения.) На диаграмме показаны закономерности электроотрицательности в группах 1 и 7.
(Если он увеличивается до фтора, он должен уменьшаться по мере снижения.) На диаграмме показаны закономерности электроотрицательности в группах 1 и 7. Представьте, что хлорид натрия связан с ковалентной связью.
Представьте, что хлорид натрия связан с ковалентной связью. Чем ближе к ядру, тем больше притяжение.
Чем ближе к ядру, тем больше притяжение.

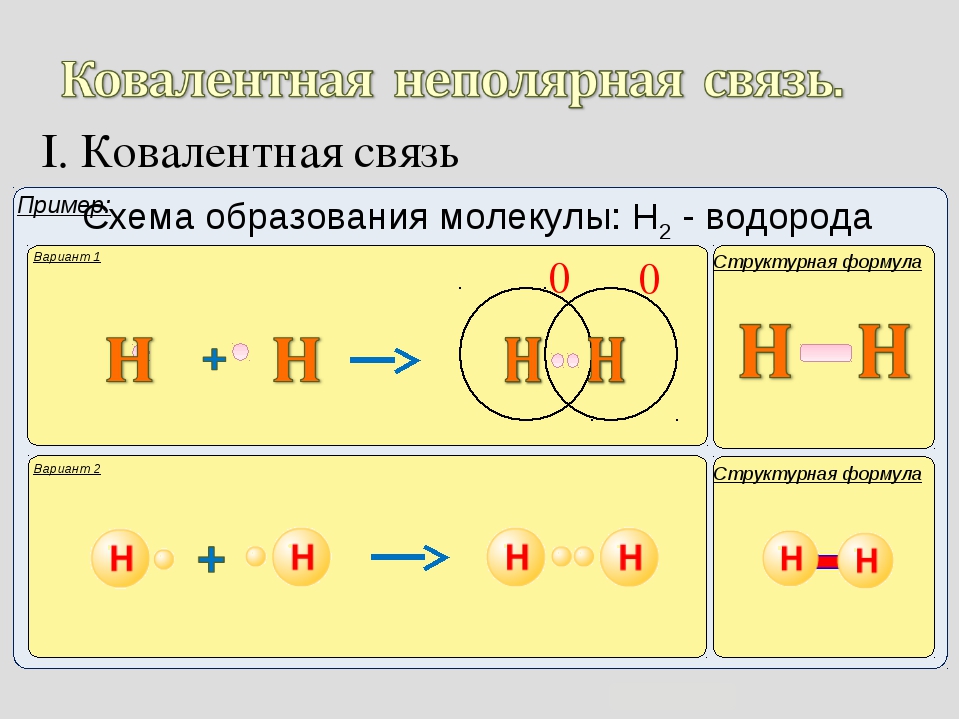

 )
) 4
4 Равное разделение.
Равное разделение. libretexts.org
libretexts.org