Методика решения задач по химии на изменение концентрации раствора
В задачах, связанных с добавлением к раствору определенного количества растворителя или растворенного вещества, необходимо сначала рассчитать массу растворенного вещества в исходном растворе, а затем использовать ее для дальнейших вычислений. Условие каждой задачи для большей наглядности лучше изобразить в виде рисунка.
Задача 1.
К 180,0 г 8% -ного раствора хлорида натрия добавили 20 г NaС1. Массовая доля хлорида натрия в образовавшемся растворе равна ….% (запишите число с точностью до десятых).
Дано:
масса исходного раствора: mисх.р-ра = 180 г;
массовая доля NaС1 в исходном растворе: (NaС1)в исх р-ре = 8%;
масса добавленной соли NaС1: m(NaСl)добавл = 20 г.
Найти:
массовую долю соли в конечном растворе: (NaС1)в кон/ р-ре
Решение:
Условие задачи удобно отобразить в виде рисунка:
1. Находим массу NaСl в исходном растворе:
Находим массу NaСl в исходном растворе:
2. Масса NaС1 в конечном растворе представляет собой сумму:
m(NаС1)в кон.р.ре = m(NаС1)в исх. р.ре + m(NаС1)добавл. = 14,4+ 20 = 34,4 г.
3. Массу добавленной соли учитываем и в массе конечного раствора:
mкон. р-ра = mисх. р-ра + m(NаС1)добавл. = 180 + 20 = 200 г.
4. Полученные данные позволяют определить массовую долю в конечном растворе:
Ответ: (NaС1)в исх р-ре = 17,2%.
Задача, в которой добавляется некоторое количество воды к порции раствора известной концентрации, решается по тому же алгоритму.
В задаче на смешение двух растворов требуется проводить немного большее количество расчетов. В этом случае необходимо вычислить массу растворенного вещества в каждом из
Задача 2.
Смешали 200 г 20%-ного раствора NаОН с 218 мл 10%-ного раствора того же вещества (p = 1,11 г/мл). Массовая доля щелочи в полученном растворе. …% (Запишите число с точностью до десятых).
Массовая доля щелочи в полученном растворе. …% (Запишите число с точностью до десятых).
Дано:
масса первого раствора NаОН: m1 исх р-ра = 200 г;
массовая доля NаОН в первом р-ре: со(МаОН) в 1 исх р-ре = 20% ;
объем второго раствора NаОН: V2исх.р-ра = 218 мл;
массовая доля NаОН во втором р-ре: (NаОН) во 2 исх. р-ре = 10% ;
плотность второго исходного раствора: р2 исх. р.р=1,11 г/мл.
Найти: массовую долю NаОН в конечном р-ре: (NаОН)в кон р-ре
Решение:
Условие задачи удобно отобразить в виде рисунка:
При решении данной задачи необходимо определить массу NаОН в каждом из исходных растворов. Далее найти суммарную массу конечного раствора и массу NаОН в нем. После этого вычисляем искомую величину.
Схематично алгоритм решения можно отразить так:
1. Находим массу NаОН в первом исходном растворе:
2. Находим массу второго исходного раствора:
Находим массу второго исходного раствора:
m2 исх. р-ра = V2 исх. р-ра. p 2 исх. р-ра = 218 . 1,11 = 242 г.
3. Находим массу NаОН во втором исходном растворе:
m(NaOH)в кон. р-ре = m(NaOH)в 1 исх. р-ре + m(NaOH)во 2 исх. р-ре = 40 + 24,2 = 64,2 г.
5. Находим массу конечного раствора:
mкон. р-ра = m1 исх. р-ра + m2 исх. р-ра = 200 + 242 = 442 г.
6. Находим массовую долю NаОН в конечном растворе:Округляем полученное значение до десятых.
Ответ: (NaOH)в кон.р-ре = 14,5%.
В задаче на выпаривание масса раствора уменьшается обычно за счет удаления растворителя. При этом масса растворенного вещества остается прежней, что приводит к увеличению концентрации.
Задача 3.
Определите массу воды, которую необходимо выпарить из 2 л 10% раствора NаОН (р = 1,11 г/мл) для повышения массовой доли NаОН в нем до 15% . Ответ: … г (запишите число с точностью до целых).
Ответ: … г (запишите число с точностью до целых).
Дано:
объем исходного раствора: Vисх. р-ра = 2 л;
плотность исходного раствора: рисх р-ра =1,11 г/мл;
массовая доля NаОН в исходном р-ре: (NаОН)в исх р.ре = 10% ;
массовая доля NаОН в конечном р-ре:(NаОН)
Найти: массу испарившейся воды: m(Н2О)испарили = ?
Решение:
При выпаривании водного раствора NаОН улетучиваться будет только вода. Масса NаОН будет одинаковой как в исходном, так и в конечном растворе.
Схематично алгоритм решения можно представить следующим образом:
1. Найдем массу исходного раствора:
m исх. р-ра = V исх. р-ра. рисх. р-ра
V исх. р-ра = 2 л = 2000 мл
mисх. р-ра = 2000 . 1,11 = 2220 г.
2. Найдем массу NаОН в исходном растворе:
Найдем массу NаОН в исходном растворе:
3. Определим массу конечного раствора:
4. Уменьшение массы раствора произошло только из-за испарения воды, следовательно, по разнице масс исходного и конечного растворов можно найти массу улетучившейся воды:
m(Н2О)испарилось = mисх р-ра – mкон. р-ра = 2220 — 1480 = 740 г.
Ответ: m(Н2О)испарилось = 740 г.
В условиях некоторых задач предполагается выведение из раствора в виде газа легколетучего растворенного вещества (например МН3; НС1; Н2S или растворенного в воде органического вещества). Для решения таких задач необходимо считать неизменной массу растворителя (воды).
Задача 4.
При нагревании 200 г 25%-ного раствора аммиака 20 г этого вещества улетучилось. Массовая доля аммиака в растворе после нагревания равна… % (запишите число с точностью до десятых).
Дано:
масса исходного раствора: mисх р-ра = 200 г;
массовая доля NН3 в исходном растворе: (NН3)в исх.
масса улетучившегося аммиака: m(NН3)улетучилось = 20 г.
Найти: массовую долю NH3 в конечном р-ре: (NН3)в кон. р ре =?
Решение:
Схематично алгоритм решения можно представить следующим образом:
1. Находим массу NН3 в исходном растворе:
2. Находим массу NН3 в конечном растворе:
m(NH3) в кон. р-ре = m(NH3) в исх. р-ре — m(NН3)улетело = 50 — 20 = 30 г.
Находим массу конечного раствора1:
mкон р-ра = mисх р-ра — m(NН3)улетучилось = 200 — 20 = 180 г.
4. Находим массовую долю аммиака в конечном растворе:
Округляем значение, согласно требованию условия, и получаем: (NН3)в кон. р-ре = 16,7% .
Ответ:
 р-ре = 16,7% .
р-ре = 16,7% .Комментарии:
1При решении данной задачи учащиеся часто забывают найти массу
конечного раствора. После определения массы оставшегося аммиака они для нахождения массовой доли NH3 в конечном растворе ошибочно делят массу оставшегося NH3 на массу исходного раствора.
Избежать этой распространенной ошибки помогают комментарии каждой записанной величины. Например, следует записывать mкон. р-ра, а не mр-ра ; m(NH3)в кон. р-ре, а не m(NH3).
Источник:
ЕГЭ. Химия. Расчетные задачи в тестах ЕГЭ. Части А, В, С / Д.Н. Турчен. — М.: Издательство «Экзамен», 2009. — 399 [1]с. (Серия «ЕГЭ. 100 баллов»). I8ВN 978-5-377-02482-8.
Концентрация растворов. Правило креста
В данном разделе рассмотрены задачи на пересчет концентрации растворов, применение правила креста для нахождения концентрации при смешении и разбавлении растворов. Больше задач на расчет массовой доли растворенного вещества представлены в разделе подготовки к ОГЭ по химии.
Больше задач на расчет массовой доли растворенного вещества представлены в разделе подготовки к ОГЭ по химии.
Концентрация растворов и способы ее выражения
Задача 1. К 150 г 20% раствора сахарозы добавили 45 г глюкозы. Рассчитайте массовые доли углеводов в новом растворе.
Показать решение »
Решение.
Вначале сахарозы было 30 г:
20 г сахарозы содержится в 100 г раствора
х г — в 150 г
х =30 г
После прибавления глюкозы:
mобщ = m (сахарозы) + m (глюкозы) = 150 + 45 = 195 г
m раствора стала 195 г
Найдем полученные массовые доли сахарозы и глюкозы:
30 г сахарозы содержится в 195 г раствора
х г — в 100 г
х =15,4
ω2 (сахарозы) = 15,4%:
45 г глюкозы содержится в 195 г раствора
х г — в 100 г
х = = 23,1
ω2 (глюкозы) = 23,1%
Задача 2. Для нейтрализации 20 мл 0,1 н раствора кислоты потребовалось 6 мл раствора едкого натра. Определить нормальную концентрацию раствора едкого натра.
Для нейтрализации 20 мл 0,1 н раствора кислоты потребовалось 6 мл раствора едкого натра. Определить нормальную концентрацию раствора едкого натра.
Задача 3. Нормальная концентрация раствора KNO3 равна 0,2 моль/л. Найти процентную концентрацию раствора KNO3 и молярную концентрацию раствора KNO3. Плотность раствора принять раной 1 г/мл.
Показать решение »
Решение:
Найдем молярную массу и молярную массу эквивалента KNO3.
В данном случае, они совпадают.
М (KNO3) = 39+14+(16×3) = 101 г/моль
Найдем массу KNO3, содержащуюся в его 0,2 н. растворе:
1 н раствор KNO3 содержит – МЭ KNO3 в 1000 мл
Т.е. 1 н – 101 г
0,2 н. – х г
– х г
х = 20,2 г
Теперь вычислим молярную концентрацию
1М раствор KNO3 содержит – М KNO3 в 1000 мл
Т.е. 1 М – 101 г
х – 20,2 г
х = 0,2 моль/л
Таким образом, Сн = См = 0,2 моль/л
Далее находим процентную концентрацию.
Сначала необходимо рассчитать массу раствора объемом 1000 мл.
m = ρ×V = 1×1000 = 1000 г
тогда, решая пропорцию, находим:
20,2 г KNO3 содержится – в 1000 г раствора
х г – в 100 г раствора
х = 2,02 г
ω = 2,02%
Задача 4. Вычислите молярную и молярную концентрацию эквивалента (нормальность) 20 % раствора хлорида кальция плотностью 1,178 г/мл.
Показать решение »
Решение.
Найдем массу раствора
mр-ра = V·ρ = 1000 · 1,178 = 1178 г.
Найдем массу CaCl2, содержащуюся в 1178 г. 20 % раствора
20 г CaCl2 содержится в 100 г раствора
х г — в 1178 г раствора
х = 235,6 г.
Молярность определим с помощью соотношения:
См = n/V
n = m/M = 235,6/111 = 2,1 моль
M(CaCl2) = 40+35,5·2 = 111 г/моль
См = 2,1/1 = 2,1 М
Молярная концентрация эквивалента определяется с помощью соотношения:
Сн = nэ/V
Мэ = fэкв· М(CaCl2) = 1/2·111 = 55,5 г/моль
nэ = m/ Мэ = 235,6/55,5 = 4,2 моль
Сн = 4,2/1 = 4,2 н
Задача 5. Чему равна нормальность 30% раствора NaOH плотностью 1,328 г/мл? К 1 л этого раствора прибавили 5 л воды. Вычислите массовую долю полученного раствора.
Вычислите массовую долю полученного раствора.
Показать решение »
Решение.
Найдем массу NaOH, содержащуюся в 1328 г. 30 % раствора используя формулу:
ω(NaOH) = m (NaOH)/m
mр-ра = V·ρ = 1000 · 1,328 = 1328 г.
m(NaOH) = ω(NaOH) · m = 0,3 · 1328 = 398,4 г.
Найдем Молярную концентрацию эквивалента или нормальность:
M(NaOH) = 23+16+1 = 40 г/моль
Сн = nэ/V
Мэ = fэкв· М(NaOH) = 1·40 = 40 г/моль
nэ = m/ Мэ = 398,4/40 = 9,96 моль
Сн = 9,96/1 = 9,96 н
Найдем массу раствора после прибавления 5 л воды:
m2 = 1328 + 5000 = 6328 г
Далее находим процентную концентрацию или массовую долю вещества.
ω2(NaOH) = m (NaOH)/m2 = 398,4/6328 = 0,063 или 6,3 %
Задача 6. К 3 л 10 % раствора HNO3 плотностью 1,054 г/мл прибавили 5 л 2 % раствора той же кислоты плотностью 1,009 г/мл. Вычислите массовую долю в процентах и молярную концентрацию полученного раствора, объем которого равен 8 л.
К 3 л 10 % раствора HNO3 плотностью 1,054 г/мл прибавили 5 л 2 % раствора той же кислоты плотностью 1,009 г/мл. Вычислите массовую долю в процентах и молярную концентрацию полученного раствора, объем которого равен 8 л.
Показать решение »
Решение.
Найдем массу растворов объемом 3 л и 5 л
m1= V1·ρ = 3000·1,054 = 3162 г
m2= V2·ρ = 5000·1,009 = 5045 г
Найдем массу HNO3, содержащуюся в 3162 г. 10 % раствора
10 г HNO3 содержится в 100 г ее раствора
х1 г — в 3162 г раствора
х1 = 316,2 г
Найдем массу HNO3, содержащуюся в 5045 г. 2 % раствора
2 г HNO3 содержится в 100 г ее раствора
х2 г — в 5045 г раствора
х2 = 100,9 г
При смешивании:
m (HNO3) = 316,2+100,9 = 417,1 г
mр-ра (HNO3) = 3162+5045 = 8207 г
Найдем Молярность
См = n/V
n = m/M = 417,1/63 = 6,62 моль
M(HNO3) = 1+14+16·3 = 63 г/моль
См= 6,62/1 = 6,62 М
ω(HNO3) = m (HNO3)/mр-ра = 417,1/8207 = 0,05 или 5 %
Задача 7. Определить молярность, нормальность, моляльность и титр 4 % раствора FeSO4 объем которого равен 1,5 л, плотность 1037 кг/м3
Определить молярность, нормальность, моляльность и титр 4 % раствора FeSO4 объем которого равен 1,5 л, плотность 1037 кг/м3
Показать решение »
Решение.
M (FeSO4) = 56+32+16·4 = 152 г/моль
Мэ = fэкв· М(FeSO4) = 1/2·152 = 76 г/моль
Найдем m раствора объемом 1,5 л
m = V·ρ = 1,5·10-3 ·1037 = 1,56 кг
Найдем m 4 % раствора
m(FeSO4) = ω(FeSO4) · mр-ра = 0,04·1,56 = 0,0624 кг = 62,4 г
Найдем молярность, которая определяется как количество молей растворенного вещества в одном литре раствора
n = m/М = 62,4/152 = 0,41 моль
См = n/V = 0,41/1,5 = 0,274 М
Найдем нормальность:
nэ = m/Мэ = 62,4/76 = 0,82 моль
Сн = nэ/V = 0,82/1,5 = 0,547 н
Моляльная концентрация равна:
b (x) = n(x)/m
Масса растворителя равна: mH2O = 1560-62,4 = 1497,6 г = 1,5 кг
b (FeSO4) = n(FeSO4)/m = 0,41/1,5 = 0,27 моль/кг
Титр определим следующим образом:
Т (х) = m (х)/V
Т (FeSO4) = m (FeSO4)/V = 62,4/1500 = 0,0416 г/мл
Задачи на смешение и разбавление растворов
Такие задачи можно решить с помощью правила креста или правила смешения. Суть его заключается в составлении «креста», в виде которого располагают две прямые линии. В центре пишут ту концентрацию, которую надо получить, у концов линий креста слева – концентрации исходных растворов (большую – сверху, меньшую — снизу), у концов линий креста справа – искомые концентрации (или массы) растворов, которые получают вычитанием по направлению линий из большей величины меньшей. В общем виде схема решения задач по правилу креста имеет вид:
Суть его заключается в составлении «креста», в виде которого располагают две прямые линии. В центре пишут ту концентрацию, которую надо получить, у концов линий креста слева – концентрации исходных растворов (большую – сверху, меньшую — снизу), у концов линий креста справа – искомые концентрации (или массы) растворов, которые получают вычитанием по направлению линий из большей величины меньшей. В общем виде схема решения задач по правилу креста имеет вид:
Таким образом, следует взять mА грамм раствора с массовой долей а% и прибавить к нему mB грамм раствора с массовой долей b%. Если надо узнать, какие массы растворов данной концентрации следует взять, чтобы получить заданную массу раствора новой концентрации, то сначала определяют отношение mА и mB . Затем пропорционально этому отношению делят заданную массу.
Задача 8. Сколько граммов раствора с массовой долей серной кислоты 96% необходимо влить в 1 л воды, чтобы получить раствор с массовой долей 10%
Показать решение »
Решение.
Для решения данной задачи используем правило креста.
Чистый растворитель (воду) можно представить как раствор с массовой долей растворенного вещества 0%
Определим m раствора с ω (H2SO4) = 96%, который надо влить в 1 л воды:
10 г H2SO4 надо влить в 86 г воды
х г — 1000 г
х = 116,28 г
m (р-ра H2SO4) = 116,28 г
Задача 9. Сколько мл 0,5 М и 0,1 М растворов азотной кислоты следует взять для приготовления 1000 мл 0,2 М раствора.
Показать решение »
Решение.
По правилу креста, определяем в каких соотношениях следует взять 0,5 М и 0,1 М растворы азотной кислоты, чтобы получить раствор заданной концентрации:
V0.5/V0.1 = 0,1/0,3 = 1/3
Взяв 0,1 л и 0,3 л исходных растворов, получим 0,4 л 0,2 М раствора HNO3, но по условию задачи нужно получить 1 л. Для этого разделим 1 л на две части в соотношении 1:3, составив пропорции:
Для этого разделим 1 л на две части в соотношении 1:3, составив пропорции:
Для 0,5 М раствора HNO3
из 0,1 л 0,5 М раствора получим 0,4 л 0,2 М р-ра HNO3
х1 л — 1 л
х1 = 0,25 л
Для 0,1 М раствора HNO3
из 0,3 л 0,5 М раствора получим 0,4 л 0,2 М р-ра HNO3
х2 л — 1 л
х2 = 0,75 л
Задачи по химии, решение задач по химии
На практике мы иногда сталкиваемся с задачами, связанными с определением количественной оценкой веществ, вступающих в химические реакции, оценкой количества получаемых в этой реакции продуктов, интересующих нас веществ. Хозяйкам наверняка часто приходится определять процентное содержание того или иного вещества в растворе и сколько того или другого вещества при этом надо взять. Как правильно рассчитать количество вещества, которое бы нейтрализовало или обезвредило другое вещество? Сколько газа выделится, если к раствору лимонной кислоты добавить соду? Как приготовить, например, 5%-й раствор марганцовки, а также много других задач, встречаемых в бытовой практике.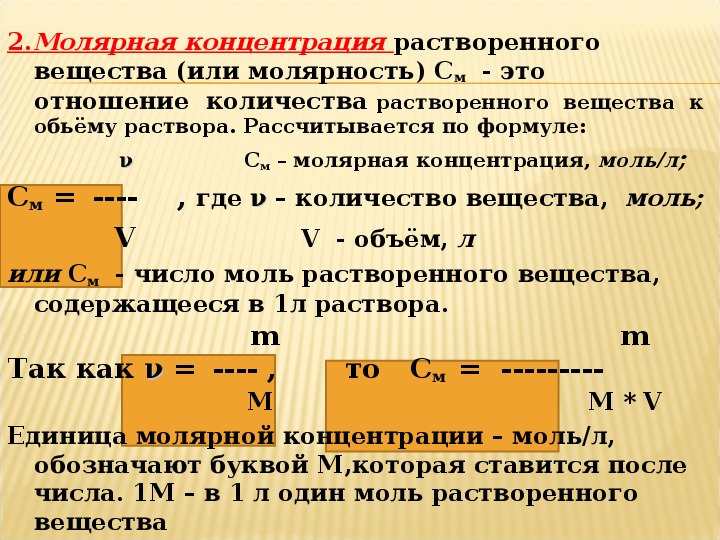
Цель статьи Решение задач по химии — показать, как можно легко решать подобные задачи, не прибегая к сложным химическим расчётам, а применяя лишь общие знания из курса математики и немного общих знаний из химии.
Что нужно знать для решения задач по химии
Кстати, что Вам необходимо знать для решения простых задач по химии:
M — молярная масса (молекулярная масса вещества) — эту величину для простых веществ берут из таблицы Менделеева (число, записанное в правом нижнем углу каждого элемента, например, у углерода M(C)=12,01115 г/моль, при этом дробную часть обычно отбрасывают). Если это газ (например, водород), то M(H2) =1 x 2 =2 г/моль), и так для всех элементов — газов.
В основном мы имеем дело со сложными веществами, молярная масса которых равна сумме молярных масс входящих в него простых элементов, например, углекислый газ (CO2): M(CO2) = 12+16×2 = 44 г/моль.
W — концентрация вещества — это сколько вещества по массе содержится в 100 г раствора, например 5% раствор содержит 5 г сухого вещества и 95 г растворителя.
Ну что ж, рассмотрим наиболее широко распространённую задачку о том, как определить процентное содержание вещества в растворе и сколько нужно взять при этом вещества и самого раствора.
Задача по химии 1Имеется 200 мл 25% раствора уксусной кислоты (CH3 -COOH). Сколько нужно взять воды, чтобы из этого раствора приготовить раствор 5% уксусной кислоты?
Решение:
(М раствора) = (М растворенного вещества) + (М растворителя)1) По формуле W1 = (M вещества) / (М раствора) определим массу растворенного вещества:
(M вещества) = W1 x (М раствора), т.е. 0,25 x 200 = 50 г.
2) Чтобы получить раствор меньшей концентрации, нужно его разбавить водой, при этом масса растворенного в нём вещества не изменется. Поэтому запишем такую же формулу для нового раствора:
Поэтому запишем такую же формулу для нового раствора:
W2 = (M вещества) / ( М растворенного вещества + М растворителя ). Подставив числа, получим:
0,05 = 50 / (М растворителя + 50), откуда находим, что М растворителя = 950 г.
3) Итак, масса нового раствора будет равна (М растворенного вещества) + (М растворителя) = 50 + 950 = 1000 г (1л). Зная массу имевшегося раствора (200 г) и массу нового раствора (1000 г) определяем, что выду нужно добавить 800 г. Ответ: 800 г.
Иногда требуется решить обратную задачу:
Имеется раствор 250 г с концентрацией 5%. Требуется определить, сколько необходимо взять растворимого вещества, чтобы повысить концентрацию раствора до 25%?Решение:
1) Воспользуемся формулой W1 = (M вещества) / (М раствора) и определим массу рстворимого вещества в имеющемся 5% растворе и массу воды в этом растворе:
(M вещества) = 0,05 x 250 = 12,5 г. , значит масса (М растворителя) = (М раствора) — (M вещества) = 250 — 12,5 = 237,5 г.
, значит масса (М растворителя) = (М раствора) — (M вещества) = 250 — 12,5 = 237,5 г.
2) Запишем формулу для нового раствора:
W2 = (M нового вещества) / ( М нового вещества + М растворителя ). Подставив числа, получим:
0,25 = (M нового вещества) / ( М нового вещества + 237,5 ), откуда М нового вещества = 79,16 г.
3) Итак, в ранее имевшемся 5% рстворе содержалось 12,5 г растворенного вещества, а в новом растворе его содержится 79,16 г., значит для получения нового раствора нужно добавить 79,16- 12,5 г = 66,66 г вещества. Ответ: 66,66 г.
Здесь вы можете рассчитать свои растворы, их концентрации для своих практических целей, проверить себя!
Задача по химии 2
Задача на определение количества продуктов реакции или реагентов.
Допустим такое условие. Нам нужно обезвредить кислую среду. Вы случайно разлили 200 мл соляной кислоты (HCl), а под руками оказалась стиральная сода (Na2CO3) (или второе её название — кальцинированная сода). Так вот: сколько нужно взять стиральной соды, чтобы обезвредить 200 мл соляной кислоты!?
Нам нужно обезвредить кислую среду. Вы случайно разлили 200 мл соляной кислоты (HCl), а под руками оказалась стиральная сода (Na2CO3) (или второе её название — кальцинированная сода). Так вот: сколько нужно взять стиральной соды, чтобы обезвредить 200 мл соляной кислоты!?
Решение:
Запишем уравнение химической реакции соляной кислоты со стиральной содой:
2HCl + Na2CO3 => 2NaCl + H2O + CO2.
Из начального курса химии мы знаем, что при реакции кислоты с солью образуется другая кислота (более слабая) и другая соль. В нашем случае образуется угольная кислота, которая сразу же распадается на воду и углекислый газ, и раствор поваренной соли.
Теперь по таблице Менделеева нужно определить молекулярные массы веществ соляной кислоты (2 х HCl) и стиральной соды (Na2CO3). Молекулярная масса с ложного вещества считается как сумма масс входящих в него веществ с учётом количества атомов в молекуле и числа молекул!
Например молекулярная масса 2-x молекул HCl: Mr (HCl) = 2 x (1+ 35,5)= 73 г/моль;
молекулярная масса 1 молекула Na2CO3: Mr (Na2CO3) = 2 х 23 + 12 + 16 х 3)= 106 г/моль
Теперь осталось составить пропорцию:
73 мл (HCl) вступают в реакцию с 106 г Na2CO3
200 мл (HCl) вступают в реакцию с X г Na2CO3, откуда находим, что X = 200 х 106 / 73 = 290 г.
Так вот, чтобы обезвредить 73 мл разлитой кислоты (концентрированной) нужно её смешать с 290 г стиральной соды. Всё!
Такая химическая задачка может немного усложниться, если учитывать концентрацию кислоты. В этом случае, мы должны посчитать, сколько чистого вещества находится в растворе (как в предыдущей задаче 1), а затем составить пропорцию с найденным количеством соляной кислоты. Но в любом случае если даже кислота будет иметь меньшую концентрацию, то наше решение с избытком удовлетворит решение, так как, в таком случае сода будет взята в избытке!
Задача по химии 3Нужно рассчитать, сколько % каждого простого вещества находится в сложном веществе — CaSO4 — гипс.
Решение:
Берём таблицу Менделеева и находим общую относительную молекулярную массу CaSO4: (помним, что общая молекулярная сложного вещества равна сумме молекулярных масс входящих в него простых веществ — выбираем из таблицы)
M (CaSO4) = 40 + 32 +16×4 = 136 г/моль
Теперь рассчитываем долю каждого элемента в отдельности:
40:136 =0,29 (29%)
32:136 = 0,24 (24%)
Процентное содержание кислорода находим как оставшуюся часть задачи: (100%-29%-24% = 47%). Вот и всё.
Вот и всё.
Доводилось ли Вам читать на упаковках продуктов срок годности продуктов! Наверняка! Там стоит дата изготовления и срок хранения при определённой температуре. Но не всегда удаётся хранить продукты при рекомендуемой температуре. Так вот! Можно определить срок хранения продукта, зная условия его рекомендуемого хранения. Итак, задача по химии:
Имеется торт с кремом, срок хранения которого 4 дня при температуре +50C. Вопрос: как долго этот торт можно хранить при температуре +250C?
Решение:
Прежде всего, при решении таких задач (задача по химии на скорость химической реакции) существует правило:
при повышении температуры на каждые 10 0C скорость химической реакции увеличивается в 2…4 раза
откуда следует формула
Vt1 — скорость реакции (рекомендуемая)
Vt2 — скорость реакции при новых условиях
Y — коэффициент равный 2, 3 или 4 (пр решении задач обычно принимается 3)
t1 — температура хранения (рекомендуемая, указанная на упаковке)
t2 — температура хранения при новых условиях
Итак, в нашем случае: t1 = +50C
; t2 = +250C; коэффициент Y = 3
тогда Vt2 / Vt1 = Y(25 — 5) / 10C = 31,5C = 32 = 9 раз.
Итак, если хранить торт при температуре +250C, вместо +50C, то он может храниться по времени в 9 раз меньше, а именно: 4 суток = 96 часов, тогда 96 / 9 = 1,5 часа. Вот так!
Урок «Растворы. Решение задач на растворы» (11 класс)
Технологическая карта урока
Предмет: химия
Класс: 11
Тема: «Растворы. Решение задач на растворы».
Цель урока: воспитание убежденности в позитивной роли химии в жизни современного общества, необходимости грамотного отношения к своему здоровью и окружающей среде.
Задачи:
1. Подвести обучающихся к пониманию необходимости знаний о растворах.
2.Познакомить с новым способом решения задач. Способствовать развитию умения мыслить логически и владеть химическим языком,
3. Развивать навыки наблюдения, экспериментальные навыки, решения задач, умения выделять главное и делать выводы.
Развивать навыки наблюдения, экспериментальные навыки, решения задач, умения выделять главное и делать выводы.
4. Воспитывать умение работать самостоятельно. Показать связь изученной темы с жизнью. Развивать смекалку учащихся.
5. Создать на уроке условия для сохранения здоровья.
Тип урока: комбинированный.
Необходимое оборудование: химические реактивы (растворы HCl, H2SO4, BaCl2, Na2CO3, Mg), химическая посуда, презентация на тему «Растворы», компьютер, экран, проектор.
Формируемые универсальные учебные действия:
Личностные УУД: умение ориентироваться в социальных ролях и межличностных отношениях.
Познавательные УУД: умение анализировать и синтезировать причинно-следственные связи, доказывать свои суждения, сформулировать проблему и найти способы ее решения, умение исследовать, обобщать.
Регулятивные УУД: умение действовать по плану, контролировать, корректировать, оценивать процесс и результаты своей деятельности.
Коммуникативные УУД: умение сотрудничать, вступать в дискуссию, управлять поведением партнера, уметь с достаточной полнотой и точностью выражать свои мысли в соответствии с задачами и условиями коммуникации.
Структура и ход урока
№
Этапы урока
Деятельность учителя
Деятельность обучающихся
1
2
3
4
1
Ориентировочно-мотивационный этап
Учитель начитает урок словами Н. Заболоцкого.
Приложение 1.
Сообщает тему урока, затем в целях актуализации знаний проводит фронтальную беседу по вопросам
Слайды 3-11
Слушают учителя, фиксируют проблему, Высказывают предположение о важности растворов в повседневной жизни.
2.
Исполнительский этап
Учитель предлагает провести химический эксперимент. Проводит инструктаж по ТБ.
Приложение 2.
Учащиеся проводят эксперимент. Общаются в парах и делают вывод
Слайд 12
3.
Первичное усвоение новых знаний
Предлагает новый способ решения задач на смешение растворов. Приложение 3.
Приводит учащимся эвристические рекомендации к решению задач из книги известного американского математика Д. Пойа. (Автора книги «Как решить задачу»)
Слайд 14.
Приложение 4.
Слушают учителя, строят высказывания.
Анализируют услышанное, аргументируют свою точку зрения.
4.
Первичная проверка понимания
Предлагает решить задачи с использованием правила смещения
Приложение 5.
Решают задачи.
Осуществляют взаимоконтроль
Записывают решение на доске.
5.
Пауза для здоровья
Предлагает сделать профилактические упражнения для глаз.
Приложение 6.
Выполняют профилактические упражнения для глаз.
6.
Первичное закрепление
Учитель предлагает провести химический эксперимент. Проводит инструктаж по ТБ.
Приложение 7.
Учащиеся проводят эксперимент. Общаются в парах и делают вывод
Приложение 7.
7.
Контроль усвоения.
Предлагает решить задачи по выбору.
Решают задачи.
Осуществляют взаимоконтроль
Приложение 8
8.
Постановка и решение проблемной задачи
Предлагает поговорить о составе табачного дыма, и напоминает о Федеральном законе «Об охране здоровья граждан от воздействия окружающего табачного дыма и последствий потребления табака»
Предлагает решить задачу.
Приложение 9.
Изучая данные таблицы и решая задачу, учащиеся, отвечают на вопросы о вреде курения и влиянии сигаретного дыма на природу, а также делают вывод для себя, стоит ли курить или стоит отказаться от этого порока.
9.
Информация о домашнем задании, инструктаж по его выполнению
Приложение 10.
Получают карточки с домашним заданием
10.
Рефлексия
Учитель заканчивает урок словами великого химика XX столетия Л. К. Полинга: «Я думаю, что химики – это те, кто на самом деле понимает мир. Этот огромный мир – удел химиков»
К. Полинга: «Я думаю, что химики – это те, кто на самом деле понимает мир. Этот огромный мир – удел химиков»
И предлагает старшеклассникам выразить свое отношение к уроку.
Поднимают вверх смайлики.
Приложение 11.
Приложение 1.
Два мира есть у человека:
Один, который нас творит,
Другой, который мы от века
Творим по мере наших сил…
1) Что происходит с веществами при растворении их в воде?
2) Что такое растворы?
3) Какую роль играют растворы в жизни человека?
4) Какие способы выражения концентрации растворов вы знаете?
Приложение 2.
Опыт 1. К 1 мл 10 %-ного раствора хлорида натрия прилейте 1 мл. 5 %-ного раствора хлорида натрия. Что наблюдаете? Как меняется концентрация вещества в растворе при сливании двух этих растворов? Как изменится концентрация соли, если в раствор соли добавить 10 г хлорида натрия? А если добавить 50 мл воды?
При смешивании исходного раствора с более разбавленным раствором того же вещества, либо при разбавлении водой происходит понижение концентрации исходного раствора. Напротив, добавление к исходному раствору концентрированного раствора того же вещества или добавление дополнительного количества растворённого вещества концентрация исходного раствора увеличивается
Напротив, добавление к исходному раствору концентрированного раствора того же вещества или добавление дополнительного количества растворённого вещества концентрация исходного раствора увеличивается
Приложение 3.
Учитель предлагает новый способ решения таких задач.
Для решения подобных задач удобнее пользоваться правилом смещения (правило креста или квадрат Пирсона), согласно которому количества смешиваемых растворов обратно пропорциональны разностям концентраций смешиваемых растворов; массовые концентрации исходных растворов помещают друг под другом в углу квадрата с левой стороны; задаваемая концентрация растворённого вещества помещается в центре квадрата, а разности между ней и концентрациями исходных растворов (из большего вычитается меньшее) размещаются на концах диагоналей по правым углам квадрата. Следует помнить, что концентрация воды равна 0%, концентрация твёрдого безводного вещества – 100%.
ω1 ω 3 – ω 2 m1
ω 3
ω 2 ω 1 – ω 3 m2
Приложение 4.
Общие рекомендации к решению задач.
«Обдумай цель раньше, чем начать…» — люди начинают вносить предложения, обсуждать и даже бороться за дело, не поняв, какой цели они добиваются.
«С началом считается глупец, о конце думает мудрец» — если вы не уяснили конечной цели, не трудно при решении задачи сбиться с пути, а затем и вовсе забросить её.
«Мудрый меняет свои решения, а дурак никогда» — если мы терпим неудачу, приходится пробовать другие средства и другие пути.
«Подмечай главную возможность» — преимущество «знатока» в том, что он всегда начеку и лучше ориентируется в ситуации.
«Желаемое мы охотно принимаем за действительное» — наш план даёт лишь один общий контур решения. Надо убедиться, что детали соответствуют ему, поэтому мы должны внимательно рассмотреть каждую из них одну за другой.
Приложение 5.
Пример 1. Определить массы исходных растворов с массовыми долями серной кислоты 7,5 % и 60 %, если при их смешивании образовался раствор массой 350 г с массовой долей кислоты 15 %.
Решение
60 7,5 m1
15
7,5 45 m2 = 350 – m1
m1 = 50 г и m2 = 300 г
Ответ: 50 г 60% раствора и 300 г 7,5% раствора.
Задачи для закрепления
В каких массовых соотношениях надо смешать 20% и 5% -ные растворы одного вещества, чтобы получить 10% раствор?
Решение.
20 (10 -5) = 5 вес.ч.(г.)
10
5 (20 -10) = 10 вес.ч.(г.)
Числа 5 и 10 показывают, в каком массовом отношении надо взять растворы. Следовательно, для приготовления 10% раствора нужно смешать 5 г 20% раствора с 10 г 5% раствора в соотношении 1:2. Это соотношение сохранится для данных растворов независимо от того, какое весовое количество 10 % — го раствора нужно приготовить.
2. Какой объём воды надо прибавить к раствору серной кислоты объёмом 100 мл с массовой долей 20 % и плотностью 1,14 г/мл, чтобы получить 5 % раствор?
Решение.
Найдём массу исходного раствора кислоты
m (раствора H2SO4) = ρV = 1,14 г/мл · 100 мл = 114 г
В соответствии с правилом смещения
20 5 114
5
0 15 m(H2O) -?
Для приготовления 5 % -го раствора необходимо к 5 г 20 % -ной кислоты прибавить 15 г воды, т. е в соотношении 1:3.
е в соотношении 1:3.
m (H2O) = г
V (H2O) = m (H2O) / ρ (H2O) = 342 г/ 1 г/мл = 342 мл.
Ответ: 342 мл.
3. Определите массу раствора 9%-ого столового уксуса, который получают из 90 г 80 % уксусной кислоты?
Решение:
80 9 90 г
9
0 71 m(H2O) -?
m (Н2О) = 710 г.
Масса образовавшегося столового уксуса: 710 + 90 = 800 г.
Приложение 6.
1. Посмотреть влево, затем вправо, вверх и вниз, не поворачивая головы (4 раза).
2. Посмотреть вправо вниз, влево вверх, влево вниз, вправо вверх (4 раза).
3. Сделать круговые движения глазным яблоком слева направо, и затем справа налево (каждое движение по 4 раза). Те же самые движения проделать при закрытых глазах.
4. Широко открыть глаза и посмотреть вверх, сосчитать до 10 и опустить их. При выполнении упражнения следует обратить внимание на то, чтобы не морщить лоб. Это можно контролировать, положив на лоб руку. Упражнение следует повторить 8 раз.
Широко открыть глаза и посмотреть вверх, сосчитать до 10 и опустить их. При выполнении упражнения следует обратить внимание на то, чтобы не морщить лоб. Это можно контролировать, положив на лоб руку. Упражнение следует повторить 8 раз.
5. Открыть глаза и посмотреть вверх и влево, сосчитать до 10, затем опустить веки. То же самое проделать, смотря вверх и вправо. Упражнения повторить по 5 раз в каждую сторону
Приложение 7.
Опыт 1. Возьмите пробирку и поместите в неё магниевую стружку и прилейте 1 мл. соляной кислоты. Что наблюдаете? Напишите уравнение реакции.
Опыт 2. В две пробирки налейте 2 мл. раствора карбоната натрия. Затем в одну пробирку прилейте раствор соляной кислоты, а в другую – хлорида магния. Что наблюдаете? Напишите уравнение реакции.
Опыт 3. Возьмите пробирку и налейте в неё 1мл. «купоросной водки», затем добавьте 1-2 мл. раствора хлорида бария. Что наблюдаете? Напишите уравнение реакции.
«купоросной водки», затем добавьте 1-2 мл. раствора хлорида бария. Что наблюдаете? Напишите уравнение реакции.
«Купоросная водка» — серная кислота (М.В. Ломоносов)
Учитель: Как найти массу раствора в этих случаях после реакции?
Учащиеся делают вывод:
mр-ра полученного = mреагента + mр-ра 1– mосадок (газ)
mр-ра полученного = mр-ра1 + mр-ра 2– mосадок (газ)
Приложение 8.
Задачи для закрепления (карточки с заданиями)
1**) Какую массу AgNO3 необходимо добавить к 100 г 5,5 М раствора HCl (ρ = 1,1 г/мл), чтобы получить раствор, в котором массовая доля соляной кислоты равна 10 %? (Ответ: 34 г AgNO3)
2*) Рассчитайте массовые доли веществ в растворе, образовавшемся при действии 25 мл 20%-ной соляной кислоты (плотность 1,1 г/мл) на 4г сульфида железа (II). (Ответ: 19,3 % FeCl2, 7,3 % HCl.)
(Ответ: 19,3 % FeCl2, 7,3 % HCl.)
Приложение 9.
Определить % содержание ядовитых веществ: табачного дегтя, синильной кислоты и оксида углерода, если никотин составляет 2% от всего табачного дыма, а синильная кислота 1\2 часть никотина, а табачного дегтя в 7, 5 раз больше чем никотина. Оксид углерода составляет 3\5 от табачного дегтя». Для решения задачи предлагаю воспользоваться таблицей, в которой указано содержание веществ в дыме 1 сигареты.
Состав дыма сигареты:
Табачный дым – аэрозоль из газов, жидкостей и твердых веществ.
Вещества
Количество
Никотин
3 * 10-3 г
Фенол
120 * 10-6 г
Цианистый водород
400 * 10-6 г
Оксид углерода
10 * 10-3 г
Формальдегид
100 * 10-6 г
Бензол
40 * 10-6 г
Приложение 10.
Задание на дом. 1) Какой объём воды надо добавить к 100 г 70 %-ного раствора уксусной кислоты, чтобы получить 9 %-ный раствор? (678 мл)
2) Какую массу хлорида натрия следует добавить к 200 г 10 %-ного раствора хлорида натрия, чтобы получить 25 %- ный раствор? (40 г)
Приложение 11.
На уроке было комфортно и все понятно
На уроке немного затруднялся не все понятно
На уроке было трудно, ничего не понял.
Конспект урока химии «Решение задач на растворы» — К уроку — Химия
Интегрированный урок математика + химия
на тему: «Решение задач на растворы»
Задачи:
Образовательные:
1. Актуализировать понятие процента, массовой доли вещества и концентрации вещества.
2. Познакомить с нестандартным способом решения задач на смешивание двух растворов разной концентрации.
Познакомить с нестандартным способом решения задач на смешивание двух растворов разной концентрации.
Развивающие:
1. Развивать способности к самостоятельному выбору метода решения задач.
2. Умение обобщать, абстрагировать и конкретизировать знания.
3.Развитие научного мировоззрения, творческого мышления посредством создания проблемной ситуации.
Метапредметные:
— способствовать формированию умений анализировать, сопоставлять, обобщать знания;
— продолжить развивать умение работать в парах;
— воспитывать уважение к мнению других членов коллектива;
— формировать чувство ответственности за свою работу.
Личностные:
— формировать осознанную потребность в знаниях;
— развивать умение управлять своей учебной деятельностью;
Оборудование:
1. Химические препараты и посуда.
2. Мультимедиа проектор.
3. Опорные конспекты.
4. Карточки.
Карточки.
Тип урока: урок объяснения нового материала.
(Проблемное обучение с побудительным диалогом)
Методы обучения: частично-поисковый, репродуктивный, словесно – наглядно – практический.
Деятельность учителя:
Планирует работу учащихся заранее, осуществляет оперативный контроль, оказывает помощь, поддержку и вносит коррективы в их деятельность.
Организационный момент.
Учитель математики: Здравствуйте! Сегодня мы проводим необычный урок — урок на перекрестке наук математики и химии.
Учитель химии: Здравствуйте, ребята! Мы с вами увидим, как математические методы решения задач помогают при решении задач по химии.
А чтобы сформулировать тему урока, давайте проделаем небольшой эксперимент.
(Наливаю в 2 хим. стакана воду, добавляю в оба одинаковое количество сульфата меди. ) Что получилось? (Растворы). Из чего состоит раствор? (Из растворителя и растворённого вещества). А теперь добавим в один из стаканов ещё немного сульфата меди. Что стало с окраской раствора? (Он стал более насыщенным). Следовательно, чем отличаются эти растворы? (Массовой долей вещ-ва).
) Что получилось? (Растворы). Из чего состоит раствор? (Из растворителя и растворённого вещества). А теперь добавим в один из стаканов ещё немного сульфата меди. Что стало с окраской раствора? (Он стал более насыщенным). Следовательно, чем отличаются эти растворы? (Массовой долей вещ-ва).
Учитель математики: А с математической точки зрения — разное процентное содержание вещества в растворе.
Итак, тема урока « Решение задач на растворы»
Учитель математики.Цель урока: Рассмотреть алгоритм решения задач на растворы, познакомить с приемами решения задач в математике и химии, расширить знания о значении этих растворов в быту, сформировать целостную картину о взаимосвязи предметов в школе.
Учитель математики: Для урока необходимо повторить понятие процента.
— Что называют процентом? (1/100 часть числа.)
— Выразите в виде десятичной дроби 17%, 40%, 6%
— Выразите в виде обыкновенной дроби 25%, 30%, 7%
— Установите соответствие 40% 1/4
25% 0,04
80% 0,4
4% 4/5
Одним из основных действий с процентами – нахождение % от числа.
Как найти % от числа? (% записать в виде дроби, умножить число на эту дробь.)
— Найти 10% от 30 (10%=0,1 30*0,1=3)
— Вычислите 1) 20% от 70 2) 6% от 20
3) х% от 7
Учитель химии
– Что такое раствор? (Однородная система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия.)
— Приведите примеры растворов, с которыми вы встречаетесь в повседневной жизни. (уксус, нашатырный спирт, раствор марганцовки, перекись водорода и др.)
– Какое вещество чаще всего используется в качестве растворителя? (Вода.)
Часто понятие “раствор” мы связываем, прежде всего, с водой, с водными растворами. Есть и другие растворы: например спиртовые раствор йода, одеколона, лекарственные настойки.
Хотя именно вода является самым распространённым соединением и “растворителем” в природе.
¾ поверхности Земли покрыто водой
Человек на 70% состоит из воды.
В сутки человек выделяет 3 литра воды и столько же нужно ввести в организм.
Овощи – 90% воды содержат (рекордсмены-огурцы -98%)
Рыба 80% (рекордсмен у животных – медуза 98%)
Хлеб – 40%
Молоко – 75%
– Что такое массовая доля растворенного вещества? (Отношение массы растворенного вещества к общей массе раствора.)
– Вспомните формулу для вычисления массовой доли растворенного вещества и производные от нее (w = m (р.в.)/m (р-ра ) ; m (р.в.)= m (р-ра) ×w ; m (р-ра) = m (р.в.)/ w )
– По какой формуле можно рассчитать массу раствора? (m(р-ра) = m (р.в.) + m (р-ля)).
Учитель химии предлагает решить учащимся задачу:
Задача №1 Перед посадкой семена томатов дезинфицируют 15%-ным раствором марганцовки. Сколько г марганцовки потребуется для приготовления 500 г такого раствора? (Ответ: 40 г.)
Сколько г марганцовки потребуется для приготовления 500 г такого раствора? (Ответ: 40 г.)
Решение.
Дано: ω% =
ω%=15%
m(р-ра)=500г
m(в-ва)=?
m(в-ва)= m (р-ра) • ω
m(в-ва)=500 • 0,15=75г
Ответ: 75 г марганцовки.
Учитель математики.
– Давайте посмотрим на эту задачу с точки зрения математики. Какое правило на проценты вы применили при решении этой задачи? (Правило нахождения процента от числа.)
15% от 500
500*0,15=75(г)- марганцовки.
Ответ: 75 г.
– Как видите, задачи, которые вы встречаете на химии, можно решать на уроках математики без применения химических формул.
Задачам на растворы в школьной программе уделяется мало времени, но эти задачи встречаются на ОГЭ в 9 классе и ЕГЭ в 11 классах. Рассмотрим пример такой задачи.
Задача №2. При смешивании 10%-го и 30%-го раствора марганцовки получают 200 г 16%-го раствора марганцовки. Сколько граммов каждого раствора взяли?
Можно ли решить эту задачу так быстро?
О чем говорится в этой задаче? (о растворах.)
Что происходит с растворами? (смешивают.)
м растворенного в-ва 1 + м раств в= ва 2=м растворенного в-ва 3
Решение:
Раствор | %-е содержание | Масса раствора (г) | Масса вещества (г) |
1 раствор 2 раствор | 10% = 0,1 30% = 0,3 | х 200-х | 0,1х 0,3(200-х) |
Смесь | 16% = 0,16 | 200 | 0,16*200 |
0,1х + 0,3(200-х) = 0,16*200
0,1х + 60 – 0,3х = 32
-0,2х = -28
х = 140
140(г)- 10% раствора
200 – 140 = 60(г)-30% раствора.
Ответ: 140г, 60г.
Учитель химии решает задачу методом Квадрата Пирсона.
Учитель математики. Рассмотрим еще один раствор – это уксусная кислота. Разбавленный (6-10%) раствор уксусной кислоты под названием «столовый уксус» используется для приготовления майонеза, маринадов и т.д. Уксусная эссенция 70% раствор. Ее нельзя применять без разбавления для приготовления пищевых продуктов. «Столовый уксус», используют для приготовления маринадов, майонеза, салатов и других пищевых продуктов. Очень часто при приготовлении блюд под руками оказывается уксусная эссенция. Как из нее получить столовый уксус. Поможет следующая задача.
Задача №3. Какое количество воды и 70%-го раствора уксусной кислоты следует взять для того, чтобы приготовить 200 г столового уксуса (8%-ый раствор уксусной кислоты.)
Решение:
Раствор | %-е содержание | Масса раствора (г) | Масса вещества (г) |
Уксусная кислота Вода | 70%=0,7 0%=0 | х 200-х | 0,7х 0 |
Смесь | 7%=0,07 | 200 | 0,07*200 |
0,7х = 0,07*200
0,7х = 14
х = 14:0,7
х = 20
20 (г) – уксусной кислоты
200 – 20 = 180 (г) – воды.
Ответ: 20 г, 180г.
Учитель химии. А сейчас мы решим экспериментальную задачу.
Приготовить 20 г 5%-го раствора поваренной соли. (Расчётная часть). Затем выполняем практическую часть. (Напомнить правила Т-Б).
Решение 1. Расчётная часть
Дано:
ω%=5%
m(р-ра)=20г
m(в-ва)=? m(в-ва) = m (р-ра) · ω
V (р-ля) = ?m(в-ва) = 20 · 0,05 = 1 г.
m(р-ля) = m (р-ра) — m(в-ва)
m(р-ля) = 20 – 1 = 19 г
V (р-ля) = m (р-ля) : ρ= 19г : 1г/мл = 19 мл
Ответ: 1 г соли и 19 мл воды.
2. Экспериментальная часть( Соблюдать правила техники безопасности).
Уравновесить весы.
Взвесить необходимое количество соли.
Отмерить мерным цилиндром воду.
Смешать воду и соль в стакане.
Учитель математики. Проведем проверочную работу, в которую включили задачи из сборника для подготовки к экзаменам в 9 классе.
Проверочная работа.
При смешивании 15%-го и 8% -го раствора кислоты получают 70 г 10%-го раствора кислоты. Сколько граммов 15%-го раствора взяли?
| При смешивании 15%-го и 60% -го раствора соли получают 90 г 40%-го раствора соли. Сколько граммов 15%-го раствора взяли?
| ||||||||||||||||||||||||
0,15х + 0,08(70-х)=0,1*70 0,15х+ 5,6-0,08х =7 0,07х=7-5,6 0,07х=1,4 х= 1,4:0,07 х=20 20(г)- 15%-го раствора.
Ответ: 20 г.
|
0,15х+0,6(90-х)=0,4*90 0,15х+54-0,6х=36 -0,45х=36-54 -0,45х =-18 х=18:0,45 х=40 40(г)-15% раствора.
Ответ: 40 г. |
Подведение итогов урока
Учитель химии.
– Посмотрите на содержание всех решенных сегодня задач. Что их объединяет? (Задачи на растворы.)
– Действительно, во всех задачах фигурируют водные растворы; расчеты связаны с массовой долей растворенного вещества; и если вы обратили внимание, задачи касаются разных сторон нашего быта.
Учитель математики.
– Посмотрите на эти задачи с точки зрения математики. Что их объединяет? (Задачи на проценты.)
При решении всех этих задач мы используем правило нахождения процента от числа.
Оценки за урок.
Домашнее задание.
Важное место в рационе питания человека, а особенно детей занимает молоко и молочные продукты. Решим такую задачу:
Решим такую задачу:
Задача №1. Какую массу молока 10%-й жирности и пломбира 30%-й жирности необходимо взять для приготовления 100г 20%-го новогоднего коктейля?
Решение:
| %-е содержание | Масса раствора (г) | Масса вещества (г) |
Молоко Пломбир | 10%=0,1 30%=0,3 | х 100-х | 0,1х 0,3(100-х) |
Коктейль | 20%=0,2 | 100 | 0,2*100 |
0,1х + 0,3(100-х) = 0,2*100
0,1х + 30 – 0,3х = 20
-0,2х = -10
х = 50
50(г) – молока
100 – 50 = 50(г) – пломбира.
Ответ:50г молока,50г пломбира.
Задача №3. Для засола огурцов используют 7% водный раствор поваренной соли (хлорида натрия NaCl). Именно такой раствор в достаточной мере подавляет жизнедеятельность болезнетворных микроорганизмов и плесневого грибка, и в то же время не препятствует процессам молочнокислого брожения. Рассчитайте массу соли и массу воды для приготовления 1 кг такого раствора?
Рефлексия. (Синквейн)
Раствор
Разбавленный, водный
Растворять, смешивать, решать
Растворы широко встречаются в быту.
Смеси
Наш урок подошел к концу. Сейчас каждый из вас оставит на парте тот смайлик, какое настроение вы приобрели на уроке.
Спасибо за урок!
w = m (р. в.)/m (р-ра ) ; m (р.в.)= m (р-ра) ×w ; m (р-ра) = m (р.в.)/ w
в.)/m (р-ра ) ; m (р.в.)= m (р-ра) ×w ; m (р-ра) = m (р.в.)/ w
Задача №1. Перед посадкой семена томатов дезинфицируют 15%-ным раствором марганцовки. Сколько г марганцовки потребуется для приготовления 500 г такого раствора?
Задача №2.При смешивании 10%-го и 30%-го раствора марганцовки получают 200 г 16%-го раствора марганцовки. Сколько граммов каждого раствора взяли?
Решение:
Раствор | %-е содержание | Масса раствора (г) | Масса вещества (г) |
1 раствор 2 раствор |
|
|
|
Смесь |
|
|
|
Задача №3.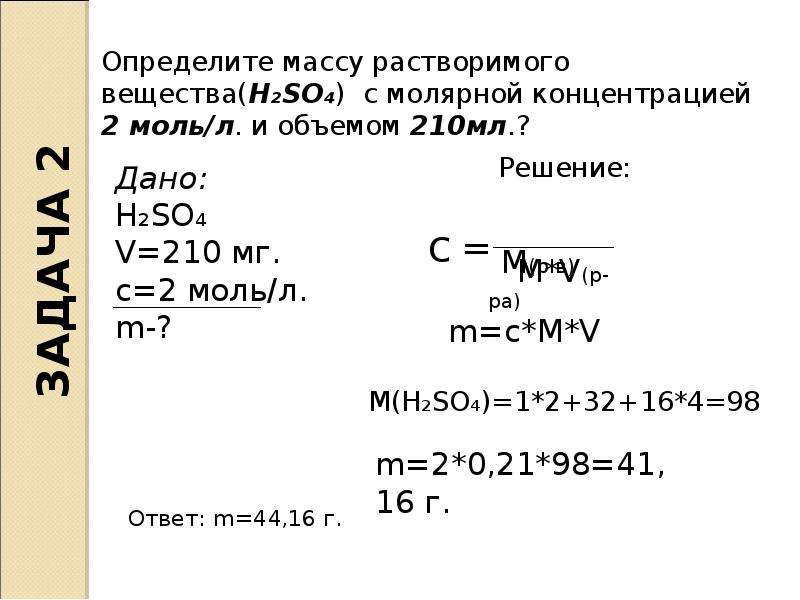 Какое количество воды и 70%-го раствора уксусной кислоты следует взять для того, чтобы приготовить 200 г столового уксуса (8%-ый раствор уксусной кислоты.)
Какое количество воды и 70%-го раствора уксусной кислоты следует взять для того, чтобы приготовить 200 г столового уксуса (8%-ый раствор уксусной кислоты.)
Решение:
Раствор | %-е содержание | Масса раствора (г) | Масса вещества (г) |
Уксусная кислота Вода |
|
|
|
Смесь |
|
|
|
Экспериментальная задача.
Приготовить 20 г 5%-го раствора поваренной соли.
Решение 1. Расчётная часть
Дано:
ω%=5%
m(р-ра)=20г
m(в-ва)=?
V (р-ля) = ?
2. Экспериментальная часть ( Соблюдать правила техники безопасности).
1. Уравновесить весы.
2. Взвесить необходимое количество соли.
3. Отмерить мерным цилиндром воду.
4. Смешать воду и соль в стакане.
Проверочная работа.
При смешивании 15%-го и 8% -го раствора кислоты получают 70 г 10%-го раствора кислоты.
| При смешивании 15%-го и 60% -го раствора соли получают 90 г 40%-го раствора соли. Сколько граммов 15%-го раствора взяли?
| ||||||||||||||||||||||||
|
|
Домашнее задание.
Задача №1. Какую массу молока 10%-й жирности и пломбира 30%-й жирности необходимо взять для приготовления 100г 20%-гомолочного коктейля?
Задача №2. Для засола огурцов используют 7% водный раствор поваренной соли (хлорида натрия NaCl). Именно такой раствор в достаточной мере подавляет жизнедеятельность болезнетворных микроорганизмов и плесневого грибка, и в то же время не препятствует процессам молочнокислого брожения. Рассчитайте массу соли и массу воды для приготовления 1 кг такого раствора?
Домашнее задание.
Задача №1. Какую массу молока 10%-й жирности и пломбира 30%-й жирности необходимо взять для приготовления 100г 20%-го молочного коктейля?
Задача №2. Для засола огурцов используют 7% водный раствор поваренной соли (хлорида натрия NaCl). Именно такой раствор в достаточной мере подавляет жизнедеятельность болезнетворных микроорганизмов и плесневого грибка, и в то же время не препятствует процессам молочнокислого брожения. Рассчитайте массу соли и массу воды для приготовления 1 кг такого раствора?
Рассчитайте массу соли и массу воды для приготовления 1 кг такого раствора?
Домашнее задание.
Задача №1. Какую массу молока 10%-й жирности и пломбира 30%-й жирности необходимо взять для приготовления 100г 20%-го молочного коктейля?
Задача №2. Для засола огурцов используют 7% водный раствор поваренной соли (хлорида натрия NaCl). Именно такой раствор в достаточной мере подавляет жизнедеятельность болезнетворных микроорганизмов и плесневого грибка, и в то же время не препятствует процессам молочнокислого брожения. Рассчитайте массу соли и массу воды для приготовления 1 кг такого раствора?
Формула концентрации раствора в химии
Определение и формула концентрации раствора
Наиболее распространены следующие способы выражения концентрации раствора.
Массовая доля – отношение (обычно – процентное) массы растворенного вещества к массе раствора:
w = msolute / msolution× 100%.
Например, 15: (масс.) водный раствор хлорида натрия – это такой раствор, в 100 единицах массы которого содержится 15 единиц массы NaCl и 85 единиц массы воды.
Молярная доля – это отношение количества растворенного вещества (или растворителя) к сумме количеств всех веществ, составляющих раствор. В случае раствора одного вещества в другом молярная доля растворенного вещества (N2) равна:
N2 = n2 / (n1 + n2),
а молярная доля растворителя (N1):
N1 = n1 / (n1 + n2),
где n1иn2 – соответственно количество вещества растворителя и растворенного вещества.
Молярная концентрация, или молярность – отношение количества растворенного вещества к объему раствора:
СМ = n / V.
Обычно молярность обозначается СМили (после численного значения молярности) М. Так, 2М H2SO4 означает раствор, в каждом литре которого содержится 2 моля серной кислоты, т.е. СМ = 2 моль/л.
Так, 2М H2SO4 означает раствор, в каждом литре которого содержится 2 моля серной кислоты, т.е. СМ = 2 моль/л.
Моляльная концентрация, или моляльность – это отношение количества растворенного вещества к массе растворителя:
m = nsolute / msolvent.
Обычно моляльность обозначается буквой m. Так, для раствора серной кислоты запись m = 2 моль/кг (воды) означает, что в этом растворе на каждый килограмм растворителя (воды) приходится 2 моля серной кислоты. Моляльность раствора в отличие от его молярности не изменяется при изменении температуры.
Нормальность раствора (нормальная концентрация, молярная концентрация эквивалента) СН(Х) – это отношение количества вещества эквивалента, содержащегося в растворе, к объему этого раствора [моль / м3]. На практике нормальность раствора по аналогии с молярной концентрацией выражают в моль/л. Так, например, с(H2SO4) = 1 моль/л, с(KOH) = 0,01 моль/л. При с(В) = 1 моль/л раствор называют нормальным, при с(В) = 0,01 моль/л – сантимолярным и т.д. Приняты и такие обозначения: 1 н. раствор H2SO4; 0,01 н. раствор KOH.
При с(В) = 1 моль/л раствор называют нормальным, при с(В) = 0,01 моль/л – сантимолярным и т.д. Приняты и такие обозначения: 1 н. раствор H2SO4; 0,01 н. раствор KOH.
Эквивалентом называется реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях. Моль вещества эквивалента содержит 6,02×1023 эквивалентов.
Титр раствора – это масса вещества, содержащаяся в одном кубическом сантиметре (одном миллилитре) раствора [г/мл]. Обычно обозначается буквой Т. Например, T(HCl) = 0,02 г/мл означает, что в 1 мл раствора содержится 0,02 г соляной кислоты.
Примеры решения задач
Задачи на растворы — презентация онлайн
1. Задачи на растворы
Способы выражения концентрацииМассовая доля растворенного вещества (ω),
процентная концентрация (С%) – показывает,
какая масса вещества растворена в 100 г раствора
и вычисляется по формуле
mвещества(г)
ω =——————m раствора(г)
Из этой формулы можно получить другие расчетные
формулы:
mв-ва = ω * mр-ра
mв-ва
m (раствора) =———ω
Действия с растворами
1
Разбавление
растворов
2
Концентрирование
растворов
3
Смешивание
2 и более
растворов
«Метод стаканчиков»
1.
 Изобразить 3 стаканчика.
Изобразить 3 стаканчика.W1
W2
W3
m1
m2
m3
исходные
конечный
растворы
раствор
2. Сверху стаканчиков записывают
массовую долю растворенного вещества
3.Под стаканчиками – массы компонентов.
«Метод стаканчиков»
4.Составляем математическое выражение
W1
W2
W3
m1
m2
m3
исходные
растворы
конечный
раствор
w1 ∙ m1 + w2 ∙ m2 = w3 ∙ m3
(алгебраическое уравнение
с одним неизвестным)
Традиционный способ решения
Решение задач связанные с разбавлением
растворов.
Задача. К 120 граммам 5% раствора соли добавили
80 г воды. Вычислите массовую долю соли в
полученном растворе.
Решение:
Составляем схему приготовления раствора.
0,05
0
х
│▬│
+
│▬│ =
│▬│
120
80
200
Составляем уравнение и решаем его относительно х
• 120 *0,05 + 0 * 80 = 200х
• 6 +0 = 200х
NB!! Доля в воде
• х = 6/200
всегда принимается
за 0
х = 0,03 или 3%
Ответ: ω (соли)=0,03 или 3%
Решение задач связанные со смешиванием
растворов.

Задача. Смешали 200 граммов раствора с массовой
долей соли 0,1 и 20 граммов этого же раствора с
массовой долей соли 0,3. Вычислите массовую
долю растворенного вещества во вновь полученном
растворе?
Решение: Составляем схему приготовления раствора.
0,1
0,3
х
│▬│
+
│▬│ =
│▬│
200
20
220
Составляем уравнение и решаем его относительно х
• 200 *0,1 + 20 * 0,3 = 220х
• 20 +6 = 220х
• х = 0,11 или 11%
Ответ: ω (соли)=0,11 или 11%
Решение задач связанные с
концентрированием раствора
Задача. К 200 граммам 4% раствора соды добавили
еще 5 г вещества. Определите массовую долю
вещества в полученном растворе.
Дано:
Решение:
m(р-ра) = 200г
Составляем схему приготовления раствора
ω1 = 4%или 0,04
0,04
1
х
m добав. в-ва = 5г
│▬│
+ │▬│ =
│▬│
Найти ω2 -?
200
5
205
Составляем уравнение и решаем его относительно х
• 200 *0,04 + 5 * 1= 205х
NB!! Доля самого
• 8+5 = 205х
cухого вещества
• х = 0,063 или 6,3%
(без раствора)
Ответ: ω (соды)=0,063 или 6,3%
всегда =1 (100%).

Решение задач связанные с
концентрированием раствора
Задача. Из 400 граммов 20% раствора соли
упариванием удалили 100 граммов воды. Чему
стала равна массовая доля соли в полученном
растворе?
Дано:
Решение:
m(р-ра) = 400г
Составляем схему приготовления раствора
ω1 = 20%или 0,2
0,2
0
х
│▬│ ▬ │▬│ = │▬│
m удал. в-ва = 100г
Найти ω2 -?
400
100
300
Составляем уравнение и решаем его относительно х
• 400 *0,2 — 100 * 0 = 300х
NB!! Доля в воде
• 80 = 300х
всегда принимается
• х = 0,266 или 26,6%
за 0
Ответ: ω (соли)=0,266 или 26,6%
1) К раствору хлорида кальция массой 160г и массовой долей
5% добавили 12г этой же соли. Массовая доля соли в
полученном растворе равна ____ %. (Запишите число с
(11,63 %)
точностью до сотых)
2) Массовая доля сахара в сиропе, полученном упариванием 1
кг 10%-го раствора сахара до массы 250 г, равна _____ %.

(Запишите число с точностью до целых). (40%)
1) К 200 г 20%-го раствора гидроксида натрия добавили 80 г воды и 16 г гидроксида
натрия. Массовая доля щелочи в полученном растворе равна_______(Запишите
число с точностью до целых).
(19%)
2)Массовая доля соли в растворе, полученном при добавлении 120г воды к 200 г
раствора с массовой долей соли 8% равна ______%. (Запишите число с точностью до
(5%)
целых)
3)Рассчитайте массу(г)соли, которую необходимо добавить к 240 мл воды, чтобы
получить 16%-й раствор. .( Запишите число с точностью до десятых) (45,7 г)
4)Смешали 120 г 12%-го раствора натриевой селитры и 360 г 8%-го раствора этой же
соли. Массовая доля соли в полученном растворе составила ______%. (Запишите
число с точностью до целых).
(9%)
4.5: Концентрация растворов — Химия LibreTexts
Многие люди имеют качественное представление о том, что подразумевается под концентрацией . Любой, кто готовил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматизированный, высококонцентрированный напиток, тогда как слишком мало дает разбавленный раствор, который трудно отличить от воды. В химии концентрация раствора — это количество растворенного вещества , которое содержится в определенном количестве растворителя или раствора.Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для растворных реакций. Химики используют множество различных методов для определения концентрации, некоторые из которых описаны в этом разделе.
В химии концентрация раствора — это количество растворенного вещества , которое содержится в определенном количестве растворителя или раствора.Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для растворных реакций. Химики используют множество различных методов для определения концентрации, некоторые из которых описаны в этом разделе.
Молярность
Наиболее распространенной единицей концентрации является молярность , которая также наиболее полезна для расчетов, связанных со стехиометрией реакций в растворе. Молярность (М) определяется как количество молей растворенного вещества, присутствующего ровно в 1 л раствора.Это эквивалентно количеству миллимолей растворенного вещества, присутствующего ровно в 1 мл раствора:
. \[ молярность = \dfrac{моли\: из\: растворенного вещества}{литры\: из\: раствора} = \dfrac{ммоль\: из\: растворенного вещества} {миллилитры\: из\: раствора} \label{4. 5 .1}\]
5 .1}\]
Таким образом, единицами молярности являются моли на литр раствора (моль/л), сокращенно \(М\). Водный раствор, содержащий 1 моль (342 г) сахарозы в количестве воды, достаточном для получения конечного объема 1,00 л, имеет концентрацию сахарозы, равную 1.00 моль/л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формулы растворенного вещества обозначают молярную концентрацию растворенного вещества. Следовательно,
\[[\rm{сахароза}] = 1,00\: М\]
читается как «концентрация сахарозы 1,00 молярная». Отношения между объемом, молярностью и молями могут быть выражены как
\[ V_L M_{моль/л} = \cancel{L} \left( \dfrac{mol}{\cancel{L}} \right) = моли \label{4.5.2}\]
или
\[ V_{мл} M_{ммоль/мл} = \cancel{мл} \left( \dfrac{ммоль} {\cancel{мл}} \right) = ммоль \label{4.5.3}\]
На рисунке \(\PageIndex{1}\) показано использование уравнений \(\ref{4.5.2}\) и \(\ref{4.5.3}\).
Рисунок \(\PageIndex{1}\): Приготовление раствора известной концентрации с использованием твердого растворенного веществаПример \(\PageIndex{1}\): расчет молей по концентрации NaOH
Рассчитайте количество молей гидроксида натрия (NaOH) в 2,50 л 0,100 М NaOH.
Дано: идентичность растворенного вещества и объем и молярность раствора
Запрос: количество растворенного вещества в молях
Стратегия:
Используйте любое уравнение \ref{4.5.2} или уравнение \ref{4.5.3}, в зависимости от единиц измерения, указанных в задаче.
Решение:
Поскольку нам дан объем раствора в литрах и нас спрашивают о количестве молей вещества, уравнение \ref{4.5.2} более полезно:
\( моль\: NaOH = V_L M_{моль/л} = (2,50\: \отменить{L}) \влево(\dfrac{0,100\: моль} {\отменить{L}} \вправо) = 0,250\:моль\:NaOH\)
Упражнение \(\PageIndex{1}\): Расчет молей по концентрации аланина
Рассчитайте количество миллимолей аланина, биологически важной молекулы, в 27.2 мл 1,53 М аланина.
- Ответить
41,6 ммоль
Расчеты с учетом молярности (M): https://youtu. be/TVTCvKoSR-Q
be/TVTCvKoSR-Q
Концентрации также часто указываются в пересчете на массу (m/m) или на основе массы на объем (m/v), особенно в клинических лабораториях и инженерных приложениях. Концентрация, выраженная в м/м, равна количеству граммов растворенного вещества на грамм раствора; концентрация на основе m/v представляет собой количество граммов растворенного вещества на миллилитр раствора.Каждое измерение можно выразить в процентах, умножив отношение на 100; результат сообщается как процент масс./масс. или процент масс./об. Концентрация очень разбавленных растворов часто выражается в частей на миллион ( частей на миллион ), что составляет граммы растворенного вещества на 10 6 г раствора, или в частей на миллиард ( частей на миллиард ), что равно граммов растворенного вещества на 10 9 г раствора. Для водных растворов при 20°C 1 ppm соответствует 1 мкг на миллилитр, а 1 ppb соответствует 1 нг на миллилитр.Эти концентрации и их единицы приведены в таблице \(\PageIndex{1}\).
| Концентрация | Единицы |
|---|---|
| м/м | г растворенного вещества/г раствора |
| т/х | г растворенного вещества/мл раствора |
| частей на миллион | г растворенного вещества/10 6 г раствора |
| мкг/мл | |
| частей на миллиард | г растворенного вещества/10 9 г раствора |
| нг/мл |
Приготовление растворов
Чтобы приготовить раствор, содержащий определенную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора. На рисунке \(\PageIndex{1}\) показана эта процедура для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворителя не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на требуемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора.Как показано на рисунке \(\PageIndex{2}\), для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
На рисунке \(\PageIndex{1}\) показана эта процедура для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворителя не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на требуемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора.Как показано на рисунке \(\PageIndex{2}\), для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Пример \(\PageIndex{2}\)
Раствор содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 •2H 2 O, в этаноле, достаточном для получения ровно 500 мл раствора. Какова молярная концентрация \(\ce{CoCl2•2h3O}\)?
Какова молярная концентрация \(\ce{CoCl2•2h3O}\)?
Дано: масса растворенного вещества и объем раствора
Запрашиваемый: концентрация (M)
Стратегия:
Чтобы найти количество молей \(\ce{CoCl2•2h3O}\), разделите массу соединения на его молярную массу. Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 •2H 2 O равна 165.87 г/моль. Следовательно,
\[ моль\: CoCl_2 \cdot 2H_2O = \left( \dfrac{10,0 \: \cancel{g}} {165,87\: \cancel{g} /моль} \right) = 0,0603\: моль \номер\]
Объем раствора в литрах равен
\[объем = 500\: \cancel{мл} \left( \dfrac{1\: L} {1000\: \cancel{мл}} \right) = 0 .500\: L \nonumber \]
Молярность — это количество молей растворенного вещества на литр раствора, поэтому молярность раствора равна
.
\[ молярность = \dfrac{0,0603\: моль} {0.500\: L} = 0,121\: M = CoCl_2 \cdot H_2O \номер\]
Упражнение \(\PageIndex{2}\)
Раствор, показанный на рисунке \(\PageIndex{2}\), содержит 90,0 г (NH 4 ) 2 Cr 2 O 7 в воде, достаточной для получения конечного объема ровно 250 мл. Какова молярная концентрация дихромата аммония?
- Ответить
\[(NH_4)_2Cr_2O_7 = 1,43\: M \без числа\]
Чтобы приготовить определенный объем раствора, который содержит определенную концентрацию растворенного вещества, нам сначала необходимо рассчитать количество молей растворенного вещества в желаемом объеме раствора, используя соотношение, показанное в уравнении \(\ref{4.5.2}\). Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере \(\PageIndex{3}\).
Пример \(\PageIndex{3}\): Решение D5W
Так называемый раствор D5W, используемый для внутривенного замещения жидкостей организма, содержит 0,310 М глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде.) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180.16 г/моль.
Дано: молярность, объем и молярная масса растворенного вещества
Запрашиваемый: масса растворенного вещества
Стратегия:
- Рассчитайте количество молей глюкозы, содержащихся в указанном объеме раствора, умножив объем раствора на его молярность.
- Получите необходимую массу глюкозы, умножив количество молей соединения на его молярную массу.
Решение:
A Сначала мы должны вычислить количество молей глюкозы, содержащихся в 500 мл 0.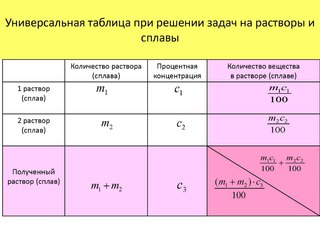 310 М раствор:
310 М раствор:
\( V_L M_{моль/л} = моли \)
\( 500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0 .310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0,155\: моль\: глюкоза \)
B Затем мы переводим количество молей глюкозы в требуемую массу глюкозы:
\( масса \: из \: глюкозы = 0,155 \: \отменить{моль\: глюкоза} \влево( \dfrac{180,16 \: г\: глюкоза} {1\: \отменить{моль\: глюкоза}} \ справа) = 27.9\:г\:глюкоза\)
Упражнение \(\PageIndex{3}\)
Другим раствором, обычно используемым для внутривенных инъекций, является физиологический раствор, 0,16 М раствор хлорида натрия в воде. Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
- Ответить
2,3 г NaCl
Раствор нужной концентрации также можно приготовить, разбавив небольшой объем более концентрированного раствора дополнительным растворителем. Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод, взвешивающий крошечные количества растворенного вещества, трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод, взвешивающий крошечные количества растворенного вещества, трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из маточного раствора показана на рисунке \(\PageIndex{3}\).Это требует расчета количества молей растворенного вещества, желаемого в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, содержащего это количество растворенного вещества. Помните, что разбавление заданного количества исходного раствора растворителем меняет , а не число молей присутствующего растворенного вещества. Таким образом, отношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно
.
\[(V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\метка{4.5.4}\]
, где индексы s и d обозначают исходный и разбавленный растворы соответственно. Пример \(\PageIndex{4}\) демонстрирует расчеты, связанные с разбавлением концентрированного маточного раствора.
Рисунок \(\PageIndex{3}\): Приготовление раствора известной концентрации путем разбавления маточного раствора. (a) Объем ( V s ), содержащий требуемые моли растворенного вещества (M s ), измеряется из маточного раствора известной концентрации.(b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до объемной метки [( V s )(M s ) = ( V d )(M d ) ].Пример \(\PageIndex{4}\)
Какой объем исходного раствора глюкозы 3,00 М необходим для приготовления 2500 мл раствора D5W в примере \(\PageIndex{3}\)?
Дано: объем и молярность разбавленного раствора
Запрошено: объем маточного раствора
Стратегия:
- Рассчитайте количество молей глюкозы, содержащихся в указанном объеме разбавленного раствора, умножив объем раствора на его молярность.

- Чтобы определить необходимый объем исходного раствора, разделите число молей глюкозы на молярность исходного раствора.
Решение:
A Раствор D5W в примере 4.5.3 представлял собой 0,310 М глюкозу. Начнем с использования уравнения 4.5.4 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
\[ моль\: глюкоза = 2500\: \cancel{мл} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{мл}} \right) \left( \dfrac{ 0 .310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0,775\: моль\: глюкоза \]
B Теперь мы должны определить объем 3,00 М маточного раствора, содержащего такое количество глюкозы:
\[объем\: из\: запас\: раствор = 0,775\: \отменить{моль\: глюкоза} \влево( \dfrac{1\: л} {3,00\: \отменить{моль\: глюкоза}} \справа) = 0,258\: л\: или\: 258\: мл \]
При определении необходимого объема исходного раствора мы должны были разделить желаемое количество молей глюкозы на концентрацию исходного раствора, чтобы получить соответствующие единицы. Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Мы также могли бы решить эту задачу за один шаг, решив уравнение 4.5.4 для В с и подставив соответствующие значения:
\[V_s = \dfrac{( V_d )(M_d)}{M_s} = \dfrac{(2,500\: L)(0,310\: \cancel{M})} {3,00\: \ отменить {M}} = 0 .258\: L \]
Как мы уже отмечали, часто существует более одного правильного способа решения проблемы.
Упражнение \(\PageIndex{4}\)
Какой объем исходного раствора 5,0 М NaCl необходим для приготовления 500 мл физиологического раствора (0,16 М NaCl)?
- Ответить
16 мл
Концентрация ионов в растворе
В примере \(\PageIndex{2}\) концентрация раствора, содержащего 90.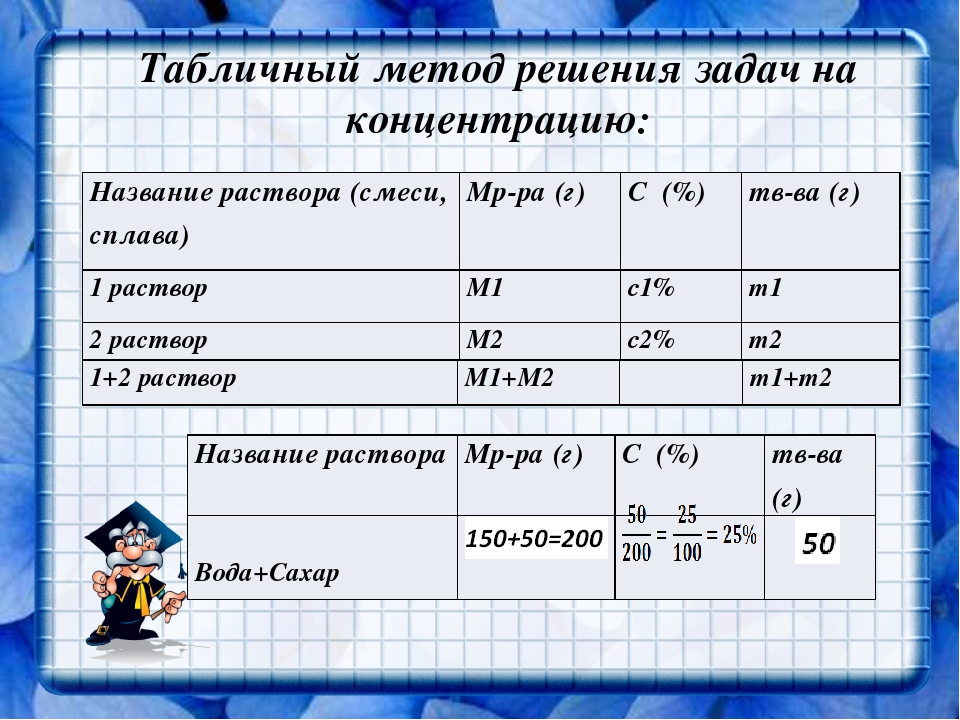 {2-} (водн.)\label{4.5.5} \]
{2-} (водн.)\label{4.5.5} \]
Таким образом, 1 моль формульных единиц дихромата аммония растворяется в воде с образованием 1 моля анионов Cr 2 O 7 2 − и 2 молей NH 4 + Индекс страницы{4}\)).
Рисунок \(\PageIndex{4}\): Растворение 1 моль ионного соединения. В этом случае при растворении 1 моля (NH 4 ) 2 Cr 2 O 7 получается раствор, содержащий 1 моль Cr 2 O 7 8 8 моль NH 4 + ионов.(Для ясности молекулы воды не показаны на молекулярном изображении раствора.) При проведении химической реакции с использованием раствора соли, такой как дихромат аммония, важно знать концентрацию каждого иона, присутствующего в растворе. Если решение содержит 1,43 м (NH 4 ) 2 CR 2 O 7 , то концентрация CR 2 O 7 2 — также должно быть 1,43 м, потому что есть один ион Cr 2 O 7 2 − на формульную единицу. Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 М = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 CR 2 o 7 O 7 производит три ионов при растворении в воде (2NH 4 + + 1CR 2 O 7 2 — ), Всего концентрация ионов в растворе составляет 3 × 1,43 М = 4.29 м.
Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 М = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 CR 2 o 7 O 7 производит три ионов при растворении в воде (2NH 4 + + 1CR 2 O 7 2 — ), Всего концентрация ионов в растворе составляет 3 × 1,43 М = 4.29 м.
Концентрация ионов в растворе растворимой соли: https://youtu.be/qsekSJBLemc
Пример \(\PageIndex{5}\)
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,21 М NaOH
- 3,7 М (CH 3 ) 2 CHOH
- 0,032 М In(№ 3 ) 3
Дано: молярность
Запрашиваемый: концентраций
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит.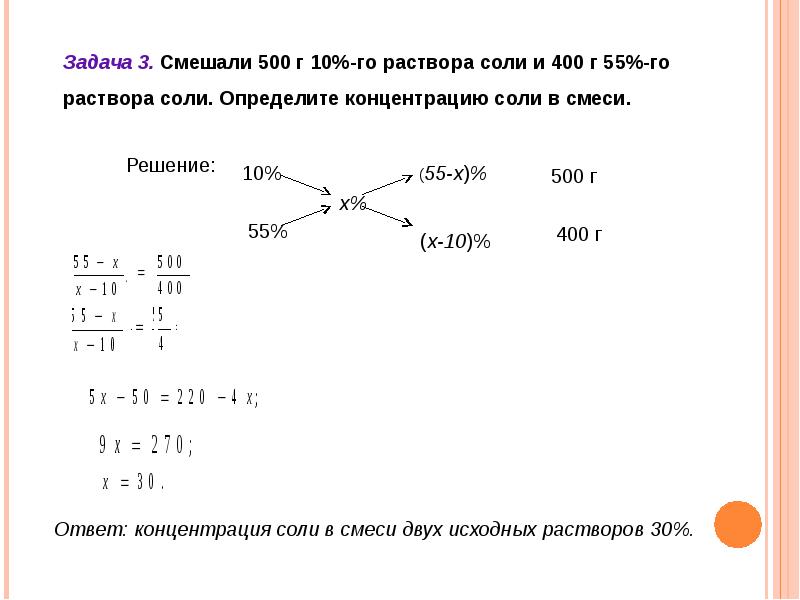 — (aq ) \)
— (aq ) \)
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0.21 М и [ОН — ] = 0,21 М.
B Таким образом, единственным растворенным веществом в растворе является (CH 3 ) 2 молекул CHOH, поэтому [(CH 3 ) 2 CHOH] = 3.- (водн.) \)
b Одна формула в (NO 3 ) 3 ) 3 производит один в 3 + ионов и три № 3 — ионы, так что 0,032 м в (NO 3 ) 3 Раствор содержит 0,032 м в 3 + и 3 × 0,032 м = 0,096 м № 3 — — это такое, [в 3 + ] = 0,032 м и [№ 3 − ] = 0,096 М.
Упражнение \(\PageIndex{5}\)
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0.{2-}] = 0,17\: М\)
- Ответ c
\([(CH_3)_2CO] = 0,50\: M\)
Глава 12.1: Подготовка растворов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Приготовление растворов
- Пример 12.1.1
- Пример 12.1.2
- Пример 12.1.3
- ионные концентрации в решении
- Пример 12.1.4
- Основные уравнения
- Сводка
- Ключ на вынос
- Концептуальные проблемы
- Ответ
- Численные проблемы
- Ответы
- Авторы
Цель обучения
- Для количественного описания концентрации растворов.

В разделе 9.3 мы описали различные способы характеристики концентрации раствора, молярности (M), моляльности (m), концентрации в процентах и мольной доли (X). Количество растворенного вещества, растворенного в определенном количестве растворителя или раствора. раствора описывает количество растворенного вещества, которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе. В этом разделе описывается, как можно приготовить растворы из маточного раствора известной концентрации
.Приготовление растворов
Чтобы приготовить раствор, содержащий определенную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора.
\(Молярность раствора = dfrac{моли\: of\: раствор {Объем раствора} \tag{12.
 1.1}\)
1.1}\)На рис. 12.1.1 показана эта процедура для раствора дигидрата хлорида кобальта(II) в этаноле. Обратите внимание, что объем растворителя не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на требуемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно прибавлять 1.00 л воды на 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рис. 12.1.2, для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Рисунок 12.1.1 Приготовление раствора известной концентрации с использованием твердого растворенного вещества
Рисунок 12.1.2 Приготовление 250 мл раствора (NH 4 ) 2 Cr 2 O 7 в воде
Растворенное вещество занимает место в растворе, поэтому для приготовления 250 мл раствора требуется менее 250 мл воды.

Пример 12.1.1
Раствор на рис. 12.1.1 содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 ·2H 2 O, в этаноле, достаточном для получения ровно 500 мл раствора. Какова молярная концентрация CoCl 2 ·2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрашиваемый: концентрация (M)
Стратегия:
Чтобы найти количество молей CoCl 2 ·2H 2 O, разделите массу соединения на его молярную массу.Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 ·2H 2 O составляет 165,87 г/моль. Следовательно,
\( моль\: CoCl_2 \cdot 2H_2O = \left( \dfrac{10,0 \: \cancel{g}} {165,87\: \cancel{g} /моль} \right) = 0,0603\: моль \)
Объем раствора в литрах равен
\(объем = 500\: \cancel{мл} \left( \dfrac{1\: L} {1000\: \cancel{мл}} \right) = 0 .
 500\: Л\)
500\: Л\)Молярность — это количество молей растворенного вещества на литр раствора, поэтому молярность раствора равна
.\( молярность = \dfrac{0,0603\: моль} {0,500\: L} = 0,121\: M = CoCl_2 \cdot H_2O \)
Упражнение
Раствор, показанный на рис. 12.1.2, содержит 90,0 г (NH 4 ) 2 Cr 2 O 7 в воде, достаточной для получения конечного объема ровно 250 мл. Какова молярная концентрация дихромата аммония?
Ответ: (NH 4 ) 2 Cr 2 O 7 = 1.43 М
Чтобы приготовить определенный объем раствора, который содержит определенную концентрацию растворенного вещества, нам сначала необходимо рассчитать количество молей растворенного вещества в желаемом объеме раствора, используя соотношение, показанное в уравнении 12.1.1. Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества.
 Эта процедура проиллюстрирована в примере 12.1.2.
Эта процедура проиллюстрирована в примере 12.1.2.Пример 12.1.2
Так называемый раствор D5W, используемый для внутривенного замещения жидкостей организма, содержит 0.310 М глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде.) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180,16 г/моль.
Дано: молярность, объем и молярная масса растворенного вещества
Запрашиваемый: масса растворенного вещества
Стратегия:
A Рассчитайте количество молей глюкозы, содержащихся в указанном объеме раствора, умножив объем раствора на его молярность.
B Получите необходимую массу глюкозы, умножив количество молей соединения на его молярную массу.
Решение:
A Сначала нужно рассчитать количество молей глюкозы, содержащихся в 500 мл 0,310 М раствора:
\( V_L M_{моль/л} = моли \)
\( 500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0 .
 310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 .155\:моль\:глюкоза\)
310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 .155\:моль\:глюкоза\)B Затем мы переводим количество молей глюкозы в требуемую массу глюкозы:
\( масса \: из \: глюкозы = 0,155 \: \отменить{моль\: глюкоза} \влево( \dfrac{180,16 \: г\: глюкоза} {1\: \отменить{моль\: глюкоза}} \ справа) = 27,9\:г\:глюкоза\)
Упражнение
Другим раствором, обычно используемым для внутривенных инъекций, является физиологический раствор, 0,16 М раствор хлорида натрия в воде. Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Ответ: 2,3 г NaCl
Раствор нужной концентрации также можно приготовить, разбавив небольшой объем более концентрированного раствора дополнительным растворителем. Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод, взвешивающий крошечные количества растворенного вещества, трудно выполнить с высокой степенью точности.
 Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.Процедура приготовления раствора известной концентрации из исходного раствора показана на рис. 12.1.3. Это требует расчета количества молей растворенного вещества, желаемого в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, содержащего это количество растворенного вещества. Помните, что разбавление заданного количества исходного раствора растворителем меняет , а не число молей присутствующего растворенного вещества. Таким образом, отношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно
.\((V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\tag{12.1.2}\)
, где индексы s и d обозначают исходный и разбавленный растворы соответственно. Пример 5 демонстрирует расчеты, связанные с разбавлением концентрированного маточного раствора.

Рисунок 12.1.3 Приготовление раствора известной концентрации путем разбавления маточного раствора (a) Объем ( V s ), содержащий желаемое количество молей растворенного вещества (M s ), измеряется из исходного раствор известной концентрации.(b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до объемной метки [( V s )(M s ) = ( V d )(M d ) ].
Пример 12.1.3
Какой объем исходного раствора глюкозы с концентрацией 3,00 М необходим для приготовления 2500 мл раствора D5W в примере 4?
Дано: объем и молярность разбавленного раствора
Запрошено: объем маточного раствора
Стратегия:
A Рассчитайте количество молей глюкозы, содержащихся в указанном объеме разбавленного раствора, умножив объем раствора на его молярность.

B Чтобы определить необходимый объем исходного раствора, разделите количество молей глюкозы на молярность исходного раствора.
Решение:
A Раствор D5W в примере 4 представлял собой 0,310 М глюкозу. Начнем с использования уравнения 12.1.2 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
\( моль\: глюкоза = 2500\: \cancel{мл} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{мл}} \right) \left( \dfrac{ 0 .310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0,775\: моль\: глюкоза \)
B Теперь мы должны определить объем 3,00 М маточного раствора, содержащего такое количество глюкозы:
\( объем\: из\: запас\: раствор = 0,775\: \отменить{моль\: глюкоза} \влево( \dfrac{1\: л} {3,00\: \отменить{моль\: глюкоза}} \справа) = 0,258\: л\: или\: 258\: мл \)
При определении необходимого объема исходного раствора мы должны были разделить желаемое количество молей глюкозы на концентрацию исходного раствора, чтобы получить соответствующие единицы.
 Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).Мы также могли бы решить эту задачу за один шаг, решив уравнение 12.1.2 для В с и подставив соответствующие значения:
\( V_s = \dfrac{( V_d )(M_d )}{M_s} = \dfrac{(2,500\: L)(0,310\: \cancel{M})} {3,00\: \ отменить {M}} = 0 .258\: L \)
Как мы уже отмечали, часто существует более одного правильного способа решения проблемы.
Упражнение
Какой объем исходного раствора 5,0 М NaCl необходим для приготовления 500 мл физиологического раствора (0,16 М NaCl)?
Ответ: 16 мл
Концентрация ионов в растворе
В разделе 9.
 {2-} (водн.)\tag{12.1.2} \)
{2-} (водн.)\tag{12.1.2} \)Таким образом, 1 моль формульных единиц дихромата аммония растворяется в воде с образованием 1 моля анионов Cr 2 O 7 2− и 2 молей катионов NH 4 + (см. рис. 12.1.4).
Рис. 12.1.4 Растворение 1 моля ионного соединения В этом случае при растворении 1 моля (NH 4 ) 2 Cr 2 O 7 получается раствор, содержащий Cr 2 O 7 2− ионов и 2 моль NH 4 + ионов.(Для ясности молекулы воды не показаны на молекулярном изображении раствора.)
Когда мы проводим химическую реакцию с использованием раствора соли, такой как дихромат аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 7 2− 3 должна быть 2 O 7 2− ион на формульную единицу.
 Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 М = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 CR 2 O 7 O 7 Производится Три Ионов при растворенном в воде (2NH 4 + + 1Cr 2 O 7 2-), Всего Концентрация ионов в раствор 3 × 1,43 М = 4,29 М,
Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 М = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 CR 2 O 7 O 7 Производится Три Ионов при растворенном в воде (2NH 4 + + 1Cr 2 O 7 2-), Всего Концентрация ионов в раствор 3 × 1,43 М = 4,29 М,Пример 12.1,4
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,21 М NaOH
- 3,7 М (СН 3 )СНОН
- 0,032 М In(№ 3 ) 3
Дано: молярность
Запрашиваемый: концентраций
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит.
 — (водн.) \)
— (водн.) \)B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0.21 М и [ОН — ] = 0,21 М.
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 9.1, что спирты — это ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты являются неэлектролитами.
B Таким образом, единственным растворенным веществом в растворе является (CH 3 ) 2 молекул CHOH, поэтому [(CH 3 ) 2 CHOH] = 3.- (водн.) \)
b Одна формула в (NO 3 ) 3 ) 3 производит один в 3 + ионов и три № 3 — ионы, так что 0,032 м в (NO 3 ) 3 Раствор содержит 0,032 м в 3 + и 3 × 0,032 м = 0,096 м № 3 — — это такое, [в 3 + ] = 0,032 м и [№ 3 − ] = 0,096 М.

Упражнение
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0.0012 М Ba(OH) 2
- 0,17 М Na 2 SO 4
- 0,50 М (CH 3 ) 2 CO, широко известный как ацетон
Ответ:
- [Ba 2 + ] = 0,0012 М; [ОН — ] = 0,0024 М
- [Na + ] = 0,34 М; [СО 4 2− ] = 0,17 М
- [(СН 3 ) 2 СО] = 0,50 М
Ключевые уравнения
связь между объемом и концентрацией основного и разбавленного растворов
Уравнение 12.1.2: \((V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\)
Резюме
Концентрация вещества представляет собой количество растворенного вещества, присутствующего в данном количестве раствора. Концентрации обычно выражают как молярность , число молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора ( исходного раствора ) до желаемого конечного объема.
Концентрации обычно выражают как молярность , число молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора ( исходного раствора ) до желаемого конечного объема.
Ключ на вынос
- Концентрации растворов обычно выражаются в молярности и могут быть приготовлены путем растворения известной массы растворенного вещества в растворителе или разбавления исходного раствора.
Концептуальные проблемы
Какое из изображений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- НХ 3
- ВЧ
- CH 3 CH 2 CH 2 OH
Na 2 SO 4
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.

- CH 3 CO 2 H
- NaCl
- Нет 2 С
- Нет данных 3 Заказ на покупку 4
- ацетальдегид
Ожидаете ли вы, что 1,0 М раствор CaCl 2 будет лучшим проводником электричества, чем 1,0 М раствор NaCl? Почему или почему нет?
Альтернативным способом определения концентрации раствора является моляльность , сокращенно m .Моляльность определяется как число молей растворенного вещества в 1 кг растворителя . Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.
Каковы преимущества использования растворов для количественных расчетов?
Ответить
Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества точнее.

Численные задачи
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.
- 0,2593 М NaBrO 3
- 1,592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 М йодата калия
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.
- 0.1065 М БаИ 2
- 1,135 М Na 2 SO 4
- 1,428 М NH 4 Br
- 0,889 М ацетат натрия
Если все растворы содержат одно и то же растворенное вещество, то в каком растворе масса растворенного вещества больше?
- 1,40 л 0,334 М раствора или 1,10 л 0,420 М раствора
- 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0.
 489 М раствор или 150 мл 0,769 М раствора
489 М раствор или 150 мл 0,769 М раствора
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) Кроты Концентрация (М) сульфат кальция 4,86 уксусная кислота 3.62 дигидрат йодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2.  42
42Какова концентрация каждого вида в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1,045 моль бромида магния в 500 мл раствора
- 0,146 моль глюкозы в 800 мл раствора
- 0,479 моль CeCl 3 в 700 мл раствора
Какова концентрация каждого вида в следующих водных растворах?
- 0.324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0,378 моль йодида калия в 750 мл раствора
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12.
 4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора - 14,2 г гексагидрата нитрата железа(III) в 300 мл раствора
Какова молярная концентрация каждого раствора?
- 12,8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4.3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
Укажите концентрацию каждого реагента в следующих уравнениях, предполагая, что 20,0 г каждого реагента и объем раствора 250 мл для каждого реагента.
- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca(OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al(NO 3 ) 3 (водн.
 ) + H 2 SO 4 (водн.) →
) + H 2 SO 4 (водн.) → - Pb(NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al(CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
Для эксперимента требуется 200.0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г/см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 , используя исходный раствор.
Гипохлорит кальция [Ca(OCl) 2 ] является эффективным дезинфицирующим средством для одежды и постельных принадлежностей.Если раствор имеет концентрацию Ca(OCl) 2 3,4 г на 100 мл раствора, какова молярность гипохлорита?
Фенол (C 6 H 5 OH) часто используется в качестве антисептика в ополаскивателях для рта и леденцах от горла.
 Если жидкость для полоскания рта имеет концентрацию фенола 1,5 г на 100 мл раствора, какова молярность фенола?
Если жидкость для полоскания рта имеет концентрацию фенола 1,5 г на 100 мл раствора, какова молярность фенола?Если таблетку, содержащую 100 мг кофеина (C 8 H 10 N 4 O 2 ), растворить в воде, получится 10.0 унций раствора, какова молярная концентрация кофеина в растворе?
На этикетке некоторых лекарств есть инструкции по добавлению 10,0 мл стерильной воды, в которых указано, что каждый миллилитр полученного раствора будет содержать 0,500 г лекарства. Если больному назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
ответы
1.
 74 × 10 −3 М кофеин
74 × 10 −3 М кофеин
Авторы
Изменено Джошуа Халперном, Скоттом Синексом и Скоттом Джонсоном
Глава 7 – Растворы – Химия
Глава 7: Растворы A Стехиометрия nd Solution 7.1 Введение 7.2 Типы растворов 7.3 Растворимость 7.4 Температура и растворимость 7.5 Влияние давления на растворимость газов: закон Генри 7.6 Твердые гидраты 7.7 Концентрация раствора 7.7.1 Молярность 7.7.2 Частей на раствор 7.8 Разведения 7.9 Концентрация ионов в растворе 7.10 Обзор 7. 11 Каталожные номера
11 Каталожные номера
7.1 Введение:
Напомним из главы 1, что растворы определяются как гомогенные смеси, которые перемешаны настолько тщательно, что ни один из компонентов не может наблюдаться независимо от другого. Решения вокруг нас. Воздух, например, является раствором. Если вы живете рядом с озером, рекой или океаном, этот водоем не чистый H 2 O, а, скорее всего, раствор. Многое из того, что мы пьем, например газированные напитки, кофе, чай и молоко, — это растворы. Решения составляют большую часть повседневной жизни.Многие химические процессы, происходящие вокруг нас, происходят в растворе. На самом деле большая часть химических процессов, происходящих в нашем организме, происходит в растворе, и многие растворы, такие как раствор лактата Рингера для внутривенного введения, важны в здравоохранении. В нашем понимании химии нам нужно немного понимать растворы. В этой главе вы узнаете об особых характеристиках растворов, о том, как они характеризуются, и о некоторых их свойствах.
В этой главе вы узнаете об особых характеристиках растворов, о том, как они характеризуются, и о некоторых их свойствах.
Навыки для развития
- Дайте определение этим терминам: раствор, растворенное вещество и растворитель.
- Различают растворы, смеси и коллоиды.
- Опишите различные типы растворов.
- Различают ненасыщенные, насыщенные и пересыщенные растворы.
Основной компонент раствора называется растворитель , а второстепенный компонент(ы) называется растворенное вещество . Если оба компонента в растворе составляют 50%, термин растворенное вещество может быть присвоен любому компоненту. Когда газообразный или твердый материал растворяется в жидкости, газ или твердый материал называют растворенным веществом.Когда две жидкости растворяются друг в друге, главный компонент называется растворителем , а второстепенный компонент называется растворенным веществом .
В растворах протекают многие химические реакции, и растворы также тесно связаны с нашей повседневной жизнью. Воздух, которым мы дышим, жидкости, которые мы пьем, и жидкости в нашем теле — все это растворы. Кроме того, нас окружают такие решения, как воздух и вода (в реках, озерах и океанах).
В тему решений мы включаем следующие разделы.
- Типы растворов: газообразные, жидкие и твердые растворы основаны на состояниях раствора.
- Стехиометрия раствора: выражение концентрации в различных единицах (масса на единицу объема, моль на единицу объема, проценты и доли), расчеты стехиометрии реакции с участием растворов.
- Растворы электролитов: растворы кислот, оснований и солей, в которых растворенные вещества диссоциируют на положительные и отрицательные гидратированные ионы.
- Метатезис или реакции обмена: реакция электролитов, приводящая к нейтральным молекулам, газам и твердым веществам.
Решение задач стехиометрии растворов требует понятий, введенных в стехиометрии в главе 6, которая также обеспечивает основу для обсуждения реакций.
7.2 Типы растворов
В главе 1 вы познакомились с концепцией смеси , которая представляет собой вещество, состоящее из двух или более веществ.Напомним, что смеси могут быть двух типов: гомогенные и гетерогенные, где гомогенные смеси сочетаются настолько тесно, что их можно наблюдать как единое вещество, даже если это не так. С другой стороны, гетерогенные смеси неоднородны и имеют области смеси, которые выглядят иначе, чем другие области смеси. Гомогенные смеси можно разделить на две категории: коллоиды и растворы. Коллоид представляет собой смесь, которая содержит частицы диаметром от 2 до 500 нм.Коллоиды кажутся однородными по своей природе и имеют одинаковый состав, но они мутные или непрозрачные. Молоко является хорошим примером коллоида. Истинные растворы имеют размер частиц типичного иона или небольшой молекулы (диаметром от ~ 0,1 до 2 нм) и прозрачны, хотя могут быть окрашены. В этой главе основное внимание будет уделено характеристикам истинных решений.
В этой главе основное внимание будет уделено характеристикам истинных решений.
Материал существует в трех состояниях: твердом, жидком и газообразном. Решения также существуют во всех этих состояниях:
- Газовые смеси обычно гомогенны и обычно представляют собой растворы газ-газ .Для количественной обработки этого типа растворов мы посвятим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, углекислого газа, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря.
- Когда молекулы газа, твердого тела или жидкости диспергированы и смешиваются с молекулами жидкости, гомогенные (однородные) состояния называются жидкими растворами .
 Твердые вещества, жидкости и газы растворяются в жидком растворителе с образованием жидких растворов. В этой главе большая часть химии, которую мы обсудим, происходит в жидких растворах, где растворителем является вода.
Твердые вещества, жидкости и газы растворяются в жидком растворителе с образованием жидких растворов. В этой главе большая часть химии, которую мы обсудим, происходит в жидких растворах, где растворителем является вода. - Многие сплавы, керамика и полимерные смеси представляют собой твердые растворы . В определенных пределах медь и цинк растворяются друг в друге и затвердевают, образуя твердые растворы, называемые латунью. Серебро, золото и медь образуют множество различных сплавов с уникальными цветами и внешним видом.Сплавы и другие твердые растворы играют важную роль в мире химии материалов.
7.3 Растворимость
Максимальное количество вещества, которое может быть растворено в данном объеме растворителя, называется растворимостью . Часто растворимость в воде выражается в граммах на 100 мл. Раствор, не достигший максимальной растворимости, называется ненасыщенным раствором. Это означает, что в растворитель можно добавить больше растворенного вещества, и растворение все равно будет происходить.
Это означает, что в растворитель можно добавить больше растворенного вещества, и растворение все равно будет происходить.
Раствор, достигший максимальной растворимости, называется насыщенным раствором . Если в этот момент добавить больше растворенного вещества, оно не растворится в растворе. Вместо этого он останется осажденным в виде твердого вещества на дне раствора. Таким образом, часто можно сказать, что раствор насыщен, если присутствует дополнительное растворенное вещество (это может существовать в виде другой фазы, такой как газ, жидкость или твердое вещество).В насыщенном растворе нет чистого изменения количества растворенного вещества, но система ни в коем случае не статична. На самом деле растворенное вещество постоянно растворяется и осаждается с одинаковой скоростью. Такое явление называется равновесием . Например:
В особых случаях раствор может быть перенасыщенным . Перенасыщенные растворы – это растворы, в которых содержание растворенного вещества превышает нормальную точку насыщения.Обычно для создания пересыщенного раствора требуется такое условие, как повышенная температура или давление. Например, ацетат натрия имеет очень высокую растворимость при 270 К. При охлаждении такой раствор остается растворенным в так называемом метастабильном состоянии . Однако при добавлении в раствор кристалла с затравкой дополнительное растворенное вещество быстро затвердевает. В процессе кристаллизации выделяется тепло, и раствор становится теплым. Обычные грелки для рук используют этот химический процесс для выработки тепла.
Перенасыщенные растворы – это растворы, в которых содержание растворенного вещества превышает нормальную точку насыщения.Обычно для создания пересыщенного раствора требуется такое условие, как повышенная температура или давление. Например, ацетат натрия имеет очень высокую растворимость при 270 К. При охлаждении такой раствор остается растворенным в так называемом метастабильном состоянии . Однако при добавлении в раствор кристалла с затравкой дополнительное растворенное вещество быстро затвердевает. В процессе кристаллизации выделяется тепло, и раствор становится теплым. Обычные грелки для рук используют этот химический процесс для выработки тепла.
Видеозапись кристаллизации пересыщенного раствора ацетата натрия. Видео: Школа естественных наук и математики Северной Каролины
Итак, как мы можем предсказать растворимость вещества?
Одной из полезных классификаций материалов является полярность. Когда вы читали о ковалентных и ионных соединениях в главах 3 и 4, вы узнали, что ионные соединения обладают самой высокой полярностью, образуя полные катионы и анионы внутри каждой молекулы, когда электроны передаются от одного атома к другому.Вы также узнали, что ковалентные связи могут быть полярными или неполярными по своей природе в зависимости от того, распределяют ли атомы, участвующие в связи, электроны неравно или поровну соответственно. Напомним, что по разнице электроотрицательностей можно определить полярность вещества. Обычно ионная связь имеет разность электроотрицательностей 1,8 или выше, тогда как полярная ковалентная связь составляет от 0,4 до 1,8, а неполярная ковалентная связь составляет 0,4 или ниже.
Когда вы читали о ковалентных и ионных соединениях в главах 3 и 4, вы узнали, что ионные соединения обладают самой высокой полярностью, образуя полные катионы и анионы внутри каждой молекулы, когда электроны передаются от одного атома к другому.Вы также узнали, что ковалентные связи могут быть полярными или неполярными по своей природе в зависимости от того, распределяют ли атомы, участвующие в связи, электроны неравно или поровну соответственно. Напомним, что по разнице электроотрицательностей можно определить полярность вещества. Обычно ионная связь имеет разность электроотрицательностей 1,8 или выше, тогда как полярная ковалентная связь составляет от 0,4 до 1,8, а неполярная ковалентная связь составляет 0,4 или ниже.
Рис. 7.1 Диаграмма разницы электроотрицательности. На приведенной выше диаграмме показано, какой тип связи образуется между двумя разными атомами. Взяв разницу между значениями электроотрицательности для каждого из атомов, участвующих в связи, можно предсказать тип связи и полярность. Обратите внимание, что полный ионный характер достигается редко, однако, когда металлы и неметаллы образуют связи, они называются с использованием правил ионной связи.
Обратите внимание, что полный ионный характер достигается редко, однако, когда металлы и неметаллы образуют связи, они называются с использованием правил ионной связи.
вещества с нулевым или низким электронэгатеритивностью, такие как H 2 , O 2 , N 2 , CH 4 , CCL 4 , CCL 4 — неволярных соединений , тогда как H 2 O, NH 3 , CH 3 OH, NO, CO, HCl, H 2 S, PH 3 разница электроотрицательности выше полярных соединений .Обычно соединения с одинаковой полярностью растворимы друг в друге. Это можно описать правилом:
Подобное растворяется в подобном. Это означает, что вещества должны иметь одинаковые межмолекулярные силы для образования растворов. Когда растворимое вещество вводится в растворитель, частицы растворенного вещества могут взаимодействовать с частицами растворителя. В случае твердого или жидкого растворенного вещества взаимодействия между частицами растворенного вещества и частицами растворителя настолько сильны, что отдельные частицы растворенного вещества отделяются друг от друга и, окруженные молекулами растворителя, попадают в раствор.(Частицы газообразных растворенных веществ уже разделены, но концепция окружения частицами растворителя все еще применима.) Этот процесс называется solvatio n и показан на рис. 7.2. Когда растворителем является вода, используется слово гидратация , а не сольватация.
В случае твердого или жидкого растворенного вещества взаимодействия между частицами растворенного вещества и частицами растворителя настолько сильны, что отдельные частицы растворенного вещества отделяются друг от друга и, окруженные молекулами растворителя, попадают в раствор.(Частицы газообразных растворенных веществ уже разделены, но концепция окружения частицами растворителя все еще применима.) Этот процесс называется solvatio n и показан на рис. 7.2. Когда растворителем является вода, используется слово гидратация , а не сольватация.
Обычно полярные растворители растворяют полярные растворенные вещества, тогда как неполярные растворители растворяют неполярные растворенные вещества. В целом процесс растворения зависит от силы притяжения между частицами растворенного вещества и частицами растворителя.Например, вода является высокополярным растворителем, способным растворять многие ионные соли. На рис. 7.2 показан процесс растворения, при котором вода действует как растворитель для растворения кристаллической соли хлорида натрия (NaCl). Обратите внимание, что когда ионные соединения растворяются в растворителе, они распадаются на свободно плавающие ионы в растворе. Это позволяет соединению взаимодействовать с растворителем. В случае растворения хлорида натрия в воде ион натрия притягивается к частичному отрицательному заряду атома кислорода в молекуле воды, тогда как ион хлорида притягивается к частично положительным атомам водорода.
7.2 показан процесс растворения, при котором вода действует как растворитель для растворения кристаллической соли хлорида натрия (NaCl). Обратите внимание, что когда ионные соединения растворяются в растворителе, они распадаются на свободно плавающие ионы в растворе. Это позволяет соединению взаимодействовать с растворителем. В случае растворения хлорида натрия в воде ион натрия притягивается к частичному отрицательному заряду атома кислорода в молекуле воды, тогда как ион хлорида притягивается к частично положительным атомам водорода.
Рисунок 7.2: Процесс растворения. Когда ионная соль, такая как хлорид натрия, показанная на (A), вступает в контакт с водой, молекулы воды диссоциируют ионные молекулы хлорида натрия в их ионное состояние, показанное в качестве молекулярной модели на (B) твердом теле. кристаллическая решетка хлорида натрия, и (С) хлорид натрия, растворенный в водном растворителе. (Фотография хлорида натрия предоставлена Крисом 73 ).
Многие ионные соединения растворимы в воде, однако не все ионные соединения растворимы.Ионные соединения, растворимые в воде, существуют в своем ионном состоянии в растворе. На рис. 7.2 вы заметите, что хлорид натрия распадается на ион натрия и ион хлорида по мере того, как он растворяется и взаимодействует с молекулами воды. Для ионных соединений, нерастворимых в воде, ионы настолько сильно притягиваются друг к другу, что не могут быть разделены парциальными зарядами молекул воды. Следующая таблица может помочь вам предсказать, какие ионные соединения будут растворимы в воде.
Диссоциация растворимых ионных соединений придает растворам этих соединений интересное свойство: они проводят электричество. Из-за этого свойства растворимые ионные соединения называются электролитами . Многие ионные соединения полностью диссоциируют и поэтому называются сильными электролитами . Хлорид натрия является примером сильного электролита.Некоторые соединения растворяются, но диссоциируют лишь частично, и растворы таких растворенных веществ могут лишь слабо проводить электричество. Эти растворенные вещества называются слабыми электролитами . Уксусная кислота (CH 3 COOH), входящая в состав уксуса, является слабым электролитом. Растворенные вещества, растворяющиеся в отдельные нейтральные молекулы без диссоциации, не сообщают своим растворам дополнительной электропроводности и называются неэлектролитами . Полярные ковалентные соединения, такие как столовый сахар (C 12 H 22 O 11 ), являются хорошими примерами неэлектролитов .
Хлорид натрия является примером сильного электролита.Некоторые соединения растворяются, но диссоциируют лишь частично, и растворы таких растворенных веществ могут лишь слабо проводить электричество. Эти растворенные вещества называются слабыми электролитами . Уксусная кислота (CH 3 COOH), входящая в состав уксуса, является слабым электролитом. Растворенные вещества, растворяющиеся в отдельные нейтральные молекулы без диссоциации, не сообщают своим растворам дополнительной электропроводности и называются неэлектролитами . Полярные ковалентные соединения, такие как столовый сахар (C 12 H 22 O 11 ), являются хорошими примерами неэлектролитов .
Термин электролит используется в медицине для обозначения любого из важных ионов, растворенных в водном растворе в организме. Важные физиологические электролиты включают Na + , K + , Ca 2 + , Mg 2 + и Cl — . Спортивные напитки, такие как Gatoraid, содержат комбинации этих ключевых электролитов, которые помогают восполнить потери электролитов после тяжелой тренировки.
Спортивные напитки, такие как Gatoraid, содержат комбинации этих ключевых электролитов, которые помогают восполнить потери электролитов после тяжелой тренировки.
Точно так же можно приготовить растворы путем смешивания двух совместимых жидкостей.Жидкость с более низкой концентрацией называется растворенным веществом, , а жидкость с более высокой концентрацией — растворителем . Например, зерновой спирт (CH 3 CH 2 OH) представляет собой полярную ковалентную молекулу, которая может смешиваться с водой. Когда два аналогичных раствора помещаются вместе и могут смешаться в раствор, говорят, что они смешиваются . С другой стороны, жидкости, которые не обладают сходными характеристиками и не могут смешиваться друг с другом, называются несмешивающимися .Например, масла, содержащиеся в оливковом масле, такие как олеиновая кислота (C 18 H 34 O 2 ), имеют в основном неполярные ковалентные связи, которые не имеют межмолекулярных сил, достаточно сильных, чтобы разорвать водородную связь между молекулы воды. Таким образом, вода и масло не смешиваются и считаются несмешиваемыми .
Таким образом, вода и масло не смешиваются и считаются несмешиваемыми .
Другие факторы, такие как температура и давление, также влияют на растворимость растворителя. Таким образом, при указании растворимости следует также учитывать эти другие факторы.
(наверх)7.4 Температура и растворимость
При рассмотрении растворимости твердых веществ зависимость температуры и растворимости не является простой или предсказуемой. На рис. 7.3 показаны зависимости растворимости некоторых органических и неорганических соединений в воде от температуры. Хотя растворимость твердого тела обычно увеличивается с повышением температуры, между строением вещества и температурной зависимостью его растворимости нет простой зависимости.Многие соединения (например, глюкоза и CH 3 CO 2 Na) демонстрируют резкое увеличение растворимости с повышением температуры. Другие (такие как NaCl и K 2 SO 4 ) демонстрируют небольшие изменения, а третьи (такие как Li 2 SO 4 ) становятся менее растворимыми с повышением температуры.
Другие (такие как NaCl и K 2 SO 4 ) демонстрируют небольшие изменения, а третьи (такие как Li 2 SO 4 ) становятся менее растворимыми с повышением температуры.
Рис. 7.3 Растворимость некоторых неорганических и органических твердых веществ в воде в зависимости от температуры. Растворимость может увеличиваться или уменьшаться в зависимости от температуры; величина этой температурной зависимости широко варьируется среди соединений.
Изменение растворимости в зависимости от температуры было измерено для широкого круга соединений, и результаты опубликованы во многих стандартных справочниках. Химики часто могут использовать эту информацию для разделения компонентов смеси путем фракционной кристаллизации , разделения соединений на основе их растворимости в данном растворителе. Например, если у нас есть смесь 150 г ацетата натрия (CH 3 CO 2 Na) и 50 г KBr, мы можем разделить два соединения, растворив смесь в 100 г воды при 80°C. и затем медленно охлаждают раствор до 0°С.Согласно температурным кривым на рис. 7.3, оба соединения растворяются в воде при 80°С, а все 50 г KBr остаются в растворе при 0°С. Только около 36 г CH 3 CO 2 Na растворимы в 100 г воды при 0°C, поэтому примерно 114 г (150 г – 36 г) CH 3 CO 2 Na кристаллизуется. выходит на охлаждение. Затем кристаллы можно отделить фильтрованием. Таким образом, фракционная кристаллизация позволяет нам восстановить около 75% исходного CH 3 CO 2 Na в практически чистом виде всего за одну стадию.
и затем медленно охлаждают раствор до 0°С.Согласно температурным кривым на рис. 7.3, оба соединения растворяются в воде при 80°С, а все 50 г KBr остаются в растворе при 0°С. Только около 36 г CH 3 CO 2 Na растворимы в 100 г воды при 0°C, поэтому примерно 114 г (150 г – 36 г) CH 3 CO 2 Na кристаллизуется. выходит на охлаждение. Затем кристаллы можно отделить фильтрованием. Таким образом, фракционная кристаллизация позволяет нам восстановить около 75% исходного CH 3 CO 2 Na в практически чистом виде всего за одну стадию.
Фракционная кристаллизация — это распространенный метод очистки самых разнообразных соединений, как показано на рис. 7.3, от антибиотиков до ферментов. Чтобы этот метод работал должным образом, исследуемое соединение должно быть более растворимым при высокой температуре, чем при низкой температуре, чтобы понижение температуры вызывало его кристаллизацию из раствора. Кроме того, примеси должны быть на более растворимыми, чем исследуемое соединение (как KBr в этом примере), и предпочтительно присутствовать в относительно небольших количествах.
Растворимость газов в жидкостях гораздо более предсказуема. Растворимость газов в жидкостях уменьшается с повышением температуры, как показано на рис. 7.4. Привлекательные межмолекулярные взаимодействия в газовой фазе практически равны нулю для большинства веществ, потому что молекулы находятся так далеко друг от друга, когда находятся в газообразной форме. Когда газ растворяется, это происходит потому, что его молекулы взаимодействуют с молекулами растворителя. Тепло высвобождается, когда формируются эти новые силы притяжения. Таким образом, если к системе добавляется внешнее тепло, оно преодолевает силы притяжения между газом и молекулами растворителя и снижает растворимость газа.
Рис. 7.4 Растворимость некоторых распространенных газов в воде в зависимости от температуры при парциальном давлении 1 атм. Растворимость газов уменьшается с повышением температуры.
Уменьшение растворимости газов при более высоких температурах имеет как практические, так и экологические последствия. Любой, кто регулярно кипятит воду в чайнике или электрическом чайнике, знает, что внутри него образуется белый или серый налет, который в конечном итоге необходимо удалить.То же самое явление происходит в гораздо большем масштабе в гигантских котлах, используемых для подачи горячей воды или пара для промышленных целей, где оно называется «котловой накипью», отложением, которое может серьезно снизить пропускную способность труб горячей воды ( Рисунок 7.5). Проблема не только современная: акведуки, построенные римлянами 2000 лет назад для подачи холодной воды из альпийских регионов в более теплые и засушливые регионы на юге Франции, были забиты аналогичными отложениями. Химия образования этих отложений умеренно сложна, но движущей силой является потеря растворенного диоксида углерода (CO 2 ) из раствора.Жесткая вода содержит растворенные ионы Ca 2+ и HCO 3 − (бикарбонат). Гидрокарбонат кальция [Ca(HCO 3 ) 2 ] хорошо растворим в воде, а карбонат кальция (CaCO 3 ) совершенно нерастворим.
Любой, кто регулярно кипятит воду в чайнике или электрическом чайнике, знает, что внутри него образуется белый или серый налет, который в конечном итоге необходимо удалить.То же самое явление происходит в гораздо большем масштабе в гигантских котлах, используемых для подачи горячей воды или пара для промышленных целей, где оно называется «котловой накипью», отложением, которое может серьезно снизить пропускную способность труб горячей воды ( Рисунок 7.5). Проблема не только современная: акведуки, построенные римлянами 2000 лет назад для подачи холодной воды из альпийских регионов в более теплые и засушливые регионы на юге Франции, были забиты аналогичными отложениями. Химия образования этих отложений умеренно сложна, но движущей силой является потеря растворенного диоксида углерода (CO 2 ) из раствора.Жесткая вода содержит растворенные ионы Ca 2+ и HCO 3 − (бикарбонат). Гидрокарбонат кальция [Ca(HCO 3 ) 2 ] хорошо растворим в воде, а карбонат кальция (CaCO 3 ) совершенно нерастворим. Раствор бикарбонат-ионов может реагировать с образованием углекислого газа, карбонат-иона и воды:
Раствор бикарбонат-ионов может реагировать с образованием углекислого газа, карбонат-иона и воды:
2HCO 3 − (водн.) → CO 2 2− (водн.) + H 2 O(л) + CO 2 (водн.)
Нагревание раствора снижает растворимость CO 2 , который переходит в газовую фазу над раствором.В присутствии ионов кальция карбонат-ионы осаждаются в виде нерастворимого карбоната кальция, основного компонента накипи в котлах.
Рисунок 7.5 Накипь в водопроводной трубе. Карбонат кальция (CaCO 3 ) отложения в трубах горячей воды могут значительно уменьшить пропускную способность трубы. Эти отложения, называемые котловой накипью, образуются, когда растворенный CO 2 переходит в газовую фазу при высоких температурах.
В тепловое загрязнение , озерная или речная вода, используемая для охлаждения промышленного реактора или электростанции, возвращается в окружающую среду при более высокой температуре, чем обычно.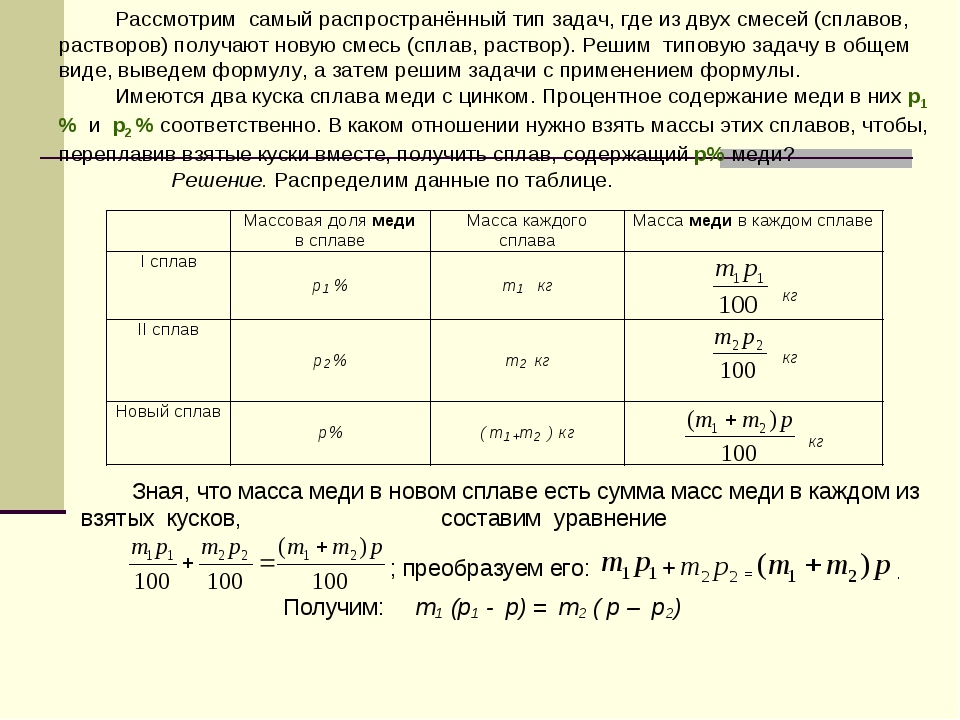 Из-за пониженной растворимости O 2 при более высоких температурах (рис. 7.4) более теплая вода содержит меньше растворенного кислорода, чем вода, поступающая в установку. Рыбы и другие водные организмы, которым для жизни необходим растворенный кислород, могут буквально задохнуться, если концентрация кислорода в их среде обитания слишком низкая. Поскольку теплая, обедненная кислородом вода менее плотная, она имеет тенденцию плавать поверх более прохладной, более плотной и богатой кислородом воды в озере или реке, образуя барьер, препятствующий растворению атмосферного кислорода.В конце концов, даже глубокие озера могут задохнуться, если проблема не будет решена. Кроме того, большинство рыб и других водных организмов, не относящихся к млекопитающим, хладнокровны, а это означает, что температура их тела такая же, как и температура окружающей среды. Температуры, значительно превышающие нормальный диапазон, могут привести к серьезному стрессу или даже смерти. Системы охлаждения для электростанций и других объектов должны быть спроектированы таким образом, чтобы свести к минимуму любое неблагоприятное воздействие на температуру окружающих водоемов.
Из-за пониженной растворимости O 2 при более высоких температурах (рис. 7.4) более теплая вода содержит меньше растворенного кислорода, чем вода, поступающая в установку. Рыбы и другие водные организмы, которым для жизни необходим растворенный кислород, могут буквально задохнуться, если концентрация кислорода в их среде обитания слишком низкая. Поскольку теплая, обедненная кислородом вода менее плотная, она имеет тенденцию плавать поверх более прохладной, более плотной и богатой кислородом воды в озере или реке, образуя барьер, препятствующий растворению атмосферного кислорода.В конце концов, даже глубокие озера могут задохнуться, если проблема не будет решена. Кроме того, большинство рыб и других водных организмов, не относящихся к млекопитающим, хладнокровны, а это означает, что температура их тела такая же, как и температура окружающей среды. Температуры, значительно превышающие нормальный диапазон, могут привести к серьезному стрессу или даже смерти. Системы охлаждения для электростанций и других объектов должны быть спроектированы таким образом, чтобы свести к минимуму любое неблагоприятное воздействие на температуру окружающих водоемов. На северо-западе Тихого океана популяции лососевых чрезвычайно чувствительны к изменениям температуры воды. В пределах этой популяции оптимальная температура воды находится между 12,8 и 17,8 o C (55-65 o F). Помимо пониженного уровня кислорода, популяции лосося гораздо более восприимчивы к болезням, хищникам и паразитарным инфекциям при более высоких температурах воды. Таким образом, тепловое загрязнение и глобальное изменение климата создают реальные проблемы для выживания и сохранения этих видов.Для получения дополнительной информации о влиянии повышения температуры на популяции лососевых посетите публикацию State of Washington’s Focus Publication.
На северо-западе Тихого океана популяции лососевых чрезвычайно чувствительны к изменениям температуры воды. В пределах этой популяции оптимальная температура воды находится между 12,8 и 17,8 o C (55-65 o F). Помимо пониженного уровня кислорода, популяции лосося гораздо более восприимчивы к болезням, хищникам и паразитарным инфекциям при более высоких температурах воды. Таким образом, тепловое загрязнение и глобальное изменение климата создают реальные проблемы для выживания и сохранения этих видов.Для получения дополнительной информации о влиянии повышения температуры на популяции лососевых посетите публикацию State of Washington’s Focus Publication.
Аналогичный эффект наблюдается в повышении температуры водоемов, таких как Чесапикский залив, крупнейший эстуарий в Северной Америке, причиной которого считается глобальное потепление. На каждые 1,5°C, на которые нагревается вода залива, способность воды растворять кислород уменьшается примерно на 1,1%. Многие морские виды, находящиеся на южной границе своего распространения, сместили свои популяции дальше на север.В 2005 году морская трава, которая является важной средой обитания для рыб и моллюсков, исчезла на большей части залива из-за рекордно высоких температур воды. Предположительно, снижение уровня кислорода уменьшило популяцию моллюсков и других фильтраторов, что затем уменьшило светопропускание, чтобы позволить расти взморникам. Сложные отношения в таких экосистемах, как Чесапикский залив, особенно чувствительны к колебаниям температуры, которые вызывают ухудшение качества среды обитания.
Многие морские виды, находящиеся на южной границе своего распространения, сместили свои популяции дальше на север.В 2005 году морская трава, которая является важной средой обитания для рыб и моллюсков, исчезла на большей части залива из-за рекордно высоких температур воды. Предположительно, снижение уровня кислорода уменьшило популяцию моллюсков и других фильтраторов, что затем уменьшило светопропускание, чтобы позволить расти взморникам. Сложные отношения в таких экосистемах, как Чесапикский залив, особенно чувствительны к колебаниям температуры, которые вызывают ухудшение качества среды обитания.
7.5 Влияние давления на растворимость газов: закон Генри
Внешнее давление очень мало влияет на растворимость жидкостей и твердых веществ. Напротив, растворимость газов увеличивается по мере увеличения парциального давления газа над раствором. Этот момент показан на рис. 7.6, на котором показано влияние повышенного давления на динамическое равновесие, которое устанавливается между молекулами растворенного газа в растворе и молекулами в газовой фазе над раствором. Поскольку концентрация молекул в газовой фазе увеличивается с ростом давления, концентрация молекул растворенного газа в равновесном растворе также выше при более высоких давлениях.
Поскольку концентрация молекул в газовой фазе увеличивается с ростом давления, концентрация молекул растворенного газа в равновесном растворе также выше при более высоких давлениях.
Рис. 7.6. Модель, показывающая, почему растворимость газа увеличивается по мере увеличения парциального давления при постоянной температуре. (а) Когда газ вступает в контакт с чистой жидкостью, некоторые молекулы газа (фиолетовые сферы) сталкиваются с поверхностью жидкости и растворяются.Когда концентрация растворенных молекул газа увеличилась настолько, что скорость, с которой молекулы газа уходят в газовую фазу, стала такой же, как скорость, с которой они растворяются, установилось динамическое равновесие, как показано здесь. (б) Увеличение давления газа увеличивает количество молекул газа в единице объема, что увеличивает скорость, с которой молекулы газа сталкиваются с поверхностью жидкости и растворяются. (c) По мере растворения дополнительных молекул газа при более высоком давлении концентрация растворенного газа увеличивается до тех пор, пока не установится новое динамическое равновесие.
Связь между давлением и растворимостью газа количественно описывается законом Генри, названным в честь его первооткрывателя, английского врача и химика Уильяма Генри (1775–1836):
C = кПа
, где C — концентрация растворенного газа в состоянии равновесия, P — парциальное давление газа, а k — константа закона Генри , которую необходимо определить экспериментально для каждой комбинации газа, растворителя, и температура.Хотя концентрацию газа можно выразить в любых удобных единицах, мы будем использовать исключительно молярность. Таким образом, единицами константы закона Генри являются моль/(л·атм) = М/атм. Значения констант закона Генри для растворов некоторых газов в воде при 20°C приведены в таблице 7.2
Видеоруководство по закону Генри от Академии Кана
Все материалы Академии Хана доступны бесплатно на сайте www.khanacademy. org
org
Как данные в таблице 7.2 видно, что концентрация растворенного газа в воде при данном давлении сильно зависит от ее физических свойств. Для ряда родственных веществ лондоновские дисперсионные силы увеличиваются с увеличением молекулярной массы. Таким образом, среди элементов группы 18 константы закона Генри плавно возрастают от He к Ne и к Ar. Таблица также показывает, что растворимость O 2 почти в два раза выше, чем у N 2 . Хотя лондонские дисперсионные силы слишком слабы, чтобы объяснить такую большую разницу, O 2 является парамагнитным и, следовательно, более поляризуемым, чем N 2 , что объясняет его высокую растворимость.(Примечание: когда вещество парамагнитно оно очень слабо притягивается полюсами магнита, но не сохраняет какого-либо постоянного магнетизма).
Таблица 7.2 Константы закона Генри для некоторых газов в воде при 20°C Парциальное давление газа можно выразить как концентрацию, записав закон Генри как P газ = C /k. Это важно во многих аспектах жизни, включая медицину, где обычно измеряют газы крови, такие как кислород и углекислый газ.Поскольку парциальное давление и концентрация прямо пропорциональны, если парциальное давление газа изменяется, а температура остается постоянной, новую концентрацию газа в жидкости можно легко рассчитать с помощью следующего уравнения:
Это важно во многих аспектах жизни, включая медицину, где обычно измеряют газы крови, такие как кислород и углекислый газ.Поскольку парциальное давление и концентрация прямо пропорциональны, если парциальное давление газа изменяется, а температура остается постоянной, новую концентрацию газа в жидкости можно легко рассчитать с помощью следующего уравнения:
Где C 1 и P 1 — концентрация и парциальное давление соответственно газа в начальных условиях, а C 2 и P 2 901 — концентрация и парциальное давление соответственно газа в конечном состоянии.Например:
Практическая задача: Концентрация CO 2 в растворе составляет 0,032 М при 3,0 атм. Какова концентрация CO 2 при давлении 5,0 атм? Решение: Чтобы решить эту проблему, сначала мы должны определить, что мы хотим найти. Это концентрация CO 2 при давлении 5,0 атм. Эти два значения представляют C 2 = ?? и P 2 = 5.0 атм. В этот момент будет проще всего изменить наше уравнение выше, чтобы найти C 2 . Далее нам нужно определить начальные условия, C 1 = 0,032 M и P 1 = 3,0 атм. Затем мы можем подставить эти значения в уравнение и найти C 2 :
Это концентрация CO 2 при давлении 5,0 атм. Эти два значения представляют C 2 = ?? и P 2 = 5.0 атм. В этот момент будет проще всего изменить наше уравнение выше, чтобы найти C 2 . Далее нам нужно определить начальные условия, C 1 = 0,032 M и P 1 = 3,0 атм. Затем мы можем подставить эти значения в уравнение и найти C 2 : Газы, химически реагирующие с водой, такие как HCl и другие галогеноводороды, H 2 S и NH 3 , не подчиняются закону Генри; все эти газы гораздо более растворимы, чем предсказывает закон Генри.Например, HCl реагирует с водой с образованием H + (водн.) и Cl — (водн.), , а не растворенных молекул HCl, и ее диссоциация на ионы приводит к гораздо более высокой растворимости, чем ожидалось для нейтральной молекулы. В целом, газы, реагирующие с водой, не подчиняются закону Генри.
В целом, газы, реагирующие с водой, не подчиняются закону Генри.
Закон Генри имеет важные применения. Например, пузырьки CO 2 образуются, как только открывается газированный напиток, потому что напиток был разлит в бутылки под CO 2 при давлении более 1 атм.Когда бутылку открывают, давление CO 2 над раствором быстро падает, и часть растворенного газа выходит из раствора в виде пузырьков. Закон Генри также объясняет, почему аквалангисты должны быть осторожны, чтобы медленно всплывать на поверхность после погружения, если они дышат сжатым воздухом. При более высоких давлениях под водой большее количество N 2 из воздуха растворяется во внутренних жидкостях водолаза. Если дайвер всплывает слишком быстро, быстрое изменение давления вызывает образование маленьких пузырьков N 2 по всему телу, состояние, известное как «изгибы».Эти пузырьки могут блокировать поток крови через мелкие кровеносные сосуды, вызывая сильную боль и даже приводя к летальному исходу в некоторых случаях.
Из-за низкой константы закона Генри для O 2 в воде уровни растворенного кислорода в воде слишком низки для удовлетворения энергетических потребностей многоклеточных организмов, включая человека. Для повышения концентрации O 2 во внутренних жидкостях организмы синтезируют легкорастворимые молекулы-носители, которые обратимо связывают O 2 . Например, эритроциты человека содержат белок, называемый гемоглобином, который специфически связывает O 2 и облегчает его транспортировку из легких в ткани, где он используется для окисления молекул пищи для получения энергии.Концентрация гемоглобина в нормальной крови составляет около 2,2 мМ, и каждая молекула гемоглобина может связывать четыре молекулы O 2 . Хотя концентрация растворенного O 2 в сыворотке крови при 37°C (нормальная температура тела) составляет всего 0,010 мМ, общая растворенная концентрация O 2 составляет 8,8 мМ, что почти в тысячу раз больше, чем было бы возможно без гемоглобина. Синтетические переносчики кислорода на основе фторированных алканов были разработаны для использования в качестве экстренной замены цельной крови.В отличие от донорской крови эти «кровезаменители» не требуют охлаждения и имеют длительный срок хранения. Их очень высокие константы закона Генри для O 2 приводят к концентрациям растворенного кислорода, сравнимым с концентрациями в нормальной крови.
Синтетические переносчики кислорода на основе фторированных алканов были разработаны для использования в качестве экстренной замены цельной крови.В отличие от донорской крови эти «кровезаменители» не требуют охлаждения и имеют длительный срок хранения. Их очень высокие константы закона Генри для O 2 приводят к концентрациям растворенного кислорода, сравнимым с концентрациями в нормальной крови.
7.6 Твердые гидраты:
Некоторые ионные твердые тела принимают небольшое количество молекул воды в свою структуру кристаллической решетки и остаются в твердом состоянии.Эти твердые вещества называются твердыми гидратами . Твердые гидраты содержат соединенные в определенном соотношении молекулы воды как неотъемлемую часть кристалла, либо связанные с металлическим центром, либо кристаллизовавшиеся с металлокомплексом. Также говорят, что такие гидраты содержат кристаллизационной воды или гидратной воды .
Ярким примером является хлорид кобальта (II), который при гидратации меняет цвет с синего на красный и поэтому может использоваться в качестве индикатора воды.
Рисунок 7.7: Хлорид кобальта как пример твердого гидрата. Безводный хлорид кобальта (вверху слева) и его структура кристаллической решетки (внизу слева) по сравнению с гексагидратом хлорида кобальта (вверху справа) и его кристаллической решеткой (внизу справа). Обратите внимание, что молекулы воды, показанные красным (кислород) и белым (водород), интегрированы в кристаллическую решетку хлорида кобальта (II), показанного синим (кобальт) и зеленым (хлорид), в зависимости от полярности. Частично отрицательные атомы кислорода притягиваются к положительно заряженному кобальту, а частично положительные атомы водорода притягиваются к отрицательно заряженным ионам хлора.Изображения предоставлены Wikipedia Commons (вверху слева и внизу слева), Benjah-bmm27 (вверху справа) и Smokefoot (внизу справа)
.
Обозначение, используемое для представления твердого гидрата: « гидратированное соединение ⋅ n H 2 O », где n — число молекул воды на формульную единицу соли. n обычно представляет собой небольшое целое число, хотя могут встречаться и дробные значения. Например, в моногидрате n равно единице, а в гексагидрате n равно 6.Например, на рис. 7.7 гидратированный хлорид кобальта будет обозначаться: «хлорид кобальта (II)⋅ 6 H 2 O». Числовые префиксы греческого происхождения, которые используются для обозначения твердых гидратов:
- Полукруглая – 1/2
- Моно – 1
- Полуторный – 1½
- Ди – 2
- Три – 3
- Тетра – 4
- Пента – 5
- Шестигранник – 6
- Гепта – 7
- Окта – 8
- Нона – 9
- Дека – 10
- Ундека – 11
- Додека – 12
Гидрат, потерявший воду, обозначается как ангидрид ; оставшуюся воду, если она есть, можно удалить только при очень сильном нагревании. Вещество, не содержащее воды, обозначается как безводный . Некоторые безводные соединения так легко гидратируются, что вытягивают воду из атмосферы и гидратируются. Эти вещества считаются гигроскопичными и могут использоваться в качестве осушителей или влагопоглотителей .
Вещество, не содержащее воды, обозначается как безводный . Некоторые безводные соединения так легко гидратируются, что вытягивают воду из атмосферы и гидратируются. Эти вещества считаются гигроскопичными и могут использоваться в качестве осушителей или влагопоглотителей .
7.7 Концентрация раствора
В химии концентрация определяется как содержание компонента, деленное на общий объем смеси.У всех нас есть качественное представление о том, что подразумевается под концентрацией . Любой, кто готовил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматизированный, высококонцентрированный напиток, тогда как слишком мало дает разбавленный раствор, который трудно отличить от воды. Количественно концентрация раствора описывает количество растворенного вещества, которое содержится в конкретном количестве этого раствора.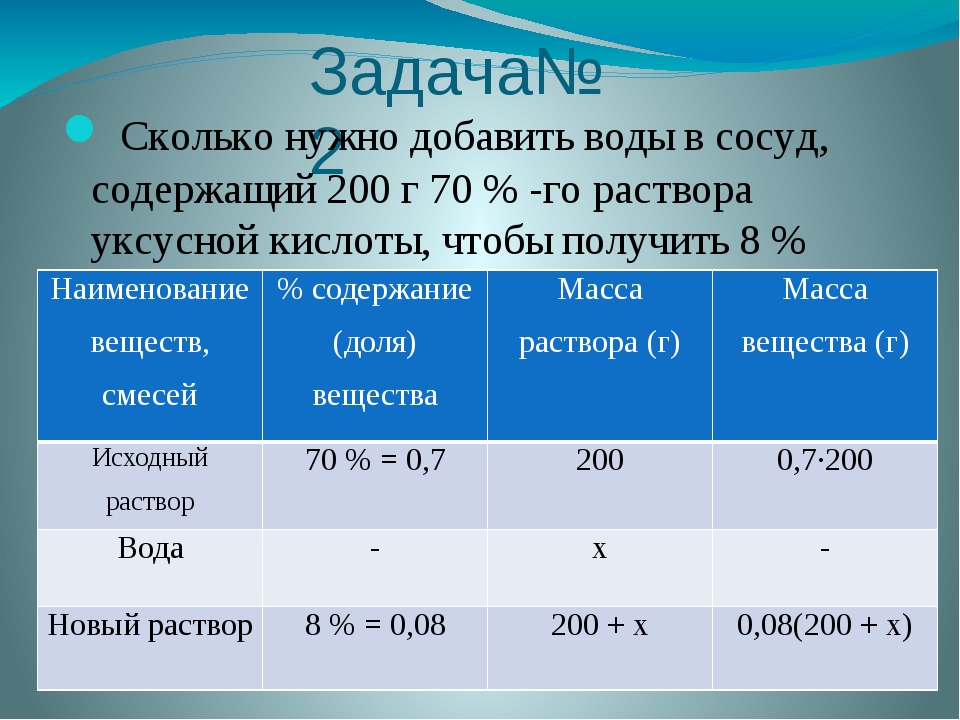 Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, происходящих в растворе, и имеет решающее значение для многих аспектов нашей жизни, от измерения правильной дозы лекарства до обнаружения химических загрязнителей, таких как свинец и мышьяк.Химики используют множество различных способов определения концентрации. В этом разделе мы рассмотрим наиболее распространенные способы представления концентрации раствора. К ним относятся: молярность и количество частей в растворе.
Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, происходящих в растворе, и имеет решающее значение для многих аспектов нашей жизни, от измерения правильной дозы лекарства до обнаружения химических загрязнителей, таких как свинец и мышьяк.Химики используют множество различных способов определения концентрации. В этом разделе мы рассмотрим наиболее распространенные способы представления концентрации раствора. К ним относятся: молярность и количество частей в растворе.
Наиболее распространенной единицей концентрации является молярность , которая также наиболее полезна для расчетов, связанных со стехиометрией реакций в растворе. Молярность (M) раствора — это число молей растворенного вещества, присутствующего ровно в 1 л раствора.
Таким образом, единицами молярности являются моли на литр раствора (моль/л), сокращенно М. Обратите внимание, что указанный объем является общим объемом раствора и включает как растворенное вещество, так и растворитель. Например, водный раствор, содержащий 1 моль (342 г) сахарозы в количестве воды, достаточном для получения конечного объема 1,00 л, имеет концентрацию сахарозы 1,00 моль/л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формула растворенного вещества представляет собой концентрацию растворенного вещества.Итак,
Обратите внимание, что указанный объем является общим объемом раствора и включает как растворенное вещество, так и растворитель. Например, водный раствор, содержащий 1 моль (342 г) сахарозы в количестве воды, достаточном для получения конечного объема 1,00 л, имеет концентрацию сахарозы 1,00 моль/л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формула растворенного вещества представляет собой концентрацию растворенного вещества.Итак,
[сахароза] = 1,00 М
читается как «концентрация сахарозы 1,00 молярная». Приведенное выше уравнение можно использовать для расчета количества растворенного вещества, необходимого для получения любого количества желаемого раствора.
Пример задачи:Рассчитайте количество молей гидроксида натрия (NaOH), необходимое для получения 2,50 л 0,100 М NaOH.
Дано: (1) идентичность растворенного вещества = NaOH, (2) объем = 2,50 л и (3) молярность раствора = 0. 100 моль/л (Примечание: при расчете задач всегда записывайте единицы молярности как моль/л, а не М. Это позволит вам сократить ваши единицы при расчете.)
100 моль/л (Примечание: при расчете задач всегда записывайте единицы молярности как моль/л, а не М. Это позволит вам сократить ваши единицы при расчете.)
Запрос: количество растворенного вещества в молях
Стратегия: (1) Измените приведенное выше уравнение, чтобы найти нужные единицы измерения, в данном случае моли. (2) Дважды проверьте все единицы измерения в уравнении и убедитесь, что они совпадают. Выполните любые необходимые преобразования, чтобы единицы измерения совпадали. (3) Правильно введите значения и посчитайте.
Решение:
(1) Измените приведенное выше уравнение, чтобы найти моли.
(2) Дважды проверьте все единицы измерения в уравнении и убедитесь, что они совпадают.
Данными значениями для этого уравнения являются объем 2,50 л и молярность 0,100 моль/л. Единицы объема для обоих этих чисел указаны в литрах (л) и, таким образом, совпадают. Поэтому никаких преобразований делать не нужно.
Поэтому никаких преобразований делать не нужно.
(3) Введите соответствующие значения и выполните расчеты.
Приготовление растворовОбратите внимание, что в приведенном выше примере у нас по-прежнему недостаточно информации, чтобы действительно сделать раствор в лаборатории. Не существует прибора, который мог бы измерить количество молей вещества. Для этого нам нужно преобразовать количество молей образца в количество граммов, представленное этим числом. Затем мы можем легко использовать весы, чтобы взвесить количество вещества, необходимое для раствора.Для примера выше:
Чтобы приготовить раствор, растворенное вещество обычно растворяют в небольшом количестве растворителя, а затем, когда растворенное вещество растворяется, окончательный объем можно довести до 2,50 л. Если вы сразу добавили 10 г NaOH до 2,50 л, конечный объем будет больше 2,50 л, а концентрация раствора будет меньше 0,100 М. Помните, что конечный объем должен включать как растворенное вещество, так и растворитель.
На рис. 7.8 показана процедура приготовления раствора дигидрата хлорида кобальта(II) в этаноле.Обратите внимание, что объем растворителя не указан. Поскольку растворенное вещество занимает место в растворе, необходимый объем растворителя на меньше, чем на требуемый общий объем раствора.
Рисунок 7.8: Приготовление раствора известной концентрации с использованием твердого растворенного вещества. Чтобы приготовить раствор, начните с добавления части растворителя в колбу. Затем отмерьте необходимое количество растворенного вещества и медленно добавьте его в растворитель.После растворения в растворителе объем раствора можно довести до конечного объема раствора. Для показанной мерной колбы это обозначено черной линией на горлышке колбы. В данном случае это означает 500 мл раствора. Мерные колбы существуют разных размеров для разных объемов растворов. Градуированные цилиндры также можно использовать для точного доведения раствора до конечного объема. Другая стеклянная посуда, включая мензурки и колбы Эрленмейера, недостаточно точна для приготовления большинства растворов.
Другая стеклянная посуда, включая мензурки и колбы Эрленмейера, недостаточно точна для приготовления большинства растворов.
Пример расчета молярности
Раствор на рис. 7.8 содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 ·2H 2 O, в этаноле, достаточном для получения ровно 500 мл раствора. Какова молярная концентрация CoCl 2 ·2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрашиваемый: концентрация (M)
Стратегия:
1.Мы знаем, что молярность равна молям на литр
.2. Чтобы рассчитать молярность, нам нужно выразить:
- масса в виде родинок
- объем в литрах
- Подставьте оба значения в приведенное выше уравнение и рассчитайте .
Решение:
- Преобразование массы в моли.
 Мы можем использовать молярную массу для преобразования граммов CoCl 2 · 2H 2 O в моли.
Мы можем использовать молярную массу для преобразования граммов CoCl 2 · 2H 2 O в моли.
- Молярная масса CoCl 2 ·2H 2 O равна 165.87 г/моль (включая две молекулы воды, поскольку они являются частью структуры кристаллической решетки этого твердого гидрата!)
2. Преобразуйте объем в литры
3. Подставьте значения в уравнение молярности:
7.7.2 Частей на растворВ потребительском и промышленном мире наиболее распространенный метод выражения концентрации основан на количестве растворенного вещества в фиксированном количестве раствора.Упомянутые здесь «количества» могут быть выражены в массе, в объеме или в том и другом (т.е. масса растворенного вещества в заданном объеме раствора). Чтобы различать эти возможности, используются сокращения (m/ м), (об/об) и (м/об).
В большинстве прикладных областей химии часто используется мера (m/m), тогда как в клинической химии обычно используется (m/v), где масса выражается в граммах и объем в мл.
Один из наиболее распространенных способов выражения таких концентраций как « частей на 100 », который мы все знаем как « процентов ».« Cent » — префикс латинского происхождения, относящийся к числу 100
(L. centum ), например, век или век . Он также обозначает 1/100 (от L. центезимус ), как в сантиметрах и денежной единице центов . Процентные растворы определяют количество растворенного вещества, растворенного в количестве раствора, умноженное на 100. Процентные растворы могут быть выражены в единицах массы растворенного вещества на массу раствора (м/м) или массы растворенного вещества на объем раствора (м/м). об.%), или объем растворенного вещества на объем раствора (об./об.%).При приготовлении процентного раствора важно указать, какие единицы измерения используются, чтобы другие тоже могли правильно составить раствор. Кроме того, помните, что раствор представляет собой сумму растворителя и растворенного вещества, когда вы выполняете процентные вычисления.
Раствор = растворенное вещество + растворитель
Таким образом, при расчете процентных растворов можно использовать следующее уравнение:
Пример 1:Например, 7,0% об/об раствор этанола в воде будет содержать 7 мл этанола в 100 мл раствора.Сколько воды в растворе?
В этой задаче мы знаем, что:
Раствор = растворенное вещество + растворитель
Таким образом, мы можем заполнить значения, а затем найти неизвестное.
100 мл = 7 мл + X мл растворителя (в данном случае вода)
переместив семерку на другую сторону, мы увидим, что:
100 мл – 7 мл = 93 мл H 2 O
Пример 2Чему равно (масс./об.)% раствора, если 24.0 г сахарозы растворяют в общем растворе объемом 243 мл?
Пример 3Сколько граммов NaCl требуется для приготовления 625 мл 13,5% раствора?
Для более разбавленных растворов используются части на миллион (10 6 ppm) и части на миллиард (10 9 ; ppb). Эти термины широко используются для выражения количества следовых загрязнителей в окружающей среде.
Эти термины широко используются для выражения количества следовых загрязнителей в окружающей среде.
Аналогично процентным единицам («частям на сотню»), ppm и ppb могут быть определены в виде масс, объемов или смешанных единиц масса-объем.Существуют также единицы ppm и ppb, определяемые по количеству атомов и молекул.
Массовые определения частей на миллион и частей на миллиард приведены здесь:
Как ppm, так и ppb являются удобными единицами измерения концентрации загрязняющих веществ и других следов загрязняющих веществ в воде. Концентрации этих загрязняющих веществ, как правило, очень низки в обработанных и природных водах, и их уровни не могут превышать относительно низкие пороговые концентрации, не оказывая неблагоприятного воздействия на здоровье и дикую природу.Например, Агентство по охране окружающей среды установило, что максимально безопасный уровень ионов фтора в водопроводной воде составляет 4 части на миллион. Проточные фильтры для воды предназначены для снижения концентрации фтора и некоторых других загрязняющих веществ в следовых количествах в водопроводной воде (рис. 7.9).
7.9).
Рисунок 7.9. (a) В некоторых районах следовые концентрации загрязняющих веществ могут сделать нефильтрованную водопроводную воду непригодной для питья и приготовления пищи. (b) Проточные фильтры для воды снижают концентрацию растворенных веществ в водопроводной воде.(кредит a: модификация работы Дженн Дерфи; кредит b: модификация работы «vastateparkstaff»/Wikimedia commons
При сообщении о таких загрязняющих веществах, как свинец в питьевой воде, концентрации ppm и ppb часто указываются в смешанных единицах измерения массы/объема. Это может быть очень полезно, поскольку нам легче думать о воде с точки зрения ее объема, а не ее массы. Кроме того, плотность воды составляет 1,0 г/мл или 1,0 мг/0,001 мл, что упрощает преобразование между двумя единицами измерения.Например, если мы обнаружим, что содержание свинца в воде составляет 4 части на миллион, это будет означать, что имеются:
Концентрации ионных растворенных веществ иногда выражают в единицах, называемых эквивалентами (уравнение). Один эквивалент равен 1 молю положительного или отрицательного заряда. Таким образом, 1 моль/л Na + (водн.) также равен 1 экв./л, поскольку натрий имеет заряд 1+. Раствор ионов Ca 2 + (водн.) с концентрацией 1 моль/л имеет концентрацию 2 экв/л, поскольку кальций имеет заряд 2+.Разбавленные растворы могут быть выражены в миллиэквивалентах (мэкв) — например, плазма крови человека имеет общую концентрацию около 150 мэкв/л.
Один эквивалент равен 1 молю положительного или отрицательного заряда. Таким образом, 1 моль/л Na + (водн.) также равен 1 экв./л, поскольку натрий имеет заряд 1+. Раствор ионов Ca 2 + (водн.) с концентрацией 1 моль/л имеет концентрацию 2 экв/л, поскольку кальций имеет заряд 2+.Разбавленные растворы могут быть выражены в миллиэквивалентах (мэкв) — например, плазма крови человека имеет общую концентрацию около 150 мэкв/л.
В более формальном определении эквивалент — это количество вещества, необходимое для выполнения одного из следующих действий:
- вступают в реакцию с одним молем ионов водорода (H + ) или выделяют его в кислотно-щелочной реакции
- реагируют или отдают один моль электронов в окислительно-восстановительной реакции.
Согласно этому определению, эквивалентно — это количество молей иона в растворе, умноженное на валентность этого иона.Если 1 моль NaCl и 1 моль CaCl 2 растворяются в растворе, в этом растворе содержится 1 экв Na, 2 экв Ca и 3 экв Cl. (Валентность кальция равна 2, поэтому для этого иона у вас есть 1 моль и 2 эквивалента.)
(Валентность кальция равна 2, поэтому для этого иона у вас есть 1 моль и 2 эквивалента.)
7.8 Разведения
Раствор нужной концентрации также можно приготовить, разбавив небольшой объем более концентрированного раствора дополнительным растворителем. Для этой цели часто используют маточный раствор, представляющий собой приготовленный раствор известной концентрации.Разбавление маточного раствора предпочтительнее при приготовлении растворов очень слабых концентраций, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества может быть трудным для выполнения с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из исходного раствора показана на рис. 7.10. Он требует расчета желаемого количества растворенного вещества в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, содержащего это количество растворенного вещества. Помните, что разбавление заданного количества маточного раствора растворителем , а не изменяет количество присутствующего растворенного вещества, изменяется только объем раствора. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора может быть выражено математически как:
Помните, что разбавление заданного количества маточного раствора растворителем , а не изменяет количество присутствующего растворенного вещества, изменяется только объем раствора. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора может быть выражено математически как:
Где M s — концентрация исходного раствора, V s — объем исходного раствора, M d — концентрация разбавленного раствора, а V d — объем разбавленного раствора. .
Рис. 7.10 Приготовление раствора известной концентрации путем разбавления маточного раствора. (a) Объем ( V s ), содержащий желаемое количество растворенного вещества (M s ), измеряется из маточного раствора известной концентрации. (b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до объемной метки [( V s )(M s ) = ( V d )(M d ) ].
Пример расчета разбавления
Какой объем 3,00 М исходного раствора глюкозы необходим для приготовления 2500 мл 0,400 М раствора?
Дано: объем и молярность разбавленного раствора и молярность исходного раствора
Запрошено: объем маточного раствора
Стратегия и решение:
Для задач на разбавление, если вы знаете 3 переменные, вы можете решить для 4-й переменной.
- Начните с перестановки уравнения для решения переменной, которую вы хотите найти. В этом случае необходимо найти объем маточного раствора, V s
2. Затем убедитесь, что одинаковые термины имеют одинаковые единицы измерения. Например, Md и Ms являются концентрациями, поэтому для выполнения расчетов они должны быть в одних и тех же единицах (в этом случае они оба указаны в молярности). Если бы концентрации были разными, скажем, один был указан в молярности, а другой в процентах, или один был в молярности, а другой в миллимолярности, один из терминов необходимо было бы преобразовать, чтобы они совпадали. Таким образом, в данном случае единицы измерения будут уравновешены, и вы останетесь с единицами объема.
Таким образом, в данном случае единицы измерения будут уравновешены, и вы останетесь с единицами объема.
3. Наконец, заполните уравнение известными значениями и рассчитайте окончательный ответ.
Обратите внимание, что если требуется 333 мл исходного раствора, вы также можете рассчитать количество растворителя, необходимого для окончательного разбавления. (Общий объем – объем исходного раствора = объем растворителя, необходимый для окончательного разбавления. В этом случае 2500 мл – 333 мл = 2167 мл воды, необходимой для окончательного разбавления (это следует делать в мерном цилиндре или мерной колбе). .
7.9 Концентрация ионов в растворе
До сих пор мы обсуждали концентрацию всего раствора в терминах общего количества растворенного вещества, деленного на объем раствора. Рассмотрим подробнее, что именно это означает при рассмотрении ионных и ковалентных соединений.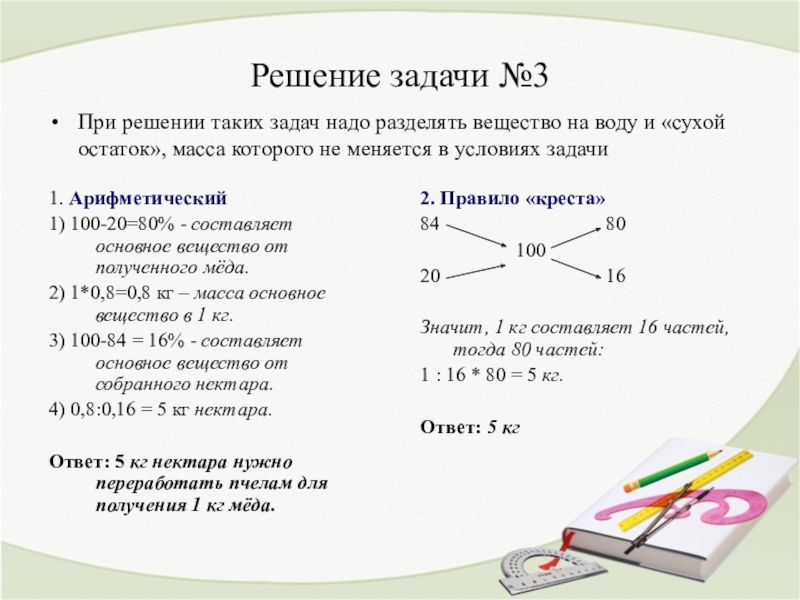 Когда ионные соединения растворяются в растворе, они распадаются на свое ионное состояние.Катионы и анионы связаны с полярными молекулами воды. Напомним, что растворы, содержащие ионы, называются электролитами из-за их способности проводить электричество. Например, аммоний дихромат (NH 4 ) 2 CR 2 O 7 O 7 — это ионное соединение, которое содержит два NH 4 + ионов и один CR 2 O 7 2— ионов на формульную единицу. Как и другие ионные соединения, это сильный электролит, который диссоциирует в водном растворе с образованием гидратированных ионов NH 4 + и Cr 2 O 7 2− .Если мы рассмотрим это решение математически, мы увидим, что на каждую растворяющуюся молекулу дихромата аммония будет приходиться три образующихся иона (два иона NH 4 + и один Cr 2 O 7 ).
Когда ионные соединения растворяются в растворе, они распадаются на свое ионное состояние.Катионы и анионы связаны с полярными молекулами воды. Напомним, что растворы, содержащие ионы, называются электролитами из-за их способности проводить электричество. Например, аммоний дихромат (NH 4 ) 2 CR 2 O 7 O 7 — это ионное соединение, которое содержит два NH 4 + ионов и один CR 2 O 7 2— ионов на формульную единицу. Как и другие ионные соединения, это сильный электролит, который диссоциирует в водном растворе с образованием гидратированных ионов NH 4 + и Cr 2 O 7 2− .Если мы рассмотрим это решение математически, мы увидим, что на каждую растворяющуюся молекулу дихромата аммония будет приходиться три образующихся иона (два иона NH 4 + и один Cr 2 O 7 ). 2− ион). Это также можно представить в более крупном молярном масштабе. При растворении 1 моля (NH 4 ) 2 Cr 2 O 7 образуется 3 моля ионов (1 моль Cr 2 O 7
2− ион). Это также можно представить в более крупном молярном масштабе. При растворении 1 моля (NH 4 ) 2 Cr 2 O 7 образуется 3 моля ионов (1 моль Cr 2 O 7
8–анионов и моль катионов NH 4 + ) в растворе (рис. 7.11). Для обсуждения взаимосвязи между концентрацией раствора и результирующим числом ионов используется термин эквивалентов .
Один эквивалент определяется как количество ионного соединения, которое обеспечивает 1 моль электрического заряда (+ или -). Он рассчитывается путем деления молярности раствора на общий заряд, созданный в растворе.
Рис. 7.11 Растворение 1 моля ионного соединения. При растворении 1 моля формульных единиц дихромата аммония в воде образуется 1 моль анионов Cr 2 O 7 2− и 2 моля катионов NH 4 + . (Для ясности молекулы воды не показаны на молекулярном изображении раствора.)
(Для ясности молекулы воды не показаны на молекулярном изображении раствора.)
Когда мы проводим химическую реакцию с использованием раствора соли, такой как дихромат аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− 900,88 также должна быть43 М, потому что на формульную единицу приходится один ион Cr 2 O 7 2− . Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 M. Поскольку каждая формульная единица (NH 4 ) 2 CR 2 O 7 O 7 Производится Три Ионов при растворенном в воде (2NH 4 + + 1Cr 2 O 7 2-), Всего Концентрация ионов в решение 3 × 1. 43 M = 4,29 M. Эквивалентное значение (NH 4 ) 2 Cr 2 O 7 можно рассчитать, разделив 1,43 M на 4,29 M, что даст 0,333 эквивалента. Так, для (NH 4 ) 2 Cr 2 O 7 растворение 0,333 моля соединения даст 1 моль ионов в растворе.
43 M = 4,29 M. Эквивалентное значение (NH 4 ) 2 Cr 2 O 7 можно рассчитать, разделив 1,43 M на 4,29 M, что даст 0,333 эквивалента. Так, для (NH 4 ) 2 Cr 2 O 7 растворение 0,333 моля соединения даст 1 моль ионов в растворе.
Каковы концентрации всех ионных частиц, полученных из растворенных веществ в этих водных растворах?
- 0.21 М NaOH
- 3,7 М (СН 3 )СНОН
- 0,032 М In(№ 3 ) 3
Дано: молярность
Запрашиваемый: концентраций
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит.
B Если соединение является неэлектролитом, его концентрация равна молярности раствора. Если соединение является сильным электролитом, определяют количество каждого иона, содержащегося в одной формульной единице. Найдите концентрацию каждого вида, умножив количество каждого иона на молярность раствора.
Найдите концентрацию каждого вида, умножив количество каждого иона на молярность раствора.
Решение:
1. 0,21 М NaOH
A Гидроксид натрия представляет собой ионное соединение, которое является сильным электролитом (и сильным основанием) в водном растворе:
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0.21 М и [ОН — ] = 0,21
2. 3,7 М (CH 3 )CHOH
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 4.1 «Водные растворы», что спирты представляют собой ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты являются неэлектролитами
Таким образом, спирты являются неэлектролитами
B Таким образом, единственным растворенным веществом в растворе является (CH 3 ) 2 молекул CHOH, поэтому [(CH 3 ) 2 CHOH] = 3.7 М
3. 0,032 М In(NO 3 ) 3
A Нитрат индия представляет собой ионное соединение, которое содержит ионы In 3+ и ионы NO 3 − , поэтому мы ожидаем, что он будет вести себя как сильный электролит в водном растворе
B Одна формульная единица In(NO 3 ) 3 дает один ион In 3+ и три иона NO 3 − , т.е. Решение содержит 0.032 M In 3+ и 3 × 0,032 M = 0,096 M NO 3 – , т. е. [In 3+ ] = 0,032 M и [NO 3 0 90 0,90 − 90] (наверх)
7.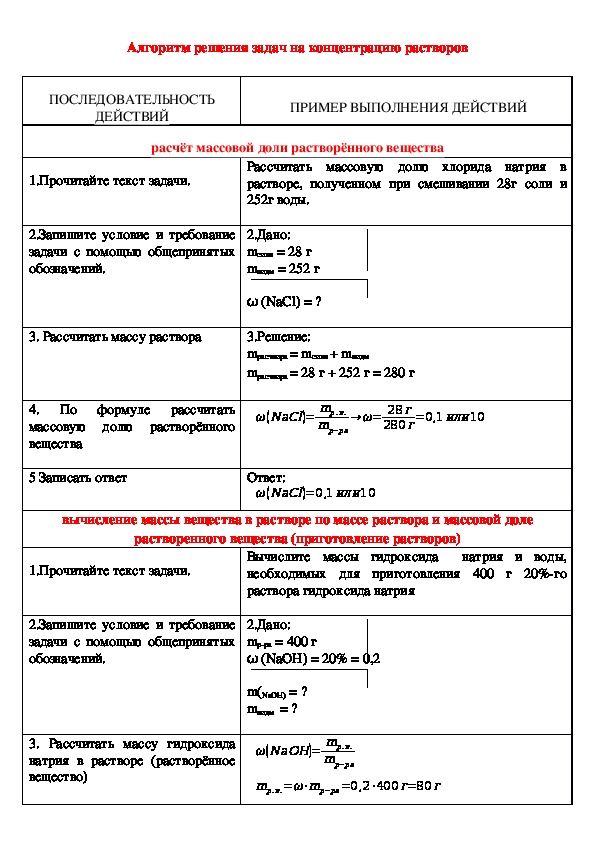 10 Обзор
10 Обзор
Чтобы убедиться, что вы понимаете материал этой главы, вам следует просмотреть значения выделенных жирным шрифтом терминов в следующем резюме и спросить себя, как они связаны с темами этой главы.
Раствор представляет собой гомогенную смесь. Основным компонентом является растворитель , а второстепенным компонентом является растворенное вещество . Решения могут иметь любую фазу; например, сплав представляет собой твердый раствор. Растворенные вещества бывают растворимыми или нерастворимыми , что означает, что они растворяются или не растворяются в определенном растворителе. Термины смешивающийся и несмешивающийся вместо растворимых и нерастворимых используются для жидких растворенных веществ и растворителей.Утверждение подобно растворению подобно является полезным руководством для предсказания того, растворится ли растворенное вещество в данном растворителе.
Растворение происходит путем сольватации , процесса, при котором частицы растворителя окружают отдельные частицы растворенного вещества, разделяя их и образуя раствор. Для водных растворов используется слово гидратация . Если растворенное вещество молекулярное, оно распадается на отдельные молекулы. Если растворенное вещество является ионным, отдельные ионы отделяются друг от друга, образуя раствор, проводящий электричество.Такие растворы называются электролитами . Если диссоциация ионов завершена, раствор представляет собой сильный электролит . Если диссоциация только частичная, раствор представляет собой слабый электролит . Растворы молекул не проводят электричество и называются неэлектролитами .
Количество растворенного вещества в растворе представлено концентрацией раствора. Максимальное количество растворенного вещества, которое растворяется в данном количестве растворителя, называется растворимостью растворенного вещества. Такие растворы насыщены . Растворы, количество которых меньше максимального, являются ненасыщенными . Большинство растворов ненасыщенные, и существуют различные способы определения их концентрации. Масса/массовые проценты , объемные/объемные проценты и массовые/объемные проценты указывают процентное содержание растворенного вещества в общем растворе. частей на миллион (ppm) и частей на миллиард (ppb) используются для описания очень малых концентраций растворенного вещества. Молярность , определяемая как количество молей растворенного вещества на литр раствора, является общепринятой единицей концентрации в химической лаборатории. Эквиваленты выражают концентрации в виде молей заряда ионов. Когда раствор разбавлен, мы используем тот факт, что количество растворенного вещества остается постоянным, чтобы иметь возможность определить объем или концентрацию конечного разбавленного раствора.
Такие растворы насыщены . Растворы, количество которых меньше максимального, являются ненасыщенными . Большинство растворов ненасыщенные, и существуют различные способы определения их концентрации. Масса/массовые проценты , объемные/объемные проценты и массовые/объемные проценты указывают процентное содержание растворенного вещества в общем растворе. частей на миллион (ppm) и частей на миллиард (ppb) используются для описания очень малых концентраций растворенного вещества. Молярность , определяемая как количество молей растворенного вещества на литр раствора, является общепринятой единицей концентрации в химической лаборатории. Эквиваленты выражают концентрации в виде молей заряда ионов. Когда раствор разбавлен, мы используем тот факт, что количество растворенного вещества остается постоянным, чтобы иметь возможность определить объем или концентрацию конечного разбавленного раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора ( исходного раствора ) до желаемого конечного объема.
Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора ( исходного раствора ) до желаемого конечного объема.
Ключ на вынос
- Концентрации растворов обычно выражаются в молярности и могут быть приготовлены путем растворения известной массы растворенного вещества в растворителе или разбавления исходного раствора.
Концептуальные проблемы
Какое из изображений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- НХ 3
- ВЧ
- CH 3 CH 2 CH 2 OH
Na 2 SO 4
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.

- CH 3 CO 2 H
- NaCl
- Нет 2 С
- Нет данных 3 Заказ на покупку 4
- ацетальдегид
Ожидаете ли вы, что 1,0 М раствор CaCl 2 будет лучшим проводником электричества, чем 1,0 М раствор NaCl? Почему или почему нет?
Альтернативным способом определения концентрации раствора является моляльность , сокращенно m .Моляльность определяется как число молей растворенного вещества в 1 кг растворителя . Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.
Каковы преимущества использования растворов для количественных расчетов?
Ответить
а) Nh4 является слабым основанием, а это означает, что некоторые молекулы будут принимать протон от молекул воды, вызывая их диссоциацию на ионы H+ и -OH.
 Ион H+ связывается с Nh4, образуя Nh5+. Таким образом, это будет больше всего похоже на стакан № 2. б) HF — слабая кислота, хотя F сильно электроотрицательна. Это связано с тем, что молекула HF может образовывать прочные водородные связи с молекулами воды и оставаться в ковалентной связи, которую труднее диссоциировать. Таким образом, стакан № 2 также является хорошим выбором для этой молекулы, так как только часть H-F будет диссоциировать на ионы h4O+ и F-. c) CH 3 CH 2 CH 2 OH представляет собой ковалентное соединение и не будет диссоциировать в какой-либо заметной степени, поэтому стакан № 3 является правильным выбором.d) Na 2 SO 4 является растворимым ионным соединением и будет полностью диссоциировать на ионы, наиболее похожие на химический стакан № 1.
Ион H+ связывается с Nh4, образуя Nh5+. Таким образом, это будет больше всего похоже на стакан № 2. б) HF — слабая кислота, хотя F сильно электроотрицательна. Это связано с тем, что молекула HF может образовывать прочные водородные связи с молекулами воды и оставаться в ковалентной связи, которую труднее диссоциировать. Таким образом, стакан № 2 также является хорошим выбором для этой молекулы, так как только часть H-F будет диссоциировать на ионы h4O+ и F-. c) CH 3 CH 2 CH 2 OH представляет собой ковалентное соединение и не будет диссоциировать в какой-либо заметной степени, поэтому стакан № 3 является правильным выбором.d) Na 2 SO 4 является растворимым ионным соединением и будет полностью диссоциировать на ионы, наиболее похожие на химический стакан № 1. Да, потому что когда CaCl 2 диссоциирует, он образует 3 иона (1 Ca 2+ и 2 иона Cl – ), тогда как NaCl диссоциирует только на 2 иона (Na + и Cl – ) для каждой молекулы.
 Таким образом, CaCl 2 будет генерировать больше ионов на моль, чем 1 моль NaCl, и будет лучшим проводником электричества.
Таким образом, CaCl 2 будет генерировать больше ионов на моль, чем 1 моль NaCl, и будет лучшим проводником электричества.Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества точнее.
Численные задачи
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.
- 0,2593 М NaBrO 3
- 1.592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 М йодата калия
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.
- 0,1065 М BaI 2
- 1,135 М Na 2 SO 4
- 1,428 М NH 4 Br
- 0,889 М ацетат натрия
Если все растворы содержат одно и то же растворенное вещество, то в каком растворе масса растворенного вещества больше?
- 1.
 40 л 0,334 М раствора или 1,10 л 0,420 М раствора
40 л 0,334 М раствора или 1,10 л 0,420 М раствора - 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0,489 М раствора или 150 мл 0,769 М раствора
- 1.
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) Кроты Концентрация (М) сульфат кальция 4,86 уксусная кислота 3.62 дигидрат йодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2,42 Какова концентрация каждого вида в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1.
 045 моль бромида магния в 500 мл раствора
045 моль бромида магния в 500 мл раствора - 0,146 моль глюкозы в 800 мл раствора
- 0,479 моль CeCl 3 в 700 мл раствора
Какова концентрация каждого вида в следующих водных растворах?
- 0,324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0.378 моль йодида калия в 750 мл раствора
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12,4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
- 14,2 г гексагидрата нитрата железа(III) в 300 мл раствора
Какова молярная концентрация каждого раствора?
- 12.8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4,3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
Укажите концентрацию каждого реагента в следующих уравнениях, предполагая, что 20,0 г каждого реагента и объем раствора 250 мл для каждого реагента.

- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca(OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al(NO 3 ) 3 (водн.) + H 2 SO 4 (водн.) →
- Pb(NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al(CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
Для эксперимента требуется 200.0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г/см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 , используя исходный раствор.
Гипохлорит кальция [Ca(OCl) 2 ] является эффективным дезинфицирующим средством для одежды и постельных принадлежностей.
 Если раствор имеет концентрацию Ca(OCl) 2 3.4 г на 100 мл раствора, какова молярность гипохлорита?
Если раствор имеет концентрацию Ca(OCl) 2 3.4 г на 100 мл раствора, какова молярность гипохлорита?Фенол (C 6 H 5 OH) часто используется в качестве антисептика в ополаскивателях для рта и леденцах от горла. Если жидкость для полоскания рта имеет концентрацию фенола 1,5 г на 100 мл раствора, какова молярность фенола?
Если таблетку, содержащую 100 мг кофеина (C 8 H 10 N 4 O 2 ), растворить в воде, чтобы получить 10,0 унций раствора, какова молярная концентрация кофеина в растворе?
На этикетке некоторых лекарств есть инструкции добавить 10.0 мл стерильной воды с указанием, что в каждом миллилитре полученного раствора будет содержаться 0,500 г лекарства. Если больному назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
ответы
а. 39,13 г б. 161,0 г в. 93,57 г d.
 201,8 г
201,8 га. 1,40 л 0,334 М раствора, б. 25,0 мл 0,134 М раствора, в. 150 мл 0,769 М раствора
а.0,815 М, б. 2,09 м, гр. 0,182 м, д. 0,684 М
а. 0,174 М, б. 0,297 М, с. 0,048 М, д. 0,135 М
а. BaCl 2 = 0,384 М, Na 2 SO 4 = 0,563 М, б. Ca(OH) 2 = 1,08 М, h4PO4 = 0,816 М, с. Al(NO 3 ) 3 = 0,376 M, H 2 SO 4 = 0,816 M, d. Pb(NO 3 ) 2 = 0,242 М, CuSO 4 = 0,501 М, э. Al(CH 3 CO 2 ) = 0.392 М, NaOH = 2,00 М
1,74 × 10 −3 М кофеин
Каталожные номера
- Чанг (Питер) Чи (2016) Неорганическая химия. Либретексты .
 Доступно по адресу: https://chem.libretexts.org/Core/Inorganic_Chemistry/Chemical_Reactions/Chemical_Reactions_1/Solutions .
Доступно по адресу: https://chem.libretexts.org/Core/Inorganic_Chemistry/Chemical_Reactions/Chemical_Reactions_1/Solutions . - Болл, Д.В., Хилл, Дж.В.и Скотт Р.Дж. (2016) КАРТА: Основы общей, органической и биологической химии . Свободные тексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Introductory_Chemistry_Textbook_Maps/Map%3A_The_Basics_of_GOB_Chemistry_(Ball_et_al.)
- Аверилл, Б.А., Элдридж, П. (2012) Основы химии . Свободные тексты. Доступно по адресу: https://2012books.lardbucket.org/books/principles-of-general-chemistry-v1.0/index.html .
- Гидрат. (2017, 30 августа).В Википедии , Свободной энциклопедии . Получено 16:20, 26 сентября 2017 г., с https://en.wikipedia.org/w/index.php?title=Hydrate&oldid=798015169 .
- Лоуэр, С. (2010). Растворы 1: Растворы и их концентрации. В онлайн-учебнике «Виртуальный учебник Chem1». Доступно по адресу: http://www.chem1.com/acad/webtext/solut/solut-1.
 html
html
Глава 7 – Растворы – Химия
Глава 7: Растворы A Стехиометрия nd Solution 7.1 Введение 7.2 Типы растворов 7.3 Растворимость 7.4 Температура и растворимость 7.5 Влияние давления на растворимость газов: закон Генри 7.6 Твердые гидраты 7.7 Концентрация раствора 7.7.1 Молярность 7.7.2 Частей на раствор 7.8 Разведения 7.9 Концентрация ионов в растворе 7.10 Окружающая среда: загрязнение свинцом 7.11 Обзор 7.12 Каталожные номера7.1 Введение:
Напомним из главы 1, что растворы определяются как гомогенные смеси, которые перемешаны настолько тщательно, что ни один из компонентов не может наблюдаться независимо от другого. Решения вокруг нас. Воздух, например, является раствором.Если вы живете рядом с озером, рекой или океаном, этот водоем не чистый H 2 O, а, скорее всего, раствор. Многое из того, что мы пьем, например газированные напитки, кофе, чай и молоко, — это растворы. Решения составляют большую часть повседневной жизни. Многие химические процессы, происходящие вокруг нас, происходят в растворе. На самом деле большая часть химических процессов, происходящих в нашем организме, происходит в растворе, и многие растворы, такие как раствор лактата Рингера для внутривенного введения, важны в здравоохранении. В нашем понимании химии нам нужно немного понимать растворы.В этой главе вы узнаете об особых характеристиках растворов, о том, как они характеризуются, и о некоторых их свойствах.
Решения вокруг нас. Воздух, например, является раствором.Если вы живете рядом с озером, рекой или океаном, этот водоем не чистый H 2 O, а, скорее всего, раствор. Многое из того, что мы пьем, например газированные напитки, кофе, чай и молоко, — это растворы. Решения составляют большую часть повседневной жизни. Многие химические процессы, происходящие вокруг нас, происходят в растворе. На самом деле большая часть химических процессов, происходящих в нашем организме, происходит в растворе, и многие растворы, такие как раствор лактата Рингера для внутривенного введения, важны в здравоохранении. В нашем понимании химии нам нужно немного понимать растворы.В этой главе вы узнаете об особых характеристиках растворов, о том, как они характеризуются, и о некоторых их свойствах.
Навыки для развития
- Дайте определение этим терминам: раствор, растворенное вещество и растворитель.
- Различают растворы, смеси и коллоиды.
- Опишите различные типы растворов.

- Различают ненасыщенные, насыщенные и пересыщенные растворы.
Основной компонент раствора называется растворитель , а второстепенный компонент(ы) называется растворенное вещество .Если оба компонента в растворе составляют 50%, термин растворенное вещество может быть присвоен любому компоненту. Когда газообразный или твердый материал растворяется в жидкости, газ или твердый материал называют растворенным веществом. Когда две жидкости растворяются друг в друге, главный компонент называется растворителем , а второстепенный компонент называется растворенным веществом .
В растворах протекают многие химические реакции, и растворы также тесно связаны с нашей повседневной жизнью.Воздух, которым мы дышим, жидкости, которые мы пьем, и жидкости в нашем теле — все это растворы. Кроме того, нас окружают такие решения, как воздух и вода (в реках, озерах и океанах).
В тему решений мы включаем следующие разделы.
- Типы растворов: газообразные, жидкие и твердые растворы основаны на состояниях раствора.
- Стехиометрия раствора: выражение концентрации в различных единицах (масса на единицу объема, моль на единицу объема, проценты и доли), расчеты стехиометрии реакции с участием растворов.
- Растворы электролитов: растворы кислот, оснований и солей, в которых растворенные вещества диссоциируют на положительные и отрицательные гидратированные ионы.
- Метатезис или реакции обмена: реакция электролитов, приводящая к нейтральным молекулам, газам и твердым веществам.
Решение задач стехиометрии растворов требует понятий, введенных в стехиометрии в главе 6, которая также обеспечивает основу для обсуждения реакций.
(наверх)7.2 типа решений
В главе 1 вы познакомились с концепцией смеси , которая представляет собой вещество, состоящее из двух или более веществ. Напомним, что смеси могут быть двух типов: гомогенные и гетерогенные, где гомогенные смеси сочетаются настолько тесно, что их можно наблюдать как единое вещество, даже если это не так. С другой стороны, гетерогенные смеси неоднородны и имеют области смеси, которые выглядят иначе, чем другие области смеси.Гомогенные смеси можно разделить на две категории: коллоиды и растворы. Коллоид представляет собой смесь, которая содержит частицы диаметром от 2 до 500 нм. Коллоиды кажутся однородными по своей природе и имеют одинаковый состав, но они мутные или непрозрачные. Молоко является хорошим примером коллоида. Истинные растворы имеют размер частиц типичного иона или небольшой молекулы (диаметром от ~ 0,1 до 2 нм) и прозрачны, хотя могут быть окрашены. В этой главе основное внимание будет уделено характеристикам истинных решений.
Напомним, что смеси могут быть двух типов: гомогенные и гетерогенные, где гомогенные смеси сочетаются настолько тесно, что их можно наблюдать как единое вещество, даже если это не так. С другой стороны, гетерогенные смеси неоднородны и имеют области смеси, которые выглядят иначе, чем другие области смеси.Гомогенные смеси можно разделить на две категории: коллоиды и растворы. Коллоид представляет собой смесь, которая содержит частицы диаметром от 2 до 500 нм. Коллоиды кажутся однородными по своей природе и имеют одинаковый состав, но они мутные или непрозрачные. Молоко является хорошим примером коллоида. Истинные растворы имеют размер частиц типичного иона или небольшой молекулы (диаметром от ~ 0,1 до 2 нм) и прозрачны, хотя могут быть окрашены. В этой главе основное внимание будет уделено характеристикам истинных решений.
Материал существует в трех состояниях: твердом, жидком и газообразном. Решения также существуют во всех этих состояниях:
- Газовые смеси обычно гомогенны и обычно представляют собой растворы газ-газ .
 Для количественной обработки этого типа растворов мы посвятим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, углекислого газа, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря.
Для количественной обработки этого типа растворов мы посвятим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, углекислого газа, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря. - Когда молекулы газа, твердого тела или жидкости диспергированы и смешиваются с молекулами жидкости, гомогенные (однородные) состояния называются жидкими растворами . Твердые вещества, жидкости и газы растворяются в жидком растворителе с образованием жидких растворов. В этой главе большая часть химии, которую мы обсудим, происходит в жидких растворах, где растворителем является вода.
- Многие сплавы, керамика и полимерные смеси представляют собой твердые растворы . В определенных пределах медь и цинк растворяются друг в друге и затвердевают, образуя твердые растворы, называемые латунью.
 Серебро, золото и медь образуют множество различных сплавов с уникальными цветами и внешним видом. Сплавы и другие твердые растворы играют важную роль в мире химии материалов.
Серебро, золото и медь образуют множество различных сплавов с уникальными цветами и внешним видом. Сплавы и другие твердые растворы играют важную роль в мире химии материалов.
7.3 Растворимость
Максимальное количество вещества, которое может быть растворено в данном объеме растворителя, называется растворимостью . Часто растворимость в воде выражается в граммах на 100 мл. Раствор, не достигший максимальной растворимости, называется ненасыщенным раствором. Это означает, что в растворитель можно добавить больше растворенного вещества, и растворение все равно будет происходить.
Раствор, достигший максимальной растворимости, называется насыщенным раствором . Если в этот момент добавить больше растворенного вещества, оно не растворится в растворе. Вместо этого он останется осажденным в виде твердого вещества на дне раствора. Таким образом, часто можно сказать, что раствор насыщен, если присутствует дополнительное растворенное вещество (это может существовать в виде другой фазы, такой как газ, жидкость или твердое вещество).В насыщенном растворе нет чистого изменения количества растворенного вещества, но система ни в коем случае не статична. На самом деле растворенное вещество постоянно растворяется и осаждается с одинаковой скоростью. Такое явление называется равновесием . Например:
Таким образом, часто можно сказать, что раствор насыщен, если присутствует дополнительное растворенное вещество (это может существовать в виде другой фазы, такой как газ, жидкость или твердое вещество).В насыщенном растворе нет чистого изменения количества растворенного вещества, но система ни в коем случае не статична. На самом деле растворенное вещество постоянно растворяется и осаждается с одинаковой скоростью. Такое явление называется равновесием . Например:
В особых случаях раствор может быть перенасыщенным . Перенасыщенные растворы – это растворы, в которых содержание растворенного вещества превышает нормальную точку насыщения.Обычно для создания пересыщенного раствора требуется такое условие, как повышенная температура или давление. Например, ацетат натрия имеет очень высокую растворимость при 270 К. При охлаждении такой раствор остается растворенным в так называемом метастабильном состоянии . Однако при добавлении в раствор кристалла с затравкой дополнительное растворенное вещество быстро затвердевает. В процессе кристаллизации выделяется тепло, и раствор становится теплым. Обычные грелки для рук используют этот химический процесс для выработки тепла.
Однако при добавлении в раствор кристалла с затравкой дополнительное растворенное вещество быстро затвердевает. В процессе кристаллизации выделяется тепло, и раствор становится теплым. Обычные грелки для рук используют этот химический процесс для выработки тепла.
Видео 7.1: Видео, показывающее кристаллизацию пересыщенного раствора ацетата натрия. Видео: Школа естественных наук и математики Северной Каролины
Итак, как мы можем предсказать растворимость вещества?
Одной из полезных классификаций материалов является полярность. Когда вы читали о ковалентных и ионных соединениях в главах 3 и 4, вы узнали, что ионные соединения обладают самой высокой полярностью, образуя полные катионы и анионы внутри каждой молекулы, когда электроны передаются от одного атома к другому.Вы также узнали, что ковалентные связи могут быть полярными или неполярными по своей природе в зависимости от того, распределяют ли атомы, участвующие в связи, электроны неравно или поровну соответственно. Напомним, что по разнице электроотрицательностей можно определить полярность вещества. Обычно ионная связь имеет разность электроотрицательностей 1,8 или выше, тогда как полярная ковалентная связь составляет от 0,4 до 1,8, а неполярная ковалентная связь составляет 0,4 или ниже.
Напомним, что по разнице электроотрицательностей можно определить полярность вещества. Обычно ионная связь имеет разность электроотрицательностей 1,8 или выше, тогда как полярная ковалентная связь составляет от 0,4 до 1,8, а неполярная ковалентная связь составляет 0,4 или ниже.
Рис. 7.1 Диаграмма разницы электроотрицательности. На приведенной выше диаграмме показано, какой тип связи образуется между двумя разными атомами. Взяв разницу между значениями электроотрицательности для каждого из атомов, участвующих в связи, можно предсказать тип связи и полярность. Обратите внимание, что полный ионный характер достигается редко, однако, когда металлы и неметаллы образуют связи, они называются с использованием правил ионной связи.
вещества с нулевым или низким электронэгатеритивностью, такие как H 2 , O 2 , N 2 , CH 4 , CCL 4 , CCL 4 — неволярных соединений , тогда как H 2 O, NH 3 , CH 3 OH, NO, CO, HCl, H 2 S, PH 3 разница электроотрицательности выше полярных соединений . Обычно соединения с одинаковой полярностью растворимы друг в друге. Это можно описать правилом:
Обычно соединения с одинаковой полярностью растворимы друг в друге. Это можно описать правилом:
Это означает, что вещества должны иметь одинаковые межмолекулярные силы для образования растворов. Когда растворимое вещество вводится в растворитель, частицы растворенного вещества могут взаимодействовать с частицами растворителя. В случае твердого или жидкого растворенного вещества взаимодействия между частицами растворенного вещества и частицами растворителя настолько сильны, что отдельные частицы растворенного вещества отделяются друг от друга и, окруженные молекулами растворителя, попадают в раствор.(Частицы газообразных растворенных веществ уже разделены, но концепция окружения частицами растворителя все еще применима.) Этот процесс называется solvatio n и показан на рис. 7.2. Когда растворителем является вода, используется слово гидратация , а не сольватация.
Обычно полярные растворители растворяют полярные растворенные вещества, тогда как неполярные растворители растворяют неполярные растворенные вещества. В целом процесс растворения зависит от силы притяжения между частицами растворенного вещества и частицами растворителя.Например, вода является высокополярным растворителем, способным растворять многие ионные соли. На рис. 7.2 показан процесс растворения, при котором вода действует как растворитель для растворения кристаллической соли хлорида натрия (NaCl). Обратите внимание, что когда ионные соединения растворяются в растворителе, они распадаются на свободно плавающие ионы в растворе. Это позволяет соединению взаимодействовать с растворителем. В случае растворения хлорида натрия в воде ион натрия притягивается к частичному отрицательному заряду атома кислорода в молекуле воды, тогда как ион хлорида притягивается к частично положительным атомам водорода.
Рисунок 7.2: Процесс растворения. Когда ионная соль, такая как хлорид натрия, показанная на (A), вступает в контакт с водой, молекулы воды диссоциируют ионные молекулы хлорида натрия в их ионное состояние, показанное в качестве молекулярной модели на (B) твердом теле. кристаллическая решетка хлорида натрия, и (С) хлорид натрия, растворенный в водном растворителе. (Фотография хлорида натрия предоставлена Крисом 73 ).
кристаллическая решетка хлорида натрия, и (С) хлорид натрия, растворенный в водном растворителе. (Фотография хлорида натрия предоставлена Крисом 73 ).
Многие ионные соединения растворимы в воде, однако не все ионные соединения растворимы.Ионные соединения, растворимые в воде, существуют в своем ионном состоянии в растворе. На рис. 7.2 вы заметите, что хлорид натрия распадается на ион натрия и ион хлорида по мере того, как он растворяется и взаимодействует с молекулами воды. Для ионных соединений, нерастворимых в воде, ионы настолько сильно притягиваются друг к другу, что не могут быть разделены парциальными зарядами молекул воды. Следующая таблица может помочь вам предсказать, какие ионные соединения будут растворимы в воде.
Диссоциация растворимых ионных соединений придает растворам этих соединений интересное свойство: они проводят электричество. Из-за этого свойства растворимые ионные соединения называются электролитами . Многие ионные соединения полностью диссоциируют и поэтому называются сильными электролитами . Хлорид натрия является примером сильного электролита.Некоторые соединения растворяются, но диссоциируют лишь частично, и растворы таких растворенных веществ могут лишь слабо проводить электричество. Эти растворенные вещества называются слабыми электролитами . Уксусная кислота (CH 3 COOH), входящая в состав уксуса, является слабым электролитом. Растворенные вещества, растворяющиеся в отдельные нейтральные молекулы без диссоциации, не сообщают своим растворам дополнительной электропроводности и называются неэлектролитами . Полярные ковалентные соединения, такие как столовый сахар (C 12 H 22 O 11 ), являются хорошими примерами неэлектролитов .
Многие ионные соединения полностью диссоциируют и поэтому называются сильными электролитами . Хлорид натрия является примером сильного электролита.Некоторые соединения растворяются, но диссоциируют лишь частично, и растворы таких растворенных веществ могут лишь слабо проводить электричество. Эти растворенные вещества называются слабыми электролитами . Уксусная кислота (CH 3 COOH), входящая в состав уксуса, является слабым электролитом. Растворенные вещества, растворяющиеся в отдельные нейтральные молекулы без диссоциации, не сообщают своим растворам дополнительной электропроводности и называются неэлектролитами . Полярные ковалентные соединения, такие как столовый сахар (C 12 H 22 O 11 ), являются хорошими примерами неэлектролитов .
Термин электролит используется в медицине для обозначения любого из важных ионов, растворенных в водном растворе в организме. Важные физиологические электролиты включают Na + , K + , Ca 2 + , Mg 2 + и Cl — . Спортивные напитки, такие как Gatoraid, содержат комбинации этих ключевых электролитов, которые помогают восполнить потери электролитов после тяжелой тренировки.
Важные физиологические электролиты включают Na + , K + , Ca 2 + , Mg 2 + и Cl — . Спортивные напитки, такие как Gatoraid, содержат комбинации этих ключевых электролитов, которые помогают восполнить потери электролитов после тяжелой тренировки.
Точно так же можно приготовить растворы путем смешивания двух совместимых жидкостей.Жидкость с более низкой концентрацией называется растворенным веществом, , а жидкость с более высокой концентрацией — растворителем . Например, зерновой спирт (CH 3 CH 2 OH) представляет собой полярную ковалентную молекулу, которая может смешиваться с водой. Когда два аналогичных раствора помещаются вместе и могут смешаться в раствор, говорят, что они смешиваются . С другой стороны, жидкости, которые не обладают сходными характеристиками и не могут смешиваться друг с другом, называются несмешивающимися . Например, масла, содержащиеся в оливковом масле, такие как олеиновая кислота (C 18 H 34 O 2 ), имеют в основном неполярные ковалентные связи, которые не имеют межмолекулярных сил, достаточно сильных, чтобы разорвать водородную связь между молекулы воды. Таким образом, вода и масло не смешиваются и считаются несмешиваемыми .
Например, масла, содержащиеся в оливковом масле, такие как олеиновая кислота (C 18 H 34 O 2 ), имеют в основном неполярные ковалентные связи, которые не имеют межмолекулярных сил, достаточно сильных, чтобы разорвать водородную связь между молекулы воды. Таким образом, вода и масло не смешиваются и считаются несмешиваемыми .
Другие факторы, такие как температура и давление, также влияют на растворимость растворителя. Таким образом, при указании растворимости следует также учитывать эти другие факторы.
(наверх)7.4 Температура и растворимость
При рассмотрении растворимости твердых веществ зависимость температуры и растворимости не является простой или предсказуемой. На рис. 7.3 показаны зависимости растворимости некоторых органических и неорганических соединений в воде от температуры. Хотя растворимость твердого тела обычно увеличивается с повышением температуры, между строением вещества и температурной зависимостью его растворимости нет простой зависимости. Многие соединения (например, глюкоза и CH 3 CO 2 Na) демонстрируют резкое увеличение растворимости с повышением температуры. Другие (такие как NaCl и K 2 SO 4 ) демонстрируют небольшие изменения, а третьи (такие как Li 2 SO 4 ) становятся менее растворимыми с повышением температуры.
Многие соединения (например, глюкоза и CH 3 CO 2 Na) демонстрируют резкое увеличение растворимости с повышением температуры. Другие (такие как NaCl и K 2 SO 4 ) демонстрируют небольшие изменения, а третьи (такие как Li 2 SO 4 ) становятся менее растворимыми с повышением температуры.
Рис. 7.3 Растворимость некоторых неорганических и органических твердых веществ в воде в зависимости от температуры. Растворимость может увеличиваться или уменьшаться в зависимости от температуры; величина этой температурной зависимости широко варьируется среди соединений.
Изменение растворимости в зависимости от температуры было измерено для широкого круга соединений, и результаты опубликованы во многих стандартных справочниках. Химики часто могут использовать эту информацию для разделения компонентов смеси путем фракционной кристаллизации , разделения соединений на основе их растворимости в данном растворителе. Например, если у нас есть смесь 150 г ацетата натрия (CH 3 CO 2 Na) и 50 г KBr, мы можем разделить два соединения, растворив смесь в 100 г воды при 80°C. и затем медленно охлаждают раствор до 0°С.Согласно температурным кривым на рис. 7.3, оба соединения растворяются в воде при 80°С, а все 50 г KBr остаются в растворе при 0°С. Только около 36 г CH 3 CO 2 Na растворимы в 100 г воды при 0°C, поэтому примерно 114 г (150 г – 36 г) CH 3 CO 2 Na кристаллизуется. выходит на охлаждение. Затем кристаллы можно отделить фильтрованием. Таким образом, фракционная кристаллизация позволяет нам восстановить около 75% исходного CH 3 CO 2 Na в практически чистом виде всего за одну стадию.
Например, если у нас есть смесь 150 г ацетата натрия (CH 3 CO 2 Na) и 50 г KBr, мы можем разделить два соединения, растворив смесь в 100 г воды при 80°C. и затем медленно охлаждают раствор до 0°С.Согласно температурным кривым на рис. 7.3, оба соединения растворяются в воде при 80°С, а все 50 г KBr остаются в растворе при 0°С. Только около 36 г CH 3 CO 2 Na растворимы в 100 г воды при 0°C, поэтому примерно 114 г (150 г – 36 г) CH 3 CO 2 Na кристаллизуется. выходит на охлаждение. Затем кристаллы можно отделить фильтрованием. Таким образом, фракционная кристаллизация позволяет нам восстановить около 75% исходного CH 3 CO 2 Na в практически чистом виде всего за одну стадию.
Фракционная кристаллизация — это распространенный метод очистки самых разнообразных соединений, как показано на рис. 7.3, от антибиотиков до ферментов. Чтобы этот метод работал должным образом, исследуемое соединение должно быть более растворимым при высокой температуре, чем при низкой температуре, чтобы понижение температуры вызывало его кристаллизацию из раствора. Кроме того, примеси должны быть на более растворимыми, чем исследуемое соединение (как KBr в этом примере), и предпочтительно присутствовать в относительно небольших количествах.
Кроме того, примеси должны быть на более растворимыми, чем исследуемое соединение (как KBr в этом примере), и предпочтительно присутствовать в относительно небольших количествах.
Растворимость газов в жидкостях гораздо более предсказуема. Растворимость газов в жидкостях уменьшается с повышением температуры, как показано на рис. 7.4. Привлекательные межмолекулярные взаимодействия в газовой фазе практически равны нулю для большинства веществ, потому что молекулы находятся так далеко друг от друга, когда находятся в газообразной форме. Когда газ растворяется, это происходит потому, что его молекулы взаимодействуют с молекулами растворителя. Тепло высвобождается, когда формируются эти новые силы притяжения. Таким образом, если к системе добавляется внешнее тепло, оно преодолевает силы притяжения между газом и молекулами растворителя и снижает растворимость газа.
Рис. 7.4 Растворимость некоторых распространенных газов в воде в зависимости от температуры при парциальном давлении 1 атм. Растворимость газов уменьшается с повышением температуры.
Растворимость газов уменьшается с повышением температуры.
Уменьшение растворимости газов при более высоких температурах имеет как практические, так и экологические последствия. Любой, кто регулярно кипятит воду в чайнике или электрическом чайнике, знает, что внутри него образуется белый или серый налет, который в конечном итоге необходимо удалить.То же самое явление происходит в гораздо большем масштабе в гигантских котлах, используемых для подачи горячей воды или пара для промышленных целей, где оно называется «котловой накипью», отложением, которое может серьезно снизить пропускную способность труб горячей воды ( Рисунок 7.5). Проблема не только современная: акведуки, построенные римлянами 2000 лет назад для подачи холодной воды из альпийских регионов в более теплые и засушливые регионы на юге Франции, были забиты аналогичными отложениями. Химия образования этих отложений умеренно сложна, но движущей силой является потеря растворенного диоксида углерода (CO 2 ) из раствора. Жесткая вода содержит растворенные ионы Ca 2+ и HCO 3 − (бикарбонат). Гидрокарбонат кальция [Ca(HCO 3 ) 2 ] хорошо растворим в воде, а карбонат кальция (CaCO 3 ) совершенно нерастворим. Раствор бикарбонат-ионов может реагировать с образованием углекислого газа, карбонат-иона и воды:
Жесткая вода содержит растворенные ионы Ca 2+ и HCO 3 − (бикарбонат). Гидрокарбонат кальция [Ca(HCO 3 ) 2 ] хорошо растворим в воде, а карбонат кальция (CaCO 3 ) совершенно нерастворим. Раствор бикарбонат-ионов может реагировать с образованием углекислого газа, карбонат-иона и воды:
2HCO 3 − (водн.) → CO 2 2− (водн.) + H 2 O(л) + CO 2 (водн.)
Нагревание раствора снижает растворимость CO 2 , который переходит в газовую фазу над раствором.В присутствии ионов кальция карбонат-ионы осаждаются в виде нерастворимого карбоната кальция, основного компонента накипи в котлах.
Рисунок 7.5 Накипь в водопроводной трубе. Карбонат кальция (CaCO 3 ) отложения в трубах горячей воды могут значительно уменьшить пропускную способность трубы. Эти отложения, называемые котловой накипью, образуются, когда растворенный CO 2 переходит в газовую фазу при высоких температурах.
В тепловое загрязнение , озерная или речная вода, используемая для охлаждения промышленного реактора или электростанции, возвращается в окружающую среду при более высокой температуре, чем обычно.Из-за пониженной растворимости O 2 при более высоких температурах (рис. 7.4) более теплая вода содержит меньше растворенного кислорода, чем вода, поступающая в установку. Рыбы и другие водные организмы, которым для жизни необходим растворенный кислород, могут буквально задохнуться, если концентрация кислорода в их среде обитания слишком низкая. Поскольку теплая, обедненная кислородом вода менее плотная, она имеет тенденцию плавать поверх более прохладной, более плотной и богатой кислородом воды в озере или реке, образуя барьер, препятствующий растворению атмосферного кислорода.В конце концов, даже глубокие озера могут задохнуться, если проблема не будет решена. Кроме того, большинство рыб и других водных организмов, не относящихся к млекопитающим, хладнокровны, а это означает, что температура их тела такая же, как и температура окружающей среды. Температуры, значительно превышающие нормальный диапазон, могут привести к серьезному стрессу или даже смерти. Системы охлаждения для электростанций и других объектов должны быть спроектированы таким образом, чтобы свести к минимуму любое неблагоприятное воздействие на температуру окружающих водоемов.На северо-западе Тихого океана популяции лососевых чрезвычайно чувствительны к изменениям температуры воды. В пределах этой популяции оптимальная температура воды находится между 12,8 и 17,8 o C (55-65 o F). Помимо пониженного уровня кислорода, популяции лосося гораздо более восприимчивы к болезням, хищникам и паразитарным инфекциям при более высоких температурах воды. Таким образом, тепловое загрязнение и глобальное изменение климата создают реальные проблемы для выживания и сохранения этих видов.Для получения дополнительной информации о влиянии повышения температуры на популяции лососевых посетите публикацию State of Washington’s Focus Publication.
Температуры, значительно превышающие нормальный диапазон, могут привести к серьезному стрессу или даже смерти. Системы охлаждения для электростанций и других объектов должны быть спроектированы таким образом, чтобы свести к минимуму любое неблагоприятное воздействие на температуру окружающих водоемов.На северо-западе Тихого океана популяции лососевых чрезвычайно чувствительны к изменениям температуры воды. В пределах этой популяции оптимальная температура воды находится между 12,8 и 17,8 o C (55-65 o F). Помимо пониженного уровня кислорода, популяции лосося гораздо более восприимчивы к болезням, хищникам и паразитарным инфекциям при более высоких температурах воды. Таким образом, тепловое загрязнение и глобальное изменение климата создают реальные проблемы для выживания и сохранения этих видов.Для получения дополнительной информации о влиянии повышения температуры на популяции лососевых посетите публикацию State of Washington’s Focus Publication.
Аналогичный эффект наблюдается в повышении температуры водоемов, таких как Чесапикский залив, крупнейший эстуарий в Северной Америке, причиной которого считается глобальное потепление. На каждые 1,5°C, на которые нагревается вода залива, способность воды растворять кислород уменьшается примерно на 1,1%. Многие морские виды, находящиеся на южной границе своего распространения, сместили свои популяции дальше на север.В 2005 году морская трава, которая является важной средой обитания для рыб и моллюсков, исчезла на большей части залива из-за рекордно высоких температур воды. Предположительно, снижение уровня кислорода уменьшило популяцию моллюсков и других фильтраторов, что затем уменьшило светопропускание, чтобы позволить расти взморникам. Сложные отношения в таких экосистемах, как Чесапикский залив, особенно чувствительны к колебаниям температуры, которые вызывают ухудшение качества среды обитания.
На каждые 1,5°C, на которые нагревается вода залива, способность воды растворять кислород уменьшается примерно на 1,1%. Многие морские виды, находящиеся на южной границе своего распространения, сместили свои популяции дальше на север.В 2005 году морская трава, которая является важной средой обитания для рыб и моллюсков, исчезла на большей части залива из-за рекордно высоких температур воды. Предположительно, снижение уровня кислорода уменьшило популяцию моллюсков и других фильтраторов, что затем уменьшило светопропускание, чтобы позволить расти взморникам. Сложные отношения в таких экосистемах, как Чесапикский залив, особенно чувствительны к колебаниям температуры, которые вызывают ухудшение качества среды обитания.
7.5 Влияние давления на растворимость газов: закон Генри
Внешнее давление очень мало влияет на растворимость жидкостей и твердых веществ. Напротив, растворимость газов увеличивается по мере увеличения парциального давления газа над раствором. Этот момент показан на рис. 7.6, на котором показано влияние повышенного давления на динамическое равновесие, которое устанавливается между молекулами растворенного газа в растворе и молекулами в газовой фазе над раствором.Поскольку концентрация молекул в газовой фазе увеличивается с ростом давления, концентрация молекул растворенного газа в равновесном растворе также выше при более высоких давлениях.
Этот момент показан на рис. 7.6, на котором показано влияние повышенного давления на динамическое равновесие, которое устанавливается между молекулами растворенного газа в растворе и молекулами в газовой фазе над раствором.Поскольку концентрация молекул в газовой фазе увеличивается с ростом давления, концентрация молекул растворенного газа в равновесном растворе также выше при более высоких давлениях.
Рис. 7.6. Модель, показывающая, почему растворимость газа увеличивается по мере увеличения парциального давления при постоянной температуре. (а) Когда газ вступает в контакт с чистой жидкостью, некоторые молекулы газа (фиолетовые сферы) сталкиваются с поверхностью жидкости и растворяются.Когда концентрация растворенных молекул газа увеличилась настолько, что скорость, с которой молекулы газа уходят в газовую фазу, стала такой же, как скорость, с которой они растворяются, установилось динамическое равновесие, как показано здесь. (б) Увеличение давления газа увеличивает количество молекул газа в единице объема, что увеличивает скорость, с которой молекулы газа сталкиваются с поверхностью жидкости и растворяются. (c) По мере растворения дополнительных молекул газа при более высоком давлении концентрация растворенного газа увеличивается до тех пор, пока не установится новое динамическое равновесие.
(c) По мере растворения дополнительных молекул газа при более высоком давлении концентрация растворенного газа увеличивается до тех пор, пока не установится новое динамическое равновесие.
Связь между давлением и растворимостью газа количественно описывается законом Генри, названным в честь его первооткрывателя, английского врача и химика Уильяма Генри (1775–1836):
C = кПа
, где C — концентрация растворенного газа в состоянии равновесия, P — парциальное давление газа, а k — константа закона Генри , которую необходимо определить экспериментально для каждой комбинации газа, растворителя, и температура.Хотя концентрацию газа можно выразить в любых удобных единицах, мы будем использовать исключительно молярность. Таким образом, единицами константы закона Генри являются моль/(л·атм) = М/атм. Значения констант закона Генри для растворов некоторых газов в воде при 20°C приведены в таблице 7.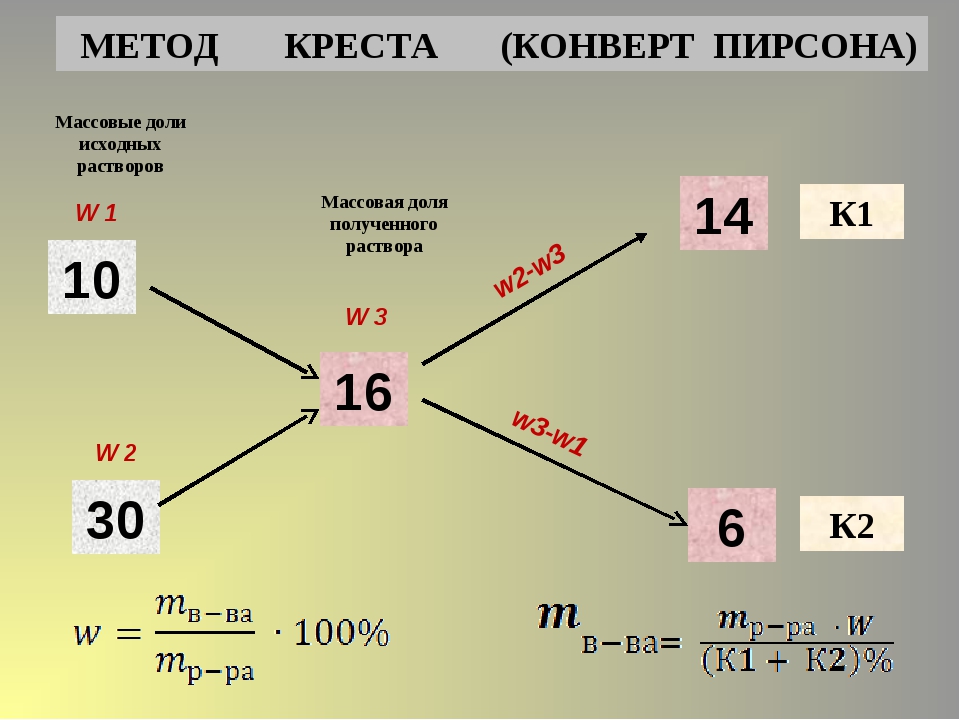 2
2
Видеоруководство по закону Генри от Академии Кана
Все материалы Академии Хана доступны бесплатно на сайте www.khanacademy.org
Как данные в таблице 7.2 видно, что концентрация растворенного газа в воде при данном давлении сильно зависит от ее физических свойств. Для ряда родственных веществ лондоновские дисперсионные силы увеличиваются с увеличением молекулярной массы. Таким образом, среди элементов группы 18 константы закона Генри плавно возрастают от He к Ne и к Ar. Таблица также показывает, что растворимость O 2 почти в два раза выше, чем у N 2 . Хотя лондонские дисперсионные силы слишком слабы, чтобы объяснить такую большую разницу, O 2 является парамагнитным и, следовательно, более поляризуемым, чем N 2 , что объясняет его высокую растворимость.(Примечание: когда вещество парамагнитно оно очень слабо притягивается полюсами магнита, но не сохраняет какого-либо постоянного магнетизма).
Парциальное давление газа можно выразить как концентрацию, записав закон Генри как P газ = C /k. Это важно во многих аспектах жизни, включая медицину, где обычно измеряют газы крови, такие как кислород и углекислый газ.Поскольку парциальное давление и концентрация прямо пропорциональны, если парциальное давление газа изменяется, а температура остается постоянной, новую концентрацию газа в жидкости можно легко рассчитать с помощью следующего уравнения:
Где C 1 и P 1 — концентрация и парциальное давление соответственно газа в начальных условиях, а C 2 и P 2 901 — концентрация и парциальное давление соответственно газа в конечном состоянии.Например:
Практическая задача: Концентрация CO 2 в растворе составляет 0,032 М при 3,0 атм. Какова концентрация CO 2 при давлении 5,0 атм? Решение: Чтобы решить эту проблему, сначала мы должны определить, что мы хотим найти. Это концентрация CO 2 при давлении 5,0 атм. Эти два значения представляют C 2 = ?? и P 2 = 5.0 атм. В этот момент будет проще всего изменить наше уравнение выше, чтобы найти C 2 . Далее нам нужно определить начальные условия, C 1 = 0,032 M и P 1 = 3,0 атм. Затем мы можем подставить эти значения в уравнение и найти C 2 :
Какова концентрация CO 2 при давлении 5,0 атм? Решение: Чтобы решить эту проблему, сначала мы должны определить, что мы хотим найти. Это концентрация CO 2 при давлении 5,0 атм. Эти два значения представляют C 2 = ?? и P 2 = 5.0 атм. В этот момент будет проще всего изменить наше уравнение выше, чтобы найти C 2 . Далее нам нужно определить начальные условия, C 1 = 0,032 M и P 1 = 3,0 атм. Затем мы можем подставить эти значения в уравнение и найти C 2 : Газы, химически реагирующие с водой, такие как HCl и другие галогеноводороды, H 2 S и NH 3 , не подчиняются закону Генри; все эти газы гораздо более растворимы, чем предсказывает закон Генри.Например, HCl реагирует с водой с образованием H + (водн. ) и Cl — (водн.), , а не растворенных молекул HCl, и ее диссоциация на ионы приводит к гораздо более высокой растворимости, чем ожидалось для нейтральной молекулы. В целом, газы, реагирующие с водой, не подчиняются закону Генри.
) и Cl — (водн.), , а не растворенных молекул HCl, и ее диссоциация на ионы приводит к гораздо более высокой растворимости, чем ожидалось для нейтральной молекулы. В целом, газы, реагирующие с водой, не подчиняются закону Генри.
Закон Генри имеет важные применения. Например, пузырьки CO 2 образуются, как только открывается газированный напиток, потому что напиток был разлит в бутылки под CO 2 при давлении более 1 атм.Когда бутылку открывают, давление CO 2 над раствором быстро падает, и часть растворенного газа выходит из раствора в виде пузырьков. Закон Генри также объясняет, почему аквалангисты должны быть осторожны, чтобы медленно всплывать на поверхность после погружения, если они дышат сжатым воздухом. При более высоких давлениях под водой большее количество N 2 из воздуха растворяется во внутренних жидкостях водолаза. Если дайвер всплывает слишком быстро, быстрое изменение давления вызывает образование маленьких пузырьков N 2 по всему телу, состояние, известное как «изгибы».Эти пузырьки могут блокировать поток крови через мелкие кровеносные сосуды, вызывая сильную боль и даже приводя к летальному исходу в некоторых случаях.
Если дайвер всплывает слишком быстро, быстрое изменение давления вызывает образование маленьких пузырьков N 2 по всему телу, состояние, известное как «изгибы».Эти пузырьки могут блокировать поток крови через мелкие кровеносные сосуды, вызывая сильную боль и даже приводя к летальному исходу в некоторых случаях.
Из-за низкой константы закона Генри для O 2 в воде уровни растворенного кислорода в воде слишком низки для удовлетворения энергетических потребностей многоклеточных организмов, включая человека. Для повышения концентрации O 2 во внутренних жидкостях организмы синтезируют легкорастворимые молекулы-носители, которые обратимо связывают O 2 . Например, эритроциты человека содержат белок, называемый гемоглобином, который специфически связывает O 2 и облегчает его транспортировку из легких в ткани, где он используется для окисления молекул пищи для получения энергии.Концентрация гемоглобина в нормальной крови составляет около 2,2 мМ, и каждая молекула гемоглобина может связывать четыре молекулы O 2 . Хотя концентрация растворенного O 2 в сыворотке крови при 37°C (нормальная температура тела) составляет всего 0,010 мМ, общая растворенная концентрация O 2 составляет 8,8 мМ, что почти в тысячу раз больше, чем было бы возможно без гемоглобина. Синтетические переносчики кислорода на основе фторированных алканов были разработаны для использования в качестве экстренной замены цельной крови.В отличие от донорской крови эти «кровезаменители» не требуют охлаждения и имеют длительный срок хранения. Их очень высокие константы закона Генри для O 2 приводят к концентрациям растворенного кислорода, сравнимым с концентрациями в нормальной крови.
Хотя концентрация растворенного O 2 в сыворотке крови при 37°C (нормальная температура тела) составляет всего 0,010 мМ, общая растворенная концентрация O 2 составляет 8,8 мМ, что почти в тысячу раз больше, чем было бы возможно без гемоглобина. Синтетические переносчики кислорода на основе фторированных алканов были разработаны для использования в качестве экстренной замены цельной крови.В отличие от донорской крови эти «кровезаменители» не требуют охлаждения и имеют длительный срок хранения. Их очень высокие константы закона Генри для O 2 приводят к концентрациям растворенного кислорода, сравнимым с концентрациями в нормальной крови.
7.6 Твердые гидраты:
Некоторые ионные твердые тела принимают небольшое количество молекул воды в свою структуру кристаллической решетки и остаются в твердом состоянии.Эти твердые вещества называются твердыми гидратами . Твердые гидраты содержат соединенные в определенном соотношении молекулы воды как неотъемлемую часть кристалла, либо связанные с металлическим центром, либо кристаллизовавшиеся с металлокомплексом. Также говорят, что такие гидраты содержат кристаллизационной воды или гидратной воды .
Твердые гидраты содержат соединенные в определенном соотношении молекулы воды как неотъемлемую часть кристалла, либо связанные с металлическим центром, либо кристаллизовавшиеся с металлокомплексом. Также говорят, что такие гидраты содержат кристаллизационной воды или гидратной воды .
Ярким примером является хлорид кобальта (II), который при гидратации меняет цвет с синего на красный и поэтому может использоваться в качестве индикатора воды.
Рисунок 7.7: Хлорид кобальта как пример твердого гидрата. Безводный хлорид кобальта (вверху слева) и его структура кристаллической решетки (внизу слева) по сравнению с гексагидратом хлорида кобальта (вверху справа) и его кристаллической решеткой (внизу справа). Обратите внимание, что молекулы воды, показанные красным (кислород) и белым (водород), интегрированы в кристаллическую решетку хлорида кобальта (II), показанного синим (кобальт) и зеленым (хлорид), в зависимости от полярности. Частично отрицательные атомы кислорода притягиваются к положительно заряженному кобальту, а частично положительные атомы водорода притягиваются к отрицательно заряженным ионам хлора.Изображения предоставлены Wikipedia Commons (вверху слева и внизу слева), Benjah-bmm27 (вверху справа) и Smokefoot (внизу справа)
Частично отрицательные атомы кислорода притягиваются к положительно заряженному кобальту, а частично положительные атомы водорода притягиваются к отрицательно заряженным ионам хлора.Изображения предоставлены Wikipedia Commons (вверху слева и внизу слева), Benjah-bmm27 (вверху справа) и Smokefoot (внизу справа)
Обозначение, используемое для представления твердого гидрата: « гидратированное соединение ⋅ n H 2 O », где n — число молекул воды на формульную единицу соли. n обычно представляет собой небольшое целое число, хотя могут встречаться и дробные значения. Например, в моногидрате n равно единице, а в гексагидрате n равно 6.Например, на рис. 7.7 гидратированный хлорид кобальта будет обозначаться: «хлорид кобальта (II)⋅ 6 H 2 O». Числовые префиксы греческого происхождения, которые используются для обозначения твердых гидратов:
- Полукруглая – 1/2
- Моно – 1
- Полуторный – 1½
- Ди – 2
- Три – 3
- Тетра – 4
- Пента – 5
- Шестигранник – 6
- Гепта – 7
- Окта – 8
- Нона – 9
- Дека – 10
- Ундека – 11
- Додека – 12
Гидрат, потерявший воду, обозначается как ангидрид ; оставшуюся воду, если она есть, можно удалить только при очень сильном нагревании. Вещество, не содержащее воды, обозначается как безводный . Некоторые безводные соединения так легко гидратируются, что вытягивают воду из атмосферы и гидратируются. Эти вещества считаются гигроскопичными и могут использоваться в качестве осушителей или влагопоглотителей .
Вещество, не содержащее воды, обозначается как безводный . Некоторые безводные соединения так легко гидратируются, что вытягивают воду из атмосферы и гидратируются. Эти вещества считаются гигроскопичными и могут использоваться в качестве осушителей или влагопоглотителей .
7.7 Концентрация раствора
В химии концентрация определяется как содержание компонента, деленное на общий объем смеси.У всех нас есть качественное представление о том, что подразумевается под концентрацией . Любой, кто готовил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматизированный, высококонцентрированный напиток, тогда как слишком мало дает разбавленный раствор, который трудно отличить от воды. Количественно концентрация раствора описывает количество растворенного вещества, которое содержится в конкретном количестве этого раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, происходящих в растворе, и имеет решающее значение для многих аспектов нашей жизни, от измерения правильной дозы лекарства до обнаружения химических загрязнителей, таких как свинец и мышьяк.Химики используют множество различных способов определения концентрации. В этом разделе мы рассмотрим наиболее распространенные способы представления концентрации раствора. К ним относятся: молярность и количество частей в растворе.
Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, происходящих в растворе, и имеет решающее значение для многих аспектов нашей жизни, от измерения правильной дозы лекарства до обнаружения химических загрязнителей, таких как свинец и мышьяк.Химики используют множество различных способов определения концентрации. В этом разделе мы рассмотрим наиболее распространенные способы представления концентрации раствора. К ним относятся: молярность и количество частей в растворе.
Наиболее распространенной единицей концентрации является молярность , которая также наиболее полезна для расчетов, связанных со стехиометрией реакций в растворе. Молярность (M) раствора — это число молей растворенного вещества, присутствующего ровно в 1 л раствора.
Таким образом, единицами молярности являются моли на литр раствора (моль/л), сокращенно М. Обратите внимание, что указанный объем является общим объемом раствора и включает как растворенное вещество, так и растворитель. Например, водный раствор, содержащий 1 моль (342 г) сахарозы в количестве воды, достаточном для получения конечного объема 1,00 л, имеет концентрацию сахарозы 1,00 моль/л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формула растворенного вещества представляет собой концентрацию растворенного вещества.Итак,
Обратите внимание, что указанный объем является общим объемом раствора и включает как растворенное вещество, так и растворитель. Например, водный раствор, содержащий 1 моль (342 г) сахарозы в количестве воды, достаточном для получения конечного объема 1,00 л, имеет концентрацию сахарозы 1,00 моль/л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формула растворенного вещества представляет собой концентрацию растворенного вещества.Итак,
[сахароза] = 1,00 М
читается как «концентрация сахарозы 1,00 молярная». Приведенное выше уравнение можно использовать для расчета количества растворенного вещества, необходимого для получения любого количества желаемого раствора.
Пример задачи:Рассчитайте количество молей гидроксида натрия (NaOH), необходимое для получения 2,50 л 0,100 М NaOH.
Дано: (1) идентичность растворенного вещества = NaOH, (2) объем = 2,50 л и (3) молярность раствора = 0. 100 моль/л (Примечание: при расчете задач всегда записывайте единицы молярности как моль/л, а не М. Это позволит вам сократить ваши единицы при расчете.)
100 моль/л (Примечание: при расчете задач всегда записывайте единицы молярности как моль/л, а не М. Это позволит вам сократить ваши единицы при расчете.)
Запрос: количество растворенного вещества в молях
Стратегия: (1) Измените приведенное выше уравнение, чтобы найти нужные единицы измерения, в данном случае моли. (2) Дважды проверьте все единицы измерения в уравнении и убедитесь, что они совпадают. Выполните любые необходимые преобразования, чтобы единицы измерения совпадали. (3) Правильно введите значения и посчитайте.
Решение:
(1) Измените приведенное выше уравнение, чтобы найти моли.
(2) Дважды проверьте все единицы измерения в уравнении и убедитесь, что они совпадают.
Данными значениями для этого уравнения являются объем 2,50 л и молярность 0,100 моль/л. Единицы объема для обоих этих чисел указаны в литрах (л) и, таким образом, совпадают. Поэтому никаких преобразований делать не нужно.
Поэтому никаких преобразований делать не нужно.
(3) Введите соответствующие значения и выполните расчеты.
Приготовление растворовОбратите внимание, что в приведенном выше примере у нас по-прежнему недостаточно информации, чтобы действительно сделать раствор в лаборатории. Не существует прибора, который мог бы измерить количество молей вещества. Для этого нам нужно преобразовать количество молей образца в количество граммов, представленное этим числом. Затем мы можем легко использовать весы, чтобы взвесить количество вещества, необходимое для раствора.Для примера выше:
Чтобы приготовить раствор, растворенное вещество обычно растворяют в небольшом количестве растворителя, а затем, когда растворенное вещество растворяется, окончательный объем можно довести до 2,50 л. Если вы сразу добавили 10 г NaOH до 2,50 л, конечный объем будет больше 2,50 л, а концентрация раствора будет меньше 0,100 М. Помните, что конечный объем должен включать как растворенное вещество, так и растворитель.
На рис. 7.8 показана процедура приготовления раствора дигидрата хлорида кобальта(II) в этаноле.Обратите внимание, что объем растворителя не указан. Поскольку растворенное вещество занимает место в растворе, необходимый объем растворителя на меньше, чем на требуемый общий объем раствора.
Рисунок 7.8: Приготовление раствора известной концентрации с использованием твердого растворенного вещества. Чтобы приготовить раствор, начните с добавления части растворителя в колбу. Затем отмерьте необходимое количество растворенного вещества и медленно добавьте его в растворитель.После растворения в растворителе объем раствора можно довести до конечного объема раствора. Для показанной мерной колбы это обозначено черной линией на горлышке колбы. В данном случае это означает 500 мл раствора. Мерные колбы существуют разных размеров для разных объемов растворов. Градуированные цилиндры также можно использовать для точного доведения раствора до конечного объема. Другая стеклянная посуда, включая мензурки и колбы Эрленмейера, недостаточно точна для приготовления большинства растворов.
Другая стеклянная посуда, включая мензурки и колбы Эрленмейера, недостаточно точна для приготовления большинства растворов.
Пример расчета молярности
Раствор на рис. 7.8 содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 ·2H 2 O, в этаноле, достаточном для получения ровно 500 мл раствора. Какова молярная концентрация CoCl 2 ·2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрашиваемый: концентрация (M)
Стратегия:
1.Мы знаем, что молярность равна молям на литр
.2. Чтобы рассчитать молярность, нам нужно выразить:
- масса в виде родинок
- объем в литрах
- Подставьте оба значения в приведенное выше уравнение и рассчитайте .
Решение:
- Преобразование массы в моли.
 Мы можем использовать молярную массу для преобразования граммов CoCl 2 · 2H 2 O в моли.
Мы можем использовать молярную массу для преобразования граммов CoCl 2 · 2H 2 O в моли.
- Молярная масса CoCl 2 ·2H 2 O равна 165.87 г/моль (включая две молекулы воды, поскольку они являются частью структуры кристаллической решетки этого твердого гидрата!)
2. Преобразуйте объем в литры
3. Подставьте значения в уравнение молярности:
7.7.2 Частей на растворВ потребительском и промышленном мире наиболее распространенный метод выражения концентрации основан на количестве растворенного вещества в фиксированном количестве раствора.Упомянутые здесь «количества» могут быть выражены в массе, в объеме или в том и другом (т.е. масса растворенного вещества в заданном объеме раствора). Чтобы различать эти возможности, используются сокращения (m/ м), (об/об) и (м/об).
В большинстве прикладных областей химии часто используется мера (m/m), тогда как в клинической химии обычно используется (m/v), где масса выражается в граммах и объем в мл.
Один из наиболее распространенных способов выражения таких концентраций как « частей на 100 », который мы все знаем как « процентов ».« Cent » — префикс латинского происхождения, относящийся к числу 100
(L. centum ), например, век или век . Он также обозначает 1/100 (от L. центезимус ), как в сантиметрах и денежной единице центов . Процентные растворы определяют количество растворенного вещества, растворенного в количестве раствора, умноженное на 100. Процентные растворы могут быть выражены в единицах массы растворенного вещества на массу раствора (м/м) или массы растворенного вещества на объем раствора (м/м). об.%), или объем растворенного вещества на объем раствора (об./об.%).При приготовлении процентного раствора важно указать, какие единицы измерения используются, чтобы другие тоже могли правильно составить раствор. Кроме того, помните, что раствор представляет собой сумму растворителя и растворенного вещества, когда вы выполняете процентные вычисления.
Раствор = растворенное вещество + растворитель
Таким образом, при расчете процентных растворов можно использовать следующее уравнение:
Пример 1:Например, 7,0% об/об раствор этанола в воде будет содержать 7 мл этанола в 100 мл раствора.Сколько воды в растворе?
В этой задаче мы знаем, что:
Раствор = растворенное вещество + растворитель
Таким образом, мы можем заполнить значения, а затем найти неизвестное.
100 мл = 7 мл + X мл растворителя (в данном случае вода)
переместив семерку на другую сторону, мы увидим, что:
100 мл – 7 мл = 93 мл H 2 O
Пример 2Чему равно (масс./об.)% раствора, если 24.0 г сахарозы растворяют в общем растворе объемом 243 мл?
Пример 3Сколько граммов NaCl требуется для приготовления 625 мл 13,5% раствора?
Для более разбавленных растворов используются части на миллион (10 6 ppm) и части на миллиард (10 9 ; ppb). Эти термины широко используются для выражения количества следовых загрязнителей в окружающей среде.
Аналогично процентным единицам («частям на сотню»), ppm и ppb могут быть определены в виде масс, объемов или смешанных единиц масса-объем.Существуют также единицы ppm и ppb, определяемые по количеству атомов и молекул.
Массовые определения частей на миллион и частей на миллиард приведены здесь:
Как ppm, так и ppb являются удобными единицами измерения концентрации загрязняющих веществ и других следов загрязняющих веществ в воде. Концентрации этих загрязняющих веществ, как правило, очень низки в обработанных и природных водах, и их уровни не могут превышать относительно низкие пороговые концентрации, не оказывая неблагоприятного воздействия на здоровье и дикую природу.Например, Агентство по охране окружающей среды установило, что максимально безопасный уровень ионов фтора в водопроводной воде составляет 4 части на миллион. Проточные фильтры для воды предназначены для снижения концентрации фтора и некоторых других загрязняющих веществ в следовых количествах в водопроводной воде (рис. 7.9).
Рисунок 7.9. (a) В некоторых районах следовые концентрации загрязняющих веществ могут сделать нефильтрованную водопроводную воду непригодной для питья и приготовления пищи. (b) Проточные фильтры для воды снижают концентрацию растворенных веществ в водопроводной воде.(кредит a: модификация работы Дженн Дерфи; кредит b: модификация работы «vastateparkstaff»/Wikimedia commons
При сообщении о таких загрязняющих веществах, как свинец в питьевой воде, концентрации ppm и ppb часто указываются в смешанных единицах измерения массы/объема. Это может быть очень полезно, поскольку нам легче думать о воде с точки зрения ее объема, а не ее массы. Кроме того, плотность воды составляет 1,0 г/мл или 1,0 мг/0,001 мл, что упрощает преобразование между двумя единицами измерения.Например, если мы обнаружим, что содержание свинца в воде составляет 4 части на миллион, это будет означать, что имеются:
Концентрации ионных растворенных веществ иногда выражают в единицах, называемых эквивалентами (уравнение). Один эквивалент равен 1 молю положительного или отрицательного заряда. Таким образом, 1 моль/л Na + (водн.) также равен 1 экв./л, поскольку натрий имеет заряд 1+. Раствор ионов Ca 2 + (водн.) с концентрацией 1 моль/л имеет концентрацию 2 экв/л, поскольку кальций имеет заряд 2+.Разбавленные растворы могут быть выражены в миллиэквивалентах (мэкв) — например, плазма крови человека имеет общую концентрацию около 150 мэкв/л.
В более формальном определении эквивалент — это количество вещества, необходимое для выполнения одного из следующих действий:
- вступают в реакцию с одним молем ионов водорода (H + ) или выделяют его в кислотно-щелочной реакции
- реагируют или отдают один моль электронов в окислительно-восстановительной реакции.
Согласно этому определению, эквивалентно — это количество молей иона в растворе, умноженное на валентность этого иона.Если 1 моль NaCl и 1 моль CaCl 2 растворяются в растворе, в этом растворе содержится 1 экв Na, 2 экв Ca и 3 экв Cl. (Валентность кальция равна 2, поэтому для этого иона у вас есть 1 моль и 2 эквивалента.)
(наверх)7.8 Разведения
Раствор нужной концентрации также можно приготовить, разбавив небольшой объем более концентрированного раствора дополнительным растворителем. Для этой цели часто используют маточный раствор, представляющий собой приготовленный раствор известной концентрации.Разбавление маточного раствора предпочтительнее при приготовлении растворов очень слабых концентраций, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества может быть трудным для выполнения с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Раствор нужной концентрации также можно приготовить, разбавив небольшой объем более концентрированного раствора дополнительным растворителем.Для этой цели часто используют маточный раствор, представляющий собой приготовленный раствор известной концентрации. Разбавление маточного раствора предпочтительнее при приготовлении растворов очень слабых концентраций, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества может быть трудным для выполнения с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из исходного раствора показана на рисунке 7.10. Требуется вычислить желаемое количество растворенного вещества в конечном объеме более разбавленного раствора, а затем вычислить объем исходного раствора, содержащего это количество растворенного вещества. Помните, что разбавление заданного количества маточного раствора растворителем , а не изменяет количество присутствующего растворенного вещества, изменяется только объем раствора. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора может быть выражено математически как:
Где M s — концентрация исходного раствора, V s — объем исходного раствора, M d — концентрация разбавленного раствора, а V d — объем разбавленного раствора. .
Рис. 7.10 Приготовление раствора известной концентрации путем разбавления маточного раствора. (a) Объем ( V s ), содержащий желаемое количество растворенного вещества (M s ), измеряется из маточного раствора известной концентрации. (b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до объемной метки [( V s )(M s ) = ( V d )(M d ) ].
Пример расчета разбавления
Какой объем 3,00 М исходного раствора глюкозы необходим для приготовления 2500 мл 0,400 М раствора?
Дано: объем и молярность разбавленного раствора и молярность исходного раствора
Запрошено: объем маточного раствора
Стратегия и решение:
Для задач на разбавление, если вы знаете 3 переменные, вы можете решить для 4-й переменной.
- Начните с перестановки уравнения для решения переменной, которую вы хотите найти. В этом случае необходимо найти объем маточного раствора, V s
2. Затем убедитесь, что одинаковые термины имеют одинаковые единицы измерения. Например, Md и Ms являются концентрациями, поэтому для выполнения расчетов они должны быть в одних и тех же единицах (в этом случае они оба указаны в молярности). Если бы концентрации были разными, скажем, один был указан в молярности, а другой в процентах, или один был в молярности, а другой в миллимолярности, один из терминов необходимо было бы преобразовать, чтобы они совпадали.Таким образом, в данном случае единицы измерения будут уравновешены, и вы останетесь с единицами объема.
3. Наконец, заполните уравнение известными значениями и рассчитайте окончательный ответ.
Обратите внимание, что если требуется 333 мл исходного раствора, вы также можете рассчитать количество растворителя, необходимого для окончательного разбавления. (Общий объем – объем исходного раствора = объем растворителя, необходимый для окончательного разбавления. В этом случае 2500 мл – 333 мл = 2167 мл воды, необходимой для окончательного разбавления (это следует делать в мерном цилиндре или мерной колбе). .
7.9 Концентрация ионов в растворе
До сих пор мы обсуждали концентрацию всего раствора в терминах общего количества растворенного вещества, деленного на объем раствора. Рассмотрим подробнее, что именно это означает при рассмотрении ионных и ковалентных соединений. Когда ионные соединения растворяются в растворе, они распадаются на свое ионное состояние.Катионы и анионы связаны с полярными молекулами воды. Напомним, что растворы, содержащие ионы, называются электролитами из-за их способности проводить электричество. Например, аммоний дихромат (NH 4 ) 2 CR 2 O 7 O 7 — это ионное соединение, которое содержит два NH 4 + ионов и один CR 2 O 7 2— ионов на формульную единицу. Как и другие ионные соединения, это сильный электролит, который диссоциирует в водном растворе с образованием гидратированных ионов NH 4 + и Cr 2 O 7 2− .Если мы рассмотрим это решение математически, мы увидим, что на каждую растворяющуюся молекулу дихромата аммония будет приходиться три образующихся иона (два иона NH 4 + и один Cr 2 O 7 ). 2− ион). Это также можно представить в более крупном молярном масштабе. При растворении 1 моля (NH 4 ) 2 Cr 2 O 7 образуется 3 моля ионов (1 моль Cr 2 O 7
8–анионов и моль катионов NH 4 + ) в растворе (рис. 7.11). Для обсуждения взаимосвязи между концентрацией раствора и результирующим числом ионов используется термин эквивалентов .
Один эквивалент определяется как количество ионного соединения, которое обеспечивает 1 моль электрического заряда (+ или -). Он рассчитывается путем деления молярности раствора на общий заряд, созданный в растворе.
Рис. 7.11 Растворение 1 моля ионного соединения. При растворении 1 моля формульных единиц дихромата аммония в воде образуется 1 моль анионов Cr 2 O 7 2− и 2 моля катионов NH 4 + . (Для ясности молекулы воды не показаны на молекулярном изображении раствора.)
Когда мы проводим химическую реакцию с использованием раствора соли, такой как дихромат аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− 900,88 также должна быть43 М, потому что на формульную единицу приходится один ион Cr 2 O 7 2− . Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 M. Поскольку каждая формульная единица (NH 4 ) 2 CR 2 O 7 O 7 Производится Три Ионов при растворенном в воде (2NH 4 + + 1Cr 2 O 7 2-), Всего Концентрация ионов в решение 3 × 1.43 M = 4,29 M. Эквивалентное значение (NH 4 ) 2 Cr 2 O 7 можно рассчитать, разделив 1,43 M на 4,29 M, что даст 0,333 эквивалента. Так, для (NH 4 ) 2 Cr 2 O 7 растворение 0,333 моля соединения даст 1 моль ионов в растворе.
Каковы концентрации всех ионных частиц, полученных из растворенных веществ в этих водных растворах?
- 0.21 М NaOH
- 3,7 М (СН 3 )СНОН
- 0,032 М In(№ 3 ) 3
Дано: молярность
Запрашиваемый: концентраций
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит.
B Если соединение является неэлектролитом, его концентрация равна молярности раствора. Если соединение является сильным электролитом, определяют количество каждого иона, содержащегося в одной формульной единице.Найдите концентрацию каждого вида, умножив количество каждого иона на молярность раствора.
Решение:
1. 0,21 М NaOH
A Гидроксид натрия представляет собой ионное соединение, которое является сильным электролитом (и сильным основанием) в водном растворе:
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0.21 М и [ОН — ] = 0,21
2. 3,7 М (CH 3 )CHOH
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 4.1 «Водные растворы», что спирты представляют собой ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты являются неэлектролитами
B Таким образом, единственным растворенным веществом в растворе является (CH 3 ) 2 молекул CHOH, поэтому [(CH 3 ) 2 CHOH] = 3.7 М
3. 0,032 М In(NO 3 ) 3
A Нитрат индия представляет собой ионное соединение, которое содержит ионы In 3+ и ионы NO 3 − , поэтому мы ожидаем, что он будет вести себя как сильный электролит в водном растворе
B Одна формульная единица In(NO 3 ) 3 дает один ион In 3+ и три иона NO 3 − , т.е. Решение содержит 0.032 M In 3+ и 3 × 0,032 M = 0,096 M NO 3 – , т. е. [In 3+ ] = 0,032 M и [NO 3 0 90 0,90 − 90] (наверх) В главе 5 вы познакомились с EPA и тем, как отслеживаются параметры качества воздуха для определения уровней загрязнения.Одним из шести основных параметров, контролируемых в соответствии с Законом о чистом воздухе, является свинец. Свинец встречается в земной коре в очень малых количествах, ~ 0,001%, и выглядит как серо-голубой металл, мягкий и плотный. Он широко использовался в Соединенных Штатах во многих различных продуктах, включая батареи и смеси металлов, в качестве припоя для труб и в гончарных изделиях, хрустальном стекле и других известных коммерческих продуктах. Использование свинца было особенно высоким в красках для наружных работ и в качестве добавки к бензину (рис. 7.12). Из-за растущих проблем со здоровьем использование свинца во многих продуктах было прекращено и прекращено. Однако загрязнение свинцом почвы, воды и воздуха по-прежнему представляет проблему и создает повышенный риск для здоровья населения. Рисунок 7.12 История использования свинца в красках и бензине на протяжении большей части 20-го века. На графике показано преобладание красок на основе свинца на начальном этапе, за которым последовал бум на транспорте, что привело к широкому использованию этилированного бензина.Снижение после середины 1970-х годов произошло из-за контроля, введенного EPA для отказа от этилированного бензина. Источник: Filippelli, et al (2005), используется с разрешения. Национальные стандарты качества атмосферного воздуха (NAAQS) для свинца установлены на верхнем пределе 0,15 микрограммов на кубический метр общего количества взвешенных частиц в качестве среднего значения за 3 месяца. Как видно из рисунка 7.13, уровень содержания свинца в атмосфере был очень высоким до середины 1990-х годов, после чего мы наблюдаем резкое падение уровня содержания свинца в атмосфере.Этот всплеск уровня свинца в значительной степени связан с выбросами транспортных средств, когда свинец использовался в качестве добавки к бензину. В 1970 году, когда было полностью признано негативное воздействие свинца на здоровье, Агентство по охране окружающей среды начало программу сокращения использования свинца в бензине. Полный запрет на этилированный бензин вступил в силу в 1996 году. Рисунок 7.13 Уровни свинца в атмосфере с 1980 по 2014 год. (A) Как интерпретировать графики качества воздуха от EPA. синяя полоса показывает распределение уровней загрязнения воздуха между участками тренда, отображая средние 80 %.Белая линия представляет собой среднее значение среди всех трендовых сайтов. На девяноста процентах сайтов концентрации ниже верхней линии, а на десяти процентах сайтов концентрации ниже нижней линии. (B) Годовой максимальный средний уровень содержания свинца в атмосфере за 3 месяца, демонстрирующий снижение уровня загрязнения свинцом на 99% с 1980 по 2017 год. Источник: EPA Компания General Motors идентифицировала использование тетраэтилсвинца (TEL) в качестве присадки к топливу, повышающей общее октановое число бензина.Это позволило существенно повысить компрессию двигателя, что привело к повышению производительности автомобиля и большей экономии топлива. TEL получают реакцией хлорэтана со сплавом натрия – свинца 4 NaPb + 4 CH 3 CH 2 Cl → (CH 3 CH 2 ) 4 Pb + 4 NaCl + 3 Pb Продукт извлекается перегонкой с водяным паром, в результате чего остается шлам из отходов свинца и хлорида натрия.Несмотря на десятилетия исследований, не было обнаружено никаких реакций, улучшающих этот довольно сложный процесс, в котором участвует металлический натрий и который превращает только 25% свинца в TEL. ТЭЛ представляет собой вязкую бесцветную жидкость. Поскольку TEL имеет нейтральный заряд и содержит внешние углеродные группы, он обладает высокой липофильностью (любящей жир) и растворим в бензине. При сжигании этилированного бензина выделяется не только углекислый газ и вода, но и свинец (CH 3 CH 2 ) 4 Pb + 13 O 2 → 8 CO 2 + 10 H 2 O + Pb Полученный свинец также может окисляться во время горения с образованием оксида свинца (II) 2 Pb + O 2 → 2 PbO Образование Pb и PbO в двигателе автомобиля приводит к быстрому чрезмерному накоплению и серьезному повреждению двигателя.Таким образом, в бензин также необходимо было добавить молекулы, поглощающие свинец, для реакции со свинцовыми продуктами, образующимися при сгорании. Обычно для этого процесса использовали 1,2-дибромэтан и 1,2-дихлорэтан. Эти агенты реагируют с побочными продуктами свинца и образуют летучие бромид свинца (II) и хлорид свинца (II), которые затем могут выбрасываться в атмосферу из двигателя. Повышенный уровень содержания свинца в атмосфере, вызванный использованием автомобиля, сильно коррелирует с повышенным уровнем содержания свинца в крови населения. 7.14 Снижение среднего уровня содержания свинца в крови у детей в США и общего количества свинца, ежегодно используемого в бензине, за 1974-1992 годы (адаптировано из USEPA 1999). Как только свинец всасывается в организм, он не выводится из организма. Вместо этого он накапливается в минерализующихся тканях, таких как кости и зубы, или в мягких тканях, таких как печень, почки и мозг. Мозг очень чувствителен. Исследование свинца в Цинциннати показало, что воздействие свинца в детстве вызывает потерю серого вещества в мозге, особенно в лобных областях, участвующих в исполнительной функции и принятии решений (рис. 7.15). Рисунок 7.15 Воздействие свинца в детстве уменьшает размер мозга. Мозг взрослых, подвергшихся воздействию свинца в детстве, показывает уменьшение объема, особенно в префронтальной коре на МРТ. Области потери объема показаны цветом на шаблоне нормального мозга. Источник: Сесил, К.М. и др. Острое воздействие свинца может вызвать отравление свинцом и привести к болям в животе, запорам, головным болям, раздражительности, проблемам с памятью, неспособности иметь детей и покалываниям в руках и ногах.Это вызывает почти 10% умственной отсталости по неизвестной причине и может привести к поведенческим проблемам. Некоторые из эффектов являются постоянными. В тяжелых случаях возможны анемия, судороги, кома или смерть. Воздействие свинца может происходить через загрязненный воздух, воду, пыль, продукты питания или потребительские товары Дети подвергаются большему риску, поскольку они с большей вероятностью берут в рот предметы, содержащие свинцовую краску, и поглощают большую часть свинца. что они едят. Воздействие на работе является частой причиной отравления свинцом у взрослых людей, занимающихся определенными видами деятельности с особым риском.Диагноз обычно ставится путем измерения уровня свинца в крови. Центры по контролю за заболеваниями (США) установили верхний предел содержания свинца в крови для взрослых на уровне 10 мкг/дл (10 мкг/100 г) и для детей на уровне 5 мкг/дл. Ряд исследований, проведенных за последнее десятилетие, показали сильную корреляцию между уровнем содержания свинца в крови дошкольников и последующим уровнем преступности, особенно насильственных преступлений, совершенных 20 лет спустя (рис. 7.16). Рисунок 7.16 Корреляция уровня свинца в крови дошкольников и насильственных преступлений, совершенных 23 года спустя. В начале 1990-х количество убийств и насильственных преступлений достигло рекордно высокого уровня, и конца этому не видно. Однако к концу 1990-х годов количество насильственных преступлений по стране сократилось на 40%. Было предложено множество гипотез этого быстрого снижения, в том числе увеличение числа заключенных и увеличение числа сотрудников полиции.Однако уровни свинца в крови демонстрируют очень сильную корреляцию с частотой насильственных преступлений с запаздыванием примерно в 20 лет. Кроме того, исследования на животных, включая хомяков и кошек, показали, что воздействие свинца усиливает или потенцирует агрессивное поведение. Кроме того, данные, собранные Риком Невином из других стран (Франция, Западная Германия, Италия и Австралия), которые имеют разные показатели содержания под стражей и полиции, показывают аналогичные тенденции в насильственных преступлениях с уровнями свинца в крови детей.Таким образом, есть убедительные доказательства того, что повышенное воздействие свинца в детстве в результате использования этилированного бензина объясняет, по крайней мере частично, рост уровня насильственных преступлений в 1980-х и начале 1990-х годов в Соединенных Штатах. Несмотря на то, что за последние 40-50 лет использование свинца резко сократилось, свинец все еще можно обнаружить в повышенных количествах в почве, особенно в городских и промышленных районах.Кроме того, ранее свинец использовался для строительства водопроводных труб, так как он прочен и податлив. Свинец больше не используется для строительства труб, но в более старых городах, таких как Флинт, все еще есть свинцовые трубы, а также медные и железные водопроводные трубы, в которых использовалась свинцовая пайка в стыках и соединениях труб. В апреле 2014 года это стало серьезной проблемой для жителей города Флинт, штат Мичиган. Город Флинт, штат Мичиган, столкнулся с серьезными финансовыми проблемами и, пытаясь сэкономить деньги, решил построить новый водопровод от озера Гурон для подачи питьевой воды в этот район.По оценкам, экономия затрат составит около 10 миллионов долларов в год. Однако строительство газопровода займет несколько лет. Таким образом, чтобы сразу сэкономить деньги, город Флинт решил временно переключить городскую воду на реку Флинт, пока заканчивался новый трубопровод. Тем не менее, речную воду труднее обрабатывать из-за больших колебаний количества остатков стока, и почти сразу же жители Флинта, штат Мичиган, начали жаловаться на неприятный запах и бесцветную воду, текущую из их кранов (рис.7.17). Рисунок 7.17. ЛиЭнн Уолтерс демонстрирует образцы водопроводной воды на публичном собрании в январе 2015 года. Источник: Ladapo, J.A, et. др. (2017). Анализ воды первоначально показал высокий уровень фекальных колиформных бактерий, что заставило Флинта, штат Мичиган, выпустить рекомендации по кипячению и увеличить количество хлора, используемого для обработки воды. Это, в свою очередь, увеличило производство тригалометанов. Тригалометаны образуются во время реакции дезинфицирующих средств на основе хлора в воде с присутствующими органическими материалами, такими как водоросли, присутствующие в реке Флинт.Тригалометаны связаны со многими проблемами со здоровьем, включая проблемы с печенью, почками и легкими, а также создают неприятный запах и вкус воды. Они также опасны при вдыхании, что делает душ в горячей загрязненной воде серьезным риском для здоровья. Таким образом, пытаясь уменьшить образование побочных продуктов тригалометана, город Флинт начал добавлять в воду больше FeCl 3 , чтобы помочь удалить дополнительные органические материалы из этого источника воды.Однако им не удалось добавить какие-либо антикоррозионные молекулы, такие как ортофосфат. Многие водоочистные сооружения используют низкие концентрации ортофосфатов для взаимодействия со свинцом в трубах и образования нерастворимой футеровки из фосфата свинца, которая не просачивается в систему водоснабжения (рис. 7.18). Отсутствие контроля коррозии со стороны города Флинт в сочетании с повышенным содержанием FeCl 3 привело к резкому увеличению количества присутствующих ионов Cl – . Результатом было общее увеличение коррозионного потенциала, измеренного по массовому отношению хлорида к сульфату, от 0.45 для Детройтского водоснабжения до 1,60 для нового водоснабжения Флинт-Ривер. При таком коррозионном потенциале молекулы кислорода в воде начали окисляться и выделять растворимые формы свинца в водную систему (рис. 7.18). В дополнение к окисленным побочным продуктам свинца также выделялись окисленные формы железа, вызывающие большее обесцвечивание воды. Рис. 7.18 Процесс коррозии во Флинте, штат Мичиган, водный кризис. Чтобы посмотреть интерактивную анимацию этого химического процесса, посмотрите этот Видео Scientific American – Коррозионная химия: как свинец попал в питьевую воду Флинта Из-за общественного протеста и отказа города Флинт принимать меры по поводу плохого качества воды Технологический институт Вирджинии начал программу тестирования воды и обнаружил чрезвычайно высокие уровни содержания свинца во многих домах во Флинте, штат Мичиган.CDC заявляет, что не существует безопасных уровней свинца, которые можно потреблять, а стандарты EPA ограничивают содержание свинца в питьевой воде до 15 частей на миллиард. Самая высокая проба, зарегистрированная Технологическим институтом Вирджинии, составила 13 000 частей на миллиард из пробы в доме ЛиЭнн Уолтерс (рис. 7.17). Город Флинт вернулся к использованию системы водоснабжения Детройта в октябре 2015 года. Однако риск воздействия свинца на детей в этом районе, превышающий допустимый уровень в крови CDC, за этот период удвоился (рис. 7.19). В настоящее время ведется несколько ожидающих рассмотрения судебных исков из-за халатности властей города Флинт и органов, регулирующих качество воды в регионе. Рисунок 7.19. Сравнение уровней свинца в крови во Флинте, штат Мичиган, до и после перехода на источник воды реки Флинт. Верхняя диаграмма показывает, что качество воды в 1 из 6 домов во Флинте, штат Мичиган, после перехода на источник воды из реки Флинт превысило пределы безопасности EPA. На нижней панели показаны уровни содержания свинца в крови детей, регулярно проверяемых на содержание свинца в этом районе как до, так и после перехода на новый источник воды. Источник: Исследование Flint Water Study Предлагаемое задание: Учителя могут загрузить задание на основе обсуждения на тему «Несправедливость в отношении окружающей среды и влияние загрязнения воды токсичными веществами» во Флинте, штат Мичиган, Задание экологической справедливости Flint Water Crisis Чтобы убедиться, что вы понимаете материал этой главы, вам следует просмотреть значения выделенных жирным шрифтом терминов в следующем резюме и спросить себя, как они связаны с темами этой главы. Раствор представляет собой гомогенную смесь. Основным компонентом является растворитель , а второстепенным компонентом является растворенное вещество . Решения могут иметь любую фазу; например, сплав представляет собой твердый раствор.Растворенные вещества бывают растворимыми или нерастворимыми , что означает, что они растворяются или не растворяются в определенном растворителе. Термины смешивающийся и несмешивающийся вместо растворимых и нерастворимых используются для жидких растворенных веществ и растворителей. Утверждение подобно растворению подобно является полезным руководством для предсказания того, растворится ли растворенное вещество в данном растворителе. Растворение происходит путем сольватации , процесса, при котором частицы растворителя окружают отдельные частицы растворенного вещества, разделяя их и образуя раствор.Для водных растворов используется слово гидратация . Если растворенное вещество молекулярное, оно распадается на отдельные молекулы. Если растворенное вещество является ионным, отдельные ионы отделяются друг от друга, образуя раствор, проводящий электричество. Такие растворы называются электролитами . Если диссоциация ионов завершена, раствор представляет собой сильный электролит . Если диссоциация только частичная, раствор представляет собой слабый электролит . Растворы молекул не проводят электричество и называются неэлектролитами . Количество растворенного вещества в растворе представлено концентрацией раствора. Максимальное количество растворенного вещества, которое растворяется в данном количестве растворителя, называется растворимостью растворенного вещества. Такие растворы насыщены . Растворы, количество которых меньше максимального, являются ненасыщенными . Большинство растворов ненасыщенные, и существуют различные способы определения их концентрации. Масса/массовые проценты , объемные/объемные проценты и массовые/объемные проценты указывают процентное содержание растворенного вещества в общем растворе. частей на миллион (ppm) и частей на миллиард (ppb) используются для описания очень малых концентраций растворенного вещества. Молярность , определяемая как количество молей растворенного вещества на литр раствора, является общепринятой единицей концентрации в химической лаборатории. Эквиваленты выражают концентрации в виде молей заряда ионов. Когда раствор разбавлен, мы используем тот факт, что количество растворенного вещества остается постоянным, чтобы иметь возможность определить объем или концентрацию конечного разбавленного раствора.Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора ( исходного раствора ) до желаемого конечного объема. Какое из изображений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы. Na 2 SO 4 Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы. Ожидаете ли вы, что 1,0 М раствор CaCl 2 будет лучшим проводником электричества, чем 1,0 М раствор NaCl? Почему или почему нет? Альтернативным способом определения концентрации раствора является моляльность , сокращенно m .Моляльность определяется как число молей растворенного вещества в 1 кг растворителя . Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ. Каковы преимущества использования растворов для количественных расчетов? а) Nh4 является слабым основанием, а это означает, что некоторые молекулы будут принимать протон от молекул воды, вызывая их диссоциацию на ионы H+ и -OH.Ион H+ связывается с Nh4, образуя Nh5+. Таким образом, это будет больше всего похоже на стакан № 2. б) HF — слабая кислота, хотя F сильно электроотрицательна. Это связано с тем, что молекула HF может образовывать прочные водородные связи с молекулами воды и оставаться в ковалентной связи, которую труднее диссоциировать. Таким образом, стакан № 2 также является хорошим выбором для этой молекулы, так как только часть H-F будет диссоциировать на ионы h4O+ и F-. c) CH 3 CH 2 CH 2 OH представляет собой ковалентное соединение и не будет диссоциировать в какой-либо заметной степени, поэтому стакан № 3 является правильным выбором.d) Na 2 SO 4 является растворимым ионным соединением и будет полностью диссоциировать на ионы, наиболее похожие на химический стакан № 1. Да, потому что когда CaCl 2 диссоциирует, он образует 3 иона (1 Ca 2+ и 2 иона Cl – ), тогда как NaCl диссоциирует только на 2 иона (Na + и Cl – ) для каждой молекулы. Таким образом, CaCl 2 будет генерировать больше ионов на моль, чем 1 моль NaCl, и будет лучшим проводником электричества. Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества точнее. Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора. Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора. Если все растворы содержат одно и то же растворенное вещество, то в каком растворе масса растворенного вещества больше? Заполните следующую таблицу для 500 мл раствора. Какова концентрация каждого вида в следующих водных растворах? Какова концентрация каждого вида в следующих водных растворах? Какова молярная концентрация каждого раствора? Какова молярная концентрация каждого раствора? Укажите концентрацию каждого реагента в следующих уравнениях, предполагая, что 20,0 г каждого реагента и объем раствора 250 мл для каждого реагента. Для эксперимента требуется 200.0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г/см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 , используя исходный раствор. Гипохлорит кальция [Ca(OCl) 2 ] является эффективным дезинфицирующим средством для одежды и постельных принадлежностей. Если раствор имеет концентрацию Ca(OCl) 2 3.4 г на 100 мл раствора, какова молярность гипохлорита? Фенол (C 6 H 5 OH) часто используется в качестве антисептика в ополаскивателях для рта и леденцах от горла. Если жидкость для полоскания рта имеет концентрацию фенола 1,5 г на 100 мл раствора, какова молярность фенола? Если таблетку, содержащую 100 мг кофеина (C 8 H 10 N 4 O 2 ), растворить в воде, чтобы получить 10,0 унций раствора, какова молярная концентрация кофеина в растворе? На этикетке некоторых лекарств есть инструкции добавить 10.0 мл стерильной воды с указанием, что в каждом миллилитре полученного раствора будет содержаться 0,500 г лекарства. Если больному назначена доза 900,0 мг, сколько миллилитров раствора следует ввести? а. 39,13 г б. 161,0 г в. 93,57 г d. 201,8 г а. 1,40 л 0,334 М раствора, б. 25,0 мл 0,134 М раствора, в. 150 мл 0,769 М раствора а.0,815 М, б. 2,09 м, гр. 0,182 м, д. 0,684 М а. 0,174 М, б. 0,297 М, с. 0,048 М, д. 0,135 М а. BaCl 2 = 0,384 М, Na 2 SO 4 = 0,563 М, б. Ca(OH) 2 = 1,08 М, h4PO4 = 0,816 М, с. Al(NO 3 ) 3 = 0,376 M, H 2 SO 4 = 0,816 M, d. Pb(NO 3 ) 2 = 0,242 М, CuSO 4 = 0,501 М, э. Al(CH 3 CO 2 ) = 0.392 М, NaOH = 2,00 М 1,74 × 10 −3 М кофеин Примечание по технике безопасности. Используйте безопасные для пищевых продуктов чашки и ложки, которые не использовались с лабораторными химикатами или биологическими веществами. Рабочий лист Таблица 2.4. Таблица данных для концентрации и разбавления Вопросы для занятия: Изучение нашей жидкой Земли, продукт Группы исследований и разработок учебных программ (CRDG) Педагогического колледжа.Гавайский университет, 2011 г. Этот документ можно свободно воспроизводить и распространять в некоммерческих образовательных целях. Задание на формирующую оценку растворов и концентрации (FA) предлагает учащимся выяснить, что означает концентрация, сравнивая три приготовленных ими раствора. Этот FA нацелен на отношения структура-свойства, потому что он предназначен для изучения мышления учащихся о том, что заставляет решения вести себя по-разному.FA фокусируется на процессе растворения и значении концентрации. В задании FA учащиеся используют лист «Решения и концентрации», чтобы направлять свою деятельность. Сначала их просят нарисовать и объяснить, что происходит, когда CuSO 4 растворяется в воде. Затем им дают три комбинации количеств CuSO 4 и воды и просят предсказать, какое из них будет наиболее концентрированным, и как они могут это определить. После этого они делают решения и сравнивают со своими прогнозами.Наконец, они рассматривают два вопроса, которые дополнительно исследуют их размышления о концентрации: как определить, какой раствор является наиболее концентрированным, если соль смешать с водой вместо CuSO 4 , и как они могут приготовить раствор с той же концентрацией наиболее концентрированного раствора. CuSO 4 раствор, если указано другое количество CuSO 4 . Это задание FA было протестировано с участием школьников-химиков, которые учились в 11-м и 12-м классах. В классе, в котором его тестировали, учащиеся недавно закончили подраздел, в котором изучали родинки.Ранее в этом году студенты также изучали молекулярную структуру воды и немного о кристаллической структуре ионных твердых тел. Кроме того, класс немного рассказал о том, почему водные растворы проводят электричество, когда в них растворены ионные соединения, и провели лабораторные испытания растворов на проводимость. Этот FA был расположен как раз перед тем, как класс начал раздел о растворах и концентрациях по отношению к химическим величинам. После просмотра студенческой работы с другим коллегой я решил внести некоторые изменения в FA, чтобы облегчить процесс объяснения студентами их мыслей. Во-первых, я решил разъяснить, что хочу, чтобы учащиеся рисовали микроскопический вид раствора. Хотя я явно ожидал этого, это было неясно из указаний, и студенты набросали макроскопический вид решения. Во-вторых, я решил изменить вопрос 2, попросив учащихся указать правило формулы, которое поможет им в их прогнозировании. Таким образом, я надеюсь, что они начнут думать о концепции соотношения как индикаторе концентрации.Кроме того, поскольку большинство ответов на вопрос 2 были расплывчатыми и неконкретными, я надеюсь, что, используя термин формула/правило, учащиеся будут более сосредоточены в своем мышлении. Наконец, я перенес вопрос о соли (бесцветный раствор) в конец, чтобы он не отвлекал внимание учащихся от созданных ими растворов и давал понять, что речь сейчас идет о другом случае. Вопрос 1. В этом упражнении вы создадите три раствора, растворив CuSO 4 (синее вещество в воде). Как вы думаете, что происходит, когда твердое вещество растворяется в воде? Используйте как предложения, так и набросок. Он будет рассеиваться и смешиваться с водой, а ионы будут распространяться, чтобы он мог проводить ток. Я думаю, что при их смешивании вода станет синей и CuSO 4 растворится. Поскольку Cu — неметалл, а SO — металл, это показывает, что он ионный, что означает, что он растворяется. Вопрос 2: В первом растворе вы растворите 1 г CuSO 4 в 100 мл воды. Во втором растворе вы растворите 2 г в 200 мл воды. А в третьем растворе 1 г растворите в 50 мл воды. Как вы думаете, какой из них будет более концентрированным? Вопрос 3: Теперь сделайте три решения. Какой из них более концентрированный, а какой наименее? Как вы можете сказать? Вопрос 4. Теперь предположим, что у вас есть два раствора соли (вода плюс соль), поскольку солевой раствор не имеет цвета, как определить, какой из них более концентрированный? 2 г → 50, потому что цвет темнее, что делает его более концентрированным, потому что в нем меньше воды и больше граммов. Вопрос 5: Если я дам вам 5 граммов CuSO 4 сколько воды вам понадобится для приготовления раствора с той же концентрацией, что и самая концентрированная из вышеперечисленных? Объясните свое мышление. В этом упражнении учащиеся начинают со сравнения концентраций нескольких растворов и размышляют о своем текущем уровне понимания.Затем они работают в парах, используя карточки, чтобы связать массу растворенного вещества, объем воды и концентрацию раствора, изучая процесс расчета концентрации. План урока включает дополнительное задание, дающее учащимся дополнительную практику расчета концентрации растворов. Студенты поймут: Дайте каждому учащемуся лист «Объяснение концентраций». Организуйте студентов: Когда пары записали и показали правильные ответы, дайте им набор «Пустые карточки концентрации» и растворенное вещество на выбор: Распространение и поддержка с подсказками во время пар: В качестве дополнения поставьте следующую задачу и проработайте решение на пленарном заседании. Рассчитайте конечные концентрации в моль дм -3 H + , Na + , Cl — и SO 4 2- , когда следующие три раствора смешивают вместе, чтобы получить общий объем 2 дм 3 : Дайте каждому учащемуся лист «Обзор» для заполнения и сдачи. Дайте письменный отзыв, который признает достижения и помогает учащимся осознать свои следующие шаги и то, как их предпринять. Моментальный снимок уверенности учащихся в начале занятия дает учащимся базовый уровень, а также информирует учителя. Написание объяснений того, как выполнять простые расчеты, и структурированное обсуждение их компетентности помогают учащимся осознать свои сильные и слабые стороны. Их обучение закрепляется, когда они задают дополнительное упражнение по сопоставлению карточек для своих сверстников. Окончательный обзор помогает учащимся пройти оценку, которая укрепит их уверенность и поможет им интерпретировать отзывы учителя. Общий объем = 2 дм 3 (т.е. 2000 см 3 ) Предположим, что все соединения являются сильными электролитами и полностью диссоциируют в водном растворе. Окончательный раствор содержит: Следовательно: Первоначально этот план урока был частью веб-сайта Assessment for Learning , опубликованного в 2008 году.
7.10 Окружающая среда: загрязнение свинцом История использования свинца в США
Биологическое действие свинца
7.11 Резюме Ключ на вынос
Концептуальные проблемы
Ответить
Численные задачи
Соединение Масса (г) Кроты Концентрация (М) сульфат кальция 4,86 уксусная кислота 3.62 дигидрат йодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2,42 ответы
(наверх)
7.12 Каталожные номера Деятельность: Концентрация и разбавление | manoa.hawaii.edu/ExploringOurFluidEarth
Упражнение: Концентрация и разбавление | manoa.hawaii.edu/ExploringOurFluidEarth
Подходит для печати Научная и инженерная практика NGSS:
NGSS Crosscutting Concepts:
Основные дисциплинарные идеи NGSS:
Материалы
Процедура
Решения и концентрация | Chemical Education Xchange
Тони Якоби Юстиция Тони Я думаю, что 200 мл воды будут более концентрированными, потому что в ней больше всего воды и соотношение 200 мл и 100 мл воды. Якоби Второй [2 г в 200 мл], потому что в нем меньше воды и больше вещества.Также в других больше воды, но меньше раствора. Юстиция
Так как 1 г равен 100 мл, а 2 г равен 200 мл, для того, чтобы 1 г превратился в 100 мл, необходимо умножить время на 2. Тони 50 мл воды являются наиболее концентрированными из-за соотношения воды. Якоби 50 мл, потому что из всех трех 50 мл темнее. Юстиция 1 г → 50 мл, так как занимает больше места. Тони Вы можете определить, какой из них более концентрированный, измерив воду. Якоби Не думаю, что это что-то изменит, потому что соль не имеет цвета, а с водой она мало что изменит. Правосудие
2 г → 50 (темнее)
1 г → 100 (средний)
1 г → 200 (самый светлый)
Тони Если я получу 5 граммов CuSO 4 , мне понадобятся еще 5 граммов CuSO 4 . Якоби Если у меня есть 5 граммов CuSO 4 тогда мне понадобится около 300 граммов воды. Правосудие Расчет и сравнение концентраций растворов | 16-18 лет | План урока
Цели обучения
Последовательность действий
Введение и демонстрация
Объяснение концентраций
Сопоставление карт: этап 1
Сопоставление карт: этап 2
Расширение деятельности
Проблема
Перед отделкой
Обратная связь
Комментарий
Практические указания
Аппарат
Химикаты
Здоровье, безопасность и технические примечания
Другое оборудование
Ответы
Сопоставление карт
Концентрация Масса NaOH Объем воды 4 г дм -3 NaOH 2 г 0.5 дм 3 0,4 моль дм -3 NaOH 4 г 250 см 3 0,5 моль дм -3 NaOH 40 г 2,0 дм 3 2,5 моль дм -3 Na + ионы 10 г 100 см 3 Расширение деятельности
Дополнительная информация


 Сколько граммов 15%-го раствора взяли?
Сколько граммов 15%-го раствора взяли?

 1.1}\)
1.1}\)
 500\: Л\)
500\: Л\) Эта процедура проиллюстрирована в примере 12.1.2.
Эта процедура проиллюстрирована в примере 12.1.2. 310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 .155\:моль\:глюкоза\)
310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 .155\:моль\:глюкоза\) Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.

 Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М). {2-} (водн.)\tag{12.1.2} \)
{2-} (водн.)\tag{12.1.2} \) Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 М = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 CR 2 O 7 O 7 Производится Три Ионов при растворенном в воде (2NH 4 + + 1Cr 2 O 7 2-), Всего Концентрация ионов в раствор 3 × 1,43 М = 4,29 М,
Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 М = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 CR 2 O 7 O 7 Производится Три Ионов при растворенном в воде (2NH 4 + + 1Cr 2 O 7 2-), Всего Концентрация ионов в раствор 3 × 1,43 М = 4,29 М,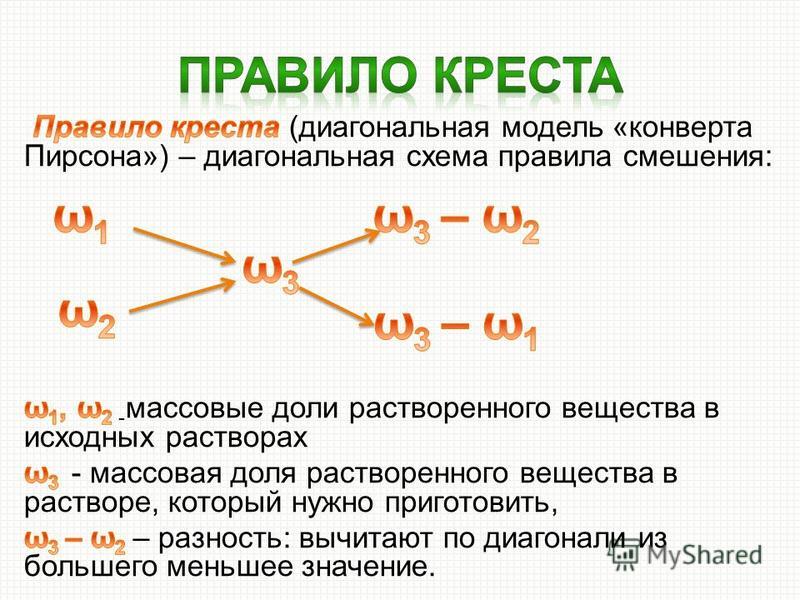 — (водн.) \)
— (водн.) \)


 489 М раствор или 150 мл 0,769 М раствора
489 М раствор или 150 мл 0,769 М раствора 42
42 4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора ) + H 2 SO 4 (водн.) →
) + H 2 SO 4 (водн.) → Если жидкость для полоскания рта имеет концентрацию фенола 1,5 г на 100 мл раствора, какова молярность фенола?
Если жидкость для полоскания рта имеет концентрацию фенола 1,5 г на 100 мл раствора, какова молярность фенола? 74 × 10 −3 М кофеин
74 × 10 −3 М кофеин Твердые вещества, жидкости и газы растворяются в жидком растворителе с образованием жидких растворов. В этой главе большая часть химии, которую мы обсудим, происходит в жидких растворах, где растворителем является вода.
Твердые вещества, жидкости и газы растворяются в жидком растворителе с образованием жидких растворов. В этой главе большая часть химии, которую мы обсудим, происходит в жидких растворах, где растворителем является вода. Мы можем использовать молярную массу для преобразования граммов CoCl 2 · 2H 2 O в моли.
Мы можем использовать молярную массу для преобразования граммов CoCl 2 · 2H 2 O в моли.
 Ион H+ связывается с Nh4, образуя Nh5+. Таким образом, это будет больше всего похоже на стакан № 2. б) HF — слабая кислота, хотя F сильно электроотрицательна. Это связано с тем, что молекула HF может образовывать прочные водородные связи с молекулами воды и оставаться в ковалентной связи, которую труднее диссоциировать. Таким образом, стакан № 2 также является хорошим выбором для этой молекулы, так как только часть H-F будет диссоциировать на ионы h4O+ и F-. c) CH 3 CH 2 CH 2 OH представляет собой ковалентное соединение и не будет диссоциировать в какой-либо заметной степени, поэтому стакан № 3 является правильным выбором.d) Na 2 SO 4 является растворимым ионным соединением и будет полностью диссоциировать на ионы, наиболее похожие на химический стакан № 1.
Ион H+ связывается с Nh4, образуя Nh5+. Таким образом, это будет больше всего похоже на стакан № 2. б) HF — слабая кислота, хотя F сильно электроотрицательна. Это связано с тем, что молекула HF может образовывать прочные водородные связи с молекулами воды и оставаться в ковалентной связи, которую труднее диссоциировать. Таким образом, стакан № 2 также является хорошим выбором для этой молекулы, так как только часть H-F будет диссоциировать на ионы h4O+ и F-. c) CH 3 CH 2 CH 2 OH представляет собой ковалентное соединение и не будет диссоциировать в какой-либо заметной степени, поэтому стакан № 3 является правильным выбором.d) Na 2 SO 4 является растворимым ионным соединением и будет полностью диссоциировать на ионы, наиболее похожие на химический стакан № 1.  Таким образом, CaCl 2 будет генерировать больше ионов на моль, чем 1 моль NaCl, и будет лучшим проводником электричества.
Таким образом, CaCl 2 будет генерировать больше ионов на моль, чем 1 моль NaCl, и будет лучшим проводником электричества. 40 л 0,334 М раствора или 1,10 л 0,420 М раствора
40 л 0,334 М раствора или 1,10 л 0,420 М раствора 045 моль бромида магния в 500 мл раствора
045 моль бромида магния в 500 мл раствора
 Если раствор имеет концентрацию Ca(OCl) 2 3.4 г на 100 мл раствора, какова молярность гипохлорита?
Если раствор имеет концентрацию Ca(OCl) 2 3.4 г на 100 мл раствора, какова молярность гипохлорита? 201,8 г
201,8 г Доступно по адресу: https://chem.libretexts.org/Core/Inorganic_Chemistry/Chemical_Reactions/Chemical_Reactions_1/Solutions
Доступно по адресу: https://chem.libretexts.org/Core/Inorganic_Chemistry/Chemical_Reactions/Chemical_Reactions_1/Solutions html
html
 Для количественной обработки этого типа растворов мы посвятим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, углекислого газа, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря.
Для количественной обработки этого типа растворов мы посвятим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, углекислого газа, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря. Серебро, золото и медь образуют множество различных сплавов с уникальными цветами и внешним видом. Сплавы и другие твердые растворы играют важную роль в мире химии материалов.
Серебро, золото и медь образуют множество различных сплавов с уникальными цветами и внешним видом. Сплавы и другие твердые растворы играют важную роль в мире химии материалов. Мы можем использовать молярную массу для преобразования граммов CoCl 2 · 2H 2 O в моли.
Мы можем использовать молярную массу для преобразования граммов CoCl 2 · 2H 2 O в моли.