Расчеты объемных отношений газов. Тепловой эффект.
Задание №1
В результате реакции, термохимическое уравнение которой
2H2(г) + O2(г) = 2H2O(г) + 484 кДж,
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
РешениеОтвет: 108
Пояснение:
Из уравнения реакции следует, что при образовании 2 моль воды выделяется 484 кДж теплоты. У нас же выделилось 1452 кДж теплоты. Составим пропорцию
2 моль H2O — 484 кДж
x моль H2O — 1452 кДж
Составим уравнение:
2 : x = 484 : 1452
x = 2 ∙ 1452 /484 = 6
т.е. n(H2O) = 6 моль, следовательно:
m(H2O) = n(H2O) ∙ M(H2O) = 6 ∙ 18 = 108 г
Задание №2
При взаимодействии оксида серы (IV) с 5,6 л (н.у.) кислорода в соответствии с уравнением
2SO2(г) + O2(г) = 2SO3(г) + Q
выделилось 19 кДж теплоты. Определите тепловой эффект реакции. (Запишите число с точностью до целых.)
РешениеОтвет: 76
Пояснение:
Рассчитаем количество вещества кислорода:
n(O2) = 5,6/22,4 = 0,25 моль
Т.е. при взаимодействии 0,25 моль кислорода с оксидом серы (IV) выделяется 19 кДж теплоты. Из представленного в условии термохимического уравнения следует, что при взаимодействии 1 моль кислорода с оксидом серы выделяется количество теплоты равное Q (тепловой эффект реакции). Тогда справедлива пропорция:
0,25 моль кислорода — 19 кДж
1 моль кислорода — Q
Исходя из этой пропорции:
0,25 ∙ Q = 1 ∙ 19
Q = 76 кДж
Таким образом, тепловой эффект реакции составляет 76 кДж.
Задание №3
В соответствии с термохимическим уравнением реакции
C(графит) + O2(газ) = CO2(газ) + 393 кДж
выделилось 786 кДж теплоты. Какой объем (н.у.) углекислого газа при этом образовался? (Запишите число с точностью до десятых.)
РешениеОтвет: 44,8
Пояснение:
В соответствии с термохимическим уравнением реакции при образовании 1 моль углекислого газа выделяется 393 кДж теплоты. В нашем же случае вместо этого выделилось 786 кДж теплоты. Обозначив искомое количество вещества углекислого газа равным х моль, можно записать пропорцию:
1 моль CO2 — 393 кДж теплоты
x моль CO2 — 786 кДж теплоты
Следовательно, справедливо уравнение:
1 ∙ 786 = 393 ∙ x
Решая которое получаем:
x = 2
Т.е. количество вещества углекислого газа при образовании которого выделяется 786 кДж теплоты составляет 2 моль.
Рассчитаем объем такого количества углекислого газа при н.у.:
V(CO2) = 2 моль ∙ 22,4 л/моль = 44,8 л
Задание №4
В соответствии с термохимическим уравнением реакции
CH4(газ) + 2O2(газ) = CO2(газ) + 2H2O(г) + 802 кДж
выделилось 2406 кДж теплоты. Определите объем (н.у.) израсходованного кислорода в литрах. (Запишите число с точностью до десятых.)
РешениеОтвет: 134,4
Пояснение:
Согласно термохимическому уравнению при участии в реакции горения метана 2 моль кислорода выделяется 802 кДж теплоты. В нашем же случае выделяется количество теплоты равное 2406 кДж. Обозначив количество вещества кислорода необходимое для выделения 2406 кДж теплоты через х моль мы можем записать следующую пропорцию:
2 моль O2 — 802 кДж теплоты
x моль O2 — 2406 кДж теплоты
Тогда, справедливо следующее уравнение:
2 ∙ 2406 = 802 ∙ x
Решая которое находим ,что:
x = 6
Таким образом, количество вещества кислорода равно 6 моль. Рассчитаем его объем:
V(O2) = 6 ∙ 22,4 = 134,4 л.
Задание №5
Вычислите количество теплоты, которое потребуется для получения 25 г железа согласно уравнению реакции
Fe2O3(тв.) + 3CO(г) = 2Fe(тв.) + 3CO2(г) — 27 кДж
(Запишите число с точностью до целых.)
РешениеОтвет: 6
Пояснение:
Рассчитаем количество вещества железа:
n(Fe) = m(Fe)/M(Fe) = 25/56 = 0,4464 моль,
Согласно термохимическому уравнению при образовании 2 моль металлического железа поглощается 27 кДж теплоты. Пусть количество поглощаемой в результате образования 0,4464 моль железа равно х кДж. Тогда можно записать пропорцию:
2 моль Fe — 27 кДж
0,4464 моль Fe — x кДж
Следовательно, справедливо уравнение:
2 ∙ x = 0,4464 ∙ 27
x = 6
Таким образом, количество теплоты, которое необходимо для получения 25 г железа равно 6 кДж.
Задание №6
Вычислите объем сгоревшего согласно уравнению реакции
2C2H2(г) + 5O2(г) = 4CO2(г) + 2H2O(ж) + 2700 кДж
ацетилена, если при этом выделилось 67,5 кДж теплоты. (Запишите число с точностью до сотых.)
РешениеОтвет: 1,12
Пояснение:
Согласно термохимическому уравнению при сгорании 2 моль ацетилена выделяется 2700 кДж теплоты. В нашем же случае выделилось 67,5 кДж. Пусть, количество вещества ацетилена, которое сгорело при этом равно х моль. Таким образом можно записать пропорцию:
2 моль C2H2 — 2700 кДж
x моль — 67,5 кДж
2 ∙ 67,5 = 2700 ∙ x
x = 0,05
Таким образом, количество вещества ацетилена равно 0,05 моль. Рассчитаем его объем:
V(C2H2) = 0,05 моль ∙ 22,4 л/моль = 1,12 л
Задание №7
В результате реакции, термохимическое уравнение которой
C6H12O6(тв.) + 6O2(г) = 6CO2(г) + 6H2O(г) + 2800 кДж
выделилось 280 кДж теплоты. Вычислите массу глюкозы, которая окислилась в результате этой реакции. (Запишите число с точностью до целых.)
РешениеОтвет: 18
Пояснение:
Согласно термохимическому уравнению при окислении 1 моль глюкозы выделяется 2800 кДж теплоты. В нашем же случае выделилось 280 кДж теплоты. Пусть количество глюкозы, которое окислилось при этом равно x моль. Тогда можно записать следующую пропорцию:
1 моль глюкозы – 2800 кДж теплоты
x моль глюкозы – 280 кДж теплоты
Следовательно, справедливо уравнение:
1 ∙ 280 = 2800 ∙ x
Решая которое находим, что:
x = 0,1 моль, т.е. количество глюкозы составляет 0,1 моль. Рассчитаем ее массу:
m(C6H12O6) = M(C6H12O6) ∙ n(C6H12O6) = 0,1 моль ∙ 180 г/моль = 18 г.
Задание №8
Какое количество вещества аммиака вступает в реакцию в соответствии с термохимическим уравнением
4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(г) + 1268 кДж,
если в результате реакции выделилось 634 кДж теплоты? (Запишите число с точностью до целых.)
РешениеОтвет: 2
Пояснение:
Согласно термохимическому уравнению при окислении 4 моль аммиака выделяется 1268 кДж теплоты. В нашем же случае выделилось 634 кДж теплоты. Обозначим количество вещества аммиака, которое при этом окислилось как x моль. Тогда можно записать пропорцию:
4 моль аммиака – 1268 кДж
x моль аммиака – 634 кДж
Следовательно, справедливо уравнение:
4 ∙ 634 = 1268 ∙ x
Решая которое находим, что:
x = 2, т.е. количество вещества аммиака составляет 2 моль.
Задание №9
В соответствии с термохимическим уравнением реакции
C6H12O6(тв.) + 6O2(г) = 6CO2(г) + 6H2O(г) + 2800 кДж
получено 1400 кДж теплоты. Какая масса (в граммах) глюкозы при этом окислилась? (Запишите число с точностью до целых.)
РешениеОтвет: 90
Пояснение:
Согласно термохимическому уравнению при окислении 1 моль глюкозы выделяется 2800 кДж теплоты. В нашем же случае выделилось 1400 кДж теплоты. Пусть количество глюкозы, которое окислилось при этом равно x моль. Тогда можно записать следующую пропорцию:
1 моль глюкозы – 2800 кДж теплоты
x моль глюкозы – 1400 кДж теплоты
Следовательно, справедливо уравнение:
1 ∙ 1400 = 2800 ∙ x
x = 0,5, т.е. количество вещества глюкозы для получения 1400 кДж тепла составляет 0,5 моль. Рассчитаем ее массу:
m(C6H12O6) = M(C6H12O6) ∙ n(C6H12O6) = 0,5 моль ∙ 180 г/моль = 90 г.
Задание №10
В соответствии с термохимическим уравнением реакции
2Mg(тв.) + O2(г) = 2MgO(тв.) + 1200 кДж
выделилось 240 кДж теплоты. Определите массу полученного оксида магния. (Запишите число в точностью до целых.)
РешениеОтвет: 16
Пояснение:
Согласно термохимическому уравнению при образовании 2 моль оксида магния выделяется 1200 кДж теплоты. В нашем же случае выделилось 240 кДж теплоты. Пусть количество оксида магния, образовавшегося при этом равно x моль. Тогда можно записать пропорцию:
2 моль MgO – 1200 кДж
x моль MgO – 240 кДж
Следовательно, справедливо уравнение:
2 ∙ 240 = 1200 ∙ x
Решая которое находим, что:
x = 0,4, т.е. при выделении 240 кДж теплоты количество вещества образовавшегося оксида магния составляет 0,4 моль. Тогда его масса равна:
m(MgO) = n(MgO) ∙ M(MgO) = 0,4 ∙ 40 = 16 г
Задание №11
В ходе реакции, термохимическое уравнение которой
CaCO3(тв.) = CaO(тв.) + CO2(г) -180 кДж,
было затрачено 450 кДж теплоты. Определите объем (н.у.) получившегося при этом газа. (Запишите число с точностью до целых.)
РешениеОтвет: 56
Пояснение:
Выделившийся газ – CO2.
В соответствии с термохимическим уравнением при образовании одного моля CO2 поглощается 180 кДж теплоты. В нашем же случае поглощено 450 кДж теплоты. Обозначив количество вещества углекислого газа, образовавшегося при этом как x моль, можно записать следующую пропорцию:
1 моль CO2 – 180 кДж
x моль CO2 – 450 кДж
Следовательно, справедливо уравнение:
1 ∙ 450 = 180 ∙ x
x = 2,5, т.е. количество вещества углекислого газа составляет 2,5 моль. Рассчитаем его объем:
V(CO2) = Vm ∙ n(CO2) = 22,4 ∙ 2,5 = 56 л
Задание №12
В соответствии с термохимическим уравнением реакции
3Fe3O4(тв.) + 8Al(тв.) = 9Fe(тв.) + 4Al2O3(тв.) + 3330 кДж
образовалось 168 г железа. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.)
РешениеОтвет: 1110
Пояснение:
Рассчитаем количество вещества железа с массой 168 г:
n(Fe) = m(Fe)/M(Fe) = 168/56 = 3 моль,
В соответствии с термохимическим уравнением реакции при образовании 9 моль металлического железа выделяется 3330 кДж. В нашем же случае образуется 3 моль железа. Обозначив количество теплоты выделившейся при этом как x кДж можно составить пропорцию:
9 моль Fe — 3330 кДж
3 моль Fe — x кДж
тогда справедливо уравнение:
9 ∙ x = 3 ∙ 3330
x = 1110
Таким образом, количество теплоты выделяющееся при образовании 168 г металлического железа составляет 1110 кДж.
Задание №13
Определите количество теплоты, которое выделится при взаимодействии 280 г негашеной извести с водой в соответствии с термохимическим уравнением реакции
CaO(тв.) + H2O(ж) = Ca(OH)2(тв.) + 64,8 кДж.
(Запишите число с точностью до целых.)
РешениеОтвет: 324
Пояснение:
Негашеная известь — тривиальное название оксида кальция CaO. Рассчитаем его количество вещества, зная массу:
n(CaO) = 280 г/ 56 г/моль = 5 моль,
В соответствии с термохимическим уравнением реакции при взаимодействии с водой 1 моль CaO выделяется количество теплоты равное 64,8 кДж. В нашем же случае в реакции принимает участие 5 моль оксида кальция, в связи с чем мы можем записать следующую пропорцию:
1 моль CaO — 64,8 кДж
5 моль CaO — x кДж
Следовательно, справедливо уравнение:
1 ∙ x = 5 ∙ 64,8
Решая которое находим, что:
x = 324 кДж
Таким образом, количество теплоты, которое выделится при взаимодействии 280 г негашеной извести водой составляет 324 кДж.
Задание №14
В результате реакции, термохимическое уравнение которой
4FeS2(тв.) + 11O2(г) = 8SO2(г) + 2Fe2O3(тв.) + 3310 кДж
выделилось 6620 кДж теплоты. Определите массу образовавшегося оксида железа (III). (Запишите число с точностью до целых.)
РешениеОтвет: 640
Пояснение:
В соответствии с термохимическим уравнением реакции при образовании 2 моль Fe2O3 выделяется 3310 кДж теплоты. В нашем же случае, выделилось 6620 кДж теплоты. Пусть количество вещества Fe2O3, образовавшегося при этом составляет x моль. Тогда можно записать следующую пропорцию:
2 моль Fe2O3 — 3310 кДж
x моль Fe2O3 — 6620 кДж
Следовательно, справедливо уравнение:
2 ∙ 6620 = x ∙ 3310
Решая которое находим, что:
x = 4
Таким образом, количество вещества Fe2O3 образовавшееся при этом составляет 4 моль. Следовательно масса образовавшегося Fe2O3 составляет:
m(Fe2O3) = M(Fe2O3) ∙ n(Fe2O3) = 160 ∙ 4 = 640 г
Задание №15
При образовании 560 мл (н.у.) газообразного аммиака в соответствии с уравнением
N2(г) + 3H2(г) = 2NH3(г) + Q
выделилось 1,15 кДж теплоты. Чему равен тепловой эффект этой реакции? (Запишите число с точностью до целых.)
РешениеОтвет: 92
Пояснение:
Посчитаем какое количество вещества содержится в 560 мл газообразного аммиака. Прежде всего переведем его объем из мл в л:
560 мл = 0,56 л.
Теперь, зная, что 1 моль любого газа при н.у. занимает объем равный 22,4 л, можно рассчитать количество вещества аммиака:
n(NH3) = V(NH3)/Vm = 0,56 л / 22,4 л/моль = 0,025 моль,
Из условия задания следует, что при образовании 0,025 моль (0,56 л) аммиака выделилось 1,15 кДж теплоты. В термохимическом же уравнении реакции фигурирует количество вещества аммиака равное 2 моль (коэффициент 2 перед NH3) и при этом выделяется количество тепла, равное Q (тепловой эффект реакции). Таким образом, мы можем записать следующую пропорцию:
0,025 моль — 1,15 кДж
2 моль — Q
Следовательно справедливо уравнение:
0,025 ∙ Q = 2 ∙ 1,15 кДж
Решая которое находим, что:
Q = 92 кДж
Т.е. тепловой эффект реакции равен 92 кДж.
Задание №16
В соответствии с термохимическим уравнением реакции
3Fe3O4(тв.) + 8Al(тв.) = 9Fe(тв.) + 4Al2O3(тв.) + 3330 кДж
восстановили 464 г железной окалины. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.)
РешениеОтвет: 2220
Пояснение:
Рассчитаем количество вещества железной окалины массой 464 г:
n(Fe3O4) = m(Fe3O4)/M(Fe3O4) = 464/232 = 2 моль,
В соответствии с термохимическим уравнением реакции при восстановлении 3 моль Fe3O4 выделяется 3330 кДж теплоты. Пусть при восстановлении 2 моль Fe3O4 выделяется x кДж теплоты. Тогда можно составить следующую пропорцию:
3 моль Fe3O4 — 3330 кДж
2 моль Fe3O4 — x кДж
Следовательно, справедливо уравнение:
3 ∙ x = 2 ∙ 3330
Решая которое, получаем, что:
x = 2220
Таким образом, количество теплоты, выделившейся при восстановлении 464 г железной окалины составляет 2220 кДж.
Задание №17
В соответствии с термохимическим уравнением реакции
CH4(г) + 2O2(г) = CO2(г) + 2H2O(г) + 802 кДж,
выделилось 2406 кДж теплоты. Определите объем (н.у.) израсходованного кислорода. (Запишите число с точностью до десятых.)
РешениеОтвет: 134,4
Пояснение:
В соответствии с термохимическим уравнением реакции при реакции с метаном 2 моль кислорода выделяется 802 кДж. В нашем же случае выделилось 2406 кДж теплоты. Пусть количество вещества израсходованного при этом кислорода составляет x моль. Тогда можно записать пропорцию:
2 моль O2 – 802 кДж
x моль O2 – 2406 кДж
Следовательно, справедливо уравнение:
2 ∙ 2406 = 802 ∙ x
x = 6
Т.е. количество вещества кислорода составляет 6 моль. Найдем его объем:
V(O2) = Vm ∙ n(O2) = 22,4 ∙ 6 = 134,4 л.
Задание №18
В соответствии с термохимическим уравнением реакции
C(тв.) + O2(газ) = CO2(газ) + 393 кДж
получено 422,2 кДж теплоты. Какой объем (н.у.) кислорода при этом израсходован? (Запишите число с точностью до целых.)
РешениеОтвет: 24
Пояснение:
В соответствии с термохимическим уравнением при израсходовании на горение угля 1 моля кислорода выделяется 393 кДж теплоты. В нашем же случае выделяется 422,2 кДж. Пусть при выделении такого количества теплоты расходуется x моль кислорода. Тогда, мы можем записать пропорцию:
1 моль O2 – 393 кДж
x моль O2 – 422,2 кДж
Следовательно, справедливо уравнение:
1 ∙ 422,2 = 393 ∙ x
Решая которое находим, что:
x = 1,0743
т.е. количество вещества израсходованного кислорода составляет 1,0743 моль. Рассчитаем его объем:
V(O2) = Vm ∙ n(O2) = 22,4 ∙ 1,0743 ≈ 24 л
Задание №19
Какой объем (н.у.) кислорода потребуется для получения 5600 кДж теплоты в соответствии с термохимическим уравнением реакции
C6H12O6(тв.) + 6O2(г) = 6CO2(г) + 6H2O(г) + 2800 кДж?
(Запишите число с точностью до десятых.)
РешениеОтвет: 268,8
Пояснение:
Исходя из термохимического уравнения:
6 моль O2 — 2800 кДж теплоты
В нашем же случае должно выделиться 5600 кДж. Пусть количество вещества кислорода необходимое для выделения такого количества тепла составляет x моль. Тогда справедлива пропорция:
6 моль O2 — 2800 кДж теплоты
x моль O2 — 5600 кДж теплоты
Следовательно, верным является уравнение:
6 ∙ 5600 = 2800 ∙ x
x = 12
Таким образом, количество вещества кислорода, которое должно принять участие в окислении глюкозы для выделения 5600 кДж теплоты, составляет 12 моль. Рассчитаем объем такого количества кислорода при н.у.:
V(O2) = Vm ∙ n(O2) = 22,4 ∙ 12 = 268,8 л
Задание №20
При сжигании ацетилена в соответствии с термохимическим уравнением реакции
2C2H2(г) + 5O2(г) = 4CO2(г) + 2H2O(ж) + 930 кДж
выделилось 186 кДж теплоты. Какой объем (н.у.) кислорода затрачен на сжигание ацетилена? (Запишите число с точностью до десятых.)
РешениеОтвет: 22,4
Пояснение:
Из термохимического уравнения реакции следует, что когда в реакции принимает участие 5 моль O2 выделяется 930 кДж теплоты.
В нашем же случае выделяется 186 кДж теплоты. Пусть количество вещества кислорода, израсходованного при этом, составляет x моль. Тогда мы можем записать следующую пропорцию:
5 моль O2 – 930 кДж
x моль O2 – 186 кДж
Следовательно, справедливо уравнение:
5 ∙ 186 = 930 ∙ x
Решая которое находим, что:
x = 1
Таким образом, количество вещества кислорода составляет 1 моль. Найдем его объем:
V(O2) = n(O2) ∙ Vm = 1 ∙ 22,4 = 22,4 л
Задание №21
В соответствии с термохимическим уравнением реакции
2H2O(ж)+4NO2(г)+O2(г) = 4HNO3(г) + 258 кДж
выделилось 2580 кДж теплоты. Определите количество вещества оксида азота(IV), вступившего в реакцию. (Запишите число с точностью до целых.)
РешениеОтвет: 40
Пояснение:
Из термохимического уравнения реакции следует, что когда в реакции принимает участие 4 моль NO2 выделяется 258 кДж теплоты.
В нашем же случае выделяется 2580 кДж теплоты. Пусть количество вещества оксида азота (IV), прореагировавшего при этом, составляет x моль. Тогда мы можем записать следующую пропорцию:
4 моль NO2 – 258 кДж
x моль NO2 – 2580 кДж
Следовательно, справедливо уравнение:
4 ∙ 2580 = x ∙ 258
Решая которое находим, что:
x = 40
Таким образом, количество вещества оксида азота (IV) составляет 40 моль.
Задание №22
Определите объём газообразного продукта (в литрах), который получается при взаимодействии 1 л водорода с избытком хлора. Объёмы газов измерены при одинаковых условиях. (Запишите число с точностью до целых.)
РешениеОтвет: 2
Пояснение:
Запишем уравнение реакции взаимодействия водорода с хлором:
H2 + Cl2 = 2HCl
Одним из следствий закона Авогадро является то, что объемы прореагировавших и образовавшихся газов относятся друг к другу точно так же, как и коэффициенты перед этими газообразными веществами в уравнении реакции. Для газообразных водорода и хлороводорода, применительно к нашей реакции, мы можем записать что:
V(H2)/V(HCl) = k(H2)/k(HCl), откуда:
V(HCl) = V(H2) ∙ k(HCl)/k(H2) = 1 л ∙ 2/1 = 2 л
Задание №23
Определите количество теплоты, которое выделяется при окислении серы кислородом взятым в объёме 100,8 л (н.у.) в соответствии с термохимическим уравнением реакции
S(тв.) + O2(г) = SO2(г) + 298 кДж.
(Запишите число с точностью до целых.)
РешениеЗадание №24
Определите количество теплоты, которое выделится при обжиге 720 г FeS2 согласно термохимическому уравнению реакции
4FeS2(тв.) + 11O2(г) = 8SO2(г) + 2Fe2O3(тв.) + 3310 кДж.
(Запишите число с точностью до целых.)
РешениеЗадание №25
Вычислите количество выделившейся теплоты, если в реакцию вступает 3,5 моль кислорода в соответствии с термохимическим уравнением реакции
2H2O(ж) + 4NO2(г) + O2(г) = 4HNO3(ж) + 258 кДж.
(Запишите число с точностью до целых.)
РешениеЗадание №26
Какое количество теплоты выделится при взаимодействии 3,6 моль кремния с фтором в соответствии с термохимическим уравнением реакции
Si(тв.) + 2F2(г) = SiF4(г) + 1615 кДж.
(Запишите число с точностью до целых.)
РешениеЗадание №27
В реакцию, термохимическое уравнение которой
MgO(тв.) + CO2(г) → MgCO3(тв.) + 102 кДж,
вступило 88 г углекислого газа. Какое количество теплоты выделится при этом? (Запишите число с точностью до целых.)
РешениеКонспект урока на тему «Тепловой эффект химической реакции»
Тип урока:
Комбинированный урок
Базовый учебники Рудзитис Г.Е., Фельдман Ф.Г. «Химия. Неорганическая химия, учебник для 8 класса общеобразовательной школы» М.: Просвещение, 2011год.
Используемое оборудование:
ноутбук, проектор, экран, сетевой фильтр
Краткое описание:
Содержание урока: Закон сохранения энергии. Превращение энергии в ходе химических реакций. Тепловой эффект химической реакции. Экзо– и эндотермические реакции. Термохимические уравнения. Определение теплового эффекта химической реакции. Цели урока: Обеспечить развитие представлений учащихся о законе сохранения энергии. Организовать деятельность учащихся по применению знаний закона сохранения энергии в разнообразных ситуациях. Актуализировать личностный смысл учащихся к изучению темы, помочь осознать практическую направленность учебного материала. Содействовать развитию у школьников научных методов познания (наблюдение, эксперимент), химически правильной речи. Требования к уровню подготовки учащихся: Знать: * закон сохранения энергии; * термины: тепловой эффект химической реакции, экзотермические и эндотермические реакции, термохимическое уравнение. Понимать: причину появления теплового эффекта химической реакции. Уметь: * определять тип химических реакций по тепловому эффекту; * составлять уравнения реакций; * проводить вычисления теплового эффекта химической реакции. * использовать приобретенные знания и умения в практической деятельности и повседневной жизни для: критической оценки информации о веществах, используемых в быту; Оценивать: * значимость представлений о тепловом эффекте реакции для прогнозирования ее практического осуществления; * экологические последствия протекания экзотермических реакций; Понимать: личную ответственность за качество приобретаемых знаний и умений. Проявлять: * уверенность в личных возможностях, самостоятельность в работе; * способность к самоанализу, самодиагностике. Оборудование:Учебно-электронное пособие «Химия (8-11 классы). Виртуальная лаборатория», «Химия для всех – XXI», «Репетитор по химии Кирилла и Мефодия», компьютер, проектор, экран.
Тема урока: Тепловой эффект химической реакции
Цель урока.
— Обеспечить развитие представлений учащихся о законе сохранения энергии, организовать деятельность учащихся по применению знаний закона сохранения энергии в разнообразных ситуациях.
Задачи урока:
Обучающие. Сформировать понятие об экзо- и эндотермических реакциях, тепловом эффекте химической реакции, термохимическом уравнении.
Развивающие. Развитие логического мышления и умений сравнивать, обобщать, анализировать на примерах реакций горения и термического разложения, обогащение словарного запаса учащихся.
Воспитательные. Воспитание интереса к предмету посредством изучения материала, имеющего теоретическую и практическую значимость, а также занимательный материал. Формирование доброжелательных, толерантных отношений между учителем и учащимися.
Главной задачей является формирование понятий термохимических процессов, подготовка учащихся к решению задач.
Требования к уровню подготовки учащихся:
Знать:
* закон сохранения энергии;
* термины: тепловой эффект химической реакции, экзотермические и эндотермические реакции, термохимическое уравнение.
Понимать: причину появления теплового эффекта химической реакции.
Уметь:
* определять тип химических реакций по тепловому эффекту;
* составлять уравнения реакций;
* проводить вычисления теплового эффекта химической реакции.
* использовать приобретенные знания и умения в практической деятельности и повседневной жизни для критической оценки информации о веществах, используемых в быту;
Оценивать:
* значимость представлений о тепловом эффекте реакции для прогнозирования ее практического осуществления;
Понимать: личную ответственность за качество приобретаемых знаний и умений.
Проявлять:
* уверенность в личных возможностях, самостоятельность в работе;
* способность к самоанализу, самодиагностике.
Оборудование:Учебно-электронное пособие «Химия (8-11 классы). Виртуальная лаборатория»,
«Химия для всех – XXI», «Репетитор по химии Кирилла и Мефодия», компьютер,
проектор, экран.
Эпиграф урока: «Кислород – это вещество, вокруг которого вращается вся земная химия»
Я.Берцелиус
Ход урока.
I. Организационный момент. На уроке мы продолжим изучать тему «Кислород. Горение». Давайте вспомним, что уже вы узнали при изучении этой темы.
II. Актуализация знаний.
На слайде задания:
Из следующего перечня формул веществ выписать только формулы оксидов.
NaCl, Al2O3, HN O3, KOH, P2 O5, CH4, H2SO4, CO2, Cu (OH)2, Cl2O7,
Mg(NO3)2, Na2O, H3PO4/
Определить валентность элементов по формулам оксидов:
N2O, NO, N2O3, NO2, N2O5, SO3
Составить формулы оксидов
магния (II), железа (III), серы (IV), бора (III), хрома (VI).
Продолжить уравнения реакций
а) Zn + O2→
б) Al + O2→
в) H2S + O2→
Решить задачу
Вычислить массу кислорода, прореагировавшего с медью, если образовалось 4г оксида меди (II).
Дается некоторое время на выполнение теста (5-7 минут).
6.Осуществить превращения
H2O→X→CO2
Ребята, проверьте себя! (На следующем слайде правильные ответы).
III. Формирование новых знаний.
Хисматуллина Нармина на дом получила задание, рассчитать содержание кислорода по массе во всех учениках 8-го класса.
Слушаем ее отчет о проделанной работе.
Сокунов Никита определил массу кислорода, находящегося в воздухе в нашем классе.
Решение:
- Vкл = 6×11×3 = 198м3 ≈ 200м3
Vвозд = 200м3
V(O2) = 1/5 × 200 = 40м3 = =40000 л
1 л O2 – 1,43 г
40000 л O2 – х г
m (O2) = ρ × V = 1,43 г/л × 40000 л = 57200г = =57,2кг
А масса кислорода в нашей классной комнате m(O2) = 57,2 кг.
??? Почему же мы не поддерживаем горение, имея в своем организме такое большое количество кислорода, 62%?
Ответ, т.к. в нашем организме кислород находится в основном в соединениях, а в воздухе он находится в виде молекул. А в реакции горения вступает молекулярный кислород.
3. Мы с вами изучаем тему «Кислород. Оксиды. Горение». И, конечно же, нельзя пройти мимо явлений, наблюдаемых при реакциях, идущих с участием кислорода. . Тема сегодняшнего урока «Тепловой эффект химических реакций».
В результате реакций горения выделяется свет и тепло, которые мы можем увидеть и почувствовать. В результате некоторых других химических реакций теплота, наоборот, затрачивается или поглощается, и мы можем почувствовать понижение температуры. В этом случае мы можем говорить также о выделении или поглощении энергии.
В каждом веществе запасено определенное количество энергии. С этим свойством веществ мы сталкиваемся уже за завтраком, обедом или ужином, так как продукты питания позволяют нашему организму использовать энергию самых разнообразных химических соединений, содержащихся в пище. В организме эта энергия преобразуется в движение, работу, идет на поддержание постоянной (и довольно высокой!) температуры тела.
Энергия химических соединений сосредоточена главным образом в химических связях. Чтобы разрушить связь между двумя атомами, требуется ЗАТРАТИТЬ ЭНЕРГИЮ. Когда химическая связь образуется, энергия ВЫДЕЛЯЕТСЯ.
Любая химическая реакция заключается в разрыве одних химических связей и образовании других.
Когда в результате химической реакции при образовании новых связей выделяется энергии БОЛЬШЕ, чем потребовалось для разрушения «старых» связей в исходных веществах, то
Таким образом, любая химическая реакция сопровождается выделением или поглощением энергии . Чаще всего энергия выделяется или поглощается в виде теплоты (реже — в виде световой или механической энергии). Эту теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для одного МОЛЯ реагента или (реже) для моля продукта реакции. Такая величина называется ТЕПЛОВЫМ ЭФФЕКТОМ РЕАКЦИИ. Например, тепловой эффект реакции сгорания водорода в кислороде можно выразить любым из двух уравнений (слайд):
2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
или
H2(г) + 1/2 O2(г) = H2О(ж) + 286 кДж
Оба уравнения одинаково правильны и оба выражают тепловой эффект экзотермической реакции образования воды из водорода и кислорода. Первое — на 1 моль использованного кислорода, а второе — на 1 моль сгоревшего водорода или на 1 моль образовавшейся воды.
Значки (г), (ж) обозначают газообразное и жидкое состояние веществ. Встречаются также обозначения (тв) или (к) — твердое, кристаллическое вещество, (водн) — растворенное в воде вещество и т.д.
Обозначение агрегатного состояния вещества имеет важное значение.
Уравнения химических реакций, в которых вместе с реагентами и продуктами записан и тепловой эффект реакции, называются ТЕРМОХИМИЧЕСКИМИ УРАВНЕНИЯМИ.
Тепловые эффекты химических реакций нужны для многих технических расчетов. Представьте себя на минуту конструктором мощной ракеты, способной выводить на орбиту космические корабли и другие полезные грузы (слайд).
Самая мощная в мире российская ракета «Энергия» перед стартом на космодроме Байконур. Двигатели одной из её ступеней работают на сжиженных газах — водороде и кислороде.
Допустим, вам известна работа (в кДж), которую придется затратить для доставки ракеты с грузом с поверхности Земли до орбиты, известна также работа по преодолению сопротивления воздуха и другие затраты энергии во время полета. Как рассчитать необходимый запас водорода и кислорода, которые (в сжиженном состоянии) используются в этой ракете в качестве топлива и окислителя?
Без помощи теплового эффекта реакции образования воды из водорода и кислорода сделать это затруднительно. Ведь тепловой эффект — это и есть та самая энергия, которая должна вывести ракету на орбиту. В камерах сгорания ракеты эта теплота превращается в кинетическую энергию молекул раскаленного газа (пара), который вырывается из сопел и создает реактивную тягу.
В химической промышленности тепловые эффекты нужны для расчета количества теплоты для нагревания реакторов, в которых идут эндотермические реакции. В энергетике с помощью теплот сгорания топлива рассчитывают выработку тепловой энергии.
Врачи-диетологи используют тепловые эффекты окисления пищевых продуктов в организме для составления правильных рационов питания не только для больных, но и для здоровых людей — спортсменов, работников различных профессий. По традиции для расчетов здесь используют не джоули, а другие энергетические единицы — калории (1 кал = 4,1868 Дж).
Решение задач по термохимическим уравнениям реакций.
Алгоритм решения:
а) Прочитать внимательно задачу.
б) Составить термохимическое уравнение.
в) Перенести данные из условия в уравнение.
г) Найти по уравнению массу или количество вещества.
д) Составить и решить пропорцию.
е) Записать ответ.
Задача 1.Определите количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, с помощью термохимического уравнения.
2 Mg + O2 = 2MgO + 1204 кДж
Даноm (Mg0) = 120г
Найти:
Q1 -?
Решение:
1) Определяем количества оксида магния, используя формулу для нахождения количества вещества через массу.
n = m / M
n(MgO) = 120г/ 40 г/моль = 3 моль
2) Составляем пропорцию с учетом коэффициентов в уравнении реакции
По уравнению 2 моль MgO — 1204 кДж
По условию 3 моль MgO — Q1
Отсюда
3 моль* 1204кДж
Q1
=
————————
= 1803 кДж
2моль
Ответ: при образовании 120г оксида магния выделится 1803 кДж энергии.
Задача 2. В результате реакции, термохимическое уравнение которой
2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж
выделилось 652,5 кДж теплоты. Определите массу сгоревшего ацетилена.
Дано:
Q1 = 652,5 кДж
Найти:
m(C2H2)-?
Решение:
Установим пропорциональные отношения между
количеством вещества ацетилена и количеством теплоты.
По уравнению 2 моль C2H2_———- 2610 кДж
По условию х моль ———- 652,5 кДж
Решаем пропорцию
2 моль* 652,5кДж
х
=
————————
= 0,5 моль
2610 кДж
2) Определяем массу ацетилена по формуле m= n * M
m = 0,5 моль * 26 г/моль = 13 г.
Ответ: масса сгоревшего ацетилена 13 г.
Задача 3. В результате горения 48 г метана выделилось 2406 кДж теплоты. Составьте термохимическое уравнение этой реакции.
Дано:m(CH4)= 48г
Q1 = 2406 кДж
Найти:
Q -?
Решение:
1. Запишем уравнение реакции горения метана в общем виде
CH4+ 2O2 = CO2 +2H2O + Q
2. Определим количество 48 г метана
n = m / M
n(CH4) = 48г/ 16 г/моль = 3 моль
3. Составляем пропорцию с учетом коэффициентов в уравнении реакции
По условию 3моль CH4 — 2406 кДж
По уравнению 1 моль CH4 — Q
Решаем пропорцию
1 моль* 2406 кДж
х
=
————————
= 802 кДж
3 моля
Ответ: термохимическое уравнение реакции горения метана
CH4+ 2O2 = CO2 +2H2O + 802 кДж
IV. Закрепление
Решите самостоятельно:
Задача 4.Сколько выделится теплоты на ведро (10 кг) угля, если известно, что тепловой эффект реакции горения угля выражается следующим термохимическим уравнением:
С + О2 —> CO2 + 394 кДж?
Дано :Р е ш е н и е
m(C) = 10 кг, или 104 г,
M(С) = 12 г/моль.
Q = 394 кДж.
Составляем пропорцию:
12 г С – 394 кДж,
104 г С – х кДж;
х = 328 333,3 кДж.
О т в е т. При сгорании ведра угля выделится 328 333,3 кДж теплоты.
Сокунов Никита решил эту задачу так, как мы решали на уроках физики по удельной теплоте сгорания. Сравним наши ответы.
Тепловой эффект при реакции сгорания топлива будет одинаковый при расчете и физическим, и химическим способом.
IV. Рефлексия.
Что происходит с энергией при химических реакциях?
Что происходит с энергией при разрыве химических связей?
Что происходит с энергией при образовании химических связей?
Что мы можем наблюдать при выделении энергии (теплоты)?
Как называются реакции, идущие с выделением теплоты?
Что мы можем наблюдать при поглощении энергии (теплоты)?
Как называются реакции, идущие с поглощением теплоты?
Как называется теплота (энергия) образующаяся при химических реакциях?
Как записать в уравнение химической реакции выделяющуюся теплоту? Поглощающуюся теплоту?
Для чего необходимо знать тепловой эффект химической реакции?
V. Подведение итогов урока. Домашнее задание.
§23 – учить и пересказывать, учить записи в тетради, вопросы 11-13 (устно), задачи 1, 2 на стр.69.
Конспект урока «Тепловой эффект химической реакции»
МКОУ «Новогуровская средняя общеобразовательная школа»
Тема урока:
«Тепловой эффект химимческих реакций»
8 класс
Урок подготовила и провела:
учитель химии
Арсеньева Е.Н.
рпгт Новогуровский
2011 – 2012 учебный год
Содержание урока: Закон сохранения энергии. Превращение энергии в ходе химических реакций.
Тепловой эффект химической реакции. Экзо– и эндотермические реакции.
Термохимические уравнения. Определение теплового эффекта химической
реакции.
Цели урока: Обеспечить развитие представлений учащихся о законе сохранения энергии.
Организовать деятельность учащихся по применению знаний закона сохранения
энергии в разнообразных ситуациях.
Актуализировать личностный смысл учащихся к изучению темы, помочь осознать
практическую направленность учебного материала.
Содействовать развитию у школьников научных методов познания (наблюдение,
эксперимент), химически правильной речи.
Требования к уровню подготовки учащихся:
Знать:
* закон сохранения энергии;
* термины: тепловой эффект химической реакции, экзотермические и эндотермические реакции, термохимическое уравнение.
Понимать: причину появления теплового эффекта химической реакции.
Уметь:
* определять тип химических реакций по тепловому эффекту;
* составлять уравнения реакций;
* проводить вычисления теплового эффекта химической реакции.
* использовать приобретенные знания и умения в практической деятельности и повседневной жизни
для: критической оценки информации о веществах, используемых в быту;
Оценивать:
* значимость представлений о тепловом эффекте реакции для прогнозирования ее практического осуществления;
* экологические последствия протекания экзотермических реакций;
Понимать: личную ответственность за качество приобретаемых знаний и умений.
Проявлять:
* уверенность в личных возможностях, самостоятельность в работе;
* способность к самоанализу, самодиагностике.
Оборудование: Учебно-электронное пособие «Химия (8-11 классы). Виртуальная лаборатория»,
«Химия для всех – XXI», «Репетитор по химии Кирилла и Мефодия», компьютер,
проектор, экран.
Ход урока.
I. Организационный момент. Сообщаю учащимся тему, цели и задачи урока.
II.Проверка домашнего задания.
— Мы с вами изучаем тему «Кислород. Оксиды. Горение». И, конечно же, нельзя пройти мимо явлений наблюдаемых при реакциях идущих с участием кислорода. Тема сегодняшнего урока «Тепловой эффект химических реакций». Но, сначала повторим:
Фронтальный опрос класса.
Назовите химический знак кислорода?
Какое положение занимает кислород в периодической таблице Д.И.Менделеева?
Какова его Аr?
Назовите валентность кислорода?
Каково содержание кислорода в земной коре? В состав каких веществ входит элемент кислород?
Составьте химические формулы следующих оксидов:
NaO, CaO, AlO, CO, SO, NO, ClO.
Какова химическая формула простого вещества кислорода?
Какова его Мr? М?
Где в природе находится кислород как простое вещество?
Перечислите физические свойства кислорода.
Перечислите химические свойства кислорода.
Закончите следующие уравнения химических реакций:
Cu + O2 … ; S +O2 … ; CH4 + O2 … + … ; H2S + O2 … + … .
Какие из них относятся к реакциям окисления, а какие к реакциям горения?
По каким признакам вы это определили?
III. Объяснение нового материала.
— Да, действительно, в результате реакций горения выделяется свет и тепло, которые мы можем увидеть и почувствовать. В результате некоторых других химических реакций теплота, наоборот, затрачивается или поглощается, и мы можем почувствовать понижение температуры. В этом случае мы можем говорить также о выделении или поглощении энергии.
В каждом веществе запасено определенное количество энергии. С этим свойством веществ мы сталкиваемся уже за завтраком, обедом или ужином, так как продукты питания позволяют нашему организму использовать энергию самых разнообразных химических соединений, содержащихся в пище. В организме эта энергия преобразуется в движение, работу, идет на поддержание постоянной (и довольно высокой!) температуры тела.
Энергия химических соединений сосредоточена главным образом в химических связях. Чтобы разрушить связь между двумя атомами, требуется ЗАТРАТИТЬ ЭНЕРГИЮ. Когда химическая связь образуется, энергия ВЫДЕЛЯЕТСЯ.
Любая химическая реакция заключается в разрыве одних химических связей и образовании других.
Когда в результате химической реакции при образовании новых связей выделяется энергии БОЛЬШЕ, чем потребовалось для разрушения «старых» связей в исходных веществах, то избыток энергии высвобождается в виде тепла. Примером могут служить реакции горения. Например, природный газ (метан CH4) сгорает в кислороде воздуха с выделением большого количества теплоты (сайд.). Такие реакции называются ЭКЗОТЕРМИЧЕСКИМИ от латинского «экзо» — наружу (имея в виду выделяющуюся энергию).
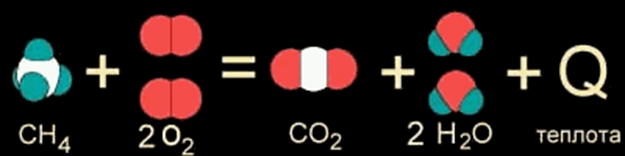
В других случаях на разрушение связей в исходных веществах требуется энергии больше, чем может выделиться при образовании новых связей. Такие реакции происходят только при подводе энергии извне и называются ЭНДОТЕРМИЧЕСКИМИ (от латинского «эндо» — внутрь). Примером является образование оксида углерода (II) CO и водорода H2 из угля и воды, которое происходит только при нагревании (слайд ).
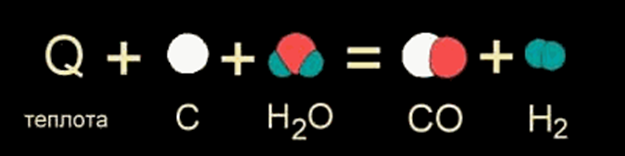
Таким образом, любая химическая реакция сопровождается выделением или поглощением энергии. Чаще всего энергия выделяется или поглощается в виде теплоты (реже — в виде световой или механической энергии). Эту теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для одного МОЛЯ реагента или (реже) для моля продукта реакции. Такая величина называется ТЕПЛОВЫМ ЭФФЕКТОМ РЕАКЦИИ. Например, тепловой эффект реакции сгорания водорода в кислороде можно выразить любым из двух уравнений (слайд):
2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
или
H2(г) + 1/2 O2(г) = H2О(ж) + 286 кДж
Оба уравнения одинаково правильны и оба выражают тепловой эффект экзотермической реакции образования воды из водорода и кислорода. Первое — на 1 моль использованного кислорода, а второе — на 1 моль сгоревшего водорода или на 1 моль образовавшейся воды.
Значки (г), (ж) обозначают газообразное и жидкое состояние веществ. Встречаются также обозначения (тв) или (к) — твердое, кристаллическое вещество, (водн) — растворенное в воде вещество и т.д.
Обозначение агрегатного состояния вещества имеет важное значение.
Уравнения химических реакций, в которых вместе с реагентами и продуктами записан и тепловой эффект реакции, называются ТЕРМОХИМИЧЕСКИМИ УРАВНЕНИЯМИ.
Тепловые эффекты химических реакций нужны для многих технических расчетов. Представьте себя на минуту конструктором мощной ракеты, способной выводить на орбиту космические корабли и другие полезные грузы (слайд).
Рис. Самая мощная в мире российская ракета «Энергия» перед стартом на космодроме Байконур. Двигатели одной из её ступеней работают на сжиженных газах — водороде и кислороде.
Допустим, вам известна работа (в кДж), которую придется затратить для доставки ракеты с грузом с поверхности Земли до орбиты, известна также работа по преодолению сопротивления воздуха и другие затраты энергии во время полета. Как рассчитать необходимый запас водорода и кислорода, которые (в сжиженном состоянии) используются в этой ракете в качестве топлива и окислителя?
Без помощи теплового эффекта реакции образования воды из водорода и кислорода сделать это затруднительно. Ведь тепловой эффект — это и есть та самая энергия, которая должна вывести ракету на орбиту. В камерах сгорания ракеты эта теплота превращается в кинетическую энергию молекул раскаленного газа (пара), который вырывается из сопел и создает реактивную тягу.
В химической промышленности тепловые эффекты нужны для расчета количества теплоты для нагревания реакторов, в которых идут эндотермические реакции. В энергетике с помощью теплот сгорания топлива рассчитывают выработку тепловой энергии.
Врачи-диетологи используют тепловые эффекты окисления пищевых продуктов в организме для составления правильных рационов питания не только для больных, но и для здоровых людей — спортсменов, работников различных профессий. По традиции для расчетов здесь используют не джоули, а другие энергетические единицы — калории (1 кал = 4,1868 Дж).
Решение задач по термохимическим уравнениям реакций.
Алгоритм решения:
а) Прочитать внимательно задачу.
б) Составить термохимическое уравнение.
в) Перенести данные из условия в уравнение.
г) Найти по уравнению массу или количество вещества.
д) Составить и решить пропорцию.
е) Записать ответ.
Задача 1. Определите количество теплоты, которое выделится при образовании 120 г MgO в результате
реакции горения магния, с помощью термохимического уравнения.
2 Mg + O2 = 2MgO + 1204 кДж
Дано:
m (Mg0) = 120г
Найти:
Q1 -?
Решение:
1) Определяем количества оксида магния, используя формулу для нахождения количества вещества через массу.
= m / M
(MgO) = 120г/ 40 г/моль = 3 моль
2) Составляем пропорцию с учетом коэффициентов в уравнении реакции
По уравнению 2 моля MgO — 1204 кДж
По условию 3 моля MgO — Q1
Отсюда
3 моль* 1204кДж
Q1
=
————————
= 1803 кДж
2моль
Ответ: при образовании 120г оксида магния выделится 1803 кДж энергии.
Задача 2. В результате реакции, термохимическое уравнение которой
2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж
выделилось 652,5 кДж теплоты. Определите массу сгоревшего ацетилена.
Дано:
Q1 = 652,5 кДж
Найти:
m(C2H2)-?
Решение:
1) Установим пропорциональные отношения между количеством вещества ацетилена и количеством теплоты.
По уравнению 2 моль C2H2_———- 2610 кДж
По условию х моль ———- 652,5 кДж
Решаем пропорцию
2 моль* 652,5кДж
х
=
————————
= 0,5 моль
2610 кДж
2) Определяем массу ацетилена по формуле m= * M
m = 0,5 моль * 26 г/моль = 13 г.
Ответ: масса сгоревшего ацетилена 13 г.
Задача 3. В результате горения 48 г метана выделилось 2406 кДж теплоты. Составьте
термохимическое уравнение этой реакции.
Дано:
m(CH4)= 48г
Q1 = 2406 кДж
Найти:
Q -?
Решение:
1. Запишем уравнение реакции горения метана в общем виде
CH4+ 2O2 = CO2 +2H2O + Q
2. Определим количество 48 г метана
= m / M
(CH4) = 48г/ 16 г/моль = 3 моль
3. Составляем пропорцию с учетом коэффициентов в уравнении реакции
По условию 3моля CH4 — 2406 кДж
По уравнению 1 моль CH4 — Q
Решаем пропорцию
1 моль* 2406 кДж
х
=
————————
= 802 кДж
3 моля
Ответ: термохимическое уравнение реакции горения метана
CH4+ 2O2 = CO2 +2H2O + 802 кДж
Решите самостоятельно:
Задача 4. Сколько выделится теплоты на ведро (10 кг) угля, если известно, что тепловой эффект
реакции горения угля выражается следующим термохимическим уравнением:
С + О2 —> CO2 + 394 кДж?
Дано: Р е ш е н и е
m(C) = 10 кг, или 104 г, M(С) = 12 г/моль.
Q = 394 кДж.
Составляем пропорцию:
12 г С – 394 кДж,
104 г С – х кДж;
х = 328 333,3 кДж.
О т в е т. При сгорании ведра угля выделится 328 333,3 кДж теплоты.
IV.Подведение итогов.
Что происходит с энергией при химических реакциях?
Что происходит с энергией при разрыве химических связей?
Что происходит с энергией при образовании химических связей?
Что мы можем наблюдать при выделении энергии (теплоты)?
Как называются реакции, идущие с выделением теплоты?
Что мы можем наблюдать при поглощении энергии (теплоты)?
Как называются реакции, идущие с поглощением теплоты?
Как называется теплота (энергия) образующаяся при химических реакциях?
Как записать в уравнение химической реакции выделяющуюся теплоту? Поглощающуюся теплоту?
Для чего необходимо знать тепловой эффект химической реакции?
V.Домашнее задание.
§23 – учить и пересказывать, учить записи в тетради, вопросы 11-13 (устно), задачи 1, 2 на стр.69.
Задачи к разделу Основы термодинамики
Решение.
Вычисления энергии Гиббса проводим согласно выражению:
ΔGр-ции = ΔHр-ции – TΔSр-ции
Необходимо рассчитать энтальпию и энтропию химической реакции.
ΔHр-ции = ΣH0кон – ΣH0исх кДж/моль
Используя справочные данные стандартных энтальпий веществ, находим:
ΔHр-ции= 2·ΔH0Cr + 3·ΔH0CO — ΔH0Cr2O3 — 3·ΔH0C= 2·0 + 3·(- 110,6) – (-1141) — 3·0 = 809,2 кДж/моль
ΔSр-ции=ΣS0кон – ΣS0исх Дж/моль·K
Аналогично, используя справочные данные стандартных энтропий веществ, находим:
ΔSр-ции= 2·ΔS0Cr + 3·ΔS0CO — ΔS0Cr2O3 — 3·ΔS0C= 2·23,6 + 3·197,7 – 81,2 — 3·5,7 = 542 Дж/(моль·K)
Найдем энергию Гиббса при 1000 К
ΔG1000 = ΔH – TΔS= 809,2 – 1000 ·542 /1000 = 267,2 кДж/моль
ΔG1000 > 0, следовательно, реакция самопроизвольно не идет.
Найдем энергию Гиббса при 3000 К
ΔG3000= ΔH – TΔS = 809,2 – 3000 ·542 /1000 = — 816,8 кДж/моль
ΔG3000 ˂ 0, следовательно, реакция протекает самопроизвольно.
Практическая работа по теме «Расчет тепловых эффектов химических реакций»
ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ И НАУКИ КЕМЕРОВСКОЙ ОБЛАСТИ
ГПОУ «ЮРГИНСКИЙ ТЕХНОЛОГИЧЕСКИЙ КОЛЛЕДЖ»
Цикловая методическая комиссия отделения технология продукции общественного питания
УТВЕРЖДАЮ
Заместитель директора по НМР
____________И.Н. Ташиян
«___»_____________ 2016 г.
Расчет ТЕПЛОВЫХ ЭФФЕКТОВ ХИМИЧЕСКИХ РЕАКЦИЙ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
к выполнению практической работы
Дисциплина ХИМИЯ
Специальность 19.02.10Технология продукции общественного питания
2016
Методические указания составлены на основе Федерального государственного образовательного стандарта среднего профессионального образования по специальности 19.02.10 Технология продукции общественного питания, утвержденным приказом Министерства образования и науки РФ 22.04.2014 №384 и в соответствии с рабочей программой по Химии, утвержденной 01.09.2016г.
ОДОБРЕНО ЦМК отделения ТПОП
Протокол №__ от__________ 2016
Председатель ЦМК
отделения ТПОП ____________Е.Е. Бояринова
СОСТАВИТЕЛЬ:
Преподаватель общеобразовательных
Дисциплин ГПОУ ЮТК ___________ С.Н. Кондратьева
РЕЦЕНЗЕНТ:
Преподаватель общеобразовательных
дисциплин ГПОУ ЮТК ____________Н.Н. Гутова
Заведующий отделением ТПОП ___________ Д.Б. Тарасова
Заведующий
Лабораторией стандартизации ____________ Е.Н. Соловьева
Зарегистрировано в методическом кабинете ___________ 2016г.
Зам. Директора по НМР _____________ И.Н. Ташиян
Введение
Методические указания для выполнения практической работы предназначены для обучающихся ГПОУ «Юргинский технологический колледж», составлены по теме «Расчет тепловых эффектов химических реакций», а также в соответствии с программой дисциплины Химия для специальности 19.02.10 Технология продукции общественного питания. Выполнение практической работы нацелено на формирование навыков самостоятельной работы при решении расчетных задач, умения решать задачи по образцу и применять полученные знания при решении задач, не разобранных в образце.
1 МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ВЫПОЛНЕНИЮ ПРАКТИЧЕСКОЙ РАБОТЫ
Цель работы: расчёт энтальпий (тепловых эффектов) процессов, протекающих при растворении солей в воде.
В результате проведения практической работы студент должен:
Знать основные положения об атомах и молекулах, классификацию веществ, основные законы термодинамики, термодинамические характеристики веществ.
Уметь рассчитывать тепловые эффекты химических реакций по данному термохимическому уравнению, пользуясь следствием из закона Гесса.
Объем времени, отведенный на выполнение практической работы: 80 минут.
Материально – техническое оснащение: краткий справочник физико-химических величин (таблица), термодинамические характеристики веществ (таблица) периодическая система химических элементов Д. И. Менделеева
2 ТеоретическИЙ МАТЕРИАЛ ПО ТЕМЕ ПРАКТИЧЕСКОЙ РАБОТЫ
Для расчёта энтальпий (тепловых эффектов) химических реакций при стандартных уравнению пользуются следствием из закона Гесса:
тепловой эффект химической реакции при стандартных условиях равен разности между суммой стандартных теплот образования продуктов реакции и исходных веществ, взятых с учётом стехиометрических коэффициентов.
Теплотой образования сложного вещества называется тепловой эффект реакции образования 1 моля этого вещества при стандартных условиях. Теплоты образования большинства веществ можно найти в справочнике. Теплоты образования простых веществ равны нулю.
Например, тепловой эффект реакции
4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(г)
ΔH˚ =4ΔH˚обр(NO(г)) + 6ΔH˚ обр (H2O(г)) — 4ΔH˚ обр (NH3(г)) –
— 5 ΔH˚ обр (O2(г)) = 4· 90,4 + 6 · (-241,8) + 4 · (-46,2) – 5 · 0 = -904, 8 кДж
Данная реакция является экзотермической, т.к. ΔH˚< 0.
3 АЛГОРИТМ ПО ВЫПОЛНЕНИЮ ПРАКТИЧЕСКОГО ЗАДАНИЯ
Изучить теоретический материал по теме практической работы
Ответить на контрольные вопросы
Записать на листе для отчета – дату, тему занятия, цель практической работы
Выполнить задания для самостоятельного решения в соответствии с указанным преподавателем вариантом
Сделать вывод по работе
Сдать отчет на проверку преподавателю
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. Рассчитать тепловые эффекты химических реакций при стандартных условиях, определить, будет реакция эндотермической или экзотермической.
Таблица 3.1 – Данные для выполнения задания
а) выполнил работу в полном объеме с соблюдением необходимой последовательности проведения опытов и измерений;б) самостоятельно и рационально выбрал и подготовил для опыта необходимое оборудование, все опыты провел в условиях и режимах, обеспечивающих получение результатов и выводов с наибольшей точностью;
в) в представленном отчете правильно и аккуратно выполнил все записи уравнений химических реакций, таблицы, рисунки, чертежи, графики, вычисления и сделал выводы;
г) соблюдал требования безопасности труда.
Оценка «4» ставится в том случае, если выполнены требования к оценке «5», но:
а) опыт проводился в условиях, не обеспечивающих достаточной точности измерении,
б) или было допущено два-три недочета, или не более одной негрубой ошибки и одного недочета.
Оценка «3» ставится, если работа выполнена не полностью, но объем выполненной части таков, что позволяет получить правильные результаты и выводы, или если в ходе проведения опыта и измерений были допущены следующие ошибки:
а) или в отчете были допущены в общей сложности не более двух ошибок в записях уравнений реакций, измерениях, в вычислениях, графиках, таблицах, схемах не принципиального для данной работы характера, но повлиявших на результат выполнения,
б) или работа выполнена не полностью, однако объем выполненной части таков, что позволяет получить правильные результаты и выводы по основным, принципиально важным задачам работы.
Оценка «2» ставится в том случае, если:
а) работа выполнена не полностью, и объем выполненной части работы не позволяет сделать правильных выводов,
б) или опыты, измерения, вычисления, наблюдения производились неправильно,
в) или в ходе работы и в отчете обнаружились в совокупности все недостатки, отмеченные в требованиях к, оценке «3».
4 КОНТРОЛЬНЫЕ ВОПРОСЫ
1 Дать понятие термодинамики.
2 Охарактеризовать изменение скорости атомов и молекул, находящихся в непрерывном движении, с увеличением температуры.
3 Дать понятие внутренней энергией.
4 Сформулировать I-закон термодинамики.
5 Дать понятие энтальпии.
6 Дать понятие экзотермической, эндотермической реакции.
7 Сформулировать закон Гесса?
Список источников
Основные источники
1 Габриелян, О.С. Химия [Текст]: учебник / О.С. Габриелян 6-е изд., стер. – М.: Химия, 2014.- 324 с.
2 Габриелян, О.С. Химия в тестах, задачах и упражнениях [Текст]: учеб. пособие / О.С. Габриелян 5-е изд., стер. – М.: Химия, 2014.- 184 с.
3 Ерохин, Ю.М. Химия, стер. [Текст]: учебник / Ю.М. Ерохин1 4-е изд., стер. – М.: Химия, 2015.- 300 с.
4 Келина, Н.Ю. Аналитическая химия в таблицах и схемах [Текст]: / Н.Ю. Келина– М.: Химия, 2014.- 124 с.
5 Хомченко, Г.П. Общая химия [Текст]: учебник для техникумов / Хомченко Г.П. – М.: Химия, 2015.- 520 с.
Дополнительные источники
1 Артеменко, А.И. Органическая химия [Текст]: Учебник для студентов техникумов, колледжей, учащихся школ, лицеев и гимназий. / А. И. Артеменко – М.: Химия, 2012.- 280 с.
2 Лукьянов, А.Б. Физическая и коллоидная химия [Текст]: учебник для техникумов / А.Б.Лукьянов. – М.: Химия, 2009. – 286 с.
3 Фридрихсберг, Д.А. – Курс коллоидной химии [Текст]: учебник для техникумов / Д.А. Фридрихсберг – Л.: Химия, 2010. — 368 с.
Интернет-ресурсы
1Органическая химия Web учебник для среднейшколы. Интерактивный мультимедиа учебник для средней школы. [Эл. ресурс]-URL: www.chemistry.ssu.samara.ru
2 Учебник химии. Химия — органическая и неорганическая химия. Формулы, справочники и опыты по химии. chemel.ru/
3 Левченков С.И. — Лекции по физической и коллоидной химии. www.physchem.chimfak.rsu.ru /…/Colloids_1.htm
12 ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ И НАУКИ КЕМЕРОВСКОЙ ОБЛАСТИ14 ГПОУ ЮРГИНСКИЙ ТЕХНОЛОГИЧЕСКИЙ КОЛЛЕДЖ
12 Отделение ТЕХНОЛОГИЯ ПРОДУКЦИИ ОБЩЕСТВЕННОГО ПИТАНИЯ
20 РЕШЕНИЕ ЗАДАЧ ПО ТЕМЕ «АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ»
16 отчет по практической РАБОТе № 1
Дисциплина: «химия»
12 Обучающийся(щаяся) гр. _____
Оценка «________»
Преподаватель
С.Н. Кондратьева
(подпись)
(дата)
14 2016
План-конспект урока по химии (8 класс) по теме: Тема урока : «Тепловой эффект химических реакций».
Тема: Тепловой эффект химических реакций.
Цель:
Образовательная: Сформировать понятие об экзо- и эндотермических реакциях, тепловом эффекте химической реакции, термохимическом уравнении. Научиться составлять термохимические уравнения и производить расчеты теплоты по уравнению реакции.
Развивающая: Развитие логического мышления и умений сравнивать, обобщать, анализировать , наблюдать, анализировать природные явления и проводимый химический эксперимент.
Воспитательная: Воспитание интереса к предмету химия. Формирование у учащихся коммуникативных навыков, чувства товарищества и взаимопомощи, умения работать в парах.
Оборудование: вещества: штатив с пробирками, 2 термометра, Zn; HCI; Nh5NO3 , свеча , спички.
- Мультимедийный проектор, компьютер, презентация “Тепловой эффект химических реакций.
Ход урока
I. Организационно-мотивационный этап
Приветствие учащихся.
II. Актуализация знаний учащихся
На столе зажженная свеча.
Зачитывается отрывок из стихотворения Б.Пастернака «Зимняя ночь»
Мело, мело по всей земле
Во все пределы.
Свеча горела на столе,
Свеча горела.
О каком явлении идет речь в этом стихотворении? О горении свечи. А горение свечи это какое явление физическое или химическое? Правильно, химическое. А как иначе называются химические явления? Верно, химическими реакциями. Опишите признаки наблюдаемой реакции. Выделение света и тепла. А все ли реакции сопровождаются выделением тепла и света?
Давайте проведем химический эксперимент и найдем ответ на поставленный вопрос.
III. Объяснение нового материала
Приступим к выполнению эксперимента:
Опыт 1. Взаимодействие цинка с кислотой.
В пробирку с Zn осторожно прилейте раствор соляной кислоты HCl, что наблюдаете? Потрогайте нижнюю часть пробирки, что вы ощущаете?
Давайте запишем уравнение данной реакции и укажем ее признаки.
Zn + 2HCl = ZnCl2 + h3↑ + Q
Признаками проводимой реакции будут выделение газа и теплоты.
Опыт 2. Растворение аммиачной селитры в воде
В пробирку с белым кристаллическим веществом прилейте имеющуюся воду, встряхните. Потрогайте нижнюю часть пробирки, что вы ощущаете?
Nh5NO3 + h3O ⇄ Nh5OH + HNO3 – Q
Признаком проводимой реакции будет поглощение теплоты.
Мы провели с вами 2 реакции, по какому признаку можно их классифицировать ?
Правильно, по поглощению или по выделению теплоты.
Количество теплоты, которое выделяется или поглощается при химической реакции, называют тепловым эффектом реакции.
Тепловой эффект обозначается Q и измеряется в Дж или кДж.
Давайте запишем классификацию химических реакций по тепловому эффекту.
Реакции, протекающие с выделение теплоты, называют экзотермическими.
Реакции, протекающие с поглощением теплоты, называют эндотермическими.
Химические уравнения, в которых указывается тепловой эффект, называют термохимическими.
Например: 2HgO —> 2Hg + O2 – 180 кДж, С(тв) + O2(г) —> СO2(г) + 394 кДж
Раздел химии, в задачу которого входит определение и изучение тепловых эффектов реакции называется Термохимией.
4. По термохимическим уравнениям реакций можно проводить различные расчёты. Для решения задач по термохимическим уравнениям реакций нужно записать само уравнение и провести необходимые расчеты по нему.
Алгоритм решения задач по термохимическому уравнению реакции
- Кратко записать условия задачи (“дано”).
- Записать термохимическое уравнение реакции (ТХУ), одной чертой в уравнении реакции подчеркивают то, что известно, двумя чертами подчёркивают то, что необходимо определить.
- Провести вспомогательные вычисления. m=M* v
- Составить пропорцию, используя вспомогательные вычисления и условия задачи, и решить ее.
- Записать ответ.
Объяснение решения задач:
1. Вычислите массу разложившегося мела (СаСО3), если известно, что на его разложение затрачено 1570 кДж.
Мr (СаСО3) = Аr(Са) + Аr(С) + Аr(О) 3 = 40 + 12 + 16 3 = 100
Мr = Мr m = v * М
M(СаСО3) = 1 моль* 100 г/моль = 100г
100г СаСО3 — 157 кДж —
х г СаСО3 — 1570 кДж
100г : 157 кДж = х г : 1570 кДж
х = 1000г СаСО3
Ответ: m (СаСО3) = 1 кг (или разложилось 1000г мела)
2. При взаимодействии 2г кальция с кислородом выделилось 127кДж теплоты. Напишите термохимическое уравнение для данной реакции.
IV. Закрепление изученного материала
Чтобы проверить степень усвоения вами нового материала, давайте проведем небольшую тестовую работу.
1. Заполни пропуски
Реакции, протекающие с выделением теплоты и света, называют реакциями
…. Это реакции ….
Выберите пропущенные слова (укажи буквы, соответствующие по смыслу пропускам):
а) разложения;
б) эндотермические;
в) экзотермические.
г)замещения
2. Какие схемы можно назвать термохимическими уравнениями реакций?
а) 2 h3(г) + O2(г) = 2 h3О(ж) + 572 кДж
б) 2 h3 + O2 = 2 h3О + 572 кДж
в) 2 h3(г) + O2(г) = 2 h3О(ж)
3. Какая запись, соответствует эндотермической реакции?
а) С(тв) + O2(г) = СO2(г) + 394 кДж
б) СаСO3 = СO2 + СаО – 310 кДж
г) Н2 + I2 = 2HI – 52 кДж
д) 3Fe + O2 = Fe3O4 + 118 кДж
4. Приведены уравнения реакций:
1. С+О2 = СО2 + 402,24кДж
2. 2HgO = 2Hg + О2 -180кДж
4.Определите тип, к которому относятся данные реакции.
а) обе реакции экзотермические
б) обе реакции эндотермические
в) А – эндотермическая, а Б – экзотермическая
г) А – экзотермическая, а Б – эндотермическая
V. Подведение итогов:
Подведение результатов, объявление оценок.
VI. Д/з параграф 23, задача 1, 2 стр.69 (письменно)
«Тепловой эффект реакции». Химия – 11 класс.
Просмотр содержимого документа
«Карточка по теме: «Тепловой эффект реакции». Химия – 11 класс.»
Карточка по теме: «Тепловой эффект реакции». Химия – 11 класс.
1. Определите количество теплоты, необходимое для разложения карбоната кальция в соответствии с термохимическим уравнением:
CaCO3 = CaO + CO2 – 177 кДж, если в результате выделилось 44,8 л (н.у.) углекислого газа.
2. В результате реакции, термохимическое уравнение которой: 3Fe + 2O2 = Fe3O4 + 1200 кДж, выделилось 600 кДж теплоты. Найдите массу (в граммах) окисленного железа.
3. Определите объем метана (в литрах н.у.), при сгорании которого в соответствии с термохимическим уравнением: CH4 + 2O2 = CO2 + 2H2O + 892 кДж, выделится 297,3 кДж теплоты.
4. Определите количество теплоты, которое выделится при образовании 120 г оксида магния, в результате реакции горения магния, с помощью термохимического уравнения: 2Mg + O2 = 2MgO + 1204 кДж
5. В результате реакции, термохимическое уравнение которой: 2C2H2 + 5O2 = 4CO2 + 2H2O + 2610 кДж, выделилось 652,5 кДж теплоты. Определите массу сгоревшего ацетилена.
6. Определите количество теплоты, которая выделится при образовании 90 г воды в соответствии с термохимическим уравнением: CH4 + 2O2 = CO2 + 2H2O + 892 кДж
7. Теплота сгорания серы равна 297 кДж. Определите массу сгоревшей серы, если при этом выделилось 1336,5 кДж теплоты.
8. Теплота сгорания этана равна 1560 кДж. Какое количество тепла выделится при сгорании 2000 л этана.
9. В результате реакции, термохимическое уравнение которой: SO3 + H2O = H2SO4 + 88 кДж, выделилось 264 кДж теплоты. Вычислите массу, образовавшейся при этом серной кислоты.
10. По термохимическому уравнению реакции: Н2 + СI2 = 2HCl + 184 кДж определите, сколько теплоты выделится при сгорании 4 граммов водорода в хлоре. ( Ответ: 368 кДж)
11. При сжигании 48 граммов метана выделилось 2676 кДж теплоты. Найдите тепловой эффект реакции . Уравнение реакции: СН4 + 2О2 = СО2 + 2Н2О + Q ( Ответ: 892 кДж)
12. При взаимодействии 45 г глюкозы с избытком кислорода в соответствии с термохимическим уравнением: C6H12O6 + 6O2 = 6CO2 + 6H2O + Q выделилось 700 кДж теплоты. Определите тепловой эффект реакции. (Ответ: 2800 кДж)