Задачи на термохимические уравнения | Подготовка к ЦТ и ЕГЭ по химии
Предлагаем вам задания части В с подробными видео-объяснениями из ЦТ, РТ и ДРТ всех лет по теме: Термохимические уравнения
1. Демо ЦТ по химии 2015/2016. В8. Химическая реакция протекает согласно термохимическому уравнению:
BaO(т) + SO2(г) = BaSO3(т) + 65кДж. Установите соответствие:
Количественные данные | Количество выделившейся теплоты |
А. m(BaO) = 61,2 гБ. V(SO2) = 14,56 дм3В. m(BaSO3) = 26,04 гГ. N(O) в BaSO3 = 5,418∙1024 | 1. 42,252. 7,83. 264. 195 |
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность, например А2Б3В1Г4.
2. ДРТ 2018/2019. В4. При сжигании метанола в кислороде, которое протекает по термохимическому уравнению 2CH3OH + 3O2 = 2CO2 + 4H2O + 1452 кДж, выделилось 174,24 кДж теплоты, причём непрореагировавшим остался кислород объёмом (н.у.) 11,2 дм3. Рассчитайте массовую долю (%) кислорода в первоначальной смеси.
3. РТ по химии 2015/2016 (3 этап). В10. Разложение сульфита бария протекает согласно термохимическому уравнению:
BaSO3 (т) = BaO (т) + SO2(г) –599,04кДж.
Для разложения образца сульфита бария необходимо 46,8 кДж теплоты. Выделившейся при этом газ был полностью поглощён раствором гидроксида натрия массой 160 г с массовой долей щёлочи 1,75%. Рассчитайте массовую долю (%) соли в полученном растворе.
4. РТ 2017/2018 (3 этап). В3. Превращение метана в метанол в промышленности осуществляют, сжигая часть метана до углекислого газа и используя выделяющееся тепло для превращения остальной части метана:
СH4(г) + 2О2(г) = СО2(г) + 2Н2О(г) + 890 кДж,
2СH4(г) + О2(г) = 2СН3ОН(г) – 174 кДж.
Рассчитайте, какой максимальный объём метанола (дм3, в условиях опыта метанол – газ) можно получить из метана объёмом (н.у.) 2 м3 в этих условиях.
5. РТ 2018/2019 (1 этап). В11. При полном сгорании ацетилена массой 31,2 г выделяется 1566 кДж теплоты, а при полном сгорании сероводорода массой 30,6 г – 506,52 кДж. Рассчитайте количество теплоты (кДж), которое выделится при полном сгорании смеси ацетилена с сероводородом объёмом (н.у.) 33,6 дм3, если объём ацетилена в 2 раза меньше объёма сероводорода.
6. РТ 2018/2019 (2 этап). В10. Рассчитайте количество теплоты (кДж), которые выделилось в результате реакции, протекающей по уравнению 2Са (тв.) + О2 (г.) = 2СаО (тв.) + 1274 кДж, если для реакции взяли кальций и кислород общей массой 121,04 г, но кислород весь не прореагировал, так как был в избытке и его оставшийся объёмом составил 29,456 дм3 (н.у.).
7. РТ 2019/2020 (2 этап). В2. Рассчитайте молярную массу (г/моль) смеси этана и пропана, при сжигании которой массой 200 г выделяется 10230 кДж. Также известно, что тепловой эффект сжигания этана равен 1560 кДж/моль, а пропана – 2220 кДж/моль.
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ, ЦТ, РТ и ДРТ всех лет с подробными видео-объяснениями, задачам и всем материалам сайта кликнув здесь «Получить все материалы сайта»
Дидактический материал по химии на тему «Задачи по термохимическим уравнениям реакций» (8 класс)
Задачи по термохимическим уравнениям реакций 8 класс
Задача 1.
Определите количество теплоты, которое выделится при образовании
120 г MgO в результате реакции горения магния, с помощью термохимического уравнения 2 Mq + O2 = 2MqO + 1204 кДж.
Задача 2.
В результате реакции, термохимическое уравнение которой
2 C2H2 + 5O2 = 4CO2 + 2H2O + 2610 кДж выделилось 652,5 кДж теплоты. Определите массу сгоревшего ацетилена (C2H2).
Задача 3.
В результате горения 48 г метана (CH4) выделилось 2406 кДж теплоты. Составьте термохимическое уравнение этой реакции.
CH4 + 2O2 = CO2 + 2H2O + Q кДж
Задача 4.
Какой объем кислорода (при н.у.) выделится в результате реакции, термохимическое уравнение которой 2KClO3 = 2KCl + 3O2 – 91 кДж,
если на разложение бертолетовой соли было затрачено 182 кДж теплоты.
Задача 5.
По термохимическому уравнению H2 + Cl2 = 2HCl + 184,36 кДж рассчитайте, какой объем хлора затрачен на образование хлороводорода (при н.у.), если при этом выделилось 921,8 кДж теплоты.
Задача 6.
Тепловой эффект реакции горения серы равен 297 кДж. Какая масса серы сгорела, если выделилось 742,5 кДж теплоты.
Задача 7.
Согласно термохимическому уравнению реакции
CH4 + 2O2 = CO
2 + 2H2O + 802 кДж определите количество теплоты, выделившейся при сжигании 24 г метана (CH4).Задачи «Термохимические уравнения» для 11 класса
1.На основании термохимического уравнения горения ацетилена вычислите количество теплоты, которое выделиться при горении ацетилена массой 2,6 грамм. 2C2H2 + 5O2 = 4CO2 + 2H2O + 3200 кДж
2. На основании термохимического уравнения горения ацетилена, вычислите количество теплоты, которое выделиться при горении ацетилена массой 2,6 грамм. 2C2H2 + 5O2 = 4CO2 + 2H2O + 2610 кДж
3.На основании термохимического уравнения горения ацетилена, вычислите массу сгоревшего ацетилена, если в ходе реакции
выделилось 326,25 кДж теплоты.
2C2H2 + 5O2 = 4CO2 + 2H2O + 2110 кДж
4.На основании термохимического уравнения горения ацетилена, вычислите массу сгоревшего ацетилена, если в ходе реакции
выделилось 6525 кДж теплоты.
2C2H2 + 5O2 = 4CO2 + 2H2O + 1410 кДж
5. На основании термохимического уравнения горения этилена, вычислите массу сгоревшего этилена, если в ходе реакции
выделилось 2450 кДж теплоты.
C2H4 + 3O 2 = 2CO2 + 2H2O + 1320 кДж
6. На основании термохимического уравнения горения этилена, вычислите объем сгоревшего этилена, если в ходе реакции
выделилось 326,25 кДж теплоты.
C2H4 + 3O2 = 2CO2 + 2H2O + 2400 кДж
7. На основании термохимического уравнения горения фосфора, рассчитайте массу сгоревшего фосфора, если в результате реакции
выделилось 45150 кДж теплоты.
4P + 5O2 =2P2O5 + 2510 кДж
8. На основании термохимического уравнения горения фосфора, рассчитайте массу сгоревшего фосфора, если в результате реакции
выделилось 645 кДж теплоты.
4
1.На основании термохимического уравнения горения ацетилена вычислите количество теплоты, которое выделиться при горении ацетилена массой 2,6 грамм. 2C2H2 + 5O2 = 4CO2 + 2H2O + 3200 кДж
2. На основании термохимического уравнения горения ацетилена, вычислите количество теплоты, которое выделиться при горении ацетилена массой 2,6 грамм. 2C2H2 + 5O2 = 4CO2 + 2H2O + 2610 кДж
3.На основании термохимического уравнения горения ацетилена, вычислите массу сгоревшего ацетилена, если в ходе реакции
выделилось 326,25 кДж теплоты.
2C2H2 + 5O2 = 4CO2 + 2H2O + 2110 кДж
4.На основании термохимического уравнения горения ацетилена, вычислите массу сгоревшего ацетилена, если в ходе реакции
выделилось 6525 кДж теплоты.
2C2H2 + 5O2 = 4CO2 + 2H2O + 1410 кДж
5. На основании термохимического уравнения горения этилена, вычислите массу сгоревшего этилена, если в ходе реакции
выделилось 2450 кДж теплоты.
C2H4 + 3O2 = 2CO2 + 2H2O + 1320 кДж
6. На основании термохимического уравнения горения этилена, вычислите объем сгоревшего этилена, если в ходе реакции
выделилось 326,25 кДж теплоты.
C2H4 + 3O2 = 2CO2 + 2H2O + 2400 кДж
7. На основании термохимического уравнения горения фосфора, рассчитайте массу сгоревшего фосфора, если в результате реакции
выделилось 45150 кДж теплоты.
4P + 5O2 =2P2O5 + 2510 кДж
8. На основании термохимического уравнения горения фосфора, рассчитайте массу сгоревшего фосфора, если в результате реакции
выделилось 645 кДж теплоты.
4P + 5O2 =2P2O5
+3010 кДжКоличество теплоты. Задачи 32 — 34
Задача 32.
Определить количество теплоты, необходимое для нагревания 10 г азота от 20 до 25°С, если объем газа не изменяется.
Решение:
М(N2) = 28 г/моль.
Количество теплоты, получаемое системой при изохорном процессе, может быть вычислено по уравнению:
Qp = nCv(T2 — T1) = m/MCv(T2 — T1)
Молярная теплоемкость идеального газа при постоянном объеме для двухатомных молекул:
Cv = 5/2R . Следовательно,
Qp = 10/28 . 5/2 . 8,314 . (25 — 20) = 37,116 Дж.
Ответ: Qp = 37,116 Дж.
Задача 33.
Определите количество теплоты, которое нужно затратить для нагревания 10 г водорода от 30 до 100 °С при постоянном объеме.
М(Н2) = 2 г/моль.
Количество теплоты, получаемое системой при изохорном процессе, может быть вычислено по уравнению:
Qp = nCv(T2 — T1) = m/MCv(T2 — T1)
Молярная теплоемкость идеального газа при постоянном объеме для двухатомных молекул:
Cv = 5/2R. Следовательно,
Qp = 10/2 . 5/2 . 8,314 . (100 — 30) = 7274,75 Дж.
Ответ: 7274,75 Дж.
Задача 34.
Определите количество теплоты, которое нужно затратить для нагревания 8,5 г аммиака от 25 до 40 °С при постоянном объеме.
Решение:
М(NH3) = 17 г/моль.
Количество теплоты, получаемое системой при изохорном процессе, может быть вычислено по уравнению:
Qp = nCv(T2 — T1) = m/MCv(T2 — T1)
Молекула аммиака имеет форму треугольной пирамиды. Молярная теплоемкость идеального газа при постоянном объеме без учета энергии колебательного движения, то есть при сравнительно невысоких температурах для нелинейных трехатомных и многоатомных молекул:
Сv = 3R. Следовательно,
Qp = 8,5/17 . 3 . 8,314 . (40 — 25) = 187 Дж.
Ответ: 187 Дж.
Задачи на термохимические расчеты. Уроки химии
Сегодня у нас урок химии 61 – Задачи на термохимические расчеты. Как изучить? Полезные советы и рекомендации – повторите уроки химии, особенно урок № 7.
 1. Реакция протекает по уравнению:
1. Реакция протекает по уравнению:
2AI + Fe2O3 = AI2O3 + 2Fe + 846 кДж
Сколько теплоты выделится при израсходовании 9 гр. восстановителя?
2. Реакция идет по уравнению:
AI(OH)3 + 3HCI = AICI3 + 3h3O + 234 кДж
Сколько теплоты выделится, если для реакции взято 3,9 гр. AI(OH)3?
3. Теплота образования хлороводорода равна 8,96 кДж/моль. Рассчитайте тепловой эффект реакции соединения 2,5 л. водорода с хлором.
4. Вычислить тепловой эффект химической реакции
h3SO3 + Br2 + h3O = h3SO4 + 2HBr + Q
Если при образовании 1,96 гр. h3SO4 выделится 4,5 кДж.
5. С2Н2 + 2,5О2 → 2CO2 + h3O + 1305 кДж.
Какое количество теплоты выделится при сгорании 5,6 л. С2Н2?
6. Вычислить теплоту образования оксида фосфора (пятивалентного), если при сжигании 2 гр. фосфора выделяется 50 кДж.
7. Вычислить теплоту сгорания графита (принимая, что он не содержит примесей) до СО, исходя из следующих данных: С + О2 = СО2 + 393 кДж
СО + ½ О2 = СО2 + 282 кДж.
8. Термохимическое уравнение реакции сгорания ацетилена
2 С2Н2 + 5О2 → 4СО2 + 2Н2О + 2610 кДж.
Сколько теплоты выделится, если будет израсходовано: а) 13 гр. ацетилена; б) 1,12 л. ацетилена; в) 1 моль ацетилена.
9. Определите количество теплоты, выделяющееся при гашении 100 кг. извести водой, если теплоты образования реагирующих веществ равны:
∆Н СаО(к) = — 635,1 кДж; ∆Н Са(ОН)2 (к) = 986,2 кДж; ∆Н Н2О (ж) = — 285,84 кДж.
10. Теплота образования НСI 89,6 кДж/моль. Вычислить сколько теплоты выделится при образовании 1 л. НСI (при н.у.).
11. Вычислить тепловой эффект реакции N2(г) + О2(г) =2NO(г)
если известно, что 2 NO(г) + О2(г) = 2NO2 (г) + 112,94 кДж
N2(г) + 2О2(г) = 2NO2(г) – 67,64 кДж
12. При сжигании серы выделилось 73,48 кДж и получилось при этом 16 гр. SO2.
Вычислить теплоту образования SO2.
13. Реакция идет по уравнению CuO + 2HCI = CuCI2 + h3O + 64 кДж
Определить количество теплоты, которое выделится при взаимодействии 160 гр. CuO.
14. Сколько кДж теплоты выделится при образовании 1 моля SO2, если 5 гр. серы выделяет 45 кДж. Теплоты.
15. Определить сколько теплоты выделится при сгорании 1,15 кг. этилового спирта. Термохимическое уравнение реакции его горения:
С2Н5ОН + 3О2 → 2CO2 + 3h3O + 1379 кДж.
16. Сколько теплоты выделится при взрыве 8,4 л. гремучего газа, если известно, что теплота образования водяного пара равна 242 кДж/моль.
17. Определить теплоту образования закиси азота, исходя из уравнения:
С + 2 N2O = CO2 + 2N2 + 555,9 кДж.
Теплота образования СО2 = 392,9 кДж.
18. Теплота образования углекислого газа 394 кДж/моль. Сколько гр. углекислого газа образовалось, если выделилось 98,5 кДж тепла.
19.При образовании 8,1 гр. хлорида меди (II) выделилось 13,44 кДж. тепла. Вычислить теплоту образования хлорида меди (II).
20. При сжигании 8 гр, серы выделилось 73 кДж. тепла. Определить тепловой эффект реакции горения серы.
Это у нас был урок химии 61 – Задачи на термохимические расчеты.
Friend me:
к нашему сайту.
Решение задач по теме «Количество теплоты»
Просмотр содержимого документа
«Решение задач по теме «Количество теплоты»»
Урок № Тема: Решение задач по теме «Количество теплоты»
Цель урока: отработка практических навыков при решении задач; развитие навыков устного счета.
Ход урока
Решение качественных задач
Почему в пустынях днем жарко, а ночью температура падает ниже 0°С?
По куску свинца и куску стали той же массы ударили молотком одинаковое число раз. Какой кусок нагрелся больше? Почему?
Почему железные печи скорее нагревают комнату, чем кирпичные, но не так долго остаются теплыми?
Медной и стальной гирькам одинаковой массы передали равные количества теплоты. У какой гирьки температура изменится сильнее?
На что расходуется больше энергии: на нагревание воды или на нагревание алюминиевой кастрюли, если их массы одинаковы?
Решение расчетных задач
Целесообразно, если первые две задачи будут решены у доски с возможным коллективным обсуждением. Это позволит определять правильные подходы в рассуждениях и оформлении решения.
Задача 1
При нагревании куска меди от 20°С до 170°С было затрачено 140000 Дж тепла. Определить массу меди.
Задача 2
Чему равна удельная теплоемкость жидкости, если для нагревания 2 л ее на 20°С потребовалось 150000 Дж. Плотность жидкости 1,5 г/см3.

Задача 3
Два медных шара массами т0 и 4т0 нагревают так, что оба шара получают одинаковое количество теплоты. При этом больший шар нагрелся на 5°С. Насколько нагрелся шар меньшей массы?
Задача 4
Какое количество теплоты выделяется при охлаждении 4 м3 льда от -10°С до- 40°С?
Задача 5
В каком случае потребуется для нагревания двух веществ большее количество теплоты, если нагрев двух веществ одинаков  =
=  . Первое вещество — кирпич массы 2 кг и с = 880
. Первое вещество — кирпич массы 2 кг и с = 880 , и латунь масса 2 кг и латунь — масса 2 кг и с = 400
, и латунь масса 2 кг и латунь — масса 2 кг и с = 400 
Задача 6
Стальной брусок массы 4 кг нагрели. При этом было затрачено 200 000 Дж тепла. Определите конечную температуру тела, если начальная температура равна  = 10°С.
= 10°С.
Задача 7
Металлический цилиндр массой 200 г нагрели в кипящей воде до 100 °С и затем опустили в воду массой 400 г, имеющую температуру 22 °С. Через некоторое время температура воды и цилиндра стала равной 25 °С. Какова удельная теплоемкость металла, из которого изготовлен цилиндр? (Потери теплоты не учитывать. Как бы изменился результат, если бы потери были учтены?)

Если бы потери теплоты были учтены, то количество теплоты, отданное горячим цилиндром, было бы больше количества теплоты, полученного холодной водой (часть энергии горячего цилиндра была бы отдана на нагревание внутреннего сосуда калориметра).
Задача 8
Металлический цилиндр массой 250 г, имеющий температуру 20 °С, опущен в кипяток массой 120 г. В конце процесса теплообмена воды и металла температура стала равна 84 °С. Определить по этим данным удельную теплоемкость металла, из которого изготовлен цилиндр.

Домашнее задание: повторить §7 — 9 учебника; № 1024, 1025, 1027.
Решение задач на расчёт количества теплоты, необходимого для нагревания тела или выделяемого им при охлаждении.
План- конспект
открытого урока физики в 8 «Е» классе
МОУ гимназии №77 г. о. Тольятти
учителя физики
Ивановой Марии Константиновны
Тема урока:
Решение задач на расчёт количества теплоты, необходимого для нагревания тела или выделяемого им при охлаждении.
Дата проведения:
19 сентября 2014 года
Цель урока:
отработать практические навыки расчета количества теплоты, необходимого для нагревания и выделяемого при охлаждении;
развивать навыки счёта, совершенствовать логические умения при анализе сюжета задач, решении качественных и расчётных задач;
воспитывать умение работать в парах, уважать мнение оппонента и отстаивать свою точку зрения, соблюдать аккуратность при оформлении задач по физике.
Оборудование урока:
компьютер, проектор, презентация по теме (Приложение №1), материалы единой коллекции цифровых образовательных ресурсов.
Тип урока:
«Суньте палец в пламя от спички, и вы испытаете ощущение, равного которому нет ни на небе, ни на земле; однако все, что произошло, есть просто следствие соударений молекул».
Дж. Уилер
Ход урока:
Организационный момент
Приветствие учащихся.
Проверка отсутствующих учащихся.
Сообщение темы и целей урока.
Проверка домашнего задания.
1. Фронтальный опрос
Что является единицей удельной теплоемкости вещества?
Почему водоемы замерзают медленно? Почему с рек и особенно озер долго не сходит лед, хотя давно стоит теплая погода?
Почему на Черноморском побережье Кавказа даже зимой достаточно тепло?
Почему многие металлы остывают значительно быстрее воды? (Слайд №2)
2. Индивидуальный опрос (карточки с разноуровневыми заданиями для нескольких учащихся)
Изучение новой темы.
1. Повторение понятия количества теплоты.
Количество теплоты — количественная мера изменения внутренней энергии при теплообмене.
Количество теплоты, поглощаемое телом, принято считать положительным, а выделяемое – отрицательным. Выражение «тело обладает некоторым количеством теплоты» или «в теле содержится (запасено) какое- то количество теплоты» не имеет смысла. Количество теплоты можно получить или отдать в каком- либо процессе, но обладать им нельзя.
При теплообмене на границе между телами происходит взаимодействие медленно движущихся молекул холодного тела с быстро движущимися молекулами горячего тела. В результате кинетические энергии молекул выравниваются и скорости молекул холодного тела увеличиваются, а горячего уменьшаются.
При теплообмене не происходит превращения энергии из одной формы в другую, часть внутренней энергии горячего тела передается холодному телу.
2. Формула количества теплоты.
Выведем рабочую формулу, чтобы решать задачи по расчету количества теплоты: Q = cm (t2— t1) — запись на доске и в тетрадях.
Выясняем, что количество теплоты, отданное или полученное телом зависит от начальной температуры тела, его массы и от его удельной теплоемкости.
На практике часто пользуются тепловыми расчетами. Например, при строительстве зданий необходимо учитывать, какое количество теплоты должна отдавать зданию вся система отопления. Следует также знать, какое количество теплоты будет уходить в окружающее пространство через окна, стены, двери.
3. Зависимость количества теплоты от различных величин.(Слайды №3, №4, №5,№6)
4. Удельная теплоёмкость (Слайд №7)
5. Единицы измерения количества теплоты (Слайд №8)
6. Пример решения задачи на расчёт количества теплоты (Слайд №10)
7. Решение задач на расчёт количества теплоты на доске и в тетрадях



Выясняем также, что если между телами происходит теплообмен, то внутренняя энергия всех нагревающихся тел увеличивается на столько, на сколько уменьшается внутренняя энергия остывающих тел. Для этого используем пример решенной задачи из § 9 учебника.

Динамическая пауза.
IV. Закрепление изученного материала.
1. Вопросы для самоконтроля (Слайд №9)
2. Решение качественных задач:
Почему в пустынях днем жарко, а ночью температура падает ниже 0°С ? (Песок обладает малой удельной теплоемкостью, поэтому быстро нагревается и охлаждается.)
По куску свинца и куску стали, той же массы ударили молотком одинаковое число раз. Какой кусок нагрелся больше? Почему? (Кусок свинца нагрелся больше, т. к. удельная теплоемкость свинца меньше.)
Почему железные печи скорее нагревают комнату, чем кирпичные, но не так долго остаются теплыми? (Удельная теплоемкость меди меньше, чем у кирпича.)
Медной и стальной гирькам одинаковой массы передали равные количества теплоты. У какой гирьки температура изменится сильнее? (У медной, т.к. удельная теплоемкость меди меньше.)
На что расходуется больше энергии: на нагревание воды или на нагревание алюминиевой кастрюли, если их массы одинаковы? (На нагревание воды, т. к. удельная теплоемкость воды большая.)
Как известно, железо имеет большую удельную теплоемкость, чем медь. Следовательно, жало пальника, изготовленное из железа, обладало бы большим запасом внутренней энергии, чем такое же жало из меди, при равенстве их масс и температур. Почему, несмотря на это, жало паяльника делают из меди? (Медь обладает большой теплопроводностью.)
Известно, что теплопроводность металла значительно больше теплопроводности стекла. Почему же тогда калориметры делают из металла, а не из стекла? (Металл обладает большой теплопроводностью и малой удельной теплоемкостью, благодаря этому температура внутри калориметра быстро выравнивается, а на нагревание его затрачивается мало тепла. Кроме того, излучение металла значительно меньше излучения стекла, что уменьшает потери тепла.)
Известно, что рыхлый снег хорошо предохраняет почву от промерзания, потому что в нем заключено много воздуха, который является плохим проводником тепла. Но ведь и к почве, не покрытой снегом, прилегают слои воздуха. Отчего же в таком случае она сильно не промерзает? (Воздух, соприкасаясь с непокрытой снегом почвой, все время находится в движении, перемешивается. Этот движущийся воздух отнимает от земли тепло и усиливает испарение из нее влаги. Воздух же, находящийся между частицами снега, малоподвижен и, как плохой проводник тепла, предохраняет землю от промерзания.)
3. Решение расчетных задач
Первые две задачи решаются высокомотивированными учащимися у доски с коллективным обсуждением. Находим правильные подходы в рассуждениях и оформлении решения задач.
Задача №1.
При нагревании куска меди от 20°С до 170°С Было затрачено 140000 Дж тепла. Определить массу меди.
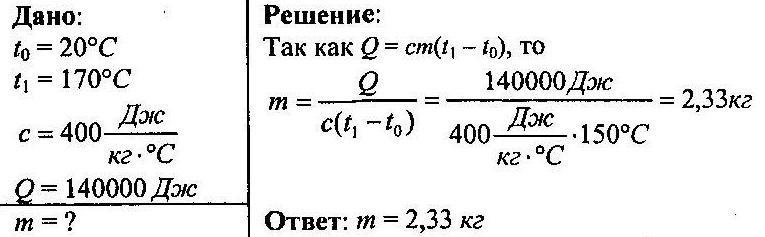
Задача №2
Чему равна удельная теплоемкость жидкости, если для нагревания 2 л её на 20°С потребовалось 150000 Дж. Плотность жидкости 1,5 г/см³
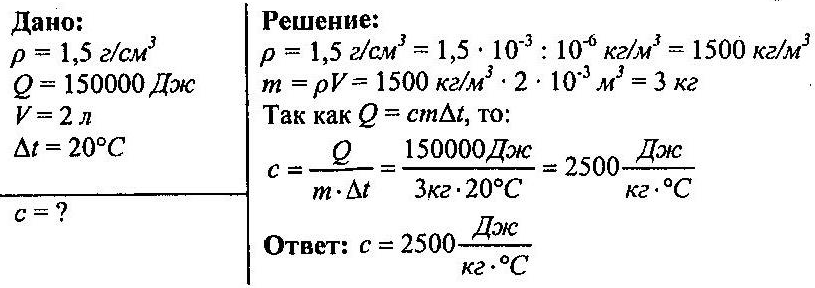
Ответы на следующие задачи учащиеся находят в парах:
Задача №3.
Два медных шара массами mo и 4mo нагревают так, что оба шара получают одинаковое количество теплоты. При этом большой шар нагрелся на 5°C Насколько нагрелся шар меньшей массы?
Задача №4.
Какое количество теплоты выделяется при охлаждении 4 м³ льда от 10°C до– 40°C?
Далее для самостоятельного решения учащимся предлагаются задачи:
Задача №5.
В каком случае потребуется для нагревания двух веществ большее количество теплоты, если нагрев двух веществ одинаков ∆t1 = ∆t2 Первое вещество- кирпич массы 2 кг и с =880Дж/кг ∙ °C , и латунь — масса 2 кг и с = 400 Дж/кг ∙ °C
Задача №6.
Стальной брусок массы 4 кг нагрели. При этом было затрачено 200000 Дж тепла. Определите конечную температуру тела, если начальная температура равна t0 = 10°C
При самостоятельном решении задач у учеников, это естественно, возникают вопросы. Наиболее часто задаваемые вопросы разбираем коллективно. На те вопросы, которые носят частный характер, даются индивидуальные ответы.
Рефлексия. Выставление отметок.
Учитель: Итак, ребята, чему вы сегодня научились на уроке и что узнали нового?
Примерные ответы учащихся:
Отработали навыки решения качественных и расчётных задач по теме «Расчет количества теплоты, необходимого для нагревания тела и выделяемого при охлаждении».
Убедились на практике в том, как перекликаются и связаны такие предметы как физика и математика.
Задание на дом:
Прочитать §9.
Решить задачи № 1024, 1025, из сборника задач В.И. Лукашика, Е. В. Ивановой.
Самостоятельно придумать задачу на расчёт количества теплоты, необходимого для нагревания тела или выделяемого им при охлаждении.