Контрольная работа для 8 класса по теме :»Валентность, типы химических реакций».
Контрольная работа № 1 по теме: «Основные химические понятия»
Вариант № 1
Задание № 1
Какие из перечисленных явлений относят к химическим?
Замерзание воды Таянье льда
Плавление свинца Ржавление гвоздя
Горение газа Плавление алюминия
Поднятие дрожжевого теста Кипение воды
Помутнение микстуры лекарства Плавление воска
Задание № 2
Определите валентность каждого элемента в соединениях?
CO2, SO3, Fe2O3, H2O, PH3, CH4, CaCl2, NH3, CaCO3, Na2SO4, HNO3
Задание № 3
Расставьте коэффициенты в реакции и определите её тип?
H2+N2NH3 CaCO3CaO+CO2
CH4+O2CO2+H
Mn+H2H2O+Mn KClO3KCl+O2
Задание № 4
Составьте формулы соединений серного ангидрида состоящего их атома серы (VI) и кислорода. И сероводородной кислоты, состоящей из водорода и серы (II). Рассчитайте массовые доли каждого элемента в этих соединениях, сравните массовые доли серы в этих соединениях?
Задание № 5
Определите валентность азота в следующих соединениях?
N2O, NO2, HNO3, HNO2
Задание № 6
Предложите схему разделения следующей смеси веществ?
Вода+ Песок + Сахар+ Железные кнопки+ Бензин
Контрольная работа № 1 по теме: «Основные химические понятия»
Вариант № 2
Задание № 1
Какие из перечисленных явлений относят к химическим?
Таянье льда Горение дров
Плавление меди Позеленее памятника
Прогоркание масла Сжижение кислорода
Прокисание молока Испарение спирта
Замерзание воды Плавление стекла
Задание № 2
Определите валентность каждого элемента в соединениях?
SO2, NO2, Al2O3, H2S, Ag2S, CO2, NaCl, MgSi, ZnCO3, Na2SiO3, H2SO4
Задание № 3
Расставьте коэффициенты в реакции и определите её тип?
H2+O2H2O Al+CuCl2Cu+AlCl3
Zn+HClZnCl2+H2 BaCl2+H2SO4BaSO4+HCl
HgOO2+Hg Cl2+H2HCl
Задание № 4
Составьте формулы соединений- оксида азота состоящего их атома азота(IV) и кислорода. И аммиака, состоящего из азота (III) и водорода. Рассчитайте массовые доли каждого элемента в этих соединениях, сравните массовые доли азота в этих соединениях?
Задание № 5
Определите валентность серы в следующих соединениях?
SO, SO2, H2SO3, H2SO4
Задание № 6
Предложите схему разделения следующей смеси веществ?
Вода+ Нефть+ Спирт+ Глина+ Железные опилки
Проверочная работа по теме «Валентность» (8 класс)
Проверочная работа по теме: «Валентность».
Вариант № 1.
1. Составьте формулы следующих соединений:
А) кальция с хлором (I)
Б) магния с азотом (III)
В) калия с кислородом
Г) железа (III) с иодом (I)
Д) кремния (IV) c хлором (I)
2. Определите валентность элементов:
Nb2O5, TiO2 , Mn2O7, SO3 , WO3, CH4
3. Сера образует с водородом соединение H 2S.
Составьте формулы соединений: натрия с серой, алюминия с серой, кальция с серой, в которых сера проявляет такую же валентность, как и с водородом.
4. Выпишите формулы, в которых валентность элемента определена неправильно и определите ее правильно:
II II II IV VIII
Ag2O , CuO , Fe2O3 , SO3 , RuO4
Проверочная работа по теме: « Валентность».
Вариант № 2.
1. Составьте формулы следующих соединений:
А) магния с кремнием (IV)
Б) кальция с фосфором (V)
В) кремния (IV) с кислородом
Г) углерода (IV) с хлором (I)
Д) алюминия с бромом (I)
2. Определите валентность элементов:
Cr2O3 , Re2O7 , TeO3 , SnO2 , In2O3 , OsO4
3. Бром образует с водородом соединение HBr.
4. Выпишите формулы, которые составлены по данным валентностям неправильно и составьте их правильно:
III II IV IV I
AlO , NO , SiO2 , SO3 , ClO2
Тест по теме «Валентность» 8 класс
Тест по теме: Валентность.
Вариант 1
Элемент, атомы которого всегда одновалентны
N 2) K 3) Ca 4) Cl
Валентность магния всегда равна
1 2) 2 3) 3 4) 4
Выберите неверное утверждение. Валентность —
Свойство атомов химического элемента присоединять определённое число атомов других химических элементов
Число, показывающее, сколько атомов водорода может присоединить к себе атом данного элемента
Число, показывающее, сколько атомов кислорода может присоединить к к себе атом данного элемента
Число, полученное от деления суммы единиц валентности на индекс элемента
Валентность углерода в СО2 равна
2 2) 3 3) 4 4) 6
Формула оксида хлора (I)
Cl2O6 2) Cl2O 3) ClO2 4) Cl2O7
Максимальную валентность сера проявляет в соединении
1) H2S 2) SO 2 3) СаS 4) SO3
Элемент, атомы которого могут иметь валентности II, IV, VI
1) N 2) S 3) Si 4) O
Определите валентность фосфора в соединении Ca3P2
1) IV 2) II 3) III 4) V
Вычислите массовую долю серы в соединении CuFeS2
Тест по теме: Валентность.
Вариант 2
Элемент, атомы которого всегда двухвалентны
1) H 2) S 3) Ba 4) Fe
Валентность натрия всегда равна
1) 1 2) 2 3) 3 4) 4
Для определения валентности элемента по валентности другого элемента не требуется знать:
1) Cостав соединения
Валентность второго элемента
Сумму единиц валентности
Относительную молекулярную массу
Валентность фосфора в Р2О5 равна
10 2) 3 3) 5 4) 6
Формула оксида меди (II)
1) Cu2O 2) CuO 3) Cu2O2 4) Cu2O3
Максимальную валентность азот проявляет в соединении
1) NH3 2) NO 2 3) N2O5 4) N2O
Элемент, атомы которого могут иметь валентности II, III
1) Cu 2) Fe 3) Ca 4) Al
Определите валентность серы в соединении Al2S3
1) I 2) II 3) VI 4) IV
Вычислите массовую долю серы в соединении Cu5FeS4
Тест по теме: Валентность.
Вариант 3
Элемент, атомы которого всегда трёхвалентны
1) Р 2) Al 3) Fe 4) N
Валентность водорода всегда равна
1) 1 2) 2 3) 3 4) 4
В бинарных соединениях (состоящих из двух элементов)
1) Валентность атома одного элемента всегда должна быть равна валентности атома другого элемента
Число всех атомов одного элемента должно быть равно числу атомов другого элемента
Сумма всех единиц валентности атомов одного элемента должна быть равна сумме всех единиц валентности атомов другого элемента
Число всех атомов одного элемента должно быть равно числу атомов другого элемента
Валентность азота в NО2 равна
1) 2 2) 3 3) 4 4) 6
Формула оксида фосфора (III)
1) P2O5 2) P2O 3) P2O3 4) P2O7
Минимальную валентность сера проявляет в соединении
1) SF6 2) SO 2 3) СаS 4) SO3
Элемент, атомы которого могут иметь валентности II, IV, VI
1) P 2) S 3) C 4) O
Определите валентность хлора в соединении Cl2O5
1) IV 2) II 3) III 4) V
Вычислите массовую долю серы в соединении Na2SO4
Тест по теме: Валентность.
Вариант 4
Элемент, атомы которого всегда двухвалентны
1) Al 2) O 3) Cu 4) Fe
Валентность бария всегда равна
1) 1 2) 2 3) 3 4) 4
Максимальная валентность элемента обычно равна:
1) Атомной массе
Номеру группы в Периодической системе элементов Д.И. Менделеева
Номеру периода в Периодической системе элементов Д.И. Менделеева
Порядковому номеру в Периодической системе элементов Д.И. Менделеева
Валентность фосфора в РН3 равна
1 2) 3 3) 5 4) 6
Формула оксида меди (I)
1) Cu2O 2) CuO 3) Cu2O2 4) Cu2O3
Минимальную валентность азот проявляет в соединении
1) NH3 2) NO 2 3) N2O5 4) N2O
Элемент, атомы которого могут иметь валентности I, II
1) Cu 2) Fe 3) Ca 4) Al
Определите валентность азота в соединении N2O3
1) I 2) II 3) III 4) IV
Вычислите массовую долю серы в соединении CuSO4
Урок 7-8 класс, закрепление умений и навыков составления формул по валентности и определения валентности по формуле соединения
Составление формул бинарных соединений по валентности атомов элементов. Определение валентности по формулам бинарных соединений.
Цель:
Формирование умений на основании знаний валентности составлять химические формулы бинарных соединений и по формулам определять валентности атомов химических элементов.
Обобщить и углубить знания о содержании химической формулы, составе простых и сложных веществ.
Тип урока:
Урок углубления и систематизации знаний.
Формы работы:
Фронтальная беседа, групповая и индивидуальная работа по карточкам-заданиям.
Оборудование:
Периодическая система химических элементов.
Ход урока:
Организация класса к уроку.
Проверка домашнего задания (в форме переклички)
Усвоение и закрепление знаний.
1) На доске (или на экране интерактивной доски) предварительно записаны формулы соединений. По цепочке учащиеся выходят к доске и определяют валентности атомов:
ClI S II ОII NIII
CaCl2 Li2S Na2O Na3N
AlCl3 BaS MgO Zn3N2
KCl PbS2 Cr2O3 C3N4
PCl5 Al2O3 SiO2 CrN
SiCl4 CS2 Аs2O5 Mg3N2
2) Для выполнения следующего задания объединяем учащихся в группы по 3-4 ученика (или в пары исходя из количества учащихся и возможностей класса с учетом необходимости консультирования учителем работы каждой группы).
Задание: выбрать в периодической системе 3 атома для которых валентность в соединении с кислородом может быть равна:
1 группа – I; 2 группа – II; 3 группа – III; 4 группа – IV; и составить формулы этих веществ согласно их валентности.
Представитель группы записывает свой вариант ответа на доске (или группы обмениваются выполненными заданиями для взаимопроверки). Следующая группа исправляет, дополняет и комментирует ответ предыдущей группы.
Углубление и систематизация знаний.
1) ?Если мы знаем валентность атомов, то можем составить формулу соединения?
2) ?Каким правилом мы должны воспользоваться при составлении химической формулы?
/Сумма единиц валентности атомов одного элемента равна сумме единиц валентности атомов другого элемента в бинарном соединении/
3) ?Как можно уравнять единицы валентности элемента?
/Изменить соответственно количество атомов в молекуле при помощи индекса/
В данном случае сумма единиц валентности – это наименьшее общее кратное валентности элемента и количества этих атомов.
Попробуем использовать эти положения на примере:
III II
Al O
НОК = 6
Следовательно дополнительный множитель для Al – 2,
дополнительный множитель для О – 3
а значит формула соединения Al2O3
4) Группы получают карточки – задания — Составить формулы бинарных соединений по известным валентнастям атомов, входящих в состав этих соединений:
I II III I II I III II VI II
1 группа: K O; N H; Zn Cl; Al S; S O;
III I IV II II III III I V II
2 группа: Cr Cl; S O; Ca N; P H; N O;
IV I III II I II II III V I
3 группа: C Br; Fe O; Na S; Ca N; P Cl;
V II II I II II IV I III II
4 группа: P O; Pb Cl; Ba S; Si H; N O;
Группы под руководством учителя обсуждают, выполняют задание, записывают ответы на доске, корректируют ответы.
5) Химические формулы – «химические слова», составляются не произвольно, а в строгом соответствии с правилами. Смысл химической формулы значительно глубже, чем только качественный и количественный состав.
Химическая формула показывает, какие атомы входят в состав того или иного вещества, как атомы химических элементов связаны между собой, в каком количественном соотношении. Частично ответить на этот вопрос помогает понятие валентность.
Вспомним:
1) Как можно определить валентность атома?
2) Как составить химическую формулу зная, валентность атома?
”Крестики — нолики“.
Выигрышный путь – І валентные металлы
K2O Fe2O3 Al2O3
SO3 Na2O CO2
CO SiO2 Cu2O
Выигрышный путь ІІІ – валентные металлы
K2O Fe2O3 SnO2
Li2O Al2O3 SO3
Cl2O7 Cr2O3 ZnO
Экспресс – опрос (индивидуальная работа учащихся письменно по вариантам или устно на экране)
Вариант І
1) В периодической системе группы это:
а) вертикальные столбцы;
б) диагонали;
в) горизонтальные ряды;
2) Химический символ Фосфора:
а) Si;
б) H;
в) S;
г) P;
3) Относительная атомная масса Карбона:
а) 16;
б) 8;
в) 12;
г) 6;
4) В формуле Н2, цифра 2 называется:
а) индекс;
б) коэффициент;
в) множитель;
5) Формулы простых веществ:
а) NaCl;
б) Cu;
в) O2;
г) CO2
6) К элементам металлам относятся:
а) Cu;
б) Na;
в) Br;
г) C;
7) Валентность Оксигена в соединениях:
а) І;
б) ІІ;
в) ІІІ;
8) Валентность атома металла равна ІІІ в соединении
а) MnO2;
б) Mn2O7;
в) Mn2O3;
г) MnO;
9) Валентность Нитрогена в соединении N2O равна:
а) 4;
б) 3;
в) 2;
г) 1;
10) Составьте формулу соединения по валентности:
Mg(II) N(III)
Вариант ІI
1) В периодической системе периоды это:
а) вертикальные столбцы;
б) диагонали;
в) горизонтальные ряды;
2) Химический символ Сульфура:
а) Si;
б) H;
в) S;
г) P;
3) Относительная атомная масса Оксигена:
а) 16;
б) 8;
в) 12;
г) 6;
4) В записи 2О3, цифра 2 называется:
а) индекс;
б) коэффициент;
в) множитель;
5) Формулы сложных веществ:
а) NaCl;
б) Cu;
в) O2;
г) CO2
6) К элементам неметаллам относятся:
а) Cu;
б) Na;
в) Br;
г) C;
7) Валентность Гидрогена в соединениях:
а) І;
б) ІІ;
в) ІІІ;
8) Валентность атома металла равна IV в соединении
а) MnO2;
б) Mn2O7;
в) Mn2O3;
г) MnO;
9) Валентность Нитрогена в соединении N2O3 равна:
а) 4;
б) 3;
в) 2;
г) 1;
10) Составьте формулу соединения по валентности:
As(V) O(II)
Проверяем ответы по ключу на экране (или на доске), обсуждаем ошибки и выставляем оценки за урок.
Домашнее задание.
Валентность. 8 класс. Химия
Учитель. Проверим правильность выполнения задания. Каждая команда представляет свои варианты. Выставим баллы каждой команде.3. Изучение новых знаний
Задание 1: дана общая формула соединения водорода с каким-либо элементом
Э Нn.
Зная, что валентность водорода равна I, определите валентность элемента.
Ребята работают парами, при необходимости объединяются в четвёрки, спорят, совещаются. Придя к какому-то мнению, предлагают свой аргументированный вариант ответа. В результате получаем схему №1
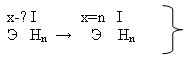 схема 1
схема 1
Задание для закрепления:
определите валентности элементов в соединениях с водородом: PH3, HF, H2S, CaH2,
назовите соединения.
Учитель. Проверим правильность выполнения задания. Каждая команда представляет свои варианты. Выставим баллы каждой команде.
Задание 2: таким же способом можно определить валентности элементов в соединениях с кислородом зная, что кислород двухвалентен. Например:
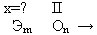
Ребята работают командами, спорят, совещаются. Придя к какому-то мнению, предлагают свой аргументированный вариант ответа. В результате получаем схему №2
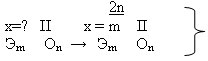 схема 2
схема 2
Задание для закрепления:
определите валентности элементов в соединениях с кислородом:
NO2, N2O5, SO2, SO3, Cl2O7.
Как называются бинарные соединения, содержащие кислород?
Учитель. Проверим правильность выполнения задания. Каждая команда представляет свои варианты. Выставим баллы каждой команде.
Задание 3: что же нужно обязательно знать, чтобы определить валентность элементов в бинарном соединении? (валентность одного из элементов)
Определите валентность атомов в соединении
x-? a
Ym Zn ->
Ребята работают парами, спорят, совещаются. Придя к какому-то мнению, предлагают свой аргументированный вариант ответа. В результате получаем схему №3
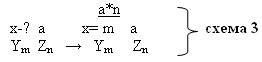
Учитель: какая из полученных нами схем
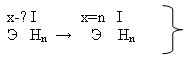 схема 1
схема 1
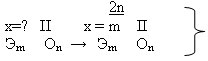 схема 2
схема 2
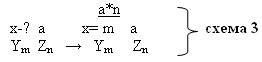
наиболее полно отражает правило определения валентности по формуле? (схема 3, т.к.она отражает общий случай, а схемы 1 и 2 лишь частные)
Учитель. Каждая команда представляет свои варианты. Выставим баллы каждой команде.
4. Закрепление изученного материала.
Самостоятельная работа
Проверьте, правильно ли написаны формулы следующих соединений: Na2S, KBr, Al2O3, Mg3N2, MgO.
Учитель. Каждая команда представляет свои варианты. Выставим баллы каждой команде.
5. Обобщение и систематизация знаний.
Творческая работа в группах
Задание 4. Используя наборы для составления моделей молекул различных веществ, составьте формулы и модели молекул для следующих соединений:
1-я группа – меди и кислорода,
2-я группа – цинка и хлора,
3-я группа – калия и йода,
4-я группа – магния и серы.
После окончания работы один учащийся из группы отчитывается о выполненном задании и вместе с классом проводит анализ ошибок.
Учитель. Каждая команда представляет свои варианты. Выставим баллы каждой команде.
Задание5 . Напишите формулы соединений металлов с неметаллами: кальция с кислородом, алюминия с хлором, натрия с фосфором. Назовите эти соединения.
Учитель. Каждая команда представляет свои варианты. Выставим баллы каждой команде.
Подведем итоги нашей с вами работы, подсчитаем баллы каждой команды.
Команда победитель – 5
Остальные команды – 4
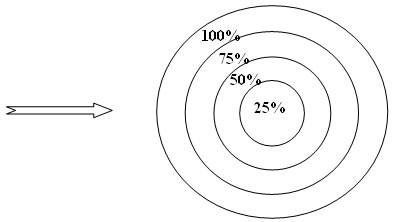
6. Рефлексия
У Вас есть возможность сделать самооценку своей деятельности на уроке. Вам предлагается “Мишень эффективности”.
Отметьте свои знания по новой теме, отметив на рисунке соответствующий им сектор штриховкой. Сдайте свои записи.
7. Домашнее задание. По учебнику “Химия-8” (УМК Кузнецова Н.Е. и др.) § 14, упражнение1-71 обязательное (дополнительные с 1-72 по 1-74).
Сообщения о французском ученом Ж.Л.Прусте и английском ученом Дж.Дальтоне.
Литература
Кузнецова Н.Е. и др. Химия: Учебник для учащихся 8 класса общеобразовательных учреждений.- М.: Вентана-Граф, 2010. – 320с.: ил.
Кузнецова Н.Е., Шаталов М.А. Обучение химии на основе межпредметной интеграции: 8-9 классы: Учебно-методическое пособие.- М.: Вентана-Граф, 2004. – 352с.
Емельянова Е.О., Иодко А.Г. Организация познавательной деятельности учащихся на уроках химии в 8-9 классах. Опорные конспекты с практическими заданиями, тестами: В 2-х частях. Часть I.– М.: Школьная пресса, 2002.- 144с.
Кузнецова Л.М. Новая технология обучения химии в 8 классе.- Обнинск: Титул,1999.- 208с.:ил
Валентность химических элементов — Химия
Тема урока: Валентность химических элементов. Определение валентности элементов по формулам их соединений
Цели урока.
Дидактические:
опираясь на знания учащихся, повторить понятия “химическая формула”;
способствовать формированию у учащихся понятия “валентность” и умению определять валентность атомов элементов по формулам веществ;
акцентировать внимание школьников на возможности интеграции курсов химии, математики.
Развивающие:
продолжить формирование умений формулировать определения;
разъяснять смысл изученных понятий и объяснять последовательность действий при определении валентности по формуле вещества;
способствовать обогащению словарного запаса, развитию эмоций, творческих способностей;
развивать умение выделять главное, существенное, сравнивать, обобщать, развивать дикцию, речь.
Воспитательные:
воспитывать чувство товарищества, умение работать коллективно;
повысить уровень эстетического воспитания учащихся;
ориентировать учащихся на здоровый образ жизни.
Планируемые результаты обучения:
Учащиеся должны уметь формулировать определение “валентность”, знать валентность атомов водорода и кислорода в соединениях, определять по ней валентность атомов других элементов в бинарных соединениях,
Уметь разъяснять смысл понятия “валентность” и последовательность действий при определении валентности атомов элементов по формулам веществ.
Понятия, впервые вводимые на уроке: валентность, постоянная и переменная валентность.
Организационные формы: беседа, индивидуальные задания, самостоятельная работа.
Средства обучения: алгоритм определения валентности.
Демонстрационное оборудование: шаростержневые модели молекул хлороводорода, воды, аммиака, метана.
Оборудование для учащихся: на каждом столе “Алгоритм определения валентности”.
Ход урока
I. Ориентировочно-мотивационный этап.
1. Фронтальная беседа с учащимися по пройденной теме “Химическая формула”.
Задание: Что здесь написано? (Демонстрация учителем формул, отпечатанных на отдельных листах).
2. Индивидуальная работа по карточкам трёх учащихся по теме “Относительная молекулярная масса”. (Выполняют решение на доске). Проверка учителем.
Карточка № 1. Рассчитайте относительную молекулярную массу данных веществ: NaCl, K2O.
Карточка № 2. Рассчитайте относительную молекулярную массу данных веществ: CuO, SO2.
Карточка № 3. Рассчитайте относительную молекулярную массу данных веществ: CH4, NO.
3. Самостоятельная работа учащихся в тетрадях.
Задача информационно-вычислительного характера (условие записано в раздаточном материале).
Эффективность зубных паст в профилактике кариеса можно сравнить по содержанию в них активного фтора, способного взаимодействовать с зубной эмалью. Зубная паста “Crest” (производство США) содержит, как указано на упаковке, SnF2, а зубная паста “FM extra DENT” (производство Болгария) содержит NaF. Вычислите, какая из этих двух паст более сильнодействующее средство для профилактики кариеса.
Проверка: один учащийся устно читает решение.
II. Операционно-исполнительный этап.
1. Объяснение учителя. Постановка проблемы.
Понятие о валентности.
– До сих пор мы пользовались готовыми формулами, приведёнными в учебнике. Химические формулы можно вывести на основании данных о составе веществ. Но чаще всего при составлении химических формул учитываются закономерности, которым подчиняются элементы, соединяясь между собой.
Задание: сравните качественный и количественный состав в молекулах: HCl , H2O, NH3, CH4.
Беседа с учащимися:
– Что общего в составе молекул?
Предполагаемый ответ: Наличие атомов водорода.
– Чем они отличаются друг от друга?
Предполагаемый ответ:
HCl – один атом хлора удерживает один атом водорода,
H2O – один атом кислорода удерживает два атома водорода,
NH3 – один атом азота удерживает три атома водорода,
CH4 – один атом углерода удерживает четыре атома водорода.
Демонстрация шаростержневых моделей.
Проблема: Почему различные атомы удерживают различное количество атомов водорода?
(Выслушиваем варианты ответов учащихся).
Вывод: У атомов разная способность удерживать определённое количество других атомов в соединениях. Это и называется валентностью. Слово “валентность” происходит от лат. valentia – сила.
Запись в тетради:
Валентность – это свойство атомов удерживать определённое число других атомов в соединении.
Валентность – это свойство атома химического элемента присоединять или замещать определенное число атомов другого химического элемента.
Валентность обозначается римскими цифрами.
Записи на доске и в тетрадях:
I I | I II | I III | I IV |
Валентность атома водорода принята за единицу, а у кислорода – II.
2. Эволюция понятия “валентность”.
– В начале XIX века Дж. Дальтоном был сформулирован закон кратных отношений, из которого следовало, что каждый атом одного элемента может соединяться с одним, двумя, тремя и т.д. атомами другого элемента (как, например, в рассмотренных нами соединениях атомов с водородом).
В середине XIX века, когда были определены точные относительные веса атомов (И.Я. Берцелиус и др.), стало ясно, что наибольшее число атомов, с которыми может соединяться данный атом, не превышает определённой величины, зависящей от его природы. Эта способность связывать или замещать определённое число других атомов и была названа Э.Франклендом в 1853 г. “валентность”.
Поскольку в то время для водорода не были известны соединения, где он был бы связан более чем с одним атомом любого другого элемента, атом водорода был выбран в качестве стандарта, обладающего валентностью, равной 1.
В конце 50-х гг. XIX вeка А.С. Купер и А.Кекуле постулировали принцип постоянной четырёхвалентности углерода в органических соединениях. Представления о валентности составили важную часть теории химического строения А.М. Бутлерова в 1861 г.
Периодический закон Д.И. Менделеева в 1869 г. вскрыл зависимость валентности элемента от его положения в периодической системе.
Вклад в эволюцию понятия “валентность” в разные годы внесли В.Коссель, А.Вернер, Г.Льюис.
Начиная с 30-х гг. XX века представления о природе и характере валентности постоянно расширялись и углублялись. Существенный прогресс был достигнут в 1927 г., когда В.Гейтлер и Ф.Лондон выполнили первый количественный квантово-химический расчёт молекулы водорода H2.
3. Определение валентности атомов элементов в соединениях.
Правило определения валентности: число единиц валентностей всех атомов одного элемента равно числу единиц валентности всех атомов другого элемента.
Алгоритм определения валентности.
Алгоритм определения валентности | Пример | |
1. Запишите формулу вещества. | H2S, Cu2O | |
2. Обозначьте известную валентность элемента | I | II |
3. Найдите число единиц валентности атомов известного элемента, умножив валентность элемента на количество его атомов | 2 | 2 |
4. Поделите число единиц валентности атомов на количество атомов другого элемента. Полученный ответ и является искомой валентностью | 2 | 2 |
5. Сделайте проверку, то есть подсчитайте число единиц валентностей каждого элемента | I II | I II |
4. Упражнение: определить валентность элементов в веществах (тренажёр: ученики цепочкой выходят к доске). Задание в раздаточном материале.
SiH4, CrO3, H2S, CO2, CO, SO3, SO2, Fe2O3, FeO, HCl, HBr, Cl2O5, Cl2O7, РН3, K2O, Al2O3, P2O5, NO2, N2O5, Cr2O3, SiO2, B2O3, SiH4, Mn2O7, MnO, CuO, N2O3.
III. Оценочно-рефлексивный этап.
Первичная проверка усвоения знаний.
В течение трёх минут необходимо выполнить одно из трёх заданий по выбору. Выбирайте только то задание, с которым вы справитесь. Задание в раздаточном материале.
Репродуктивный уровень (“3”). Определите валентность атомов химических элементов по формулам соединений: NH3, Au2O3, SiH4, CuO.
Прикладной уровень (“4”). Из приведённого ряда выпишите только те формулы, в которых атомы металлов двухвалентны: MnO, Fe2O3 , CrO3, CuO, K2O, СаH2.
Творческий уровень (“5”). Найдите закономерность в последовательности формул: N2O, NO, N2O3 и проставьте валентности над каждым элементом.
Проверка выборочная. Работа над ошибками. Ответы на обратной стороне доски.
IV. Подведение итогов урока.
Беседа с учащимися:
Какую проблему мы поставили в начале урока?
К какому выводу мы пришли?
Дать определение “валентности”.
Чему равна валентность атома водорода? Кислорода?
Как определить валентность атома в соединении?
Оценка работы учащихся в целом и отдельных учащихся.
Домашнее задание: §11,12 в.1-3 с.37.
– Благодарю за урок. До свидания.