Задания по Валентность для 7 класса
Задания по Валентности
ВАРИАНТ 1
1. Составьте формулы бинарных соединений по их валентности:
I I II
А)CaO Б) KBr В) ZnCl Г) PbO
IV I III III
Д) S O Е) NaCl Ж) Fe O З) Al N
2. Определите валентность по формулам:
А) P2 O5 Б) K2O В) HCl Г) Na2S
Д) CaCl2 Е) Cu2O Ж) NO З) SO3
ВАРИАНТ 2
1. Составьте формулы бинарных соединений по их валентности:
II I III
А) CO Б) Zn Br В) HO Г) P H
II IV
Д) Al O Е) K S Ж) Mg O З) Si O
2. Определите валентность по формулам:
А) Na3 N Б) Ni2 O3 В) Cl2 O5 Г) Mg F2
Д) HI Е) Al2 S3 Ж) Cr2 O3 З) CO2
ВАРИАНТ 3
1. Составьте формулы бинарных соединений по их валентности:
I I IV
А) Mg Cl Б) Na O В) Ag O Г) C H
III II III I
Д) P O Е) H S Ж) Fe Cl З) H F
2. Определите валентность по формулам:
А) BaO Б) CO2 В) CaS Г) CrO3
Д) Zn3 N2 Е) Fe2 O3 Ж) ZnO З) Br2 O5

Урок химии. Определение валентности элементов по формулам бинарных соединений.
IIAl2O3
3. Делением суммы валентностей другого атома на количество его атомов в формуле вещества находим валентность каждого атома: VI делённое на два атома равно III.
Следовательно, валентность каждого атома алюминия в соединении равна III.
4. Записываем валентность другого атома в формуле соединения римской цифрой над знаком элемента
III II
Al2O3
Ф И З К У Л Ь Т М И Н У Т К А
6. Первичное закрепление изученного материала.
6.1. Упражнение-тренажер (два ряда-варианта работают эстафетой у доски, один ряд-вариант работает на месте с последующим отчётом с тетрадкой у доски, задания распечатаны на каждую парту и по одному из варианта для работы у доски, раздаются на первую парту каждого ряда одновременно. После выполнения одной формулы мелок и карточка-задание передаются следующему участнику эстафеты, приложение 5).
Вариант 1. Определите валентности атомов элементов по формулам:
CO, CO2, H2S, SiO2, B2O3, HCl, Li2O, PH3, P2O5
Вариант 2. Определите валентности атомов элементов по формулам:
CH4, Fe2O3, FeO, K2O, Cl2O7, H2O, SO3, SO2, HBr
Вариант 3. Определите валентности атомов элементов по формулам:
Na2O, HJ, Mn2O7, NH3, N2O3, SiH4, CrO, Cr2O3, CuO
7. Закрепление, обсуждение и коррекция изученного материала.
Обсуждение правильности выполнения заданий эстафеты, поиск ошибок и причин допущенных ошибок.
Один или двое обучающихся из числа работавших на месте записывают на доске ответы своего задания с комментированием ответов.
8. Оценочно-рефлексивный этап.
В течение 3-х минут необходимо выполнить одно из трёх заданий (по выбору обучающихся), (задания распечатаны на каждую парту, приложение 6).
Выберите только то задание, с которым вы справитесь за 3 минуты.
на «3». Определите валентность атомов химических элементов по формулам соединений: Cu2O, PH3, Au2O3, SiH4
на «4». Из приведённого ряда формул выпишите только те, в которых атомы металлов проявляют валентность II: Fe2O3, BaO, K2O, CuO, CaH2, CrO3, ZnO
на «5». Найдите закономерность в последовательности формул и проставьте валентности над знаком атома элемента: N2O5, NO2, N2O3, NO, N2O
9. Подведение итогов занятия.
Подводится итог-обобщение изученного на уроке материала.
Объявление оценок, полученных обучающимися за урок.
10. Задаётся и объясняется домашнее задание.
— Ребята! Запишите, пожалуйста, домашнее задание к следующему уроку (задание появляется на мультимедиа доске или записано на обороте обычной доски):
Учить §16 (с.57, 58) (определение валентности элементов по формулам их
соединений), упражнение 5(с.58) выполнить.
Подготовить сообщение «Жизнь и научная деятельность М.В. Ломоносова» или
«Жизнь и научная деятельность Дж. Дальтона».
— До свидания, ребята! Спасибо за хорошую работу на уроке.
Приложение 1
Задание 1. Составьте формулы следующих оксидов: оксид натрия, оксид алюминия, оксид магния, оксид фосфора (V).
Задание 2. Составьте формулы хлоридов (I) и сульфидов (II) калия, железа (III).
Задание 3. Составьте формулы оксидов азота, если атом азота проявляет переменную валентность от I до V.
Приложение 2
Фронтальная беседа по вопросам:
1. Дайте определение понятию «Химическая формула». Приведите примеры.
2. Дайте определение понятию «Валентность атомов». Приведите примеры.
3. Перечислите атомы элементов, проявляющие постоянную валентность.
4. Перечислите пункты алгоритма составления формулы бинарных соединений по валентности атомов.
5. Какие сведения можно получить по химической формуле вещества?
6. Какие вещества называют «оксиды»? Приведите примеры.
Приложение 3
Игра «Третий лишний».
Выберите по формулам третье лишнее вещество в каждом ряду. Укажите причину Вашего выбора.
А. FeO, ZnO, CaCl2.
Б. AlCl3, MgCl2, BaCl2.
В. MnO2, P2O5, MnO2.
Г. MgO, Na2SO4, K2S.
Приложение 4
Алгоритм определения валентности атомов элементов по формуле бинарного соединения.
1. Записываем формулу вещества и определяем атом элемента, проявляющий постоянную валентность (чаще всего это кислород (II) или водород (I)).
II
Al2O3
2. Определяем сумму валентностей атомов кислорода в соединении: валентность II умножаем на количество атомов 3 равно VI.
Следовательно, на атомы алюминия также приходится сумма валентностей VI.
- II
Al2O3
3. Делением суммы валентностей другого атома на количество его атомов в формуле вещества находим валентность каждого атома: VI делённое на два атома равно III.
Следовательно, валентность каждого атома алюминия в соединении равна III.
4. Записываем валентность другого атома в формуле соединения римской цифрой над знаком элемента
III II
Al2O3
Приложение 5
Упражнение-тренажер.
Вариант 1. Определите валентности атомов элементов по формулам:
CO, CO2, H2S, SiO2, B2O3, HCl, Li2O, PH3, P2O5
Вариант 2. Определите валентности атомов элементов по формулам:
CH4, Fe2O3, FeO, K2O, Cl2O7, H2O, SO3, SO2, HBr
Вариант 3. Определите валентности атомов элементов по формулам:
Na2O, HJ, Mn2O7, NH3, N2O3, SiH4, CrO, Cr2O3, CuO
Приложение 6
Оценочно-рефлексивный этап.
Выберите только то задание, с которым вы справитесь за 3 минуты.
на «3». Определите валентность атомов химических элементов по формулам соединений: Cu2O, PH3, Au2O3, SiH4
на «4». Из приведённого ряда формул выпишите только те, в которых атомы металлов проявляют валентность II: Fe2O3, BaO, K2O, CuO, CaH2, CrO3, ZnO
на «5». Найдите закономерность в последовательности формул и проставьте валентности над знаком атома элемента: N2O5, NO2, N2O3, NO, N2O
Урок-игра по теме «Валентность химических элементов»
Урок по теме «Валентность химических элементов. Химическая формула»
Тип урока: ОБОБЩАЮЩИЙ.
Вид урока: УРОК-ИГРА.
Цели урока:
— закрепить и обобщить знания учащихся по изученной теме, развивать умение применять полученные знания при составлении формул бинарных соединений по валентности и определении валентности атомов химических элементов по формулам бинарных соединений, а также при проведении вычислений по химическим формулам;
— продолжить формирование навыков коллективной работы, воспитывать потребность во взаимопомощи, ответственность не только за свои знания, но и за знания товарищей;
— продолжить формирование стойкого позитивного интереса к предмету.
Оборудование: цветные карточки с заданиями для участников, песочные часы.
Учащиеся делятся на 5 команд по 5-6 участников. В каждой команде есть консультант. Заранее назначенный и прошедший инструктаж. Его задача — получить для своей команды набор карточек с определенным заданием, распределить карточки среди участников , при необходимости оказать помощь, поставить заработанные баллы в лист учета, передать отработанные карточки другой команде, получить новый комплект карточек.
Команды садятся за 5 столов и передают задания по кругу.
Задание1. «Вспоминай-ка»
А. 1.Что изучает химия?
2.Что показывает индекс, коэффициент?
3.Что такое относительная атомная масса?
Б. 1.Что такое тело, вещество? Приведите примеры.
2.Что такое химическая формула?
3.Что такое атом, молекула?
В.1.Что такое чистое вещество? Приведите примеры.
2.Что такое химический элемент?
3.Что показывает относительная молекулярная масса?
Г. 1.Что такое сложное вещество? Приведите примеры.
2.Что такое валентность?
3.Как определить валентность элемента в бинарном соединении.
Д. 1.Что такое простое вещество? Приведите примеры
2.Чем отличаются простые и сложные вещества?
3.У каких элементов валентность постоянная.
Задание 2. « Составляй-ка»
Составьте формулы оксидов указанных элементов.
А .Na, S(IV), Fe(III), N(II), Ca
Б. Mg, N(V), K, B, Si(IV)
В. S(IV), Zn, N( III), H, P(V)
Г. Al, Cu(II), N(I), Ba, Cr(VII)
Д. Ag, P(III), Cr(II), N(IV), Na.
Определите валентность химических элементов по формулам соединений.
А. CH4, SnO2, Na2S, HF, SO2
Б. HCl, Br2O7, ZnS, PH3 , Ag2O
В. NH3, Cr2O3, K2O, CO, HBr
Г. H2S, Au2O3, PbO2 ,SiH4, CrO3
Д. Ph4, CrO, SiO2 ,N2O5, Cu2O.
Задание 4. «Рассчитай-ка»
По химической формуле определите:
а) качественный и количественный состав молекулы;
б) относительную молекулярную массу;
в) валентность каждого химического элемента
А.NO , Б.SO 3, В.CO , Г.SO2 , Д.CO2
Задание 5.
Составьте структурную формулу вещества. Изготовьте шаростержневую модель молекулы .
А.NH3, Б.SiH4, В.H2S, Г.HCl, Д.CO2.
Каждое правильно выполненное задание оценивается в 3 балла. Таким образом, максимально возможное число баллов для каждого участника 0-15. Результаты работы консультант заносит в лист учета (см. таблицу) в конце урока. Исходя из суммы баллов, выставляет всем отметки:
14-15 баллов-«5» ,11-13 баллов-«4» ,8-10 баллов- «3».
Лист учета
Работа по химии на тему «Определение валентности элементов по формулам их соединений «
Тема урока: Валентность химических элементов. Определение валентности элементов по формулам их соединений
Цели урока.
Дидактические:
опираясь на знания учащихся, повторить понятия “химическая формула”;
способствовать формированию у учащихся понятия “валентность” и умению определять валентность атомов элементов по формулам веществ;
акцентировать внимание школьников на возможности интеграции курсов химии, математики.
Развивающие:
продолжить формирование умений формулировать определения;
разъяснять смысл изученных понятий и объяснять последовательность действий при определении валентности по формуле вещества;
способствовать обогащению словарного запаса, развитию эмоций, творческих способностей;
развивать умение выделять главное, существенное, сравнивать, обобщать, развивать дикцию, речь.
Воспитательные:
воспитывать чувство товарищества, умение работать коллективно;
повысить уровень эстетического воспитания учащихся;
ориентировать учащихся на здоровый образ жизни.
Планируемые результаты обучения:
Учащиеся должны уметь формулировать определение “валентность”, знать валентность атомов водорода и кислорода в соединениях, определять по ней валентность атомов других элементов в бинарных соединениях,
Уметь разъяснять смысл понятия “валентность” и последовательность действий при определении валентности атомов элементов по формулам веществ.
Понятия, впервые вводимые на уроке: валентность, постоянная и переменная валентность.
Организационные формы: беседа, индивидуальные задания, самостоятельная работа.
Демонстрационное оборудование: шаростержневые модели молекул хлороводорода, воды, аммиака, метана.
Оборудование для учащихся: на каждом столе “Алгоритм определения валентности”.
Ход урока
I. Ориентировочно-мотивационный этап.
1. Фронтальная беседа с учащимися по пройденной теме “Химическая формула”.
Задание: Что здесь написано? (Демонстрация учителем формул, отпечатанных на отдельных листах).
2. Индивидуальная работа по карточкам трёх учащихся по теме “Относительная молекулярная масса”. (Выполняют решение на доске). Проверка учителем.
Карточка № 1. Рассчитайте относительную молекулярную массу данных веществ: NaCl, K2O.
Карточка № 2. Рассчитайте относительную молекулярную массу данных веществ: CuO, SO2.Карточка № 3. Рассчитайте относительную молекулярную массу данных веществ: CH4, NO.
3. Самостоятельная работа учащихся в тетрадях.
Задача информационно-вычислительного характера (условие записано в раздаточном материале).
Эффективность зубных паст в профилактике кариеса можно сравнить по содержанию в них активного фтора, способного взаимодействовать с зубной эмалью. Зубная паста “Crest” (производство США) содержит, как указано на упаковке, SnF2, а зубная паста “FM extra DENT” (производство Болгария) содержит NaF. Вычислите, какая из этих двух паст более сильнодействующее средство для профилактики кариеса.
Проверка: один учащийся устно читает решение.
II. Операционно-исполнительный этап.
1. Объяснение учителя. Постановка проблемы.
Понятие о валентности.
– До сих пор мы пользовались готовыми формулами, приведёнными в учебнике. Химические формулы можно вывести на основании данных о составе веществ. Но чаще всего при составлении химических формул учитываются закономерности, которым подчиняются элементы, соединяясь между собой.
Задание: сравните качественный и количественный состав в молекулах: HCl , H2O, NH3, CH4.
Беседа с учащимися:
– Что общего в составе молекул?
Предполагаемый ответ: Наличие атомов водорода.
– Чем они отличаются друг от друга?
Предполагаемый ответ:
HCl – один атом хлора удерживает один атом водорода,
H2O – один атом кислорода удерживает два атома водорода,
NH3 – один атом азота удерживает три атома водорода,
CH4 – один атом углерода удерживает четыре атома водорода.
Демонстрация шаростержневых моделей.
Проблема: Почему различные атомы удерживают различное количество атомов водорода?
(Выслушиваем варианты ответов учащихся).
Вывод: У атомов разная способность удерживать определённое количество других атомов в соединениях. Это и называется валентностью. Слово “валентность” происходит от лат. valentia – сила.
Запись в тетради:
Валентность – это свойство атомов удерживать определённое число других атомов в соединении.
Валентность – это свойство атома химического элемента присоединять или замещать определенное число атомов другого химического элемента.
Валентность обозначается римскими цифрами.
Записи на доске и в тетрадях:
Валентность атома водорода принята за единицу, а у кислорода – II.2. Эволюция понятия “валентность”.
– В начале XIX века Дж. Дальтоном был сформулирован закон кратных отношений, из которого следовало, что каждый атом одного элемента может соединяться с одним, двумя, тремя и т.д. атомами другого элемента (как, например, в рассмотренных нами соединениях атомов с водородом).
В середине XIX века, когда были определены точные относительные веса атомов (И.Я. Берцелиус и др.), стало ясно, что наибольшее число атомов, с которыми может соединяться данный атом, не превышает определённой величины, зависящей от его природы. Эта способность связывать или замещать определённое число других атомов и была названа Э.Франклендом в 1853 г. “валентность”.
Поскольку в то время для водорода не были известны соединения, где он был бы связан более чем с одним атомом любого другого элемента, атом водорода был выбран в качестве стандарта, обладающего валентностью, равной 1.
В конце 50-х гг. XIX вeка А.С. Купер и А.Кекуле постулировали принцип постоянной четырёхвалентности углерода в органических соединениях. Представления о валентности составили важную часть теории химического строения А.М. Бутлерова в 1861 г.
Периодический закон Д.И. Менделеева в 1869 г. вскрыл зависимость валентности элемента от его положения в периодической системе.
Вклад в эволюцию понятия “валентность” в разные годы внесли В.Коссель, А.Вернер, Г.Льюис.
Начиная с 30-х гг. XX века представления о природе и характере валентности постоянно расширялись и углублялись. Существенный прогресс был достигнут в 1927 г., когда В.Гейтлер и Ф.Лондон выполнили первый количественный квантово-химический расчёт молекулы водорода H2.
3. Определение валентности атомов элементов в соединениях.
Правило определения валентности: число единиц валентностей всех атомов одного элемента равно числу единиц валентности всех атомов другого элемента.
Алгоритм определения валентности.
4. Упражнение: определить валентность элементов в веществах (тренажёр: ученики цепочкой выходят к доске). Задание в раздаточном материале.SiH4, CrO3, H2S, CO2, CO, SO3, SO2, Fe2O3, FeO, HCl, HBr, Cl2O5, Cl2O7, РН3, K2O, Al2O3, P2O5, NO2, N2O5, Cr2O3, SiO2, B2O3, SiH4, Mn2O7, MnO, CuO, N2O3.
III. Оценочно-рефлексивный этап.
Первичная проверка усвоения знаний.
В течение трёх минут необходимо выполнить одно из трёх заданий по выбору. Выбирайте только то задание, с которым вы справитесь. Задание в раздаточном материале.
Репродуктивный уровень (“3”). Определите валентность атомов химических элементов по формулам соединений: NH3, Au2O3, SiH4, CuO.
Прикладной уровень (“4”). Из приведённого ряда выпишите только те формулы, в которых атомы металлов двухвалентны: MnO, Fe2O3 , CrO3, CuO, K2O, СаH2.
Творческий уровень (“5”). Найдите закономерность в последовательности формул: N2O, NO, N2O3 и проставьте валентности над каждым элементом.
Проверка выборочная. Работа над ошибками. Ответы на обратной стороне доски.
IV. Подведение итогов урока.
Беседа с учащимися:
Какую проблему мы поставили в начале урока?
К какому выводу мы пришли?
Дать определение “валентности”.
Чему равна валентность атома водорода? Кислорода?
Как определить валентность атома в соединении?
Оценка работы учащихся в целом и отдельных учащихся.
Домашнее задание: §11,12 в.1-3 с.37.
– Благодарю за урок. До свидания.
Технологическая карта урока химии на тему «Валентность. Определение валентности по формуле».
Технологическая карта урока
Предмет Химия
Класс ____8__________________________________________________
Авторы УМК Г.Е. Рудзитис, Ф.Г. Фельдман
Тема урока_____Валентность. Определение валентности по формуле_
Тип урока____комбинированный________________________________
№
Этап урока
Деятельность учителя
Деятельность учащихся
Формируемые УУД
I
Вводно-мотивационный
Звучит музыка. На экране корабль,карта.
Ребята!Любой человек,невзирая на возраст, любит путешествовать. Сегодня я вас приглашаю совершить путешествие на этом прекрасном корабле и наш капитан сегодня……Это звание он получает за свои успехи на предыдущих уроках.
Давайте дадим название нашему кораблю. В дорогу мы возмем с собою героев стихотворения Редьярда Киплинга:
Есть у меня шестерка слуг,
Проворных,удалых,
И всё,что вижу я вокруг,-
Всё знаю я от них.
Они по знаку моему
Являются в нужде.
Зовут их: Как и Почему,
Кто,Что,Когда и Где.
Настраиваются на урок
Формирование личностного смысла обучения
II
Актуализация знаний
Мы приближаемся к острову «Формулярия»(На экране-фигурки стражников)
Подходы к острову осуществляют стражи порядка. Чтобы попасть на остров необходимо выполнить задания.
Вариант 1.Молекула вещества состоит из одного атома натрия и двух атомов серы, запишите формулу вещества,вычислите массовые отношения и массовые доли элементов в нем.(задание 2 варианта аналогично)
Два ученика выполняют задание на закрытой части доски,остальные-в тетрадях,затем самопроверка, выполненного задания учениками на закрытой части доски.
Регулятивные:
Прогнозирование результата и оценивание уровня достижения результата.
III
Постановка учебной задачи
До сих пор мы пользовались готовыми формулами, приведёнными в учебнике. Химические формулы можно вывести на основании данных о составе веществ. Но чаще всего при составлении химических формул учитываются закономерности, которым подчиняются элементы, соединяясь между собой.
Задание: сравните качественный и количественный состав в молекулах: HCl , h3O, Nh4, Ch5. (Формулы на экране)
Используя наборы для составления моделей молекул различных веществ, составьте модели молекул этих соединений.
Беседа с учащимися:
– Что общего в составе молекул?
Предполагаемый ответ: Наличие атомов водорода.
– Чем они отличаются друг от друга?
(Предполагаемый ответ:
HCl – один атом хлора удерживает один атом водорода,
h3O – один атом кислорода удерживает два атома водорода,
Nh4 – один атом азота удерживает три атома водорода,
Ch5 – один атом углерода удерживает четыре атома водорода.)
Проблема: Почему различные атомы удерживают различное количество атомов водорода?
(Выслушиваем варианты ответов учащихся).
Давайте определим гипотезу, которую мы должны доказать в ходе урока(На доске появляется запись: У атомов разная способность удерживать определённое количество других атомов в соединениях.)
А доказать нашу гипотезу нам поможет королева острова Валентность.(Наэкране появляется изображение королевы)
Довайте определим цели нашего урока.(Учитель выслушивает ответы учащихся, формулирует совместные цели)
Выполняют задание,демонстрируют шаростержневые модели, отвечают на вопросы учителя.
Участвуют в постановке гипотезы, определяют цели урока.
Регулятивные:
Постановка цели и анализирование условий достижения цели.
Прогнозирование результата
Познавательные:
Определение понятий.
Умение структурировать знания.
Умение выделять существенные характеристики объектов.
Умение устанавливать причинно-следственные связи.
построение логической цепи рассуждений
Регулятивные:
познавательная инициатива, планирование, прогнозирование
Коммуникативные:
Умение участвовать в коллективном обсуждении проблемы, аргументировать свою позицию
IV
Операционно -исполнительский
1.Давайте познакомимся с королевой Валентность.Слово “валентность” происходит от лат. valentia – сила.
Задание: найдите в учебнике определение валентности,запишите его в тетрадь.
Ребята, а что показывают формулы веществ?
(Формулы показывают, что атомы соединяются между собой в различных соотношениях.) Изучение состава веществ, образованных водородом и атомами других элементов показало, что его атом не может присоединить более одного атома других элементов. Это позволило принять валентность водорода за 1. Отсюда следует, что если в состав молекулы НСl входит по 1 атому водорода и хлора, то валентности этих элементов равны.
Поскольку в молекуле H2O содержится один атом кислорода и 2 атома водорода, значит валентность кислорода в 2 раза превышает валентность водорода и равна 2. (Демонстрация шаростержневых моделей)
Валентность обозначают римскими цифрами.
Задание: Исползуя таблицу «Валентность некоторых элементов в химических соединениях» на с.32 учебника заполните пропуски в предложениях:
1. H, O, AL, Zn, Ca — элементы,атомы которых имеют валентность………………..
2. C, S, Fe, Cu,N -элементы,атомы которых имеют валентность………………..
Сделайте вывод. (Атомы некоторых химических элементов имеют постоянную, атомы других- переменную валентность)
2.Определение валентности атомов элементов в соединениях.
Задание 1 группе учащихся: Используя материал учебника на с.34 заполните таблицу отображающую порядок действий при определении валентности атомов элементов в соединениях.
Порядок действия
Пример
Задание 2 группе учащихся:Запишите порядок действий при определении валентности атомов элементов в соединениях,анализируя предложенный пример.
Порядок действия
Пример
1
2.
3.
II
1. Al2 O3
6 II
2.Al2 O3
II * 3 = 6 (НОК)
III6 II
3.Al2 O3
6 : 2 =III
(Задания в раздаточном материале.)
Обсуждение полученных результатов
Как определить валентность атома в соединении?
Упражнение: определить валентность элементов в веществах (тренажёр: ученики цепочкой выходят к доске). Задание в раздаточном материале.
Sih5, CrO3, h3S, CO2, CO, SO3, SO2, Fe2O3, FeO, HCl, HBr, Cl2O5, Cl2O7, РН3, K2O, Al2O3, P2O5, NO2, N2O5, Cr2O3, SiO2, B2O3, Sih5, Mn2O7, MnO, CuO, N2O3.
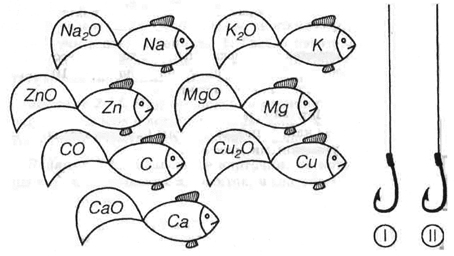
Ребята! Жители Формуляндии приглашают нас
на рыбалку.(Задание в раздаточном материале.)
Задание:
Поймайте «химических рыбок на крючок валентности:
Работают сучебником,
записывают определение в тетрадь.
Выполняют задание, делают вывод.
Работают в группах,заполняют таблицы,затем- проверка по образцу, предложенному учителем.
Отвечают на вопрос
Ученики цепочкой выходят к доске, выполняют задания.
Самостоятельно выполняют задание,затем- самопроверка по эталону ответа.
Познавательные:
Определение понятий.
Умение структурировать знания.
Умение выделять существенные характеристики объектов.
Умение устанавливать причинно-следственные связи.
Самостоятельный поиск информации.
Коммуникативные:
Умение организовывать учебное сотрудничество и совместную деятельность с партнёрами
Умение участвовать в коллективном обсуждении проблемы, аргументировать свою позицию
V
Рефлексивно-оценочный
Вот и подошло к концу наше путешествие. Помотрите,нас провожает королева и жители острова(На экране). А мы с вами обсудим следующие вопросы:
Какую проблему мы поставили в начале урока?
К какому выводу мы пришли?
Дать определение “валентности”.
Чему равна валентность атома водорода? Кислорода?
Как определить валентность атома в соединении?
Спасибо всем за урок.(Учитель коментирует и выставляет оценки за урок,дает домашнее задание:п.11-12, упр. 4 стр. 37.)
Коммуникативные – умение выражать свои мысли;
Познавательные – смыслообразование
Методическая разработка урока по химии по теме «Валентность. Определение валентности по формулам» в 8-м классе
Методическая разработка урока по химии по теме «Валентность. Определение валентности по формулам» в 8-м классе
Цели урока.
Дидактические:
опираясь на знания учащихся, повторить понятия “химическая формула”;
способствовать формированию у учащихся понятия “валентность” и умению определять валентность атомов элементов по формулам веществ;
акцентировать внимание школьников на возможности интеграции курсов химии, математики.
Развивающие:
продолжить формирование умений формулировать определения;
разъяснять смысл изученных понятий и объяснять последовательность действий при определении валентности по формуле вещества;
способствовать обогащению словарного запаса, развитию эмоций, творческих способностей;
развивать умение выделять главное, существенное, сравнивать, обобщать, развивать дикцию, речь.
Воспитательные:
воспитывать чувство товарищества, умение работать коллективно;
повысить уровень эстетического воспитания учащихся;
ориентировать учащихся на здоровый образ жизни.
Планируемые результаты обучения:
Учащиеся должны уметь формулировать определение “валентность”, знать валентность атомов водорода и кислорода в соединениях, определять по ней валентность атомов других элементов в бинарных соединениях,
Уметь разъяснять смысл понятия “валентность” и последовательность действий при определении валентности атомов элементов по формулам веществ.
Понятия, впервые вводимые на уроке: валентность, постоянная и переменная валентность.
Организационные формы: беседа, индивидуальные задания, самостоятельная работа.
Средства обучения: алгоритм определения валентности.
Демонстрационное оборудование: шаростержневые модели молекул хлороводорода, воды, аммиака, метана.
Оборудование для учащихся: на каждом столе “Алгоритм определения валентности”.
Опережающее задание: индивидуальное задание – подготовить сообщение на тему “Эволюция понятия “валентность”.
Ход урока
I. Ориентировочно-мотивационный этап.
1. Фронтальная беседа с учащимися по пройденной теме “Химическая формула”.
Задание: Что здесь написано? (Демонстрация учителем формул, отпечатанных на отдельных листах).
2. Индивидуальная работа по карточкам трёх учащихся по теме “Относительная молекулярная масса”. (Выполняют решение на доске). Проверка учителем.
Карточка № 1. Рассчитайте относительную молекулярную массу данных веществ: NaCl, K2O.
Справочные данные:
Аr (Na) = 23
Аr (Cl) = 35,5
Аr (K) = 39
Аr (O) = 16
Карточка № 2. Рассчитайте относительную молекулярную массу данных веществ: CuO, SO2.
Справочные данные:
Аr (Cu) = 64
Аr (O) = 16
Аr (S) =3 2
Карточка № 3. Рассчитайте относительную молекулярную массу данных веществ: CH4, NO.
Справочные данные:
Аr (С) = 12
Аr (H) = 1
Аr (N) = 14
Аr (O) = 16
3. Самостоятельная работа учащихся в тетрадях.
Задача информационно-вычислительного характера (условие записано в раздаточном материале).
Эффективность зубных паст в профилактике кариеса можно сравнить по содержанию в них активного фтора, способного взаимодействовать с зубной эмалью. Зубная паста “Crest” (производство США) содержит, как указано на упаковке, SnF2, а зубная паста “FM extra DENT” (производство Болгария) содержит NaF. Вычислите, какая из этих двух паст более сильнодействующее средство для профилактики кариеса.
Проверка: один учащийся устно читает решение.
II. Операционно-исполнительный этап.
1. Объяснение учителя. Постановка проблемы.
Понятие о валентности.
– До сих пор мы пользовались готовыми формулами, приведёнными в учебнике. Химические формулы можно вывести на основании данных о составе веществ. Но чаще всего при составлении химических формул учитываются закономерности, которым подчиняются элементы, соединяясь между собой.
Задание: сравните качественный и количественный состав в молекулах: HCl , H2O, NH3, CH4.
Беседа с учащимися:
– Что общего в составе молекул?
Предполагаемый ответ: Наличие атомов водорода.
– Чем они отличаются друг от друга?
Предполагаемый ответ:
HCl – один атом хлора удерживает один атом водорода,
H2O – один атом кислорода удерживает два атома водорода,
NH3 – один атом азота удерживает три атома водорода,
CH4 – один атом углерода удерживает четыре атома водорода.
Демонстрация шаростержневых моделей.
Проблема: Почему различные атомы удерживают различное количество атомов водорода?
(Выслушиваем варианты ответов учащихся).
Вывод: У атомов разная способность удерживать определённое количество других атомов в соединениях. Это и называется валентностью. Слово “валентность” происходит от лат. valentia – сила.
Запись в тетради:
Валентность – это свойство атомов удерживать определённое число других атомов в соединении.
Валентность обозначается римскими цифрами.
Записи на доске и в тетрадях:
OI III
H3N
I IV
H4C
Валентность атома водорода принята за единицу, а у кислорода – II.
2. Эволюция понятия “валентность” (сообщение учащегося).
– В начале XIX века Дж. Дальтоном был сформулирован закон кратных отношений, из которого следовало, что каждый атом одного элемента может соединяться с одним, двумя, тремя и т.д. атомами другого элемента (как, например, в рассмотренных нами соединениях атомов с водородом).
В середине XIX века, когда были определены точные относительные веса атомов (И.Я. Берцелиус и др.), стало ясно, что наибольшее число атомов, с которыми может соединяться данный атом, не превышает определённой величины, зависящей от его природы. Эта способность связывать или замещать определённое число других атомов и была названа Э.Франклендом в 1853 г. “валентность”.
Поскольку в то время для водорода не были известны соединения, где он был бы связан более чем с одним атомом любого другого элемента, атом водорода был выбран в качестве стандарта, обладающего валентностью, равной 1.
В конце 50-х гг. XIX вeка А.С. Купер и А.Кекуле постулировали принцип постоянной четырёхвалентности углерода в органических соединениях. Представления о валентности составили важную часть теории химического строения А.М. Бутлерова в 1861 г.
Периодический закон Д.И. Менделеева в 1869 г. вскрыл зависимость валентности элемента от его положения в периодической системе.
Вклад в эволюцию понятия “валентность” в разные годы внесли В.Коссель, А.Вернер, Г.Льюис.
Начиная с 30-х гг. XX века представления о природе и характере валентности постоянно расширялись и углублялись. Существенный прогресс был достигнут в 1927 г., когда В.Гейтлер и Ф.Лондон выполнили первый количественный квантово-химический расчёт молекулы водорода H2.
3. Определение валентности атомов элементов в соединениях.
Правило определения валентности: число единиц валентностей всех атомов одного элемента равно числу единиц валентности всех атомов другого элемента.
Алгоритм определения валентности.
S, Cu2O2. Обозначьте известную валентность элемента
I
H2S,
II
Cu2O
3. Найдите число единиц валентности атомов известного элемента, умножив валентность элемента на количество его атомов
2
I
H2S
2
II
Cu2O
4. Поделите число единиц валентности атомов на количество атомов другого элемента. Полученный ответ и является искомой валентностью
2
I II
H2S
2
I II
Cu2O
5. Сделайте проверку, то есть подсчитайте число единиц валентностей каждого элемента
I II
H2S
(2=2)
I II
Cu2O
(2=2)
4. Упражнение: определить валентность элементов в веществах (тренажёр: ученики цепочкой выходят к доске). Задание в раздаточном материале.
SiH4, CrO3, H2S, CO2, CO, SO3, SO2, Fe2O3, FeO, HCl, HBr, Cl2O5, Cl2O7, РН3, K2O, Al2O3, P2O5, NO2, N2O5, Cr2O3, SiO2, B2O3, SiH4, Mn2O7, MnO, CuO, N2O3.
III. Оценочно-рефлексивный этап.
Первичная проверка усвоения знаний.
В течение трёх минут необходимо выполнить одно из трёх заданий по выбору. Выбирайте только то задание, с которым вы справитесь. Задание в раздаточном материале.
Репродуктивный уровень (“3”). Определите валентность атомов химических элементов по формулам соединений: NH3, Au2O3, SiH4, CuO.
Прикладной уровень (“4”). Из приведённого ряда выпишите только те формулы, в которых атомы металлов двухвалентны: MnO, Fe2O3 , CrO3, CuO, K2O, СаH2.
Творческий уровень (“5”). Найдите закономерность в последовательности формул: N2O, NO, N2O3 и проставьте валентности над каждым элементом.
Проверка выборочная. Консультант из числа учащихся по готовому шаблону проверяет 4 тетради учащихся.
Работа над ошибками. Ответы на обратной стороне доски.
IV. Подведение итогов урока.
Беседа с учащимися:
Какую проблему мы поставили в начале урока?
К какому выводу мы пришли?
Дать определение “валентности”.
Чему равна валентность атома водорода? Кислорода?
Как определить валентность атома в соединении?
Оценка работы учащихся в целом и отдельных учащихся.
Домашнее задание: § 4, стр. 23–25, упр. на стр. 25.
– Благодарю за урок. До свидания.
Самостоятельная работа по теме «Валентность химических элементов»
I вариант
1. Определите валентность химических элементов в следующих соединениях:
СО, ZnS, SiН4
2. Расставьте индексы в химических формулах следующих соединений:
а) K..O..
I
б) Аl..I..
V I
в) Р..Cl..
3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
а) железа (II)
б) азота (IV)
4. Составьте химические формулы соединений с хлором (I) следующих элементов (символ хлора в данных формулах ставится на второе место):
а) бария
б) железа (III)
II вариант
1. Определите валентность химических элементов в следующих соединениях:
HBr, Ca3P2, MgCl2
2. Расставьте индексы в химических формулах следующих соединений:
VI
а) S..O..
III I
б) Fe..Cl..
I II
в) Cu..S..
3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
а) калия
б) кремния(IV)
4. Составьте химические формулы соединений с хлором (I) следующих элементов (символ хлора в данных формулах ставится на второе место):
а) алюминия
б) кальция
III вариант
1. Определите валентность химических элементов в следующих соединениях:
NO, Na2S, СaCl2
2. Расставьте индексы в химических формулах следующих соединений:
I II
а) Ag..S..
II
б) Аl..S..
IV
в) Si..H..
3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
а) хлора (VII)
б) бария
4. Составьте химические формулы соединений с серой (II) следующих элементов (символ серы в данных формулах ставится на второе место):
а) железа (III)
б) меди (II)
IV вариант
1. Определите валентность химических элементов в следующих соединениях:
NaI, SiCl4, MgS
2. Расставьте индексы в химических формулах следующих соединений:
I
а) N..O..
I
б) Ba..Cl..
IV
в) Si..O..
3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
а) cеры(VI)
б) углерода(II)
4. Составьте химические формулы соединений с бромом (I) следующих элементов (символ брома в данных формулах ставится на второе место):
а) cеребра (I)
б) алюминия