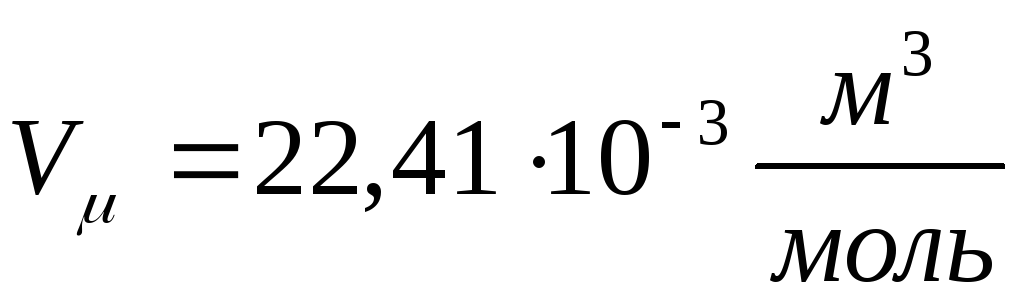Закон Авогадро — Электронный учебник K-tree
Авогадро анонсировал следующий закон:
В равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
А теперь давайте разбираться, что он имел ввиду… Никто не знает, как получить 1 литр чистого газа в XIX веке, Авогадро в тот момент руководствовался своим огромным опытом и знаниями в этой области и объявленный закон являлся не чем иным, как гипотезой. Поэтому закон выделенный абзацем выше нужно запомнить как есть.
А для того, что бы понять данный закон, давайте определимся с терминами:
Нормальные условия
В химии существует понятие «нормальные условия», это очень дружелюбный термин, который обозначает нормальные температуру и давление, а именно — 0°С (или 273,15 К) и 1 атм. В химии всегда подразумевается, что эксперимент проходит в нормальных условиях.
Моль
Моль — это 6,022 141 29 (27) · 1023 элементов (атомы, молекулы или хомячки — не важно, это просто число). Далее будет идти сокращение 6,022· 1023, но Вы понимаете, о чём речь.
Молярная масса
Молярной массой вещества названа масса 6,022·1023 атомов химического элемента. То есть молярная масса гелия — это масса 6,022·1023 атомов гелия. Молярная масса никеля — это масса 6,022·1023 атомов никеля. И, внимание! Молярная масса молекулы воды (H2O) равна массе 2 × 6,022·1023 атомов водорода плюс масса 6,022·1023 атомов кислорода.
Откуда берётся молярная масса? Это сложный химический эксперимент, описан в статье про моль, а для решения задач будет достаточно данных из справочника, например, молярная масса химических элементов указана в таблице менделеева.
Газ
Молекулы газа состоят из одного или более атомов. Из одного атома состоят газы гелий, неон, аргон, криптон, ксенон, радон и оганесон — это элементы последней группы таблицы Менделеева. Одноатомность таких газов следует из строения электронной оболочки атомов
Двухатомными газами являются водород, азот, кислород, фтор и хлор. Молекулы таких газов состоят из двух атомов, то есть: H2, N2, O2, F2, Cl2
Объяснение закона Авогадро
При нормальных условиях:
1 л водорода весит 0,09 г — это результат эксперимента, молярная масса газа водорода — 2·1,008 г/моль. 1 л кислорода весит 1,429 г — это также результат эксперимента, молярная масса газа кислорода — 32 г/моль.
2.016/0.09 = 22,4 л/моль
32/1,429 = 22,4 л/моль
Этот эксперимент Вы можете повторить в домашних условиях 😉
Таким образом, 1 моль газа при нормальных условиях занимает объём 22,4 л, откуда можно сделать вывод: в 22,4 л газа содержится 1 моль молекул.
Задача
Какую массу будет иметь 40 л газа кислорода?
РешениеЧто бы определить массу из объёма потребуется узнать количество молекул газа, затем посчитать их массу.
В 22,4 л газа содержится один моль молекул, откуда:
40/22,4 ≈ 1.79
в 40 л газа содержится 1.79 моль молекул
Кислород — это двухатомный газ, а значит его формула O2, то есть в одной молекуле содержится 2 атома кислорода. Следовательно:
1.79×2 = 3.58
В 1.79 моль молекул содержится 3.58 моль атомов кислорода.
В таблице Менделеева указана молярная масса кислорода и она равна 15,999 г/моль, откуда:
15.999 × 3.58 ≈ 57.28 г
Ответ: 40 л газа кислорода имеет массу 57.28 г
k-tree.ru
АВОГАДРО ЗАКОН — это… Что такое АВОГАДРО ЗАКОН?
- АВОГАДРО ЗАКОН
- АВОГАДРО ЗАКОН (Avogadro), основан на высказанной в 1811 г. итальянским физиком Авогадро гипотезе, гласящей, что «при одинаковых условиях t° и давления, в равных объемах всех газов содержится одно и то же число молекул». Из этой гипотезы., ставшей затем, после подтверждения ее с точки зрения кинетической теории газов (см.), законом, следует, что плотности газов, измеренные при одинаковых внешних условиях, относятся, как их молеку- лярные веса (см.). Следовательно, последние можно вычислить из плотностей газов, приняв молекулярный вес какого-нибудь газа за единицу сравнения. Найденные в нек-рых случаях «аномальные» плотности легко были объяснены явлениями диссоциации. Из закона Авогадро следует, что
- АВИЦЕННА
- АВРАН
Смотреть что такое «АВОГАДРО ЗАКОН» в других словарях:
АВОГАДРО ЗАКОН — один из осн. законов идеального газа, согласно к рому в равных объёмах V разл. газов при одинаковых давлении p и темп ре Т содержится одинаковое число молекул. Открыт в 1811 итал. учёным А. Авогадро (A. Avogadro). Согласно А. з., 1 кмоль любого… … Физическая энциклопедия
АВОГАДРО ЗАКОН — в равных объемах идеальных газов при одинаковых давлении и температуре содержится одинаковое число молекул; открыт А. Авогадро в 1811 … Большой Энциклопедический словарь
Авогадро закон — в равных объёмах идеальных газов при одинаковых давлении и темп ре содержится одинаковое число молекул; открыт закон Авогадро в 1811. * * * АВОГАДРО ЗАКОН АВОГАДРО ЗАКОН, один из основных законов идеальных газов (см. ИДЕАЛЬНЫЙ ГАЗ): в равных… … Энциклопедический словарь
Авогадро закон — один из основных законов идеальных газов, согласно которому в равных объёмах различных газов при одинаковых температурах и давлениях содержится одинаковое число молекул. Число молекул в одном моле (См. Моль) называют Авогадро числом. А. з … Большая советская энциклопедия
Авогадро закон — одно из важных основных положений химии, гласящее, что в одинаковых объемах различных паров и газов находится одинаковое число частиц . Формулированное еще в 1811 году (Амедеем Авогадро, профессором физики в Турине, род. в 1776 г., умер в 1856… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
АВОГАДРО ЗАКОН — [по имени итал. физика и химика А. Авогадро (A. Avogadro; 1776 1856)] один из осн. газовых законов, согласно к рому в равных объёмах разл. идеальных газов при одинаковых темп ре и давлении содержится одинаковое число молекул. Эквивалентная… … Большой энциклопедический политехнический словарь
АВОГАДРО ЗАКОН — в равных объёмах идеальных газов при одинаковых давлении и темп ре содержится одинаковое число молекул; открыт А. Авогадро в 1811 … Естествознание. Энциклопедический словарь
АВОГАДРО ЗАКОН — в равных объемах идеальных газов при одинаковых давлении и т ре содержится одинаковое число молекул. Согласно А. з., 1 моль любого идеального газа при нормальных условиях (1,01 * 105 Па, 0 … Химическая энциклопедия
Авогадро закон — в равных объемах идеальных газов при одинаковых давлении и температуре содержится одинаковое число молекул. Открыт в 1811 году … Начала современного естествознания
big_medicine.academic.ru
АВОГАДРО ЗАКОН — это… Что такое АВОГАДРО ЗАКОН?
- АВОГАДРО ЗАКОН
- АВОГАДРО ЗАКОН
-
один из осн. законов идеального газа, согласно к-рому в равных объёмах V разл. газов при одинаковых давлении p и темп-ре Т содержится одинаковое число молекул. Открыт в 1811 итал. учёным А. Авогадро (A. Avogadro). Согласно А. з., 1 кмоль любого идеального газа при норм. условиях (р=101325 Па=760 мм рт. ст. и T=0°С) занимает объём 22,4136 м3; число молекул в одном моле наз. Авогадро постоянной.
Согласно _кинетич. теории газов, pV=l/3 Nmv2 (N — число, т — масса, ?v2 — ср. квадратичная скорость молекул), a 1/2mv2=3/2 kT. Отсюда видно, что для двух газов при условии T1=T2, p1=p2 и v1=v2 должно быть и N1=N2,.
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
- АВОГАДРО ЗАКОН
-
— закон, согласно к-рому при одинаковых темп-pax Т и давлениях р в равных объёмах любых идеальных газов содержится одинаковое число молекул N А. Открыт А. Авогадро (A. Avogadro) в 1811. А. з. можно сформулировать иначе: 1 моль любого из веществ в газообразном состоянии при одинаковых
А. з. является следствием кинетической теории газов, согласно к-рой для идеального газа (т — масса молекул, — их ср. квадратич. скорость). Т. к. , для двух разл. газов при , и получим:
, т. е .
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.
- АБСОРБЦИЯ СВЕТА
- АВОГАДРО ПОСТОЯННАЯ
Смотреть что такое «АВОГАДРО ЗАКОН» в других словарях:
АВОГАДРО ЗАКОН — (Avogadro), основан на высказанной в 1811 г. итальянским физиком Авогадро гипотезе, гласящей, что «при одинаковых условиях t° и давления, в равных объемах всех газов содержится одно и то же число молекул». Из этой гипотезы.,… … Большая медицинская энциклопедия
АВОГАДРО ЗАКОН — в равных объемах идеальных газов при одинаковых давлении и температуре содержится одинаковое число молекул; открыт А. Авогадро в 1811 … Большой Энциклопедический словарь
Авогадро закон — в равных объёмах идеальных газов при одинаковых давлении и темп ре содержится одинаковое число молекул; открыт закон Авогадро в 1811. * * * АВОГАДРО ЗАКОН АВОГАДРО ЗАКОН, один из основных законов идеальных газов (см. ИДЕАЛЬНЫЙ ГАЗ): в равных… … Энциклопедический словарь
Авогадро закон — один из основных законов идеальных газов, согласно которому в равных объёмах различных газов при одинаковых температурах и давлениях содержится одинаковое число молекул. Число молекул в одном моле (См. Моль) называют Авогадро числом. А. з … Большая советская энциклопедия
Авогадро закон — одно из важных основных положений химии, гласящее, что в одинаковых объемах различных паров и газов находится одинаковое число частиц . Формулированное еще в 1811 году (Амедеем Авогадро, профессором физики в Турине, род. в 1776 г., умер в 1856… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
АВОГАДРО ЗАКОН — [по имени итал. физика и химика А. Авогадро (A. Avogadro; 1776 1856)] один из осн. газовых законов, согласно к рому в равных объёмах разл. идеальных газов при одинаковых темп ре и давлении содержится одинаковое число молекул. Эквивалентная… … Большой энциклопедический политехнический словарь
АВОГАДРО ЗАКОН — в равных объёмах идеальных газов при одинаковых давлении и темп ре содержится одинаковое число молекул; открыт А. Авогадро в 1811 … Естествознание. Энциклопедический словарь
АВОГАДРО ЗАКОН — в равных объемах идеальных газов при одинаковых давлении и т ре содержится одинаковое число молекул. Согласно А. з., 1 моль любого идеального газа при нормальных условиях (1,01 * 105 Па, 0 … Химическая энциклопедия
Авогадро закон — … Википедия
Авогадро закон — в равных объемах идеальных газов при одинаковых давлении и температуре содержится одинаковое число молекул. Открыт в 1811 году … Начала современного естествознания
partners.academic.ru
Закон Авогадро (стр. 1 из 3)
АНО ВПО ЦС РФ «РОССИЙСКИЙ УНИВЕРСИТЕТ КООПЕРАЦИЙ»
ФАКУЛЬТЕТ «СЕРВИС»
РЕФЕРАТ
Тема:
Закон Авогадро
Выполнил: студент
1 курса Иконников А.В.
САНКТ-ПЕТЕРБУРГ
2009
Содержание
Введение
Амедео Авогадро (1776—1856)
Закон Авогадро
Заключение
Список литературы
Введение
Предвидеть результаты эксперимента, почувствовать общее начало, предугадать закономерность – этим отмечено творчество многих ученых. Чаще всего прогнозирование распространяется только на ту область, которой занят исследователь, а решимость храбро шагнуть далеко вперед в своих предсказаниях дана далеко не каждому. Иногда смелость может придать способность к логическим построениям.
Амедео Авогадро (1776—1856)
В историю физики Авогадро вошел как автор одного из важнейших законов молекулярной физики.
Лоренцо Романо Карло ди Кваренья э ди Черрето родился 9 августа 1776 года в Турине — столице итальянской провинции Пьемонт в семье служащего судебного ведомства Филиппе Авогадро. Амедео был третьим из восьми детей. Предки его с XII века состояли на службе католической церкви адвокатами и по традиции того времени их профессии и должности передавались по наследству. Когда пришла пора выбирать профессию, Амедео также занялся юриспруденцией. В этой науке он быстро преуспел и уже в двадцать лет получил ученую степень доктора церковного права.
Юридическая практика не увлекала Амедео, его интересы были далеки от юриспруденции. В юношеские годы он недолго посещал так называемую школу геометрии и экспериментальной физики. Она-то и пробудила в нем любовь к этим наукам. Но, не получив достаточно систематических знаний, он вынужден был заняться самообразованием Когда ему уже исполнилось 25 лет, он стал все свободное время посвящать изучению физико-математических наук.
Авогадро начал свою научную деятельность с изучения электрических явлений. Этот интерес особенно усилился после того, как Вольта в 1800 году изобрел первый источник электрического тока, а также в связи с дискуссией между Гальвани и Вольта о природе электричества. Эти вопросы находились на переднем крае науки того времени, и естественно, что молодой Авогадро решил попробовать свои силы именно здесь.
Работы Авогадро, посвященные разным проблемам электричества, появлялись вплоть до 1846 года. Большое внимание уделял он также исследованиям в области электрохимии, пытаясь найти связь между электрическими и химическими явлениями, что привело его к созданию своеобразной электрохимической теории. В этом отношении его исследования соприкасались с работами известных химиков Дэви и Берцелиуса.
В 1803 и 1804 годах Амедео, совместно со своим братом Феличе, представил в Туринскую Академию наук две работы, посвященные теории электрических и электрохимических явлений, за что и был избран в 1804 году членом-корреспондентом этой академии В первой работе под названием «Аналитическая заметка об электричестве» он объяснял поведение проводников и диэлектриков в электрическом поле, в частности явление поляризации диэлектриков. Высказанные им идеи получили затем более полное развитие в работах других ученых, в частности Ампера
В 1806 году Авогадро получает место репетитора в Туринском лицее, а затем, в 1809 году, переводится преподавателем физики и математики в лицей города Верчелли, в котором он проработал около десяти лет В этот период он знакомится с огромным количеством научной литературы, делая многочисленные выписки из прочитанных книг и журнальных статей.
Эти выписки, которые он не прекращал вести до конца своих дней, составили 75 томов примерно по 700 страниц в каждом! Содержание этих томов свидетельствует о разносторонности интересов Авогадро, о колоссальной работе, которую он проделал, «переквалифицировавшись» из юриста в физика.
Свою семейную жизнь Авогадро устроил довольно поздно, когда ему было уже за тридцать. Работая в Верчелли, он познакомился со своей будущей женой Анной Марией Маццье ди Джузеппе, дочерью нотариуса, которая была моложе его на 18 лет. От этого брака он имел восемь детей — двоих сыновей и шесть дочерей. Никто из них не унаследовал его профессии и интересов.
Закон Авогадро
В 1808 Гей-Люссак (совместно с немецким естествоиспытателем Александром Гумбольдтом) сформулировал так называемый закон объемных отношений, согласно которому соотношение между объемами реагирующих газов выражается простыми целыми числами. Например, 2 объема водорода соединяются с 1 объемом водорода, давая 2 объема водяного пара; 1 объем хлора соединяется с 1 объемом водорода, давая 2 объема хлороводорода и т.д. Этот закон в то время мало что давал ученым, поскольку не было единого мнения о том, из чего состоят частицы разных газов. Не существовало и четкого различия между такими понятиями как атом, молекула, корпускула.
В 1811 Авогадро, тщательно проанализировав результаты экспериментов Гей-Люссака и других ученых, пришел к выводу, что закон объемных отношений позволяет понять, как же «устроены» молекулы газов. «Первая гипотеза, – писал он, – которая возникает в связи с этим и которая представляется единственно приемлемой, состоит в предположении, что число составных молекул любого газа всегда одно и то же в одном и том же объеме…» А «составные молекулы» (сейчас мы их называем просто молекулами), по мысли Авогадро, состоят из более мелких частиц – атомов.
Тремя годами позже Авогадро изложил свою гипотезу еще более четко и сформулировал ее в виде закона, который носит его имя: «Равные объемы газообразных веществ при одинаковом давлении и температуре содержат одно и то же число молекул, так что плотность различных газов служит мерой массы их молекул…» Это добавление было очень важным: оно означало, что можно, измеряя плотность разных газов, определять относительные массы молекул, из которых эти газы состоят. Действительно, если в 1 л водорода содержится столько же молекул, что и в 1 л кислорода, то отношение плотностей этих газов равно отношение масс молекул. Авогадро особо отмечал, что молекулы в газах не обязательно должны состоять из одиночных атомов, а могут содержать несколько атомов – одинаковых или разных. (Справедливости ради следует сказать, что в 1814 известный французский физик А.М. Ампер независимо от Авогадро пришел к тем же выводам.)
Во времена Авогадро его гипотезу невозможно было доказать теоретически. Но эта гипотеза давала простую возможность экспериментально устанавливать состав молекул газообразных соединений и определять их относительную массу. Попробуем проследить логику таких рассуждений. Эксперимент показывает, что объемы водорода, кислорода и образующихся из этих газов паров воды относятся как 2:1:2. Выводы из этого факта можно сделать разные. Первый: молекулы водорода и кислорода состоят из двух атомов (Н2 и О2), а молекула воды – из трех, и тогда верно уравнение 2Н2 + О2 2Н2О. Но возможен и такой вывод: молекулы водорода одноатомны, а молекулы кислорода и воды двухатомны, и тогда верно уравнение 2Н + О2 2НО с тем же соотношением объе мов 2:1:2. В первом случае из соотношения масс водорода и кислорода в воде (1:8) следовало, что относительная атомная масса кислорода равна 16, а во втором – что она равна 8. Кстати, даже через 50 лет после работ Гей-Люссака некоторые ученые продолжали настаивать на том, что формула воды именно НО, а не Н2О. Другие же считали, что правильна формула Н2О2. Соответственно в ряде таблиц атомную массу кислорода принимали равной 8.
Однако был простой способ выбрать из двух предположений одно верное. Для этого надо было лишь проанализировать результаты и других аналогичных экспериментов. Так, из них следовало, что равные объемы водорода и хлора дают удвоенный объем хлороводорода. Этот факт сразу отвергал возможность одноатомности водорода: реакции типа H + Cl HCl, H + Cl2 HCl2 и им подобные не дают удвоенного объема HCl. Следовательно, молекулы водорода (а также хлора) состоят из двух атомов. Но если молекулы водорода двухатомны, то двухатомны и молекулы кислорода, а в молекулах воды три атома, и ее формула – Н2О. Удивительно, что такие простые доводы в течение десятилетий не могли убедить некоторых химиков в справедливости теории Авогадро, которая в течение нескольких десятилетий оставалась практически незамеченной.
Отчасти это объясняется отсутствием в те времена простой и ясной записи формул и уравнений химических реакций. Но главное – противником теории Авогадро был знаменитый шведский химик Йенс Якоб Берцелиус, имевший непререкаемый авторитет среди химиков всего мира. Согласно его теории, все атомы имеют электрические заряды, а молекулы образованы атомами с противоположными зарядами, которые притягиваются друг к другу. Считалось, что атомы кислорода имеют сильный отрицательный заряд, а атомы водорода – положительный. С точки зрения этой теории невозможно было представить молекулу кислорода, состоящую из двух одинаково заряженных атомов! Но если молекулы кислорода одноатомны, то в реакции кислорода с азотом: N + O NO соотношение объемов должно быть 1:1:1. А это противоречило эксперименту: 1 л азота и 1 л кислорода давали 2 л NO. На этом основании Берцелиус и большинство других химиков отвергли гипотезу Авогадро как не соответствующую экспериментальным данным!
Возродил гипотезу Авогадро и убедил химиков в ее справедливости в конце 1850-х молодой итальянский химик Станислао Канниццаро (1826–1910). Он принял для молекул газообразных элементов правильные (удвоенные) формулы: H2, O2, Cl2, Br2 и т.д. и согласовал гипотезу Авогадро со всеми экспериментальными данными. «Краеугольный камень современной атомной теории, – писал Канниццаро, – составляет теория Авогадро… Эта теория представляет самый логичный исходный пункт для разъяснения основных идей о молекулах и атомах и для доказательства последних… Вначале казалось, что физические факты были в несогласии с теорией Авогадро и Ампера, так что она была оставлена в стороне и скоро забыта; но затем химики самой логикой их исследований и в результате спонтанной эволюции науки, незаметно для них, были приведены к той же теории… Кто не увидит в этом длительном и неосознанном кружении науки вокруг и в направлении поставленной цели решительного доказательства в пользу теории Авогадро и Ампера? Теория, к которой пришли, отправляясь от различных и даже противоположных пунктов, теория, которая позволила предвидеть немало фактов, подтвержденных опытом, должна быть чем-то большим, чем простой научной выдумкой. Она должна быть… самой истиной».
mirznanii.com
§ 3.8. Законы Авогадро и Дальтона
Следует сказать еще о двух газовых законах. Один из них касается числа молекул различных газов при одинаковых давлениях и температурах, а другой относится к смеси газов.
Закон Авогадро
В начале XIX в. было установлено правило кратных отношений для газов, вступающих в химическую реакцию. Если температуры и давления газов, соединяющихся друг с другом, равны, то их объемы находятся в простых отношениях: 1:1, 1:2, 1 : 3 и т. д. На основании этого правила Авогадро в 1811 г. высказал смелую для того времени гипотезу: в равных объемах газов при одинаковых температурах и давлениях содержится одинаковое число молекул. При отношении 1 : 1 молекулы реагирующих газов соединяются попарно. Если отношение объемов равно 1 : 2, то каждая молекула первого газа присоединяет к себе две молекулы второго и т. д.
В настоящее время гипотеза Авогадро строго доказана и носит название закона Авогадро.
Согласно закону Авогадро различные газы, взятые в количестве 1 моль, имеют одинаковые объемы при одинаковых давлениях р и температурах t, так как число молекул в них одно и то же. При нормальных условиях, т. е. при температуре О °С и атмосферном давлении 101 325 Па, этот объем, как показывают измерения, равен
 (3.8.1)
(3.8.1)
Объем VM0 называют молярным.
Почему же в равных объемах газов при одинаковых давлениях и температурах всегда обнаруживается одно и то же число молекул независимо от того, какой газ взят? Объяснить это можно только с помощью молекулярно-кинетической энергии (см. §4.5).
Закон Дальтона
Чаще имеют дело не с чистым газом — кислородом, водородом и т. д., а со смесью газов. Атмосферный воздух, в частности, представляет собой смесь азота, кислорода и многих других газов. Каждый из газов смеси вносит свой «вклад» в суммарное давление на стенки сосуда. Давление, которое имел бы каждый из газов, составляющих смесь, если удалить из сосуда остальные газы, называют парциальным (т. е. частным) давлением.
Простейшее предположение, которое можно сделать, состоит в том, что давление смеси газов р равно сумме парциальных давлений всех газов р1, р2, р3 …:
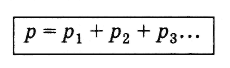 (3.8.2)
(3.8.2)
Английский химик Д. Дальтон установил, что для достаточно разреженных газов именно так и есть в действительности. Соотношение (3.8.2) называют законом Дальтона.
С точки зрения молекулярно-кинетической теории закон Дальтона выполняется потому, что взаимодействие между молекулами идеального газа пренебрежимо мало. Поэтому каждый газ оказывает на стенку сосуда такое давление, как если бы остальных газов не было.
Моль любого газа при нормальных условиях занимает объем 22,4 л. Это значение объема установлено экспериментально. В смеси газов каждый из них оказывает давление на стенки сосуда независимо от присутствия других газов.
§ 3.9. Уравнение состояния идеального газа
Состояние данной массы газа характеризуется тремя макроскопическими параметрами: давлением р, объемом V и температурой Т. Сейчас мы найдем связь между ними.
Уравнение состояния
В § 3.5 и 3.6 вы ознакомились с поведением идеального газа в специально созданных условиях. Два параметра из трех (р, V или V, Т) изменялись при постоянном значении третьего (Г или р). Обычно же в природе и технике у газа меняются сразу все три параметра. Например, когда нагретый у поверхности Земли воздух поднимается вверх, то он расширяется, давление его уменьшается и температура понижается.
Используя газовые законы (3.5.2) и (3.7.8), можно получить уравнение, связывающее все три параметра p, V и T, характеризующие состояние газа данной массы. Это уравнение называют уравнением состояния идеального газа.
studfile.net
6. Закон Авогадро,
Количество вещества V— физическая величина, определяемая числом специфических структурных элементов — молекул, атомов или ионов, из которых состоит вещество.
Единица количества вещества — моль — количество вещества системы, содержащей столько же структурных элементов, сколько содержится в 0,012 кг изотопа углерода 12С.
В одном моле различных веществ содержится одно и то же число молекул NА, называемое числом Авогадро. |
|
Закон Авогадро: моли любых газов при одинаковой температуре и давлении занимают одинаковые объемы.
При нормальных условиях (Т = Т0, р = р0) этот объем Vμ (молярный объем) равен: |
|
Молярная масса 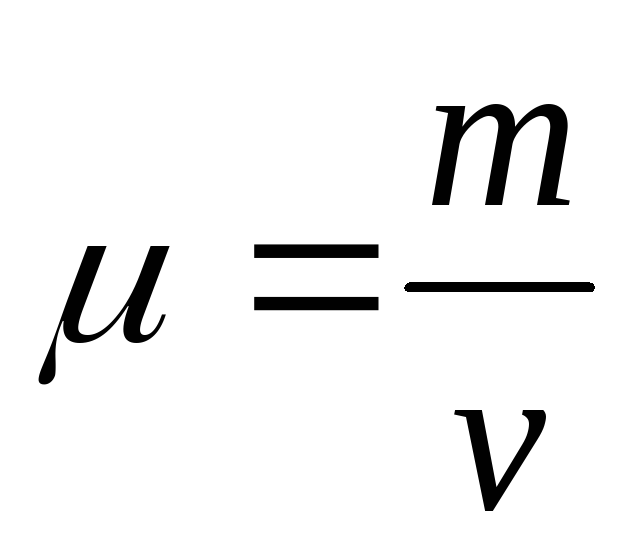 —
это
масса
одного
моля
вещества.
Отсюда:
—
это
масса
одного
моля
вещества.
Отсюда: 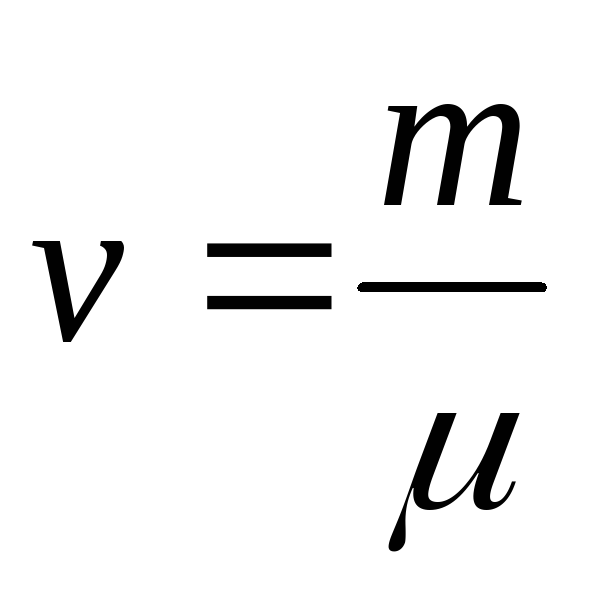
Единица молярной массы — килограмм на моль (кг/моль).
7. Закон Дальтона.
Парциальное давление — давление, которое производил бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при той же температуре.
Закон Дальтона: давление
смеси
идеальных
газов
равно
сумме
парциальных
давлений р1,р2,…,рn входящих
в
нее
газов: p =p1+p2+— + pn или 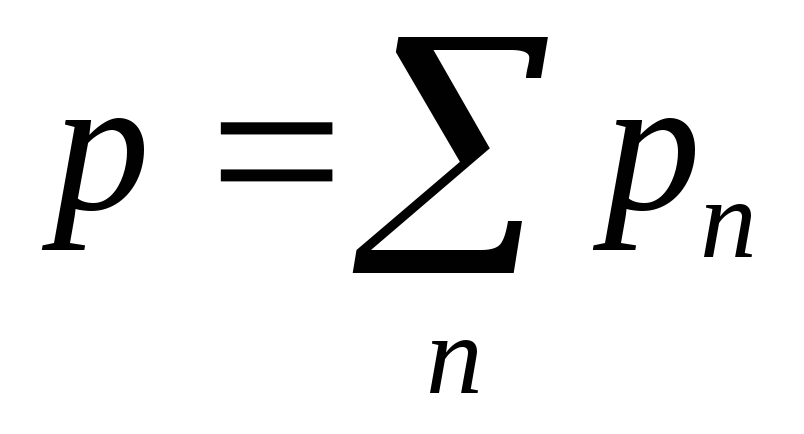
8 .Закон Гей-Люссака.
1) Давление р данной массы m газа при постоянном объеме изменяется линейно с температурой: p = p0(1 + αt), при V =const, m = const.
2) Объем V данной
массы m газа
при
постоянном
давлении
изменяется
линейно
с
температурой t: V = V0 (1
+ α t),
при р = const; m = const. где 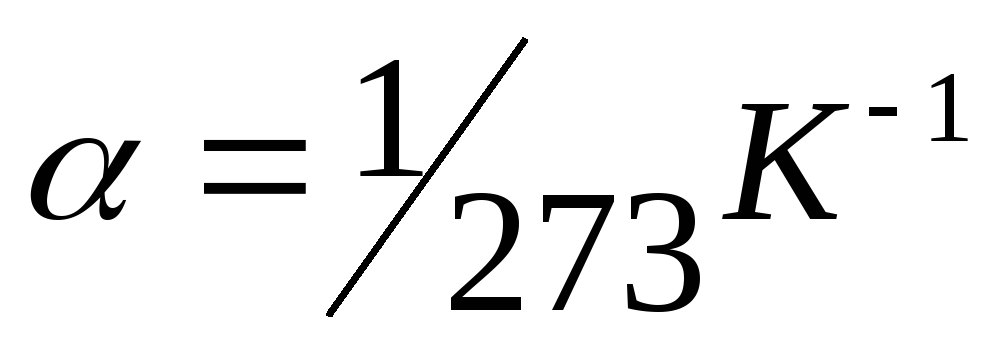 ,V0 и p0 —
объем
и
давление
при
t=
0°С;
,V0 и p0 —
объем
и
давление
при
t=
0°С;
Процесс, протекающий при постоянном давлении, называется изобарным. На диаграмме в координатах (V,t) этот процесс изображается прямой, называемой
изобарой.
Процесс, протекающий при постоянном объеме, называется изохорным. На диаграмме в координатах (p,t) он изображается прямой, называемой изохорой.
Изобары
и
изохоры
пересекают
ось
температуры
в точке 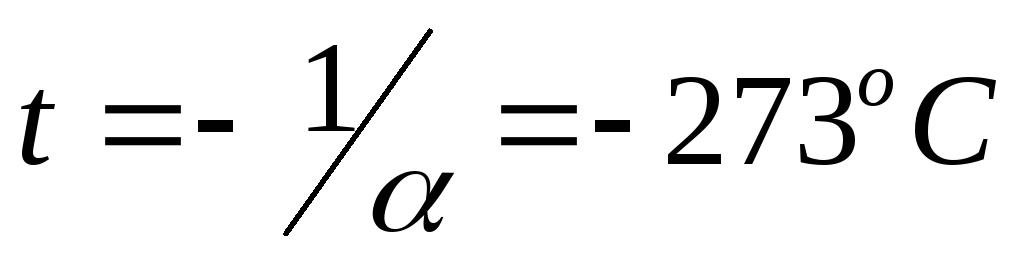 .
Если
начало
отсчета
сместить
в
эту
точку,
то
получим
.
Если
начало
отсчета
сместить
в
эту
точку,
то
получим
шкалу
Кельвина
(термодинамическую
температуру):  .
.
В термодинамической шкале температур:
V = V0(1 + αt) = V0αT, p = p0(1 +αt) = р0αТ
Откуда:
 или
или  const при р = const; m
= const
const при р = const; m
= const
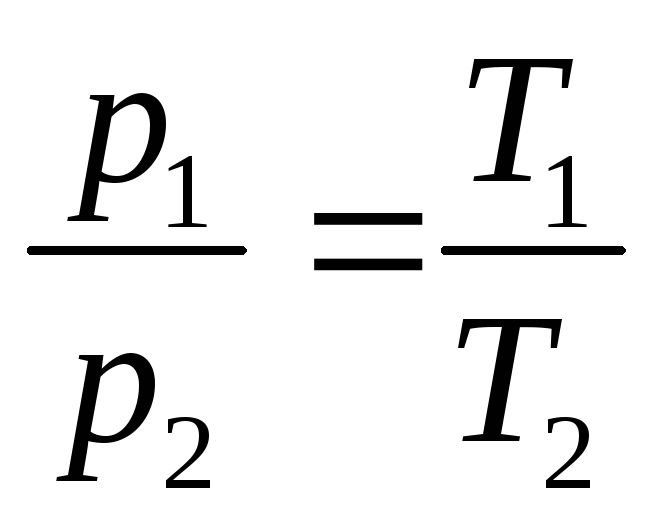 или
или  const при V = const; m
= const (з-н
Шарля),
const при V = const; m
= const (з-н
Шарля),
где индексы 1 и 2 относятся к произвольным состояниям, лежащим на одной изобаре или изохоре.
9. Уравнение состояния идеального газа.
Уравнением состояния термодинамической системы называется уравнение, которое связывает давление р, объем V и температуру Т термодинамической системы, находящейся в состоянии термодинамического равновесия:
f(p,V,T) = 0
где каждая из переменных является функцией двух других.

По законам Бойля-Мариотта и Гей-Люссака.
 ,
, 
Исключая 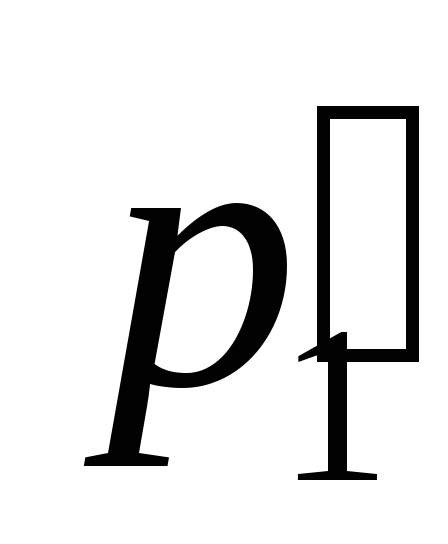 , получим уравнение состояния идеального газа:
, получим уравнение состояния идеального газа:
 или
или 
По закону Авогадро, при одинаковых р и Т моли всех газов занимают
одинаковый молярный объем Vμ. Уравнение состояния для моля
идеального газа: pVμ = RT, где константа R = 8,31 Дж/(моль·К) — называется
универсальной газовой постоянной.
Объем
газа массы т:  Отсюда
Отсюда 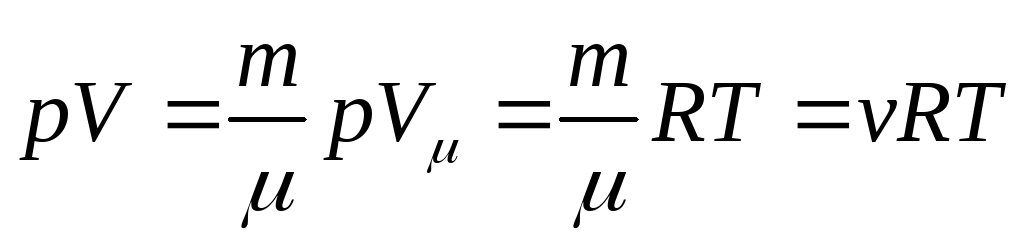
Уравнение Менделеева—Клапейрона — уравнение состояния для
массы т идеального газа:

Если
использовать постоянную Больцмана:  ,
,
то уравнение состояния примет вид:

где 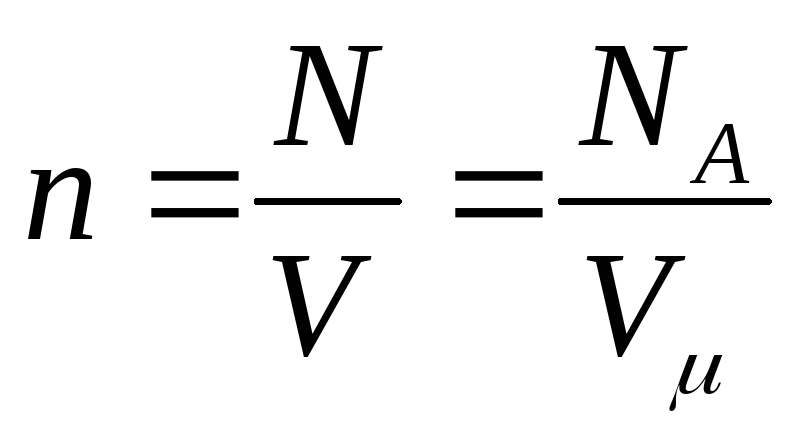 — концентрация молекул —
число
молекул
в
единице
— концентрация молекул —
число
молекул
в
единице
объема.
Таким образом:
давление идеального газа при данной температуре прямо пропорционально концентрации его молекул,
при одинаковых температуре и давлении все газы содержат в единице объема одинаковое число молекул.
Число молекул, содержащихся в 1м3 газа при нормальных условиях, называется числом Лошмидта:
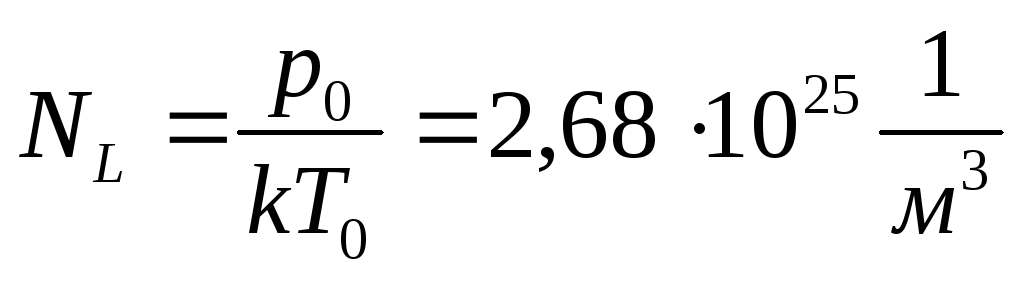
studfile.net
Закон Авогадро — Википедия
Материал из Википедии — свободной энциклопедии
Зако́н Авога́дро — закон, согласно которому в равных объёмах различных газов, взятых при одинаковых температурах и давлениях, содержится одно и то же количество молекул. В виде гипотезы был сформулирован в 1811 году Амедео Авогадро (1776—1856), профессором физики в Турине. Гипотеза была подтверждена многочисленными экспериментальными исследованиями и поэтому стала называться законом Авогадро, став впоследствии (через 50 лет, после съезда химиков в Карлсруэ) количественной основой современной химии (стехиометрии)[1]. Закон Авогадро точно выполняется для идеального газа, а для реальных газов он является тем более точным, чем газ более разреженный.
История[ | ]
Первые количественные исследования реакций между газами принадлежат французскому ученому Гей-Люссаку. Он является автором законов о тепловом расширении газов и закона объемных отношений. Эти законы были теоретически объяснены в 1811 году итальянским физиком Амедео Авогадро[2].
Следствия закона[ | ]
Первое следствие из закона Авогадро: один моль (одинаковое количество молей) любого газа при одинаковых — изобаричных и изотермичных — условиях занимает одинаковый объём.
Согласно закону Авогадро, одно и то же количество молекул любого газа занимает при одинаковых условиях один и тот же объём. С другой стороны, 1 моль любого вещества содержит (по определению) одинаковое количество частиц (англ.) (например, молекул). Отсюда следует, что при определённых температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объём.
В частности, при нормальных условиях, то есть при 0 °C (273,15 К) и 101,325 кПа, объём 1 моля газа равен 22,413 962(13) л. Эту физическую константу называют стандартным молярным объёмом идеального газа и обозначают Vm. Пересчитать эту величину на другие температуру и давление можно с помощью уравнения Клапейрона:
- PVT=101,3 kPa⋅22,414 l273 K.{\displaystyle {\frac {PV}{T}}={\frac {101,3~\mathrm {kPa} \cdot 22,414~\mathrm {l} }{273~\mathrm {K} }}.}
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа ко второму.
Это положение имело важное значение для развития химии, так как оно дает возможность определять молекулярную массу веществ, способных переходить в газообразное или парообразное состояние (см. Атомно-молекулярное учение). Если через μ обозначить молекулярную массу вещества и через ρ′ — его относительную плотность в газообразном состоянии, то отношение μ / ρ′ должно быть постоянным для всех веществ. Опыт показал, что для всех изученных веществ, переходящих в газообразное состояние без разложения, эта постоянная равна 28,9 а.е.м. (атомных единицы массы), если при определении относительную плотность исходить из плотности воздуха; но эта постоянная будет равняться 2 а.е.м., если принять за единицу плотность водорода. Обозначив эту постоянную, или, что то же, общее для всех газов отношение молекулярной массы к относительной плотности через С, мы из формулы имеем с другой стороны μ′ = ρ′C. Так как относительная плотность ρ′ газа определяется легко, то, подставив её значение в формулу, можно вывести и неизвестную молекулярную массу данного вещества.
Пример использования закона Авогадро[ | ]
Элементный анализ одного из углеводородов, выполненный А. М. Бутлеровым, указывал, что отношение атомного содержания углерода к водороду составляет в нём 1 к 2, а потому его относительный состав может быть выражен формулой СН2 или C2H4, C4H8 и вообще (СН2)n. Молекулярная масса этого углеводорода определяется, следуя закону Авогадро, из плотности его пара, которая оказалась в 5,85 раз больше плотности воздуха; отсюда молекулярная масса этого вещества равна ρ′C = 5,85 · 28,9 а.е.м. = 169,06 а.е.м. Формуле
encyclopaedia.bid