Периодическая система химических элементов (таблица Менделеева)
https://ria.ru/20190129/1550014194.html
Периодическая система химических элементов (таблица Менделеева)
Периодическая система химических элементов (таблица Менделеева) — РИА Новости, 29.01.2019
Периодическая система химических элементов (таблица Менделеева)
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация. РИА Новости, 29.01.2019
2019-01-29T04:51
2019-01-29T04:51
2019-01-29T04:51
справки
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/99408/72/994087230_0:105:2000:1230_1920x0_80_0_0_b528d261d40438ab5524fc6ad7f580a3.jpg
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация. Является табличным представлением периодического закона, открытого Дмитрием Менделеевым. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер.Прообразом Периодической системы химических элементов служит таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходств», составленная Менделеевым в 1869 году. По мере совершенствования этой таблицы он развил представления о периодах и группах элементов и о месте каждого элемента в системе. В 1871 году в книге «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классическая короткая форма Периодической системы химических элементов. Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og).
Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер.Прообразом Периодической системы химических элементов служит таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходств», составленная Менделеевым в 1869 году. По мере совершенствования этой таблицы он развил представления о периодах и группах элементов и о месте каждого элемента в системе. В 1871 году в книге «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классическая короткая форма Периодической системы химических элементов. Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали «большой гонкой».Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером). Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов.
Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали «большой гонкой».Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером). Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.Первый период содержит два элемента – водород и гелий. Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов. Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов. Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды.
В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.Первый период содержит два элемента – водород и гелий. Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов. Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов. Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды. Лантаноиды и актиноиды помещены отдельно внизу таблицы.Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия «химический элемент» и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.
Лантаноиды и актиноиды помещены отдельно внизу таблицы.Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия «химический элемент» и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики. По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2019
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/99408/72/994087230_112:0:1889:1333_1920x0_80_0_0_597a34ca28aa89475eedcbd63e1a68a3.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
справки
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация.
Является табличным представлением периодического закона, открытого Дмитрием Менделеевым. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер.Прообразом Периодической системы химических элементов служит таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходств», составленная Менделеевым в 1869 году. По мере совершенствования этой таблицы он развил представления о периодах и группах элементов и о месте каждого элемента в системе. В 1871 году в книге «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классическая короткая форма Периодической системы химических элементов.
Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали «большой гонкой».Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером).
Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.
Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18).
В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.
Первый период содержит два элемента – водород и гелий.
Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов.
Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов.
Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.
Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды.
Лантаноиды и актиноиды помещены отдельно внизу таблицы.
Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия «химический элемент» и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.
Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
Периодический закон и ПСХЭ Д. И. Менделеева
Периодический закон и Периодическая система химических элементов Д.И. Менделеева
С первых дней изучения химии мы используете периодическую таблицу. Она демонстрирует то, что все химические элементы представляют собой единое целое, т.е. систему. Поэтому периодическую таблицу Д.И. Менделеева называют Периодической системой химических элементов.
Д.И.
Менделеев — выдающийся русский химик, создатель естественной
классификации химических элементов – Периодической системы элементов,
являющейся выражением периодического закона химических элементов.
Как же он это сделал? Давайте представим себе …
В качестве основы для систематизации химических элементов он выбрал главную
А. Шанкуртуа Д. Ньюлендс Л. Мейер
Установить
такую закономерность было непросто, ведь в то время было известно ещё не очень
много химических элементов, да и атомные массы большинства из них были
определены неточно. Но Д .И. Менделеев для каждого химического
элемента записал на карточке: символ элемента, значение относительной
атомной массы, формулы и характер высшего оксида и гидроксида.
Но Д .И. Менделеев для каждого химического
элемента записал на карточке: символ элемента, значение относительной
атомной массы, формулы и характер высшего оксида и гидроксида.
Так было расположено 63 известных, в то время, химических элементов в одну цепочку в порядке возрастания их относительных атомных масс. Проанализировал эту совокупность, была найдена в ней определённая закономерность. В этой цепочке есть интервалы, в которых свойства элементов и их соединений изменяются сходным образом.
Так, через семь элементов (благородные газы тогда были не открыты), если начинать с лития (Li), появляется снова щелочной металл натрий (Na), ещё через семь элементов – следующий щелочной металл – калий (K).
Точно такая же повторяемость обнаружена и у галогенов (элементов VII A группы):

Запомните: в пределах одного периода с увеличением относительных атомных масс металлические свойства ослабевают, а неметаллические свойства усиливаются, увеличивается степень окисления элементов в высших оксидах от +1 до +8, а степень окисления элементов в летучих водородных соединениях увеличивается от -4 до -1. Основные оксиды через амфотерные сменяются кислотными, а гидроксиды от щелочей через амфотерные гидроксиды сменяются кислородсодержащими кислотами.
Систематизируя химические элементы на основе их относительных атомных масс, уделялось большое внимание свойствам элементов и образованных ими веществ, поэтому и распределялись элементы со сходными свойствами друг под другом, т.е. в группы
. Иногда, приходилось ставить элементы с большими значениями относительных атомных впереди элементов с меньшими значениями относительных атомных масс.
Например, кобальт (Co) перед никелем (Ni), теллур (Te) – перед йодом (I). Такой порядок расположения был необходимым потому, что иначе эти элементы попали бы в группу несходных с ними по свойствам элементов. Однако делалось это интуитивно, без возможности объяснить эти исключения из общего правила, как и периодичность изменения свойств элементов и образованных ими веществ. Но уже тогда предполагалось, что эта причина кроется в сложном строении атома.
Вот почему таблицу химических элементов называют «периодической». Т.к. общие закономерности в изменении свойств атомов
Эту закономерность была сформулирована в виде Периодического закона в 1869 году:
Д. И. Менделеев пришёл к открытию Периодического
закона. Проведя сопоставление свойств и относительных атомных масс химических
элементов и уже тогда, сделал несколько прогнозов о свойствах ещё
неизвестных в то время элементов, и указал пути их открытия.
Для этих химических элементов он оставил пустые клеточки.
И. Менделеев пришёл к открытию Периодического
закона. Проведя сопоставление свойств и относительных атомных масс химических
элементов и уже тогда, сделал несколько прогнозов о свойствах ещё
неизвестных в то время элементов, и указал пути их открытия.
Для этих химических элементов он оставил пустые клеточки.
Поэтому, в соответствии с современными представлениями строения атома, основой классификации химических элементов является
не относительная атомная масса, а заряд ядра атома. И современная формулировка Периодического закона сейчас звучит иначе:|
|
Периодичность
в изменении свойств элементов и их соединений объясняется
периодической повторяемостью в строении внешних энергетических уровней их
атомов. Именно число энергетических уровней, общее число
электронов и число электронов на внешнем уровне отражают
физический смысл номера периода и группы, порядкового номера. Строение
атома позволяет объяснить и причины изменения металлических и неметаллических
свойств элементов в пределах группы и периода.
Строение
атома позволяет объяснить и причины изменения металлических и неметаллических
свойств элементов в пределах группы и периода.
Периодический закон и Периодическая система:
· обобщают знания о химических элементах и образованных ими веществах
· объясняют периодичность в изменении их свойств
· объясняют причину сходства свойств элементов
· позволяют прогнозировать, т.е. предсказывать свойства и пути открытия новых химических элементов.
Американские учёные, открывшие элемент №101, дали ему название «менделевий» в знак признания заслуг великого русского химика Д.И. Менделеева, который первым применил Периодическую систему элементов для предсказания свойств тогда ещё не открытых элементов.
Учёные-первооткрыватели
новых элементов высоко оценили открытие русского учёного.
Например, К. Винклер говорил:
«Вряд ли может существовать более яркое доказательство справедливости учения о периодичности элементов, чем открытие до сих пор гипотетического экасилиция; оно составляет, конечно, более чем простое подтверждение смелой теории, — оно знаменует собой выдающееся расширение химического поля зрения, гигантский шаг в области познания».
Дмитрием Ивановичем Менделеевым сдана в набор рукопись «Опыт системы элементов, основанной на их атомном весе и химическом сходстве»
17 февраля (1 марта) 1869 г. Дмитрием Ивановичем Менделеевым была сдана в набор рукопись «Опыт системы элементов, основанной на их атомном весе и химическом сходстве» — первый вариант Периодической таблицы элементов. Окончательная формулировка закона была дана учёным в июле 1871 г.
Периодический закон был открыт Д. И. Менделеевым в ходе работы над текстом учебника «Основы химии», когда он столкнулся с трудностями систематизации фактического материала.
Открытие периодической таблицы элементов было совершено не случайно, это был результат огромного труда, длительной и кропотливой работы, которая была затрачена и самим Дмитрием Ивановичем, и множеством химиков из числа его предшественников и современников. «Когда я стал окончательно оформлять мою классификацию элементов, я написал на отдельных карточках каждый элемент и его соединения, и затем, расположив их в порядке групп и рядов, получил первую наглядную таблицу периодического закона. Но это был лишь заключительный аккорд, итог всего предыдущего труда…» — говорил учёный. Менделеев подчёркивал, что его открытие было итогом, завершившим собой двадцатилетнее размышление о связях между элементами, обдумывание со всех сторон взаимоотношений элементов.
17 февраля (1 марта) рукопись статьи, содержащая таблицу под названием «Опыт системы элементов, основанной на их атомном весе и химическом сходстве», была закончена и сдана в печать с пометками для наборщиков и с датой «17 февраля 1869 г.
В первом варианте системы элементы были расставлены учёным по девятнадцати горизонтальным рядам и по шести вертикальным столбцам. 17 февраля (1 марта) открытие периодического закона отнюдь не завершилось, а только началось. Его разработку и углубление Дмитрий Иванович продолжал еще в течение почти трёх лет. В 1870 г. Менделеев в «Основах химии» опубликовал второй вариант системы («Естественную систему элементов»): горизонтальные столбцы элементов-аналогов превратились в восемь вертикально расположенных групп; шесть вертикальных столбцов первого варианта превратились в периоды, начинавшиеся щелочным металлом и заканчивающиеся галогеном. Каждый период был разбит на два ряда; элементы разных вошедших в группу рядов образовали подгруппы.
Сущность открытия Менделеева заключалась в том, что с ростом атомной массы химических элементов их свойства меняются не монотонно, а периодически. После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, свойства начинают повторяться. Отличием работы Менделеева от работ его предшественников было то, что основ для классификации элементов у Менделеева была не одна, а две — атомная масса и химическое сходство. Для того, чтобы периодичность полностью соблюдалась, Менделеев исправил атомные массы некоторых элементов, несколько элементов разместил в своей системе вопреки принятым в то время представлениям об их сходстве с другими, оставил в таблице пустые клетки, где должны были разместиться пока не открытые элементы.
В 1871 г. на основе этих работ Менделеев сформулировал Периодический закон, форма которого со временем была несколько усовершенствована.
Периодическая система элементов оказала большое влияние на последующее развитие химии. Она не только была первой естественной классификацией химических элементов, показавшей, что они образуют стройную систему и находятся в тесной связи друг с другом, но и явилась могучим орудием для дальнейших исследований. В то время, когда Менделеев на основе открытого им периодического закона составлял свою таблицу, многие элементы были еще неизвестны. Менделеев был не только убеждён, что должны существовать неизвестные еще элементы, которые заполнят эти места, но и заранее предсказал свойства таких элементов, основываясь на их положении среди других элементов периодической системы. В течение следующих 15 лет предсказания Менделеева блестяще подтвердились; все три ожидаемых элемента были открыты (Ga, Sc, Ge), что было величайшим триумфом периодического закона.
Она не только была первой естественной классификацией химических элементов, показавшей, что они образуют стройную систему и находятся в тесной связи друг с другом, но и явилась могучим орудием для дальнейших исследований. В то время, когда Менделеев на основе открытого им периодического закона составлял свою таблицу, многие элементы были еще неизвестны. Менделеев был не только убеждён, что должны существовать неизвестные еще элементы, которые заполнят эти места, но и заранее предсказал свойства таких элементов, основываясь на их положении среди других элементов периодической системы. В течение следующих 15 лет предсказания Менделеева блестяще подтвердились; все три ожидаемых элемента были открыты (Ga, Sc, Ge), что было величайшим триумфом периодического закона.
Большое значение имела периодическая система также при установлении валентности и атомных масс некоторых элементов. Точно так же периодическая система дала толчок к исправлению атомных масс некоторых элементов. Именно на её основе были искусственно созданы трансурановые элементы. Последующее развитие науки позволило, опираясь на периодический закон, гораздо глубже познать строение вещества, чем это было возможно при жизни Менделеева. Сам учёный о своём законе сказал так: «Будущее не грозит периодическому закону разрушением, а обещаются только надстройка и развитие».
Последующее развитие науки позволило, опираясь на периодический закон, гораздо глубже познать строение вещества, чем это было возможно при жизни Менделеева. Сам учёный о своём законе сказал так: «Будущее не грозит периодическому закону разрушением, а обещаются только надстройка и развитие».
Лит.: Агафошин Н. П. Периодический закон и периодическая система элементов Д. И. Менделеева. М., 1973; Евдокимов Ю. К истории периодического закона // Наука и жизнь. № 5 (2009). С. 12—15; Кедров Б. M. День одного великого открытия. M., 1958; Кедров Б. M., Трифонов Д. H. Закон периодичности и химические элементы. Открытия и хронология. M., 1969; Макареня А. А., Рысев Ю. В. Д. И. Менделеев. М., 1983; Макареня А. А., Трифонов Д. Н. Периодический закон Д. И. Менделеева. М., 1969; Макареня А. А., Трифонов Д. Н. Периодический закон Д. И. Менделеева. М., 1969; Менделеев Д. И. Периодический закон. Основные статьи. M., 1958.
См. также в Президентской библиотеке:
Кузнецов Б. Г. Ломоносов. Лобачевский. Менделеев : очерки жизни и мировоззрения. М.; Л., 1945;
Г. Ломоносов. Лобачевский. Менделеев : очерки жизни и мировоззрения. М.; Л., 1945;
Менделеев Д. И. Заветные мысли Д. Менделеева. СПб., 1903-1905;
Семенченко В. К. Менделеев и физика атома. Пенза, 1945;
Тобольск. Памятник Д. И. Менделееву [Изоматериал] / фото А. Мусина. М., 1969;
Учреждена Главная палата мер и весов // День в истории. 20 июня 1893 г.
Таблица Менделеева
Экспонат состоит из сенсорного экрана с диагональю 68 см, на котором представлена периодическая таблица химических элементов Д. И. Менделеева.
Посетитель имеет возможность самостоятельно конструировать химические соединения, перетаскивая представленные на экране элементы из таблицы в центральное окно, являющееся имитацией пробирки для химических экспериментов. Например, для конструирования поваренной соли нужно «уложить в пробирку» один атом натрия и один атом хлора. Если химическая формула составлена правильно, всплывает окно с фотоснимком и характеристиками синтезированного соединения. Если формула ошибочна, будут предложены варианты выбора элементов, до получения положительного результата. Удалив полученное вещество, можно конструировать новое.
Если формула ошибочна, будут предложены варианты выбора элементов, до получения положительного результата. Удалив полученное вещество, можно конструировать новое.
Таблица является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан им в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). В настоящее время предложено несколько сотен вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.). Международным союзом теоретической и прикладной химии (IUPAC), в качестве основного, предложен т.н. длинный вариант таблицы Менделеева, состоящий из 18 вертикальных столбцов (группы) и 7 горизонтальных строк (периоды), где группы определяют основные физико-химические свойства, а периоды, в определённой мере, подобны друг другу, так как каждый период (за исключением первого) начинается типичным металлом (Li, Nа, К, Rb, Cs, Fr) и заканчивается благородным газом (Не, Ne, Ar, Kr, Хе, Rn), которому предшествует галоген (F, Cl, Br, I, At,).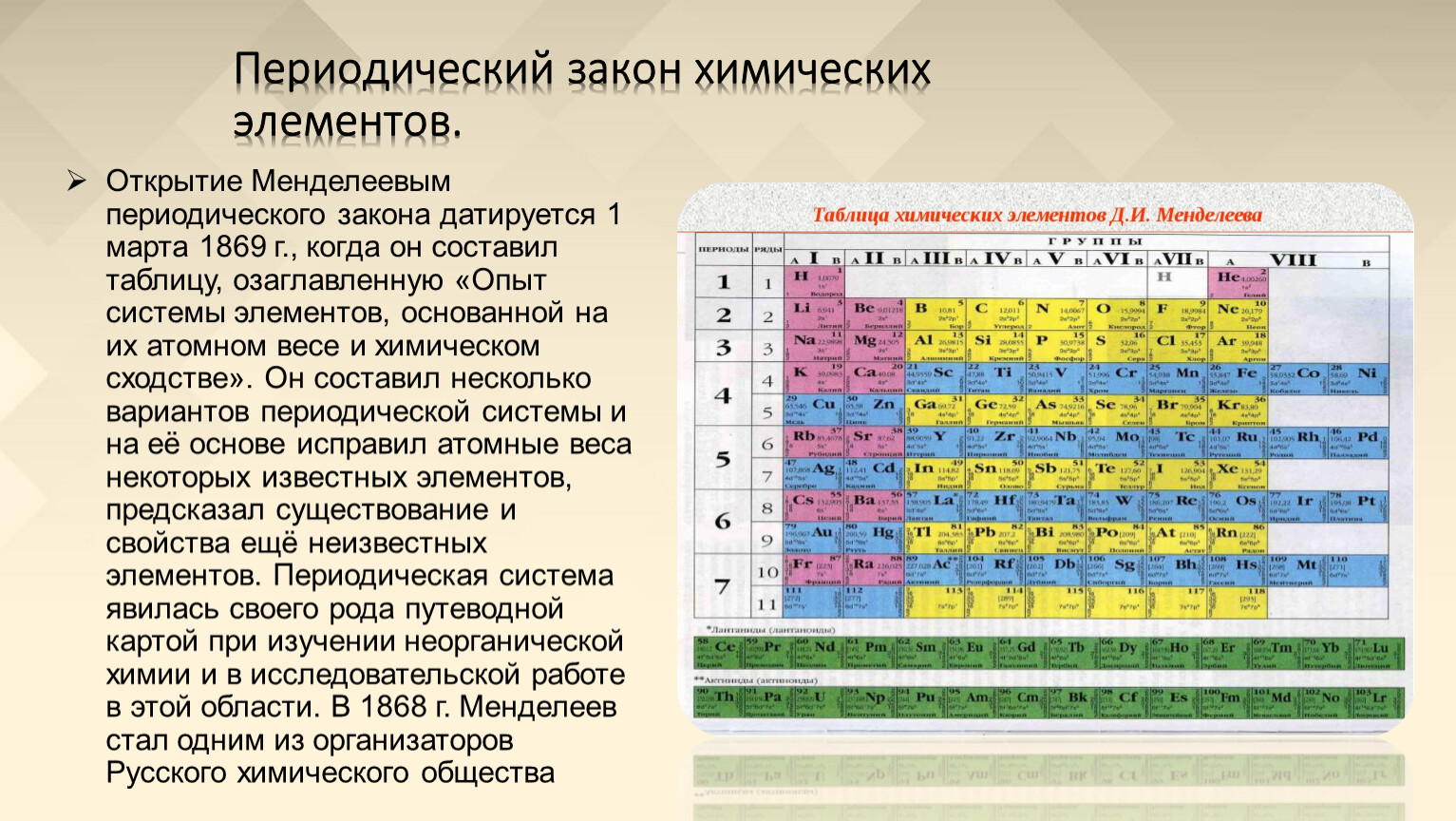
Именно этот вариант таблицы представлен на экспонате.
Периодический закон был сформулирован Д. И. Менделеевым в следующем виде (1871): «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Научная достоверность Периодического закона получили подтверждение очень скоро: в 1875—1886 годах были открыты галлий (экаалюминий), скандий (экабор) и германий (экасилиций), для которых Менделеев, пользуясь периодической системой, предсказал не только возможность их существования, но и, с поразительной точностью, целый ряд физических и химических свойств.
С развитием атомной физики и квантовой химии Периодический закон получил строгое теоретическое обоснование. Была создана квантово-механическая модель периодического изменения электронного строения атомов химических элементов по мере возрастания зарядов их ядер, что в большинстве случаев соответствует расположению по атомным весам.
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
Дальнейшее развитие периодической системы связано с заполнением пустых клеток таблицы, в которые помещались всё новые и новые элементы: благородные газы, природные и искусственно полученные радиоактивные элементы. Седьмой период периодической системы до сих пор не завершён, проблема нижней границы таблицы Менделеева остаётся одной из важнейших в современной теоретической химии.
Периодический закон Менделеева | Русские химики
Главный закон, управляющий миром химических элементов, открыл великий русский ученый Дмитрий Иванович Менделеев.
Ко времени этого открытия было известно 63 химических элемента. Накопилось огромное количество сведений и об их свойствах. Однако, изобилие не осмысленных с единой точки зрения фактов было источником трудностей и путаницы в химии. Гениальный русский химик, открыв закон, которому подчиняются свойства элементов, а также и строение атомов, разрешил эти трудности.
Однако, изобилие не осмысленных с единой точки зрения фактов было источником трудностей и путаницы в химии. Гениальный русский химик, открыв закон, которому подчиняются свойства элементов, а также и строение атомов, разрешил эти трудности.
Дмитрий Иванович Менделеев.
Тщательно изучая и сопоставляя свойства химических элементов, он стремился раскрыть тайны далекого и близкого их родства.
Менделеев так описывает, свои искания: «…невольно зарождается мысль о том, что между массой и химическими особенностями элементов необходимо должна быть Связь… Искать же что-либо — хотя бы грибов или какую-либо зависимость — нельзя иначе, как смотря и пробуя. Вот я и стал подбирать, написав на отдельных карточках элементы с их атомными весами и коренными свойствами, сходные элементы и близкие атомные веса, что быстро и привело к тому заключению, что свойства элементов стоят в периодической зависимости от их атомного веса…»
Расположив элементы в порядке нарастания атомных весов, ученый получил ряды элементов; в каждом из рядов свойства элементов периодически повторяются.
По определению самого Менделеева, открытый им периодический закон заключается в том, что «свойства элементов (а следовательно, и образованных ими простых и сложных тел) находятся в периодической зависимости от их атомных весов».
Великую прозорливость проявил Менделеев, открыв периодичность в мире элементов, в то время когда множество элементов не было еще открыто, а атомные веса некоторых из известных элементов были определены неверно. Но доказать неопровержимо существование этой закономерности оказалось делом чрезвычайно трудным.
Когда Менделеев в своих изысканиях исходил из атомных весов, встречавшихся в работах того времени, периодичность нередко нарушалась.
Но ученый не стал в тупик. Он твердо был убежден в существовании периодической зависимости свойств элементов от их атомных весов. И когда он наблюдал нарушения периодичности, для него был возможен лишь один-единственный вывод, — очевидно, неверны или неполны данные, которыми располагала наука. Он исправлял на основании теоретических расчетов атомные веса некоторых элементов. Так было с индием, платиновыми металлами, ураном и другими элементами; позднейшие, более точные измерения их весов подтвердили правильность этих исправлений.
Он исправлял на основании теоретических расчетов атомные веса некоторых элементов. Так было с индием, платиновыми металлами, ураном и другими элементами; позднейшие, более точные измерения их весов подтвердили правильность этих исправлений.
В 1869 году, опубликовав в журнале Русского химического общества свою работу «Соотношение свойств с атомным весом элементов», Менделеев познакомил ученый мир с открытым им периодическим законом. К статье была приложена таблица периодической системы элементов. Излагая сущность открытого закона, великий ученый указывал также на существование еще неизвестных науке элементов.
В таблице Менделеева химические элементы располагаются в порядке возрастания их атомного веса.
Много мест в своей системе Менделеев оставил для еще не открытых элементов, примерный атомный вес и другие свойства которых ученый высчитал, учитывая характер соседних элементов. Менделеев впервые в истории химии предсказал существование неизвестных элементов. Он писал, что должны существовать еще элементы, которые он назвал экаалюминием, экабором и экакремнием.
Он писал, что должны существовать еще элементы, которые он назвал экаалюминием, экабором и экакремнием.
Ряд ученых отнесся к предсказанию русского ученого с большим недоверием.
Но вот в августе 1875 года французский ученый Лекок де Буа-бодран путем спектрального анализа обнаружил в цинковой обманке новый элемент, названный им галлием (Галлия — старинное наименование Франции).
В 1879 году известный шведский химик Нильсон открыл второй из предсказанных Менделеевым элементов. Свойства скандий, как назвал новый элемент Нильсон, полностью совпали со свойствами предсказанного Менделеевым экабора. Оправдались даже опасения русского ученого, что открытию экабора в минералах будет мешать присутствие другого химического элемента — иттрия.
«Таким образом, — заканчивает Нильсон свое сообщение об открытии нового элемента, — подтверждаются соображения русского химика, которые не только позволили предсказать существование названных элементов — скандия и галлия, но и предвидеть заранее их важнейшие свойства».
Наконец в 1886 году немецкий ученый Винклер открыл третий предугаданный Менделеевым элемент. В своем сообщении об этом Винклер указывал, что новый элемент — германий — как раз и есть предсказанный Менделеевым экакремний.
Это было полное торжество открытия Менделеева.
Фридрих Энгельс писал, что открытием периодического закона Менделеев «совершил научный подвиг».
Открытие Менделеева явилось могучим подтверждением одного из основных законов диалектики — закона перехода количества в качество.
Свойства химических элементов зависят от атомных весов. Закон перехода количества в качество, как писал Фридрих Энгельс, «имеет силу… и для самих химических элементов».
Одним из укрепителей периодического закона Д. И. Менделеева был известный чешский ученый Богуслав Браунер (1855—1935). Браунер своими работами подтвердил, что место, указанное Менделеевым для химического элемента бериллия в системе, является правильным. Отсюда и атомный вес этого элемента, высчитанный русским ученым на основании периодического закона, тоже правилен.
Отсюда и атомный вес этого элемента, высчитанный русским ученым на основании периодического закона, тоже правилен.
Менделеев с благодарностью писал потом о работе Б. Ф. Браунера, вспоминая, как часто ему «приходилось слышать о том, что вопрос об атомном весе бериллия грозит поколебать общность периодического закона, может потребовать глубоких в нем преобразований».
Атомный вес церия Менделеев исправил на основании открытого им закона с 92, как было признано всеми, на 138. Это вызвало бурный протест со стороны некоторых ученых.
«Как, — писал химик Раммельсберг, — исправлять атомные веса, руководствуясь какой-то таблицей! Да это чистейшей воды спекуляция!— шумел он. — Это подгон фактов под какую-то схему!»
Менделеев ответил на это: «Я полагаю, что ныне не должно, невозможно делать какие-либо точные соображения об элементах, минуя закон периодичности».
Позднее Браунер своими работами подтвердил правильность атомного веса церия, теоретически выведенного Менделеевым. Браунер же, а затем и английский физик Мозли указали на необходимость выделения в особое место так называемых редкоземельных элементов.
Браунер же, а затем и английский физик Мозли указали на необходимость выделения в особое место так называемых редкоземельных элементов.
В 1884 году ученый-революционер Н. А. Морозов, находясь в заключении в Шлиссельбургской крепости, закончил там свою работу по анализу таблицы Менделеева. Он тоже теоретически предсказал существование группы химических элементов — инертных газов.
Принадлежность элемента к той или иной группе таблицы Менделеева указывает на количество протонов и нейтронов в ядре атома элемента и количество электронов в электронной оболочке.
Принадлежность элемента к тому или иному периоду таблицы Менделеева говорит о количестве слоев в электронной оболочке атома.
Там, где теперь в таблице Менделеева поставлены «благородные газы» — гелий, неон, аргон и другие, у Морозова были числа 4, 20, 40 и т. д., показывающие атомные веса недостающих элементов. Все эти химические элементы были выделены Морозовым в отдельную, нулевую группу.
Предвидение русских ученых было подтверждено работами английских ученых Релея и Рамзея, открывших инертные газы.
Неоспоримо величие русского гения — Менделеева. Но все же нашлись люди, которые пытались отнять у Менделеева право называться автором периодического закона. Менделеев вступил в борьбу за приоритет России в открытии периодического закона.
«Утверждение закона, — писал он, — возможно только при помощи вывода из него следствий, без него невозможных и неожидаемых, и оправдания тех следствий в опытной проверке. Потому-то, увидев периодический закон, я со своей стороны (1869—1871 гг.) вывел из него такие логические следствия, которые могли показать, верен ли он или нет… Без такого способа испытания не может утвердиться ни один закон природы. Ни Шанкуртуа, которому французы приписывают право на открытие периодического закона, ни Ньюлендс, которого выставляют англичане, ни Л. Мейер, которого цитировали иные как основателя периодического закона, не рисковали предугадывать свойства неоткрытых элементов, изменять «принятые веса атомов» и вообще считать периодический закон новым, строго постановленным законом природы, могущим охватывать еще доселе необобщенные факты, как это сделано мною с самого начала».
Предвосхищая позднейшие открытия естествознания, гениальный творец периодического закона предсказал, что атом неделим лишь химическим способом.
С помощью закона Менделеева русские ученые Б. Н. Чичерин и Н. А. Морозов (об их работах говорится ниже) предложили на основании умозрительных положений первую модель атома, в которой он изображается в виде системы тел, напоминающей солнечную систему. Позднейшие опытные исследования и математические расчеты показали, что такое уподобление имеет некоторые основания.
Закон Менделеева — мощное орудие познания природы и ее закономерностей. Все последующее развитие химии и физики шло в непосредственной связи с законом Менделеева и в зависимости от него. Все открытия в этих науках освещались его законом. С помощью этого закона показывался теоретический смысл открытий. В то же время каждое такое открытие приводило к уточнению и расширению закона, не затрагивая его принципиальных основ.
Руководствуясь периодическим законом, наука определила строение атомов всех элементов, которые, как установлено, состоят из электронной оболочки и ядра.
Число электронов возрастает от одного у атома водорода до 101 у атома менделеевия, открытого недавно и названного именем первооткрывателя периодического закона; число это находится в полном соответствии с порядковым номером элемента в системе Менделеева. Заряд ядра равен сумме зарядов электронов. Положительный заряд ядра, уравновешивающий отрицательные электроны, растет от 1 до 101. Положительный заряд ядра — это основное свойство атома, сообщающее ему химическую индивидуальность, так как от положительного заряда ядра зависит число электронов.
Ядро также оказалось сложным: оно состоит из протонов и нейтронов. Это основная масса атома; масса электрона в расчет не принимается, так как она в 1836,5 раза меньше массы протона.
Электроны у всех атомов одинаковы, но располагаются они вокруг ядра в различных слоях. Количество этих слоев раскрывает глубочайшее значение периодов, на которые разбиты все элементы в системе Менделеева. Каждый период отличается от другого наличием у атомов его элементов лишнего электронного слоя.
От строения электронной оболочки зависят химические свойства атома, так как химические реакции связаны с обменом внешних электронов. Кроме того, ряд физических свойств — электро- и теплопроводность, а также и оптические свойства тоже связаны с электронами.
Современная наука все шире и шире раскрывает значение гениального творения Менделеева.
Периодический закон указывал на сходство химических свойств элементов, расположенных в одной группе, то есть в одном и том же вертикальном столбце таблицы.
Теперь это прекрасно объясняется строением электронной оболочки атома. Элементы одной и той же группы имеют одинаковое количество электронов во внешнем слое: элементы первой группы — литий, натрий, калий и другие — имеют по одному электрону во внешнем слое; элементы второй группы — бериллий, магний, кальций и другие — по два электрона; элементы третьей группы — по три, и, наконец, элементы нулевой группы: гелий — два, неон, криптон и другие — по восемь электронов. Это максимальное из возможных количество электронов в наружном слое и обеспечивает данным атомам полную инертность: в обычных условиях они не вступают в химические соединения.
Это максимальное из возможных количество электронов в наружном слое и обеспечивает данным атомам полную инертность: в обычных условиях они не вступают в химические соединения.
Изотопы.
Современная наука показала, что вес атомов одного и того же элемента может быть не одинаков, — это зависит от различного количества нейтронов в атомном ядре данного химического элемента. Поэтому в отдельной клетке менделеевской таблицы располагается не один тип атомов, а несколько. Такие атомы называются изотопами (в переводе с греческого «изотоп» означает «занимающий одно и то же место»). Химический элемент олово состоит, например, из 12 разновидностей, чрезвычайно близких по свойствам, но с разными атомными весами: средний атомный вес олова 118,7.
Изотопы имеются почти у всех элементов.
Пока обнаружено 300 естественных изотопов, искусственно удалось получить около 800. Но все они закономерно располагаются в 101 клетке таблицы Менделеева.
Все эти открытия, вызванные к жизни законом Менделеева, подчеркивают гениальность русского ученого, открывшего основной закон неживой природы, который, однако, имеет также колоссальное значение и для органического мира.
Искусственное получение новых химических элементов, не существующих в природе.
Системой Менделеева пользуются сейчас ученые и при расщеплении атомов и при создании новых элементов.
Этим атомным законом руководствуются и химики, и физики, и геологи, и агрономы, и строители, и механики, и электрики, и астрономы.
Спектроскоп показал, что элементы, которые существуют на Земле, есть и на других планетах. Те химические превращения, какие происходят у нас, могут протекать и в других частях вселенной.
Современная наука вторглась в недра атома. Родилась новая наука — физика атомного ядра. Воздействуя на атомное ядро, ученые теперь превращают одни элементы в другие, синтезируют такие элементы, которых в земной коре в настоящее время не встречается. К новым, искусственно созданным элементам относится группа заурановых химических элементов. Современная наука открыла путь и к использованию внутриядерной энергии. Все эти открытия неразрывно связаны с законом Менделеева.
К новым, искусственно созданным элементам относится группа заурановых химических элементов. Современная наука открыла путь и к использованию внутриядерной энергии. Все эти открытия неразрывно связаны с законом Менделеева.
О чём Менделеев думал 20 лет
1 марта в России отмечали памятную дату — день открытия Дмитрием Менделеевым периодического закона. Хотя на самом деле в этот день в 1869 году великий русский учёный, которому на тот момент было всего 35 лет, представил лишь первый вариант периодической системы химических элементов, а затем продолжил работу над её усовершенствованием и детализацией.
Впервые прообраз таблицы появился в первом издании учебника «Основы химии», который разрабатывал Менделеев. По мнению историков, именно работа над учебником и заставила его задуматься над природой и взаимосвязью химических элементов и попытаться поместить их в понятную систему. Хотя на самом деле мыслями об этом он был поглощён с самого детства.
«Вы научили любить природу с её правдою, науку с её истиной…», — написал он в посвящении своей матери на одном из своих трудов. Жива в народной памяти легенда, что якобы таблица целиком явилась Менделееву во сне. Современники записали его личное опровержение таких домыслов: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово».
Читайте также:
• Уральский механик двинул техническую революцию • Сименс «изобрёл» трамвай по русскому образцу • Русский актёр спас всех лётчиков мира
Уже в апреле о таблице Менделеева узнали в Европе — её опубликовали в лейпцигском «Журнале практической химии». Но по сей день периодический закон и сама система химических элементов за рубежом не носит имени её первооткрывателя. Ведь Менделеев был вовсе не первым, кто задумался над систематизацией всех известных человеку веществ, из которых состоит вся Вселенная. Однако заслуга Дмитрия Ивановича не просто в том, что он придумал лаконичную и красочную таблицу. Он первый понял, что с ростом атомной массы свойства элементов периодически повторяются. В отличие от западных коллег за основу, помимо атомной массы, он взял ещё и химическое сходство веществ.
Он первый понял, что с ростом атомной массы свойства элементов периодически повторяются. В отличие от западных коллег за основу, помимо атомной массы, он взял ещё и химическое сходство веществ.
Смелый новатор, на основе своего закона он не стеснялся исправлять общепринятые показатели веществ — и впоследствии его исправления были признаны правильными. Закон Менделеева предсказал и открытие новых элементов — автор не только оставил для них в таблице пустые клетки, но и заранее описал свойства ещё неизвестных веществ. Когда в 1875 году открыли галлий, скандий и германий, учёные были удивлены, обнаружив у них именно те свойства, которые предрёк Менделеев.
Сегодня его таблицей пользуется весь мир — от школьников до академиков. И до сих пор периодический закон ни разу не давал сбоев.
Закон нулевого уровня – Наука – Коммерсантъ
Ничего сравнимого с Периодическим законом российская наука мировой не дала. Это открытие высшего, нулевого уровня, так сказал о Периодической таблице химических элементов Дмитрия Менделеева вице-президент РАН Алексей Хохлов. Что позволяет отнести открытие Менделеева, которому исполнилось 150 лет, к числу важнейших в истории науки?
Что позволяет отнести открытие Менделеева, которому исполнилось 150 лет, к числу важнейших в истории науки?
Таблицы с двумя недостатками
За 40 лет до Менделеева сходные по свойствам элементы объединил в триады немецкий химик Иоганн Вольфганг Дёберейнер. Известны таблицы польского химика Леопольда Гмелина, немецкого врача, химика и гигиениста Макса Йозефа фон Петтенкофера, французского химика Жана Батиста Дюма… И конечно, работы середины XIX века — «земная спираль» Александра де Шанкуртуа, «Октавы» Джона Ньюлендса, таблицы Уильяма Одлинга и Лотара Мейера 1864 года. Варианты таблиц приведены в порядке возрастания качества. Но у всех были два недостатка. Во-первых, не все известные элементы вписывались в систему; во-вторых, все таблицы включали только известные элементы. А это все равно что сложить N-лучевую звезду, обладая N-x лучами, где x>0.
Таблица с предсказаниями
6 марта 1869 года на заседании Русского химического общества Менделеев зачитал доклад «Опыт системы элементов, основанной на их атомном весе и химическом сродстве».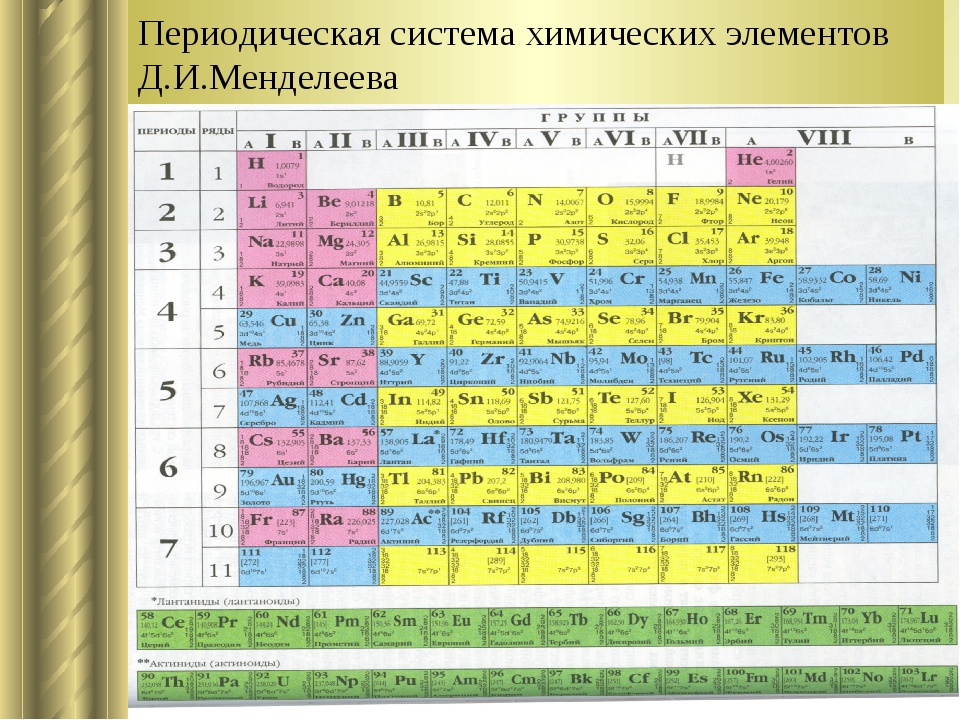 В следующие полтора года Менделеев уточнил характер этой зависимости и 3 декабря 1870 года вывел окончательную формулировку закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
В следующие полтора года Менделеев уточнил характер этой зависимости и 3 декабря 1870 года вывел окончательную формулировку закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Главное в Периодической системе Менделеева — ее предсказательная способность. Он не побоялся сказать, что набор элементов неполон; что существуют неоткрытые элементы с весами более легкими, чем уже известные,— иначе не складывается единая система. В таблице Менделеева появились ячейки для «экаалюминия», «экабора» и «экасилиция». Для каждого из этих элементов Менделеев предложил примерную атомную массу, набор ключевых химических и физических свойств. Кроме того, он указал на неправильно определенную массу 9 химических элементов и впоследствии описал еще 8 неизвестных науке элементов.
Глубокий патриот
Говорят, что на здоровье [Менделеева] сильно подействовал исход Японской войны. Будучи глубоким патриотом, он очень тяжело переживал наши неудачи на Дальнем Востоке, нередко даже плакал… К 1906 г. он как-то быстро стал дряхлеть, стал часто прихварывать. В этом году он два раза ездил за границу и как будто поправился. Но дни его были сочтены, и он сам уже как бы предчувствовал близкий конец.
он как-то быстро стал дряхлеть, стал часто прихварывать. В этом году он два раза ездил за границу и как будто поправился. Но дни его были сочтены, и он сам уже как бы предчувствовал близкий конец.
Лев Чугаев, «Дмитрий Менделеев, жизнь и деятельность»
Таблица верна
Лотар Мейер, который выпустил в 1870 году работу «Природа элементов как функция их атомного веса», уже сослался на таблицу Менделеева. Мейер писал, что ему не хватило научной дерзости Менделеева, чтобы понять всю систему.
Но в работе русского ученого было столько нового, что часть научного сообщества встретила его исследование с недоверием. Тем более что он указывал на неправильно определенные характеристики уже открытых элементов. Прямой и жесткий, Менделеев не стеснялся открыто указывать людям на их ошибки — можно себе представить, как встретили академики его открытие.
Но в 1875 году во Франции открывают предсказанный «экаалюминий» (галлий), в 1879 году — «экабор» (скандий), а в 1885-м — «экасилиций» (германий). Характеристики каждого полностью укладываются в значения, предсказанные Менделеевым. И научный мир признает, что эта система — верная. Даже открытые сегодня, спустя 150 лет, химические элементы по-прежнему укладываются в эту систему. «Можно смело утверждать, что во Вселенной не существует химических элементов вне описанной Менделеевым системы»,— сказал декан химического факультета МГУ имени Ломоносова, член-корреспондент РАН и один из ведущих радиохимиков мира Степан Калмыков.
Характеристики каждого полностью укладываются в значения, предсказанные Менделеевым. И научный мир признает, что эта система — верная. Даже открытые сегодня, спустя 150 лет, химические элементы по-прежнему укладываются в эту систему. «Можно смело утверждать, что во Вселенной не существует химических элементов вне описанной Менделеевым системы»,— сказал декан химического факультета МГУ имени Ломоносова, член-корреспондент РАН и один из ведущих радиохимиков мира Степан Калмыков.
Слишком вкусил от физиологии
Менделеев дал мне тему, рассказал, как приготовлять вещество, азотистометиловый эфир, что делать с ним, дал мне комнату, посуду, материалы, и я с великим удовольствием принялся за работу, тем более что не имел до того в руках веществ, кипящих при низких температурах, а это кипело при 12°C. Результаты той ученической работы описал сам Дмитрий Иванович. Быть учеником такого учителя, как Менделеев, было, конечно, и приятно, и полезно, но я уже слишком много вкусил от физиологии, чтобы изменить ей, и химиком не сделался.
«Автобиографические записки Ивана Михайловича Сеченова»
Таблица сокровищ
Как говорили великие люди (например, Генри Форд): «Не обязательно знать все. Главное — знать, где посмотреть». Периодический закон стал картой сокровищ для химиков, прямо указывая, какие элементы и с какими характеристиками стоит искать. Начался взрывной рост неорганической химии: понимание свойств и их изменений по группам и периодам позволило ученым либо впервые, либо более простым способом синтезировать множество новых неорганических соединений.
Но исследователи задались следующим вопросом: «Почему так, а не иначе?» В начале XX века с открытием радиоактивности, электрона, протона, а затем и нейтрона Периодический закон получил новые подтверждения, обрел дополнительный физический смысл. Оказалось, что порядковый номер элемента тождествен заряду ядра, что элементы разной массы, но с одинаковым зарядом ядра химически эквивалентны. Что электроны бегают вокруг ядра не кучкой, а по орбитам, что и приводит именно к таким химическим свойствам.
Ученые осознали и природу химической связи, из-за чего получили мощный толчок целые направления: каталитическая химия, квантовая химия, элементоорганическая химия, вычислительная химия и многие другие.
Не менее важно, пожалуй, и то, чего ученые не делали благодаря Периодическому закону. Понимая, как устроены химические элементы, исследователи не провели множества экспериментов.
Ругайся — и будешь здоров
Нельзя отрицать, что нрав у него был крутой, но он был вспыльчив, да отходчив. Слушать его крик, воркотню было иногда нелегко, но мы знали, что он кричит и ворчит не со зла, а такова уж его натура. Вероятно, в шутку он говорил, что держать в себе раздражение вредно для здоровья; надо, чтобы оно выходило наружу. «Ругайся себе направо-налево и будешь здоров».
Вячеслав Тищенко, «Воспоминания о Д. И. Менделееве»
Таблица с отклонениями
Первооткрыватель 10 трансурановых элементов, ректор Калифорнийского университета в Беркли, человек-элемент Гленн Теодор Сиборг и его коллеги в 1955 году решили назвать элемент №101 менделевием. Как писал Сиборг: «Согласно обычаю, ученые, получившие новый элемент, имеют право дать ему имя. Американские ученые предложили назвать элемент 101 менделевием — в честь великого русского химика, который первым использовал Периодическую систему для предсказания химических свойств неоткрытых элементов. Этот принцип явился ключевым при открытии почти всех трансурановых элементов и бесспорно сохранит свое значение в последующих попытках продвинуться в этой области науки».
Как писал Сиборг: «Согласно обычаю, ученые, получившие новый элемент, имеют право дать ему имя. Американские ученые предложили назвать элемент 101 менделевием — в честь великого русского химика, который первым использовал Периодическую систему для предсказания химических свойств неоткрытых элементов. Этот принцип явился ключевым при открытии почти всех трансурановых элементов и бесспорно сохранит свое значение в последующих попытках продвинуться в этой области науки».
Даже отклонения от Периодического закона, которые обнаружила при открытии последней пятерки элементов группа физиков под руководством еще одного человека-элемента, академика Юрия Оганесяна, также вытекают из этого закона. И каждое новое открытие так или иначе подтверждает величие закона Менделеева.
Он не гнался за патентованием изобретений, хотя за приоритет в открытиях бился жестко. Поэтому в признание его заслуг было бы правильно присвоить Периодической таблице его имя. И к такому решению постепенно склоняется все мировое сообщество. Неслучайно год 150-летия со дня открытия Менделеевым Периодического закона объявлен Международным годом Периодической таблицы химических элементов. Вероятно, вопрос о всемирном присвоении Периодической таблице химических элементов имени Менделеева в конце года будет поставлен на голосование перед IUPAC (Международным союзом теоретической и прикладной химии).
Неслучайно год 150-летия со дня открытия Менделеевым Периодического закона объявлен Международным годом Периодической таблицы химических элементов. Вероятно, вопрос о всемирном присвоении Периодической таблице химических элементов имени Менделеева в конце года будет поставлен на голосование перед IUPAC (Международным союзом теоретической и прикладной химии).
Валерий Сергеев
Самый быстрый словарь в мире | Vocabulary.com
Закон Менделеева (химия) принцип, согласно которому химические свойства элементов являются периодическими функциями их атомных номеров
Закон Менделя (генетика) один из двух принципов наследственности, сформулированных Грегором Менделем на основе его экспериментов с растениями; принципы были ограничены и изменены последующими генетическими исследованиями
бездумно без интеллектуального участия
миндальные листья ива ива на западе США с листьями, подобными листьям персика или миндаля
Менделеев Русский химик, который разработал периодическую таблицу химических элементов и предсказал открытие нескольких новых элементов (1834–1907)
менделевий радиоактивный трансурановый элемент, синтезируемый бомбардировкой эйнштейния альфа-частицами (Md — текущий символ менделевия, но раньше Mv был символом)
Менделеев Русский химик, который разработал периодическую таблицу химических элементов и предсказал открытие нескольких новых элементов (1834–1907)
нижнечелюстно-лицевой области или относящейся к нижней челюсти и лицу
Мендельсон Немецкий музыкант и композитор-романтик оркестровых и хоровых произведений (1809-1847)
Менделианство теория наследования, основанная на законах Менделя
Мендельсон Немецкий архитектор, эмигрировавший в Палестину в 1937 году
Психиатрическая больница больница для психически некомпетентных или неуравновешенных лиц
Ментоловая мазь мазь, содержащая ментол
Мандельштам русский поэт, умерший в лагере (1891-1938)
Менделизм теория наследования, основанная на законах Менделя
умственная способность одна из когнитивных или перцептивных способностей ума
безмозглость полное отсутствие смысла или идей
бездумный, лишенный интеллекта или здравого смысла
умственная отсталость легкая умственная отсталость
душевнобольные, страдающие тяжелым психическим заболеванием
Сравнение-контраст-соединение: история таблицы Менделеева
до 1869 г.
Когда ученые начали классифицировать и систематизировать элементы, было известно около 63 элементов.Многие из них, например золото, серебро, олово, медь, свинец и ртуть, были известны с древних времен. Фосфор был открыт в 1669 году. В течение следующих 220 лет было обнаружено гораздо больше элементов. За это время ученые определили массы отдельных элементов. Они узнали многие другие химические свойства, методично подвергая отдельные элементы воздействию различных химикатов и наблюдая за реакциями. По мере того как было получено больше информации об отдельных элементах, ученые захотели организовать элементы удобным образом.С 1817 года и во времена Менделеева многие ученые внесли важный вклад в то, что впоследствии стало современной таблицей Менделеева.
За это время ученые определили массы отдельных элементов. Они узнали многие другие химические свойства, методично подвергая отдельные элементы воздействию различных химикатов и наблюдая за реакциями. По мере того как было получено больше информации об отдельных элементах, ученые захотели организовать элементы удобным образом.С 1817 года и во времена Менделеева многие ученые внесли важный вклад в то, что впоследствии стало современной таблицей Менделеева.
- В 1817 году Иоганн Доберейнер заметил, что атомная масса стронция находится где-то посередине между массами кальция и бария. Эти три элемента обладали схожими свойствами. Доберейнер обнаружил еще несколько таких наборов из трех и назвал их Законом триад.
- В 1862 году А. Э. Бегуйе де Шанкуртуа расположил элементы на цилиндре, причем элементы обернулись вокруг цилиндра.На этой трехмерной таблице элементы выстроились в вертикальные столбцы.
- В 1863 году Джон Ньюлендс опубликовал таблицу с элементами, расположенными группами по восемь (SF Рис.
 2.11), предлагая элементы, соответствующие Закону октав.
2.11), предлагая элементы, соответствующие Закону октав.
Ньюлендса не была принята очень хорошо, потому что два элемента находились в одной коробке в нескольких местах на его столе. В конце 1800-х годов Лотар Мейер разрабатывал периодическую таблицу одновременно с Менделеевым.Периодическая таблица Мейера была очень похожа на таблицу Менделеева, но, поскольку она была опубликована после Менделеева, Менделеев получил наибольшее признание. Менделеева называют «отцом таблицы Менделеева».
Таблица Менделеева
Дмитрий Менделеев родился в 1834 году в России. Он был самым младшим из 13 (или 11, 14 или 17, в зависимости от источника) детей. Менделеев интересовался многими областями науки и на протяжении всей своей жизни изучал самые разные научные темы.В детстве он изучал химию на стеклодувной фабрике своей матери. В университете он получил ученую степень по химии, работая учителем. Преподавая химию в качестве профессора в Санкт-Петербургском университете, Менделеев почувствовал, что нет подходящих учебников для преподавания химии, поэтому он начал писать свои собственные. Работая над своим учебником с 1868 по 1870 год, он начал формулировать идеи о способах организации элементов. Первая попытка Менделеева организовать элементы видна на рис.2.12. В своей первой периодической таблице Менделеев расположил элементы по их массе и другим химическим свойствам. В то время основная химическая структура атомов была неизвестна.
Работая над своим учебником с 1868 по 1870 год, он начал формулировать идеи о способах организации элементов. Первая попытка Менделеева организовать элементы видна на рис.2.12. В своей первой периодической таблице Менделеев расположил элементы по их массе и другим химическим свойствам. В то время основная химическая структура атомов была неизвестна.
Менделеев расширил свою периодическую таблицу, включив в нее все элементы, известные в то время. Эта версия таблицы Менделеева была опубликована в 1869 году. Черновик этой таблицы Менделеева, написанный самим Менделеевым, представлен в SF Рис. 2.13.
Менделеев продолжил уточнение своей таблицы Менделеева, опубликовав новую версию (SF Рис.2.14) в 1871 году. В этой версии из-за паттернов, которые наблюдал Менделеев, он смог заметить дыры в паттернах и предсказать, что есть элементы, которые еще не были обнаружены, которые могли бы заполнить эти дыры. Хотя некоторые ученые скептически относились к этой таблице, когда были открыты новые элементы и некоторые предсказания Менделеева были подтверждены доказательствами, его периодическая таблица была принята научным сообществом. В периодическую таблицу Менделеева были внесены дальнейшие усовершенствования, включая добавление новых элементов, для создания современной таблицы Менделеева.
В периодическую таблицу Менделеева были внесены дальнейшие усовершенствования, включая добавление новых элементов, для создания современной таблицы Менделеева.
Важность периодической таблицы
Периодическая таблица Менделеева — это больше, чем просто таблица известных элементов. Название «периодическая таблица» указывает на периодический характер расположения элементов. Есть тенденции в элементах слева направо в периодической таблице. Менделеев знал, что атомная масса увеличивается слева направо, и присвоил номера элементам на основе своей периодической таблицы. По мере того, как ученые продолжали узнавать больше об атоме, они узнали, что не только атомная масса и число, но и другие свойства, такие как размер и структура атома, также постепенно менялись слева направо в периодической таблице.Ученые также обнаружили связь между атомной массой, основной структурой атомов и поведением элементов. В наше время мы можем использовать периодическую таблицу, чтобы узнать много информации о каждом элементе, а также сделать прогнозы о том, как элементы будут вести себя в определенных ситуациях.
Слава Менделеева
Менделеев внес много других вкладов в химию, но наибольшую известность он получил благодаря таблице Менделеева. Его высоко ценят во всем мире, но особенно в России и бывшем Советском Союзе (SF Рис.2.15 A – C). В Соединенных Штатах Американское химическое общество — это организация, продвигающая изучение химии. Аналогичная организация в России называется Русское химическое общество им. Менделеева. Также есть лунный кратер и элемент под номером 101, менделевий, названный в его честь.
Краткая история периодической таблицы
Периодическая таблица элементов часто встречается в классах, коридорах кампуса и библиотеках, но это больше, чем табличная организация чистых веществ.Ученые могут использовать эту таблицу для анализа реакционной способности элементов, прогнозирования химических реакций, понимания тенденций изменения периодических свойств различных элементов и размышлений о свойствах тех, которые еще предстоит открыть.
В современной таблице Менделеева элементы упорядочены по их атомным номерам и периодическим свойствам. Несколько ученых работали более века, чтобы собрать элементы в этот формат.
Викимедиа
Среди ученых, которые работали над созданием таблицы элементов, были Антуан Лавуазье, Иоганн Вольфанг Доберейнер, Джон Ньюлендс и Генри Мозли (слева направо).
В 1789 году французский химик Антуан Лавуазье попытался сгруппировать элементы как металлы и неметаллы. Сорок лет спустя немецкий физик Иоганн Вольфанг Дёберейнер обнаружил сходство физических и химических свойств некоторых элементов. Он расположил их в группы по три в порядке возрастания атомного веса и назвал их триадами, заметив, что некоторые свойства среднего элемента, такие как атомный вес и плотность, приблизительно соответствуют среднему значению этих свойств в двух других в каждой триаде.
Прорыв произошел с публикацией пересмотренного списка элементов и их атомных масс на первой международной конференции по химии в Карлсруэ, Германия, в 1860 году. Они пришли к выводу, что водороду будет присвоен атомный вес 1, а атомный вес другого элементы будут определены путем сравнения с водородом. Например, углерод, который в 12 раз тяжелее водорода, имел бы атомную массу 12,
Они пришли к выводу, что водороду будет присвоен атомный вес 1, а атомный вес другого элементы будут определены путем сравнения с водородом. Например, углерод, который в 12 раз тяжелее водорода, имел бы атомную массу 12,
Дмитрий Менделеев
Лотар Мейер
Британский химик Джон Ньюлендс первым организовал элементы в периодическую таблицу с возрастанием атомных масс.Он обнаружил, что каждые восемь элементов обладают схожими свойствами, и назвал это законом октав. Он расположил элементы в восьми группах, но не оставил пробелов для неоткрытых элементов.
В 1869 году русский химик Дмитрий Менделеев создал структуру, которая стала современной периодической таблицей, оставив пробелы для элементов, которые еще не были обнаружены. Располагая элементы в соответствии с их атомным весом, если он обнаруживал, что они не вписываются в группу, он переставлял их. Менделеев предсказал свойства некоторых неоткрытых элементов и дал им такие названия, как «эка-алюминий» для элемента со свойствами, подобными алюминию. Позже эка-алюминий был открыт как галлий. Некоторые несоответствия остались; положение некоторых элементов, таких как йод и теллур, не могло быть объяснено.
Позже эка-алюминий был открыт как галлий. Некоторые несоответствия остались; положение некоторых элементов, таких как йод и теллур, не могло быть объяснено.
Немецкий химик Лотар Мейер создал версию таблицы Менделеева, аналогичную таблице Менделеева, в 1870 году. Он оставил пробелы для неоткрытых элементов, но так и не предсказал их свойства. Лондонское королевское общество наградило медалью Дэви в 1882 году Менделееву и Мейеру. Позднее открытие элементов, предсказанных Менделеевым, включая галлий (1875 г.), скандий (1879 г.) и германий (1886 г.), подтвердило его предсказания, и его периодическая таблица получила всеобщее признание.В 1955 году в его честь 101-й элемент был назван менделевием.
Викимедиа
Периодическая таблица Менделеева 1869 года на русском языке с названием, которое переводится как «Эксперимент над системой элементов … на основе их атомного веса и химического сходства». .
Понятия о субатомных частицах не существовало в 19, 90, 170, веках. В 1913 году английский физик Генри Мозли использовал рентгеновские лучи для измерения длин волн элементов и сопоставил эти измерения с их атомными номерами.Затем он переставил элементы в периодической таблице на основе атомных номеров. Это помогло объяснить различия в более ранних версиях, в которых использовались атомные массы.
В 1913 году английский физик Генри Мозли использовал рентгеновские лучи для измерения длин волн элементов и сопоставил эти измерения с их атомными номерами.Затем он переставил элементы в периодической таблице на основе атомных номеров. Это помогло объяснить различия в более ранних версиях, в которых использовались атомные массы.
В периодической таблице горизонтальные ряды называются периодами, причем металлы находятся в крайнем левом углу, а неметаллы — в правом. Вертикальные столбцы, называемые группами, состоят из элементов со схожими химическими свойствами. Таблица Менделеева предоставляет информацию об атомной структуре элементов и химическом сходстве или различии между ними.Ученые используют стол для изучения химических веществ и разработки экспериментов. Он используется для разработки химикатов, используемых в фармацевтической и косметической промышленности, и батарей, используемых в технологических устройствах.
ЮНЕСКО объявила 2019 год Международным годом Периодической таблицы Менделеева в ознаменование 150 -й годовщины публикации Менделеева. Исследователи и учителя со всего мира воспользовались этой возможностью, чтобы поразмышлять о важности периодической таблицы Менделеева и распространить информацию о ней в классах и за ее пределами.Семинары и конференции побуждали людей использовать знания периодической таблицы для решения проблем в области здравоохранения, технологий, сельского хозяйства, окружающей среды и образования. Издательства организовывали ежемесячные мероприятия, такие как конкурсы викторин, подкасты, разделы с личными историями и туры по отраслевым сайтам. Эти инициативы продемонстрировали, как элементы являются неотъемлемой частью нашей повседневной жизни: лекарства, пестициды и литиевые батареи.
Исследователи и учителя со всего мира воспользовались этой возможностью, чтобы поразмышлять о важности периодической таблицы Менделеева и распространить информацию о ней в классах и за ее пределами.Семинары и конференции побуждали людей использовать знания периодической таблицы для решения проблем в области здравоохранения, технологий, сельского хозяйства, окружающей среды и образования. Издательства организовывали ежемесячные мероприятия, такие как конкурсы викторин, подкасты, разделы с личными историями и туры по отраслевым сайтам. Эти инициативы продемонстрировали, как элементы являются неотъемлемой частью нашей повседневной жизни: лекарства, пестициды и литиевые батареи.
На своем веб-сайте, посвященном празднованию этого праздника, ЮНЕСКО написала: «Периодическая таблица химических элементов — это больше, чем просто справочник или каталог всех известных атомов во Вселенной; По сути, это окно во вселенную, помогающее расширить наше понимание мира вокруг нас.”
MENDELEEV’S LAW — Определение и синонимы слова Mendeleev’s law в словаре английский языка
MENDELEEV’S LAW — Определение и синонимы слова Mendeleev’s law в словаре английский языка Educalingo Файлы cookie используются для персонализации рекламы и получения статистики веб-трафика. Мы также делимся информацией об использовании сайта с нашими партнерами по социальным сетям, рекламе и аналитике.
Мы также делимся информацией об использовании сайта с нашими партнерами по социальным сетям, рекламе и аналитике.
educationalingo
ПРОИЗВОДСТВО ЗАКОНА МЕНДЕЛЕЕВА
ГРАММАТИЧЕСКАЯ КАТЕГОРИЯ ЗАКОНА МЕНДЕЛЕЕВА
Закон Менделеева — это существительное .Существительное — это тип слова, значение которого определяет реальность. Существительные дают имена всем вещам: людям, предметам, ощущениям, чувствам и т. Д.ЧТО ЗАКОН МЕНДЕЛЕЕВА ОЗНАЧАЕТ НА АНГЛИЙСКОМ ЯЗЫКЕ?
Значение закона Менделеева в словаре английского языка
Определение закона Менделеева в словаре — это принцип, согласно которому химические свойства элементов являются периодическими функциями их атомного веса.
СЛОВ, РИФМУЮЩИХСЯ СО СЛОВОМ МЕНДЕЛЕЕВА
kaʊns ələrətˈlɔː
Синонимы и антонимы закона Менделеева в словаре английский языка
Перевод «закона Менделеева» на 25 языков
ПЕРЕВОД ЗАКОНА МЕНДЕЛЕЕВА
Узнайте перевод закона Менделеева на 25 языков с нашим многоязычным переводчиком английского языка. перевода закона Менделеева с английского на другие языки, представленные в этом разделе, были получены путем автоматического статистического перевода; где основной единицей перевода является слово «закон Менделеева» на английском языке.Переводчик английский —
китайский 门捷列夫 定律1325 миллионов говорящих
Переводчик английский —
испанский Ла лей де Менделеев570 миллионов говорящих
Переводчик с английского на
хинди मेंडेलीव का कानून380 миллионов говорящих
Переводчик с английского на
арабский انون مندليف ل280 миллионов говорящих
Переводчик английский —
русский Закон Менделеева278 миллионов говорящих
Переводчик с английского на
португальский А лей де Менделеев270 миллионов говорящих
Переводчик с английского на
бенгальский মেন্ডেলভের আইন260 миллионов говорящих
Переводчик с английского на
с французского La loi de Mendeleïev220 миллионов говорящих
Переводчик с английского на малайский
Унданг-унданг Менделеев190 миллионов говорящих
Переводчик английский —
немецкий Mendelejew -Gesetz180 миллионов говорящих
Переводчик английский —
японский メ ン デ レ ー エ フ の 法則130 миллионов говорящих
Переводчик с английского на
корейский 멘델레예프 의 법칙85 миллионов говорящих
Переводчик с английского на
яванский Хукум Менделеев85 миллионов говорящих
Переводчик с английского на
вьетнамский Пхап Лют Менделеев80 миллионов говорящих
Переводчик с английского на
тамильский மெண்டலீவ் சட்டத்தை75 миллионов говорящих
Переводчик с английского языка —
маратхи मेंडेलीवचा कायदा75 миллионов говорящих
Переводчик с английского на
турецкий Менделеева канунлары70 миллионов говорящих
Переводчик английский —
итальянский Legge di Mendeleev65 миллионов говорящих
Переводчик английский —
польский Prawo Mendelejewa50 миллионов говорящих
Переводчик английский —
украинский Закон Менделєєва40 миллионов говорящих
Переводчик с английского на
румынский Легея Луи Менделеева30 миллионов говорящих
Переводчик с английского на
греческий Μος του Менделеев15 миллионов говорящих
Переводчик с английского на
африкаанс Менделеева мокрая14 миллионов говорящих
Переводчик с английского на
шведский Отставание Менделеева10 миллионов говорящих
Переводчик с английского на
норвежский Менделеев лов5 миллионов говорящих
Тенденции использования закона Менделеева
ТЕНДЕНЦИИ ИСПОЛЬЗОВАНИЯ ТЕРМИНАЛА «ЗАКОН МЕНДЕЛЕЕВА»
Термин «закон Менделеева» практически не употребляется и занимает 202 места. 698 позиция в нашем списке наиболее широко используемых терминов в словаре английского языка.
На показанной выше карте показана частотность использования термина «Mendeleev’s law» в разных странах.
Тенденции основных поисковых запросов и примеры использования слова Mendeleev’s law Список основных поисковых запросов, предпринимаемых пользователями для доступа к нашему онлайн-словарю английского языка, и наиболее часто используемых выражений со словом «закон Менделеева».
698 позиция в нашем списке наиболее широко используемых терминов в словаре английского языка.
На показанной выше карте показана частотность использования термина «Mendeleev’s law» в разных странах.
Тенденции основных поисковых запросов и примеры использования слова Mendeleev’s law Список основных поисковых запросов, предпринимаемых пользователями для доступа к нашему онлайн-словарю английского языка, и наиболее часто используемых выражений со словом «закон Менделеева».ЧАСТОТА ИСПОЛЬЗОВАНИЯ ТЕРМИНАЛА «ЗАКОН МЕНДЕЛЕЕВА» ВО ВРЕМЯ
На графике показано годового изменения частотности использования слова «Mendeleev’s law» за последние 500 лет. Его реализация основана на анализе того, как часто термин «закон Менделеева» встречается в оцифрованных печатных источниках на английском языке в период с 1500 года по настоящее время.
Примеры использования в английской литературе, цитаты и новости о законе Менделеева
10 АНГЛИЙСКИХ КНИГ ПО
«ЗАКОНУ МЕНДЕЛЕЕВА» Поиск случаев использования закона Менделеева в следующих библиографических источниках. Книги, относящиеся к закону Менделеева и краткие выдержки из него, чтобы представить контекст его использования в английской литературе.1
Целевой показатель на 2011 год: наука 10Итак, согласно закону Менделеева , изотопы элемента должны находить отдельные место в периодической таблице, но изотопам не было уделено отдельного места в таблице Менделеева. периодическая таблица. (b) Положение водорода: Положение водорода не было правильно …
2
Предварительная химия в Excel Хотя закон Менделеева и таблица были очень полезны, они не совсем верны. Теперь сформулируем Периодический закон: химические и физические свойства
элементы являются периодической функцией атомных номеров. Прошло более 100 лет с тех пор, как
…
Теперь сформулируем Периодический закон: химические и физические свойства
элементы являются периодической функцией атомных номеров. Прошло более 100 лет с тех пор, как
…
3
Критическая оценка физической науки как человека …Липтон (1991) и Махер (1988) выступают за предиктивистский тезис, а именно, закон Менделеева получил большее признание после открытия первого предсказанного элемент (галлий) в 1875 г.Менделеев оставил несколько свободных мест в своем столе и …
4
Наука в русской культуре: 1861-1917 гг. 27 Закон Менделеева в том виде, в каком он был представлен в 1869 г., требовал существенной доработки.
и проверка: в его первоначальной периодической таблице элементов были пустые места, которые нужно было заполнить
элементами, еще не открытыми; он потерял некоторые элементы, потому что их . ..
..
5
Введение в исследования науки: философские и…Естественно сказать, например, что натрий взаимодействует с водой с образованием щелочи. потому что это элемент группы I Периодической таблицы, и в соответствии с Закон Менделеева все элементы группы I обладают этим свойством. Это было бы даже подробнее …
6
Учебник неорганической химииЗакон Менделеева был соответственно изменен следующим образом: «Свойства элементы являются периодической функцией своего заряда или атомного номера ».4.4 ПЕРИОДИЧЕСКИЙ ЗАКОН И ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМОВ Градация в недвижимость …
7
Философия химии: между манифестом и … 74 Никакой химический анализ, каким бы точным он ни был, никогда не сможет показать закон
многократных пропорций ошибаться (Duhem 1974: 213, 1902: 159-61). Ср. Поланьи
(1958: 40-43). Часто Закон Менделеева периодичности упоминается как «третий»…
Ср. Поланьи
(1958: 40-43). Часто Закон Менделеева периодичности упоминается как «третий»…
… Закон диффузии Грэма и закон частичного давления Дальтона. Закон Бойлса, Закон Чарльза, Закон Генри, Принципы движения, Закон отклонения Феррелла и Правило Крамера, закон Менделеева периодичности элементов. Законы Поставка …
DR KUMDONG BINDUL NOSTRA, 2014
1 Таким образом, это экспериментальное доказательство — проверка предсказаний теории. фактическими наблюдениями и исправлением неверных фактов — что приводит к принятие закона Менделеева .Отец русской химии Дмитрий Иванович …
10
Физика прочности и контроля разрушения: адаптация … По оси абсцисс отложены относительные атомные массы химических элементов (
верхний ряд чисел), в соответствии с периодическим законом Менделеева , это
разбиты на точки (обозначены римскими цифрами) и строки (арабскими цифрами)
).
Анатолий А.Комаровский, Виктор Петрович Астахов, 2002
ССЫЛКА
«EDUCALINGO. Закон Менделеева [онлайн]. Доступно на
Концепция химических элементов Дмитрия Менделеева до Периодического закона
Страница из
НАПЕЧАТАНО ИЗ ОНЛАЙН-СТИПЕНДИИ ОКСФОРДА (Оксфорд.Universitypressscholarship.com). (c) Авторские права Oxford University Press, 2021. Все права защищены. Отдельный пользователь может распечатать одну главу монографии в формате PDF в OSO для личного использования. дата: 06 января 2022 г.
- Глава:
- (стр.53) 3 Концепция химических элементов Дмитрия Менделеева до появления Периодического закона
- Источник:
- Что такое химический элемент?
- Автор (ы):
Натан М. Брукс
- Издатель:
- Oxford University Press
DOI: 10. 1093 / oso / 9780190933784.003.0004
1093 / oso / 9780190933784.003.0004
В этой статье исследуются научные работы Дмитрия Менделеева до открытия им периодического закона в 1869 году, уделяя особое внимание тому, как он решал вопросы концепции элементов и их атомных весов. . Ранние работы Менделеева для его бакалаврских и магистерских диссертаций по изоморфизму и конкретных томов почти полностью основывались на существующей литературе по этим темам с небольшим количеством оригинальных исследований. Однако знания, полученные Менделеевым в ходе этой работы, оказались полезными при разработке своего периодического закона.Менделеев посетил Международный химический конгресс в Карлсруэ в 11860 году и написал, что он был очень впечатлен работой Канниццаро и его выступлениями на конгрессе. Менделеев не всегда принимал атомные веса Канниццаро и продолжал полагаться в основном на ценности Герхардта и Лорана с небольшими изменениями. Менделеев в начале своей научной карьеры уделял много внимания органической химии, в том числе издал учебник, в котором он развил свою «Теорию пределов» в качестве организующего принципа.Хотя эту теорию быстро затмила Структурная теория органической химии, она оказала влияние на Менделеева в его размышлениях об организации элементов. За годы, непосредственно предшествующие формулировке периодического закона, Менделеев начал разрабатывать абстрактное определение элемента, которое оказалось важным для его размышлений о периодическом законе.
Менделеев в начале своей научной карьеры уделял много внимания органической химии, в том числе издал учебник, в котором он развил свою «Теорию пределов» в качестве организующего принципа.Хотя эту теорию быстро затмила Структурная теория органической химии, она оказала влияние на Менделеева в его размышлениях об организации элементов. За годы, непосредственно предшествующие формулировке периодического закона, Менделеев начал разрабатывать абстрактное определение элемента, которое оказалось важным для его размышлений о периодическом законе.
Ключевые слова: Дмитрий Менделеев, периодический закон, изоморфизм, удельные тома
Для получения доступа к полному тексту книг в рамках службы для стипендииOxford Online требуется подписка или покупка.Однако публичные пользователи могут свободно искать на сайте и просматривать аннотации и ключевые слова для каждой книги и главы.
Пожалуйста, подпишитесь или войдите для доступа к полному тексту.
Если вы считаете, что у вас должен быть доступ к этому заголовку, обратитесь к своему библиотекарю.
Для устранения неполадок, пожалуйста, проверьте наш FAQs , и если вы не можете найти там ответ, пожалуйста связаться с нами .
Гений таблицы Менделеева
AB Наука о знаниях и трудоустройстве 10-4 (2006) 10 Блок A: Исследование свойств материи
AB Наука о знаниях и трудоустройстве 20-4 (2006) 11 Блок A: Применение материи и химических изменений
AB Наука о знаниях и возможностях трудоустройства 8, 9 (пересмотрено в 2009 г.) 9 Блок B: Материя и химические изменения
AB Наука 14 (2003 г., обновлено 2014 г.) 10 Блок A: Исследование свойств материи
AB
Наука 7-8-9 (2003 г., обновлено в 2014 г. )
9
Блок B: Материя и химические изменения
)
9
Блок B: Материя и химические изменения
До нашей эры Химия 11 (июнь 2018) 11 Большая идея: атомы и молекулы — строительные блоки материи.
До нашей эры 9 класс естественных наук (июнь 2016 г.) 9 Большая идея: электронное расположение атомов влияет на их химическую природу.
МБ Старший 1 по науке (2000) 9 Кластер 2: атомы и элементы
NL 9 класс естествознания 9 Раздел 2: Атомы, элементы и соединения (редакция 2011 г.)
NL Наука 3200 (2005) 12 Блок 1: Химические реакции
NT Наука о знаниях и трудоустройстве 10-4 (Альберта, 2006 г.) 10 Блок A: Исследование свойств материи
NT Наука о знаниях и трудоустройстве 20-4 (Альберта, 2006 г.) 11 Блок A: Применение материи и химических изменений
NT Наука о знаниях и возможности трудоустройства 9 (Альберта, редакция 2009 г.) 9 Блок B: Материя и химические изменения
NT Наука 14 (Альберта, 2003 г., обновлено 2014 г.) 10 Блок A: Исследование свойств материи
NT
Наука 9 (Альберта, 2003 г. , обновлено в 2014 г.)
9
Блок B: Материя и химические изменения
, обновлено в 2014 г.)
9
Блок B: Материя и химические изменения
НУ Наука о знаниях и трудоустройстве 10-4 (2006) 10 Блок A: Исследование свойств материи
НУ Наука о знаниях и трудоустройстве 20-4 (Альберта, 2006 г.) 11 Блок A: Применение материи и химических изменений
НУ Наука о знаниях и возможности трудоустройства 9 (Альберта, редакция 2009 г.) 9 Блок B: Материя и химические изменения
НУ Наука 14 (2003 г., обновлено 2014 г.) 10 Блок A: Исследование свойств материи
НУ Наука 9 (Альберта, 2003 г., обновлено в 2014 г.) 9 Блок B: Материя и химические изменения
НА Естественные науки, 9 класс, академический (SNC1D) (2008) 9 Нить C: атомы, элементы и соединения
НА Прикладные науки 9 класс (SNC1P) 9 Строка C: исследование вопроса
PE Естественные науки 9 класс (пересмотрено в 2018 г.) 9 Знание содержания: CK 2.1
КК Наука и технология Секция I Материальный мир: Организация
КК Наука и технология Раздел II Материальный мир: Организация
SK Наука 9 (2009) 9 Физическая наука — атомы и элементы (AE)
YT
Chemistry 11 (Британская Колумбия, июнь 2018 г. )
11
Большая идея: атомы и молекулы — строительные блоки материи.
)
11
Большая идея: атомы и молекулы — строительные блоки материи.
YT Science Grade 9 (Британская Колумбия, июнь 2016 г.) 9 Большая идея: электронное расположение атомов влияет на их химическую природу.
Менделеев и периодическая таблица Менделеева: ответ на Шерри
Периодичность в периодической таблице и атомной теории По словам Шерри, «Они [Ниаз и др.] Утверждают, что большинство историков придерживаются наивного индуктивистского подхода к разработке периодической таблицы и что они считают, что Менделеев действовал на основе эмпирических наблюдений, а не атомной теории »(стр. 3, курсив добавлен). И снова Скерри пишет: «Похоже, что Niaz et al. полагают, что если они смогут показать, что Менделеев действительно обладал способностью «спекулировать», то они смогут выступить против подавляющего большинства историков науки, которые явно ошибочно полагают, что Менделеев не был спекулянтом, а просто следовал данным наблюдений, как хороший наивный индуктивист »( п. 4, курсив наш). Собственно, нигде в рукописи мы не называем современных историков или Менделеева наивными индуктивистами. Напротив, мы назвали их подход индуктивным обобщением. Изучающий философию науки хорошо знает, что это разные вещи. Более того, нигде в нашей статье мы не называем подход историков ошибочным. Мы просто пытались представить альтернативную интерпретацию вклада Менделеева, которая была принята как таковая рецензентами исследований по истории и философии науки.
4, курсив наш). Собственно, нигде в рукописи мы не называем современных историков или Менделеева наивными индуктивистами. Напротив, мы назвали их подход индуктивным обобщением. Изучающий философию науки хорошо знает, что это разные вещи. Более того, нигде в нашей статье мы не называем подход историков ошибочным. Мы просто пытались представить альтернативную интерпретацию вклада Менделеева, которая была принята как таковая рецензентами исследований по истории и философии науки.
В ответ на наш шаг 4 (Ниаз и др., Стр. 274) Скерри отметил: «Само собой разумеется, что этот отрывок не обеспечивает очень убедительных боеприпасов для Ниаза и др.. По крайней мере, по паре причин. Во-первых, это заявление Менделеева спустя полные 20 лет после открытия химической периодичности. Во-вторых, это заявление, сделанное перед широкой аудиторией на лекции ученого, оглядывающееся на свои достижения. Такие утверждения, как известно, склонны к грандиозным обобщениям … »(стр.6, курсив наш). Теперь рассмотрим следующую информацию:
- a)
Согласно Кадзи (2003), еще в 1864 году в лекции по теоретической химии Менделеев заявил: «На самом деле, в то время как теория атома была решительно подкреплена законом, определенных химических соединений, ему также бросили вызов так называемые неопределенные соединения »(стр.
 194). Это показывает амбивалентность Менделеева (которую мы подчеркивали на протяжении всей статьи), а также признание связи между атомной теорией и законом определенных пропорций.Интересно, что эти взгляды были высказаны Менделеевым за целых 25 лет до лекции Фарадея;
194). Это показывает амбивалентность Менделеева (которую мы подчеркивали на протяжении всей статьи), а также признание связи между атомной теорией и законом определенных пропорций.Интересно, что эти взгляды были высказаны Менделеевым за целых 25 лет до лекции Фарадея; - b)
Ван Спронсен (1969) считает лекцию Менделеева Фарадея 1889 года «очень влиятельной» (стр. 348). Более того, обзор литературы показывает, что большинство ученых цитируют лекцию Менделеева Фарадея.
Читатели заметят, что мы представили встречные доказательства в отношении двух аргументов, выдвинутых Шерри, и, следовательно, наша аргументация в Шаге 4 была поддержана.
В ответ на наш Шаг 5 (Niaz et al., 2004, pp. 274-275), Скерри заявил: «Вопреки тому, что авторы заключили в последней строке, процитированной выше, это утверждение не является признанием какой-либо роли, которую они сыграли. атомистической теорией … Менделеев последовательно выступал против единства материи и против гипотезы Праута на этот счет »(стр. 8). Если мы еще раз прочитаем цитату Менделеева в Шаге 5, то выяснится, что речь шла не о гипотезе Праута (которую Менделеев отрицал и мы отмечали в нашей статье, стр.275), а скорее закон множественных пропорций Дальтона, который был поставлен на карту. Фактически, сам Менделеев (1889) объясняет данные, представленные в отношении оксидов на этапе 5, следующими категоричными терминами: «Периодический закон ясно показал, что массы атомов увеличиваются скачкообразно, ступенчато, которые четко связаны между собой. каким-то образом с законом кратных пропорций Дальтона … »(стр. 642). Интересно отметить, что мы процитировали это объяснение Менделеева в Niaz et al (2004, p. 275), и по какой-то причине Шерри решил проигнорировать его! Точно так же Вайсберг (2007) поддержал аналогичный тезис: «Менделеев показал, что количество кислорода в оксидах было периодической функцией группы (столбца) элемента в Периодической таблице… Это можно объяснить с помощью Периодического закона, но иначе осталась бы загадкой »(стр.
8). Если мы еще раз прочитаем цитату Менделеева в Шаге 5, то выяснится, что речь шла не о гипотезе Праута (которую Менделеев отрицал и мы отмечали в нашей статье, стр.275), а скорее закон множественных пропорций Дальтона, который был поставлен на карту. Фактически, сам Менделеев (1889) объясняет данные, представленные в отношении оксидов на этапе 5, следующими категоричными терминами: «Периодический закон ясно показал, что массы атомов увеличиваются скачкообразно, ступенчато, которые четко связаны между собой. каким-то образом с законом кратных пропорций Дальтона … »(стр. 642). Интересно отметить, что мы процитировали это объяснение Менделеева в Niaz et al (2004, p. 275), и по какой-то причине Шерри решил проигнорировать его! Точно так же Вайсберг (2007) поддержал аналогичный тезис: «Менделеев показал, что количество кислорода в оксидах было периодической функцией группы (столбца) элемента в Периодической таблице… Это можно объяснить с помощью Периодического закона, но иначе осталась бы загадкой »(стр. 214-215). Более того, закон множественных пропорций Дальтона рассматривается деканом современной химии как доказательство, подтверждающее атомную теорию: «Открытие закона множественных пропорций было первым большим успехом атомной теории Дальтона. Этот закон не был выведен из экспериментальных результатов, но был выведен из теории, а затем проверен экспериментами »(Полинг, 1964, стр. 26). Поистине поразительно сходство между объяснением, данным Менделеевым в 1864, 1889 гг., И его подтверждением Полингом в 1964 г.!
214-215). Более того, закон множественных пропорций Дальтона рассматривается деканом современной химии как доказательство, подтверждающее атомную теорию: «Открытие закона множественных пропорций было первым большим успехом атомной теории Дальтона. Этот закон не был выведен из экспериментальных результатов, но был выведен из теории, а затем проверен экспериментами »(Полинг, 1964, стр. 26). Поистине поразительно сходство между объяснением, данным Менделеевым в 1864, 1889 гг., И его подтверждением Полингом в 1964 г.!
По словам Шерри: «В то время как авторы [Niaz et al., 2004] подразумевают, что публичные заявления Менделеева были сделаны по «политическим причинам» и что он ложно пытался выдать себя за позитивиста, такая интерпретация кажется немного надуманной »(стр. 9, курсив добавлен). Это грубое искажение наших взглядов, поскольку нигде мы не использовали такие выражения, ни явно, ни косвенно. Напротив, мы утверждали, что Менделеев был довольно двусмысленным / амбивалентным в отношении атомной теории и ее роли в периодической таблице.
По словам Шерри: «… Лакатос написал сноску, в которой говорилось, что пост-дикция должна рассматриваться как разновидность« предсказания », авторы которой, кажется, не осознают всей ценности этой уступки» (стр.10). Это действительно удивительно! Это Лакатош сделал сноску, и, следовательно, ссора Шерри не с нами.
Относительно новых предсказаний Шерри заявляет: «Кроме того, во многих статьях делается попытка более глубоко исследовать этот вопрос в контексте периодической таблицы. Хотя Niaz et al. цитируя некоторые из этих работ, они, кажется, упускают из виду центральный момент, поскольку сразу же возвращаются к обсуждению Лакатоша и его взглядов на предсказание в более узком смысле нового предсказания »(стр. 10).Читатели наверняка хотели бы увидеть некоторые ссылки, в которых «этот вопрос рассматривается более глубоко». Однако Шерри не приводит ни одного примера.
Согласно Скерри: «В статье Скерри и Уорролл утверждается, что Браш не должен отказываться даже от применения своей точки зрения к принятию периодической таблицы Менделеева» (стр. 11). На самом деле Браш (Brush, 2007) не отступил и четко заявил: «Я нашел мало доказательств предсказательности в физике, но нашел их в химии, в частности, в случае периодического закона Менделеева» (стр.257). Так в чем же аргумент!
11). На самом деле Браш (Brush, 2007) не отступил и четко заявил: «Я нашел мало доказательств предсказательности в физике, но нашел их в химии, в частности, в случае периодического закона Менделеева» (стр.257). Так в чем же аргумент!
И снова Скерри задает риторический вопрос: «Почему единственной альтернативой индуктивному накоплению знаний должно быть только использование теории?» (стр.12). Читатели хотели бы узнать о некоторых альтернативах, а Шерри не предлагает их.
По словам Шерри: «Должны ли мы понимать, что Niaz et al. здесь даже хотят приравнять понятие гипотезы к понятию научной теории? » (стр.13). Взаимосвязь между гипотезами, предсказаниями и теориями важна как в естественнонаучном образовании, так и в философии науки.Согласно Лоусону (2010): «Люди уровня 1 рассматривают науку как индуктивную и описательную деятельность. Лица на уровне 2 рассматривают науку с точки зрения генерации и проверки гипотез. Лица с уровнем 3 рассматривают науку как теоретическую основу. То есть теории генерируются, их постулаты проверяются с помощью запланированных тестов с предсказанными последствиями, а теории используются для генерации конкретных гипотез, которые, в свою очередь, проверяются аналогичным образом »(стр. 257, курсив добавлен). Интересно, что Лоусон рассматривает нашу интерпретацию вклада Менделеева как пример эпистемологии уровня 3.Согласно Брашу (2007): «Следует признать, что физики (и некоторые другие ученые) используют слово« предсказание »для обозначения« дедукции »(эмпирического факта из гипотезы или теории) независимо от новизны» (стр. 257, п. 1). Это ясно показывает, что гипотезы, прогнозы и теории неразрывно связаны. Следовательно, утверждение Вартофски (1968) о том, что Менделеев «… использовал таблицу Менделеева как гипотезу, из которой можно было делать прогнозы» (стр. 203), обязательно относится к теоретической структуре.На странице 13 Скерри воспроизвел эту цитату, но без необходимых знаков цитаты, таким образом, казалось, будто это утверждение приписывается Ниазу и др.
То есть теории генерируются, их постулаты проверяются с помощью запланированных тестов с предсказанными последствиями, а теории используются для генерации конкретных гипотез, которые, в свою очередь, проверяются аналогичным образом »(стр. 257, курсив добавлен). Интересно, что Лоусон рассматривает нашу интерпретацию вклада Менделеева как пример эпистемологии уровня 3.Согласно Брашу (2007): «Следует признать, что физики (и некоторые другие ученые) используют слово« предсказание »для обозначения« дедукции »(эмпирического факта из гипотезы или теории) независимо от новизны» (стр. 257, п. 1). Это ясно показывает, что гипотезы, прогнозы и теории неразрывно связаны. Следовательно, утверждение Вартофски (1968) о том, что Менделеев «… использовал таблицу Менделеева как гипотезу, из которой можно было делать прогнозы» (стр. 203), обязательно относится к теоретической структуре.На странице 13 Скерри воспроизвел эту цитату, но без необходимых знаков цитаты, таким образом, казалось, будто это утверждение приписывается Ниазу и др. (2004). Мы считаем это искажением фактов. В этом контексте важно отметить, что Скерри в примечании (п. 8) заявляет: «… аргументы Niaz et al. утверждение, что Менделеев действовал как теоретик, состоит из одной-единственной цитаты из физика Зимана, который, возможно, не был слишком рефлексивным… »(стр. 17, курсив добавлен). Новичок, изучающий философию науки, может задаться вопросом, так ли рассуждают философы, когда доказательства идут против них.
(2004). Мы считаем это искажением фактов. В этом контексте важно отметить, что Скерри в примечании (п. 8) заявляет: «… аргументы Niaz et al. утверждение, что Менделеев действовал как теоретик, состоит из одной-единственной цитаты из физика Зимана, который, возможно, не был слишком рефлексивным… »(стр. 17, курсив добавлен). Новичок, изучающий философию науки, может задаться вопросом, так ли рассуждают философы, когда доказательства идут против них.
В другом примечании (п. 6) Шерри заявляет: «Насколько мне известно, единственным историком или философом науки, который выступал за« теоретическое »прочтение открытия Менделеева, является Майкл Вайсберг, чью статью я подверг критике в недавней публикации. (Scerri, 2012). Это интересно читать, поскольку критика Вайсберга Скерри была опубликована в журнале, редактором которого является Скерри. И снова начинающий студент хотел бы знать, был ли Вайсберг приглашен для ответа. Более того, читатели хотели бы знать, что именно утверждал Вайсберг (2007): «… Менделеев не знал эмпирически о существовании пустых мест, которые нужно было заполнить… Сначала ему нужно было выдвинуть гипотезу о существовании недостающих элементов, проанализировав теоретическую структуру, которую он имел. созданный.Затем он смог использовать тенденции, установленные Периодической таблицей, чтобы делать прогнозы о свойствах «отсутствующих» элементов. Это предсказание было теоретическим, а не просто классификационным достижением »(стр. 214, курсив добавлен). Теперь, когда Шерри утверждает, что он критиковал тезис Вайсберга, давайте посмотрим, что именно было опровергнуто: «К сожалению, Вайсберг ничего не говорит в поддержку своего утверждения о том, что Менделеев исследовал« теоретическую структуру, которую он создал ». Это утверждение должно быть мотивировано некоторой ссылкой на собственные сочинения Менделеева, хотя я не думаю, что это станет возможным, исходя из моих знаний о трудах русского химика »(Scerri, 2012, p.277). Действительно, было бы интересно посмотреть, что Скерри обнаружил в «трудах русского химика». На данный момент у нас есть разработка Вейсберга (2007) теоретической структуры Менеделеева, которую Шерри проигнорировал: «Когда элементы были правильно упорядочены, утверждал Менделеев, можно было увидеть периодическую зависимость свойств элементов от их атомного веса.
созданный.Затем он смог использовать тенденции, установленные Периодической таблицей, чтобы делать прогнозы о свойствах «отсутствующих» элементов. Это предсказание было теоретическим, а не просто классификационным достижением »(стр. 214, курсив добавлен). Теперь, когда Шерри утверждает, что он критиковал тезис Вайсберга, давайте посмотрим, что именно было опровергнуто: «К сожалению, Вайсберг ничего не говорит в поддержку своего утверждения о том, что Менделеев исследовал« теоретическую структуру, которую он создал ». Это утверждение должно быть мотивировано некоторой ссылкой на собственные сочинения Менделеева, хотя я не думаю, что это станет возможным, исходя из моих знаний о трудах русского химика »(Scerri, 2012, p.277). Действительно, было бы интересно посмотреть, что Скерри обнаружил в «трудах русского химика». На данный момент у нас есть разработка Вейсберга (2007) теоретической структуры Менеделеева, которую Шерри проигнорировал: «Когда элементы были правильно упорядочены, утверждал Менделеев, можно было увидеть периодическую зависимость свойств элементов от их атомного веса. Этот принцип, который Менделеев назвал Периодическим законом, является одним из основополагающих принципов организации химии »(стр. 213).
Этот принцип, который Менделеев назвал Периодическим законом, является одним из основополагающих принципов организации химии »(стр. 213).
Согласно Шерри: «Если, как предполагает Картрайт, все научные законы строго лгут, то, конечно, закон Менделеева также не может считаться строго действующим законом науки» (стр. 15). Изучающий философию науки хорошо знает контекст, в котором Картрайт предположил, что научные законы «лгут», а именно включение модификаторов ceteris paribus может сделать законы более приближенными. На наш взгляд, если законы в лучшем случае приближаются, то и теории — следовательно, теоретические основы Менделеева нуждаются в улучшении.Эта идея была объяснена Вейсбергом (2007) убедительно: «Хотя верно, что периодическая система Менделеева нуждается в дальнейшем теоретическом объяснении, то же самое можно сказать о любой теории, которая не является фундаментальной физической» (стр. 215).
Заключение Шерри довольно подробно (5845 слов) критиковал наши взгляды на периодическую таблицу Менделеева.
 2.11), предлагая элементы, соответствующие Закону октав.
2.11), предлагая элементы, соответствующие Закону октав. 194). Это показывает амбивалентность Менделеева (которую мы подчеркивали на протяжении всей статьи), а также признание связи между атомной теорией и законом определенных пропорций.Интересно, что эти взгляды были высказаны Менделеевым за целых 25 лет до лекции Фарадея;
194). Это показывает амбивалентность Менделеева (которую мы подчеркивали на протяжении всей статьи), а также признание связи между атомной теорией и законом определенных пропорций.Интересно, что эти взгляды были высказаны Менделеевым за целых 25 лет до лекции Фарадея;