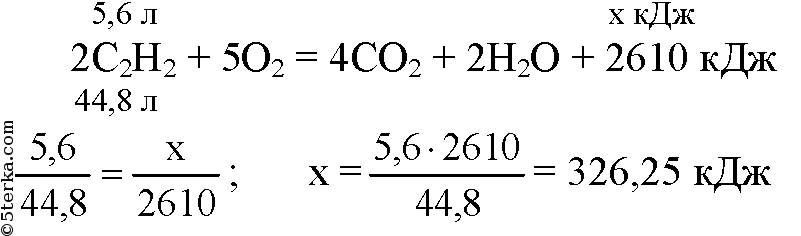Тепловой эффект химических реакций. Эндо- и экзо-термические реакции. Решение задач.
Урок № 38 (5) Предмет химия класс 8 (а,б,в), дата 25.01.17
Тема урока: Тепловой эффект химических реакций. Эндо- иэкзо-термические реакции. Решение задач.
Цели урока: Дать учащимся понятия « поглощение теплоты», « выделение теплоты», « энергия», « эндо – и экзотермические реакции», « тепловой эффект химической реакции».
Обучающая: Научить учащихся решать задачи по термохимическим уравнениям реакций.;
Развивающая: способствовать развитию у учащихся логического мышления, умения анализировать и сравнивать, работать с дополнительной информацией;
Воспитывающая: продолжать воспитывать интерес к предмету, умение работать в коллективе, бережное отношение к природе (атмосфере).
Тип урока: комбинированный
Форма проведения: лекция, самостоятельная работа.
Методы : словесный, проблема, практический, объяснително-иллюстрационный,
Оборудование урока: учебные таблицы.
Ход урока:
Организационный момент:
приветствие, перекличка, рабочий настрой, мотивационный аспект начала урока.
2. Актуализация опорных знаний (Мобилизующее начало урока):
1. Рассказать о термохимических реакциях?
2.какие реакции называют эндотермическими?
3. какие реакции называют экзотермическими?
Основной этап урока (Познавательно-операционная часть урока):
Термохимические уравнения включают в себя кроме химических формул тепловой эффект реакции.
Например: Термохимическое уравнение разложения малахита
(CuOH)2 CO3 = 2CuO + H 2 O + CO 2 — 47 кДж
Мы видим, что на разложение 1 моля малахита необходимо израсходовать 47 кДж, при этом образуется 2 моля оксида меди, 1 моль воды и 1 моль углекислого газа. Если мы затратим энергии в 2 раза больше, мы сумеем разложить 2 моля малахита, при этом получим 4 моля оксида меди, 2 моля воды и 2 моля углекислого газа.
Аналогично можно установить пропорциональные отношения, используя коэффициенты и молярные массы участников реакции. 47 кДж энергии затратится на разложение 94 г малахита, при этом выделится 160 г оксида меди, 18 г воды и 44 г углекислого газа. Пропорция несложная, но, используя массовые числа, учащиеся часто допускают расчетные ошибки, поэтому я рекомендую решать задачи с пропорциями через количество вещества.
47 кДж энергии затратится на разложение 94 г малахита, при этом выделится 160 г оксида меди, 18 г воды и 44 г углекислого газа. Пропорция несложная, но, используя массовые числа, учащиеся часто допускают расчетные ошибки, поэтому я рекомендую решать задачи с пропорциями через количество вещества.
Решим задачи:
Задача 1. Определите количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, с помощью термохимического уравнения.
2 Mq + O2 = 2MqO + 1204 кДж
Q1 -?
Решение:
1) Определяем количества оксида магния, используя формулу для нахождения количества вещества через массу.
n = m / M
n(MqO) = 120г/ 40 г/моль = 3 моль
2) Составляем пропорцию с учетом коэффициентов в уравнении реакции
По уравнению 2 моля MqO — 1204 кДж
По условию 3 моля MqO — Q1
Отсюда
3 моль* 1204кДж
Q1
=
————————
= 1803 кДж
2моль
Ответ: При образовании 120г оксида магния выделится 1803 кДж энергии.
Задача 2. В результате реакции, термохимическое уравнение которой
2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж
выделилось 652,5 кДж теплоты. Определите массу сгоревшего ацетилена.
m(C2H2)-?
Решение:
1) Установим пропорциональные отношения между количеством вещества ацетилена и количеством теплоты.
По уравнению 2 моль C2H2_———- 2610 кДж
По условию х моль ———- 652,5 кДж
Решаем пропорцию
2 моль* 652,5кДж
х
=
————————
= 0,5 моль
2610 кДж
2) Определяем массу ацетилена по формуле m= n * M
m = 0,5 моль * 26 г/моль = 13 г.
Ответ: масса сгоревшего ацетилена 13 г.
Задача 3. В результате горения 48 г метана выделилось 2406 кДж теплоты. Составьте термохимическое уравнение этой реакции.
Q -?
Решение:
1. Запишем уравнение реакции горения метана в общем виде
CH4+ 2O2 = CO2 +2H2O + Q
2. Определим количество 48 г метана
n = m / M
n(CH4) = 48г/ 16 г/моль = 3 моль
3. Составляем пропорцию с учетом коэффициентов в уравнении реакции
По условию 3моля CH4 — 2406 кДж
По уравнению 1 моль CH4
— Q
Решаем пропорцию
1 моль* 2406 кДж
х
=
————————
= 802 кДж
3 моля
Ответ: термохимическое уравнение реакции горения метана
CH4+ 2O2 = CO2 +2H2O + 802 кДж
Задача 4.
2KClO3 = 2KCl + 3O2 – 91 кДж,
если на разложение бертолетовой соли было затрачено 182 кДж теплоты.
V (O2)-?
Решение:
1)Установим пропорциональные отношения между количеством вещества кислорода и количеством теплоты.
По уравнению 3 моль O2 ———- 91 кДж
По условию х моль ———- 182 кДж
Решаем пропорцию
3 моль* 182 кДж
х
=
————————
= 6 моль
91 кДж
2) Вычислим объем кислорода, согласно закону Авогадро
(Vm = 22б4 л. моль) V = n * Vm
моль) V = n * Vm
V(O2) = 6 моль * 22,4 л/моль = 134,4 л
Ответ: объем выделившегося кислорода равен 134,4 л.
4.Закрепление полученных знаний, подведение выводов и записывание их в тетрадь
1.Согласно термохимическому уравнению реакции
CH4+ 2O2 = CO2 +2H2O + 802 кДж
определите количество теплоты, выделившейся при сжигании 24 г метана.
2. Тепловой эффект реакции горения серы равен 297 кДж. Какая масса серы сгорела, если выделилось 742,5 кДж теплоты.
3. По термохимическому уравнению H2+ Cl2 = 2HCl + 184,36 кДж рассчитайте, какой объем затрачен на образование хлороводорода (при н. у.), если при этом выделилось 921,8 кДж теплоты.
у.), если при этом выделилось 921,8 кДж теплоты.
5.Домашнее задание: повторение §38
6.Подведение итогов.
Учитель химии Саут А.К._______________
Урок химии по теме «Тепловой эффект химических реакций». 8-й класс
Цель:
- Познакомить с понятием “тепловой эффект химических реакций”, классификацией химических реакций (явлений) по тепловому эффекту.
- Уметь составлять термохимические уравнения и производить расчеты теплоты по уравнению реакции.
- Владеть понятиями “теплота”, “энергия”, “экзо- и эндотермические реакции”, “тепловой эффект”, “термохимическое уравнение”, выделение и поглощение энергии.
- Развивать у учащихся умение наблюдать,
анализировать природные явления и проводимый
химический эксперимент; совершенствовать навыки
ведения наблюдений, устанавливать
причинно-следственные связи, делать выводы и
заключения.

- Воспитывать у учащихся коммуникативных навыков, чувства товарищества и взаимопомощи, умение работать в парах.
- Выполняя лабораторные опыты соблюдать технику безопасности (инструкция № 73 — работа с веществами и растворами; № 20 — проведение опытов).
Оборудование: вещества: штатив с пробирками, 2 термометра, Mg; HCI; NH4NO3 .
- Информационные карты “Расчет теплового эффекта реакции по уравнению”
- Мультимедийный проектор, компьютер, презентация “Тепловой эффект химических реакций” .
Ход урока
I. Организационно-мотивационный этап
II. Актуализация знаний учащихся
Отработка понятий: химические реакции, признаки химических реакций.
III. Изучение новой темы
1. Лабораторный эксперимент.
Опыт 1. Взаимодействие Mg с кислотой.
Взаимодействие Mg с кислотой.
1) В пробирку с порошком магния (Mg) прилить осторожно, по каплям! 0,5 мл раствора кислоты HCl, что наблюдаете?
2) Аккуратно! потрогайте нижнюю часть пробирки. Наблюдения и уравнение реакции записать в таблицу:
Mg + HCl —>
Опыт 2. Растворение азотного удобрения в воде
1) В пробирку с белым кристаллическим веществом прилейте имеющуюся воду, встряхните
2) потрогайте пробирку; наблюдения запишите в соответствующую графу таблицы:
| исходные вещества | как проводили опыт | признаки (наблюдения) и уравнение реакции |
| магний Mg и соляная кислота HCl | к порошку магния прилили 1 мл раствора кислоты | Mg + HCl —> |
| азотное удобрение NH4NO3 и вода H2O | к белому кристаллическому веществу прилили 2-3 мл воды, перемешали |
2. Понятие тепловой эффект химических
реакций
Понятие тепловой эффект химических
реакций
Причина теплового эффекта — разница внутренней энергии продуктов реакции и внутренней энергии реагентов.
(работа с учебником стр. 65 –определение )
3. Термохимия, термохимические уравнения.
Термохимия — раздел химии, в задачу которого входит определение и изучение тепловых эффектов реакции.
Термохимические уравнения – уравнения в которых указывается количество поглощенной или выделенной теплоты.
2HgO —> 2Hg + O2 – 180 кДж, С(тв) + O2(г) —> СO2(г) + 394 кДж
4. По термохимическим уравнениям реакций можно проводить различные расчёты. Для решения задач по термохимическим уравнениям реакций нужно записать само уравнение и провести необходимые расчеты по нему.
Алгоритм решения задач по термохимическому уравнению реакции
- Кратко записать условия задачи (“дано”).

- Записать термохимическое уравнение реакции (ТХУ), одной чертой в уравнении реакции подчеркивают то, что известно, двумя чертами подчёркивают то, что необходимо определить.
- Провести вспомогательные вычисления (корень квадратный, Мr, М, m).
- Составить соотношение, используя вспомогательные вычисления и условия задачи; решить соотношение (пропорцию).
- Записать ответ.
Пример задачи
Ответ: 2Са + О2 —> 2СаО + 5080 кДж
Решение задач учениками.
1.
х= 20* 5654/337 = 38,81 кДж
Ответ: 38,81 кДж.
2. Вычислите массу разложившегося мела (СаСО3), если известно, что на его разложение затрачено 1570 кДж.
Мr (СаСО3) = Аr(Са) + Аr(С) + Аr(О) 3 = 40 + 12 + 16 3 = 100
Мr = Мr m = v * М
M(СаСО3) = 1 моль* 100 г/моль = 100г
100г СаСО3 — 157 кДж —
х г СаСО3 — 1570 кДж
100г : 157 кДж = х г : 1570 кДж
х = 1000г СаСО3
Ответ: m (СаСО3) = 1 кг (или разложилось 1000г мела)
IV. Закрепление изученного материала
Закрепление изученного материала
1. Заполни пропуски
Реакции, протекающие с выделением теплоты и света, называют реакциями
…. Это реакции ….
Выберите пропущенные слова (укажи буквы, соответствующие по смыслу пропускам):
а) разложения;
б) горения;
в) эндотермические;
г) экзотермические.
2. Какие схемы можно назвать термохимическими уравнениями реакций?
а) 2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
б) 2 H2 + O2 = 2 H2О + 572 кДж
в) 2 H2(г) + O2(г) = 2 H2О(ж)
г) H2 + O2 —> H2О + 572 кДж
3. Какая запись, соответствует эндотермической реакции?
а) С(тв) + O2(г) = СO2(г) + 394 кДж
б) СаСO3 = СO2 + СаО – 310 кДж
г) Н2 + I2 = 2HI – 52 кДж
д) 3Fe + O2 = Fe3O4 + 118 кДж
4. Установите соответствие между схемой реакции
и её типом:
Установите соответствие между схемой реакции
и её типом:
А) СH4(г) + 2 O2(г) = СO2(г) + 2 H2О(ж) + 890 кДж
Б) 2 H2О = 2 H2 + О2 – 572 кДж
1. Эндотермическая реакция
2. Экзотермическая реакция
5. Приведены уравнения реакций:
А. СаО + Н2О = Са(ОН)2
Б. 2HgO = 2Hg + O2
Определите тип, к которому относятся данные реакции.
1) обе реакции экзотермические
2) обе реакции эндотермические
3) А – эндотермическая, а Б – экзотермическая
4) А – экзотермическая, а Б – эндотермическая
V. Итог по уроку:
— Как классифицируются реакции по тепловому эффекту?
— Что такое тепловой эффект реакции?
— Чем отличаются термохимические уравнения
VI. Д/з параграф 23, задача1, 2 стр.69
(письменно)
Д/з параграф 23, задача1, 2 стр.69
(письменно)
Урок 2. тепловой эффект химических реакций. понятие об экзо- и эндотермических реакциях — Химия — 9 класс
Конспект
Мы знаем, что химические реакции могут сопровождаться различными признаками. Рассмотрим реакцию расстворения нитрата аммония в воде. Образование инея говорит, что понизилась температура раствора. То есть произошло поглощение тепла. Если нагревать малахит, то он будет разлагаться на оксид меди (II), углекислый газ и воду. Но если прекратить нагревание, но реакция так же прекратится. Реакции, протекающие с поглощением тепла, называют эндотермические реакции. В уравнении такой химической реакции иногда указывают тепловой эффект, который пишется со знаком минус. Тепло выделяется и при горении дров в печи и газа, что позволяет нам отапливать помещение и готовить пищу, органические удобрения окисляются с выделением тепла, которое можно использовать в парниках. Реакции, протекающие с выделением тепла, называют экзотермические реакции. В уравнении такой химической реакции указывают тепловой эффект, который пишется со знаком плюс.Газовые плиты сделаны из стали, в конфорках горит пропан-бутановая смесь, но пламя не причиняет вреда металлу. А вот пламя горящего водорода сразу же расплавит сталь. А как понять, сколько тепла выделяется или поглощается в процессе реакции? Для этого используются специальные химические уравнения — термохимические. В термохимических уравнениях показывают не только знак теплового эффекта, но и количество теплоты, которое выделяется или поглощается в процессе химической реакции. Также в термохимических уравнениях указывают агрегатное состояние вещества. Примеры расчетов по термохимическим уравнениям. По термохимическому уравнению можно определить количество тепла, которое выделится или поглотиться, если даны масса или объём одного из участников реакции или определить массу и объём по известному тепловому эффекту.
Реакции, протекающие с выделением тепла, называют экзотермические реакции. В уравнении такой химической реакции указывают тепловой эффект, который пишется со знаком плюс.Газовые плиты сделаны из стали, в конфорках горит пропан-бутановая смесь, но пламя не причиняет вреда металлу. А вот пламя горящего водорода сразу же расплавит сталь. А как понять, сколько тепла выделяется или поглощается в процессе реакции? Для этого используются специальные химические уравнения — термохимические. В термохимических уравнениях показывают не только знак теплового эффекта, но и количество теплоты, которое выделяется или поглощается в процессе химической реакции. Также в термохимических уравнениях указывают агрегатное состояние вещества. Примеры расчетов по термохимическим уравнениям. По термохимическому уравнению можно определить количество тепла, которое выделится или поглотиться, если даны масса или объём одного из участников реакции или определить массу и объём по известному тепловому эффекту.
Тепловой эффект химических реакций — Химия.
 9 класс. Григорович
9 класс. ГригоровичХимия. 9 класс. Григорович
Вспомните: одним из признаков химической реакции является выделение или поглощение теплоты.
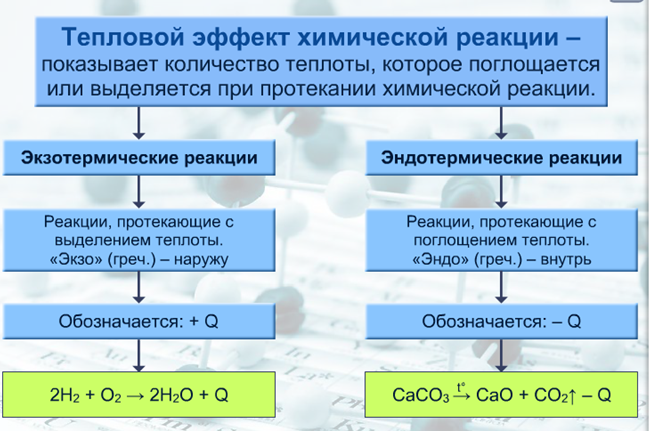
Экзотермические и эндотермические реакции
Экзотермические реакции:
- протекают с выделением теплоты;
- после инициации прекращаются, когда израсходуется один из реагентов;
- реакционная смесь в процессе реакции разогревается.
Вы уже знаете, что при растворении веществ может выделяться или поглощаться энергия. В ходе химических реакций реакционная смесь также может выделять энергию в окружающую среду или поглощать ее из нее. В большинстве химических реакций энергия выделяется или поглощается в виде теплоты, а в некоторых реакциях — в виде света.
• Химические реакции, протекающие с выделением теплоты, называются экзотермическими.
Если в ходе реакции выделяется теплота, то реакционная смесь разогревается. Экзотермическими являются все реакции горения и многие другие реакции. Например, при гашении извести (взаимодействии кальций оксида с водой) выделяется так много теплоты, что вода может закипеть и распушить твердое вещество. Поэтому кальций гидроксид также называют «пушонкой» (рис. 18.1):
Экзотермическими являются все реакции горения и многие другие реакции. Например, при гашении извести (взаимодействии кальций оксида с водой) выделяется так много теплоты, что вода может закипеть и распушить твердое вещество. Поэтому кальций гидроксид также называют «пушонкой» (рис. 18.1):
CaO + H2O = Са(ОН)2
Рис. 18.1. Гашение негашеной извести водой сопровождается выделением большого количества теплоты
Много теплоты выделяется также в процессе реакций с участием химически активных веществ — галогенов, щелочных металлов и др.
Некоторые экзотермические реакции не начинаются сразу после смешивания (начала контакта) реагентов. Например, деревья постоянно контактируют с кислородом (в воздухе), но не воспламеняются. Для того чтобы началось горение, необходимо подогреть древесину, т. е. инициировать реакцию. После инициации горение само себя «поддерживает» и не закончится, пока не прекратится доступ кислорода или вся древесина не сгорит.
Таким образом, для экзотермических реакций характерно следующее: они не прекращаются, пока не израсходуется один из реагентов; реакционная смесь в ходе реакции разогревается.
• Химические реакции, протекающие с поглощением теплоты, называются эндотермическими.
Эндотермические реакции:
- происходят с поглощением теплоты;
- останавливаются при прекращении подогрева;
- реакционная смесь в процессе реакции охлаждается.
К эндотермическим реакциям относятся большинство реакций разложения, например разложение кальций карбоната (известняка):
СаСО3(тв.) = СаО(тв.) + CO2(г.)
Большинство эндотермических реакций необходимо постоянно поддерживать, обычно нагреванием. Например, чтобы началось разложение кальций карбоната, его необходимо нагреть до температуры около 1100 °С и постоянно ее поддерживать. При эндотермической реакции теплота поглощается, и, если прекратить нагрев, процесс остановится.
Существуют химические реакции, в которых энергия выделяется в виде света. Самой распространенной такой реакцией является горение. Но есть и другие. Так, при хранении белого фосфора на воздухе он сразу начинает реагировать с кислородом. Часть энергии в процессе этой реакции выделяется в виде света, поэтому белый фосфор светится в темноте. Это явление называют хемилюминесценцией. Именно оно стало интригой детектива «Собака Баскервилей» сэра А. Конан Дойла.
Явление хемилюминесценции присуще и живым организмам: химические реакции обусловливают свечение в темноте светлячков, некоторых медуз и др. К слову сказать, хемилюминесценция очень распространена среди растений и животных в фантастическом мире кинофильма «Аватар».
Существуют химические реакции, происходящие с поглощением света. Их называют фотохимическими. Самая известная фотохимическая реакция — это фотосинтез. Также под действием света происходит превращение кислорода в озон. В фотохимических процессах принимают участие особые молекулы сетчатки нашего глаза, благодаря чему мы видим.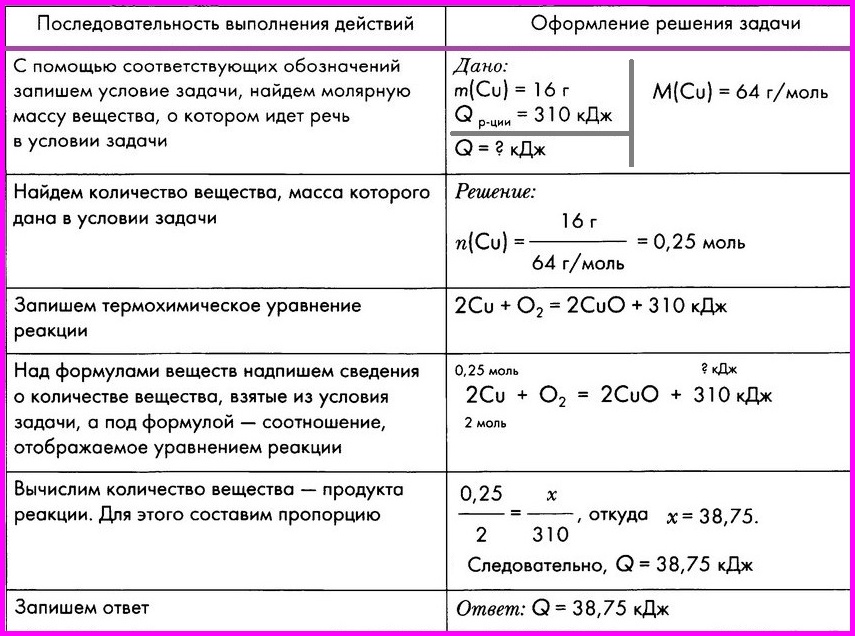
Белый фосфор на воздухе в темноте
Свечение светлячков
Свечение обитателей океанских глубин
Редко встречаются эндотермические реакции, протекающие при обычных условиях. Их легко распознать по охлаждению реакционной смеси. Например, при взаимодействии барий гидроксида с аммоний нитратом реакционная смесь замерзает, а сосуд покрывается каплями воды и даже может примерзнуть к подставке (рис. 18.2):
Ba(OH)2 + 2NH4NO3 = Ba(NO3)2 + 2NH3↑ +2H2O
Рис. 18.2. Взаимодействие барий гидроксида с аммоний нитратом
Тепловой эффект химических реакций. Понятие об энтальпии
Как вы уже знаете, при химических реакциях происходит перегруппировка атомов, содержащихся в веществах-реагентах. Для этого необходимо часть химических связей разорвать. И наоборот, в ходе образования продуктов реакции возникают новые связи. Поскольку разрыв и образование химических связей сопровождается поглощением и выделением энергии соответственно, то для химических реакций характерно выделение или поглощение энергии (рис. 18.3).
Поскольку разрыв и образование химических связей сопровождается поглощением и выделением энергии соответственно, то для химических реакций характерно выделение или поглощение энергии (рис. 18.3).
Рис. 18.3. Разрыв и образование химических связей при реакции водорода с йодом
Количественно все виды взаимодействий (энергию химических связей, межмолекулярных взаимодействий и др.) в веществе определяют специальной величиной — энтальпией (от греч. entalpio — нагреваю).
• Энтальпия — физическая величина, характеризующая энергию системы (вещества или смеси), которая доступна для преобразования в теплоту при постоянном давлении.
Энтальпию вещества еще называют его «теплосодержанием», поскольку она показывает, сколько теплоты «запасено» в веществе. Энтальпию обозначают буквой H. В системе СИ единицей измерения энтальпии является Дж/моль (кДж/моль), но все еще используют устаревшую единицу — калорию.
Энтальпия:
- характеризует «теплосодержание» вещества;
- обозначается H;
- единица измерения — Дж/моль или кДж/моль;
- разница энтальпии продуктов реакции и реагентов ΔΗ — это тепловой эффект реакции.

Измерить энтальпию вещества невозможно, поэтому на практике используют величину, характеризующую изменение энтальпии при протекании процессов, — ΔΗ. Количество теплоты, выделяющейся или поглощающейся в процессе взаимодействия (т. е. ΔΗ), можно определить экспериментально. Изменение энтальпии в реакционной смеси при химических реакциях составляет тепловой эффект химической реакции.
• Тепловой эффект реакции ΔΗ — это разница между энтальпией продуктов реакции и энтальпией реагентов:
ΔH(реакции) = Н(продуктов реакции) — Н(реагентов)
Если энтальпия продуктов реакции меньше энтальпии реагентов (ΔΗ < 0, т. е. является отрицательной величиной), то энтальпия системы уменьшается, а избыточная энергия выделяется в окружающую среду в виде теплоты или света (рис. 18.4, а). Это соответствует экзотермической реакции.
- Экзотермические реакции:
ΔΗ < 0 — теплота выделяется.
- Эндотермические реакции:
ΔΗ > 0 — теплота поглощается.
Рис. 18.4. Изменение энтальпии системы при экзотермической (а) и эндотермической (б) реакциях
В эндотермических реакциях, наоборот, энтальпия продуктов реакции больше энтальпии реагентов (ΔΗ > 0, т. е. является положительной величиной). Энергия, необходимая для увеличения энтальпии, поглощается из окружающей среды (рис. 18.4, б).
Герман Иванович Гесс (1802-1850)
Выдающийся химик. Родился в Женеве, затем семья переехала в Россию. Учился в Дерптском университете, где в 20 лет защитил диссертацию, в которой исследовал лечебное действие минеральных вод. Работал вместе с Берцелиусом в Стокгольме, а потом — в Иркутске. В 28 лет его избрали в Петербургскую академию наук, он стал заведующим кафедрой Петербургского технологического института. Разработал способ получения серебра из минералов и описал свойства многих минералов, первым заметил каталитическое действие платины. Но наибольшее признание получил как основатель термохимии: сформулировал основной ее закон — закон постоянства суммы теплоты, названный его именем.
Но наибольшее признание получил как основатель термохимии: сформулировал основной ее закон — закон постоянства суммы теплоты, названный его именем.
Каким будет значение ΔΗ, зависит только от энергетического запаса реагентов и продуктов реакции, т. е. для каждой реакции количество теплоты, которое выделится (поглотится), зависит только от природы веществ и их количества.
Тепловые эффекты реакций изучает специальный раздел химии — термохимия. Основателем термохимии считают Германа Гесса, но самый больший вклад в ее развитие сделал Джозайя Гиббс, который применил законы физики и математическое моделирование для изучения химических процессов и основал новый раздел химии — химическую термодинамику.
Джозайя Уиллард Гиббс (1839-1903)
Американский физико-химик и математик, один из основателей химической термодинамики. В 19 лет закончил Йельский университет, а через пять лет защитил диссертацию и в должности профессора преподавал там латынь, математику и математическую физику. Основные исследования Гиббса были связаны с изучением тепловых процессов в химии, где он достиг выдающихся результатов. Его именем названы многие из разработанных им понятий химической термодинамики: энергия Гиббса, парадокс Гиббса, каноническое распределение Гиббса и др. В 40 лет был избран в Национальную академию наук США. До сих пор в его работах не найдено ни одной ошибки, а все его идеи используют в современной науке.
Основные исследования Гиббса были связаны с изучением тепловых процессов в химии, где он достиг выдающихся результатов. Его именем названы многие из разработанных им понятий химической термодинамики: энергия Гиббса, парадокс Гиббса, каноническое распределение Гиббса и др. В 40 лет был избран в Национальную академию наук США. До сих пор в его работах не найдено ни одной ошибки, а все его идеи используют в современной науке.
Лингвистическая задача
- 1. На греческом exo означает «извне», endon — «внутри». Что, по вашему мнению, означают термины «экзотермический» и «эндотермический»?
- 2. На латыни calor и на греческом therme означает «теплота». Dynamis — греческое слово, означающее «сила, мощь», а kinetikos — «то, что приводит в движение». Предположите, какое значение имеют термины «калория», «калориметрия», «термометр», «термодинамика», «химическая кинетика».
Ключевая идея
В процессе эндотермических реакций реакционная среда охлаждается, а в экзотермических — нагревается.
Контрольные вопросы
- 200. Дайте определение понятиям «тепловой эффект реакции», «эндотермическая реакция», «экзотермическая реакция».
- 201. Приведите примеры экзотермических и эндотермических реакций.
- 202. Как обозначают изменение энтальпии реакции? В каких единицах ее измеряют?
- 203. Как по значению изменения энтальпии реакции определить, является химическая реакция экзотермической или эндотермической?
- 204. Почему при химических реакциях обязательно происходит выделение или поглощение энергии? Ответ поясните.
- 205. Как изменяется температура реакционной среды, если происходит экзотермическая реакция? эндотермическая реакция?
- 206. Как можно различить экзо- и эндотермические реакции?
Задания для усвоения материала
207. Как вы считаете, почему большинство реакций разложения являются эндотермическими?
208. Процессы выращивания пшеницы и изготовления из нее хлеба требуют энергии. Сначала растение поглощает солнечный свет и превращает углекислый газ и воду в углеводы в процессе фотосинтеза. Пшеницу собирают и перемалывают в муку. Муку привозят в пекарню, где выпекают хлеб. Хлеб употребляют в пищу люди. Энергия из пищи расходуется человеком для физической активности. Какие формы энергии и как превращаются из одной формы в другую в этих процессах?
Сначала растение поглощает солнечный свет и превращает углекислый газ и воду в углеводы в процессе фотосинтеза. Пшеницу собирают и перемалывают в муку. Муку привозят в пекарню, где выпекают хлеб. Хлеб употребляют в пищу люди. Энергия из пищи расходуется человеком для физической активности. Какие формы энергии и как превращаются из одной формы в другую в этих процессах?
209. Предложите план эксперимента для определения теплового эффекта химической реакции. Какие измерения вы должны сделать для достижения цели? Какие факторы будут влиять на точность эксперимента?
ГДЗ к учебнику можно найти тут. Контрольная работа по химии «Тепловой эффект химической реакции»; 11 класс — К уроку — Химия
Контрольная работа по химии «Тепловой эффект химической реакции»
1 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 9 г. H2O выделяется 123 кДж теплоты
H2O выделяется 123 кДж теплоты
2. По термохимическому уравнению
S(тв.) + O2 (г)= SO2 (г)+297 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 640 г серы;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 59,4 кДж теплоты; в) сколько граммов серы сгорело, если известно, что выделилось 594 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 1 моль/л, а через 4 секунды концентрация этого вещества стала равна 0,6 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 2, при:
а) повышении температуры на 30°С; б) понижении температуры от 70°С до 20 °С.
2 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 18 г. H2O выделяется 123 кДж теплоты
2. По термохимическому уравнению
С(тв.) + O2 (г)= СO2 (г)+394 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 1 кг угля;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 240 кДж теплоты; в) сколько литров СO2 образуется, если выделяется 788 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 1 моль/л, а через 2 секунды концентрация этого вещества стала равна 0,6 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 2, при:
Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 2, при:
а) повышении температуры на 20°С; б) понижении температуры от 50°С до 20 °С.
3 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 27 г. H2O выделяется 123 кДж теплоты
2. По термохимическому уравнению
S(тв.) + O2 (г)= SO2 (г)+297 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 320 г серы;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 118,8 кДж теплоты;
в) сколько граммов серы сгорело, если известно, что выделилось 297 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 2 моль/л, а через 4 секунды концентрация этого вещества стала равна 0,6 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 2 моль/л, а через 4 секунды концентрация этого вещества стала равна 0,6 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 2, при:
а) повышении температуры на 10°С; б) понижении температуры от 60°С до 20 °С.
4 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 90 г. H2O выделяется 246 кДж теплоты
2. По термохимическому уравнению
С(тв.) + O2 (г)= СO2 (г)+394 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 500 г угля;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 480 кДж теплоты; в) сколько литров СO2 образуется, если выделяется 394 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 3 моль/л, а через 4 секунды концентрация этого вещества стала равна 0,6 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 3 моль/л, а через 4 секунды концентрация этого вещества стала равна 0,6 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 3, при:
а) повышении температуры на 30°С; б) понижении температуры от 30°С до 20 °С.
5 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 54 г. H2O выделяется 123 кДж теплоты
2. По термохимическому уравнению
С(тв.) + O2 (г)= СO2 (г)+394 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 250 кг угля;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 720 кДж теплоты; в) сколько литров СO2 образуется, если выделяется 197 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 1 моль/л, а через 3 секунды концентрация этого вещества стала равна 0,6 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 1 моль/л, а через 3 секунды концентрация этого вещества стала равна 0,6 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 2, при:
а) повышении температуры на 20°С; б) понижении температуры от 60°С до 10 °С.
6 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 63 г. H2O выделяется 123 кДж теплоты
2. По термохимическому уравнению
S(тв.) + O2 (г)= SO2 (г)+297 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 160 г серы;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 178,2 кДж теплоты; в) сколько граммов серы сгорело, если известно, что выделилось 1782 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 4 моль/л, а через 4 секунды концентрация этого вещества стала равна 2 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 4 моль/л, а через 4 секунды концентрация этого вещества стала равна 2 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 2, при:
а) повышении температуры на 50°С; б) понижении температуры от 40°С до 20 °С.
7 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 7,2 г. H2O выделяется 123 кДж теплоты
2. По термохимическому уравнению
S(тв.) + O2 (г)= SO2 (г)+297 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 240 г серы;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 356,4 кДж теплоты; в) сколько граммов серы сгорело, если известно, что выделилось 356,4 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 6 моль/л, а через 4 секунды концентрация этого вещества стала равна 4 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 6 моль/л, а через 4 секунды концентрация этого вещества стала равна 4 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 3, при:
а) повышении температуры на 30°С; б) понижении температуры от 40°С до 20 °С.
9 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 81 г. H2O выделяется 123 кДж теплоты
2. По термохимическому уравнению
С(тв.) + O2 (г)= СO2 (г)+394 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 1,5 кг угля;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 1440 кДж теплоты;
в) сколько литров СO2 образуется, если выделяется 394 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 6 моль/л, а через 4 секунды концентрация этого вещества стала равна 3 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 6 моль/л, а через 4 секунды концентрация этого вещества стала равна 3 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 4, при:
а) повышении температуры на 20°С; б) понижении температуры от 40°С до 10 °С.
10 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 90 г. H2O выделяется 123 кДж теплоты
2. По термохимическому уравнению
S(тв.) + O2 (г)= SO2 (г)+297 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 480 г серы;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 712,8 кДж теплоты;
в) сколько граммов серы сгорело, если известно, что выделилось 1069,2 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 7 моль/л, а через 4 секунды концентрация этого вещества стала равна 3 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 7 моль/л, а через 4 секунды концентрация этого вещества стала равна 3 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 5, при:
а) повышении температуры на 20°С; б) понижении температуры от 30°С до 10 °С.
11 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 9,9 г. H2O выделяется 123 кДж теплоты
2. По термохимическому уравнению
С(тв.) + O2 (г)= СO2 (г)+394 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 250 г угля;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 1680 кДж теплоты; в) сколько литров СO2 образуется, если выделяется 2364 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 8 моль/л, а через 4 секунды концентрация этого вещества стала равна 6 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 8 моль/л, а через 4 секунды концентрация этого вещества стала равна 6 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 2, при:
а) повышении температуры на 60°С; б) понижении температуры от 70°С до 40 °С.
12 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 9 г. H2O выделяется 246 кДж теплоты
2. По термохимическому уравнению
S(тв.) + O2 (г)= SO2 (г)+297 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 1200 г серы;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 213,84 кДж теплоты;
в) сколько граммов серы сгорело, если известно, что выделилось 178,2 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 9 моль/л, а через 4 секунды концентрация этого вещества стала равна 6 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 9 моль/л, а через 4 секунды концентрация этого вещества стала равна 6 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 2, при:
а) повышении температуры на 60°С; б) понижении температуры от 70°С до 60 °С.
13 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 9 г. H2O выделяется 369 кДж теплоты
2. По термохимическому уравнению
С(тв.) + O2 (г)= СO2 (г)+394 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 2 кг угля;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 216 кДж теплоты; в) сколько литров СO2 образуется, если выделяется 2400 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 5 моль/л, а через 4 секунды концентрация этого вещества стала равна 3 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 5 моль/л, а через 4 секунды концентрация этого вещества стала равна 3 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 3, при:
а) повышении температуры на 30°С; б) понижении температуры от 70°С до 30 °С.
14 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 9 г. H2O выделяется 492 кДж теплоты
2. По термохимическому уравнению
S(тв.) + O2 (г)= SO2 (г)+297 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 240 г серы;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 356,4 кДж теплоты;
в) сколько граммов серы сгорело, если известно, что выделилось 356,4 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 10 моль/л, а через 4 секунды концентрация этого вещества стала равна 8 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 10 моль/л, а через 4 секунды концентрация этого вещества стала равна 8 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 2, при:
а) повышении температуры на 30°С; б) понижении температуры от 60°С до 40 °С.
15 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 9 г. H2O выделяется 615 кДж теплоты
2. По термохимическому уравнению
С(тв.) + O2 (г)= СO2 (г)+394 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 1,75 кг угля;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 380 кДж теплоты; в) сколько литров СO2 образуется, если выделяется 885 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 12 моль/л, а через 6 секунд концентрация этого вещества стала равна 6 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 12 моль/л, а через 6 секунд концентрация этого вещества стала равна 6 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 2, при:
а) повышении температуры на 30°С; б) понижении температуры от 70°С до 20 °С.
16 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 9 г. H2O выделяется 738 кДж теплоты
2. По термохимическому уравнению
S(тв.) + O2 (г)= SO2 (г)+297 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 240 г серы;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 356,4 кДж теплоты;
в) сколько граммов серы сгорело, если известно, что выделилось 356,4 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 13 моль/л, а через 6 секунд концентрация этого вещества стала равна 3 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 13 моль/л, а через 6 секунд концентрация этого вещества стала равна 3 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 2, при:
а) повышении температуры на 30°С; б) понижении температуры от 70°С до 40 °С.
17 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 18 г. H2O выделяется 862 кДж теплоты
2. По термохимическому уравнению
С(тв.) + O2 (г)= СO2 (г)+394 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 2,25 кг угля;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 580 кДж теплоты;
в) сколько литров СO2 образуется, если выделяется 685 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 0,8 моль/л, а через 8 секунд концентрация этого вещества стала равна 0,6 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 0,8 моль/л, а через 8 секунд концентрация этого вещества стала равна 0,6 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 2, при:
а) повышении температуры на 30°С; б) понижении температуры от 60°С до 20 °С.
18 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 27 г. H2O выделяется 985 кДж теплоты
2. По термохимическому уравнению
S(тв.) + O2 (г)= SO2 (г)+297 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 186 г серы;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 159,4 кДж теплоты; в) сколько граммов серы сгорело, если известно, что выделилось 694 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 11 моль/л, а через 4 секунды концентрация этого вещества стала равна 9 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 11 моль/л, а через 4 секунды концентрация этого вещества стала равна 9 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 2, при:
а) повышении температуры на 30°С; б) понижении температуры от 40°С до 10 °С.
19 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 45 г. H2O выделяется 1008 кДж теплоты
2. По термохимическому уравнению
С(тв.) + O2 (г)= СO2 (г)+394 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 3 кг угля;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 390 кДж теплоты; в) сколько литров СO2 образуется, если выделяется 785 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 1 моль/л, а через 2 секунды концентрация этого вещества стала равна 4 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 1 моль/л, а через 2 секунды концентрация этого вещества стала равна 4 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 2, при:
а) повышении температуры на 30°С; б) понижении температуры от 50°С до 20 °С.
20 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 54 г. H2O выделяется 1131 кДж теплоты
2. По термохимическому уравнению
S(тв.) + O2 (г)= SO2 (г)+297 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 540 г серы;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 99,6 кДж теплоты; в) сколько граммов серы сгорело, если известно, что выделилось 796 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 1 моль/л, а через 2 секунды концентрация этого вещества стала равна 0,4 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 1 моль/л, а через 2 секунды концентрация этого вещества стала равна 0,4 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 2, при:
а) повышении температуры на 40°С; б) понижении температуры от 40°С до 20 °С.
21 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 63 г. H2O выделяется 1254 кДж теплоты
2. По термохимическому уравнению
С(тв.) + O2 (г)= СO2 (г)+394 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 3,25 кг угля;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 780 кДж теплоты; в) сколько литров СO2 образуется, если выделяется 985 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 0,8 моль/л, а через 3 секунды концентрация этого вещества стала равна 0,6 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 0,8 моль/л, а через 3 секунды концентрация этого вещества стала равна 0,6 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 2, при:
а) повышении температуры на 30°С; б) понижении температуры от 70°С до 20 °С.
22 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 7,2 г. H2O выделяется 137,7 кДж теплоты
2. По термохимическому уравнению
S(тв.) + O2 (г)= SO2 (г)+297 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 730 г серы;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 68,9 кДж теплоты; в) сколько граммов серы сгорело, если известно, что выделилось 682 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 14 моль/л, а через 4 секунды концентрация этого вещества стала равна 07 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 14 моль/л, а через 4 секунды концентрация этого вещества стала равна 07 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 2, при:
а) повышении температуры на 30°С; б) понижении температуры от 70°С до 20 °С.
23 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 81 г. H2O выделяется 1500 кДж теплоты
2. По термохимическому уравнению
С(тв.) + O2 (г)= СO2 (г)+394 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 3,5 кг угля;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 440 кДж теплоты; в) сколько литров СO2 образуется, если выделяется 987 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 18 моль/л, а через 4 секунды концентрация этого вещества стала равна 9 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 18 моль/л, а через 4 секунды концентрация этого вещества стала равна 9 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 2, при:
а) повышении температуры на 40°С; б) понижении температуры от 40°С до 20°С.
24 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 90 г. H2O выделяется 1623 кДж теплоты
2. По термохимическому уравнению S(тв.) + O2 (г)= SO2 (г)+297 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 530 г серы;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 128,4 кДж теплоты; в) сколько граммов серы сгорело, если известно, что выделилось 884 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 1 моль/л, а через 4 секунды концентрация этого вещества стала равна 0,6 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 1 моль/л, а через 4 секунды концентрация этого вещества стала равна 0,6 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 2, при:
а) повышении температуры на 30°С; б) понижении температуры от 60°С до 20°С.
25 вариант
1. Составьте термохимическое уравнение образования воды (газообразной) из простых веществ, если известно, что при образовании 90 г. H2O выделяется 1846 кДж теплоты
2. По термохимическому уравнению
С(тв.) + O2 (г)= СO2 (г)+394 кДж рассчитайте:
а) какое количество теплоты выделится при сгорании 3,75 кг угля;
б) сколько литров кислорода вступает в реакцию, если при этом выделяется 654 кДж теплоты; в) сколько литров СO2 образуется, если выделяется 732 кДж теплоты
3. Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 7 моль/л, а через 3 секунды концентрация этого вещества стала равна 4 моль/л.
Определите скорость химической реакции А+В =АВ, если начальная концентрация вещества А была равна 7 моль/л, а через 3 секунды концентрация этого вещества стала равна 4 моль/л.
4. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 2, при:
а) повышении температуры на 20°С; б) понижении температуры от 50°С до 20 °С.
ГДЗ (ответы) Химия 9 класс Попель П.П., Крикля Л.С., 2017 §16 Тепловой эффект химической реакции » Допомога учням
Другие задания смотри здесь…
Упражнение 124. Что понимают под тепловым эффектом химической реакции? Количество теплоты, которое выделяется или поглощается в результате протекания химической реакции.
Упражнение 125. Как классифицируют реакции в зависимости от их теплового эффекта? Реакции, протекающие с выделением теплоты, называют экзотермическими, а реакции, протекающие с поглощением теплоты, — эндотермическими.
Упражнение 126. При очень высокой температуре водяной пар разлагается на простые вещества. Как можно объяснить то, что эта реакция является эндотермической? Данная реакция разложения происходит при сильном нагреве (требует энергии снаружи), то есть протекает с поглощением теплоты, поэтому является эндотермической.
Упражнение 127. При образовании 1 моль хлороводорода из простых веществ выделяется 92,2 кДж теплоты. Напишите соответствующее термохимическое уравнение.
H2 + Cl2 = 2HCl; ΔН =–184,4 кДж
Вычисляем тепловой эффект реакции.
По условии задачи при образовании 1 моль хлороводорода выделяется 92,2 кДж теплоты,
по химическому уравнению при образовании 2 моль хлороводорода — х кДж теплоты.
x = 2 моль • 92,2 кДж : 1 моль = 184,4 кДж теплоты.
Химическая реакция происходит с выделением теплоты, следовательно является экзотермической, поэтому тепловой эффект реакции отрицательный.
Записываем термохимическое уравнение:
H2 + Cl2 = 2HCl; ΔН =–184,4 кДж
Упражнение 128. Воспользовавшись термохимическим уравнением N2+3H2=2NH3; ΔН=–92,4 кДж, напишите термохимическое уравнение реакции разложения аммиака на простые вещества.
2NH3 = N2 + 3H2 ; ΔН = +92,4 кДж
Тепловой эффект химической реакции равен тепловому эффекту обратной реакции, но имеет противоположный знак. Тепловой эффект касается того количества моль, что показывают коэффициенты уравнения реакции.
Другие задания смотри здесь..
презентация к уроку «Тепловой эффект химических реакций»
Урок химии по теме: «Тепловой эффект химических реакций». Расчёты по термохимическим уравнениям (ТХУ)
Химические явления – химические реакции
Химическая реакция – процесс превращения одних веществ в другие.
2Н 2 + О 2 = 2Н 2 О
Признаки химических реакций
- Изменение цвета
- Выделение газа
- Образование или растворение осадка
- Появление или исчезновение запаха
- Выделение или поглощение тепла
Классификация химических реакций по тепловому эффекту
идут с поглощением энергии N 2 + O 2 = 2NO – Q
идут с выделением энергии S + O2 = SO2 + Q
2Hg + O 2 – 180 кДж, С(тв) + O 2 (г) — СO 2 (г) + 394 кДж «Термохимия — раздел химии, в задачу которого входит определение и изучение тепловых эффектов реакции.
Термохимические уравнения – уравнения в которых указывается количество поглощенной или выделенной теплоты.
2HgO — 2Hg + O 2 – 180 кДж,
С(тв) + O 2 (г) — СO 2 (г) + 394 кДж
По термохимическим уравнениям реакций можно проводить различные расчёты. Для решения задач по термохимическим уравнениям реакций нужно записать само уравнение и провести необходимые расчеты по нему.
Алгоритм решения задач по термохимическому уравнению реакции
1. Кратко записать условия задачи (“дано”).
2.Записать термохимическое уравнение реакции (ТХУ), одной чертой в уравнении реакции подчеркивают то, что известно, двумя чертами подчёркивают то, что необходимо определить.
3.Провести вспомогательные вычисления ( М r , М, m).
4.Составить соотношение, используя вспомогательные вычисления и условия задачи; решить соотношение (пропорцию).
5.Записать ответ.
Температура и скорость химической реакции | Глава 6: Химические изменения
Тебе это нравится? Не любить это? Пожалуйста, уделите время и поделитесь с нами своим мнением. Спасибо!
Спасибо!
Урок 6.4
Ключевые понятия
- Реагенты должны двигаться достаточно быстро и достаточно сильно ударить друг друга, чтобы произошла химическая реакция.
- Повышение температуры увеличивает среднюю скорость молекул реагента.
- По мере того, как все больше молекул движется быстрее, количество молекул, движущихся достаточно быстро, чтобы реагировать, увеличивается, что приводит к более быстрому образованию продуктов.
Сводка
Учащиеся приготовят те же два прозрачных бесцветных раствора (раствор пищевой соды и раствор хлорида кальция) из Урока 3. Они помогут спланировать эксперимент, чтобы увидеть, влияет ли температура растворов на скорость их реакции. Затем студенты попытаются объяснить на молекулярном уровне, почему температура влияет на скорость реакции.
Объектив
Учащиеся смогут определять и контролировать переменные для разработки эксперимента, чтобы увидеть, влияет ли температура на скорость химической реакции. Студенты смогут объяснить на молекулярном уровне, почему температура реагентов влияет на скорость реакции.
Студенты смогут объяснить на молекулярном уровне, почему температура реагентов влияет на скорость реакции.
Оценка
Загрузите лист активности учащегося и раздайте по одному каждому учащемуся, если это указано в упражнении. Лист упражнений будет служить компонентом «Оценить» каждого плана урока 5-E.
Безопасность
Убедитесь, что вы и ученики носите правильно подогнанные очки.
Материалы для демонстрации
- Горячая вода в изолированном стакане
- Ледяная вода в изолированном стакане
- 2 светящиеся палочки
Материалы для каждой группы
- Сода пищевая
- Хлорид кальция
- Вода
- Цилиндр градуированный
- Весы или мерная ложка (чайная ложка)
- 2 широких (9 унций) прозрачных пластиковых стакана
- 4 маленьких прозрачных пластиковых стакана
- 2 пластиковых контейнера для деликатесов
- Горячая вода (40–50 ° C)
- Холодная вода (0–5 ° C)
- Малярная лента
- Ручка
Проведите демонстрацию светящихся палочек, чтобы представить идею о том, что температура может влиять на скорость химической реакции.

Вопрос для расследования
Как нагревание или охлаждение светящейся палочки влияет на ее химическую реакцию?
Материалы для демонстрации
- Горячая вода в изолированном стакане
- Ледяная вода в изолированном стакане
- 2 светящиеся палочки
Подготовка учителей
Не включайте светящиеся палочки, когда готовитесь к демонстрации.Перед приходом учеников поместите одну светящуюся палочку в горячую воду, а другую — в ледяную. Перед демонстрацией светящиеся палочки должны быть в воде как минимум за пару минут.
Скажите ученикам, что вы нагрели одну светящуюся палочку и охладили другую.
Задайте вопрос студентам:
- Как запустить светящуюся палочку?
- Согните палку, пока не услышите хлопок.
- Что делать, если вы хотите, чтобы ваша светящаяся палочка прослужила дольше?
- Поместите светящуюся палочку в морозильную камеру, когда вы ее не используете.

Объясните: когда ученики сгибают палку, чтобы запустить ее, они разбивают небольшой контейнер, наполненный химическим веществом, внутри световой палки. После разрушения химические вещества, которые были разделены, объединяются и вступают в реакцию друг с другом. Если положить светящуюся палочку в морозильную камеру, чтобы она прослужила дольше, температура может иметь какое-то отношение к скорости химической реакции.
Процедура
- Извлеките светящиеся палочки из горячей и холодной воды.
Попросите двух учеников согнуть и включить светящиеся палочки.
- Покажите студентам обе светящиеся палочки и спросите их, что они наблюдают. Вы можете разносить палки по классу, чтобы они почувствовали разницу в температуре.
Ожидаемые результаты
Теплый светящийся стержень будет ярче холодного.
Задайте вопрос студентам:
- Как узнать, происходит ли химическая реакция быстрее или медленнее в каждой светящейся палочке?
- Теплая светящаяся палочка ярче, поэтому химическая реакция может протекать быстрее.
 Холодная светящаяся палочка не такая яркая, поэтому химическая реакция может протекать медленнее.
Холодная светящаяся палочка не такая яркая, поэтому химическая реакция может протекать медленнее. - Некоторые люди кладут светящиеся палочки в морозильную камеру, чтобы они прослужили дольше. Как вы думаете, почему это работает?
- Химическая реакция светового джойстика в холодном состоянии протекает медленнее.
- Считаете ли вы, что использование более теплых реагентов увеличивает скорость других химических реакций? Почему?
- Разумно думать, что температура влияет на скорость других химических реакций, потому что температура влияет на эту реакцию.
Спросите студентов, как они могут поставить эксперимент, чтобы выяснить, влияет ли температура реагентов на скорость реакции.
Обсудите со студентами химические реакции, которые они провели на последнем уроке. Они объединили раствор хлорида кальция с раствором пищевой соды. Они увидели, что при объединении растворов образовывались твердое вещество и газ.
 Скажите учащимся, что они согреют и охладят раствор хлорида кальция и раствор пищевой соды, чтобы выяснить, влияет ли температура на скорость химической реакции.
Скажите учащимся, что они согреют и охладят раствор хлорида кальция и раствор пищевой соды, чтобы выяснить, влияет ли температура на скорость химической реакции.Задайте вопрос студентам:
- Сколько наборов решений мы должны использовать?
- Учащиеся должны использовать два набора: один с подогревом, а другой с охлаждением. Скажите студентам, что они будут использовать ванны с горячей и холодной водой, как в демонстрации, для нагрева и охлаждения растворов.
- Должны ли нагретые образцы раствора пищевой соды и раствора хлорида кальция быть такими же, как охлажденные образцы?
- Да.Следует использовать образцы того же раствора и такое же количество холодного раствора, что и теплого раствора.
- В демонстрации светящейся палочки мы могли бы сказать, что реакция происходила быстрее, если бы свет был ярче. Как мы можем определить, происходит ли реакция в этой химической реакции быстрее?
- Химическая реакция происходит быстрее, чем больше продукции производится.
 Мы должны искать больше пузырьков (двуокиси углерода) и большего количества белого осадка (карбонат кальция).
Мы должны искать больше пузырьков (двуокиси углерода) и большего количества белого осадка (карбонат кальция).
Попросите учащихся нагреть пару реагентов и охладить другую и сравнить количество продуктов в каждой реакции.
Вопрос для расследования
Влияет ли температура реагентов на скорость химической реакции?
материалов для каждой группы
- Сода пищевая
- Хлорид кальция
- Вода
- Цилиндр градуированный
- Весы или мерная ложка (½ чайной ложки)
- 4 маленьких пластиковых стаканчика
- 2 пластиковых контейнера для деликатесов
- Горячая вода (около 50 ° C)
- Холодная вода (0–5 ° C)
- Малярная лента
- Ручка
Процедура
Приготовьте раствор пищевой соды
- Используйте малярную ленту и ручку, чтобы промаркировать 2 небольших пластиковых стаканчика с раствором пищевой соды и 2 небольших пластиковых стаканчика с раствором хлорида кальция.

- С помощью градуированного цилиндра добавьте 20 мл воды в одну из чашек с раствором пищевой соды.
- Добавьте 2 г (около ½ чайной ложки) пищевой соды в воду в чашке с этикеткой. Взбивайте, пока не растворится как можно больше пищевой соды. (На дне чашки может быть нерастворенная пищевая сода.)
- Налейте половину раствора пищевой соды в другую чашку с раствором пищевой соды.
- Используйте малярную ленту и ручку, чтобы промаркировать 2 небольших пластиковых стаканчика с раствором пищевой соды и 2 небольших пластиковых стаканчика с раствором хлорида кальция.
Приготовьте раствор хлорида кальция
- С помощью градуированного цилиндра добавьте 20 мл воды в одну из чашек с раствором хлорида кальция.
- Добавьте 2 г (около ½ чайной ложки) хлорида кальция в воду в чашке с этикеткой. Помешивайте, пока хлорид кальция не растворится.
- Налейте половину вашего раствора хлорида кальция в другую чашку с раствором хлорида кальция.
Нагрев и охлаждение решений
- Налейте горячую воду в один пластиковый контейнер и холодную воду в другой, пока каждый не будет заполнен примерно на.
 Вода не должна быть очень глубокой. Это ваши ванны с горячей и холодной водой.
Вода не должна быть очень глубокой. Это ваши ванны с горячей и холодной водой. - Поместите в горячую воду одну чашку раствора пищевой соды и одну чашку раствора хлорида кальция. Осторожно покрутите чашки в воде примерно 30 секунд, чтобы нагреть растворы.
- Ваш партнер должен поместить и подержать одну чашку раствора пищевой соды и одну чашку раствора хлорида кальция в холодной воде. Осторожно покрутите чашки в воде примерно 30 секунд, чтобы охладить растворы.
- Налейте горячую воду в один пластиковый контейнер и холодную воду в другой, пока каждый не будет заполнен примерно на.
Объедините решения
- В то же время вы и ваш партнер должны сочетать два теплых решения друг с другом и два холодных решения друг с другом.
Ожидаемые результаты
Теплые растворы реагируют немедленно и намного быстрее, чем холодные. В объединенных теплых растворах быстро появятся пузырьки и частицы белого твердого вещества.Холодные растворы станут мутно-серыми и останутся такими на некоторое время. Со временем объединенные растворы постепенно станут белыми и пузырьками, и появятся частицы белого твердого вещества.

Обсудите наблюдения студентов.
Задайте вопрос студентам:
- Влияет ли температура реагентов на скорость химической реакции?
- Да. Теплые растворы реагируют намного быстрее, чем холодные.
Покажите студентам, что более быстро движущиеся молекулы в теплых реагентах ударяют друг друга с большей энергией и поэтому с большей вероятностью будут реагировать.
Задайте вопрос студентам:
- Как вы думаете, почему на молекулярном уровне теплые растворы реагируют быстрее, чем холодные?
Объясните учащимся, что для реакции молекул реагентов им необходимо контактировать с другими молекулами реагентов с достаточной энергией, чтобы определенные атомы или группы атомов разошлись и рекомбинировали, чтобы образовать продукты.Когда реагенты нагреваются, средняя кинетическая энергия молекул увеличивается. Это означает, что больше молекул движутся быстрее и сталкиваются друг с другом с большей энергией.
 Если большее количество молекул ударяется друг о друга с достаточной энергией для реакции, скорость реакции увеличивается.
Если большее количество молекул ударяется друг о друга с достаточной энергией для реакции, скорость реакции увеличивается.Спроецируйте анимацию. Молекулы сталкиваются и реагируют.
Укажите, что более медленно движущиеся молекулы ударяются и отскакивают, не реагируя. Но более быстрые молекулы ударяют друг друга с достаточной энергией, чтобы разорвать связи и отреагировать.
Представьте идею о том, что для протекания некоторых химических реакций необходимо добавлять энергию.
Сообщите учащимся, что реакция между раствором пищевой соды и раствором хлорида кальция происходит при комнатной температуре. Студенты увидели, что скорость реакции можно ускорить, если реагенты нагреть, и замедлить, если реагенты охладить.
Объясните, что существует множество реакций, которые вообще не происходят при комнатной температуре.Чтобы эти реакции произошли, реагенты необходимо нагреть. Когда они нагреваются, у реагентов достаточно энергии для реакции.
 Часто, как только реакция началась, энергии, произведенной самой реакцией, достаточно, чтобы она продолжалась.
Часто, как только реакция началась, энергии, произведенной самой реакцией, достаточно, чтобы она продолжалась.Спроектируйте видео «Вулкан из дихромата аммония» из «Химии оживает», том 1.
Скажите студентам, что для начала этой реакции требуется тепло, но выделяется достаточно тепла, чтобы реакция продолжалась. Вы также можете упомянуть студентам, что обычная горящая свеча работает точно так же.Воск свечи и кислород не вступают в реакцию, пока не будет добавлен жар спички. Затем тепло горящего воска обеспечивает тепло, чтобы поддерживать реакцию.
15+ STEM-уроков и занятий по изучению химических реакций
Эми Коуэн on 20 августа 2020 г., 8:00Используйте эти бесплатные планы уроков и заданий по STEM, чтобы учить и изучать химические реакции с учениками K-12.
Лучший способ научить химическим реакциям — показать их в действии или, когда это возможно, позволить студентам изучить их на практике. Если вы планируете преподавать модуль по химическим реакциям, вы можете найти именно то, что вам нужно, в одном из 15+ бесплатных уроков и заданий STEM, перечисленных ниже.
Если вы планируете преподавать модуль по химическим реакциям, вы можете найти именно то, что вам нужно, в одном из 15+ бесплатных уроков и заданий STEM, перечисленных ниже.
Планы уроков по изучению химических реакций
Планы уроковсодержат материалы для поддержки преподавателей, ведущих практическое обучение STEM со студентами.Планы уроков предлагают согласование с NGSS, содержат справочные материалы, внушающие уверенность учителям даже в областях, которые могут быть для них новыми, и включают дополнительные ресурсы, такие как рабочие листы, видео, вопросы для обсуждения и материалы для оценки. (В некоторых случаях у нас есть и — задание и план урока по схожей теме. Планы уроков предлагают дополнительную поддержку преподавателям, но мы также отметили версии занятий.)
1. Дизайнерский слайм (классы 3-5)
На уроке Slime Shop: Engineer Your Own Slime учащиеся используют процесс инженерного проектирования для создания своих собственных слаймов.
 (Также доступна версия Activity.)
(Также доступна версия Activity.)2. Ананас + творог (сорт 5)
In the Что ферменты в ананасовом соке делают с молоком? На уроке учащиеся узнают о ферментах, которые объединяют ананас и молоко, и наблюдают, что происходит и почему. (Также доступна версия Activity.)
3. Химия холодной упаковки (классы 6-8)
На уроке «Химия холодной упаковки: изучение эндотермических и экзотермических реакций» учащиеся изучают эндотермические и экзотермические реакции и выбирают лучшую химическую реакцию для создания своей собственной холодильной упаковки.

4.Молочный пластик (классы 6-8)
В модели превратите молоко в пластик! На уроке учащиеся используют химическую реакцию между молоком и уксусом для создания казеиновой молочной пластмассы и узнают о полимеризации. (Также доступна версия Activity.)
5. Каталаза, субстрат и скорость реакции (классы 9–12)
На уроке «Контроль скорости реакции вспенивания» учащиеся изучают роль субстрата в контроле скорости реакции.
6. Скорость и температура реакций (классы 9–12)
из серии : ускоряйте темп с ростом температуры! На уроке учащиеся исследуют реакцию изменения цвета пищевого красителя и отбеливателя.
 Как температура влияет на скорость реакции?
Как температура влияет на скорость реакции?7.Скорость реакции и площадь поверхности (классы 9-12)
среди скорости реакции: когда площадь поверхности имеет значение! На уроке учащиеся используют измельченные таблетки Alka-Seltzer® разного размера, чтобы исследовать взаимосвязь между площадью поверхности и скоростью реакции.
Деятельность по изучению химических реакций
1. Зубная паста «Слон»
Зубная паста не используется, но реакция Elephant Toothpaste создает забавную, эффектную демонстрацию вспенивания реакции, возникающей при смешивании перекиси водорода с дрожжами и мылом для посуды.(Необязательно: учащиеся могут использовать пищевые красители различных цветов для создания своих собственных уникальных дисплеев.)
2.
 Лавовая лампа химической реакции
Лавовая лампа химической реакцииВ упражнении «Сделайте лавовую лампу на базе Alka-Seltzer» учащиеся могут насладиться великолепным эффектом пузырящейся лавовой лампы, когда они смешают Alka-Seltzer®, минеральное или растительное масло и воду.
3. Лимонный вулкан
В упражнении «« Сделай лимонный вулкан »» учащиеся создают свои собственные шипящие вулканы, смешивая пищевую соду и лимон (лимонная кислота), и видят, какое отношение выделение углекислого газа (CO2) имеет к эффекту вулкана.
4.Невидимые чернила
Есть куркума? В Секретные сообщения невидимыми чернилами! В упражнении учащиеся изучают два различных типа химических реакций, чтобы понять, какая из них лучше всего подходит для написания и расшифровки секретных сообщений.
 (Совет! Узнайте из первых уст, как все было, когда эта семья занималась домашними делами.)
(Совет! Узнайте из первых уст, как все было, когда эта семья занималась домашними делами.)5.Бомбочки для ванн
В упражнении Изготовление самодельных бомбочек для ванн ученики изучают различные рецепты и ингредиенты, чтобы увидеть, из которых получится самая шипучая бомба для ванны и почему. (Для студентов, выполняющих научные проекты, посвященные этой химической реакции, доступен удобный комплект бомбы для ванны.)
6. Изучение ферментов
В упражнении Exploring Enzymes учащиеся узнают о ферментах в организме и узнают, как фермент каталаза помогает защитить клетки.
7.
 Огненная змея
Огненная змеяВ упражнении Make a Fire Snake комбинация жидкости для зажигалок, песка, пищевой соды и сахара запускает химическую реакцию, в которой впечатляющая огненная змея, кажется, волшебным образом растет во время горения.
8.Химия капусты
В упражнении «Изменение цвета капусты» учащиеся используют капусту для приготовления индикаторного раствора, а затем узнают о кислотах и щелочах, тестируя различные продукты и жидкости.
9. Пенистый искусственный снег
В упражнении Foaming Fake Snow учащиеся лепят искусственный снег и изучают химические реакции и поверхностно-активные вещества.
Узнать больше
Узнайте больше о типах химических реакций от наших партнеров на ChemTalk.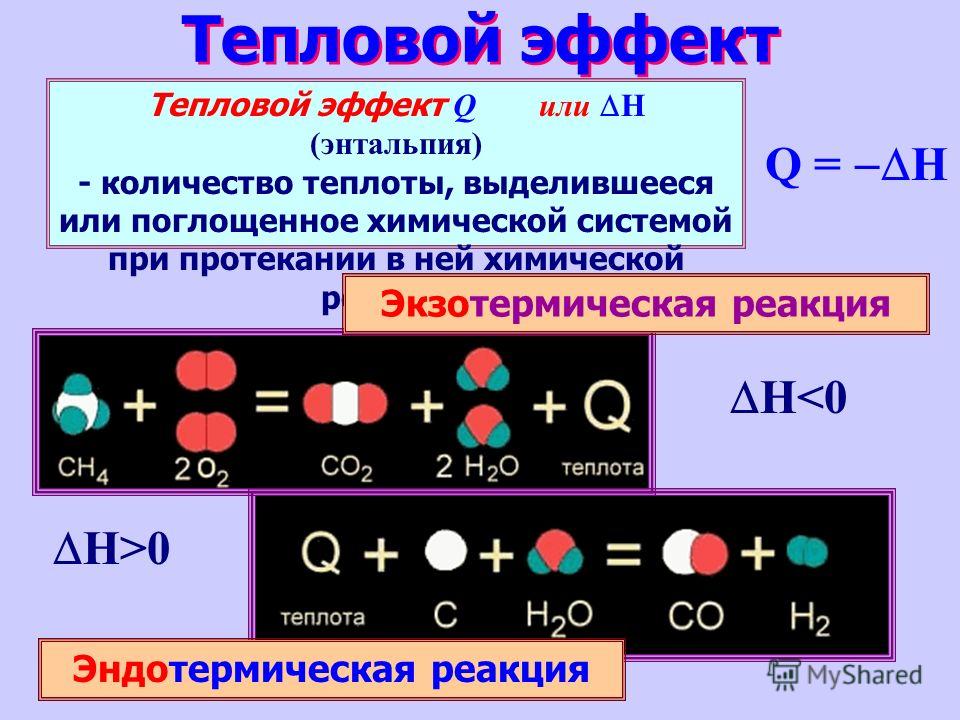
Тематические коллекции
Подобные коллекции помогают преподавателям находить тематические задания в определенной предметной области или находить задания и уроки, соответствующие требованиям учебной программы. Мы надеемся, что с помощью этих коллекций учителям будет удобно просматривать родственные уроки и задания. Для других коллекций см. Списки Teaching Science Units и Thematic Collections. Мы также рекомендуем вам просмотреть полные разделы «Занятия по STEM для детей» и «Планы уроков». Доступны фильтры, которые помогут вам сузить область поиска.
Вам также могут понравиться эти похожие сообщения:
7.1 Как мы узнаем, что произошла химическая реакция? | Химические реакции
Обзор главы
1 неделя
Эта глава основывается на кратком введении в химические реакции, которое было рассмотрено в главе 1 (Атомы) Gr. 8 Материя и материалы, особенно параграф Чистые вещества. Важное послание этой главы состоит в том, что атомы перестраиваются во время химической реакции.Атомы не меняются, но то, как они расположены по отношению друг к другу, меняется. Это означает, что молекулы меняются, даже если количество атомов каждого типа, присутствующих в начале реакции, остается неизменным на всем протяжении. Чтобы помочь учащимся установить эту важную концептуальную связь, диаграммы частиц используются для представления некоторых реакций в этой главе. Учащимся также будет предоставлена возможность самостоятельно нарисовать такие диаграммы в упражнениях и ответить на вопросы этой главы.
Важное послание этой главы состоит в том, что атомы перестраиваются во время химической реакции.Атомы не меняются, но то, как они расположены по отношению друг к другу, меняется. Это означает, что молекулы меняются, даже если количество атомов каждого типа, присутствующих в начале реакции, остается неизменным на всем протяжении. Чтобы помочь учащимся установить эту важную концептуальную связь, диаграммы частиц используются для представления некоторых реакций в этой главе. Учащимся также будет предоставлена возможность самостоятельно нарисовать такие диаграммы в упражнениях и ответить на вопросы этой главы.
Упражнение «Можем ли мы использовать химическую реакцию, чтобы заглянуть внутрь яйца?» Занимает несколько дней. Предлагается начать с него на первом уроке этой главы. Это поможет показать учащимся, что химические изменения обычно наблюдаются в макроскопическом масштабе и что макроскопические наблюдения свидетельствуют об активности на уровне частиц.
Также неплохо подготовить известковую воду, необходимую для исследования «Можно ли использовать чистую известковую воду для обнаружения углекислого газа?», Прежде чем вы начнете эту главу.Чтобы сделать чистую известковую воду, следуйте инструкциям ниже:
Инструкции по приготовлению чистой известковой воды
Поместите несколько столовых ложек гидроксида кальция Ca (OH) 2 в прозрачную бутыль с реагентом на 500 мл и залейте водой. Встряхните или размешайте, чтобы получилась мутная суспензия.
Оставьте суспензию на несколько дней. Прозрачная жидкость над твердым Ca (OH) 2 представляет собой насыщенный раствор Ca (OH) 2 , также известный как чистая известковая вода.
Осторожно декантируйте столько, сколько вам нужно, не взбалтывая твердый осадок Ca (OH) 2 на дне.

Чтобы приготовить еще, просто добавьте еще воды, встряхните и дайте снова отстояться. Когда осадок полностью растворится, просто добавьте еще твердого Ca (OH) 2 .
3.1 Как мы узнаем, что произошла химическая реакция? (1.5 часов)
Задачи | Навыки | Рекомендация |
Деятельность: Разница между физическими и химическими изменениями | Доступ и вызов информации, сортировка и классификация, | Предлагается |
Задание: Можно ли с помощью химической реакции заглянуть внутрь яйца? | Наблюдение, запись информации, рисование и маркировка, интерпретация | CAPS рекомендуется |
3. 2 Реагенты и продукты (1,5 часа)
2 Реагенты и продукты (1,5 часа)
Задачи | Навыки | Рекомендация |
Задание: Анализ эксперимента с яичной скорлупой | Интерпретация, объяснение химической реакции | CAPS Рекомендуется |
Деятельность: Изучение реакции ферментации | Доступ и вызов информации, интерпретация | Дополнительно |
Действие: Некоторые химические реакции, происходящие из жизни и жизни | Подкрепление, отзыв информации | CAPS рекомендуется |
Деятельность: Карьера в химии | Доступ к информации и ее вызов, исследование, чтение и письмо, общение | Дополнительно |
В предыдущей главе мы рассмотрели модель частиц материи и, в частности, изменения состояния. Вы помните, как нагревали и охлаждали воск свечи, чтобы наблюдать, как он тает, а затем затвердевает. Воск сначала превратился из твердого вещества в жидкость, а затем снова в твердое состояние. Это физических изменений, . Химические свойства вещества не меняются.
Вы помните, как нагревали и охлаждали воск свечи, чтобы наблюдать, как он тает, а затем затвердевает. Воск сначала превратился из твердого вещества в жидкость, а затем снова в твердое состояние. Это физических изменений, . Химические свойства вещества не меняются.
Теперь мы посмотрим, что происходит, когда мы получаем химических изменений в веществах. Они происходят в ходе химических реакций.
Как мы узнаем, что произошла химическая реакция?
- химическая реакция Реакционная колба
- или реакционная емкость
Во время химической реакции одно или несколько веществ превращаются в новые.Вы знаете какие-нибудь химические реакции? Вы можете привести один или два примера?
Учащиеся могут помнить, что ржавление железа — это химическая реакция, или они могут привести в качестве примеров некоторые реакции из главы 1.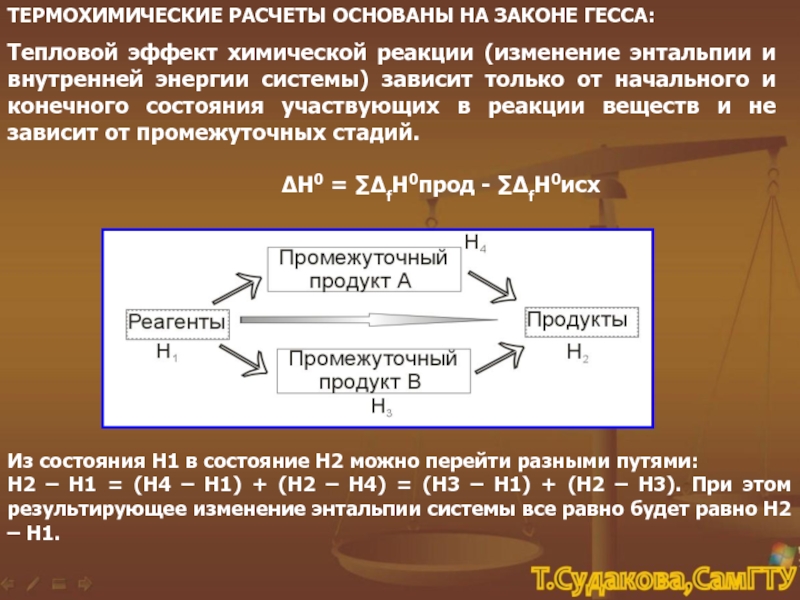 Учащиеся также могут ссылаться на «изменение состояния» как на реакцию. Однако это НЕ химическая реакция или изменение. Объясните учащимся, что это всего лишь физическое изменение, а не химическое изменение.
Учащиеся также могут ссылаться на «изменение состояния» как на реакцию. Однако это НЕ химическая реакция или изменение. Объясните учащимся, что это всего лишь физическое изменение, а не химическое изменение.
Как мы узнаем, что происходит химическая реакция? Какие признаки?
Предложите учащимся обсудить это в небольших группах в течение нескольких минут.Составьте список на доске всех их предложений, который может включать:
- Смесь может измениться и выглядеть иначе. (Каким образом? Может произойти изменение цвета и образование пузырьков или «кристаллов».)
- Возможен взрыв.
- Смесь может изменять температуру, нагреваясь или остывая. Это НЕ следует путать с физическими изменениями во время нагрева и охлаждения, например, когда вещество плавится или затвердевает.
Мы можем определить, произошла ли химическая реакция, когда произойдет одно или несколько из следующих событий:
В большинстве практических руководств по введению в химию перечисляются только три визуальные подсказки, указанные выше, как признаки того, что реакция имела место. Тем не менее, приведенные ниже невизуальные знаки тоже заслуживают внимания.
Тем не менее, приведенные ниже невизуальные знаки тоже заслуживают внимания.
Все вышеперечисленные знаки являются визуальными или фиксируются визуально.Значит, мы их видим. Другие наши органы чувств также могут помочь нам определить, произошла ли химическая реакция:
- Иногда можно почувствовать запах химических изменений, например, когда образуется новый материал с сильным запахом.
- Могут ощущаться другие химические изменения, например, когда в результате реакции выделяется тепло.
- Слышны некоторые химические изменения, например когда происходит взрыв.
Видео о физических и химических изменениях.
Это короткое задание, чтобы убедиться, что учащиеся понимают разницу между химическими и физическими изменениями, и использует примеры из повседневной жизни.
ИНСТРУКЦИЯ:
Ниже представлена таблица, в которой перечислены некоторые химические и физические изменения.
Вам необходимо решить, является ли изменение физическим или химическим, и записать ответ в последний столбец.
Изменить | Это физическое или химическое изменение? |
Нарезка картофеля кубиками | |
Кипяток в кастрюле на плите | |
Яичница на сковороде | |
Яичные белки для взбивания | |
Растворение сахара в воде | |
Горящий газ в газовой плите | |
Ваше мороженое тает на солнце | |
Молоко скисает | |
Ворота железные наружные ржавчины |
Вот ответы. Учащимся нужно только указать физический или химический состав — некоторые объяснения были предоставлены в качестве справочной информации для учителя и, если вы хотите, объяснить изменения своим учащимся.
Учащимся нужно только указать физический или химический состав — некоторые объяснения были предоставлены в качестве справочной информации для учителя и, если вы хотите, объяснить изменения своим учащимся.
Изменить | Это физическое или химическое изменение? |
Нарезка картофеля кубиками | Физический |
Кипяток в кастрюле на плите | Физический |
Яичница на сковороде | Химический (яичные белки подвергаются химическому изменению и сшиваются, образуя сеть) |
Яичные белки для взбивания | Физический (воздух нагнетается в жидкость, но новое вещество не образуется) |
Растворение сахара в воде | Физический (зерна сахара диспергированы в воде, но отдельные молекулы сахара не изменяются) |
Горящий газ в газовой плите | Химическая (форма водяного пара и углекислого газа) |
Ваше мороженое тает на солнце | Физический |
Молоко скисает | Химическая (производится молочная кислота) |
Ворота железные наружные ржавчины | Химический (формы оксида железа — более подробно об этом пойдет речь в Гр. |
Теперь мы применим наш контрольный список на практике, посмотрев на реакцию, достаточно безопасную, чтобы попробовать дома. Вы когда-нибудь задумывались, как будет выглядеть сырое яйцо без скорлупы? Мы собираемся использовать химическую реакцию, чтобы удалить скорлупу с яйца, не разбивая его!
Как сделать так, чтобы яйцо выглядело так? http: // www.flickr.com/photos/gemsling/2687069763/ Начните это упражнение как можно скорее, потому что для полного растворения яичной скорлупы требуется несколько дней. Возможно, стоит провести реакцию в двух экземплярах на случай, если с экспериментом что-то пойдет не так. Яйцо без скорлупы очень нежное и может разбиться, и тогда было бы неплохо иметь «запасное» яйцо.
Видео об эксперименте с голым яйцом
МАТЕРИАЛЫ:
- яиц
- стакан
- белый уксус
ИНСТРУКЦИЯ:
Осторожно поместите яйцо в стакан.Будьте осторожны, чтобы не треснуть скорлупу.
Залейте яйцо уксусом. Подождите несколько минут. Вы видите что-нибудь, что происходит на поверхности яичной скорлупы?
- Напишите свои наблюдения ниже.
- О чем свидетельствует это наблюдение?
- Яичная скорлупа постепенно покрывается пузырями.

Пузырьки — признак происходящей химической реакции.
Оставьте яйцо в уксусе на 4-5 дней. После этого вы должны завершить оставшуюся часть упражнения.
Примечание: Может потребоваться долить уксус, если реакция начинает замедляться.Не забудьте вернуться к занятиям в конце недели, когда яичная скорлупа полностью растворится.
Через 4–5 дней посмотрите на яйцо в уксусе и запишите свои наблюдения. На уксусе плывет пенистый коричневый слой.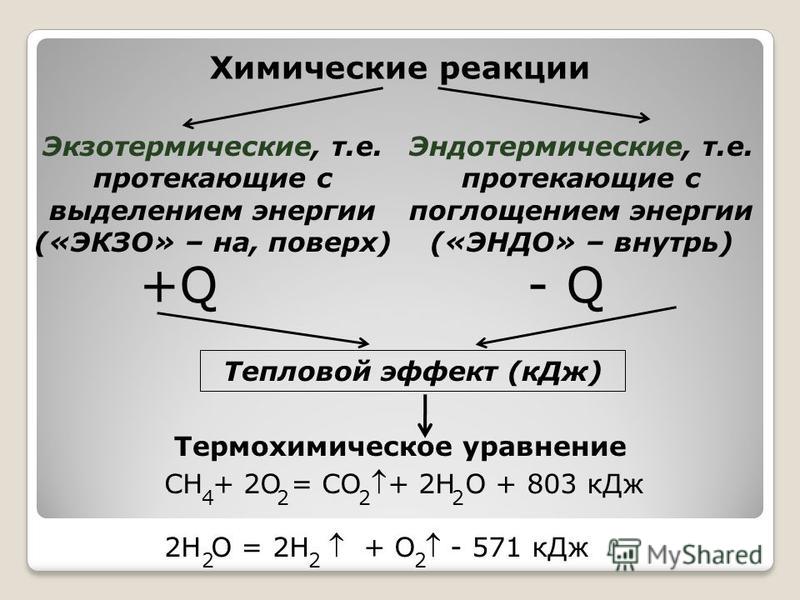
Осторожно выньте яйцо из уксуса большой ложкой.Коснитесь поверхности яйца. Напишите свои наблюдения ниже. Что случилось с оболочкой?
Яйцо на ощупь мягкое и шаткое. Оболочка исчезла, потому что растворилась. На его месте порошковое покрытие.
Сотрите с яйца порошкообразный налет и опустите его в чистую воду.Как это выглядит сейчас?Яйцо потеряло скорлупу, и мы видим внутри яичный белок и желток.
Нарисуйте и обозначьте изображения того, как выглядело содержимое стакана до и после реакции.
Учащиеся должны нарисовать изображения эксперимента в начале и в конце.На первом фото должно быть целое яйцо в стакане, залитое прозрачным жидким уксусом. На втором изображении должно быть показано прозрачное яйцо с четко обозначенными белками и желтком, погруженное в прозрачный жидкий уксус с плавающим сверху коричневым слоем.
ВОПРОСЫ:
Какие признаки вы увидели, говорящие о том, что произошла химическая реакция? Яйцо выглядит иначе.Мы также увидели пузыри на яичной скорлупе, а затем на уксусе появился пенистый, липкий слой.
Абзац учащегося должен содержать как минимум следующие идеи:
- Яичная скорлупа прореагировала с уксусом и была «съедена».
- Яичная скорлупа растворяется в уксусе.
- Материал яичной скорлупы претерпел химические изменения. Их заменили на другие материалы.
Кости, зубы и жемчуг растворятся в уксусе, как и яичная скорлупа, хотя это может занять гораздо больше времени.
Как можно превратить одно соединение в другое? Что происходит с частицами, когда соединения вступают в реакцию? В следующем разделе мы ответим на эти вопросы.
Реактивы и продукты
- реагент
- товар
- химическое уравнение
- коэффициенты
- ферментация
В главе 1 мы узнали, что соединения образуются в результате химических реакций.Вы можете вспомнить, что такое соединение? Напишите здесь определение.
Соединение — это материал, состоящий из атомов двух или более элементов, которые химически связаны друг с другом в фиксированном соотношении. Поощряйте своих учеников записывать это на полях своей рабочей тетради.
Запишите формулы трех различных соединений.
Ответ, зависящий от учащегося.H 2 O, CO 2 , NaCl и т. Д.
Д.
При активности яичной скорлупы карбонат кальция в яичной скорлупе вступил в реакцию с уксусной кислотой и образовал ацетат кальция, диоксид углерода и воду.
Мы можем записать это химическое уравнение следующим образом:
яичная скорлупа + уксус → ацетат кальция + углекислый газ + вода
ВОПРОСЫ:
Есть два исходных вещества до , эта химическая реакция имеет место.Кто они такие?
Яичная скорлупа (карбонат кальция) и уксус (уксусная кислота).
Присутствуют три вещества после реакции.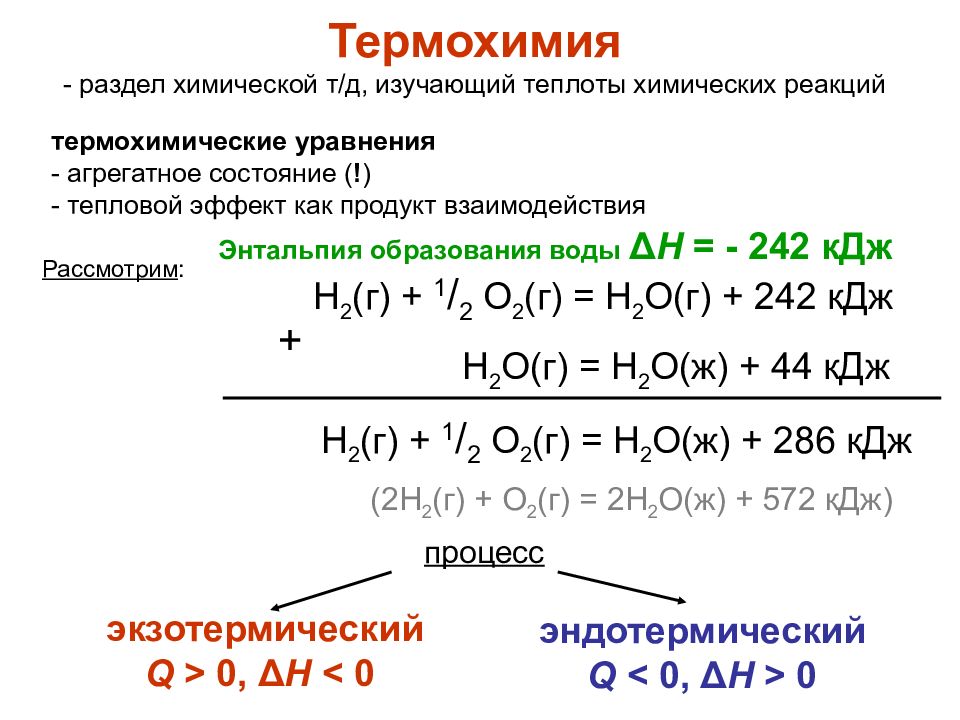 Что это?
Что это?
Это ацетат кальция, диоксид углерода и вода.
Каковы химические формулы соединений воды и углекислого газа?Вода — это H 2 O, а диоксид углерода — CO 2 .
Мы называем вещества, которые присутствуют до того, как произошла химическая реакция, реагентами .Каковы реактивы эксперимента с яичной скорлупой?
Яичная скорлупа (карбонат кальция) и уксус (уксусная кислота).
Используйте это, чтобы оценить понимание учащимся на данный момент.Они должны упомянуть, что реагенты используются для производства продуктов.
Мы называем вещества, которые образуются в ходе химической реакции, продуктами . Каковы результаты эксперимента с яичной скорлупой?
Это ацетат кальция, диоксид углерода и вода.
Во время химической реакции реагенты используются для производства продуктов. Атомы в реагентах были перегруппированы в новые соединения (продукты).
Атомы в реагентах были перегруппированы в новые соединения (продукты).
Химическая реакция — это перегруппировка атомов
Попросите ваших учеников проделать эти реакции сами на своих партах перед ними, используя бусинки / горох / чечевицу / шарики, и перегруппируйте атомы, чтобы получить продукты.
Чтобы преобразовать соединение в другое соединение, нам нужно изменить способ расположения атомов в соединении. Именно это и есть химическая реакция: перегруппировка атомов с целью превращения одного или нескольких соединений в новые соединения.
Каждый раз, когда атомы отделяются друг от друга и рекомбинируют в различные комбинации атомов, мы говорим, что произошла химическая реакция.
Мы собираемся использовать цветные кружки для обозначения атомов в соединениях, которые происходят в химических реакциях.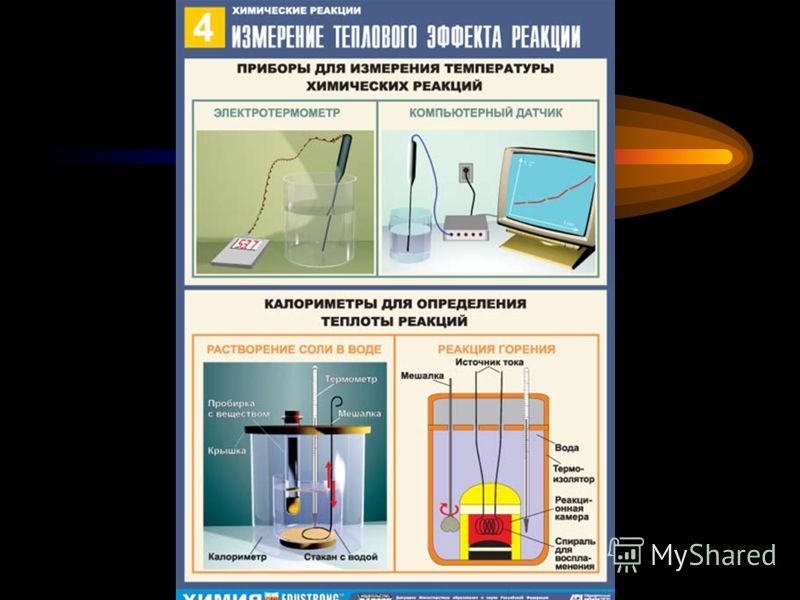 Если у вас остались прежние бусинки или пластилин, вы также можете сами провести эти реакции на своем столе. Взгляните на следующую диаграмму.
Если у вас остались прежние бусинки или пластилин, вы также можете сами провести эти реакции на своем столе. Взгляните на следующую диаграмму.
Углерод и кислород слева от стрелки реагируют с образованием углекислого газа справа от стрелки.
Слева от стрелки у нас есть ситуация «до». Эта сторона представляет вещества, которые у нас есть до реакции. Их называют реагентами .
Справа от стрелки — ситуация «после». Эта сторона представляет собой вещества, которые у нас есть после того, как реакция произошла. Их называют изделиями .
РЕАКТИВЫ (до реакции) → ПРОДУКТЫ (после реакции)
Вы видите, как перегруппировались атомы? Это означает, что произошла химическая реакция. Обозначьте диаграмму «реагентами» и «продуктом».
Реакция между углеродом и кислородом происходит, когда мы сжигаем уголь. Уголь — это углерод, и когда он горит в кислороде, образуется углекислый газ.
Уголь — это углерод, и когда он горит в кислороде, образуется углекислый газ.
На схеме ниже представлена другая химическая реакция. Кислород (красные молекулы) реагирует с водородом (белая молекула) с образованием воды.
Какие реагенты в этой реакции?
Какой продукт в этой реакции?
Как вы думаете, почему водород и кислород представлены как два соединенных атома?
Это ссылка на то, что учащиеся рассмотрели в главе 1 о двухатомных молекулах.Эти элементы существуют в виде двухатомных молекул, поэтому в них два атома соединены вместе.
Вы помните, как мы говорили о химических связях между атомами в молекуле в главе 1? Химическая связь — это сила, удерживающая атомы вместе. Следовательно, во время химической реакции связи между атомами должны разорваться, чтобы атомы могли перегруппироваться с образованием продуктов. Между атомами продукта образуются новые связи.
Следовательно, во время химической реакции связи между атомами должны разорваться, чтобы атомы могли перегруппироваться с образованием продуктов. Между атомами продукта образуются новые связи.
Далее мы рассмотрим химическую реакцию, которая использовалась человечеством на протяжении веков.
Ферментация — это химическая реакция
Вы когда-нибудь забывали немного молока или сока в бутылке, чтобы обнаружить, что они «исчезли» через несколько дней? Если вы случайно его попробовали, возможно, он был кислым, а в случае сока — немного шипучим. Ваши чувства могли предупредить вас, чтобы вы больше его не употребляли. Вы помните, как учились на гр. 7 что наше чувство вкуса защищает нас от испорченной пищи?
Кислый вкус молока или сока вызван продуктами брожения .Какие соединения имеют кислый вкус?
Ферментация приводит не только к образованию нежелательных продуктов. Йогурт, пахта и сыр — это кисломолочные продукты. В этих примерах в процессе ферментации образуются кислоты, которые придают этим продуктам кислый вкус.
Йогурт, пахта и сыр — это кисломолочные продукты. В этих примерах в процессе ферментации образуются кислоты, которые придают этим продуктам кислый вкус.
Ферментация — это также процесс, с помощью которого для производства алкоголя можно использовать различные фрукты, овощи и злаки.Во многих культурах приготовление алкогольных напитков является частью их традиционных знаний.
Два ведра имбирного пива для брожения. http://www.flickr.com/photos/nikonvscanon/4231775258/Как работает ферментация
Видео о том, как работает ферментация (5:39), короткое и веселое. Первые две минуты дают краткое описание. В оставшейся части видео ведущий демонстрирует, как самому приготовить имбирное пиво.
Базовую реакцию в процессе ферментации можно резюмировать следующим образом:
глюкоза → спирт + углекислый газ
Какие реагенты и продукты присутствуют в этой реакции?
Глюкоза — реагент, спирт и диоксид углерода — продукты.
Мы можем изобразить молекулы, чтобы показать, как атомы перестраиваются во время реакции:
На приведенной выше диаграмме серые атомы представляют собой углерод (C), красные атомы — кислород (O), а маленькие белые — водород (H). Запишите названия соединений, участвующих в этой реакции.
Учащиеся должны написать слева глюкоза, а справа — алкоголь, а затем углекислый газ.
Сама по себе глюкоза не превращается в спирт и углекислый газ! Микроорганизмы, такие как дрожжи и бактерии, активно сбраживают глюкозу.
Дрожжи производят специальные химические вещества, называемые ферментами, которые могут разрушать связи в сахарах, таких как глюкоза, с образованием более мелких молекул, таких как спирт и углекислый газ.
Учащиеся впервые столкнулись бы с бактериями в Gr.7 Life and Living при изучении биоразнообразия и классификации организмов. Более подробно они рассмотрят микроорганизмы в гр. 9 Жизнь и жизнь.
В Южной Африке популярным напитком является имбирное или ананасовое пиво! Шипучие пузырьки в имбирном или ананасовом пиве — это пузырьки углекислого газа, вырабатываемые дрожжами во время брожения. Сделаем имбирное пиво!
Это дополнительное мероприятие, которое можно выполнять, если у вас есть время в классе.Также может быть выполнен как проект . В следующем семестре мы снова рассмотрим ферментацию в книге «Материя и материалы». В процессе ферментации глюкоза не полностью расщепляется, поэтому она выделяет меньше энергии (в форме АТФ), чем при дыхании. Ферментация также является анаэробной, что означает, что она не требует кислорода, тогда как для дыхания требуется кислород. Спирт образуется при брожении. Однако имбирное пиво безалкогольное . Хотя его называют пивом, оно не является алкогольным, потому что не ферментируется достаточно долго.
Спирт образуется при брожении. Однако имбирное пиво безалкогольное . Хотя его называют пивом, оно не является алкогольным, потому что не ферментируется достаточно долго.
ИНСТРУКЦИЯ:
- Вам нужно исследовать, как приготовить традиционное южноафриканское имбирное пиво.
- Определите, какие ингредиенты вам понадобятся.
- Как только вы это сделаете, вы можете всем классом выбрать лучший рецепт, который вы будете использовать. Затем вы можете варить имбирное пиво в классе со своим учителем.
- Ответьте на следующие вопросы.
Здесь представлен рецепт имбирного пива. Учащийся также должен изучить свой собственный рецепт в группах и написать лучший рецепт, который у них есть. Затем вы можете либо выбрать один из их рецептов, либо использовать этот, либо вы можете протестировать разные рецепты, чтобы увидеть, какой из них лучше всего работает.
Пошаговое руководство по приготовлению имбирного пива. http://whatsforsupper-juno.blogspot.com/2007/06/old-fashioned-home-made-ginger-beer.html
МАТЕРИАЛЫ:
- 6-8 лимонов среднего размера
- цедра 2 лимонов тертая
- 250 мл (1 стакан) свежевыжатого лимонного сока (примерно из 6 лимонов)
- 2 кусочка свежего имбиря размером с большой палец
- 2 чайные ложки сухого порошка имбиря
- 6 изюмов
- 750 мл (3 стакана) белого сахара
- 5 литров воды
- 1 пакетик по 10 г быстрорастворимых (сухих) дрожжей
- терка
- соковыжималка для лимона
- контейнер или ведро
- ложка деревянная
- большая бутылка
- несколько бутылок меньшего размера с крышками
- воздушные шары
- резинки
ИНСТРУКЦИЯ:
- Натереть цедру 2 лимонов на терке в большую емкость или ведро.

- Натереть свежий имбирь крупными зубьями терки.
- Выжмите сок примерно из 6 лимонов. Вам понадобится 250 мл. Добавьте в смесь сок.
- Добавьте сушеный имбирь, изюм и сахар.
- Добавьте 1 литр горячей воды (не кипящей) и перемешивайте около 3 минут, пока сахар полностью не растворится.
- Добавьте еще 4 литра теплой воды.Убедитесь, что вода достаточно прохладная, чтобы вам было удобно держать в ней палец (иначе дрожжи погибнут!).
- Посыпьте пакетик сухих дрожжей водой и оставьте на несколько минут.
- Все перемешать деревянной ложкой.
- Налейте жидкость в большую бутылку и наденьте баллон на горлышко бутылки. Прикрепите баллон к шее толстой резинкой.
- Поставьте флакон в теплое место, но не под прямыми солнечными лучами.
- Дать постоять примерно 4 — 5 часов.

- Когда изюм всплывет вверх, имбирное пиво готово к употреблению.
- Процедить жидкость через сито. Убедитесь, что вы работаете над раковиной или подобным местом.
- Разлейте имбирное пиво в чистые прозрачные стеклянные бутылки и добавьте в каждую изюм. Убедитесь, что вы не наполняете бутылки полностью, а оставляете не менее 7-10 см между жидкостью и горлышком бутылки.
- Прикрепите баллон к горлышкам половины бутылок и закрепите их резиновыми лентами.
- Наверните крышки на другую половину бутылок.
- Храните бутылки вдали от источников тепла и солнечных лучей. (Необязательно находиться в теплом месте.)
- Оставить на ночь минимум на 8 часов.
- Аккуратно откручиваем колпачки. Газ внутри захочет уйти, поэтому делайте это медленно и осторожно.
ВОПРОСЫ:
Какие реагенты вступают в реакцию при приготовлении имбирного пива? Химическая реакция происходит между сахаром и ферментирующими фруктами и дрожжами. Итак, реагентами являются сахар и фрукты (имбирь и изюм).
Итак, реагентами являются сахар и фрукты (имбирь и изюм).
Продукт — двуокись углерода (и очень небольшое количество спирта).
Почему в имбирном пиве появляются пузырьки?Это углекислый газ, задержанный в жидкости.
Как вы думаете, откуда взялся газ? Это результат химической реакции между дрожжами, сахаром и ферментирующими фруктами.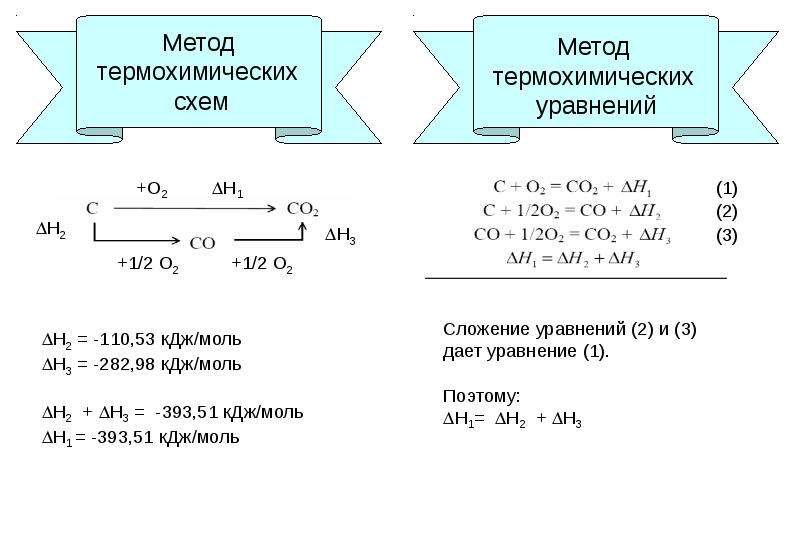
Реагентами являются древесина и кислород, а продуктами — диоксид углерода и вода.
Химические реакции могут помочь нам обнаружить определенные вещества
Некоторые химические реакции могут дать уникальные и даже впечатляющие результаты! Вы когда-нибудь видели эксперимент с вулканом? Этот эксперимент показан по ссылке на видео в окне посещения.
Видео, показывающее вулкан из дихромата аммония
Когда дихромат аммония горит в кислороде, в результате реакции образуются ярко-оранжевые искры. В результате реакции образуются газообразный азот (N 2 ), вода и темно-зеленое соединение, называемое оксидом хрома, в качестве продуктов. Эта реакция уникальна. Только дихромат аммония вступает в реакцию с кислородом, образуя именно эти продукты с этими особыми визуальными эффектами.
Дихромат аммония до его сжигания в кислороде. Оксид хрома является продуктом.Когда два вещества реагируют уникальным и характерным образом при смешивании, одно из них может быть использовано для обнаружения другого.
Это упражнение укрепляет некоторые концепции дыхания и фотосинтеза, усвоенные в начале года в «Жизнь и жизнь». CAPS предлагает повторить эксперимент, надувая пузыри через известковую воду. Мы сделали это в главе 1 в этом году в качестве упражнения, но вы можете кратко повторить его здесь, чтобы снова показать результаты, если учащиеся плохо его помнят.
CAPS предлагает повторить эксперимент, надувая пузыри через известковую воду. Мы сделали это в главе 1 в этом году в качестве упражнения, но вы можете кратко повторить его здесь, чтобы снова показать результаты, если учащиеся плохо его помнят.
Вы помните, что в главе 1 книги «Жизнь и жизнь» мы использовали чистую известковую воду для обнаружения углекислого газа в дыхании? Какого цвета стала прозрачная известковая вода, когда мы пустили через нее пузыри?
Получился молочно-белого цвета.
Известковая вода — это раствор гидроксида кальция в воде. Между известковой водой и углекислым газом происходит реакция с образованием белого вещества в воде, называемого карбонатом кальция. Какие реагенты и продукты в этой реакции?
Какие реагенты и продукты в этой реакции?Реагентами являются известковая вода (гидроксид кальция) и диоксид углерода, а продуктами — карбонат кальция и вода.
Мы говорим, что использовали изменение цвета известковой воды, чтобы обнаружить углекислый газ в нашем дыхании. Двуокись углерода — это побочный продукт химической реакции, протекающей во время дыхания у всех организмов. Напишите словесное уравнение для дыхания.глюкоза + кислород → энергия + углекислый газ + вода
В «Жизнь и жизнь» мы говорили об ингредиентах дыхания, поскольку еще не выучили термины «реагент» и «продукт». Какие реагенты и какие продукты выделяются при дыхании?
Какие реагенты и какие продукты выделяются при дыхании?Реагенты — глюкоза и кислород. Продуктами являются энергия, углекислый газ и вода.
Каковы реагенты и продукты фотосинтеза?Реагенты — углекислый газ и вода, продукты — глюкоза и кислород.
Мы также узнали, что химические реакции — это просто перегруппировки атомов в молекулах с образованием разных молекул. Этим зарабатывают на жизнь многие химики! Они находят способы перегруппировки атомов, чтобы создавать новые соединения.
Карьера по химии
Этот раздел не предназначен для оценки, и вы можете его пропустить.Тем не менее, мы настоятельно рекомендуем вам дать своим ученикам возможность открыть для себя применение того, что они изучают в классе, в окружающем их мире, даже если это будет домашнее задание. Для учащихся очень важно понимать, что то, чему они учатся в классе, выходит далеко за пределы вашего класса. Поощряйте их любопытство!
Естественные науки — это открытия! Мы хотим показать вам, как то, что вы изучаете в классе, полезно в реальном мире.Этот предмет слишком велик для нас, чтобы изучать его все в школе. Вы можете выбрать множество профессий, основанных на науке. Интересуйтесь окружающим миром и исследуйте его, используя свои растущие научные знания!
В следующем году вы выберете предметы, которые вы будете изучать до 12 класса. Выберете ли вы физические науки, науки о жизни и математику? Прежде чем решить, какие предметы выбрать, подумайте, что вы можете делать с каждым из них после школы.
Выберете ли вы физические науки, науки о жизни и математику? Прежде чем решить, какие предметы выбрать, подумайте, что вы можете делать с каждым из них после школы.
Давайте узнаем немного больше о возможностях областей, связанных с тем, что мы изучали в Matter and Materials.
Мария Кюри (1867-1934) была известным химиком и физиком, получившим особую награду за свои исследования радиоактивности. Она была первой женщиной, получившей Нобелевскую премию, единственной женщиной, выигравшей в двух областях, и единственным человеком, который еще не получил Нобелевскую премию в нескольких науках!Многие учащиеся могут задаться вопросом, в чем разница между химиком и инженером-химиком?
A химик изучает состав и свойства вещества.Они используют полученные знания для разработки новых соединений, продуктов и процессов, улучшающих нашу повседневную жизнь. Химик требует обширных знаний в области химии и компетентности в лабораторных условиях. Химики часто исследуют химические реакции, чтобы получить новые материалы и соединения. Это могут быть новые лекарства, инновационные строительные материалы, новые виды топлива, не наносящие вреда окружающей среде, и многое другое. Исследование новых химических реакций сложно. Работа часто исследуется в группах с другими учеными и инженерами.
Химик требует обширных знаний в области химии и компетентности в лабораторных условиях. Химики часто исследуют химические реакции, чтобы получить новые материалы и соединения. Это могут быть новые лекарства, инновационные строительные материалы, новые виды топлива, не наносящие вреда окружающей среде, и многое другое. Исследование новых химических реакций сложно. Работа часто исследуется в группах с другими учеными и инженерами.
A Инженер-химик обычно участвует в разработке способов производства новых соединений, разработанных химиками в больших масштабах, или в поиске способов снижения стоимости производства этих соединений. Инженеру-химику нужны общие знания в области химии, но также необходимо много знать о процессах и о том, что ими движет.
Исследователь работает над открытием чего-то нового или нового способа работы, в то время как инженер оптимизирует известный процесс или выясняет, как лучше всего получить известное соединение.
Пригласите химика / инженера: Вы знаете кого-нибудь, кто является химиком или инженером-химиком? Возможно, вы живете недалеко от университета? Если да, то можете пригласить химика или инженера в школу и рассказать классу о работе, которую делают химики. Кроме того, вы можете посетить химика или инженера на их рабочем месте и попросить их показать вам все вокруг. Вы можете попросить своих учеников заранее подготовить несколько вопросов: вы можете спросить их об их работе, их обучении и о том, какие качества, по их мнению, необходимы, если кто-то хочет стать химиком.Просто не забудьте сначала записаться на прием! Это мероприятие можно превратить в небольшой групповой проект. Учащимся может быть предложено написать краткий отчет о собранной информации. Это не для целей оценки.
Существует множество применений и применений химии, и многие люди в разных профессиях тем или иным образом используют химию. Давайте разберемся.
Давайте разберемся.
ИНСТРУКЦИЯ:
- Ниже приведен список различных профессий, в которых химию так или иначе используют.Просмотрите список, а затем выберите пять профессий, которые вам интересны.
- Поищите в Интернете, чтобы узнать, в чем заключается каждая профессия.
- Опишите свою карьеру одной строкой.
- Если есть карьера, которая вас действительно интересует, нарисуйте рядом смайлик и обязательно прочитайте дополнительную информацию по теме и о том, куда вас может привести химия! Узнайте, какой уровень химии вам понадобится для этой конкретной карьеры.
- Есть много других профессий, помимо перечисленных здесь, в которых каким-либо образом используется химия, поэтому, если вы знаете что-то еще, что не указано здесь и это вас интересует, следуйте своему любопытству и откройте для себя возможности!
Некоторые профессии, связанные с химией:
- Агрохимия
- Биохимия
- Биотехнологии
- Химическое образование / преподавание
- Химик-исследователь
- Экологическая химия
- Судебная медицина
- Пищевая наука и технологии
- Генетик
- Геохимия
- Материаловедение
- Медицина и медицинская химия
- Нефтяная и нефтяная промышленность
- Органическая химия
- Океанография
- Патентный закон
- Фармацевтические препараты
- Освоение космоса
- Зоология
Описание интересующих Вас профессий:
3.
 10. Химические реакции в живых организмах
10. Химические реакции в живых организмахСборочный конвейер
Мы остаемся живыми, потому что в наших телах постоянно происходят миллионы различных химических реакций. Каждая из наших ячеек похожа на загруженный конвейер по сборке автомобилей, изображенный здесь. Сырье, полуфабрикаты и отходы постоянно используются, производятся, транспортируются и выбрасываются. «Рабочие» на линии сборки клеток — это в основном ферменты. Это белки, которые вызывают биохимические реакции.
Рисунок \ (\ PageIndex {1} \): Сборочный конвейерЧто такое биохимические реакции?
Химические реакции, происходящие внутри живых существ, называются биохимическими реакциями. Сумма всех биохимических реакций в организме обозначается как метаболизм . Метаболизм включает как экзотермические (выделяющие тепло) химические реакции, так и эндотермические (поглощающие тепло) химические реакции.
Катаболические реакции
Экзергонические реакции в организме называются катаболическими реакциями . Эти реакции разбивают молекулы на более мелкие части и высвобождают энергию. Примером катаболической реакции является расщепление глюкозы во время клеточного дыхания, которое высвобождает энергию, необходимую клеткам для осуществления жизненных процессов.
Эти реакции разбивают молекулы на более мелкие части и высвобождают энергию. Примером катаболической реакции является расщепление глюкозы во время клеточного дыхания, которое высвобождает энергию, необходимую клеткам для осуществления жизненных процессов.
Анаболические реакции
Эндергонические реакции в организмах называются анаболическими реакциями . Эти реакции поглощают энергию и строят более крупные молекулы из более мелких. Примером анаболической реакции является соединение аминокислот с образованием белка.Как вы думаете, какие типы реакций — катаболические или анаболические — возникают, когда ваше тело переваривает пищу?
Ферменты
Большинство биохимических реакций в организме требует помощи. Почему это так? Во-первых, внутри живых существ температура обычно слишком низкая, чтобы биохимические реакции происходили достаточно быстро, чтобы поддерживать жизнь. Концентрации реагентов также могут быть слишком низкими, чтобы они могли объединиться и вступить в реакцию. Где биохимические реакции получают необходимую помощь? На помощь приходят ферменты.
Где биохимические реакции получают необходимую помощь? На помощь приходят ферменты.
Фермент — это белок, ускоряющий биохимическую реакцию. Это биологический катализатор. Фермент обычно работает за счет уменьшения количества энергии активации, необходимой для начала реакции. На рисунке \ (\ PageIndex {2} \) показана энергия активации, необходимая для соединения глюкозы с кислородом с образованием диоксида углерода и воды. Общая реакция высвобождает энергию, но для запуска процесса требуется начальная энергия активации. Энергия активации без фермента намного выше, чем энергия активации при использовании фермента.
Рисунок \ (\ PageIndex {2} \): действие фермента. Этот график показывает, что происходит, когда глюкоза соединяется с кислородом. Фермент ускоряет реакцию за счет снижения энергии активации. Сравните необходимую энергию активации с ферментом и без него.Как хорошо работают ферменты
Ферменты участвуют в большинстве биохимических реакций и отлично выполняют свою работу. Типичная биохимическая реакция, которая без фермента могла бы протекать через несколько дней или даже несколько столетий, скорее всего, произойдет всего за доли секунды с правильным ферментом! Без ферментов, ускоряющих биохимические реакции, большинство организмов не могло бы выжить.Ферменты специфичны для субстрата. Субстрат фермента — это конкретное вещество, на которое он влияет (Рисунок \ (\ PageIndex {3} \)). Каждый фермент работает только с определенным субстратом, что объясняет, почему существует так много разных ферментов. Кроме того, для работы фермента требуются определенные условия, такие как правильная температура и pH. Некоторые ферменты лучше всего работают в кислых условиях, например, в то время как другие лучше всего работают в нейтральной среде.
Типичная биохимическая реакция, которая без фермента могла бы протекать через несколько дней или даже несколько столетий, скорее всего, произойдет всего за доли секунды с правильным ферментом! Без ферментов, ускоряющих биохимические реакции, большинство организмов не могло бы выжить.Ферменты специфичны для субстрата. Субстрат фермента — это конкретное вещество, на которое он влияет (Рисунок \ (\ PageIndex {3} \)). Каждый фермент работает только с определенным субстратом, что объясняет, почему существует так много разных ферментов. Кроме того, для работы фермента требуются определенные условия, такие как правильная температура и pH. Некоторые ферменты лучше всего работают в кислых условиях, например, в то время как другие лучше всего работают в нейтральной среде.
Заболевания, связанные с недостаточностью ферментов
Существуют сотни известных наследственных нарушений обмена веществ у людей.В большинстве из них единственный фермент либо вообще не вырабатывается организмом, либо вырабатывается в неработающей форме. Отсутствующий или дефектный фермент подобен отсутствующему работнику на конвейере клетки. Отсутствие нормального фермента означает, что не происходит накопления токсичных химикатов или необходимого продукта. Как правило, нормальный фермент отсутствует, потому что человек с заболеванием унаследовал две копии мутации гена, которая могла произойти изначально много поколений назад.
Отсутствующий или дефектный фермент подобен отсутствующему работнику на конвейере клетки. Отсутствие нормального фермента означает, что не происходит накопления токсичных химикатов или необходимого продукта. Как правило, нормальный фермент отсутствует, потому что человек с заболеванием унаследовал две копии мутации гена, которая могла произойти изначально много поколений назад.
Любое наследственное нарушение обмена веществ обычно довольно редко встречается в общей популяции.Однако существует так много различных нарушений обмена веществ, что можно ожидать, что у 1 из 1000–2 500 новорожденных будет одно. У некоторых этнических групп населения, таких как евреи-ашкенази (евреи центрально-восточноевропейского происхождения), частота некоторых наследственных метаболических нарушений намного выше.
Рисунок \ (\ PageIndex {3} \): на рисунке показано, как ферменты превращают субстраты в продукты. субстрат (A) связывается в сайте активации фермента (D) и образует комплекс субстрат-фермент (B). Затем фермент превращает субстрат в продукт (C), разрывая или создавая связи между атомами субстрата.
Затем фермент превращает субстрат в продукт (C), разрывая или создавая связи между атомами субстрата.Функция: надежные источники
Наиболее частым из всех известных нарушений, связанных с недостаточностью ферментов, является дефицит глюкозо-6-фосфат-дегидрогеназы, или G6PD. В США заболевание чаще всего встречается у мужчин афроамериканского происхождения. Фермент G6PD необходим для предотвращения аномального распада эритроцитов. Без фермента эритроциты преждевременно разрушаются, что приводит к анемии.
Выберите одну из следующих тем о дефиците G6PD:
- генетическая основа
- Признаки и симптомы
- Диагностика и лечение
- распространение по всему миру
Для темы, которую вы выбрали, зайдите в Интернет, чтобы узнать о ней больше. Найдите как минимум три источника дополнительной информации, которые вы считаете надежными. Сравните информацию, предоставленную из разных источников, и определите любые расхождения между ними. При необходимости проведите дополнительное онлайн-исследование, чтобы попытаться найти надежное единодушное мнение о противоречивой проблеме.
При необходимости проведите дополнительное онлайн-исследование, чтобы попытаться найти надежное единодушное мнение о противоречивой проблеме.
эндотермических и экзотермических реакций — стенограмма видео и урока
Экзотермические и эндотермические реакции
Если два вещества объединяются и образуются тепло и свет, это убедительное доказательство того, что реакция имела место. Если выделяется тепло, реакция экзотермична. Экзотермический означает, что во время реакции молекулы перешли из более высокого энергетического состояния в более низкое. Эндотермическая реакция обратная. Это когда реакция начинается холоднее и заканчивается более горячей, забирая энергию от начала до конца.
В эндотермической реакции система нагревается по мере охлаждения окружающей среды. В экзотермической реакции система теряет тепло по мере нагрева окружающей среды.
Тот пакет со льдом, который тренер надевает на тесто? Это пример эндотермической реакции. Эндотермическая реакция — это когда для реакции требуется тепло, поэтому она забирает тепло из окружающей среды, заставляя их чувствовать себя холодными. Также как этот пакет со льдом.
Эндотермическая реакция — это когда для реакции требуется тепло, поэтому она забирает тепло из окружающей среды, заставляя их чувствовать себя холодными. Также как этот пакет со льдом.
О, смотри, это был день рождения мальчика, и они празднуют в бальном парке.Его мать зажигает свечи. Видите эту зажженную свечу? Это пример экзотермической реакции. При экзотермических реакциях выделяется тепло.
На молекулярном уровне экзотермическая реакция — это образование связи. Когда две вещи соединяются, они становятся более счастливыми и им требуется меньше энергии, чтобы оставаться вместе. Поскольку у нас есть закон сохранения энергии, мы знаем, что энергия, в которой они не нуждаются, должна куда-то уходить, поэтому они отдают ее своему окружению.
Как мы все знаем, легче собраться, чем расстаться. Чтобы расстаться, нужна энергия. Как и при разрыве химической связи, для разрыва требуется энергия. Это эндотермическая реакция.
Другой способ взглянуть на экзотермические и эндотермические реакции — это подумать о двух магнитах. Если магниты слиплись, то для их разрыва требуется энергия, как и для разрыва связей. Если магниты разделены, им нравится быть вместе и фактически притягивать друг друга, высвобождая при этом энергию.Это похоже на образование химических связей.
Энтальпия
Изменение энтальпии — это количество энергии в виде тепла, которое теряется или приобретается системой. Каждая связь между молекулами имеет определенное количество энергии. Это означает, что вы можете вычислить, сколько энергии потребовалось для образования соединения и сколько потребуется, чтобы разложить это соединение. Вы можете получить числа энтальпии из таблицы в учебнике. Цифры обозначают силу химической связи. Обычно они измеряются в ккал / моль или кДж / моль.
Обычно они измеряются в ккал / моль или кДж / моль.
Вы можете использовать энтальпийное число связей на каждой стороне химического уравнения, чтобы определить, является ли реакция эндотермической или экзотермической. Вы просто складываете количество энергии разорванных связей и вычитаете продукты из реагентов.
В качестве примера возьмем воду. Вот сбалансированное уравнение для производства воды:
2h3 + O2 ↔ 2h3 O
И вот как каждое из этих соединений выглядит при рисовании: H-H, O = O, H-O-H.
Есть две связи H-H, каждая из которых имеет 436 единиц энергии.Одна связь O = O имеет 499 единиц энергии. Есть четыре связи O-H, каждая из которых имеет 463 единицы энергии. Итак, математика выглядит так:
Реактивы: 2 (436) + 499 = 1371
Продукт: 4 (463) = 1852
Это становится:
1371 — 1852 = -481 ед.
Поскольку уравнение дало отрицательное число для энтальпии, что означает выделение тепла, поэтому реакция экзотермична.
Краткое содержание урока
Химические реакции происходят, когда одно или несколько веществ превращаются в одно или несколько разных веществ.Мы знаем из закона сохранения энергии, что энергия не может быть ни создана, ни уничтожена. Любая энергия, полученная или потерянная в результате реакции, должна куда-то уйти.
Когда химическая реакция объединяет две или более вещи и создает химическую связь, выделяется энергия, так что это экзотермическая реакция. Эти реакции обычно вызывают жар, потому что выделяется тепло. Если в результате реакции разрывается одна или несколько связей, необходима или потребляется энергия, поэтому это эндотермическая реакция. Эти реакции обычно проявляются в виде холода.
Результаты обучения
В конце этого урока вы сможете:
- различать эндотермические и экзотермические реакции
- Используйте энтальпию, чтобы определить, является ли реакция эндотермической или экзотермической
4.1 Энергия и метаболизм — Концепции биологии — 1-е канадское издание
Цели обучения
К концу этого раздела вы сможете:
- Объясните, какие метаболические пути проходят
- Изложите первый и второй законы термодинамики
- Объясните разницу между кинетической и потенциальной энергией
- Опишите эндергонические и экзэргонические реакции
- Обсудите, как ферменты действуют как молекулярные катализаторы
Посмотрите видео о гетеротрофах.
Ученые используют термин биоэнергетика для описания концепции потока энергии (рис. 4.2) через живые системы, такие как клетки. Клеточные процессы , такие как построение и разрушение сложных молекул , происходят посредством ступенчатых химических реакций . Некоторые из этих химических реакций являются спонтанными и высвобождают энергию, тогда как другие требуют энергии для протекания. Точно так же, как живые существа должны постоянно потреблять пищу для пополнения своих запасов энергии, клетки должны постоянно производить больше энергии, чтобы восполнить то, что используется многими химическими реакциями, требующими энергии, которые постоянно происходят.В совокупности все химические реакции , которые происходят внутри клеток, включая те, которые потребляют или генерируют энергию, называются метаболизмом клетки .
Рис. 4.2. В конечном счете, большинство форм жизни получают энергию от солнца. Растения используют фотосинтез для захвата солнечного света, а травоядные животные поедают растения для получения энергии. Плотоядные животные едят травоядных, и возможное разложение растительного и животного материала способствует пополнению запаса питательных веществ.
Плотоядные животные едят травоядных, и возможное разложение растительного и животного материала способствует пополнению запаса питательных веществ.Рассмотрим метаболизм сахара.Это классический пример одного из многих клеточных процессов, которые используют и производят энергию. Живые существа потребляют сахар в качестве основного источника энергии, потому что молекулы сахара имеют большое количество энергии, хранящейся в их связях. По большей части фотосинтезирующие организмы, такие как растения, производят эти сахара. Во время фотосинтеза растения используют энергию (первоначально из солнечного света) для преобразования газообразного диоксида углерода (CO 2 ) в молекулы сахара (например, глюкозы: C 6 H 12 O 6 ).Они потребляют углекислый газ и выделяют кислород в качестве побочного продукта. Эта реакция кратко описана как:
6CO 2 + 6H 2 O + энергия ——-> C 6 H 12 O 6 + 6O 2
Поскольку этот процесс включает синтез молекулы, накапливающей энергию, для его выполнения требуется подача энергии. Во время световых реакций фотосинтеза энергия обеспечивается молекулой, называемой аденозинтрифосфатом (АТФ) , которая является основным источником энергии для всех клеток.Так же, как доллар используется в качестве валюты для покупки товаров, клетки используют молекулы АТФ в качестве энергетической валюты для выполнения немедленной работы. Напротив, молекулы-накопители энергии, такие как глюкоза, потребляются только для того, чтобы расщепиться для использования своей энергии. Реакцию, которая собирает энергию молекулы сахара в клетках, нуждающихся в кислороде для выживания, можно описать обратной реакцией на фотосинтез. В этой реакции расходуется кислород и выделяется углекислый газ в качестве побочного продукта. Реакция резюмируется как:
Во время световых реакций фотосинтеза энергия обеспечивается молекулой, называемой аденозинтрифосфатом (АТФ) , которая является основным источником энергии для всех клеток.Так же, как доллар используется в качестве валюты для покупки товаров, клетки используют молекулы АТФ в качестве энергетической валюты для выполнения немедленной работы. Напротив, молекулы-накопители энергии, такие как глюкоза, потребляются только для того, чтобы расщепиться для использования своей энергии. Реакцию, которая собирает энергию молекулы сахара в клетках, нуждающихся в кислороде для выживания, можно описать обратной реакцией на фотосинтез. В этой реакции расходуется кислород и выделяется углекислый газ в качестве побочного продукта. Реакция резюмируется как:
C 6 H 12 O 6 + 6O 2 ——> 6CO 2 + 6H 2 O + энергия
Обе эти реакции включают много этапов.
Процессы производства и расщепления молекул сахара иллюстрируют два примера метаболических путей. Метаболический путь — это серия химических реакций, в которых исходная молекула изменяется, шаг за шагом, через ряд промежуточных продуктов метаболизма, в конечном итоге давая конечный продукт. В примере метаболизма сахара первый метаболический путь синтезирует сахар из более мелких молекул, а другой путь расщепляет сахар на более мелкие молекулы. Эти два противоположных процесса — первый, требующий энергии, а второй — производящий энергию — называются анаболическими путями (строительные полимеры) и катаболическими путями (разрушение полимеров на их мономеры) соответственно.Следовательно, метаболизм состоит из синтеза (анаболизма) и деградации (катаболизма) (рис. 4.3).
Метаболический путь — это серия химических реакций, в которых исходная молекула изменяется, шаг за шагом, через ряд промежуточных продуктов метаболизма, в конечном итоге давая конечный продукт. В примере метаболизма сахара первый метаболический путь синтезирует сахар из более мелких молекул, а другой путь расщепляет сахар на более мелкие молекулы. Эти два противоположных процесса — первый, требующий энергии, а второй — производящий энергию — называются анаболическими путями (строительные полимеры) и катаболическими путями (разрушение полимеров на их мономеры) соответственно.Следовательно, метаболизм состоит из синтеза (анаболизма) и деградации (катаболизма) (рис. 4.3).
Важно знать, что химические реакции метаболических путей не происходят сами по себе. Каждая стадия реакции ускоряется или катализируется белком, называемым ферментом. Ферменты важны для катализирования всех типов биологических реакций — как тех, которые требуют энергии, так и тех, которые выделяют энергию.
Термодинамика относится к изучению энергии и передачи энергии с участием физической материи. Материя, относящаяся к конкретному случаю передачи энергии, называется системой, а все, что находится за пределами этой материи, называется окружающей средой. Например, при нагревании кастрюли с водой на плите система включает плиту, кастрюлю и воду.Энергия передается внутри системы (между плитой, кастрюлей и водой). Есть два типа систем: открытая и закрытая. В открытой системе можно обмениваться энергией с окружающей средой. Плита открыта, потому что тепло может быть отдано воздуху. Закрытая система не может обмениваться энергией со своим окружением.
Биологические организмы — это открытые системы. Между ними и их окружением происходит обмен энергией, поскольку они используют энергию солнца для фотосинтеза или потребляют молекулы, накапливающие энергию, и выделяют энергию в окружающую среду, выполняя работу и выделяя тепло. Как и все в физическом мире, энергия подчиняется физическим законам. Законы термодинамики управляют передачей энергии внутри и между всеми системами во Вселенной.
Как и все в физическом мире, энергия подчиняется физическим законам. Законы термодинамики управляют передачей энергии внутри и между всеми системами во Вселенной.
В общем, энергия определяется как способность выполнять работу или создавать какие-либо изменения. Энергия существует в разных формах. Например, электрическая энергия, световая энергия и тепловая энергия — это разные виды энергии. Чтобы понять, как энергия поступает в биологические системы и выходит из них, важно понимать два физических закона, управляющих энергией.
Первый закон термодинамики гласит, что общее количество энергии во Вселенной постоянно и сохраняется. Другими словами, во Вселенной всегда было и будет точно такое же количество энергии. Энергия существует во многих различных формах . Согласно первому закону термодинамики, энергия может передаваться с места на место или преобразовываться в различные формы, , но не может быть создана или уничтожена . Передачи и преобразования энергии происходят вокруг нас постоянно. Лампочки преобразуют электрическую энергию в световую и тепловую. Газовые плиты преобразуют химическую энергию природного газа в тепловую. Растения осуществляют одно из наиболее биологически полезных преобразований энергии на Земле: преобразование энергии солнечного света в химическую энергию, хранящуюся в органических молекулах (рис. 4.2). Некоторые примеры преобразований энергии показаны на Рисунке 4.4.
Лампочки преобразуют электрическую энергию в световую и тепловую. Газовые плиты преобразуют химическую энергию природного газа в тепловую. Растения осуществляют одно из наиболее биологически полезных преобразований энергии на Земле: преобразование энергии солнечного света в химическую энергию, хранящуюся в органических молекулах (рис. 4.2). Некоторые примеры преобразований энергии показаны на Рисунке 4.4.
Задача всех живых организмов — получить энергию из окружающей среды в формах, которые они могут передавать или преобразовывать в полезную энергию для выполнения работы.Живые клетки эволюционировали, чтобы справиться с этой задачей. Химическая энергия, хранящаяся в органических молекулах, таких как сахара и жиры, передается и преобразуется через ряд клеточных химических реакций в энергию в молекулах АТФ. Энергия в молекулах АТФ легко доступна для работы. Примеры типов работы, которую должны выполнять клетки, включают построение сложных молекул, транспортировку материалов, обеспечение движения ресничек или жгутиков и сокращение мышечных волокон для создания движения.
Основные задачи получения живой клетки, преобразование и использование энергии для работы может показаться простым.Однако второй закон термодинамики объясняет, почему эти задачи сложнее, чем кажется. Все передачи и преобразования энергии никогда не бывают полностью эффективными . При каждой передаче энергии некоторое количество энергии теряется в непригодной для использования форме. В большинстве случаев это форма тепловой энергии. Термодинамически тепловая энергия определяется как энергия, передаваемая от одной системы к другой, но не работающая. Например, когда включается электрическая лампочка, часть энергии, преобразуемой из электрической энергии в световую, теряется в виде тепловой энергии.Точно так же часть энергии теряется в виде тепловой энергии во время клеточных метаболических реакций.
Например, когда включается электрическая лампочка, часть энергии, преобразуемой из электрической энергии в световую, теряется в виде тепловой энергии.Точно так же часть энергии теряется в виде тепловой энергии во время клеточных метаболических реакций.
Важным понятием в физических системах является понятие порядка и беспорядка. Чем больше энергии теряется системой в свое окружение, тем менее упорядоченной и случайной является система. Ученые называют меру случайности или беспорядка в системе энтропией . Высокая энтропия означает высокий беспорядок и низкую энергию. Молекулы и химические реакции также имеют разную энтропию. Например, энтропия увеличивается, когда молекулы с высокой концентрацией в одном месте диффундируют и разлетаются.Второй закон термодинамики гласит, что энергия всегда будет теряться в виде тепла при передаче или преобразовании энергии.
Живые существа очень упорядочены, для поддержания низкого энтропийного состояния требуется постоянная подводимая энергия.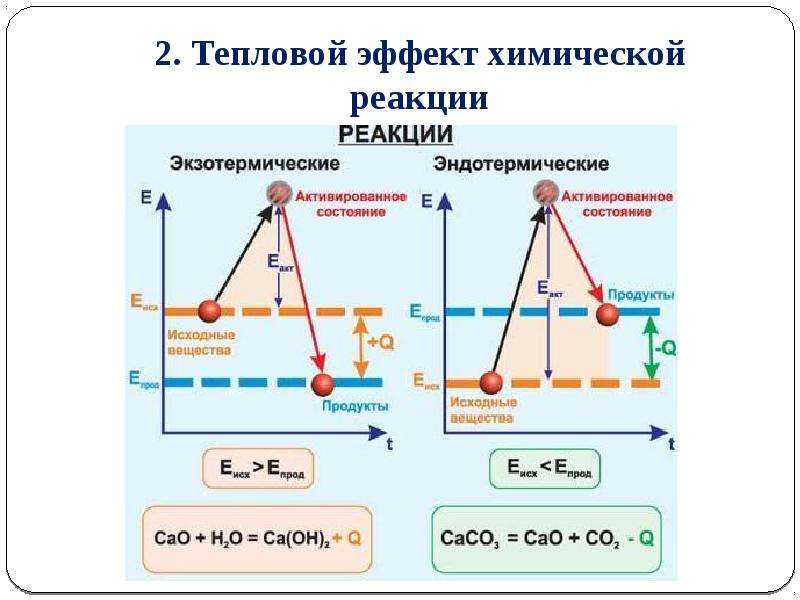
Когда объект находится в движении, с ним связана энергия. Подумайте о шаре для разрушения. Даже медленно движущийся шар-разрушитель может нанести большой урон другим объектам. Энергия, связанная с движущимися объектами, называется кинетической энергией (Рисунок 4.5). Ускоряющаяся пуля, идущий человек и быстрое движение молекул в воздухе (выделяющих тепло) — все они обладают кинетической энергией.
А что, если тот же самый неподвижный шар для разрушения поднять краном на два этажа над землей? Если подвешенный шар для разрушения неподвижен, связана ли с ним энергия? Ответ положительный. Энергия, которая требовалась для подъема разрушающего шара, не исчезла, но теперь сохраняется в разрушающем шаре в силу его положения и силы тяжести, действующей на него.Этот вид энергии называется потенциальной энергией (рис. 4.5). Если мяч упадет, потенциальная энергия будет преобразована в кинетическую энергию до тех пор, пока вся потенциальная энергия не будет исчерпана, когда мяч упадет на землю. Шары-крушители тоже качаются, как маятник; во время качания происходит постоянное изменение потенциальной энергии (самая высокая в верхней части качания) на кинетическую энергию (самая высокая в нижней части качания). Другие примеры потенциальной энергии включают энергию воды, удерживаемой за плотиной, или человека, который собирается прыгнуть с парашютом из самолета.
Шары-крушители тоже качаются, как маятник; во время качания происходит постоянное изменение потенциальной энергии (самая высокая в верхней части качания) на кинетическую энергию (самая высокая в нижней части качания). Другие примеры потенциальной энергии включают энергию воды, удерживаемой за плотиной, или человека, который собирается прыгнуть с парашютом из самолета.
Потенциальная энергия связана не только с расположением материи, но и со структурой материи. Даже пружина на земле имеет потенциальную энергию, если она сжата; то же самое делает и туго натянутая резинка. На молекулярном уровне связи, которые удерживают атомы молекул вместе, существуют в определенной структуре, обладающей потенциальной энергией.Помните, что анаболические клеточные пути требуют энергии для синтеза сложных молекул из более простых, а катаболические пути выделяют энергию, когда сложные молекулы расщепляются. Тот факт, что энергия может выделяться при разрыве определенных химических связей, означает, что эти связи обладают потенциальной энергией. Фактически, в связях всех пищевых молекул, которые мы едим, хранится потенциальная энергия, которая в конечном итоге используется для использования. Это потому, что эти связи могут высвобождать энергию при разрыве.Тип потенциальной энергии, которая существует в химических связях и высвобождается при разрыве этих связей, называется химической энергией. Химическая энергия отвечает за обеспечение живых клеток энергией из пищи. Высвобождение энергии происходит при разрыве молекулярных связей в молекулах пищи.
Тот факт, что энергия может выделяться при разрыве определенных химических связей, означает, что эти связи обладают потенциальной энергией. Фактически, в связях всех пищевых молекул, которые мы едим, хранится потенциальная энергия, которая в конечном итоге используется для использования. Это потому, что эти связи могут высвобождать энергию при разрыве.Тип потенциальной энергии, которая существует в химических связях и высвобождается при разрыве этих связей, называется химической энергией. Химическая энергия отвечает за обеспечение живых клеток энергией из пищи. Высвобождение энергии происходит при разрыве молекулярных связей в молекулах пищи.
Посмотрите видео о килокалориях.
Концепция в действии
Посетите сайт и выберите «Маятник» в меню «Работа и энергия», чтобы увидеть изменение кинетической и потенциальной энергии движущегося маятника.
После того, как мы узнали, что химические реакции высвобождают энергию при разрыве энергонакопительных связей, возникает следующий важный вопрос: как количественно и выражается энергия, связанная с этими химическими реакциями? Как можно сравнить энергию, выделяемую в результате одной реакции, с энергией другой реакции? Измерение свободной энергии используется для количественной оценки этой передачи энергии. Напомним, что согласно второму закону термодинамики, любая передача энергии связана с потерей некоторого количества энергии в непригодной для использования форме, такой как тепло.Под свободной энергией понимается энергия, связанная с химической реакцией, которая доступна после учета потерь. Другими словами, свободная энергия — это полезная энергия или энергия, доступная для выполнения работы.
Если во время химической реакции выделяется энергия, то изменение свободной энергии, обозначенное как ∆G (дельта G), будет отрицательным числом. Отрицательное изменение свободной энергии также означает, что продукты реакции имеют меньше свободной энергии, чем реагенты, потому что они выделяют некоторую свободную энергию во время реакции.Реакции, которые имеют отрицательное изменение свободной энергии и, следовательно, высвобождают свободную энергию, называются экзергоническими реакциями. Подумайте: ex эргономичный означает, что энергия ex в системе. Эти реакции также называются спонтанными реакциями, и их продукты имеют меньше накопленной энергии, чем реагенты. Необходимо провести важное различие между термином «спонтанный» и идеей немедленного протекания химической реакции. В отличие от повседневного использования этого термина, спонтанная реакция — это не реакция, которая возникает внезапно или быстро.Ржавчина железа — это пример спонтанной реакции, которая происходит медленно, мало-помалу, с течением времени.
Если химическая реакция поглощает энергию, а не высвобождает ее в остатке, то ∆G для этой реакции будет положительным значением. В этом случае у продуктов больше свободной энергии, чем у реагентов. Таким образом, продукты этих реакций можно рассматривать как молекулы, запасающие энергию. Эти химические реакции называются эндергоническими реакциями, и они являются несамопроизвольными .Эндергоническая реакция не будет происходить сама по себе без добавления свободной энергии.
Рисунок 4.6. Показаны некоторые примеры эндергонических процессов (требующих энергии) и экзэргонических процессов (тех, которые выделяют энергию). (кредит a: модификация работы Натали Мэйнор; кредит b: модификация работы Министерством сельского хозяйства США; кредит c: модификация работы Кори Занкера; кредит d: модификация работы Гарри Мальша)Посмотрите на каждый из представленных процессов и решите если он эндергонический или экзэргонический.
Есть еще одна важная концепция, которую необходимо учитывать в отношении эндергонических и экзэргонических реакций. Экзергонические реакции требуют небольшого количества энергии для начала, прежде чем они смогут приступить к своим этапам высвобождения энергии. Эти реакции имеют чистое высвобождение энергии, но все же требуют некоторого ввода энергии вначале. Это небольшое количество энергии, необходимое для протекания всех химических реакций, называется энергией активации.
Концепция в действии
Посмотрите анимацию перехода от свободной энергии к переходному состоянию реакции.
Вещество, которое способствует протеканию химической реакции, называется катализатором, а молекулы, катализирующие биохимические реакции, называются ферментами. Большинство ферментов являются белками и выполняют важную задачу , снижая энергию активации химических реакций внутри клетки. Большинство реакций, критических для живой клетки, протекают слишком медленно при нормальных температурах, чтобы быть полезными для клетки. Без ферментов для ускорения этих реакций жизнь не могла бы существовать.Ферменты делают это, связываясь с молекулами реагентов и удерживая их таким образом, чтобы облегчить процессы разрыва и образования химических связей. Важно помнить, что ферменты не изменяют, является ли реакция экзергонической (спонтанной) или эндергонической. Это потому, что они не изменяют свободную энергию реагентов или продуктов. Они только уменьшают энергию активации, необходимую для продолжения реакции (рис. 4.7). Кроме того, сам фермент не изменяется в результате реакции, которую он катализирует.После того, как одна реакция катализируется, фермент может участвовать в других реакциях.
Рис. 4.7. Ферменты снижают энергию активации реакции, но не изменяют свободную энергию реакции.Химические реагенты, с которыми связывается фермент, называются субстратами фермента. В зависимости от конкретной химической реакции может быть один или несколько субстратов. В некоторых реакциях один реагент-субстрат распадается на несколько продуктов. В других случаях два субстрата могут объединиться, чтобы создать одну большую молекулу.Два реагента также могут вступить в реакцию, и оба они будут модифицированы, но выходят из реакции в виде двух продуктов. Место внутри фермента, где связывается субстрат, называется активным сайтом фермента . Активный сайт — это место, где происходит «действие». Поскольку ферменты являются белками, в активном центре существует уникальная комбинация боковых цепей аминокислот. Каждая боковая цепь характеризуется разными свойствами. Они могут быть большими или маленькими, слабокислотными или основными, гидрофильными или гидрофобными, положительно или отрицательно заряженными или нейтральными.Уникальная комбинация боковых цепей создает очень специфическую химическую среду в активном центре. Эта специфическая среда подходит для связывания с одним конкретным химическим субстратом (или субстратами).
Активные сайты подвержены влиянию местной среды. Повышение температуры окружающей среды обычно увеличивает скорость реакции, катализируемой ферментами или иначе. Однако температуры, выходящие за пределы оптимального диапазона, снижают скорость, с которой фермент катализирует реакцию. Высокие температуры в конечном итоге вызовут денатурирование ферментов, необратимое изменение трехмерной формы и, следовательно, функции фермента.Ферменты также подходят для наилучшего функционирования в определенном диапазоне pH и концентрации соли, и, как и в случае с температурой, экстремальные значения pH и концентрации соли могут вызывать денатурирование ферментов.
На протяжении многих лет ученые полагали, что связывание фермента с субстратом происходит простым способом «замок и ключ». Эта модель утверждает, что фермент и субстрат идеально сочетаются друг с другом за один мгновенный шаг. Однако текущие исследования поддерживают модель, называемую индуцированной подгонкой (рис. 4.8). Модель индуцированной подгонки расширяет модель замка и ключа, описывая более динамическое связывание между ферментом и субстратом.Когда фермент и субстрат объединяются, их взаимодействие вызывает небольшой сдвиг в структуре фермента, который формирует идеальную структуру связывания между ферментом и субстратом.
Концепция в действии
Просмотрите анимацию индуцированной посадки.
Когда фермент связывает свой субстрат, образуется комплекс фермент-субстрат. Этот комплекс снижает энергию активации реакции и способствует ее быстрому развитию одним из множества возможных способов. На базовом уровне ферменты способствуют химическим реакциям, в которых участвует более одного субстрата, объединяя субстраты вместе в оптимальной ориентации для реакции.Другой способ, которым ферменты способствуют реакции своих субстратов, — это создание оптимальной среды в активном центре для протекания реакции. Химические свойства, проистекающие из особого расположения R-групп аминокислот в активном центре, создают идеальную среду для реакции определенных субстратов фермента.
Комплекс фермент-субстрат может также снизить энергию активации за счет нарушения структуры связи, так что ее легче разорвать. Наконец, ферменты также могут снижать энергию активации, принимая участие в самой химической реакции.В этих случаях важно помнить, что фермент всегда возвращается в исходное состояние по завершении реакции. Одним из отличительных свойств ферментов является то, что они в конечном итоге остаются неизменными в результате катализируемых ими реакций. После того, как фермент катализирует реакцию, он высвобождает свой продукт (продукты) и может катализировать новую реакцию.
Рис. 4.8. Модель индуцированной подгонки представляет собой корректировку модели «замок-и-ключ» и объясняет, как ферменты и субстраты претерпевают динамические модификации во время переходного состояния, чтобы увеличить сродство субстрата к активному сайту.Казалось бы, идеальным иметь сценарий, при котором все ферменты организма существуют в изобилии и оптимально функционируют во всех клеточных условиях, во всех клетках, во все времена. Однако различные механизмы гарантируют, что этого не произойдет. Клеточные потребности и условия постоянно меняются от клетки к клетке и со временем меняются внутри отдельных клеток. Необходимые ферменты клеток желудка отличаются от ферментов жировых клеток, клеток кожи, клеток крови и нервных клеток. Кроме того, клетка пищеварительного органа намного усерднее обрабатывает и расщепляет питательные вещества в течение времени, которое следует за едой, по сравнению со многими часами после еды.Поскольку эти клеточные потребности и условия меняются, также должны изменяться количества и функциональность различных ферментов.
Поскольку скорость биохимических реакций контролируется энергией активации, а ферменты ниже и определяют энергию активации химических реакций, относительные количества и функционирование различных ферментов в клетке в конечном итоге определяют, какие реакции будут протекать и с какой скоростью. Это определение строго контролируется в клетках. В определенных клеточных средах активность ферментов частично контролируется факторами окружающей среды, такими как pH, температура, концентрация соли и, в некоторых случаях, кофакторами или коферментами.
Ферменты также могут регулироваться способами, которые либо способствуют, либо снижают активность фермента. Есть много видов молекул, которые подавляют или стимулируют функцию ферментов, и различные механизмы, с помощью которых они это делают. В некоторых случаях ингибирования фермента молекула ингибитора достаточно похожа на субстрат, чтобы она могла связываться с активным центром и просто блокировать связывание субстрата. Когда это происходит, фермент ингибируется посредством конкурентного ингибирования , потому что молекула ингибитора конкурирует с субстратом за связывание с активным центром.
С другой стороны, при неконкурентном ингибировании молекула ингибитора связывается с ферментом в месте, отличном от активного сайта, называемом аллостерическим сайтом , но все же удается блокировать связывание субстрата с активным сайтом. Некоторые молекулы ингибитора связываются с ферментами в том месте, где их связывание вызывает конформационное изменение, которое снижает сродство фермента к его субстрату. Этот тип торможения называется аллостерическим торможением (рис. 4.9).Большинство аллостерически регулируемых ферментов состоят из более чем одного полипептида, что означает, что они имеют более одной белковой субъединицы. Когда аллостерический ингибитор связывается с областью фермента, все активные центры белковых субъединиц слегка изменяются, так что они связывают свои субстраты с меньшей эффективностью. Есть аллостерические активаторы, а также ингибиторы. Аллостерические активаторы связываются с участками фермента, удаленными от активного центра, вызывая конформационные изменения, которые увеличивают сродство активного сайта (ов) фермента к его субстрату (ам) (рис.9).
Рис. 4.9. Аллостерическое ингибирование работает, косвенно вызывая конформационные изменения активного сайта, так что субстрат больше не подходит. Напротив, при аллостерической активации молекула активатора изменяет форму активного центра, чтобы обеспечить лучшее прилегание субстрата.Через призму коренных народов
Растения не могут убежать или спрятаться от своих хищников, и они разработали множество стратегий, чтобы отпугнуть тех, кто их съел. Подумайте о шипах, раздражителях и вторичных метаболитах: это соединения, которые напрямую не помогают растениям расти, а созданы специально для защиты от хищников.Вторичные метаболиты — наиболее распространенный способ отпугивания хищников. Некоторые примеры вторичных метаболитов — атропин, никотин, ТГК и кофеин. Люди обнаружили, что эти вторичные метаболиты являются богатым источником материалов для лекарств. Подсчитано, что 90% лекарств в современной аптеке имеют свои «корни» в этих вторичных метаболитах.
Лечение травами первых людей открыло миру эти вторичные метаболиты. Например, коренные народы издавна использовали кору ивовых кустарников и ольхи для приготовления чая, тонизирующего средства или припарок, чтобы уменьшить воспаление.Вы узнаете больше о воспалительной реакции иммунной системы в главе 11.
Рис. 4.10. Кора тихоокеанской ивы содержит соединение салицин.И ива, и кора ольхи содержат соединение салицин. У большинства из нас в аптечке есть это соединение в виде салициловой кислоты или аспирина. Доказано, что аспирин уменьшает боль и воспаление, и, попав в наши клетки, салицин превращается в салициловую кислоту.
Так как это работает? Салицин или аспирин действуют как ингибитор фермента.В воспалительной реакции ключом к этому процессу являются два фермента, ЦОГ1 и ЦОГ2. Салицин или аспирин специфически модифицируют аминокислоту (серин) в активном центре этих двух родственных ферментов. Эта модификация активных центров не позволяет нормальному субстрату связываться и, таким образом, нарушается воспалительный процесс. Как вы читали в этой главе, это делает его конкурентным ингибитором ферментов.
Разработчик фармацевтических препаратов
Рис. 4.11 Задумывались ли вы, как создаются фармацевтические препараты? (кредит: Дебора Остин)Ферменты — ключевые компоненты метаболических путей.Понимание того, как работают ферменты и как их можно регулировать, — ключевые принципы, лежащие в основе разработки многих фармацевтических препаратов, представленных сегодня на рынке. Биологи, работающие в этой области, совместно с другими учеными разрабатывают лекарства (рис. 4.11).
Рассмотрим, к примеру, статины. Статины — это название одного класса лекарств, которые могут снижать уровень холестерина. Эти соединения являются ингибиторами фермента HMG-CoA редуктазы, который является ферментом, синтезирующим холестерин из липидов в организме.Ингибируя этот фермент, можно снизить уровень холестерина, синтезируемого в организме. Точно так же ацетаминофен, широко продаваемый под торговой маркой Tylenol, является ингибитором фермента циклооксигеназы. Хотя он используется для снятия температуры и воспаления (боли), его механизм действия до сих пор полностью не изучен.
Как обнаруживаются наркотики? Одна из самых больших проблем при открытии новых лекарств — это определение мишени для лекарства. Мишень лекарства — это молекула, которая буквально является мишенью лекарства.В случае статинов мишенью для лечения является HMG-CoA редуктаза. Мишени для лекарств определяются путем кропотливых лабораторных исследований. Одного определения цели недостаточно; ученым также необходимо знать, как мишень действует внутри клетки и какие реакции идут наперекосяк в случае болезни. Как только цель и путь определены, начинается фактический процесс разработки лекарств. На этом этапе химики и биологи работают вместе, чтобы разработать и синтезировать молекулы, которые могут блокировать или активировать определенную реакцию.Однако это только начало: если и когда прототип лекарственного средства успешно выполняет свою функцию, он подвергается множеству тестов, от экспериментов in vitro до клинических испытаний, прежде чем он получит одобрение Управления по контролю за продуктами и лекарствами США. магазин.
Многие ферменты не работают оптимально или даже не работают, если они не связаны с другими специфическими небелковыми вспомогательными молекулами. Они могут связываться либо временно посредством ионных или водородных связей, либо навсегда посредством более прочных ковалентных связей.Связывание с этими молекулами способствует оптимальной форме и функционированию соответствующих ферментов. Двумя примерами этих типов вспомогательных молекул являются кофакторы и коферменты. Кофакторы — это неорганические ионы, такие как ионы железа и магния. Коферменты — это органические вспомогательные молекулы, имеющие базовую атомную структуру, состоящую из углерода и водорода. Подобно ферментам, эти молекулы участвуют в реакциях без изменения самих себя и в конечном итоге перерабатываются и используются повторно. Витамины являются источником коферментов.Некоторые витамины являются предшественниками коферментов, а другие действуют непосредственно как коферменты. Витамин C является прямым коферментом множества ферментов, которые участвуют в создании важной соединительной ткани — коллагена. Следовательно, функция фермента частично регулируется обилием различных кофакторов и коферментов, которые могут поступать с пищей организма или, в некоторых случаях, вырабатываться организмом.
Рис. 4.12. Витамины являются важными коферментами или предшественниками коферментов и необходимы для правильного функционирования ферментов.Мультивитаминные капсулы обычно содержат смеси всех витаминов в разном процентном соотношении.Подавление обратной связи в метаболических путях
Молекулы могут регулировать функцию ферментов разными способами. Однако остается главный вопрос: что это за молекулы и откуда они берутся? Как вы уже знаете, некоторые из них являются кофакторами и коферментами. Какие другие молекулы в клетке обеспечивают ферментативную регуляцию, такую как аллостерическая модуляция, а также конкурентное и неконкурентное ингибирование? Возможно, наиболее подходящими источниками регуляторных молекул для ферментативного клеточного метаболизма являются продукты самих клеточных метаболических реакций.Наиболее эффективным и элегантным образом клетки эволюционировали, чтобы использовать продукты собственных реакций для подавления активности ферментов с помощью обратной связи. Подавление обратной связи предполагает использование продукта реакции для регулирования его собственного дальнейшего производства (рис. 4.12). Клетка реагирует на обилие продуктов замедлением производства во время анаболических или катаболических реакций. Такие продукты реакции могут ингибировать ферменты, которые катализируют их производство с помощью механизмов, описанных выше.
Рисунок 4.13 Метаболические пути — это серия реакций, катализируемых множеством ферментов. Ингибирование обратной связи, когда конечный продукт пути ингибирует вышестоящий процесс, является важным регуляторным механизмом в клетках.Производство как аминокислот, так и нуклеотидов контролируется посредством ингибирования с обратной связью. Кроме того, АТФ является аллостерическим регулятором некоторых ферментов, участвующих в катаболическом распаде сахара, процессе, который создает АТФ. Таким образом, когда АТФ в избытке, клетка может предотвратить производство АТФ.С другой стороны, АДФ служит положительным аллостерическим регулятором (аллостерическим активатором) для некоторых из тех же ферментов, которые ингибируются АТФ. Таким образом, когда относительные уровни АДФ высоки по сравнению с АТФ, клетка начинает производить больше АТФ за счет катаболизма сахара.
Клетки выполняют жизненные функции посредством различных химических реакций. Метаболизм клетки — это комбинация химических реакций, которые происходят в ней. Катаболические реакции расщепляют сложные химические вещества на более простые и связаны с выделением энергии.Анаболические процессы создают сложные молекулы из более простых и требуют энергии.
При изучении энергии термин «система» относится к веществу и окружающей среде, участвующим в передаче энергии. Энтропия — это мера беспорядка в системе. Физические законы, описывающие передачу энергии, являются законами термодинамики. Первый закон гласит, что общее количество энергии во Вселенной постоянно. Второй закон термодинамики гласит, что любая передача энергии включает некоторую потерю энергии в непригодной для использования форме, такой как тепловая энергия.Энергия бывает разных форм: кинетической, потенциальной и свободной. Изменение свободной энергии реакции может быть отрицательным (высвобождает энергию, экзергонический) или положительным (потребляет энергию, эндергоническим). Все реакции требуют начального ввода энергии, называемой энергией активации.
Ферменты — это химические катализаторы, которые ускоряют химические реакции за счет снижения их энергии активации. Ферменты имеют активный центр с уникальной химической средой, которая соответствует определенным химическим реагентам для этого фермента, называемым субстратами.Считается, что ферменты и субстраты связываются в соответствии с моделью индуцированной подгонки. Действие ферментов регулируется для сохранения ресурсов и оптимального реагирования на окружающую среду.
Глоссарий
энергия активации: количество начальной энергии, необходимой для протекания реакции
активный сайт: специфическая область на ферменте, где субстрат связывается
аллостерическое ингибирование: механизм ингибирования действия фермента, при котором регуляторная молекула связывается со вторым сайтом (не активным сайтом) и инициирует изменение конформации в активном сайте, предотвращая связывание с субстратом
анаболический: описывает путь, который требует ввода чистой энергии для синтеза сложных молекул из более простых
биоэнергетика: концепция потока энергии через живые системы
катаболический: описывает путь, по которому сложные молекулы расщепляются на более простые с выделением энергии в качестве дополнительного продукта реакции.
конкурентное ингибирование: общий механизм регуляции активности фермента, при котором молекула, отличная от субстрата фермента, способна связывать активный сайт и предотвращать связывание самого субстрата, тем самым подавляя общую скорость реакции фермента
endergonic: описывает химическую реакцию, которая приводит к продуктам, которые хранят больше химической потенциальной энергии, чем реагенты.
фермент: молекула, катализирующая биохимическую реакцию
exergonic: описывает химическую реакцию, которая приводит к продуктам с меньшей химической потенциальной энергией, чем реагенты, плюс высвобождение свободной энергии
ингибирование с обратной связью: механизм регулирования активности фермента, при котором продукт реакции или конечный продукт серии последовательных реакций ингибирует фермент на более ранней стадии в серии реакций
тепловая энергия: энергия, передаваемая из одной системы в другую, которая не работает
кинетическая энергия: тип энергии, связанной с движущимися объектами
метаболизм: все химические реакции, происходящие внутри клеток, включая те, которые используют энергию, и те, которые высвобождают энергию
неконкурентное ингибирование: общий механизм регуляции активности фермента, в котором регуляторная молекула связывается с сайтом, отличным от активного сайта, и предотвращает связывание активного сайта с субстратом; таким образом, молекула ингибитора не конкурирует с субстратом за активный центр; аллостерическое торможение — это форма неконкурентного торможения
потенциальная энергия: тип энергии, который относится к потенциалу совершать работу
субстрат: молекула, на которую действует фермент
термодинамика: наука о взаимосвязи тепла, энергии и работы
Центральная роль ферментов как биологических катализаторов — клетка
Фундаментальная задача белков — действовать как ферменты — катализаторы, которые увеличивают скорость практически всех химических реакций внутри клеток.Хотя РНК способны катализировать некоторые реакции, большинство биологических реакций катализируются белками. В отсутствие ферментативного катализа большинство биохимических реакций протекают настолько медленно, что они не могли бы происходить в мягких условиях температуры и давления, совместимых с жизнью. Ферменты ускоряют скорость таких реакций более чем в миллион раз, поэтому реакции, на которые в отсутствие катализа ушли бы годы, могут происходить за доли секунды, если их катализирует соответствующий фермент.Клетки содержат тысячи различных ферментов, и их активность определяет, какая из многих возможных химических реакций действительно происходит внутри клетки.
Каталитическая активность ферментов
Как и все другие катализаторы, ферменты характеризуются двумя основными свойствами. Во-первых, они увеличивают скорость химических реакций, при этом сами по себе реакция не поглощается и не изменяется навсегда. Во-вторых, они увеличивают скорость реакции без изменения химического равновесия между реагентами и продуктами.
Эти принципы ферментативного катализа проиллюстрированы в следующем примере, в котором молекула, на которую воздействует фермент (называемая субстратом [ S ]), превращается в продукт ( P ) в результате реакции. В отсутствие фермента реакция может быть записана следующим образом:
Химическое равновесие между S и P определяется законами термодинамики (как обсуждается далее в следующем разделе этой главы) и представлено соотношением скоростей прямой и обратной реакции ( S → P и P → S соответственно).В присутствии соответствующего фермента превращение S в P ускоряется, но равновесие между S и P не изменяется. Следовательно, фермент должен одинаково ускорять как прямую, так и обратную реакции. Реакция может быть записана следующим образом:
Обратите внимание, что фермент ( E ) не изменяется в результате реакции, поэтому химическое равновесие остается неизменным, определяемым исключительно термодинамическими свойствами S и P .
Влияние фермента на такую реакцию лучше всего иллюстрируется изменениями энергии, которые должны произойти во время превращения S в P (). Равновесие реакции определяется конечными энергетическими состояниями S и P , на которые не влияет ферментативный катализ. Однако для того, чтобы реакция продолжилась, подложку необходимо сначала преобразовать в состояние с более высокой энергией, называемое переходным состоянием . Энергия, необходимая для достижения переходного состояния (энергия активации), представляет собой барьер для развития реакции, ограничивая скорость реакции.Ферменты (и другие катализаторы) действуют за счет снижения энергии активации, тем самым увеличивая скорость реакции. Повышенная скорость одинакова как в прямом, так и в обратном направлениях, поскольку оба должны проходить через одно и то же переходное состояние.
Рисунок 2.22
Энергетические диаграммы для катализированных и некаталитических реакций. Проиллюстрированная реакция представляет собой простое преобразование субстрата S в продукт P. Поскольку конечное энергетическое состояние P ниже, чем у S , реакция протекает слева направо.Для (подробнее …)
Каталитическая активность ферментов включает связывание их субстратов с образованием комплекса фермент-субстрат ( ES ). Субстрат связывается с определенной областью фермента, называемой активным центром. Связавшись с активным центром, субстрат превращается в продукт реакции, который затем высвобождается из фермента. Таким образом, реакция, катализируемая ферментами, может быть записана следующим образом:
Обратите внимание, что E остается неизменным с обеих сторон уравнения, поэтому равновесие не нарушается.Однако фермент обеспечивает поверхность, на которой реакции, превращающие S в P , могут протекать более легко. Это результат взаимодействий между ферментом и субстратом, которые снижают энергию активации и способствуют образованию переходного состояния.
Механизмы ферментативного катализа
Связывание субстрата с активным центром фермента является очень специфическим взаимодействием. Активные сайты — это щели или бороздки на поверхности фермента, обычно состоящие из аминокислот из разных частей полипептидной цепи, которые собраны вместе в третичной структуре свернутого белка.Субстраты изначально связываются с активным центром за счет нековалентных взаимодействий, включая водородные связи, ионные связи и гидрофобные взаимодействия. Как только субстрат связывается с активным центром фермента, несколько механизмов могут ускорить его превращение в продукт реакции.
Хотя простой пример, обсужденный в предыдущем разделе, включает только одну молекулу субстрата, большинство биохимических реакций включают взаимодействия между двумя или более различными субстратами. Например, образование пептидной связи включает соединение двух аминокислот.Для таких реакций связывание двух или более субстратов с активным центром в правильном положении и ориентации ускоряет реакцию (). Фермент обеспечивает матрицу, на которой реагенты собираются вместе и должным образом ориентируются, чтобы способствовать образованию переходного состояния, в котором они взаимодействуют.
Рисунок 2.23
Ферментативный катализ реакции между двумя субстратами. Фермент обеспечивает матрицу, на которой два субстрата сводятся вместе в правильном положении и ориентации для взаимодействия друг с другом.
Ферменты ускоряют реакции, также изменяя конформацию своих субстратов, чтобы приблизиться к конформации переходного состояния. Простейшей моделью взаимодействия фермент-субстрат является модель lock-and-key , в которой субстрат точно входит в активный центр (). Однако во многих случаях конфигурации как фермента, так и субстрата модифицируются связыванием субстрата — процесс, называемый индуцированной подгонкой . В таких случаях конформация субстрата изменяется так, что она больше напоминает конформацию переходного состояния.Напряжение, вызванное таким искажением подложки, может дополнительно облегчить ее переход в переходное состояние за счет ослабления критических связей. Более того, переходное состояние стабилизируется за счет его прочного связывания с ферментом, тем самым снижая требуемую энергию активации.
Рисунок 2.24
Модели взаимодействия фермент-субстрат. (A) В модели с замком и ключом субстрат точно входит в активный центр фермента. (B) В модели индуцированной подгонки связывание субстрата искажает конформации как субстрата, так и фермента.Это искажение (подробнее …)
Помимо объединения нескольких субстратов и искажения конформации субстратов для достижения переходного состояния, многие ферменты непосредственно участвуют в каталитическом процессе. В таких случаях боковые цепи конкретных аминокислот в активном центре могут реагировать с субстратом и образовывать связи с промежуточными продуктами реакции. Кислые и основные аминокислоты часто участвуют в этих каталитических механизмах, как показано в следующем обсуждении химотрипсина как примера ферментативного катализа.
Химотрипсин является членом семейства ферментов (сериновых протеаз), которые переваривают белки, катализируя гидролиз пептидных связей. Реакцию можно записать следующим образом:
Различные члены семейства сериновых протеаз (включая химотрипсин, трипсин, эластазу и тромбин) имеют различные субстратные специфичности; они предпочтительно расщепляют пептидные связи, прилегающие к различным аминокислотам. Например, в то время как химотрипсин расщепляет связи, соседние с гидрофобными аминокислотами, такими как триптофан и фенилаланин, трипсин расщепляет связи рядом с основными аминокислотами, такими как лизин и аргинин.Однако все сериновые протеазы похожи по структуре и используют один и тот же механизм катализа. Активные центры этих ферментов содержат три важные аминокислоты — серин, гистидин и аспартат, которые управляют гидролизом пептидной связи. Действительно, эти ферменты называются сериновыми протеазами из-за центральной роли серинового остатка.
Субстраты связываются с сериновыми протеазами путем встраивания аминокислоты, прилегающей к сайту расщепления, в карман на активном сайте фермента ().Природа этого кармана определяет субстратную специфичность различных членов семейства сериновых протеаз. Например, связывающий карман химотрипсина содержит гидрофобные аминокислоты, которые взаимодействуют с гидрофобными боковыми цепями его предпочтительных субстратов. Напротив, связывающий карман трипсина содержит отрицательно заряженную кислотную аминокислоту (аспартат), которая способна образовывать ионную связь с остатками лизина или аргинина своих субстратов.
Рисунок 2.25
Связывание субстрата сериновыми протеазами.Аминокислота, примыкающая к расщепляемой пептидной связи, вставляется в карман в активном центре фермента. В химотрипсине карман связывает гидрофобные аминокислоты; связывающий карман трипсина содержит (подробнее …)
Субстрат связывается с расщепляемой пептидной связью рядом с серином активного сайта (). Затем протон этого серина переносится на гистидин в активном центре. Конформация активного центра способствует переносу протона, поскольку гистидин взаимодействует с отрицательно заряженным остатком аспартата.Серин реагирует с субстратом, образуя тетраэдрическое переходное состояние. Затем пептидная связь расщепляется, и фермент высвобождает С-концевую часть субстрата. Однако N-концевой пептид остается связанным с серином. Эта ситуация разрешается, когда молекула воды (второй субстрат) входит в активный центр и меняет предыдущие реакции. Протон молекулы воды переносится на гистидин, а его гидроксильная группа переносится на пептид, образуя второе тетраэдрическое переходное состояние.Затем протон переносится от гистидина обратно к серину, и пептид высвобождается из фермента, завершая реакцию.
Рисунок 2.26
Каталитический механизм химотрипсина. Три аминокислоты в активном центре (Ser-195, His-57 и Asp-102) играют решающую роль в катализе.
Этот пример иллюстрирует несколько особенностей ферментативного катализа; специфичность взаимодействий фермент-субстрат, расположение различных молекул субстрата в активном центре и участие остатков активного сайта в формировании и стабилизации переходного состояния.Хотя тысячи ферментов в клетках катализируют множество различных типов химических реакций, к их работе применимы одни и те же основные принципы.
Коферменты
Помимо связывания своих субстратов, активные центры многих ферментов связывают другие небольшие молекулы, которые участвуют в катализе. Протезные группы — это небольшие молекулы, связанные с белками, в которых они играют важнейшие функциональные роли. Например, кислород, переносимый миоглобином и гемоглобином, связан с гемом, простетической группой этих белков.Во многих случаях ионы металлов (например, цинка или железа) связаны с ферментами и играют центральную роль в каталитическом процессе. Кроме того, различные низкомолекулярные органические молекулы участвуют в определенных типах ферментативных реакций. Эти молекулы называются коферментами, потому что они работают вместе с ферментами, увеличивая скорость реакции. В отличие от субстратов, коферменты не изменяются необратимо в результате реакций, в которых они участвуют. Скорее они перерабатываются и могут участвовать во множестве ферментативных реакций.
Коферменты служат переносчиками нескольких типов химических групп. Ярким примером кофермента является никотинамидадениндинуклеотид ( NAD + ), который действует как переносчик электронов в реакциях окисления-восстановления (). NAD + может принимать ион водорода (H + ) и два электрона (e — ) от одной подложки, образуя NADH. Затем НАДН может отдавать эти электроны второй подложке, повторно образуя НАД + .Таким образом, NAD + переносит электроны от первой подложки (которая окисляется) ко второй (которая восстанавливается).
Рисунок 2.27
Роль НАД + в окислительно-восстановительных реакциях. (A) Никотинамидадениндинуклеотид (NAD + ) действует как переносчик электронов в окислительно-восстановительных реакциях, принимая электроны (e — ) с образованием NADH. (B) Например, NAD + может принимать электроны от одного субстрата (подробнее …)
Несколько других коферментов также действуют как переносчики электронов, а третьи участвуют в переносе множества дополнительных химических групп (e .g. карбоксильные группы и ацильные группы; ). Одни и те же коферменты действуют вместе с множеством различных ферментов, катализируя перенос определенных химических групп между широким спектром субстратов. Многие коферменты тесно связаны с витаминами, которые вносят часть или всю структуру кофермента. Витамины не требуются бактериям, таким как E. coli , но они являются необходимыми компонентами рациона человека и других высших животных, которые утратили способность синтезировать эти соединения.
Регуляция активности ферментов
Важной особенностью большинства ферментов является то, что их активность непостоянна, а вместо этого может модулироваться. То есть активность ферментов можно регулировать, чтобы они функционировали надлежащим образом для удовлетворения разнообразных физиологических потребностей, которые могут возникнуть в течение жизни клетки.
Одним из распространенных типов регуляции ферментов является ингибирование с обратной связью, при котором продукт метаболического пути подавляет активность фермента, участвующего в его синтезе.Например, аминокислота изолейцин синтезируется серией реакций, начиная с аминокислоты треонина (). Первый этап этого пути катализируется ферментом треониндезаминазой, который ингибируется изолейцином, конечным продуктом этого пути. Таким образом, достаточное количество изолейцина в клетке ингибирует треониндезаминазу, блокируя дальнейший синтез изолейцина. Если концентрация изолейцина снижается, подавление обратной связи снимается, треониндезаминаза больше не ингибируется и синтезируется дополнительный изолейцин.Регулируя таким образом активность треониндезаминазы, клетка синтезирует необходимое количество изолейцина, но не тратит энергию на синтез большего количества изолейцина, чем необходимо.
Рисунок 2.28
Запрет обратной связи. Первый этап превращения треонина в изолейцин катализируется ферментом треониндезаминазой. Активность этого фермента подавляется изолейцином, конечным продуктом метаболизма.
Ингибирование по обратной связи является одним из примеров аллостерической регуляции, при которой активность фермента контролируется связыванием малых молекул с регуляторными участками фермента ().Термин «аллостерическая регуляция» происходит от того факта, что регуляторные молекулы связываются не с каталитическим сайтом, а с отдельным сайтом на белке ( алло = «другой» и стерический = «сайт»). Связывание регуляторной молекулы изменяет конформацию белка, что, в свою очередь, изменяет форму активного центра и каталитическую активность фермента. В случае треониндезаминазы связывание регуляторной молекулы (изолейцина) подавляет ферментативную активность. В других случаях регуляторные молекулы служат активаторами, стимулируя, а не ингибируя их целевые ферменты.
Рисунок 2.29
Аллостерическая регуляция. В этом примере активность фермента ингибируется связыванием регуляторной молекулы с аллостерическим сайтом. В отсутствие ингибитора субстрат связывается с активным центром фермента, и реакция продолжается. Связывание (подробнее …)
Активность ферментов также может регулироваться их взаимодействием с другими белками и ковалентными модификациями, такими как добавление фосфатных групп к остаткам серина, треонина или тирозина.Фосфорилирование — особенно распространенный механизм регулирования активности ферментов; добавление фосфатных групп либо стимулирует, либо подавляет активность многих различных ферментов (). Например, мышечные клетки реагируют на адреналин (адреналин), расщепляя гликоген на глюкозу, тем самым обеспечивая источник энергии для повышенной мышечной активности. Распад гликогена катализируется ферментом гликогенфосфорилазой, который активируется фосфорилированием в ответ на связывание адреналина с рецептором на поверхности мышечной клетки.Фосфорилирование белков играет центральную роль в контроле не только метаболических реакций, но и многих других клеточных функций, включая рост и дифференцировку клеток.
Рисунок 2.30
Фосфорилирование белков. Некоторые ферменты регулируются добавлением фосфатных групп к ОН-группам боковой цепи серина (как показано здесь), треонина или остатков тирозина. Например, фермент гликогенфосфорилаза, катализирующий превращение (подробнее …)
.



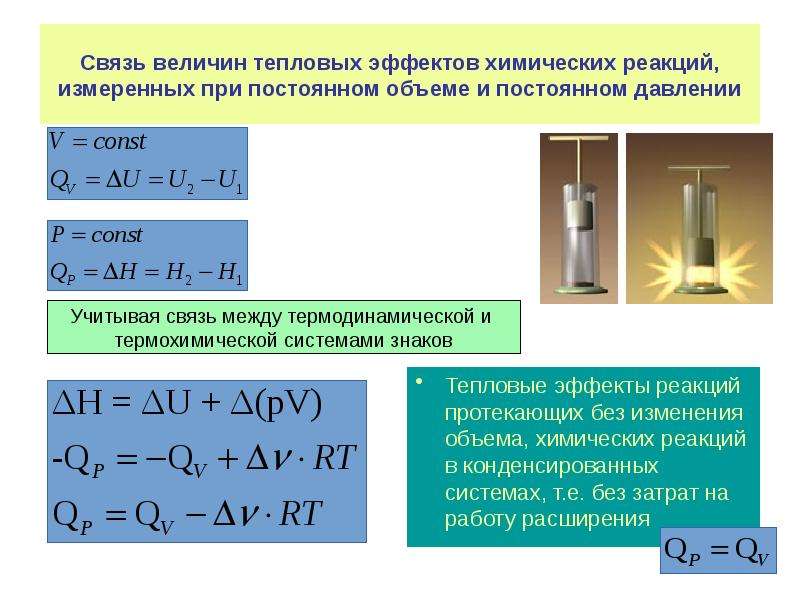
 Холодная светящаяся палочка не такая яркая, поэтому химическая реакция может протекать медленнее.
Холодная светящаяся палочка не такая яркая, поэтому химическая реакция может протекать медленнее. Скажите учащимся, что они согреют и охладят раствор хлорида кальция и раствор пищевой соды, чтобы выяснить, влияет ли температура на скорость химической реакции.
Скажите учащимся, что они согреют и охладят раствор хлорида кальция и раствор пищевой соды, чтобы выяснить, влияет ли температура на скорость химической реакции. Мы должны искать больше пузырьков (двуокиси углерода) и большего количества белого осадка (карбонат кальция).
Мы должны искать больше пузырьков (двуокиси углерода) и большего количества белого осадка (карбонат кальция).
 Вода не должна быть очень глубокой. Это ваши ванны с горячей и холодной водой.
Вода не должна быть очень глубокой. Это ваши ванны с горячей и холодной водой.
 Если большее количество молекул ударяется друг о друга с достаточной энергией для реакции, скорость реакции увеличивается.
Если большее количество молекул ударяется друг о друга с достаточной энергией для реакции, скорость реакции увеличивается. Часто, как только реакция началась, энергии, произведенной самой реакцией, достаточно, чтобы она продолжалась.
Часто, как только реакция началась, энергии, произведенной самой реакцией, достаточно, чтобы она продолжалась.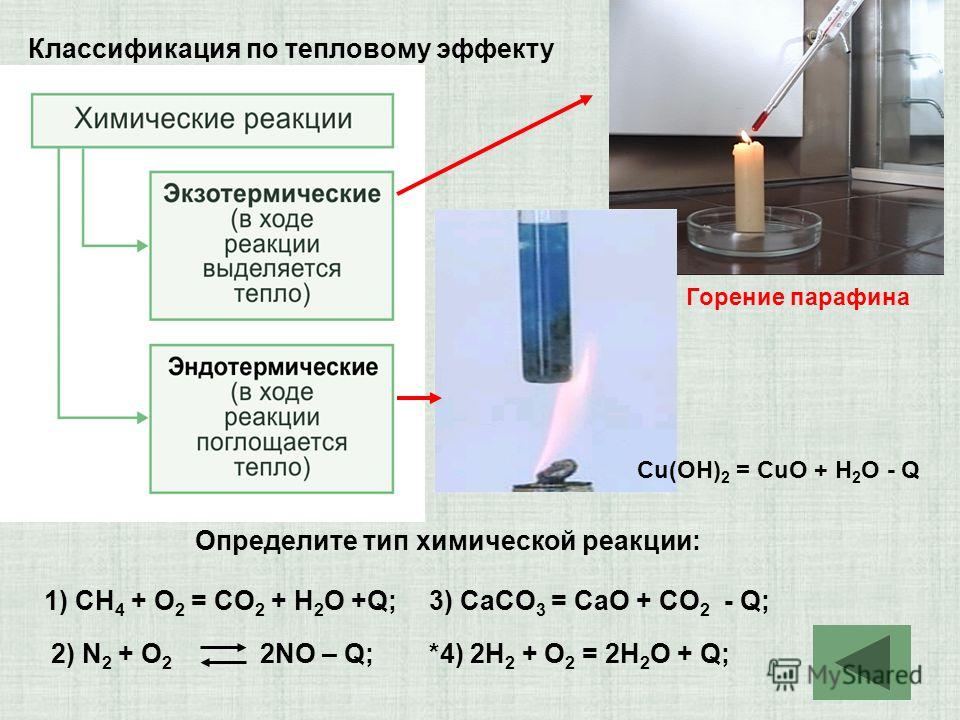 (Также доступна версия Activity.)
(Также доступна версия Activity.)
 Как температура влияет на скорость реакции?
Как температура влияет на скорость реакции? Лавовая лампа химической реакции
Лавовая лампа химической реакции (Совет! Узнайте из первых уст, как все было, когда эта семья занималась домашними делами.)
(Совет! Узнайте из первых уст, как все было, когда эта семья занималась домашними делами.) Огненная змея
Огненная змея
 9)
9)