Периодический закон — Википедия
 Памятник на территории Словацкого технологического университета (Братислава), посвященный Д. И. Менделееву
Памятник на территории Словацкого технологического университета (Братислава), посвященный Д. И. МенделеевуПериодический закон — фундаментальный закон природы, открытый Д. И. Менделеевым в 1869 году при сопоставлении свойств известных в то время химических элементов и их величин атомных масс.
Определения
Периодический закон был сформулирован Д. И. Менделеевым в следующем виде (1869):
 | Свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса[1]. |  |
С развитием атомной физики и квантовой химии Периодический закон получил строгое теоретическое обоснование. Благодаря классическим работам Й. Ридберга (1897), А. Ван-ден-Брука (1913), Г. Мозли (1913) был раскрыт физический смысл порядкового (атомного) номера элемента. Позднее была создана квантово-механическая модель периодического изменения электронного строения атомов химических элементов по мере возрастания зарядов их ядер (Н. Бор, В. Паули, Э. Шрёдингер, В. Гейзенберг и др.). В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку:
Особенность Периодического закона среди других фундаментальных законов заключается в том, что он не имеет выражения в виде математического уравнения. Периодический закон универсален для Вселенной: как образно заметил известный русский химик Н. Д. Зелинский, Периодический закон явился «открытием взаимной связи всех атомов в мироздании». Графическим (табличным) выражением закона является разработанная Менделеевым периодическая система химических элементов. Всего предложено несколько сотен [2] вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.).
Видео по теме
История
Поиски основы естественной классификации и систематизации химических элементов начались задолго до открытия Периодического закона. Трудности, с которыми сталкивались естествоиспытатели, которые первыми работали в этой области, были вызваны недостаточностью экспериментальных данных: в начале XIX века число известных химических элементов было мало, а принятые значения атомных масс многих элементов неверны.
Триады Дёберейнера и первые системы элементов
В 1829 году немецкий химик Иоганн Вольфганг Дёберейнер предпринял первую значимую попытку систематизации элементов[3]. Он заметил, что некоторые сходные по своим свойствам элементы можно объединить по три в группы, которые он назвал триадами:
Сущность предложенного
Хотя разбить все известные элементы на триады Дёберейнеру, естественно, не удалось, закон триад явно указывал на наличие взаимосвязи между атомной массой и свойствами элементов и их соединений. Все дальнейшие попытки систематизации основывались на размещении элементов в соответствии с их атомными массами.
Идеи Дёберейнера были развиты другим немецким химиком Леопольдом Гмелином, который показал, что взаимосвязь между свойствами элементов и их атомными массами значительно сложнее, нежели триады. В 1843 году Гмелин опубликовал таблицу, в которой химически сходные элементы были расставлены по группам в порядке возрастания соединительных (эквивалентных) весов. Элементы составляли триады, а также тетрады и пентады (группы из четырёх и пяти элементов), причём электроотрицательность элементов в таблице плавно изменялась сверху вниз.
В 1850-х годах Макс фон Петтенкофер и Жан Дюма предложили «дифференциальные системы», направленные на выявление общих закономерностей в изменении атомного веса элементов, которые детально разработали немецкие химики Адольф Штреккер и Густав Чермак.
В начале 60-х годов XIX века появилось сразу несколько работ, которые непосредственно предшествовали Периодическому закону.
«Земная спираль» де Шанкуртуа
Александр де Шанкуртуа располагал все известные в то время химические элементы в единой последовательности возрастания их атомных масс и полученный ряд наносил на поверхность цилиндра по линии, исходящей из его основания под углом 45° к плоскости основания (лат. vis tellurique «земная спираль»)[4]. При развертывании поверхности цилиндра оказывалось, что на вертикальных линиях, параллельных оси цилиндра, находились химические элементы со сходными свойствами. Так, на одну вертикаль попадали литий, натрий, калий; бериллий, магний, кальций; кислород, сера, селен, теллур и т. д. Недостатком спирали де Шанкуртуа было то обстоятельство, что на одной линии с близкими по своей химической природе элементами оказывались при этом и элементы совсем иного химического поведения. В группу щелочных металлов попадал марганец, в группу кислорода и серы — ничего общего с ними не имеющий титан.
Октавы Ньюлендса
 Таблица Ньюлендса (1866)
Таблица Ньюлендса (1866)Вскоре после спирали де Шанкуртуа английский учёный Джон Ньюлендс сделал попытку сопоставить химические свойства элементов с их атомными массами[5]. Расположив элементы в порядке возрастания их атомных масс, Ньюлендс заметил, что сходство в свойствах проявляется между каждым восьмым элементом. Найденную закономерность Ньюлендс назвал законом октав по аналогии с семью интервалами музыкальной гаммы. В своей таблице он располагал химические элементы в вертикальные группы по семь элементов в каждой и при этом обнаружил, что (при небольшом изменении порядка некоторых элементов) сходные по химическим свойствам элементы оказываются на одной горизонтальной линии.
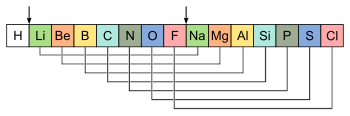 Закон октав Ньюлендса
Закон октав НьюлендсаДжон Ньюлендс, безусловно, первым дал ряд элементов, расположенных в порядке возрастания атомных масс, присвоил химическим элементам соответствующий порядковый номер и заметил систематическое соотношение между этим порядком и физико-химическими свойствами элементов. Он писал, что в такой последовательности повторяются свойства элементов, эквивалентные веса (массы) которых отличаются на 7 единиц, или на значение, кратное 7, то есть как будто бы восьмой по порядку элемент повторяет свойства первого, как в музыке восьмая нота повторяет первую. Ньюлендс пытался придать этой зависимости, действительно имеющей место для лёгких элементов, всеобщий характер. В его таблице в горизонтальных рядах располагались сходные элементы, однако в том же ряду часто оказывались и элементы совершенно отличные по свойствам. Кроме того, в некоторых ячейках Ньюлендс вынужден был разместить по два элемента; наконец, таблица не содержала свободных мест; в итоге закон октав был принят чрезвычайно скептически.
Таблицы Одлинга и Мейера
В 1864 году Уильям Одлинг опубликовал таблицу, в которой элементы были размещены согласно их атомным весам и сходству химических свойств, не сопроводив её, однако, какими-либо комментариями.
В том же 1864 году появилась первая таблица немецкого химика Лотара Мейера; в неё были включены 28 элементов, размещённые в шесть столбцов согласно их валентностям[6]. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерное (аналогичное триадам Дёберейнера) изменение атомной массы в рядах сходных элементов.
| Валентность IV | Валентность III | Валентность II | Валентность I | Валентность I | Валентность II | Разность масс | |
| I ряд | Li | Be | ~16 | ||||
| II ряд | C | N | O | F | Na | Mg | ~16 |
| III ряд | Si | P | S | Cl | K | Ca | ~45 |
| IV ряд | As | Se | Br | Rb | Sr | ~45 | |
| V ряд | Sn | Sb | Te | I | Cs | Ba | ~90 |
| VI ряд | Pb | Bi | Tl | ~90 |
В 1870 году вышла работа Мейера, содержащая новую таблицу под названием «Природа элементов как функция их атомного веса», состоявшая из девяти вертикальных столбцов. Сходные элементы располагались в горизонтальных рядах таблицы; некоторые ячейки Мейер оставил незаполненными. Таблица сопровождалась графиком зависимости атомного объёма элемента от атомного веса, имеющий характерный пилообразный вид, прекрасно иллюстрирующий термин «периодичность», уже предложенный к тому времени Менделеевым.
Открытие Периодического закона
Портрет Д. И. Менделеева (1861)

6 марта 1869 года (18 марта 1869 года) на заседании Русского химического общества было зачитано сообщение русского ученого Дмитрия Ивановича Менделеева об открытии им Периодического закона химических элементов[7], вскоре соответствующая статья опубликована в «Журнале Русского физико-химического общества»
В августе 1871 года Менделеев написал итоговую статью «Периодическая законность химических элементов» (нем. Die periodische Gesetzmässigkeit der Elemente) и в 1872 году опубликовал её на немецком языке в журнале Annalen der Chemie und Pharmacie. В этой работе Менделеев дал формулировку периодического закона, остававшуюся в силе на протяжении более сорока лет[10]:
Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса[11].
Оригинальный текст (нем.)
Die Eigenschaften der Elemente (folglich auch der aus ihnen gebildeten einfachen und zusammengesetzten Körper) befinden sich in periodischer Abhängigkeit von deren Atomgewichten[12].
Тогда же Менделеев придал своей периодической таблице вид, ставший классическим (т. н. короткопериодный вариант).
В отличие от своих предшественников, Менделеев не только составил таблицу и указал на наличие несомненных закономерностей в численных величинах атомных масс, но и решился назвать эти закономерности общим законом природы. На основании предположения, что атомная масса предопределяет свойства элемента, он взял на себя смелость изменить принятые атомные веса некоторых элементов и подробно описать свойства не открытых ещё элементов. Для предсказания свойств простых веществ и соединений Менделеев исходил из того, что свойства каждого элемента являются промежуточными между соответствующими свойствами двух соседних элементов в группе периодической таблицы (то есть сверху и снизу) и одновременно двух соседних элементов в периоде (слева и справа) (т. н. «правило звезды»).
Д. И. Менделеев на протяжении многих лет боролся за признание Периодического закона; его идеи получили признание только после того, как были открыты предсказанные Менделеевым элементы: экаалюминий, экабор и экасилиций, соответственно галлий (Поль Лекок де Буабодран, 1875), скандий (Ларс Нильсон, 1879) и германий (Клеменс Винклер, 1886). С середины 1880-х годов Периодический закон был окончательно признан в качестве одной из теоретических основ химии.
Развитие Периодического закона в XX веке
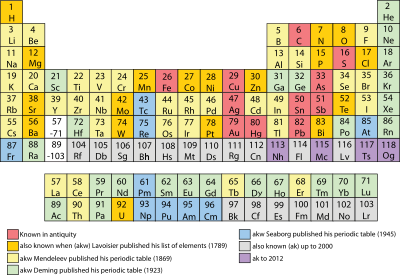 Порядок открытия химических элементов. Красные — известны с древности, оранжевые — известны во времена Лавуазье (1789), жёлтый — во времена Менделеева (1869), зелёный — к публикации Деминга (1923), синий — к таблице Сиборга (1945), серый — к 2000 году, фиолетовый — к 2012 году
Порядок открытия химических элементов. Красные — известны с древности, оранжевые — известны во времена Лавуазье (1789), жёлтый — во времена Менделеева (1869), зелёный — к публикации Деминга (1923), синий — к таблице Сиборга (1945), серый — к 2000 году, фиолетовый — к 2012 годуВ начале XX века Периодическая система элементов неоднократно видоизменялась для приведения в соответствие с новейшими научными данными. Д. И. Менделеев и У. Рамзай пришли к выводу о необходимости образования в таблице нулевой группы элементов, в которую вошли инертные газы[13]. Инертные газы явились, таким образом, элементами, переходными между галогенами и щелочными металлами. Б. Браунер нашёл решение проблемы размещения в таблице всех редкоземельных элементов, предложив в 1902 году помещать их в одну ячейку; в предложенном им варианте таблицы шестой период таблицы был длиннее, чем четвёртый и пятый, которые, в свою очередь, длиннее, чем второй и третий периоды.
Дальнейшее развитие Периодического закона было связано с успехами физики: установление делимости атома на основании открытия электрона и радиоактивности в конце концов позволило понять причины периодичности свойств химических элементов и создать теорию Периодической системы.
Для химии серьёзную проблему составляла необходимость размещения в Периодической таблице многочисленных продуктов радиоактивного распада, имеющих близкие атомные массы, но значительно отличающихся периодами полураспада. Т. Сведберг в 1909 году доказал, что свинец и неон, полученные в результате радиоактивного распада и отличающиеся по величине атомных масс от «обычных» элементов, химически им полностью тождественны. В 1911 году Ф. Содди предложил размещать химически неразличимые элементы, имеющие различные атомные массы (изотопы) в одной ячейке таблицы.
В 1913 году английский физик Г. Мозли установил, что корень из характеристической частоты рентгеновского излучения элемента (ν) линейно зависит от целочисленной величины — атомного номера (Z), который совпадает с номером элемента в Периодической таблице:
- ν=R(Z−σ)2(1m2−1n2){\displaystyle \nu =R(Z-\sigma )^{2}\left({\frac {1}{m^{2}}}-{\frac {1}{n^{2}}}\right)} , где R — постоянная Ридберга, σ — постоянная экранирования.
Закон Мозли дал возможность экспериментально определить положение элементов в Периодической таблице.
Атомный номер, совпадающий, как предположил в 1911 году голландский физик А. Ван ден Брук, с величиной положительного заряда ядра атома, стал основой классификации химических элементов. В 1920 году английский физик Дж. Чедвик экспериментально подтвердил гипотезу Ван ден Брука; тем самым был раскрыт физический смысл порядкового номера элемента в Периодической системе. Периодический закон получил современную формулировку: «Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядер атомов элементов».
В 1921—1923 годах, основываясь на модели атома Бора-Зоммерфельда, представляющей собой компромисс между классическими и квантовыми представлениями, Н. Бор заложил основы формальной теории Периодической системы. Причина периодичности свойств элементов, как показал Бор, заключалась в периодическом повторении строения внешнего электронного уровня атома.
Были разработаны полудлинный (см. выше) и длинный варианты Периодической Таблицы, состоящие из блоков (семейств), в которых внешние электронные орбитали атомов одинаковы по орбитальному квантовому числу (s, p, d и f). В s-блок входят щелочные и щёлочноземельные металлы, в d — переходные металлы, в f — лантаноиды и актиноиды, в p — остальные элементы.
В середине XX века В. М. Клечковский эмпирически установил и теоретически обосновал правило, описывающее последовательность заполнения электронных орбиталей атомов по мере роста заряда ядра. В отличие от предыдущих подходов, это правило учитывает взаимодействие между электронами в атоме.
Периодические свойства химических элементов
В принципе, свойства химического элемента объединяют все без исключения его характеристики в состоянии свободных атомов или ионов, гидратированных или сольватированных, в состоянии простого вещества, а также формы и свойства образуемых им многочисленных соединений. Но обычно под свойствами химического элемента подразумевают, во-первых, свойства его свободных атомов и, во-вторых, свойства простого вещества. Большинство этих свойств проявляет явную периодическую зависимость от атомных номеров химических элементов[14]. Среди этих свойств наиболее важными, имеющими особое значение при объяснении или предсказании химического поведения элементов и образуемых ими соединений являются:
Проявления периодического закона в отношении энергии ионизации
Зависимость энергии ионизации атома от порядкового номера элемента (рис. 1) носит отчетливо периодический характер. Легче всего удалить электрон из атомов щелочных металлов, включающих по одному валентному электрону, труднее всего — из атомов благородных газов, обладающих замкнутой электронной оболочкой. Поэтому периодичность изменения энергии ионизации атомов характеризуется минимумами, отвечающими щелочным металлам, и максимумами, приходящимися на благородные газы. Наряду с этими резко выраженными минимумами и максимумами на кривой энергии ионизации атомов наблюдаются слабо выраженные минимумы и максимумы, которые по-прежнему нетрудно объяснить с учётом упомянутых эффектов экранирования и проникновения, эффектов межэлектронных взаимодействий и т. д[15].
Проявления периодического закона в отношении энергии сродства к электрону
Рис. 2. Зависимость сродства к электрону атома от атомного номера элемента (экзоэффект указан со знаком минус, эндоэффект со знаком плюс)Периодичность значений энергий сродства атомов к электрону объясняется, естественно, теми же самыми факторами, которые уже были отмечены при обсуждении ионизационных потенциалов (см. определение энергии сродства к электрону).
Наибольшим сродством к электрону обладают p-элементы VII группы. Наименьшее сродство к электрону у атомов с конфигурацией s2 (Be, Mg, Zn) и s2p6 (Ne, Ar) или с наполовину заполненными p-орбиталями (N, P, As)[16]:
| Li | Be | B | C | N | O | F | Ne | |
|---|---|---|---|---|---|---|---|---|
| Электронная конфигурация | s1 | s2 | s2p1 | s2p2 | s2p3 | s2p4 | s2p5 | s2p6 |
| ε, эВ | -0,59 | 0,19 | -0,30 | -1,27 | 0,21 | -1,47 | -3,45 | 0,22 |
Проявления периодического закона в отношении электроотрицательности
Рис. 3. Шкала электроотрицательности по ПолингуСтрого говоря, элементу нельзя приписать постоянную электроотрицательность. Электроотрицательность атома зависит от многих факторов, в частности от валентного состояния атома, формальной степени окисления, координационного числа, природы лигандов, составляющих окружение атома в молекулярной системе, и от некоторых других. В последнее время все чаще для характеристики электроотрицательности используют так называемую орбитальную электроотрицательность, зависящую от типа атомной орбитали, участвующей в образовании связи, и от её электронной заселенности, то есть от того, занята атомная орбиталь неподелённой электронной парой, однократно заселена неспаренным электроном или является вакантной. Но, несмотря на известные трудности в интерпретации и определении электроотрицательности, она всегда остается необходимой для качественного описания и предсказания природы связей в молекулярной системе, включая энергию связи, распределение электронного заряда и степень ионности, силовую постоянную и т. д.
Периодичность атомной электроотрицательности является важной составной частью периодического закона и легко может быть объяснена, исходя из непреложной, хотя и не совсем однозначной, зависимости значений электроотрицательности от соответствующих значений энергий ионизации и сродства к электрону[17].
В периодах наблюдается общая тенденция роста электроотрицательности, а в подгруппах — её падение. Наименьшая электроотрицательность у s-элементов I группы, наибольшая — у p-элементов VII группы.
Проявления периодического закона в отношении атомных и ионных радиусов
Рис. 4. Зависимость орбитальных радиусов атомов от порядкового номера элементаПериодический характер изменения размеров атомов и ионов известен давно. Сложность здесь состоит в том, что из-за волновой природы электронного движения атомы не имеют строго определенных размеров. Так как непосредственное определение абсолютных размеров (радиусов) изолированных атомов невозможно, в данном случае часто используют их эмпирические значения. Их получают из измеренных межъядерных расстояний в кристаллах и свободных молекулах, разбивая каждое межъядерное расстояние на две части и приравнивая одну из них к радиусу первого (из двух связанных соответствующей химической связью) атома, а другую — к радиусу второго атома. При таком разделении учитывают различные факторы, включая природу химической связи, степени окисления двух связанных атомов, характер координации каждого из них и т. д[18]. Таким способом получают так называемые металлические, ковалентные, ионные и ван-дер-ваальсовы радиусы. Ван-дер-ваальсовы радиусы следует рассматривать как радиусы несвязанных атомов; их находят по межъядерным расстояниям в твердых или жидких веществах, где атомы находятся в непосредственной близости друг от друга (например, атомы Ar в твердом аргоне или атомы N из двух соседних молекул N2 в твердом азоте), но не связаны между собой какой-либо химической связью.
Но, очевидно, лучшим описанием эффективных размеров изолированного атома является теоретически рассчитанное положение (расстояние от ядра) главного максимума зарядовой плотности его наружных электронов. Это так называемый орбитальный радиус атома. Периодичность в изменении значений орбитальных атомных радиусов в зависимости от порядкового номера элемента проявляется довольно отчетливо (см. рис. 4), и основные моменты здесь состоят в наличии очень ярко выраженных максимумов, приходящихся на атомы щелочных металлов, и таких же минимумов, отвечающих благородным газам. Уменьшение значений орбитальных атомных радиусов при переходе от щелочного металла к соответствующему (ближайшему) благородному газу носит, за исключением ряда Li—Ne, немонотонный характер, особенно при появлении между щелочным металлом и благородным газом семейств переходных элементов (металлов) и лантаноидов или актиноидов. В больших периодах в семействах d- и f-элементов наблюдается менее резкое уменьшение радиусов, так как заполнение орбиталей электронами происходит в пред-предвнешнем слое. В подгруппах элементов радиусы атомов и однотипных ионов в общем увеличиваются.
Проявления периодического закона в отношении энергии атомизации
Энергия атомизации простых веществ является характеристикой, которая во многом определяет их реакционную способность[19]. Зависимость энергии атомизации простых веществ от порядкового номера элемента имеет периодический характер. Основные моменты такой периодической зависимости состоят в следующем: энергия атомизации растет при переходе от щелочного металла (для них эти значения сравнительно невелики и близки 84 кДж/моль) к следующим за ним элементам, достигает максимума, затем убывает, становясь очень небольшой для галогена (63—126 кДж/моль) и, наконец, превращается в нуль в случае примыкающего к галогену благородного газа, который, как известно, при стандартных условиях существует в виде практически не взаимодействующих атомов. Положение максимума энергии атомизации в ряду элементов от щелочного металла до соответствующего (ближайшего) благородного газа зависит от многих факторов, выходящих за рамки настоящего изложения. Так, в ряду Li—Ne наибольшей энергией атомизации характеризуется углерод (718,2 кДж/моль), а в рядах K—Kr и Cs—Rn наибольшими энергиями атомизации обладают переходные металлы: ванадий (516,6 кДж/моль) и вольфрам (844,2 кДж/моль). Неравномерное изменение энергии атомизации в пределах одного ряда элементов от щелочного металла до благородного газа оказывается довольно сложным, особенно если этот ряд включает семейство переходных металлов.
Проявления периодического закона в отношении степени окисления
Одним из основных понятий в химии было и остается понятие степени окисления (степень окисления, состояние окисления, окислительное состояние). Несмотря на то что степень окисления представляется во многом формальной и более искусственной относительно других традиционных химических понятий, она до сих пор остается широко распространенной и сохраняет свою значимость для обобщения и более глубокого понимания основных принципов образования химических соединений[20].
Следует подчеркнуть, что степень окисления элемента, будучи формальной характеристикой, не дает представления ни об эффективных зарядах атомов этого элемента в соединении, ни о
Периодический закон Менделеева
Утверждение атомно-молекулярной теории на рубеже XVIII–XIX вв. сопровождалось бурным ростом числа известных химических элементов. Только за первое десятилетие XIX в. было открыто 14 новых элементов. Английский химик Г. Дэви (1778–1829) за один год с помощью электролиза получил шесть новых элементов– натрий, калий, магний, кальций, стронций, барий. К 1830 г. число известных элементов достигло 55.
Существование такого количества элементов, весьма разнообразных по свойствам, озадачивало химиков и требовало систематизации элементов. Некоторые ученые, заметив сходства нескольких элементов, объединяли их в отдельные группы, однако причины заметного изменения свойств не были установлены. Периодический закон химических элементов– фундаментальный закон природы – был открыт великим русским химиком Д.И. Менделеевым в 1869 г. в результате систематизации химических элементов в зависимости от их атомных весов: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Несмотря на огромную значимость открытия Менделеева, оно представляло лишь гениальное эмпирическое обобщение фактов, а их физический смысл долго оставался непонятным. Причина заключалась в том, что в XIX в. отсутствовали какие-либо представления о сложном строении атома. Сам Менделеев по этому поводу писал: «Периодическая изменяемость простых и сложных тел подчиняется некоторому высшему закону, природу которого, а тем более причину еще нет средств охватить. По всей вероятности, она кроется в основных началах внутренней механики атомов и частиц».
Данные о строении атомного ядра и распределении электронов в атомах позволяют по-новому рассмотреть периодический закон, который в современной формулировке гласит: свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядра атомов (порядкового номера).
Такая формулировка закона не противоречит формулировке, данной Менделеевым. Она только базируется на новых данных, которые придают закону физическую обоснованность, и подтверждают его правильность. Примерами, иллюстрирующим проявление периодического закона химических элементов, может служить периодическая зависимость плотности простых веществ в твердом состоянии от порядкового номера элемента (заряда ядра), или же такие характеристики атома как его размер, энергия ионизации, электроотрицательность, степень окисления, имеющие периодическую зависимость от заряда атомного ядра (рис. 4.3).
Табличной формой представления периодического закона является периодическая система химических элементов, разработанная Менделеевым в 1869–1871 гг.

Рис. 4.3.Зависимость плотности простых веществ в твердом состоянии от порядкового номера.
В периодической системе химических элементов все известные в настоящее время химические элементы расположены в порядке возрастания зарядов их атомных ядер, численно равных порядковому номеру элемента, и образуют 7 горизонтальных периодов, каждый из которых, за исключением первого, начинается щелочным металлом и заканчивается инертным газом, причем, седьмой период является незавершенным. Первые три периода, состоящие из одного ряда, называются малыми, остальные – большими.
 По
вертикали химические элементы
располагаются в 8 вертикальных
столбцах-группах, причем каждая группа
делится на две подгруппы – главную,
состоящую из элементов второго и третьего
периодов и сходных с ними элементов
больших периодов, и – побочную, состоящую
из металлов больших периодов. Отдельно
внизу таблицы помещены элементы с
порядковыми номерами 58–71, называемые
лантаноидами, и – элементы с порядковыми
номерами 90–103, называемые актиноидами.
В каждой клетке периодической системы
химических элементов, помимо наименования
элемента и его порядкового номера,
приведено значение относительной
атомной массы элемента и показано
распределение электронов по энергетическим
уровням (рис. 4.4).
По
вертикали химические элементы
располагаются в 8 вертикальных
столбцах-группах, причем каждая группа
делится на две подгруппы – главную,
состоящую из элементов второго и третьего
периодов и сходных с ними элементов
больших периодов, и – побочную, состоящую
из металлов больших периодов. Отдельно
внизу таблицы помещены элементы с
порядковыми номерами 58–71, называемые
лантаноидами, и – элементы с порядковыми
номерами 90–103, называемые актиноидами.
В каждой клетке периодической системы
химических элементов, помимо наименования
элемента и его порядкового номера,
приведено значение относительной
атомной массы элемента и показано
распределение электронов по энергетическим
уровням (рис. 4.4).


Рис. 4.4. Фрагмент периодической системы химических элементов.
На основе периодического закона химических элементов и периодической таблицы Менделеев пришел к выводу о существовании новых элементов, свойства которых он подробно описал и дал им условные названия – экабор, экаалюминий и экасилиций. Предсказания Менделеева блестяще подтвердились, – все три элемента были открыты и получили названия тех стран, где были сделаны открытия и найдены минералы, содержащие эти элементы: галлий,скандий,германий. Таким образом, Менделеев провел блестящий теоретический анализ огромного числа экспериментальных данных, синтезировал свои результаты в виде общего закона и сделал на его основе предсказания, которые вскоре были подтверждены экспериментально. Эта работа является классическим примером научного подхода к познанию окружающего мира.
Предсказанные Менделеевым элементы — Википедия
 Периодическая система Д. И. Менделеева (1871 год)
Периодическая система Д. И. Менделеева (1871 год)В 1869 году Дмитрий Иванович Менделеев опубликовал Периодическую таблицу элементов, в которой химические элементы были расположены в соответствии с наличием у них сходных свойств в порядке возрастания атомного веса[1].
В отличие от работ предшественников Менделеев исходил из допущения существования еще не открытых элементов на основе периодического изменения физических и химических свойств известных элементов. Им были оставлены в таблице пустые ячейки для ещё не открытых элементов и предсказаны их свойства. Чтобы дать предсказанным элементам «временные» названия, Менделеев использовал приставки «эка», «дви» и «три» (от санскритских слов «один», «два» и «три»), в зависимости от того, на сколько позиций вниз от уже открытого элемента с похожими свойствами находился предсказанный элемент. Так, германий до своего открытия в 1886 году носил название «экасилиций», а рений, открытый в 1926 году, назывался «двимарганец».
Первоначальные предсказания (1869—1870 годы)[править | править код]
Уже в первом варианте Периодической таблицы, опубликованном Д. И. Менделеевым в 1869 году, включено больше элементов, чем их было открыто на тот момент. В нём оставлены четыре свободные ячейки для еще неизвестных элементов и указаны их атомные веса (в «паях», близких по значению к массе атома водорода).
Развивая в 1869—1871 годах идеи периодичности, Д. И. Менделеев ввёл понятие о месте элемента в периодической системе как совокупности его свойств в сопоставлении со свойствами других элементов. Для предсказания свойств простых веществ и соединений он исходил из того, что свойства каждого элемента являются промежуточными между соответствующими свойствами двух соседних элементов в группе периодической таблицы, двух соседних элементов в периоде и элементов по диагонали — так называемое «правило звезды». На этой основе, в частности, опираясь на результаты изучения последовательности изменения стеклообразующих оксидов, исправил значения атомных масс 9 элементов. Предсказал в 1870 году существование, вычислил атомные массы и описал свойства трёх ещё не открытых тогда элементов — «экаалюминия», «экабора» и «экасилиция»[2]. Затем предсказал существование ещё восьми элементов, в том числе «двителлура» — полония, «экаиода» — астата, «экамарганца» — технеция, «экацезия» — франция.
Предсказания Менделеева вызвали в научном мире скепсис и острую критику. Так, немецкий физикохимик Вильгельм Оствальд, будущий лауреат Нобелевской премии, утверждал, что открыт не закон, а принцип классификации «чего-то неопределенного». Роберт Бунзен, первооткрыватель рубидия и цезия, писал, что Менделеев увлекает химиков «в надуманный мир чистых абстракций», а Герман Кольбе в 1870 г. назвал работу Менделеева спекулятивной. Правота Менделеева была убедительно доказана, когда были открыты предсказанные им элементы: галлий (Поль Лекок де Буабодран, 1875), скандий (Ларс Нильсон, 1879) и германий (Клеменс Винклер, 1886) — соответственно экаалюминий, экабор и экасилиций.
В 1875 г. французский химик Поль Эмиль Лекок де Буабодран открыл в минерале вюртците — сульфиде цинка ZnS — предсказанный Менделеевым «экаалюминий» и назвал его в честь своей родины галлием Ga (латинское название Франции — Галлия). Он писал: «Я думаю, нет необходимости настаивать на огромном значении подтверждения теоретических выводов господина Менделеева». Менделеев точно предсказал свойства галлия: его атомную массу, плотность металла, формулу оксида, хлорида, сульфата. Менделеев предугадал, что это будет очень легкоплавкий металл. Ниже в таблице сравниваются свойства, предсказанные Менделеевым, с действительными характеристиками галлия.
| Свойство | Экаалюминий | Галлий |
|---|---|---|
| Атомная масса | 68 | 69,72 |
| Плотность (г/см³) | 6,0 | 5,904 |
| Температура плавления (°C) | низкая | 29,78 |
| Формула оксида | Ea2O3 (плотность 5,5 г см−3, растворяется и в кислотах, и в основаниях) | Ga2O3 (плотность 5,88 г см−3, растворяется и в кислотах, и в основаниях) |
| Формула хлорида | Ea2Cl6 (летучий) | Ga2Cl6 (летучий) |
В 1879 г. шведский химик Ларс Нильсон открыл в сложном минерале гадолините скандий. Позже Пер Теодор Клеве доказал совпадение свойств предсказанного экабора и только что открытого скандия и известил об этом Менделеева. Менделеев предсказал для экабора атомную массу 44, а атомная масса скандия оказалась равна 44,955910. Нильсон писал: «Не остается никакого сомнения, что в скандии открыт экабор… Так подтверждаются нагляднейшим образом соображения русского химика, которые не только дали возможность предсказать существование скандия и галлия, но и предвидеть заранее их важнейшие свойства».
По поводу элемента экасилиция Менделеев писал: «Мне кажется, наиболее интересным из несомненно недостающих металлов будет тот, который принадлежит к IV группе аналогов углерода, а именно к III ряду. Это будет металл, следующий тотчас же за кремнием, и потому назовем его экасилицием». Германий был впервые выделен в 1886 году во Фрейбурге немецким химиком Клеменсом Винклером при анализе редкого минерала аргиродита. Его открытие оказалось лучшим на то время подтверждением теории Менделеева, поскольку германий по своим свойствам значительно резче отличается от соседних элементов, чем два предсказанных ранее элемента.
| Свойство | Экасилиций | Германий |
|---|---|---|
| Атомная масса | 72 | 72,61 |
| Плотность (г/см³) | 5,5 | 5,35 |
| Температура плавления (°C) | высокая | 947 |
| Цвет | серый | серый |
| Тип оксида | тугоплавкий диоксид | тугоплавкий диоксид |
| Плотность оксида (г/см³) | 4,7 | 4,7 |
| Реакция оксида | слабое основание | слабое основание |
| Температура кипения хлорида | ниже 100 °C | 86 °C (GeCl4) |
| Плотность хлорида (г/см³) | 1,9 | 1,9 |
Триумф предсказательной силы открытия Менделеева был настолько силён, что Винклер натолкнулся на неприятие со стороны некоторых химиков предложенного им названия «германий». Они стали обвинять Винклера в национализме и в присвоении открытия, которое сделал Менделеев, уже давший элементу имя «экасилиций». Обескураженный Винклер обратился за советом к самому Дмитрию Ивановичу. Тот объяснил, что именно первооткрыватель нового элемента должен дать ему название. Позже Винклер писал: «Едва ли можно найти иное более поразительное доказательство справедливости учения о периодичности, как во вновь открытом элементе. Это не просто подтверждение смелой теории, здесь мы видим очевидное расширение химического кругозора, мощный шаг в области познания».
Менделеев включил присланные ему портреты Лекока де Буабодрана, Нильсона и Винклера в общую рамку, озаглавив ее «Укрепители периодического закона». С конца 1880-х годов Периодический закон был окончательно признан в качестве одной из теоретических основ химии.
Никто из учёных, занимавшихся до Менделеева или одновременно с ним исследованиями соотношений между атомными весами и свойствами элементов, не смог сформулировать эту закономерность так ясно, как это сделал он. В частности, это относится к Дж. Ньюлендсу и Л. Мейеру. Предсказание ещё неизвестных элементов, их свойств и свойств их соединений является исключительно заслугой Д. И. Менделеева. …Наилучшим образом он смог применить свой метод горизонтальной, вертикальной и диагональной интерполяции в открытой им периодической системе для предсказания свойств…
— Анорганикум : В 2-х т. / [Блументаль Г., Энгельс З., Фиц И. и др.] ; Ред. Л. Кольдиц. — М. : Мир, 1984
В 1871 году Менделеев предсказал существование элемента, расположенного между торием и ураном. Тридцатью годами позже, в 1900 году, Уильям Крукс выделил протактиний как неизвестную радиоактивную примесь в образце урана. Различные изотопы протактиния затем выделяли в Германии в 1913 и 1918 годах[3], но современное название элемент получил только в 1948 году.
Версия Периодической таблицы, изданная в 1869, предсказывала существование более тяжёлого аналога титана и циркония, но в 1871 году Менделеев поместил на это место лантан. Открытие в 1923 году гафния подтвердило первоначальное предположение Менделеева.
В период создания первых вариантов периодической таблицы свойства редкоземельных элементов были изучены плохо и недостоверно. Кроме того, для тяжелых элементов периодическое изменение свойств имеет более сложный характер: критерий аналогии атомов не мог помочь Менделееву, как в случае экабора, экаалюминия и экасилиция; в этом случае этот критерий был лишен по крайней мере предсказательной силы, что снижало его научную ценность. Это объясняет, почему предсказания Менделеева для более тяжёлых элементов сбылись не так точно, как для лёгких, и почему эти предсказания не так широко известны.
Гипотеза об трансводородных элементах[править | править код]
В 1902 году после открытия гелия и аргона Менделеев поместил их в нулевую группу таблицы[4]. Сомневаясь в правильности атомной теории, объясняющей закон постоянства состава, он не мог априори считать водород легчайшим из элементов и полагал, что ещё более лёгкий член химически инертной нулевой группы мог оказаться незамеченным. Существованием этого элемента Менделеев пытался объяснить радиоактивность.
Более тяжёлый из двух гипотетических трансводородных элементов Менделеев отождествлял с коронием, получившим название по ассоциации с необъяснённой спектральной линией солнечной короны. Ошибочная калибровка прибора дала длину волны 531,68 нм, которая позже была исправлена на 530,3 нм. Эту длину волны Гротриан и Эдлен в 1939 году соотнесли с линией железа[5].
Легчайшему из газов нулевой группы, первому в Периодической таблице, приписывалась теоретическая атомная масса между 5,3·10−11 и 9,6·10−7. Частицам этого газа, названного им ньютонием, Менделеев приписал кинетическую скорость порядка 2,5·106 м/с. Почти невесомые, частицы обоих этих газов, по Менделееву, должны были легко проходить через толщу материи, практически не вступая в химические реакции. Высокая подвижность и очень малая атомная масса трансводородных газов приводила бы к тому, что они могли быть очень разреженными, по внешним признакам оставаясь при этом плотными.
Позже Менделеев опубликовал теоретическую разработку об эфире. Книга, называвшаяся «Химическая концепция эфира», вышла в 1904 году, и в ней вновь содержалось упоминание о двух гипотетических инертных газах легче водорода, коронии и ньютонии[6]. Под «эфирным газом» Менделеев понимал межзвёздную атмосферу, состоящую из двух трансводородных газов с примесями других элементов и образовавшуюся в результате внутренних процессов, идущих на звёздах.
- ↑ Kaji, Masanori. D.I.Mendeleev’s concept of chemical elements and The Principles of Chemistry (англ.) // Bulletin for the History of Chemistry (англ.)русск. : journal. — 2002. — Vol. 27, no. 1. — P. 4—16. Архивировано 17 декабря 2008 года.
- ↑ Менделеев Д. И. Естественная система элементов и применение её к указанию свойств неоткрытых элементов // Журнал Русского химического общества. — 1871. — Т. III. — С. 25—56. Архивировано 17 марта 2014 года.
- ↑ Emsley, John. Nature’s Building Blocks (англ.). — (Hardcover, First Edition). — Oxford University Press, 2001. — P. 347. — ISBN 0198503407.
- ↑ Менделеев, Д. Основы химии (рус.). — 7-е издание. — 1902.
- ↑ Swings, P. Edlén’s Identification of the Coronal Lines with Forbidden Lines of Fe X, XI, XIII, XIV, XV; Ni XII, XIII, XV, XVI; Ca XII, XIII, XV; a X, XIV (англ.) // The Astrophysical Journal : journal. — IOP Publishing, 1943. — July (vol. 98, no. 119). — P. 116—124. — DOI:10.1086/144550. и [1]
- ↑ Менделеев, Д. Попытка химического понимания мирового эфира (рус.). — Санкт-Петербург, 1903.
Английский перевод:
Mendeléeff, D. (англ.)русск.. An Attempt Towards A Chemical Conception Of The Ether (англ.) / G. Kamensky (translator). — Longmans, Green & Co., 1904.
См. также
Bensaude-Vincent, Bernadette. L’éther, élément chimique: un essai malheureux de Mendéleev en 1904 (фр.) // British Journal for the History of Science (англ.)русск. : magazine. — 1982. — Vol. 15. — P. 183—188. — DOI:10.1017/S0007087400019166.
- Scerri Eric. The Periodic Table: Its Story and Its Significance (англ.). — New York: Oxford University Press, 2007. — ISBN 0195305736.
Периодический закон Менделеева — это… Что такое Периодический закон Менделеева?
- Периодический закон Менделеева
- фундаментальный закон, устанавливающий периодическое изменение свойств химических элементов в зависимости от увеличения зарядов ядер их атомов. Открыт Д. И. Менделеевым в 1869 при сопоставлении свойств всех известных в то время элементов и величин их атомных весов. Термин «периодический закон» Менделеев впервые употребил в ноябре 1870, а в октябре 1871 дал окончательную формулировку П. з.: «… свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса» («Периодический закон. [Основные статьи]», 1958, с. 111). Графическим (табличным) выражением П. з. явилась разработанная Менделеевым Периодическая система элементов.
Физический смысл П.
з. был вскрыт лишь после выяснения того, что заряд ядра атома возрастает при переходе от одного химического элемента к соседнему (в периодической системе) на единицу элементарного заряда. Численно заряд ядра равен порядковому номеру (атомному номеру Z) соответствующего элемента в периодической системе, то есть числу протонов в ядре, в свою очередь равному числу электронов соответствующего нейтрального атома (см. Атом). Химические свойства атомов определяются структурой их внешних электронных оболочек, периодически изменяющейся с увеличением заряда ядра, и, следовательно, в основе П. з. лежит представление об изменении заряда ядра атомов, а не атомной массы элементов. Наглядная иллюстрация П. з.— кривые периодические изменения некоторых физических величин (ионизационных потенциалов, атомных радиусов, атомных объёмов) в зависимости от Z (см. Атомная физика). Какого-либо общего математического выражения П. з. не существует.
П. з. имеет огромное естественнонаучное и философское значение. Он позволил рассматривать все элементы в их взаимной связи и прогнозировать свойства неизвестных элементов. Благодаря П. з. многие научные поиски (например, в области изучения строения вещества — в химии, физике, геохимии, космохимии, астрофизике) получили целенаправленный характер. П. з.— яркое проявление действия общих законов диалектики, в частности закона перехода количества в качество.
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
- Периодические решения
- Периодичность плодоношения
Смотреть что такое «Периодический закон Менделеева» в других словарях:
ПЕРИОДИЧЕСКИЙ ЗАКОН МЕНДЕЛЕЕВА — см. Периодическая система элементов Менделеева … Большой Энциклопедический словарь
ПЕРИОДИЧЕСКИЙ ЗАКОН МЕНДЕЛЕЕВА — ПЕРИОДИЧЕСКИЙ ЗАКОН МЕНДЕЛЕЕВА, в химии закон, сформулированный Дмитрием Ивановичем МЕНДЕЛЕЕВЫМ в 1869 г., согласно которому свойства химических ЭЛЕМЕНТОВ находятся в периодической зависимости от их ОТНОСИТЕЛЬНОЙ АТОМНОЙ МАССЫ. Объединение… … Научно-технический энциклопедический словарь
периодический закон Менделеева — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN periodic law … Справочник технического переводчика
периодический закон Менделеева — см. Периодическая система химических элементов. * * * ПЕРИОДИЧЕСКИЙ ЗАКОН МЕНДЕЛЕЕВА ПЕРИОДИЧЕСКИЙ ЗАКОН МЕНДЕЛЕЕВА, см. Периодическая система элементов Менделеева (см. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ МЕНДЕЛЕЕВА) … Энциклопедический словарь
периодический закон Менделеева — Mendelejevo periodinis dėsnis statusas T sritis fizika atitikmenys: angl. periodic law of Mendeleef vok. Periodengesetz von Mendelejew, n rus. периодический закон Менделеева, m pranc. loi périodique de Mendéléev, f … Fizikos terminų žodynas
ПЕРИОДИЧЕСКИЙ ЗАКОН МЕНДЕЛЕЕВА — Открыт Д. И. Менделеевым в процессе работы над учебником Основы химии (1868 1871). Первоначально была разработана (1 марта 1869) таблица Опыт системы элементов, основанной на их атомном весе и химическом сходстве (см. Периодическая система… … Химическая энциклопедия
ПЕРИОДИЧЕСКИЙ ЗАКОН МЕНДЕЛЕЕВА — см. Периодическая система химических элементов … Естествознание. Энциклопедический словарь
Периодический закон — Памятник на территории Словацкого технологического университета (Братислава), посвященный Д. И. Менделееву Периодический закон фундаментальный закон природы, открытый Д. И. Ме … Википедия
ЗАКОН МЕНДЕЛЕЕВА (ПЕРИОДИЧЕСКИЙ ЗАКОН Д И МЕНДЕЛЕЕВА) — ЗАКОН МЕНДЕЛЕЕВА (ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА) в 1869 г. русский учёный открыл и сформулировал фундаментальный закон природы. Современная формулировка периодического закона: «Свойства простых тел, формы и свойства соединений элементов… … Большая политехническая энциклопедия
МЕНДЕЛЕЕВА ПЕРИОДИЧЕСКИЙ ЗАКОН — см. Периодическая система элементов Менделеева … Большой энциклопедический политехнический словарь
Периодический закон Менделеева — это… Что такое Периодический закон Менделеева?
- Периодический закон Менделеева
- фундаментальный закон, устанавливающий периодическое изменение свойств химических элементов в зависимости от увеличения зарядов ядер их атомов. Открыт Д. И. Менделеевым в 1869 при сопоставлении свойств всех известных в то время элементов и величин их атомных весов. Термин «периодический закон» Менделеев впервые употребил в ноябре 1870, а в октябре 1871 дал окончательную формулировку П. з.: «… свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса» («Периодический закон. [Основные статьи]», 1958, с. 111). Графическим (табличным) выражением П. з. явилась разработанная Менделеевым Периодическая система элементов.
Физический смысл П.
з. был вскрыт лишь после выяснения того, что заряд ядра атома возрастает при переходе от одного химического элемента к соседнему (в периодической системе) на единицу элементарного заряда. Численно заряд ядра равен порядковому номеру (атомному номеру Z) соответствующего элемента в периодической системе, то есть числу протонов в ядре, в свою очередь равному числу электронов соответствующего нейтрального атома (см. Атом). Химические свойства атомов определяются структурой их внешних электронных оболочек, периодически изменяющейся с увеличением заряда ядра, и, следовательно, в основе П. з. лежит представление об изменении заряда ядра атомов, а не атомной массы элементов. Наглядная иллюстрация П. з.— кривые периодические изменения некоторых физических величин (ионизационных потенциалов, атомных радиусов, атомных объёмов) в зависимости от Z (см. Атомная физика). Какого-либо общего математического выражения П. з. не существует.
П. з. имеет огромное естественнонаучное и философское значение. Он позволил рассматривать все элементы в их взаимной связи и прогнозировать свойства неизвестных элементов. Благодаря П. з. многие научные поиски (например, в области изучения строения вещества — в химии, физике, геохимии, космохимии, астрофизике) получили целенаправленный характер. П. з.— яркое проявление действия общих законов диалектики, в частности закона перехода количества в качество.
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
- Периодические решения
- Периодичность плодоношения
Смотреть что такое «Периодический закон Менделеева» в других словарях:
ПЕРИОДИЧЕСКИЙ ЗАКОН МЕНДЕЛЕЕВА — см. Периодическая система элементов Менделеева … Большой Энциклопедический словарь
ПЕРИОДИЧЕСКИЙ ЗАКОН МЕНДЕЛЕЕВА — ПЕРИОДИЧЕСКИЙ ЗАКОН МЕНДЕЛЕЕВА, в химии закон, сформулированный Дмитрием Ивановичем МЕНДЕЛЕЕВЫМ в 1869 г., согласно которому свойства химических ЭЛЕМЕНТОВ находятся в периодической зависимости от их ОТНОСИТЕЛЬНОЙ АТОМНОЙ МАССЫ. Объединение… … Научно-технический энциклопедический словарь
периодический закон Менделеева — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN periodic law … Справочник технического переводчика
периодический закон Менделеева — см. Периодическая система химических элементов. * * * ПЕРИОДИЧЕСКИЙ ЗАКОН МЕНДЕЛЕЕВА ПЕРИОДИЧЕСКИЙ ЗАКОН МЕНДЕЛЕЕВА, см. Периодическая система элементов Менделеева (см. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ МЕНДЕЛЕЕВА) … Энциклопедический словарь
периодический закон Менделеева — Mendelejevo periodinis dėsnis statusas T sritis fizika atitikmenys: angl. periodic law of Mendeleef vok. Periodengesetz von Mendelejew, n rus. периодический закон Менделеева, m pranc. loi périodique de Mendéléev, f … Fizikos terminų žodynas
ПЕРИОДИЧЕСКИЙ ЗАКОН МЕНДЕЛЕЕВА — Открыт Д. И. Менделеевым в процессе работы над учебником Основы химии (1868 1871). Первоначально была разработана (1 марта 1869) таблица Опыт системы элементов, основанной на их атомном весе и химическом сходстве (см. Периодическая система… … Химическая энциклопедия
ПЕРИОДИЧЕСКИЙ ЗАКОН МЕНДЕЛЕЕВА — см. Периодическая система химических элементов … Естествознание. Энциклопедический словарь
Периодический закон — Памятник на территории Словацкого технологического университета (Братислава), посвященный Д. И. Менделееву Периодический закон фундаментальный закон природы, открытый Д. И. Ме … Википедия
ЗАКОН МЕНДЕЛЕЕВА (ПЕРИОДИЧЕСКИЙ ЗАКОН Д И МЕНДЕЛЕЕВА) — ЗАКОН МЕНДЕЛЕЕВА (ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА) в 1869 г. русский учёный открыл и сформулировал фундаментальный закон природы. Современная формулировка периодического закона: «Свойства простых тел, формы и свойства соединений элементов… … Большая политехническая энциклопедия
МЕНДЕЛЕЕВА ПЕРИОДИЧЕСКИЙ ЗАКОН — см. Периодическая система элементов Менделеева … Большой энциклопедический политехнический словарь