Урок №17-18. Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ
Проблемный вопрос: изменится ли масса реагирующих веществ по сравнению с массой продуктов реакции?
Чтобы ответить на данный вопрос наблюдайте за следующими видео-экспериментами:
Горение свечи в замкнутом сосуде
Сохранение массы веществ в реакциях
Вывод: Масса веществ до и после реакции не изменилась.
Формулировка закона сохранения массы: масса веществ,
вступивших в реакцию, равна массе образовавшихся веществ.
С точки зрения атомно-молекулярного учения этот закон объясняется тем, что при химических реакциях общее количество атомов не изменяется, а происходит лишь их перегруппировка.
Закон сохранения массы
веществ является основным законом химии, все расчеты по химическим реакциям
производятся на его основе. Именно с открытием этого закона связывают
возникновение современной химии как точной науки.
Закон сохранения массы был теоретически открыт в 1748 году и экспериментально подтверждён в 1756 году русским ученым М.В. Ломоносовым.
Французский учёный Антуан Лавуазье в 1789 году окончательно убедил учёный мир в универсальности этого закона. Как Ломоносов, так и Лавуазье пользовались в своих экспериментах очень точными весами. Они нагревали металлы (свинец, олово, и ртуть) в запаянных сосудах и взвешивали исходные вещества и продукты реакции.
Химические уравнения
Закон сохранения массы веществ применяется при составлении уравнений химических реакций.
Химическое уравнение – это условная запись химической реакции посредством химических формул и коэффициентов.
Посмотрим видео — эксперимент: Нагревание смеси железа и серы.
В результате химического взаимодействия серы и железа
получено вещество – сульфид железа (II) – оно отличается от исходной
смеси. Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно
их разделить и с помощью магнита. Произошло химическое превращение.
Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно
их разделить и с помощью магнита. Произошло химическое превращение.
Исходные вещества, принимающие участие в химических
реакциях называются реагентами.
Новые вещества, образующиеся в результате химической реакции называются продуктами.
Запишем протекающую реакцию в виде уравнения химической реакции:
Fe + S = FeS
Алгоритм составления уравнения химической реакции
Составим уравнение химической реакции взаимодействия фосфора и кислорода |
1. В левой
части уравнения записываем химические формулы реагентов (веществ, вступающих
в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – H2; N2; O2; F2; Cl2; Br2; I2. P + O2 → |
2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов:
P + O2 → P2O5
|
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
4P + 5O2 = 2P2O5
|
РАБОТА С ТРЕНАЖЁРАМИ
Тренажёр №1
Тренажёр №2
Тренажёр №3
Тренажёр №4
Тренажёр №5
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1.
Zn + O2 → ZnO
Fe + Cl2→ FeCl3
Mg + HCl → MgCl2 + H2
Al(OH)3 → Al2O3 + H2O
HNO3→ H2O+NO2+O2
CaO+H2O→ Ca(OH)2
H2+Cl2→ HCl
KClO3→ KClO4+KCl
Fe(OH)2+H2O+O2
→ Fe(OH)3KBr+Cl2→ KCl+Br2
№2.
1) Na и O2
2) Na и Cl2
3) Al и S
Закон сохранения массы и эненргии
После доказательства существования атомов и молекул важнейшим открытием атомно-молекулярной теории стал закон сохранения массы, который был сформулирован в виде философской концепции великим русским ученым Михаилом Васильевичем Ломоносовым (1711-1765) в 1748 г. и подтвержден экспериментально им самим в 1756 г. и независимо от него французским химиком А.Л.Лавуазье в 1789 г.
Масса всех веществ, вступающих в химическую реакцию, равна массе всех продуктов реакции.
Опыты по сжиганию веществ, которые проводились до Ломоносова, наводили на мысль о том, что масса веществ в процессе реакции не сохраняется. При нагревании на воздухе ртуть превращалась в красную окалину, масса которой была больше массы металла. Масса золы, образующейся при сгорании дерева, напротив, всегда меньше массы исходного вещества.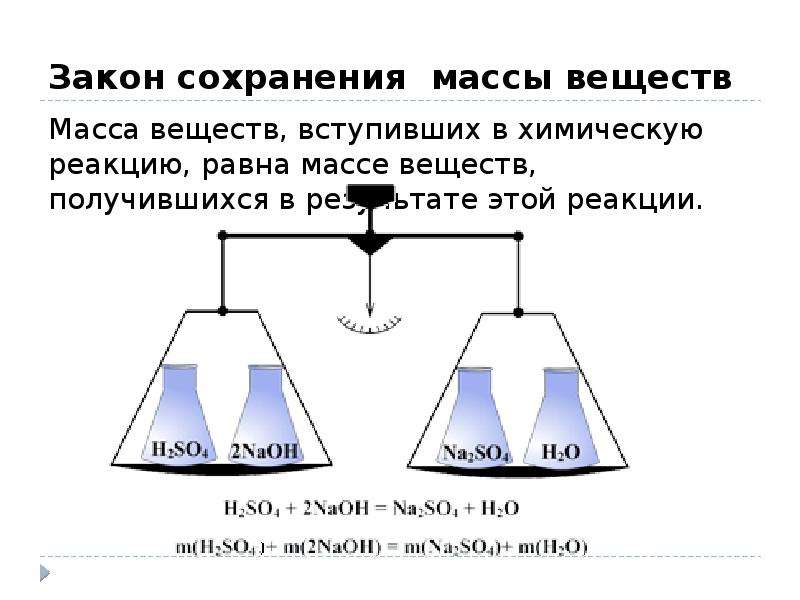
Ломоносов провел простой опыт, который показал, что горение металла есть реакция присоединения, а увеличение массы металла происходит за счет присоединения части воздуха. Он прокаливал металлы в запаянном стеклянном сосуде и обнаружил, что масса сосуда не изменялась, хотя химическая реакция происходила. После того, как сосуд был вскрыт, туда устремлялся воздух, и масса сосуда увеличивалась. Таким образом, при аккуратном измерении массы всех участников реакции выясняется, что масса веществ при химической реакции сохраняется. Закон сохранения массы имел огромное значение для атомно-молекулярной теории. Он подтвердил, что атомы являются неделимыми и при химических реакциях не изменяются. Молекулы при реакции обмениваются атомами, но общее число атомов каждого вида не изменяется, и поэтому общая масса веществ в процессе реакции сохраняется.
Закон сохранения массы является частным случаем общего закона природы – закона сохранения энергии, который утверждает, что энергия изолированной системы постоянна. Энергия – это мера движения и взаимодействия различных видов материи. При любых процессах в изолированной системе энергия не производится и не уничтожается, она может только переходить из одной формы в другую.
Энергия – это мера движения и взаимодействия различных видов материи. При любых процессах в изолированной системе энергия не производится и не уничтожается, она может только переходить из одной формы в другую.
Одной из форм энергии является так называемая энергия покоя, которая связана с массой соотношением Эйнштейна
Е0 = m0•с2,
где с – скорость света в вакууме (с = 3•108 м/с). Это соотношение показывает, что масса может переходить в энергию и наоборот. Именно это и происходит во всех ядерных реакциях, и поэтому закон сохранения массы в ядерных процессах нарушается. Однако, закон сохранения энергии остается справедливым и в этом случае, если учитывать энергию покоя.
В химических реакциях изменение массы, вызванное выделением или поглощением энергия, очень мало. Типичный тепловой эффект химической реакции по порядку величины равен 100 кДж/моль. Посчитаем, как при этом изменяется масса:
∆m = ∆E/с2 = 105 / (3•108)2 ~ 10-12 кг/моль = 10-9г/моль.
Закон сохранения массы
1. Исторический очерк
Закон сохранения массы исторически понимался как одна из формулировок закона сохранения материи. Одним из первых его сформулировал древнегреческий философ Эмпедокл V век до н. э.:
Ничто не может произойти из ничего, и никак не может то, что есть, уничтожиться.
Ранее Эмпедокла «принцип сохранения» применялся представителями Милетской школы для формулировки теоретических представлений о первовеществе, основе всего сущего. Позже аналогичный тезис высказывали Демокрит, Аристотель и Эпикур в пересказе Лукреция Кара.
Средневековые учёные также не высказывали никаких сомнений в истинности этого закона. Фрэнсис Бэкон в 1620 году провозгласил: «Сумма материи остается всегда постоянной и не может быть увеличена или уменьшена… ни одна мельчайшая её часть не может быть ни одолена всей массой мира, ни разрушена совокупной силой всех агентов, ни вообще как-нибудь уничтожена».
В ходе развития алхимии, а затем и научной химии, было замечено, что при любых химических превращениях суммарный вес реагентов не меняется. В 1630 году Жан Рэ, химик из Перигора, писал Мерсенну:
Вес настолько тесно привязан к веществу элементов, что, превращаясь из одного в другой, они всегда сохраняют тот же самый вес.
С появлением в трудах Ньютона понятия массы как меры количества вещества, формулировка закона сохранения материи была уточнена: масса есть инвариант, то есть при всех процессах общая масса не уменьшается и не увеличивается.
В 1673 году опыты Роберта Бойля поставили закон сохранения массы под сомнение — у него при химической реакции с нагреванием вес вещества увеличился. Бойль из этого сделал вывод, что носитель теплоты «флогистон», по тогдашней терминологии имеет вес; эта гипотеза восстанавливала доверие к сохранению массы. Однако сразу после публикации Бойля французский химик Шерубен дОрлеан Cherubin dOrleans, 1679 год указал на ошибку Бойля: увеличение веса происходило за счёт воздуха, а в запаянном сосуде вес сохранялся неизменным. Позднее, в 1755 году об этом писал и М. В. Ломоносов в письме Л. Эйлеру см. текст в Викитеке:
Позднее, в 1755 году об этом писал и М. В. Ломоносов в письме Л. Эйлеру см. текст в Викитеке:
Все встречающиеся в природе изменения происходят так, что если к чему-либо нечто прибавилось, это отнимается у чего-то другого. Так, сколько материи прибавляется к какому-либо телу, столько же теряется у другого, сколько часов я затрачиваю на сон, столько же отнимаю от бодрствования и т. д.
В СССР на основании этой фразы М. В. Ломоносова объявили автором закона сохранения массы, хотя он никогда не претендовал на такой приоритет и в своём «Обзоре важнейших открытий» данный закон не упоминает. Современные историки подобные претензии считают безосновательными. Ошибочно мнение, что закон сохранения массы был Ломоносовым доказан опытным путём;
Всеобщий закон сформулирован Ломоносовым на основе общефилософских материалистических соображений, никогда не подвергался им сомнению или проверке, а напротив, служил ему твёрдой исходной позицией во всех исследованиях на всём протяжении его жизни.
В дальнейшем, вплоть до создания физики микромира, закон сохранения массы считался истинным и очевидным. Иммануил Кант объявил этот закон постулатом естествознания 1786. Лавуазье в «Начальном учебнике химии» 1789 привёл точную количественную формулировку закона сохранения массы вещества, однако не объявил его каким-то новым и важным законом, а просто упомянул мимоходом как давно известный и достоверно установленный факт. Для химических реакций Лавуазье сформулировал закон в следующих выражениях:
Ничто не творится ни в искусственных процессах, ни в природных, и можно выставить положение, что во всякой операции имеется одинаковое количество материи до и после, что качество и количество начал остались теми же самыми, произошли лишь перемещения, перегруппировки. На этом положении основано всё искусство делать опыты в химии.
Другими словами, сохраняется масса закрытой физической системы, в которой происходит химическая реакция, а сумма масс всех веществ, вступивших в эту реакцию, равна сумме масс всех продуктов реакции то есть тоже сохраняется. Масса, таким образом, считается аддитивной.
Масса, таким образом, считается аддитивной.
Закон сохранения массы, масса продуктов реакции равна массе веществ вступивших в реакцию
Купить рН-метры, pH meters в Санкт-Петербурге
В каталоге товаров/продукции представлены рН-метры — pH метры Россия, карманные рН-метры, портативные рН-метры, стационарные рН-метры, рН-метры для пищевой промышленности, категории: pH meter made in Russia, pocket pH meters, portable pH meters, stationary pH meters, pH meters for food industry, ; портативные, стационарные лабораторные модели измерителей водородного показателя (показателя pH), компактные карманные приборы рН-метры, автономные портативные рН-метры для оперативного определения кислотности или щелочности среды, лабораторные модели стационарные измерители водородного показателя (показателя pH), ,pH метры Россия
Подробнее… Купить pH метры производства Россия — pH meter made in Russia в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить портативные, стационарные pH метры Россия в Санкт-Петербурге по выгодной цене. компактные модели рН-метров, приборов для измерения водородного показателя.
Купить портативные, стационарные pH метры Россия в Санкт-Петербурге по выгодной цене. компактные модели рН-метров, приборов для измерения водородного показателя.
карманные рН-метры
Подробнее… Купить карманные рН-метры — pocket pH meters в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Легкие и удобные устройства предназначены для оперативного определения кислотности или щелочности среды / определения уровня pH среды в полевых условиях, когда использование более громоздких лабораторных «портативных рН-метров»; «стационарных рН-метров» приборов зат…рН-метры для пищевой промышленности
Подробнее… Приборы для анализа пищевых продуктов — купить рН-метры для пищевой промышленности — pH meters for food industry в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Универсальные измерительные приборы контроля качества продуктов питания применяются в различных лабораториях и производстве.
Купить прибор в Санкт-Петербурге по выгодной цене. рН-метры. В каталоге ХИМСНАБ-СПБ представлены…
Универсальные измерительные приборы контроля качества продуктов питания применяются в различных лабораториях и производстве.
Купить прибор в Санкт-Петербурге по выгодной цене. рН-метры. В каталоге ХИМСНАБ-СПБ представлены…Купить электроды для измерения pH, анализаторы pH-электроды для рН-метров
Выносные электроды предназначеных для проведения измерений в лабораторных и полевых измерений рН, определения окислительно-восстановительного потенциала, удельной электрической проводимости и температуры воды, водных растворов. Анализаторы состоят из измерительного преобразователя и комбинированных датчиков (первичных преобразователей), обеспечивающих измерение параметров водной среды. Измерительные приборы отличает высокая производительность и точность осуществляемых измерений.
Купить электроды и датчики, electrodes and sensors в Санкт-Петербурге
В каталоге товаров/продукции представлены электроды и датчики — Ион-селективные электроды, pH-электроды, электроды для измерения pH, датчики ОВП, редокс-электроды, датчики проводимости, датчики температуры, кислородные датчики, электроды вспомогательные (сравнения), категории: Ion-selective electrodes, pH-electrodes, sensors ORP, conductivity sensors, temperature sensors, oxygen sensors, the auxiliary electrode (comparison), ; Ион-селективные электроды, pH-электрод, датчики ph, электрод ph метра, электроды для измерения ph, измерительный электрод ph, рН-метрический электрод, измерение значения концентрации ионов водорода, определение концентрации ионов водорода, электроды датчики ОВП, редокс-электроды, измерение окислительно-восстановительного потенциала, многодиапазонные зонды и электроды, электроды датчики проводимости, электрод сенсор датчик температуры, электрод сенсор датчик кислородный, специальные лабораторные и промышленные электроды сравнения, электроды вспомогательные,Ион-селективные электроды
Подробнее. ..
Купить Ион-селективные электроды — Ion-selective electrodes в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить Ион-селективный электрод в Санкт-Петербурге по выгодной цене.
Проведение лабораторных ионометрических исследований, ионометрический анализ образцов требует наличия анализаторов и специализированного лабораторного оборудования: ионоселективного электрода, вспомогательного…
..
Купить Ион-селективные электроды — Ion-selective electrodes в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить Ион-селективный электрод в Санкт-Петербурге по выгодной цене.
Проведение лабораторных ионометрических исследований, ионометрический анализ образцов требует наличия анализаторов и специализированного лабораторного оборудования: ионоселективного электрода, вспомогательного…pH-электроды, электроды для измерения pH
Подробнее… Купить pH-электроды (pH-electrodes) лабораторные измерительные устройства, анализаторы жидкости, растворов, воды и водных сред используемые для получения точных и воспроизводимых показаний приборов, опредлеление кислотности или щелочности выраженной в виде pH. В комании ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93 можно приобрести рН-электроды для рН-метров, анализаторов воды предназначе. ..
..датчики ОВП, редокс-электроды
Подробнее… Индикаторные элементы для проведения измерения окислительно-восстановительных потенциалов. В обратимых окислительно-восстановительных системах позволяют проводить определение концентрации компонентов. Специализированные электроды и датчики ОВП, редокс-электроды имеют особые электрохимические характеристики для потенциометрических измерений, регистрации ОВП растворов. Измерительное оборудован…датчики проводимости
Подробнее… Купить многодиапазонные датчики проводимости — conductivity sensors для кондуктометров использующих выносной (сменный) электрод в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить датчик проводимости в Санкт-Петербурге по выгодной цене. Специализированные электроды и датчики, electrodes and sensors с подключаемым кабелем используемые для определения проводимости и солесодержания в вод…
Специализированные электроды и датчики, electrodes and sensors с подключаемым кабелем используемые для определения проводимости и солесодержания в вод…кислородные датчики
Подробнее… Купить кислородные датчики — oxygen sensors для стационарных и портативных оксиметров в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Модели стандартных полярографических датчиков растворенного кислорода применяемых в настольных и портативных приборах. Отдельные модели датчиков кислорода состоят из платинового катода, серебряного анода и фторопластовой мембраны. Конструкции датчика делаю…электроды вспомогательные (сравнения)
Подробнее… Купить электроды вспомогательные (сравнения) — auxiliary electrode (comparison) в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Лабораторный вспомогательный или опорный электрод, заполненный концентрированным раствором КСl — электролит является вторым по значимости элементом измерительного прибора «рН-метра» . Данный тип электрода позволяет создать опорную точку, относитель… индикаторная бумага в ПОЛОСКАХ или индикаторная бумага в КАТУШКАХ. Подобрать по диапазону pH: 0 — 6 рН; 1 — 12 рН; 4,5 — 10 рН; 7 — 14 рН; 1 — 11 рН; 5,5 — 9 рН; 1 — 14 рН; 0 — 14 рН; 0 — 12 рН, также в каталоге ХИМСНАБ-СПБ
лабораторного оборудования и приборов, раздела измерительные приборы можно приобрести приборы для измерения водородного показателя pH:
«рН-метры»;
«карманные рН-метры»;
«портативные рН-метры»;
«стационарные рН-метры» и
«pH-электроды»
Оставьте заявку ON-LINE или позвоните.
Лабораторный вспомогательный или опорный электрод, заполненный концентрированным раствором КСl — электролит является вторым по значимости элементом измерительного прибора «рН-метра» . Данный тип электрода позволяет создать опорную точку, относитель… индикаторная бумага в ПОЛОСКАХ или индикаторная бумага в КАТУШКАХ. Подобрать по диапазону pH: 0 — 6 рН; 1 — 12 рН; 4,5 — 10 рН; 7 — 14 рН; 1 — 11 рН; 5,5 — 9 рН; 1 — 14 рН; 0 — 14 рН; 0 — 12 рН, также в каталоге ХИМСНАБ-СПБ
лабораторного оборудования и приборов, раздела измерительные приборы можно приобрести приборы для измерения водородного показателя pH:
«рН-метры»;
«карманные рН-метры»;
«портативные рН-метры»;
«стационарные рН-метры» и
«pH-электроды»
Оставьте заявку ON-LINE или позвоните. Менеджер компании ответит на ваши вопросы.
Менеджер компании ответит на ваши вопросы.
Широкий ассортимент
В каталоге компании более 4000 наименований продукции в 200 товарных категориях: химические реактивы, лаб. оборудование и посуда, аксессуары и принадлежности для лабораторий, различные виды удобрений, химическое сырьеи многе другое. Можно подобрать продукцию воспользовавшись фильтром характеристик.
Проверенные поставщики
Компания реализует товары и продукцию только от проверенных поставщиков гарантирующих качестно продукции.
Консультация по продукции
Менеджеры компании проконсультируют вас по ассортименту реализуемой продукции, звоните в рабочее время
Доставка
География потребителей выходит за пределы России, компания «Химснаб-СПБ» осуществляет доставку приобретаемых товаров и продукции по Санкт-Петербургу, Ленинрадской обл, России и странам СНГ.
Индивидуальный подход
Строим свое сотрудничество с клиентом с учетом всех пожеланий клиента. Гибкий и индивидуальный подход к каждому клиенту, ориентированность на долгосрочные партнерские отношения, строгое соблюдение оговоренных сроков и предоставления документов заказчику являются неоспоримыми преимуществами компании «Химснаб-СПБ». Мы заботимся о том, чтобы каждый наш клиент остался доволен приобретаемой продукцией и полученным результатом, который является нашим общим успехом!
Малотоннажная химия
Реализация продукции малотоннажной химии: продукция химической и нефтехимической промышленности. Малотоннажная химия дает возможность на скромном оборудовании и в небольших объемах производить дорогостоящие модификаторы, пластификаторы, ингибиторы и другие микродобавки, способные наделять конечный продукт новыми свойствами
Комплексное снабжение, оснащение
Компания Химснаб-СПБ имеет многолетний опыт работы на рынке химической продукции и лабораторного оборудования. Компания тесно сотрудничает со многими промышленными и производственными организациями и имеет возможность осуществлять комплексное снабжение и оснащение предприятии различных отраслений промышленности необходимым оборудованием и расходными материалами.
Компания тесно сотрудничает со многими промышленными и производственными организациями и имеет возможность осуществлять комплексное снабжение и оснащение предприятии различных отраслений промышленности необходимым оборудованием и расходными материалами.
Предствленная информация на страницах данного интернет-сайта и в каталоге продукции носит исключительно информационный характер и ни при каких условиях не является публичной офертой, определяемой положениями Статьи 437 (2) Гражданского кодекса РФ. Для получения подробной информации о наличии и стоимости указанных товаров и (или) услуг,обращайтесь к менеджерам отдела продаж: форма обратной связи, e-mail, телефон.
Реализация продукции для сельского хозяйства, химической, строительной, нефтегазовой, металлургической, текстильной, кожевенной, и других отраслей промышленности.
Программа вступительных испытаний по химии
Программа по химии для поступающих в Московский государственный университет состоит из двух разделов.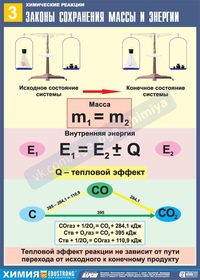 В первом разделе представлены основные теоретические понятия химии, которыми должен владеть абитуриент с тем, чтобы уметь обосновывать химические и физические свойства веществ, перечисленных во втором разделе, посвященном элементам и их соединениям.
В первом разделе представлены основные теоретические понятия химии, которыми должен владеть абитуриент с тем, чтобы уметь обосновывать химические и физические свойства веществ, перечисленных во втором разделе, посвященном элементам и их соединениям.
Экзаменационный билет может содержать до 10 заданий с дифференцированной оценкой, охватывающих все разделы программы для поступающих. Примеры экзаменационных заданий последних лет помещены в сборниках [3,4,8] (см. список рекомендуемой литературы в конце программы). На экзамене можно пользоваться микрокалькуляторами и справочными таблицами, такими как «Периодическая система химических элементов», «Растворимость оснований, кислот и солей в воде», «Ряд стандартных электродных потенциалов».
Часть I. Основы теоретической химии
Предмет химии. Место химии в естествознании. Масса и энергия. Основные понятия химии. Вещество. Молекула. Атом. Электрон. Ион. Химический элемент. Химическая формула. Относительная атомная и молекулярная масса. Моль. Молярная масса.
Моль. Молярная масса.
Химические превращения. Закон сохранения массы и энергии. Закон постоянства состава. Стехиометрия.
Строение атома. Атомное ядро. Изотопы. Стабильные и нестабильные ядра. Радиоактивные превращения, деление ядер и ядерный синтез. Уравнение радиоактивного распада. Период полураспада.
Двойственная природа электрона. Строение электронных оболочек атомов. Квантовые числа. Атомные орбитали. Электронные конфигурации атомов в основном и возбужденном состояниях, принцип Паули, правило Хунда.
Периодический закон Д.И.Менделеева и его обоснование с точки зрения электронного строения атомов. Периодическая система элементов.
Химическая связь. Типы химических связей: ковалентная, ионная, металлическая, водородная. Механизмы образования ковалентной связи: обменный и донорно-акцепторный. Энергия связи. Потенциал ионизации, сродство к электрону, электроотрицательность. Полярность связи, индуктивный эффект. Кратные связи. Модель гибридизации орбиталей. Связь электронной структуры молекул с их геометрическим строением (на примере соединений элементов 2-го периода). Делокализация электронов в сопряженных системах, мезомерный эффект. Понятие о молекулярных орбиталях.
Кратные связи. Модель гибридизации орбиталей. Связь электронной структуры молекул с их геометрическим строением (на примере соединений элементов 2-го периода). Делокализация электронов в сопряженных системах, мезомерный эффект. Понятие о молекулярных орбиталях.
Валентность и степень окисления. Структурные формулы. Изомерия. Виды изомерии, структурная и пространственная изомерия.
Агрегатные состояния вещества и переходы между ними в зависимости от температуры и давления. Газы. Газовые законы. Уравнение Клайперона-Менделеева. Закон Авогадро, молярный объем. Жидкости. Ассоциация молекул в жидкостях. Твердые тела. Основные типы кристаллических решеток: кубические и гексагональные.
Классификация и номенклатура химических веществ. Индивидуальные вещества, смеси, растворы. Простые вещества, аллотропия. Металлы и неметаллы. Сложные вещества. Основные классы неорганических веществ: оксиды, основания, кислоты, соли. Комплексные соединения. Основные классы органических веществ: углеводороды, галоген-, кислород- и азотосодержащие вещества. Карбо- и гетероциклы. Полимеры и макромолекулы.
Основные классы органических веществ: углеводороды, галоген-, кислород- и азотосодержащие вещества. Карбо- и гетероциклы. Полимеры и макромолекулы.
Химические реакции и их классификация. Типы разрыва химических связей. Гомо- и гетеролитические реакции. Окислительно-восстановительные реакции.
Тепловые эффекты химических реакций. Термохимические уравнения. Теплота образования химических соединений. Закон Гесса и его следствия.
Скорость химической реакции. Представление о механизмах химических реакций. Элементарная стадия реакции. Гомогенные и гетерогенные реакции. Зависимость скорости гомогенных реакций от концентрации (закон действующих масс). Константа скорости химической реакции, ее зависимость от температуры. Энергия активации.
Явление катализа. Катализаторы. Примеры каталитических процессов. Представление о механизмах гомогенного и гетерогенного катализа.
Обратимые реакции. Химическое равновесие. Константа равновесия, степень превращения. Смещение химического равновесия под действием температуры и давления (концентрации). Принцип Ле Шателье.
Дисперсные системы. Коллоидные системы. Растворы. Механизм образования растворов. Растворимость веществ и ее зависимость от температуры и природы растворителя. Способы выражения концентрации растворов: массовая доля, мольная доля, молярная концентрация, объемная доля. Отличие физических свойств раствора от свойств растворителя. Твердые растворы. Сплавы.
Электролиты. Растворы электролитов. Электролитическая диссоциация кислот, оснований и солей. Кислотно-основные взаимодействия в растворах. Протонные кислоты, кислоты Льюиса. Амфотерность. Константа диссоциации. Степень диссоциации. Ионное произведение воды. Водородный показатель. Гидролиз солей. Равновесие между ионами в растворе и твердой фазой. Произведение растворимости. Образование простейших комплексов в растворах. Координационное число. Константа устойчивости комплексов. Ионные уравнения реакций.
Окислительно-восстановительные реакции в растворах. Определение стехиометрических коэффициентов в уравнениях окислительно-восстановительных реакций. Стандартные потенциалы окислительно-восстановительных реакций. Ряд стандартных электродных потенциалов. Электролиз растворов и расплавов. Законы электролиза Фарадея.
Часть II. Элементы и их соединения.
Неорганическая химия
Абитуриенты должны на основании Периодического закона давать сравнительную характеристику элементов в группах и периодах. Характеристика элементов включает: электронные конфигурации атома; возможные валентности и степени окисления элемента в соединениях; формы простых веществ и основные типы соединений, их физические и химические свойства, лабораторные и промышленные способы получения; распространенность элемента и его соединений в природе, практическое значение и области применения соединений. При описании химических свойств должны быть отражены реакции с участием неорганических и органических соединений (кислотно-основные и окислительно-восстановительные превращения), а также качественные реакции.
Водород. Изотопы водорода. Соединения водорода с металлами и неметаллами. Вода. Пероксид водорода.
Галогены. Галогеноводороды. Галогениды. Кислородсодержащие соединения хлора.
Кислород. Оксиды и пероксиды. Озон.
Сера. Сероводород, сульфиды, полисульфиды. Оксиды серы (IV) и (VI). Сернистая и серная кислоты и их соли. Эфиры серной кислоты. Тиосульфат натрия.
Азот. Аммиак, соли аммония, амиды металлов, нитриды. Оксиды азота. Азотистая и азотная кислоты и их соли. Эфиры азотной кислоты.
Фосфор. Фосфин, фосфиды. Окисды фосфора (III) и (V). Галогениды фосфора. Орто-, мета- и дифосфорная кислоты. Ортофосфаты. Эфиры фосфорной кислоты.
Углерод. Изотопы углерода. Простейшие углеводороды: метан, этилен, ацетилен. Карбиды кальция, алюминия и железа. Оксиды углерода (II) и (IV). Карбонилы переходных металлов. Угольная кислота и ее соли.
Кремний. Силан. Силицид магния. Оксид кремния (IV). Кремнивые кислоты, силикаты.
Бор. Трифторид бора. Орто- и тетраборная кислоты. Тетраборат натрия.
Благородные газы. Примеры соединений криптона и ксенона.
Щелочные металлы. Оксиды, пероксиды, гидроксиды и соли щелочных металлов.
Щелочноземельные металлы, бериллий, магний: их оксиды, гидроксиды и соли. Представление о магнийорганических соединениях (реактив Гриньяра).
Алюминий. Оксид, гидроксид и соли алюминия. Комплексные соединения алюминия. Представления об алюмосиликатах.
Медь, серебро. Оксиды меди (I) и (II), оксид серебра (I). Гидрооксид меди (II). Соли серебра и меди. Комплексные соединения серебра и меди.
Цинк, ртуть. Оксиды цинка и ртути. Гидроксид цинка и его соли.
Хром. Оксиды хрома (II), (III) и (VI). Гидрооксиды и соли хрома (II) и (III). Хроматы и дихроматы (VI). Комплексные соединения хрома (III).
Марганец. Оксиды марганца (II) и (IV). Гидрооксид и соли марганца (II). Манганат и перманганат калия.
Железо, кобальт, никель. Оксиды железа (II), (II)-(III) и (III). Гидроксиды и соли железа (II) и (III). Ферраты (III) и (VI). Комплексные соединения железа. Соли и комплексные соединения кобальта (II) и никеля (II).
Органическая химия
Характеристика каждого класса органических соединений включает: особенности электронного и пространственного строения соединений данного класса, закономерности изменения физических и химических свойств в гомологическом ряду, номенклатуру, виды изомерии, основные типы химических реакций и их механизмы. Характеристика конкретных соединений включает физические и химические свойства, лабораторные и промышленные способы получения, области применения. При описании химических свойств необходимо учитывать реакции с участием как радикала, так и функциональной группы.
Структурная теория как основа органической химии. Углеродный скелет. Функциональная группа. Гомологические ряды. Изомерия: структурная и пространственная. Представление об оптической изомерии. Взаимное влияние атомов в молекуле. Классификация органических реакций по механизму и заряду активных частиц.
Алканы и циклоалканы. Конформеры.
Алкены и циклоалкены. Сопряженные диены.
Алкины. Кислотные свойства алкинов.
Ароматические углеводороды (арены). Бензол и его гомологи. Стирол. Реакции ароматической системы и углеводородного радикала. Ориентирующее действие заместителей в бензольном кольце (ориентанты I и II рода). Понятие о конденсированных ароматических углеводородах.
Галогенопроизводные углеводородов: алкил-, арил-, и винилгалогениды. Реакции замещения и отщепления.
Спирты простые и многоатомные. Первичные, вторичные и третичные спирты. Фенолы. Простые эфиры.
Карбонильные соединения: альдегиды и кетоны. Предельные, непредельные и ароматические альдегиды. Понятие о кето-енольной таутомерии.
Карбоновые кислоты. Предельные, непредельные и ароматические кислоты. Моно- и дикарбоновые кислоты. Производные карбоновых кислот: соли, ангидриды, галогенангидриды, сложные эфиры, амиды. Жиры.
Нитросоединения: нитрометан, нитробензол.
Амины. Алифатические и ароматические амины. Первичные, вторичные и третичные амины. Основность аминов. Четвертичные аммониевые соли и основания.
Галогензамещенные кислоты. Оксикислоты: молочная, винная и салициловая кислоты. Аминокислоты: глицин, аланин, цистеин, серин, фенилаланин, тирозин, лизин, глутаминовая кислота. Пептиды. Представление о структуре белков.
Углеводы. Моносахариды: рибоза, дезоксирибоза, глюкоза, фруктоза. Циклические формы моносахаридов. Понятие о пространственных изомерах углеводов. Дисахариды: целлобиоза, мальтоза, сахароза. Полисахариды: крахмал, целлюлоза.
Пиррол. Пиридин. Пиримидиновые и пуриновые основания, входящие в состав нуклеиновых кислот. Представление о структуре нуклеиновых кислот.
Реакции полимеризации и поликонденсации. Отдельные типы высокомолекулярных соединений: полиэтилен, полипропилен, полистирол, поливинилхлорид, политетрафторэтилен, каучуки, сополимеры, фенол-формальдегидные смолы, искусственные и синтетические волокна.
Рекомендуемая литература
- Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. Современный курс для поступающих в вузы. — М.: Экзамен, 1998-2006.
- Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия для школьников старших классов и поступающих в вузы. — М.: Дрофа, 1995-2000; Мир и образование, 2004.
- Кузьменко Н.Е., Еремин В.В. 2500 задач по химии для школьников и абитуриентов. — М.: Мир и образование, 2004.
- Химия. Формулы успеха на вступительных экзаменах /Под ред. Н.Е.Кузьменко и В.И.Теренина. — М.: Изд-во Моск.университета, 2006.
- Химия: Справочные материалы / Под ред. Ю.Д.Третьякова. — М.: Астрель, 2002.
- Еремина Е.А., Рыжова О.Н. Краткий справочник по химии для школьников. — М.: Мир и образование, 2002-2006.
- Химия. Большой справочник для школьников и поступающих в ВУЗы. — М.: Дрофа, 1999-2001.
- Кузьменко Н.Е., Еремин В.В., Чуранов С.С. Сборник конкурсных задач по химии. — М.: Экзамен, 2001, 2002, 2205.
- Фримантл М. Химия в действии. В 2-х ч. — М.: Мир, 1991, 1998.
- Еремин В.В., Дроздов А.А., Кузьменко Н.Е., Лунин В.В. Учебник по химии для 8-9 классов общеобразовательных школ. — М.: Мир и образование, 2004-2006.
Презентация «Закон сохранения массы веществ
Слайды и текст этой онлайн презентации
Слайд 1
Урок по химии для учащихся 8 класса.
Учитель МБОУ «ООШ» г. Кирсанова: Е.А. Гвоздева.
Закон сохранения массы веществ.
Химические уравнения.
Слайд 2
1789г.
Роберт Бойль
1673г.
1748г.
М. В. Ломоносов
Антуан Лавуазье
Слайд 3
История открытия закона
Бойль проделал множество опытов по прокаливанию металлов в запаянных ретортах и всякий раз масса окалины оказывалась больше массы прокаливаемого металла.
Слайд 4
История открытия закона
Русский учёный М.В. Ломоносов предположил, что чувственный опыт обманывает нас. 5 июля 1748 года он написал в письме Леонарду Эйлеру: «Все перемены в натуре случающиеся такого суть состояния, что сколько чего у одного тела отнимется, столько же присовокупится к другому.»
Слайд 5
М.В Ломоносов сформулировал закон сохранения массы в 1748 г., а экспериментально подтвердил в 1756 г.
Закон сохранения массы показывает, что масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате химической реакции.
История открытия закона
m (исходных веществ) = m (продуктов реакции)
Слайд 6
История открытия закона
Значительно позже этот
закон, независимо от
М.В. Ломоносова, был
открыт французским
ученым А.Лавуазье.
Слайд 7
Химические уравнения
Химическое уравнение – условная запись химической реакции с помощью химических формул и коэффициентов
С точки зрения атомно-молекулярного учения этот закон объясняется тем, что при химических реакциях общее количество атомов не изменяется, а происходит лишь их перегруппировка.
Исходные вещества, принимающие участие в химических реакциях называются реагентами.
Новые вещества, образующиеся в результате химической реакции называются продуктами.
Слайд 8
Алгоритм составления уравнений
1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – h3; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку:
P + O2 →
2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов:
P + O2 → P2O5
Слайд 9
Алгоритм составления уравнений
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
Вначале уравнивают число атомов, которых в реагирующих веществах (продуктах) содержится больше.
Находим коэффициенты путём деления наименьшего кратного на число атомов данного вида, полученные цифры ставим в уравнение реакции:
4P + 5O2 = 2P2O5
Слайд 10
Закрепление
1. Cu + O2 CuO
2. HCl h3 +Cl2
3. Ag2O + C Ag +CO2
4. ZnO + HNO3 Zn(NO3)2 + h3O
Слайд 11
Домашнее задание:§ 26-27,
№ 1-3 стр. 145.
Закон сохранения массы веществ Химические уравнения
Закон сохранения массы веществ. Химические уравнения [c.21]Для решения большинства химических задач ключевым этапом является расчет по уравнению химической реакции. Сам процесс расчета может проводиться несколькими незначительно отличающимися друг от друга способами, но принципы, позволяющие производить подобные действия, остаются одинаковыми для всех случаев. В основе расчетов по уравнениям химических реакций лежит закон сохранения массы вещества при химических превращениях. Современную формулировку зтого закона можно представить следующим образом [c.249]
Закон сохранения массы вещества. Расстановка коэффициентов в уравнениях химических реакций. Расчеты по уравнениям химических реакций [c.249]
Закон сохранения массы веществ, находящихся в реакторе и участвующих в химических реакциях, приводит к совокупности уравнений материального баланса. Каждое из.них представляет собой дифференциальное уравнение, определяющее скорость изменения концентрации какого-либо реагента. [c.16]
Вследствие незначительности энергетических эффектов химических реакций изменение массы в результате реакции практически равно нулю. Поэтому сумма масс веществ с обеих сторон уравнения должна быть одной и той же (закон сохранения массы при химических реакциях). [c.365]
Химические уравнения. Закон сохранения массы веществ. Расчеты по химическим уравнениям [c.19]
ХИМИЧЕСКИЕ УРАВНЕНИЯ — запись химических реакции с помощью химических формул и численных коэффициентов в соответствии с законом сохранения массы вещества при химических превращениях. X. у. лежат в основе расчетов, связанных с данной реакцией. [c.274]
Для составления уравнения окислительно-восстановительной реакции необходимо прежде всего знать химические формулы исходных и получающихся веществ. Исходные вещества мы знаем, а продукты реакции устанавливаются либо экспериментально, либо на основании известных свойств элементов. В левой и правой частях уравнения реакции должно быть одинаковое число одних и тех же атомов. Следовательно, правильно записанная реакция является выражением закона сохранения массы вещества. Согласно закону эквивалентов вещества всегда соединяются между собой или замешают друг друга в определенных весовых соотношениях, соответствующих их эквивалентам. [c.115]
Химические реакции изображаются химическими уравнениями. Химические уравнения отражают закон сохранения массы веществ и изображаются посредством химических формул и химических знаков. Каждое уравнение состоит из двух частей, соединенных знаком равенства. В левой части пишут формулы веществ, вступающих в реакцию, в правой — формулы веществ, образующихся в результате реакции. Число атомов каждого элемента в левой и правой частях уравнения должно быть одинаковым. [c.24]
Подобные уравнения составляются на основе закона сохранения массы веществ и показывают количественные соотношения веществ, участвующих в химической реакции, В том случае, если указывается, какое количество молей веществ участвует в реакции и какое количество энергии при этом выделяется (поглощается), говорят о термохимических уравнениях реакций (см. гл. V). [c.167]
Следует помнить, что каждое химическое уравнение не только-несет информацию о качественном составе веществ, принимающих участие в реакции, но и отражает закон сохранения массы веществ, и дает представление о количественных отношениях масс веществ, формулы которых записаны б уравнении для каждой реакции масса вещ еств, вступающих в реакцию, равна массе веществ, образующихся в результате ее. [c.25]
Расчеты в аналитической химии базируются на законах сохранения массы веществ, постоянства состава и эквивалентов. Для проведения любых расчетов надо помнить следующее а) уравнения реакций характеризуют химические превращения также и с количественной стороны б) масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции [c.158]
Расчеты по химическим уравнениям (стехиометрические расчеты) основаны на законе сохранения массы веществ. Однако в реальных химических процессах из-за неполного протекания реакции и различных потерь веществ масса образующихся продуктов часто бывает меньше той, которая должна образоваться в соответствии с законом сохранения массы веществ. Выход продукта реакции (или массовая доля выхода) — это выраженное в процентах отношение массы реально полученного продукта к его массе, которая должна образоваться в соответствии с теоретическим расчетом, т. е. [c.18]
В полученном уравнении число атомов каждого элемента в левой части равно числу тех же атомов в правой. Это означает, что это уравнение удовлетворяет закону сохранения массы веществ (см. 1.9), следовательно, написано правильно . Коэффициенты перед формулами веществ в уравнениях химических реакций называют стехиометриче-скими коэффициентами. [c.16]
В левую часть уравнения записывают вещества, вступающие в химическую реакцию (исходные вещества), а в правую- вещества, образующиеся в результате реакции (продукты реакции), причем число атомов каждого элемента в левой части уравнения должно быть равно числу атомов этого элемента в правой части (закон сохранения массы веществ). [c.15]
Закон сохранения массы веществ дает материальную основу для составления уравнений химических реакций. Опираясь на него, можно производить расчеты по химическим уравнениям (см. 1.12). [c.21]
Знание закона сохранения массы веществ помогает составлять уравнения химических реакций и производить по ним расчеты. Так, запись [c.18]
Составление уравнений химических реакций и расчеты по ним основываются на законе сохранения массы веществ М. В. Ломоносова. [c.21]
Закон сохранения массы веществ доказан экспериментально. Опираясь на этот закон, можно составлять химические уравнения и по ним производить расчеты. [c.18]
Химические уравнения — запись химических реакций при помощи химических формул и численных коэффициентов в соответствии с законом сохранения массы вещества. X. у. позволяют производить необходимые расчеты, связанные с данной реакцией. [c.148]
При химических реакциях атомы не исчезают и не возникают вновь общее число атомов остается постоянным до и после реакции. И, поскольку атомы имеют постоянную массу, не меняется и масса веществ до и после реакции. Закон сохранения массы веществ М, В. Ломоносов связывал с законом сохранения энергии (количества движения) и рассматривал эти законы в единстве как всеобщий закон природы. Закон сохранения массы веществ дает материальную основу для составления уравнений химических реакций. Опираясь на него, производят расчеты по химическим уравнениям. [c.36]
Запись химической реакции посредством химических формул называют химическим уравнением. Составление химических уравнений основано на использовании основных законов химии, в том числе закона сохранения массы веществ прн химической реакции и закона постоянства состава. [c.31]
Эго означает, что масса образовавшейся воды равна не 18 кг, как следует из уравнения реакции, а 18 — 2,68 10 кг. Такие отступления от закона сохранения массы вещества экспериментально измерить невозможно (массы очень малы) и в химических реакциях они не учитываются. [c.13]
И в этом случае оно также будет правильным, так как соблюдается закон сохранения массы веществ. В химических уравнениях коэффициент 1 обычно опускается. [c.16]
Чтобы записать химическое уравнение, нужно привести его в соответствие с законом сохранения массы веществ. Количество ато- [c.24]
Химические уравнения составляются на основании закона сохранения массы веществ, с учетом валентности элементов в формулах молекул реагирующих веществ и продуктов реакции. [c.51]
По закону сохранения массы при химической реакции масса исходных веществ равна массе конечных продуктов, что записывается уравнением [c.148]
Расчеты в фотометрическом анализе в большинстве случаев выполняют с использованием основного закона светопоглош,ения, закона действуюш,их масс и закона сохранения массы вещества. Обстоятельные расчеты, связанные с различными вопросами фотометрического анализа и аналитического определения веществ, описаны в монографии Н. П. Комаря [405] и книге Л. П. Адамовича [404]. В монографии Батлера [406], посвященной математическому описанию ионных равновесий, изложены методика составления и способы решения системы уравнений. В предлагаемом ниже материале приведены некоторые приемы и способы расчета ионных равновесий, основанные на применении вышеназванных химических законов с использованием условных констант. Там же даны различные примеры приближенных расчетов, которые, несмотря на упрощающие допущения, позволяют получать вполне удовлетворительные результаты. [c.330]
Уже в самом начале при изучении химии вам нужно было вычислить количество продуктов, образующихся из данного количества исходных веществ. Используя закон сохранения массы веществ при химических реакциях и учение об атомно-молекулярном строении вещества, вы составляете уравнения химических реакций и проводите эти вычисления. Они являются отправными и во всех инженерно-химических расчетах, так как позволяют определить потолок — стехиометрический выход продукта (стехиометрический — вычисленный по уравнению химической реакции). Эти вычисления можно вести в единицах количества вещества и в обычных единицах [c.32]
Предельно возможное количество продукта, образующегося из исходных веществ, определяется законом сохранения массы веществ при химической реакции и вычисляется на основе ее стехиометрического уравнения. Это так называемый стехиомет-рический выход. Однако практический выход продукта в химическом реакторе всегда меньше стехиометрического. [c.451]
Реакция подчиняется закону сохранения массы вещества. Количества атомов каждого элемента при химической реакции остаются постоянными. Поэтому в правильно составленном уравнении число атомов каждого элемента слева и справа от знака равенства должно быть одинаковым, как и общее число атомов в левой и правой частях его. [c.31]
Расчеты по химическим уравнениям (стехиометрические расчёты) основаньг на законе сохранения массы веществ. Каждая формула в уравнении выражает [c.7]
Химическое уравнение составляют на основе закона сохранения массы веществ, т. е. исходя из того, что число атомов каждого элемента в левой и правой частях уэав-нения должно быть одинаковым. Для этого перед ( )ор-мулами веществ ставят коэффициенты. [c.22]
Закон сохранения массы веществ, находящихся в реакторе и участвующих в химических реакциях, приводит к совокупности уравнений материального баланса. Каждое из них представляет собой дифференциальное уравнение, определятощее скорость изменения концетрации какого-либо реагента. В случае, когда можно пренебречь изменением объема реагирующей смеси и термодиффузионным переносом массы, общее уравнение материального баланса записывается в виде [c.552]
Интересно отметить, что формулы окислов металлов принимались, как правило, состоящими из атомов металла и одного атома кислорода. Поэтому атомные веса одковалептпых металлов, как видно из приведенной выше таблицы атомных весов, вдвое больше, чем принятые в настоящее время. Просмотр различных руководств по химии, вышедших в конце XVIII века и почти до конца первой половины XIX века, показал, что закон сохранения массы вещества, хотя и был известен, но о нем упоминалось только вскользь. При этом до Гесса ни в одном учебнике не применялись химические уравнения. Гесс, особенно в последних изданиях своего учебника Основания чистой химии , широко пользовался химическими уравнениями, не придавая им, однако, того количественного значения, которое придается им ныне. [c.193]
Принцип сохранения массы — обзор
8.4 Расчет трехфазного равновесия
Двух- и трехфазное равновесие часто возникает во время обработки углеводородов и связанных систем. Пенг и Робинсон (1976b) [42] предложили схему расчета трехфазного равновесия для систем, которые имеют богатую водой жидкую фазу, богатую углеводородами жидкую фазу и паровую фазу.
Применение принципа сохранения массы к 1 моль воды-углеводорода в трехфазном состоянии термодинамического равновесия при фиксированной температуре T и давлении p дает
(8-12) nL + nw + nv = 1
(8-13) nLxi + nwxwi + nvyi = zi
(8-14) ∑inxi = ∑i = 1nxwi = ∑i = 1nyi = ∑i = 1nzi = 1
, где n L , n w , n v = количество молей богатой углеводородами жидкости, богатой водой жидкости и пара, соответственно
x i , x wi , y i = мольная доля компонента i в жидкости, богатой углеводородами, жидкости, богатой водой, и паре соответственно.
Равновесные отношения между составами каждой фазы определяются следующими выражениями:
(8-15) Ki = yixi = ΦiLΦiv
и
(8-16) Kwi = yixwi = ΦiwΦiv
где K i = равновесное соотношение компонента i между паром и жидкостью, богатой углеводородами
K wi = равновесное соотношение компонента i между паром и жидкостью, богатой водой
ΦiL = коэффициент летучести компонента i в жидкости, богатой углеводородами
Φiv = коэффициент летучести компонента i в паровой фазе
Φiw = коэффициент летучести компонента i в жидкости, богатой водой
Комбинирование уравнений с 8-12 по 8 -16 дает следующие обычные нелинейные уравнения:
(8-17) ∑i = 1xi = ∑i = 1 [zinL (1 − Ki) + nw (KiKwi − Ki) + Ki] = 1
(8-18 ) ∑i = 1xwi = ∑i = 1 [zi (Ki / Kwi) nL (1 − Ki) + nw (KiKwi − Ki) + Ki] = 1
(8- 19) ∑i = 1yi = ∑i = 1 [ziKinL (1 − Ki) + nw (KiKwi − Ki) + Ki] = 1
Предполагая, что равновесные отношения между фазами можно вычислить, эти уравнения объединяются для решения два неизвестных n L и n v , и, следовательно, x i , x wi и y i .Именно природа конкретного расчета равновесия определяет подходящую комбинацию уравнений с 8-17 по 8-19. Комбинация этих трех выражений может затем использоваться для определения фазовых и объемных свойств трехфазной системы.
Существует три основных типа расчетов фазового поведения для трехфазной системы:
- 1.
Прогнозирование точки пузырька.
- 2.
Прогноз точки росы.
- 3.
Расчет Flash.
Пенг и Робинсон (1980) [43] предложили следующие схемы комбинирования уравнений с 8-17 по 8-19.
- •
Для определения давления точки кипения .
∑ixi − ∑ixwi = 0 [∑iyi] −1 = 0
Подстановка уравнений с 8-17 по 8-19 в это соотношение дает
(8-20) f (nL, nw) = ∑i [zi (1-Ki / Kwi) nL (1-Ki) + nw (Ki / Kwi-Ki) + Ki] = 0
и
(8-21) g (nL, nw) = ∑i [ziKinL (1 − Ki) + nw (Ki / Kwi − Ki) + Ki] −1 = 0
- •
Для давления точки росы .
∑ixwi − ∑iyi = 0 [∑ixi] −1 = 0
Объединение с уравнениями с 8-17 по 8-19 дает
(8-22) f (nL, nw) = ∑i [ziKi (1 / Kwi − 1) nL (1 − Ki) + nw (Ki / Kwi − Ki) + Ki] = 0
и
(8-23) g (nL, nw) = ∑i [zinL (1 −Ki) + nw (Ki / Kwi − Ki) + Ki] −1 = 0
- •
Для расчетов вспышки .
∑ixi − ∑iyi = 0 [∑ixwi] −1 = 0
или
(8-24) f (nL, nw) = ∑i [zi (1 − Ki) nL (1 − Ki) ) + nw (Ki / Kwi − Ki) + Ki] = 0
и
(8-25) g (nL, nw) = ∑i [ziKi / KwinL (1 − Ki) + nw (Ki / Kwi− Ki) + Ki] -1.0 = 0
Обратите внимание, что при выполнении любого из этих прогнозов свойств у нас всегда есть две неизвестные переменные, n L и n w , и между ними два уравнения. При условии, что равновесные отношения и общий состав известны, уравнения могут быть решены одновременно с использованием соответствующей итерационной техники, например, метода Ньютона-Рафсона. Применение этого итеративного метода для решения уравнений 8-24 и 8-25 кратко описывается в следующих шагах.
- Шаг 1.
Принять начальные значения для неизвестных переменных n L и n w .
- Шаг 2.
Вычислите новые значения n L и n w , решив следующие два линейных уравнения:
[nLnw] new = [nLnw] — [∂f / ∂nL∂f / ∂nw∂g / ∂nL∂g / ∂nw] −1 [f (nL, nw) g (nL, nw)]
, гдеf (n L , n w ) = значение функция f (n L , n w ), как выражено уравнением 8-24
g (n L , n w ) = значение функции g (n L , n w ), выраженное уравнением 8-25
Первая производная этих функций по n L и n w задается следующими выражениями:
(∂f / ∂nL) = ∑i = 1 [−zi (1 − Ki) 2 [nL (1 − Ki) + nw (Ki / Kwi − Ki) + Ki] 2] (∂f / ∂nw) = ∑i = 1 [−zi (1 − Ki) (Ki / Kwi − Ki) [nL (1 − Ki) + nw (Ki / Kwi − Ki) + Ki] 2] (∂g / ∂nL) = ∑i = 1 [−zi (Ki / Kwi) (1 − Ki) [nL (1 − Ki) + nw (Ki / Kwi − Ki) + Ki] 2] (∂g / ∂nw) = ∑i = 1 [−zi (KiKwi) (Ki / Kwi-Ki) [nL (1-Ki) + nw (Ki / Kwi-Ki) + Ki] 2]
- 9008 9 Шаг 3.
Новые вычисленные значения n L и n w затем сравниваются с начальными значениями. Если никаких изменений в значениях не наблюдается, то были получены правильные значения n L и n w . В противном случае предыдущие шаги повторяются с новыми вычисленными значениями, используемыми в качестве начальных значений.
Пенг и Робинсон (1980) [43] предложили две модификации при использовании их уравнения состояния для расчетов трехфазного равновесия.Первая модификация касается использования параметра α, выраженного уравнением 7-68 для соединения воды. Пенг и Робинсон предположили, что, когда приведенная температура этого соединения меньше 0,85, применяется следующее уравнение:
(8-26) α = [1,0085677 + 0,82154 (1-Tr0,5)] 2
, где T r — приведенная температура (T / T c ) H 2 O водной составляющей.
Вторая модификация касается применения уравнения 7-38 для богатой водой жидкой фазы.Коэффициент бинарного взаимодействия, зависящий от температуры, был введен в уравнение, чтобы дать
(8-27) (aα) m = ∑i∑j [xwixwj (aiajαiαj) 0,5 (1 − τij)]
, где τ ij — температурно-зависимый коэффициент бинарного взаимодействия. Пенг и Робинсон предложили графические корреляции для определения этого параметра для каждой водной двойной пары. Lim et al. (1984) [31] математически выразили эти графические корреляции следующим обобщенным уравнением:
(8-28) τij = a1 [TTci] 2 [pcipcj] 2 + a2 [TTci] [pcipcj] + a3
где T = температура системы, ° R
T ci = критическая температура интересующего компонента, ° R
p ci = критическое давление интересующего компонента, psia
p cj = критическое давление водного соединения, psia
Значения коэффициентов a 1 , a 2 и 3 предыдущего полинома для выбранных двоичных файлов:
| Компонент i | a 1 | a 2 | a 3 |
|---|---|---|---|
| C 1 | 0 | 1.659 | −0,761 |
| C 2 | 0 | 2,109 | −0,607 |
| C 3 −0328 | −18,032 | 9030 | 4 | 0 | 2,800 | −0,488 |
| n — C 6 | 49,472 | −5,783 | −0,152 |
Для заданных значений параметров неуглеродного взаимодействия компонентов следующие выражения:
- •
Для N 2 -H 2 O двоичный .
(8-29) τij = 0,402 (T / Tci) −1,586
где τ ij = бинарный параметр между азотом и водным соединением
T ci = критическая температура азота, ° R
- •
Для CO 2 -H 2 O двоичный .
(8-30) τij = -0,074 [TTci] 2 + 0,478 [TTci] -0,503
, где T ci — критическая температура CO 2 .
В ходе расчетов фазового равновесия всегда желательно предоставлять начальные значения для равновесных соотношений, чтобы итерационная процедура могла протекать как можно надежнее и быстрее.Пенг и Робинсон (1980) [43] использовали корреляцию равновесного отношения Вильсона, чтобы получить начальные значения K для углеводородно-паровой фазы:
Ki = pci / pexp [5,3727 (1 + ωi) (1-Tci / T)]
Для фазы водяного пара Пэн и Робинсон предложили следующее выражение:
Kwi = 106 [pciT / (Tcip)]
3,7: Сохранение массы — нет новой материи
- Последнее обновление
- Сохранить как PDF
- Закон сохранения массы
- Резюме
- Взносы и атрибуция
Может показаться, что горение разрушает материю, но такое же количество или масса материи все еще существует после костра, как и раньше.Посмотрите на рисунок \ (\ PageIndex {1} \) ниже. Он показывает, что когда дерево горит, оно соединяется с кислородом и превращается не только в золу, но также в углекислый газ и водяной пар. Газы уносятся в воздух, оставляя после себя только пепел. Предположим, вы измерили массу древесины до того, как она сгорела, и массу золы после того, как она сгорела. Также предположим, что вы смогли измерить кислород, используемый огнем, и газы, выделяемые огнем. Что бы вы нашли? Общая масса вещества после пожара будет равна общей массе вещества до пожара.
Рисунок \ (\ PageIndex {1} \): Горение — это химический процесс. Пламя возникает в результате сгорания топлива. (CC BY-SA 2.5; Эйнар Хелланд Бергер за огонь и Вальтер Зигмунд за пепел).Закон сохранения массы
Закон сохранения массы был создан в 1789 году французским химиком Антуаном Лавуазье. Закон сохранения массы гласит, что материя не может быть создана или разрушена в результате химической реакции. Например, когда горит древесина, масса сажи, золы и газов равна исходной массе древесного угля и кислорода, когда они впервые прореагировали.Таким образом, масса продукта равна массе реагента. Реагент — это химическая реакция двух или более элементов с образованием нового вещества, а продукт — это вещество, которое образуется в результате химической реакции (Видео \ (\ PageIndex {1} \)). Материя и соответствующая ей масса не могут быть созданы или разрушены, но могут изменить форму на другие вещества, такие как жидкости, газы и твердые тела.
Видео \ (\ PageIndex {1} \): это красивая небольшая демонстрация, показывающая сохранение массы в действии.Если вы станете свидетелем сгорания дотла 300-килограммового дерева, после сожжения останется только пепел, и все они вместе весят 10 кг. Это может заставить вас задуматься, куда делись остальные 290 кг. Недостающие 290 кг были выброшены в атмосферу в виде дыма, поэтому единственное, что вы можете увидеть, это 10 кг золы. Если вы знаете закон сохранения массы, то вы знаете, что остальные 290 кг должны куда-то уйти, потому что они должны равняться массе дерева до того, как оно сгорело.
Пример \ (\ PageIndex {1} \)
Если отопление 10.0 граммов карбоната кальция (CaCO 3 ) дает 4,4 г диоксида углерода (CO 2 ) и 5,6 г оксида кальция (CaO), что показывает, что эти наблюдения согласуются с законом сохранения массы.
Решение
\ [\ begin {align *} \ text {Масса реагентов} & = \ text {Масса продуктов} \\ [4pt] 10.0 \, \ text {g of} \ ce {CaCO3} & = 4.4 \ , \ text {g of} \ ce {CO2} + 5.6 \, \ text {g of} \ ce {CaO} \\ [4pt] 10.0 \, \ text {g of реагент} & = 10.0 \, \ text {g of products} \ end {align *} \]
Поскольку масса реагента равна массе продуктов, наблюдения согласуются с законом сохранения массы.
Упражнение \ (\ PageIndex {1} \)
Гидроксид калия (\ (\ ce {KOH} \)) легко реагирует с диоксидом углерода (\ (\ ce {CO2} \)) с образованием карбоната калия (\ (\ ce {K2CO3} \)) и воды (\ ( \ ce {h3O} \)). Сколько граммов карбоната калия получается, если 224,4 г \ (\ ce {KOH} \) вступает в реакцию с 88?0 г \ (\ ce {CO2} \)? В результате реакции также образуется 36,0 г воды.
- Ответить
- 276,4 г карбоната калия
Закон также применим как к химическим, так и к физическим изменениям. Например, если у вас есть кубик льда, который плавится в жидкость, и вы нагреваете эту жидкость, она превращается в газ. Кажется, что он исчез, но все еще там.
Сводка
- Горение и другие изменения материи не разрушают материю.
- Масса вещества всегда одна и та же до и после изменений.
- Закон сохранения массы гласит, что материя не может быть создана или уничтожена.
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или широко) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Закон сохранения массы: определение, формула, история (с примерами)
Обновлено 22 декабря 2020 г.
Кевин Бек
Один из великих определяющих принципов физики состоит в том, что многие из ее важнейших свойств неуклонно подчиняются важный принцип: при легко определяемых условиях они сохраняются , это означает, что общее количество этих количеств, содержащихся в выбранной вами системе, никогда не изменяется.
Четыре общие величины в физике характеризуются применимыми к ним законами сохранения. Это энергия , импульс , угловой момент и масса . Первые три из них являются величинами, часто специфичными для задач механики, но масса универсальна, и открытие — или, так сказать, демонстрация — того, что масса сохраняется, одновременно подтверждая некоторые давние подозрения в мире науки, было жизненно важным для доказательства. .
Закон сохранения массы
Закон сохранения массы гласит, что в закрытой системе (включая всю вселенную) масса не может быть ни создана, ни уничтожена химическими веществами. или физические изменения.Другими словами, общая масса всегда сохраняется . Дерзкий изречение «Что входит, должно выходить!» кажется буквальным научным трюизмом, поскольку никогда не было доказано, что ничто просто не исчезает без каких-либо физических следов.
Все компоненты всех молекул в каждой клетке кожи, которую вы когда-либо сбрасывали, с их атомами кислорода, водорода, азота, серы и углерода, все еще существуют. Точно так же, как мистическое фантастическое шоу «Секретные материалы » заявляет об истине, вся масса, которая когда-либо существовала, находится «где-то где-то ».«
Вместо этого его можно было бы назвать« законом сохранения материи », потому что в отсутствие гравитации в особо« массивных »объектах нет ничего особенного в мире; подробнее об этом важном различии следует ниже, поскольку его значимость трудно переоценить.
История закона сохранения массы
Открытие закона сохранения массы было сделано в 1789 году французским ученым Антуаном Лавуазье; другие выдвигали эту идею раньше, но Лавуазье был первым, кто это доказал.
В то время преобладающее мнение в химии об атомной теории все еще исходило от древних греков, и благодаря более поздним идеям считалось, что что-то внутри огня (« флогистон ») на самом деле было веществом. . По мнению ученых, это объясняет, почему куча пепла легче того, что было сожжено для образования пепла.
Лавуазье нагрел оксид ртути и заметил, что количество уменьшенного веса химического вещества было равно весу газообразного кислорода, высвободившегося в химической реакции.
Прежде чем химики смогли объяснить массу вещей, которые было трудно отслеживать, таких как водяной пар и следовые газы, они не могли адекватно проверить какие-либо принципы сохранения материи, даже если они подозревали, что такие законы действительно действуют.
В любом случае это привело Лавуазье к утверждению, что материя должна сохраняться в химических реакциях, что означает, что общее количество вещества на каждой стороне химического уравнения одинаково. Это означает, что общее количество атомов (но не обязательно общее количество молекул) в реагентах должно равняться количеству в продуктах, независимо от природы химического изменения.
- « Масса продуктов в химических уравнениях равна массе реагентов » является основой стехиометрии или процесса учета, с помощью которого химические реакции и уравнения математически уравновешиваются с точки зрения массы и количество атомов с каждой стороны.
Обзор сохранения массы
Одна из трудностей, с которыми люди могут столкнуться с законом сохранения массы, состоит в том, что пределы ваших чувств делают некоторые аспекты закона менее интуитивными.
Например, когда вы съедите фунт еды и выпьете фунт жидкости, вы можете весить столько же шесть или около того часов спустя, даже если не пойдете в туалет. Отчасти это связано с тем, что соединения углерода в пище превращаются в углекислый газ (CO 2 ) и постепенно выдыхаются в виде пара (обычно невидимого) при дыхании.
По своей сути, как химическая концепция, закон сохранения массы является неотъемлемой частью понимания физической науки, включая физику. Например, в задаче об импульсе о столкновении мы можем предположить, что полная масса в системе не изменилась с той, которая была до столкновения, до чего-то другого после столкновения, потому что масса, такая как импульс и энергия, сохраняется.
Что еще «сохраняется» в физических науках?
Закон сохранения энергии гласит, что полная энергия изолированной системы никогда не изменяется, и это можно выразить разными способами. Один из них — KE (кинетическая энергия) + PE (потенциальная энергия) + внутренняя энергия (IE) = константа. Этот закон следует из первого закона термодинамики и гарантирует, что энергия, как и масса, не может быть создана или уничтожена.
- Сумма KE и PE называется механической энергией, и является постоянной в системах, в которых действуют только консервативные силы (то есть, когда энергия не «тратится впустую» в виде потерь на трение или тепла).
Импульс (m v ) и угловой момент ( L = m vr ) также сохраняются в физике, и соответствующие законы сильно определяют многое. поведения частиц в классической аналитической механике.
Закон сохранения массы: пример
При нагревании карбоната кальция, или CaCO 3 , образуется соединение кальция с выделением загадочного газа. Допустим, у вас есть 1 кг (1000 г) CaCO 3 , и вы обнаруживаете, что при нагревании остается 560 граммов соединения кальция.
Каков вероятный состав оставшегося химического вещества кальция и какое соединение образовалось в виде газа?
Во-первых, поскольку это, по сути, химическая проблема, вам нужно обратиться к периодической таблице элементов (см. Пример в разделе Ресурсы).
Вам говорят, что у вас есть начальные 1000 г CaCO 3 . Из молекулярных масс составляющих атомов в таблице вы видите, что Ca = 40 г / моль, C = 12 г / моль и O = 16 г / моль, что делает молекулярную массу карбоната кальция в целом 100 г / моль. моль (помните, что в CaCO 3 есть три атома кислорода).Однако у вас есть 1000 г CaCO 3 , что составляет 10 моль вещества.
В этом примере кальций содержит 10 молей атомов Са; поскольку каждый атом Ca составляет 40 г / моль, у вас есть 400 г Ca, которые, как вы можете смело предположить, остались после нагревания CaCO 3 . В этом примере оставшиеся 160 г (560-400) соединения после нагревания представляют 10 моль атомов кислорода. Это должно оставить 440 г массы в виде выделенного газа.
Вычисленное уравнение должно иметь вид
10 \ text {CaCO} _3 \ implies10 \ text {CaO} + \ text {?}
и знак «?» газ должен содержать углерод и кислород в некоторой комбинации; в нем должно быть 20 молей атомов кислорода — у вас уже есть 10 молей атомов кислорода слева от знака + — и, следовательно, 10 молей атомов углерода.Знак «?» — CO 2. (В современном научном мире вы слышали о двуокиси углерода, что делает эту проблему чем-то вроде тривиального упражнения. Но вспомните время, когда даже ученые даже не знали, что находится в «воздухе».)
Эйнштейн и уравнение массы-энергии
Студентов-физиков может сбить с толку знаменитое уравнение сохранения массы-энергии E = mc 2 , постулированное Альбертом Эйнштейном в начале 1900-х гг. если это противоречит закону сохранения массы (или энергии), поскольку это, кажется, подразумевает, что масса может быть преобразована в энергию и наоборот.
Ни один закон не нарушен; вместо этого закон утверждает, что масса и энергия на самом деле являются разными формами одного и того же.
Это что-то вроде измерения их в разных единицах в зависимости от ситуации.
Масса, энергия и вес в реальном мире
Вы, возможно, не можете помочь, но бессознательно приравниваете массу к весу по причинам, описанным выше — масса — это вес только тогда, когда гравитация находится в смеси, но когда в вашем опыте есть сила , а не (когда вы на Земле, а не в камере с невесомостью)?
Таким образом, трудно представить себе материю как простую материю, подобную энергии как таковой, которая подчиняется определенным фундаментальным законам и принципам.
Кроме того, точно так же, как энергия может менять форму между кинетическим, потенциальным, электрическим, тепловым и другими типами, материя делает то же самое, хотя различные формы материи называются состояниями : твердое тело, газ, жидкость и плазма.
Если вы сможете отфильтровать то, как ваши собственные органы чувств воспринимают различия в этих величинах, вы сможете понять, что реальных различий в физике немного.
Возможность связать основные концепции вместе в «точных науках» может сначала показаться трудной задачей, но в конце концов это всегда увлекательно и полезно.
Закон сохранения материи | Заявление и примеры
Закон сохранения материи в специальной теории относительности
В начале 20 века понятие массы претерпело радикальный пересмотр. Масса утратила абсолютность . Один из поразительных результатов теории относительности Эйнштейна состоит в том, что масса и энергия эквивалентны и преобразуются друг в друга. Эквивалентность массы и энергии описывается знаменитой формулой Эйнштейна E = mc 2 .Другими словами, энергия равна массе , умноженной на квадрата скорости света . Поскольку скорость света — это очень большое число, формула подразумевает, что любое небольшое количество вещества содержит очень большое количество энергии. Было замечено, что масса объекта эквивалентна энергии, может быть взаимопревращаемой с энергией и значительно возрастает при чрезвычайно высоких скоростях, близких к скорости света. Под общей энергией объекта понималась его масса покоя на , а также увеличение массы на , вызванное увеличением на кинетической энергии .
В специальной теории относительности определенные типы материи могут быть созданы или разрушены , но во всех этих процессах масса и энергия, связанные с такой материей , остаются неизменными в количестве . Было обнаружено, что масса покоя атомного ядра значительно меньше, чем сумма масс покоя составляющих его протонов, нейтронов и электронов . Масса больше не считалась неизменной в закрытой системе. Разница — это мера энергии связи ядра, которая удерживает ядро вместе.Согласно соотношению Эйнштейна ( E = mc 2 ) эта энергия связи пропорциональна этой разности масс и известна как дефект массы .
Пример: Дефект массы 63Cu
Рассчитайте дефект массы ядра 63 Cu , если фактическая масса 63 Cu в основном ядерном состоянии составляет 62, ед.63 Ядро Cu имеет 29 протонов и также имеет (63 — 29) 34 нейтрона.
Масса протона 1.00728 u , а нейтрона 1.00867 u .
Общая масса: 29 протонов x (1,00728 ед. / Протон) + 34 нейтрона x (1,00867 ед. / Нейтрон) = 63,50590 ед. / Нейтрон
Дефект массы составляет Δm = 63,50590 u — 62,
u = 0,59223 uПреобразуйте дефект массы в энергию (энергию связи ядра).
(0,59223 ед / ядро) x (1,6606 x 10 -27 кг / ед) = 9.8346 x 10 -28 кг / ядро
ΔE = Δmc 2
ΔE = (9,8346 x 10 -28 кг / ядро) x (2,9979 x 10 8 м / с) 2 = 8,8387 x 10 -11 Дж / ядро
Энергия, вычисленная в предыдущем примере, равна энергии связи ядра . Однако энергия связи ядра может быть выражена в кДж / моль (для лучшего понимания).
Рассчитайте ядерную энергию связи 1 моля 63 Cu:
(8.8387 x 10 -11 Дж / ядро) x (1 кДж / 1000 Дж) x (6.022 x 10 23 ядер / моль) = 5,3227 x 10 10 кДж / моль ядер.
Один моль 63 Cu (~ 63 грамма) связан с ядерной энергией связи (5,3227 x 10 10 кДж / моль), которая эквивалентна:
- 14,8 миллионов киловатт-часов (≈ 15 ГВт · ч)
- 336 100 галлонов США автомобильного бензина
Пример: Дефект массы активной зоны реактора
Рассчитайте дефект массы активной зоны реактора 3000 МВт -й после одного года эксплуатации.Известно, что средняя извлекаемая энергия на одно деление составляет около 200 МэВ , т.е. полная энергия за вычетом энергии энергии антинейтрино, которые излучаются.
Скорость реакции на все 3000 МВт th активная зона реактора составляет около 9,33 × 10 19 делений в секунду .
Общее выделение энергии в джоулях составляет:
200 × 10 6 (эВ) x 1,602 × 10 -19 (Дж / эВ) x 9.33 × 10 19 (с -1 ) x 31,5 × 10 6 (секунд в году) = 9,4 × 10 16 Дж / год
Дефект массы рассчитывается как:
Δm = ΔE / c 2
Δm = 9,4 × 10 16 / (2,9979 x 10 8 ) 2 = 1,046 кг
Это означает, что в типичной активной зоне реактора мощностью 3000 МВтт около 1 килограмма вещества превращается в чистую энергию.
Обратите внимание, что типичная годовая загрузка урана для активной зоны реактора мощностью 3000 МВт тепл. Т. Н. Составляет около 20 тонн из обогащенного урана (т.е.е. около 22,7 тонны UO 2 ). Вся активная зона реактора может содержать около 80 тонн обогащенного урана.
Дефект массы непосредственно из E = mc
2Дефект массы можно рассчитать непосредственно из соотношения Эйнштейна ( E = mc 2 ) как:
Δm = ΔE / c 2
Δm = 3000 × 10 6 (W = Дж / с) x 31,5 × 10 6 (секунд в году) / (2,9979 x 10 8 ) 2 = 1.051 кг
Кривая энергии связи ядра.Источник: hyperphysics.phy-astr.gsu.edu
Во время ядерного расщепления или ядерного синтеза часть массы ядра преобразуется в огромное количество энергии, и, таким образом, эта масса удаляется из общей массы исходные частицы, а масса в получившемся ядре отсутствует. Энергии связи ядер огромны, они порядка миллиона раз больше, чем энергии связи электронов атомов.
Обычно и в химических и в ядерных реакциях происходит некоторое преобразование между массой покоя и энергией, так что продукты обычно имеют меньшую или большую массу, чем реагенты. Следовательно, новый принцип сохранения — сохранение массы-энергии .
См. Также: Энергия, выделяемая при делении
Материя — создание антиматерии
Материя — антиматерия создание происходит естественным образом в высокоэнергетических процессах с участием космических лучей, а также в экспериментах с высокими энергиями на ускорителях на Земле.Космические лучи высокой энергии, падающие на атмосферу Земли (или любое другое вещество в Солнечной системе), производят мизерные количества античастиц в образующихся струях частиц, которые немедленно аннигилируют при контакте с близлежащим веществом. Присутствие образовавшегося антивещества обнаруживается двумя гамма-лучами (с энергией 511 кэВ), возникающими каждый раз, когда позитроны аннигилируют с соседним веществом.Создание антивещества также очень распространено в ядерном распаде многих изотопов. Допустим, распад калия-40 .Встречающийся в природе калий состоит из трех изотопов, из которых 40 К является радиоактивным . Следы 40 K обнаружены во всем калии, и это самый распространенный радиоизотоп в организме человека . 40 K представляет собой радиоактивный изотоп калия, который имеет очень длительный период полураспада 1,251 × 10 9 лет и претерпевает оба типа бета-распада .
- Примерно 89,28% времени (10,72% приходится на захват электронов) он распадается до кальция-40 ( 40 Ca) с испусканием бета-частицы (β —, электрон) с максимальной энергией. из 1.33 МэВ и -антинейтрино , который является -античастицей к нейтрино.
- Очень редко (0,001% времени) он распадется до 40 Ar, испуская позитрон (β +) и нейтрино.
Другой очень интересный источник антивещества — это ядерный реактор . Ядерные реакторы являются основным источником антинейтрино, генерируемых человеком. Это связано с тем, что антинейтрино образуются при отрицательном бета-распаде.В ядерном реакторе особенно происходит распад β — , потому что общей чертой осколков деления является избыток нейтронов. Обратите внимание, что миллиарды солнечных нейтрино в секунду проходят (в основном без какого-либо взаимодействия) через каждый квадратный сантиметр (~ 6 × 10 10 ) на поверхности Земли, и излучение антинейтрино никоим образом не опасно.
Наконец, дело в том, что антивещество намного больше обычного , чем может показаться.
В январе 2011 года исследования Американского астрономического общества обнаружили антивещества (позитронов) , возникающих над грозовыми облаками .Предполагается, что эти позитроны образуются в земных гамма-вспышках (TGF). Эти позитроны образуются в гамма-вспышках, создаваемых электронами, ускоренными сильными электрическими полями в облаках. TGF — это короткие всплески, возникающие во время грозы и связанные с молнией. Потоки позитронов и электронов сталкиваются выше в атмосфере, чтобы произвести больше гамма-лучей. Ежедневно во всем мире может происходить около 500 TGF, но в большинстве случаев они остаются незамеченными.
См. Также: Производство электрон-позитронных пар
См. Также: Реактор как источник антинейтрино
Материя — аннигиляция антиматерии
Когда позитрон (частица антивещества) приходит в состояние покоя, он взаимодействует с электроном, что приводит к аннигиляции обеих частиц и полному преобразованию их массы покоя в чистую энергию в виде двух противоположно направленных 0.Фотоны с энергией 511 МэВ.Как было написано, частица и ее античастица имеют одинаковую массу, но противоположный электрический заряд и другие различия в квантовых числах. Это означает, что протон имеет положительный заряд, а антипротон — отрицательный, и поэтому они притягиваются друг к другу. Известно, что столкновение любой частицы с ее партнером-античастицей приводит к их взаимной аннигиляции . Поскольку материя и антивещество несут огромное количество энергии (из-за E = mc 2 ), их взаимная аннигиляция связана с образованием интенсивных фотонов (гамма-лучей), нейтрино и иногда менее массивных частиц — пары античастиц.
Одним из наиболее известных процессов является аннигиляция электрон-позитрон . Электрон-позитронная аннигиляция происходит, когда отрицательно заряженный электрон и положительно заряженный позитрон сталкиваются. Когда низкоэнергетический электрон аннигилирует низкоэнергетический позитрон (античастица электрона), они могут произвести только два или более фотонов (гамма-лучи). Производство только одного фотона запрещено из-за сохранения количества движения и полной энергии. Производство другой частицы также запрещено, потому что обе частицы (электрон-позитрон) вместе не несут достаточно массы-энергии для образования более тяжелых частиц.Когда электрон и позитрон сталкиваются, они аннигилируют, что приводит к полному преобразованию их массы покоя в чистую энергию (согласно формуле E = mc 2 ) в виде двух противоположно направленных гамма-лучей (фотонов) с энергией 0,511 МэВ.
e — + e + → γ + γ (2x 0,511 МэВ)
Этот процесс должен удовлетворять ряду законов сохранения, в том числе:
- Сохранение электрического заряда. Чистая плата до и после равна нулю.
- Сохранение количества движения и полной энергии. Т
- Сохранение момента количества движения.
Закон сохранения вещества в гидродинамике
Масса не может быть ни создана, ни уничтожена.
Уравнение непрерывности — определениеЭтот принцип широко известен как принцип сохранения материи и утверждает, что масса объекта или совокупности объектов никогда не меняется со временем, независимо от того, как составные части перестраиваются.Этот принцип может быть использован при анализе текучих сред . Сохранение массы в гидродинамике утверждает, что все массовые расходы в контрольный объем равны всем массовым расходам на выходе контрольного объема плюс скорость изменения массы в контрольном объеме. Этот принцип математически выражается следующим уравнением:
ṁ дюйм = ṁ выход + ∆m ⁄ ∆t
Ввод массы в единицу времени = Уход массы в единицу времени + Увеличение массы в контрольном объеме в единицу времени
Пример расходов в реакторе.Это иллюстративный пример, данные не отражают конструкцию реактора.Это уравнение описывает нестационарный поток . Нестационарный поток относится к состоянию, при котором свойства жидкости в любой отдельной точке системы могут изменяться с течением времени. Устойчивый поток относится к состоянию, при котором свойства текучей среды (температура , давление и скорость ) в любой отдельной точке системы не меняются с течением времени . Но одним из наиболее важных свойств, которое является постоянным в системе с установившимся потоком, является массовый расход системы.Это означает, что нет накопления массы в каком-либо компоненте системы.
См. Также: Уравнение непрерывности
Уравнение непрерывности
Уравнение неразрывности — это просто математическое выражение принципа сохранения массы. Для контрольного объема, который имеет одно впускное отверстие и единственное выпускное отверстие , принцип сохранения массы гласит, что для установившегося расхода массовый расход в объем должен равняться массовому расходу на выходе.
ṁ из = ṁ из
Масса, вводимая в единицу времени = Масса, уходящая в единицу времени
Это уравнение называется уравнением неразрывности для установившегося одномерного потока. Для устойчивого потока через контрольный объем с множеством входов и выходов чистый массовый расход должен быть равен нулю, где приток отрицательный, а отток положительный.
Этот принцип может быть применен к трубке , такой как показанная выше. Никакая жидкость не течет через границу, образованную линиями тока , поэтому масса входит и выходит только через два конца этой секции обтекаемой трубки.
Когда жидкость находится в движении, она должна двигаться таким образом, чтобы сохранить массу. Чтобы увидеть, как сохранение массы накладывает ограничения на поле скорости, рассмотрим установившийся поток жидкости через канал (то есть потоки на входе и выходе не меняются со временем).
Дифференциальная форма уравнения непрерывности
Общее уравнение неразрывности можно также записать в дифференциальной форме :
∂⍴ ⁄ ∂t + ∇. (⍴ ͞v) = σ
где
- ∇.дивергенция,
- ρ — плотность количества q,
- ⍴ ͞v — поток величины q,
- σ — образование q на единицу объема в единицу времени. Термины, которые создают (σ> 0) или удаляют (σ <0) q, называются «источниками» и «стоками» соответственно. Если q - сохраняющаяся величина (например, энергия), σ равно 0.
Почему в химических реакциях сохраняется масса?
Категория: Химия Опубликовано: 21 октября 2013 г.
Каждая химическая реакция включает преобразование энергии в массу.Public Domain Image, источник: Кристофер С. Бэрд.
Масса , а не , сохраняющаяся в химических реакциях. Фундаментальный закон сохранения Вселенной — это сохранение массы-энергии. Это означает, что общая масса и энергии до реакции в закрытой системе равна общей массе и энергии после реакции. Согласно знаменитому уравнению Эйнштейна, E = mc 2 , масса может быть преобразована в энергию, а энергия может быть преобразована в массу.Это не какой-то экзотический процесс, но на самом деле происходит каждый раз, когда происходит реакция . Следовательно, масса никогда не сохраняется, потому что небольшая ее часть превращается в энергию (или небольшая часть энергии превращается в массу) в каждой реакции. Но масса + энергия всегда сохраняется. Энергия не может быть создана из ничего. Его можно создать только путем уничтожения соответствующего количества массы согласно E = mc 2 . Между массой и энергией энергия является более фундаментальным свойством.Фактически, современные физики просто считают массу альтернативной формой энергии. По этой причине они обычно не называют это «Законом сохранения массы / энергии», а скорее называют его «Законом сохранения энергии», подразумевая, что это утверждение включает массу.
В ядерных реакциях (изменения ядра атомов) выделяется или поглощается достаточно энергии, поэтому изменение массы является значительным и должно учитываться. Напротив, химические реакции (изменение только электронов в атомах) выделяют или поглощают очень мало энергии по сравнению с ядерными реакциями, поэтому изменение массы системы часто настолько мало, что им можно пренебречь.Поэтому только в качестве разумного приближения химики часто говорят о сохранении массы и используют его для уравновешивания уравнений. Но, строго говоря, изменение массы системы во время химической реакции хоть и небольшое, но никогда не равно нулю. Если бы изменение массы было в точности равным нулю, энергии не было бы откуда взяться. Химики любят говорить о «химической потенциальной энергии» и говорить так, будто энергия, выделяемая в реакции, исходит из потенциальной энергии. Но «химическая потенциальная энергия» — это просто устаревший термин для обозначения того, что мы теперь знаем, как массу.По сути, когда химики говорят «потенциальная энергия», они имеют в виду «массу». В атоме нет какого-то ведра потенциальной энергии, из которого могла бы вытягиваться реакция. Просто масса.
Потеря (или увеличение) массы во время всех реакций, химических или ядерных, очень хорошо установлено и подтверждено экспериментально. Есть четыре основных типа основных реакций:
- Разрыв связей, который всегда поглощает энергию и увеличивает массу.
- Образование связей, которые всегда высвобождают энергию и уменьшают массу.
- Преобразование существующих связей, которое на самом деле является возбуждением системы в разные состояния (всегда поглощает энергию и увеличивает массу) и девозбуждением системы в разные состояния (всегда высвобождает энергию и уменьшает массу).
- Создание частиц (всегда поглощает энергию и увеличивает массу) и аннигиляция частиц (всегда высвобождает энергию и уменьшает массу).
Обратите внимание: когда химическая реакция поглощает энергию и, следовательно, набирает массу, это не похоже на создание электронов.Дополнительная масса не вызвана появлением новых частиц. Скорее, лишняя масса удерживается в системе в целом. В зависимости от положения и состояния частиц в системе относительно друг друга, система приобретает или теряет массу в дополнение к массам отдельных частиц. Эта концепция очень похожа на классическую концепцию потенциальной энергии, но теперь мы знаем, что энергия фактически хранится в виде массы. Если вы измеряете с помощью очень чувствительного оборудования сумму массы двух миллионов атомов водорода и одного миллиона атомов кислорода, которые отделены друг от друга, а затем измеряете массу одного миллиона молекул воды, вы обнаружите, что эти массы отличаются.
Темы: химическая реакция, сохранение энергии, сохранение массы, энергии, массы, реакция
Принцип сохранения импульса
Один из самых сильных законов физики — это закон сохранения количества движения. Закон сохранения количества движения можно сформулировать следующим образом.
Для столкновения, происходящего между объектом 1 и объектом 2 в изолированной системе, общий импульс двух объектов до столкновения равен общему импульсу двух объектов после столкновения.То есть импульс, потерянный объектом 1, равен импульсу, полученному объектом 2.
Приведенное выше утверждение говорит нам, что общий импульс коллекции из объектов (система ) равен сохраненным — то есть общее количество импульса является постоянным или неизменным значением. Этот закон сохранения импульса будет в центре внимания оставшейся части урока 2. Чтобы понять основы сохранения импульса, давайте начнем с краткого логического доказательства.
Логика сохранения импульсаРассмотрим столкновение между двумя объектами — объектом 1 и объектом 2. Для такого столкновения силы, действующие между двумя объектами, равны по величине и противоположны по направлению (третий закон Ньютона). Это утверждение можно выразить в виде уравнения следующим образом.
Силы действуют между двумя объектами в течение заданного времени. В некоторых случаях время велико; в других случаях времени мало.Независимо от того, сколько времени длится, можно сказать, что время, в течение которого сила действует на объект 1, равно времени, в течение которого сила действует на объект 2. Это просто логично. Силы возникают в результате взаимодействия (или контакта) между двумя объектами. Если объект 1 контактирует с объектом 2 в течение 0,050 секунды, то объект 2 должен контактировать с объектом 1 в течение того же времени (0,050 секунды). В виде уравнения это может быть указано как
Поскольку силы между двумя объектами равны по величине и противоположны по направлению, и поскольку времена, в течение которых эти силы действуют, равны по величине, отсюда следует, что импульсы, испытываемые двумя объектами, также равны по величине и противоположны по направлению. .В виде уравнения это может быть указано как
Но импульс, испытываемый объектом, равен изменению импульса этого объекта (теорема об изменении импульса-импульса). Таким образом, поскольку каждый объект испытывает равные и противоположные импульсы, логически следует, что они также должны испытывать равные и противоположные изменения импульса. В виде уравнения это может быть указано как
Закон сохранения импульсаПриведенное выше уравнение является одним из утверждений закона сохранения количества движения.При столкновении изменение количества движения объекта 1 равно и противоположно изменению количества движения объекта 2. То есть, импульс, потерянный объектом 1, равен импульсу, полученному объектом 2. В большинстве столкновений между двумя объектами один объект замедляется и теряет импульс, в то время как другой объект ускоряется и набирает скорость. Если объект 1 теряет 75 единиц импульса, то объект 2 получает 75 единиц импульса. Тем не менее, общий импульс двух объектов (объект 1 плюс объект 2) до столкновения такой же, как и после столкновения.Полный импульс системы (совокупность двух объектов) сохраняется.
Полезная аналогия для понимания сохранения импульса включает денежную транзакцию между двумя людьми. Давайте называть этих двух людей Джеком и Джилл. Предположим, что мы должны были проверить карманы Джека и Джилл до и после денежной транзакции, чтобы определить, сколько денег у каждого из них. До транзакции у Джека было 100 долларов, а у Джилл — 100 долларов.Общая сумма денег двух человек до транзакции составляет 200 долларов. Во время транзакции Джек платит Джилл 50 долларов за покупаемый предмет. Из кармана Джека в карман Джилл переводится 50 долларов. Джек потерял 50 долларов, а Джилл получила 50 долларов. Деньги, потерянные Джеком, равны деньгам, полученным Джилл. После транзакции у Джека в кармане осталось 50 долларов, а у Джилл — 150 долларов. Тем не менее, общая сумма денег двух человек после транзакции составляет 200 долларов. Общая сумма денег (деньги Джека плюс деньги Джилл) до транзакции равна общей сумме денег после транзакции.Можно сказать, что общая сумма денег , система (сбор двух человек) сохранена. Это то же самое до и после транзакции.
Полезным средством изображения передачи и сохранения денег между Джеком и Джилл является таблица.
В таблице показано количество денег, которыми владели эти два человека до и после взаимодействия. Он также показывает общую сумму денег до и после взаимодействия.Обратите внимание, что общая сумма денег (200 долларов США) одинакова до и после взаимодействия — она сохраняется. Наконец, в таблице показано изменение количества денег, которыми владеют два человека. Обратите внимание, что изменение денежного счета Джека (-50 долларов США) равно и противоположно изменению денежного счета Джилл (+50 долларов США).
Для любого столкновения, происходящего в изолированной системе, импульс сохраняется. Суммарный импульс совокупности объектов в системе до столкновения такой же, как и после столкновения.Обычная физическая лаборатория включает в себя падение кирпича на движущуюся тележку.
Выпавший кирпич находится в состоянии покоя и начинается с нулевого импульса. Загруженная тележка (тележка с кирпичом на ней) движется со значительной инерцией. Фактический импульс загруженной тележки можно определить, используя скорость (часто определяемую анализом тикерной ленты) и массу. Общий импульс — это сумма импульса брошенного кирпича (0 единиц) и импульса загруженной тележки.После столкновения импульсы двух отдельных объектов (упавшего кирпича и загруженной тележки) можно определить по их измеренной массе и их скорости (часто обнаруживаемой при анализе тикерной ленты). Если импульс сохраняется во время столкновения, то сумма импульса брошенного кирпича и загруженной тележки после столкновения должна быть такой же, как и до столкновения. Импульс, потерянный загруженной тележкой, должен равняться (или приблизительно равняться) импульсу, набранному брошенным кирпичом. Данные по моменту взаимодействия между упавшим кирпичом и загруженной тележкой можно представить в виде таблицы, аналогичной таблице денег выше.
| До Столкновение Импульс | После Столкновение Импульс | Изменение в Импульс | |
| Осыпанный кирпич | 0 единиц | 14 шт. | +14 единиц |
| Тележка с грузом | 45 единиц | 31 ед. | -14 единиц |
| Всего | 45 единиц | 45 единиц |
Обратите внимание, что загруженная тележка потеряла 14 единиц импульса, а упавший кирпич получил 14 единиц импульса.Отметим также, что полный импульс системы (45 единиц) был таким же до столкновения, как и после столкновения.
Столкновения обычно происходят в контактных видах спорта (например, в футболе) и в видах спорта с ракеткой и битой (например, в бейсболе, гольфе, теннисе и т. Д.). Рассмотрим столкновение в футболе между защитником и полузащитником во время стойки у линии ворот . Защитник прыгает через линию ворот и в воздухе сталкивается с полузащитником. Полузащитник и защитник держат друг друга и едут вместе после столкновения.У защитника есть импульс 100 кг * м / с, восток перед столкновением, а полузащитник имеет импульс 120 кг * м / с, запад перед столкновением. Полный импульс системы перед столкновением составляет 20 кг * м / с, запад (при необходимости просмотрите раздел о добавлении векторов). Следовательно, полный импульс системы после столкновения также должен быть 20 кг * м / с, запад. Защитник и полузащитник движутся вместе как единое целое после столкновения с общим импульсом 20 кг * м / с. Импульс сохраняется при столкновении.Векторная диаграмма может быть использована для представления этого принципа сохранения импульса; на такой диаграмме стрелка используется для обозначения величины и направления вектора импульса для отдельных объектов до столкновения и объединенного импульса после столкновения.
Теперь предположим, что набивной мяч брошен клоуну, который отдыхает на льду; клоун ловит набивной мяч и скользит вместе с мячом по льду.Импульс набивного мяча до столкновения составляет 80 кг * м / с. Импульс клоуна до столкновения равен 0 м / с. Полный импульс системы до столкновения составляет 80 кг * м / с. Следовательно, полный импульс системы после столкновения также должен составлять 80 кг * м / с. Клоун и набивной мяч движутся вместе как единое целое после столкновения с общим импульсом 80 кг * м / с. Импульс сохраняется при столкновении.
Импульс сохраняется для любого взаимодействия между двумя объектами, происходящего в изолированной системе.Это сохранение импульса можно наблюдать с помощью анализа полного импульса системы или анализа изменения импульса. Полезные средства представления такого анализа включают таблицу импульсов и векторную диаграмму. Позже в Уроке 2 мы будем использовать принцип сохранения импульса для решения задач, в которых предсказывается скорость объектов после столкновения.
Смотри! Используя датчики движения и тележки на трассе с низким коэффициентом трения, можно собирать данные, чтобы продемонстрировать закон сохранения количества движения.Видео ниже демонстрирует процесс.
Мы хотели бы предложить … Иногда просто прочитать об этом недостаточно. Вы должны с ним взаимодействовать! И это именно то, что вы делаете, когда используете один из интерактивных материалов The Physics Classroom. Мы хотели бы предложить вам совместить чтение этой страницы с использованием наших интерактивных тележек и кирпичей, интерактивных тележек для взрыва и / или наших интерактивных тележек для столкновений.Эти интерактивные элементы можно найти в разделе Physics Interactive на нашем веб-сайте, и они предоставляют интерактивный опыт анализа импульса отдельных объектов и систем объектов при столкновении.
Выразите свое понимание концепции и математики импульса, ответив на следующие вопросы. Нажмите на кнопку, чтобы просмотреть ответы.
1. При тушении пожара пожарный должен проявлять особую осторожность, держа шланг, из которого на высокой скорости выделяется большое количество воды. Почему такая задача может быть сложной?
2. Лобовое столкновение большого грузовика и Volkswagen.
а. Какой автомобиль испытывает наибольшую силу удара?
г.Какой автомобиль испытывает наибольший импульс?
г. Какой автомобиль претерпевает наибольшие изменения?
г. Какой автомобиль испытывает наибольшее ускорение?
3. Майлз Туго и Бен Травлун едут в автобусе со скоростью шоссе в хороший летний день, когда на лобовое стекло попадает несчастный жук. Майлз и Бен начинают обсуждать физику ситуации.Майлз предполагает, что изменение скорости движения жука намного больше, чем у автобуса. В конце концов, утверждает Майлз, не было заметного изменения скорости автобуса по сравнению с очевидным изменением скорости ошибки. Бен полностью не согласен, утверждая, что и жук, и автобус сталкиваются с одной и той же силой, изменением импульса и импульсом. С кем ты согласен? Поддержите свой ответ.
4.Если мяч выбрасывается вверх от земли с десятью единицами импульса, каков импульс отдачи Земли? ____________ Мы чувствуем это? Объяснять.
5. Если шар для боулинга весом 5 кг проецируется вверх со скоростью 2,0 м / с, то какова скорость отдачи Земли (масса = 6,0 x 10 24 кг).
6.Линейный игрок весом 120 кг, движущийся на запад со скоростью 2 м / с, схватывает 80-килограммового защитника, движущегося на восток со скоростью 8 м / с. После столкновения оба игрока движутся на восток со скоростью 2 м / с. Нарисуйте векторную диаграмму, на которой импульсы каждого игрока до и после столкновения представлены вектором импульса. Обозначьте величину каждого вектора импульса.
См. Ответ ниже.7. Стремясь применить самую суровую смертную казнь к довольно непопулярному заключенному, команда казней в тюрьме Темных веков ищет пулю, которая в десять раз массивнее самой винтовки.Какой тип людей захочет стрелять из винтовки с пулей, которая в десять раз массивнее винтовки? Объяснять.
8. Бейсболист свободно держит биту и бьет по мячу. Выразите свое понимание сохранения импульса, заполнив таблицы ниже.
9.Крылатая ракета «Томагавк» запускается из ствола мобильной ракетной установки. Пренебрегайте трением. Выразите свое понимание сохранения импульса, заполнив таблицы ниже.
Вернитесь к вопросу № 6.
законов о сохранении
Во всей физике всего шесть законов сохранения.Каждый описывает количество, которое сохраняется, то есть общая сумма остается неизменной до и после того, как что-то происходит. В этих законах есть ограничение, заключающееся в том, что система закрыта, то есть на систему не влияет ничто за ее пределами.Давайте рассмотрим законы сохранения, известные вам из классической физики. Затем мы опишем два закона сохранения физики элементарных частиц.
Сохранение заряда
Это все время используется в химии.Общий заряд в системе сохраняется.
Na + OH — + H + Cl — Na + Cl — + H + OH — соль в воде
1 + + 1 — + 1 + + 1 — = 0 = 0 + 0 Проверьте это взаимодействие частиц:
p + + n o p + + p +
1 + + 0 1 + + 1 +
1 2.Такой реакции не может быть!
Сохранение Момемтума
Momemtum, p , (вектор)
равна массе, м, (скаляр), умноженной на скорость, v , (вектор).
Рассмотрим столкновение игрушечных машинок:
| До столкновения | После столкновения | ||
| м 1 = 1 кг | м 2 = 2 кг | м 1 = 1 кг | м 2 = 2 кг |
| v 1 = + 5 м / с | v 2 = — 5 м / s | v 1 ‘= — 3 м / с | v 2 ‘ = — 1 м / с |
Рассчитайте общую скорость и общий импульс до и после столкновения.Помните, что v и p — векторы.
| До столкновения | После столкновения | ||
| м 1 = 1 кг | м 2 = 2 кг | м 1 = 1 кг | м 2 = 2 кг |
| S v = + 5 м / с + — 5 м / с = 0 | S v = — 3 м / с + — 1 м / с = — 4 | ||
| S p = + 5 кг м / с + — 10 кг м / с = — 5 кг м / с | S p = — 3 кг м / с + — 2 кг м / с = — 5 кг м / с | ||
Итак, общая скорость НЕ сохраняется, но импульс сохраняется!
Посмотрите на эти следы частиц (рассчитанные компьютером) при столкновении электрона и позитрона.К чему вы пришли?
После:
Похоже, что импульс не сохраняется, если нет одной или нескольких невидимых частиц.
В 1930-х годах, когда казалось, что в таких событиях нарушается закон сохранения импульса, физики элементарных частиц осознали, что должны быть невидимые частицы. Так были впервые постулированы нейтрино, но они были открыты гораздо позже.
Сохранение энергии / массы \
>
Рассмотрим следующую реакцию:
В этом примере KE i = 0. Обратите внимание, что потенциальную энергию не нужно учитывать, потому что начальное и конечное состояния не взаимодействуют.
Сохранение углового момента
Угловой момент ( L ) включает положение массы ( R ),
а также его угловая скорость w .
Когда звезда падает (или фигуристка тянет за руки), R становится меньше, Если угловой момент сохраняется, либо m, либо v должно увеличиваться, когда R уменьшается.Увеличить v для фигуриста намного проще, чем увеличить m! Увеличение против позволяет сохранить L .
m 1 R 1 v 1 = м 2 R 2 V 2 Спин
Иногда можно услышать о «спине» электронов или других частиц.
Как частицы без размеров могут иметь спин? И как это может быть внутренней характеристикой? В конце концов, бейсбольный мяч не вращается, когда вы его ловите.
В книге IEEE The Quest for the Spin Transistor обсуждается вращение и рассказывается о более поздних исследованиях.
Сохранение барионного числа
Барионы — это адроны (составные частицы, состоящие из кварков), состоящие из любых трех кварков. В реакции сохраняется барионное число. Вы должны посчитать каждый
барион как +1 и каждый антибарион как -1. Небарионы имеют барионное число 0.
Это наблюдаемое событие, сохраняющее как электрический заряд, так и барионное число.
п + р + + р o
Это сохраняет заряд, но не барионное число, поэтому не происходит.
Сохранение лептонного числа
Всего существует шесть лептонов: три из них имеют электрический заряд, а три, называемые нейтрино, — нет.
 Между реагентами ставим знак «+»,
а затем стрелку:
Между реагентами ставим знак «+»,
а затем стрелку: Наименьшее кратное для атомов натрия –10:
Наименьшее кратное для атомов натрия –10: