11 класс Урок №2 — 3. Закон сохранения массы веществ, закон сохранения и превращения энергии при химических реакциях. Закон постоянства состава веществ. Вещества молекулярного и немолекулярного строения. Решение расчётных задач
11 класс Урок №2 — 3. Закон сохранения массы веществ, закон сохранения и превращения энергии при химических реакциях. Закон постоянства состава веществ. Вещества молекулярного и немолекулярного строения. Решение расчётных задач
Цели урока Знать формулировки законов, применять законы для решения задач. Знать формулировки законов, применять законы для решения задач.Проверка домашнего задания 1. Что такое период? Сколько периодов в периодической системе? Какими элементами начинаются и заканчиваются периоды? Какие бывают периоды? 2. Что в периодической системе называют группой? Сколько групп имеется в периодической системе? На какие подгруппы делятся группы в периодической системе? 3. Как устроен атом? Как, пользуясь ПСХЭ, определить количество частиц в атоме? 4. Как определить количество энергетических уровней (электронных слоев) в электронной оболочке атома? Как распределяются электроны по электронным слоям? 5. Как определить количество электронов на внешнем электронном слое? 6. Что такое изотопы? Что называется химическим элементом?
Как определить количество энергетических уровней (электронных слоев) в электронной оболочке атома? Как распределяются электроны по электронным слоям? 5. Как определить количество электронов на внешнем электронном слое? 6. Что такое изотопы? Что называется химическим элементом?
Изучение нового материала. Беседа, работа в тетради. Стехиометрические химические законы
(Закон сохранения массы, закон постоянства состава, закон Авогадро)
Основные понятия
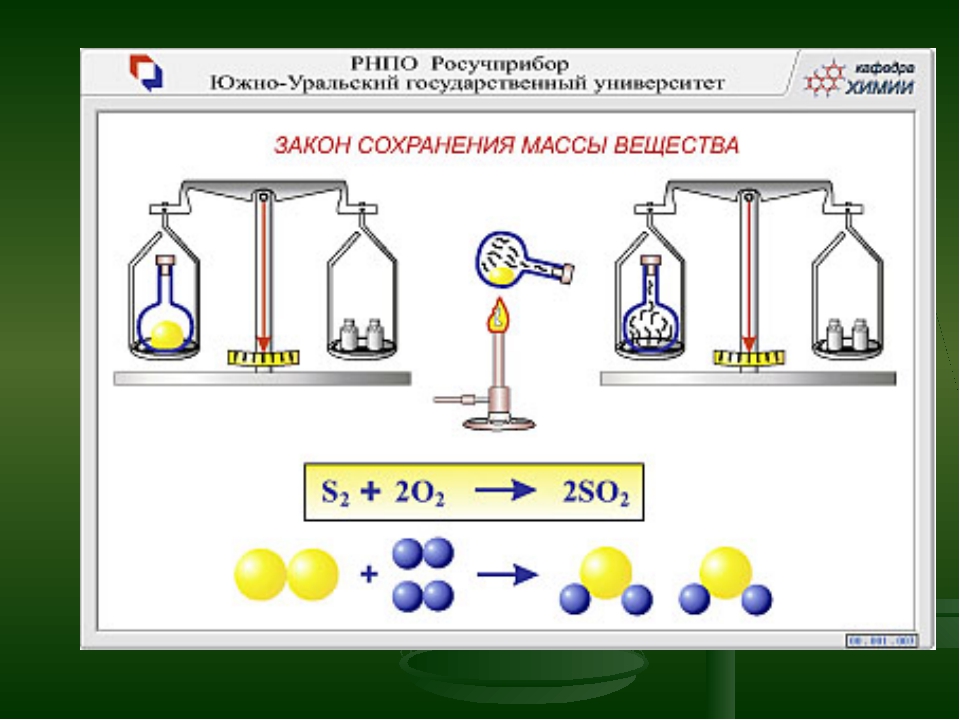
1. Закон сохранения массы вещества: масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. (М.В.Ломоносов, 1748 г)
2H2 + O2 = 2H2O
m(H2) + m(O2) = m(H2O)
(2∙2г/моль) + (1∙32г/моль) = (2∙18г/моль)
2. Закон постоянства состава вещества: всякое чистое вещество, независимо от способа его получения имеет постоянный качественный и количественный состав.
Следует помнить!
Закон строго применим только к соединениям с молекулярной структурой (Дальтонидам). Соединения с немолекулярной структурой (Бертоллиды) часто имеют переменный состав.
Обратное утверждение, что определённому составу отвечает определённое соединение, неверно. Так, диметиловый эфир и этиловый спирт имеют одинаковый количественный и качественный состав, но это разные вещества.
Повторите вещества молекулярного и немолекулярного состава по материалам урока №6, 8 класс
3. Закон Авогадро: в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. (1811 г)
Cледствия из закона Авогадро:
1 следствие:
Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объём.
Так, 6,02 ∙ 1023 молекул (1 моль) любого газа и любой смеси газов при н.у. занимает объём равный 22,4 л.
2 следствие:
Отношение объёмов реагирующих веществ, измеренных при одинаковых условиях, равно отношению стехиометрических коэффициентов, т.е. равно отношению количеств этих веществ.
V1:V2:V3 = ν1:ν2:ν3
H2 + Cl2 = 2HCl
V(H2):V(Cl2):V(HCl) = ν(H2):ν(Cl2):ν(HCl) = 1 : 1 : 2
3 следствие:
Отношение масс одинаковых объёмов различных газов при одинаковых условиях равно отношению их плотностей (1).
Отношение масс одинаковых объёмов различных газов при одинаковых условиях равно отношению их молярных масс (поскольку в равных объёмах газов при одинаковых условиях содержится одинаковое число молекул и, следовательно, одинаковое число молей) (2).
Это отношение называется относительной плотностью одного газа по другому (3)
D – показывает во сколько раз один газ тяжелее или легче другого и является безразмерной величиной.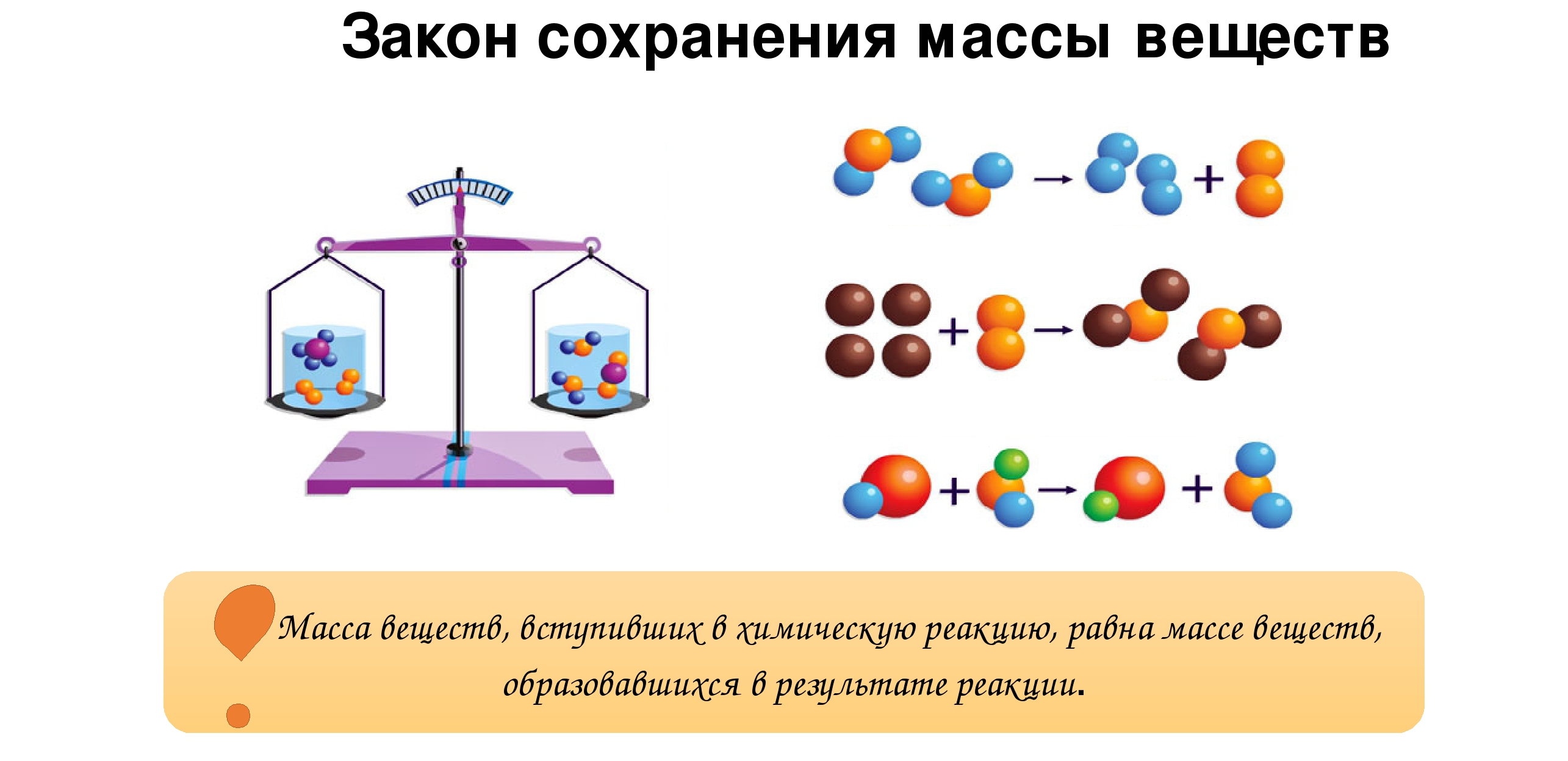 23=5 моль
23=5 моль
V(Н2)=5*22,4=112л
m(Н2О)=5*18=90г
№4. Какова молярная масса газа, если 1 л его при н.у. имеет массу 3,17 г?
n=1/22,4=0,05(моль)
M=3,17/0,05=63,4(г/моль)
№5. 33,6 л смеси СО и СО2 имеют массу 48 г. Рассчитать массовые доли компонентов смеси.
РЕШЕНИЕ : Обозначим через х моль количество угарного газа и через у моль количество углекислого газа.
Тогда, масса СО в смеси составит: m(CO) = n(CO) *M(CO) = 28x
А масса СО2 в смеси составит: m(CO2)= n(CO2)*M(CO2) = 44y
Объём, занимаемый газами, можно подсчитать:
V = Vm*m/ M
Отсюда объёмы газов в смеси равны: V(CO)=22,4x , V(CO2) = 22,4 y
В условии задачи даны суммарные масса и объём смеси, следовательно,
28х + 44у = 48
22,4х + 22,4у = 33,6
Получилась система уравнений с двумя неизвестными. Решая её, найдём: х=1,125; у = 0,375 . Далее находим массы компонентов в смеси:
m (СО) = 28х = 31,5 г
m(СО2) = 44у = 16,5 г
Теперь нетрудно рассчитать массовые доли СО и СО2 , учитывая, что 48 г составляют 100 %, тогда
w (СО) = 31,5 : 48 = 0,656 или 65,6%
w (СО2)=16,5 : 48 = 0,344 или 34,4%
Теперь рассчитаем объёмные доли газов в смеси :
фсумм. = 1,125 + 0,375 = 1,5
= 1,125 + 0,375 = 1,5
ф(СО) = 1,125 : 1,5 = 0,656 или 65,6%
ф(СО2)=0,375 : 1,5 = 0,344 или 34,4%
№6. Плотность газовой смеси, состоящей из СО и СО2, по воздуху составляет 1,214. Определить состав в мольных (объёмных) долях.
№7. Какой объём кислорода (н.у.) потребуется для полного сгорания 10 м3 пропана
C3H8 + 5O2 => 3CO2 + 4h3O
По уравнению реакции на один объем пропана требуется 5 объемов кислорода. Значит на 10 м3 потребуется 50 м3 кислорода.
Содержание кислорода в воздухе составляет примерно 21%
Значит, потребуется 50/0,21 = 23,7 м3 воздуха
Закон сохранения массы веществ. Закон сохранения энергии. Закон постоянства состава
I. Закон сохранения массы вещества
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. (М.В.Ломоносов, 1748 г)
(М.В.Ломоносов, 1748 г)
Подтвердить правильность закона сохранения массы веществ можно с помощью следующего опыта. В первом сосуде Ландольта подготовим растворы йодида калия и нитрата свинца. Во втором сосуде – пройдет реакция хлорида железа с роданидом калия. Плотно закрываем пробки. Уравновешиваем чашки весов. Сохранится ли равновесие после окончания реакций? В первом сосуде выпадает желтый осадок йодида свинца, во втором образуется темно-красный роданид трехвалентного железа. В сосудах Ландольта произошли химические реакции: образовались новые вещества. Но равновесие не нарушилось. Масса исходных веществ всегда равна массе продуктов реакции.
Рис. Эксперимент, подтверждающий правильность закона сохранения массы веществ
Опыты, иллюстрирующие закон сохранения массы веществ
Приведем пример еще одного опыта, доказывающего правильность закона сохранения массы веществ в химических реакциях.
Рис. Эксперимент с горящей свечой в колбе
Открытие закона сохранения массы веществ имело огромное значение для дальнейшего развития химии. На основании закона сохранения массы веществ производят важнейшие расчеты и составляют уравнения химических реакций.
2H2 + O2 = 2H2O
m(H2) + m(O2) = m(H
(2∙2г/моль) + (1∙32г/моль) = (2∙18г/моль)
II. Закон постоянства состава вещества
1. Открытие закона постоянства состава веществ
Открытие закона постоянства состава веществ
Ученые XVII-XVIII вв. проводили множество количественных измерений, в т.ч. по определению массовой доли элемента в веществе. Но результаты их опытов были неточными, и как следствие, не совпадали.
Французский химик Клод Луи Бертолле пытался доказать, что состав веществ зависит от пропорций, в которых находятся реагирующие вещества.
Рис. Клод Луи Бертолле
В отличие от него другой французский химик Жозеф Луи Пруст провел много экспериментов по исследованию состава различных веществ и сделал вывод о постоянстве состава вещества.
Рис. Жозеф Луи Пруст
В 1808 г. Пруст сформулировал закон постоянства состава веществ: «Вещества имеют постоянный состав независимо от способа и места их получения».
2. Суть закона
Суть закона
В своей работе «Исследование меди» в 1799 г. Пруст показал, что природный карбонат меди и карбонат меди, полученный химиками в лаборатории, имеют один и тот же состав.
Ничем не различаются вода, текущая из нашего крана, вода из родника, или вода, полученная синтетическим путем (имеется в виду состав чистого вещества – воды, а не состав смеси). Вода всегда будет содержать по массе 11,1 % водорода и 88,9 % кислорода.
Но природа гораздо разнообразнее, чем любая теория, созданная человеком. И из закона постоянства состава веществ есть исключения. В XX веке было обнаружено, что некоторые соединения не имеют постоянного состава.
3. Ограниченность закона
Таким образом, нельзя сказать, что Клод Бертолле был абсолютно неправ. Закон постоянства состава веществ имеет ограничения.
Вещества, имеющие переменный состав существуют, их назвали в честь Бертолле – бертоллидами.
Бертоллиды — соединения переменного состава, не подчиняющиеся законам постоянных и кратных отношений. Бертоллиды являются нестехиометрическими бинарными соединениями переменного состава, который зависит от способа получения. Многочисленные случаи образования бертоллидов открыты в металлических системах, а также среди оксидов, сульфидов, карбидов, гидридов и др. Например, оксид ванадия(II) может иметь в зависимости от условий получения, состав от V0,9 до V1,3.
Следует помнить!
- Закон строго применим только к соединениям с молекулярной структурой (Дальтонидам). Соединения с немолекулярной структурой (Бертоллиды) часто имеют переменный состав.
- Обратное утверждение, что определённому составу отвечает определённое соединение, неверно. Так, диметиловый эфир и этиловый спирт имеют одинаковый количественный и качественный состав, но это разные вещества.

III. Закон Авогадро
В равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. (1811 г)
Cледствия из закона Авогадро:
1 следствие:
Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объём.
Так, 6,02 ∙ 1023 молекул (1 моль) любого газа и любой смеси газов при н.у. занимает объём равный 22,4 л.
2 следствие:
Отношение объёмов реагирующих веществ, измеренных при одинаковых условиях, равно отношению стехиометрических коэффициентов, т.е. равно отношению количеств этих веществ.
V1:V2:V3 = ν1:ν2:ν3
H2 + Cl2 = 2HCl
V(H2):V(Cl2):V(HCl) = ν(H2):ν(Cl2):ν(HCl) = 1 : 1 : 2
3 следствие:
Отношение масс одинаковых объёмов различных газов при одинаковых условиях равно отношению их плотностей (1).
Отношение масс одинаковых объёмов различных газов при одинаковых условиях равно отношению их молярных масс (поскольку в равных объёмах газов при одинаковых условиях содержится одинаковое число молекул и, следовательно, одинаковое число молей) (2).
Это отношение называется относительной плотностью одного газа по другому (3)
D – показывает во сколько раз один газ тяжелее или легче другого и является безразмерной величиной.
Например, (4)
IV. Закон объёмных отношений
При неизменных температуре и давлении объёмы, вступающих в реакцию газов, относятся друг к другу, а также к объёмам образующихся газообразных продуктов, как небольшие целые числа. (Ж.Гей-Люссак, 1805 г)
Формулировка закона сохранения массы — урок. Химия, 8–9 класс.
Закон сохранения массы веществ в химических реакциях был сформулирован на основе работ по прокаливанию металлов.
В XVII в. английский учёный Р. Бойль проводил опыты по прокаливанию свинца. После окончания опытов он взвешивал полученные продукты и сравнивал их массу с массой исходного металла. Масса окалины всегда была больше массы свинца.
английский учёный Р. Бойль проводил опыты по прокаливанию свинца. После окончания опытов он взвешивал полученные продукты и сравнивал их массу с массой исходного металла. Масса окалины всегда была больше массы свинца.
Русский учёный М. В. Ломоносов повторил опыты Р. Бойля. Но металлы он прокаливал в запаянных стеклянных сосудах — ретортах. Взвешивание сосудов до и после реакции показало, что их масса остаётся неизменной.
В \(1748\) г. М. В. Ломоносов сделал вывод: «Все перемены, в натуре случающиеся, суть такого состояния, что сколько чего у одного тела отнимется, столько присовокупится к другому. Так ежели где убудет материи, то умножится в другом месте».
В \(1789\) г. французскому химику А. Лавуазье удалось объяснить причину разных результатов взвешивания веществ в открытых и закрытых сосудах. Он доказал, что образование окалины происходит за счёт присоединения к металлу кислорода, содержащегося в воздухе.
Так был открыт М. В. Ломоносовым и экспериментально подтверждён А. Лавуазье закон сохранения массы.
В. Ломоносовым и экспериментально подтверждён А. Лавуазье закон сохранения массы.
Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ.
При химических реакциях атомы не исчезают и не появляются. Продукты реакции образуются из атомов, содержащихся в исходных веществах. Поэтому масса и остаётся неизменной.
Пример:
реакция горения природного газа (метана):
метан \(+\) кислород \(=\) углекислый газ \(+\) вода.
Исходные вещества — метан Ch5 и кислород O2:
Продукты реакции — углекислый газ CO2 и вода h3O:
В молекулах исходных веществ и в молекулах продуктов реакции содержатся атомы углерода, водорода и кислорода. Их число не меняется, поэтому и масса веществ остаётся неизменной.
Их число не меняется, поэтому и масса веществ остаётся неизменной.
масса метана \(+\) масса кислорода \(=\) масса углекислого газа \(+\) масса воды,
m(Ch5)+m(O2)=m(CO2)+m(h3O).
Урок №2 — 3. Закон сохранения массы веществ, закон сохранения и превращения энергии при химических реакциях. Закон постоянства состава веществ. Вещества молекулярного и немолекулярного строения. Решение расчётных задач
Стехиометрические химические законы
(Закон сохранения массы, закон постоянства состава, закон Авогадро)
Основные понятия
1. Закон сохранения массы вещества: масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. (М.В.Ломоносов, 1748 г)
2H2 + O2 = 2H2O
m(H2) + m(O2) = m(H2O)
(2∙2г/моль) + (1∙32г/моль) = (2∙18г/моль)
2. Закон постоянства
состава вещества: всякое чистое
вещество, независимо от способа его получения имеет постоянный качественный и
количественный состав. (Ж.Пруст, 1801
г)
Закон постоянства
состава вещества: всякое чистое
вещество, независимо от способа его получения имеет постоянный качественный и
количественный состав. (Ж.Пруст, 1801
г)
Следует помнить!
- Закон строго применим только к соединениям с молекулярной структурой (Дальтонидам). Соединения с немолекулярной структурой (Бертоллиды) часто имеют переменный состав.
- Обратное утверждение, что определённому составу отвечает определённое соединение, неверно. Так, диметиловый эфир и этиловый спирт имеют одинаковый количественный и качественный состав, но это разные вещества.
Повторите вещества молекулярного и немолекулярного состава по материалам урока №6, 8 класс
3. Закон Авогадро: в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. (1811 г)
Cледствия из закона Авогадро:
1 следствие:
Одинаковое число молекул
различных газов при одинаковых условиях занимает одинаковый объём.
Так, 6,02 ∙ 1023 молекул (1 моль) любого газа и любой смеси газов при н.у. занимает объём равный 22,4 л.
2 следствие:
Отношение объёмов реагирующих веществ, измеренных при одинаковых условиях, равно отношению стехиометрических коэффициентов, т.е. равно отношению количеств этих веществ.
V1:V2:V3 = ν1:ν2:ν3
H2 + Cl2 = 2HCl
V(H2):V(Cl2):V(HCl) = ν(H2):ν(Cl2):ν(HCl) = 1 : 1 : 2
3 следствие:
Отношение масс одинаковых объёмов различных газов при одинаковых условиях равно отношению их плотностей:
Отношение масс одинаковых объёмов различных газов при одинаковых условиях равно отношению их молярных масс (поскольку в равных объёмах газов при одинаковых условиях содержится одинаковое число молекул и, следовательно, одинаковое число молей):
Это отношение называется
относительной плотностью одного газа по другому.
D = |
|
D – показывает во сколько раз один газ тяжелее или легче другого и является безразмерной величиной.
Например,
D(CO2) по воздуху = |
|
= 44/29 = 1,5 раза
|
4. Закон объёмных отношений: При неизменных температуре и давлении объёмы, вступающих в реакцию газов, относятся друг к другу, а также к объёмам образующихся газообразных продуктов, как небольшие целые числа. (Ж.Гей-Люссак, 1805 г)
Задачи для самостоятельного решения:
№1. Какое число молекул содержится в 1 м3 хлора при
н.у.?
Какое число молекул содержится в 1 м3 хлора при
н.у.?
№2. Определите абсолютную массу атома гелия.
№3. В каких объёмах азота и воды при н.у. содержится 3,01 ∙ 1024 молекул?
№4. Какова молярная масса газа, если 1 л его при н.у. имеет массу 3,17 г?
№5. 33,6 л смеси СО и СО2 имеют массу 48 г. Рассчитать массовые доли компонентов смеси.
№6. Плотность газовой смеси, состоящей из СО и СО2, по воздуху составляет 1,214. Определить состав в мольных (объёмных) долях.
№7. Какой объём кислорода (н.у.) потребуется для полного сгорания 10 м3 пропана (н.у.)?
Закон сохранения массы вещества — Справочник химика 21
Закон сохранения массы веществ (М. В. Ломоносов, 1748) масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции. [c.4]
[c.4]Для решения большинства химических задач ключевым этапом является расчет по уравнению химической реакции. Сам процесс расчета может проводиться несколькими незначительно отличающимися друг от друга способами, но принципы, позволяющие производить подобные действия, остаются одинаковыми для всех случаев. В основе расчетов по уравнениям химических реакций лежит закон сохранения массы вещества при химических превращениях. Современную формулировку зтого закона можно представить следующим образом [c.249]
Теоретическую основу аналитической химии составляют фундаментальные законы естествознания, такие, как периодический закон Д. И. Менделеева, законы сохранения массы вещества и [c.5]
Закон сохранения массы вещества. Расстановка коэффициентов в уравнениях химических реакций. Расчеты по уравнениям химических реакций [c.249]
По закону сохранения массы вещества, вес веществ, вступивших в реакцию, равен весу полученных веществ. Чтобы этот закон выполнялся, в уравнении реакции нужно расставить коэффициенты [c.16]
Чтобы этот закон выполнялся, в уравнении реакции нужно расставить коэффициенты [c.16]
Стехиометрия основывается на стехиометрических законах сохранения массы веществ, постоянства состава, эквивалентов, кратных отношений, объемных отношений, Авогадро. [c.10]
Закон сохранения массы веществ, находящихся в реакторе и участвующих в химических реакциях, приводит к совокупности уравнений материального баланса. Каждое из.них представляет собой дифференциальное уравнение, определяющее скорость изменения концентрации какого-либо реагента. [c.16]
В основе ядерных реакций, как и химических процессов, лежит закон сохранения массы вещества и энергии. [c.71]
Материальный баланс печного процесса — это количественное выражение равенства массы поступивших в нее веществ и получающихся при этом продуктов и отходов. Основой материального баланса является закон сохранения массы вещества. [c.137]
М. Б. Ломоносов (1711 — 1765) впервые стал систематически применять весы при изучении химических реакций. Б 1756 г. он экспериментально установил один из основных законов природы — закон сохранения массы вещества, составивший основу количественного анализа и имеющий огромное значение для всей науки. М. В. Ломоносов разработал многие приемы химического анализа и исследования, не потерявшие значения до наших дней [c.8]
Б. Ломоносов (1711 — 1765) впервые стал систематически применять весы при изучении химических реакций. Б 1756 г. он экспериментально установил один из основных законов природы — закон сохранения массы вещества, составивший основу количественного анализа и имеющий огромное значение для всей науки. М. В. Ломоносов разработал многие приемы химического анализа и исследования, не потерявшие значения до наших дней [c.8]
Основой материального баланса являются законы сохранения массы вещества и стехиометрических соотношений. [c.5]
Материальный баланс составляют по уравнению основной суммарной реакции с учетом побочных реакций согласно закону сохранения массы вещества. Общая масса всех поступающих [c.5]
Закон сохранения массы вещества в химических реакциях подвергался многочисленным проверкам и не было экспериментально обнаружено отклонений от него. Укажите в самых общих чертах пути повышения точности (уменьшения погрешности) эксперимента. [c.13]
[c.13]
Закон сохранения массы вещества позволяет оценивать количества продуктов реакции по количествам исходных веществ и [c.249]
Покажите справедливость закона сохранения массы веществ М. В. Ломоносова на следующих явлениях а) при взаимодействии цинка с соляной кислотой масса образующегося хлорида цинка меньше массы цинка и кислоты, вступивших в реакцию [c.11]
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ [c.23]
ХИМИЧЕСКИЕ УРАВНЕНИЯ — запись химических реакции с помощью химических формул и численных коэффициентов в соответствии с законом сохранения массы вещества при химических превращениях. X. у. лежат в основе расчетов, связанных с данной реакцией. [c.274]
Открытие закона сохранения массы вещества и энергии. [c.15]
Для формирования химии как науки исключительно важное значение имело открытие закона сохранения массы вещества и энергии (движения). [c.15]
[c.15]
Открытие закона сохранения массы вещества и энергии Работы М. В. Ломоносова и А.-Л. Лавуазье…….. [c.429]
Закон сохранения массы вещества. Впервые его высказал М. В. Ломоносов в письме к Эйлеру от 5 июня 1748 г., опубликованном на русском языке в 1760 г. Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимется, столько присовокупится к другому… Это определение, за исключением архаичности языка, не устарело. [c.13]
Для составления уравнения окислительно-восстановительной реакции необходимо прежде всего знать химические формулы исходных и получающихся веществ. Исходные вещества мы знаем, а продукты реакции устанавливаются либо экспериментально, либо на основании известных свойств элементов. В левой и правой частях уравнения реакции должно быть одинаковое число одних и тех же атомов. Следовательно, правильно записанная реакция является выражением закона сохранения массы вещества. Согласно закону эквивалентов вещества всегда соединяются между собой или замешают друг друга в определенных весовых соотношениях, соответствующих их эквивалентам. [c.115]
Согласно закону эквивалентов вещества всегда соединяются между собой или замешают друг друга в определенных весовых соотношениях, соответствующих их эквивалентам. [c.115]
Закон сохранения массы веществ при химических реакциях Ломоносов рассматривал как одно из проявлений всеобщего закона сохранения материи и движения. [c.25]
П р и м е р 2. В условии задачи указано, что при взаимодействии натрия с водой образовался 12%-ный раствор щелочи. В этом случае закон сохранения массы веществ удобно выразить уравнением [c.8]
Рассмотренное уравнение удовлетворяет законам сохранения массы вещества и зарядов, поэтому стрелку (—) можно заменить знаком равенства и в полном ионно-молекулярном виде уравнение реакции будет иметь вид [c.47]
Закон сохранения массы вещества. Применяя количественные методы исследования химических реакций, М. В. Ломоносов установил, что при химических превращениях общий вес вещества остается неизменным. На основании своих опытов он сформулировал закон сохранения массы веш,еств [c.25]
На основании своих опытов он сформулировал закон сохранения массы веш,еств [c.25]
С точки зрения атомно-молекулярной теории закон сохранения массы веществ объясняется тем, что при химических реакциях общее количество атомов не изменяется, а происходит только их перегруппировка. А так как атомы имеют постоянную массу, то это и приводит к закону сохранения массы веществ. [c.25]
Закон постоянства состава. Закон сохранения массы веществ послужил основой для изучения количественного состава различных веществ, и к началу [c.26]
Подобные уравнения составляются на основе закона сохранения массы веществ и показывают количественные соотношения веществ, участвующих в химической реакции, В том случае, если указывается, какое количество молей веществ участвует в реакции и какое количество энергии при этом выделяется (поглощается), говорят о термохимических уравнениях реакций (см. гл. V). [c.167]
Огромной заслугой Ломоносова перед наукой было то, что он первый количественно обосновал основной закон химических превращений— закон сохранения массы вещества. Его опыты с накаливанием металлов в запаянных сосудах дали экспериментальное доказательство правильности материалистического представления о неуничтожаемости вещества. Уже тогда Ломоносов подошел к обобщенному определению принципа сохранения материи и движения, получившего ныне всестороннее доказательство и признание как всеобщего закона природы. Впервые Ломоносов сформулировал этот закон в 1748 г. в письме к Л. Эйлеру и опубликовал его в 1756 г. Все перемены в натуре случающиеся такого суть состояния, что сколько чего у одного тела отнимется, столько же присовокупигся к [c.13]
Его опыты с накаливанием металлов в запаянных сосудах дали экспериментальное доказательство правильности материалистического представления о неуничтожаемости вещества. Уже тогда Ломоносов подошел к обобщенному определению принципа сохранения материи и движения, получившего ныне всестороннее доказательство и признание как всеобщего закона природы. Впервые Ломоносов сформулировал этот закон в 1748 г. в письме к Л. Эйлеру и опубликовал его в 1756 г. Все перемены в натуре случающиеся такого суть состояния, что сколько чего у одного тела отнимется, столько же присовокупигся к [c.13]
Пример 1. Пусть необходимо в общем виде записать в математической форме закон сохранения массы веществ для реакции [c.7]
ПОНЯТНО, что ДЛЯ каждой отдельной реакции в уравнении, отражающем закон сохранения массы веществ, будут фигурировать другие величины. Однако даже для одной и той же реакции этот закон -можно выразить видоизмененными уравнениями, описывающими зависимость между величинами, которые, например, заданы в условии задачи. [c.7]
[c.7]
Оно, как и предыдущие, отражает закон сохранения массы веществ для данной реакции. [c.8]
Следует помнить, что каждое химическое уравнение не только-несет информацию о качественном составе веществ, принимающих участие в реакции, но и отражает закон сохранения массы веществ, и дает представление о количественных отношениях масс веществ, формулы которых записаны б уравнении для каждой реакции масса вещ еств, вступающих в реакцию, равна массе веществ, образующихся в результате ее. [c.25]
Искомая величина X —масса воды, образовавшейся в результате реакции. На основании закона сохранения массы веществ сумма масс оксидов металлов и серной кислоты, вступивших в реак-дию, равна сумме масс сульфатов металлов и воды, образовавшихся, в результате реакции. Обозначив массу серной кислоты /Пн,со запишем [c.26]
Согласно этому закону, масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате ее. Обозначив массы веществ, вступивших в реакцию и образовавшихся в результате ее, соответственно mNa, tnufi и mNaon, гпн,, запишем алгебраическое уравнение, отражающее закон сохранения массы веществ для данной реакции [c.7]
Обозначив массы веществ, вступивших в реакцию и образовавшихся в результате ее, соответственно mNa, tnufi и mNaon, гпн,, запишем алгебраическое уравнение, отражающее закон сохранения массы веществ для данной реакции [c.7]
Решение. Искомая величина X — объем 8%-ного раствора серной кислоты. Уравнение составим на основании закона сохранения массы веществ масса серной кислоты в X л 8%-ного раствора равна массе кислоты в 0,6 л 0,1 М раствора. [c.70]
Материальный баланс составляется на основании закона сохранения массы вещества, согласно которому во всякой замкнутой системе масса веществ, встуинвии х в реакцию, равна массе веществ, получившихся в результате реакции. Материальный баланс технологического процесса — это масса веществ, поступивших на технологическую операцию (приход), равная массе веществ, полученных в ее результате (расход) [c.62]
ЧТО выражает закон сохранения массы веществ в химических реакциях (1).
 Однако мы не будем требовать существования положительного решения системы (10), благодаря чему аналогично (7)—(9) можно рассматривать классы задач, подобные приведенному примеру 1. Обозначим через А матрицу, строками которой являются все лпнейно независимые решения системы (10), т. е. [c.106]
Однако мы не будем требовать существования положительного решения системы (10), благодаря чему аналогично (7)—(9) можно рассматривать классы задач, подобные приведенному примеру 1. Обозначим через А матрицу, строками которой являются все лпнейно независимые решения системы (10), т. е. [c.106]М. В. Ломоносов первым из ученых (в 1748 г.) сформулировал закон сохранения массы вещества при химической реакции. Q писал … все перСхМены, в., натуре случающиеся, такого суть состояния, что, сколько чего у одного тела отнимается, столько присовокупится к другому . Этот закон в современной формулировке гласит Масса веществ, вступивших в реакцию, всегда равна массе веществ, образовавшихся в результате реакции. [c.3]
В исходной молекуле кислорода содержится 2 атома кислорода. В одной молекуле продукта реакции — воды -только один аюм О. Таким образом, если провзаимодействовала одна молекула О , то, чтобы выполнялся закон сохранения массы вещества, должно образоваться 2 молекулы воды. В двух молекулах воды содержится 4 атома водорода. А в исходных молекулах водорода — по два атома в молекуле. Значит, для получения двух молекул воды необходимы две молекулы li . Таким образом схему реакции можно превратить в уравнение [c.250]
В двух молекулах воды содержится 4 атома водорода. А в исходных молекулах водорода — по два атома в молекуле. Значит, для получения двух молекул воды необходимы две молекулы li . Таким образом схему реакции можно превратить в уравнение [c.250]
Возникновение физической хнмии как самостоятельной науки относится к середине XVIII в. Первый в мире курс физической химии был создан М. В. Ломоносовым (1752—1754). На основе своих физико-химических исследований М. В. Ломоносов пришел к принципиально новому определению химии как науки о свойствах тел, исходя из того, что все изменения в природе связаны с движением материи. Он первым обосновал основной закон сохранения массы вещества и пришел к определению принципа сохранения материи и движения, получившего признание как всеобщий закон природы. [c.6]
Исследования М. В. Ломоносова позволили ему сформулировать основной закон природы — закон сохранения массы вещества (1758) Все перемены, в натуре случающиееся, такого суть состояния, что сколько чего у одного тела отнимается, столько же присоединяется к другому. Так, ежели где убудет несколько материи, то умножится в другом месте… Сей всеобщий естественный закон простирается и в самые правила движения… [c.15]
Так, ежели где убудет несколько материи, то умножится в другом месте… Сей всеобщий естественный закон простирается и в самые правила движения… [c.15]
Получено оно следующим образом. При взаимодействии цинка с соляной кислотой образуется хлорид цинка (Zn b) и выделяется свободный водород. Но поскольку в левой части уравнения в молекуле соляной кислоты содержится только один атом водорода и один атом хлора, то, согласно закону сохранения массы вещества, в реакцию должны вступить две молекулы соляной кислоты. [c.19]
Закон сохранения массы веществ. Уравнения химических реакций
В течение тысячелетий люди верили, что вещество может бесследно исчезать, а также возникать из ничего. Это утверждение подтвердил и такой известный учёный, как Роберт Бойль.
Бойль проделал множество опытов по прокаливанию металлов в запаянных ретортах и всякий раз масса окалины оказывалась больше массы прокаливаемого металла.
Вот что записал учёный после одного из своих опытов в 1673 году:
«После
двух часов нагревания был открыт запаянный кончик реторты, причём в неё
ворвался с шумом наружный воздух. По нашему наблюдению при этой операции была
прибыль в весе на 8 гранов…»
По нашему наблюдению при этой операции была
прибыль в весе на 8 гранов…»
Русский учёный М.В. Ломоносов предположил, что чувственный опыт обманывает нас. 5 июля 1748 года он написал в письме Леонарду Эйлеру:
«Все перемены в натуре случающиеся такого суть состояния, что сколько чего у одного тела отнимется, столько же присовокупится к другому. Так, ежели где убудет материи, то умножится в другом месте; сколько часов положит кто на бдение, столько же сну отнимет…»
Лишь в 1756 году Ломоносову удалось проверить опытным путём теоретически открытый закон сохранения массы вещества при химических реакциях. Подобно Бойлю русский учёный делал опыт в запаянных ретортах. Но, в отличие от Бойля, Ломоносов взвешивал сосуды как до, так и после прокаливания не вскрывая.
«Оными опытами нашлось, что славного Роберта Бойля мнение ложно, ибо без пропущения внешнего воздуха вес сожжённого металла остаётся в одной мере…»
youtube.com/embed/QBWIBsnoKB0?rel=0&wmode=opaque» frameborder=»0″ allowfullscreen=»true»>
Спустя 41 год после опытов Ломоносова французский учёный Антуан Лоран Лавуазье практически повторил формулировку закона в своём учебнике.
Современная формулировка закона сохранения массы:
Масса веществ, вступивших в реакцию, равна массе образовавшихся веществ.
С точки зрения атомно-молекулярного учения закон объясняется тем, что общее количество атомов в результате не изменятся, а происходит лишь их перегруппировка.
Закон сохранения массы веществ применяют при составлении уравнений химических реакций. Что такое уравнение реакции и как его составить?
Таким образом, уравнение химической реакции – это условная
запись химической реакции с помощью химических формул и коэффициентов.
Вещества, которые изначально вступили в реакцию, называются исходными веществами.
вещества, образующиеся в результате реакции, называются продуктами реакции.
Тренинг: (выполняя задания, дождитесь, когда картинка меняться не будет)Урок химии «Закон сохранения массы веществ». 8-й класс
Цель урока: Познакомить учащихся с законом сохранения массы веществ: материальным балансом химических уравнений.
Задачи.
- Продолжить работу по составлению уравнений реакций, формул веществ, определению валентности.
- Воспитывать чувство гордости за отечественного ученого М.В.Ломоносова.
- Развитие монологической речи, навыков самоконтроля, самостоятельной работы.
Тип урока: изучение новой темы.
Форма урока: традиционный урок.
Методические приемы: рассказ, демонстрация опыта, сообщения учащихся.
Понятия:
- химические уравнения;
- материальный баланс химических уравнений;
- масса вещества.

Оборудование: портрет М.В.Ломоносова, карточки-задания, мультимидийный проектор, прибор для демонстрации закона сохранения массы веществ, весы с разновесами, вещества: раствор H2SO4 и раствор CaCI2 .
Ход урока
I. Организационный момент.
II. Актуализация знаний учащихся.
1. Проверка домашнего задания (у доски).
а). Рассчитайте относительную молекулярную массу для следующих веществ:
Na2CO3; Р205; А1203
б). Рассчитайте массовую долю натрия в гидроксиде натрия
2. Индивидуальные задания (карточки-задания)
а) Разделить приведенные явления на физические и химические:
– процесс фотосинтеза,
– горение угля.
– ржавление гвоздя.
– испарение воды,
– сгибание гвоздя,
– дробление сахара,
– скисание молока,
– таяние мороженного.
– плавление парафиновой свечи.
б) Определить валентность элементов по формулам: NН3; С12О7; МпО2; СаС12
в) Рассчитайте молекулярные массы следующих веществ: NaNO3; А1СI3; КзРО4
3. Работа с классом.
а). Составить формулы веществ (устно).
|
IV |
Ш |
II | I | I | |||
| СО | Fе О | Мq | С1 | Na | P |
б). Определить валентность (устно)
Определить валентность (устно)
Р2О5 FеО Мqз N2 СиС12
в). Разделить вещества на группы:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| Р2О5; | Cа; | Ва; | NаС1; | А1; | С; | А1(ОН)3; | С12; | СаО; | Н2S; | S |
| простые: 2; 3; 5; 6; 8; 11 | сложные:1; 4; 7; 9; 10 | |||||||||
г). Задание № 4 стр. 5.
4Р + 5О2 → 2Р2О5
2Са + О2 → 2СаО
2АI + ЗСI2 →2А1С13
4А1 + ЗО2→2А12О3
Что собой представляет уравнение химической реакции?
(Условная запись химических процессов с помощью химических знаков и
символов. )
)
III. Изучение новой темы.
1. Записываем уравнение реакции и анализируем масса реагентов и продуктов реакции.
2Са + О2 → 2СаО
2*40 + 16*2 = 2*(40 + 16)
2. Демонстрация закона сохранения массы веществ.
В одно колено прибора для иллюстрации закона сохранения массы веществ 3–5 мм раствора хлорида кальция, в другое раствор серной кислоты и определяем вес прибора с растворами. Затем переливаем несколько раз растворы из одного колена в другое и вторично взвешиваем.
Вывод: Масса вступивших веществ в реакцию равна массе веществ образовавшихся
3. В этом и состоит закон сохранения массы веществ. Для нас, знающих, что в
ходе химических процессов происходят только лишь изменения соединений атомов
между собой при сохранении самих атомов, закон очевиден. Понятие атома в химии
установилось лишь в первой половине 19 века. Ученые химики того времени,
наблюдая и исследуя химические процессы, отмечали, что масса продуктов реакции
отличается от массы исходных веществ. Над данной проблемой работал Р.Бойль
(сжигал металлы в незапаянных ретортах). Он не учитывал возможность участия в
реакции газов.
Над данной проблемой работал Р.Бойль
(сжигал металлы в незапаянных ретортах). Он не учитывал возможность участия в
реакции газов.
Михаил Васильевич Ломоносов сумел доказать (практически), что в результате обжига металла общая масса продуктов реакции равна массе реагентов.
4. Значение закона (записываем в тетради).
- Вещества не исчезают бесследно и не образуются из ничего.
- Сущность химических явлений заключается в перераспределении атомов исходных веществ с образованием новых веществ.
- Позволяет составлять уравнения реакций и производить расчеты.
- Жизнь и деятельность М.В. Ломоносова . [1]
Приложение 1 (сообщение учащегося).
Приложение 2 (презентация).
6. Слово учителя: Особое внимание уделял М.В.Ломоносов подготовке
российских ученых. Возлагал на молодежь большие надежды. Он не принимал мнения,
что высшее образование необходимо только представителям господствующего класса.
Отрывок из стихотворения (читает ученик).
О вы, которых ожидает Отечество от недр своих
И видеть таковых желает,
Каких зовет от стран чужих,
О, ваши дни благословенны!
Дерзайте ныне ободренны
Раченьем вашим показать,
Что может собственных Платонов
И быстрых разумом Невтонов
Российская земля рождать.
Науки юношей питают,
Отраду старым подают,
В счастливой жизни украшают,
В несчастной случай берегут;
В домашних трудностях утеха
И в дальних странствах не помеха.
Науки пользуют везде,
Среди народов и в пустыне,
В градском шуму и наедине,
В покое сладки и в труде. [2]
7. Более двух столетий прошло со дня смерти М.В.Ломоносова. Лучшие люди России всегда отдавали должное его заслугам.
“На берегах Ледовитого моря подобно северному сиянию, блеснул Ломоносов. Ослепительно и прекрасно было это явление! Оно доказало собой, что человек есть
человек во всяком состоянии и во всяком климате, что гений умеет торжествовать
над всеми препятствиями, какие ни противопоставляет ему враждебная судьба, что,
наконец, русский способен ко всему великому и прекрасному не менее всякого
европейца”. В.Г. Белинский . [1]
Ослепительно и прекрасно было это явление! Оно доказало собой, что человек есть
человек во всяком состоянии и во всяком климате, что гений умеет торжествовать
над всеми препятствиями, какие ни противопоставляет ему враждебная судьба, что,
наконец, русский способен ко всему великому и прекрасному не менее всякого
европейца”. В.Г. Белинский . [1]
IV. Выводы по уроку:
- В чем сущность закона сохранения массы веществ?
Закон сохранения массы веществ заключается в том, что масса вступивших веществ в реакцию равна массе веществ образованных. - Какое значение имеет закон сохранения массы веществ?
Слово учителя:
Уравнение реакции отражает материальный баланс вступивших в реакцию веществ (реагентов) и образовавшихся продуктов.
V. Закрепление.
- Почему масса железной окалины больше массы железа? Какие вещества могут
входить в состав окалины? (В состав окалины входят железо и кислород.
 )
) - Почему масса золы меньше массы сгоревшей древесины? (Углекислый газ, вода испаряются.)
- Анализ уравнения реакции:
2Н2О → 2Н2 + О2
2*(1*2+16) = 2*2 + 2*16
VI. Домашнее задание.
§ 3.4, 3.5 вопрос № 1 стр.55 (устно).
Литература.
- Карпеев Э.П. Михаил Васильевич Ломоносов: Кн.для учащихся. – М. :Просвещение. 2007. – 96с.
- Ломоносов М.В. Избранное/ Сост., вступ. ст. и примеч. В.И. Коровина.-3-е изд.-М.: Дет. лит., 1978. – 128с. (стр. 51– 52).
- http://www.chemport.ru/data/ – электронный справочник по химии.
3.7: Сохранение массы – новой материи не существует
- Последнее обновление
- Сохранить как PDF
- Закон сохранения массы
- Резюме
- Вклады и атрибуции
Может показаться, что горение уничтожает материю, но после костра остается такое же количество или масса материи, как и прежде. Посмотрите на рисунок \(\PageIndex{1}\) ниже. Он показывает, что при горении древесина соединяется с кислородом и превращается не только в пепел, но и в углекислый газ и водяной пар. Газы улетучиваются в воздух, оставляя только пепел. Предположим, вы измерили массу дров до того, как они сгорели, и массу пепла после того, как они сгорели. Также предположим, что вы смогли измерить количество кислорода, используемого при пожаре, и газов, образующихся при пожаре. Что бы вы нашли? Общая масса материи после пожара будет такой же, как и общая масса материи до пожара.
Посмотрите на рисунок \(\PageIndex{1}\) ниже. Он показывает, что при горении древесина соединяется с кислородом и превращается не только в пепел, но и в углекислый газ и водяной пар. Газы улетучиваются в воздух, оставляя только пепел. Предположим, вы измерили массу дров до того, как они сгорели, и массу пепла после того, как они сгорели. Также предположим, что вы смогли измерить количество кислорода, используемого при пожаре, и газов, образующихся при пожаре. Что бы вы нашли? Общая масса материи после пожара будет такой же, как и общая масса материи до пожара.
Закон сохранения массы
Закон сохранения массы был открыт в 1789 году французским химиком Антуаном Лавуазье. Закон сохранения массы гласит, что материя не может быть создана или уничтожена в результате химической реакции. Например, при горении дерева масса сажи, золы и газов равна первоначальной массе древесного угля и кислорода, когда они впервые вступали в реакцию.Таким образом, масса продукта равна массе реагента. Реагент – это химическая реакция двух или более элементов с образованием нового вещества, а продукт – это вещество, образующееся в результате химической реакции (видео \(\PageIndex{1}\)). Материя и соответствующая ей масса не могут быть созданы или уничтожены, но могут превращаться в другие вещества, такие как жидкости, газы и твердые тела.
Например, при горении дерева масса сажи, золы и газов равна первоначальной массе древесного угля и кислорода, когда они впервые вступали в реакцию.Таким образом, масса продукта равна массе реагента. Реагент – это химическая реакция двух или более элементов с образованием нового вещества, а продукт – это вещество, образующееся в результате химической реакции (видео \(\PageIndex{1}\)). Материя и соответствующая ей масса не могут быть созданы или уничтожены, но могут превращаться в другие вещества, такие как жидкости, газы и твердые тела.
Если вы станете свидетелем того, как 300-килограммовое дерево сгорит дотла, после сожжения останется только пепел, и все они вместе весят 10 кг. Это может заставить вас задаться вопросом, куда делись остальные 290 кг. Недостающие 290 кг были выброшены в атмосферу в виде дыма, поэтому единственное, что вы можете увидеть, это 10 кг пепла. Если вы знаете закон сохранения массы, то вы знаете, что остальные 290 кг должны куда-то деться, потому что они должны равняться массе дерева до того, как оно сгорит.
Пример \(\PageIndex{1}\)
При обогреве 10.0 граммов карбоната кальция (CaCO 3 ) дает 4,4 г двуокиси углерода (CO 2 ) и 5,6 г оксида кальция (CaO), показывают, что эти наблюдения согласуются с законом сохранения массы.
Раствор
\[\begin{align*} \text{Масса реагентов} &= \text{Масса продуктов} \\[4pt] 10,0\, \text{г } \ce{CaCO3} &= 4,4 \ ,\text{г }\ce{CO2} + 5,6\, \text{г } \ce{CaO} \\[4pt] 10,0\,\text{г реагента} &= 10.0\, \text{g товаров} \end{align*}\]
Поскольку масса реагента равна массе продуктов, наблюдения согласуются с законом сохранения массы.
Упражнение \(\PageIndex{1}\)
Гидроксид калия (\(\ce{KOH}\)) легко реагирует с диоксидом углерода (\(\ce{CO2}\)) с образованием карбоната калия (\(\ce{K2CO3}\)) и воды (\( \ce{h3O}\)). Сколько граммов карбоната калия образуется, если 224,4 г \(\ce{KOH}\) реагирует с 88.0 г \(\ce{CO2}\)? В результате реакции также образуется 36,0 г воды.
- Ответить
- 276,4 г карбоната калия
Закон также применим как к химическим, так и к физическим изменениям. Например, если у вас есть кубик льда, который превращается в жидкость, и вы нагреваете эту жидкость, она становится газом. Кажется, что он исчез, но все еще там.
Резюме
- Горение и другие изменения материи не разрушают материю.
- Масса материи всегда одинакова до и после того, как происходят изменения.
- Закон сохранения массы гласит, что материя не может быть создана или уничтожена.
Взносы и ссылки
Эта страница была создана на основе контента следующих авторов и отредактирована (тематически или подробно) командой разработчиков LibreTexts в соответствии со стилем, презентацией и качеством платформы:
5.1: Закон сохранения материи
Цели обучения
- Правильно определить закон в том, что касается науки.

- Назовите закон сохранения материи.
В науке закон — это общее утверждение, объясняющее большое количество наблюдений. Прежде чем быть принятым, закон должен быть многократно проверен при многих условиях. Поэтому законы считаются высшей формой научного знания и обычно считаются неприкосновенными. Научные законы составляют ядро научного знания. Одним из научных законов, лежащих в основе понимания химии, является закон сохранения материи.В нем говорится, что в любой данной системе, закрытой для переноса материи (входящей и исходящей), количество материи в системе остается постоянным. Краткий способ выразить этот закон состоит в том, чтобы сказать, что количество материи в системе составляет сохраненных .
С развитием более точных представлений об элементах, соединениях и смесях ученые начали исследовать, как и почему вещества реагируют. Французский химик А. Лавуазье положил начало научному изучению вещества, указав, что вещества реагируют по определенным законам. {\text{Кислород}}}_{\text{7,4 г}} \]
{\text{Кислород}}}_{\text{7,4 г}} \]
Другой способ выразить это так: «В химической реакции материя не создается и не разрушается». Закон сохранения массы также известен как «закон неразрушимости материи».
Пример \(\PageIndex{1}\)
Если при нагревании 10 граммов \(\ce{CaCO3}\) образуется 4,4 г \(\ce{CO2}\) и 5,6 г \(\ce{CaO}\), покажите, что эти наблюдения согласуются с закон сохранения массы.
Образец карбоната кальция (CaCO 3 ).(Общественное достояние; Уокерма).
Раствор
- Масса реагентов, \(\ce{CaCO3}\) : \(10 \,г\)
- Массы продуктов, \(\ce{CO2}\) и \(\ce{CaO}\): \(4,4 \,г+ 5,6\, г = 10\, г\).
Поскольку масса реагентов = масса продуктов, наблюдения согласуются с законом сохранения массы.
Что это значит для химии? При любом химическом изменении одно или несколько исходных веществ превращаются в другое вещество или вещества. И начальная, и конечная субстанции состоят из атомов, потому что вся материя состоит из атомов. Согласно закону сохранения материи, материя не создается и не разрушается, поэтому мы должны иметь такое же число и вид атомов после химического изменения, какие были до химического изменения.
И начальная, и конечная субстанции состоят из атомов, потому что вся материя состоит из атомов. Согласно закону сохранения материи, материя не создается и не разрушается, поэтому мы должны иметь такое же число и вид атомов после химического изменения, какие были до химического изменения.
Может показаться, что горение уничтожает материю, но после костра остается то же количество или масса материи, что и раньше. На рис. 5.1.1 показано, что при горении древесина соединяется с кислородом и превращается не только в пепел, но и в углекислый газ и водяной пар.Газы улетучиваются в воздух, оставляя только пепел. Предположим, мы измерили массу дров до того, как они сгорели, и массу пепла после того, как они сгорели. Предположим также, что мы смогли измерить количество кислорода, используемого при пожаре, и газов, образующихся при пожаре. Что бы мы нашли? Общая масса материи после пожара будет такой же, как и общая масса материи до пожара.
Рисунок 5.1.1: Горение – это химический процесс. Пламя возникает в результате сгорания топлива (горения).Изображения использованы с разрешения (CC BY-SA 2.5; Эйнар Хелланд Бергер для огня и пепла).
Пламя возникает в результате сгорания топлива (горения).Изображения использованы с разрешения (CC BY-SA 2.5; Эйнар Хелланд Бергер для огня и пепла).Упражнение \(\PageIndex{1}\)
- Что такое закон сохранения материи?
- Как закон сохранения материи применим к химии?
- Ответ a:
Закон сохранения материи гласит, что в любой данной системе, закрытой для переноса материи, количество материи в системе остается постоянным
- Ответ б:
Закон сохранения вещества гласит, что в химических реакциях общая масса продуктов должна равняться общей массе реагентов.
Ключ на вынос
Количество вещества в закрытой системе сохраняется.
Авторы и авторство
Упражнения
Выразите закон сохранения материи своими словами.
2. Объясните, почему концепция сохранения материи считается научным законом.
Объясните, почему концепция сохранения материи считается научным законом.
3. Гидроксид калия (\(\ce{KOH}\)) легко реагирует с диоксидом углерода (\(\ce{CO2}\)) с образованием карбоната калия (\(\ce{K2CO3}\)) и воды ( \(\ce{h3O}\)).Сколько граммов карбоната калия получится, если 224,4 г \(\ce{KOH}\) прореагируют с 88,0 г \(\ce{CO2}\). В результате реакции также образовалось 36,0 г воды.
Ответы
1. Материя не может быть создана или уничтожена.
2. Концепция является научным законом, поскольку она основана на экспериментировании.
3. 276,4 г
2 простых примера закона сохранения массы
Химия — важный предмет, который вам обязательно нужно знать, если вы планируете изучать химию или другую научную специальность в колледже. Одна вещь, с которой вы должны быть знакомы, это закон сохранения массы. Что это? И как это используется в химии?
Продолжайте читать, чтобы узнать, что такое закон сохранения массы и как он появился. Мы также дадим вам несколько примеров закона сохранения массы, чтобы помочь вам лучше понять концепцию.
Мы также дадим вам несколько примеров закона сохранения массы, чтобы помочь вам лучше понять концепцию.
Что такое закон сохранения массы?
Во-первых, что такое закон сохранения массы? Этот закон гласит, что в закрытой системе материя не может быть ни создана, ни уничтожена — она может только менять форму.
Иными словами, количество или масса вещества в изолированной системе будет всегда постоянной независимо от любых химических реакций или физических изменений, которые происходят. (Обратите внимание, что изолированная или закрытая система — это система, которая не взаимодействует с окружающей средой.)
Этот закон важен в химии, особенно при комбинировании различных материалов и проверке реакций между ними.
В химии закон сохранения массы гласит, что масса продуктов (химических веществ, образующихся в результате химической реакции) всегда будет равна массе реагентов (веществ, вступающих в химическую реакцию).
Представьте, что это похоже на балансировку алгебраического уравнения. Обе стороны вокруг знака равенства могут выглядеть по-разному (например, 6 a + 2 b = 20), но они по-прежнему представляют одно и то же общее количество. Это похоже на то, как масса должна быть постоянной для всей материи в замкнутой системе, даже если эта материя меняет форму!
Но как работает закон сохранения массы?
Когда вещество подвергается химической реакции, вы можете предположить, что часть или даже вся присутствующая материя исчезает, но на самом деле это просто изменение формы.
Подумайте о том, когда жидкость превращается в газ. Можно подумать, что материя (в данном случае жидкость) просто исчезла. Но если бы вы действительно измерили газ, , вы бы обнаружили, что начальная масса жидкости на самом деле не изменилась. Это означает, что вещество, которое теперь является газом, по-прежнему имеет ту же массу, что и когда оно было жидкостью (да, газ тоже имеет массу!).
Какова история, стоящая за законом сохранения массы?
Хотя многие люди, в том числе древние греки, заложили научную основу, необходимую для открытия закона сохранения массы, именно французский химик Антуан Лавуазье (1743-1794) чаще всего считается его первооткрывателем .Вот почему этот закон иногда называют законом Лавуазье.
Лавуазье гордится своим открытием.
В конце 1700-х годов Лавуазье экспериментально доказал, что общая масса , а не изменяется в химической реакции, что привело его к заявлению, что материя всегда сохраняется в химической реакции.
Эксперименты Лавуазье ознаменовали собой первый случай, когда кто-то четко проверил эту идею сохранения материи, измерив массы материалов до и после того, как они подверглись химической реакции.
В конечном счете, открытие закона сохранения массы имело огромное значение для области химии, потому что оно доказало, что материя не просто исчезает (как казалось), а скорее меняет форму на другую субстанцию с такой же массой.
Каковы некоторые законы сохранения массы Примеры?
Закон сохранения массы Примеры полезны для визуализации и понимания этой важной научной концепции. Вот два примера, которые помогут проиллюстрировать, как работает этот закон.
Пример 1: костер/походный костер
Одним из распространенных примеров, с которым вы столкнетесь, является изображение костра или походного костра.
Представьте себе: вы собрали с друзьями несколько палочек и зажгли их спичкой. После пары поджаренных зефирок и песен у костра вы понимаете, что костер, или костер, который вы развели, полностью сгорел. Все, что у вас осталось, это небольшая кучка пепла и немного дыма.
Поначалу вы можете предположить, что часть исходной массы костров из веток каким-то образом исчезла.Но на самом деле нет — он просто преобразился!
В этом сценарии, когда палочки горят, они соединяются с кислородом воздуха, превращаясь не только в пепел, но также в углекислый газ и водяной пар. В результате, если бы мы измерили общую массу деревянных палочек и кислорода до того, как подожгли палочки, мы бы обнаружили, что эта масса равна массе пепла, углекислого газа и водяного пара вместе взятых. .
В результате, если бы мы измерили общую массу деревянных палочек и кислорода до того, как подожгли палочки, мы бы обнаружили, что эта масса равна массе пепла, углекислого газа и водяного пара вместе взятых. .
Пример 2: Горящая свеча
Аналогичным законом сохранения массы является пример изображения горящей свечи.
Для этого примера представьте обычную свечу с воском и фитилем. Однако, как только свеча полностью сгорит, вы увидите, что воска определенно намного меньше, чем было до того, как вы ее зажгли. Это означает, что часть воска (не вся, как вы, вероятно, заметили по зажженным свечам в реальной жизни!) превратилась в газов , а именно в водяной пар и углекислый газ.
Как показал предыдущий пример с костром, никакая материя (и, следовательно, никакая масса) не теряется в процессе горения.
Резюме
: что такое закон сохранения массы?
Закон сохранения массы — научный закон, популяризированный и систематизированный французским химиком XVIII века Антуаном Лавуазье.
Согласно закону , в изолированной системе материя не может быть создана или уничтожена — только изменена. Это означает, что общая масса всех веществ до химической реакции будет равна общей массе всех веществ после химической реакции.Проще говоря, материя (и, следовательно, масса) всегда сохраняется, даже если вещество меняет химическую или физическую форму.
Знание этого научного закона важно для изучения химии, поэтому, если вы планируете заняться этой областью, вам обязательно нужно понять, что такое закон сохранения массы!
Что дальше?
Есть ли другие научные темы, которые вы хотите рассмотреть? Тогда вам повезло! Наши гиды научат вас множеству полезных тем, от как конвертировать градусы Цельсия в градусы Фаренгейта, до плотности воды и до того, как сбалансировать химические уравнения.
Нужна помощь в определении стилистических приемов в книге, которую вы читаете на уроке английского языка? Пусть наш полный список самых важных литературных приемов поможет вам!
Сохранение материи при физических и химических изменениях
Материя составляет все видимое в известной Вселенной, от переносных горшков до сверхновых. А поскольку материя никогда не создается и не уничтожается, она вращается в нашем мире.Атомы, которые были в динозавре миллионы лет назад — и в звезде миллиарды лет до этого — могут быть внутри вас сегодня.
А поскольку материя никогда не создается и не уничтожается, она вращается в нашем мире.Атомы, которые были в динозавре миллионы лет назад — и в звезде миллиарды лет до этого — могут быть внутри вас сегодня.
Материя — это все, что имеет массу и занимает пространство. Он включает в себя молекулы, атомы, элементарные частицы и любое вещество, из которого состоят эти частицы. Материя может изменять форму посредством физических и химических изменений, но при любом из этих изменений материя сохраняется . До и после изменения существует одинаковое количество материи — ни одна из них не создается и не уничтожается.Эта концепция называется законом сохранения массы.
При физическом изменении физические свойства вещества могут измениться, но его химический состав не изменится. Вода, например, состоит из двух атомов водорода и одного атома кислорода. Вода — единственное известное вещество на Земле, которое существует в природе в трех состояниях: твердом, жидком и газообразном. Чтобы перейти из одного состояния в другое, вода должна претерпевать физические изменения. Когда вода замерзает, она становится твердой и менее плотной, но химически остается прежней.До и после изменения присутствует одинаковое количество молекул воды, а химические свойства воды остаются постоянными.
Чтобы перейти из одного состояния в другое, вода должна претерпевать физические изменения. Когда вода замерзает, она становится твердой и менее плотной, но химически остается прежней.До и после изменения присутствует одинаковое количество молекул воды, а химические свойства воды остаются постоянными.
Однако для образования воды атомы водорода и кислорода должны подвергнуться химическим изменениям. Чтобы произошло химическое изменение, атомы должны либо разорвать связи, либо образовать связи. Добавление или вычитание атомных связей изменяет химические свойства участвующих веществ. И водород, и кислород двухатомны — в природе они существуют в виде связанных пар (H 2 и O 2 соответственно).В правильных условиях и при наличии достаточной энергии эти двухатомные связи разорвутся, и атомы соединятся, образуя H 2 O (вода). Химики записывают эту химическую реакцию как:
.2H 2 + O 2 → 2H 2 O
Это уравнение говорит о том, что для образования двух молекул воды требуется две молекулы водорода и одна молекула кислорода. Обратите внимание, что с обеих сторон уравнения одинаковое количество атомов водорода и атомов кислорода. В химических изменениях, как и в физических, материя сохраняется.Отличие в данном случае состоит в том, что вещества до и после изменения имеют разные физические и химические свойства. Водород и кислород представляют собой газы при стандартной температуре и давлении, тогда как вода представляет собой бесцветную жидкость без запаха.
Обратите внимание, что с обеих сторон уравнения одинаковое количество атомов водорода и атомов кислорода. В химических изменениях, как и в физических, материя сохраняется.Отличие в данном случае состоит в том, что вещества до и после изменения имеют разные физические и химические свойства. Водород и кислород представляют собой газы при стандартной температуре и давлении, тогда как вода представляет собой бесцветную жидкость без запаха.
В экосистемах происходит множество химических и физических изменений, происходящих одновременно, и материя сохраняется в каждой из них — без исключений. Рассмотрим поток, текущий через каньон — сколько химических и физических изменений происходит в любой данный момент?
Сначала рассмотрим воду.Во многих ручьях каньонов вода поступает с возвышенностей и образуется в виде снега. Конечно, вода не начиналась с — она вращалась по всему миру с тех пор, как на Земле впервые появилась вода. Но в контексте каньонного ручья он начинался в горах как снег. Снег должен пройти физическое изменение — растаять — чтобы присоединиться к потоку. Когда жидкая вода течет через каньон, она может испаряться (еще одно физическое изменение) в водяной пар. Вода дает очень яркий пример того, как материя движется по кругу в нашем мире, часто меняя форму, но никогда не исчезая.
Снег должен пройти физическое изменение — растаять — чтобы присоединиться к потоку. Когда жидкая вода течет через каньон, она может испаряться (еще одно физическое изменение) в водяной пар. Вода дает очень яркий пример того, как материя движется по кругу в нашем мире, часто меняя форму, но никогда не исчезая.
Далее рассмотрим растения и водоросли, живущие в ручье и вдоль него. В процессе, называемом фотосинтезом, эти организмы преобразуют световую энергию солнца в химическую энергию, хранящуюся в сахарах. Однако световая энергия не производит атомы, из которых состоят эти сахара — это нарушило бы закон сохранения массы — она просто обеспечивает энергию для химических изменений. Атомы образуются из углекислого газа в воздухе и воды в почве. Энергия света позволяет этим связям разорваться и восстановиться для производства сахара и кислорода, как показано в химическом уравнении фотосинтеза:
6CO 2 + 6H 2 O + светлый → C 6 H 12 O 6 (сахар)+ 6O 2
Это уравнение говорит о том, что шесть молекул углекислого газа соединяются с шестью молекулами воды, образуя одну молекулу сахара и шесть молекул кислорода. Если вы сложите все атомы углерода, водорода и кислорода по обе стороны уравнения, суммы будут равны; материя сохраняется в этом химическом изменении.
Если вы сложите все атомы углерода, водорода и кислорода по обе стороны уравнения, суммы будут равны; материя сохраняется в этом химическом изменении.
Когда животные в ручье и вокруг него едят эти растения, их тела используют накопленную химическую энергию для питания своих клеток и передвижения. Они используют питательные вещества в своей пище для роста и восстановления своих тел — атомы для новых клеток должны откуда-то браться. Любая пища, попадающая в организм животного, должна либо покинуть его тело, либо стать его частью; атомы не разрушаются и не создаются.
Вещество также сохраняется во время физических и химических изменений в горном цикле. По мере того, как ручей углубляется в каньон, камни на дне каньона не исчезают. Они размываются потоком и уносятся небольшими кусочками, называемыми отложениями. Эти отложения могут оседать на дне озера или пруда в конце ручья, со временем накапливаясь слоями. Вес каждого дополнительного слоя уплотняет слои под ним, в конечном итоге добавляя такое большое давление, что образуются новые осадочные породы. Это физическое изменение камня, но при правильных условиях камень может измениться и химически. В любом случае вещество в породе сохраняется.
Это физическое изменение камня, но при правильных условиях камень может измениться и химически. В любом случае вещество в породе сохраняется.
Суть в следующем: Материя циркулирует во Вселенной в различных формах. При любом физическом или химическом изменении материя не появляется и не исчезает. Атомы, созданные звездами (очень, очень давно), составляют все живое и неживое на Земле — даже вас. Невозможно узнать, как далеко и через какие формы прошли ваши атомы, чтобы создать вас.И невозможно знать, где они окажутся в следующий раз.
Это не вся история материи, однако, это история видимой материи. Ученые узнали, что около 25 процентов массы Вселенной состоит из темной материи — материи, которую нельзя увидеть, но которую можно обнаружить благодаря ее гравитационным эффектам. Точная природа темной материи еще не определена. Еще 70 процентов Вселенной — это еще более загадочный компонент, называемый темной энергией, который действует в противовес гравитации.Таким образом, «нормальная» материя составляет не более пяти процентов Вселенной.
Сохранение массы при растворении и осаждении | 11-14 лет | План урока
Это простое практическое задание заставляет учащихся задуматься о сохранении массы, когда вещества растворяются или когда в результате химических реакций образуются осадки. Работая в малых группах, они проводят простой эксперимент и согласовывают ответы на вопросы.
Цели обучения
Учащиеся смогут объяснить, что:
- Масса сохраняется при растворении.
- Масса сохраняется во время реакции осаждения.
- Какое бы изменение ни произошло, общая масса вовлеченных веществ не изменится.
Последовательность действий
Введение
Представьте тему и цели обучения, объяснив учащимся, что они собираются посмотреть на два события, которые:
- Люди часто объясняют, используя разные идеи.
- В химии много попадется, поэтому нужно правильно их понять.
Деятельность: этап 1
Дайте каждому учащемуся рабочий лист «Растворение и осаждение».
Разделите учащихся на группы по три человека. Дайте каждой группе по одной колбе с надписью «Растворение».
Распространение и поддержка подсказок группами:
- Работа над растворяющей задачей.
- Обсудить результаты и согласовать объяснение.
- Выберите представителя, который объяснит доводы своей группы перед остальным классом.
Дайте группам примерно 15 минут на выполнение задания.
Пленарное заседание 1
На пленарном заседании:
- Извлеките из каждой группы информацию об их понимании того, что масса сохраняется при растворении веществ.
Объясните, что в следующем задании они собираются протестировать другое событие.
Деятельность: этап 2
Дайте каждой группе по одной колбе с надписью «Осадок».
Распространение и поддержка подсказок группами:
- Работа над заданием на осадки.
- Обсудить результаты и согласовать объяснение.

- Выберите представителя, который объяснит доводы своей группы перед остальным классом.
Дайте группам примерно 15 минут на выполнение задания.
Пленарное заседание 2
На пленарном заседании:
- Извлеките из каждой группы информацию об их понимании того, что масса сохраняется при образовании осадка.
- Попросите учащихся подумать, как изменилось их мышление во время выполнения экспериментов, и записать это на обратной стороне рабочих листов.
- Собрать в рабочих листах.
Обратная связь
При предоставлении письменного отзыва:
- Укажите, где индивидуальные идеи учащихся неверны.
- Поддерживайте и поощряйте учащихся в изменении их мышления на научно правильную точку зрения.
Комментарий
Идея сохранения массы играет центральную роль в развитии хорошего понимания химических реакций. Делясь своими идеями в «безопасных» группах, учащиеся могут продвигаться к научному пониманию на поддерживаемой основе.
Обратная связь с классом позволяет учителю оценить, поняли ли группы ключевую концепцию.
Письменная обратная связь может указать учащимся, которым все еще нужно изменить свое мышление, и поощрить тех, кто сформировал правильное мнение.
Практические указания
Оборудование
Для подготовленных колб с надписью «Растворение» (см. «Примечания по охране труда и технике безопасности», примечания 3 и 4)
- Коническая колба, 500 см 3
- Небольшая трубка для удобного размещения внутри колбы
- Пробки для плотного прилегания к колбе
- Вода, около 150 см 3 в колбе
- Около 5–10 г одного из следующих твердых веществ в маленьких пробирках: хлорид натрия, сахар, сульфат меди (II) (ВРЕДНО)
Для подготовленных колб с маркировкой «Осадки» (см. «Примечания по охране труда и технике безопасности», примечания 3 и 5)
- Коническая колба, 500 см 3
- Небольшая трубка для удобного размещения внутри колбы
- Пробки для плотного прилегания к колбе
- Пары растворов на 1 моль дм -3 , образующих осадок при смешивании (например, сульфат натрия/нитрат бария (ВРЕДНЫЕ и ОКИСЛЯЮЩИЕ), йодид калия/нитрат свинца(II) (ТОКСИЧЕСКИЕ), фосфат аммония/хлорид кальция (РАЗДРАЖАЮЩИЙ))
Другое оборудование
- Доступ к балансу взвешивания до 0.
 01 г
01 г
Здоровье, безопасность и технические примечания
- Прочтите наше стандартное руководство по охране труда и технике безопасности.
- Учитель несет ответственность за проведение соответствующей оценки риска.
- Чтобы подготовить колбы, обвяжите ниткой горлышки маленьких трубочек. Убедитесь, что длина резьбы поддерживает пробирку в вертикальном положении в колбе, но позволяет содержимому смешиваться, когда колба наклонена, но не открывается.
- Поместите выбранное тело в пробирку.Налейте в колбу около 150 см 3 воды. Нитью расположите подготовленную пробирку в колбе так, чтобы содержимое перемешивалось при наклоне колбы. Пометьте колбу «Растворить».
- Поместите выбранный раствор (10–20 см 3 ) в пробирку. Поместите второй раствор в колбу. Нитью расположите подготовленные пробирки в колбе так, чтобы содержимое перемешивалось при наклоне колбы. Пометьте колбу «Осадок».
Основная опасность
- Ненадежные пробки в колбе, что приводит к утечке.

Альтернативная стратегия
Если времени и/или ресурсов мало, учитель может продемонстрировать химические явления. Группы могут обсудить результаты и сделать свои прогнозы, как было предложено.
Ответы
Значения массы должны оставаться неизменными при растворении и осаждении. Ответы должны отражать это.
Заметки по обучению в начальной школе
Если вы преподаете естественные науки, см. руководство ниже, чтобы узнать, как использовать этот ресурс.
Развитие навыков
Дети будут развивать свои научные навыки с помощью:
- Задавать собственные вопросы о научных явлениях.
- Использование ряда научного оборудования для проведения точных и точных измерений или показаний.
- Использование соответствующего научного языка и идей для объяснения, оценки и передачи своих результатов.
Результаты обучения
Дети будут:
- Обратите внимание, что некоторые материалы растворяются в жидкости с образованием раствора, и опишите, как извлечь вещество из раствора.

- Показать, что растворение, смешение и изменение состояния являются обратимыми изменениями.
Поддерживаемые концепции
Дети узнают:
- Некоторые материалы растворяются с образованием раствора.
- Что материалы все еще присутствуют, когда они растворились, и что они не исчезли.
- Эта масса сохраняется при растворении и осаждении.
Рекомендуемое использование деятельности
Это задание можно использовать для изучения процессов растворения и осаждения всем классом, когда дети работают в малых группах, наблюдая и отвечая на заданные вопросы.В качестве альтернативы взрослые могут продемонстрировать эти действия, чтобы стимулировать обсуждение и вопросы.
Практические соображения
Важно, чтобы ключевые слова «растворять» и «осаждать» правильно понимались детьми при вступлении в эту деятельность.
Задание «Растворение» более актуально для основной учебной программы по естественным наукам, и ему можно было бы уделить больше внимания.
Конические колбы, пробки и пробирки могут не потребоваться для этого вида деятельности, если можно найти альтернативные источники, такие как мини-бутылки для поп-музыки и чистые горшки из творога.
%PDF-1.4 % 2287 0 объект > эндообъект внешняя ссылка 2287 1200 0000000016 00000 н 0000030508 00000 н 0000030721 00000 н 0000030969 00000 н 0000031101 00000 н 0000031361 00000 н 0000031416 00000 н 0000031555 00000 н 0000031695 00000 н 0000031835 00000 н 0000031974 00000 н 0000034145 00000 н 0000034196 00000 н 0000034248 00000 н 0000034299 00000 н 0000034350 00000 н 0000034401 00000 н 0000034452 00000 н 0000034504 00000 н 0000034554 00000 н 0000034604 00000 н 0000034655 00000 н 0000034706 00000 н 0000034757 00000 н 0000034809 00000 н 0000034860 00000 н 0000034911 00000 н 0000034963 00000 н 0000035014 00000 н 0000035066 00000 н 0000035117 00000 н 0000035168 00000 н 0000035220 00000 н 0000035271 00000 н 0000035322 00000 н 0000035373 00000 н 0000035439 00000 н 0000045121 00000 н 0000054792 00000 н 0000054857 00000 н 0000062910 00000 н 0000070172 00000 н 0000077656 00000 н 0000084359 00000 н 0000085554 00000 н 0000086755 00000 н 0000087294 00000 н 0000088291 00000 н 0000089481 00000 н 00000
00000 н 0000091475 00000 н 0000092472 00000 н 0000093469 00000 н 0000094466 00000 н 0000094533 00000 н 0000095530 00000 н 0000096719 00000 н 0000097907 00000 н 0000099107 00000 н 0000113604 00000 н 0000113825 00000 н 0000114162 00000 н 0000114282 00000 н 0000128219 00000 н 0000128437 00000 н 0000128815 00000 н 0000128981 00000 н 0000129187 00000 н 0000129566 00000 н 0000129790 00000 н 0000143625 00000 н 0000143848 00000 н 0000144220 00000 н 0000144365 00000 н 0000157867 00000 н 0000158073 00000 н 0000158466 00000 н 0000158743 00000 н 0000159937 00000 н 0000161135 00000 н 0000182885 00000 н 0000183095 00000 н 0000197394 00000 н 0000197617 00000 н 0000197674 00000 н 0000203058 00000 н 0000203259 00000 н 0000327885 00000 н 0000328087 00000 н 0000328149 00000 н 0000337904 00000 н 0000346064 00000 н 0000346119 00000 н 0000346663 00000 н 0000360762 00000 н 0000360944 00000 н 0000362385 00000 н 0000362822 00000 н 0000364099 00000 н 0000364220 00000 н 0000364727 00000 н 0000364847 00000 н 0000365744 00000 н 0000365883 00000 н 0000366709 00000 н 0000366899 00000 н 0000367927 00000 н 0000369288 00000 н 0000370659 00000 н 0000371740 00000 н 0000371860 00000 н 0000372380 00000 н 0000372573 00000 н 0000373347 00000 н 0000373465 00000 н 0000373973 00000 н 0000374169 00000 н 0000375004 00000 н 0000375684 00000 н 0000381515 00000 н 0000382025 00000 н 0000382690 00000 н 0000383285 00000 н 0000383932 00000 н 0000384663 00000 н 0000385422 00000 н 0000386149 00000 н 0000387052 00000 н 0000387188 00000 н 0000387404 00000 н 0000387547 00000 н 0000387763 00000 н 0000387928 00000 н 0000388148 00000 н 0000392520 00000 н 0000392705 00000 н 0000392901 00000 н 0000393589 00000 н 0000394270 00000 н 0000399067 00000 н 0000399890 00000 н 0000400302 00000 н 0000400600 00000 н 0000402431 00000 н 0000404076 00000 н 0000404872 00000 н 0000405042 00000 н 0000406224 00000 н 0000406966 00000 н 0000407807 00000 н 0000408835 00000 н 0000408899 00000 н 0000409127 00000 н 0000409241 00000 н 0000409441 00000 н 0000409610 00000 н 0000411313 00000 н 0000412561 00000 н 0000412793 00000 н 0000413021 00000 н 0000415628 00000 н 0000418889 00000 н 0000421655 00000 н 0000424104 00000 н 0000425970 00000 н 0000428756 00000 н 0000431440 00000 н 0000443763 00000 н 0000448806 00000 н 0000452708 00000 н 0000457847 00000 н 0000464425 00000 н 0000475692 00000 н 0000480814 00000 н 0000484675 00000 н 0000486557 00000 н 0000488277 00000 н 0000489218 00000 н 00004
00000 н 0000490910 00000 н 0000494268 00000 н 0000494627 00000 н 0000500747 00000 н 0000501028 00000 н 0000506027 00000 н 0000506254 00000 н 0000509550 00000 н 0000512205 00000 н 0000513560 00000 н 0000534474 00000 н 0000548754 00000 н 0000569199 00000 н 0000589638 00000 н 0000603932 00000 н 0000624282 00000 н 0000638711 00000 н 0000659122 00000 н 0000679595 00000 н 0000693969 00000 н 0000714479 00000 н 0000734937 00000 н 0000749291 00000 н 0000769820 00000 н 00007
00000 н 0000810776 00000 н 0000825420 00000 н 0000846217 00000 н 0000866693 00000 н 0000878245 00000 н 0000889817 00000 н 0000910686 00000 н 0000922523 00000 н 0000934337 00000 н 0000946126 00000 н 0000966904 00000 н 0000978856 00000 н 0000998791 00000 н 0001009941 00000 н 0001021132 00000 н 0001041567 00000 н 0001053154 00000 н 0001064740 00000 н 0001084571 00000 н 0001095706 00000 н 0001106835 00000 н 0001107122 00000 н 0001107410 00000 н 0001107768 00000 н 0001107888 00000 н 0001108280 00000 н 0001108464 00000 н 0001108508 00000 н 0001108552 00000 н 0001108596 00000 н 0001108640 00000 н 0001108715 00000 н 0001108854 00000 н 0001108929 00000 н 0001108966 00000 н 0001109065 00000 н 0001109115 00000 н 0001109206 00000 н 0001109253 00000 н 0001109351 00000 н 0001109403 00000 н 0001109454 00000 н 0001109567 00000 н 0001109617 00000 н 0001109671 00000 н 0001109797 00000 н 0001109847 00000 н 0001109965 00000 н 0001110046 00000 н 0001110096 00000 н 0001110185 00000 н 0001110235 00000 н 0001110341 00000 н 0001110391 00000 н 0001110488 00000 н 0001110538 00000 н 0001110642 00000 н 0001110692 00000 н 0001110795 00000 н 0001110845 00000 н 0001110942 00000 н 0001110992 00000 н 0001111103 00000 н 0001111153 00000 н 0001111245 00000 н 0001111295 00000 н 0001111387 00000 н 0001111437 00000 н 0001111540 00000 н 0001111590 00000 н 0001111694 00000 н 0001111744 00000 н 0001111796 00000 н 0001111848 00000 н 0001111901 00000 н 0001111953 00000 н 0001112005 00000 н 0001112057 00000 н 0001112109 00000 н 0001112161 00000 н 0001112213 00000 н 0001112265 00000 н 0001112318 00000 н 0001112371 00000 н 0001112421 00000 н 0001112473 00000 н 0001112525 00000 н 0001112620 00000 н 0001112670 00000 н 0001112797 00000 н 0001112924 00000 н 0001112974 00000 н 0001113052 00000 н 0001113204 00000 н 0001113286 00000 н 0001113336 00000 н 0001113433 00000 н 0001113591 00000 н 0001113672 00000 н 0001113722 00000 н 0001113819 00000 н 0001114001 00000 н 0001114082 00000 н 0001114132 00000 н 0001114230 00000 н 0001114378 00000 н 0001114459 00000 н 0001114509 00000 н 0001114609 00000 н 0001114760 00000 н 0001114841 00000 н 0001114891 00000 н 0001114988 00000 н 0001115140 00000 н 0001115221 00000 н 0001115271 00000 н 0001115369 00000 н 0001115521 00000 н 0001115603 00000 н 0001115653 00000 н 0001115751 00000 н 0001115908 00000 н 0001115991 00000 н 0001116041 00000 н 0001116138 00000 н 0001116287 00000 н 0001116368 00000 н 0001116418 00000 н 0001116515 00000 н 0001116678 00000 н 0001116759 00000 н 0001116809 00000 н 0001116907 00000 н 0001117064 00000 н 0001117145 00000 н 0001117195 00000 н 0001117293 00000 н 0001117433 00000 н 0001117514 00000 н 0001117564 00000 н 0001117661 00000 н 0001117812 00000 н 0001117893 00000 н 0001117943 00000 н 0001118042 00000 н 0001118225 00000 н 0001118340 00000 н 0001118385 00000 н 0001118517 00000 н 0001118661 00000 н 0001118742 00000 н 0001118792 00000 н 0001118889 00000 н 0001119041 00000 н 0001119122 00000 н 0001119172 00000 н 0001119269 00000 н 0001119420 00000 н 0001119501 00000 н 0001119551 00000 н 0001119648 00000 н 0001119809 00000 н 0001119890 00000 н 0001119940 00000 н 0001120037 00000 н 0001120206 00000 н 0001120287 00000 н 0001120337 00000 н 0001120434 00000 н 0001120588 00000 н 0001120669 00000 н 0001120719 00000 н 0001120818 00000 н 0001120977 00000 н 0001121059 00000 н 0001121109 00000 н 0001121206 00000 н 0001121371 00000 н 0001121452 00000 н 0001121502 00000 н 0001121600 00000 н 0001121748 00000 н 0001121829 00000 н 0001121879 00000 н 0001121976 00000 н 0001122135 00000 н 0001122216 00000 н 0001122266 00000 н 0001122363 00000 н 0001122463 00000 н 0001122514 00000 н 0001122566 00000 н 0001122617 00000 н 0001122722 00000 н 0001122773 00000 н 0001122880 00000 н 0001122931 00000 н 0001123023 00000 н 0001123074 00000 н 0001123191 00000 н 0001123242 00000 н 0001123397 00000 н 0001123462 00000 н 0001123513 00000 н 0001123632 00000 н 0001123682 00000 н 0001123805 00000 н 0001123855 00000 н 0001123905 00000 н 0001123956 00000 н 0001124008 00000 н 0001124059 00000 н 0001124109 00000 н 0001124160 00000 н 0001124211 00000 н 0001124263 00000 н 0001124313 00000 н 0001124364 00000 н 0001124414 00000 н 0001124464 00000 н 0001124514 00000 н 0001124565 00000 н 0001124670 00000 н 0001124721 00000 н 0001124827 00000 н 0001124878 00000 н 0001124970 00000 н 0001125021 00000 н 0001125136 00000 н 0001125187 00000 н 0001125305 00000 н 0001125356 00000 н 0001125498 00000 н 0001125549 00000 н 0001125707 00000 н 0001125771 00000 н 0001125821 00000 н 0001125871 00000 н 0001125921 00000 н 0001125971 00000 н 0001126021 00000 н 0001126071 00000 н 0001126121 00000 н 0001126171 00000 н 0001126221 00000 н 0001126271 00000 н 0001126321 00000 н 0001126372 00000 н 0001126422 00000 н 0001126472 00000 н 0001126523 00000 н 0001126629 00000 н 0001126680 00000 н 0001126786 00000 н 0001126837 00000 н 0001126929 00000 н 0001126980 00000 н 0001127101 00000 н 0001127152 00000 н 0001127307 00000 н 0001127371 00000 н 0001127422 00000 н 0001127538 00000 н 0001127588 00000 н 0001127706 00000 н 0001127756 00000 н 0001127806 00000 н 0001127856 00000 н 0001127907 00000 н 0001127958 00000 н 0001128008 00000 н 0001128058 00000 н 0001128109 00000 н 0001128159 00000 н 0001128209 00000 н 0001128259 00000 н 0001128309 00000 н 0001128359 00000 н 0001128410 00000 н 0001128461 00000 н 0001128566 00000 н 0001128617 00000 н 0001128723 00000 н 0001128774 00000 н 0001128866 00000 н 0001128917 00000 н 0001129053 00000 н 0001129104 00000 н 0001129257 00000 н 0001129321 00000 н 0001129372 00000 н 0001129487 00000 н 0001129537 00000 н 0001129659 00000 н 0001129709 00000 н 0001129759 00000 н 0001129809 00000 н 0001129859 00000 н 0001129910 00000 н 0001129960 00000 н 0001130010 00000 н 0001130060 00000 н 0001130110 00000 н 0001130161 00000 н 0001130211 00000 н 0001130261 00000 н 0001130311 00000 н 0001130361 00000 н 0001130412 00000 н 0001130517 00000 н 0001130568 00000 н 0001130674 00000 н 0001130725 00000 н 0001130817 00000 н 0001130868 00000 н 0001130988 00000 н 0001131039 00000 н 0001131164 00000 н 0001131215 00000 н 0001131378 00000 н 0001131442 00000 н 0001131492 00000 н 0001131542 00000 н 0001131593 00000 н 0001131643 00000 н 0001131693 00000 н 0001131744 00000 н 0001131794 00000 н 0001131845 00000 н 0001131895 00000 н 0001131945 00000 н 0001131995 00000 н 0001132045 00000 н 0001132095 00000 н 0001132146 00000 н 0001132251 00000 н 0001132302 00000 н 0001132408 00000 н 0001132459 00000 н 0001132551 00000 н 0001132602 00000 н 0001132753 00000 н 0001132817 00000 н 0001132868 00000 н 0001132997 00000 н 0001133048 00000 н 0001133186 00000 н 0001133236 00000 н 0001133286 00000 н 0001133336 00000 н 0001133386 00000 н 0001133437 00000 н 0001133488 00000 н 0001133539 00000 н 0001133591 00000 н 0001133641 00000 н 0001133691 00000 н 0001133741 00000 н 0001133791 00000 н 0001133842 00000 н 0001133893 00000 н 0001133998 00000 н 0001134049 00000 н 0001134156 00000 н 0001134207 00000 н 0001134299 00000 н 0001134350 00000 н 0001134529 00000 н 0001134594 00000 н 0001134645 00000 н 0001134781 00000 н 0001134832 00000 н 0001134962 00000 н 0001135012 00000 н 0001135123 00000 н 0001135173 00000 н 0001135223 00000 н 0001135273 00000 н 0001135323 00000 н 0001135373 00000 н 0001135424 00000 н 0001135474 00000 н 0001135525 00000 н 0001135575 00000 н 0001135625 00000 н 0001135676 00000 н 0001135727 00000 н 0001135777 00000 н 0001135827 00000 н 0001135878 00000 н 0001135983 00000 н 0001136034 00000 н 0001136141 00000 н 0001136192 00000 н 0001136284 00000 н 0001136335 00000 н 0001136463 00000 н 0001136514 00000 н 0001136629 00000 н 0001136680 00000 н 0001136799 00000 н 0001136850 00000 н 0001136964 00000 н 0001137015 00000 н 0001137169 00000 н 0001137233 00000 н 0001137283 00000 н 0001137334 00000 н 0001137384 00000 н 0001137434 00000 н 0001137484 00000 н 0001137534 00000 н 0001137584 00000 н 0001137635 00000 н 0001137686 00000 н 0001137736 00000 н 0001137786 00000 н 0001137836 00000 н 0001137886 00000 н 0001137936 00000 н 0001137986 00000 н 0001138037 00000 н 0001138142 00000 н 0001138193 00000 н 0001138299 00000 н 0001138350 00000 н 0001138442 00000 н 0001138493 00000 н 0001138659 00000 н 0001138723 00000 н 0001138774 00000 н 0001138902 00000 н 0001138952 00000 н 0001139075 00000 н 0001139125 00000 н 0001139176 00000 н 0001139226 00000 н 0001139277 00000 н 0001139328 00000 н 0001139378 00000 н 0001139428 00000 н 0001139478 00000 н 0001139529 00000 н 0001139579 00000 н 0001139629 00000 н 0001139679 00000 н 0001139729 00000 н 0001139780 00000 н 0001139887 00000 н 0001139938 00000 н 0001140045 00000 н 0001140096 00000 н 0001140188 00000 н 0001140239 00000 н 0001140358 00000 н 0001140409 00000 н 0001140578 00000 н 0001140642 00000 н 0001140693 00000 н 0001140810 00000 н 0001140861 00000 н 0001140977 00000 н 0001141027 00000 н 0001141142 00000 н 0001141192 00000 н 0001141242 00000 н 0001141292 00000 н 0001141342 00000 н 0001141392 00000 н 0001141443 00000 н 0001141493 00000 н 0001141543 00000 н 0001141594 00000 н 0001141644 00000 н 0001141694 00000 н 0001141744 00000 н 0001141794 00000 н 0001141844 00000 н 0001141894 00000 н 0001141939 00000 н 0001142082 00000 н 0001142127 00000 н 0001142268 00000 н 0001142313 00000 н 0001142439 00000 н 0001142484 00000 н 0001142631 00000 н 0001142675 00000 н 0001142826 00000 н 0001142870 00000 н 0001143067 00000 н 0001143165 00000 н 0001143209 00000 н 0001143367 00000 н 0001143411 00000 н 0001143455 00000 н 0001143497 00000 н 0001143548 00000 н 0001143655 00000 н 0001143706 00000 н 0001143814 00000 н 0001143865 00000 н 0001143957 00000 н 0001144008 00000 н 0001144120 00000 н 0001144171 00000 н 0001144326 00000 н 0001144390 00000 н 0001144441 00000 н 0001144560 00000 н 0001144611 00000 н 0001144716 00000 н 0001144766 00000 н 0001144817 00000 н 0001144867 00000 н 0001144917 00000 н 0001144968 00000 н 0001145018 00000 н 0001145068 00000 н 0001145118 00000 н 0001145168 00000 н 0001145219 00000 н 0001145269 00000 н 0001145319 00000 н 0001145369 00000 н 0001145419 00000 н 0001145470 00000 н 0001145577 00000 н 0001145628 00000 н 0001145736 00000 н 0001145787 00000 н 0001145880 00000 н 0001145931 00000 н 0001146047 00000 н 0001146098 00000 н 0001146252 00000 н 0001146316 00000 н 0001146367 00000 н 0001146478 00000 н 0001146528 00000 н 0001146578 00000 н 0001146628 00000 н 0001146679 00000 н 0001146730 00000 н 0001146781 00000 н 0001146831 00000 н 0001146882 00000 н 0001146932 00000 н 0001146982 00000 н 0001147032 00000 н 0001147082 00000 н 0001147132 00000 н 0001147183 00000 н 0001147290 00000 н 0001147341 00000 н 0001147449 00000 н 0001147500 00000 н 0001147592 00000 н 0001147643 00000 н 0001147817 00000 н 0001147881 00000 н 0001147932 00000 н 0001148059 00000 н 0001148110 00000 н 0001148232 00000 н 0001148282 00000 н 0001148398 00000 н 0001148448 00000 н 0001148498 00000 н 0001148548 00000 н 0001148598 00000 н 0001148649 00000 н 0001148700 00000 н 0001148750 00000 н 0001148800 00000 н 0001148850 00000 н 0001148902 00000 н 0001148953 00000 н 0001149003 00000 н 0001149053 00000 н 0001149103 00000 н 0001149154 00000 н 0001149260 00000 н 0001149311 00000 н 0001149418 00000 н 0001149469 00000 н 0001149562 00000 н 0001149613 00000 н 0001149733 00000 н 0001149784 00000 н 0001149912 00000 н 0001149963 00000 н 0001150086 00000 н 0001150137 00000 н 0001150278 00000 н 0001150343 00000 н 0001150393 00000 н 0001150499 00000 н 0001150549 00000 н 0001150600 00000 н 0001150650 00000 н 0001150701 00000 н 0001150752 00000 н 0001150803 00000 н 0001150853 00000 н 0001150903 00000 н 0001150953 00000 н 0001151003 00000 н 0001151053 00000 н 0001151103 00000 н 0001151153 00000 н 0001151203 00000 н 0001151253 00000 н 0001151304 00000 н 0001151411 00000 н 0001151462 00000 н 0001151569 00000 н 0001151620 00000 н 0001151712 00000 н 0001151763 00000 н 0001151916 00000 н 0001151967 00000 н 0001152086 00000 н 0001152137 00000 н 0001152308 00000 н 0001152372 00000 н 0001152423 00000 н 0001152548 00000 н 0001152598 00000 н 0001152648 00000 н 0001152698 00000 н 0001152749 00000 н 0001152799 00000 н 0001152849 00000 н 0001152901 00000 н 0001152952 00000 н 0001153002 00000 н 0001153052 00000 н 0001153102 00000 н 0001153152 00000 н 0001153202 00000 н 0001153252 00000 н 0001153303 00000 н 0001153409 00000 н 0001153460 00000 н 0001153567 00000 н 0001153618 00000 н 0001153710 00000 н 0001153761 00000 н 0001153888 00000 н 0001153939 00000 н 0001154116 00000 н 0001154180 00000 н 0001154231 00000 н 0001154357 00000 н 0001154407 00000 н 0001154457 00000 н 0001154507 00000 н 0001154558 00000 н 0001154608 00000 н 0001154658 00000 н 0001154708 00000 н 0001154759 00000 н 0001154809 00000 н 0001154859 00000 н 0001154910 00000 н 0001154960 00000 н 0001155011 00000 н 0001155062 00000 н 0001155169 00000 н 0001155220 00000 н 0001155328 00000 н 0001155379 00000 н 0001155471 00000 н 0001155522 00000 н 0001155635 00000 н 0001155686 00000 н 0001155807 00000 н 0001155858 00000 н 0001156025 00000 н 0001156089 00000 н 0001156140 00000 н 0001156271 00000 н 0001156321 00000 н 0001156371 00000 н 0001156422 00000 н 0001156473 00000 н 0001156523 00000 н 0001156573 00000 н 0001156623 00000 н 0001156673 00000 н 0001156723 00000 н 0001156773 00000 н 0001156823 00000 н 0001156873 00000 н 0001156923 00000 н 0001156973 00000 н 0001157024 00000 н 0001157131 00000 н 0001157182 00000 н 0001157290 00000 н 0001157341 00000 н 0001157433 00000 н 0001157484 00000 н 0001157608 00000 н 0001157659 00000 н 0001157821 00000 н 0001157885 00000 н 0001157935 00000 н 0001157985 00000 н 0001158035 00000 н 0001158085 00000 н 0001158135 00000 н 0001158185 00000 н 0001158235 00000 н 0001158285 00000 н 0001158335 00000 н 0001158385 00000 н 0001158435 00000 н 0001158485 00000 н 0001158536 00000 н 0001158642 00000 н 0001158693 00000 н 0001158800 00000 н 0001158851 00000 н 0001158943 00000 н 0001158994 00000 н 0001159105 00000 н 0001159156 00000 н 0001159303 00000 н 0001159367 00000 н 0001159418 00000 н 0001159530 00000 н 0001159580 00000 н 0001159630 00000 н 0001159680 00000 н 0001159731 00000 н 0001159781 00000 н 0001159832 00000 н 0001159882 00000 н 0001159932 00000 н 0001159982 00000 н 0001160032 00000 н 0001160082 00000 н 0001160132 00000 н 0001160182 00000 н 0001160233 00000 н 0001160339 00000 н 0001160390 00000 н 0001160498 00000 н 0001160549 00000 н 0001160641 00000 н 0001160692 00000 н 0001160812 00000 н 0001160863 00000 н 0001160982 00000 н 0001161033 00000 н 0001161189 00000 н 0001161253 00000 н 0001161304 00000 н 0001161412 00000 н 0001161462 00000 н 0001161594 00000 н 0001161644 00000 н 0001161694 00000 н 0001161744 00000 н 0001161794 00000 н 0001161845 00000 н 0001161895 00000 н 0001161945 00000 н 0001161995 00000 н 0001162047 00000 н 0001162098 00000 н 0001162148 00000 н 0001162198 00000 н 0001162248 00000 н 0001162298 00000 н 0001162349 00000 н 0001162400 00000 н 0001162507 00000 н 0001162558 00000 н 0001162667 00000 н 0001162718 00000 н 0001162810 00000 н 0001162861 00000 н 0001162968 00000 н 0001163019 00000 н 0001163155 00000 н 0001163206 00000 н 0001163361 00000 н 0001163425 00000 н 0001163476 00000 н 0001163603 00000 н 0001163653 00000 н 0001163786 00000 н 0001163836 00000 н 0001163886 00000 н 0001163936 00000 н 0001163986 00000 н 0001164037 00000 н 0001164087 00000 н 0001164137 00000 н 0001164187 00000 н 0001164238 00000 н 0001164288 00000 н 0001164338 00000 н 0001164388 00000 н 0001164438 00000 н 0001164488 00000 н 0001164538 00000 н 0001164589 00000 н 0001164695 00000 н 0001164746 00000 н 0001164853 00000 н 0001164904 00000 н 0001164996 00000 н 0001165047 00000 н 0001165156 00000 н 0001165207 00000 н 0001165321 00000 н 0001165372 00000 н 0001165515 00000 н 0001165579 00000 н 0001165630 00000 н 0001165742 00000 н 0001165792 00000 н 0001165900 00000 н 0001165950 00000 н 0001166000 00000 н 0001166050 00000 н 0001166100 00000 н 0001166151 00000 н 0001166201 00000 н 0001166251 00000 н 0001166302 00000 н 0001166352 00000 н 0001166402 00000 н 0001166452 00000 н 0001166502 00000 н 0001166552 00000 н 0001166602 00000 н 0001166653 00000 н 0001166704 00000 н 0001166810 00000 н 0001166861 00000 н 0001166969 00000 н 0001167020 00000 н 0001167112 00000 н 0001167163 00000 н 0001167308 00000 н 0001167359 00000 н 0001167475 00000 н 0001167526 00000 н 0001167680 00000 н 0001167744 00000 н 0001167794 00000 н 0001167912 00000 н 0001167962 00000 н 0001168012 00000 н 0001168062 00000 н 0001168113 00000 н 0001168163 00000 н 0001168214 00000 н 0001168264 00000 н 0001168314 00000 н 0001168364 00000 н 0001168414 00000 н 0001168464 00000 н 0001168514 00000 н 0001168564 00000 н 0001168614 00000 н 0001168666 00000 н 0001168756 00000 н 0001168808 00000 н 0001168910 00000 н 0001168962 00000 н 0001169086 00000 н 0001169137 00000 н 0001169252 00000 н 0001169303 00000 н 0001169444 00000 н 0001169530 00000 н 0001169581 00000 н 0001169683 00000 н 0001169820 00000 н 0001169911 00000 н 0001169962 00000 н 0001170062 00000 н 0001170113 00000 н 0001170229 00000 н 0001170280 00000 н 0001170397 00000 н 0001170448 00000 н 0001170550 00000 н 0001170601 00000 н 0001170706 00000 н 0001170757 00000 н 0001170857 00000 н 0001170908 00000 н 0001171013 00000 н 0001171064 00000 н 0001171176 00000 н 0001171227 00000 н 0001171331 00000 н 0001171382 00000 н 0001171487 00000 н 0001171538 00000 н 0001171659 00000 н 0001171710 00000 н 0001171760 00000 н 0001171811 00000 н 0001171861 00000 н 0001171913 00000 н 0001171963 00000 н 0001172014 00000 н 0001172065 00000 н 0001172115 00000 н 0001172165 00000 н 0001172215 00000 н 0001172265 00000 н 0001172315 00000 н 0001172366 00000 н 0001172416 00000 н 0001172467 00000 н 0001172630 00000 н 0001172681 00000 н 0001172791 00000 н 0001172842 00000 н 0001172953 00000 н 0001173004 00000 н 0001173117 00000 н 0001173168 00000 н 0001173278 00000 н 0001173329 00000 н 0001173456 00000 н 0001173507 00000 н 0001173615 00000 н 0001173666 00000 н 0001173786 00000 н 0001173837 00000 н 0001173954 00000 н 0001174005 00000 н 0001174055 00000 н 0001174105 00000 н 0001174156 00000 н 0001174206 00000 н 0001174256 00000 н 0001174306 00000 н 0001174356 00000 н 0001174406 00000 н 0001174456 00000 н 0001174506 00000 н 0001174556 00000 н 0001174607 00000 н 0001174657 00000 н 0001174707 00000 н 0001174757 00000 н 0001174807 00000 н 0001174857 00000 н 0001174907 00000 н 0001174957 00000 н 0001175036 00000 н 0001175086 00000 н 0001175179 00000 н 0001175230 00000 н 0001175338 00000 н 0001175389 00000 н 0001175497 00000 н 0001175548 00000 н 0001175657 00000 н 0001175708 00000 н 0001175816 00000 н 0001175867 00000 н 0001175973 00000 н 0001176024 00000 н 0001176140 00000 н 0001176191 00000 н 0001176306 00000 н 0001176357 00000 н 0001176465 00000 н 0001176515 00000 н 0001176565 00000 н 0001176615 00000 н 0001176665 00000 н 0001176715 00000 н 0001176765 00000 н 0001176816 00000 н 0001176866 00000 н 0001176916 00000 н 0001176966 00000 н 0001177016 00000 н 0001177066 00000 н 0001177116 00000 н 0001177169 00000 н 0001177220 00000 н 0000024794 00000 н трейлер ]>> startxref 0 %%EOF 3486 0 объект >поток &YcN’tnСохранение материи и массы
Эта основная идея исследуется через:
Противопоставление студенческих и научных взглядов
Студенческий повседневный опыт
Для многих студентов идея сохранения материи не является естественной. Они замечают, что сахар исчезает при смешивании с водой, большое бревно сгорает до небольшого количества пепла, машины ржавеют и появляются большие ямы, вода выкипает, иней и конденсат появляются якобы из ниоткуда, а деревья растут, по-видимому, только из почвы.
Они замечают, что сахар исчезает при смешивании с водой, большое бревно сгорает до небольшого количества пепла, машины ржавеют и появляются большие ямы, вода выкипает, иней и конденсат появляются якобы из ниоткуда, а деревья растут, по-видимому, только из почвы.
Студентам может показаться, что материя исчезает или появляется при таких процессах, как растворение, горение, испарение, кипение, гниение, дыхание, ржавление, конденсация и рост растений. Невидимые газы участвуют во многих из этих процессов, что привело ко многим из этих альтернативных студенческих концепций.
Исследование: Driver (1985), Russell, Harlen & Watt (1989)
Студенты также часто считают, что материя обменивается или превращается в энергию (например, они считают, что древесина превращается в тепло при сгорании, а пища превращается в энергию при сжигании). мы метаболизируем его), или они путают энергию пищи (указанный на пакетах как килоджоули) с весами перечисленных ингредиентов. Студенты также часто считают, что солнечная энергия превращается в растительную материю в процессе фотосинтеза.
Процесс испарения может также бросить вызов представлениям студентов, поскольку многие студенты считают, что вещества становятся легче, если они переходят в газообразное состояние. Если жидкость испаряется внутри запечатанного контейнера, то они считают, что общий вес контейнера и жидкости уменьшится на вес жидкости, потому что она, по-видимому, исчезла.
Исследование: Stavy (1990)
Хотя на этом уровне большинство учащихся будут иметь представление о корпускулярной природе атомов, для многих число атомов не сохраняется во время химических реакций.Например, количество атомов в коре деревьев, по-видимому, увеличивается, их количество уменьшается во время таких процессов, как горение или распад, и увеличивается во время фотосинтеза.
Научный взгляд
Идея неделимости атомов помогает объяснить сохранение материи. Если количество атомов остается неизменным независимо от того, как они перестраиваются, то их общий вес остается неизменным.
При всех физических и химических изменениях общее число атомов остается одним и тем же, поэтому, когда вещества взаимодействуют друг с другом, соединяются или распадаются, общий вес системы остается одним и тем же.
Растущие растения получают свой новый углерод (большую часть их сухого веса) из двуокиси углерода, т. е. из воздуха. Когда мы теряем вес с помощью диеты или физических упражнений, большая часть потери приходится на выдыхание атомов углерода, которые метаболизируются из нашего жира в виде углекислого газа. Когда жидкость испаряется в герметичном контейнере, вес остается прежним; на частицы газа действует гравитация так же, как на теннисные мячи, и, следовательно, они ударяются о нижнюю поверхность контейнера с большей силой, чем о верхнюю.
Предсказание Альберта Эйнштейна о том, что масса может быть преобразована в энергию, было экспериментально подтверждено многочисленными ядерными экспериментами. Следствием этого является то, что утверждение «общий вес системы остается прежним» является более правильным лишь очень хорошим приближением для всех неядерных изменений.
Критические обучающие идеи
В физических и химических изменениях:
- частицы не просто не исчезают и не создаются, а меняются их устройства
- при любом изменении материи, вся материя должна учитываться.
 Материя не превращается в энергию и не возникает из нее
Материя не превращается в энергию и не возникает из нее - частицы перестраиваются для создания веществ, отличных от исходных
- нет изменения веса, когда вещества входят в газообразное состояние и выходят из него.
Исследуйте взаимосвязь между идеями о сохранении массы в Карты разработки концепций — (Сохранение материи, Состояние материи, Поток материи в экосистемах)
В вашем обучении сохранению материи и, следовательно, веса, учащимся необходимо поощрять изменение своих взглядов с тех, которые основаны на их повседневном опыте, на более научные взгляды, такие как идея о том, что в мире существует только фиксированное количество частиц, и эти строительные блоки постоянно перестраиваются в новые вещи.
Это сложная абстрактная идея, и мы можем использовать аналогии, чтобы помочь учащимся понять ее. Например: «Это немного похоже на ведро Lego: вы можете построить много разных вещей, но у вас есть только определенное количество деталей Lego, чтобы сделать это». Одна из трудностей заключается в том, что закрытые системы, включающие такие изменения, как горение и дыхание, почти невозможно настроить и взвесить в классе. Вы можете опровергнуть экспериментально лишь некоторые из распространенных альтернативных концепций в этой области.
Одна из трудностей заключается в том, что закрытые системы, включающие такие изменения, как горение и дыхание, почти невозможно настроить и взвесить в классе. Вы можете опровергнуть экспериментально лишь некоторые из распространенных альтернативных концепций в этой области.
Исследование: Loughran, Milroy, Berry, Gunstone & Mulhall (2001)
Важно обсудить различные ситуации изменения, которые, по-видимому, связаны с несохранением материи, и вернуться к этому вопросу в других темах, таких как экосистемы, пища и питание, и источники энергии. Учащихся следует поощрять делать прогнозы об этих процессах в благоприятной среде в классе, где им можно помочь разработать новые теории, критически проанализировать свое понимание и понимание других и сравнить их с научными взглядами, представленными учителем.Легче попытаться устранить альтернативные концепции, которые можно сначала проверить экспериментально, и затем дать учащимся понять научную модель как модель, которая может наилучшим образом объяснить широкий спектр явлений.
Размышления учащихся о том, как изменились их взгляды, будут ценным компонентом достижения долгосрочных концептуальных изменений у учащихся и понимания научных объяснений.
Исследование: Loughran, Milroy, Berry, Gunstone & Mulhall (2001)
Преподавательская деятельность
Учащиеся должны обсуждать и наблюдать явления, в которых наблюдается очевидное изменение веса, и поощрять поиск альтернативных объяснений.
Способствуйте осмыслению и разъяснению существующих идей и позволяйте учащимся увидеть, как изменились их идеи
Попросите учащихся записать и сохранить свои взгляды на ряд ситуаций, таких как следующие:
- Свежий труп запечатан в герметичное подземелье. 100 лет спустя труп превратился в скелет. Общая масса подземелья, трупа и прочего содержимого увеличивается, уменьшается или остается неизменной? Куда девается плоть?
- Представьте, что в закрытом помещении горит куча дров.Увеличивается ли общая масса помещения и его продуктов, уменьшается или остается неизменной? (См.
 дерево, растущее в коробке, ниже).
дерево, растущее в коробке, ниже).
Открытие обсуждения путем обмена опытом и содействие осмыслению и уточнению существующих идей
Занятия POE (Предсказать-Наблюдать-Объяснить) могут быть полезны как для выявления предшествующих взглядов учащихся, так и для переосмысления этих концепций.
Попросите учащихся предсказать, что произойдет, если материалы (например, стальная вата или магний) сгорят.Затем учащиеся должны взвесить материалы до и после сжигания, следя за тем, чтобы все продукты сгорания сохранились. Обратите внимание, что эти эксперименты не доказывают, что общий вес сохраняется в замкнутой системе. В этом случае система открыта, и общий вес стальной ваты/магния увеличивается, так как они соединяются с кислородом воздуха. Что эти эксперименты действительно убедительно показывают, так это то, что вес не всегда теряется во время горения, и, следовательно, представление о превращении материи в тепло несостоятельно.
Точно так же изучите, что происходит при испарении. Взвесьте плотно закрытую колбу, содержащую 1–2 мл ацетона, медленно нагрейте ее и снова взвесьте. (Студенты часто предсказывают, что вес колбы уменьшился, потому что газы легче жидкостей или молекулы больше не сидят на дне.)
Взвесьте плотно закрытую колбу, содержащую 1–2 мл ацетона, медленно нагрейте ее и снова взвесьте. (Студенты часто предсказывают, что вес колбы уменьшился, потому что газы легче жидкостей или молекулы больше не сидят на дне.)
Способствовать осмыслению и разъяснению существующих идей «неправильные» комментарии) могут позволить учащимся обдумать и переформулировать свои взгляды (после просмотра приведенных выше изменений и многих других, которые можно придумать).
Уточнить и закрепить идеи для/посредством сообщения другим
На основе действий, описанных выше, небольшие группы учащихся могут сделать плакаты и представить их классу, чтобы поделиться своими идеями и объяснениями.
Открытие обсуждения путем обмена опытом и содействие осмыслению и уточнению существующих идей
Студент может взвесить несколько таблеток антацида и небольшую бутылку безалкогольного напитка, наполненную водой, по отдельности, чтобы определить их общий вес.Затем таблетки добавляют в воду, бутылку быстро закрывают и повторно взвешивают после полного растворения таблеток. Вес «до» и «после» должен быть одинаковым, несмотря на то, что таблетки полностью исчезли и образовался газ. Предложите учащимся обсудить результаты и сделать некоторые выводы о том, насколько эти результаты согласуются с их взглядами на сохранение материи или оспаривают их.
Вес «до» и «после» должен быть одинаковым, несмотря на то, что таблетки полностью исчезли и образовался газ. Предложите учащимся обсудить результаты и сделать некоторые выводы о том, насколько эти результаты согласуются с их взглядами на сохранение материи или оспаривают их.
Способствовать осмыслению и разъяснению существующих идей
Еще одна задача, проверяющая понимание учащимися теории сохранения материи, заключается в следующем: внутри большой герметичной стеклянной коробки много влажной почвы, резервуар для воды с капельным орошением и семя быстрорастущего дерева.Ящик ставится на солнце на год, и внутри ящика растет дерево. Учащихся спрашивают, увеличится, уменьшится или останется неизменным общий вес коробки и содержимого в течение года роста дерева.
| Преподавательская деятельность — Понимание теории сохранения материи | |
|---|---|
На изображении 1 дерево начинается как семя. | |
На изображении 2 видно, что год спустя выросло дерево. |
Еще один вариант: без открытия ящика дерево поджигается. Изменится ли вес ящика после сжигания? Что произойдет с числом атомов до и после обоих этих изменений?
Уточнить и закрепить идеи для/путем общения с другими
Попросите учащихся рассмотреть следующую ситуацию: ваша рука состоит из атомов углерода (содержащихся в белковых молекулах). Рассмотрим один из этих атомов углерода, назовем его «Гилберт».Предположим, что миллион лет назад Гилберт находился в травинке. Напишите возможную историю Гилберта за последний миллион лет. В своем ответе укажите как можно больше процессов.
Когда вы представляете это задание, предупредите учащихся, что они, скорее всего, вернутся к своим прежним взглядам. (Очень немногим учащимся удается написать эту историю, не опираясь на свои прежние взгляды и не написав вещей, противоречащих тому, чему их только что учили. Распространенной ошибкой является возвращение к убеждению, что растения черпают большую часть материала, необходимого для роста, из почва, причем Гилберт неоднократно возвращался в почву в результате разложения мертвого органического материала, а затем извлекался из почвы другим растением).Для учащихся, которые возвращаются с рассказами, демонстрирующими очень мало знаний о том, что они только что узнали, посмотрите, смогут ли они объяснить, почему они написали рассказы таким образом.
Распространенной ошибкой является возвращение к убеждению, что растения черпают большую часть материала, необходимого для роста, из почва, причем Гилберт неоднократно возвращался в почву в результате разложения мертвого органического материала, а затем извлекался из почвы другим растением).Для учащихся, которые возвращаются с рассказами, демонстрирующими очень мало знаний о том, что они только что узнали, посмотрите, смогут ли они объяснить, почему они написали рассказы таким образом.
Поощряйте размышления о том, как изменились идеи учащихся
Попросите учащихся еще раз просмотреть свои взгляды на сценарии, связанные с распадом и возгоранием, и подумать, изменились ли они в своих взглядах. Если да, спросите их, как бы они изменили свои ответы на ситуации и почему они изменили бы их. (Никогда не оценивайте их первоначальные ответы, но можно оценить рефлексивные ответы во второй раз).
Студенты также могли сформулировать свои собственные гипотезы об изменении веса при горении, дыхании и фотосинтезе и провести исследования, чтобы подтвердить или опровергнуть их.


 )
)

 01 г
01 г

 Материя не превращается в энергию и не возникает из нее
Материя не превращается в энергию и не возникает из нее дерево, растущее в коробке, ниже).
дерево, растущее в коробке, ниже).