Сущность химической реакции. Закон сохранения массы веществ
Тема: Первоначальные химические представления
Урок: Сущность химической реакции. Закон сохранения массы веществ
Вопрос о сущности химического превращения долгое время оставался загадкой для естествоиспытателей. Только с развитием атомно-молекулярной теории стало возможным предположить, как на уровне атомов и молекул происходят химические реакции.
В соответствие с атомно-молекулярной теорией, вещества состоят из молекул, а молекулы – из атомов. В ходе химической реакции атомы, входящие в состав исходных веществ, не исчезают и не появляются новые атомы.
Тогда, мы можем предположить, что в результате химической реакции продукты реакции образуются из атомов, которые ранее входили в состав исходных веществ. Вот модель химической реакции:
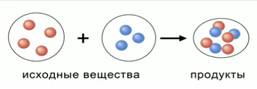
Рис. 1. Модель химической реакции с позиции АМТ
Проанализировав данную модель, мы можем выдвинуть гипотезу (научно обоснованное предположение):
Суммарная масса продуктов реакции должна быть равна суммарной массе исходных веществ.
Еще Леонардо да Винчи сказал: «Знания, не проверенные опытом, матерью всякой достоверности, бесплодны и полны ошибок». Значит, гипотеза никогда не станет законом, если ее не подтвердить экспериментально.
Экспериментальный метод в химии начал широко использоваться после исследований Р. Бойля в 17 в. Английский естествоиспытатель прокаливал металлы в незапаянных сосудах – ретортах и обнаружил, что после прокаливания масса металла становилась больше.
Основываясь на этих опытах, он не учитывал роль воздуха и сделал неправильный вывод, что масса веществ в ходе химических реакций изменяется.
М.В. Ломоносов, в отличие от Р. Бойля, прокаливал металлы не на открытом воздухе, а в запаянных ретортах и взвешивал их до и после прокаливания. Он доказал, что масса веществ до и после реакции остается неизменной и что при прокаливании к металлу присоединяется воздух (кислород в то время не был еще открыт). Но Ломоносов не опубликовал результаты своих исследований.
В 1774 г. опыты Р. Бойля повторил А. Лавуазье с совершенно такими же результатами, как и Ломоносов. Но он сделал новое, очень важное, наблюдение, а именно, что только часть воздуха запаянной реторты соединилась с металлом и что увеличение веса металла, перешедшего в окалину, равно уменьшению веса воздуха в реторте. Вместе с тем часть металла осталась в свободном виде.
Таким образом, независимо друг от друга, М.В. Ломоносов и А. Лавуазье подтвердили справедливость предположения о сохранении массы веществ в результате химической реакции.
Это предположение стало законом лишь после десятилетнего исследования немецкого химика Г. Ландольта в начале 20 века. Сегодня закон сохранения массы веществ формулируется так:
Масса веществ, участвующих в реакции, равна массе продуктов реакции.
Подтвердить правильность закона сохранения массы веществ можно с помощью следующего опыта. В первом сосуде Ландольта подготовим растворы йодида калия и нитрата свинца. Во втором сосуде – пройдет реакция хлорида железа с роданидом калия. Плотно закрываем пробки. Уравновешиваем чашки весов. Сохранится ли равновесие после окончания реакций? В первом сосуде выпадает желтый осадок йодида свинца, во втором образуется темно-красный роданид трехвалентного железа. В сосудах Ландольта произошли химические реакции: образовались новые вещества. Но равновесие не нарушилось (Рис. 2). Масса исходных веществ всегда равна массе продуктов реакции.

Рис. 2. Эксперимент, подтверждающий правильность закона сохранения массы веществ
Приведем пример еще одного опыта, доказывающего правильность закона сохранения массы веществ в химических реакциях. Внутри колбы при закрытой пробке будет гореть свеча. Уравновесим весы. Подожжем свечу и опустим ее в колбу. Плотно закроем колбу пробкой. Горение свечи – это химический процесс. Израсходовав находящийся в колбе кислород, свеча гаснет, химическая реакция завершается. Но равновесие весов не нарушается: масса продуктов реакции остается такой же, какой была масса исходных веществ (Рис. 3).

Рис. 3. Эксперимент с горящей свечой в колбе
Открытие закона сохранения массы веществ имело огромное значение для дальнейшего развития химии. На основании закона сохранения массы веществ производят важнейшие расчеты и составляют уравнения химических реакций.
Список рекомендованной литературы
1. Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006.
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.15-16)
3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§6)
4. Химия: неорг. химия: учеб. для 8 кл. общеобр. учреждений / Г.Е. Рудзитис, ФюГю Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2016. (§18-19).
5. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов (Источник).
2. Электронная версия журнала «Химия и жизнь» (Источник).
3. Тесты по химии (онлайн) (Источник).
Домашнее задание
с. 16 №№ 3,5 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
План-конспект урока «Закон сохранения массы веществ. Химические уравнения»
Предмет: Химия Класс: 7
Тема урока: Закон сохранения массы веществ. Химические уравнения.
Цель: Формирование понимания сущности химических реакций и умения расставлять коэффициенты.
Задачи. Образовательные:
1.Опытным путём доказать и сформулировать закон сохранения массы веществ.
2.Дать понятие о химическом уравнении, как условной записи химической реакции с помощью химических формул.
3.Начать формирование навыков расставлять коэффициенты в уравнениях химических реакций.
Развивающие:
1.Развитие умения решать несложные проблемы, формировать гипотезы. 2.Совершенствовать умения работать с реактивами и лабораторным оборудованием, с моделями атомов и молекул.
3. Развивать способность к логическому мышлению.
Воспитательные:
1.Продолжить формирование научного мировоззрения.
2.Воспитывать коммуникативную компетентность, а также наблюдательность, внимание и инициативу.
Оборудование и реактивы.
Реактивы (растворы сульфата меди и гидроксида натрия), пробирка, технические весы, разновесы, шаростержневые модели атомов и молекул, колбы, таблицы с формулами веществ и с заданиями Что лишнее?, компьютер, проектор
Содержание, методыI Организационный момент
Приветствие обучающихся. Отметка отсутствующих.
II
Подготовка обучающихся к активному усвоению знаний
Мотивация: знания по химии необходимы для получения профессии (врача, фармацевта, инженера-химика и др.)
Актуализация знаний и умений.
Методы: словестный, беседа по вопросам.
Что называется химическим элементом?
Что называется химической формулой?
Какие явления происходят с веществами?
Какие явления называются химическими?
Как по другому называют химические явления?
По каким признакам можно судить, что произошла химическая реакция?
Методы: наглядный и словестный (беседа). Карточки с формулами веществ.
? Прочитать формулу и объяснить, что показывает индекс и коэффициент в формуле.
Форма контроля – самоконтроль и контроль учителя.
Фронтальная работа.
Доказать и сформулировать закон сохранения массы веществ.
Узнать что называется химическим уравнением.
Научиться расставлять коэффициенты в УХР.
III
Изучение новой темы
Закон сохранения массы веществ.
Методы: практический и наглядный. Проблемно – поисковый подход.
Проблемный вопрос. Изменится ли масса реагирующих веществ по сравнению с массой продуктов реакции?
Лабораторная работа под руководством учителя. Обучающиеся проводят опыт (взаимодействие CuSO4 c NaOH)
? Что наблюдаете? О чем это говорит? По каким признакам можно судить, что произошла химическая реакция?
Демонстрационный опыт. Поставить на чашу весов 2 стаканчика с веществами CuSO4 c NaOH, уравновесить весы, слить растворы в один стаканчик, другой ставим рядом.
Обучающиеся отмечают, что равновесие весов не нарушается.
Формулируем ЗСМВ: Масса веществ вступивших в реакцию равна массе образовавшихся веществ.(Слайд 2)
Обучающиеся записывают в тетрадь.
Слайд 3 с изображением русского ученого М.В. Ломоносова и французского ученого А. Лавуазье и годы открытия ЗСМВ.
Обучающиеся записывают в тетрадь.
Химические уравнения.
Методы: практический, словестный, наглядный (моделирование и эвристическая беседа, опорный конспект)
? Что происходит в веществе в ходе химической реакции?
Выдвижение гипотез обучающимися:
Атомы сохраняются и их число не изменяется.
Атомы разрушаются, образуются новые.
Моделирование молекул под руководством учителя.
Задания
Построить 2 модели молекул h3, состоящих их 2 атомов водорода.
Построить 1 модель молекулы O2, состоящей из 2 атомов кислорода.
Из 2 молекул h3 и одной молекулы O2 построить модели молекул воды (предварительно разберите модели молекул h3 и O2)
? Сколько моделей молекул воды получилось?
Записываем ход реакции между h3 и O2 (на доске, а обучающиеся записывают в тетради)
2h3 + O2 = 2h3O
исходные продукт
Обучающиеся делают вывод: Сколько атомов каждого элемента было до реакции, столько же осталось после её завершения.
В результате химической реакции атомы переходят в другие вещества, происходит перегруппировка атомов.
Формулируем понятие химического уравнения: Химическое уравнение — это условная запись химической реакции с помощью химических формул и математических знаков (слайд 4)
Обучающиеся записывают в тетрадь.
Опорные конспекты на слайдах:
Правила составления химических уравнений (Слайд 5)
В левой части уравнения записать формулы веществ, вступающих в реакцию(исходные). Затем поставить =
N2 + h3 =
В правой части записать формулы веществ образующихся в результате реакции (продукты)
Все формулы составляются в соответствии со степенью окисления.
N2 + H2 = NH3
Слева и справа должно быть одинаковое число атомов, достигается это расстановкой коэффициентов перед формулами веществ.
N2 + 3H2 = 2NH3
Алгоритм расстановки коэффициентов в уравнении химической реакции (слайд 6)
Подсчитать количество атомов каждого элемента в правой и левой части.
 P + O2 P2O5 1 атом 2 атома 2 атома 5 атомов
P + O2 P2O5 1 атом 2 атома 2 атома 5 атомов
Определить у какого элемента количество атомов меняется, найти наименьшее общее кратное (НОК). Начинать лучше с атомов кислорода.
 P + O2 P2O5 (НОК атомов кислорода = 10)
P + O2 P2O5 (НОК атомов кислорода = 10)
Разделить НОК на индексы – получить коэффициенты. Поставить коэффициенты перед формулами
 P + 5O2 2P2O5
P + 5O2 2P2O5
Пересчитать количество атомов, при необходимости действие повторить
4P + 5O2 = 2P2O5
Обучающиеся получают опорный конспект – памятку.
Расстановка коэффициентов в уравнениях .
Запись на доске с объяснением
4P + 5O2 = 2P2O5
N2 + 3H2 = 2NH3
Обучающиеся записывают в тетрадь.
Индивидуальная работа у доски
Mg + __ HCl = MgCl2 + h3
__ Al + __O2 = __Al2O3
__Fe + __O2 = Fe3O4
__Al + __FeO = Al2O3+ __Fe
Обучающиеся записывают в тетрадь
IV
Закрепление знаний
Самостоятельная работа по вариантам (слайд 7)
1. Составить формулы по степени окисления
I вариант II вариант
KO, SO PO, AlO
2.Расставить коэффициенты в химических уравнениях
C + h3 = Ch5 N2 + O2 = NO
Mg + O2 = MgO Ca + O2 = CaO
Варианты ответов (слайд 8)
I вариант II вариант
K2O, SO3 P2O5, Al2O3
C + 2h3 = Ch5 N2 + O2 = 2NO
2Mg + O2 = 2MgO 2Ca + O2 = 2CaO
Форма контроля взаимоконтроль
V
Обобщение
Метод словестный (самовоспроизводящая беседа)
Формулировка ЗСМВ.
Дать понятие химического уравнения
Правила составления химического уравнения.
VI
Информация о домашнем задании
Дифференцированный подход.
Уровень. Расставить коэффициенты в УХР.
Fe2O3 + h3 = Fe + h3O
ZnO + C = Zn + CO2
Уровень. Дописать УХР и расставить коэффициенты
Mg + O2 =
K + Cl2 =
Дополнительное задание по желанию: найти информацию об истории открытия ЗСМВ
VII
Подведение итогов урока
Самооценка обучающимися своей деятельности на уроке.
Выставление отметок в журнал.
Паспорт урока
Тема: Закон сохранения массы веществ. Химические уравнения.
Цель: Формирование понимания сущности химических реакций и умения расставлять коэффициенты.
Задачи. Образовательные: 1.Опытным путём доказать и сформулировать закон сохранения массы веществ. 2.Дать понятие о химическом уравнении, как условной записи химической реакции с помощью химических формул.
3.Начать формирование навыков расставлять коэффициенты в уравнениях химических реакций.
Развивающие: 1.Развитие умения решать несложные проблемы, формировать гипотезы. 2.Совершенствовать умения работать с реактивами и лабораторным оборудованием, с моделями атомов и молекул. 3. Развивать способность к логическому мышлению.
Воспитательные: 1.Продолжить формирование научного мировоззрения.
2.Воспитывать коммуникативную компетентность, а также наблюдательность, внимание и инициативу.
Тип урока. Комбинированный.
Методы: 1.Словесный ( эвристическая и воспроизводящая беседы) – развитие коммуникативных качеств, совершенствование интеллекта, активизация умственной работы обучающихся, поддержание внимания и интереса, развитие речи.
2. Наглядный – развитие наблюдательности , внимания, логического мышления (демонстрационный опыт, таблицы с формулами веществ,
использование компьютера и оборудования ИКТ.)
3.Практический – развитие самостоятельности, умения работать с реактивами и лабораторным оборудованием, применять теоретические знания на практике (лабораторный опыт, моделирование молекул.)
Формы организации.
1.Индивидуальная работа (на доске.)
2.Фронтальная (актуализация знаний, решение проблемной ситуации, выдвижение гипотез, формирование научного мировоззрения.)
3.Групповая (работа в парах – лабораторный опыт, моделирование.)
Формы контроля.
1.Самоконтроль (самооценка при фронтальной работе.)
2.Взаимоконтроль (при выполнении самостоятельной работы по вариантам.)
Формы познавательных заданий.
1.Вопросы (проблемная ситуация, выдвижение гипотез.)
2.Экспериментальные задачи (лабораторный опыт.)
3.Моделирование.
Планируемые результаты.
1.Знать формулировку закона сохранения массы веществ.
2.Понимать смысл уравнений химических реакций и уметь расставлять коэффициенты в уравнениях.
Форма урока.
Традиционная с элементами поисковой деятельности.
Оборудование и реактивы.
Реактивы (растворы сульфата меди и гидроксида натрия), пробирка, технические весы, разновесы, шаростержневые модели атомов и молекул, колбы, таблицы с формулами веществ и с заданиями Что лишнее?, компьютер, проектор.
Урок проводился в 7 классе. Ребята изучают химию первый год по авторской программе «Пропедевтический курс химии для 7 класса»,утверждённой директором МОБУ «Краснооктябрьская СОШ.» Курс рассчитан на 34 часа в год (1час в неделю.) Обучающиеся этого класса за 1 четверть имели средний балл обученности – 4,0 ; % качества знаний- 76, за 2 четверть – средний балл – 4,1 ; % качества знаний – 90.
На начальном этапе изучения химии у обучающихся этого класса высокий познавательный интерес.
В изучаемой теме – это первый урок, всего по плану – 2 урока.
Образовательные технологии, применяемые на уроке.
1.Технология развивающего обучения при актуализации знаний, (эвристическая беседа), при изучении новой темы формировала теоретическое сознание и мышление (сущность закона с точки зрения атомно- молекулярного учения.) Старалась передать детям не столько знания, сколько способы умственных действий.
2. Технология проблемного обучения (закон сохранения массы веществ начинаем изучать с демонстрационного опыта обучающиеся самостоятельно пытаются сформулировать закон; выдвигают гипотезы и приходят к истине составляя модели молекул.) Происходит творческое овладение знаниями, навыками, умениями и развитие мыслительных способностей.
3. Технология личностно- ориентированного обучения (домашнее задание имеет 2 уровня ,а также по желанию задано найти информацию об истории открытия закона сохранения массы веществ.) Развивать индивидуальные
познавательные способности каждого ребёнка.
Химические явления. Закон сохранения массы веществ
Химические явления, или химические реакции, отличаются от физических тем, что в результате химических реакций происходит превращение одних веществ в другие. Причем, образовавшиеся вещества отличаются от исходных по своим свойствам. Например, железный гвоздь на воздухе ржавеет, ржавчина – это уже не железо, а совсем другое вещество, отличающееся по свойствам от железа. С химическими явлениями мы встречаемся и в повседневной жизни: скисание молока, гниение листьев, фотосинтез.

Признаки химических реакций: выпадение осадка, выделение газа, появление запаха, выделение или поглощение теплоты, появление света, изменение цвета.

Проследим за протеканием химических реакций и установим признаки, которые подтверждают образование новых веществ и появление у них новых свойств.
Например, при растворении никеля в соляной кислоте, образуется раствор соли изумрудно-зеленого цвета. Образование новых веществ говорит о том, что прошла химическая реакция, признак ее – изменение цвета.

Добавив в раствор сульфида натрия соляной кислоты, появляется запах тухлых яиц. Это запах сероводорода. Признак этой реакции – появление запаха, а образование сероводорода говорит о том, что это химическое явление.
Если к бесцветному раствору йодида калия добавить бесцветный раствор нитрата свинца (II), то образуется две новые соли и выпадает осадок желтого цвета.

Химическое явление можно наблюдать, если кусочек мела бросить в раствор соляной кислоты. При этом наблюдается бурное выделение углекислого газа.

А железный гвоздь, опущенный в раствор соляной кислоты, покрывается пузырьками, эти пузырьки – водород.

Если мы к раствору медного купороса добавим щелочь, то у нас образуется осадок голубого цвета. Прилив к этому осадку раствор кислоты, он раствориться. Эти признаки свидетельствуют о том, что прошла химическая реакция.

Смешаем порошки серы и железа, но новые вещества не образуются, а просто будет смесь веществ, которую можно разделить на компоненты с помощью магнита, или смешав с водой. Под действием магнита, железные опилки притягиваются к нему, а сера нет. При растворении в воде сера всплывает вверх, а железные опилки опустятся вниз. Но если исходную смесь нагреть, то происходит между ними химическая реакция, которая сопровождается выделением большого количества теплоты и образуется новое вещество – FeS – сульфид железа (II). Оно серого цвета, тонет в воде и не притягивается магнитом. Поэтому это явление, горение железных опилок и серы, является химическим.

Если же в ложечке сжечь серу, но она загорится синим пламенем, при этом выделяется теплота и свет, появляется запах жженой серы, эти признаки тоже свидетельствуют о том, что процесс горения серы относится к химическим явлениям.
Реакция горения магния идет очень быстро, он горит ослепительным пламенем с образованием нового вещества – оксида магния. Фосфор тоже сгорает в кислороде с образованием оксида фосфора (V).

Реакции, которые протекают с выделение теплоты и света, называются реакциями горения.
Кроме того, реакции, протекающие с выделением теплоты, называются экзотермическими (экзо – наружу), а реакции, протекающие с поглощением теплоты, называются эндотермическими (эндо – внутрь). К эндотермическим реакциям относится реакция разложения оксида ртути (II). Оксид ртути (II) представляет собой вещество красного цвета. При нагревании образуется кислород, который улетучивается и ртуть – металл серебристо-белого цвета.

Чтобы химическая реакция прошла, необходимы определенные условия:
· Необходимо, чтобы реагирующие вещества соприкоснулись, чем больше будет площадь их соприкосновения, тем быстрее пойдет реакция, для этого твердые вещества измельчают и перемешивают, а растворимые – растворяют и сливают растворы;
· Нагревание – второе условие, которое в основном необходимо для эндотермических реакций, для экзотермических оно необходимо для начала реакции, а в некоторых случаях и вовсе не нужно;
· Некоторые реакции не протекают без света, электрического тока. Например, для процесса фотосинтеза – свет – это необходимое условие.
В 1748 г. М.В. Ломоносов открыл закон сохранения массы веществ, который гласит: масса веществ, вступивших в химическую реакцию, равна массе веществ, получившихся в результате ее.

Носителями массы веществ являются атомы химических элементов, из которых состоят как вещества, которые вступают в химическую реакцию (реагенты), так и вещества, образовавшиеся в результате реакции (продукты реакции). При химических реакциях атомы не разрушаются и не образуются, а происходит только их перегруппировка.
Для подтверждения своего закона Ломоносов провел следующий опыт: в специальный сосуд налил соляную кислоту и щелочь – гидроксид натрия. К раствору щелочи налил несколько капель фенолфталеина и раствор щелочи окрасился в малиновый цвет. Закрыл сосуд пробкой, взвесил, а затем слил растворы. При этом окраска малиновая исчезла, т.к. прошла химическая реакция, а масса продуктов реакции оказалась такой же, как и исходная.
Подтверждение закона сохранения массы веществ

Мы можем сами доказать справедливость этого закона. Уравновесим на весах колбу с раствором хлорида железа (III), в которую опущена пробирка с гидроксидом натрия. Взвесим колбу. Смешаем растворы, у нас появляется осадок бурого цвета – гидроксид железа (III). Появление осадка говорит о том, что прошла химическая реакция. Взвесим колбу снова и видим, что масса не изменилась.
Закон сохранения массы веществ является основным законом химии. На основании этого закона составляют уравнения химических реакций и проводят расчеты по уравнениям.
Презентация «Закон сохранения массы вещества. Химические уравнения»
Просмотр содержимого документа
«Презентация «Закон сохранения массы вещества. Химические уравнения»»

Закон сохранения массы вещества. Химические уравнения.
Учитель МБОУ «Усть-Бакчарская СОШ»
Ковалёва Ю.Д.

- Знаменитый английский химик Роберт Бойль, прокаливая в открытой реторте различные металлы и взвешивая их до и после нагревания, обнаружил, что массы металлов становятся больше. Основываясь на этих опытах, он предложил, что существует некая» огненная материя», которая при нагревании металла соединяется с ним, увеличивая его массу.

М.В. Ломоносов в отличии от Р.Бойля прокаливал металлы не на открытом воздухе, а в запаянных ретотрах и взвешивал их до и после прокаливания. Он доказал, что масса веществ до и после реакции остаётся неизменной и что при прокаливании к металлу присоединяется какая-то часть воздуха. Описанное явление называют закон сохранения массы.

- Французский химик Антуан Лоран Лавуазье
( независимо от М.В. Ломоносова) сформулировал этот закон в 1789 году.
Закон сохранения массы веществ .
Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ.

- Видио эксперимент.

Химические уравнения.
- Химическое уравнение – это условная запись химической реакции посредством химических формул и коэффициентов.
- Исходные вещества, принимающие участие в химических реакциях называются реагентами.
- Новые вещества, образующиеся в результате химической реакции называются продуктами.
- Видио эксперимент.
Алгоритм составления уравнения химической реакции
Составим уравнение химической реакции взаимодействия фосфора и кислорода
1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – H 2 ; N 2 ; O 2 ; F 2 ; Cl 2 ; Br 2 ; I 2 . Между реагентами ставим знак «+», а затем стрелку:
P + O 2 →
2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов:
P + O 2 → P 2 O 5
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
Вначале уравнивают число атомов, которых в реагирующих веществах (продуктах) содержится больше.
В данном случае это атомы кислорода.
Находим наименьшее общее кратное чисел атомов кислорода в левой и правой частях уравнения. Наименьшее кратное для атомов натрия –10:
Находим коэффициенты путём деления наименьшего кратного на число атомов данного вида, полученные цифры ставим в уравнение реакции:
Закон сохранения массы вещества не выполнен, так как число атомов фосфора в реагентах и продуктах реакции не равно, поступаем аналогично ситуации с кислородом:
Получаем окончательный вид уравнения химической реакции. Стрелку заменяем на знак равенства. Закон сохранения массы вещества выполнен:
4P + 5O 2 = 2P 2 O 5

Задания для закрепления.
- Преобразуйте следующие схемы в уравнения химических реакций расставив необходимые коэффициенты и заменив стрелки на знак равенства: Zn + O 2 → ZnO
- Fe + Cl 2 → FeCl 3
- Mg + HCl → MgCl 2 + H 2
- Al(OH) 3 → Al 2 O 3 + H 2 O
- HNO 3 → H 2 O+NO 2 +O 2
- CaO+H 2 O→ Ca(OH) 2
- H 2 +Cl 2 → HCl
- KClO 3 → KClO 4 +KCl
- Fe(OH) 2 +H 2 O+O 2 → Fe(OH) 3
- KBr+Cl 2 → KCl+Br 2

Домашнее задание.
- Параграф 19-20
- Упражнения 3,4,5 стр 68
Химия 8 класс закон сохранения массы веществ
Масса веществ, вступивших в химическую реакцию, равна массе веществ,образовавшихся в результате реакции.
Закон сохранения массы веществ.
(М. В. Ломоносов, 1748 г. ; А. Лавуазье, 1789 г. )
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Атомно-молекулярное учение этот закон объясняет следующим образом: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка (т. е. химическое превращение- это процесс разрыва одних связей между атомами и образование других, в результате чего из молекул исходных веществ получаются молекулы продуктов реакции) . Поскольку число атомов до и после реакции остается неизменным, то их общая масса также изменяться не должна. Под массой понимали величину, характеризующую количество материи.
В начале 20 века формулировка закона сохранения массы подверглась пересмотру в связи с появлением теории относительности (А. Эйнштейн, 1905 г.) , согласно которой масса тела зависит от его скорости и, следовательно, характеризует не только количество материи, но и ее движение. Полученная телом энергия DE связана с увеличением его массы Dm соотношением DE = Dm•c2, где с — скорость света. Это соотношение не используется в химических реакциях, т. к. 1 кДж энергии соответствует изменению массы на ~10-11 г и Dm практически не может быть измерено. В ядерных реакциях, где DЕ в ~106 раз больше, чем в химических реакциях, Dm следует учитывать.
Исходя из закона сохранения массы, можно составлять уравнения химических реакций и по ним производить расчеты. Он является основой количественного химического анализа.
Составление химических уравнений.
Включает три этапа:
1. Запись формул веществ, вступивших в реакцию (слева) и продуктов реакции (справа) , соединив их по смыслу знаками «+» и «—>» :
HgO —> Hg + O2
2. Подбор коэффициентов для каждого вещества так, чтобы количество атомов каждого элемента в левой и правой части уравнения было одинаково:
2HgO —> 2Hg + O2
3. Проверка числа атомов каждого элемента в левой и правой частях уравнения.
Закон сохранения массы веществ. Химические уравнения

Закон сохранения массы веществ. ХИМИЧЕСКИЕ УРАВНЕНИЯ
Учитель химии МАОУ «СОШ №12» г. Кунгура Пермского края Фотеева В.А.

ТЕСТ
2вариант
1 вариант
Какие из перечисленных явлений относятся к физическим?
Какие из перечисленных явлений являются химическими (химическими реакциями)?
А) кипение воды
А) замерзание воды
Б) разложение воды электрическим током
Б) горение серы
В) брожение сока
В) гашение соды с уксусом
Г) плавление металлов
Г) плавление парафина
Д) подгорание пищи
Д) выпаривание раствора соли
Е) перегонка воды
Е) подгорание пищи
Ж) фильтрование
Ж) гашение соды уксусом
З) заваривание чая
З) пожелтение листьев

Проверка
2вариант
1 вариант
Какие из перечисленных явлений относятся к физическим?
Какие из перечисленных явлений являются химическими (химическими реакциями)?
А) кипение воды
Б) горение серы
В) брожение сока
Г) плавление парафина
Д) подгорание пищи
Д) выпаривание раствора соли
Ж) фильтрование
Ж) гашение соды уксусом
З) заваривание чая
З) пожелтение листьев

Давайте вспомним!!!
- Что называется химической реакцией?
- Какие вы знаете признаки химических реакций?
- А как вы думаете, происходят ли с веществами количественные изменения, например, что происходит с массой веществ?
- Какие будут мнения?
- Мнения разделись. Кто же из вас прав?
Какова будет тема урока?
( Что происходит с массой веществ при химических реакциях?)
- Как мы это можем выяснить?
- (Провести опыт, прочитать в учебнике).

ОПЫТ:
в замкнутой системе взвешиваются вещества, вступающие в реакцию: растворы хлорида бария (BaCl 2 ) и сульфата магния (МgSO 4 ) — m1 , а также образующиеся в результате реакции вещества: сульфата бария (BaSO 4 ) и хлорида магния (МgCl2 ) — m2.

- Какое явление вы наблюдали? Почему вы так считаете?
- Что произошло с массой веществ до и после реакции?
- Что является мельчайшей частицей вещества?
- Из каких частиц состоят молекулы? Вспомните определение АТОМА.
- Что показывает химическая формула?
- Как рассчитывается молярная масса, масса вещества?
- Так почему же m1=m2?
- Можете ли вы сразу ответить на данный вопрос? Почему? Что нужно знать?
( Может быть, знать химические формулы — состав веществ до и после реакции и посмотреть изменяется ли атомный состав веществ до и после реакции?)
- Какой вопрос возникает?
(Изменяется ли атомный состав веществ до и после реакции?)
- Какова цель нашего урока?
(Выяснить, изменяется ли качественный и количественный состав атомов при хим. реакциях?)

Решение проблемы
Запишем данную реакцию на русском,а затем на хим.языке:
хлорид бария + сульфат магния сульфат бария + хлорид магния
- BaCl 2 + MgSO 4 Ba SO 4 + Mg Cl 2
- 1атом Ba 1атом Mg 1атом Ba 1атом Mg
- 2атома Cl 1атом S 1атом S 2 атома Cl
- 4атома O 4атома O
До реакции После реакции
Какой вывод можно сделать?
( Атомы и их состав до и после реакции не изменились )

- Результаты взвешивания веществ до и после реакции подтверждают закон сохранения массы веществ. Учащиеся стоят перед решением проблемной задачи: почему m1=m2? Благодаря актуализации ранее полученных знаний о строении веществ, учащиеся сравнительно легко приходят к следующему выводу: m1= m2, так как атомы и их количество в результате химических превращений не изменяются, а только соединяются по-другому с образованием новых веществ.

Давайте проверим наш вывод расчётами:
BaCl 2 + MgSO 4 Ba SO 4 + Mg Cl 2
n= n= n= n=
M= M= M= M=
m= + m= m= + m=
До реакции — m1 После реакции – m2
-Что показали расчёты?
-Что Вы доказали?
( m1= m2 ) Почему?

Закон сохранения
массы вещества
«Все перемены в натуре случающиеся такого суть состояния, что сколько чего у одного тела отнимется, столько же присовокупится к другому. Так, ежели где убудет материи, то умножится в другом месте…»

Давайте вспомним
Химическая формула – условная запись состава вещества с помощью химических знаков и индексов.
Индекс показывает число атомов в формульной единице вещества.
Коэффициент показывает число несоединенных друг с другом частиц
Химическая формула
Коэффициент
Индекс
5Н 2 О
На основании данного закона составляют уравнения химических реакций
с помощью химических формул, коэффициентов и
математических знаков.

Уравнение реакции
х А + у В = с АВ
А,В, АВ- химические формулы
х, у, с — коэффициенты

ФОСФОР + КИСЛОРОД = ОКСИД ФОСФОРА (V)
1. P + O 2 P 2 +5 O 5 -2
2 . Начинаем с кислорода.
3. O — 2 атома слева O — 5 атомов справа
4. НОК = 10
5. 10 : 2 = 5 P + 5 O 2 P 2 O 5
6. 10 : 5 = 2 P + 5O 2 2 P 2 O 5
7. В левую часть уравнения перед формулой фосфора необходимо поставить
коэффициент – 4
4 P + 5 O 2 = 2 P 2 O 5

Выполнить упражнения:
1.Расставить коэффициенты в химической реакции
Al + O 2 Al 2 O 3
2.Записать химическую реакцию химическими формулами и расставить коэффициенты
гидроксид железа (III) + азотная кислота нитрат железа (III) + вода

Самостоятельная работа.
1 уровень:
Найдите и исправьте ошибки:
Al + 3HCl ═ AlCl 3 + 3H 2 ↑
2 уровень:
Расставьте коэффициенты в схеме химической реакции:
FeSO 4 + KOH → Fe(OH) 2 + K 2 SO 4
3 уровень:
Составьте уравнение химической реакции и расставьте коэффициенты:
Оксид фосфора (V) + гидроксид натрия → фосфат натрия + вода

Ответы
1 уровень:
2 Al + 6 HCl ═ 2 AlCl 3 + 3 H 2 ↑
2 уровень:
FeSO 4 + 2 KOH ═ Fe(OH) 2 + K 2 SO 4
3 уровень:
P 2 O 5 + 6 NaOH ═ 2 Na 3 PO 4 + 3 H 2 O
 m2 «
m2 «
?
Подобно Бойлю русский учёный делал опыт в запаянных ретортах. Но, в отличие от Бойля, Ломоносов взвешивал сосуды как до, так и после прокаливания не вскрывая. m1=m2
После двух часов нагревания был открыт запаянный кончик реторты, причём в неё ворвался с шумом наружный воздух.
По нашему наблюдению при этой операции была прибыль в весе на 8 гранов…» m1 m2

ПРОВЕРЬ СЕБЯ
1).М.В. Ломоносов открыл закон сохранения массы веществ в:
А.1789г. Б.1756г. В.1673г.
2).Установите правильную последователь- ность закона сохранения массы веществ:
A — массе веществ,
Б- масса веществ
В- в результате ее
Г-вступивших в реакцию,
Д-получившихся
Е- равна
3). Условная запись химической реакции это- А. химическая формула Б. коэффициент
В. химическое уравнение Г. индекс

РЕФЛЕКСИЯ
Выберите выражение, которое соответствует Вашей работе на уроке:
1. Терпение и труд всё перетрут.
2. Тяжело в учении – легко в бою.
3. Плох тот солдат, который не мечтает стать генералом.
4. Единственный путь, ведущий к знанию, — это деятельность.
5. Всякое знание лишь тогда имеет ценность, когда оно делает нас энергичнее.

Домашнее задание
Стр.96-98 § 27, упр.1(б), 2(г),3(б)

Давайте вспомним!!!
- Какие явления называются химическими?
- Какие условия необходимы для того, чтобы произошла химическая реакция?
- По каким признакам можно судить о том, что произошла химическая реакция?
- А как мы обозначали состав вещества?
- А реакцию можно обозначить? Какова тема и цель нашего урока?
План-конспект урока по химии (11 класс) по теме: Термохимия
Слайд 1
11 КЛАСС УРОК ПО ТЕМЕ ПОЧЕМУ ПРОТЕКАЮТ ХИМИЧЕСКИЕ РЕАКЦИИСлайд 2
План урока. Закон сохранения массы и энергии. Тепловой эффект химической реакции. Экзотермические и эндотермические реакции. Термохимия. Законы термохимии. Кто он Герман Гесс? Понятие об энтропии и энтальпии. Выводы по теме.
Слайд 3
Почему протекают химические реакции Закон сохранения массы и энергии. Масса веществ, вступающих в реакцию равна массе веществ, образующихся в результате реакции. Закон сохранения массы дает материальную основу для составления уравнений химических реакций и проведения расчетов по ним.
Слайд 4
Закон сохранения массы и энергии Взаимосвязь массы и энергии выражается уравнением Эйнштейна: E = mc 2 где Е – энергия; m – масса; с – скорость света в вакууме.
Слайд 5
Тепловые эффекты химических реакций нужны для многих технических расчетов. Представьте себя на минуту конструктором мощной ракеты, способной выводить на орбиту космические корабли и другие полезные грузы
Слайд 6
Тепловые эффекты химических реакций. Химическая реакция заключается в разрыве одних и образовании других связей, поэтому она сопровождается выделением или поглощением энергии в виде теплоты, света, работы расширения образовавшихся газов. • И трещат сухие сучья, Разгораясь жарко, Освещая тьму ночную Далеко и ярко! И.Суриков
Слайд 7
Классификация реакций
Слайд 8
Реакции, протекающие с выделением теплоты, проявляют положительный тепловой эффект (Q>0, Δ H0), т.е. с отрицательным тепловым эффектом, являются эндотермическими.
Слайд 9
Тепловой эффект химической реакции Количество теплоты, которое выделяется или поглощается в результате реакций между определенными количествами реагентов обычно обозначают символом Q. Q р = Q кон. — Q исх. Гидратация серной кислоты
Слайд 11
Раздел химии, занимающийся изучением превращения энергии в химических реакциях, называется ТЕРМОХИМИЕЙ . Существует два важнейших закона термохимии. Первый из них, закон Лавуазье–Лапласа, формулируется следующим образом:
Слайд 12
закон Лавуазье–Лапласа Тепловой эффект прямой реакции всегда равен тепловому эффекту обратной реакции с противоположным знаком.
Слайд 13
Второй закон термохимии был сформулирован в 1840 г российским академиком Г. И. Гессом: Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса.
Слайд 14
Сульфат натрия Na 2 SO 4 можно получить двумя путями из едкого натра NaOH . Первый путь (одностадийный): 2 NaOH + H 2 SO 4 = Na 2 SO 4 + 2 H 2 O + 131 кДж; Второй путь (двухстадийный): а) NaOH + H 2 SO 4 = Na Н SO 4 + H 2 O + 62 кДж б) NaHSO 4 + NaOH = Na 2 SO 4 + H 2 O + 69 кДж складывая тепловые эффекты двух последовательных реакций в способе (2) мы получаем тот же тепловой эффект, что и для способа (1): 65 кДж + 69 кДж = 131 кДж
Слайд 16
Энтальпия это определенное свойство вещества, оно является мерой энергии, накапливаемой веществом при его образовании. Величина, характеризующая теплосодержание — Δ Н
Слайд 17
Энтальпия и тепловой эффект противоположны по знаку При экзотермических реакциях , когда тепло выделяется, Δ Н отрицательно. При эндотермических реакциях (тепло поглощается) и Δ H положительно.
Слайд 18
Как вычислить тепловой эффект реакции Тепловой эффект химической реакции равен разности суммы теплот образования продуктов реакции и суммы теплот образования исходных веществ (суммирование проводится с учетом числа молей веществ, участвующих в реакции, т. е. стехиометрических коэффициентов в уравнении протекающей реакции): Δ H = H кон. — H исх.
Слайд 19
энтропия S Термодинамическая энтропия S, часто просто именуемая энтропия, в химии и термодинамике является функцией состояния термодинамической системы . изменение энтропии это отношение общего количества тепла к величине абсолютной температуры Термодинамическая система — это некая физическая система, состоящая из большого количества частиц, способная обмениваться с окружающей средой энергией и веществом.
Слайд 20
энтропия Функция характеризующая степень беспорядка Δ S Чем больше частиц в системе, тем больше в системе беспорядка Твердое вещество жидкость газ Степень беспорядка увеличивается —— > Вычислить изменения энтропии можно на основании справочных данных по формуле: Δ S = S кон. — S исх.
Слайд 21
Выводы Всякая химическая реакция характеризуется двумя энергетическими характеристиками: энтальпией ( Δ H ) и энтропией ( Δ S ). Для самопроизвольных реакций характерно стремление к уменьшению энергии за счет выделения ее в окружающую среду и к увеличению степени беспорядка. При вычислении Q р необходимо учитывать закон Гесса.
Слайд 22
Задача При соединении 18 г алюминия с кислородом выделяется 547 кДж теплоты. Составьте термохимическое уравнение этой реакции .
Слайд 23
Задача 5 При соединении 18 г алюминия с кислородом выделяется 547 кДж теплоты. Составьте термохимическое уравнение этой реакции . Решение Составить уравнение. 3О 2 + 4А l = 2А l 2 О 3 + Х кДж Вычислить количество вещества содержащего 18 г алюминия. n = m / M n (А l ) = 18г : 27г/моль =0,67 моль Составить и решить пропорцию. При окислении 0,67 моль алюминия выделяется 547 кДж теплоты При окислении 4 моль алюминия выделяется Х кДж теплоты Х = 4 •547 : 0,67 = 3265,67 кДж Составим термохимическое уравнение этой реакции. 3О 2 + 4А l = 2А l 2 О 3 + 2365 кДж
Слайд 24
Домашнее задание Изучить материал учебника параграф 12, выполнить задания № 5-8; составить суточный рацион питания для подростков
Слайд 25
В результате реакции, термохимическое уравнение которой 2h3(г) + O2(г) = 2h3O(г) + 484 кДж, выделилось 1479 кДж теплоты. Масса образовавшейся при этом воды равна 1) 100 г 2) 110 г 3) 120 г 4) 130 г
Слайд 26
Спасибо за внимание!