Закон Авогадро
Возьмем постоянную температуру T=const, постоянный объем V=const и неизменное давление. В этих условиях количество молекул (частиц) в любом идеальном газе будет оставаться постоянным. Данный параметр обозначается буквой N, а само утверждение называется законом Авогадро.
Определение 1При условии неизменности температуры и давления один моль любого газа будет занимать одинаковый объем.
Уточним, что при решении задач часто упоминаются так называемые нормальные условия. Это означает, что давление равно одной атмосфере или p=105 Па=760 мм рт.ст, t=0 °C. В этих условиях молярный объем любого идеального газа будет равен:
RTp=Vμ=22,4·10-3 м3моль=22,4 лмоль.
Если нам нужно рассчитать давление смеси разреженных газов, то нужно воспользоваться законом Дальтона.
Что такое число Лошмидта
Определение 2Количество молекул в постоянном объеме идеального газа в нормальных условиях называют числом Лошмидта.
Оно будет равно:
nL=NAVμ=2,686754·1025 м-3.
Значение закона Авогадро
Данный закон был открыт в 1811 г. физиком Амадео Авогадро в рамках атомно-молекулярной теории. Он считал, что в составе одной молекулы может находиться несколько атомов. Благодаря этому утверждению он смог объяснить и описать в терминах своей теории опыты Гей-Люссака, который ранее предположил существование закона объемных отношений, однако не смог обосновать его теоретически и решил принять за аксиому.
Определение 3Соотношение объемов реагирующих газов может быть выражено с помощью простых целых чисел. Это правило называется законом объемных отношений.
Зная закон Авогадро, можно сделать вывод, что и соотношение плотностей идеальных газов будет равно отношению их молярных масс в нормальных условиях:
ρ1ρ2=μ1μ2.
Первое отношение в данном равенстве – так называемая относительная плотность первого газа по второму. Также мы можем преобразовать формулу Авогадро, записав ее с помощью масс веществ, поскольку с учетом одинаковых объемов равенство будет аналогичным:
D=ρ1ρ2=m1m2.
Мы можем вычислить относительную плотность газа по отношению к водороду или воздуху. поскольку знаем их молярные массы. Они равны μvozd=29·10-3 кгмоль и μh3=2·10-
zaochnik.com
Закон Авогадро — Вікіпедія
Матеріал з Вікіпедії — вільної енциклопедії.
Зако́н Авога́дро — однакові об’єми будь-яких газів при однаковому тиску і температурі містять однакову кількість молекул. Цей закон був відкритий італійським фізиком Амедео Авогадро в 1811 році.
Наслідок закону Авогадро: однакові кількості молекул різних газів при однаковій температурі і однаковому тиску займають однакові об’єми. Так як 1 моль будь-яких газів містить однакову кількість молекул — 6,02·1023, це число називають сталою Авогадро і позначають NA{\displaystyle N_{A}}.
Об’єм, який займає один моль будь-якого газу при нормальних умовах, називається молярним об’ємом (позначається V
Наслідки закону
Із закону Авогадро випливають важливі наслідки, які використовують у хімічних дослідженнях.
- Перший наслідок: молі різних газів за однакових умов займають однакові об’єми.
За нормальних умов молярний об’єм є сталою стандартною величиною () і дорівнює 22,412 л/моль. Закон Авогадро можна використовувати для визначення молярної маси будь-якого газу:
де m — маса газу, M — молярна маса газу, V0 — приведений до нормальних умов об’єм газу.
- Другий наслідок: маси однакових об’ємів різних газів за однакових температури та тиску співвідносяться між собою, як їхні молярні маси:
Наслідок випливає з того, що загальна маса певного об’єму газу дорівнює добутку числа молекул N на масу молекули μ, отже m = Nμ. Маси двох різних газів, які за однакових умов займають однакові об’єми, становлять відповідно m1 = Nμ1 та m2 = Nμ2. У цих виразах згідно із законом Авогадро число молекул N однакове, тому співвідношенню мас цих газів відповідає співвідношення їхніх молекулярних мас.
uk.wikipedia.org
2. Закон Авогадро и его следствия.
1.Химия – часть естествознания. Химические процессы. Типы химических соединений. Химическая номенклатура. Номенклатура средних, кислых, основных солей.
Химия – часть естествознания.
Химия-наука о веществах. Она изучает вещества и их превращения, сопровождающиеся изменением внутреннего строения вещества и электронной структуры взаимодействующих атомов, но не затрагивающие состав и структуру ядер.
Известно около 7000000 химических соединений и из них 400000 неорганических.
Химия – одна из фундаментальных дисциплин. Она является частью естествознания, наук о природе. Она связана с множеством других наук, таких как физика, медицина, биология, экология и т.д.
Химические процессы.
Типы химических соединений.
Химическая номенклатура.
В настоящее время для названия химических элементов используют тривиальную и рациональную номенклатуру, причем последняя делится на русскую, полусистематическую (международную) и систематическую.
В тривиальной номенклатуре используют исторически сложившиеся собственные имена химических веществ. Они не отражают состав химических соединений. Использование таких названий чаще всего дань традиции. Пример: СаО – негашеная известь, N2О – веселящий газ.
В рамках русской номенклатуры используют для названия химических соединений корни русских названий, а в полусистематической – латинских. Чтение формул химических соединений начинается справа налево. И русская и полусистематическая номенклатуры в полной мере отражаю состав химических соединений. Пример: СаО – окись кальция (оксид кальция), N2O – полуокись азота (оксид азота I).
В целях унификации и упрощения формирования названий международный союз теоретической и прикладной химии предложил иную систему формирования химических соединений. Согласно этим правилам называть эти вещества следует слева направо. Пример: СаО – кальций оксид, N2O – диазот оксид.
В настоящее время самые распространенные в использовании русская и полусистематическая номенклатура.
Номенклатура средних, кислых, основных солей.
По химическому составу различают средние, кислые, основные соли. Существуют еще двойные, смешенные и комплексные соли. Большинство солей независимо от их растворимости в воде являются сильными электролитами.
Нормальные соли.
Закон Авогадро.
Амадео Авогадро в 1811 году выдвинул гипотезу, которая в дальнейшем была подтверждена опытными данными и потому стала называться законом Авогадро:
Одинаковые объемы различных газов при одинаковых условиях (температуре и давлении) содержат одинаковое число молекул.
Авогадро предположил, что молекулы простых газов состоят из двух одинаковых атомов. Таким образом, при соединении водорода с хлором их молекулы распадаются на атомы, которые образуют молекулы хлористого водорода. Из одной молекулы хлора и одной молекулы водорода образуется две молекулы хлористого водорода.
Следствия закона Авогадро.
Равные количества газообразных веществ, находящихся при одинаковых условиях (давлении и температуре), занимают равные объемы.
В частности: при нормальных условиях 1 моль любого газа занимает объем, равный 22.4 литра. Этот объем называют молярным объемом газа. Нормальные условия: 273К, 760мм рт. ст. или 1,01*10^5Па.Плотности любых газообразных веществ, находящихся при одинаковых условиях (Т, Р), относятся как их мольные (молярные) массы.
Отношение плотностей – относительная плотность одного газа по другому (Dотн.), тогда отношение молярных масс – тоже равно Dотн.
Если относительная плотность газа определена по водороду или по воздуху, то значение μ=2Dн и μ=29Dвозд. Где 29 – мольная масса воздуха.
Если газ находится в реальных условиях, то его объем вычисляется по формуле Менделеева-Клапейрона:
P*V=(m/μ)*R*T, где R=8,31 Дж/моль*К
Газовые смеси.
Если в газовой смеси нет взаимодействия, то каждый газ смеси обладает своими индивидуальными свойствами и подчиняется рассмотренным ранее законам.
Состав газовых смесей может выражаться: массовыми, объемными, мольными долями.
Массовая доля газа – отношение массы газа к массе всей газовой смеси.
Объемная доля газа – отношение объема газа к объему всей смеси.
Мольная доля газа – отношение числа молей газа к числу молей смеси.
Одним из следствий закона Авогадро: объемная доля = мольной доле.
Основные характеристики газовой смеси суммируются из характеристик ее компонентов. Так общее давление газовой смеси равно сумме парциальных давлений газа.
3. Закон эквивалентов. Эквивалент. Эквивалентная масса и эквивалентный объем. Эквивалентные массы сложных соединений.
Эквивалент.
Эквивалентом вещества (элемента) Э называется такое его количество, которое взаимодействует с одним молем атомов водорода или вообще с одним эквивалентом любого другого вещества (элемента). Например, найдем эквивалент некоторых веществ: HCl – 1 моль, h3O. С одним молем водорода соединяется 1 моль хлора и ½ атомов кислорода, и следовательно эквиваленты равна соответственно 1 и ½.
Эквивалентная масса и эквивалентный объем.
Эквивалентная масса (Эм) называется масса одного эквивалента вещества (элемента).
Эквивалентные массы ранее рассмотренных элементов равны Эм(Cl)=35.3 г/моль, Эм(O)=8 г/моль.
Эквивалентную массу любого элемента можно определить по формуле: Эм=μ/СО, где СО- абсолютная величина степени окисления в соединениях. Поскольку большинство элементов имеют переменную степень окисления, то значения их эквивалентов в различных соединениях различно. Например найдем
Если в задаче указаны объемы газов, то удобнее пользоваться понятием эквивалентный объем, вычисляемый с помощью закона Авогадро. Эквивалентным объемом называется объем занимаемый при н.у. одним эквивалентом вещества. Так 1 моль водорода, т.е. 2г. Занимает объем 22.4л., следовательно 1г. (т.е. одна эквивалентная масса), будет занимать 11,2л. Аналогично можно найти эквивалентный объем кислорода который равен 5.6л.
Закон эквивалентов.
Массы реагирующих веществ, а также продуктов реакции пропорциональны изх эквивалентным массам. m1/m2=Эм1/Эм2
Для химической реакции:
νаА+νвВ=νсС+νдД справедливо nЭм(А)=nЭм(В)=nЭм(С)=nЭм(Д)
Где nЭм – число эквивалентных масс. Поэтому если известно число эквивалентных масс одного из веществ, то отпадает необходимость в подсчете числа Эм оставшихся веществ. Очевидно, что число эквивалентных масс равно отношению массы вещества к эквивалентной массе.
Закон эквивалентов для эквивалентных объемов записывается в следующем виде:
V1/V2=Эv1/Эv2
Эквивалентные массы сложных соединений.
На основе закона эквивалентных масс справедливы следующие формулы для расчета Эм:
Эм(оксида)=μ(оксида)/∑СОэл-та ,где ∑СОэл-та – суммарная степень окисления одного из элементов (она равна произведению степери окисления элемента на число атомов этого элемента)
Эм(соли)=μ(соли)/∑z , где ∑z – суммарный заряд иона (катиона или аниона).
Эм(кислоты)=μ(кислоты)/nh(основность-число Н)
Эм(основания)=μ(основания)/nон(кислотность основания – число ОН)
h4PO4+2KOH=K2HPO4+2h3O
3Ca(OH)2+h4PO4=(CaOH)3PO4+3h3O
Al2(SO4)3+6KOH=2Al(OH)3+3K2SO4
Электрон является объектом микромира и в своем поведении он подчиняется особым законам, не похожим на законы макромира. Движение объектов микромира описывается не законами механики Ньютона, а законами квантовой механики. Квантовая механики основывается на двух основных принципах.
Принцип корпускулярно-волнового дуализма.
Согласно этому принципу поведение объектов микромира может быть описано как движение частицы (корпускулы) и как волновой процесс. Физически это представить невозможно. Математически это описывается уравнением Де Бройля:
ק=(h*ν)/m*υ, где ν – длина волны, соответствующая электрону массой m и движущегося со скоростью υ.
Принцип неопределенности Гейзенберга.
Для электрона не возможно с какой либо точностью определить координату х и импульс (px=m*Vx, где Vx – скорость электрона в направлении координаты х)
ΔxΔp≥h/2∏
Неопределенности (погрешности) нашего знания о величинах х и рх. Мы можем говорить лишь о вероятностном расположении электрона в этом месте. Чем точнее мы определяем х, тем неопределеннее для нас становится величина рх.
Из этих двух принципов складывается ветоятностно-статистический характер квантовой механики.
6. Последовательность заполнения электронами состояний в атомах различных элементов (энергетические состояния электронов в многоэлектронных атомах). Электронные формулы многоэлектронных атомов на примере элементов 2 и 3 периодов. Принцип Паули. Правило Хунда. Электронные формулы элементов в основном и возбужденных состояниях на примере атомов азота, углерода, серы.
Последовательность заполнения электронами состояний в атомах различных элементов (энергетические состояния электронов в многоэлектронных атомах).
Согласно принципу минимума энергии, наиболее точным состоянием атома будет то, при котором электроны размещаются на орбиталях с наименьшей энергией. Состояние атома, которое характеризуется минимальным значением энергии электрона называется основным (невозбужденным).
Порядок заполнения орбиталей энергетически определяется:
1).принцип минимума энергии
2).принцип Паули
3).правило Хунда
Принцип наименьшей энергии
Так появление второго электрона у атома гелия приводит к тому, что на эффект взаимодействия электрона с положительным ядром, влияет еще и сила отталкивания электронов между собой. При дальнейшем росте электронов, внутренние или основные электроны препятствуют взаимодействию внешних с ядром. То есть внутренние электроны экранируют внешние, В связи с этими причинами в многоэлектронных атомах различаются подуровни с соответственно различным значением энергии. Порядок чередования подуровней определяется двумя правилами Клечковского:
1).Меньшая энергия отвечает подуровню с меньшим значением суммы n+l
2).При одинаковых значениях суммы меньшая энергия отвечает подуровню с меньшим значением m
Таблица. 4s подуровень по энергии ниже, чем 3d подуровень, т.к. s электроны меньше экранируются, чем d электроны, т.к. могут ближе проникнуть к ядру.
Принцип Паули
В атоме не может быть двух электронов с одинаковым наборов квантовых чисел. Таким образом, на одной орбитали может находится не более двух электронов, причем с разными спинами вращения.
Правило Хунда
Подуровень заполняется таким образом, чтобы их суммарный спин был максимальным. То есть в пределах подуровня сначала заполняется максимальное число квантовых ячеек.
7. Характер изменения химических свойств элементов по мере увеличения их порядкового номера. S-, p-, d-, f— элементы. Связь между электронной конфигурацией атомов элементов и их положением в периодической системе.
Характер изменения химических свойств элементов по мере увеличения их порядкового номера.
При увеличении порядкового номера в периодах слева направо нарастают неметаллические (кислые) свойства. В группах нарастают металлические (основные свойства). Это приводит к тому, что вблизи диагонали проведенной из левого верхнего угла в правый нижний элементы образующие соединения амфотерного характера.
Кроме того, периодическое изменение свойств элементов с увеличением порядкового номера объясняется периодическим изменением строения атомов, а именно числом электронов на их внешних энергетических уровнях.
S-, p-, d-, f— элементы. Связь между электронной конфигурацией атомов элементов и их положением в периодической системе.
Начало каждого периода соответствует началу застройки нового энергетического уровня. Номер периода определяет номер внешнего уровня. Он является застраивающимся у элементов главных подгрупп. Т.е. s и p элементов. У d элементов идет заполнение первого с наружи уровня. У f- второго снаружи. Т.е. внешний и застраивающийся уровень не всегда совпадают. Т.к у d элементов заполняется первый снаружи уровень, а химические свойства в первую очередь определяются структурой внешнего энергетического уровня, то химические свойства этих элементов похожи между собой (например, все они металлы). У них отсутствует резкое изменение свойств при переходе от элемента к элементу. Как, например, у s и p элементов. Еще более похожи свойства f элементов (лантаноиды и актиноиды), поскольку у них заполняются еще более глубокие подуровни.
10.Ковалентность в методе валентных связей. Валентные возможности атомов элементов второго периода в основном и возбужденном состояниях. Сравнить валентные возможности (ковалентность) S и О, F и Cl в рамках метода валентных связей.
Ковалентность в методе валентных связей.
Каждый атом предоставляет один из пары электронов. Общее число электронных пар, которое он образует с атомами других элементов, называется ковалентностью.
Валентные возможности атомов элементов второго периода в основном и возбужденном состояниях.
Сравнить валентные возможности (ковалентность) S и О, F и Cl в рамках метода валентных связей.
studfile.net
Закон авогадро
В равных объемах любых газов, находящихся при одинаковых температуре и давлении, содержится одинаковое число молекул.
Из закона Авогадро следует, что 1 моль любого газа занимает одинаковый объем.
При нормальных условиях (н.у.) (Т=273К или 00С и Р=101325 Па или 1 атм или 760 мм. рт. ст.) этот объем называется молярным (VМ ) и равен 22,4 л.
Уравнение состояния идеального газа
Из закона Авогадро следует, что массы равных объемов двух газов относятся друг к другу, как их молярные массы:
D =  =
=  . (2.2)
. (2.2)
Величиной D называется относительная плотность первого газа по второму.
ПРИМЕР: плотность кислорода по воздуху D =  =
= 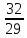 = 1,1.
= 1,1.
Объединенное уравнение, описывающее состояние идеального газа, носит название УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА (уравнение Клапейрона – Менделеева):
PV= RT, (2.3)
13
где
для газов = 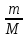 =
= 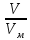 .
В этом уравнении
Р(Па) — давление, при котором
.
В этом уравнении
Р(Па) — давление, при котором
находится данное количество газа; V(м3) — объем, занимаемый газом; (моль) – число молей газа; Т (К) – абсолютная температура; R (8,31 Дж/моль·К) –
универсальная газовая постоянная (R – это работа расширения 1 моль идеального газа при нагревании его на 1 градус). Универсальная газовая постоянная связана с константой Больцмана соотношением
R=k Na = 13,805
Na = 13,805 10-22
10-22  6,02
6,02 1023 = 8,31 Дж/моль·К.
1023 = 8,31 Дж/моль·К.
Для расчета параметров газа, находящегося в смеси с другими газами, используют понятие парциального давления.
Парциальное давление газа – это давление, которое оказывал бы данный газ, если бы занимал весь объем, занимаемый газовой смесью. Общее давление газовой смеси равно сумме парциальных давлений отдельных газов. Парциальные давления газов в смеси пропорциональны их объемному содержанию.
ПРИМЕР: газовая смесь (воздух) состоит на 20% из кислорода и на 80% из азота. Давление воздуха составляет 1 атмосферу. В этом случае парциальное давление кислорода РО2 = 0,2 атм., а парциальное давление азота – РN2=0,8 атм.
14
3. Строение атома
Простейшая модель строения атома в современной науке принадлежит Резерфорду. Согласно этой модели атом представляет собой электронейтральную систему, состоящую из положительно заряженного ядра и совокупности отрицательно заряженных электронов, которые двигаются в поле этого ядра. Заряд ядра и порядковый номер элемента в таблице Д.И.Менделеева определяется числом протонов в ядре. Формальный заряд протона равен +1. Число электронов в атоме равно числу протонов в его ядре. Формальный заряд электрона -1. Модель Резерфорда не могла объяснить природу устойчивости атомов (согласно классической механике заряженная частица – электрон, двигаясь по круговой или иной орбите вокруг ядра, должна непрерывно испускать энергию и в течение 10-6с упасть на это ядро. Этого не происходит. Время жизни отдельных атомов может
превышать миллиарды лет. Кроме того, была не понятна зависимость химических свойств атомов от заряда их ядра и способность испускать и поглощать энергию в виде строго определенных порций – квантов. В 1913 году датский физик Нильс Бор попытался объединить модель Резерфорда с квантовой теорией Макса Планка. Созданная им теория строения атома водорода базируется на двух постулатах: 1.В атоме существуют некоторые орбиты, по которым электрон может двигаться не испуская и не поглощая энергии;
2.При переходе электрона с одной орбиты на друную атом испускает или поглощает энергию строго определенной частоты.
В рамках своей теории Бор получил уравнение полной энергии электрона в атоме, а также уравнения, позволяющие рассчитать скорость электрона и радиус разрешенных орбит. Оказалось, что полная энергия электрона в атоме — величина отрицательная. Электрон может находиться в составе атома до тех пор, пока его положительная кинетическая энергия будет меньше по абсолютной величине, чем его отрицательная потенциальная энергия взаимодействия с ядром.
Уравнения представляют собой набор постоянных величин (констант), кроме множителя n, котрый может принимать значения любых целых чисел − 1,2,3,4 …. Значение множителя n соответствует номеру разрешенного электронного уровня, по которому электрон может двигаться без изменения своей энергии. При переходе с уровня на уровень энергия электрона меняется скачкообразно, так как между ними электрон существовать не может. Повышение номера уровня соответствует увеличению энергии электрона, а понижение – уменьшению энергии. Таким образом, наименьшим запасом энергии электрон обладает находясь на первом энергетическом уровне (первой боровской орбите). Это положение соответствует минимальному запасу энергии атома и, значит, наиболее устойчивому состоянию. Переход электрона на вышестоящие уровни определяется термином «возбужденное состояние атома». Возврат атома в нормальное состояние соответствует переходу электрона на исходный энергетический уровень, при этом атом последовательно испускает кванты (порции) энергии, соответствующие разнице энергий между разрешенными уровнями.
15
Эти кванты энергии фиксируются специальными приборами, в результате чего исследователи получают атомный спектр, который имеет вид набора светлых и темных полос, лежащих в определенной области спектра.Чем ближе к ядру атома располагается разрешенный электронный уровень, тем больше энергия (короче длина волны), необходимая для возбуждения атома.
Дальнейшее развитие учения о строении атома связано со становлением науки, получившей название квантовая механика. В основе ее лежат корпускулярно- – волновые представления о природе микрочастиц.
Луи де Бройль в 1924 году вывел соотношение, которое получило его имя :
 , (3.1)
, (3.1)
где m – масса частицы; ν – скорость частицы; h – постоянная Планка; λ
– длина волны. Согласно этому соотношению
любой частице, обладающей массой m и движущейся со скоростью 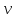 ,
соответствует длина волныλ.
,
соответствует длина волныλ.
В 1927 году немецкий физик В.Гейзенберг вывел положение, получившее название «принцип неопределенности Гейзенберга», согласно которому невозможно одновременно точно определить координаты микрочастицы и ее скорость (импульс). Чем точнее определяется местоположение частицы, тем менее точно можно определить ее скорость. Эта неопределенность заставила отказаться от понятия траектория движения электрона. Было введено понятие вероятности нахождения электрона в различных точках атомного пространства, а вместо боровских разрешенных орбит понятие «электронная орбиталь».
Последний термин обозначает часть околоядерного пространства, где электрон бывает с максимальной долей вероятности. Область этого пространства, в которой электрон проводит более 90% своего времени называется граничная поверхность.
В 1926 году австрийский физик Э.Шредингер предложил уравнение, связывающее воедино корпускулярно-волновые свойства микрочастиц с их
энергией. В уравнение входит величина ψ, называемая волновой функцией. По существу, волновая функция – это решение уравнения Шредингера, называемое «атомная орбиталь». Квадрат этой функции ψ2 – определяется как вероятность нахождения электрона в разных точках атомного пространства.
Расчеты, сделанные для атома водорода показали, что точки атомного пространства, где электрон находится с максимальной долей вероятности, образуют пространственную фигуру, практически полностью по форме и размерам совпадающую с первой боровской орбитой.
Изучение атомных спектров многоэлектронных атомов показало, что они имеют более тонкую структуру, чем простые линии. Внутри линий были обнаружены пакеты более тонких линий – «мультиплетов», появление которых связано с взаимодействием электрона со своими соседями. Эти взаимодействия были учтены, когда для описания движения электронов в теории Бора были использованы четыре квановых числа.
16
studfile.net
Закон Авогадро | Все формулы
Сообщение от администратора:
Ребята! Кто давно хотел выучить английский?
Переходите по моей ссылке и получите два бесплатных урока в школе английского языка SkyEng!
Занимаюсь там сам — очень круто. Прогресс налицо.
В приложении можно учить слова, тренировать аудирование и произношение.
Попробуйте. Два урока бесплатно по моей ссылке!
Жмите СЮДА
Закон Авогадро — В равных объемах различных газов при постоянных температуре и давлении содержится одинаковое число молекул.
Из Закона Авогадро выводится 2 следствия:
Следствие 1 : Один моль любого газа при одинаковых условиях занимает одинаковый объем
В частности, при нормальных условиях (T=0 °C (273К) и p=101,3 кПа) объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm. Пересчитать эту величину на другие температуру и давление можно с помощью уравнения Менделеева-Клапейрона
Из Уравнения Менделеева-Клапейрона выводятся еще 3 закона
1) Закон Шарля :
2) Закон Гей-Люссака :
3) Закон Боля-Мариотта :
Следствие 2 : Отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов
Эта постоянная величина называется относительной плотностью газов и обозначается D. Так как молярные объемы всех газов одинаковы (1-е следствие закона Авогадро), то отношение молярных масс любой пары газов также равна этой постоянной:
В Формуле мы использовали :
— Относительная плотность газа
— Молярные массы
— Давление
— Молярный объем
— Масса
— Универсальная газовая постоянная
— Абсолютная температу
xn--b1agsdjmeuf9e.xn--p1ai
Закон Авогадро — Википедия
Материал из Википедии — свободной энциклопедии
Зако́н Авога́́дро — закон, согласно которому в равных объёмах различных газов, взятых при одинаковых температурах и давлениях, содержится одно и то же количество молекул. В виде гипотезы был сформулирован в 1811 году Амедео Авогадро (1776—1856), профессором физики в Турине. Гипотеза была подтверждена многочисленными экспериментальными исследованиями и поэтому стала называться законом Авогадро, став впоследствии (через 50 лет, после съезда химиков в Карлсруэ) количественной основой современной химии (стехиометрии)[1]. Закон Авогадро точно выполняется для идеального газа, а для реальных газов он является тем более точным, чем газ более разреженный.
История
Первые количественные исследования реакций между газами принадлежат французскому ученому Гей-Люссаку. Он является автором законов о тепловом расширении газов и закона объемных отношений. Эти законы были теоретически объяснены в 1811 году итальянским физиком Амедео Авогадро[2].
Следствия закона
Первое следствие из закона Авогадро: один моль (одинаковое количество молей) любого газа при одинаковых — изобаричных и изотермичных — условиях занимает одинаковый объём.
Согласно закону Авогадро, одно и то же количество молекул любого газа занимает при одинаковых условиях один и тот же объём. С другой стороны, 1 моль любого вещества содержит (по определению) одинаковое количество частиц (англ.)русск. (например, молекул). Отсюда следует, что при определённых температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объём.
В частности, при нормальных условиях, то есть при 0 °C (273,15 К) и 101,325 кПа, объём 1 моля газа равен 22,413 962(13) л. Эту физическую константу называют стандартным молярным объёмом идеального газа и обозначают Vm. Пересчитать эту величину на другие температуру и давление можно с помощью уравнения Клапейрона:
- PVT=101,3 kPa⋅22,414 l273 K.{\displaystyle {\frac {PV}{T}}={\frac {101,3~\mathrm {kPa} \cdot 22,414~\mathrm {l} }{273~\mathrm {K} }}.}
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа ко второму.
Это положение имело важное значение для развития химии, так как оно дает возможность определять молекулярную массу веществ, способных переходить в газообразное или парообразное состояние (см. Атомно-молекулярное учение). Если через μ обозначить молекулярную массу вещества и через ρ′ — его относительную плотность в газообразном состоянии, то отношение μ / ρ′ должно быть постоянным для всех веществ. Опыт показал, что для всех изученных веществ, переходящих в газообразное состояние без разложения, эта постоянная равна 28,9 а.е.м. (атомных единицы массы), если при определении относительную плотность исходить из плотности воздуха; но эта постоянная будет равняться 2 а.е.м., если принять за единицу плотность водорода. Обозначив эту постоянную, или, что то же, общее для всех газов отношение молекулярной массы к относительной плотности через С, мы из формулы имеем с другой стороны μ′ = ρ′C. Так как относительная плотность ρ′ газа определяется легко, то, подставив её значение в формулу, можно вывести и неизвестную молекулярную массу данного вещества.
Пример использования закона Авогадро
Элементный анализ одного из углеводородов, выполненный А. М. Бутлеровым, указывал, что отношение атомного содержания углерода к водороду составляет в нём 1 к 2, а потому его относительный состав может быть выражен формулой СН2 или C2H4, C4H8 и вообще (СН2)n. Молекулярная масса этого углеводорода определяется, следуя закону Авогадро, из плотности его пара, которая оказалась в 5,85 раз больше плотности воздуха; отсюда молекулярная масса этого вещества равна ρ′C = 5,85 · 28,9 а.е.м. = 169,06 а.е.м. Формуле C11H22 отвечает молекулярная масса 154 а.е.м., формуле C12H24 — 168 а.е.м., а C13H26 — 182 а.е.м. Формула C12H24 (циклододекан) близко отвечает наблюдаемой величине, а потому она и должна выражать собой состав молекулы исследуемого углеводорода (CH2)n.
См. также
Примечания
Источники
- ↑ Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии: В 2-х томах. Пер. с англ.. — М. : Мир, 1982. — Т. 1. — С. 62—65, 295. — 652 с. : ил.
- ↑ Глинка Н. Л. Общая химия. — 22 изд., испр. — Л. : Химия, 1977. — С. 18—19. — 719 с.
Сноски
Литература
Ссылки
wikipedia.green
Закон Авогадро
В 1811 году итальянский физик А. Авогадро объяснил простые отношения между объемами газообразных участников реакции на основании установленного им закона.
В равных объемах любых газов и паров при одинаковых условиях содержится одинаковое количество молекул.
Закону Авогадро подчиняются только газообразные вещества. В газах промежутки между молекулами велики по сравнение с их размерами, а собственный же объем молекул очень мал. Общий объем газов определяется, главным образом, расстояниями между молекулами, примерно одинаковыми у всех газов (при одинаковых внешних условиях).
Если вещество находится в твердом или жидком состоянии, то его объем зависит от размеров самих молекул Следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объем.
В частности, при нормальных условиях, т.е. при 0 С (273К) и 101,3 кПа, объем 1 моля газа, равен 22,4 л. Этот объем называют молярным объемом газа Vm. Таким образом, при нормальных условиях (н.у.) молярный объем любого газа Vm= 22,4 л/моль.
Закон Авогадро используется в расчетах для газообразных веществ. При пересчете объема газа от нормальных условий к любым иным используется объединенный газовый закон Бойля-Мариотта и Гей-Люссака:

где Рo, Vo, Тo — давление, объем газа и температура при нормальных условиях (Рo = 101,3 кПа, Тo = 273К).
Если известна масса (m) или количество () газа и требуется вычислить его объем, или наоборот, используют уравнение Менделеева — Клапейрона:
PV = RT,
где = m/M — отношение массы вещества к его молярной массе, R — универсальная газовая постоянная, равная 8,31 Дж/(мольК).
Из закона Авогадро вытекает еще одно важное следствие: отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов. Эта постоянная величина называется относительной плотностью газа и обозначается D. Так как молярные объемы всех газов одинаковы (1-е следствие закона Авогадро), то отношение молярных масс любой пары газов также равна этой постоянной:
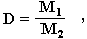
где М1 и М2 — молярные массы двух газообразных веществ.
Величина D определяется экспериментально как отношение масс одинаковых объемов исследуемого газа (М1) и эталонного газа с известной молекулярной массой (М2). По величинам D и М2можно найти молярную массу исследуемого газа:
M1 = D M2.
Средняя кинетическая энергия движения молекул прямопропорциональна абсолютной температуре.

Билет№30.
Термодинамический подход. Использование термодинамических параметров в описании состояния макросистемы.
Макросистема-система, сост. из очень большого числа молекул и атомов.
Термодинамика-наука о тепловых явлениях, в которой не учитывается молекулярное строение тел и тепловые явления характеризуются параметрами, регистрируемыми приборами (термометром, манометром и др.), не реагирующими на воздействие отдельных молекул. Законы термодинамики описывают тепловые свойства тел, число молекул в которых огромно. Такие тела называютсямакросистемами. Тепловые свойства макросистем опред-сятермодинамическими парам-ми(параметрами состояния): температурой, давлением и удельным объемом (объемом единицы массы). Эти параметры часто называются функциями сос-ия сис-мы.
Всякая термо-ая сис-ма в любом состоянии обладает внутренней энергией-энергией теплового (поступательного, вращательного и колебательного) движения молекул и потенциальной энергией их взаимодействия. Возможны два способа изменения внутренней энергии термодинамической сис-мы при её взаимодействии с внешними телами: совершение работы и теплообмен.
Билет №31.
Изопроцессы и первый закон термодинамики.
Первое
началотермодинамики: кол-во теплоты
 Q,
сообщенное телу , идет на увеличение
его внутренней энергии
Q,
сообщенное телу , идет на увеличение
его внутренней энергии
 Uи на совершении телом работы
Uи на совершении телом работы
 А,
т.е.
А,
т.е.
Q =
=
 U+
U+
 A.
A.
Из первого начала термо-ки следует важный вывод: невозможен вечный двигательпервого рода, т.е. такой двигатель, который совершал бы работу «из ничего», без внешнего источника энергии.
Всякая предоставленная самой себе сис-ма стремится перейти в состояние термод-огоравновесия,в кот. тела находятся в сост-ии покоя по отношению друг к другу, обладая одинаковыми температурой и давлением.
Равенство температур во всех точках есть условие равновесия двух систем или двух частей одной и той же системы.
Это положение наз. нулевым началом термод-ки.
Вторе начало термодинамики:
Формулировка Клаузиуга: не возможен процесс, ед-венным рез-том, кот. явл. передача энергии в форме теплоты от менее нагретого тела к более нагретому. Т2>Т1. Возможен процесс наоборот, т.е. от более нагретого тела к менее нагретому. Этот процесс справедлив только в замкнутой системе отсчета.
Формулировка Кельвина: не возможен периодич. процесс, ед-венным рез-том кот. явл. превращение теплоты, получ. от нагревателя (теплоотдатчика) в эквивалентную Е работу.IIнач. термод-ки искл. возм-ть созд. вечного двигателяIIрода, т.е. двигателя в кот. рабочее тело, совершая круговой процесс, получило бы энергию в форме теплоты от одного внеш. тела и целиком передавало бы её в форме работы другому внеш. телу.
Биле №32.
Энтропия и второй закон термодинамики.
Количественной характеристикой теплового состояния сис-мы явл. термод-ая вероятность W, равная числу микроскопических способов, с помощью кот. это состояние может быть достигнуто. Система, предоставленная самой себе, стремится перейти в состояние с большим значениемW. Принято пользоваться не самой вероятностьюW, а её логарифмом, кот. ещё умножается на пост-ую Больцманаk. Определенную таким образом величинуS=klnWназ.энтропией системы.
Второе начало термодинамики, оред-ее направление тепловых процессов, формулируется как з-н возрастания энтропии:
для
всех происходящих в замкнутой системе
тепловых процессов энтропия сис-мы
возрастает; максимально возможное
значение энтропии замкнутой сис-мы
достигается в тепловом равновесии:
 S≥0.
Энтропия характеризует меру хаоса, кот.
для всех естественных процессов
возрастает.
S≥0.
Энтропия характеризует меру хаоса, кот.
для всех естественных процессов
возрастает.
Работы Больцмана в области кинетической теории, разработку Планком квантовой теории излучения и Эйнштейном теории спонтанной эмиссии; в основе всех этих достижений лежит второй з-н термод-ки. При абсолютном нуле температуры энтропия принимает значение, не зависящее от давления, агрегатного состояния и других характеристик вещества. Такое значение можно положить равным нулю.
Это утверждение наз. тепловой теоремой. Теорема не вытекает из первых двух начал, поэтому в силу своей общности она рассматривается как третье начало термодинамики.
studfile.net