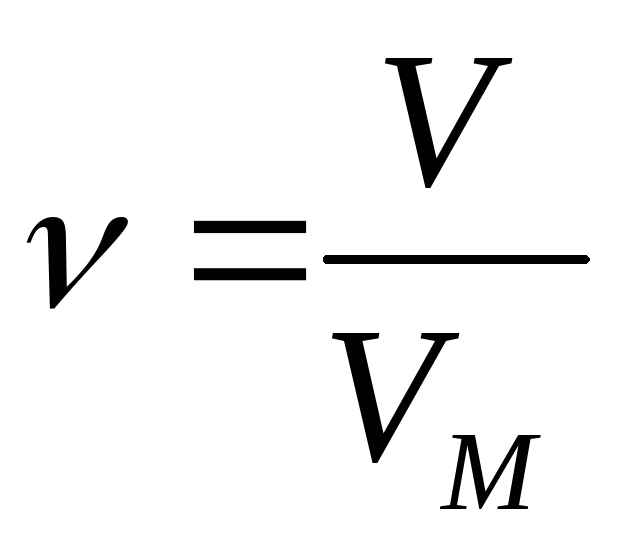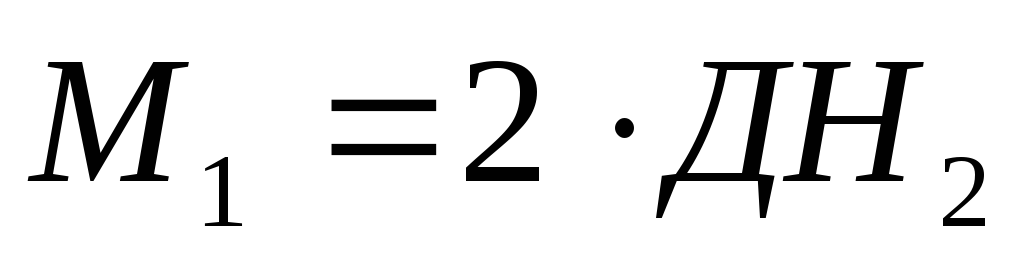Закон Авогадро | Все Формулы
![Rendered by QuickLaTeX.com \[ \]](/800/600/https/xn----ctbjzeloexg6f.xn--p1ai/wp-content/ql-cache/quicklatex.com-9b26b31cc88858c6b01bc73f6d36171f_l3.png)
Закон Авогадро — В равных объемах различных газов при постоянных температуре и давлении содержится одинаковое число молекул.
Из Закона Авогадро выводится 2 следствия:
Следствие 1 : Один моль любого газа при одинаковых условиях занимает одинаковый объем
В частности, при нормальных условиях (T=0 °C (273К) и p=101,3 кПа) объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm. Пересчитать эту величину на другие температуру и давление можно с помощью уравнения Менделеева-Клапейрона
![Rendered by QuickLaTeX.com \[\large pV_m=RT \]](/800/600/https/xn----ctbjzeloexg6f.xn--p1ai/wp-content/ql-cache/quicklatex.com-919a853773cf093c55dbd7998d0ebc9e_l3.png)
![Rendered by QuickLaTeX.com \[\large pV=\frac{m}{M}RT \]](/800/600/https/xn----ctbjzeloexg6f.xn--p1ai/wp-content/ql-cache/quicklatex.com-fc01b8da4ec18dd54b250bd4e7030466_l3.png)
Из Уравнения Менделеева-Клапейрона выводятся еще 3 закона
1) Закон Шарля :
![Rendered by QuickLaTeX.com \[\large V=const \Rightarrow \frac{P_1}{T_1}=\frac{P_2}{T_2} \]](/800/600/https/xn----ctbjzeloexg6f.xn--p1ai/wp-content/ql-cache/quicklatex.com-50bb758ef80a176ce228f3ed7106c1d3_l3.png)
2) Закон Гей-Люссака :
![Rendered by QuickLaTeX.com \[\large P=const\Rightarrow \frac{V_1}{T_1}=\frac{V_2}{T_2} \]](/800/600/https/xn----ctbjzeloexg6f.xn--p1ai/wp-content/ql-cache/quicklatex.com-1a91039538d346915cbe426a5db99874_l3.png)
3) Закон Боля-Мариотта :
![Rendered by QuickLaTeX.com \[\large T=const \Rightarrow P_1V_1=P_2V_2\]](/800/600/https/xn----ctbjzeloexg6f.xn--p1ai/wp-content/ql-cache/quicklatex.com-ee13af532c0ebc02249d361dc136db7b_l3.png)
Следствие 2 : Отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов
Эта постоянная величина называется относительной плотностью газов и обозначается D. Так как молярные объемы всех газов одинаковы (1-е следствие закона Авогадро), то отношение молярных масс любой пары газов также равна этой постоянной:
![Rendered by QuickLaTeX.com \[\large D=\frac{M_1}{M_2}\]](/800/600/https/xn----ctbjzeloexg6f.xn--p1ai/wp-content/ql-cache/quicklatex.com-4c37c53921ec14582e8539ae7eb9c656_l3.png)
В Формуле мы использовали :
D — Относительная плотность газа
M — Молярные массы
p — Давление
![Rendered by QuickLaTeX.com \[ V_m \]](/800/600/https/xn----ctbjzeloexg6f.xn--p1ai/wp-content/ql-cache/quicklatex.com-3e75e0866eea7c06b9cb7bdc89512dff_l3.png)
— Молярный объем
m — Масса
R = 8,31 — Универсальная газовая постоянная
T — Абсолютная температу
Газовые законы. Константы Авогадро.
Закон Авогадро (А. Авогадро, 1811)
В равных объемах газов (V) при одинаковых условиях (температуре Т и давлении Р) содержится одинаковое число молекул.
Следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объем.
В частности, при нормальных условиях, т.е. при 0° С (273К) и 101,3 кПа, объем 1 моля газа, равен 22,4 л. Этот объем называют молярным объемом газа Vm. Таким образом, при нормальных условиях (н.у.) молярный объем любого газа Vm = 22,4 л/моль.
Закон Авогадро используется в расчетах для газообразных веществ. При пересчете объема газа от нормальных условий к любым иным используется объединенный газовый закон Бойля-Мариотта и Гей-Люссака:
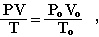
где Рo, Vo, Тo — давление, объем газа и температура при нормальных условиях (Рo = 101,3 кПа, Тo = 273К).
Если известна масса (m) или количество (n) газа и требуется вычислить его объем, или наоборот, используют уравнение Менделеева — Клапейрона:
PV = n RT,
где n = m/M — отношение массы вещества к его молярной массе, R — универсальная газовая постоянная, равная 8,31 Дж/(мольЧК).
Из закона Авогадро вытекает еще одно важное следствие: отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов. Эта постоянная величина называется относительной плотностью газа и обозначается D. Так как молярные объемы всех газов одинаковы (1-е следствие закона Авогадро), то отношение молярных масс любой пары газов также равна этой постоянной:
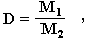
где М1 и М2 — молярные массы двух газообразных веществ.
Величина D определяется экспериментально как отношение масс одинаковых объемов исследуемого газа (М1) и эталонного газа с известной молекулярной массой (М2). По величинам D и М2 можно найти молярную массу исследуемого газа:
M1 = D ∙ M2.
Число Авогадро — физическая величина, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле вещества. Определяется как количество атомов в 12 граммах (точно) чистого изотопа углерода-12. Обозначается обычно как NA, а иногда и L.
Значение числа Авогадро, рекомендованное CODATA в 2014 году:
NA = 6,022 140 857(74)·1023 моль−1.
Закон Бойля-Мариотта:
Утверждение закона Бойля — Мариотта состоит в следующем:
При постоянных температуре и массе газа произведение давления газа на его объём постоянно.
В математической форме это утверждение записывается в виде формулы
pV=C
где p— давление газа;
V— объём газа,
а C — постоянная в оговоренных условиях величина. В общем случае значение C определяется химической природой, массой и температурой газа.
Закон Гей-Люссака:
Относительное изменение объёма данной массы газа при неизменном давлении P пропорционально изменению температуры:
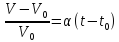
Закон Шарля:
Формулировка закона Шарля следующая:
Давление газа фиксированной массы и фиксированного объёма прямо пропорционально абсолютной температуре газа.
Проще говоря, если температура газа увеличивается, то и его давление тоже увеличивается, если при этом масса и объём газа остаются неизменными. Закон имеет особенно простой математический вид, если температура измеряется по абсолютной шкале, например, в градусах Кельвина. Математически закон записывают так:
P~T
или
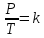
где:
P — давление газа,T — температура газа (в градусах Кельвина),
K — константа.
4. Закон Авогадро
Равные объемы всех газов при одинаковых условиях (давления и температуры) содержат одинаковое количество молекул.
Следствие:
Один моль любого газа при одинаковых условиях занимает один и тот же объем, при нормальных условиях этот объем равен 22,4 литра.

Молярная масса вещества в газообразном состоянии равна его удвоенной относительной плотности по водороду

Отношение молярной массы одного газа к молярной массе другого газа называется относительной плотностью первого ко второму.
5. Эквивалент.
а) Эквивалент – это такая формальная частица (она может быть реальной или условной) которая равноценна по химическому действию атома водорода данной реакции.
б) Эквивалент – это такая реальная или условная частица которая может присоединять, освобождать или быть каким то другим образом и эквивалентно одному атому водорода в данной реакции.
Эквивалент
элемента Х обозначаются 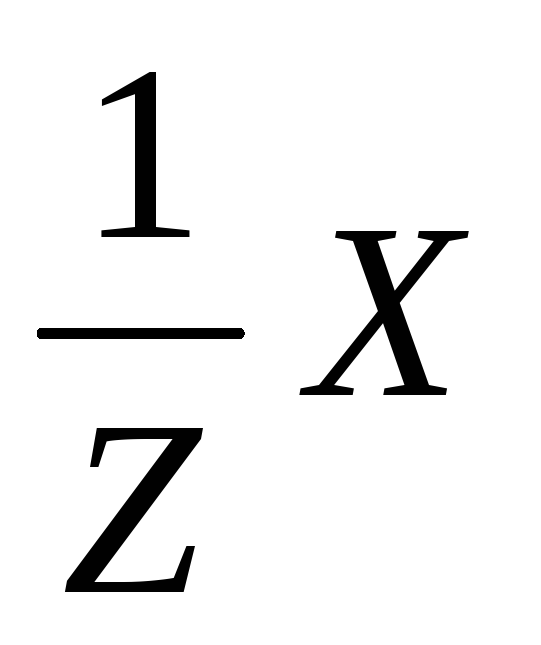 .
.
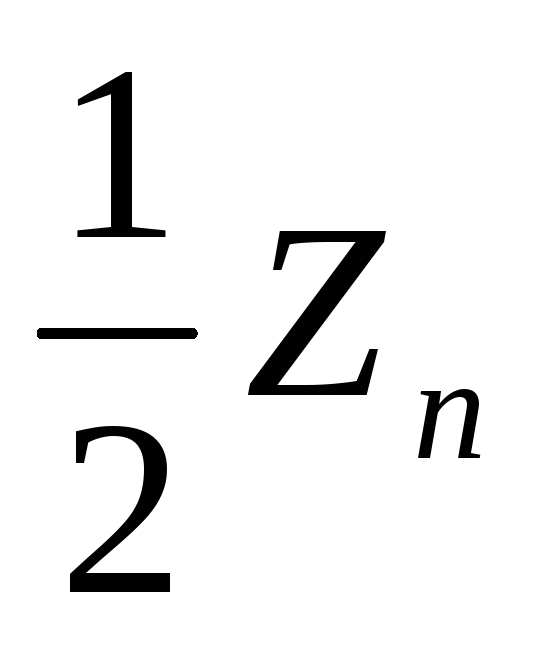
Z – валентность элемента.
В системе СИ основной единицей количества вещества является моль для эквивалента также используется моль например:
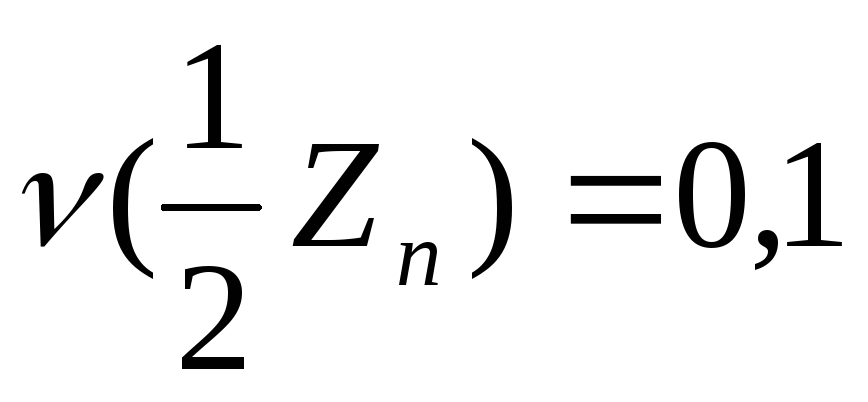 моль.
моль.
Масса моля эквивалента называется молярной массой эквивалента. Так например масса моля эквивалента Zn равна32,68 гр.Zn. Молярная масса эквивалента алюминия9гр. Выражается молярная масса эквивалента гр/моль. Молярная масса эквивалента равна атомной массе деленной на валентность этого элемента. Эквивалент кислоты равняется молярной массе кислоты и деленной на количество протонов которые принимают участие в данной реакции. Эквивалент основания равняется молярной массе основания деленной на количество гидроксо групп принимающих участие в данной реакции. Эквивалент соли равняется молярной массе деленное на произведение количества атомов металла в соли на его валентность. Закон эквивалента вещества реагирует между собой или образуются в реакциях в массовых отношениях которые пропорциональны отношению их эквивалентов.
Лекция № 2
1.Строение атома.
Атом– состоит из ядра в котором сосредоточена вся масса атома. Вокруг ядра вращаются электроны. Центробежная сила противодействует силе притяжения электронов.
Атом состоит из протонов и нейтронов. Количество протонов равно порядковому номеру элементов периодической системе, т. е. Численно равно положительному разряду ядра. Количество нейтронов равно разнице между атомной массой элемента и количеством протонов. Так, например у лития Li количество протонов равно три, а нейтронов 7-3 = 4.
Размер
атома равен  10-8 см. размер ядра 10-13 см.
10-8 см. размер ядра 10-13 см.
Порядковый номер элемента указывает число положительных зарядов ядра, а так же количество электронов вращающихся вокруг ядра.
Электроны
в атоме распределяются по энергетическим
уровням (слой или оболочка). Каждый
электрон характеризуется четырьмя
квантовыми числами n, l, m, s. Главное квантовое число n
характеризует энергию электрона, а так
же размер электронного облака. Оно может
принимать значения целых чисел от 1 до  .
Второе орбитальное квантовое числоl характеризует энергетическое состояние
электрона в подуровне и форму электронного
облака. Электроны уровня группируются
в подуровни. l принимает
значение от 0 до n-1.
Каждому значению l при одном и том же n соответствует определенный подуровень.
Число подуровня равно номеру уровня l = 0,
то s,
если l = 1,
то p, l = 2 то d, l = 3 то 1.
.
Второе орбитальное квантовое числоl характеризует энергетическое состояние
электрона в подуровне и форму электронного
облака. Электроны уровня группируются
в подуровни. l принимает
значение от 0 до n-1.
Каждому значению l при одном и том же n соответствует определенный подуровень.
Число подуровня равно номеру уровня l = 0,
то s,
если l = 1,
то p, l = 2 то d, l = 3 то 1.
Каждому значению соответствует буквенное соотношение.
Если n = 1, то l = 0 число подуровней 1, и обозначается 1s.
Если n = 2, то l = 0 и 1 число подуровней 2, и обозначается 2s 2р.
Если n = 3, то l = 0, 1, 2 число подуровней 3, и обозначается 3s 3р 3 d.
Электроны c l = 0 называются s электронами.
Электроны c l = 1 называются р электронами.
Электроны c l = 2 называются d электронами.
Электроны c l = 3 называются f электронами.
s – облако имеет форму шара (сферическое).
p – oблако имеет гантелеобразную форму.
d и f – Имеет более сложную форму.
М агнитно-квантовое
число характеризует ориентацию орбитали
в пространстве и равняется от + l до – l.
Число значений магнитно- квантовых
чисел m
= 2 l + 1 это число орбиталей равное с данным
значением l.
Энергетическое состаяние электрона
схематически изображается ячейкой
так изображается атомная орбиталь.
агнитно-квантовое
число характеризует ориентацию орбитали
в пространстве и равняется от + l до – l.
Число значений магнитно- квантовых
чисел m
= 2 l + 1 это число орбиталей равное с данным
значением l.
Энергетическое состаяние электрона
схематически изображается ячейкой
так изображается атомная орбиталь.
l | m | Кол-во ячеек | |
s | 0 | 1 | 1 |
p | 1 | +1,0,-1 | 3 |
d | 2 | +2,+1,0,-1,-2 | 5 |
f | 3 | от +3 до -3 | 7 |
Спиновое квантовое число обозначается s, характеризует собственное вращение электронов вокруг своей оси. Оно может принимать значение от +1,2 до –1,2.
Два электрона с одинаковыми значениями n, l, m но с разными значениями s, называется спаренными.
Принцип Паули – в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел. Общее количество электронов на энергетическом уровне определяется по формуле:
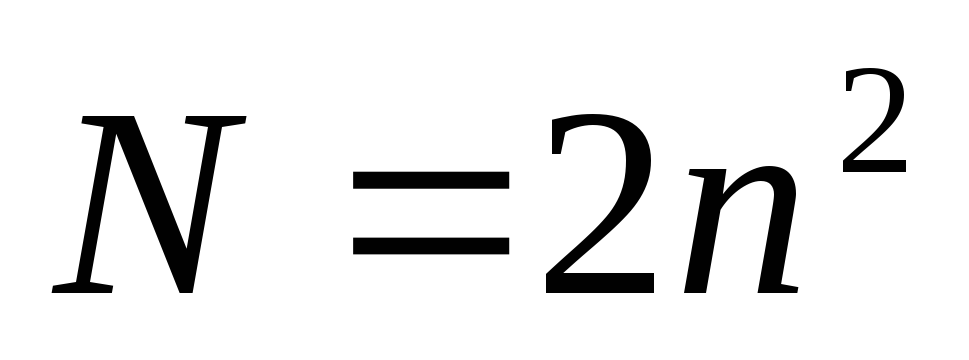
Наименьшей энергией обладают электроны первого уровня. Электроны последующих уровней обладают большим запасом энергии. Электроны внешних энергетических уровней могут отрываться и присоединятся к другим атомам на внешний энергетический уровень, при отрыве электронов от атомов образуется положительно заряженный ион. При присоединении электрона в атоме образуется отрицательно заряженный ион. Последовательность дополнения энергетических уровней описывается правилам Клечковского. Заполнение энергетических уровней атомов с увеличением порядкового номера элементов происходит последовательно с ростом суммы n + l. А при равных значениях n + l заполняется то которому соответствует большее число l.
1s – n + l = 1+ 0 = 1
2s – n + l = 2+ 0 = 2
2p – n + l = 2+ 1 =3
3s – n + l = 3+ 0 =3
3p – n + l = 3+1 =4
4s – n + l = 4+ 0 =4
3d – n + l = 3+2 =5
Порядок заполнения согласно правилу Клечковского 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d. Распределение электронов в атоме по уровням и подуровням изображаются в виде электронных формул, правило Хунда. Орбитали подуровня заполняются сначала по одному электрону, а затем по второму с противоположно направленными спинами.
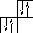
Количество нес-паренных электро-нов определяется валентностью.
n 3х валентен
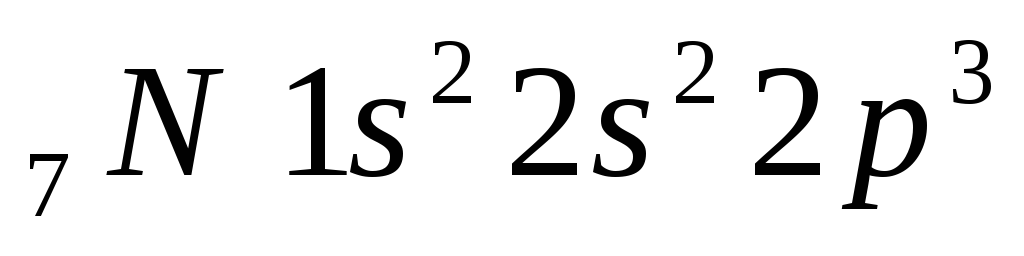



О 2х валентен
2х валентен
Два не спаренных электрона, по этому в основном сос-тоянии 2х валентен.
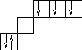
– возбужденное состояние.
4неспаренных электрона
валентность = 4
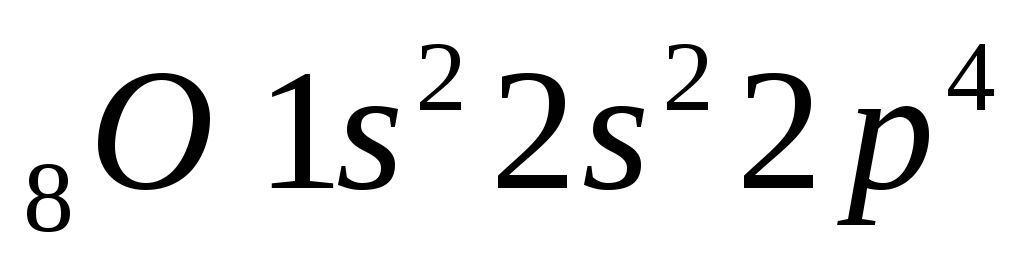



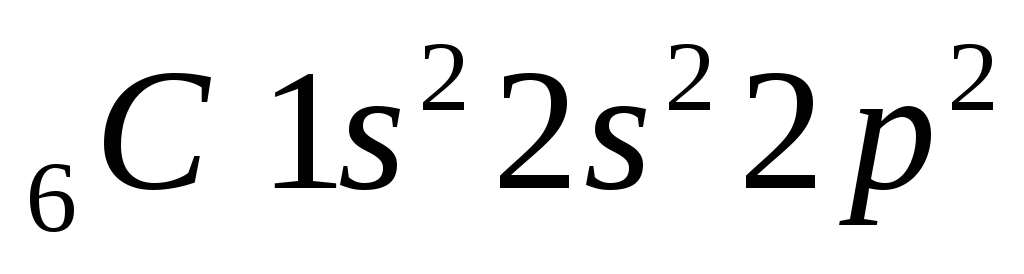


Авогадро закон Википедия
Зако́н Авога́дро — закон, согласно которому в равных объёмах различных газов, взятых при одинаковых температурах и давлениях, содержится одно и то же количество молекул. В виде гипотезы был сформулирован в 1811 году Амедео Авогадро (1776—1856), профессором физики в Турине. Гипотеза была подтверждена многочисленными экспериментальными исследованиями и поэтому стала называться законом Авогадро, став впоследствии (через 50 лет, после съезда химиков в Карлсруэ) количественной основой современной химии (стехиометрии)[1]. Закон Авогадро точно выполняется для идеального газа, а для реальных газов он является тем более точным, чем газ более разреженный.
История[ | ]
Первые количественные исследования реакций между газами принадлежат французскому ученому Гей-Люссаку. Он является автором законов о тепловом расширении газов и закона объемных отношений. Эти законы были теоретически объяснены в 1811 году итальянским физиком Амедео Авогадро[2]. Примечательным является тот факт, что при жизни открытие Авогадро осталось незамеченым из-за критики со стороны авторитетных химиков той эпохи — Йёнса Якоба Берцелиуса и Джона Дальтона, которые отрицали возможность существования двухатомных молекул простых веществ. И только в 1858 г. работа Авогадро была случайно обнаружена итальянским химиком Станислао Канниццаро и обнародована в 1860 г. на Первом международном химическом конгрессе химиков в Карлсруэ (Германия).
Следствия закона[ | ]
Первое следствие из закона Авогадро: один моль (одинаковое количество молей) любого газа при одинаковых — изобарных и изотермических — условиях занимает одинаковый объём.
Согласно закону Авогадро, одно и то же количество молекул любого газа занимает при одинаковых условиях один и тот же объём. С другой стороны, 1 моль любого вещества содержит (по определению) одинаковое количество частиц (англ.)русск. (например, молекул). Отсюда следует, что при определённых температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объём.
В частности, при нормальных условиях, то есть при 0 °C (273,15 К) и 101,325 кПа, объём 1 моля газа равен 22,413 962(13) л. Эту физическую константу называют стандартным молярным объёмом идеального газа и обозначают Vm. Найти молярный объём при других температуре и давлении можно с помощью уравнения Клапейрона:
- Vm=RTp{\displaystyle V_{\rm {m}}={\frac {RT}{p}}}, где R ≈ 8,314 Дж/(моль·К) — универсальная газовая постоянная.
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа ко второму.
Это положение имело важное значение для развития химии, так как оно дает возможность определять молекулярную массу веществ, способных переходить в газообразное или парообразное состояние (см. Атомно-молекулярное учение). Если через μ обозначить молекулярную массу вещест