Химические элементы. Символы химических элементов. Видеоурок. Химия 8 Класс
Тема: Первоначальные химические представления
Урок: Символы химических элементов
Еще в Средневековье, во времена алхимии использовались различные знаки для обозначения веществ, в основном металлов. Ведь основной целью алхимиков было получение из различных металлов золота. Поэтому каждый из них использовал свою систему обозначений.
В 19 в. появилась необходимость использования понятной для всех ученых символики. И одним из первых такую символику предложил Джон Дальтон. Но его обозначениями было неудобно пользоваться.

Рис. 1. Джон Дальтон и его система обозначения химических элементов
Современную систему химических знаков предложил в начале XIX в. шведский химик Йёнс Якоб Берцелиус. Ученый предложил обозначать химические элементы
Например, химический элемент кислород (по-латински Oxygenium) получил обозначение О.
А химический элемент водород (Hydrogenium) – Н. Если названия нескольких элементов начинались на одну и ту же букву, то в символе элемента указывали вторую или одну из последующих букв названия. Например, ртуть (Hydrargyrum) обозначается Hg.
Обратите внимание, что первая буква знака химического элемента всегда заглавная, если есть вторая буква – то она строчная. Необходимо запоминать не только названия элементов и их символы, но и произношение, т.е. как эти символы читаются.
Определенных правил произношения знаков химических элементов нет. Их надо учить наизусть. Знаки некоторых химических элементов произносятся так же, как и соответствующая буква: кислород – «о», сера – «эс», фосфор – «пэ», азот – «эн», углерод – «цэ».
Знаки других элементов произносятся так же, как и называются сами элементы: «натрий», «калий», «хлор», «фтор».
Произношение некоторых знаков соответствует их латинскому названию: кремний – «силициум», ртуть – «гидраргирум», медь – «купрум», железо – «феррум».

Рис. 2. Символы и названия некоторых химических элементов
Знак химического элемента имеет несколько значений. Во-первых, им обозначают все атомы данного элемента. Во-вторых, знаком химического элемента можно обозначить один или несколько атомов данного элемента. Например, запись O может означать: «химический элемент кислород» или «один атом кислорода».
Чтобы обозначить несколько атомов данного химического элемента, нужно перед его знаком поставить число, соответствующее количеству атомов. Например, запись 3N означает «три атома азота».
Цифра, стоящая перед знаком химического элемента, называется коэффициентом.
Список рекомендованной литературы
1. Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006.
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.19-21)
3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§8)
4. Химия: неорг. химия: учеб. для 8 кл. общеобр. учреждений / Г.Е. Рудзитис, ФюГю Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§6)
5. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов (Источник).
2. Электронная версия журнала «Химия и жизнь» (Источник).
3. Тесты по химии (онлайн) (Источник).
Домашнее задание
с.19-21 №№ 1-5 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
Применение кислорода. Видеоурок. Химия 8 Класс
Урок посвящен изучению основных областей применения кислорода. Из материалов урока вы узнаете, на каких свойствах кислорода основано его применение в металлургии, медицине, пищевой промышленности и других областях.
Тема: Вещества и их превращения
Урок: Применение кислорода
Применение любого вещества связано с его свойствами. Так и применение кислорода обусловлено, в основном, его способностями поддерживать дыхание и обеспечивать горение.
Рассмотрим основные области применения кислорода.
В МЕТАЛЛУРГИИ, ДЛЯ РЕЗКИ И СВАРКИ МЕТАЛЛОВ
Кислород используют в металлургии при производстве стали. Также, во многих металлургических агрегатах для более эффективного сжигания топлива вместо воздуха в горелках используют кислородо-воздушную смесь, т.е. обогащают воздух кислородом.

Рис. 1. Производство стали
Кислород в баллонах широко используется для газопламенной резки и сварки металлов. Горючий газ ацетилен, сгорая в токе кислорода, позволяет получить температуру выше 3000°С! Это приблизительно вдвое больше температуры плавления железа.
Кислород, входящий в состав воздуха, применяют для сжигания топлива: например, в двигателях автомобилей, тепловозов и теплоходов.
В качестве окислителя для ракетного топлива применяется жидкий кислород. Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива.
В медицине кислород тоже нашел свое применение. Кислород используется для обогащения дыхательных газовых смесей при нарушении дыхания, для лечения астмы, профилактики гипоксии в виде кислородных коктейлей, кислородных подушек. Однако чистым кислородом при нормальном давлении долго дышать нельзя – это опасно для здоровья.
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E948, как пропеллент и упаковочный газ. Пропелленты — газы, выдавливающие пищевые продукты из ёмкости (контейнера, баллончика со спреем, танка или хранилища для сыпучих продуктов).
Кислород выполняет бесценную биологическую роль.
Кислород необходим практически всем живым существам для дыхания. Дыхание – это окислительно-восстановительный процесс, где кислород является окислителем. С помощью дыхания живые существа вырабатывают энергию, необходимую для поддержания жизни.

Рис. 2. Основные области применения кислорода
Список рекомендованной литературы
1. Сборник задач и упражнений по химии: 8-й кл.: к учеб. П.А. Оржековского и др. «Химия. 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с.70-84)
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с. 70-72)
3. Химия. 8 класс. Учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.:Астрель, 2013. (§22)
4. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005. (§28)
5. Рудзитис Г.Е., Фельдман Ф.Г. Химия: неорг. химия: учеб. для 8 кл. общеобразоват. учреждений. М.: Просвещение. 2018. § 22-25.
6. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Тесты по химии (онлайн) (Источник).
2. Единая коллекция цифровых образовательных ресурсов: (Источник).
3. Получение и применение кислорода (Источник).
4. Применение кислорода (Источник).
Домашнее задание:
1) с. 70-72 №№ 1,2,4 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
2) с.128 №№ 5,8
Схемы, рисунки и таблицы по химии — Схемо.РФ
- Войти
- Регистрация
- Схемы
- Биология
- География
- История
- Математика и алгебра
- Медицина
- Обществознание
- Педагогика
- Политология
- Право
- Психология
- Русский язык
- Социология
- Физика
- Философия
- Химия
- Экономика
- Прочее
Образование ионной связи — урок. Химия, 8–9 класс.
Представим, что встретились два атома: атом щелочного металла и атом галогена. У атома металла на внешнем энергетическом уровне — единственный электрон, а атому неметалла как раз не хватает одного электрона, чтобы завершить свой внешний уровень.
Атом металла легко отдаст свой слабо связанный с ядром валентный электрон атому неметалла, который предоставит ему свободное место на внешнем энергетическом уровне. Оба в результате получат заполненные внешние уровни.
Атом металла при этом приобретёт положительный заряд, а атом галогена превратится в отрицательно заряженную частицу. Такие частицы называются ионами.
Ионы — заряженные частицы, в которые превращаются атомы в результате отдачи или принятия электронов.
Образовавшиеся разноимённо заряженные ионы притягиваются друг к другу, и возникает химическая связь, которая называется ионной.
Ионная связь — связь между положительно и отрицательно заряженными ионами.
Рассмотрим механизм образования ионной связи на примере взаимодействия натрия и хлора.
Na0+Cl0→Na++Cl−→Na+Cl−
Такое превращение атомов в ионы происходит всегда при взаимодействии атомов типичных металлов и типичных неметаллов, электроотрицательности которых резко различаются.
Ионная связь образуется в сложных веществах, состоящих из атомов металлов и неметаллов.
Рассмотрим другие примеры образования ионной связи.Пример:
Взаимодействие кальция и фтора
1. Кальций — элемент главной подгруппы второй группы. Ему легче отдать два внешних электрона, чем принять недостающие.

2. Фтор — элемент главной подгруппы седьмой группы. Ему легче принять один электрон, чем отдать семь.

3. Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно \(2\). Определим число атомов фтора, которые примут два электрона от атома кальция: \(2\) \(:\) \(1\) \(=\) \(2\).
4. Составим схему образования ионной связи:
Ca0+2F0→Ca2+F2−.
Пример:
Взаимодействие натрия и кислорода
1. Натрий — элемент главной подгруппы первой группы. Он легко отдаёт один внешний электрон.

2. Кислород — элемент главной подгруппы шестой группы. Ему легче принять два электрона, чем отдать шесть.

3. Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно \(2\) \(:\) \(1\) \(=\) \(2\). Определим число атомов натрия, которые отдадут два электрона атому кислорода: \(2\).
4. Составим схему образования ионной связи:
2Na0+O0→Na2+O2−.
С помощью ионной связи образуются также соединения, в которых имеются сложные ионы:
Nh5+,NO3−,OH−,SO42−,PO43−,CO32−.
Значит, ионная связь существует также в солях и основаниях.
Обрати внимание!
Соли аммония Nh5NO3,Nh5Cl,Nh5SO42 не содержат металла, но образованы ионной связью.
Ионы создают вокруг себя электрическое поле, действующее во всех направлениях. Поэтому каждый ион окружён ионами противоположного знака. Такое соединение представляет собой огромную группу положительных и отрицательных частиц, расположенных в определённом порядке.

Притяжение между ионами довольно сильное, поэтому ионные вещества имеют высокие температуры кипения и плавления.
Обрати внимание!
Все ионные соединения при обычных условиях — твёрдые вещества.
Примеры веществ с ионной связью:

Питьевая сода

Железный купорос

Поваренная соль
Источники:
Габриелян О. С. Химия. 8 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2013. — 63 с.
Предмет химии. Вещества — ГДЗ Габриелян Сладков 8 класс рабочая тетрадь
Часть 1
1. Химия изучает:
— вещества
— их строения
— их свойства
2. Вещество это —
то, из чего состоят физические тела.
3. Признаки, по которым одни вещества отличаются от других,
— это свойства, например: агрегатное состояние, цвет, запах, плотность и т.д.
4. Существует взаимосвязь: свойство вещества — применение вещества.
Например, для стекла:
1) Прозрачное — оконные стекла
2) изготовление хрусталя
3) витражное стекло
5. Вещества состоят из молекул, которые, в свою очередь, образованы из атомов. Определенный вид атомов называют химическим элементом. Всего известно 120 химический элементов.
6. Химический элемент существует в трех формах.
Часть 2
1. Установите соответсвие между понятием и примером.
2. Вычеркните лишнее:
колба, приборка, химический стакан, мензурка, ступка, мерный цилиндр, кристаллизатор.
Укажите признак, общий для оставшихся объектов.
Химическая посуда из стекла
3. Составьте задание, аналогичное предыдущему.
Вычеркните лишнее — приборка, мерная колба, цилиндр, штатив.
4. Заполните таблицу «Физические свойства вещества». В качестве примеров опишите вещества, используемые на кухне.
5. Укажите прилагательные, которые характеризуют свойства воды.
1) жидкая
2) пластичная
3) бесцветная
4) прозрачная
5) ароматная
6) электропроводная
Ответ: 1, 3, 4
6. Заполните таблицу «Сравнение физических свойств газообразных веществ».
7. Заполните таблицу «Сравнение физических свойств меди и железа».
8. Составьте кроссворд о свойствах и применении какого-либо вещества (по своему выбору).
9. На примере химического элемента водорода укажите правильную последовательность (1-2-3) перечисленных понятий от единичного к общему. Конкретизируте ее, используя слова и рисунки моделей частиц.
3) Вещество — это то, из чего состоят физические тела.
1) Атом — это химически неделимая частица.
2) Молекула — это наименьшая частица вещества.
10. Выражения, являющиеся синонимами понятия «химический элемент».
1) вид одинаковых атомов
2) вид одинаковых молекул
3) вид атомов, имеющих одинаковые свойства
4) простые вещества
5) названия видов атомов
Ответ: 1, 3
11. Установите соответствие между формой существования химического элемента и рисунками моделей частиц.
12. Проанализируйте рисунки и впишите пропущенные слова.
На рисунках изображено две молекулы сложных веществ, образованных из двух химических элементов.
13. Отметьте фразы, в которых говорится о сере как о химическом элементе. Из букв, соответствующих правильным ответам, вы составите название химического элемента, соединения которого используют для обеззараживания воды: хлор.
В тех фразах, которые вы не выбрали, речь идет о сере как о простом вещества.
Онлайн урок: Кислород по предмету Химия 8 класс
Кислород – самый распространенный на Земле химический элемент:
земная кора содержит 47% кислорода
мировой океан состоит из кислорода на 85%
Кроме этого, кислород – основной участник обмена веществ в живых организмах – дыхания и фотосинтеза.
В таблице приведены основные сведения о кислороде.
Химический элемент | Простое вещество |
Название «Oxygenium» произошло от двух слов, в переводе «рождающий кислоты» Химический знак – О Атомный номер – 8 Расположение в периодической системе – 2 период, VI группа Типичный неметалл (сильный окислитель) Атомная масса – 16 а. е. м. Валентность – 2 Степени окисления – –2; 0; +1; +2
| Химическая формула – O2 Молекулярная масса – 32 а. е. м. Бесцветный газ без запаха; светло-голубая жидкость; синие кристаллы Температура кипения – –183 °С Температура плавления – –218 °С |
В жидком состоянии кислород имеет голубой цвет, поэтому на всех формулах мы его будем обозначать голубым!
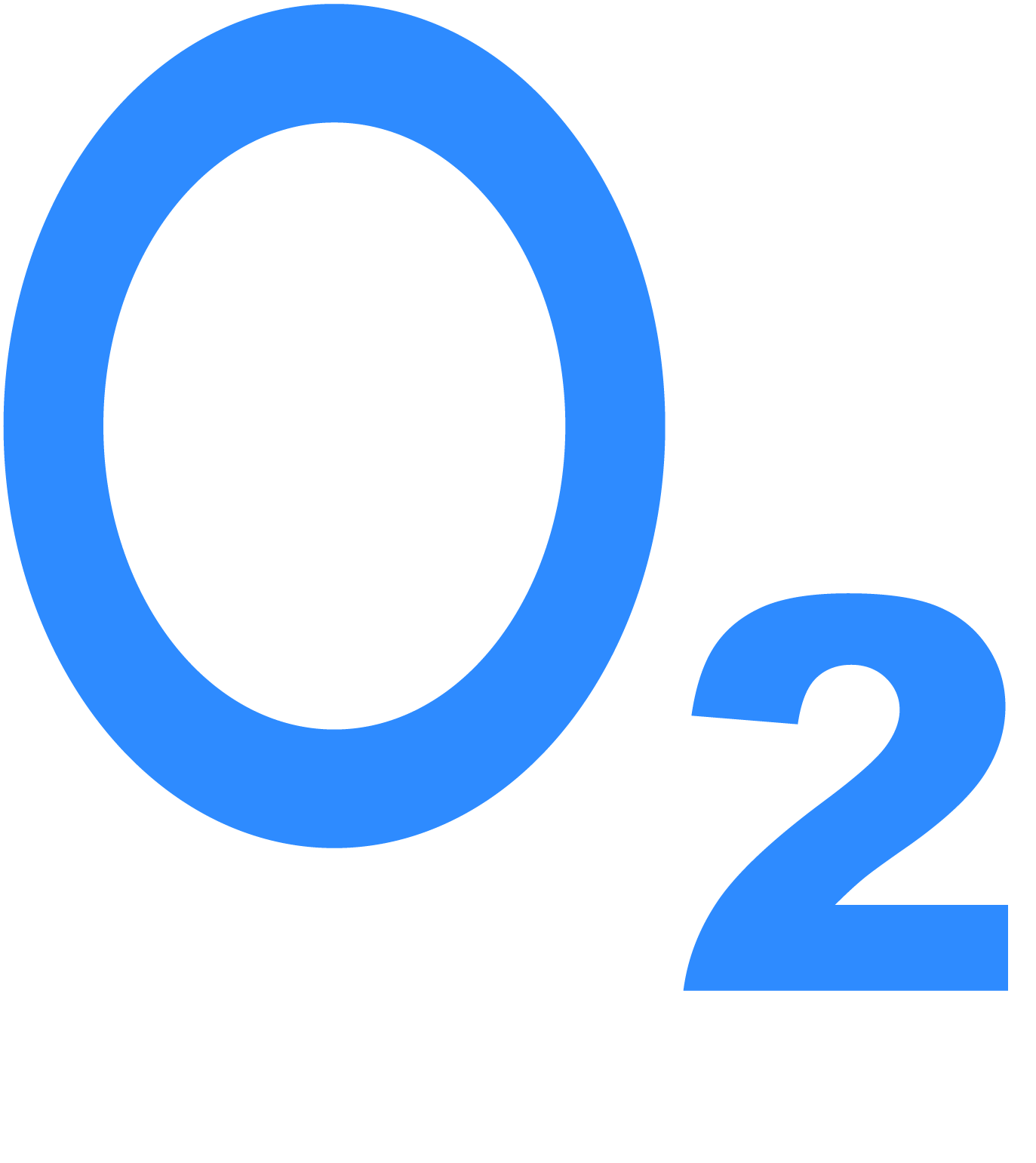
Изучением кислорода занимались несколько учёных примерно в одно и то же время.
Официально первооткрывателем кислорода считается англичанин Джозеф Пристли (1774 год).
Однако установлен факт, что в свое время Леонардо да Винчи изучал химию кислорода, не подозревая тогда, что он является элементом.
Название «кислород» в русский язык ввёл Михаил Ломоносов, который также ввёл в употребление термин «кислота», который в те времена обозначал оксид – соединение элемента с кислородом.
Поэтому истинное значение названия «кислород» переводится как «рождающий оксиды». Некоторое время в России кислород называли «кислотвор».
Химический элемент кислород образует два простых вещества: кислород (O2) и озон (O3).
Lorem ipsum dolor sit amet, consectetur adipisicing elit. Adipisci autem beatae consectetur corporis dolores ea, eius, esse id illo inventore iste mollitia nemo nesciunt nisi obcaecati optio similique tempore voluptate!
Adipisci alias assumenda consequatur cupiditate, ex id minima quam rem sint vitae? Animi dolores earum enim fugit magni nihil odit provident quaerat. Aliquid aspernatur eos esse magnam maiores necessitatibus, nulla?
Эта информация доступна зарегистрированным пользователям
Кислород активно участвует в обмене веществ, именно ему обязана наша планета возникновением на ней жизни.
Атмосфера содержит 21 % кислорода.
Считается, что несколько сотен миллионов лет назад концентрация кислорода в атмосфере была почти в 2 раза выше – около 40%.
Количество кислорода в воздухе ниже 8% является угрозой для жизни человека.
В отличие от кислорода, озон даже в газообразном состоянии имеет голубой цвет, в жидком – насыщенный фиолетовый, в твёрдом – почти чёрный.
Lorem ipsum dolor sit amet, consectetur adipisicing elit. Adipisci autem beatae consectetur corporis dolores ea, eius, esse id illo inventore iste mollitia nemo nesciunt nisi obcaecati optio similique tempore voluptate!
Adipisci alias assumenda consequatur cupiditate, ex id minima quam rem sint vitae? Animi dolores earum enim fugit magni nihil odit provident quaerat. Aliquid aspernatur eos esse magnam maiores necessitatibus, nulla?
Эта информация доступна зарегистрированным пользователям
Озон (O3) образуется из кислорода при воздействии ионизирующих излучений: радиации или жестких ультрафиолетовых лучей (это свойство кислорода было открыто в 1899 году учеными Пьером и Марией Кюри).
Он образуется в атмосфере под воздействием разрядов молнии, а также при работе бытовой техники, например, лазерных принтеров.
При этом вы можете чувствовать характерный запах – это и есть запах озона.
Слово «озон» с греческого языка так и переводится: «пахну».
Озон также способен в некоторой степени задерживать ультрафиолетовые лучи. Это его свойство является одним из факторов существования жизни на Земле.
Кислород и озон являются парамагнетиками – это значит, что они притягиваются к магниту.
Это заметно при проведении опытов с жидкими кислородом и озоном.
Lorem ipsum dolor sit amet, consectetur adipisicing elit. Adipisci autem beatae consectetur corporis dolores ea, eius, esse id illo inventore iste mollitia nemo nesciunt nisi obcaecati optio similique tempore voluptate!
Adipisci alias assumenda consequatur cupiditate, ex id minima quam rem sint vitae? Animi dolores earum enim fugit magni nihil odit provident quaerat. Aliquid aspernatur eos esse magnam maiores necessitatibus, nulla?
Эта информация доступна зарегистрированным пользователям