Группы химических элементов — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 15 мая 2015; проверки требуют 7 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 15 мая 2015; проверки требуют 7 правок.Группа химических элементов — термин, используемый ИЮПАК для описания номенклатурной классификации химических элементов[1].
- Щелочные металлы — металлы первой группы: Li, Na, K, Rb, Cs, Fr.
- Щелочноземельные металлы — металлы второй группы: Be, Mg, Ca, Sr, Ba, Ra.
- Пниктогены (пниктиды[2]) — элементы пятой группы: N, P, As, Sb, Bi.
- Халькогены — элементы шестой группы: O, S, Se, Te, Po.
- Галогены (галоиды[2]) — элементы седьмой группы: F, Cl, Br, I, At.
- Инертные газы (благородные газы) — элементы восьмой группы: He, Ne, Ar, Kr, Xe, Rn.
- Лантаноиды (лантаниды[2]) — элементы 57—71: La, Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu.
- Актиноиды (актиниды[2]) — элементы 89—103: Ac, Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr.
- Редкоземельные элементы — Sc, Y и лантаноиды.
- Переходные металлы — элементы побочных подгрупп.
Многие другие названия для групп элементов не утверждены ИЮПАК, но употребляются в различных областях науки. Например:
- Платиновая группа — Ru, Rh, Pd, Os, Ir, Pt.
- Благородные металлы — термин, который в основном используется для описания элементов, не подвергающихся коррозии — Au, Ag и металлы платиновой группы.
- Тяжёлые металлы — термин, использующийся для описания элементов с высокими значениями атомного веса (и/или плотности).
- Природные металлы — металлы, находящиеся в природе; не являются искусственно полученными.
- Постпереходные металлы — металлы, у которых наблюдается полное заполнение d-подоболочки: Zn, Ga, Cd, In, Sn, Hg, Tl, Pb, Bi.
- Лёгкие металлы — термин, иногда использующийся для описания некоторых металлов p-блока: алюминий, галлий, индий, олово, таллий, свинец и висмут (иногда в эту группу включают также германий, сурьму и полоний).
- Трансурановые элементы, трансураны — элементы, следующие за ураном (атомный номер больше 92).
- Трансплутониевые элементы — элементы, следующие за плутонием (атомный номер больше 94).
- Трансфермиевые элементы — элементы, следующие за фермием (атомный номер больше 100).
- Трансактиноидные элементы, трансактиноиды — элементы (они же сверхтяжёлые), следующие за актиноидами (атомный номер больше 103).
- Суперактиноиды — гипотетически возможная группа элементов, с атомными номерами 121—153 (которые входят в g-блок).
- Тяжёлый атом — термин, используемый в компьютерной химии для описания всех элементов, кроме водорода и гелия.
Геохимические группы элементов[править | править код]
Классификация Гольдшмидта[править | править код]
- Атмофильные элементы — склонные к накоплению в атмосфере Земли, включают в себя кислород, водород, азот и инертные газы.
- Халькофильные элементы — элементы сульфидных руд. К ним относятся S, Cu, Zn, Ga, Ge, As, Se, Ag, Cd, In, Sn, Sb, Te, Au, Hg, Tl, Pb, Bi, Po.
- Литофильные элементы — обладающие сродством к силикатным минералам и расплавам. К ним относятся Al, At, B, Ba, Be, Br, Ca, Cl, Cr, Cs, F, I, Hf, K, Li, Mg, Na, Nb, O, P, Rb, Sc, Si, Sr, Ta, Th, Ti, U, V, Y, Zr, W, лантаноиды.
- Сидерофильные элементы обладают сродством к железу. К ним относятся Au, Co, Fe, Ir, Mn, Mo, Ni, Os, Pd, Pt, Re, Rh, Ru.
Другие классификации[править | править код]
- Петрогенные элементы — основные элементы, составляющие породы и минералы: O, Si, Ti, Al, Mg, Fe, Ca, K, Mn, P, Na, K
- Редкие/редкоземельные и рассеянные элементы — все остальные элементы
Биохимические группы элементов[править | править код]
- Биологически значимые элементы
- Макроэлементы — суточное поступление в организм человека более 200 мг
- Микроэлементы — бор, фтор, кремний, ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, мышьяк, селен, молибден, иод
- Биологически инертные элементы
Подгруппа — Википедия
Материал из Википедии — свободной энциклопедии
Подгруппа ― подмножество H{\displaystyle H} группы G{\displaystyle G}, само являющееся группой относительно операции, определяющей G{\displaystyle G}.
Подмножество H{\displaystyle H} группы G{\displaystyle G} является её подгруппой тогда и только тогда, когда:
- H{\displaystyle H} содержит единичный элемент из G{\displaystyle G}
- содержит произведение любых двух элементов из H{\displaystyle H},
- содержит вместе со всяким своим элементом h{\displaystyle h} обратный к нему элемент h−1{\displaystyle h^{-1}}.
В случае конечных и, вообще, периодических групп третье условие является следствием первых двух.
- Подмножество группы G{\displaystyle G}, состоящее из одного элемента 1{\displaystyle 1}, будет, очевидно, подгруппой, и эта подгруппа называется единичной подгруппой группы G{\displaystyle G}.
- Сама G{\displaystyle G} также является своей подгруппой.
- Всякая подгруппа, отличная от всей группы, называется истинной подгруппой этой группы. Истинная подгруппа некоторой бесконечной группы может быть изоморфна самой группе.
- Сама группа G{\displaystyle G} и единичная подгруппа называется несобственными подгруппами группы G{\displaystyle G}, все остальные ― собственными.
- Пересечение всех подгрупп группы G{\displaystyle G}, содержащих все элементы некоторого непустого множества M{\displaystyle M}, называется подгруппой, порождённой множеством M{\displaystyle M}, и обозначается ⟨M⟩{\displaystyle \langle M\rangle }.
- Если M{\displaystyle M} состоит из одного элемента a{\displaystyle a}, то ⟨a⟩{\displaystyle \langle a\rangle } называется циклической подгруппой элемента a{\displaystyle a}.
- Группа, совпадающая с одной из своих циклических подгрупп, называется циклической группой.
- Если группа G1{\displaystyle G_{1}} изоморфна некоторой подгруппе H{\displaystyle H} группы G{\displaystyle G}, то говорят, что группа G1{\displaystyle G_{1}} может быть вложена в группу G{\displaystyle G}.
- Если H{\displaystyle H} — подгруппа группы G{\displaystyle G}, то для любого a∈G{\displaystyle a\in G} подмножество
- aHa−1={aha−1∣h∈H}{\displaystyle aHa^{-1}=\{\,aha^{-1}\mid h\in H\,\}}
- является подгруппой. При этом подгруппы aHa−1{\displaystyle aHa^{-1}} и H{\displaystyle H} называются сопряжёнными.
Для подгруппы H{\displaystyle H} и некоторого элемента a∈G{\displaystyle a\in G}, определяется левый смежный класс aH={ax:x∈H}{\displaystyle aH=\{ax:x\in H\}}. Количество левых смежных классов подгруппы H{\displaystyle H} называется индексом подгруппы H{\displaystyle H} в G{\displaystyle G} и обозначается [G:H]{\displaystyle [G:H]}. Аналогично можно определить правые классы смежности Ha={xa:x∈H}{\displaystyle Ha=\{xa:x\in H\}}.
Если левые и правые классы смежности подгруппы совпадают, то она называется нормальной. Это свойство даёт возможность построить факторгруппу G/H{\displaystyle G/H} группы G{\displaystyle G} по нормальной подгруппе H{\displaystyle H}.
Подгруппа углерода — Википедия
Материал из Википедии — свободной энциклопедии
| Группа → | 14 | ||||||
|---|---|---|---|---|---|---|---|
| ↓ Период | |||||||
| 2 | |||||||
| 3 | |||||||
| 4 |
| ||||||
| 5 | |||||||
| 6 |
| ||||||
| 7 |
| ||||||
Подгру́ппа углеро́да — химические элементы 14-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы IV группы)[1]. В группу входят углерод С, кремний Si, германий Ge, олово Sn, свинец Pb[2] и недавно открытый искусственный радиоактивный элемент флеровий Fl.
| Свойства | C | Si | Ge | Sn | Pb |
|---|---|---|---|---|---|
| Зарядовое число | 6 | 14 | 32 | 50 | 82 |
| Валентные электроны | 2s22p2 | 3s23p2 | 4s24p2 | 5s25p2 | 6s26p2 |
| Энергия ионизации атома R → R3+, эB | 11,3 | 8,2 | 7,9 | 7,3 | 7,4 |
| Относительная электроотрицательность | 2,50 | 1,74 | 2,02 | 1,72 | 1,55 |
| Степень окисления в соединениях | +4, +2, −4 | +4, +2, −4 | +4, −4 | +4, +2, −4 | +4, +2, −4 |
| Радиус атома, нм | 0,077 | 0,134 | 0,139 | 0,158 | 0,175 |
Углерод[править | править код]
| C | 6 |
| 12,011 | |
| [He]2s22p2 | |
| Углерод | |
Углерод — неметалл. Основные кристаллические модификации углерода — алмаз и графит[4].
Кремний[править | править код]
| Si | 14 |
| 28,0855 | |
| [Ne]3s23p2 | |
| Кремний | |
Кремний — неметалл темно-серого цвета. Составляет 27,6 % массы земной коры[5].
Германий[править | править код]
| Ge | 32 |
| 72,61 | |
| 4s24p2 | |
| Германий | |
Германий — металл серебристо-серого цвета. Плотность германия в твёрдом состоянии равна 5,327 г/см3, в жидком —5,557 г/см3.
Олово[править | править код]
| Sn | 50 |
| 118,71 | |
| [Kr]4d105s25p2 | |
| Олово | |
Олово — ковкий, лёгкий металл серебристо-белого цвета.
Свинец[править | править код]
| Pb | 82 |
| 207,2 | |
| [Xe]4f145d106s26p2 | |
| Свинец | |
Свинец — ковкий металл серого цвета. Элемент довольно мягок, можно без затруднения порезать ножом.
Флеровий[править | править код]
| Fl | 114 |
| (289) | |
| [Rn]5f146d107s27p2 | |
| Флеровий | |
Флеровий — искусственный сверхтяжёлый радиоактивный элемент. Из известных изотопов наиболее устойчив 289Fl. Период полураспада составляет около 2,7 секунд для 289Fl и 0,8 секунды для 288Fl.
Функциональная группа — Википедия
Материал из Википедии — свободной энциклопедииТекущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 6 мая 2019; проверки требует 1 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 6 мая 2019; проверки требует 1 правка.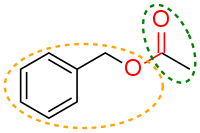 Бензил ацетат имеет эфирную функциональную группу (показано красным), ацетильную группу (зелёная) и бензильную группу (оранжевая).
Бензил ацетат имеет эфирную функциональную группу (показано красным), ацетильную группу (зелёная) и бензильную группу (оранжевая).Функциональная группа — структурный фрагмент органической молекулы (некоторая группа атомов), определяющий её химические свойства. Старшая функциональная группа соединения является критерием его отнесения к тому или иному классу органических соединений[1].
Функциональные группы, входящие в состав различных молекул, обычно ведут себя одинаково в одной и той же химической реакции, хотя их химическая активность может быть различной.
Некоторые авторы не относят к функциональным группам такие структурные единицы как ароматические системы, сопряжённые связи и прочее. Однако согласно определению, приведенному выше, которое используется большинством авторов химической литературы, такие группы также можно причислять к функциональным группам, так как они в большой мере определяют химические свойства веществ.
В литературе можно встретить похожее понятие радикал или углеводородный радикал (не путать с понятием свободный радикал), чаще всего используемый для обозначения углеводородных заместителей в органической молекуле. Однако многие ученые не акцентируют внимание на различиях понятий углеводородный радикал и функциональная группа и используют оба понятия параллельно. Хотя это и достаточно близкие понятия, путать их не следует.
Особое внимание надо обратить на использование этих терминов в контексте ароматических фрагментов молекул. В таких случаях, если речь идёт о химической реакции с учётом ароматического фрагмента, то его следует называть функциональной группой, а если о фрагменте молекулы, который проявляет некий мезомерный или индуктивный эффект в молекуле, то его следует называть углеводородным радикалом.
Известно более 100 функциональных групп.
- Функциональные группы, содержащие атом кислорода:
- Функциональные группы, содержащие атом азота:
- Функциональные группы, содержащие атом серы:
- тиольная (сульфгидрильная, меркапто-) –SH
- сульфидная >S
- дисульфидная –S–S–
- сульфоксидная >S=O,
- сульфонная >SO2 и др.
- Функциональные группы, содержащие ненасыщенные углерод-углеродные связи:
- Функциональные группы, содержащие прочие атомы:
Молекулы, в состав которых входит больше чем одна функциональныая группа называются полифункциональными.
При построении названия органического соединения, согласно номенклатуре ИЮПАК, отталкиваются от наличия в данном соединении функциональных групп.
Углеводородные группы[править | править код]
Известно множество других функциональных групп из этой категории, носящих специфические названия, например: изопропил, трет-бутил и т.д.
Галогеновые группы[править | править код]
Функциональные группы, содержащие кислород[править | править код]
Эфирная группа (R1-O-R2) — простые эфиры (ethers) — два углеводородных радикала, соединенные через атом кислорода
Карбонильная группа (R1-C(O)-R2)
Альдегидная группа (H-C(O)-R1)
Карбоксильная группа (R1-С(O)-OH)
Сложноэфирная группа (R1-C(O)-O-R2) — сложные эфиры (esters) — продукты реакции этерификации между карбоновой кислотой и спиртом
Функциональные группы, содержащие азот[править | править код]
Аминогруппа (Nh3-R1)
Нитрогруппа (R1-NO2)
Нитрозогруппа (R1-N(O))
Функциональные группы, содержащие серу[править | править код]
Сульфогруппа (R1-SO3H)
Сульфиногруппа (R1-SO2H)
Гидроксисульфанил (R1-SOH)
Функциональные группы, содержащие фосфор[править | править код]
- ↑ Химическая энциклопедия
Группа (математика) — Википедия
У этого термина существуют и другие значения, см. Группа.Гру́ппа в математике — множество, на котором определена ассоциативная бинарная операция, причём для этой операции имеется нейтральный элемент (аналог единицы для умножения), и каждый элемент множества имеет обратный. Ветвь общей алгебры, занимающаяся группами, называется теорией групп[1].
Один из примеров группы — множество целых чисел, снабжённое операцией сложения: сумма любых двух целых чисел также даёт целое число, роль нейтрального элемента играет ноль, а число с противоположным знаком является обратным элементом. Другие примеры — множество вещественных чисел с операцией сложения, множество вращений плоскости вокруг начала координат. Благодаря абстрактному определению группы через систему аксиом, не привязанной к специфике образующих множеств, в теории групп создан универсальный аппарат для изучения широкого класса математических объектов самого разнообразного происхождения с точки зрения общих свойств их структуры. Вездесущность групп в математике и за её пределами делает их важнейшей конструкцией в современной математике и её приложениях.
Группа фундаментально родственна понятию симметрии и является важным инструментом в изучении всех её проявлений. Например, группа симметрии отражает свойства геометрического объекта: она состоит из множества преобразований, оставляющих объект неизменным, и операции комбинирования двух таких преобразований, следующих друг за другом. Такие группы симметрии, как точечные группы симметрии, помогают понять явление молекулярной симметрии в химии; группа Пуанкаре характеризует симметрию физического пространства-времени, а специальные унитарные группы применяются в стандартной модели физики элементарных частиц[2].
Понятие группы ввёл Эварист Галуа, изучая многочлены в 1830-е годы[3].
Современная теория групп является активным разделом математики[4]. Один из наиболее впечатляющих результатов достигнут в классификации простых конечных групп, которая была завершена в 1981 году: доказательство теоремы составляет десятки тысяч страниц сотен научных статей более ста авторов, опубликованных с 1955 года, но статьи продолжают появляться из-за обнаруживаемых пробелов в доказательстве[5]. С середины 1980-х годов значительное развитие получила геометрическая теория групп, изучающая конечно-порождённые группы как геометрические объекты.
Непустое множество G с заданной на нём бинарной операцией ∗{\displaystyle {*}}: G×G→G{\displaystyle \mathrm {G} \times \mathrm {G} \rightarrow \mathrm {G} } называется группой (G,∗){\displaystyle (\mathrm {G} ,*)}, если выполнены следующие аксиомы:
- ассоциативность: ∀(a,b,c∈G):(a∗b)∗c=a∗(b∗c){\displaystyle \forall (a,b,c\in G)\colon (a*b)*c=a*(b*c)};
- наличие нейтрального элемента: ∃e∈G∀a∈G:(e∗a=a∗e=a){\displaystyle \exists e\in G\quad \forall a\in G\colon (e*a=a*e=a)};
- наличие обратного элемента: ∀a∈G∃a−1∈G:(a∗a−1=a−1∗a=e){\displaystyle \forall a\in G\quad \exists a^{-1}\in G\colon (a*a^{-1}=a^{-1}*a=e)}.
Последние две аксиомы можно заменить одной аксиомой существования операции обратной ∗{\displaystyle *}:
∀(a,b∈G)∃(x,y∈G):(a∗x=b)∧(y∗a=b){\displaystyle \forall (a,b\in G)\quad \exists (x,y\in G)\colon (a*x=b)\land (y*a=b)}.
При этом вышеприведённые аксиомы не являются строго минимальными. Для существования нейтрального и обратного элементов достаточно наличия левого нейтрального элемента и левого обратного элемента. При этом можно доказать, что они автоматически будут обычным нейтральным и обратным элементами[6].
Связанные определения[править | править код]
- В общем случае от группы не требуется выполнения свойства коммутативности.
- Пары элементов a,b{\displaystyle a,\;b}, для которых выполнено равенство a∗b=b∗a{\displaystyle a*b=b*a}, называются перестановочными или коммутирующими.
- Множество элементов, перестановочных со всеми элементами группы, называется центром группы.
- Группа, в которой любые два элемента коммутируют, называется коммутативной или абелевой.
- Подгруппа — подмножество H{\displaystyle H} группы G{\displaystyle G}, которое является группой относительно операции, определённой в G{\displaystyle G}.
- Порядок группы (G,∗){\displaystyle (G,*)} — мощность G{\displaystyle G} (то есть число её элементов).
- Если множество G{\displaystyle G} конечно, то группа называется конечной.
- Гомоморфизмы групп — это отображения групп, которые сохраняют групповую структуру. То есть отображение групп f:(G,∗)→(H,×){\displaystyle f\colon (G,*)\to (H,\times )} называется гомоморфизмом, если удовлетворяет условию f(a∗b)=f(a)×f(b){\displaystyle f(a*b)=f(a)\times f(b)}.
- Две группы называются изоморфными, если существуют гомоморфизм групп f:(G,∗)→(H,×){\displaystyle f\colon (G,*)\to (H,\times )} и гомоморфизм групп g:(H,×)→(G,∗){\displaystyle g\colon (H,\times )\to (G,*)}, такие что f(g(a))=a{\displaystyle f(g(a))=a} и g(f(b))=b{\displaystyle g(f(b))=b}, где b∈G{\displaystyle b\in G} и a∈H{\displaystyle a\in H}. В этом случае эти гомоморфизмы называются изоморфизмами.
- Для элемента g∈G{\displaystyle g\in G} левый смежный класс по подгруппе H{\displaystyle H} — множество gH={gh∣h∈H}{\displaystyle gH=\{gh\mid h\in H\}}, правый смежный класс по подгруппе H{\displaystyle H} — множество Hg={hg∣h∈H}{\displaystyle Hg=\{hg\mid h\in H\}}.
- Нормальная подгруппа — подгруппа особого типа, левый и правый смежные классы по которой совпадают. Для любого g∈G{\displaystyle g\in G}, gH=Hg{\displaystyle gH=Hg}.
- Факторгруппа — множество смежных классов группы по её нормальной подгруппе, само являющееся группой.
Мультипликативная запись[править | править код]
Обычно групповую операцию называют (абстрактным) умножением; тогда применяется мультипликативная запись:
Если групповая операция именуется умножением, то саму такую группу G{\displaystyle \mathrm {G} } при этом называют мультипликативной и при полном способе записи (когда хотят явно указать групповую операцию) обозначают так: (G,⋅){\displaystyle (\mathrm {G} ,\cdot )}.
Кратные произведения aa{\displaystyle aa}, aaa{\displaystyle aaa}, …{\displaystyle …} записывают в виде натуральных степеней a2{\displaystyle a^{2}}, a3{\displaystyle a^{3}},…{\displaystyle …}[7]. Для элемента a{\displaystyle a} корректно[8] определена целая степень, записывается следующим образом: a0=e{\displaystyle a^{0}=e}, a−n=(a−1)n{\displaystyle a^{-n}=(a^{-1})^{n}}.
Аддитивная запись[править | править код]
В коммутативной группе определяющая операция часто рассматривается как (абстрактное) сложение и записывается аддитивно:
Если групповая операция именуется сложением, то саму такую группу G{\displaystyle \mathrm {G} } при этом называют аддитивной и при полном способе записи обозначают так: (G,+){\displaystyle (\mathrm {G} ,+)}[9].
Существует гигантское количество примеров групп, а также их применений в современном мире. Множество целых чисел, снабжённое операцией сложения, является аддитивной группой или группой по сложению. Множество рациональных чисел, не включающее 0{\displaystyle 0}, с операцией умножения является мультипликативной группой. Эти группы положили начало возникновению важнейших конструкций в разделе общей алгебры. Группы применяются в различных областях математики. Математические объекты часто связываются с группами для дальнейшего изучения их свойств. Например, Анри Пуанкаре основал топологию, введя понятие фундаментальной группы[10]. Помимо теоретического применения групп существует множество способов применения групп на практике. К примеру, они применяются в криптографии, которая опирается на вычислительную теорию групп и знания в области алгоритмов.
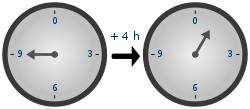 Часы показывают время по модулю 12. n=129+4≡1(mod12){\displaystyle {\begin{aligned}n=12\\9+4&\equiv 1{\pmod {12}}\,\end{aligned}}}.
Часы показывают время по модулю 12. n=129+4≡1(mod12){\displaystyle {\begin{aligned}n=12\\9+4&\equiv 1{\pmod {12}}\,\end{aligned}}}.В модульной арифметике складывают два целых числа, а полученную сумму делят на целое положительное число, называемое впоследствии модулем. Результатом модульной операции является остаток от деления. Для любого модуля n{\displaystyle n} множество целых чисел от 0{\displaystyle 0} до n−1{\displaystyle n-1} образует группу по сложению. Обратным элементом к a{\displaystyle a} является число a−1=n−a{\displaystyle a^{-1}=n-a}, нейтральный элемент — 0{\displaystyle 0}. Наглядным примером такой группы могут быть часы с циферблатом[11].
Применение теории групп не ограничивается только математикой, её широко используют в таких науках как физика, химия и информатика.
- Целые числа с операцией сложения. (Z,+){\displaystyle (\mathbb {Z} ,+)} — коммутативная группа с нейтральным элементом 0{\displaystyle 0}. Целые числа с операцией умножения не будут образовывать группу. Замкнутость, ассоциативность и существование нейтрального элемента будет иметь место, но не выполнится аксиома о существовании обратного элемента. Например, a=2{\displaystyle a=2}, тогда a⋅b=1{\displaystyle a\cdot b=1} то есть b=1/2{\displaystyle b=1/2}. Обратный элемент не является целым числом[12].
- Положительные рациональные числа с операцией умножения. Произведение рациональных чисел — снова рациональное число, обратный элемент к рациональному числу представляется обратной дробью, имеется ассоциативность, а нейтральным элементом является единица[12].
- Свободная группа с двумя образующими (F2{\displaystyle F_{2}}) состоит из пустого слова (единица группы) и всех конечных слов из четырёх символов a{\displaystyle a}, a−1{\displaystyle a^{-1}}, b{\displaystyle b} и b−1{\displaystyle b^{-1}} таких, что a{\displaystyle a} не появляется рядом с a−1{\displaystyle a^{-1}} и b{\displaystyle b} не появляется рядом с b−1{\displaystyle b^{-1}}. Операция умножения таких слов — это просто соединение двух слов в одно с последующим сокращением пар aa−1{\displaystyle aa^{-1}}, a−1a{\displaystyle a^{-1}a}, bb−1{\displaystyle bb^{-1}} и b−1b{\displaystyle b^{-1}b}[13].
- Симметрическая группа. Множество всех биекций конечного множества в себя с операцией композиции является конечной группой, которая называется симметрической группой, или группой перестановок. Мощность конечной симметрической группы Sn{\displaystyle S_{n}} для множества из n{\displaystyle n} элементов равна n!{\displaystyle n!}. При n≥3{\displaystyle n\geq 3} эта группа не является абелевой[14]. Любая конечная группа является подгруппой некоторой симметрической группы (теорема Кэли)[12][15].
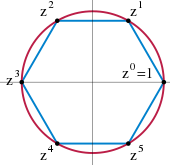 6 комплексных корней из единицы образуют циклическую группу
6 комплексных корней из единицы образуют циклическую группу- 31≡3(mod5)32≡4(mod5)33≡2(mod5)34≡1(mod5){\displaystyle {\begin{aligned}3^{1}&\equiv 3{\pmod {5}}\\3^{2}&\equiv 4{\pmod {5}}\\3^{3}&\equiv 2{\pmod {5}}\\3^{4}&\equiv 1{\pmod {5}}\,\end{aligned}}}
- Группа кубика Рубика — подгруппа симметрической группы S48{\displaystyle S_{48}}, элементы которой соответствуют преобразованиям кубика Рубика. Композиция двух преобразований снова является преобразованием, для каждого преобразования существует обратный элемент, имеется ассоциативность и нейтральный элемент[17].
- Группы Галуа. Были введены в математику для решения полиномиальных уравнений с помощью свойств симметрии. Например, решение квадратного уравнения ax2+bx+c=0{\displaystyle ax^{2}+bx+c=0} даёт корни: x=−b±b2−4ac2a.{\displaystyle x={\frac {-b\pm {\sqrt {b^{2}-4ac}}}{2a}}.} Подобная формула есть для уравнения третьей и четвёртой степени, но не существует для полиномиального уравнения степени 5{\displaystyle 5} и выше[18].
Подгруппа азота — Википедия
Материал из Википедии — свободной энциклопедии
| Группа → | 15 | ||||||
|---|---|---|---|---|---|---|---|
| ↓ Период | |||||||
| 2 | |||||||
| 3 | |||||||
| 4 |
| ||||||
| 5 |
| ||||||
| 6 |
| ||||||
| 7 |
| ||||||
Подгру́ппа азо́та, или пниктоге́ны[1], также пникти́ды — химические элементы 15-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы V группы)[2]. В группу входят азот N, фосфор P, мышьяк As, сурьма Sb, висмут Bi и искусственно полученный радиоактивный Московий Mc[3]. Элементы главной подгруппы V группы имеют пять электронов на внешнем электронном уровне. В целом характеризуются как неметаллы. Способность к присоединению электронов выражена значительно слабее, по сравнению с халькогенами и галогенами. Все элементы подгруппы азота имеют электронную конфигурацию внешнего энергетического уровня атома ns²np³ и могут проявлять в соединениях степени окисления от −3 до +5[3]. Вследствие относительно меньшей электроотрицательности связь с водородом менее полярна,чем связь с водородом халькогенов и галогенов. Водородные соединения этих элементов не отщепляют в водном растворе ионы водорода, иными словами, не обладают кислотными свойствами. Первые представители подгруппы — азот и фосфор — типичные неметаллы, мышьяк и сурьма проявляют металлические свойства, висмут — типичный металл. Таким образом, в данной группе резко изменяются свойства составляющих её элементов: от типичного неметалла до типичного металла. Химия этих элементов очень разнообразна и, учитывая различия в свойствах элементов, при изучении её разбивают на две подгруппы — подгруппу азота и подгруппу мышьяка.
Свойства элементов подгруппы азота и простых веществ[править | править код]
Азот[править | править код]
 Оптический линейчатый эмиссионный спектр азота
Оптический линейчатый эмиссионный спектр азота| N | 7 |
| 14,00674 | |
| 2s22p3; | |
| Азот | |
Азот — бесцветный газ, не имеющий запаха, мало растворим в воде (2,3 мл/100г при 0 °C, 0,8 мл/100г при 80 °C).
Также может быть и в жидком состоянии, при температуре кипения (−195,8 °C) — бесцветная жидкость. При контакте с воздухом поглощает кислород.
При температуре в −209,86 °C азот переходит в твердое состояние в виде снега. При контакте с воздухом поглощает кислород, при этом плавится, образуя раствор кислорода в азоте.
Фосфор[править | править код]
| P | 15 |
| 30,973762 | |
| 3s23p3 | |
| Фосфор | |
Фосфор — неметалл, в чистом виде имеет 4 аллотропные модификации:
- Белый фосфор — самая химически активная модификация фосфора. Имеет молекулярное строение; формула P4, форма молекулы — тетраэдр. По внешнему виду белый фосфор очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий. Температура плавления 44,1 °C, плотность 1823 кг/м³. Чрезвычайно химически активен. Например, он медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией). Ядовит, летальная доза белого фосфора для взрослого мужчины составляет 0,05—0,1 г.
- Красный фосфор — представляет собой полимер со сложной структурой. Имеет формулу Pn. В зависимости от способа получения и степени дробления красного фосфора, имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии — тёмно-фиолетовый с медным оттенком металлический блеск. Красный фосфор на воздухе не самовоспламеняется, вплоть до температуры 240—250 °С (при переходе в белую форму во время возгонки), но самовоспламеняется при трении или ударе, у него полностью отсутствует явление хемолюминесценции. Нерастворим в воде, а также в бензоле, сероуглероде и других, растворим в трибромиде фосфора. При температуре возгонки красный фосфор превращается в пар, при охлаждении которого образуется в основном белый фосфор. Ядовитость его в тысячи раз меньше, чем у белого, поэтому он применяется гораздо шире, например, в производстве спичек (составом на основе красного фосфора покрыта тёрочная поверхность коробков). Плотность красного фосфора также выше, и достигает 2400 кг/м³ в литом виде. При хранении на воздухе красный фосфор в присутствии влаги постепенно окисляется, образуя гигроскопичный оксид, поглощает воду и отсыревает («отмокает»), образуя вязкую фосфорную кислоту; поэтому его хранят в герметичной таре. При «отмокании» — промывают водой от остатков фосфорных кислот, высушивают и используют по назначению.
- Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов, имеющих высокую (2690 кг/м³) плотность. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2×109 Па (20 тысяч атмосфер) и температуру около 200 °С. Начало быстрого перехода лежит в области 13 000 атмосфер и температуре около 230 °С. Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, совершенно нерастворимое в воде и в органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Чёрный фосфор проводит электрический ток и имеет свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 18×105Па.
- Металлический фосфор. При 8,3×1010 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу с плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25×1011 Па — ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
Мышьяк[править | править код]
| As | 33 |
| 74,9216 | |
| 4s24p3 | |
| Мышьяк | |
Мышьяк — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) четвёртого периода периодической системы; имеет атомный номер 33, обозначается символом As. Простое вещество представляет собой хрупкий полуметалл стального цвета. Мышьяк существует в нескольких аллотропических модификациях. Наиболее устойчив при обычных условиях и при нагревании металлический или серый мышьяк. Плотность серого мышьяка равна 5,72 г/см3. При нагревании под нормальным давлением он сублимируется. В отличие от других модификаций, серый мышьяк обладает металлической электрической проводимостью. В воде мышьяк нерастворим.
Сурьма[править | править код]
| Sb | 51 |
| 121,76 | |
| 5s25p3 | |
| Сурьма | |
Сурьма — полуметалл серебристо-белого цвета с синеватым оттенком, грубозернистого строения. Известны четыре металлические аллотропные модификации сурьмы, существующие при различных давлениях, и три аморфные модификации (жёлтая, чёрная и взрывчатая сурьма). Желтая сурьма образуется при действии кислорода на жидкий SbH3. При нагревании, а также при освещении видимым светом переходит в черную сурьму. Черная сурьма обладает полупроводниковыми свойствами. Взрывчатая сурьма — серебристо-белая, обладает металлическим блеском. Образуется при электролизе SbCl3 при малой плотности тока. Взрывается при ударе и трении. Взрывчатая сурьма при растирании или ударе со взрывом превращается в металлическую сурьму. Сурьму вводят в некоторые сплавы для придания им твердости. Сплав, состоящий из сурьмы, свинца и небольшого количества олова, называется типографским металлом или гартом. В своих соединениях сурьма обнаруживает большое сходство с мышьяком, но отличается от него более сильно выраженными металлическими свойствами.
Висмут[править | править код]
| Bi | 83 |
| 208,98038 | |
| [Xe]4f145d106s26p3 | |
| Висмут | |
Висмут — тяжёлый серебристо-белый металл с розоватым оттенком. Со временем покрывается тёмно-серой оксидной плёнкой. Наряду со свинцом и оловом входит в состав большинства легкоплавких припоев и сплавов для изготовления плавких предохранителей и элементов пожарной сигнализации. Пары висмута ядовиты. Химические свойства весьма сходны с сурьмой и мышьяком, в основном висмут проявляет свойства типичного металла, однако слабые неметаллические свойства тоже есть.
Московий[править | править код]
| Mc | 115 |
| (289) | |
| [Rn]5f146d107s27p3 | |
| Московий | |
Московий (лат. Moscovium, Mc) — 115-й химический элемент V группы периодической системы, атомный номер 115, атомная масса 289, наиболее стабильным является нуклид 289Mc (период полураспада оценивается в 156 мс).
Происхождение названий химических элементов — Википедия
| № | Символ | Русское название | Латинское название | Этимология названия |
|---|---|---|---|---|
| 1 | H | Водород | Hydrogenium | Калька латинского названия, которое происходит от др.-греч. ὕδωρ — «вода» и γεννάω — «рождаю». |
| 2 | He | Гелий | Helium | От др.-греч. ἥλιος — «солнце». |
| 3 | Li | Литий | Lithium | От др.-греч. λίθος — «камень». |
| 4 | Be | Бериллий | Beryllium | От названия минерала берилл. |
| 5 | B | Бор | Borum | От названия минерала бура. |
| 6 | C | Углерод | Carboneum | Буквально «рождающий уголь». Латинское название происходит от лат. carbō — «уголь». |
| 7 | N | Азот | Nitrogenium | От др.-греч. ἄζωτος — «безжизненный». Латинское название означает «рождающий селитру». |
| 8 | O | Кислород | Oxygenium | Калька термина оксиген, происходящего от др.-греч. ὀξύς — «кислый» и др.-греч. γεννάω — «рождаю». |
| 9 | F | Фтор | Fluorum | От др.-греч. φθόρος — «разрушение». Латинское название происходит от fluere — «течь» (по свойству соединения фтора, фторида кальция, понижать температуру плавления руды и увеличивать текучесть расплава). |
| 10 | Ne | Неон | Neon | От др.-греч. νέος — «новый». |
| 11 | Na | Натрий | Natrium | От араб. натрун — «бурлящее вещество», что первоначально относилось к природной соде. |
| 12 | Mg | Магний | Magnesium | От названия древнего города Магнезия в Малой Азии, в окрестностях которого имеются залежи минерала магнезита. |
| 13 | Al | Алюминий | Aluminium | От лат. alumen — «квасцы». |
| 14 | Si | Кремний | Silicium | От др.-греч. κρημνός — «утёс, гора». Латинское название происходит от лат. silex — «кремень». |
| 15 | P | Фосфор | Phosphorus | От др.-греч. φῶς — «свет» и φέρω — «несу». |
| 16 | S | Сера | Sulfur | Русское название серы восходит к праслав. *sěra, которое сравнивают с лат. sērum — «сыворотка»[1]. Латинское название восходит к индоевропейскому корню *swelp- — «гореть»[2]. |
| 17 | Cl | Хлор | Chlorum | От др.-греч. χλωρός — «зеленоватый». |
| 18 | Ar | Аргон | Argon | От др.-греч. ἀργός — «ленивый, медленный, неактивный». |
| 19 | K | Калий | Kalium | От араб. аль-кали — «поташ». |
| 20 | Ca | Кальций | Calcium | От лат. calx (в родительном падеже calcis) — «известь». |
| 21 | Sc | Скандий | Scandium | Элемент назван в честь Скандинавии. |
| 22 | Ti | Титан | Titanium | Элемент назван в честь титанов, персонажей древнегреческой мифологии. |
| 23 | V | Ванадий | Vanadium | Элемент назван в честь скандинавской богини красоты Ванадис. |
| 24 | Cr | Хром | Chromium | От др.-греч. χρῶμα — цвет. |
| 25 | Mn | Марганец | Manganum | От нем. Manganerz — «марганцевая руда». |
| 26 | Fe | Железо | Ferrum | Русское название восходит к праслав. *želězo, которое вместе с балтийскими словами либо в древности заимствовано как бродячий культурный термин, восходящий к хетт. ḫapalki (ср. др.-греч. χαλκός), либо родственно словам железа́, желвак, поскольку болотная руда обладает комковатой структурой. Латинское Ferrum либо из ближневосточных языков через этрусское посредство, либо восходит к *fersom, ср. рус. дресва — также в связи со структурой руды. |
| 27 | Co | Кобальт | Cobaltum | От нем. Kobold — «кобольд» (горный дух). |
| 28 | Ni | Никель | Niccolum | Сокращение от нем. Kupfernickel — «медный дьявол». |
| 29 | Cu | Медь | Cuprum | Этимология русского названия (вместе с родственными славянскими) не выяснена. Слово сравнивалось со ст.‑слав. смѣдъ «тёмный» и названием страны Мидия (греч. Μηδία). Латинский термин происходит от названия острова Кипр (лат. Cuprum), на котором добывали медь. |
| 30 | Zn | Цинк | Zincum | От лат. zincum — «белый налёт» или от нем. Zinke — «зубец». |
| 31 | Ga | Галлий | Gallium | Элемент назван в честь Франции, по её латинскому названию — Галлия (Gallia). |
| 32 | Ge | Германий | Germanium | Название дано в честь Германии. |
| 33 | As | Мышьяк | Arsenicum | Название мышьяка в русском языке связывают с употреблением его соединений для истребления мышей и крыс. Греческое название ἀρσενικόν происходит от перс. زرنيخ — «жёлтый аурипигмент»[3]. |
| 34 | Se | Селен | Selenium | От др.-греч. σελήνη — Луна. Элемент назван так в связи с тем, что в природе он является спутником химически сходного с ним теллура (названного в честь Земли). |
| 35 | Br | Бром | Bromum | От др.-греч. βρῶμος — «зловоние». |
| 36 | Kr | Криптон | Krypton | От др.-греч. κρυπτός — «скрытый». |
| 37 | Rb | Рубидий | Rubidium | От лат. rubidus — «тёмно-красный» (по цвету наиболее характерных красных линий спектра). |
| 38 | Sr | Стронций | Strontium | Элемент, как и минерал стронцианит, получил название в честь деревни Стронциан (Лохабер, Шотландия), где был впервые обнаружен. |
| 39 | Y | Иттрий | Yttrium | От названия минерала иттербита, из которого был впервые выделен иттрий. Минерал, в свою очередь, назван в честь села Иттербю в Швеции. |
| 40 | Zr | Цирконий | Zirconium | От названия минерала циркона, из которого был впервые выделен этот элемент. Происхождение самого слова циркон неясно. Возможно, оно происходит от арабского zarkûn — «киноварь» или от персидского zargun — «золотистый цвет». |
| 41 | Nb | Ниобий | Niobium | Элемент назван в честь героини древнегреческой мифологии Ниобы — дочери Тантала, что подчёркивает сходство ниобия с химическим элементом танталом. |
| 42 | Mo | Молибден | Molybdenum | От др.-греч. μόλυβδος — «свинец» (из-за внешнего сходства молибденита, минерала, из которого впервые удалось выделить оксид молибдена, с галенитом — сульфидом свинца). |
| 43 | Tc | Технеций | Technetium | От др.-греч. τεχνητός — «искусственный». |
| 44 | Ru | Рутений | Ruthenium | Элемент назван в честь России, по её латинскому названию — Рутения (Ruthenia). |
| 45 | Rh | Родий | Rhodium | От др.-греч. ῥόδον — «роза» (типичные соединения родия имеют глубокий тёмно-красный цвет). |
| 46 | Pd | Палладий | Palladium | Элемент назван по имени астероида Паллада, открытого незадолго до палладия. В свою очередь, астероид назван в честь Афины Паллады из древнегреческой мифологии. |
| 47 | Ag | Серебро | Argentum | С родственными славянскими словами восходит к праслав. *sьrebro, которое является древним заимствованием из какого-то неиндоевропейского языка, вместе с параллельными лит. sidãbras, латыш. sidrabs, sudrabs, готск. silubr. Возможно, из анатолийского subau-ro «блестящий», либо из аккад. šarpu- «очищенное серебро», либо из доиндоевропейского субстрата Южной Италии и средиземноморских островов, ср. баск. zillar, zirar, zidar «серебро». По-гречески серебро ἄργυρος, árgyros, от индоевропейского корня, означающего «белый, блистающий». Отсюда происходит латинское название. |
| 48 | Cd | Кадмий | Cadmium | Элемент назван по греческому названию руды, из которой в Германии добывали цинк, — καδμεία. В свою очередь, руда получила своё название в честь Кадма, героя древнегреческой мифологии. |
| 49 | In | Индий | Indium | Элемент назван по цвету индиго — цвету спектральной линии индия. |
| 50 | Sn | Олово | Stannum | Славянское название вместе с родственными балтийскими восходит к пра-и.е. *albh- «белый»[4] (при этом непонятно возникновение -v- вместо ожидаемого -b- и отсутствие метатезы в славянском слове, что побуждает Ю. В. Откупщикова говорить о заимствовании). Латинское название, вероятно, имеет кельтский источник. |
| 51 | Sb | Сурьма | Stibium | Русское название произошло от тур. sürme: им обозначался порошок свинцового блеска, также служивший для чернения бровей. По другим данным, название восходит к перс. сурме — «металл». Происхождение латинского термина доподлинно неизвестно. |
| 52 | Te | Теллур | Tellurium | От лат. tellus (в родительном падеже telluris) — Земля. |
| 53 | I | Иод | Iodum | От др.-греч. ἰώδης — «фиалкоподобный», что связано с цветом пара, который наблюдал французский химик Бернар Куртуа, нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой. |
| 54 | Xe | Ксенон | Xenon | От др.-греч. ξένος — «чужой». |
| 55 | Cs | Цезий | Caesium | От лат. caesius — «небесно-голубой» (из-за наличия двух ярких синих линий в эмиссионном спектре). |
| 56 | Ba | Барий | Barium | От др.-греч. βαρύς — «тяжёлый», так как его оксид был охарактеризован как имеющий необычно высокую для таких веществ плотность. |
| 57 | La | Лантан | Lanthanum | От др.-греч. λανθάνω — «скрываюсь, таюсь». |
| 58 | Ce | Церий | Cerium | Элемент назван в честь самой большой из малых планет, Цереры. |
| 59 | Pr | Празеодим | Praseodymium | От др.-греч. πράσιος — «светло-зелёный» и δίδυμος — «близнец». |
| 60 | Nd | Неодим | Neodymium | От др.-греч. νέος — «новый» и δίδυμος — «близнец». |
| 61 | Pm | Прометий | Promethium | Элемент назван в честь мифического героя Прометея, похитившего у Зевса огонь и передавшего его людям. |
| 62 | Sm | Самарий | Samarium | Элемент назван по минералу самарскиту, из которого был впервые выделен. |
| 63 | Eu | Европий | Europium | Название дано в честь Европы. |
| 64 | Gd | Гадолиний | Gadolinium | Название дано в честь финского химика Юхана Гадолина. |
| 65 | Tb | Тербий | Terbium | Элемент назван в честь села Иттербю, находящегося на острове Ресарё, входящем в Стокгольмский архипелаг. |
| 66 | Dy | Диспрозий | Dysprosium | От др.-греч. δυσπρόσιτος — «труднодоступный». |
| 67 | Ho | Гольмий | Holmium | Элемент назван по старинному латинскому названию города Стокгольм — Гольмия (Holmia). |
| 68 | Er | Эрбий | Erbium | Название дано в честь села Иттербю. |
| 69 | Tm | Тулий | Thulium | Элемент назван в честь расположенного на севере Европы легендарного острова Туле, древнего названия Скандинавии. |
| 70 | Yb | Иттербий | Ytterbium | Наряду ещё с тремя химическими элементами (иттрий, тербий, эрбий) получил название в честь села Иттербю. |
| 71 | Lu | Лютеций | Lutetium | Элемент назван по латинскому названию Парижа — Лютеция (Lutetia). |
| 72 | Hf | Гафний | Hafnium | Элемент назван в честь Копенгагена, по его латинскому названию — Гафния (Hafnia). |
| 73 | Ta | Тантал | Tantalum | Элемент назван в честь героя древнегреческой мифологии Тантала, что связано с трудностями, возникшими при его получении в чистом виде. |
| 74 | W | Вольфрам | Wolframium | От нем. Wolf Rahm — «волчья пена» (название связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков). |
| 75 | Re | Рений | Rhenium | Элемент назван в честь Рейнской провинции Германии. |
| 76 | Os | Осмий | Osmium | От др.-греч. ὀσμή — «запах» (по резко пахнущему летучему оксиду осмия). |
| 77 | Ir | Иридий | Iridium | От др.-греч. ἶρις — «радуга» (из-за разнообразной окраски солей иридия). |
| 78 | Pt | Платина | Platinum | Название было дано испанскими конкистадорами, которые в середине XVI века впервые познакомились в Южной Америке новым металлом, внешне похожим на серебро (исп. plata). Название элемента буквально означает «маленькое серебро», «серебришко», что объясняется тем, что платина долгое время не находила применения и ценилась вдвое ниже серебра из-за своей исключительной тугоплавкости. |
| 79 | Au | Золото | Aurum | Праславянское *zolto (рус. золото, ст.‑слав. злато, польск. złoto) родственно лит. geltonas «жёлтый», латыш. zelts «золото, золотой»; с другим вокализмом: нем. gold, англ. gold; далее авест. zaranya, др.-инд. hiraṇyam «золото», также рус. жёлтый, зелёный, от праиндоевропейского корня *ǵʰel- «жёлтый, зелёный, яркий». |
| 80 | Hg | Ртуть | Hydrargyrum | Русское название ртути происходит от праславянского причастия *rьtǫtь, родственного с лит. rìsti — «катиться»[5]. Латинское — букв. «жидкое серебро». |
| 81 | Tl | Таллий | Thallium | От др.-греч. θαλλός — «молодая, зелёная ветвь» (по характерным зелёным линиям спектра и зелёной окраске пламени). |
| 82 | Pb | Свинец | Plumbum | Вместе с родственными лит. švinas, латыш. svins не имеет удовлетворительной этимологии. Возможно — от пра-и.е. ḱṷei- «светиться, блестеть» при помощи суффикса -n- (ср. рус. светиться от пра-и.е. ḱṷei-t-), аналогично нем. Blei «свинец» от пра-и.е. blei- «блестеть». |
| 83 | Bi | Висмут | Bismuthum | От нем. weisse Masse — «белая масса». |
| 84 | Po | Полоний | Polonium | Элемент назван в честь Польши, по её латинскому названию — Полония (Polonia). |
| 85 | At | Астат | Astatium | От др.-греч. ἄστατος — «неустойчивый». |
| 86 | Rn | Радон | Radon | От лат. radius — «луч». |
| 87 | Fr | Франций | Francium | Элемент назван в честь Франции. |
| 88 | Ra | Радий | Radium | От лат. radius — «луч». |
| 89 | Ac | Актиний | Actinium | От др.-греч. ἀκτίς — «луч». |
| 90 | Th | Торий | Thorium | От имени бога грома Тора в скандинавской мифологии. |
| 91 | Pa | Протактиний | Protactinium | Элемент назван так потому, что служит «родоначальником» актиния (при α-распаде 231Pa образуется 227Ac). |
| 92 | U | Уран | Uranium | Элемент получил название по планете Уран. |
| 93 | Np | Нептуний | Neptunium | Элемент назван в честь планеты Нептун. |
| 94 | Pu | Плутоний | Plutonium | Название дано в честь планеты Плутон, по аналогии с ураном и нептунием. |
| 95 | Am | Америций | Americium | Элемент назван в честь части света Америки. |
| 96 | Cm | Кюрий | Curium | Название дано в честь Пьера и Марии Кюри. |
| 97 | Bk | Берклий | Berkelium | Элемент назван в честь города Беркли (США), в котором он был впервые получен. |
| 98 | Cf | Калифорний | Californium | Элемент назван в честь Калифорнийского университета в Беркли, где и был получен. Как писали авторы, этим названием они хотели указать, что открыть новый элемент им было так же трудно, как век назад пионерам Америки достичь Калифорнии. |
| 99 | Es | Эйнштейний | Einsteinium | Название дано в честь Альберта Эйнштейна. |
| 100 | Fm | Фермий | Fermium | Элемент назван по имени итальянского физика Энрико Ферми. |
| 101 | Md | Менделевий | Mendelevium | Название дано в честь Дмитрия Менделеева, создателя периодической системы элементов. |
| 102 | No | Нобелий | Nobelium | Элемент назван в честь Альфреда Нобеля. |
| 103 | Lr | Лоуренсий | Lawrencium | Элемент назван по имени изобретателя циклотрона, физика Эрнеста Лоуренса. |
| 104 | Rf | Резерфордий | Rutherfordium | Название дано в честь выдающегося английского физика Эрнеста Резерфорда. |
| 105 | Db | Дубний | Dubnium | Элемент получил название в честь наукограда Дубна. |
| 106 | Sg | Сиборгий | Seaborgium | Название дано в честь американского физика Гленна Сиборга[6], который участвовал в открытии плутония и девяти других трансурановых элементов. |
| 107 | Bh | Борий | Bohrium | Элемент назван по имени датского физика Нильса Бора. |
| 108 | Hs | Хассий | Hassium | Элемент получил название в честь немецкой земли Гессен (Hassia — латинское название средневекового княжества Гессен, центром которого был Дармштадт)[7]. Причина такого названия в том, что элемент был синтезирован в Центре исследования тяжёлых ионов в Дармштадте. |
| 109 | Mt | Мейтнерий | Meitnerium | Элемент назван по имени австрийского физика Лизы Мейтнер. |
| 110 | Ds | Дармштадтий | Darmstadtium | Элемент получил название в честь города Дармштадт, где был впервые синтезирован. |
| 111 | Rg | Рентгений | Roentgenium | Элемент назван по имени знаменитого немецкого физика, лауреата Нобелевской премии, открывшего знаменитые лучи, Вильгельма Конрада Рентгена. |
| 112 | Cn | Коперниций | Copernicium | Название дано в честь Николая Коперника[8]. |
| 113 | Nh | Нихоний | Nihonium | Элемент назван в честь Японии. Название происходит от одного из двух японских вариантов самоназвания страны — Нихон, что переводится как «страна восходящего солнца». |
| 114 | Fl | Флеровий | Flerovium | Название дано в честь российского физика Г. Н. Флёрова, руководителя группы, синтезировавшей элементы с номерами от 102 до 110. |
| 115 | Mc | Московий | Moscovium | Элемент получил название в честь Московской области, в которой находится Дубна. |
| 116 | Lv | Ливерморий | Livermorium | Название дано в честь города Ливермор (Калифорния), где располагается Ливерморская национальная лаборатория. |
| 117 | Ts | Теннессин | Tennessium/Tennessinum | Элемент назван в честь штата Теннесси, в котором расположены Национальная лаборатория Ок-Ридж, Университет Вандербильта и Университет Теннесси, внёсшие вклад в изучение сверхтяжёлых элементов. |
| 118 | Og | Оганесон | Oganesson | Название дано в честь российского физика Ю. Ц. Оганесяна, руководителя группы, синтезировавшей элементы с номерами от 114 до 118. |