Значение химии. — Химия — 8 класс
Просмотр содержимого документа
«Значение химии.»

« Широко распростирает химия руки свои в дела человеческие …
Куда ни посмотри, куда ни оглянись, везде обращаются перед очами нашими успехи ее прилежания».
Так уже более 200 лет назад сказал гениальный русский ученый М. В. Ломоносов.

Химия всюду…

Химия одевает нас и лечит

Химия помогает выращивать высокие урожаи

Химия помогает строить и украшать наше жилище

Без достижений химии нельзя было бы создать космические корабли

Химией создано более трех миллионов искусственных соединений. Это в тысячу раз больше, чем могла создать природа ( пластмассы, краски, растворители, конструкционные материалы, витамины, гормоны, волокна).

Вся деятельность человека буквально каждый его шаг, начиная с утреннего туалета, приготовления пищи- связана с химическими процессами или продуктами химических производств.

У химии великое настоящее, но ещё великое будущее!

Автор:Щегелева Елена Борисовна,учитель химии.
Республика Карелия, Медвежьегорский район,д.Чёлмужи
Муниципальное казённое общеобразовательное учреждение Медвежьегорского района«Чёлмужская средняя общеобразовательная школа»
multiurok.ru
Описание элемента по положению в Периодической системе . Видеоурок. Химия 8 Класс
Урок посвящен изучению характеристики элемента по его положению в периодической системе элементов. В ходе урока вы научитесь определять на основании положения элемента в периодической системе особенности строения его атома и свойства образуемых им веществ; сравнивать эти свойства со свойствами «соседей» элемента по подгруппе и периоду.
Тема: Обобщение пройденного материала
Урок: Описание химического элемента по положению в Периодической системе
Для того чтобы определить состав ядра и распределение электронов по слоям в атоме химического элемента, нужно знать порядковый номер элемента, номер периода, номер группы и подгруппу в Периодической системе.
Рассмотрим конкретный пример. Определим строение атома калия. Порядковый номер калия равен 19. Порядковый номер определяет число протонов в ядре и общее число электронов в атоме. Число нейтронов в конкретном атоме можно определить по разнице между массовым числом и числом протонов. Для изотопа калия с массовым числом 39 число протонов равно 19, число нейтронов равно 39-19=20, число электронов – 19.
По номеру периода можно определить число электронных слоев в атоме. Калий – элемент 4 периода, значит, все его 19 электронов расположены на 4-х электронных слоях. При этом нужно помнить, что на 1-м слое может максимально находиться не более 2-х электронов, на втором – не более 8. Число электронов на последнем слое равно номеру группы (для элементов главных подгрупп). У калия всего 1 внешний электрон, он находится на 4-м слое. Оставшиеся электроны – на третьем слое. Таким образом, в атоме калия электроны распределяются по слоям в следующем количестве: 2, 8, 8, 1 (Рис. 1).
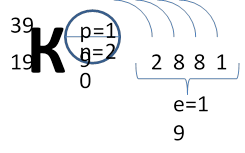
Рис. 1. Схема строения атома калия
Номер группы определяет не только число внешних электронов, но высшую валентность элемента. Численное значение низшей валентности для элементов V-VII групп равно 8 — номер группы. Итак, высшая и единственная валентность калия равна I.
По положению элемента в периодической системе можно определить его принадлежность к металлам или неметаллам, а также свойства образованных им высших оксида и гидроксида. Элементы главных подгрупп, лежащие выше диагонали Be-At, относятся к неметаллам. Остальные элементы – металлы. При этом металлические свойства слева направо по периоду ослабевают, а сверху вниз по группе усиливаются.
Таким образом, калий – металл. Его металлические свойства выражены сильнее, чем у натрия и кальция.
Если элемент образует простое вещество-металл, то его высший оксид и гидроксид будут основными. Если неметалл – то кислотными. Если переходный металл – то амфотерными (Рис. 2).
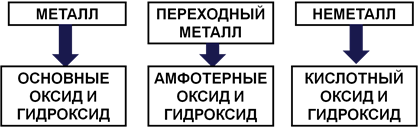
Рис. 2. Связь свойств элементов и образованных ими соединений
Так как калий – металл, его высший оксид и гидроксид будут проявлять основные свойства.
Составим формулы высшего оксида и гидроксида калия. Высшая валентность калия равна I, значит, формула высшего оксида – К2О, его характер – основный.
Основному оксиду соответствует основание – КОН.
Можно подтвердить основный характер оксида и гидроксида кали
interneturok.ru
Химические элементы. Символы химических элементов — урок. Химия, 8–9 класс.
Химический элемент — это определённый вид атомов.
Атомы разных химических элементов отличаются массой, размерами, строением и свойствами.
Каждый химический элемент имеет название и обозначается символом или химическим знаком.
Символ химического элемента состоит из одной или двух букв. Как правило, используются первые буквы его латинского названия.
Название элемента | Символ | Произношение |
| Азот | N | «эн» |
| Алюминий | Al | «алюминий» |
| Барий | Ba | «барий» |
| Бром | Br | «бром» |
| Водород | H | «аш» |
| Гелий | He | «гелий» |
| Железо | Fe | «феррум» |
| Золото | Au | «аурум» |
| Иод | I | «иод» |
| Калий | K | «калий» |
| Кальций | Ca | «кальций» |
| Кислород | O | «о» |
| Кремний | Si | «силициум» |
| Магний | Mg | «магний» |
| Медь | Cu | «купрум» |
| Натрий | Na | «натрий» |
| Сера | S | «эс» |
| Серебро | Ag | «аргентум» |
| Углерод | C | «це» |
| Фосфор | P | «пэ» |
| Фтор | F | «фтор» |
| Хлор | Cl | «хлор» |
| Цинк | Zn | «цинк» |
Названия и символы \(118\) химических элементов приведены в периодической таблице. Более \(20\) элементов получены искусственно с помощью сложных физических методов. Таблица постоянно дополняется новыми элементами.
Атомы химических элементов соединяются друг с другом в разных комбинациях и образуют огромное количество природных и синтетических веществ.

www.yaklass.ru
определения в курсе 8 класса — Все определения по химии — Уроки
Относительная атомная масса — это отношение массы атома к 1/12 массы атома углерода.
Относительная молекулярная масса — это отношение массы молекулы к 1/12 массы атома углерода.
Изотопы — это химические элементы с одинаковым зарядом ядра, но разными массовыми числами; это химические элементы с одинаковым количеством протонов в ядре, но разным количеством нейтронов.
Массовое число — это сумма протонов и нейтронов в ядре
Ионная связь — это связь между ионами.
Электроотрицательность — это способность атома одного элемента, притягивать к себе электроны от другоро элемента.
Ковалентная связь — это связь между атомами неметаллов за счет образования общих электронных пар.
Металическая связь — связь между атомами и катионами металла за счет общих свободных электронов.
Аллотропия — это способность одного химического элемента образовывать несколько простых веществ.
Молярная масса — масса одного моля вещества.
Молярный объем — объем одного моля вещества.
Степень окисления — это условный заряд атома, вычисленный исходя из предположения, что все вещества состоят из ионов.
Оксиды — это сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления (
Основания — это сложные вещества, состоящие из катионов металла и одного или нескольких гидрокси-анионов ОН¯.
Кислоты — это сложные вещества, состоящие из атомов водорода и кислотного остатка.
Соли — это сложные вещества, состоящие из катионов металла и анионов кислотного остатка.
Экзотермическая реакция — это реакция, идущая с выделением теплоты.
Эндотермическая реакция— это реакция, идущая с поглощением теплоты.
Катализаторы — это вещества, которые ускоряют химическую реакцию, сами при этом не расходуются.
Ферменты — это биологические катализаторы.
Каталитические реакции — это реакции, идущие с участием катализатора.
Обратимые реакции —
это реакции идущие как в прямом, так и в обратном направлении.Необратимые реакции — это реакции идущие до конца в одном направлении.
Электролиты — это вещества, растворы и расплавы которых проводят электрический ток.
Электролитическая диссоциация — это распад электролита на ионы при расплавлении его или растворении в воде.
Окислительно-восстановительные реакции — это реакции, идущие с изменением степени окисления элементов.
Восстановитель — элемент, который повышает степень окисления, отдает электроны.
Окислитель— элемент, который понижает степень окисления, принимает электроны.
Окисление — процесс отдачи электронов.
Восстановление — процесс принятия электронов.
Учитель: Представление о том, что вещество состоит из отдельных, очень малых частиц, — атомная гипотеза – возникло еще в Древней Греции. Древнегреческий философ Демокрит 2500 лет назад высказал мысль о том, что все тела в природе состоят из мельчайших невидимых, непроницаемых, неделимых, вечно движущихся частиц – атомов. Учитель: Учение о молекулах и атомах было разработано в середине 18 века великим русским ученым Михаилом Васильевичем Ломоносовым (1711 – 1765 гг.) Он утверждал, что тела в природе состоят из корпускул (молекул), в состав которых входят элементы (атомы). Многообразие веществ ученый прозорливо объяснял соединением разных атомов в молекулах и различным расположением атомов в них. Учитель: Что мы можем сказать о М.В. Ломоносове? Кем он был? М.В. Ломоносов был естествоиспытателем, философом, поэтом, историком, географом, политическим деятелем. К сегодняшнему уроку вашим домашним заданием была подготовка группами произвольного состава (по 3-4 человека) информационных проектов о жизни и деятельности М.В. Ломоносова с представлением информации проекта в форме буклета. (Представление 2-3 буклетов) Учитель: Основной теорией химии, сохранившей свое значение и до наших дней является атомно-молекулярное учение. Атомно-молекулярное учение – это учение, в основу которого положено представление о том, что наименьшими структурными единицами веществ являются атомы и молекулы. Из атомов состоят: все металлы; многие неметаллы (инертные газы, С, Si, B, Se, As, Te). Из молекул состоят: все органические вещества; некоторые неорганические: простые газы (N2, h3, Cl2, F2), сложные (CO2, NO2, SO3, SO2). | Формирование ассоциативного ряда (воспроизведение имеющихся знаний по данной теме) Учащиеся называют основные смысловые единицы, свои предположения и ассоциации, связанные с темой урока. -Учащиеся высказывают свои мысли и суждения о великом русском ученом. -Учащиеся представляют классу информационные буклеты с презентацией на экране. Ученики класса прослушивают представляемую информацию, задают вопросы. Учащиеся записывают информацию в форме опорного конспекта. | 1. 2. | Работа по созданию первой модели: «простого вещества»: Учитель: — Чем отличаются друг от друга атомы разных видов? В ваших наборах атомы разных химических элементов отличаются еще и цветом. Модель атомов водорода – синего цвета, модели атомов кислорода, больших по размеру – красного цвета. -Состав любого вещества всегда одинаков независимо от способа его получения. -Как же можно выразить состав вещества при помощи химических знаков? Ведь во многих веществах атомы соединяются друг с другом. Например, газ, который поддерживает горение – кислород – состоит из молекул. Каждая его молекула состоит из двух атомов кислорода. Зная это, создайте модель молекулы кислорода, запишите химическую формулу кислорода. Работа по созданию второй модели: «сложного вещества»: Учитель: А сейчас, в своей исследовательской лаборатории, создайте модель молекулы воды, зная, что каждая молекула воды состоит из двух атомов водорода и одного атома кислорода (h3O). Запишем химическую формулу воды. — Попробуйте объяснить, что обозначает индекс? O2 ; h3O индекс — Поместите на поднос отдельно существующие атомы: — три атома водорода (3H) — четыре атома кислорода (4O) — Что в данном случае обозначает коэффициент? 3H; 4O коэффициент — А теперь прошу вас создать еще одну модель молекул воды. — Сколько молекул воды находится на вашем подносе? — Как это записать? — Что в данном случае обозначает коэффициент? — Значит, 3H 2h3O коэффициент может обозначать или количество одиночных атомов, или количество молекул. — Итак, выражение состава вещества при помощи химических знаков называется химической формулой. Учитель: О чем может рассказать химическая формула? На интерактивной доске появляются разные формулы веществ: h3O, O2, HCl, Сl2 Учитель: На какие 2 группы можно разделить предложенные формулы, исходя из состава веществ? — Дайте определение простых и сложных веществ. — На интерактивной доске вы видите химические формулы веществ, назовите формулы простых веществ: HNO3, h3, S, CaCO3 — Почему они относятся к простым веществам? — Сейчас из предложенного ряда формул назовите формулы сложных веществ h3SO4, P, AlCl3, Ca — Почему эти вещества являются сложными? | Ответы обучающихся: -Они отличаются размерами и массой. Учащиеся работают в парах: «Исследовательских лабораториях» (каждой паре выдан набор для составления шаростержневых моделей) Учащиеся строят модели по заданию учителя. Учащиеся строят модель простого вещества – кислорода и записывают формулу – O2 Учащиеся записывают формулу–h3O и строят модель сложного вещества — Индекс обозначает количество атомов, входящих в состав молекулы. Во время работы учащихся в «исследовательских лабораториях», на интерактивной доске также появляются цветные, отдельно существующие одиночные атомы. — Коэффициент обозначает количество одиночных, существующих отдельно друг от друга, атомов. Ответы учащихся: — Две — 2h3O — Количество молекул — О том, из каких атомов состоит молекула (это качественный состав вещества) и о том, в каком количестве атомы входят в состав молекулы (это количественный состав вещества). Учащиеся читают химическую формулу вещества и дают характеристику качественного и количественного состава данного вещества. — Простые (O2, Сl2) и сложные (h3O, HCl). — Простые вещества состоят из атомов одинаковых химических элементов, а сложные вещества состоят из атомов разных химических элементов. — h3, S Ответы учащихся — h3SO4, AlCl3 Ответы учащихся |
nsportal.ru
| 1. |
Названия химических элементов
Сложность: лёгкое |
1 |
| 2. |
Символы химических элементов
Сложность: лёгкое |
1 |
| 3. |
Химические элементы в природе
Сложность: лёгкое |
1 |
| 4. |
С какой буквы начинается название элемента
Сложность: среднее |
2 |
| 5. |
Как произносятся символы
Сложность: среднее |
2 |
| 6. |
Атомные массы
Сложность: среднее |
2 |
| 7. |
Химический элемент и вещество
Сложность: сложное |
3 |
| 8. |
Определи массу образца
Сложность: сложное |
4 |
| 9. |
Найди число атомов
Сложность: сложное |
4 |
www.yaklass.ru
Основные законы химии — Химия

Основные понятия и законы химии

Содержание
- Основные понятия химии…………………………………. 3
- Состав веществ. Изменение веществ………………… 8
- Основные законы химии………………………………….. 24
- Обозначения, названия и единицы физической величины…………………………………………………………….. 34
- Задания……………………………………………………………. 35

Основные
понятия
химии.

Химия – это наука о составе, строении, свойствах и превращениях веществ.
Вещество – один из видов материи, который характеризуется массой покоя. Это совокупность атомов, ионов или молекул, состоящих из одного или нескольких химических элементов.

Атом – это электронейтральная частица, состоящего из положительно заряженного ядра и отрицательно заряженных электронов. Атом – наименьшая частичка химического элемента, предел химической делимости материи.

Молекула – это отдельная электронейтральная частица, образующаяся при возникновении ковалентных связей между атомами одного или нескольких элементов, которая определяет химические свойства вещества.

Химический элемент – это совокупность атомов с одинаковым зарядом ядра.
Вещества, образованные одним химическим элементом, называют простыми . Один и тот же химический элемент может образовывать несколько простых веществ. Это явление называют аллотропией , а различные простые вещества, образованные одним элементом, — аллотропными видоизменениями , или аллотропными модификациями .

Состав веществ. Изменение веществ.

Простые вещества – это вещества, образованные одним химическим элементом.
Вещества, образованные из двух и более химических элементов, называют сложными . Сложных веществ гораздо больше, чем простых.

Различают в качественный и количественный состав веществ.
Качественный состав – это совокупность химических элементов и (или) атомных группировок, составляющих данное химическое вещество.
Количественный состав – это показатели, характеризующие количество или число атомов того или иного химического элемента и (или) атомных группировок, образующих данное химическое вещество.

Состав веществ отображают посредством химической символики.
По предложению Й. Я. Берцелиуса элементы принято обозначать первой или первой и одной из последующих букв латинских названий элементов.

Химический знак (символ) – несет значительную информацию. Он обозначает название элемента, один его атом, один моль атомов этого элемента. По символу химического элемента можно определить его атомный номер и относительную атомную массу.

Химическая формула – это способ отображения химического состава вещества. Она обозначает название вещества, одну молекулу его, один моль этого вещества. По химической формуле можно определить качественный состав вещества, число атомов и количество вещества каждого элемента в одном моле вещества, его относительную молекулярную и молярную массу.

Формулы вещества составляют на основании еще одного важнейшего понятия в химии – валентности.
Валентность – это способность атомов одного химического элемента соединятся со строго определенным числом атомов другого химического элемента.

Широко используются несколько видов химических формул:
- Простейшая (эмпирическая) формула показывает качественный состав и соотношения, в которых находятся частицы, образующие данное вещество.
- Молекулярная (истинная) формула показывает качественный состав и число составляющих вещество частиц, но не показывает порядок связей частиц в веществе, т. е. его структуру .
- Графическая формула отражает порядок соединения атомов, т. е. связи между ними.

Относительная атомная масса ( ) химического элемента – это величина, показывающая отношение средней массы атома природной изотопной смеси элемента к 1/12 массы атома углерода :
Единая углеродная атомная единица массы (а. е. м.) равна:
1 а. е. м. = кг.

Относительная атомная масса – одна из основных характеристик химического элемента.
Относительная молекулярная масса ( ) равна сумме относительных атомных масс всех атомов, образующих молекулу вещества.

Количество вещества (n или v) характеризуют числом атомов, молекул или других формульных единиц данного вещества.
В Международной системе СИ за единицу количества вещества принят моль.
Моль – это количество вещества, содержащее столько же формульных единиц, сколько атомов содержат 0,012 кг изотопа углерода .


Массу одного моля называют молярной массой и обозначают буквой М:
г/моль.


Молярная масса может быть выражена через число молекул (или атомов) в одном моле вещества ( ) и массу ( ) отдельной молекулы (или атома):
Массу молекулы (атома) в килограммах можно рассчитать по уравнению
следовательно
(кг/моль) =
(кг/моль)

Из этого выражения можно определить число молекул или атомов, содержащихся в одном месте любого вещества, которое называют постоянной Авогадро.
Постоянная Авогадро ( ) – число атомов или молекул (или других формульных единиц), содержащихся в одном моле вещества; она всегда равна

Основные
законы
химии

- Закон сохранения массы.
Был открыт М. В. Ломоносовым и сформулирован А. Лавуазье:
Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции .
Этот закон является одним из основных стехиометрических законов химии.
Посмотреть видеоролик.

Стехиометрия – раздел химии, в котором рассматриваются массовые и объемные соотношения между реагирующими веществами, вывод химических формул и составление уравнений химических реакций.

- Закон постоянства состава вещества.
Сформулирован Ж.-Л. Прустом в 1799 г.:
Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Однако уже в начале XIX в. К. Бертолле показал, что элементы могут соединятся друг с другом в разных соотношениях в зависимости от массы реагирующих веществ.

Современная формулировка закона постоянства состава вещества таков:
Состав соединений молекулярной структуры является постоянным независимо от способа их получения. Состав соединений немолекулярной структуры (с атомной, ионной или металлической кристаллической решеткой) не является постоянным и зависит от способа их получения .

Вещества постоянного состава называют дальтонидами в честь английского физика и химика Дж. Дальтона, а вещества переменного состава – бертоллидами в честь французского химика К. Бертолле.
Посмотреть видеоролик.

- Закон Авогадро.
Сформулирован А. Авогадро в результате проведения многочисленных экспериментов:
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.

Из закона Авогадро вытекают 2 следствия:
- Один моль любого газа при одинаковых условиях занимает один и тот же объем. Этот объем, называемый молярным ( ), при нормальных условиях (давление = 101325 Па и абсолютной температуре = 273,15 К) равен 22,4 л:

- Массы двух разных газов, занимающих одинаковый объем при одинаковых условиях, относятся между собой как их молярные массы
Отношение масс двух газов, занимающих равный объем при одинаковых условиях, называют относительной плотностью одного газа по другому и обозначают буквой D.

Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона).
или
где p – давление;
V – объем газа; m – масса газа;
М – молярная масса газа;
Т – температура;
n – количество вещества газа, моль;
R – универсальная газовая постоянная, значение которой зависит от единиц, в которых измеряют давление и объем.

Основные законы химии

Задания
- Найдите относительные молекулярные массы веществ, состав которых описывается формулами:
- Рассчитайте относительные молекулярные массы медного купороса и кристаллической соды
multiurok.ru