Гидролиз дихромата алюминия Al2(Cr2O7)3
Al2(Cr2O7)3 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Первая ступень (стадия) гидролиза
Молекулярное уравнение
Al2(Cr2O7)3 + 2HOH ⇄ 2AlOHCr2O7 + H2Cr2O7
Полное ионное уравнение
2Al3+ + 3Cr2O72- + 2HOH ⇄ 2AlOH2+ + 2Cr2O72- + 2H+ + Cr2O72-
Сокращенное (краткое) ионное уравнение
Al3+ + HOH ⇄ AlOH2+ + H+
Вторая ступень (стадия) гидролиза
Молекулярное уравнение
2AlOHCr2O7 + 2HOH ⇄ (Al(OH)2)2Cr2O7 + H2Cr2O7
Полное ионное уравнение
2AlOH2+ + 2Cr2O72- + 2HOH ⇄ 2Al(OH)2+ + Cr2O72- + 2H+ + Cr
Сокращенное (краткое) ионное уравнение
AlOH2+ + HOH ⇄ Al(OH)2+ + H+
Третья ступень (стадия) гидролиза
Молекулярное уравнение
(Al(OH)2)2Cr2O7 + 2HOH ⇄ 2Al(OH)3 + H2Cr2O7
Полное ионное уравнение
2Al(OH)2+ + Cr2O72- + 2HOH ⇄ 2Al(OH)3 + 2H+ + Cr2O72-
Сокращенное (краткое) ионное уравнение
Al(OH)2+ + HOH ⇄ Al(OH)3 + H+
В результате гидролиза образовались ионы водорода (H+), поэтому раствор имеет кислую среду (pH < 7).
gomolog.ru
Алюминия бихромат — Справочник химика 21
Смешения частично высушенной отфильтрованной массы с бихроматом калия и свежеосажденной гидроокисью алюминия, содержащей некоторое количество гидроокиси магния, добавляемой для облегчения фильтрации последней. [c.321]Такие окислители, как хроматы н бихроматы, являются плохими катодными деполяризаторами и в то же время сильно пассивируют практически важные металлы (Fe, Al, Zn, u). Достаточно добавить в водопроводную воду 0,1% двухромовокислого калия, чтобы резко снизить скорость коррозии углеродистой стали н алюминия. При содержании в воде сильных активаторов коррозии (например, хлористых солей) концеитрацию бихромата следует увеличить до 2—3%. Хроматы и бихроматы относятся к типу смешанных замедлителей коррозии, но тормозят преимущественной анодный процесс. [c.312]
Действие окислителей и восстановителей. Катионы бария, стронция, кальция, магния, алюминия устойчивы по отношению к окислителям и восстановителям. Ионы марганца, хрома (III), железа (И) и (III) и висмута (III) вступают в реакции окисления и восстановления как в кислой, так и щелочной средах. В щелочной среде хлор, бром, перекись водорода, гипохлорит, двуокись свинца, перманганат окисляют ионы хрома (III) в хромат, а в кислой среде — в бихромат.
Вместо хромового ангидрида можно применять бихромат калия, на 25 г которого следует взять 35 г окиси хрома я 17 г алюминия. [c.32]
Хроматные покрытия наносят на поверхности цинковых, оцинкованных или кадмированных деталей. Применяются они также для защиты от коррозии деталей из магния, меди, алюминия и других металлов. Основным компонентом хро-матных покрытий являются соединения трех- и шестивалентного хрома и хромата металла основы. Тонкие, светлые покрытия состоят преимущественно из соединений трехвалентного хрома, тогда как более толстые слои желтого цвета содержат одновременно соединения трех- и шестивалентного хрома. Процесс хроматирования осуществляется в растворе, содержащем чаще всего хромовый ангидрид, бихромат натрия или калия, небольшие количества серной и азотной кислот, а также активаторы — муравьиную кислоту, хлорное железо, нитрат цинка. [c.129]
Скорость коррозии алюминия можно понизить путем введения в коррозионную среду ингибиторов — жидкого стекла,.спир-та, нитросоединений и растворов лактата натрия в воде, спиртовых растворов нитрата натрия или калия и бихромата калия, а также растворы нитросоединений в аминах и др. [c.124]
В растворы хлорида кальция необходимо вводить 1,6—2,0 кг/м бихромата калия с добавкой 0,8—1,0 кг/м щелочи, чтобы превратить бихромат в хромат. При pH 9 хроматы снижают коррозию углеродистой стали примерно в пять раз [1]. Для рассолов хлорида натрия или смеси хлоридов кальция и магния концентрация бихромата калия должна быть увеличена в два-три раза, т. е. до 3—4 кг/м . Для защиты оборудования из алюминия необходимо вводить в рассол 10 кг/м бихромата калия [20]. Бихромат эффективен и для защиты латуни добавка 2 кг/м бихромата калия обеспечивает защиту латунных образцов в рассоле в течение 5 лет [4].
Определению плутония не мешают уран, молибден, алюминий, бериллий, галлий и, естественно, железо. Мешают марганец и хром, так как перманганат и бихромат, получающиеся в результате окисления двуокисью свинца, прекрасно титруются ионами Fe +. Перманганат может быть предварительно восстановлен щавелевой кислотой до обесцвечивания раствора. Хромат может быть восстановлен до трехвалентного хрома мышьяковистой кислотой, которая не восстанавливает плутоний. [c.239]
Существенное влияние оказывает состав воды и температурно-временной режим обработки поверхности [57]. Например, при обработке алюминия в ванне серная кислота — бихромат натрия с температурой не выше 60 °С образуется прочный слой р-оксида алюминия — АЬОз-ЗНгО [65]. Еслп при последующей промывке водой температура поднимается выще 60°С, то структура оксидной пленки изменяется и образуется слой а-оксида (АЬОз-НгО). При этом прочность соединений, склеенных эпоксидными клеями, существенно снижается. [c.123]
Стадию смешения исходного сырья — гидроксокарбоната меди, гидроксида алюминия и хромовой кислоты — проводят в пластификаторе 2 с паровым обогревом (рис. 3.11). Полученную массу сушат 8—10 ч на ленточной сушилке 3 при 100—120 °С, во вращающейся прокалочной печи 4, обогреваемой топочными газами, при температуре примерно 450 °С в течение 6—8 ч. Прокаленную шихту повторно смешивают со связующей добавкой (бихромат меди с оксидом цинка) в шнековом смесителе 5, подсушивают на ленточной сушилке (5 при 100—110°С в течение 8—10 ч, смешивают в смесителе 7 с графитом и таблетируют на таблеточной машине 8. [c.120]
Ацетилтриэтилцитрат Алюминий Гидрид алюминия Бихромат аммония
Aluniiniumbi hromat n двухромовокислый алюминий, бихромат алюминия, дихромат алюминия, АЬ(Сг 07)а. [c.25]
Недавняя работа Херинттопа и Рапдила [21] содержит много сведений относительно дегидрирования па окиси хрома и подтверждает предположение Баландина и Брусова. Херингтон и Райдил при.готовляли катализатор путем пропитки активирован-но1 1 окиси алюминия бихроматом аммония и разложения последнего нагреванием. Они провели количественное изучение кинетики это 1 реакции, причем продукты реакции анализировались [c.56]
Схема экстракции по методу Редокс приведена на рис. 6-3-9 [353, 391]. Растворителем служит метилизобутилкетон, а высали вающим соединением А1(НОз)з. Для окисления плутония в сыреа вводится бихромат натрия МагСГаО,, количество HNOз меньше, чем необходимое для образования нитрата уранила, что обеспечивает низкий коэффициент распределения для примесей. Промывающей жидкостью в первой колонне служит раствор нитрата алюминия и бихромата натрия. Во вторую колонну вводится восстановитель и образуется Ри , нерастворимый в метилизобутилкетоне, благодаря чему уран и плутоний разделяются. Водный урановый экстракт после концентрации выпариванием еще раз очищается в двух последовательных колоннах. В конечном итоге содержание примесей в уране уменьшается в 10 —10 раз. Содержание Ри в и меньше десяти частей на биллион, а и в Ри— менее 1 %. Выход Ри и и более 99,5 %. [c.435]
Толстослойное анодирование служит противокоррозионной защитой в агрессивных средах, где требуется наряду с высокой коррозионной сто
www.chem21.info
Al + K2Cr2O7 + h3SO4 = ? уравнение реакции
В результате окисления алюминия дихроматом калия в кислой среде, создаваемой серной кислотой (Al + K2Cr2O7 + h3SO4 = ?) происходит образование сульфатов алюминия, хрома (II) и калия, а также воды. Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что простые вещества и вода на ионы не распадаются, т.е. не диссоциируют.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Данная реакция относится к окислительно-восстановительным, поскольку химические элементы хром и алюминий изменяют свои степени окисления. Схемы электронного баланса выглядят следующим образом:
Окисление – это отдача электронов веществом, т.е. повышение степени окисление элемента. Вещества, отдающие свои электроны в процессе реакции, называются восстановителями (в данном случае это алюминий).
Восстановление – это смещение электронов к веществу или понижение степени окисления элемента. Вещества, принимающее электроны, называется окислителем (в данном случае это дихромат калия).
ru.solverbook.com
65. Хроматы и дихроматы
Хроматы – соли хромовой кислоты Н2Сг04, существующей лишь водных растворах с концентрацией не выше 75 %. Валентность хрома в хроматах – 6. Хроматы щелочных металлов и магния имеют хорошую растворимость в воде, а растворимость щелочноземельных металлов очень резко снижается в ряду CaCrO4 – SrCrO4 – BaCrO4 – RaCrO4. Хроматы – желтые кристаллические вещества – желтую окраску обеспечивает хромат-ион Сг042- . Дихроматы – соли дихромовой кислоты Н2Сг07 . В отличие от хроматов, почти все соли-дихроматы хорошо растворимы в воде. Дихроматы имеют ярко-оранжевую окраску, обеспеченную дихромат-ионом: Сг072-. Хромат и дихромат-ионы способны к взаимопревращению в зависимости от кислотности среды: если раствор подкислить, то хромат-ионы будут переходить в дихромат-ионы по схеме:
Если добавить щелочи, то пойдет обратная реакция:
Хроматы получают взаимодействием оксида хрома (VI) или раствора хромовой кислоты h3CrO4 с оксидами, гидроксидами, карбонатами металлов или при обменной реакции с участием растворимых солей-хроматов, или путем окисления комплексных солей – гидроксохроматов в избыточном растворе щелочи:
Хромат калия K2CrO 4 – кристаллы желтого цвета, при нагревании краснеют. Кристаллогидратов не образует. Дихроматы – сильные окислители:
Получают дихроматы из соединений Cr (III) в кислой среде:
Дихромат аммония (Nh5)2Cr2O7 – оранжевые кристаллы, не образует кристаллогидратов. При слабом нагревании он самовоспламеняется с выбросом искр – раскаленных частиц Cr2O3 , N2 и паров воды – «химический вулкан».
Дихромат калия K2Cr2O7?2h3O и Na2Cr2O7 – хромпики, оранжево-красные кристаллы, кристаллогидратов не образует. Используется в пиротехнике, в хроматометрии, в производстве спичек. Смесь равных объемов раствора K2Cr2O7 и концентрированной серной кислоты – хромовая смесь – является очень сильным окислителем, в лабораториях применяется для мытья стеклянной посуды. Хроматы применяются для протравы семян, при крашении, в лакокрасочной, кожевенной (в качестве дубящих реагентов кожи), текстильной промышленности; используются в лабораторном способе разделения хрома-тов кальция, стронция и бария.
Наиболее распространенным в природе, минералом является минерал PbCrO 4 – крокоит . Хромат – тарапакаит и дихромат калия – лопецит – также являются природными минералами.
66. Общая характеристика семейства железа
Семейство железа входит в состав побочной подгруппы восьмой группы и является в ней первой триадой, включающей в себя железо, кобальт и никель . Эти элементы имеют два электрона на наружном слое атома, все они являются металлами. По свойствам все три элемента похожи между собой. Для них характерна степень окисления 2, 3, 4. Реже проявляются более высокие степени окисления. Ни один элемент из семейства железа не проявляет максимальной степени окисления +8. Все металлы триады образуют разнообразные соединения, проявляя степени окисления +2 и +3. Проявление высокой степени окисления и амфотерных свойств характерно для железа.
Температуры плавления элементов триады железа высокие, тем не менее, ниже, чем у элементов, находящихся в серединах серий переходных металлов.
Железо – первый элемент в переходных рядах, имеющий спаренный электрон на внутренней d-орбитали. Спаренные электроны с такой орбитали труднее участвуют в образовании химической связи, чем неспаренные. У триады железа существуют особенности орбитального строения, проявляющиеся в виде магнитных и ферромагнитных свойств. В результате ориентированности атомов металлы образуют постоянные магниты. Все металлы семейства железа проявляют электроположительное поведение. Инертны в среде окислителя, даже кислорода, так как образуют оксидные пленки.
Химические свойства железа:
1) взаимодействует с кислородом при высоких температурах;
2) оксиды в низшей степени окисления MO ;
3) при взаимодействии с галогенами образует галогениды, дигалогениды;
4) образует комплексные соединения;
5) образует карбонилы – соединения, в которых переходный металл образует связь с ионом металла или водорода и координированными карбониловыми группами (пентакарбонил кобальта [Co(CO)5]) ;
6) взаимодействуют с серой и сероводородом при нагревании, образуя сульфиды.
Железо – второй (после алюминия) по распространенности металл, встречается в виде различных руд, пригодных для переработки. Из них получают почти чистый Fe3O4 , который вместе с известняком и коксом используется для выплавки чугуна в доменной печи.
Кобальт выделяют из руд, содержащих много мышьяка и некоторой доли серебра, достаточной для промышленной переработки.
Никель – в руде много примесей: сульфиды никеля, меди и железа. Половина получаемого никеля расходуется в производстве стали для повышения ее коррозионной стойкости и твердости. Он используется также для создания прочных покрытий на стальных изделиях.
studfile.net
65. Хроматы и дихроматы
Хроматы – соли хромовой кислоты Н2Сг04, существующей лишь водных растворах с концентрацией не выше 75 %. Валентность хрома в хроматах – 6. Хроматы щелочных металлов и магния имеют хорошую растворимость в воде, а растворимость щелочноземельных металлов очень резко снижается в ряду CaCrO4 – SrCrO4 – BaCrO4 – RaCrO4. Хроматы – желтые кристаллические вещества – желтую окраску обеспечивает хромат-ион Сг042-. Дихроматы – соли дихромовой кислоты Н2Сг07. В отличие от хроматов, почти все соли-дихроматы хорошо растворимы в воде. Дихроматы имеют ярко-оранжевую окраску, обеспеченную дихромат-ионом: Сг072-. Хромат и дихромат-ионы способны к взаимопревращению в зависимости от кислотности среды: если раствор подкислить, то хромат-ионы будут переходить в дихромат-ионы по схеме:
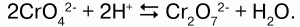
Если добавить щелочи, то пойдет обратная реакция:
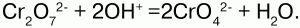
Хроматы получают взаимодействием оксида хрома (VI) или раствора хромовой кислоты h3CrO4 с оксидами, гидроксидами, карбонатами металлов или при обменной реакции с участием растворимых солей-хроматов, или путем окисления комплексных солей – гидроксохроматов в избыточном растворе щелочи:
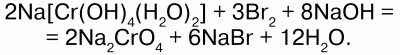
Хромат калия K2CrO4 – кристаллы желтого цвета, при нагревании краснеют. Кристаллогидратов не образует. Дихроматы – сильные окислители:
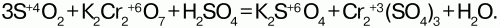
Получают дихроматы из соединений Cr (III) в кислой среде:
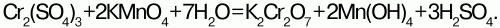
Дихромат аммония (Nh5)2Cr2O7 – оранжевые кристаллы, не образует кристаллогидратов. При слабом нагревании он самовоспламеняется с выбросом искр – раскаленных частиц Cr2O3, N2 и паров воды – «химический вулкан».
Дихромат калия K2Cr2O7?2h3O и Na2Cr2O7 – хромпики, оранжево-красные кристаллы, кристаллогидратов не образует. Используется в пиротехнике, в хроматометрии, в производстве спичек. Смесь равных объемов раствора K2Cr2O7 и концентрированной серной кислоты – хромовая смесь – является очень сильным окислителем, в лабораториях применяется для мытья стеклянной посуды. Хроматы применяются для протравы семян, при крашении, в лакокрасочной, кожевенной (в качестве дубящих реагентов кожи), текстильной промышленности; используются в лабораторном способе разделения хрома-тов кальция, стронция и бария.
Наиболее распространенным в природе, минералом является минерал PbCrO4 – крокоит. Хромат – тарапакаит и дихромат калия – лопецит – также являются природными минералами.
66. Общая характеристика семейства железа
Семейство железа входит в состав побочной подгруппы восьмой группы и является в ней первой триадой, включающей в себя железо, кобальт и никель. Эти элементы имеют два электрона на наружном слое атома, все они являются металлами. По свойствам все три элемента похожи между собой. Для них характерна степень окисления 2, 3, 4. Реже проявляются более высокие степени окисления. Ни один элемент из семейства железа не проявляет максимальной степени окисления +8. Все металлы триады образуют разнообразные соединения, проявляя степени окисления +2 и +3. Проявление высокой степени окисления и амфотерных свойств характерно для железа.
Температуры плавления элементов триады железа высокие, тем не менее, ниже, чем у элементов, находящихся в серединах серий переходных металлов.
Железо – первый элемент в переходных рядах, имеющий спаренный электрон на внутренней d-орбитали. Спаренные электроны с такой орбитали труднее участвуют в образовании химической связи, чем неспаренные. У триады железа существуют особенности орбитального строения, проявляющиеся в виде магнитных и ферромагнитных свойств. В результате ориентированности атомов металлы образуют постоянные магниты. Все металлы семейства железа проявляют электроположительное поведение. Инертны в среде окислителя, даже кислорода, так как образуют оксидные пленки.
Химические свойства железа:
1) взаимодействует с кислородом при высоких температурах;
2) оксиды в низшей степени окисления MO;
3) при взаимодействии с галогенами образует галогениды, дигалогениды;
4) образует комплексные соединения;
5) образует карбонилы – соединения, в которых переходный металл образует связь с ионом металла или водорода и координированными карбониловыми группами (пентакарбонил кобальта [Co(CO)5]);
6) взаимодействуют с серой и сероводородом при нагревании, образуя сульфиды.
Железо – второй (после алюминия) по распространенности металл, встречается в виде различных руд, пригодных для переработки. Из них получают почти чистый Fe3O4, который вместе с известняком и коксом используется для выплавки чугуна в доменной печи.
Кобальт выделяют из руд, содержащих много мышьяка и некоторой доли серебра, достаточной для промышленной переработки.
Никель – в руде много примесей: сульфиды никеля, меди и железа. Половина получаемого никеля расходуется в производстве стали для повышения ее коррозионной стойкости и твердости. Он используется также для создания прочных покрытий на стальных изделиях.
studfile.net
Хроматы защита алюминия — Справочник химика 21
Хроматные покрытия наносят на поверхности цинковых, оцинкованных или кадмированных деталей. Применяются они также для защиты от коррозии деталей из магния, меди, алюминия и других металлов. Основным компонентом хро-матных покрытий являются соединения трех- и шестивалентного хрома и хромата металла основы. Тонкие, светлые покрытия состоят преимущественно из соединений трехвалентного хрома, тогда как более толстые слои желтого цвета содержат одновременно соединения трех- и шестивалентного хрома. Процесс хроматирования осуществляется в растворе, содержащем чаще всего хромовый ангидрид, бихромат натрия или калия, небольшие количества серной и азотной кислот, а также активаторы — муравьиную кислоту, хлорное железо, нитрат цинка. [c.129]Бест и Мак-Грю [147] исследовали влияние прерывистого контакта различных металлов с рассолами хлорида натрия и хлорида кальция. Они обнаружили, что прибавление 1 % хромата натрия (от твердого хлорида кальция или натрия) эффективно снижает скорость коррозии. Такое же количество бихромата натрия (т. е. более низкое значение pH) является менее эффективным, но все же действует как ингибитор. В случае хромата расходуется меньшее количество шестивалентного хрома. Для защиты алюминия марки 758 от агрессивного действия рассола оказалось достаточным прибавление 0,5% раствора хромата. Добавка хромата в количестве 0,5% к любому из рассматриваемых рассолов достаточна для предупреждения коррозии магниевых сплавов. [c.176]
Хроматы как анодные ингибиторы способны при неполной защите увеличивать интенсивность коррозии, что можно видеть из рис. 5,1. Зависимость интенсивности коррозии от концентрации хромата калия выражается кривой с максимумом. Иными словами, имеется критическая концентрация, ниже которой интенсивность коррозии непрерывно возрастает с концентрацией ингибитора. При увеличении концентрации ингибитора за критическое значение интенсивность коррозии начинает падать и при 0,062 моль/л достигается полная защита. Бихромат калия, а также другие неорганические хроматы изменяют общую коррозию и ее интенсивность по такому же закону, как и хромат калия. Однако защитная концентрация у бихромата как более кислого реагента для стали почти в 3 раза выше, чем у хромата. Для алюминия же более эффективен бихромат. Защитные концентрации хроматов по отношению к стали [c.157]
Контакт стали с более благородными металлами понижает защитное действие хромата и бихромата. Чтобы осуществить защиту от коррозии конструкции, состоящей из различных металлов, необходимы ббльшие добавки хроматов по сравнению с теми, что применяются для защиты от коррозии чистой стали. Так, если конструкция состоит из стали, меди и алюминия, то в водопроводной воде, содержащей до 30, г/л хлоридов, сталь будет анодом, а медь и алюминий — катодами. Полностью прекратить коррозию элементов такой конструкции удается при создании pH воды 8—9 и при применении увеличенного количества бихромата калия. Если температура воды повышена до 80—100 °С, то вместе с бихроматом калия нужно ввести высокомодульный силикат. [c.85]
Хроматы как анодные ингибиторы способны при неполной защите увеличивать интенсивность коррозии, т. е. существует критическая концентрация, ниже которой интенсивность коррозии непрерывно возрастает. При увеличении концентрации хромата сверх критической интенсивность коррозии начинает снижаться, и при концентрации 0,062 моль/л достигается полная защита. Бихромат калия, а также другие неорганические хроматы изменяют общую коррозию и ее интенсивность по такому же закону, как и хромат калия. Однако защитная концентрация. у бихромата как более кислого реагента для стали почти в 3 раза выше, чем у хромата. Для алюминия же более эффективен бихромат. [c.127]
Антикоррозионная бумага марки ХЦА 14-80 на основе хромата циклогексиламина обеспечивает защиту от атмосферной коррозии меди и ее сплавов, стали различных марок, алюминия и его сплавов на срок 3—5 лет. Однако бумага марки ХЦА не защищает цинк и кадмий, что является наряду с относительно высокой токсичностью существенным недостатком указанного вида антикоррозионной бумаги, препятствующим ее использованию для консервации и упаковки большинства современных изделий, для которых широко используется кадмирование поверхности. Технология производства антикоррозионной бумаги ХЦА практически не отличается от таковой для бумаги марки НДА и имеет присущие последней недостатки, связанные с нанесением хромата циклогексиламина на [c.123]
Хроматирование применяют на цинке, алюминии, магнии и латуни. Обработку проводят, используя водный раствор хромовой кислоты или хромата, часто содержащий другие добавки, например фосфорную и соляную кислоты. На поверхности образуется тонкое (0,1-2,0 г/м ) хроматное покрытие зеленого, желтого, черного или бледно-голубого цвета, которое заметно улучшает ее коррозионную стойкость. Хроматирование широко применяют для оцинкованной стали с целью защитить ее от образования белой ржавчины во время транспортировки и хранения. Его значительное неудобство состоит, однако, в том, что у работающих с некоторыми типами хроматированных материалов, может возникнуть аллергическая экзема в результате контакта с шестивалентным хромом. Другое неудобство состоит в том, что такие средства защиты от белой ржавчины труднее удаляются и могут впоследствии затруднить окрашивание. В настоящее время предпринимают значительные усилия чтобы разработать эффективную защиту против белой ржавчины, не имеющую недостатков свойственных хроматированию. [c.84]
В растворы хлорида кальция необходимо вводить 1,6—2,0 кг/м бихромата калия с добавкой 0,8—1,0 кг/м щелочи, чтобы превратить бихромат в хромат. При pH 9 хроматы снижают коррозию углеродистой стали примерно в пять раз [1]. Для рассолов хлорида натрия или смеси хлоридов кальция и магния концентрация бихромата калия должна быть увеличена в два-три раза, т. е. до 3—4 кг/м . Для защиты оборудования из алюминия необходимо вводить в рассол 10 кг/м бихромата калия [20]. Бихромат эффективен и для защиты латуни добавка 2 кг/м бихромата калия обеспечивает защиту латунных образцов в рассоле в течение 5 лет [4]. [c.330]
Коррозия таких металлов, как сталь, алюминий, медь и их сплавы, используемых для изготовления замкнутых водных циркуляционных систем, обусловлена преимущественно действием О2 и 04, растворенных в воде. Защита от коррозии путем удаления кислорода (добавлением гидразина или сульфита) невозможна для открытых водных охлаждающих систем. Обычно в качестве ингибиторов используют хроматы или полифосфаты, хотя использование весьма эффективных хроматов встречает серьезные возражения вследствие их токсичности. Полифосфаты добавляются в охлаждающие водные системы не только для защиты
www.chem21.info
ХРОМАТЫ И ДИХРОМАТЫ | Энциклопедия Кругосвет
ХРОМАТЫ И ДИХРОМАТЫ. Хроматы – соли не существующей в свободном состоянии хромовой кислоты H2CrO4, получаемой лишь в виде водных растворов с концентрацией не выше 75%. Их получают при взаимодействии оксида хрома(VI) или раствора хромовой кислоты H2CrO4 с оксидами, гидроксидами, карбонатами металлов или при обменной реакции с участием растворимых солей-хроматов. Хорошо растворяются в воде хроматы щелочных металлов и магния, а для щелочноземельных металлов растворимость настолько резко снижается в ряду CaCrO4 – SrCrO4 – BaCrO4 – RaCrO4, что на этом удалось построить лабораторный способ разделения кальция, стронция и бария: хромат кальция не выпадает в осадок из миллимолярных (0,001 моль/л) растворов, а осадок хромата стронция, в отличие от хромата бария, растворяется под действием уксусной кислоты.
Кристаллические хроматы и их растворы в воде имеют желтый цвет. При их подкислении, например, добавлением небольшого количества разбавленной серной кислоты ионы CrO42- превращаются в дихроматные ионы Cr2O72-, отщепляя воду, и приобретают оранжевый цвет:
2CrO42- + 2 H3O+ Cr2O72- + 3H2O
Cr2O72- + 3H2O
В отличие от хроматов, почти все соли-дихроматы хорошо растворимы в воде. Дихроматы – сильные окислители. В кислой среде для них характерна полуреакция:
Cr2O72- + 14H+ + 6 е— = 2Cr3+ + 7H2O,
где каждый атом хрома(+VI) в анионе принимает по три электрона и превращается в катион Cr3+, тотчас же присоединяющий к себе молекулы воды, переходя в гексааквакатион. Раствор при этом становится зеленым.
Особые свойства у дихромата аммония: он легко разлагается. При слабом нагревании дихромат аммония (NH4)2Cr2O7 самовоспламеняется с выбрасыванием искр (этот опыт называют химическим вулканом) – раскаленных частичек оксида хрома(III) Cr2O3, газообразного азота N2 и паров воды. Хромат калия K2CrO4 плавится без разложения при 968° С, а дихромат калия K2Cr2O7 разлагается в соответствии с уравнением реакции:
4K2Cr2O7 = 4K2CrO4 + 2 Cr2O3 + 3O2
Наиболее широко применяются хромат и дихромат калия и дихромат аммония.
Хромат калия K2CrO4 – кристаллы желтого цвета, при нагревании краснеют. Кристаллогидратов не образует. Плотность 2,732 г/см3, температура плавления 968,3° С, растворимость при 20° С составляет 63,0 г/100 г воды.
Дихромат калия K2Cr2O7 – оранжево-красные кристаллы, кристаллогидратов не образует, плотность 2,684 г/см3, плавится при 397° С (дальнейшее нагревание расплава ведет к разложению), растворимость при 20° С равна 12,48 г соли на 100 г воды. Техническое название дихромата калия K2Cr2O7 — хромпик. Широко используется как окислитель в спичечной промышленности, пиротехнике и как реагент в хроматометрии.
Хроматометрия (точнее – дихроматометрия) – объемный (титриметрический) метод химического анализа (см. ТИТРОВАНИЕ), основанный на применении раствора K2Cr2O7 определенной концентрации и позволяющий определить содержание восстановителей и некоторых катионов металлов.
Смесь равных объемов насыщенного на холоде раствора K2Cr2O7 и концентрированной серной кислоты (хромовая смесь) обладает очень сильным окислительным действием и применяется в лабораториях для мытья химической посуды.
Дихромат аммония также не образует кристаллогидратов, но разлагается при нагревании. Это оранжевые кристаллы с плотностью 2,15 г/см3 и растворимостью 35,6 г/100 г воды (при 20° С). Удобный исходный реагент для получения высокочистого оксида хрома(III) (стойкий зеленый пигмент и составная часть некоторых катализаторов и известной смеси для полировки оптики – пасты ГОИ). Кроме того, дихромат аммония применяется как компонент светочувствительного слоя фотоматериалов и ряда пиротехнических составов, консервант древесины, окислитель в органическом синтезе и отбеливатель для жиров, воска и парафина.
Хроматы применяются также в качестве протравы при крашении, дубящих реагентов в кожевенном производстве, для протравы семян (K2CrO4), ингибиторов коррозии (CaCrO4, BaCrO4, ZnCrO4), пигментов (баритовый желтый BaCrO4, желтый крон PbCrO4, красный крон Pb2CrO5) а также выступают в роли компонентов материалов для термохромных датчиков.
Хроматы встречаются в природе, в первую очередь это, например, минерал крокоит PbCrO4. Именно этот минерал, привезенный во Францию с Урала («сибирский красный свинец»), послужил в 1797 сырьем для получения оксида хрома, из которого Никола Воклен впервые выделил новый элемент – хром. Другие хроматные минералы – лопецит (дихромат калия, калиевый хромпик), и тарапакаит (хромат калия) распространены значительно меньше.
Любовь Аликберова
www.krugosvet.ru