АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ — Студопедия
Тема лекции: ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ.
План:
МЕСТО ХИМИИ СРЕДИ ДРУГИХ НАУК
ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
ОСНОВНЫЕ ГАЗОВЫЕ ЗАКОНЫ
ХИМИЧЕСКИЙ ЭКВИВАЛЕНТ. ЗАКОН ЭКВИВАЛЕНТНЫХ ОТНОШЕНИЙ
ХИМИЧЕСКИЕ РЕАКЦИИ. КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
МЕСТО ХИМИИ СРЕДИ ДРУГИХ НАУК
Химия относится к естественным наукам, изучающим окружающий нас материальный мир, его явления и законы.
Основным законом природы является закон вечности материи и ее движения. Отдельные формы движения материи изучаются отдельными науками. Место химии, имеющей дело главным образом с молекулярным (и атомным) уровнем организации материи, между физикой элементарных частиц (субатомный уровень) и биологией (надмолекулярный уровень).
Химия— наука о веществах, их составе, строении, свойствах и превращениях, связанных с изменением состава, строения и свойств образующих их частиц.
Великий русский ученый М. В. Ломоносов сказал: «Широко простирает химия руки свои в дела человеческие». Действительно, практически нет ни одной технической дисциплины, которая могла бы обойтись без знаний химии. Даже такие современные и далекие, казалось бы, от химии науки, как электроника, информатика, сегодня получили новый импульс в своем развитии, заключив «союз» с химией (запись информации на молекулярном уровне, разработка биокомпьютеров и др.). Что тогда говорить о фундаментальных дисциплинах: физике, биологии и др., где давно существуют самостоятельные разделы, пограничные с химией (химическая физика, биохимия, геохимия и пр.).
ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
Представление об атомах, как конструкционных элементах вещественного мира, зародилось еще в древней Греции (Левкипп, Демокрит, 1У-Ш вв. до н. э.). Но только в конце XVIII — начале XIX в. было создано атомно-молекулярное учение. Важнейший вклад в обобщение накопленного материала был сделан М. В. Ломоносовым.
Атомно-молекулярное учение включает в себя следующие основные положения:
1. Все вещества не являются сплошными, а состоят из частиц (молекул, атомов, ионов).
2. Молекулы состоят из атомов (элементов).
3. Различия между веществами определяются различиями образующих их частиц, которые отличаются друг от друга составом, строением и свойствами.
4. Все частицы находятся в постоянном движении, скорость которого увеличивается при нагревании.
Атом — наименьшая частица химического элемента, являющаяся носителем его свойств. Это электронейтральная микросистема, поведение которой подчиняется законам квантовой механики.
Химический элемент — вид атомов, имеющих одинаковый положительный заряд ядра и характеризующихся определенной совокупностью свойств.
Изотопы — атомы одного элемента, различающиеся массой (количеством нейтронов в ядре).
Любой химический элемент в природе представлен определенным изотопным составом, поэтому его масса рассчитывается как некоторая средняя величина из масс изотопов с учетом их содержания в природе.
Молекула — наименьшая частица вещества, являющаяся носителем его свойств и способная к самостоятельному существованию.
Простое вещество — вещество, молекулы которого состоят только из атомов одного элемента.
Аллотропия — способность элемента образовать простые вещества, имеющие различный состав, строение и свойства.
Разновидности аллотропных модификаций определяются:
• различным числом атомов элемента в составе молекулы простого вещества, например, кислород (О2) и озон (О3).
• различиями в строении кристаллической решетки простого вещества, например, соединения углерода: графит (плоская, или двумерная, решетка) и алмаз (объемная, или трехмерная решетка).
Сложное вещество — вещество, молекулы которого состоят из атомов разных элементов.
Сложные вещества, состоящие только из двух элементов, называются бинарными, например:
Ø оксиды: CO, CO2, CaO, Na2O, FeO, Fe2O3;
Ø галогениды: NaCl, CaF2, FeBr3;
Ø сульфиды: ZnS, Na2S, CS2;
Ø гидриды: CaH2, LiH, NaH;
Ø нитриды: Li3N, Ca3N2, AlN;
Ø фосфиды: Li3P, Mg3P2, AlP;
Ø карбиды: Be2C, Al4
Ø силициды: Ca2Si, Na4Si.
Сложные соединения, состоящие более чем из двух элементов, относятся к основным классам неорганических соединений. Это гидроксиды (кислоты и основания) и соли, в том числе комплексные соединения.
Атомы и молекулы имеют абсолютную массу, например, масса атома С12 равна 2·10-26 кг.
Такими величинами пользоваться на практике неудобно, поэтому в химии принята относительная шкала масс.
Атомная единица массы (а. е. м.) равна 1/12 массы изотопа С12.
Относительная атомная масса (Аr — безразмерная величина) равна отношению средней массы атома к а. е. м.
Относительная молекулярная масса (Мr — безразмерная величина) равна отношению средней массы молекулы к а. е. м.
Моль (ν — «ню» или n) — количество вещества, содержащее столько же структурных единиц (атомов, молекул или ионов), сколько атомов содержится в 12 г изотопа С 12.
Число Авогадро — число частиц (атомов, молекул, ионов и др.), содержащееся в 1 моле любого вещества.
NA = 6,02·1023.
Более точные значения некоторых фундаментальных констант приводятся в таблицах приложения.
Молярная масса вещества (М) — это масса 1 моля вещества. Она рассчитывается как отношение массы вещества к его количеству:
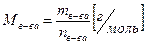 (1)
(1)
Молярная масса численно равна Аr (для атомов) или Мr (для молекул).
Из уравнения 1 можно определить количество вещества, если известны его масса и молярная масса:

Молярный объем (Vm для газов) — объем одного моля вещества. Рассчитывается как отношение объема газа к его количеству:
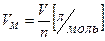 (3)
(3)
Объем 1 моля любого газа при нормальных условиях (Р = 1 атм = 760 мм. рт. ст. = 101,3 кПа; T = 273ТС = 0°С) равен 22,4 л.
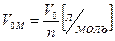 (4)
(4)
Плотность вещества равна отношению его массы к объему.
 (5)
(5)
Атомно-молекулярное учение — Википедия
Атомно-молекулярное учение — совокупность теоретических представлений естествознания о дискретном строении веществ.
В развитие атомно-молекулярного учения большой вклад внесли М. В. Ломоносов, Дж. Дальтон, А. Лавуазье, Ж. Пруст, А. Авогадро, Й. Берцелиус, Д. И. Менделеев, А. М. Бутлеров.
История
Античная атомистика
Представление о том, что материя состоит из отдельных частиц — атомов возникло ещё в древней Греции в V в. до н. э. Атомизм был создан представителями древнегреческой философии Левкиппом (500—440 до н. э.) и его учеником Демокритом (460—370 до н. э.).
Левкипп задался вопросом, можно ли каждую частичку материи, какая бы малая она ни была, разделить на еще более мелкие частицы. Левкипп считал, что в результате такого давления можно получить настолько малую частицу, что дальнейшее деление станет невозможным.
Ученик Левкиппа философ Демокрит назвал эти крошечные частицы «атомами» (атмос-неделимый). Он считал, что атомы каждого элемента имеют особые размеры и форму и что именно этим объясняются различия в свойствах веществ. Вещества, которые мы видим и ощущаем, образуется при соединение между собой атомов различных элементов, и, изменив природу этого соединения, можно одно вещество превратить в другое.
Становление атомистической гипотезы в XVI—XVIII веках
Атомистическая теория Дальтона
Перечень символов химических элементов и их атомных весов Дж. Дальтона (1808)Создание научной теории стало возможно только в XVIII-XIX веках, когда физика и химия стали базироваться на точных экспериментальных данных.
Экспериментальное подтверждение атомной гипотезы нашёл английский химик Джон Дальтон. В начале XIX века Дальтон открыл несколько новых эмпирических закономерностей: закон парциальных давлений (закон Дальтона), закон растворимости газов в жидкостях (закон Генри-Дальтона) и, наконец, закон кратных отношений (1803). Объяснить эти закономерности (прежде всего закон кратных отношений), не прибегая к предположению о дискретности материи, невозможно. В 1808 году Дальтон изложил свою атомистическую гипотезу в труде «Новая система химической философии».
Основные положения теории Дальтона состояли в следующем (в основе атомно-молекулярного учения лежит принцип дискретности (прерывности строения) веществ)[1]:
- Всякое вещество не является чем-то сплошным, а состоит из отдельных очень малых частиц — все вещества состоят из большого числа атомов (простых или сложных).
Различие между веществами обусловлено различием между их частицами - Атомы одного вещества полностью тождественны. Простые атомы абсолютно неизменны и неделимы.
- Частицы (атомы) различных веществ различны — как по массе, так и по свойствам
- Атомы различных элементов способны соединяться между собой в определённых соотношениях.
- Важнейшим свойством атомов является атомный вес.
Уже в 1803 году в лабораторном журнале Дальтона появилась первая таблица относительных атомных весов некоторых элементов и соединений (атомный вес водорода был принят равным единице). Дальтон ввёл символы химических элементов в виде окружностей с различными фигурами внутри. Впоследствии Дальтон неоднократно корректировал атомные веса элементов, однако для большинства элементов им приводились неверные значения.
Эпоха классической химии
Основные положения
Атомно-молекулярная теория базируется на следующих законах и утверждениях:
- Все вещества состоят из атомов
- Атомы одного химического вещества (химический элемент) обладают одинаковыми свойствами, но отличаются от атомов другого вещества
- При взаимодействии атомов образуются молекулы (гомоядерные — простые вещества, гетероядерные — сложные вещества)
- При физических явлениях молекулы не изменяются, при химических происходит изменение их состава
- Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состояли исходные вещества
- Закон сохранения массы — масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции
- Закон постоянства состава (закон кратных отношений) — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами
- Аллотропия — существование одного и того же химического элемента в виде нескольких простых веществ, различных по строению и свойствам.
Вытекающие законы и положения
Согласно современным квантово-механическим представлениям, у атомов в молекуле более или менее неизменным остается только остов, то есть ядро и внутренние электронные оболочки, тогда как характер движения внешних (валентных) электронов коренным образом изменяется так, что образуется новая (как бы отдельная), молекулярная электронная оболочка, охватывающая всю молекулу (см. Химическая связь). В этом смысле никаких неизменных атомов в молекулах нет.
Доказательство существования атомов и молекул
Теории Левкипп и Демокрита об атомах не была подтверждена эксперементально, поскольку древние греки вообще не проводили экспериментов, они ставили размышления выше наблюдений.
Первый эксперимент, подтверждающий атомную природу вещества, был проведен лишь спустя 2000 лет. В 1662 г. ирландский химик Роберт Бойль (1627—1691) при сжатии воздуха в U-образной трубке под давлением столбика ртути обнаружил, что объем воздуха в трубке обратно пропорционален давлению:
- p V = C o n s t {\displaystyle pV=Const}
Французский физик Эдм Мариотт (1620—1684) подтвердил это соотношение через 14 лет после Бойля и заметил, что оно выполняется только при постоянной температуре.
Результаты, полученные Бойлем Мариоттом, можно объяснить, только если признать, что воздух состоит из атомов, между которыми имеется пустое пространство. Сжатие воздуха обусловлено сближением атомов и уменьшением объема пустого пространства.
См. также
Примечания
Литература
- Начала химии / Н.Е.Кузьменко.: В.В.Еремин, В.А.Попков. — М.: Лаборатория знаний, 2016. — 704 с. — ISBN 978-5-906828-17-0.
Онлайн урок: Атомы. Молекулы по предмету Химия 8 класс
Теперь, когда мы можем обозначать массы атомов, мы также можем обозначать и массы молекул.
Очевидно, что масса молекулы – это сумма масс всех составляющих её атомов.
Относительную молекулярную массу веществ рассчитывают по химическим формулам, выражающим их состав.
О химических формулах говорилось в одном из предыдущих уроков.
По химической формуле вещества мы также можем вычислить массовые доли элементов в химических соединениях.
Для чего это нужно? Знание процентного состава вещества помогает химикам в правильных пропорциях смешивать реактивы для проведения эксперимента; пиротехникам – верно смешать компоненты для получения эффектного фейерверка; агрономам – правильно рассчитать количество удобрений для внесения в почву строго определенного количества минерала: азота, фосфора, калия – ведь они содержатся в удобрении в виде соединений.


В этих и многих других случаях от правильного расчёта зависит успешность всего мероприятия.
В химических лабораториях на основе результатов анализа химических соединений определяют формулы исследуемых веществ.
Чаще всего для этого неизвестное вещество разрушают (например, нагреванием или сжиганием) для получения более простых веществ, состав которых уже известен.
После этого определяют массы этих самых веществ (продуктов реакции) и по ним находят химическую формулу неизвестного вещества.
Например, если сжечь лист бумаги, мы получим пары воды, углекислый газ, азот и пепел.
Мы знаем, сколько водорода содержится в воде, углерода в углекислом газе.
Собрав и взвесив все эти продукты реакции, мы сможем составить формулу целлюлозы – вещества, из которого состоит бумага.
Конечно, это пояснение очень упрощённое, но сама суть, надеемся, вам ясна.
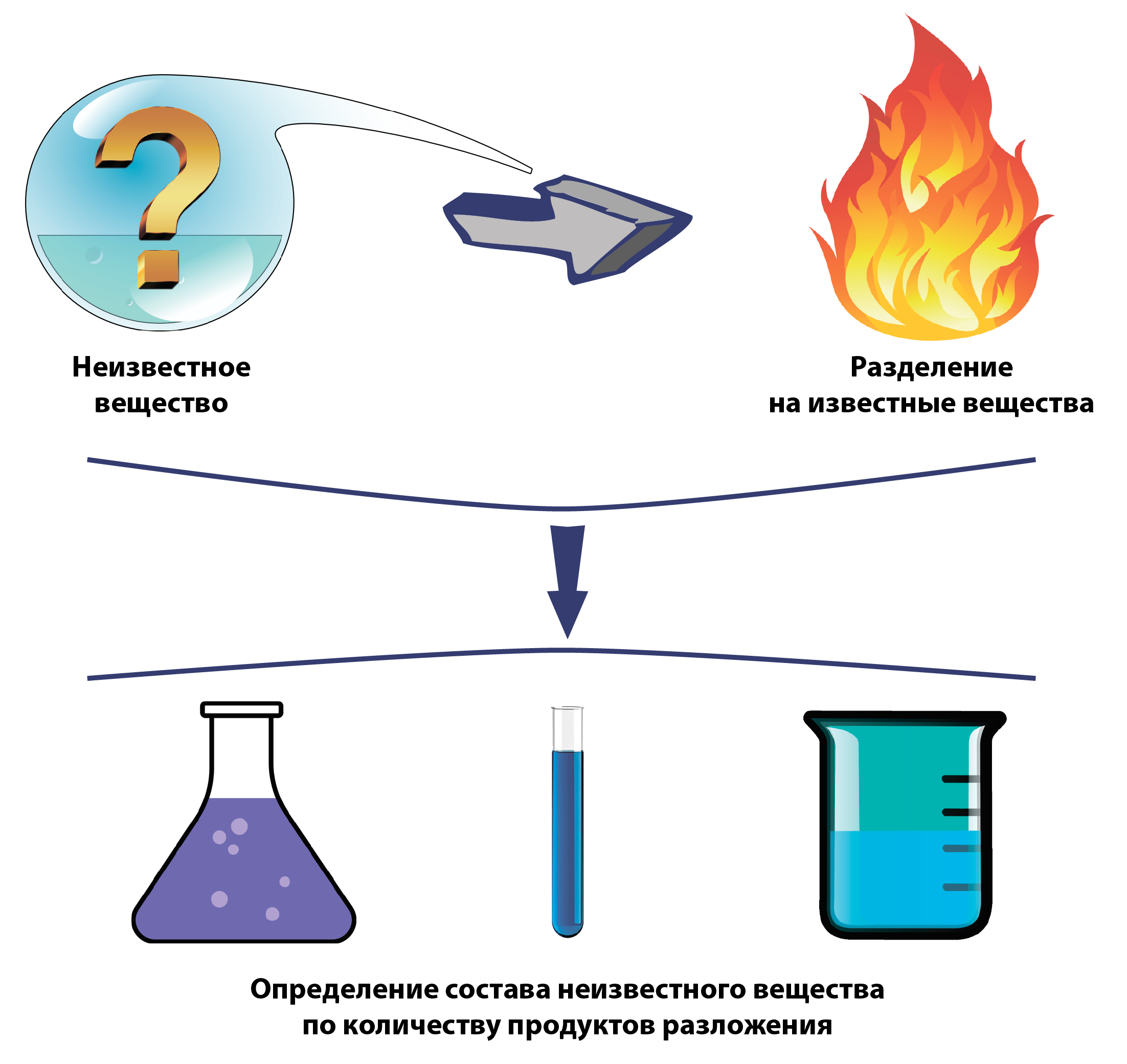
Этот способ основан на Законе постоянства состава, который впервые сформулировал уже упомянутый нами М. В. Ломоносов.
«Ничто не берётся из ниоткуда и не исчезает бесследно», – говорил он.
К настоящему времени формулировка этой фразы почти не изменилась.
Химические символы и формулы не только обозначают определенный химический элемент или вещество, но и несут большую информацию об обозначаемом объекте.
Химический символ обозначает химический элемент или отдельный атом элемента.
По нему можно определить место элемента в периодической системе Д. И. Менделеева, а отсюда и значение его относительной атомной массы.
А зная положение элемента в периодической системе, химик может сказать о нём очень и очень многое.
Атомы, молекулы. Атомно-молекулярное учение в химии и его значение.
Краткосрочный план
Қысқамерзімді жоспар
ФИО учителя, стаж, категория (мұғалімнің аты-жөні, еңбек өтілі, санаты) Нугуманова К. А., 4 года, 2 категория
Класс (сынып): 8
Дата проведения (өткізілген күні): 07.09.2015
Тема урока (сабақтың тақырыбы): Атомы, молекулы. Атомно-молекулярное учение в химии и его значение.
Задачи (сабақтың міндеттері)
— Дать представление об атомах и молекулах периодичности изменения свойств элементов в главных подгруппах;
— закрепить полученные знания о попытках классификации
— Развивать критическое мышление на уроках;
— Воспитывать умение работы в парах.
Тип урока (сабақтың типі): изучения нового материала
Вид урока (сабақтың түрі): комбинированный
Ресурсы (ресурстар): ИКТ, презентация
Этап
Кезең
Цель
Мақсат
Деятельность учителя
Мұғалімнің әрекеті
Деятельность учащихся
Оқушылардың әрекеті
Идеи семи модулей
Жеті модульдің идеялары
Результат
Нәтижесі
Время
Уақыт
Побуждение.
Создание благоприятного климата в классе.
Письменный опрос.
Постановка совместных целей и задач на урок.
Наблюдает и координирует работу учащихся
Работа впарах по терминам:
Перекристаллизация, перегонка, отстаивание, смеси, однородные, неоднородные смеси, чистые вещества, фильтрат.
Диалоговое обучение, критическое мышление, ОДО и ОО, ОТиО
Мотивация, совместное целеполагание.
работа в парах
5 мин
Презентация
Знакомство с атомами и молекулами
На основе изученных знаний п физике дать представление атомам и молекулам
Обсуждение
Диалоговое обучение
5 мин
Знакомство с атомно-молекулярным учением
Знакомит с учеными и положениями АМУ
Запись в тетрадях, обсуждение
Диалоговое обучение, критическое мышление
Будут знать основные положения АМУ
12 мин
Применение
Научить решать задачи
Работа с рабочими тетрадями
Выполняют задания в парах или группах
ИКТ, критическое мышление
Могут различать атомы и молекулы, и определять состав молекул
20 мин
Рефлексия
Научить самооценивать свою работу. Давать рефлексию уроку.
Подведение итогов урока. Что понравилось? Что узнал (а)?
Учащиеся отвечают на вопросы без затруднений.
Диалоговое обучение, критическое мышление
Умеют самооценивать свою работу на уроке.
3 мин
Атомно-молекулярное учение — Википедия. Что такое Атомно-молекулярное учение
Атомно-молекулярное учение — совокупность теоретических представлений естествознания о дискретном строении веществ.
В развитие атомно-молекулярного учения большой вклад внесли М. В. Ломоносов, Дж. Дальтон, А. Лавуазье, Ж. Пруст, А. Авогадро, Й. Берцелиус, Д. И. Менделеев, А. М. Бутлеров.
История
Античная атомистика
Представление о том, что материя состоит из отдельных частиц — атомов возникло ещё в древней Греции в V в. до н. э. Атомизм был создан представителями древнегреческой философии Левкиппом (500—440 до н. э.) и его учеником Демокритом (460—370 до н. э.).
Левкипп задался вопросом, можно ли каждую частичку материи, какая бы малая она ни была, разделить на еще более мелкие частицы. Левкипп считал, что в результате такого давления можно получить настолько малую частицу, что дальнейшее деление станет невозможным.
Ученик Левкиппа философ Демокрит назвал эти крошечные частицы «атомами» (атмос-неделимый). Он считал, что атомы каждого элемента имеют особые размеры и форму и что именно этим объясняются различия в свойствах веществ. Вещества, которые мы видим и ощущаем, образуется при соединение между собой атомов различных элементов, и, изменив природу этого соединения, можно одно вещество превратить в другое.
Становление атомистической гипотезы в XVI—XVIII веках
Атомистическая теория Дальтона
Перечень символов химических элементов и их атомных весов Дж. Дальтона (1808)Создание научной теории стало возможно только в XVIII-XIX веках, когда физика и химия стали базироваться на точных экспериментальных данных.
Экспериментальное подтверждение атомной гипотезы нашёл английский химик Джон Дальтон. В начале XIX века Дальтон открыл несколько новых эмпирических закономерностей: закон парциальных давлений (закон Дальтона), закон растворимости газов в жидкостях (закон Генри-Дальтона) и, наконец, закон кратных отношений (1803). Объяснить эти закономерности (прежде всего закон кратных отношений), не прибегая к предположению о дискретности материи, невозможно. В 1808 году Дальтон изложил свою атомистическую гипотезу в труде «Новая система химической философии».
Основные положения теории Дальтона состояли в следующем (в основе атомно-молекулярного учения лежит принцип дискретности (прерывности строения) веществ)[1]:
- Всякое вещество не является чем-то сплошным, а состоит из отдельных очень малых частиц — все вещества состоят из большого числа атомов (простых или сложных).
Различие между веществами обусловлено различием между их частицами - Атомы одного вещества полностью тождественны. Простые атомы абсолютно неизменны и неделимы.
- Частицы (атомы) различных веществ различны — как по массе, так и по свойствам
- Атомы различных элементов способны соединяться между собой в определённых соотношениях.
- Важнейшим свойством атомов является атомный вес.
Уже в 1803 году в лабораторном журнале Дальтона появилась первая таблица относительных атомных весов некоторых элементов и соединений (атомный вес водорода был принят равным единице). Дальтон ввёл символы химических элементов в виде окружностей с различными фигурами внутри. Впоследствии Дальтон неоднократно корректировал атомные веса элементов, однако для большинства элементов им приводились неверные значения.
Эпоха классической химии
Основные положения
Атомно-молекулярная теория базируется на следующих законах и утверждениях:
- Все вещества состоят из атомов
- Атомы одного химического вещества (химический элемент) обладают одинаковыми свойствами, но отличаются от атомов другого вещества
- При взаимодействии атомов образуются молекулы (гомоядерные — простые вещества, гетероядерные — сложные вещества)
- При физических явлениях молекулы не изменяются, при химических происходит изменение их состава
- Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состояли исходные вещества
- Закон сохранения массы — масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции
- Закон постоянства состава (закон кратных отношений) — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами
- Аллотропия — существование одного и того же химического элемента в виде нескольких простых веществ, различных по строению и свойствам.
Вытекающие законы и положения
Согласно современным квантово-механическим представлениям, у атомов в молекуле более или менее неизменным остается только остов, то есть ядро и внутренние электронные оболочки, тогда как характер движения внешних (валентных) электронов коренным образом изменяется так, что образуется новая (как бы отдельная), молекулярная электронная оболочка, охватывающая всю молекулу (см. Химическая связь). В этом смысле никаких неизменных атомов в молекулах нет.
Доказательство существования атомов и молекул
Теории Левкипп и Демокрита об атомах не была подтверждена эксперементально, поскольку древние греки вообще не проводили экспериментов, они ставили размышления выше наблюдений.
Первый эксперимент, подтверждающий атомную природу вещества, был проведен лишь спустя 2000 лет. В 1662 г. ирландский химик Роберт Бойль (1627—1691) при сжатии воздуха в U-образной трубке под давлением столбика ртути обнаружил, что объем воздуха в трубке обратно пропорционален давлению:
- p V = C o n s t {\displaystyle pV=Const}
Французский физик Эдм Мариотт (1620—1684) подтвердил это соотношение через 14 лет после Бойля и заметил, что оно выполняется только при постоянной температуре.
Результаты, полученные Бойлем Мариоттом, можно объяснить, только если признать, что воздух состоит из атомов, между которыми имеется пустое пространство. Сжатие воздуха обусловлено сближением атомов и уменьшением объема пустого пространства.
См. также
Примечания
Литература
- Начала химии / Н.Е.Кузьменко.: В.В.Еремин, В.А.Попков. — М.: Лаборатория знаний, 2016. — 704 с. — ISBN 978-5-906828-17-0.
Основы атомно молекулярного учения. Развитие атомно-молекулярного учения. Скорость химических реакций
Начиная с XVII века, в науке существовало молекулярное учение, которое использовалось для объяснения физических явлений. Практическое применение молекулярной теории в химии было ограничено тем, что ее положения не могли объяснить сущность протекания химических реакций, ответить на вопрос, как из одних веществ в ходе химического процесса образуются новые.
Основные законы химии
Благодаря этой интерпретации силы тяжести или веса как подвижности, Гассенди дает физике стимул к динамизму. Материя внутренне динамична, активна, движется сама по себе и не передает движение от одного объекта к другому по картезианскому пути. Механизмы механизма не движутся путем первоначального толчка, но у них есть способность, сила, двигаться. И это движение осуществляется путем ответа на определенные законы, которые человек может изучать, открывать и контролировать, то есть человек может заниматься наукой о природе.
Решение этого вопроса оказалось возможным на основе атомно-молекулярного учения. В 1741 г. в книге «Элементы математической химии» Михаил Васильевич Ломоносов фактически сформулировал основы атомно-молекулярного учения. Русский учёный-энциклопедист рассматривал строение вещества не как определенную комбинацию атомов, но как сочетание более крупных частиц – корпускул , которые, в свою очередь, состоят из более мелких частиц – элементов .
Основные положения атомно-молекулярного учения
Иногда это изменение было неправильно истолковано и тривиализовано как простая христианизация Эпикура. Однако то, что Гассенди достигает с этой модификацией, имеет гораздо более глубокое значение, чем совместимость христианства и эпикурейства. Фактически, многие модификации Гассенди по унаследованной атомистической теории имеют последствия в физике, а не в теологии. Как известно, это противоречило понятию христианского творения, поскольку случайная составляющая отклонения атома от его траектории устранила бы всю божественную волю.
Терминология Ломоносова со временем претерпела изменения: то, что он называл корпускулами, стали называть молекулами, а на смену термину элемент пришёл термин атом. Однако суть высказанных им идей и определений блестяще выдержала испытание временем.
История развития и утверждения в науке атомно-молекулярного учения оказалась очень непростой. Работа с объектами микромира вызывала огромные трудности: атомы и молекулы было невозможно увидеть и, таким образом, убедиться в их существовании, а попытки измерения атомных масс нередко заканчивались получением ошибочных результатов. Через 67 лет после открытия Ломоносова, в 1808 году, известный английский учёный Джон Дальтон выдвинул атомную гипотезу. Согласно ей, атомы представляют собой мельчайшие частицы вещества, которые невозможно разделить на составные части или превратить друг в друга. По Дальтону, все атомы одного элемента имеют совершенно одинаковый вес и отличаются от атомов других элементов. Соединив учение об атомах с учением о химических элементах, разработанным Робертом Бойлем и Михаилом Васильевичем Ломоносовым, Дальтон обеспечил прочный фундамент для дальнейших теоретических исследований в химии. К сожалению, Дальтон отрицал существование молекул у простых веществ. Он считал, что из молекул состоят только сложные вещества. Это не способствовало дальнейшему развитию и применению атомно-молекулярного учения.
Таким образом, веская причина для канона Дина устранить этот случайный компонент была богословской. Однако он также имеет очень важные значения для его философии. Таким образом, происхождение, с помощью которого образуются соединения, находится в пределах конечных корпускул, составляющих их. Атомы, находящиеся под напряжением внутри, обладают способностью сообщать движение другим, откатываться назад и вперед и, следовательно, способность распутываться, освобождать себя, отскакивать, ударять по другим атомам, отвергать их, отойти от них и в равной мере уметь держаться друг за друга, связываться друг с другом, объединяться вместе, быстро обертывать друг друга.
Условия для распространения идей атомно-молекулярного учения в естествознании сложились лишь во второй половине XIX века. В 1860 году на Международном съезде естествоиспытателей в немецком городе Карлсруэ были приняты научные определения атома и молекулы. Учения о строении веществ тогда ещё не было, поэтому было принято положение о том, что все вещества состоят из молекул. Считалось, что простые вещества, например металлы, состоят из одноатомных молекул. Впоследствии такое сплошное распространение принципа молекулярного строения на все вещества оказалось ошибочным.
То есть, чтобы образовать соединения из небольших молекулярных групп. Сила, внутренне обладающая атомами, позволяет им группироваться в молекулы. Это первый существенный разрыв с древним атомизмом: «атомы были созданы Богом и для него они обязаны всей своей энергией». И немного позже, говоря о рождении мира: «поколение, как объясняется Эпикуром, нуждается в исправлении: порождающая сила, напечатанная Богом, была причиной земли и воды, так что растения изобилуют и животных». Но креационистский тезис приобретает в «Синтагма философском» измерение, которое дистанцирует его от атомизма Эпикура.
Основное содержание атомно-молекулярного учения можно представить следующими положениями.
1. Молекула – наименьшая часть вещества, сохраняющая его состав и важнейшие свойства.
2. Молекулы состоят из атомов. Атомы одного элемента сходны друг с другом, но отличаются от атомов других химических элементов.
Возражение и модификация тезиса клиники в Анонсах становятся Синтагмой в фундаментальной характеристике гашеннического атомизма: материя имеет внутреннюю деятельность для себя. Таким образом, создавая себя из самых атомных недр, движения и поколения тел. На этом уровне, молекулярном уровне, есть встреча между атомизмом и химией: химическая наука отвечает за молекулярный анализ, чтобы объяснить сложность материи с простейшего или элементарного уровня. Таким образом, атомизм становится химическим с этого молекулярного уровня, и химия становится атомарной, когда она превосходит молекулярный уровень и пытается разрешить состав молекул.
3. Атомы и молекулы находятся в непрерывном движении.
4. При физических явлениях молекулы сохраняются, а при химических – разрушаются.
5. Атомы в химических реакциях не разрушаются. Новые вещества образуются в процессе химических реакций из тех атомов, из которых состояли исходные вещества.
Распространение атомно-молекулярного учения способствовало утверждению определений важнейших химических понятий, формированию и развитию единого химического языка, объяснению открытых законов и развитию дальнейших теоретических исследований.
Химия неспособна к окончательному анализу реального, который растворяется в атомах. Однако знание этих атомов не подлежит какой-либо науке о природе. То, чему посвящают естественные науки, было бы продуктом или последствиями атомного состава всего реального.
То есть физика будет изучать движение вещей, но это движение происходит от атомов, химия изучает молекулярный состав вещества, но этот молекулярный состав в конечном итоге состоит из атомов. Напомним, что понятие молекулы в Гассенди является переинтерпретацией атомов спермы Эпикура и повторения Семины Лукреция. Однако переинтерпретация влечет за собой очень важную новизну: концепция оригинальных семян как определенной группировки атомов не найдена ни в Эпикуре, ни в Лукреции, когда объясняется видимые соединения, ни один из них не вводит промежуточную форму между ними. атомов и указанных соединений.
Литература:
Н.Е. Кузнецова. Химия. 8 класс. Учебник для общеобразовательных учреждений. – М. Вентана-Граф, 2012.
Для визуального оформления использовались источники:
https :// www . google . ru / url ? sa = i & rct = j & q =& esrc = s & s
Конспект урока «Атомы, молекулы. Атомно-молекулярное учение в химии и его значение.»
Конспект урока: Атомы, молекулы. Атомно-молекулярное учение в химии и его значение.
Цель: сформировать знания об атомах, молекулах, атомно-молекулярном учении в химии и его значении.
Задачи:
Образовательные: объяснить различия между понятиями «атом» и «молекула», атомно-молекулярное учение на примерах.
Развивающие: развивать умения сравнивать, выделять главное, обобщать, делать выводы, объяснять новые понятия, анализировать результаты своей деятельности, творческое мышление.
Воспитательные: интерес к предмету, чувство коллективизма, навыки самоорганизации, самоанализа и взаимопомощи, сотрудничества.
Ожидаемые результаты: знать понятия — атом, молекула, основные положения атомно-молекулярного учения, уметь объяснить различия между понятиями атом и молекула.
Тип урока: изучение нового материала с первичным закреплением полученных знаний.
Формы работы: индивидуальная, парная, групповая.
Методы: словесный, наглядный, проблемно-поисковый, интерактивный.
Ключевые идеи: атом, молекула, атомно-молекулярное учение.
Оборудование и ресурсы: таблицы, слайдовая презентация, сигнальные карточки, оценочные листы, экран настроения, маркеры, фломастеры, цветные карандаши, листы бумаги А3, А4.
ВведениеТренинг «Улыбнись»
Приветствие учителя и психологический настрой
Создание положительного микроклимата, через минутку настроения, программирование учеников на успех
Психологический настрой учащихся на дальнейшую деятельность.
Встав в круг – улыбаются друг другу, желают хорошего настроения.
Презентация
Деление на группы
Творческие задания учащихся
1.Сказка
Жили-были Железо и Сера. Они жили в маленьком острове. У них не было друзей. И однажды они построили корабль и отправились в путешествие, по пути им встречались островки, на которых жили Золото и Хлор, Медь и Фосфор. Железо и Сера пригласили их с собой в путешествие. Они нашли себе много друзей. Вскоре они пришли в большой город Химия. Добрый человек Менделеев построил им дом. Мы этот дом называем таблицей. И теперь они живут в каждой книге химии до сих пор.
2.Тест
1. Какой из этих элементов правильно записан:
а) Nа – азот; б) Ca – калий; в) Сr – хром; г) Hg – неон; д) C – йод; е) W – ванадий;
2. В каком году учение о молекулах и атомах окончательно было признано:
а) 1855; б) 1871; в) 1862; г) 1860.
3. Какие из веществ — простые:
а) MgCl2; б) HCl; в) Cl2; г) Br2O7; д) Р2О5; е) Ar.
4. Найдите правильный ответ:
а) тела: стул, сода, жир, мел, железо; б) вещества: вода, льдина, медь, свеча, ручка.
5. Найдите правильный ответ:
а) физическое явление: свечение солнца, образование накипи, проявление фотопленки, свечение звезд; б) химическое явление: горение газа, таянье снега, растворение сахара, смешение серы и железа.
По цвету жетонов делятся на группы.
Взаимооценивание
Основная часть
Самостоятельная работа
Работа в группах
Физминутка «Глазки»
Индивидуальная работа
Проблемная ситуация
Каковы отличия между атомом и молекулой?
Определяем цели урока
Приём ИНСЕРТ
Игра «Найди ошибку» — указать формулу вещества, отличающуюся от других.
N2, О2, Cl2, Р (даны формулы молекул, лишнее – атом).
H2О, HCl, H2, HNO3 (формулы сложных веществ, лишнее – молекула простого вещества).
Al, SO3, Zn, S (формулы атомов, лишнее – молекула сложного вещества).
P, Al, Zn, Cu (все атомы металлов, лишнее – неметалл).
1.Какая из записей означает «пять молекул кислорода»:
1) 5H2О; 2) 5О; 3) Р2О5; 4) 5О2.
2.Какая из записей означает «три атома водорода»:
1) 5О; 2) 3О; 3) 4Н; 4) 3Н
Домашнее задание
Параграф 6,16, упр.9
Выполняя упражнения, решают проблемную ситуацию.
Взаимооценивание групп
Самооценивание
Записывают задание в дневник.
Заключение
Всегда полезно оценить самого себя, определить затруднения и найти пути их преодоления
Суммативное оценивание
Рефлексия
Попрошу высказать своё мнение о сегодняшнем уроке
Итоги урока
Самоанализ деятельности и самооценка
Учащиеся поднимают сигнальные карточки
(разноцветные ладошки)
атомов и молекул — определение, история, части атома, видео и примеры
- Классы
- Класс 1-3
- Класс 4-5
- Класс 6-10
- Класс 11-12
- КОНКУРСНЫЙ ЭКЗАМЕН
- BNAT 000 NC
- 000 NC Книги
- Книги NCERT для класса 5
- Книги NCERT для класса 6
- Книги NCERT для класса 7
- Книги NCERT для класса 8
- Книги NCERT для класса 9
- Книги NCERT для класса 10
- Книги NCERT для класса 11
- Книги NCERT для класса 12
- NCERT Exemplar
- NCERT Exemplar Class 8
- NCERT Exemplar Class 9
- NCERT Exemplar Class 10
- NCERT Exemplar Class 11
- NCERT 9000 9000
- NCERT Exemplar Class
- Решения RS Aggarwal, класс 12
- Решения RS Aggarwal, класс 11
- Решения RS Aggarwal, класс 10 90 003 Решения RS Aggarwal класса 9
- Решения RS Aggarwal класса 8
- Решения RS Aggarwal класса 7
- Решения RS Aggarwal класса 6
- Решения RD Sharma
- RD Sharma Class 6 Решения
- Решения RD Sharma Решения RD Sharma Class 8
- Решения RD Sharma Class 9
- Решения RD Sharma Class 10
- Решения RD Sharma Class 11
- Решения RD Sharma Class 12
- 000 NC Книги
- PHYSICS
- Механика
- Оптика
- Термодинамика Электромагнетизм
- ХИМИЯ
- Органическая химия
- Неорганическая химия
- Периодическая таблица
- MATHS
- Теорема Пифагора 0004
- 000300030004 9000
- Простые числа
- Взаимосвязи и функции
- Последовательности и серии
- Таблицы умножения
- Детерминанты и матрицы
- Прибыль и убыток
- Полиномиальные уравнения
- Деление фракций
- BNAT 000 NC
- 000
- 000
- 000
- 000
- 000
- 000 Microology
- 000
- 000 Microology
- 000 BIOG3000
- FORMULAS
- Математические формулы
- Алгебраические формулы
- Тригонометрические формулы
- Геометрические формулы
- КАЛЬКУЛЯТОРЫ
- Математические калькуляторы
- 0003000 PBS4000
- 000300030002 Примеры калькуляторов химии Класс 6
- Образцы бумаги CBSE для класса 7
- Образцы бумаги CBSE для класса 8
- Образцы бумаги CBSE для класса 9
- Образцы бумаги CBSE для класса 10
- Образцы бумаги CBSE для класса 11
- Образцы бумаги CBSE чел для класса 12
- Классы
- CBSE Контрольный документ за предыдущий год
- CBSE Контрольный документ за предыдущий год Класс 10
- Контрольный документ за предыдущий год CBSE, класс 12
- HC Verma Solutions
- HC Verma Solutions Class 11 Physics
- Решения HC Verma, класс 12, физика
- Решения Лакмира Сингха
- Решения Лакмира Сингха, класс 9
- Решения Лакмира Сингха, класс 10
- Решения Лакмира Сингха, класс 8
- Заметки CBSE
- CBSE Notes
- Примечания CBSE класса 7
- Примечания CBSE класса 8
- Примечания CBSE класса 9
- Примечания CBSE класса 10
- Примечания CBSE класса 11
- Примечания CBSE класса 12
- Примечания к редакции
- CBSE Class
- Примечания к редакции класса 10 CBSE
- Примечания к редакции класса 11 CBSE 9000 4
- Примечания к редакции класса 12 CBSE
- Дополнительные вопросы CBSE
- Дополнительные вопросы по математике класса 8 CBSE
- Дополнительные вопросы по науке 8 класса CBSE
- Дополнительные вопросы по математике класса 9 CBSE
- Дополнительные вопросы по науке класса 9 CBSE
Дополнительные вопросы по математике для класса 10
- CBSE Class
- Дополнительные вопросы по науке, класс 10 по CBSE
- , класс 3
- , класс 4
- , класс 5
- , класс 6
- , класс 7
- , класс 8
- , класс 9 Класс 10
- Класс 11
- Класс 12
- Решения NCERT для класса 11
- Решения NCERT для класса 11 по физике
- Решения NCERT для класса 11 Химия Решения для биологии класса 11
- Решения NCERT для математики класса 11 9 0003 NCERT Solutions Class 11 Accountancy
- NCERT Solutions For Класс 12 по физике
- Решения NCERT для химии класса 12
- Решения NCERT для класса 12 по биологии
- Решения NCERT для класса 12 по математике
- Решения NCERT Класс 12 Бухгалтерия
- Решения NCERT, класс 12, бизнес-исследования
- Решения NCERT, класс 12 Экономика
- NCERT Solutions Class 12 Accountancy Part 1
- NCERT Solutions Class 12 Accountancy Part 2
- NCERT Solutions Class 12 Micro-Economics
- NCERT Solutions Class 12 Commerce
- NCERT Solutions Class 12 Macro-Economics
- Решения NCERT для математики класса 4
- Решения NCERT для класса 4 EVS
- Решения NCERT для математики класса 5
- Решения NCERT для класса 5 EVS
- Решения NCERT для математики класса 6
- Решения NCERT для науки класса 6
- Решения NCERT для социальных наук класса 6
- Решения NCERT для класса 6 Английский
- Решения NCERT для класса 7 Математика
- Решения NCERT для класса 7 Наука
- Решения NCERT для класса 7 по социальным наукам
- Решения NCERT для класса 7 Английский
- Решения NCERT для класса 8 Математика
- Решения NCERT для класса 8 Science
- Решения NCERT для социальных наук 8 класса
- Решение NCERT ns для класса 8 Английский
- Решения NCERT для социальных наук класса 9
- Решения NCERT для математики класса 9 Глава 1
- Решения NCERT для Математика класса 9 Глава 2
- Решения NCERT для математики класса 9 Глава 3
- Решения NCERT для математики класса 9 Глава 4 Решения NCERT
- для математики класса 9 Глава 5
- Решения NCERT для математики класса 9 Глава 6
- Решения NCERT для Математика класса 9 Глава 7
- Решения NCERT для математики класса 9 Глава 8 Решения NCERT
- для математики класса 9 Глава 9 Решения NCERT
- для математики класса 9 Глава 10
- Решения NCERT для математики класса 9 Глава 11
- Решения NCERT для Математика класса 9 Глава 12
- Решения NCERT для математики класса 9 Глава 13 Решения
- NCERT для математики класса 9 Глава 14
- Решения NCERT для математики класса 9 Глава 15
- Решения NCERT для науки класса 9 Глава 1
- Решения NCERT для науки класса 9 Глава 2
- Решения NCERT для класса 9 Наука Глава 3
- Решения NCERT для Науки Класса 9 Глава 4
- Решения NCERT для Науки Класса 9 Глава 5
- Решения NCERT для Науки Класса 9 Глава 6
- Решения NCERT для Науки Класса 9 Глава 7
- Решения NCERT для Класса 9 Наука Глава 8
- Решения NCERT для Науки Класса 9 Глава 9
- Решения NCERT для Науки Класса 9 Глава 10
- Решения NCERT для Науки Класса 9 Глава 12
- Решения NCERT для Науки Класса 9 Глава 11
- Решения NCERT для Класса 9 Наука Глава 13
- Решения NCERT для класса 9 Наука Глава 14
- Решения NCERT для класса 9 по науке Глава 15
- Решения NCERT для класса 10 по социальным наукам
- Решения NCERT для математики класса 10 Глава 1
- Решения NCERT для математики класса 10 Глава 2
- Решения NCERT для математики класса 10 Глава 3
- Решения NCERT для математики класса 10 Глава 4
- Решения NCERT для математики класса 10 Глава 5
- Решения NCERT для математики класса 10 Глава 6
- Решения NCERT для математики класса 10 Глава 7
- Решения NCERT для математики класса 10 Глава 8
- Решения NCERT для математики класса 10 Глава 9 Решения NCERT
- для математики класса 10 Глава 10 Решения
- NCERT для математики класса 10 Глава 11
- Решения NCERT для математики класса 10 Глава 12
- Решения NCERT для математики класса 10 Глава 13
- NCERT Sol Решения NCERT для математики класса 10 Глава 14
- Решения NCERT для математики класса 10 Глава 15
- Решения NCERT для науки класса 10 Глава 1
- Решения NCERT для науки класса 10 Глава 2
- Решения NCERT для науки 10 класса, глава 3
- Решения NCERT для науки 10 класса, глава 4
- Решения NCERT для науки класса 10 Глава 5
- Решения NCERT для науки класса 10 Глава 6
- Решения NCERT для науки класса 10 Глава 7
- Решения NCERT для науки класса 10 Глава 8
- Решения NCERT для науки класса 10 Глава 9
- Решения NCERT для науки класса 10 Глава 10
- Решения NCERT для науки класса 10
Глава 1.7: Крот и молярная масса
Крот
Согласно теории Дальтона, каждое химическое соединение имеет определенную комбинацию атомов, и соотношение чисел атомов присутствующих элементов обычно представляет собой небольшие целые числа. Мы также описали закон множественных пропорций , который гласит, что отношения масс элементов, которые образуют ряд соединений, являются небольшими целыми числами. Задача Дальтона и других ранних химиков состояла в том, чтобы обнаружить количественную связь между числом атомов в химическом веществе и его массой.Поскольку массы отдельных атомов настолько малы (порядка 10 −23 г / атом), химики не измеряют массу отдельных атомов или молекул. Например, в лаборатории масса соединений и элементов, используемых химиками, обычно колеблется от миллиграммов до граммов, в то время как в промышленности химические вещества покупаются и продаются в килограммах и тоннах. Поэтому для анализа превращений, происходящих между отдельными атомами или молекулами в химической реакции, химикам абсолютно необходимо знать, сколько атомов или молекул содержится в измеряемом количестве в лаборатории — данной массе образца.Единицей измерения этой связи является моль (моль). Количество вещества, которое содержит такое же количество единиц (например, атомов или молекул), что и количество атомов углерода точно в 12 г изотопно чистого углерода-12., От латинского моль , что означает «куча» или « куча »(, а не у маленького подземного зверя!).
Многие знакомые вещи продаются в числовых количествах с необычными названиями. Например, банки с газировкой продаются упаковками по шесть штук, яйца продаются дюжинами (12), а карандаши часто продаются оптом (12 дюжин или 144).Листы бумаги для принтера упакованы стопками по 500 штук, что на первый взгляд кажется большим количеством. Однако атомы настолько малы, что даже 500 атомов слишком малы, чтобы их можно было увидеть или измерить с помощью самых распространенных методов. Любая легко измеряемая масса элемента или соединения содержит чрезвычайно большое количество атомов, молекул или ионов, поэтому для их подсчета требуется чрезвычайно большая числовая единица. Для этого используется родинка.
моль определяется как количество вещества, которое содержит количество атомов углерода ровно в 12 г изотопно чистого углерода-12.Согласно последним экспериментальным измерениям, эта масса углерода-12 содержит 6,022142 × 10 23 атомов, но для большинства целей 6,022 × 10 23 обеспечивает достаточное количество значащих цифр. Подобно тому, как 1 моль атомов содержит 6,022 × 10 23 атомов, 1 моль яиц содержит 6,022 × 10 23 яиц. Число в моле называется числом Авогадро: 6.022142 x 10 23 , в честь итальянского ученого XIX века, который первым предложил измерить количество молекул в газе.Поскольку массу газа также можно измерить на чувствительных весах, знание количества молекул и их общей массы позволяет просто определить массу отдельной молекулы в граммах.
Крот является мостом между атомным миром (аму) и лабораторией (граммы). Он позволяет определять количество молекул или атомов путем их взвешивания. Числовое значение числа Авогадро, обычно обозначаемое как Нет, является следствием произвольного значения в один килограмм, блока металла Pt-Ir, называемого международным прототипом килограмма, и выбора эталона для шкалы атомных единиц массы, одного атома. углерода-12.Моль C-12 по определению весит ровно 12 г, а число Авогадро определяется путем подсчета количества атомов. Это не так-то просто. Число Авогадро — это фундаментальная постоянная, которая определяется наименее точно.
Определение моля, то есть решение основать его на 12 г углерода-12, произвольно, но оно было принято после некоторой дискуссии между химиками и физиками, обсуждая, использовать ли природный углерод, смесь C- 12 и С-13 или водород.Важным моментом является то, что 1 моль углерода — или чего-либо еще, будь то атомы, компакт-диски или дома — всегда имеет одинаковое количество объектов: 6.022 × 10 23 .
В следующем видео профессор Стив Бун показывает, как гипотезу Авогадро можно использовать для измерения молекулярных масс He, N 2 и CO2. Следуйте инструкциям и запишите измерения, чтобы получить относительные массы. Когда мы рассматриваем поведение газов в Блоке 5, мы можем использовать данные для расчета молекулярной массы каждого газа.Этот метод был до изобретения масс-спектрометра лучшим способом измерения молекулярной массы молекул газа
Обратите внимание на узор
У одного крота всегда одинаковое количество объектов: 6.022 × 10 23 .
Чтобы оценить величину числа Авогадро, возьмем кучу пенсов. Сложенный вертикально, моль пенсов будет иметь высоту 4,5 × 10 17 миль, что почти в шесть раз больше диаметра галактики Млечный Путь. Если бы моль пенсов распределить поровну среди всего населения Земли, каждый человек получил бы более одного триллиона долларов.Ясно, что моль настолько велика, что ее можно использовать только для измерения очень маленьких объектов, например атомов.
Концепция мола позволяет нам подсчитать определенное количество отдельных атомов и молекул путем взвешивания измеримых количеств элементов и соединений. Чтобы получить 1 моль атомов углерода-12, мы должны отвесить 12 г изотопно чистого углерода-12. Поскольку каждый элемент имеет разную атомную массу, моль каждого элемента имеет разную массу, даже если он содержит одинаковое количество атомов (6.022 × 10 23 ). Это аналогично тому факту, что дюжина очень больших яиц весит больше, чем дюжина маленьких яиц, или что общий вес 50 взрослых людей превышает общий вес 50 детей. Из-за способа определения моля для каждого элемента количество граммов в моле совпадает с количеством атомных единиц массы в атомной массе элемента. Например, масса 1 моля магния (атомная масса = 24,305 а.е.м.) равна 24,305 г. Поскольку атомная масса магния (24.305 а.е.м.) чуть более чем в два раза больше, чем у атома углерода-12 (12 а.е.м.), масса 1 моля атомов магния (24,305 г) чуть более чем вдвое больше, чем 1 моль углерода-12 (12 г). Точно так же масса 1 моля гелия (атомная масса = 4,002602 а.е.м.) равна 4,002602 г, что примерно в три раза меньше, чем 1 моль углерода-12. Используя концепцию моля, мы можем теперь переформулировать теорию Дальтона: 1 моль соединения образуется путем объединения элементов в количествах, мольные отношения которых представляют собой небольшие целые числа. Например, 1 моль воды (H 2 O) содержит 2 моля атомов водорода и 1 моль атомов кислорода.
.2: Атомно-молекулярная теория
Фонд
В нашем мире более 18 миллионов известных веществ. Мы начнем с предположения, что все материалы сделаны из элементов , материалов, которые не могут быть разложены на более простые вещества. Предположим, что мы определили все эти элементы, а их очень мало. Все другие чистые вещества, которые мы называем соединениями , состоят из этих элементов и могут разлагаться на эти элементы.Например, металлическое железо и газообразный кислород являются элементами и не могут быть восстановлены до более простых веществ, но ржавчина железа или оксид железа — это соединение, которое можно восстановить до элементарного железа и кислорода. Элементы не могут быть преобразованы: один элемент не может быть преобразован в другой. Наконец, мы все предполагаем, что продемонстрировали закон сохранения массы .
Закон сохранения массы
Общая масса всех продуктов химической реакции равна общей массе всех реагентов этой реакции.
Эти утверждения представляют собой краткое изложение многих наблюдений, для достижения которых потребовалось огромное количество экспериментов и даже более творческого мышления для систематизации, как мы их здесь записали. Делая эти предположения, мы можем приступить непосредственно к экспериментам, которые привели к развитию атомно-молекулярной теории.
Голы
Приведенные выше утверждения, хотя и верны, на самом деле более расплывчаты, чем они могут показаться на первый взгляд. Например, что именно мы имеем в виду, когда говорим, что все материалы сделаны из элементов? Почему элементы нельзя разложить? Что значит объединять элементы в соединение? Мы хотим больше узнать о природе элементов и соединений, чтобы мы могли описать процессы, с помощью которых элементы объединяются с образованием соединений, с помощью которых соединения разлагаются на элементы и с помощью которых соединения преобразуются из одного в другое во время химических реакций.
Один из способов ответить на эти вопросы — предположить, что соединение образуется, когда неразрушимые элементы просто смешиваются вместе, как, например, если мы представляем себе перемешивание смеси сахара и песка. При этом ни песок, ни сахар не разлагаются. А смесь можно разложить обратно на исходные компоненты. В этом случае, однако, полученная смесь проявляет свойства обоих компонентов : например, смесь будет иметь сладкий вкус из-за сахарного компонента, но зернистый, характерный для песочного компонента.
Напротив, соединение, которое мы называем железной ржавчиной, мало похоже на элементарное железо: железная ржавчина не показывает цвет, плотность, твердость, магнетизм элементарного железа и т. Д. Поскольку свойства элементов не поддерживаются соединением, то соединение не должно быть простой смесью элементов.
Мы могли бы, конечно, сразу перейти к ответам на эти вопросы, заявив, что сами элементы состоят из атомов: неделимых, идентичных частиц, отличительных от этого элемента.Затем соединение образуется путем объединения атомов составных элементов. Конечно, закон сохранения массы легко объяснить существованием неизменных атомов фиксированной массы.
Однако, если мы решим поспешно с выводами и предположим существование атомов без дополнительных доказательств (как поступили ведущие химики семнадцатого и восемнадцатого веков), это ни к чему не приведет. Что происходит с железом, когда после длительного нагревания на воздухе оно превращается в железную ржавчину? Почему полученная комбинация железа и воздуха не сохраняет свойств ни того, ни другого, как можно было бы ожидать, если бы атомы каждого из них смешались вместе? Атомный взгляд на природу еще не дал бы никакого понимания того, как воздух и железо взаимодействовали или объединились, чтобы сформировать новое соединение, и мы не можем сделать никаких прогнозов относительно того, сколько железа будет производить, сколько железа ржавчины.Нет никаких оснований делать какие-либо утверждения о свойствах этих атомов. Нам нужны дальнейшие наблюдения.
Наблюдение 1: Массовые отношения во время химических реакций
Закон сохранения массы сам по себе не требует атомарного взгляда на элементы. Массу можно было сохранить, даже если бы материя не была атомной. Важность Закона сохранения массы заключается в том, что он показывает, что мы можем с пользой измерить массы элементов, содержащихся в фиксированной массе соединения.Например, мы можем разложить карбонат меди на составляющие его элементы, медь, кислород и углерод, взвесив каждый и определив соотношение этих масс. В результате каждый образец карбоната меди состоит из \ (51,5 \% \) меди, \ (38,8 \% \) кислорода и \ (9,7 \% \) углерода. Другими словами, массы меди, кислорода и углерода находятся в соотношении 5,3: 4: 1 для каждого измерения каждого образца карбоната меди. Точно так же сульфид свинца — это \ (86,7 \% \) свинец и \ (13,3 \% \) сера, так что массовое отношение свинца к сере в сульфиде свинца всегда равно 6.5: 1. Каждый образец карбоната меди и каждый образец сульфида свинца будут давать эти элементарные пропорции, независимо от того, сколько материала мы разлагаем или откуда он взялся. Эти результаты являются примерами общего принципа, известного как Закон определенных пропорций .
Закон определенных пропорций
Когда два или более элемента объединяются в соединение, их массы в этом соединении находятся в фиксированном и определенном соотношении.
Эти данные помогают обосновать атомарный взгляд на материю.Мы можем просто возразить, что, например, сульфид свинца образуется, если взять один атом свинца и соединить его с одним атомом серы. Если бы это было правдой, то мы также должны сделать вывод, что отношение массы атома свинца к массе атома серы такое же, как и массовое отношение свинца к сере 6,5: 1, которое мы нашли для основного сульфида свинца. . Это атомарное объяснение выглядит как окончательный ответ на вопрос о том, что значит объединить два элемента в соединение, и оно даже должно позволить предсказать, какое количество сульфида свинца будет произведено данным количеством свинца.Например, \ (6.5 \: \ text {g} \) свинца будет производить ровно \ (7.5 \: \ text {g} \) сульфида свинца, \ (50 \: \ text {g} \) свинца будет производить \ (57.7 \: \ text {g} \) сульфида свинца и т. д.
Однако есть проблема. Мы можем проиллюстрировать это на примере трех соединений, образованных из водорода, кислорода и азота. Три измерения массовых долей приведены в следующей таблице. Сначала мы исследуем оксид азота, чтобы обнаружить, что массовое соотношение кислорода к азоту составляет 8: 7. Если это один атом азота в сочетании с одним атомом кислорода, мы ожидаем, что масса атома кислорода будет \ (8/7 = 1.В 14 \) раз больше, чем у атома азота. Во-вторых, мы исследуем аммиак, который представляет собой комбинацию азота и водорода с массовым соотношением азота к водороду 7: 1,5. Если это один азот в сочетании с одним водородом, мы ожидаем, что масса атома азота в 4,67 раза больше массы атома водорода. Эти два ожидания предсказывают связь между массой атома кислорода и массой атома водорода. Если масса атома кислорода в 1,14 раза больше массы атома азота и если масса атома азота равна 4.В 67 раз больше массы атома водорода, то мы должны заключить, что атом кислорода имеет массу, которая в \ (1,14 \ раз 4,67 = 5,34 \) раз больше массы атома водорода.
Но есть проблема с этим расчетом. Третья строка следующей таблицы показывает, что соединение, образованное из водорода и кислорода, представляет собой воду, которая, как установлено, имеет массовое соотношение кислорода к водороду 8: 1. Тогда мы должны ожидать, что масса атома кислорода в 8,0 раз больше массы атома водорода. Таким образом, три измерения в следующей таблице, по-видимому, приводят к противоречивым ожиданиям относительно атомных отношений масс.Как согласовать эти результаты?
Таблица 2.1: Массовые отношения для соединений водорода, азота и кислорода
| Соединение | Общая масса | Масса водорода | Масса азота | Масса кислорода | «Ожидаемая» относительная атомная масса водорода | «Ожидаемая» относительная атомная масса азота | «Ожидаемая» относительная атомная масса кислорода |
| Оксид азота | \ (15.0 \: \ text {g} \) | – | \ (7.0 \: \ text {g} \) | \ (8.0 \: \ text {g} \) | – | 7,0 | 8,0 |
| Аммиак | \ (8.5 \: \ text {g} \) | \ (1.5 \: \ text {g} \) | \ (7.0 \: \ text {g} \) | – | 1,5 | 7.0 | – |
| Вода | \ (9.0 \: \ text {g} \) | \ (1.0 \: \ text {g} \) | – | \ (8.0 \: \ text {g} \) | 1.0 | – | 8,0 |
Одна из возможностей состоит в том, что мы ошибались, предполагая, что существуют атомы элементов, которые объединяются, чтобы сформировать различные соединения.Если это так, то мы не удивимся, увидев различия в относительных массах сочетающихся материалов.
Другая возможность состоит в том, что мы ошиблись в наших рассуждениях. Оглядываясь назад, мы видим, что мы должны предположить, сколько атомов каждого типа содержится в каждом соединении, чтобы найти относительные массы атомов. В каждом из приведенных выше примеров мы предполагали, что соотношение атомов в каждом соединении составляет 1: 1. Если есть атомы элементов, то это предположение должно быть неверным, поскольку оно дает относительные атомные массы, которые различаются от соединения к соединению.Как мы могли найти правильные атомные отношения? Помогло бы, если бы мы знали соотношение атомных масс: например, если бы мы знали, что массовое отношение кислорода к водороду составляет 8: 1, то мы могли бы сделать вывод, что атомное соотношение в воде было бы 1 кислородом и 1 водородом. Наши рассуждения кажутся круговыми: чтобы знать атомные массы, мы должны знать формулу соединения (количество атомов каждого типа), но чтобы знать формулу, мы должны знать массы.
Какая из этих возможностей верна? Без дальнейших наблюдений мы не можем с уверенностью сказать, состоит ли материя из атомов или нет.
Наблюдение 2: множественные отношения масс
Существенное понимание вышеуказанной проблемы можно найти при изучении различных соединений, образованных из одних и тех же элементов. Например, на самом деле существует три оксида азота, то есть соединения, состоящие только из азота и кислорода. Сейчас мы будем называть оксид А, оксид В и оксид С. Массовое отношение кислорода к азоту оксида А составляет 2,28: 1. Оксид B имеет массовое отношение кислорода к азоту 1,14: 1, а оксид C имеет массовое отношение кислорода к азоту 0.57: 1.
Тот факт, что существует три отношения масс, может показаться противоречащим Закону Определенных пропорций, который на первый взгляд, кажется, гласит, что должно быть только одно отношение. Однако каждая комбинация масс дает совершенно уникальное химическое соединение с очень разными химическими свойствами. Например, оксид A очень токсичен, а оксид C используется в качестве анестезии. Верно также и то, что соотношение масс не является произвольным или непрерывно изменяемым: мы не можем выбрать любую комбинацию масс при объединении кислорода и азота, скорее мы должны подчиняться одной из трех.Так что нет никакого противоречия: нам просто нужно быть осторожными с Законом Определенных Пропорций, чтобы сказать , что каждое уникальное соединение имеет определенное соотношение масс комбинирующихся элементов.
Эти новые числа отношения масс весьма наводят на мысль о следующем. Обратите внимание, что в каждом случае мы взяли отношение массы кислорода к массе азота, равное 1, и что полученные соотношения имеют очень простое соотношение:
\ [\ begin {align} 2.28: 1.14: 0.57 & = 2: 1: 0.5 \\ & = 4: 2: 1 \ end {align} \]
Масса кислорода, содержащегося в этих соединениях, выражается в простых целочисленных отношениях, когда мы берем фиксированное количество азота.Появление этих простых целых чисел очень важно. Эти целые числа означают, что соединения содержат количество кислорода, кратное фиксированной единице массы. Самым простым объяснением этой фиксированной единицы массы является то, что кислород составляет твердых частиц . Мы называем фиксированную единицу массы атомом . Теперь мы предполагаем, что соединения образовались из комбинаций атомов с фиксированными массами, и что разные соединения имеют разное количество атомов. Из массовых соотношений видно, что оксид B содержит в два раза больше атомов кислорода (на атом азота), чем оксид C, и вдвое меньше атомов кислорода (на атом азота), чем оксид A.Простые отношения масс должны быть результатом простых соотношений, в которых атомы объединяются в молекулы. Если, например, оксид C имеет молекулярную формулу \ (\ ce {NO} \), то оксид B имеет формулу \ (\ ce {NO_2} \), а оксид A имеет формулу \ (\ ce {NO_4} \). Есть и другие возможности: если оксид B имеет молекулярную формулу \ (\ ce {NO} \), то оксид A имеет формулу \ (\ ce {NO_2} \), а оксид C имеет формулу \ (\ ce {N_2O} \) . Или, если оксид A имеет формулу \ (\ ce {NO} \), тогда оксид B имеет формулу \ (\ ce {N_2O} \), а оксид C имеет формулу \ (\ ce {N_4O} \).Эти три возможности перечислены в следующей таблице.
Таблица 2.2: Возможные молекулярные формулы для оксидов азота
| Предполагая, что: | Оксид C равен \ (\ ce {NO} \) | Оксид B представляет собой \ (\ ce {NO} \) | Оксид А представляет собой \ (\ ce {NO} \) |
| Оксид А — это | \ (\ ce {NO_4} \) | \ (\ ce {NO_2} \) | \ (\ ce {NO} \) |
| Оксид B — это | \ (\ ce {NO_2} \) | \ (\ ce {NO} \) | \ (\ ce {N_2O} \) |
| Оксид C составляет | \ (\ ce {NO} \) | \ (\ ce {N_2O} \) | \ (\ ce {N_4O} \) |
У нас нет способа (по этим данным) узнать, какая из этих молекулярных формул верна.Но мы можем утверждать, что прав либо один из них, либо аналогичный им.
Подобные данные обнаруживаются для любого набора соединений, образованных из общих элементов. Например, есть два оксида углерода, один с массовым отношением кислорода к углероду 1,33: 1, а другой с массовым соотношением 2,66: 1. Второй оксид должен иметь в два раза больше атомов кислорода на атом углерода, чем первый. Общее утверждение этого наблюдения — Закон множественных пропорций .
Закон множественных пропорций
Когда два элемента объединяются для образования более чем одного соединения, масса элемента A, который объединяется в первом соединении с заданным количеством элемента B, имеет простое целочисленное отношение с массой элемента A, который объединяется во втором соединении с такая же заданная масса элемента B.
Звучит запутанно, но пример поясняет это утверждение. Рассмотрим оксиды углерода и пусть углерод будет элементом B, а кислород — элементом A. Возьмите фиксированную заданную массу углерода (элемент B), скажем, 1 грамм. Масса кислорода, который соединяется с 1 граммом углерода с образованием первого оксида, составляет 1,33 грамма. Масса кислорода, который соединяется с 1 граммом углерода с образованием второго оксида, составляет 2,66. Эти массы находятся в соотношении 2,66: 1,33 = 2: 1, простом целочисленном соотношении.
Объясняя наши наблюдения Закона множественных пропорций для оксидов углерода и оксидов азота, мы пришли к выводу, что простое соотношение масс возникает из простого отношения атомов, содержащихся в отдельных молекулах.Таким образом, мы установили следующие постулаты атомно-молекулярной теории .
Теория: Атомно-молекулярная теория
- элементы состоят из одинаковых атомов
- все атомы одного элемента имеют одинаковую характеристическую массу
- количество и массы этих атомов не изменяются во время химического превращения
- соединения состоят из идентичных молекул, состоящих из атомов, объединенных в простом целочисленном соотношении
Обзор и вопросы для обсуждения
Предположим, что материя не состоит из атомов.Покажите на примере, как это предположение приводит к гипотетическим предсказаниям, которые противоречат закону множественных пропорций. Противоречат ли эти гипотетические примеры Закону определенных пропорций? Требуются ли оба наблюдения для подтверждения атомной теории?
Два соединения, A и B, полностью образованы из водорода и углерода. Соединение A представляет собой \ (80,0 \% \) углерод по массе и \ (20,0 \% \) водород, тогда как соединение B представляет собой \ (83,3 \% \) углерод по массе и \ (16,7 \% \) водород. Продемонстрируйте, что эти два соединения подчиняются Закону множественных пропорций.Объясните, почему эти результаты убедительно указывают на то, что элементы углерод и водород состоят из атомов.
Во многих химических реакциях масса не является постоянной величиной. Например, когда жестяная банка ржавеет, образовавшаяся ржавая жестяная банка имеет большую массу, чем до ржавления. Когда свеча горит, оставшаяся свеча неизменно имеет меньшую массу, чем до того, как она горела. Объясните эти наблюдения и опишите эксперимент, который продемонстрирует, что в этих химических реакциях действительно сохраняется масса.
На экзамене был задан следующий вопрос:
Неизвестный неметаллический элемент (Q) образует два газообразных фторида неизвестной молекулярной формулы. Образец \ (3.2 \: \ text {g} \) Q реагирует с фтором с образованием \ (10.8 \: \ text {g} \) неизвестного фторида A. A \ (6.4 \: \ text {g} \) образец Q реагирует с фтором с образованием \ (29.2 \: \ text {g} \) неизвестного фторида B. Используя только эти данные, с помощью вычислений и объяснений продемонстрируйте, что эти неизвестные соединения подчиняются Закону множественных пропорций.
Студент ответил следующим образом:
Закон множественных пропорций гласит, что когда два элемента образуют два или более соединений, отношения масс элементов между двумя соединениями в простом целочисленном соотношении. Итак, глядя на данные выше, мы видим, что отношение массы элемента Q в соединении A к массе элемента Q в соединении B составляет 3,2: 6,4 = 1: 2, что является простым целочисленным соотношением. Это демонстрирует, что эти соединения подчиняются Закону множественных пропорций.
Оцените точность ответа учащихся. В своей оценке вы должны определить, какая информация верна, а какая нет, предоставить правильную информацию там, где это необходимо, объяснить, является ли рассуждение логичным или нет, и предоставить логическое обоснование, где это необходимо.
Авторы и авторство
.моль | Определение, число и факты
Объяснение числа Авогадро Обзор того, как число Авогадро используется для измерения количества единиц любого вещества. Encyclopædia Britannica, Inc. См. Все видеоролики к этой статьеМоль , также пишется моль , в химии — стандартная научная единица измерения больших количеств очень малых объектов, таких как атомы, молекулы или другие заданные частицы.
Популярные вопросы
Как определяется родинка?
Моль определяется как 6.02214076 × 10 23 какой-либо химической единицы, будь то атомы, молекулы, ионы или другие. Моль — это удобная единица измерения из-за большого количества атомов, молекул и т. Д. В любом веществе. Изначально моль был определен как количество атомов в 12 граммах углерода-12, но в 2018 году Генеральная конференция по мерам и весам объявила, что с 20 мая 2019 года моль будет составлять всего 6,02214076 × 10 23 некоторого химического вещества. Блок.
Как рассчитывается моль?
Если вы хотите узнать, сколько у вас молей материала, разделите массу материала на его молярную массу.Молярная масса вещества — это масса в граммах одного моля этого вещества. Эта масса определяется атомным весом химической единицы, из которой состоит это вещество, в атомных единицах массы (а.е.м.). Например, серебро имеет атомный вес 107,8682 а.е.м., поэтому один моль серебра имеет массу 107,8682 грамма.
Какой у Авогадро номер?
Число Авогадро — это количество единиц в одном моль вещества, или 6,02214076 × 10 23 . Это число также называют постоянной Авогадро.Он назван в честь итальянского физика XIX века Амедео Авогадро, который обнаружил, что при одинаковых температуре и давлении два газа с одинаковым объемом имеют одинаковое количество молекул. Французский физик Жан Перрен в начале 20 века назвал количество единиц в моле числом Авогадро.
Какова формула молярной массы?
Молярная масса некоторого вещества — это масса в граммах одного моля этого вещества. Эта масса определяется атомным весом химической единицы, из которой состоит это вещество, в атомных единицах массы (а.е.м.).Например, золото имеет атомный вес 196,967 а.е.м., поэтому масса одного моля золота составляет 196,967 грамма. Для вещества, которое состоит из более чем одного типа атомов, складывается атомный вес отдельных атомов для химической единицы, составляющей это вещество. Вода состоит из двух атомов водорода и одного атома кислорода. Атомный вес одного атома водорода составляет 1,008 а.е.м., а двух атомов — 2,016. Атомный вес одного атома кислорода равен 15,999, поэтому молярная масса воды равна 2.016 + 15,999 = 18,015 грамм.
Крот обозначает чрезвычайно большое количество единиц, 6.02214076 × 10 23 . Генеральная конференция по мерам и весам определила моль как это число для Международной системы единиц (СИ), действующей с 20 мая 2019 года. Ранее моль определялся как количество атомов, определенное экспериментально и обнаруживаемое в 12 граммах углерода. 12. Число единиц в молье также носит название числа Авогадро или постоянной Авогадро в честь итальянского физика Амедео Авогадро (1776–1856).Авогадро предположил, что равные объемы газов в одних и тех же условиях содержат одинаковое количество молекул, гипотеза, которая оказалась полезной при определении атомного и молекулярного веса и привела к концепции моль. ( См. Закон Авогадро .)
Число атомов или других частиц в одном моле одинаково для всех веществ. Моль соотносится с массой элемента следующим образом: один моль атомов углерода-12 имеет 6,02214076 × 10 23 атомов и массу 12 граммов.Для сравнения: один моль кислорода по определению состоит из того же количества атомов, что и углерод-12, но его масса составляет 15,999 грамма. Следовательно, кислород имеет большую массу, чем углерод. Это рассуждение также может быть применено к молекулярной массе или массе формулы.
Понятие «моль» помогает поместить количественную информацию о том, что происходит в химическом уравнении, на макроскопический уровень. Например, в химической реакции 2H 2 O → O 2 + 2H 2 два моля воды разлагаются на два моля молекулярного водорода и один моль молекулярного кислорода.Моль можно использовать для определения простейшей формулы соединения и расчета количеств, участвующих в химических реакциях. Когда речь идет о реакциях, протекающих в растворах, полезно использовать соответствующее понятие молярности. Молярность ( M ) определяется как количество молей растворенного вещества в литре раствора.
Britannica Premium: удовлетворение растущих потребностей искателей знаний. Получите 30% подписки сегодня. Подпишись сейчас .