Планетарная модель строения атома. Методические материалы
Цифровой ресурс может использоваться для обучения в рамках программы основной и средней школы (базового уровня).
Компьютерная программа представляет собой демонстрацию по теме «Строение атома». Приводится информация о классическом опыте Резерфорда по зондированию атома с помощью α-частиц, приводятся примеры строения атомов шести различных химических элементов.
Краткая теория
Первые прямые эксперименты по исследованию внутренней структуры атомов были выполнены Э. Резерфордом и его сотрудниками Э. Марсденом и Х. Гейгером в 1909–1911 годах.
Резерфорд предложил применить зондирование атома с помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал α-частицы с кинетической энергией около 5 МэВ (скорость таких частиц очень велика – порядка 10
α-частицы – это полностью ионизированные атомы гелия. Они были открыты Резерфордом в 1899 году при изучении явления радиоактивности. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома.
Опыты Резерфорда и его сотрудников привели к выводу о том, что в центре атома находится плотное положительно заряженное ядро, диаметр которого не превышает 10–14–10–15 м. Это ядро занимает только 10–12 часть полного объема атома, но содержит весь положительный заряд и не менее 99,95 % его массы. Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома.
Опираясь на классические представления о движении микрочастиц, Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, под действием кулоновских сил со стороны ядра вращаются электроны. Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро.
Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, под действием кулоновских сил со стороны ядра вращаются электроны. Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро.
|
Рис. 1. Планетарная модель атома Резерфорда. Показаны круговые орбиты четырех электронов |
 За короткое время (порядка 10–8 с) все электроны в атоме Резерфорда должны растратить всю свою энергию и упасть на ядро. То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам.
За короткое время (порядка 10–8 с) все электроны в атоме Резерфорда должны растратить всю свою энергию и упасть на ядро. То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам.Работа с моделью
Демонстрация состоит из семи экранов. Модель может быть использована в режиме ручного переключения кадров и в режиме автоматической демонстрации ().
Рекомендации по применению модели
Данная модель может быть применена в качестве иллюстрации на уроках изучения нового материала в 9 и 11 классах по теме «Строение атома». На примере этой модели можно рассмотреть с учащимися планетарные модели строения атома различных химических элементов.
Пример планирования урока с использованием модели
Тема «Строение атома»
Цель урока: рассмотреть модель атома Томпсона, на опыте Резерфорда обосновать не состоятельность модели атома Томпсона, дать планетарную модель атома, рассмотреть модели атомов различных химических элементов, ввести понятие иона.
|
|||||||||||||||||||||||||
|
Таблица 1. |
Примеры вопросов и заданий
-
В томсоновской модели атома водорода предполагалось, что положительный заряд e, равный по модулю заряду электрона, равномерно распределен внутри шара радиусом R = 10–8 см. Определите частоту колебаний электрона вблизи центра шара.
-
Предполагая, что электрон в планетарной модели атома водорода вращается по круговой орбите радиусом a = 5,3∙10–11 м, определите:
- напряженность электрического поля ядра на орбите электрона;
- частоту обращения электрона.
-
Какое из приведенных ниже утверждений является серьезным доводом против планетарной модели атомов по Резерфорду?
- Силы электростатического притяжения ядра так велики, что электрон должен упасть на ядро.

- Из-за большой удаленности от ядра силы кулоновского притяжения так малы, что электроны должны легко их преодолевать и покидать атомное ядро.
- Электрон должен терять энергию на электромагнитное излучение и быстро упасть на ядро.
- Из-за большой массы ядра гравитационные силы притяжения должны вызвать падение электрона на ядро.
- Силы электростатического притяжения ядра так велики, что электрон должен упасть на ядро.
Планетарная модель атома
Литературный обзор
Модели
Первые модели строения атома появляются в самом начале XX века. Жан Перрен в 1901 г. высказал предположение о ядерно-планетарном устройстве атома. Подобную же модель предложил в 1904 г. японский физик Хантаро Нагаока. В модели Нагаоки атом уподоблялся планете Сатурн; роль планеты выполнял положительно заряженный шар, представляющий собой основную часть объёма атома, а электроны располагались подобно спутникам Сатурна, образующим его кольца. Однако наиболее широкое распространение получила т.н. кексовая модель атома: в 1902 г. Уильям Томсон (лорд Кельвин) высказал предположение о том, что атом представляет собой сгусток положительно заряженной материи, внутри которого равномерно распределены электроны. Простейший атом – атом водорода – представлял собой, по мнению У. Томсона, положительно заряженный шар, в центре которого находится электрон. Детально данную модель разработал Дж. Дж. Томсон, считавший, что электроны внутри положительно заряженного шара расположены в одной плоскости и образуют концентрические кольца. Дж. Дж. Томсон предложил способ определения числа электронов в атоме, основанный на рассеивании рентгеновских лучей, основанный на предположении, что именно электроны должны являться центрами рассеивания. Проведённые эксперименты показали, что количество электронов в атомах элементов равно приблизительно половине величины атомной массы. Дж. Дж. Томсон, предположив, что число электронов в атоме непрерывно возрастает при переходе от элемента к элементу, впервые попытался связать строение атомов с периодичностью свойств элементов
Уильям Томсон (лорд Кельвин) высказал предположение о том, что атом представляет собой сгусток положительно заряженной материи, внутри которого равномерно распределены электроны. Простейший атом – атом водорода – представлял собой, по мнению У. Томсона, положительно заряженный шар, в центре которого находится электрон. Детально данную модель разработал Дж. Дж. Томсон, считавший, что электроны внутри положительно заряженного шара расположены в одной плоскости и образуют концентрические кольца. Дж. Дж. Томсон предложил способ определения числа электронов в атоме, основанный на рассеивании рентгеновских лучей, основанный на предположении, что именно электроны должны являться центрами рассеивания. Проведённые эксперименты показали, что количество электронов в атомах элементов равно приблизительно половине величины атомной массы. Дж. Дж. Томсон, предположив, что число электронов в атоме непрерывно возрастает при переходе от элемента к элементу, впервые попытался связать строение атомов с периодичностью свойств элементов
Немецкий физик Филипп фон Ленард попытался создать модель, не предполагающую раздельного существования в атоме противоположных зарядов. Атом, согласно модели Ленарда, состоит из нейтральных частиц (т.н. динамид), каждая из которых является электрическим дуплетом. Выполненные Ленардом расчёты показали, что эти частицы должны иметь крайне малые размеры, и, следовательно, большая часть объёма атома представляет собой пустоту. Сосредоточение массы атома в небольшой части его объёма отчасти подтверждалось и проведёнными Ленардом в 1903 г. опытами, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу.
Атом, согласно модели Ленарда, состоит из нейтральных частиц (т.н. динамид), каждая из которых является электрическим дуплетом. Выполненные Ленардом расчёты показали, что эти частицы должны иметь крайне малые размеры, и, следовательно, большая часть объёма атома представляет собой пустоту. Сосредоточение массы атома в небольшой части его объёма отчасти подтверждалось и проведёнными Ленардом в 1903 г. опытами, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу.
Все упомянутые модели – Томсона-Томсона, Перрена-Нагаоки и Ленарда являлись сугубо гипотетическими и исключительно качественными. В 1906-1909 гг. Ганс Гейгер, Эрнст Марсден и Эрнест Резерфорд, пытаясь найти экспериментальные подтверждения модели Томсона, провели свои знаменитые опыты по рассеиванию α-частиц на золотой фольге. Они использовали α-частицы вместо электронов, т.к. благодаря своей большей массе (в 7350 раз больше массы электрона) α-частицы не претерпевают заметного отклонения при столкновении с электронами, что позволяет регистрировать только столкновения с положительной частью атома.
Результат опытов оказался совершенно противоположным ожидаемому. Большинство α-частиц проходило через золотую фольгу по прямым или почти прямым траекториям, но в то же время некоторые α-частицы отклонялись на очень большие углы, что свидетельствовало о наличии в атоме чрезвычайно плотного положительно заряженного образования. Основываясь на этих экспериментальных фактах, Резерфорд в 1911 г. предложил свою ядерную модель атома: в центре атома находится положительно заряженное ядро, объём которого ничтожно мал по сравнению с размерами атома; вокруг ядра вращаются электроны, число которых приблизительно равно половине атомной массы элемента. Модель атома Резерфорда при несомненных достоинствах содержала важное противоречие: в соответствии с законами классической электродинамики вращающийся вокруг ядра электрон должен был непрерывно испускать электромагнитное излучение, теряя энергию. Вследствие этого радиус орбиты электрона должен был быстро уменьшаться, и рассчитанное из этих представлений время жизни атома оказывалось ничтожно малым.
Вследствие этого радиус орбиты электрона должен был быстро уменьшаться, и рассчитанное из этих представлений время жизни атома оказывалось ничтожно малым.
С. И. ЛЕВЧЕНКОВ
КРАТКИЙ ОЧЕРК ИСТОРИИ ХИМИИ
Учебное пособие для студентов химфака РГУ
Copyright © С.И.Левченков, 2006.
В 1911 г. Дж.Резерфорд на основании анализа результатов эксперимента по рассеянию альфа-частиц на атомах выдвинул планетарную модель строения атома. Согласно этой модели атом состоит из тяжелого положительно заряженного ядра очень малых размеров (~1014 м), вокруг которого по некоторым орбитам движутся электроны. Радиусы этих орбит составляют порядка 10-9м. Название «планетарная» у такой модели атома отражает очевидную аналогию с Солнечной системой, в которой планеты движутся по определенным орбитам вокруг массивного притягивающего центра — Солнца.
Однако, в отличие от планетарной модели Солнечной системы, планетарная модель атома оказывается противоречивой с точки зрения классической физики. И это, прежде всего, связано с наличием у электрона заряда.
Согласно законам классической электродинамики вращающийся вокруг ядра электрон, как и любая ускоренно движущаяся заряженная частица, будет излучать электромагнитные волны. Спектр такого излучения должен быть непрерывным, то есть содержать электромагнитные волны с любой длиной волны. Этот вывод противоречит наблюдаемым в экспериментах линейным спектрам излучения атомов.
Кроме того, непрерывное излучение будет уменьшать энергию электрона. Поэтому радиус орбиты движущегося электрона обязан уменьшаться, и, в конце концов, электрон должен упасть на ядро. Иными словами, планетарная модель атома с точки зрения классической физики оказывается неустойчивой.
«Физика в техническом университете»
В рамках решения вопроса природы химической связи нами было доказано, что молекулы являются устойчивой системой, а связывающие их электроны движутся с центростремительным ускорением и при этом энергия электронов (как потенциальная, так и кинетическая) не меняется.
Этот экспериментальный факт подтверждает раз, что теории основанные на ложной модели не могут быть корректными.
18.11.2009
Планетарная модель атома — Справочник химика 21
История развития представлений о строении атома. Резерфорд, установивший наличие у атомов ядра, предложил планетарную модель атома — электроны враш,аются вокруг ядра так же, как планеты вращаются вокруг Солнца. Однако из электродинамики известно, что вращающийся вокруг некоторого центра заряд является источником электромагнитных колебаний, поэтому электрон, излучая, должен был бы непрерывно терять энергию и в итоге упасть на ядро. В 1913 г. Бор (Дания) предположил, что в атоме существуют стационарные орбиты, по которым электрон может двигаться без излучения энергии для этих орбит, согласно Бору, должно выполняться соотношение [c.17]
При развитии модели строения атома водорода Бору необходимо было преодолеть прежде всего внутренние противоречия, которые имели место в планетарной модели атома. По представлениям классической электродинамики вращающийся электрон должен непрерывно излучать энергию в виде электромагнитных волн. Отсюда следует, что электрон должен упасть на ядро, а также при непрерывном излучении спектр водорода должен быть сплошным, т. е. содержать линии, отвечающие всевозможным длинам волн. Однако, как известно, атом водорода устойчив и спектр его имеет дискретную структуру (рис. 3.5). Отсюда можно было заключить, что механические и электрические свойства макроскопических тел не могут служить моделью для такой микросистемы, как атом водорода (а также вообще микросистем). Бор вынужден был искать новую модель, которая не противоречила бы известным фактам. [c.53]
По представлениям классической электродинамики вращающийся электрон должен непрерывно излучать энергию в виде электромагнитных волн. Отсюда следует, что электрон должен упасть на ядро, а также при непрерывном излучении спектр водорода должен быть сплошным, т. е. содержать линии, отвечающие всевозможным длинам волн. Однако, как известно, атом водорода устойчив и спектр его имеет дискретную структуру (рис. 3.5). Отсюда можно было заключить, что механические и электрические свойства макроскопических тел не могут служить моделью для такой микросистемы, как атом водорода (а также вообще микросистем). Бор вынужден был искать новую модель, которая не противоречила бы известным фактам. [c.53]
Строение электронной оболочки атома по Бору. Как уже указывалось, в своей теории Н. Бор исходил из планетарной модели атома. Основываясь на положении квантовой теории света о прерывистой, дискретной природе излучения и на линейчатом характере атомных спектров, он сделал вывод, что энергия электронов в атоме не может меняться непрерывно, а изменяется скачками, т.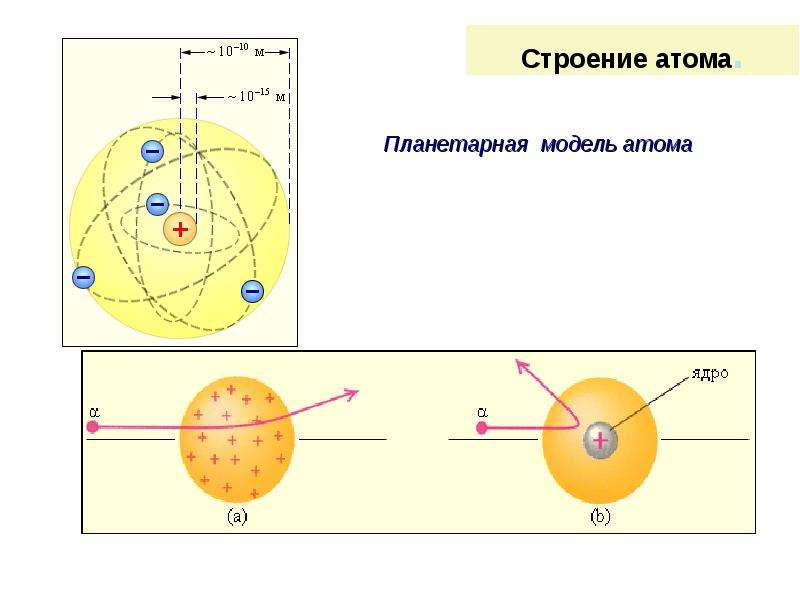 е. дискретно. Поэтому в атоме возможны не любые энергетические состояния электронов, а лишь определенные, разрешенные состояния. Иначе говоря, энергетические состояния электронов в атоме квантованы. Переход из одного разрешенного состояния в другое совершается скачкообразно и сопровождается испусканием или поглощением кванта электромагнитного излучения. [c.43]
е. дискретно. Поэтому в атоме возможны не любые энергетические состояния электронов, а лишь определенные, разрешенные состояния. Иначе говоря, энергетические состояния электронов в атоме квантованы. Переход из одного разрешенного состояния в другое совершается скачкообразно и сопровождается испусканием или поглощением кванта электромагнитного излучения. [c.43]
Правильность планетарной модели атома была вскоре подтверждена дальнейшими опытами с а- и р-частицами, пути которых стало возможным видеть и фотографировать благодаря разработанной в 1911 г. Вильсоном конденсационной камере. Принцип ее действия основан на том, что при охлаждении насыщенного паром воздуха капельки тумана [c.69]
Выводы Резерфорда стали основой для создания им планетарной модели атома вокруг положительно заряженного ядра атома, н котором сосредоточена основная часть массы атома, вращаются электроны. Заряды ядра и электронов численно равны, поэтому атом электронейтрален. Подобную модель называют теперь ядерной. [c.49]
Подобную модель называют теперь ядерной. [c.49]
Е) создании современной теории строения атома особую роль сыграли Эрнест Резерфорд, построивший планетарную модель атома (1911), и Нильс Бор, выдвинувший первую квантовую теорию атома (19П). [c.7]
Как должна была проявиться неустойчивость атомов в планетарной модели атома Резерфорда с точки зрения классической физики [c.17]
Существенный шаг в развитии представлений о строении атома сделал в 1913 г, Нильс Бор, предложивший теорию, объединяющую планетарную модель атома с квантовой теорией света, [c.41]
Планетарная модель атома [c.43]
Планетарная модель атома достаточно наглядно представляла строение атома. Пользуясь этой моделью, можно было объяснить некоторые свойства химических элементов, например способность одних атомов образовывать только положительно заряженные ионы, а других — только отрицательные. Однако планетарная модель атома находилась в противоречии с законами классической электродинамики, согласно которым вращающийся вокруг ядра электрон должен излучать энергию в виде электромагнитных волн. В соответствии с законом сохранения энергии излучение энергии электроном должно неизбежно сопровождаться уменьшением его скорости и электрон неминуемо должен упасть на ядро, в результате чего атом в виде планетарной системы должен перестать существовать. Иначе говоря, атомы должны излучать энергию в виде непрерывного, сплошного спектра и погибать как таковые. [c.45]
Однако планетарная модель атома находилась в противоречии с законами классической электродинамики, согласно которым вращающийся вокруг ядра электрон должен излучать энергию в виде электромагнитных волн. В соответствии с законом сохранения энергии излучение энергии электроном должно неизбежно сопровождаться уменьшением его скорости и электрон неминуемо должен упасть на ядро, в результате чего атом в виде планетарной системы должен перестать существовать. Иначе говоря, атомы должны излучать энергию в виде непрерывного, сплошного спектра и погибать как таковые. [c.45]
Строение электронных оболочек атома. Планетарная модель атома 43 8. Модель атома по Бору 45 9. Состояние электронов в атомах 48 10. Атомные орбитали 49 11. Периодический закон и периодическая система химических элементов Д. И. Менделеева 54 [c.381]
Уравнение Шредингера — дифференциальное уравнение в частных производных и может иметь множество решений. Однако физический смысл имеют лишь те Ч -функции (так называемые собственные функции), которые удовлетворяют ряду условий. Во-первых, эти функции должны быть непрерывными, конечными, однозначными и обращаться в нуль на бесконечном расстоянии. Наложение перечисленных условий называется нормированием -функции . Во-вторых, собственным -функциям соответствуют не любые, а только дискретные значения полной энергии Е. Как дискретные значения энергии, так и вид собственных Т-функций определяются совокупностью квантовых чисел п, I, т, которые хотя и не содержатся в самом уравнении Шредингера, но вводятся в него при решении. Таким образом, квантование энергии естественно и неизбежно вытекает из коренных свойств материальных объектов и не нуждается в особом постулировании, которое было сделано И. Бором при разработке планетарной модели атома. [c.10]
Во-первых, эти функции должны быть непрерывными, конечными, однозначными и обращаться в нуль на бесконечном расстоянии. Наложение перечисленных условий называется нормированием -функции . Во-вторых, собственным -функциям соответствуют не любые, а только дискретные значения полной энергии Е. Как дискретные значения энергии, так и вид собственных Т-функций определяются совокупностью квантовых чисел п, I, т, которые хотя и не содержатся в самом уравнении Шредингера, но вводятся в него при решении. Таким образом, квантование энергии естественно и неизбежно вытекает из коренных свойств материальных объектов и не нуждается в особом постулировании, которое было сделано И. Бором при разработке планетарной модели атома. [c.10]
Ядро занимает ничтожную часть атома. Если атом увеличить до размера футбольного поля, то ядро будет иметь величину булавочной головки. Э. Резерфорд предложил планетарную модель атома, в которой ядро играет роль Солнца, вокруг которого подобно планетам вращаются электроны. В отличие от планет все электроны совершенно одинаковы. Такое представление о строении атома в общем сохранилось и в современной физике, хотя оно и подверглось весьма значительному пересмотру и усовершенствованию. [c.145]
В отличие от планет все электроны совершенно одинаковы. Такое представление о строении атома в общем сохранилось и в современной физике, хотя оно и подверглось весьма значительному пересмотру и усовершенствованию. [c.145]
Таким образом, спектрограмма излучения данного элемента представляет собой набор большого числа линий, каждая из которых соответствует глубине расположения электронов в атоме. Спектрограмма показывает, что электроны в атоме находятся на различных глубинах , т. е. на различных расстояниях от ядра. Существенно, что атомы каждого элемента имеют свои строго индивидуальные спектры, отличающиеся от спектров остальных элементов. На этом основан спектральный анализ. Расшифровка атомных спектров и привела к дальнейшему развитию планетарной модели атома, созданной великим датским физиком Н. Бором. Изучение спектров излучения и поглощения элементов показало, что электроны во всех атомах располагаются упорядоченно, т. е. определенными группами в нескольких слоях вокруг ядра. Чем дальше находится электрон от ядра, тем слабее он притягивается к атому. Поэтому такие внешние, или периферийные, электроны относительно легко удаляются от атома. Они могут переходить от атомов, которые их удерживают слабо, к атомам, сильнее притягивающим электроны. Подобные переходы и вообще изменения в состоянии внешних электронов и составляют сущность всех химических реакций. [c.147]
Чем дальше находится электрон от ядра, тем слабее он притягивается к атому. Поэтому такие внешние, или периферийные, электроны относительно легко удаляются от атома. Они могут переходить от атомов, которые их удерживают слабо, к атомам, сильнее притягивающим электроны. Подобные переходы и вообще изменения в состоянии внешних электронов и составляют сущность всех химических реакций. [c.147]
Еще до появления планетарной модели атома был отвергнут тезис классической электромагнитной теории света о непрерывности излучения. Тезису, гласящему, что скачков не бывает, а есть только непрерывность, с полным правом можно противопоставить антитезис, по смыслу которого в действительности изменение всегда совершается скачками, но только ряд мелких и быстро следующих один За другим скачков сливается для нас в один непрерывный процесс (Плеханов). Таким антитезисом явилась квантовая теория (Планк, 1900 г.). [c.78]
Планетарная модель атома Э. Резерфорда, Н.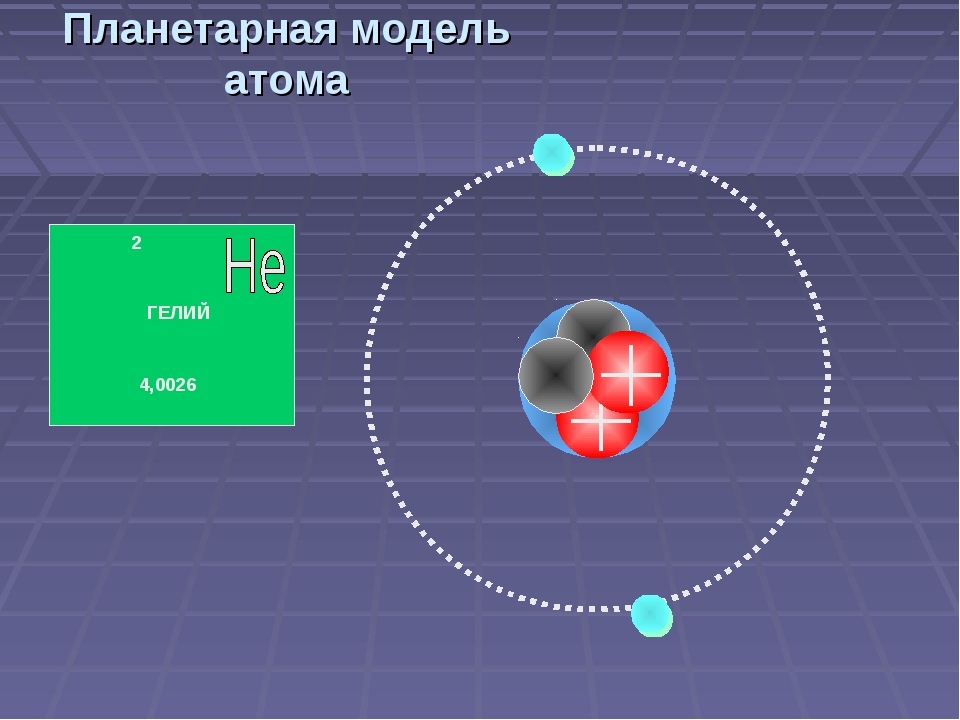 Бора, А. Зоммерфельда позволяет создать качественную картину строения электронных оболочек атомов элементов периодической системы Д. И. Менделеева, объяснить атомные спектры, количественно рассчитать энергию электрона в атоме водорода и объяснить эффект расщепления спектральных линий атомов в магнитном и электрическом поле. Однако, несмотря на отмеченные достоинства, в процессе разработки и практического использования этой теории обнаружились принципиальные недостатки, а именно [c.199]
Бора, А. Зоммерфельда позволяет создать качественную картину строения электронных оболочек атомов элементов периодической системы Д. И. Менделеева, объяснить атомные спектры, количественно рассчитать энергию электрона в атоме водорода и объяснить эффект расщепления спектральных линий атомов в магнитном и электрическом поле. Однако, несмотря на отмеченные достоинства, в процессе разработки и практического использования этой теории обнаружились принципиальные недостатки, а именно [c.199]
В 1898 г. Томсон предложил модель атома, в которой атом рассматривается как облако положительно заряженных частиц с распыленными в нем электронами. А в 1911 г., благодаря известному опыту Резерфорда, была принята планетарная модель атома. [c.15]
Модель атома Бора. Планетарная модель атома Резерфорда отражала ту очевидную истину, что основная масса атома содержится в ничтожно малой части объема — атомном ядре, а в остальной части объема атома распределены электроны. Однако характер движения электрона по орбите вокруг ядра атома противоречит теории движения электрических зарядов — электродинамике. [c.47]
Однако характер движения электрона по орбите вокруг ядра атома противоречит теории движения электрических зарядов — электродинамике. [c.47]
Опыты Резерфорда утвердили планетарную модель атома в науке. Однако оставался неясным вопрос о причине устойчивости систем, которые состоят из положительно заряженного ядра и отрицательно заряженных электронов, вращающихся вокруг него. Такая система могла бы быть устойчивой, если бы центростремительная сила сохранялась равной силе кулоновского притяжения т. е. было бы справедливо равенство [c.57]
Атомные модели. Планетарная модель атома имела большое принципиальное значение как новый и значительный шаг по пути познания внутренней структуры атома. Однако на первых порах она не могла быть уточнена, так как неизвестно было ни число, ни расположение электронов в атомах отдельных элементов. [c.62]
Планетарная модель атома. Основоположником современного учения об атоме является английский физик Резерфорд, который убедительными опытами показал, что практически вся масса и положительно заряженная материя атома сконцентрированы в малой части его объема. Эту часть атома Резерфорд назвал ядром. Положительный заряд ядра компенсируется вращающимися вокруг него электронами. В этой модели атома электроны напоминали планеты солнечной снсте- [c.40]
Эту часть атома Резерфорд назвал ядром. Положительный заряд ядра компенсируется вращающимися вокруг него электронами. В этой модели атома электроны напоминали планеты солнечной снсте- [c.40]
Датский физик Бор в 1903 г. внес в планетарную модель атома Резерфорда квантовые представления и объяснил происхождение линейчатых спектров атомов. Его теория строения атома водорода основывается иа двух постулатах . [c.48]
Планетарная модель атома сохранилась и в современных представлениях. [c.67]
Опыты Резерфорда утвердили планетарную модель атома в науке. Однако оставался неясным вопрос о приев [c.68]
В 19П г. выдающийся английский физик Э. Резерфорд предложил планетарную модель атома, которая базировалась на законах классической механики, описывающей движение макрообъектов. Согласно этой модели атом состоит из положительно заряженного ядра и электронов, которые вращаются вокруг ядра по круговым орбитам, подобно вращению планет вокруг Солнца. В ядре атома сосредоточена почти вся масса атома. Число электронов в ато.ме численно равно заряду ядра, [c.34]
В ядре атома сосредоточена почти вся масса атома. Число электронов в ато.ме численно равно заряду ядра, [c.34]
Планетарная модель атома была развита затем в работах датского физика Н. Бора и других ученых. [c.35]
В создании современной теории строения атома особую роль сыграли Э. Резерфорд, создавший планетарную модель атома (1911), и [c.5]
История развития представлений о строении атома. Резерфорд, установивший наличие у атомов ядра, предложил планетарную модель атома — электроны вращаются вокруг ядра так же, как планеты вращаются токруг Солнца. Однако из электродинамики известно, что вращающийся вокруг некоторого центра заряд является источником электромагнитных колебаний, поэтому электрон, излучая, должен был бы непрерывно терять энергию и в итоге упасть на ядро. [c.14]
Результаты опыта Резерфорд об1.яснил, предложив планетарную модель атома, уподоблявшую его солнечной системе. Согласно планетарной модели в центре атома находится очень маленькое ядро, размеры которого приблизительно в 100000 раз меньше размеров самого атома. Это ядро заключает в себе почти [c.38]
Согласно планетарной модели в центре атома находится очень маленькое ядро, размеры которого приблизительно в 100000 раз меньше размеров самого атома. Это ядро заключает в себе почти [c.38]
Необходимо отметить, что впервые планетарная модель атома была предложена русским ученым профессором Б. Н. Чичериным, о чем Д. И. Менделеев доложил 4 февраля 1888 г. на заседании РФХО. Однако в международной научной литературе публикация об этом открытии сделана не была [c.49]
Для обоснования планетарной модели атома водорода Бор воспользовался теорией квантов Планка. Он предположил, что в атомах может существовать лишь определенное расположение электронов, которое Бор назвал устойчивыми состояниями. Каждое такое состояние характеризуется своей энергией. Таким образом. Бор отказался от идеи о непрерывном излучении энергии электронами в атомах, но не смог освободиться от прнменения классической механики к структурам микромира. Б этом исходная принципиальная несостоятельность его выводов. [c.53]
[c.53]
Атомы И молекулы — системы, построенные из микрочастиц — 51дер и электронов. В начале XX в. выяснилось, что классическая физика не в состоянии правильно описать состояние этих систем. Бор создал теорию атома, носящую его имя, сохранив планетарную модель атома Резерфорда и введя в нее новые идеи квантовой теории Планка — Эйн-щтейна. Поразительный успех теории Бора в описании атома водорода и объяснении его спектра не мог быть распространен на более сложные атомы из-за противоречивости между квантовыми и классическими представлениями, лежащими в ее основе. Однако теория Бора оставила глубокий след в физике. Новая физическая теория — квантовая механика возникла из работ де Бройля, Шредингера, Гейзенберга, Дирака и др. [c.7]
К числу наиболее важных моделей следует отнести планетарную модель атома, предложенную Резерфордом (1911). Им было обнаружено, что при прохождении пучка а-частиц сквозь тонкие слои образцов чистых металлов происходит лишь небольшое их рассеяние, только малая доля а-частиц отклоняется на угол рассеяния более 90°. Причем примерно 1 частица из 10 000 отражалась в обратном направлении, Для объяснения результатов опытов Резерфорд предложил планетарную модель строения атома, сходную со строением солнечной системы. В центре атома находится положительно заряженное ядро, размеры которого (10 см) очень малы по сравнению с размерами атома (10 см), а масса ядра почти равна массе атома. Вокруг ядра движутся электроны, число которых в нейтральных атомах равно величине заркда ядра. Вскоре было показано, что положительный заряд, выраженный в единицах элементарного заряда, равен порядковому номеру элемента в периодической системе. Численные значения заряда ядра были найдены Мозли (1913) на основе изучения рентгеновских спектров и Чедвиком (1920) из данных -по рассеянию а-частиц. [c.43]
Причем примерно 1 частица из 10 000 отражалась в обратном направлении, Для объяснения результатов опытов Резерфорд предложил планетарную модель строения атома, сходную со строением солнечной системы. В центре атома находится положительно заряженное ядро, размеры которого (10 см) очень малы по сравнению с размерами атома (10 см), а масса ядра почти равна массе атома. Вокруг ядра движутся электроны, число которых в нейтральных атомах равно величине заркда ядра. Вскоре было показано, что положительный заряд, выраженный в единицах элементарного заряда, равен порядковому номеру элемента в периодической системе. Численные значения заряда ядра были найдены Мозли (1913) на основе изучения рентгеновских спектров и Чедвиком (1920) из данных -по рассеянию а-частиц. [c.43]
Так как атомы электронейтральны, то, следовательно, в них должны содержаться и какие-то частицы, заряженные положительно. При изучении внутреннего строения атомов очень важное значение имели опыты по рассеянию а-частиц при прохождении их в газе и через металлическую фольгу (а-частицы заряжены положительно). В камере Вильсона наблюдаются прямолинейные пути а-частиц в газе. Следовательно, а-частица проходит сквозь атомы. Однако она, хотя и редко, но резко отклоняется от прямолинейного пути, что указывает на столкновение ее с положительно заряженной частицей. Эти наблюдения привели к выводу, что атом состоит из положительно заряженного ядра весьма малого объема (г = = Ю- з см), в котором сосредоточена почти вся масса атома, и электронов, находящихся на значительном расстоянии от ядра. На основании обобщения экспериментальных данных, Резерфорд в 1911 г. предложил планетарную модель атома, согласно которой атом в целом дейтраден. а положительно заряженное ядро его окружено эле1 омм п ичем ч заряду ядра (порядковому [c.15]
В камере Вильсона наблюдаются прямолинейные пути а-частиц в газе. Следовательно, а-частица проходит сквозь атомы. Однако она, хотя и редко, но резко отклоняется от прямолинейного пути, что указывает на столкновение ее с положительно заряженной частицей. Эти наблюдения привели к выводу, что атом состоит из положительно заряженного ядра весьма малого объема (г = = Ю- з см), в котором сосредоточена почти вся масса атома, и электронов, находящихся на значительном расстоянии от ядра. На основании обобщения экспериментальных данных, Резерфорд в 1911 г. предложил планетарную модель атома, согласно которой атом в целом дейтраден. а положительно заряженное ядро его окружено эле1 омм п ичем ч заряду ядра (порядковому [c.15]
Основываясь на опытах Гейгера и Марсдена, английский физик Резерфорд в 1911 г. предложил так называемую ядерную (планетарную) модель атома. [c.9]
Научные исследования посвящены атомной и ядер-ной физике и имеют непосредственное отношение к химии.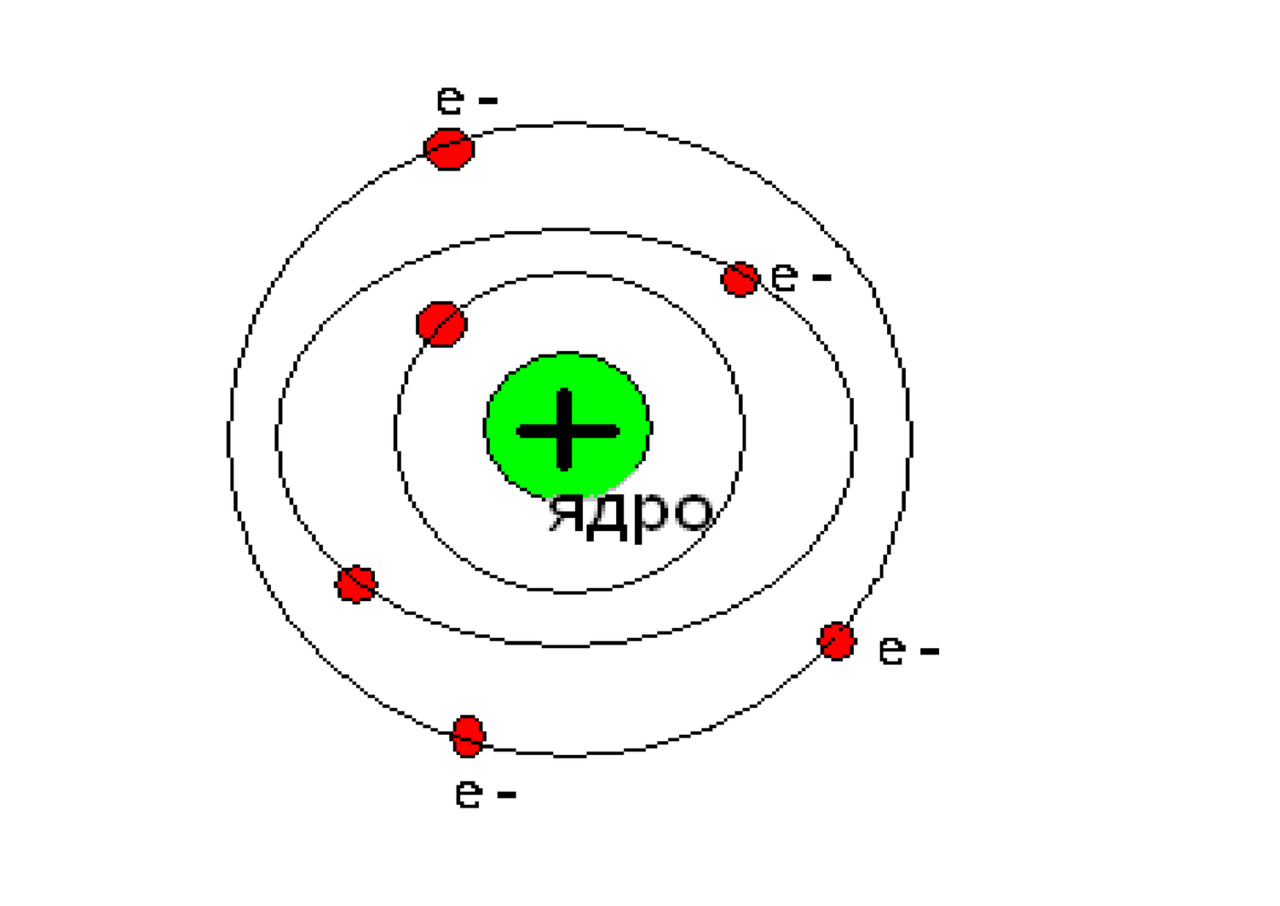 Заложил основы современного учения о радиоактивности и теории строения атома. Совместно с Ф. Содди разработал (1902) основные положения теории радиоактивного распада. Предложил ( 911) планетарную модель атома. Предсказал (1920) сушсст-вование и возможные свойства нейтрона, существование атома водорода с массой, равной 2 — дейтерия, и предложил называть ядро атома водорода протоном. [c.38]
Заложил основы современного учения о радиоактивности и теории строения атома. Совместно с Ф. Содди разработал (1902) основные положения теории радиоактивного распада. Предложил ( 911) планетарную модель атома. Предсказал (1920) сушсст-вование и возможные свойства нейтрона, существование атома водорода с массой, равной 2 — дейтерия, и предложил называть ядро атома водорода протоном. [c.38]
Планетарная модель атома Резерфорда, экспериментально наблюдаемый линейчатый характер атомных эмиссионных спектров, квантованность (согласно Планку и Эйнштейну) электромагнитного излучения легли в основу теории строения атома, которую предложил Бор в 191 3 г. [c.46]
Этот принципиальный недостаток модели в 1913 г. был устранен датским физиком Н. Бором, который распространил квантовый закон М. Планка на планетарную модель атома, предположив, что электрон в атоме не должен излучать энергию, если он движется по некоторым строго определенным стационарным орбитам. Каждой такой орбите соовтетствуют строго определенные значення энергии Е , Е , з и т. д.. [c.190]
Каждой такой орбите соовтетствуют строго определенные значення энергии Е , Е , з и т. д.. [c.190]
Не спасает положения и естественное, казалось бы, предположение о том, что электроны вокруг ядра движутся по эллиптическим орбитам подобно планетам вокруг Солнца На эту мысль наталкивает сходство сил всемирного тяготения с кулоновскими Такая планетарная модель атома удержалась в физике до наших дней, но не более как наглядное изображение Реально атом в форме такой планетарной системы не может существовать, так как вращающиеся вокруг ядра электроны движутся ускоренно Но тогда они, как всякие ускоренно движущиеся заряженные частицы, должны излучать электромагнитные волны Действительно, если застав1пъ электроны двигаться по кругу (как в ускорителях элементарных частиц — синхротронах), то возникнет электромагнитное синхрот-ронное излучение [c.9]
Данные, полученные Э. Резерфордом, послужили основой для создания так называемой ядерной или планетарной модели атома, предложенной им в 1911 г. Согласно этой модели, электроны, подобно планетам солнечной системы, двигаются по круговым, вернее эллиптическим орбитам вокруг центра, в котором размещается положительно заряженное ядро. Так как атом электрически нейтрален, то заряд его ядра должен быть равен сумме зарядов всех вращающихся вэкруг него электронов. [c.16]
Согласно этой модели, электроны, подобно планетам солнечной системы, двигаются по круговым, вернее эллиптическим орбитам вокруг центра, в котором размещается положительно заряженное ядро. Так как атом электрически нейтрален, то заряд его ядра должен быть равен сумме зарядов всех вращающихся вэкруг него электронов. [c.16]
Атом
Атом (слово происходит от древне-греческого — неделимый) — это наименьшая часть химического элемента, являющаяся носителем его свойств.
Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и электрически нейтральных нейтронов, а окружающее его облако состоит из отрицательно заряженных электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов — изотопу этого элемента.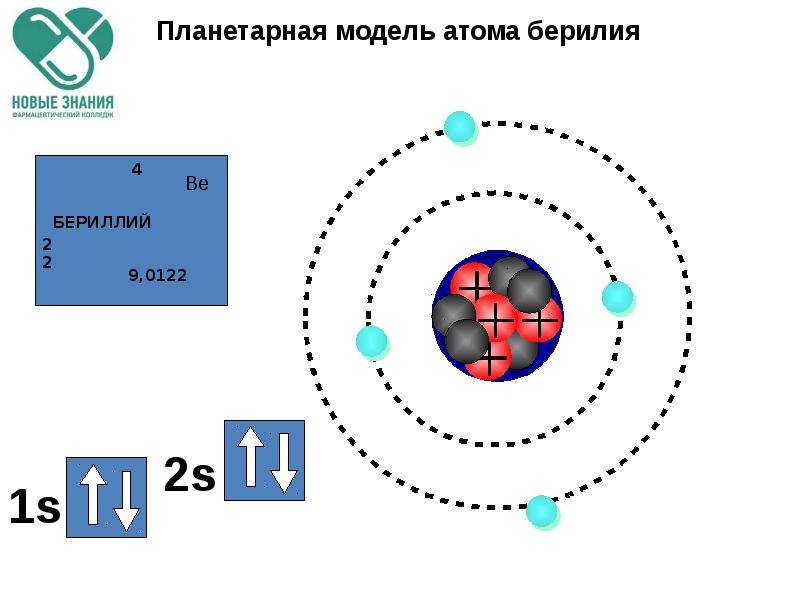
Атомы различного вида в различных количествах связанные межатомными связями образуют молекулы.
Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами. В XVII и XVIII веках химикам удалось экспериментально подтвердить эту идею, показав, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы с помощью химических методов. Однако в конце XIX — начале XX века физиками были открыты субатомные частицы и составная структура атома, и стало ясно, что атом в действительности не является «неделимым».
Модели атомов
Кусочки материи. Демокрит полагал, что свойства того или иного вещества определяются формой, массой, и прочими характеристиками образующих его атомов. Например, у огня атомы остры, поэтому огонь способен обжигать, у твёрдых тел они шероховаты, поэтому накрепко сцепляются друг с другом, у воды — гладки, поэтому она способна течь. Даже душа человека, согласно Демокриту, состоит из атомов.
Даже душа человека, согласно Демокриту, состоит из атомов.
Модель атома Томсона (модель «Пудинг с изюмом», английское значение Plum pudding model). Джозеф Джон Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Эта модель не объясняла дискретный характер излучения атома и его устойчивость. Была окончательно опровергнута Эрнестом Резерфордом после проведённого им знаменитого опыта по рассеиванию альфа-частиц.
Ранняя планетарная модель атома Нагаоки. В 1904 году японский физик Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн[гор]. В этой модели вокруг маленького положительного ядра по орбитам вращались электроны, объединённые в кольца. Модель оказалось ошибочной, но некоторые важные её положения вошли в модель английского физика Эрнеста Резерфорда.
Планетарная модель атома Бора-Резерфорда. В 1911 году Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»).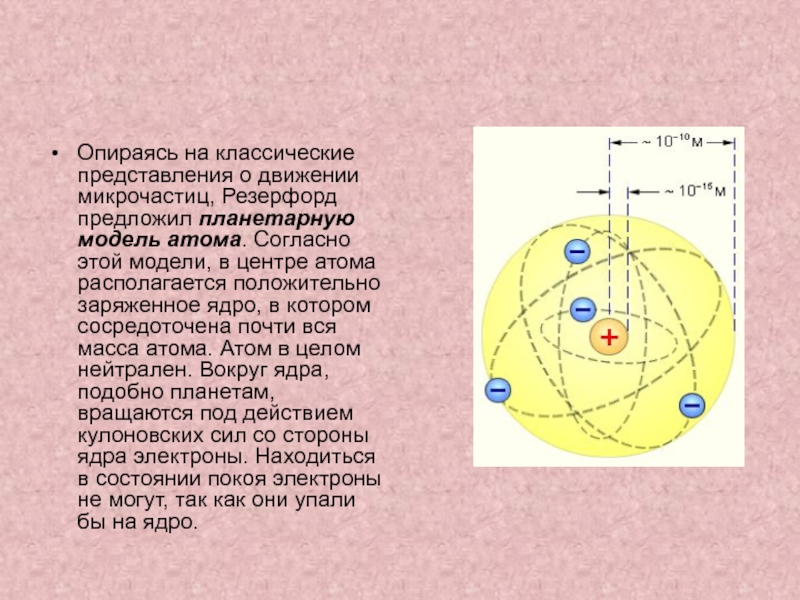 Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а следовательно, терять энергию. Расчеты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно.
Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а следовательно, терять энергию. Расчеты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно.
28 февраля 1919 года Нильс Бор предложил планетарную модель строения атома. И только спустя 9 лет его наградили за это Нобелевской премией в 1922 году. Опыты по изучению прохождения электрического тока через жидкости, проводимые Фарадеем, дали представление об электричестве как отдельных единичных зарядах. Величины этих зарядов были определены при изучении прохождения электрического тока через газы. Открытие самопроизвольного распада атомов привело к представлению о сложности атома. Открытие ядер атома дало возможность Резерфорду в 1911 году построить одну из первых моделей строения атома. Согласно теории Бора электрон вращается вокруг атома по строго стационарным круговым орбитам. Бор ввел понятие квантового соотношения между радиусом орбиты и скоростью электрона. Впоследствии теория Бора была дополнена и переосмыслена.
Бор ввел понятие квантового соотношения между радиусом орбиты и скоростью электрона. Впоследствии теория Бора была дополнена и переосмыслена.
Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает («модель атома Бора-Резерфорда»). Постулаты Нильса Бора показали, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
Современное представление об атоме
Сегодня общепринятой является модель атома, являющаяся развитием планетарной модели. Считается, что ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяется количеством протонов, в то время как количество нейтронов на химические свойства практически не влияет; при этом нейтронов в ядре, как правило, больше, чем протонов. Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).
Массу атома принято измерять в атомных единицах массы, равных 1/12 от массы атома стабильного изотопа углерода 12C.
Валентность
Внешняя электронная оболочка атома, если она не полностью заполнена, называется валентной оболочкой, а электроны этой оболочки называются валентными электронами. Число валентных электронов определяет то, как атом связывается с другими атомами посредством химической связи. Путём образования химических связей атомы стремятся заполнить свои внешние валентные оболочки.
Путём образования химических связей атомы стремятся заполнить свои внешние валентные оболочки.
Чтобы показать повторяющиеся химические свойства химических элементов, их упорядочивают в виде периодической таблицы (таблицы Менделеева). Элементы с одинаковым числом валентных электронов формируют группу, которая изображается в таблице в виде столбца (движение по горизонтальному ряду соответствуют заполнению валентной оболочки электронами). Элементы, находящиеся в самом правом столбце таблицы, имеют полностью заполненную электронами внешнюю оболочку, поэтому они отличаются крайне низкой химической активностью и называются инертными или благородными газами.
***
В атоме нет твердых частей. Предметы состоят из атомов. Но предметы твердые! Например, палец, приложенный к кирпичной стене, не проходит сквозь нее. Это связано с различиями частотных характеристик атомов и электрическими зарядами. У каждого типа атомов своя частота вибраций. Этим определяются различия физических свойств предметов. Если бы было можно менять частоту вибраций атомов, из которых состоит тело, то человек смог бы пройти сквозь стены. Но вибрационные частоты атомов руки и атомов стены близки. Поэтому палец упирается в стену.
Если бы было можно менять частоту вибраций атомов, из которых состоит тело, то человек смог бы пройти сквозь стены. Но вибрационные частоты атомов руки и атомов стены близки. Поэтому палец упирается в стену.
Для любых видов взаимодействий необходим частотный резонанс. Если осветить каменную стену светом карманного фонаря, то свет будет задержан стеной. Но излучение мобильного телефона легко пройдет сквозь эту стену. Все дело в различиях частот между излучением фонаря и мобильного телефона.
Пока вы читаете[en] этот текст, сквозь ваше тело проходят потоки самого различного излучения. Это космическое излучение, радиосигналы, сигналы миллионов мобильных телефонов, излучение, идущее из земли, солнечная[гор] радиация, излучение, которое создают бытовые приборы. Вы это не ощущаете, поскольку можете видеть только свет, а слышать только звук.
Даже если вы сидите в тишине с закрытыми глазами[en], сквозь вашу голову проходят миллионы телефонных разговоров, картины телевизионных новостей и сообщений по радио. Вы это не воспринимаете, поскольку нет резонанса частот между атомами из которых состоит ваше тело и излучением. Но если резонанс есть, — то вы немедленно реагируете. Например, когда вы вспоминаете о близком человеке, который только что подумал о вас.
Вы это не воспринимаете, поскольку нет резонанса частот между атомами из которых состоит ваше тело и излучением. Но если резонанс есть, — то вы немедленно реагируете. Например, когда вы вспоминаете о близком человеке, который только что подумал о вас.
Все во вселенной подчиняется законам резонанса.
Подробнее атомах читайте в литературе:
- Бете Г., Солпитер Э. Квантовая механика атомов с одним и двумя электронами. — Москва: Физматгиз, 1960. — 562 с.;
- Бейдер Р. Атомы в молекулах. Квантовая теория. М.: Мир, 2001. — 532 c.;
- Веселов М. Г., Лабзовский Л. Н. Теория атома: Строение электронных оболочек. — М.: Наука, 1986. — 328 с.;
- Зоммерфельд А. Строение атома и спектры. Том 1 — М.: ГИТТЛ, 1956;
- Зоммерфельд А. Строение атома и спектры. Том 2 — М.: ГИТТЛ, 1956;
- Шпольский Э. В. Атомная физика. Том 2. Основы квантовой механики и строение электронной оболочки атома 4-е изд. — М.: Наука, 1974.
- Википедия/Wikipedia.

Создание планетарной модели атома. Школьная энциклопедия
Представление о том, что атомы являются мельчайшими частицами вещества, впервые возникло во времена Древней Греции. Однако только лишь в конце XVIII века благодаря работе таких ученых, как А. Лавуазье, М. В. Ломоносов и некоторых других, было доказано, что атомы действительно существуют. Однако в те времена никто не задавался вопросом о том, каким является их внутреннее строение. Ученые все еще расценивали атомы в качестве неделимых «кирпичиков», из которых состоит вся материя.
Попытки объяснить строение атома
Кто предложил ядерную модель первым из всех ученых? Первая попытка создать модель этих частиц принадлежала Дж. Томсону. Однако удачной в полном смысле этого слова назвать ее нельзя. Ведь Томсон полагал, что атом представляет собой шарообразную и электрически нейтральную систему. При этом ученый предполагал, что положительный заряд распределен равномерно по объему этого шара, а внутри него находится отрицательно заряженное ядро. Все попытки ученого объяснить внутреннее строение атома оказались неудачными. Эрнест Резерфорд — тот, кто предложил ядерную модель строения атома через несколько лет после того, как Томсон выдвинул свою теорию.
Все попытки ученого объяснить внутреннее строение атома оказались неудачными. Эрнест Резерфорд — тот, кто предложил ядерную модель строения атома через несколько лет после того, как Томсон выдвинул свою теорию.
История исследований
При помощи исследования электролиза в 1833 году Фарадею удалось установить, что ток в растворе электролитов представляет собой поток заряженных частиц, или ионов. На основании этих исследований он смог определить минимальный заряд иона. Также немаловажную роль в развитии данного направления в физике сыграл отечественный химик Д. И. Менделеев. Именно он впервые поставил в научных кругах вопрос о том, что все атомы могут иметь одинаковую природу. Мы видим, что до того, как впервые была предложена ядерная модель строения атома Резерфорда, самыми разными учеными было проведено большое количество не менее важных экспериментов. Они продвинули атомистическую теорию строения вещества вперед.
Первые опыты
Резерфорд является действительно гениальным ученым, ведь его открытия перевернули представление о строении вещества. В 1911 году он смог поставить эксперимент, при помощи которого исследователи смогли заглянуть в загадочные глубины атома, получить представление о том, каково его внутреннее строение. Первые опыты были проведены ученым при поддержке других исследователей, однако главная роль в открытии принадлежала все-таки Резерфорду.
В 1911 году он смог поставить эксперимент, при помощи которого исследователи смогли заглянуть в загадочные глубины атома, получить представление о том, каково его внутреннее строение. Первые опыты были проведены ученым при поддержке других исследователей, однако главная роль в открытии принадлежала все-таки Резерфорду.
Эксперимент
Используя естественные источники радиоактивного излучения Резерфорд смог построить пушку, которая испускала поток альфа-частиц. Это был ящик, сделанный из свинца, внутри которого находилось радиоактивное вещество. В пушке была прорезь, благодаря которой все альфа-частицы попадали на свинцовый экран. Вылетать они могли только через прорезь. На пути этого пучка из радиоактивных частиц стояло еще несколько экранов.
Они отделяли частицы, которые отклонялись от заданного ранее направления. К мишени попадал строго сфокусированный В качестве мишени Резерфорд использовал тонкий лист из золотой фольги. После того как частицы попадали на этот лист, они продолжали свое движение и в конечном счете попадали на люминесцентный экран, который был установлен позади этой мишени.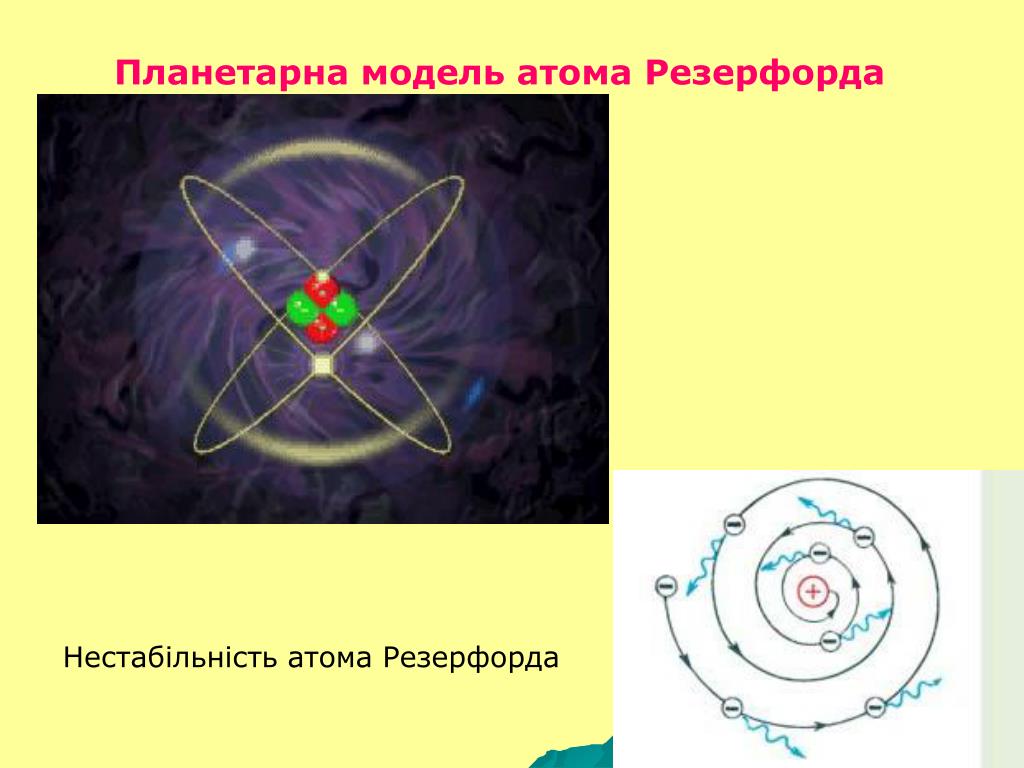 При попадании альфа-частиц на этот экран регистрировались вспышки, по которым ученый мог судить, сколько частиц отклоняются от первоначального направления при столкновении с фольгой и какова величина этого отклонения.
При попадании альфа-частиц на этот экран регистрировались вспышки, по которым ученый мог судить, сколько частиц отклоняются от первоначального направления при столкновении с фольгой и какова величина этого отклонения.
Отличия от предыдущих опытов
Школьники и студенты, которые интересуются тем, кто предложил ядерную модель строения атома, должны знать: подобные эксперименты проводились в физике и до Резерфорда. Их главная идея состояла в том, чтобы по отклонениям частиц от первоначальной траектории собрать как можно больше информации о строении атома. Все эти исследования привели к накоплению определенного объема информации в науке, провоцировали на размышление о внутреннем строении мельчайших частиц.
Уже в начале XX века ученым было известно, что в атоме содержатся электроны, имеющие отрицательный заряд. Но среди большинства исследователей преобладало мнение, что атом изнутри больше похож на сетку, заполненную отрицательно заряженными частицами. Подобные опыты позволили получить немало информации — к примеру, определить геометрические размеры атомов.
Гениальная догадка
Резерфорд обратил внимание, что никто из его предшественников ни разу не пробовал определить, могут ли альфа-частицы отклоняться под очень большими углами от своей траектории. Прежняя модель, иногда называемая среди ученых «пудинг с изюмом» (поскольку согласно данной модели электроны в атоме распределены подобно изюминкам в пудинге), просто не допускала существования внутри атома плотных компонентов структуры. Никто из ученых и не озабочивался тем, чтобы рассмотреть и такой вариант. Исследователь попросил своего студента переоборудовать установку таким образом, чтобы фиксировались и большие отклонения частиц от траектории — только для того, чтобы исключить такую возможность. Каково же было удивление и ученого, и его студента, когда оказалось, что некоторые частицы разлетаются под углом 180 о.
Что внутри атома?
Мы узнали, кто предложил ядерную модель строения атома и в чем заключался опыт этого ученого. На тот момент эксперимент Резерфорда был настоящим прорывом. Он был вынужден сделать вывод, что внутри атома большая часть массы заключена в очень плотном веществе. Схема ядерной модели строения атома предельно проста: внутри находится положительно заряженное ядро.
Он был вынужден сделать вывод, что внутри атома большая часть массы заключена в очень плотном веществе. Схема ядерной модели строения атома предельно проста: внутри находится положительно заряженное ядро.
Другие частицы, называемые электронами, вращаются вокруг этого ядра. Остальная же часть является на несколько порядков менее плотной. Расположение электронов внутри атома не является хаотичным — частицы располагаются в порядке возрастания энергии. Внутренние части атомов исследователь назвал ядрами. Названия, которые ввел ученый, используются в науке до сих пор.
Как подготовиться к уроку?
Те школьники, которые интересуются тем, кто предположил ядерную модель строения атома, могут блеснуть на уроке дополнительными знаниями. Например, можно рассказать о том, как Резерфорд, уже по прошествии длительного времени после своих экспериментов, любил приводить для своего открытия аналогию. В южноафриканскую страну доставляется контрабанда с оружием для повстанцев, которое заключено в тюках хлопка. Как таможенникам определить, где конкретно находятся опасные припасы, если весь поезд забит этими тюками? Таможенник может начать стрелять по тюкам, и там, где пули будут рикошетить, и находится оружие. Резерфорд подчеркивал, что именно так и было сделано его открытие.
Как таможенникам определить, где конкретно находятся опасные припасы, если весь поезд забит этими тюками? Таможенник может начать стрелять по тюкам, и там, где пули будут рикошетить, и находится оружие. Резерфорд подчеркивал, что именно так и было сделано его открытие.
Школьникам, которые готовятся к ответу по данной теме на уроке, желательно подготовить ответы на следующие вопросы:
1. Кто предложил ядерную модель строения атома?
2. В чем состоял смысл эксперимента?
3. Отличие ядерной модели от других моделей.
Значение теории Резерфорда
Те радикальные выводы, которые Резерфорд сделал из своих экспериментов, заставляли многих его современников сомневаться в истинности данной модели. Даже сам Резерфорд не был исключением — он опубликовал результаты своих исследований лишь через два года после открытия. Взяв за основу классические представления о том, как двигаются микрочастицы, он предложил ядерную планетарную модель строения атома. В целом атом обладает нейтральным зарядом. Вокруг ядра двигаются электроны — подобно тому, как вокруг Солнца вращаются планеты. Это движение происходит за счет кулоновских сил. В настоящий момент модель Резерфорда подверглась значительной доработке, однако открытие ученого не теряет своей актуальности и сегодня.
Вокруг ядра двигаются электроны — подобно тому, как вокруг Солнца вращаются планеты. Это движение происходит за счет кулоновских сил. В настоящий момент модель Резерфорда подверглась значительной доработке, однако открытие ученого не теряет своей актуальности и сегодня.
Планетарная модель атома
Планетарная модель атома: ядро (красное) и электроны (зелёные)
Планетарная модель атома , или модель Резерфорда , — историческая модель строения атома , которую предложил Эрнест Резерфорд в результате эксперимента с рассеянием альфа-частиц . По этой модели атом состоит из небольшого положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого движутся электроны , — подобно тому, как планеты движутся вокруг Солнца. Планетарная модель атома соответствует современным представлениям о строении атома с учётом того, что движение электронов имеет квантовый характер и не описывается законами классической механики . Исторически планетарная модель Резерфорда пришла на смену «модели сливового пудинга » Джозефа Джона Томсона , которая постулирует, что отрицательно заряженные электроны помещены внутрь положительно заряженного атома.
Новую модель строения атома Резерфорд предложил в 1911 году как вывод из эксперимента по рассеянию альфа-частиц на золотой фольге, проведённого под его руководством. При этом рассеянии неожиданно большое количество альфа-частиц рассеивалось на большие углы, что свидетельствовало о том, что центр рассеяния имеет небольшие размеры и в нём сосредоточен значительный электрический заряд. Расчёты Резерфорда показали, что рассеивающий центр, заряженный положительно или отрицательно, должен быть по крайней мере в 3000 раз меньше размера атома, который в то время уже был известен и оценивался как примерно 10 -10 м. Поскольку в то время электроны уже были известны, а их масса и заряд определены, то рассеивающий центр, который позже назвали ядром, должен был иметь противоположный электронам заряд. Резерфорд не связал величину заряда с атомным номером. Этот вывод был сделан позже. А сам Резерфорд предположил, что заряд пропорционален атомной массе.
Недостатком планетарной модели была её несовместимость с законами классической физики.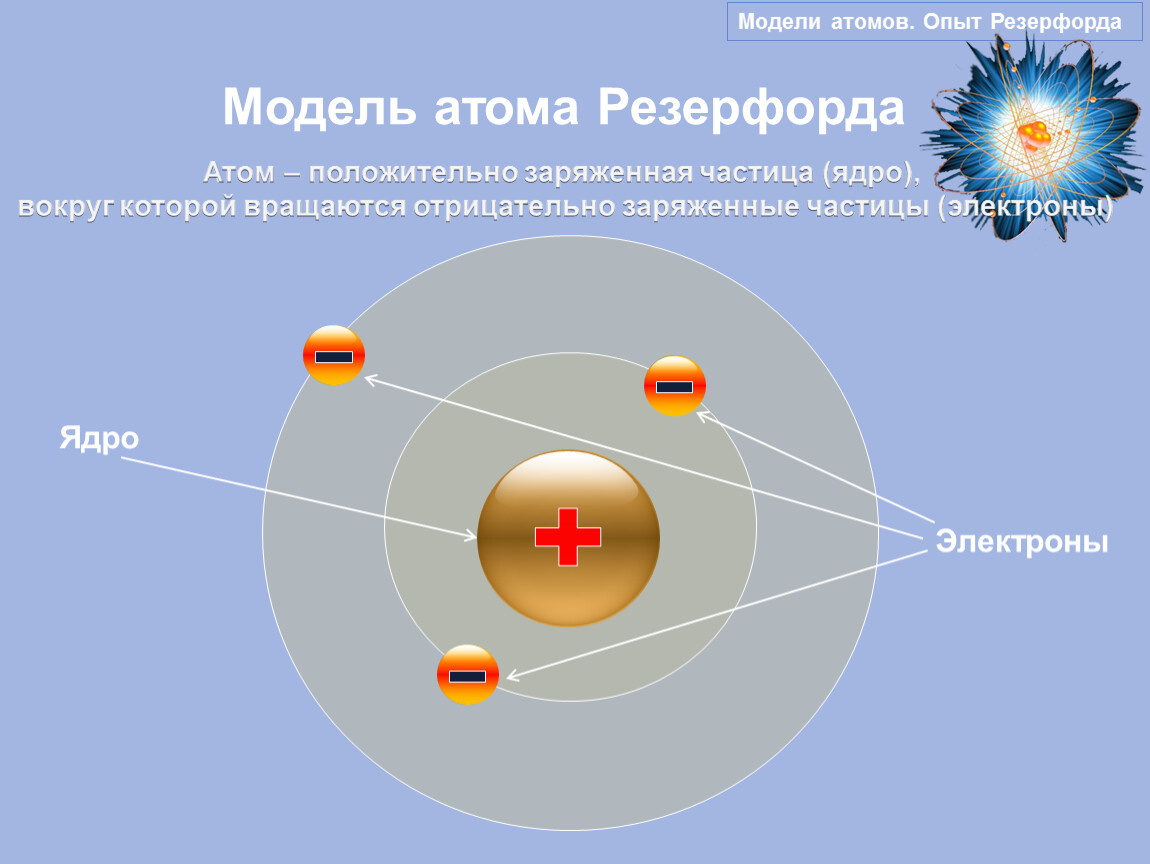 Если электроны движутся вокруг ядра как планеты вокруг Солнца, то их движение ускоренное, и, следовательно, по законам классической электродинамики они должны были бы излучать электромагнитные волны, терять энергию и падать на ядро. Следующим шагом в развитии планетарной модели стала модель Бора , постулирующая другие, отличные от классических, законы движения электронов. Полностью противоречия электродинамики смогла решить квантовая механика .
Если электроны движутся вокруг ядра как планеты вокруг Солнца, то их движение ускоренное, и, следовательно, по законам классической электродинамики они должны были бы излучать электромагнитные волны, терять энергию и падать на ядро. Следующим шагом в развитии планетарной модели стала модель Бора , постулирующая другие, отличные от классических, законы движения электронов. Полностью противоречия электродинамики смогла решить квантовая механика .
Wikimedia Foundation . 2010 .
Смотреть что такое «Планетарная модель атома» в других словарях:
планетарная модель атома — planetinis atomo modelis statusas T sritis fizika atitikmenys: angl. planetary atom model vok. Planetenmodell des Atoms, n rus. планетарная модель атома, f pranc. modèle planétaire de l’atome, m … Fizikos terminų žodynas
Боровская модель водородоподобного атома (Z заряд ядра), где отрицательно заряженный электрон заключен в атомной оболочке, окружающей малое, положительно заряженное атомное ядро … Википедия
Модель (франц. modèle, итал. modello, от лат. modulus мера, мерило, образец, норма), 1) образец, служащий эталоном (стандартом) для серийного ли массового воспроизведения (М. автомобиля, М. одежды и т. п.), а также тип, марка какого либо… …
modèle, итал. modello, от лат. modulus мера, мерило, образец, норма), 1) образец, служащий эталоном (стандартом) для серийного ли массового воспроизведения (М. автомобиля, М. одежды и т. п.), а также тип, марка какого либо… …
I Модель (Model) Вальтер (24.1.1891, Гентин, Восточная Пруссия, 21.4.1945, близ Дуйсбурга), немецко фашистский генерал фельдмаршал (1944). В армии с 1909, участвовал в 1 й мировой войне 1914 18. С ноября 1940 командовал 3 й танковой… … Большая советская энциклопедия
СТРОЕНИЕ АТОМА — (см.) построен из элементарных частиц трёх видов (см.), (см.) и (см.), образующих устойчивую систему. Протон и нейтрон входят в состав атомного (см.), электроны образуют электронную оболочку. В ядре действуют силы (см.), благодаря которым… … Большая политехническая энциклопедия
У этого термина существуют и другие значения, см. Атом (значения). Атом гелия Атом (от др. греч … Википедия
— (1871 1937), английский физик, один из создателей учения о радиоактивности и строении атома, основатель научной школы, иностранный член корреспондент РАН (1922) и почетный член АН СССР (1925). Родился в Новой Зеландии, после окончания… … Энциклопедический словарь
Родился в Новой Зеландии, после окончания… … Энциклопедический словарь
Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Книги
Первые сведения о сложном строении атома были получены при изучении процессов прохождения электрического тока через жидкости. В тридцатых годах XIX в. опыты выдающегося физика М. Фарадея навели на мысль о том, что электричество существует в виде отдельных единичных зарядов.
Открытие самопроизвольного распада атомов некоторых элементов, названное радиоактивностью, стало прямым доказательством сложности строения атома. В 1902 году английские учёные Эрнест Резерфорд и Фредерик Содди доказали, что при радиоактивном распаде атом урана превращается в два атома – атом тория и атом гелия. Это означало, что атомы не являются неизменными, неразрушимыми частицами.
В 1902 году английские учёные Эрнест Резерфорд и Фредерик Содди доказали, что при радиоактивном распаде атом урана превращается в два атома – атом тория и атом гелия. Это означало, что атомы не являются неизменными, неразрушимыми частицами.
Модель атома Резерфорда
Исследуя прохождение узкого пучка альфа-частиц через тонкие слои вещества, Резерфорд обнаружил, что большинство альфа-частиц проходит сквозь металлическую фольгу, состоящую из множества тысяч слоёв атомов, не отклоняясь от первоначального направления, не испытывая рассеяния, как будто бы на их пути не было никаких препятствий. Однако некоторые частицы отклонялись на большие углы, испытав действие больших сил.
На основании результатов опытов по наблюдению рассеивания альфа-частиц в веществе Резерфорд предложил планетарную модель строения атома. Согласно этой модели строение атома подобно строению солнечной системы. В центре каждого атома имеется положительно заряженное ядро радиусом ≈ 10 -10 м подобно планетам обращаются отрицательно заряженные электроны. Почти вся масса сосредоточена в атомном ядре. Альфа-частицы могут без рассеяния проходить через тысячи слоёв атомов так, как большая часть пространства внутри атомов пуста, а столкновения с лёгкими электронами почти не влияют на движение тяжёлой альфа-частицы. Рассеяние альфа-частиц происходит при столкновениях с атомными ядрами.
Почти вся масса сосредоточена в атомном ядре. Альфа-частицы могут без рассеяния проходить через тысячи слоёв атомов так, как большая часть пространства внутри атомов пуста, а столкновения с лёгкими электронами почти не влияют на движение тяжёлой альфа-частицы. Рассеяние альфа-частиц происходит при столкновениях с атомными ядрами.
Модель атома Резерфорда не смогла объяснить все свойства атомов.
Согласно законам классической физики атом из положительно заряженного ядра и электронов, обращающимся по круговым орбитам, должен излучать электромагнитные волны. Излучение электромагнитных волн должно приводить к уменьшению запаса потенциальной энергии в системе ядро – электрон, к постепенному уменьшению радиуса орбиты электрона и падению электрона на ядро. Однако атомы обычно не излучают электромагнитные волны, электроны не падают на атомные ядра, то есть атомы устойчивы.
Квантовые постулаты Н. Бора
Для объяснения устойчивости атомов Нильс Бор предложил отказаться от привычных классических представлений и законов при объяснении свойств атомов.
Основные свойства атомов получают последовательное качественное объяснение на основе принятия квантовых постулатов Н. Бора.
1. Электрон вращается вокруг ядра только по строго определенным (стационарным) круговым орбитам.
2. Атомная система может находиться лишь в определённых стационарных или квантовых состояниях, каждому из которых соответствует определённая энергия Е. Атом не излучает энергию в стационарных состояниях.
Стационарное состояние атома с минимальным запасом энергии называется основным состоянием , все остальные состояния называются возбуждёнными (квантовыми) состояниями. В основном состоянии атом может находиться бесконечно долго, время жизни атома в возбуждённом состоянии длится 10 -9 -10 -7 секунды.
3. Излучение или поглощение энергии происходит только при переходе атома из одного стационарного состояния в другое. Энергия кванта электромагнитного излучения при переходе из стационарного состояния с энергией Е m в состояние с энергией Е n равна разности энергий атома в двух квантовых состояниях:
∆Е = Е m – Е n = hv,
где v – частота излучения, h = 2ph = 6,62 ∙ 10 -34 Дж ∙с.
Квантовая модель строения атома
В дальнейшем некоторые положения теории Н. Бора были дополнены и переосмыслены. Наиболее значительным изменением стало введение понятие об электронном облаке, которое сменило понятие об электроне только как частице. Позже теорию Бора сменила квантовая теория, которая учитывает волновые свойства электрона и других элементарных частиц, образующих атом.
Основой современной теории строения атома является планетарная модель, дополненная и усовершенствованная. Согласно данной теории, ядро атома состоит из протонов (положительно заряженных частиц) и нейронов (не имеющих заряда частиц). А вокруг ядра по неопределённым траекториям движутся электроны (отрицательно заряженные частицы).
Остались вопросы? Хотите знать больше о моделях строения атома?
Чтобы получить помощь репетитора – зарегистрируйтесь .
Первый урок – бесплатно!
сайт,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Масса электронов в несколько тысяч раз меньше массы атомов. Так как атом в целом нейтрален, то, следовательно, основная масса атома приходится на его положительно заряженную часть.
Для экспериментального исследования распределения положительного заряда, а значит, и массы внутри атома Резерфорд предложил в 1906 г. применить зондирование атома с помощьюα -частиц. Эти частицы возникают при распаде радия и некоторых других элементов. Их масса примерно в 8000 раз больше массы электрона, а положительный заряд равен по модулю удвоенному заряду электрона. Это не что иное, как полностью ионизированные атомы гелия. Скорость α -частиц очень велика: она составляет 1/15 скорости света.
Этими
частицами Резерфорд бомбардировал
атомы тяжелых элементов. Электроны
вследствие своей малой массы не могут
заметно изменить траекторию α -частицы,
подобно тому как камушек в несколько
десятков граммов при столкновении с
автомобилем не в состоянии заметно
изменить его скорость.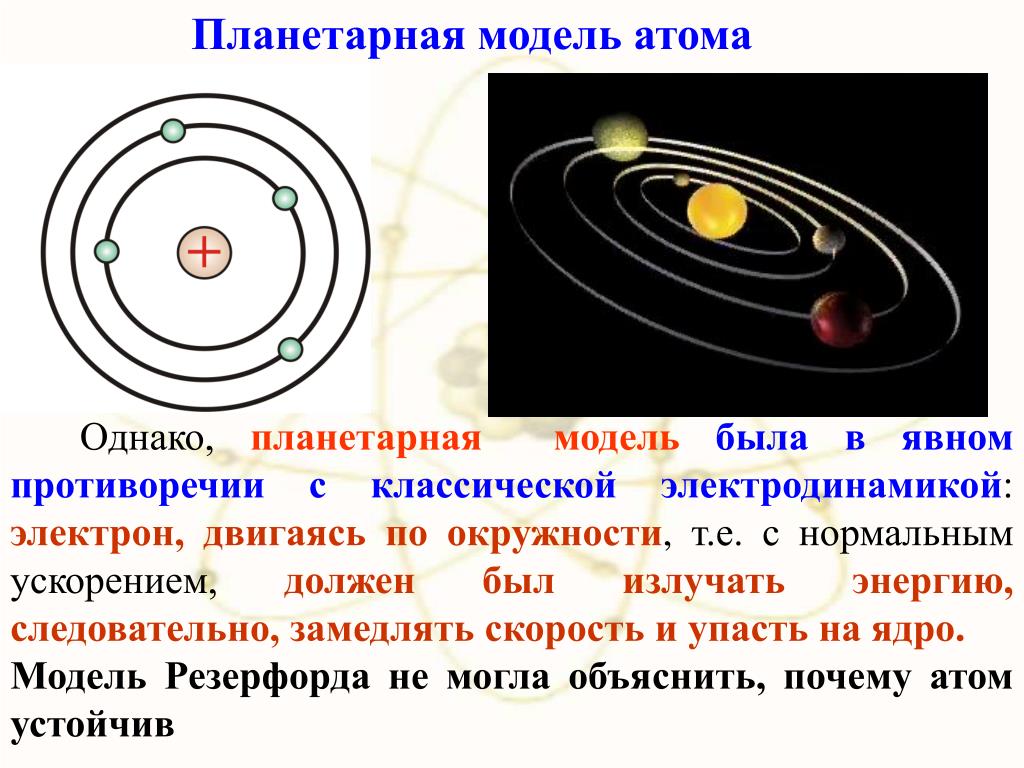 Рассеяние
(изменение направления движения) α -частиц
может вызвать только положительно
заряженная часть атома. Таким образом,
по рассеянию α -частиц
можно определить характер распределения
положительного заряда и массы внутри
атома.
Рассеяние
(изменение направления движения) α -частиц
может вызвать только положительно
заряженная часть атома. Таким образом,
по рассеянию α -частиц
можно определить характер распределения
положительного заряда и массы внутри
атома.
Радиоактивный препарат, например радий, помещался внутри свинцового цилиндра 1, вдоль которого был высверлен узкий канал. Пучок α -частиц из канала падал на тонкую фольгу 2 из исследуемого материала (золото, медь и пр.). После рассеяния α -частицы попадали на полупрозрачный экран 3, покрытый сульфидом цинка. Столкновение каждой частицы с экраном сопровождалось вспышкой света (сцинтилляцией), которую можно было наблюдать в микроскоп 4. Весь прибор размещался в сосуде, из которого был откачан воздух.
При
хорошем вакууме внутри прибора в
отсутствие фольги на экране возникал
светлый кружок, состоящий из сцинтилляций,
вызванных тонким пучком α -частиц.
Но когда на пути пучка помещали
фольгу, α -частицы
из-за рассеяния распределялись на экране
по кружку большей площади.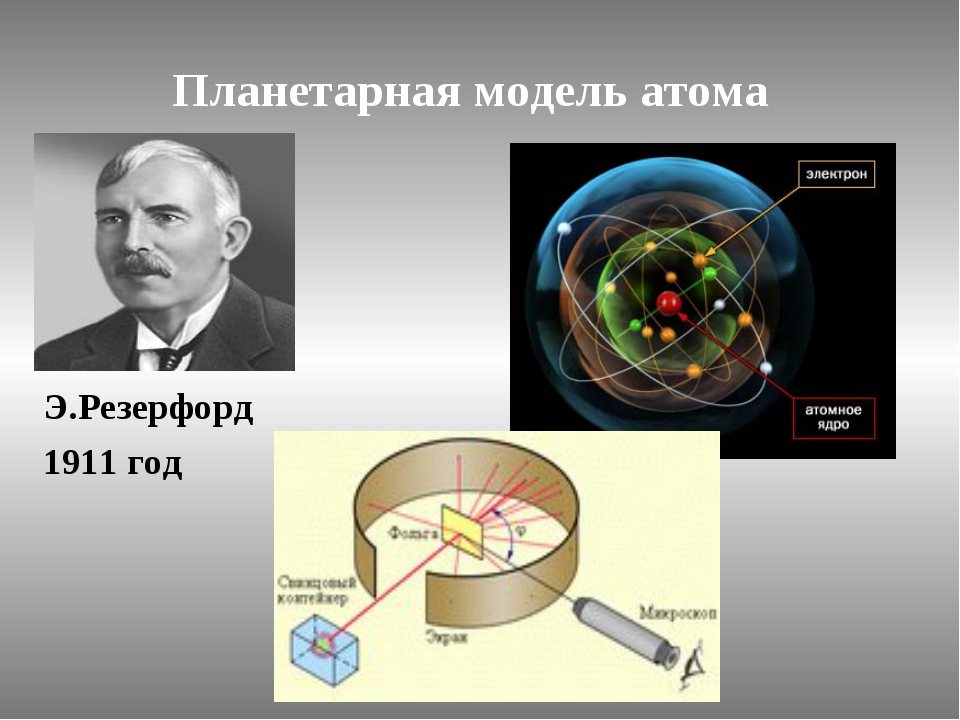 Модифицируя
экспериментальную установку, Резерфорд
попытался обнаружить отклонение α -частиц
на большие углы. Совершенно неожиданно
оказалось, что небольшое число α -частиц
(примерно одна из двух тысяч) отклонилось
на углы, большие 90°. Позднее Резерфорд
признался, что, предложив своим ученикам
эксперимент по наблюдению рассеяния α -частиц
на большие углы, он сам не верил в
положительный результат. «Это почти
столь же невероятно, — говорил Резерфорд,
— как если бы вы выстрелили 15-дюймовым
снарядом в кусок тонкой бумаги, а снаряд
возвратился бы к вам и нанес вам удар».
В самом деле, предвидеть этот результат
на основе модели Томсона было нельзя.
При распределении по всему атому
положительный заряд не может создать
достаточно интенсивное электрическое
поле, способное отбросить а-частицу
назад. Максимальная сила отталкивания
определяется по закону Кулона:
Модифицируя
экспериментальную установку, Резерфорд
попытался обнаружить отклонение α -частиц
на большие углы. Совершенно неожиданно
оказалось, что небольшое число α -частиц
(примерно одна из двух тысяч) отклонилось
на углы, большие 90°. Позднее Резерфорд
признался, что, предложив своим ученикам
эксперимент по наблюдению рассеяния α -частиц
на большие углы, он сам не верил в
положительный результат. «Это почти
столь же невероятно, — говорил Резерфорд,
— как если бы вы выстрелили 15-дюймовым
снарядом в кусок тонкой бумаги, а снаряд
возвратился бы к вам и нанес вам удар».
В самом деле, предвидеть этот результат
на основе модели Томсона было нельзя.
При распределении по всему атому
положительный заряд не может создать
достаточно интенсивное электрическое
поле, способное отбросить а-частицу
назад. Максимальная сила отталкивания
определяется по закону Кулона:
где
q α —
заряд α -частицы;
q — положительный заряд атома; r — его
радиус; k — коэффициент пропорциональности. Напряженность электрического поля
равномерно заряженного шара максимальна
на поверхности шара и убывает до нуля
по мере приближения к центру. Поэтому,
чем меньше радиус r, тем больше сила,
отталкивающаяα -частицы.
Напряженность электрического поля
равномерно заряженного шара максимальна
на поверхности шара и убывает до нуля
по мере приближения к центру. Поэтому,
чем меньше радиус r, тем больше сила,
отталкивающаяα -частицы.
Определение размеров атомного ядра. Резерфорд понял, что α -частица могла быть отброшена назад лишь в том случае, если положительный заряд атома и его масса сконцентрированы в очень малой области пространства. Так Резерфорд пришел к идее атомного ядра — тела малых размеров, в котором сконцентрированы почти вся масса и весь положительный заряд атома.
Планетарная
модель атома ,
или модель
Резерфорда ,
— историческая модель строения атома,
которую предложил Эрнест
Резерфорд в
результате эксперимента с
рассеянием альфа-частиц.
По этой модели атом состоит из небольшого
положительно заряженного ядра,
в котором сосредоточена почти вся масса
атома, вокруг которого движутся электроны,
— подобно тому, как планеты движутся
вокруг Солнца. Планетарная модель атома
соответствует современным представлениям
о строении атома с учётом того, что
движение электронов имеет квантовый
характер и
не описывается законами классической
механики.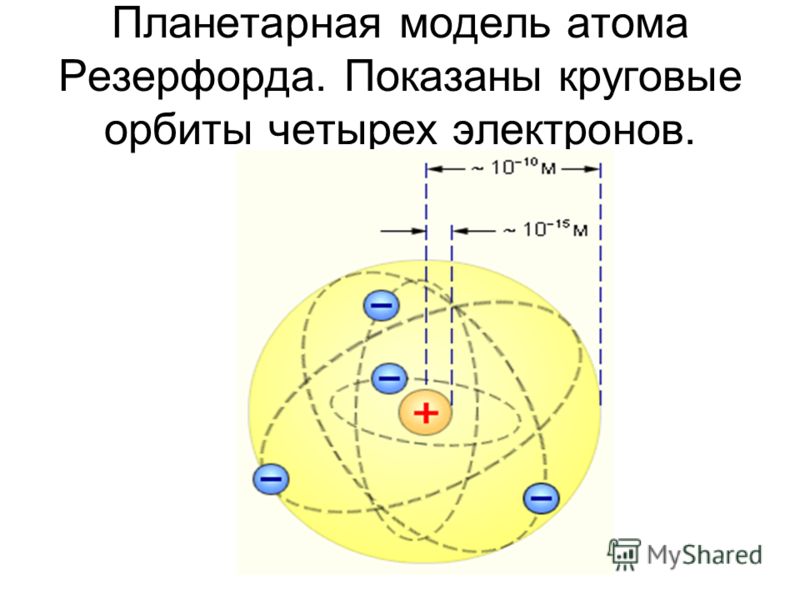 Исторически планетарная модель Резерфорда
пришла на смену «модели сливового
пудинга»Джозефа
Джона Томсона,
которая постулирует, что отрицательно
заряженные электроны помещены внутрь
положительно заряженного атома.
Исторически планетарная модель Резерфорда
пришла на смену «модели сливового
пудинга»Джозефа
Джона Томсона,
которая постулирует, что отрицательно
заряженные электроны помещены внутрь
положительно заряженного атома.
Рекомендуем также
Как делили «неделимого» | Политех (Политехнический музей)
Слово «атом», как известно, происходит от греческого слова «неделимый»: веками атомы считались мельчайшими, наименьшими, неразложимыми частицами материи. И действительно, безуспешные попытки химиков XVII–XIX веков разделить атомы на составные части, казалось, доказывали это. Но тут в дело вмешались физики.
В 1860-х обнаружилось, что из подключенного к электрической сети катоду исходят лучи, а в 1890-х выяснилось, что это поток легких отрицательно заряженных частиц (сегодня их называют электронами). В те же годы супруги Кюри открыли радиоактивность, а Резерфорд разделил его на альфа–, бета– и гамма-излучение.
После их открытий как из рога изобилия посыпались новые изотопы, масса которых в ту или иную сторону отличалась от давно установленных масс «обычных» элементов. Некоторые химики еще какое-то время пытались втиснуть их в Периодическую таблицу. Однако большинству ученых стало ясно, что проблема не в элементах, а в представлении об атоме.
Вместо неделимого шарика он оказался сложной системой с пока неясной внутренней структурой — но какой? Похож атом на шарик или на бублик? А может, на облако?… Прежде чем наука пришла к современным представлению о строении атома, физикам пришлось рассмотреть (и во многом отбросить) более простые модели.
Модель Демокрита (около 400 года до н. э.)
«Атом» каждого вещества представляет собой что-то вроде крошечной копии этого вещества. Например, «атом» острого перца — штука с колючими углами, зато атом сладкого меда — круглый и приятный.
Модель Джона Дальтона (около 1802 года)
Каждый атом — крошечная, неделимая и неуничтожимая сфера; у любого элемента он имеет свои уникальные размеры и свойства (последнее в целом верно и в рамках современных представлений).
Модель Уильяма Томсона, лорда Кельвина (1867 год)
Атомы имеют форму кольца и удерживают структуру за счет вихревого движения, как кольца дыма. Сплетаясь в сложные узлы и узоры, они получают соответствующие свойства.
Модель Джозефа Томсона (1897 год)
Атом похож на булку с изюмом: положительно заряженный сгусток материи, «хлеба», внутри которого распределены отрицательные электроны.
Модель Филиппа фон Ленарда (1903 год)
Атом — это пустота, в которой концентрируются подвижные частицы–«динамиды». Каждая из них, как магнит два полюса полюса, несет по сторонам разные заряды — положительный и отрицательный.
Модель Хантаро Нагаоки (1904 год)
Атом похож на планету Сатурн: массивное, положительно заряженное ядро в центре окружено кольцом из движущихся вокруг него быстрых электронов.
Модель Эрнеста Резерфорда (1911 год)
Атом — как Солнечная система, с положительно заряженным, крошечным, но тяжелым ядром, вокруг которого по орбитам движутся «планеты» электронов.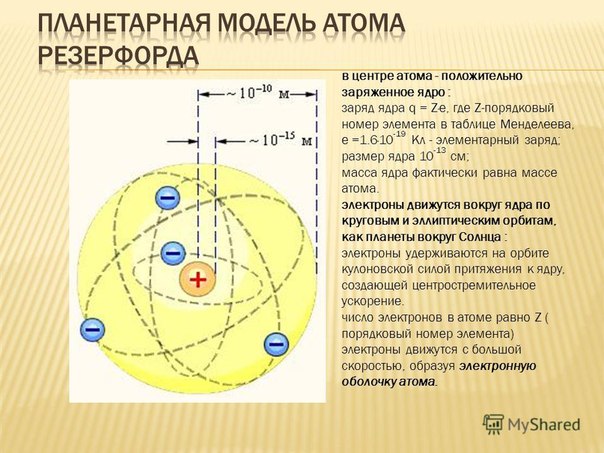 Эта модель куда лучше объясняла многие эксперименты, но не отвечала на вопрос, почему атомы способны существовать, а их электроны не падают на ядро.
Эта модель куда лучше объясняла многие эксперименты, но не отвечала на вопрос, почему атомы способны существовать, а их электроны не падают на ядро.
Модель Бора (1913 год)
Усовершенствованная планетарная модель Резерфорда, электроны в которой движутся не по любым, а лишь по разрешенным, стационарным орбитам, переходя с одной на другую «скачками», при получении или потере порции (кванта) энергии. Это объяснило и устойчивость атома, и данные спектроскопических экспериментов.
Квантово-механическая модель (1920–1930)
Современное представление о строении атома, с компактным, тяжелым, положительно заряженным ядром из протонов и нейтронов, которое окружено отрицательными электронами. При этом они движутся вокруг ядра «размазанными» практически по всему объему атома, заполняя энергетически разрешенные орбитали.
Тяжелый карлик. Биография атома
1911 год
«Эрнест Резерфорд… произвел величайшую перемену в нашем взгляде на материю со времен Демокрита».
Английский физик АРТУР ЭДДИНГТОН
Что волновало ученых?
Наступление на атом продолжалось с новой силой.
Вспомним «пудинг с изюмом» — модель атома, которую создал Томсон в 1903 г. Ведь он предположил, что атом представляет собой сферу, равномерно заряженную положительным электричеством, в которую вкраплены отрицательно заряженные электроны. Сумма всех положительных зарядов равна сумме отрицательных. В целом атом нейтрален.
Но многое было неясно в этой модели.
Что представляет собой положительно заряженная масса атома?
Как связать между собой модель атома Томсона и наблюдаемые явления испускания из атома бета-частиц, т. е. электронов, положительно заряженных альфа-частиц и гамма-лучей, не имеющих заряда?
Есть ли в атоме положительно заряженные частицы?
Наконец, правильна ли модель атома, созданная Томсоном?
Ведь он создал модель на основе предположений. А их надо подтвердить опытом.
Все эти вопросы волновали ученых. И постепенно атом раскрыл свои тайны. Особенно много сделал в этом отношении знаменитый английский ученый Эрнест Резерфорд.
Особенно много сделал в этом отношении знаменитый английский ученый Эрнест Резерфорд.
Важнейшая дата
1911 год вошел в биографию атома, как год создания новой модели атома, модели, положившей начало современному представлению об атоме. И эта модель ничего общего не имела с моделью «пудинг с изюмом» Томсона. Ее создал Резерфорд, ученик Томсона.
Доказательства правильности новой модели были неопровержимыми. И модель атома Томсона постепенно была отвергнута учеными. На смену ей пришла модель атома Резерфорда, о которой мы и хотим рассказать.
Студент делает важное предположение
Рассказывая биографию атома, мы уже несколько раз упоминали о Резерфорде. Это он впервые сделал предположение, что радиоактивность — внутриатомный процесс, а в 1899 г. обнаружил в составе излучения, испускаемого ураном, два сорта лучей: альфа- и бета-лучи. Это он в 1900 г. установил, что альфа-лучи представляют собой поток атомов гелия и что радий непрерывно превращается в другой элемент—радон.
Но еще значительно раньше (в 1891 г.), когда Резерфорд только учился в Кембриджском университете, на заседании студенческого научного общества он выступил с одним докладом. Название доклада для того времени звучало очень странно: «Эволюция элементов». В этом докладе Резерфорд высказал мысль, что все атомы состоят из одинаковых элементарных частиц. Такая мысль для того времени была очень необычной. Ведь господствовавшая тогда теория Дальтона говорила о том, что атомы элементарны, т. е. неделимы. Поэтому никто и не обратил внимания на высказывание какого-то студента. Но это было прозорливое высказывание. Потом оно блестяще подтвердилось, когда Томсон открыл электрон и разработал первую модель атома, в состав которого входили электроны.
Незадачливый преподаватель
После окончания Кембриджского университета Резерфорд поступил преподавателем в среднюю школу. Но эта деятельность для Резерфорда оказалась неудачной: ему мешало увлечение физикой.
Преподаватели школы, в которой работал Резерфорд, проходя по коридору, не раз обращали внимание на шум в классе, где вел урок Резерфорд. И среди этого шума выделялся громкий голос учителя, который с увлечением рассказывал о новых открытиях в физике, не обращая никакого внимания на шум в классе. Когда преподаватели прислушивались к тому, что говорил учитель, им казалось, что Резерфорд читает лекцию не ученикам школы, а по крайней мере научным работникам. В ней было столько непонятных терминов и объяснений, что не только ученикам, но и преподавателям было неясно содержание лекции. Резерфорд слишком увлекался и забывал о подготовке своих слушателей. Поэтому ученики и шумели.
И среди этого шума выделялся громкий голос учителя, который с увлечением рассказывал о новых открытиях в физике, не обращая никакого внимания на шум в классе. Когда преподаватели прислушивались к тому, что говорил учитель, им казалось, что Резерфорд читает лекцию не ученикам школы, а по крайней мере научным работникам. В ней было столько непонятных терминов и объяснений, что не только ученикам, но и преподавателям было неясно содержание лекции. Резерфорд слишком увлекался и забывал о подготовке своих слушателей. Поэтому ученики и шумели.
Однажды в дом к Резерфорду пришло письмо. В нем сообщалось, что ему, как лучшему бывшему студенту университета, присвоена премия. Эта премия давала возможность продолжить образование в лучших английских университетах. Мать немедленно сказала об этом сыну, копавшему картошку на огороде. Резерфорд бросил лопату и воскликнул: «Это последняя картошка, которую я выкапываю». Он ни минуты не раздумывал. Решение пришло сразу: в Кембриджский университет, к известному физику Джозефу Томсону.
Ученик опровергает учителя
Начались годы работы под руководством Томсона. Учитель сразу обратил внимание на своего талантливого ученика.
Вначале Резерфорд занимался исследованиями в области радио. Впоследствии Томсон даже сказал, что он чувствовал себя виноватым, когда посоветовал Резерфорду заняться изучением беккерелевых лучей. Ведь успехи Резерфорда в области радиотелеграфии были очень велики.
Учитель и ученик начали наступление на атом. Последовал ряд блестящих открытий Резерфорда, о которых мы уже рассказали. Наступил 1911 год. В этом году Резерфорд произвел исключительный по своему значению эксперимент, доказавший существование ядра атома.
Эксперимент заключался в следующем. Резерфорд изучал рассеяние альфа-частиц при прохождении их через очень тонкие металлические пластинки. К своему большому удивлению, он заметил, что некоторые альфа-частицы при прохождении пластинки резко изменяли свой путь. Более того, некоторые даже отскакивали назад. Было ясно, что альфа-частицы сталкивались с атомами вещества пластинки. Но почему они при этом резко изменяли направление своего полета? Ведь согласно модели Томсона атом представляет собой сферу с равномерно распределенными положительными зарядами и вкрапленными в сферу электронами.
Но почему они при этом резко изменяли направление своего полета? Ведь согласно модели Томсона атом представляет собой сферу с равномерно распределенными положительными зарядами и вкрапленными в сферу электронами.
Схема опыта Резерфорда по пропусканию альфа-частиц через очень тонкие металлические пластинки. Этот опыт показал, что атом имеет ядро, заряженное положительно, и, следовательно, отрицательные заряды атома располагаются отдельно от положительных на электронных оболочках. А в целом атом нейтрален.
В целом он нейтрален. И такую сферу альфа-частицы, несущиеся с огромной скоростью, должны были бы пробивать, по выражению Резерфорда, «как пуля бумагу».
Но они не пробивали сферу. Над этим непонятным явлением долго ломал голову Резерфорд. И наконец пришел к чрезвычайно важному выводу. Раз положительно заряженные частицы резко изменяют свой путь и даже отскакивают назад, значит, они наталкиваются на какую-то положительно заряженную преграду: ведь одноименные заряды отталкиваются. Такой преградой мог быть только атом. Но это опровергает модель Томсона, согласно которой атом в целом нейтрален. Значит, решает Резерфорд, модель атома Томсона неправильна! Весь положительный заряд атома сосредоточен в его центре, отдельно от отрицательно заряженных электронов. Только в таком случае для альфа-частиц он может служить преградой.
Такой преградой мог быть только атом. Но это опровергает модель Томсона, согласно которой атом в целом нейтрален. Значит, решает Резерфорд, модель атома Томсона неправильна! Весь положительный заряд атома сосредоточен в его центре, отдельно от отрицательно заряженных электронов. Только в таком случае для альфа-частиц он может служить преградой.
Так ученик опроверг своего учителя.
Планетарная модель
Продолжая исследования, Резерфорд постепенно создал свою знаменитую планетарную модель атома.
Согласно этой модели, весь положительный заряд атома сосредоточен в его центре—ядре. А отрицательно заряженные электроны вращаются по своим орбитам вокруг этого
Слева — модель атома, созданная Томсоном. Положительные и отрицательные заряды распределены равномерно. Справа — модель атома, созданная Резерфордом. Положительные заряды атома сосредоточены в центре ядра атома.
ядра. Примерно так же, как планеты вокруг Солнца. Отсюда и произошло название — планетарная модель.
При этом, как установил Резерфорд, ядро в 10 000 раз меньше всего атома. Заряд ядра уравновешивается зарядами вращающихся вокруг ядра электронов, которые находятся в так называемой электронной оболочке. Поэтому в целом атом нейтрален. Сколько электронов, столько и положительных зарядов в ядре.
Загадка положительных зарядов
Действительно, что это за таинственные положительные заряды в ядре? Об этом и спросил себя Резерфорд после
создания своей планетарной модели атома. И он решил разгадать эту загадку. Бомбардируя электронами атомы водорода, ученый обнаружил, что нейтральные атомы водорода превратились в положительно заряженные. Но было известно, что атомы водорода имеют один электрон и один положительный заряд в центре. Значит, решил Резерфорд, этот один положительный заряд и является ядром атома водорода. Он назвал частицу, несущую положительный заряд, протоном.
Это произошло в 1914 г., через три года после создания планетарной модели и спустя 17 лет после открытия Томсоном первой элементарной частицы, входящей в состав атома.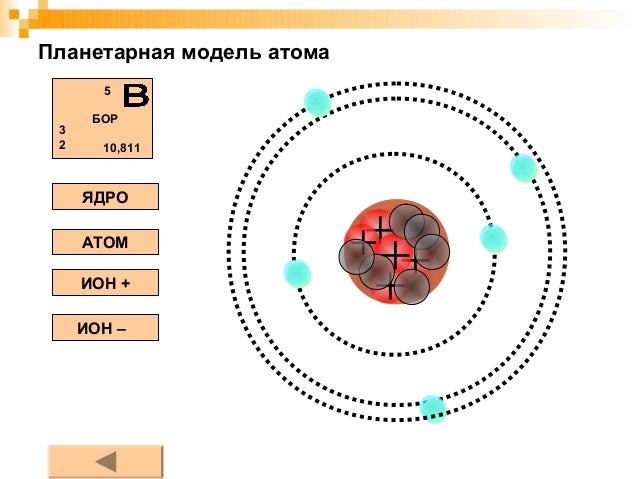 Теперь их стало две — электрон и протон.
Теперь их стало две — электрон и протон.
Учитель и ученик: Томсон (слева) и Резерфорд,
Тяжелый карлик
Когда Резерфорд определил массу протона, то оказалось, что он неимоверно «тяжел». Разумеется, по отношению к другой элементарной частице — электрону. Масса протона примерно в 1840 раз больше массы электрона. В то же время заряды у них равны. Отрицательный заряд маленького электрона полностью нейтрализует положительный заряд протона.
5.6: Атомная модель Бора — Химия LibreTexts
Подъем по лестнице требует энергии. На каждом шагу вы подталкиваете себя против гравитации и накапливаете потенциальную энергию. Когда вы возвращаетесь вниз, эта потенциальная энергия высвобождается по мере того, как вы спускаетесь шаг за шагом. Если вы не будете осторожны, вы можете высвободить всю эту потенциальную энергию сразу, упав с лестницы (что никогда не бывает хорошо). Кроме того, вы совершаете подъем или спуск по шагам. На лестнице нет «промежуточного» положения — ваша нога либо задевает ступеньку, либо касается пустого места, и у вас проблемы, пока вы не найдете ступеньку, на которую можно встать.
Кроме того, вы совершаете подъем или спуск по шагам. На лестнице нет «промежуточного» положения — ваша нога либо задевает ступеньку, либо касается пустого места, и у вас проблемы, пока вы не найдете ступеньку, на которую можно встать.
Модель атома Бора
После открытия спектров излучения водорода и фотоэлектрического эффекта датский физик Нильс Бор (1885–1962) предложил новую модель атома в 1915 году. Бор предположил, что электроны не излучают энергию, вращаясь вокруг ядра, а существуют в состояний с постоянной энергией, которые он назвал стационарными состояниями . Это означает, что электроны вращаются на фиксированных расстояниях от ядра (см. ниже). Работа Бора была в первую очередь основана на спектрах излучения водорода.Это также называют планетарной моделью атома. Он объяснил внутреннюю работу атома водорода. Бор был удостоен Нобелевской премии по физике в 1922 году за свою работу.
Спектры эмиссии водорода атомной модели Бора.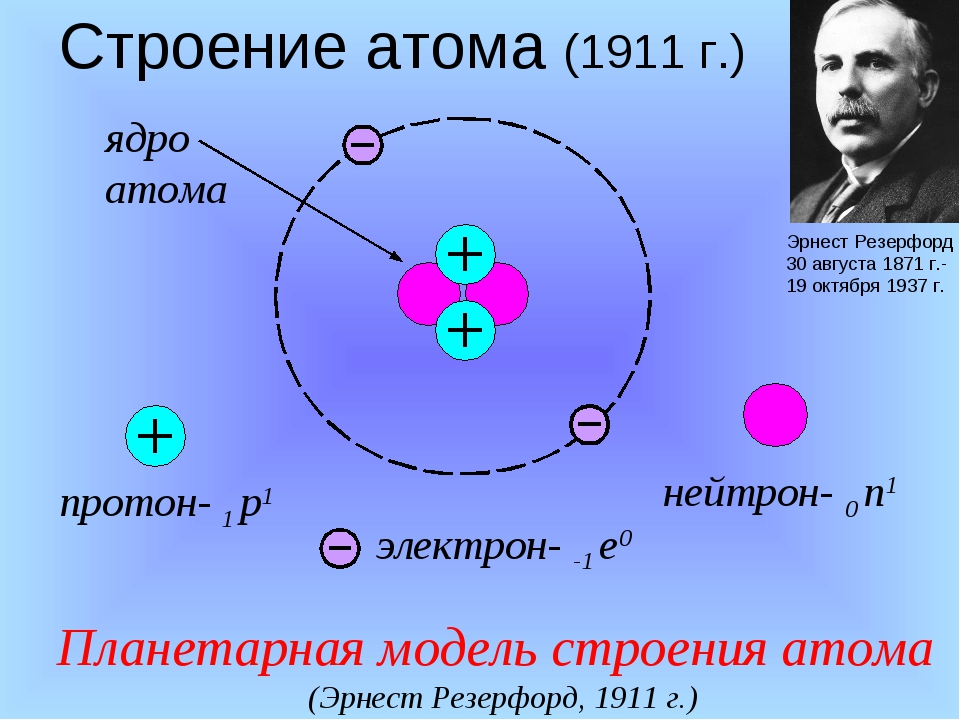
Бор объяснил, что электроны могут перемещаться по разным орбитам с добавлением энергии. Когда энергия удаляется, электроны возвращаются в свое основное состояние, испуская соответствующее количество энергии — квант света или фотон.Это послужило основой для того, что позже стало известно как квантовая теория . Это теория, основанная на том принципе, что материя и энергия обладают свойствами как частиц, так и волн. Он объясняет широкий спектр физических явлений, включая существование дискретных пакетов энергии и материи, принцип неопределенности и принцип исключения.
Согласно модели Бора, которую часто называют планетарной моделью , электроны вращаются вокруг ядра атома по определенным допустимым траекториям, называемым орбитами.Когда электрон находится на одной из этих орбит, его энергия фиксирована. Основное состояние атома водорода, где его энергия самая низкая, — это когда электрон находится на орбите, ближайшей к ядру. Все орбиты, которые находятся дальше от ядра, имеют последовательно большую энергию. Электрон не может занимать ни одно из пространств между орбитами. Повседневная аналогия модели Бора — ступеньки лестницы. Двигаясь вверх или вниз по лестнице, вы можете занимать только определенные ступени и не можете находиться в промежутках между ступенями.Движение вверх по лестнице увеличивает вашу потенциальную энергию, а движение вниз по лестнице уменьшает вашу энергию.
Все орбиты, которые находятся дальше от ядра, имеют последовательно большую энергию. Электрон не может занимать ни одно из пространств между орбитами. Повседневная аналогия модели Бора — ступеньки лестницы. Двигаясь вверх или вниз по лестнице, вы можете занимать только определенные ступени и не можете находиться в промежутках между ступенями.Движение вверх по лестнице увеличивает вашу потенциальную энергию, а движение вниз по лестнице уменьшает вашу энергию.
Работа Бора оказала сильное влияние на наше современное понимание внутренней работы атома. Однако его модель хорошо работала в качестве объяснения выбросов атома водорода, но была серьезно ограничена применительно к другим атомам. Вскоре после того, как Бор опубликовал свою планетарную модель атома, было сделано несколько новых открытий, которые привели к другому пересмотренному взгляду на атом.
Резюме
- Модель Бора постулирует, что электроны вращаются вокруг ядра на фиксированных энергетических уровнях.

- Орбиты дальше от ядра существуют на более высоких энергетических уровнях.
- Когда электроны возвращаются на более низкий энергетический уровень, они излучают энергию в виде света.
Авторы и авторство
Фонд CK-12, созданный Шэрон Бьюик, Ричардом Парсонсом, Терезой Форсайт, Шонной Робинсон и Джин Дюпон.
модель Резерфорда | Определение и факты
Модель Резерфорда , также называемая Модель атома Резерфорда, ядерный атом или планетарная модель атома , описание структуры атомов, предложенное (1911) новозеландским физиком Эрнестом Резерфорд.Модель описывала атом как крошечное, плотное, положительно заряженное ядро, называемое ядром, в котором сосредоточена почти вся масса, вокруг которого на некотором расстоянии циркулируют легкие отрицательные составляющие, называемые электронами, подобно планетам, вращающимся вокруг Солнца.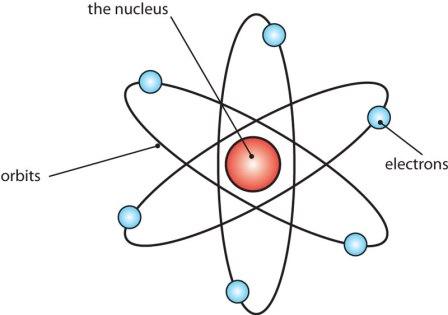 .
.
Ядро считалось маленьким и плотным, чтобы объяснить рассеяние альфа-частиц тонкой золотой фольгой, как это наблюдалось в серии экспериментов, проведенных студентом Эрнестом Марсденом под руководством Резерфорда и немецкого физика Ганса Гейгера в 1909 году.Радиоактивный источник, излучающий альфа-частицы (т. е. положительно заряженные частицы, идентичные ядру атома гелия и в 7000 раз массивнее электронов), был заключен в защитный свинцовый экран. Излучение фокусировалось в узкий пучок после прохождения щели в свинцовом экране. Перед щелью помещали тонкий срез золотой фольги, а экран, покрытый сульфидом цинка для придания ему флуоресценции, служил счетчиком для обнаружения альфа-частиц. Когда каждая альфа-частица ударялась о флуоресцентный экран, она производила вспышку света, называемую сцинтилляцией, которую можно было увидеть в микроскоп, прикрепленный к задней части экрана.Сам экран был подвижным, что позволяло Резерфорду и его коллегам определять, отклоняются ли какие-либо альфа-частицы золотой фольгой.
В 1909 году Резерфорд опроверг сэр Дж.Дж. Томсоновская модель атома как равномерно распределенного вещества. Поскольку лишь очень немногие альфа-частицы в его луче рассеивались под большими углами после удара о золотую фольгу, в то время как большинство полностью проходило сквозь нее, Резерфорд знал, что масса атома золота должна быть сосредоточена в крошечном плотном ядре.
Encyclopædia Britannica, Inc. Большинство альфа-частиц прошли прямо через золотую фольгу, что означало, что атомы в основном состоят из открытого пространства. Некоторые альфа-частицы слегка отклонялись, что свидетельствует о взаимодействии с другими положительно заряженными частицами внутри атома. Другие альфа-частицы рассеивались под большими углами, а некоторые даже отскакивали обратно к источнику. (Позже Резерфорд сказал: «Это было почти так же невероятно, как если бы вы выстрелили 15-дюймовым снарядом в кусок папиросной бумаги, а он вернулся бы и попал в вас. ») Только положительно заряженная и относительно тяжелая частица-мишень, такая как предполагаемое ядро, могла объяснить такое сильное отталкивание. Отрицательные электроны, электрически уравновешивающие положительный заряд ядра, считались движущимися по круговым орбитам вокруг ядра. Электростатическая сила притяжения между электронами и ядром уподоблялась гравитационной силе притяжения между вращающимися планетами и Солнцем. Большая часть этого планетарного атома была открытым пространством и не оказывала сопротивления прохождению альфа-частиц.
») Только положительно заряженная и относительно тяжелая частица-мишень, такая как предполагаемое ядро, могла объяснить такое сильное отталкивание. Отрицательные электроны, электрически уравновешивающие положительный заряд ядра, считались движущимися по круговым орбитам вокруг ядра. Электростатическая сила притяжения между электронами и ядром уподоблялась гравитационной силе притяжения между вращающимися планетами и Солнцем. Большая часть этого планетарного атома была открытым пространством и не оказывала сопротивления прохождению альфа-частиц.
Модель Резерфорда заменила атомную модель «сливовый пудинг» английского физика сэра Дж.Дж. Томсона, в котором электроны были встроены в положительно заряженный атом, как сливы в пудинге. Сама модель Резерфорда, полностью основанная на классической физике, через несколько лет была заменена атомной моделью Бора, включавшей в себя некоторую раннюю квантовую теорию.
Модель Бора
Модель Бора| Модель Бора |
Наиболее важные свойства атомной и молекулярной структуры могут быть
проиллюстрирован на упрощенном изображении атома, который называется Боровским
Модель .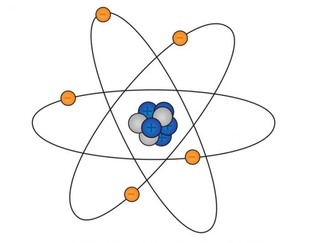 Эта модель была предложена Нильсом Бором в 1915 г.; Это
не совсем правильно, но
у него много функций, которые примерно правильные
и этого достаточно для большей части нашего обсуждения. Правильная теория о.
атом называется , квантовая механика ; Модель Бора является приближением
к квантовой механике, которая имеет то достоинство, что она намного проще.
(Вот
более реалистичное обсуждение того, как атомные орбитали выглядят в квантовой
механика.)
Эта модель была предложена Нильсом Бором в 1915 г.; Это
не совсем правильно, но
у него много функций, которые примерно правильные
и этого достаточно для большей части нашего обсуждения. Правильная теория о.
атом называется , квантовая механика ; Модель Бора является приближением
к квантовой механике, которая имеет то достоинство, что она намного проще.
(Вот
более реалистичное обсуждение того, как атомные орбитали выглядят в квантовой
механика.)
Планетарная модель атома
| Атом Бора |
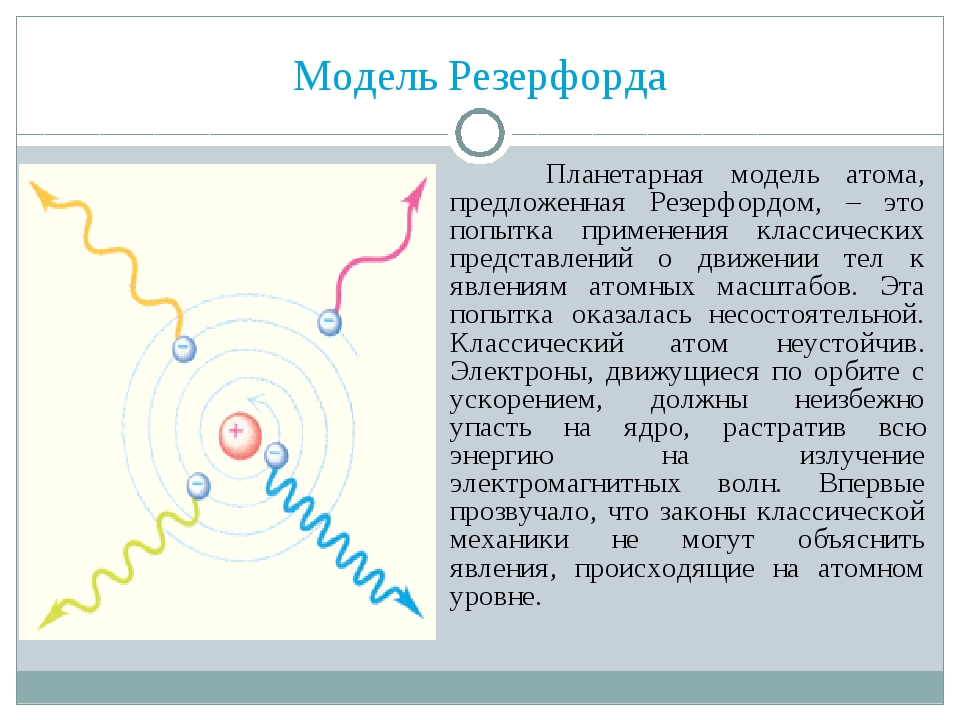 Соседнее изображение не
масштаб, поскольку в реалистическом случае
радиус ядра примерно в 100 000 раз меньше радиуса
радиус всего атома, и, насколько мы можем судить, электроны являются точечными
частицы без физической протяженности.
Соседнее изображение не
масштаб, поскольку в реалистическом случае
радиус ядра примерно в 100 000 раз меньше радиуса
радиус всего атома, и, насколько мы можем судить, электроны являются точечными
частицы без физической протяженности.Это сходство между планетарной моделью и моделью атома Бора в конечном счете возникает потому, что привлекательный гравитационная сила в солнечной системе и привлекательный Кулоновская (электрическая) сила между положительно заряженным ядром и отрицательно заряженные электроны в атоме математически имеют ту же форму. (Форма такая же, но внутренний силы Кулона взаимодействие намного больше, чем у гравитационного взаимодействия; в Кроме того, существуют положительные и отрицательные электрические заряды, поэтому кулоновская взаимодействие может быть как притягивающим, так и отталкивающим, но гравитация всегда привлекательным в нашей нынешней Вселенной.)
Но орбиты квантованы
| Квантованные уровни энергии в водороде |
 и что полностью отличается от аналогичной планетарной модели, так это то, что
энергия частиц в атоме Бора ограничена определенным дискретным
ценности. Говорят, что энергия квантуется . Это означает, что только
разрешены определенные орбиты с определенными радиусами; орбиты между ними просто не
существует.
и что полностью отличается от аналогичной планетарной модели, так это то, что
энергия частиц в атоме Бора ограничена определенным дискретным
ценности. Говорят, что энергия квантуется . Это означает, что только
разрешены определенные орбиты с определенными радиусами; орбиты между ними просто не
существует. На соседнем рисунке показаны такие квантованные уровни энергии для атома водорода.
Эти уровни помечены целым числом n .
это называется квантовым числом .
Состояние с наименьшей энергией обычно называют основным состоянием . Штаты
с последовательно большей энергией, чем основное состояние, называются первыми возбужденными состояниями.
состояние , второе возбужденное состояние и так далее. За пределами энергии
называется потенциалом ионизации единственный электрон атома водорода не
больше связаны с атомом.Тогда энергетические уровни образуют континуум. В случае
водород, этот континуум начинается на 13,6 эВ выше основного состояния («эВ» означает
для «электрон-вольта», общей единицы энергии в атомной физике).
Хотя такое поведение может показаться странным нашему разуму, обученному с рождения по смотреть явления в макроскопическом мире, так вещи ведут себя в странный квантовый мир, господствующий на атомном уровне.
Атомное возбуждение и девозбуждение
Атомы могут совершать переходы между орбитами, допускаемыми квантовой механикой. поглощая или излучая точно разность энергий между орбитами.То На следующем рисунке показано возбуждение атома, вызванное поглощением фотона и девозбуждение атома, вызванное испусканием фотона.| Возбуждение за счет поглощения света и девозбуждение за счет испускания света |
В каждом случае
длина волны испускаемого или поглощаемого света точно такова, что фотон
несет разность энергий между двумя орбитами. Этот
энергия может быть рассчитана
деля произведение постоянной Планка на скорость света hc по длине волны света). Таким образом, атом может поглотить
или излучают только определенные дискретные длины волн (или, что то же самое, частоты или
энергии).
Таким образом, атом может поглотить
или излучают только определенные дискретные длины волн (или, что то же самое, частоты или
энергии).
Модерн Атомная теория: Модели
В 1913 году Нильс Бор, студент Резерфорда, разработал новую модель атома.Он предположил, что электроны расположены в концентрические круговые орбиты вокруг ядра. Эта модель выполнена по образцу на Солнечной системы и известна как планетарная модель. Модель Бора может быть обобщены следующими четырьмя принципами:
В 1926 году Эрвин Шредингер,
Австрийский физик, взял атом Бора
смоделируйте еще один шаг. Шредингер использовал математический
уравнения для описания
вероятность нахождения электрона в определенном положении. Этот атомный
модель
известная как квантово-механическая модель атома. В отличие от Бора
модель,
квантово-механическая модель не определяет точный путь электрона,
но
скорее, предсказывает вероятность местоположения электрона. До 1932 г., в атом был считается состоящим из положительно заряженного ядра, окруженного отрицательно заряженные электроны.В 1932 году Джеймс Чедвик бомбил атомы бериллия с альфа-частицами. Произошло неизвестное излучение. Чедвик истолкованный это излучение как состоящее из частиц с нейтральным электрическим обвинение и приблизительная масса протона. Эта частица стала известна как нейтрон. С открытием нейтрон, химикам стала доступна адекватная модель атома. С 1932 г.
через продолжение
экспериментов было обнаружено много дополнительных частиц в
атом.Кроме того, новые элементы были созданы путем бомбардировки существующих ядер атомами. |
Атомное воспоминание: столетие модели Бора
В июле 1913 года Нильс Бор опубликовал первую из трех статей, в которых представил свою модель атома.
Самый легко узнаваемый образ атома напоминает миниатюрную солнечную систему с концентрическими путями электронов, образующими планетарные орбиты, и ядром в центре, подобным солнцу.В июле 1913 года датский физик Нильс Бор опубликовал первую из трех статей, в которых представил эту модель атома, которая стала известна просто как атом Бора.
Бор, один из пионеров квантовой теории, взял модель атома, представленную несколькими годами ранее физиком Эрнестом Резерфордом, и придал ей квантовую интерпретацию.
Резерфорд сделал поразительное открытие, что большая часть атома представляет собой пустое пространство. Подавляющая часть его массы находится в положительно заряженном центральном ядре, которое в 10 000 раз меньше самого атома.Плотное ядро окружено роем крошечных отрицательно заряженных электронов.
Бор, проработавший ключевой период в 1912 году в лаборатории Резерфорда в Манчестере, Великобритания, был обеспокоен несколькими несоответствиями в этой модели. Согласно правилам классической физики, электроны в конце концов по спирали опускаются в ядро, вызывая коллапс атома. Модель Резерфорда не учитывала стабильность атомов, поэтому Бор обратился за ответами к развивающейся области квантовой физики, которая имеет дело с микроскопическим масштабом.
Бор предположил, что электроны не беспорядочно кружатся вокруг ядра, а занимают орбиты, расположенные на фиксированном расстоянии от ядра. В этой картине каждая орбита связана с определенной энергией, и электрон может менять орбиту, излучая или поглощая энергию дискретными порциями (называемыми квантами). Таким образом, Бор смог объяснить спектр света, излучаемого (или поглощаемого) водородом, простейшим из всех атомов.
Таким образом, Бор смог объяснить спектр света, излучаемого (или поглощаемого) водородом, простейшим из всех атомов.
Бор опубликовал эти идеи в 1913 году и в течение следующего десятилетия вместе с другими разрабатывал теорию, пытаясь объяснить более сложные атомы.В 1922 году за свою работу он был удостоен Нобелевской премии по физике.
Тем не менее, эта модель по нескольким причинам вводила в заблуждение и в конечном итоге обречена на провал. Развивающаяся область квантовой механики показала, что невозможно одновременно знать положение и скорость электрона. Четко определенные орбиты Бора были заменены вероятностными «облаками», где, вероятно, находится электрон.
Но эта модель проложила путь многим научным достижениям. Все эксперименты по изучению атомной структуры, в том числе проведенные в ЦЕРН, такие как эксперименты с антиводородом и другими экзотическими атомами на антипротонном замедлителе и на онлайновом сепараторе масс изотопов (ISOLDE), восходят к революции в атомной теории, которую Резерфорд и Бор начал столетие назад.
«Вся атомная и субатомная физика построена на наследии этих выдающихся джентльменов», — говорит Питер Батлер из Ливерпульского университета, работающий над ISOLDE.
Модель атома БораМодель атома Бора
Модель атома Бора :
В 1913 году Бор предложил свою модель квантовой оболочки атома, чтобы объяснить, как
электроны могут иметь стабильные орбиты вокруг ядра. Движение
электронов в модели Резерфорда была неустойчива, поскольку, согласно
классическая механика и электромагнитная теория, любая заряженная частица
при движении по криволинейной траектории излучает электромагнитное излучение; Таким образом
электроны потеряли бы энергию и скрутились бы в ядро.Чтобы исправить
проблемы устойчивости, Бор модифицировал модель Резерфорда, потребовав, чтобы
электроны движутся по орбитам фиксированного размера и энергии. Энергия
электрон зависит от размера орбиты и ниже для меньших орбит.
Излучение может происходить только тогда, когда электрон перескакивает с одной орбиты на другую. Другая. Атом будет полностью стабилен в состоянии с наименьшим
орбите, так как нет орбиты с более низкой энергией, на которую электрон мог бы
Прыжок.
Другая. Атом будет полностью стабилен в состоянии с наименьшим
орбите, так как нет орбиты с более низкой энергией, на которую электрон мог бы
Прыжок.
Отправной точкой Бора было осознание того, что классическая механика сама по себе никогда не мог объяснить стабильность атома.Стабильный атом имеет определенный размер так что любое уравнение, описывающее его, должно содержать некоторую фундаментальную константу или комбинация констант с размерностью длины. классический фундаментальные константы, а именно заряды и массы электрона и ядро - не могут быть объединены, чтобы сделать длину. Бор заметил, однако, что квантовая постоянная, сформулированная немецким физиком Максом Планка имеет размеры, которые в сочетании с массой и зарядом электрон, производят меру длины.Численно мера близка известным размерам атомов. Это побудило Бора использовать постоянную Планка. в поисках теории атома.
Планк ввел свою постоянную в 1900 году в формулу, объясняющую
световое излучение, испускаемое нагретыми телами. Согласно классической теории,
сопоставимые количества световой энергии должны производиться на всех частотах.
Это не только противоречит наблюдению, но и подразумевает абсурдность
Следовательно, полная энергия, излучаемая нагретым телом, должна быть бесконечной.Планк постулировал, что энергия может излучаться или поглощаться только дискретно.
суммы, которые он назвал квантами (латинское слово «сколько»). То
квант энергии связан с частотой света новым
фундаментальная постоянная, h. При нагревании тела его лучистая энергия в
конкретный частотный диапазон, согласно классической теории, пропорционален
к температуре тела. Однако согласно гипотезе Планка
излучение может происходить только в квантовых количествах энергии. Если сияющий
энергии меньше, чем квант энергии, количество света в этом
частотный диапазон уменьшится.Формула Планка правильно описывает
излучения нагретых тел. Постоянная Планка имеет размеры
действие, которое может быть выражено как единица энергии, умноженная на время,
единицы импульса, умноженные на длину, или единицы углового момента.
Согласно классической теории,
сопоставимые количества световой энергии должны производиться на всех частотах.
Это не только противоречит наблюдению, но и подразумевает абсурдность
Следовательно, полная энергия, излучаемая нагретым телом, должна быть бесконечной.Планк постулировал, что энергия может излучаться или поглощаться только дискретно.
суммы, которые он назвал квантами (латинское слово «сколько»). То
квант энергии связан с частотой света новым
фундаментальная постоянная, h. При нагревании тела его лучистая энергия в
конкретный частотный диапазон, согласно классической теории, пропорционален
к температуре тела. Однако согласно гипотезе Планка
излучение может происходить только в квантовых количествах энергии. Если сияющий
энергии меньше, чем квант энергии, количество света в этом
частотный диапазон уменьшится.Формула Планка правильно описывает
излучения нагретых тел. Постоянная Планка имеет размеры
действие, которое может быть выражено как единица энергии, умноженная на время,
единицы импульса, умноженные на длину, или единицы углового момента.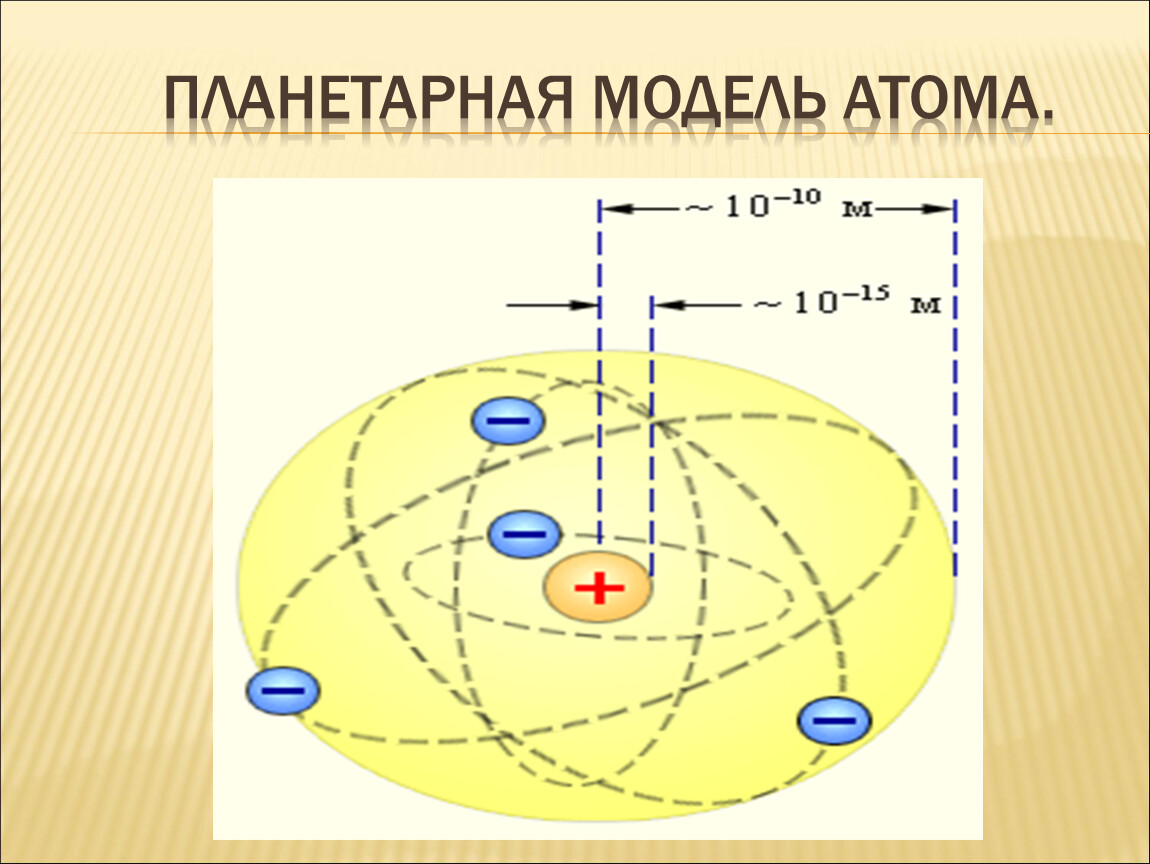 За
Например, постоянная Планка может быть записана как h = 6,6×10 -34 Дж.
секунды.
За
Например, постоянная Планка может быть записана как h = 6,6×10 -34 Дж.
секунды.
Используя постоянную Планка, Бор получил точную формулу для энергии уровней атома водорода. Он предположил, что угловой момент электрон квантуется — т.е.т. е. может иметь только дискретные значения. Он предположил, что в противном случае электроны подчиняются законам классической механики двигаясь вокруг ядра по круговым орбитам. Из-за квантования электронные орбиты имеют фиксированные размеры и энергии. То орбиты помечены целым числом, квантовым числом n.
С помощью своей модели Бор объяснил, как электроны могут прыгать с одной орбиты на другую. другой только испуская или поглощая энергию фиксированными квантами. Например, если электрон прыгает на одну орбиту ближе к ядру, он должен излучать энергию равна разности энергий двух орбит.Наоборот, когда электрон перескакивает на большую орбиту, он должен поглотить квант свет, равный по энергии разнице орбит.
Выдержка из Британской энциклопедии без разрешения.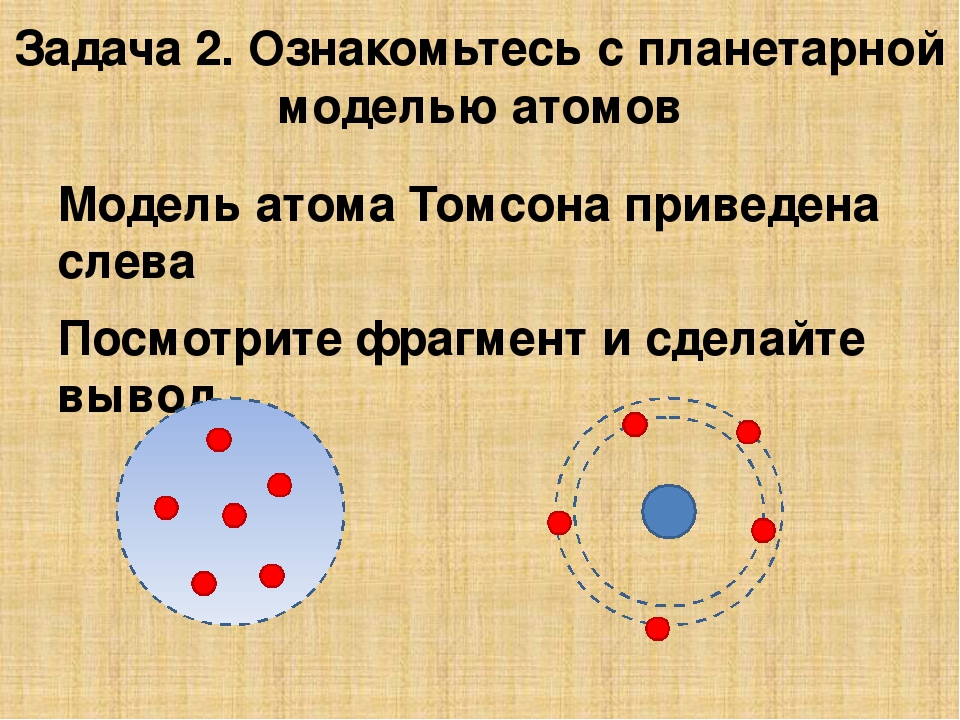
Вопросы и ответы — Как сделать модель атома?
Как сделать модель атома?
Вам нужно сделать модель или рисунок атома для урока естествознания? Если это так, следуйте этим инструкциям, чтобы узнать, куда идут все части атома.
Шаг 1. Сбор информации
Прежде чем вы сможете построить свою модель, вам необходимо знать, сколько протонов, нейтронов и электронов содержит ваш атом. Если вы еще не знаете, как использовать Периодическую таблицу элементов, чтобы найти эту информацию, прочтите «Сколько протонов, электронов и нейтронов в атоме…?» страницу, чтобы узнать, как это сделать.
Возьмем в качестве примера азот. Используя информацию, найденную в Периодической таблице элементов, мы можем сказать, что средний атом азота содержит 7 протонов, 7 нейтронов и 7 электронов.
Шаг 2. Сбор материалов
Теперь, когда вы знаете, сколько протонов, нейтронов и электронов вам потребуется для вашей модели, пришло время решить, что использовать для их представления. В прошлом использовались мячи для пинг-понга, резиновые мячи, шарикоподшипники, мячи для гольфа и пенопластовые мячи. По сути, все, что имеет округлую форму и может быть склеено друг с другом, должно работать. Полезно, если шарики будут иметь цветовую кодировку, чтобы было легче сказать, какие шарики являются протонами, какие нейтронами, а какие электронами.Также полезно, если электроны меньше, чем протоны и нейтроны.
В прошлом использовались мячи для пинг-понга, резиновые мячи, шарикоподшипники, мячи для гольфа и пенопластовые мячи. По сути, все, что имеет округлую форму и может быть склеено друг с другом, должно работать. Полезно, если шарики будут иметь цветовую кодировку, чтобы было легче сказать, какие шарики являются протонами, какие нейтронами, а какие электронами.Также полезно, если электроны меньше, чем протоны и нейтроны.
Шаг 3. Создание ядра
Ядро, центральная часть атома, состоит из протонов и нейтронов. Все протоны и нейтроны вашего атома входят в ядро. Для азота ядро будет выглядеть примерно так:
Шаг 4. Расположите электроны
Электроны находятся вне ядра. То, как вы их разместите, зависит от того, какую модель атомной структуры изучает ваш класс.Это можно сделать несколькими способами:
Планетарная модель
Эта модель изображает более раннее представление о структуре атома вскоре после открытия ядра. Эта модель обычно преподается младшим школьникам как введение в структуру атома.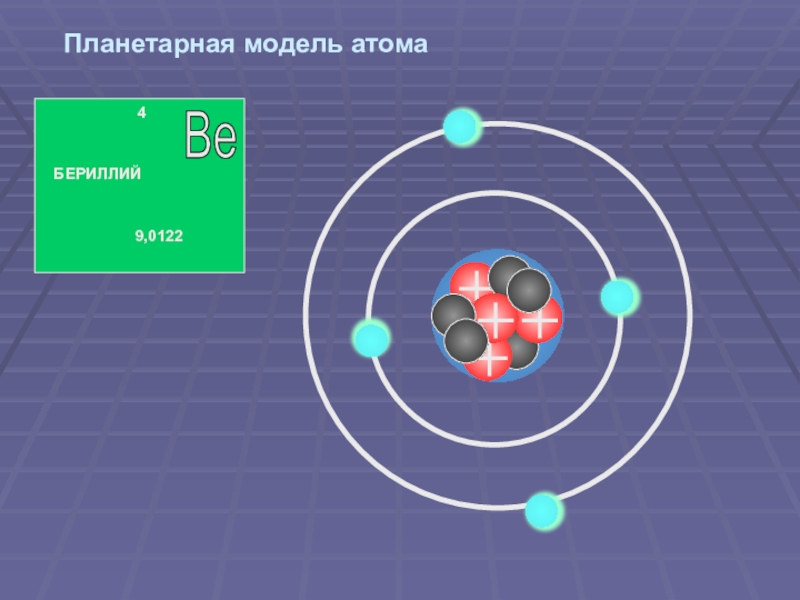 В нем говорится, что электроны вращаются вокруг ядра так же, как планеты Солнечной системы вращаются вокруг Солнца. В зависимости от вашего учителя фактические орбиты обычно не имеют значения. Обычно достаточно иметь правильное количество электронов.Планетарная модель атома азота может выглядеть примерно так:
В нем говорится, что электроны вращаются вокруг ядра так же, как планеты Солнечной системы вращаются вокруг Солнца. В зависимости от вашего учителя фактические орбиты обычно не имеют значения. Обычно достаточно иметь правильное количество электронов.Планетарная модель атома азота может выглядеть примерно так:
В планетарной модели атом азота имеет центральное ядро, состоящее из семи протонов и семи нейтронов, окруженных семью электронами.
Модель Бора
Вскоре ученые поняли, что планетарная модель является неточным описанием атомной структуры. Они узнали, что электроны могут занимать только определенные орбиты (обычно называемые энергетическими уровнями или оболочками) вокруг ядра.Они также обнаружили, что на каждом энергетическом уровне может поместиться только определенное количество электронов.
Чтобы правильно расположить электроны вокруг ядра, вам нужно обратиться к таблице конфигурации электронов вашего элемента. Чтобы найти таблицу электронной конфигурации вашего элемента, перейдите в Периодическую таблицу элементов, нажмите на свой элемент и прокрутите страницу вниз. Если вы не знаете, как читать таблицу электронных конфигураций, прочтите «Как читать таблицу электронных конфигураций?» страница для помощи.
Если вы не знаете, как читать таблицу электронных конфигураций, прочтите «Как читать таблицу электронных конфигураций?» страница для помощи.
Согласно таблице электронной конфигурации азота, атом азота содержит два электрона на первом энергетическом уровне и пять электронов на втором энергетическом уровне. Боровская модель атома азота может выглядеть так:
В боровской модели атом азота имеет центральное ядро, состоящее из семи протонов и семи нейтронов, окруженное семью электронами. Два электрона находятся на первом энергетическом уровне, а остальные пять — на втором энергетическом уровне.
Усовершенствованная модель Бора
Дальнейшие исследования показали, что модель Бора не так точна, как могла бы быть. Ученые узнали, что каждый энергетический уровень состоит из определенного количества субоболочек. Подоболочки, которые называются s, p, d и f, могут содержать только определенное количество электронов. Подоболочка s может содержать только 2 электрона, подоболочка p может содержать 6 электронов, подоболочка d может содержать 10, а подоболочка f может содержать 14./rutherford-atomic-model-141483941-5c3bb44bc9e77c0001c7a15d.jpg) Количество доступных подоболочек увеличивается с увеличением уровня энергии. увеличивается.
Количество доступных подоболочек увеличивается с увеличением уровня энергии. увеличивается.
Чтобы правильно расположить электроны вокруг ядра, вам нужно обратиться к таблице конфигурации электронов вашего элемента. Чтобы найти таблицу электронной конфигурации вашего элемента, перейдите в Периодическую таблицу элементов, нажмите на свой элемент и прокрутите страницу вниз. Если вы не знаете, как читать таблицу электронных конфигураций, прочтите «Как читать таблицу электронных конфигураций?» страница для помощи.
Согласно таблице электронной конфигурации азота, атом азота содержит два электрона на первом энергетическом уровне (оба на s-подуровне) и пять электронов на втором энергетическом уровне (два на s-подуровне и три на p подоболочка).Более точная боровская модель атома азота может выглядеть так:
В уточненной боровской модели атом азота имеет центральное ядро, состоящее из семи протонов и семи нейтронов, окруженное семью электронами. Два электрона находятся на подоболочке s первого энергетического уровня, два — на подоболочке s второго энергетического уровня и три — на подоболочке p второго энергетического уровня.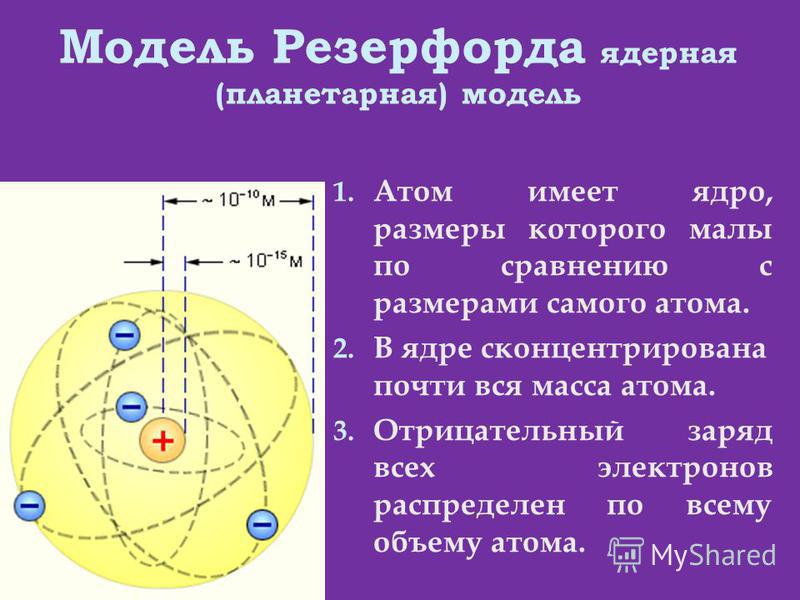
Шаг 5. Что нужно помнить
Важно помнить, что модель представляет собой упрощенное представление объекта.Некоторые из рассмотренных выше моделей более точны, чем другие, но ни одна из них не является полностью правильной. Вот несколько вещей, которые мы проигнорировали:
Размер ядра
На рисунках выше ядро слишком велико. Или, другими словами, если ядро будет таким большим, электроны будут слишком близко. Реальные атомы в основном представляют собой пустое пространство. Если бы мы хотели, чтобы наши рисунки были точными, нам пришлось бы размещать электроны на расстоянии около мили. Понятно, что принести такой большой рисунок в класс будет сложно.
Электроны не вращаются вокруг ядра
На рисунках выше мы нарисовали красивые круги, показывающие, где электроны вращаются вокруг атома. На самом деле ученые не могут точно сказать, где находится электрон в данный момент или куда он движется. Они могут рассчитать вероятность того, что электрон будет найден в заданном объеме пространства, но это не то же самое, что знать, где находится этот электрон.
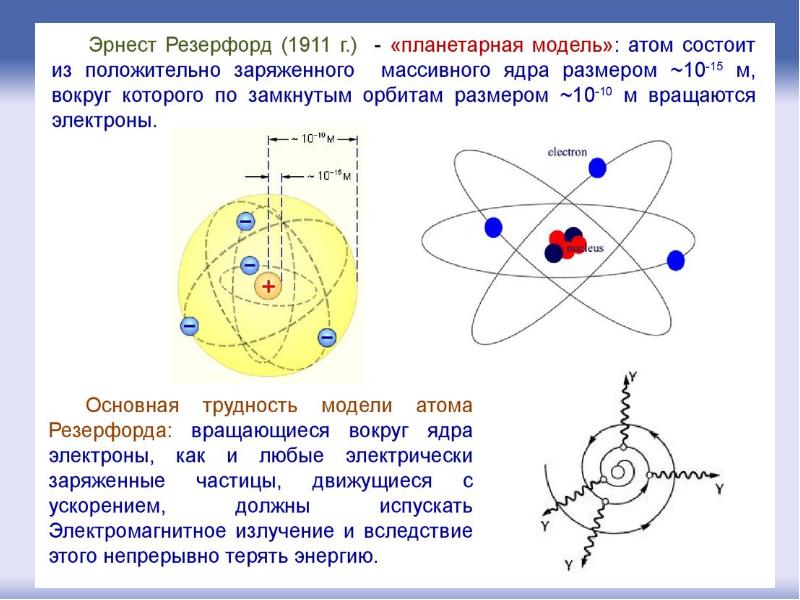 Строение атома»
Строение атома»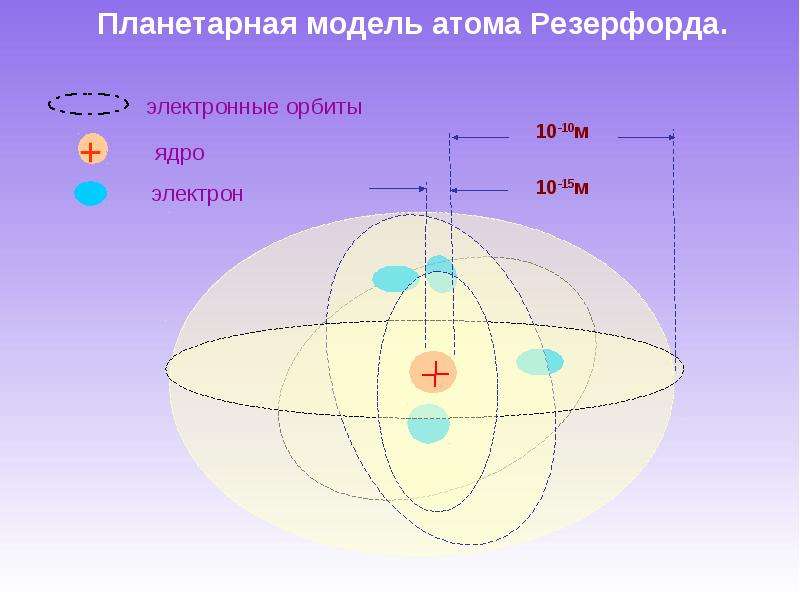


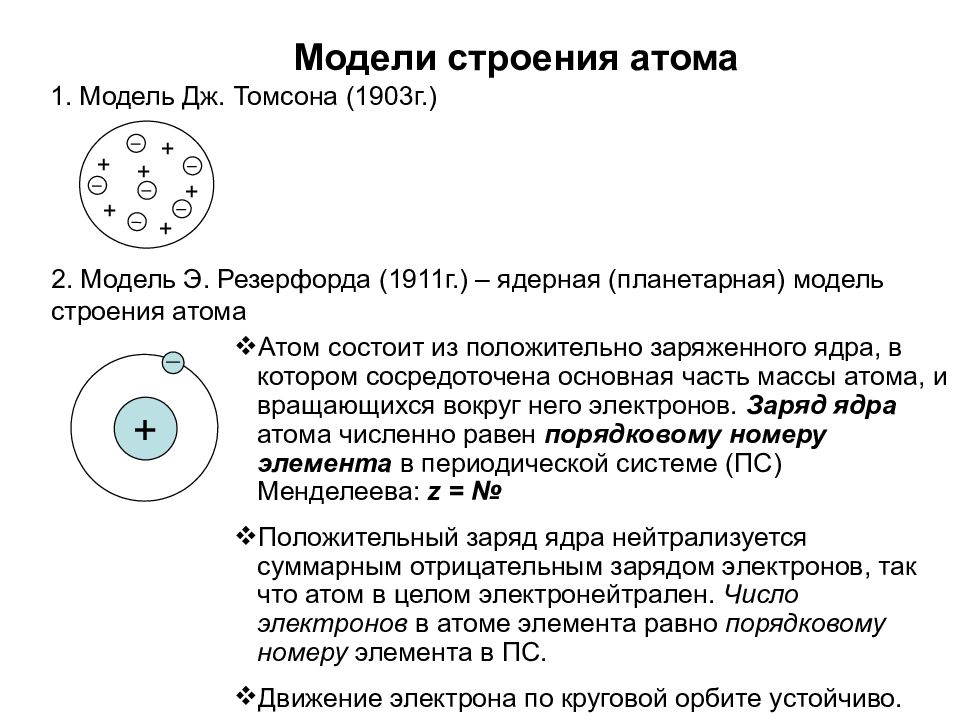 д.
д. Эта модель
возможно
изображается как ядро, окруженное электронным облаком. Где облако
больше всего
плотно, вероятность найти электрон наибольшая, и
и наоборот,
электрон с меньшей вероятностью окажется в менее плотной области облака. Таким образом,
это
модель ввела понятие субэнергетических уровней.
Эта модель
возможно
изображается как ядро, окруженное электронным облаком. Где облако
больше всего
плотно, вероятность найти электрон наибольшая, и
и наоборот,
электрон с меньшей вероятностью окажется в менее плотной области облака. Таким образом,
это
модель ввела понятие субэнергетических уровней.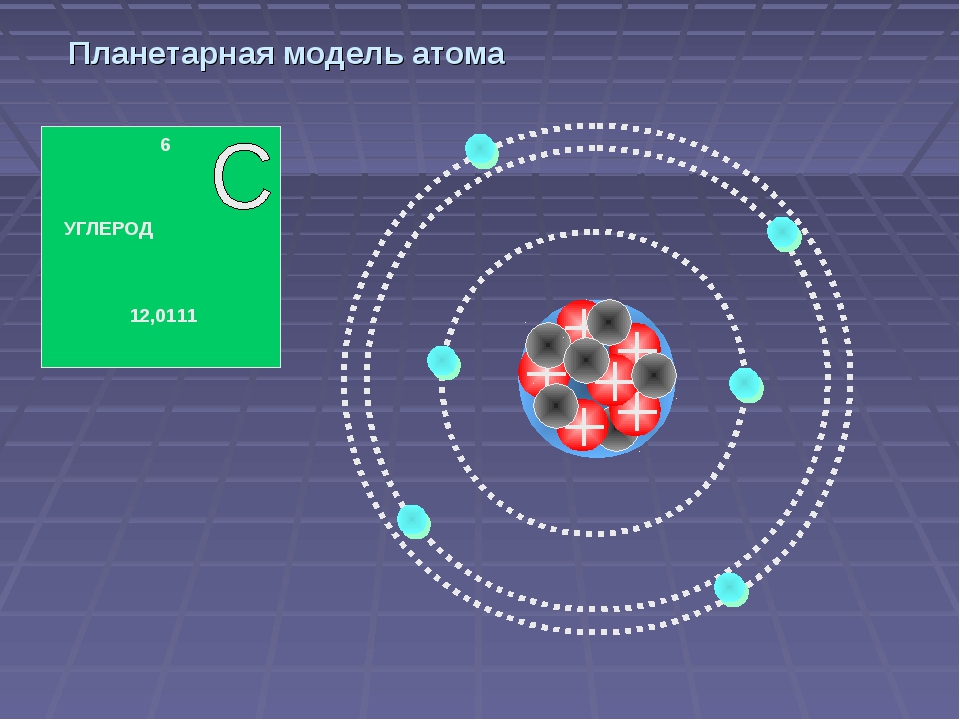 разные
субатомные частицы. Атомная теория получила дальнейшее развитие благодаря
концепция
что протоны и нейтроны состоят из еще более мелких единиц, называемых кварками.
Сами кварки находятся в
очередь из вибрирующих нитей энергии. Теория композиции
принадлежащий
атом продолжает оставаться захватывающим приключением.
разные
субатомные частицы. Атомная теория получила дальнейшее развитие благодаря
концепция
что протоны и нейтроны состоят из еще более мелких единиц, называемых кварками.
Сами кварки находятся в
очередь из вибрирующих нитей энергии. Теория композиции
принадлежащий
атом продолжает оставаться захватывающим приключением.