Произведение растворимости — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 3 ноября 2017; проверки требуют 4 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 3 ноября 2017; проверки требуют 4 правки.Произведе́ние раствори́мости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянных температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
- CaCO3(s)⇌Ca2+(aq)+CO32−(aq).{\displaystyle \mathrm {CaCO} _{3}(s)\rightleftharpoons {\mbox{Ca}}^{2+}(aq)+{\mbox{CO}}_{3}^{2-}(aq).}
Константа этого равновесия рассчитывается по уравнению:
- K={Ca2+(aq)}{CO32−(aq)}{CaCO3(s)}.{\displaystyle K={\frac {\left\{{\mbox{Ca}}^{2+}(aq)\right\}\left\{{\mbox{CO}}_{3}^{2-}(aq)\right\}}{\left\{{\mbox{CaCO}}_{3}(s)\right\}}}.}
В приближении идеального раствора с учётом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:
- Ksp=[Ca2+(aq)][CO32−(aq)].{\displaystyle K_{\mathrm {sp} }=\left[{\mbox{Ca}}^{2+}(aq)\right]\left[{\mbox{CO}}_{3}^{2-}(aq)\right].}
Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m катионов An+ и n анионов Bm−, рассчитывается по уравнению:
- Ksp=[An+(aq)]m[Bm−(aq)]n,{\displaystyle K_{\mathrm {sp} }=\left[{\mbox{A}}^{n+}(aq)\right]^{m}\left[{\mbox{B}}^{m-}(aq)\right]^{n},}
где [An+(aq)] и [Bm−(aq)] — равновесные молярные концентрации ионов данного вещества, образующихся при электролитической диссоциации.
Из произведений растворимости и отношения числа катионов к анионам (m/n) можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках[1].
Уравнение произведения растворимости не учитывает коэффициенты активности, то есть степень влияния ионных сил. Для растворов с концентрациями бо́льшими, чем 1⋅10−4 моль/л, необходимо использовать произведение активностей:
- Ksp=[aA(aq)]m[aB(aq)]n,{\displaystyle K_{\mathrm {sp} }=\left[{\mbox{a}}_{A}(aq)\right]^{m}\left[{\mbox{a}}_{B}(aq)\right]^{n},}
где аA и аB — активности ионов A и B.
Произведение активностей ионов для насыщенных растворов малорастворимых электролитов при данной температуре — постоянная величина. Она зависит от температуры и природы растворителя.
Произведение растворимости связано с растворимостью следующим соотношением:
S=Kspmm⋅nnm+n,{\displaystyle {S}={\sqrt[{m+n}]{K_{\mathrm {sp} } \over {m^{m}\cdot n^{n}}}},}
- где:
- m — количество моль катиона;
- n — количество моль аниона;
- Ksp — произведение растворимости;
- S — растворимость вещества (моль/л).
- Д. Г. Кнорре, Л. Ф. Крылова, В. С. Музыкантов. Физическая химия, М.: «Высшая школа», 1990.
- ↑ Рабинович В.А., Хавин 3.Я. Краткий химический справочник. С. 287—290.
9.5. Произведение растворимости
Подавляющее большинство веществ обладает ограниченной растворимостью в воде и других растворителях. Поэтому на практике часто приходится иметь дело с системами, в которых в состоянии равновесия находятся осадок и насыщенный раствор электролита.
Малорастворимые электролиты при растворении полностью диссоциируют на ионы (в растворе нет нейтральных молекул).
Например, для малорастворимого соединения Ag2CO3 можно записать следующий обратимый процесс:
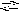 Ag2CO3(к) 2Ag+(р) + CO32(р) ,
Ag2CO3(к) 2Ag+(р) + CO32(р) ,
а соответствующая ему константа равновесия будет называться произведением растворимости:
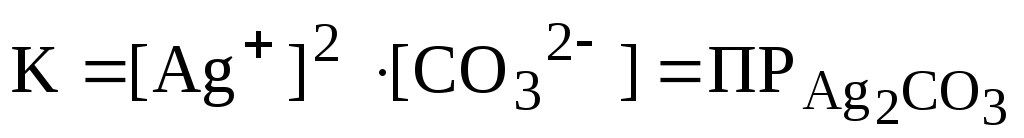 .
.
Этот процесс является гетерогенным, поэтому константа равновесия определяется только произведением концентраций ионов в растворе и не зависит от концентрации твердого компонента.
Правила записи выражений для произведения растворимости ничем не отличаются от правил записи любых выражений для Кp.Произведение растворимости равно произведению молярных концентраций ионов, участвующих в равновесии, каждая из которых возведена в степень, равную стехиометрическому коэффициенту, при соответствующем ионе в уравнении равновесия.
ПР тесно связано с растворимостью (S моль/л). Так, для электролитов, имеющих катионы и анионы одинакового заряда (AgCl, PbS и др.), очевидно
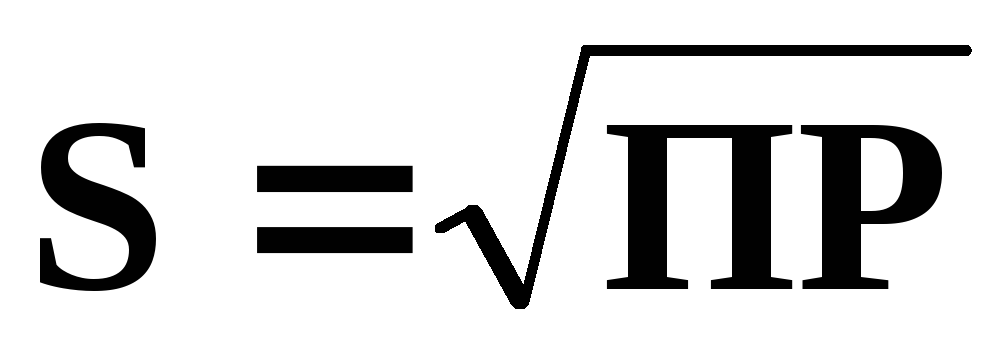 ,
а ПР
= S2
,
а ПР
= S2
В общем случае разных зарядов катиона (n+) и аниона (m):
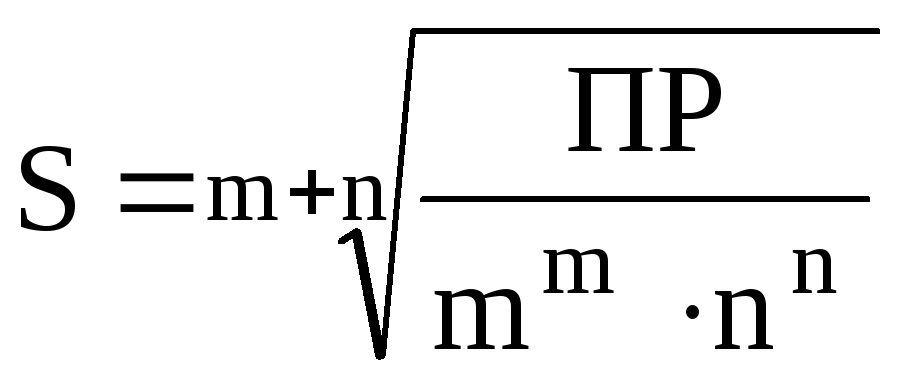 или .
или .
Очевидно,
что ПР, кроме того, можно найти по
термодинамическим данным, так как
ПР = К = 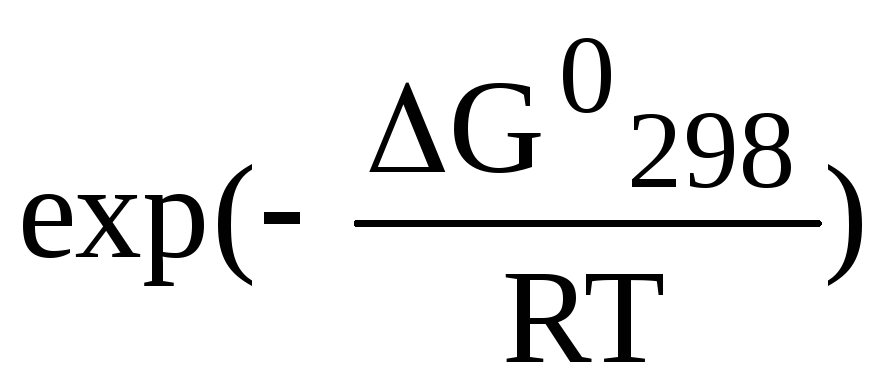
Пример 20. ПР (СаF2) = 3,9.10
Решение. Равновесие растворения описывается уравнением:
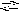 СаF2(Т) Са2+(Р) + 2F(Р) .
СаF2(Т) Са2+(Р) + 2F(Р) .
Из каждого моля растворившегося СаF2 в растворе появляются 1 моль ионов Са2+ и 2 моль ионов F. Поэтому, обозначая растворимость фторида кальция, выраженную в моль на литр, через х, молярные концентрации Ca2+ и F в растворе можно записать следующим образом: [Ca2+] = х и [F] = 2 x. Выражение для произведения растворимости в данном случае имеет вид
ПР = [Ca2+] [F]2 .
Подставляя в него [Ca2+
] = х и [F] = 2 х, находим ПР = х (2 х)2 = 4 х3 = 3,9.1011. Отсюда
х = 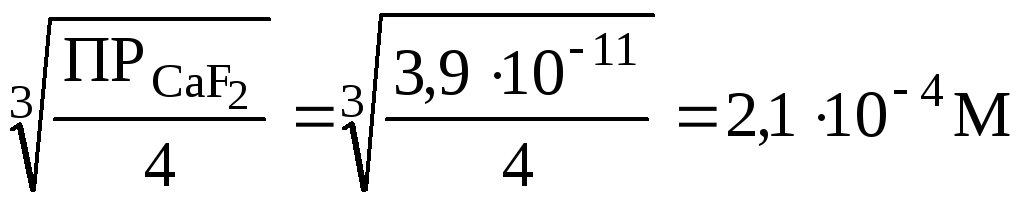 .
.
Следовательно, растворимость СаF2, выраженная в моль/л, равна 2,1.104.
Поскольку молярная масса СаF2 равна 78,1 г/моль, то растворимость СаF2, выраженная в г/литр, составит: 2,1.104 моль/л·78,1 г/моль = 1,6·102 г/л.
Пример 21. Какова растворимость (S) Ag2CO3 , если ПР (Ag2CO3) = 8,2.1012 ? Как изменится растворимость при добавлении в 1 литр насыщенного раствора 10,6 г Na2CО3 ? Какое количество Ag2CO3 выпадет при этом в осадок?
Решение.
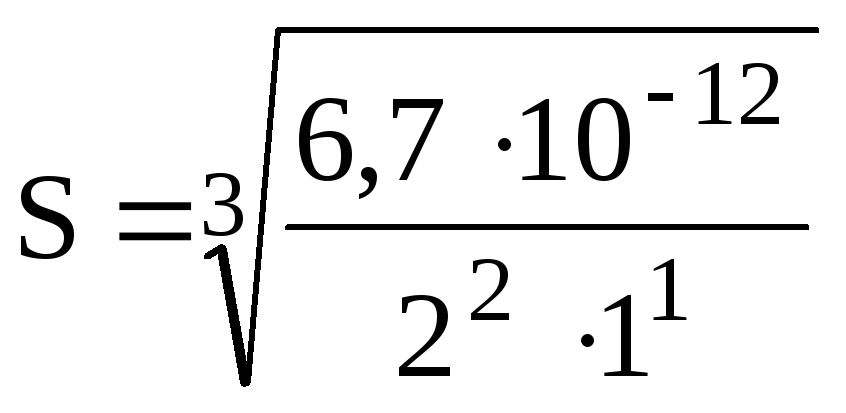 =
1,19.104 моль/л.
=
1,19.104 моль/л.
При растворении 10,6 г Na2CО3 в 1 л раствора добавляется 10,6/106 = 0,1 моль ионов CО32. Если считать, что объем раствора при этом не изменяется, и учесть, что концентрация CО32 до растворения Na2CО3 пренебрежимо мала, то равновесное значение [CО32] = 0,1 моль/л. Отсюда можно найти новую концентрацию Ag+ :
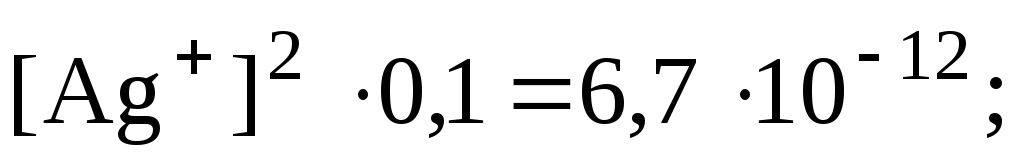
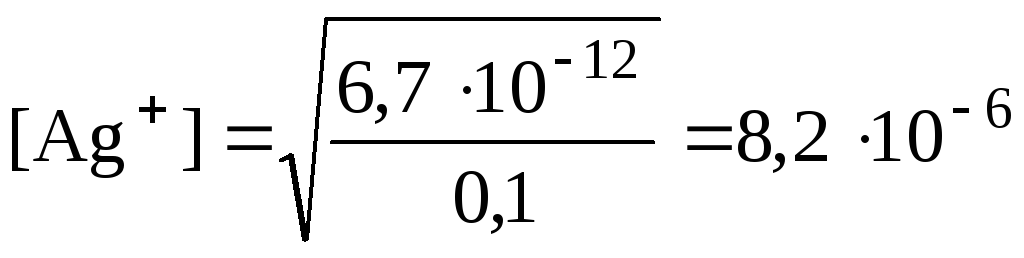 моль/л.
моль/л.
Это соответствует вдвое меньшей концентрации Ag2CO3 , то есть растворимость стала S|
= 4,1.106 моль/л, а из 1 л раствора выпало в осадок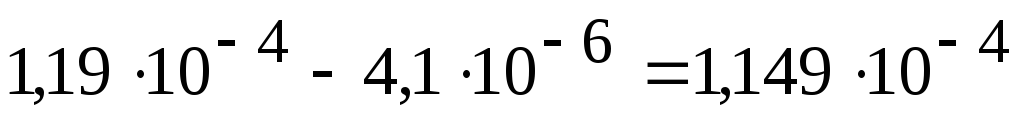 моль, или 0,32 г
Ag2CO3 .
моль, или 0,32 г
Ag2CO3 .
Полученные результаты показывают, что при добавлении в насыщенный раствор одноименного иона в концентрации, значительно превышающей первоначальную, труднорастворимое вещество практически полностью выпадает в осадок. Этот эффект (выпадение осадка из насыщенного раствора при добавлении одноименного иона) носит название «высаливание» . Он используется для извлечения ценных компонентов из растворов.
Из выражения для ПР следует, что при увеличении концентрации одного из ионов электролита в его насыщенном растворе (например, путем введения другого электролита, содержащего тот же ион) произведение концентраций ионов электролита становится больше ПР. При этом равновесие между твердой фазой и раствором смещается в сторону образования осадка, так как величина ПР не зависит от концентрации. Таким образом,

Пример 22. Будет ли образовываться осадок при смешении 0,1 л раствора нитрата свинца с концентрацией 3,0·103 М и 0,4 л раствора сульфата натрия с концентрацией 5,0·103 М ? Если да, то сколько граммов?
Решение. Возможными продуктами реакции являются PbSO4 и NaNO3. Соли натрия относятся к хорошо растворимым соединениям, однако PbSO4 имеет ПР = 1,6.108. Чтобы определить, будет ли происходить осаждение PbSO4, следует вычислить произведение концентраций ионов Pb2+ и SO4 2 и сопоставить полученный результат с ПР.
При смешении двух растворов полный объем становится равным 0,1 + 0,4 = 0,5 л. Число моль Pb2+, содержащихся в 0,1 л раствора Pb(NO3)2 с концентрацией 3,0·103 М, равно
0,1 л·(3,0·103 моль/л) = 3,0·104 моля.
Концентрация
Pb2+ в 0,5л смеси растворов должна быть равна
[Pb2+]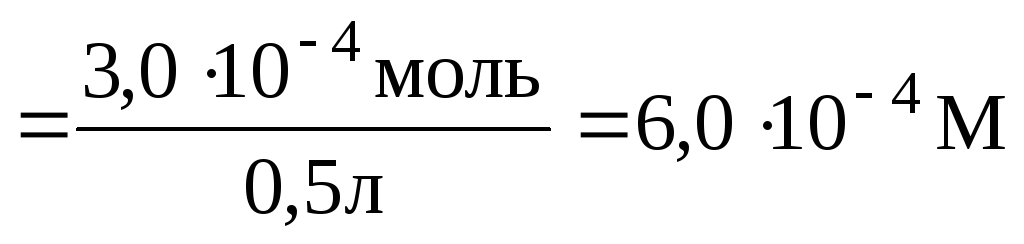 .
Число моль SO42— в 0,4 л исходного
раствора Na2SO4 равно:
.
Число моль SO42— в 0,4 л исходного
раствора Na2SO4 равно:
0,4 л·(5,0·103 моль/л) = 2,0·103 моль.
Следовательно, [SO42] в 0,5 л смеси растворов должна быть равна:
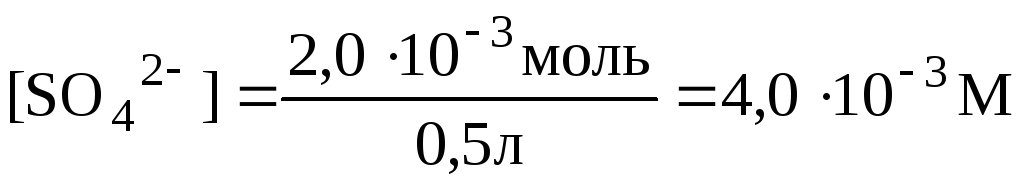
Находим произведение концентраций ионов:
[Pb2+]·[SO42] = (6,0·104)·(4,0.103) = 2,4·106.
Поскольку произведение концентраций ионов 2,4·106 больше ПР, в смеси растворов должно происходить осаждение PbSO4.
Чтобы
определить, какое количество PbSO4 выпадет в осадок, определим концентрацию
ионов Pb2+ в растворе: [Pb2+]
= 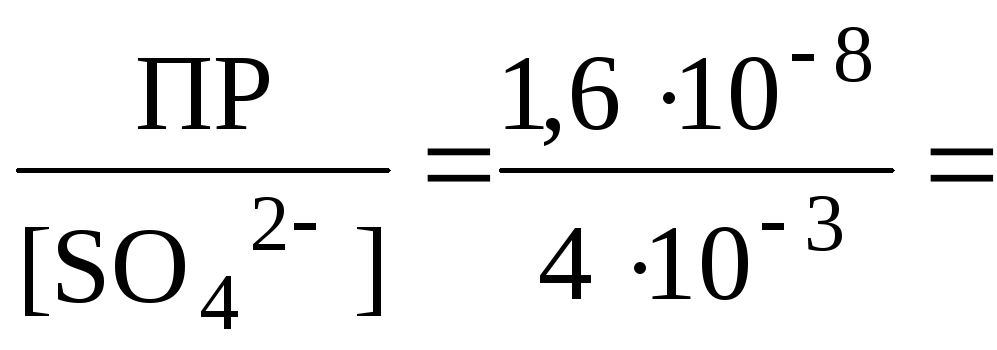 4.104 М.
4.104 М.
В 0,5 л содержится в 2 раза меньше 2·104 моль. Следовательно, в осадок выпадет 3·104 2·104 = 1·10 4 моль или m =n·М = 104·393 4·102 г.
Произведение растворимости
Определение
Поместим в химический стакан какую-либо труднорастворимую соль, например, AgCl и добавим к осадку дистиллированной воды. При этом ионы Ag+ и Cl—, испытывая притяжение со стороны окружающих диполей воды, постепенно отрываются от кристаллов и переходят в раствор. Сталкиваясь в растворе, ионы Ag+ и Cl— образуют молекулы AgCl и осаждаются на поверхности кристаллов. Таким образом, в системе происходят два взаимно противоположных процесса, что приводит к динамическому равновесию, когда в единицу времени в раствор переходит столько же ионов Ag+ и Cl—, сколько их осаждается. Накопление ионов Ag+ и Cl— в растворе прекращается, получается насыщенный раствор. Следовательно, мы будем рассматривать систему, в которой имеется осадок труднорастворимой соли в соприкосновении с насыщенным раствором этой соли. При этом происходят два взаимно противоположных процесса:
1) Переход ионов из осадка в раствор. Скорость этого процесса можно считать постоянной при неизменной температуре: V1 = K1;
2) Осаждение ионов из раствора. Скорость этого процесса V2 зависит от концентрации ионов Ag+ и Cl—. По закону действия масс:
V2 = k2
Так как данная система находится в состоянии равновесия, то
V1 = V2
k2 = k1
[Ag+]
- [Cl—] = k2 / k1 = const (при T = const)
Таким образом, произведение
концентраций ионов в насыщенном растворе труднорастворимого электролита
при постоянной температуре является постоянной величиной. Эта величина называется произведением растворимости (ПР).
В приведенном примере ПРAgCl = [Ag+] • [Cl—].
В тех случаях, когда электролит содержит два или несколько одинаковых
ионов, концентрация этих ионов, при вычислении произведения
растворимости должна быть возведена в соответствующую степень.
Например, ПРAg2S = [Ag+]2
- [S2-]; ПРPbI2 = [Pb2+] [I—]2
В общем случае выражение произведения растворимости для электролита AmBn
ПРAmBn = [A]m [B]n.
Значения произведения растворимости для разных веществ различны.
Например, ПРCaCO3 = 4,8
- 10-9; ПРAgCl = 1,56 10-10.
ПР легко вычислить, зная раcтворимость соединения при данной t°.
Пример 1
Растворимость CaCO3 равна 0,0069 или 6,9
- 10-3 г/л. Найти ПРCaCO3.
Решение
Выразим растворимость в молях:
SCaCO3 = (6,9
· 10-3) / 100,09 = 6,9 • 10-5 моль/л
MCaCO3
Так как каждая молекула CaCO3 дает при растворении по одному иону Ca2+ и CO32-, то
[Ca2+] = [ CO32-] = 6,9
следовательно, ПРCaCO3 = [Ca2+
]
- [CO32-] = 6,9 10-56,9 10-5 = 4,8 10-9
Зная величину ПР, можно в свою очередь вычислить растворимость вещества в моль/л или г/л.
Пример 2
Произведение растворимости ПРPbSO4 = 2,2
Чему равна растворимость PbSO4?
Решение
Обозначим растворимость PbSO4 через X моль/л. Перейдя в раствор, X молей PbSO4 дадут X ионов Pb2+ и X ионов SO42-, т.е.:
[Pb2+] = [SO42-] = X
ПРPbSO4 = [Pb2+] = [SO42-
] = X
X = \e(ПРPbSO4) = \e(2,2
- 10-8) = 1,5 10-4 моль/л.
Чтобы перейти к растворимости, выраженной в г/л, найденную величину умножим на молекулярную массу, после чего получим:
1,5
- 10-4 303,2 = 4,5 10-2 г/л.
Образование осадков
Если
[Ag+]
- [Cl—] < ПРAgCl — ненасыщенный раствор
[Ag+
]
- [Cl—] = ПРAgCl — насыщенный раствор
[Ag+]
- [Cl—] > ПРAgCl — перенасыщенный раствор
Осадок образуется в том
случае, когда произведение концентраций ионов малорастворимого
электролита превысит величину его произведения растворимости при данной
температуре. Когда ионное
произведение станет равным величине ПР, выпадение осадка прекращается.
Зная объем и концентрацию смешиваемых растворов, можно рассчитать,
будет ли выпадать осадок образующейся соли.
Пример 3
Выпадает ли осадок при смешении равных объемов 0,2 M растворов Pb(NO3)2 и NaCl.
ПРPbCl2
= 2,4
Решение
При смешении объем раствора возрастает вдвое и концетрация каждого из веществ уменьшится вдвое, т.е. станет 0,1 M или 1,0
- 10-1 моль/л. Таковы же будут концентрации Pb2+ и Cl—. Следовательно, [Pb2+] [Cl—]2 = 1 10-1 (1 10-1)2 = 1 10-3. Полученная величина превышает ПРPbCl2 (2,4 10-4). Поэтому часть соли PbCl2 выпадает в осадок. Из всего сказанного выше можно сделать вывод о влиянии различных факторов на образование осадков.
Влияние концентрации растворов
Труднорастворимый электролит с достаточно большой величиной ПР нельзя осадить из разбавленных растворов. Например, осадок PbCl2 не будет выпадать при смешении равных объемов 0,1 M растворов Pb(NO3)2 и NaCl. При смешивании равных объемов концентрации каждого из веществ станут 0,1 / 2 = 0,05 M или 5
- 10-2 моль/л. Ионное произведение [Pb2+] [Cl1-]2 = 5 10-2 (5 10-2)2 = 12,5 10-5. Полученная величина меньше ПРPbCl2, следовательно выпадения осадка не произойдет.
Влияние количества осадителя
Для возможно более полного осаждения употребляют избыток осадителя.
Например, осаждаем соль BaCO3: BaCl2 + Na2CO3 ® BaCO3¯ + 2NaCl. После прибавления эквивалентного количества Na2CO3 в растворе остаются ионы Ba2+, концентрация которых обусловлена величиной ПР.
Повышение концентрации ионов CO32-, вызванное прибавлением избытка осадителя (Na2CO3), повлечет за собой соответственное уменьшение концентрации ионов Ba2+ в растворе, т.е. увеличит полноту осаждения этого иона.
Влияние одноименного иона
Растворимость труднорастворимых
электролитов понижается в присутствии других сильных электролитов,
имеющих одноименные ионы. Если к ненасыщенному раствору BaSO4 понемногу прибавлять раствор Na2SO4, то ионное произведение, которое было сначала меньше ПРBaSO4 (1,1
- 10-10), постепенно достигнет ПР и превысит его. Начнется выпадение осадка.
Влияние температуры
ПР является постоянной величиной при
постоянной температуре. С увеличением температуры ПР возрастает,
поэтому осаждение лучше проводить из охлажденных растворов.
Растворение осадков
Правило произведения растворимости
важно для переведения труднорастворимых осадков в раствор. Предположим,
что надо растворить осадок BaСO3. Раствор, соприкасающийся с этим осадком, насыщен относительно BaСO3.
Это означает, что [Ba2+
]
Если добавить в раствор кислоту, то ионы H+ свяжут имеющиеся в растворе ионы CO32- в молекулы непрочной угольной кислоты:
2H+ + CO32- ® H2CO3 ® H2O + CO2
Вследствие этого резко снизится концентрация иона CO32- , ионное произведение станет меньше величины ПРBaCO3. Раствор окажется ненасыщенным относительно BaСO3 и часть осадка BaСO3
перейдет в раствор. При добавлении достаточного количества кислоты
можно весь осадок перевести в раствор. Следовательно, растворение
осадка начинается тогда, когда по какой-либо причине ионное
произведение малорастворимого электролита становится меньше величины
ПР. Для того, чтобы растворить осадок, в раствор вводят такой
электролит, ионы которого могут образовывать малодиссоциированное
соединение с одним из ионов труднорастворимого электролита. Этим
объясняется растворение труднорастворимых гидроксидов в кислотах
Fe(OH)3 + 3HCl ® FeCl3 + 3H2O
Ионы OH— связываются в малодиссоциированные молекулы H2O.
Таблица. Произведение растворимости (ПР) и растворимость при 25°С некоторых малорастворимых веществ
| Формула | Растворимость | ПР моль / л |
| AgBr | 7,94 • 10-7 | 6,3 • 10-13 |
| AgCl | 1,25 • 10-5 | 1,56 • 10-10 |
| AgI | 1,23 • 10-8 | 1,5 • 10-16 |
| Ag2CrO4 | 1,0 • 10-4 | 4,05 • 10-12 |
| BaSO4 | 7,94 • 10-7 | 6,3 • 10-13 |
| CaCO3 | 6,9 • 10-5 | 4,8 • 10-9 |
| PbCl2 | 1,02 • 10-2 | 1,7 • 10-5 |
| PbSO4 | 1,5 • 10-4 | 2,2 • 10-8 |
Произведение растворимости — это… Что такое Произведение растворимости?
Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
Константа этого равновесия рассчитывается по уравнению:
В приближении идеального раствора с учётом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:
Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m ионов An+ и n ионов Bm-, рассчитывается по уравнению:
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
Произведение активностей
Данное уравнение не учитывает коэффициенты активности, то есть степень влияния ионных сил. Для растворов с концентрациями большими, чем 1·10−4 моль/л необходимо использовать произведение активностей:
где аA и аB — активности ионов A и B.
Произведение активностей ионов для насыщенных растворов малорастворимых электролитов при данной температуре постоянная величина. Она зависит от температуры и природы растворителя.
Произведение растворимости связано с растворимостью следующим соотношением:
- где:
- m+n — суммарное количество молей катионов и анионов
- m — количество молей катиона
- n — количество молей аниона
- Ksp — произведение растворимости
- S — растворимость вещества (моль/л)
Литература
- Д. Г. Кнорре, Л. Ф. Крылова, В. С. Музыкантов. Физическая химия, М.:»Высшая школа» 1990
Ссылки
Химиотерапия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 25 декабря 2018; проверки требуют 4 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 25 декабря 2018; проверки требуют 4 правки.Химиотерапи́я — лечение какого-либо инфекционного, паразитарного заболевания либо злокачественной опухоли (рака) с помощью препаратов как яд или токсин, губительно воздействующих на инфекционный агент — возбудитель заболевания, на паразитов или на клетки злокачественных опухолей при сравнительно меньшем отрицательном воздействии на организм больного. Яд или токсин при этом называется химиопрепаратом, или химиотерапевтическим агентом.
В отличие от фармакотерапии, в которой имеется всего два объекта — фармакологический агент (лекарство) и подвергаемый его воздействию организм больного, в процессе химиотерапии задействовано три объекта — химиотерапевтический агент, организм больного и подлежащий убиению паразит, инфекционный агент или клон злокачественных опухолевых клеток.
Отличаются и цели: целью фармакотерапии является коррекция тех или иных нарушений жизнедеятельности организма, восстановление или улучшение функций поражённых заболеванием органов и систем. Целью же химиотерапии является уничтожение, убийство или, по крайней мере, торможение размножения паразитов, инфекционных агентов или злокачественных клеток, по возможности с меньшим повреждающим действием на организм больного. Нормализация жизнедеятельности и улучшение функций поражённых органов и систем при этом достигаются вторично, как следствие уничтожения или ослабления причины, вызвавшей заболевание — инфекции, опухоли или паразитарной инвазии.
В соответствии с тем, на уничтожение чего направлена химиотерапия, выделяют:
Принятие других препаратов во время химиотерапии[править | править код]
Некоторые лекарства могут вступать в реакцию с препаратами, используемыми при химиотерапии. Врач должен изучить список всех лекарств, которые принимает пациент, прежде чем приступить к лечению. В такой список должны входить все принимаемые средства, в том числе витамины, препараты против аллергии и др., а также минеральные или растительные добавки.