При нагревании гидроксида хрома 3 образуется. Оксиды хрома (II), (III) и (VI). Физические характеристики хрома
Оксид хрома (II) СrО — пирофорный черный порошок (пирофорность — способность в тонкораздробленном состоянии воспламенятьсяна воздухе). Получается окислением амальгамы хрома кислородом воздуха. Растворяется в разбавленной соляной кислоте:
На воздухе при нагревании выше 100° С оксид хрома (II) превращается в оксид хрома (III).
Соли хрома (II). По своим химическим свойствам соли Cr 2+ похожи на соли Fe 2+ . Обрабатывая их растворы щелочами в отсутствие кислорода, можно получить желтый осадок гидроксида хрома (II):
который обладает типичными основными свойствами. Является восстановителем. При прокаливании Cr(OH) 2 в отсутствие кислорода образуется оксид хрома (II) СrО. При прокаливании на воздухе превращается в Сr 2 О 3 .
Все соединения хрома (II) довольно неустойчивы и легко окисляются кислородом воздуха в соединения хрома (III):
Соли хрома (III).
При действии щелочей на соли хрома (Ш) выпадает студнеобразный осадок гидроксида хрома (III) — Сr(ОН) 3 зеленого цвета:
Гидроксид хрома (III) обладает амфотерными свойствами, растворяясь как в кислотах с образованием солей хрома (III):
так и в щелочах с образованием тетрагидроксихромитов, т. е. солей, в которых Сг 3+ входит в состав аниона:
В результате прокаливания Сr(ОН) 3 можно получить оксид хрома (III) Сr 2 О 3 :
Оксид хрома (III) Сr 2 O 3 — тугоплавкий порошок зеленого цвета. По твердости близок к корунду, поэтому его вводят в состав полирующих средств. Получается соединением элементов при высокой температуре.
Сr 2 О 3 представляет собой зеленые кристаллы, практически нерастворимые в воде. Сr 2 О 3 может быть также получен при прокаливании дихроматов калия и аммония:
При сплавлении Cr 2 O 3 со щелочами, содой и кислыми солями получаются соединения Сг 3+ , растворимые в воде:
Оксид хрома (VI) — кислотный оксид, ангидрид хромовой H 2 CrO 4 и дихромовойH 2 Cr 2 O 7 кислот.
Получается при взаимодействии концентрированной серной кислоты с насыщенным раствором дихромата натрия или калия:
СrО 3 имеет кислотный характер: легко растворяется в воде, образуя хромовые кислоты. С избытком воды образует хромовую кислоту H 2 CrO 4:
При большой концентрации СrО 3 образуется дихромовая кислота H 2 Cr 2 O 7:
которая при разбавлении переходит в хромовую кислоту:
Хромовые кислоты существуют только в водном растворе. Однако, их соли весьма устойчивы.
СrО 3 представляет собой ярко-красные кристаллы, легко растворимые в воде. Сильный окислитель: окисляет иод, серу, фосфор, уголь, превращаясь при этом в Cr 2 O 3 . Например:
Сильный окислитель: окисляет иод, серу, фосфор, уголь, превращаясь при этом в Cr 2 O 3 . Например:
При нагревании до 250° С разлагается:
Он реагируетсо щелочами, образуя желтые хроматы СrO 4 2- :
В кислой среде ион СrO 4 2- превращается в ион Сr 2 O 7 2- .
В щелочной среде эта реакция протекает в обратном направлении:
В кислой среде дихромат-ион восстанавливается до Сr 3+ :
Если сопоставить гидроксиды хрома с разной степенью окисления
Сr 2+ (ОН) 2 , Сr 3+ (ОН) 3 и Н 2 Сr 6+ O 4 , то легко сделать вывод, что с возрастанием степени окисления основные свойства гидроксидов ослабевают, а кислотные усиливаются.
Сr(ОН) 2 проявляет основные свойства, Сr(ОН) 3 — амфотерные, а H 2 CrO 4 — кислотные.
Хроматы и дихроматы (VI). Наиболее важными соединениями хрома в высшей степени окисления 6+ являются хромат (VI) калия К 2 СrО 4 и дихромат (VI) калия K 2 Cr 2 O 7 .
Хромовые кислоты образуют два ряда солей: хроматы -так называются соли хромовой кислоты, и дихроматы — так называются соли дихромовой кислоты. Хроматы окрашены в желтый цвет (цвет хромат-иона СrO 4 2-), дихроматы — в оранжевый (цвет дихромат-иона Сr 2 O 7 2-).
Хроматы окрашены в желтый цвет (цвет хромат-иона СrO 4 2-), дихроматы — в оранжевый (цвет дихромат-иона Сr 2 O 7 2-).
Дихроматы Na 2 Cr 2 O 7× 2Н 2 O и K 2 Cr 2 O 7 называются хромпиками. Они как окислители применяются в кожевенной (дубление кож), лакокрасочной, спичечной и текстильной промышленности. Хромовая смесь — так называется 3%-ный раствор дихромата калия в концентрированной серной кислоте — применяется в химических лабораториях для мытья стеклянной посуды.
Соли хромовых кислот в кислой среде — сильные окислители:
Соединения хрома (III) в щелочной среде играют роль восстановителей. Под действием различных окислителей — Cl 2 , Br 2 , H 2 O 2 , КмnO 4 и др. — они переходят в соединения хрома (IV) — хроматы:
Здесь соединение Cr (III) изображено в форме Na,так как в виде ионов Na + и — оно существует в избытке раствора щелочи.
Сильные окислители, такие, как KMnO 4 , (NH 4) 2 S 2 O 8 в кислойсреде переводят соединения Cr (III) в дихроматы:
Таким образом, окислительные свойства последовательно усиливаются с изменением степеней окисления в ряду: Cr 2+ ® Cr 3+ ® Cr 6+ . Соединения Cr (II) — сильные восстановители, легко окисляются, превращаясь в соединения крома. (III). Соединения хрома (VI) — сильные окислители, легко восстанавливаются в соединения хрома (III). Соединения с промежуточной степенью окисления, т. е. соединения хрома (III), могут при взаимодействии с сильными восстановителями проявлять окислительные свойства, переходя в соединения хрома (II), а при взаимодействии с сильными окислителями (например, бромом, KMnO 4) проявлять восстановительные свойства, превращаясь в соединения хрома (VI).
Соединения Cr (II) — сильные восстановители, легко окисляются, превращаясь в соединения крома. (III). Соединения хрома (VI) — сильные окислители, легко восстанавливаются в соединения хрома (III). Соединения с промежуточной степенью окисления, т. е. соединения хрома (III), могут при взаимодействии с сильными восстановителями проявлять окислительные свойства, переходя в соединения хрома (II), а при взаимодействии с сильными окислителями (например, бромом, KMnO 4) проявлять восстановительные свойства, превращаясь в соединения хрома (VI).
Соли хрома (III) весьма разнообразны по окраске: фиолетовые, синие, зеленые, коричневые, оранжевые, красные и черные. Все хромовые кислоты и их соли, а также оксид хрома (VI) ядовиты: поражают кожу, дыхательные пути, вызывают воспаление глаз, поэтому, работая с ними, необходимо соблюдать все меры предосторожности.
Хром образует три оксида: CrO, Cr 2 O 3 , CrO 3 .
Оксид хрома (II) CrO — пирофорный черный порошок. Обладает основными свойствами.
В окислительно-восстановительных реакциях ведет себя как восстановитель:
CrO получают разложением в вакууме карбонила хрома Cr(СО) 6 при 300°С.
Оксид хрома (III) Cr 2 O 3 — тугоплавкий порошок зеленого цвета. По твердости близок к корунду, поэтому его вводят в состав полирующих средств. Образуется при взаимодействии Cr и O 2 при высокой температуре. В лаборатории оксид хрома (III) можно получить нагреванием дихромата аммония:
(N -3 H 4) 2 Cr +6 2 O 7 =Cr +3 2 O 3 +N 0 2 +4Н 2 О
Оксид хрома (III) обладает амфотерными свойствами. При взаимодействии с кислотами образуются соли хрома (III): Cr 2 O 3 +3H 2 SO 4 =Cr 2 (SO 4) 3 +3Н 2 О
При взаимодействии с щелочами в расплаве образуются соединения хрома (III) — хромиты (в отсутствие кислорода): Cr 2 O 3 +2NaOH=2NaCrO 2 +Н 2 О
В воде оксид хрома (III) нерастворим.
В окислительно-восстановительных реакциях оксид хрома (III) ведет себя как восстановитель:
Оксид хрома (VI) CrO 3 — хромовый ангидрид, представляет собой темно-красные игольчатые кристаллы.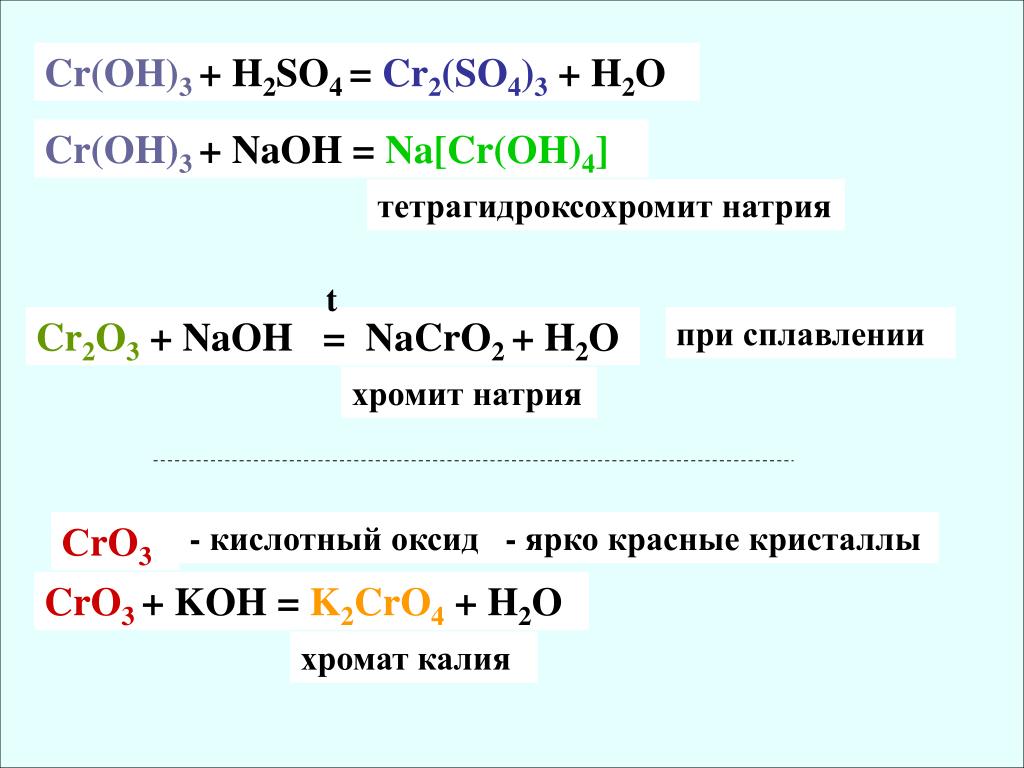 При нагревании около 200°С разлагается:
При нагревании около 200°С разлагается:
4CrO 3 =2Cr 2 O 3 +3O 2
Легко растворяется в воде, имея кислотный характер, образует хромовые кислоты. С избытком воды образуется хромовая кислота H 2 CrO 4:
CrO 3 +Н 2 O=Н 2 CrO 4
При большой концентрации CrO 3 образуется дихромовая кислота Н 2 Cr 2 О 7:
2CrO 3 +Н 2 О=Н 2 Cr 2 О 7
которая при разбавлении переходит в хромовую кислоту:
Н 2 Cr 2 О 7 +Н 2 О=2Н 2 CrO 4
Хромовые кислоты существуют только в водном растворе, ни одна из этих кислот в свободном состоянии не выделена. Однако соли их весьма устойчивы.
Оксид хрома (VI) является сильным окислителем:
3S+4CrO 3 =3SO 2 +2Cr 2 O 3
Окисляет иод, серу, фосфор, уголь, превращаясь в Cr 2 O 3 . Получают CrO 3 действием избытка концентрированной серной кислоты на насыщенный водный раствор дихромата натрия: Na 2 Cr 2 O 7 +2H 2 SO 4 =2CrO 3 +2NaHSO 4 +H 2 O Следует отметить сильную токсичность оксида хрома (VI).
Оксид хрома(II ) и гидроксид хрома(II) имеют основной характер
Cr(OH)+2HCl→CrCl+2HO
Соединение хрома(II)-сильные восстановители; переходят в соединение хрома(III) под действием кислорода воздуха.
2CrCl+ 2HCl → 2CrCl+ H
4Cr(OH)+O+ 2HO→4Cr(OH)
Оксид хрома(III ) CrO- зеленый, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома(III) или дихроматов калия и аммония:
2Cr(OH)-→CrO+ 3HO
4KCrO-→ 2CrO + 4KCrO + 3O
(NH)CrO-→ CrO+ N+ HO
С концентрированными растворами кислот и щелочей взаимодействует с трудом:
Сr 2 О 3 + 6 КОН + 3Н 2 О = 2К 3 [Сr(ОН) 6 ]
Сr 2 О 3 + 6НСl = 2СrСl 3 + 3Н 2 О
Гидроксид хрома (III) Сr(ОН) 3 получают при действии щелочей на на растворы солей хрома (III):
СrСl 3 +3КОН = Сr(ОН) 3 ↓ + 3КСl
Гидроксид
хрома (III)
представляет собой осадок серо –
зеленого цвета, при получении которого,
щелочь надо брать в недостатке.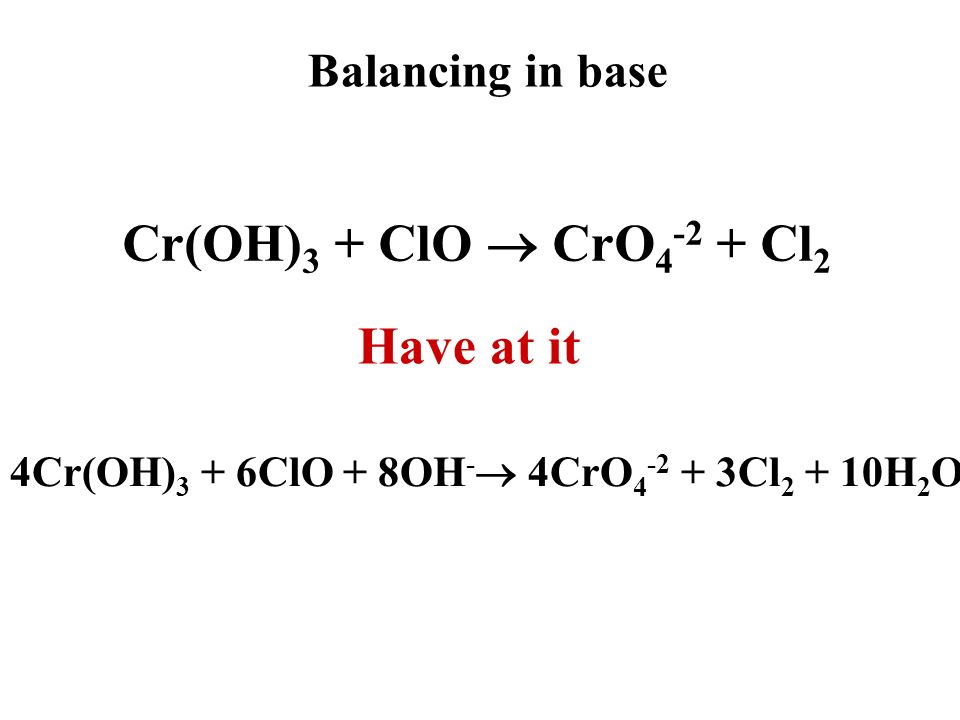
Сr(ОН) 3 + 3НNО 3 = Сr(NО 3) 3 + 3Н 2 О
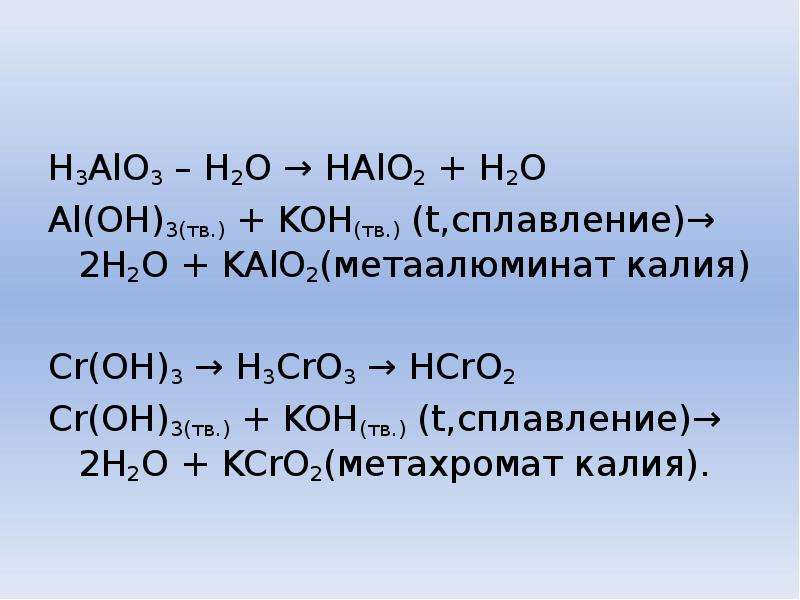
Сr(ОН) 3 + 3КОН = К 3 [Сr(ОН)6](гексагидроксохромит К)
При сплавлении Сr(ОН) 3 со щелочами получаются метахромиты и ортохромиты:
Cr(OH) 3 + KOH = KCrO 2 (метахромит К) + 2H 2 O
Cr(OH) 3 + KOH = K 3 CrO 3 (ортохромит К) + 3H 2 O
Соединения хрома(VI ).
Оксид хрома (VI ) — СrО 3 – темно – красное кристаллическое вещество, хорошо растворимо в воде – типичный кислотный оксид. Этому оксиду соответствует две кислоты:
СrО 3 + Н 2 О = Н 2 СrО 4 (хромовая кислота – образуется при избытке воды)
СrО 3 + Н 2 О =Н 2 Сr 2 О 7 (дихромовая кислота – образуется при большой концентрации оксида хрома (3)).
Оксид хрома (6) – очень сильный окислитель, поэтому энергично взаимодействует с органическими веществами:
Окисляет также иод, серу, фосфор, уголь:
При нагревании до 250 0 С оксид хрома (6) разлагается:
Оксид хрома (6) можно получить при действии концентрированной серной кислоты на твердые хроматы и дихроматы:
Хромовая
и дихромовая кислоты.
Хромовая и дихромовая кислоты существуют только в водных растворах, образуют устойчивые соли, соответственно хроматы и дихроматы. Хроматы и их растворы имеют желтую окраску, дихроматы – оранжевую.
Хромат — ионы СrО 4 2- и дихромат – ионы Сr2О 7 2- легко переходят друг в друга при изменении среды растворов
В кислой среде раствора хроматы переходят в дихроматы:
В щелочной среде дихроматы переходят в хроматы:
При разбавлении дихромовая кислота переходит в хромовую кислоту:
Зависимость свойств соединений хрома от степени окисления.
Степень окисления | |||
Характер оксида | основной | амфотерный | кислотный |
Гидроксид | Сr(ОН) 3 – Н 3 СrО 3 | ||
Характер гидроксида | основной | амфотерный | кислотный |
→ ослабление основных свойств и усиление кислотных→ | |||
Окислительно
– восстановительные свойства соединений
хрома.
Реакции в кислотной среде.
В кислотной среде соединения Сr +6 переходят в соединения Сr +3 под действием восстановителей: H 2 S, SO 2 , FeSO 4
Реакции в щелочной среде.
В щелочной среде соединения хрома Сr +3 переходят в соединения Сr +6 под действием окислителей: J2, Br2, Cl2, Ag2O, KClO3, h3O2, KMnO4:
2KCrO 2 +3 Br2 +8NaOH =2Na 2 CrO 4 + 2KBr +4NaBr + 4H 2 O
Cr +3 — 3e → Cr +6
Хром (Cr), химический элемент VI группы периодической системы Менделеева. Относится к переходным металлом с атомным номером 24 и атомной массой 51,996. В переводе с греческого, название металла означает «цвет». Такому названию металл обязан разнообразной цветовой гамме, которая присуща его различным соединениям.
Физические характеристики хрома
Металл обладает достаточной твердостью и хрупкостью одновременно. По шкале Мооса твердость хрома оценивается в 5,5. Этот показатель означает, что хром имеет максимальную твердость из всех известных на сегодня металлов, после урана, иридия, вольфрама и бериллия. Для простого вещества хрома характерен голубовато-белый окрас.
Для простого вещества хрома характерен голубовато-белый окрас.
Металл не относится к редким элементам. Его концентрация в земной коре достигает 0,02% масс. долей. В чистом виде хром не встречается никогда. Он содержится в минералах и рудах, которые являются главным источником добычи металла. Хромит (хромистый железняк, FeO*Cr 2 O 3) считается основным соединением хрома. Еще одним достаточно распространенным, однако менее важным минералом, является крокоит PbCrO 4 .
Металл легко поддается плавке при температуре 1907 0 С (2180 0 К или 3465 0 F). При температуре в 2672 0 С — закипает. Атомная масса металла составляет 51,996 г/моль.
Хром является уникальным металлом благодаря своим магнитным свойствам. В условиях комнатной температуры ему присуще антиферромагнитное упорядочение, в то время, как другие металлы обладают им в условиях исключительно пониженных температур. Однако, если хром нагреть выше 37 0 С, физические свойства хрома изменяются. Так, существенно меняется электросопротивление и коэффициент линейного расширения, модуль упругости достигает минимального значения, а внутреннее трение значительно увеличивается. Такое явление связано с прохождением точки Нееля, при которой антиферромагнитные свойства материала способны изменяться на парамагнитные. Это означает, что первый уровень пройден, и вещество резко увеличилось в объеме.
Такое явление связано с прохождением точки Нееля, при которой антиферромагнитные свойства материала способны изменяться на парамагнитные. Это означает, что первый уровень пройден, и вещество резко увеличилось в объеме.
Строение хрома представляет собой объемно-центрированную решетку, благодаря которой металл характеризуется температурой хрупко-вязкого периода. Однако, в случае с данным металлом, огромное значение имеет степень чистоты, поэтому, величина находится в пределах -50 0 С — +350 0 С. Как показывает практика, раскристаллизированный металл не имеет никакой пластичности, но мягкий отжиг и формовка делают его ковким.
Химические свойства хрома
Атом имеет следующую внешнюю конфигурацию: 3d 5 4s 1 . Как правило, в соединениях хром имеет следующие степени окисления: +2, +3, +6, среди которых наибольшую устойчивость проявляет Сr 3+ .Кроме этого существуют и другие соединения, в которых хром проявляет совершенно иную степень окисления, а именно: +1, +4, +5.
Металл не отличается особой химической активностью. Во время нахождения хрома в обычных условиях, металл проявляет устойчивость к влаге и кислороду. Однако, данная характеристика не относится к соединению хрома и фтора — CrF 3 , которое при воздействии температур, превышающих 600 0 С, взаимодействует с парами воды, образуя в результате реакции Сr 2 О 3 , а также азотом, углеродом и серой.
Во время нахождения хрома в обычных условиях, металл проявляет устойчивость к влаге и кислороду. Однако, данная характеристика не относится к соединению хрома и фтора — CrF 3 , которое при воздействии температур, превышающих 600 0 С, взаимодействует с парами воды, образуя в результате реакции Сr 2 О 3 , а также азотом, углеродом и серой.
Во время нагревания металлического хрома, он взаимодействует с галогенами, серой, кремнием, бором, углеродом, а также некоторыми другими элементами, в результате чего получаются следующие химические реакции хрома:
Cr + 2F 2 = CrF 4 (с примесью CrF 5)
2Cr + 3Cl 2 = 2CrCl 3
2Cr + 3S = Cr 2 S 3
Хроматы можно получить, если нагреть хром с расплавленной содой на воздухе, нитратами или хлоратами щелочных металлов:
2Cr + 2Na 2 CO 3 + 3O 2 = 2Na 2 CrO 4 + 2CO 2 .
Хром не обладает токсичностью, чего нельзя сказать о некоторых его соединениях. Как известно, пыль данного металла, при попадании в организм, может раздражать легкие, через кожу она не усваивается. Но, поскольку в чистом виде он не встречается, то его попадание в человеческий организм является невозможным.
Но, поскольку в чистом виде он не встречается, то его попадание в человеческий организм является невозможным.
Трехвалентный хром попадает в окружающую среду во время добычи и переработки хромовой руды. В человеческий организм попадание хрома вероятно в виде пищевой добавки, используемой в программах по похудению. Хром с валентностью, равной +3, является активным участником синтеза глюкозы. Ученые установили, что излишнее употребление хрома особого вреда человеческому организму не наносит, поскольку не происходит его всасывание, однако, он способен накапливаться в организме.
Соединения, в котором участвует шестивалентный металл, являются крайне токсичными. Вероятность их попадания в человеческий организм появляется во время производства хроматов, хромирования предметов, во время проведения некоторых сварочных работ. Попадание такого хрома в организм чревато серьезными последствиями, так как соединения, в которых присутствует шестивалентный элемент, представляют собой сильные окислители. Поэтому, могут вызвать кровотечение в желудке и кишечнике, иногда с прободением кишечника. При попадании таких соединений на кожу возникают сильные химические реакции в виде ожогов, воспалений, возникновения язв.
Поэтому, могут вызвать кровотечение в желудке и кишечнике, иногда с прободением кишечника. При попадании таких соединений на кожу возникают сильные химические реакции в виде ожогов, воспалений, возникновения язв.
В зависимости от качества хрома, которое необходимо получить на выходе, существует несколько способов производства металла: электролизом концентрированных водных растворов оксида хрома, электролизом сульфатов, а также восстановлением оксидом кремния. Однако, последний способ не очень популярен, так как при нем на выходе получается хром с огромным количеством примесей. Кроме того, он также является экономически невыгодным.
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
| +2 | CrO (чёрный) | Cr(OH)2 (желтый) | Основный | Cr2+ (соли голубого цвета) | Очень сильный восстановитель |
| Cr2O3 (зелёный) | Cr(OH)3 (серо-зеленый) | Амфотерный | Cr3+ (зеленые или лиловые соли) | ||
| +4 | CrO2 | не существует | Несолеобразующий | — | Встречается редко, малохарактерна |
| +6 | CrO3 (красный) | h3CrO4 | Кислотный | CrO42- (хроматы, желтые) | Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. Сильнейший окислитель, гигроскопичен, очень ядовит. |
Открытие хрома относится к периоду бурного развития химико-аналитических исследований солей и минералов. В России химики проявляли особый интерес к анализу минералов, найденных в Сибири и почти неизвестных в Западной Европе. Одним из таких минералов была сибирская красная свинцовая руда (крокоит), описанная еще Ломоносовым. Минерал исследовался, но ничего, кроме окислов свинца, железа и алюминия в нем не было найдено. Однако в 1797 году Вокелен, прокипятив тонко измельченный образец минерала с поташом и осадив карбонат свинца, получил раствор, окрашенный в оранжево – красный цвет. Из этого раствора он выкристаллизовал рубиново-красную соль, из которой выделили окисел и свободный металл, отличный от всех известных металлов. Вокелен назвал его Хром ( Chrome ) от греческого слова — окраска, цвет; правда здесь имелось в виду свойство не металла, а его ярко окрашенных солей .
Нахождение в природе.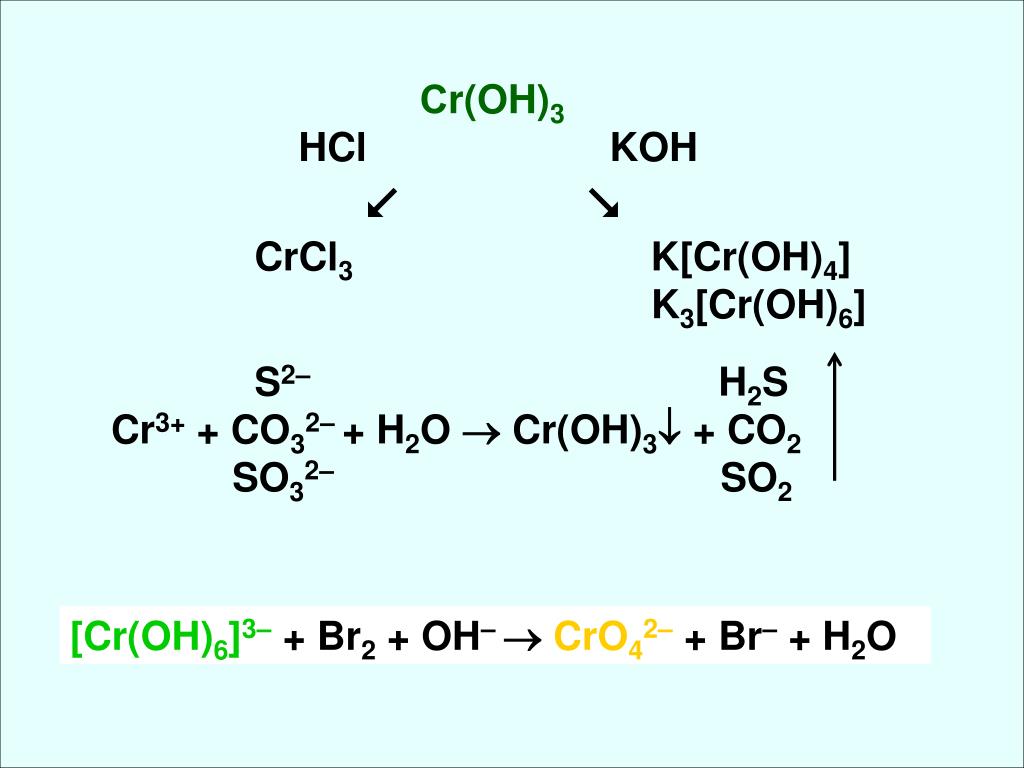
Важнейшей рудой хрома, имеющей практическое значение, является хромит, приблизительный состав которого отвечает формуле FeCrO 4.
Он встречается в Малой Азии, на Урале, в Северной Америке, на юге Африки. Техническое значение имеет также вышеназванный минерал крокоит – PbCrO 4 . В природе встречаются также оксид хрома (3) и некоторые другие его соединения. В земной коре содержание хрома в пересчете на металл составляет 0,03%. Хром обнаружен на Солнце, звездах, метеоритах.
Физические свойства .
Хром – белый, твердый и хрупкий металл, исключительно химически стойкий к воздействию кислот и щелочей. На воздухе он окисляется, имеет на поверхности тонкую прозрачную пленку оксида. Хром имеет плотность 7,1 г/см 3 , его температура плавления составляет +1875 0 С.
Получение.
При сильном нагреве хромистого железняка с углем происходит восстановление хрома и железа:
FeO * Cr 2 O 3 + 4C = 2Cr + Fe + 4CO
В результате этой реакции образуется сплав хрома с железом, отличающийся высокой прочностью. Для получения чистого хрома, его восстанавливают из оксида хрома(3) алюминием:
Для получения чистого хрома, его восстанавливают из оксида хрома(3) алюминием:
Cr 2 O 3 + 2Al = Al 2 O 3 + 2Cr
В данном процессе обычно используют два оксида – Cr 2 O 3 и CrO 3
Химические свойства.
Благодаря тонкой защитной пленке оксида, покрывающей поверхность хрома, он весьма устойчив к воздействию агрессивных кислот и щелочей. Хром не реагирует с концентрированными азотной и серной кислотами, а также с фосфорной кислотой. Со щелочами хром вступает во взаимодействие при t = 600-700 о C. Однако хром взаимодействует с разбавленными серной и соляной кислотами, вытесняя водород:
2Cr + 3H 2 SO 4 = Cr 2 (SO 4) 3 + 3H 2
2Cr + 6HCl = 2CrCl 3 + 3H 2
При высокой температуре хром горит в кислороде, образуя оксид(III).
Раскаленный хром реагирует с парами воды:
2Cr + 3H 2 O = Cr 2 O 3 + 3H 2
Хром при высокой температуре реагирует также с галогенами, галоген — водородами, серой, азотом, фосфором, углем, кремнием, бором, например:
Cr + 2HF = CrF 2 + H 2
2Cr + N2 = 2CrN
2Cr + 3S = Cr 2 S 3
Cr + Si = CrSi
Вышеуказанные физические и химические свойства хрома нашли свое применение в различных областях науки и техники. Так, например, хром и его сплавы используются для получения высокопрочных, коррозионно-стойких покрытий в машиностроении. Сплавы в виде феррохрома используются в качестве металлорежущих инструментов. Хромированные сплавы нашли применение в медицинской технике, при изготовлении химического технологического оборудования.
Так, например, хром и его сплавы используются для получения высокопрочных, коррозионно-стойких покрытий в машиностроении. Сплавы в виде феррохрома используются в качестве металлорежущих инструментов. Хромированные сплавы нашли применение в медицинской технике, при изготовлении химического технологического оборудования.
Положение хрома в периодической системе химических элементов:
Хром возглавляет побочную подгруппу VI группы периодической системы элементов. Его электронная формула следующая:
24 Cr IS 2 2S 2 2P 6 3S 2 3P 6 3d 5 4S 1
В заполнении орбиталей электронами у атома хрома нарушается закономерность, согласно которой сначала должна была бы заполнятся 4S – орбиталь до состояния 4S 2 . Однако, вследствие того, что 3d – орбиталь занимает в атоме хрома более выгодное энергетическое положение, происходит ее заполнение до значения 4d 5 . Такое явление наблюдается у атомов некоторых других элементов побочных подгрупп. Хром может проявлять степени окисления от +1 до +6. Наиболее устойчивыми являются cоединения хрома со степенями окисления +2, +3, +6.
Наиболее устойчивыми являются cоединения хрома со степенями окисления +2, +3, +6.
Соединения двухвалентного хрома.
Оксид хрома (II) CrO – пирофорный черный порошок (пирофорность – способность в тонкораздробленном состоянии воспламенятся на воздухе). CrO растворяется в разбавленной соляной кислоте:
CrO + 2HCl = CrCl 2 + H 2 O
На воздухе при нагревании свыше 100 0 С CrO превращается в Cr 2 O 3 .
Соли двухвалентного хрома образуются при растворении металлического хрома в кислотах. Эти реакции проходят в атмосфере малоактивного газа (например H 2), т.к. в присутствии воздуха легко происходит окисление Cr(II) до Cr(III).
Гидроксид хрома получают в виде желтого осадка при действии раствора щелочи на хлорид хрома (II):
CrCl 2 + 2NaOH = Cr(OH) 2 + 2NaCl
Cr(OH) 2 обладает основными свойствами, является восстановителем. Гидратированный ион Cr2+ окрашен в бледно – голубой цвет. Водный раствор CrCl 2 имеет синюю окраску. На воздухе в водных растворах соединения Cr(II) переходят в соединения Cr(III). Особенно это ярко выражается у гидроксида Cr(II):
Особенно это ярко выражается у гидроксида Cr(II):
4Cr(OH) 2 + 2H 2 O + O 2 = 4Cr(OH) 3
Соединения трехвалентного хрома.
Оксид хрома (III) Cr 2 O 3 – тугоплавкий порошок зеленого цвета. По твердости близок к корунду. В лаборатории его можно получить нагреванием дихромата аммония:
(NH 4) 2 Cr 2 O 7 = Cr 2 O 3 + N 2 + 4H 2
Cr 2 O 3 – амфотерный оксид, при сплавлении со щелочами образует хромиты: Cr 2 O 3 + 2NaOH = 2NaCrO 2 + H 2 O
Гидроксид хрома также является амфотерным соединением:
Cr(OH) 3 + HCl = CrCl 3 + 3H 2 O
Cr(OH) 3 + NaOH = NaCrO 2 + 2H 2 O
Безводный CrCl 3 имеет вид листочков темно-фиолетового цвета, совершенно нерастворим в холодной воде, при кипячении он растворяется очень медленно. Безводный сульфат хрома (III) Cr 2 (SO 4) 3 розового цвета, также плохо растворим в воде. В присутствии восстановителей образует фиолетовый сульфат хрома Cr 2 (SO 4) 3 *18H 2 O. Известны также зеленые гидраты сульфата хрома, содержащие меньшее количество воды. Хромовые квасцы KCr(SO 4) 2 *12H 2 O выкристаллизовываются из растворов, содержащих фиолетовый сульфат хрома и сульфат калия. Раствор хромовых квасцов при нагревании становится зеленым благодаря образованию сульфатов.
Хромовые квасцы KCr(SO 4) 2 *12H 2 O выкристаллизовываются из растворов, содержащих фиолетовый сульфат хрома и сульфат калия. Раствор хромовых квасцов при нагревании становится зеленым благодаря образованию сульфатов.
Реакции с хромом и его соединениями
Почти все соединения хрома и их растворы интенсивно окрашены. Имея бесцветный раствор или белый осадок, мы можем с большой долей вероятности сделать вывод об отсутствии хрома.
- Сильно нагреем в пламени горелки на фарфоровой чашке такое количество бихромата калия, которое поместится на кончике ножа. Соль не выделит кристаллизационной воды, а расплавится при температуре около 400 0 С с образование темной жидкости. Погреем ее еще несколько минут на сильном пламени. После охлаждения на черепке образуется зеленый осадок. Часть его растворим в воде (она приобретает желтый цвет), а другую часть оставим на черепке. Соль при нагревании разложилась, в результате образовался растворимый желтый хромат калия K 2 CrO 4 и зеленый Cr 2 O 3 .

- Растворим 3г порошкообразного бихромата калия в 50мл воды. К одной части добавим немного карбоната калия. Он растворится с выделением CO 2 , а окраска раствора станет светло – желтой. Из бихромата калия образуется хромат. Если теперь по порциям добавить 50% раствор серной кислоты, то снова появится красно – желтая окраска бихромата.
- Нальем в пробирку 5мл. раствора бихромата калия, прокипятим с 3мл концентрированной соляной кислоты под тягой. Из раствора выделяется желто-зеленый ядовитый газообразный хлор, потому, что хромат окислит HCl до Cl 2 и H 2 O. Сам хромат превратится в зеленый хлорид трехвалентного хрома. Его можно выделить выпариванием раствора, а потом, сплавив с содой и селитрой, перевести в хромат.
- При добавлении раствора нитрата свинца выпадает желтый хромат свинца; при взаимодействии с раствором нитрата серебра образуется красно – коричневый осадок хромата серебра.
- Добавим пероксид водорода к раствору бихромата калия и подкислим раствор серной кислотой.
 Раствор приобретает глубокий синий цвет благодаря образованию пероксида хрома. Пероксид при взбалтывании с некоторым количеством эфира перейдет в органический растворитель и окрасит его в голубой цвет. Данная реакция специфична для хрома и очень чувствительна. С ее помощью можно обнаружить хром в металлах и сплавах. Прежде всего необходимо растворить металл. При длительном кипячении с 30% — ной серной кислотой (можно добавить и соляную кислоту) хром и многие стали частично растворяются. Полученный раствор содержит сульфат хрома (III). Чтобы можно было провести реакцию обнаружения, сначала нейтрализуем его едким натром. В осадок выпадает серо-зеленый гидроксид хрома (III), который растворится в избытке NaOH и образует зеленый хромит натрия. Профильтруем раствор и добавим 30% -ый пероксид водорода. При нагревании раствор окрасится в желтый цвет, так как хромит окислится до хромата. Подкисление приведет к появлению голубой окраски раствора. Окрашенное соединение можно экстрагировать, встряхивая с эфиром.
Раствор приобретает глубокий синий цвет благодаря образованию пероксида хрома. Пероксид при взбалтывании с некоторым количеством эфира перейдет в органический растворитель и окрасит его в голубой цвет. Данная реакция специфична для хрома и очень чувствительна. С ее помощью можно обнаружить хром в металлах и сплавах. Прежде всего необходимо растворить металл. При длительном кипячении с 30% — ной серной кислотой (можно добавить и соляную кислоту) хром и многие стали частично растворяются. Полученный раствор содержит сульфат хрома (III). Чтобы можно было провести реакцию обнаружения, сначала нейтрализуем его едким натром. В осадок выпадает серо-зеленый гидроксид хрома (III), который растворится в избытке NaOH и образует зеленый хромит натрия. Профильтруем раствор и добавим 30% -ый пероксид водорода. При нагревании раствор окрасится в желтый цвет, так как хромит окислится до хромата. Подкисление приведет к появлению голубой окраски раствора. Окрашенное соединение можно экстрагировать, встряхивая с эфиром.
Аналитические реакции на ионы хрома.
- К 3-4 каплям раствора хлорида хрома CrCl 3 прибавьте 2М раствор NaOH до растворения первоначально выпавшего осадка. Обратите внимание на цвет образовавшегося хромита натрия. Нагрейте полученный раствор на водяно бане. Что при этом происходит?
- К 2-3 каплям р-ра CrCl 3 прибавьте равный объем 8М раствора NaOH и 3-4 капли 3% р-ра H 2 O 2 . Нагрейте реакционную смесь на водяной бане. Что при этом происходит? Какой осадок образуется, если полученный окрашеный раствор нейтрализовать, добавить к нему CH 3 COOH, а затем Pb(NO 3) 2 ?
- Налейте в пробирку по 4-5 капель растворов сульфата хрома Cr 2 (SO 4) 3 , IMH 2 SO 4 и KMnO 4 . Нагрейте реакционную смест в течение нескольких минут на водяной бане. Обратите внимание на изменение окраски раствора. Чем оно вызвано?
- К 3-4 каплям подкисленного азотной кислотой раствора K 2 Cr 2 O 7 прибавьте 2-3 капли раствора H 2 O 2 и перемешайте. Появляющиеся синее окрашивание раствора обусловлено возникновением надхромовой кислоты H 2 CrO 6:
Cr 2 O 7 2- + 4H 2 O 2 + 2H + = 2H 2 CrO 6 + 3H 2 O
Обратите внимание на на быстрое разложение H 2 CrO 6:
2H 2 CrO 6 + 8H+ = 2Cr 3+ + 3O 2 + 6H 2 O
синий цвет зеленый цвет
Надхромовая кислота значительно более устойчива в органических растворителях.
- К 3-4 каплям подкисленного азотной кислотой раствора K 2 Cr 2 O 7 прибавьте 5 капель изоамилового спирта, 2-3 капли раствора H 2 O 2 и взболтайте реакционную смесь. Всплывающий на верх слой органического растворителя окрашен в ярко-синий цвет. Окраска исчезает очень медленно. Сравните устойчивость H 2 CrO 6 в органической и водных фазах.
- При взаимодействии CrO 4 2- и ионами Ba 2+ выпадает желтый осадок хромата бария BaCrO 4 .
- Нитрат серебра образует с ионами CrO 4 2- осадок хромата серебра кирпично-красного цвета.
- Возьмите три пробирки. В одну из них поместите 5- 6 капель раствора K 2 Cr 2 O 7 , во вторую – такой же объем раствора K 2 CrO 4 , а в третью – по три капли обоих растворов. Затем добавте в каждую пробирку по три капли раствора иодида калия. Объясните полученный результат. Подкислите раствор во второй пробирке. Что при этом происходит? Почему?
Занимательные опыты с соединениями хрома
- Смесь CuSO 4 и K 2 Cr 2 O 7 при добавлении щелочи становится зеленой, а в присутствии кислоты становится желтой.
 Нагревая 2мг глицерина с небольшим количеством (NH 4) 2 Cr 2 O 7 с последующим добавлением спирта, после фильтрования получается ярко-зеленый раствор, который при добавлении кислоты становится желтым, а в нейтральной или щелочной среде становится зеленым.
Нагревая 2мг глицерина с небольшим количеством (NH 4) 2 Cr 2 O 7 с последующим добавлением спирта, после фильтрования получается ярко-зеленый раствор, который при добавлении кислоты становится желтым, а в нейтральной или щелочной среде становится зеленым. - Поместить в центр консервной банки с термитом «рубиновую смесь» — тщательно растертый и помещенный в алюминиевую фольгу Al 2 O 3 (4,75г) с добавкой Cr 2 O 3 (0,25г). Чтобы банка подольше не остывала, необходимо закопать под верхний обрез в песок, а после поджигания термита и начала реакции, накрыть ее железным листом и засыпать песком. Банку выкопать через сутки. В итоге образуется красно – рубиновый порошок.
- 10г бихромата калия растирают с 5г нитрата натрия или калия и 10г сахара. Смесь увлажняют и смешивают с коллодием. Если порошок спрессовать в стеклянной трубке, а затем вытолкнуть палочку и поджечь ее с торца, то начнет выползать «змея», сначала черная, а после охлаждения — зеленая. Палочка диаметром 4 мм горит со скоростью около 2мм в секунду и удлиняется в 10 раз.

- Если смешать растворы сульфата меди и дихромата калия и добавить немного раствора аммиака, то выпадет аморфный коричневый осадок состава 4СuCrO 4 * 3NH 3 * 5H 2 O, который растворяется в соляной кислоте с образованием желтого раствора, а в избытке аммиака получается зеленый раствор. Если далее к этому раствору добавить спирт, то выпадет зеленый осадок, который после фильтрации становится синим, а после высушивания – сине-фиолетовым с красными блестками, хорошо видимыми при сильном освещении.
- Оставшийся после опытов «вулкан» или «фараоновы змеи» оксид хрома можно регенерировать. Для этого надо сплавить 8г Cr 2 O 3 и 2г Na 2 CO 3 и 2,5г KNO 3 и обработать остывший сплав кипятком. Получается растворимый хромат, который можно превратить и в другие соединения Cr(II) и Cr(VI), в том числе и исходный дихромат аммония.
Примеры окислительно – восстановительных переходов с участием хрома и его соединений
1. Cr 2 O 7 2- — Cr 2 O 3 — CrO 2 — — CrO 4 2- — Cr 2 O 7 2-
a) (NH 4) 2 Cr 2 O 7 = Cr 2 O 3 + N 2 + 4H 2 Oб) Cr 2 O 3 + 2NaOH = 2NaCrO 2 + H 2 O
в) 2NaCrO 2 + 3Br 2 + 8NaOH = 6NaBr +2Na 2 CrO 4 + 4H 2 O
г) 2Na 2 CrO 4 + 2HCl = Na 2 Cr 2 O 7 + 2NaCl + H 2 O
2. Cr(OH) 2 — Cr(OH) 3 — CrCl 3 — Cr 2 O 7 2- — CrO 4 2-
Cr(OH) 2 — Cr(OH) 3 — CrCl 3 — Cr 2 O 7 2- — CrO 4 2-
а) 2Cr(OH) 2 + 1/2O 2 + H 2 O = 2Cr(OH) 3
б) Cr(OH) 3 + 3HCl = CrCl 3 + 3H 2 O
в) 2CrCl 3 + 2KMnO 4 + 3H 2 O = K 2 Cr 2 O 7 + 2Mn(OH) 2 + 6HCl
г) K 2 Cr 2 O 7 + 2KOH = 2K 2 CrO 4 + H 2 O
3. CrO — Cr(OH) 2 — Cr(OH) 3 — Cr(NO 3) 3 — Cr 2 O 3 — CrO — 2
Cr 2+
а) CrO + 2HCl = CrCl 2 + H 2 O
б) CrO + H 2 O = Cr(OH) 2
в) Cr(OH) 2 + 1/2O 2 + H 2 O = 2Cr(OH) 3
г) Cr(OH) 3 + 3HNO 3 = Cr(NO 3) 3 + 3H 2 O
д) 4Сr(NO 3) 3 = 2Cr 2 O 3 + 12NO 2 + O 2
е) Cr 2 O 3 + 2 NaOH = 2NaCrO 2 + H 2 O
Элемент хром в роли художника
Химики довольно часто обращались к проблеме создания искусственных пигментов для живописи. В XVIII-XIXвв была разработана технология получения многих живописных материалов. Луи Никола Воклен в 1797г., обнаруживший в сибирской красной руде ранее неизвестный элемент хром, приготовил новую, замечательно устойчивую краску – хромовую зелень. Хромофором ее является водный оксид хрома (III). Под названием « изумрудная зеленая» ее начали выпускать в 1837 году. Позже Л.Вокелен предложил несколько новых красок: баритовую, цинковую и хромовые желтые. Со временем они были вытеснены более стойкими желтыми, оранжевыми пигментами на основе кадмия.
Хромофором ее является водный оксид хрома (III). Под названием « изумрудная зеленая» ее начали выпускать в 1837 году. Позже Л.Вокелен предложил несколько новых красок: баритовую, цинковую и хромовые желтые. Со временем они были вытеснены более стойкими желтыми, оранжевыми пигментами на основе кадмия.
Зеленая хромовая – самая прочная и светостойкая краска, не поддающаяся воздействию атмосферных газов. Растертая на масле хромовая зелень обладает большой кроющей силой и способна к быстрому высыханию, поэтому с XIX в. ее широко применяют в живописи. Огромное значение она имеет в росписи фарфора. Дело в том, что фарфоровые изделия могут декорироваться как подглазурной, так и надглазурной росписью. В первом случае краски наносят на поверхность лишь слегка обожженного изделия, которое затем покрывают слоем глазури. Далее следует основной, высокотемпературный обжиг: для спекания фарфоровой массы и оплавления глазури изделия нагревают до 1350 – 1450 0 С. Столь высокую температуру без химических изменений выдерживают очень немногие краски, а в старину таких вообще было только две – кобальтовая и хромовая. Черный оксид кобальта, нанесенный на поверхность фарфорового изделия, при обжиге сплавляется с глазурью, химически взаимодействуя с ней. В результате образуются ярко-синие силикаты кобальта. Такую декарированную кобальтом синюю фарфоровую посуду все хорошо знают. Оксид хрома (III) не взаимодействует химически с компонентами глазури и просто залегает между фарфоровыми черепками и прозрачной глазурью «глухим» слоем.
Черный оксид кобальта, нанесенный на поверхность фарфорового изделия, при обжиге сплавляется с глазурью, химически взаимодействуя с ней. В результате образуются ярко-синие силикаты кобальта. Такую декарированную кобальтом синюю фарфоровую посуду все хорошо знают. Оксид хрома (III) не взаимодействует химически с компонентами глазури и просто залегает между фарфоровыми черепками и прозрачной глазурью «глухим» слоем.
Помимо хромовой зелени художники применяют краски, полученные из волконскоита. Этот минерал из группы монтмориллонитов (глинистый минерал подкласса сложных силикатов Na(Mo,Al), Si 4 O 10 (OH) 2 был обнаружен в 1830г. русским минералогом Кеммерером и назван в честь М.Н Волконской – дочери героя битвы при Бородино генерала Н.Н. Раевского, жены декабриста С.Г.Волконского. Волконскоит представляет собой глину, содержащую до 24% оксида хрома, а так же оксиды аллюминея и железа (III). Непостоянство состава минерала, встечающегося на Урале, в Пермской и Кировской областях, обусловливает его разнообразную окраску – от цвета зимней потемневшей пихты до ярко-зеленого цвета болотной лягушки.
Пабло Пикассо обращался к геологам нашей страны с просьбой изучить запасы волконскоита, дающего краску неповторимо свежего тона. В настоящее время разработан способ получения искусственного волконскоита. Интересно отметить, что по данным современных исследований, русские иконописцы использовали краски из этого материала еще в средние века, задолго до его «официального» открытия. Известной популярностью пользовалась у художников и зелень Гинье (создана в 1837г.), хромоформ которой является гидрат окиси хрома Cr 2 O 3 * (2-3) H 2 O, где часть воды химически связана, а часть адсорбирована. Этот пигмент придает краске изумрудный оттенок.
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Структура, свойства и применение гидроксида хрома / химия | Thpanorama
гидроксид хрома является неорганическим соединением, продуктом реакции основания с солью хрома. Его химическая формула варьируется в зависимости от степени окисления хрома (+2 или +3, для этого типа соединения). Имея, таким образом, Cr (OH)2 для гидроксида хрома (II) и Cr (OH)3 для гидроксида хрома (III).
Имея, таким образом, Cr (OH)2 для гидроксида хрома (II) и Cr (OH)3 для гидроксида хрома (III).
По электронным причинам Cr2+ он более нестабилен, чем Cr3+, поэтому Cr (OH)2 это восстановитель (он теряет электрон, чтобы перейти к +3). Таким образом, хотя оба гидроксида могут быть получены в виде осадков, Cr (OH)3 -также называется гидроксид хрома — это преобладающее соединение.
В отличие от тех гидроксидов, которые получены простым растворением оксидов металлов в воде, Cr (OH)3 он не синтезируется этим путем из-за плохой растворимости оксида хрома (Cr2О3, верхнее изображение). Тем не менее, Cr (OH)3 Считается Cr2О3· XH2Или используется в качестве изумрудно-зеленого пигмента (Guinet Green).
В лаборатории часть металлического хрома, которая растворяется в кислотном растворе для образования комплекса [Cr (OH2)6]3+. Этот водный комплекс затем реагирует с основанием (NaOH или KOH) с образованием соответствующего гидроксида хрома.
Этот водный комплекс затем реагирует с основанием (NaOH или KOH) с образованием соответствующего гидроксида хрома.
Если предыдущие этапы выполняются в условиях, обеспечивающих отсутствие кислорода, в реакции возникает Cr (OH)2 (гидроксид хрома). Затем требуется отделение и обезвоживание осажденного твердого вещества. В результате «истинный» Cr (OH) «рожден»3, зеленый порошок с полимерной структурой и неопределенным.
индекс
- 1 Физико-химические свойства
- 2 Синтез гидроксида хрома в промышленной сфере
- 3 использования
- 4 Ссылки
Верхнее изображение является простейшим представлением Cr (OH)3 в газовой фазе и изолированы. Аналогично и исходя из чисто ионного характера их взаимодействия, в твердых катионах Cr можно визуализировать3+ взаимодействуя с утроенным количеством анионов ОН—.
Однако природа связи Cr-OH является более ковалентной из-за координационной химии Cr3+.
Например, комплекс [Cr (OH2)6]3+ указывает на то, что металлический центр хрома координирован с шестью молекулами воды; Поскольку они являются нейтральными, комплекс обладает положительным зарядом исходного катиона Cr.3+.
На верхнем изображении структура комплекса [Cr (OH2)6]3+. Ионы Cl— они могут поступать, например, из соляной кислоты, если она использовалась для растворения соли или оксида хрома.
При добавлении NaOH (или KOH) в реакционную среду ион OH— депротонирует молекулу этого комплекса, образуя [Cr (OH)2)5(ОН)]2+ (Сейчас есть пять молекул воды, потому что шестой потерял протон).
Соответственно, этот новый комплекс дегидратирует другой водный комплекс, создавая димеры, связанные гидроксидными мостиками:
(Н2O)5Cr-OH-Cr (OH2)5
По мере увеличения основности среды (повышения рН) комплекс [Cr (OH)2)4(ОН)2]+, и они также увеличивают шансы новых гидроксидных мостиков создавать желатиновые полимеры. На самом деле это «серо-зеленое желе» отказывается от осаждения.
На самом деле это «серо-зеленое желе» отказывается от осаждения.
Наконец, Cr (OH2)3(ОН)3 состоит из октаэдра с Cr3+ в центре, и связаны с тремя молекулами воды и тремя ОН— которые нейтрализуют его положительный заряд; это без учета полимеризации.
Когда Cr (ОН2)3(ОН)3 обезвоживает, устраняет воду, координированную с Cr3+, и поскольку этот катион координирован с шестью видами (лигандами), возникают полимерные структуры, в которых могут быть задействованы связи Cr-Cr..
Также при обезвоживании его структуру можно рассматривать как тип Cr2О3· 3Н2O; другими словами, тригидратированный оксид хрома. Однако именно физико-химические исследования твердого тела могут пролить свет на истинную структуру Cr (OH).3 в этот момент.
Физико-химические свойстваCr (OH)3 Он имеет вид сине-зеленого порошка, но при соприкосновении с водой образует гелеобразный серо-зеленый осадок.
Нерастворим в воде, но растворим в сильных кислотах и основаниях. Кроме того, при нагревании разлагается, образуя пары оксида хрома..
амфотерностьПочему гидроксид хрома растворим в кислотных и основных растворах? Причина заключается в его амфотерной природе, которая позволяет ему реагировать как с кислотами, так и с основаниями. Это свойство характерно для Cr3+.
При взаимодействии с кислотами Cr (OH)2)3(ОН)3 растворяется, потому что разрушаются гидроксильные мостики, отвечающие за желатиновое появление осадка.
С другой стороны, когда добавляется больше основания, ОН— они продолжают замещать молекулы воды, образуя отрицательный комплекс [Cr (OH)2)2(ОН)4]—. Этот комплекс делает раствор светло-зеленого цвета, который усиливается по мере протекания реакции.
Когда все Cr (ОН2)3(ОН)3 После того, как он прореагировал, получается конечный комплекс, как указано химическим уравнением:
Cr (OH2)3(ОН)3 + 3 ОН— [Cr (OH)6] 3- + 3 ч2О
Этот отрицательный комплекс связан с окружающими катионами (Na+, если основание представляет собой NaOH), и после испарения воды осаждается соль хромита натрия (NaCrO2, изумрудно-зеленый цвет). Таким образом, как кислотная, так и основная среда способны растворять гидроксид хрома..
Таким образом, как кислотная, так и основная среда способны растворять гидроксид хрома..
В промышленности его получают осаждением сульфата хрома растворами гидроксида натрия или гидроксида аммония. Аналогичным образом, гидроксид хрома получают схематической реакцией:
CrO72- + 3 SO2 + 2H+ => 2 Cr3+ + 3 SO42- + H2О
Cr3+ + 3OH— => Cr (OH)3
Как показано в предыдущей процедуре, восстановление хрома VI до хрома III имеет большое экологическое значение.
Хром III относительно безвреден для биоты, в то время как хром VI токсичен и канцероген, а также очень растворим, поэтому важно вывести его из окружающей среды..
Технология очистки сточных вод и почвы включает восстановление Cr (VI) до Cr (III).
приложений— Формулировка макияжа.
— Средства для окрашивания волос.
— Краски для ногтей.
— Средства по уходу за кожей.
— Чистящие средства.
— На чистовую обработку металлов, которая составляет 73% его потребления в промышленности.
— В сохранности древесины.
ссылки- Уиттен, Дэвис, Пек и Стэнли. Химия. (8-е изд.). CENGAGE Learning, стр. 873, 874.
- PubChem. (2018). Гидроксид хрома. Получено 18 апреля 2018 г. из: pubchem.ncbi.nlm.nih.gov
- N4TR! UMbr. (22 июня 2015 г.) Гидроксид хрома (III). [Рисунок]. Получено 18 апреля 2018 г. с сайта commons.wikimedia.org.
- Мартинес Троя, Д., Мартин-Перес, J.J. Изучение для экспериментального использования оксидов и гидроксидов хрома в среднем учении. BORAX № 2 (1) — обзор практической химии для вторичного и бакалавриат-IES. Zaframagón-ISSN 2529-9581.
- Синтез, характеристика и стабильность гидроксидов Cr (III) и Fe (III). (2014) Papassiopi, N., Vaxevanidou, K., Christou, C., Karagianni, E. и Antipas, G.
 J. Hazard Mater. 264: 490-497.
J. Hazard Mater. 264: 490-497. - PrebChem. (9 февраля 2016 г.) Получение гидроксида хрома (III). Получено 18 апреля 2018 г. с сайта prepchem.com.
- Wikipedia. (2018). Гидроксид хрома (III). Получено 18 апреля 2018 г. с сайта en.wikipedia.org
Свойства хрома. Задача 1084
Задача 1084.
Охарактеризовать свойства хрома, указав: а) его положение в периодической системе и строение атома; б) отношение металлического хрома к воздуху, воде и кислотам; в) состав и характер оксидов и гидроксидов хрома.
Решение:
Строение и свойства металлического хрома
а) Хром (элемент №24) — металл находящейся в шестой группе побочной подгруппы, период 4, ряд 4. Электронное строение атома хрома можно представить формулой +24Cr [Ar] 3d54s1. Для хрома наблюдается проскок (или провал) электрона на d-уровень (второй s-электрон покидает 4s-подуровень и проскакивает на 3d-подуровень):
Cr – 3d54s1. Это объясняется близостью энергий ns— и (n – 1)d-уровней и стабильностью наполовину и полностью заполненных уровней. У хрома d-уровень заполнен наполовину, что и объясняет стабильность атома +24Cr [Ar] 3d54s1 по сравнению с атомом +24Cr [Ar] 3d44s2. Массовая доля хрома в земной коре – 0,02%. Для его соединений характерны степени окисления +2, +3, +6, а степени окисления +1,+4,+5 могут проявляются теоретически. Этот металл имеет амфотерные свойства за счёт незавершённой электронной оболочки. Поэтому он реагирует с щелочами и с кислотами.
Это объясняется близостью энергий ns— и (n – 1)d-уровней и стабильностью наполовину и полностью заполненных уровней. У хрома d-уровень заполнен наполовину, что и объясняет стабильность атома +24Cr [Ar] 3d54s1 по сравнению с атомом +24Cr [Ar] 3d44s2. Массовая доля хрома в земной коре – 0,02%. Для его соединений характерны степени окисления +2, +3, +6, а степени окисления +1,+4,+5 могут проявляются теоретически. Этот металл имеет амфотерные свойства за счёт незавершённой электронной оболочки. Поэтому он реагирует с щелочами и с кислотами.
б) Хром устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами:
4Cr + 3O2 Na2Cr2O7 + 2Cr2O3
Химически хром довольно инертен вследствие образования на его поверхности прочной тонкой пленки оксида. Он не окисляется на воздухе даже в присутствии влаги, а при нагревании окисление проходит только на поверхности. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами:
Он не окисляется на воздухе даже в присутствии влаги, а при нагревании окисление проходит только на поверхности. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами:
4Cr + 3O2 Na2Cr2O7 + 2Cr2O3
Хром пассивируется разбавленной и концентрированной азотной кислотой, царской водкой, и даже при кипячении металла с этими реагентами растворяется лишь незначительно. Пассивированный азотной кислотой хром, в отличие от металла без защитного слоя, не растворяется в разбавленных серной и соляной кислотах даже при длительном кипячении в растворах этих кислот, тем не менее, в определенный момент начинается быстрое растворение, сопровождающееся вспениванием от выделяющегося водорода – из пассивной формы хром переходит в активированную, не защищенную пленкой оксида:
Cr + 2HCl = CrCl2 + H2↑
Если в процессе растворения добавить азотной кислоты, то реакция сразу прекращается – хром снова пассивируется.
Амфотерные оксиды хрома
в) Оксид хрома II (CrО) – основный оксид – черный порошок. Сильный восстановитель. CrО растворяется в разбавленной соляной кислоте:
CrО + 2НСl = CrСl2 + Н2О.
Гидроксид хрома(II) — неорганическое соединение, гидроокись металла хрома с формулой Сr(OH)2, коричневое (гидрат — жёлтое) аморфное вещество, не растворимое в воде образует кристаллогидрат. Гидроксид хрома (II) имеет основной характер.
Cr(OH)2 + 2HCl → CrCl2 + 2H2O
Оксид хрома(III) Cr2O3, представляет собой зеленые микрокристаллы с плотностью 5220 кг/м3 и высокой температурой плавления (2437° С). Оксид хрома(III) проявляет амфотерные свойства, но весьма инертен и его трудно растворить в водных кислотах и щелочах. При сплавлении с гидроксидами или карбонатами щелочных металлов переходит в соответствующие хроматы:
Cr2O3 + 4KOH + KClO3 = 2K2CrO4 + KCl + 2H2O.
Cr2O3 — амфотерное соединение.
Гидроксид хрома (III) Cr(OH)3 — нерастворимое в воде вещество зелёного цвета.
Cr2(SO4)3 + 6NaOH → 2Cr(OH)3↓+ 3Na2SO4
Гидроксид хрома (III) обладает амфотерными свойствами — растворяется как в кислотах, так и в щелочах:
2Cr(OH)3 + 3H2SO4 → Cr2(SO4)3 + 6H2O
Cr(OH)3 + KOH → K[Cr(OH)4]
Хромовый ангидрид и хромовые кислоты
Оксид хрома(VI) (хромовый ангидрид) CrO3, расплывающиеся на воздухе красные кристаллы, легко растворимые в воде (до 68,2%). Тпл. =197° С (с частичным разложением). Хромовый ангидрид – сильный окислитель.
При растворении в воде, в зависимости от концентрации, образует гидроксиды хрома(VI) — хромовые кислоты различного состава:
CrO3 + H2O = H2CrO4 (желтый р-р) – хромовая кислота;
2CrO3 + H2O = H2Cr2O7 (оранжевый р-р) — двухромовая кислота;
3CrO3 + H2O = H2Cr3O10 (красный р-р) = трихромовая кислота.
Хромовая кислота — электролит средней силы. Изополихромовые кислоты — сильные окислители.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie.
 Попробуйте другой браузер, если вы подозреваете это.
Попробуйте другой браузер, если вы подозреваете это. - Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Программа нагрева для сжигания Cr(OH) 3 до пепла
Хром (Cr) является важным металлом, используемым в различных отраслях промышленности, которые вносят значительный вклад в загрязнение воздуха, почвы и воды. В природных условиях хром может существовать в основном в двух наиболее стабильных степенях окисления: (+III) и (+VI). Среди них Cr(VI) является наиболее опасным из-за его высокой подвижности в окружающей среде и выраженного вредного воздействия на все живое. Поэтому его следует удалять из всех загрязненных вод.В течение последних 25 лет наблюдается большой интерес к использованию металлического железа (Fe0) для борьбы с загрязнением Cr(VI). Первый механизм, известный как механизм восстановительного осаждения, был предложен в начале девяностых годов и объяснял эффективность Fe0 при удалении Cr(VI) в основном за счет прямого переноса электронов с поверхности Fe0 на Cr(VI) с последующим путем осаждения полученных катионов в виде простых гидроксидов и/или смешанных Fe(III)-Cr(III)(окси)гидроксидов. Недавно к этому раннему механизму добавились новые перспективы.Новая концепция, известная как механизм адсорбции-соосаждения, предполагает, что прямое восстановление FeO, если оно применимо, менее важно, чем ранее предполагалось в рамках механизма восстановительного-осаждения; соответственно, загрязняющие вещества количественно удаляются в системах FeO/h3O главным образом за счет адсорбции, соосаждения и гель-фильтрации, в то время как восстановление, когда это возможно, происходит в основном за счет непрямых восстановителей.
в результате коррозии Fe0. Несмотря на значительную исследовательскую работу, доказавшую способность металлического железа как реакционноспособного материала удалять Cr(VI), в настоящее время нет единого мнения относительно механизма этого процесса.
Первый механизм, известный как механизм восстановительного осаждения, был предложен в начале девяностых годов и объяснял эффективность Fe0 при удалении Cr(VI) в основном за счет прямого переноса электронов с поверхности Fe0 на Cr(VI) с последующим путем осаждения полученных катионов в виде простых гидроксидов и/или смешанных Fe(III)-Cr(III)(окси)гидроксидов. Недавно к этому раннему механизму добавились новые перспективы.Новая концепция, известная как механизм адсорбции-соосаждения, предполагает, что прямое восстановление FeO, если оно применимо, менее важно, чем ранее предполагалось в рамках механизма восстановительного-осаждения; соответственно, загрязняющие вещества количественно удаляются в системах FeO/h3O главным образом за счет адсорбции, соосаждения и гель-фильтрации, в то время как восстановление, когда это возможно, происходит в основном за счет непрямых восстановителей.
в результате коррозии Fe0. Несмотря на значительную исследовательскую работу, доказавшую способность металлического железа как реакционноспособного материала удалять Cr(VI), в настоящее время нет единого мнения относительно механизма этого процесса. Таким образом, после обзора наличия, химии и токсичности хрома в этой работе будет сделан критический обзор существующих знаний по этому вопросу, ясно демонстрирующий, что механизм удаления Cr(VI) с помощью FeO более сложен, чем простое восстановительное осаждение.
Таким образом, после обзора наличия, химии и токсичности хрома в этой работе будет сделан критический обзор существующих знаний по этому вопросу, ясно демонстрирующий, что механизм удаления Cr(VI) с помощью FeO более сложен, чем простое восстановительное осаждение.
Хром
ХромХром, Cr 3+
Наиболее распространенная степень окисления: +3; +2 и +6 также существуют.
М.П. 1857 или
Б.стр. 2672 или
Плотность 8,94 г/см 3
Характеристики: Серебристый, довольно хрупкий металл. Похож на алюминий, но имеет несколько степеней окисления.
Характерные реакции Cr 3+ :
(Степень окисления +3 является наиболее стабильной.)
Водный аммиак:
Аммиак реагирует с ионом хрома (III) с образованием серо-зеленого осадка гидроксида хрома (III):
Cr 3+ (водн.) + 3NH 3 (водн. ) + 3H 2 O(ж) <==> Cr(OH) 3 (тв) + 3NH 4 + (водн. )
) + 3H 2 O(ж) <==> Cr(OH) 3 (тв) + 3NH 4 + (водн. )
Cr(OH) 3 лишь незначительно растворяется в избытке аммиака.Кипячение раствора вызывает повторное осаждение гидроксида хрома (III).
Гидроксид натрия:
Сильные основания, такие как NaOH, также осаждают Cr(OH) 3 , но осадок растворяется в избытке гидроксида.
Cr 3+ (водн.) + 3OH — (водн.) <==> Cr(OH) 3 (тв.)
Cr(OH) 3 (т) + OH — (водн.) <==> Cr(OH) 4 — (водн.) (зеленый)
Перекись водорода:
В щелочном растворе перекись водорода окисляет Cr(III) до Cr(VI):
2Cr(OH) 4 — (водн.) + 3H 2 O 2 (водн.) + 2OH — (водн. ) —> 2CrO 4 2-H9041 2 О(л)
) —> 2CrO 4 2-H9041 2 О(л)
Чтобы подтвердить окисление, добавление растворов Ba 2+ осаждает желтый ион хромата, CrO 4 2-, в виде желтого хромата бария.
Нет реакции:
Класс — , SO 4 2-
Перейти к меню катионов
Каков заряд хрома в соединении CR OH 3? – Реабилитацияроботикс.нет
Каков заряд хрома в соединении CR OH 3?
Нас спрашивают о степени окисления Cr(OH)3. известно, что при реакции заряды каждого ионного элемента меняются местами и отражаются на нижних индексах.Следовательно, степень окисления Cr(OH)3 равна нулю, поскольку Cr равен +3, а степень окисления OH равна -1*3 или -3 в сумме.
Как называется соединение CR OH 3?
Гидроксид хрома
Какова формула гидроксида хрома 3?
Кр(ОН)3
Какова степень окисления CR 3?
+3
Какой заряд у CR?
«Таблица зарядов элементов».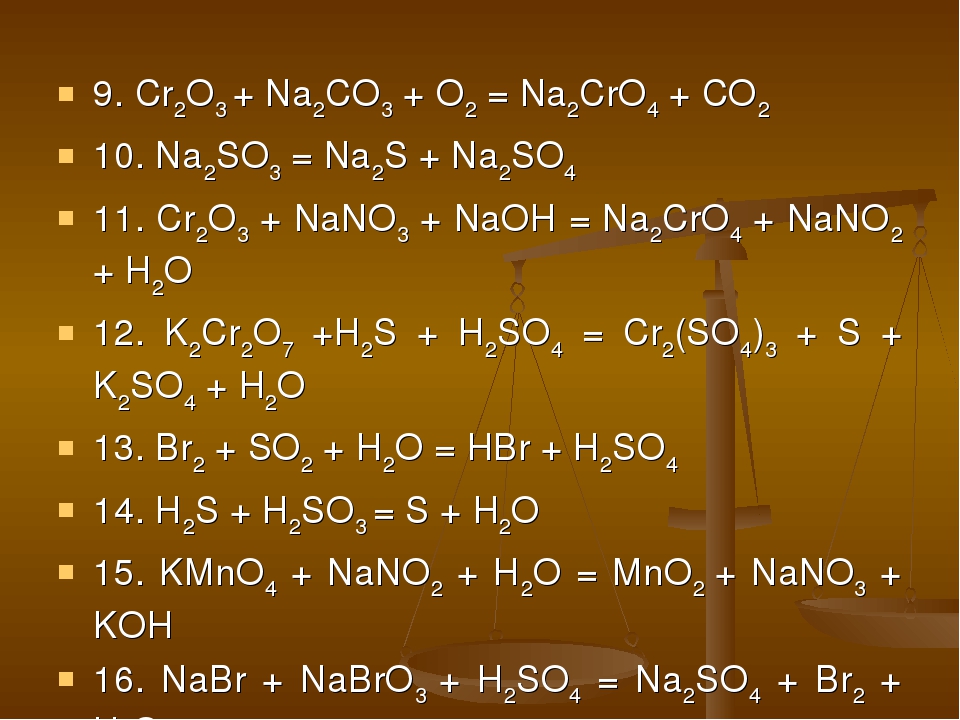 ThoughtCo, 26 августа 2020 г., thinkco.com/element-charges-chart-603986….Table of Common Element Charges.
ThoughtCo, 26 августа 2020 г., thinkco.com/element-charges-chart-603986….Table of Common Element Charges.
| Номер | Элемент | Плата |
|---|---|---|
| 24 | хром | 2+, 3+, 6+ |
| 25 | марганец | 2+, 4+, 7+ |
| 26 | железо | 2+, 3+ |
| 27 | кобальт | 2+, 3+ |
Что такое окисление Cr?
Наиболее распространенными степенями окисления хрома являются +6, +3 и +2.Однако известно несколько стабильных соединений в состояниях +5, +4 и +1. В степени окисления +6 наиболее важными частицами, образуемыми хромом, являются ионы хромата CrO42- и дихромата Cr2O72-.
Какова наиболее стабильная степень окисления Cr?
Как найти степень окисления Cr?
Итак, два атома хрома имеют степень окисления +12. Таким образом, один атом хрома будет иметь степень окисления +12/2=+6.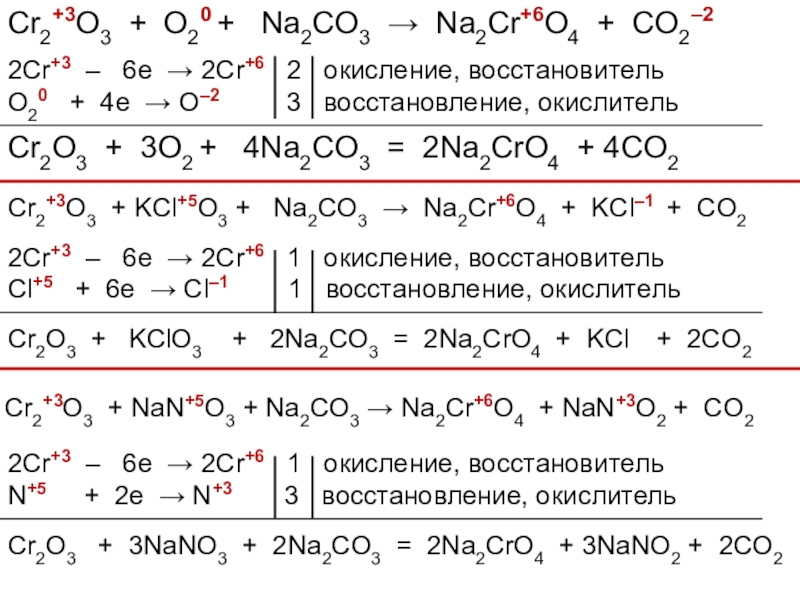 Таким образом, степень окисления Cr в K2Cr2O7 равна +6.
Таким образом, степень окисления Cr в K2Cr2O7 равна +6.
Какова степень окисления Cr в cr2o7?
Есть семь атомов кислорода, поэтому общий заряд равен −2⋅7=−14.Итак, два атома хрома имеют общую степень окисления +12. Поскольку один из них не более электроотрицательный, чем другой, мы можем разделить число на два, чтобы получить одну степень окисления хрома. Так, атом хрома здесь имеет степень окисления +6.
Какая степень окисления S в Na2S2O3?
Полный ответ: Значит, степень окисления акцепторного атома серы равна −2. И мы должны найти степень окисления другого атома серы. Поэтому степени окисления атомов серы в Na2S2O3 равны -2 и +6.
Какой заряд CR в cr2o7?
Сумма степеней окисления Cr2O72-, многоатомного иона, равна -2, заряду иона. Атомов кислорода семь, поэтому общий заряд равен − 2⋅7 = − 14… Спасибо.
| Похожие вопросы и ответы | |
|---|---|
| Какой из следующих терминов не связан с объективом | Определение термина ткань |
Какова степень окисления марганца в I MnO4 2 II MnO4?
Степень окисления Mn в MnO2, MnO4^2 – ,MnO4^- составляет 4, + 6 и + 7 соответственно.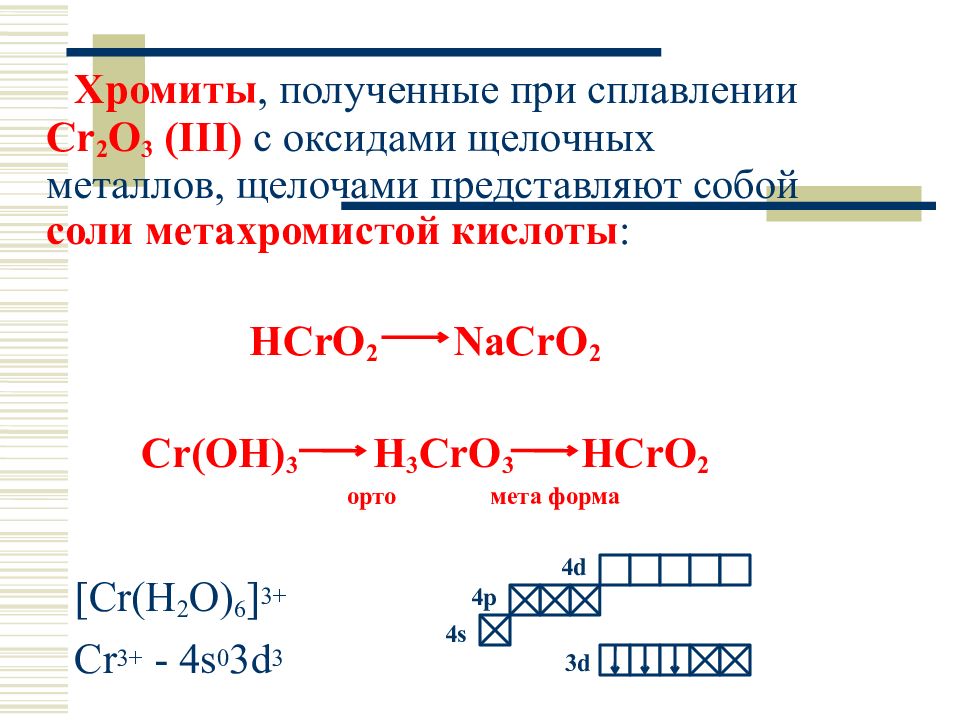
Что такое степень окисления Cu?
+2
Каков заряд Nh5Cl?
0
Как образуется Nh5Cl?
Например, Nh5Cl образуется в результате реакции слабого основания Nh4 и сильной кислоты HCl. Ион хлора не будет гидролизоваться. Однако ион аммония является сопряженной кислотой Nh4 и будет реагировать с водой с образованием ионов гидроксония.
Возгоняется ли Nh5Cl?
Хлорид аммония возгоняется при нагревании, но фактически разлагается на аммиак и газообразный хлористый водород.
Является ли Nh5Cl сильной кислотой?
Хлорид аммония (химическая формула Nh5Cl) является кислой солью, так как это соль сильной кислоты, а именно соляной кислоты, и слабого основания, а именно гидроксида аммония.
Является ли Nh5Cl слабой кислотой?
Как упоминалось в другом ответе, Nh5Cl является «кислой» солью, образованной при нейтрализации сильной кислоты (HCl) слабым основанием (Nh4).
Что уксусная кислота делает с вашим телом?
Вдыхание паров с высоким содержанием уксусной кислоты может вызвать раздражение глаз, носа и горла, кашель, стеснение в груди, головную боль, лихорадку и спутанность сознания. В серьезных случаях может произойти повреждение дыхательных путей, учащенное сердцебиение и поражение глаз. Может произойти накопление жидкости в легких, развитие которого может занять 36 часов.
В серьезных случаях может произойти повреждение дыхательных путей, учащенное сердцебиение и поражение глаз. Может произойти накопление жидкости в легких, развитие которого может занять 36 часов.
Как называется CR OH 3? – СидмартинБио
Как называется CR OH 3?
Гидроксид хрома
Химическое вещество: Гидроксид хрома (Cr(OH)3).
Какова формула хромовых квасцов?
KCrS2O8
Хромовые квасцы/Формула
Растворяется ли гидроксид хрома III в воде?
Растворимость хрома и соединений хрома Соединения хрома (III) нерастворимы в воде, поскольку они в значительной степени связаны с плавающими в воде частицами.Оксид хрома (III) и гидроксид хрома (III) являются единственными водорастворимыми соединениями.
Как называется CR OH 4?
Как называется [Cr(OH)4]-? Сразу мы знаем, что этот комплекс является анионом. Есть только один монодентатный лиганд, гидроксид. Их четыре, поэтому мы будем использовать название «тетрагидроксо». .. Правило 4: Металлы.
.. Правило 4: Металлы.
| Переходный металл | Латинский |
|---|---|
| Серебро | Аргентате |
| Свинец | Отвес |
| Золото | Аурате |
Как называется CR OH 2?
Окись гидроксида хрома
Оксид гидроксида хрома
| PubChem CID | 88686 |
|---|---|
| Структура | Найти похожие структуры |
| Молекулярная формула | CrHO2 |
| Синонимы | Оксид гидроксида хрома Оксид гидроксида хрома (Cr(OH)O) 20770-05-2 гидрокси(оксо)хром DTXSID201014420 Подробнее… |
| Молекулярный вес | 85.003 |
Как называется Hg2O?
Оксид ртути (Hg2O)
Как зовут Куо?
Оксид меди(II)
Оксид меди(II)/IUPAC ID
Ядовиты ли хромовые квасцы?
Очень опасен при проглатывании или вдыхании. Опасен при попадании на кожу (раздражает). Вещество токсично для легких, слизистых оболочек.
Опасен при попадании на кожу (раздражает). Вещество токсично для легких, слизистых оболочек.
Для чего используются хромовые квасцы?
Квасцы хрома используются при дублении кожи, поскольку хром (III) стабилизирует кожу, сшивая волокна коллагена внутри кожи.Однако это приложение устарело, поскольку предпочтительным является более простой сульфат хрома (III). Он также использовался в желатиновых эмульсиях в фотопленке в качестве отвердителя.
Что такое хром в воде?
Хром представляет собой металлический элемент без запаха и вкуса. Хром в природе содержится в горных породах, растениях, почве и вулканической пыли, а также в животных. Наиболее распространенными формами хрома, встречающимися в природных водах в окружающей среде, являются: Трехвалентный хром (хром-3)
Для чего используется гидроксид хрома?
Гидроксид хрома (III) представляет собой желеобразное зеленое неорганическое соединение с химической формулой Cr(OH)3.Это полимер с неопределенной структурой и низкой растворимостью.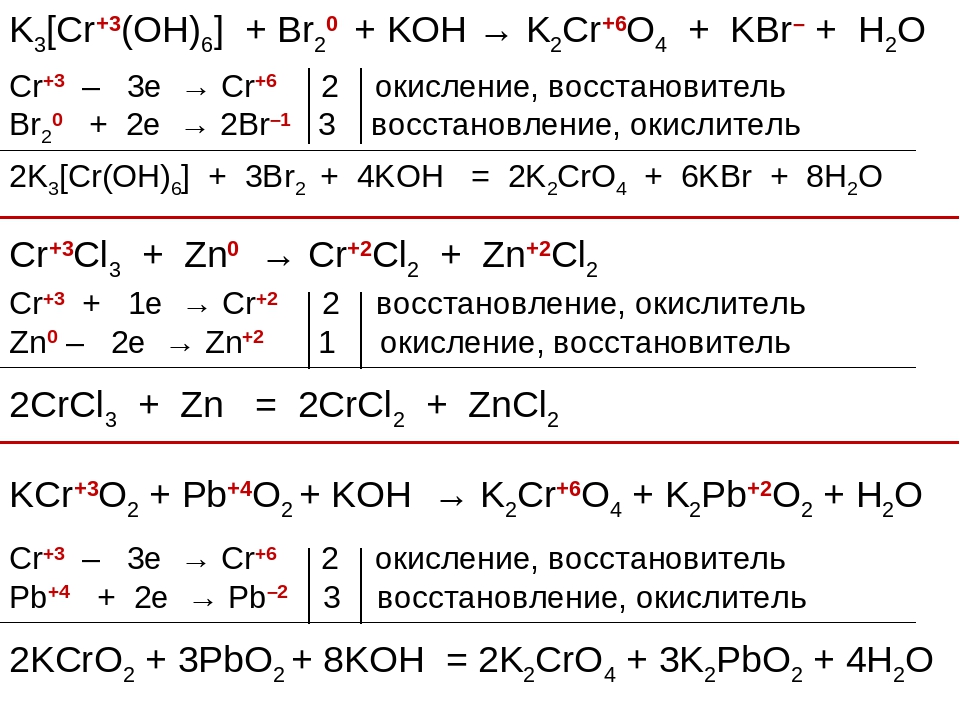 Он амфотерный, растворяется как в сильных щелочах, так и в сильных кислотах. Он используется в качестве пигмента, протравы и катализатора органических реакций.
Он амфотерный, растворяется как в сильных щелочах, так и в сильных кислотах. Он используется в качестве пигмента, протравы и катализатора органических реакций.
Как называется соединение с формулой Cr OH 3?
Гидроксид хрома (III) представляет собой желеобразное зеленое неорганическое соединение с химической формулой Cr(OH) 3. Это полимер с неопределенной структурой и низкой растворимостью. Он амфотерный, растворяется как в сильном основании, так и в сильной кислоте.
Какова молекулярная масса c2h4o2cl?
С 2 Н 3 О 2 Кл. Хлоруксусная кислота. Молекулярная масса C 2 H 3 O 2 Cl. 94,49 г/моль. Плотность хлоруксусной кислоты. 1,58 г/см 3. Температура кипения хлоруксусной кислоты. 189,3 °С. Температура плавления хлоруксусной кислоты.
Каково химическое название воды?
Используя химическую номенклатуру, в научном сообществе широко используются различные названия воды: оксид водорода; гидроксид водорода, что характеризует его как щелочь; и несколько, обозначающих его как кислоту, например, соляную кислоту, гидроксильную кислоту, гидроксильную кислоту, гидроксильную кислоту и гидроксильную кислоту.
Как называется химическое соединение с формулой CrO3?
/Хромовая кислота:/ Эта важная кислота известна также как триоксид хрома. Технический сорт можно получить у первичных производителей в безводном виде в виде мелких темно-красных хлопьев, содержащих 99% CrO3. Как и все хроматы и дихроматы, его хром находится в шестивалентном состоянии.
Регистрационное досье
— ECHA Регистрационное досье
— ECHAРегистрационное досье
Регистрационное досье
- Описание жизненного цикла
- Не рекомендуется использование
Административные данные
- Конечная точка:
- Констанция диссоциации
- Тип информации:
- Расчет (если нет (q) SAR)
- Заметки:
- Смесились:
- Миграционная фраза: оценка расчета
- исследование
- Надежность:
- 2 (надежно с ограничениями)
- Обоснование надежности в т.
 ч.недостатки:
ч.недостатки: - другое: Общепринятый метод расчета
Источник данных
Ссылка
- Тип ссылки:
- Публикация
- Название:
- Окисление и токсичность хрома в
- Автор:
- Cooper, G. R. C.
- Год:
- 2
Tính chất của Crom 3 hiđroxit Cr(OH)3
Tính chất của Crom (III) hiđroxit Cr(OH)
3 И.Эн НгхаКуанг Као
— định nghĩa: CROM (III) hiđroxit là một hidroxit có tính lưỡng tính, tạo bởi катион cr 3+ và aonion oh — , với công thức hóa học tương ứng là cr (OH) 3
— Công thức phân tử: Cr(OH) 3
II. Тинь чот вет ли и нхан бит— Tính chất vật lí: Cr(OH) 3 là chất rắn, màu lục xám, không tan trong nước.
-Nhận biết: Tác dụng với dung dịch axit HCl, tạo dung dịch có màu vàng
Cr(OH) 3 + 6HCl → 2CrCl 3 + H 2 O
III. Тинь Чот Хоа Хок
Тинь Чот Хоа Хок 1. Тинь Чот Куа Хидроксит Лунг Тинь
— Cr(OH)3 là một hiđroxit lưỡng tính, có khả năng tác dụng với cả dung dịch axit và dung dịch bazo.
Cr(OH) 3 + NaOH → NaCrO 2 + 2H 2 O
Cr(OH) 3 + 3HCl → CrCl 3 + 3H 2 O
Куанг Као
— Kém bền: Bị phân huỷ bởi nhiệt tạo oxit tương ứng:
2Cr(OH) 3 — t o → Cr 2 O 3 + 3H 2 O
2.Тинь Кхо ва Тинь Окси Хоа:
— Тинь Окси Хоа:
2CrCl 3 + Zn → 2CrCl 2 + ZnCl 2
— Тинь Кхо:
2Cr(OH) 3 + 3H 2 O 2 + 4NaOH → 2Na 2 CrO 4 + 8H 2 O
2Cr(OH) 3 + 3Cl 2 + 10 NaOH → 2Na 2 CrO 4 + 6NaCl + 8 H 2 O
2Cr(OH) 3 + 3Br 2 + 10NaOH → 2Na 2 CrO 4 + 6NaBr + 8H 2 O
2 Cr(OH) 3 + 3NaOCl + 4NaOH → 2Na 2 CrO 4 + 3NaCl + 5H 2 O
Куанг Као
IV. Điều chế
Điều chế — Cho muối Cr 3+ tác dụng với dung dịch bazo.
CrCl 3 + 3NaOH → Cr(OH) 3 + 3NaCl
Giới thiệu kênh Youtube VietJack
Это приложение VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi онлайн, Bài giang….mien phí. Tải ngay ứng dụng trên Android và iOS.
Тео Дои Чунг Той Мьен Пхи Трен Мунг Кса Хой facebook và youtube:loạt bài Wiki Tính Chất Hóa HọC Trình Bày Toàn Bộ Tính Chất Hóa Học, vật lí, nhận biết, điều chế và ứng dụng của tất cả các đơn chất, hợp chất hóa học đđ học trong chương trình hóa học cấp 2 , 3.
Nếu thấy hay, hay động viên và chia sẻ nhé! Cac binh luận khong phù hợp với nội quy binh luận trang web sẽ bị cấm binh luận vĩnh viễn.
tinh-chat-cua-crom-cr-va-hop-chat-cua-crom.

 Раствор приобретает глубокий синий цвет благодаря образованию пероксида хрома. Пероксид при взбалтывании с некоторым количеством эфира перейдет в органический растворитель и окрасит его в голубой цвет. Данная реакция специфична для хрома и очень чувствительна. С ее помощью можно обнаружить хром в металлах и сплавах. Прежде всего необходимо растворить металл. При длительном кипячении с 30% — ной серной кислотой (можно добавить и соляную кислоту) хром и многие стали частично растворяются. Полученный раствор содержит сульфат хрома (III). Чтобы можно было провести реакцию обнаружения, сначала нейтрализуем его едким натром. В осадок выпадает серо-зеленый гидроксид хрома (III), который растворится в избытке NaOH и образует зеленый хромит натрия. Профильтруем раствор и добавим 30% -ый пероксид водорода. При нагревании раствор окрасится в желтый цвет, так как хромит окислится до хромата. Подкисление приведет к появлению голубой окраски раствора. Окрашенное соединение можно экстрагировать, встряхивая с эфиром.
Раствор приобретает глубокий синий цвет благодаря образованию пероксида хрома. Пероксид при взбалтывании с некоторым количеством эфира перейдет в органический растворитель и окрасит его в голубой цвет. Данная реакция специфична для хрома и очень чувствительна. С ее помощью можно обнаружить хром в металлах и сплавах. Прежде всего необходимо растворить металл. При длительном кипячении с 30% — ной серной кислотой (можно добавить и соляную кислоту) хром и многие стали частично растворяются. Полученный раствор содержит сульфат хрома (III). Чтобы можно было провести реакцию обнаружения, сначала нейтрализуем его едким натром. В осадок выпадает серо-зеленый гидроксид хрома (III), который растворится в избытке NaOH и образует зеленый хромит натрия. Профильтруем раствор и добавим 30% -ый пероксид водорода. При нагревании раствор окрасится в желтый цвет, так как хромит окислится до хромата. Подкисление приведет к появлению голубой окраски раствора. Окрашенное соединение можно экстрагировать, встряхивая с эфиром.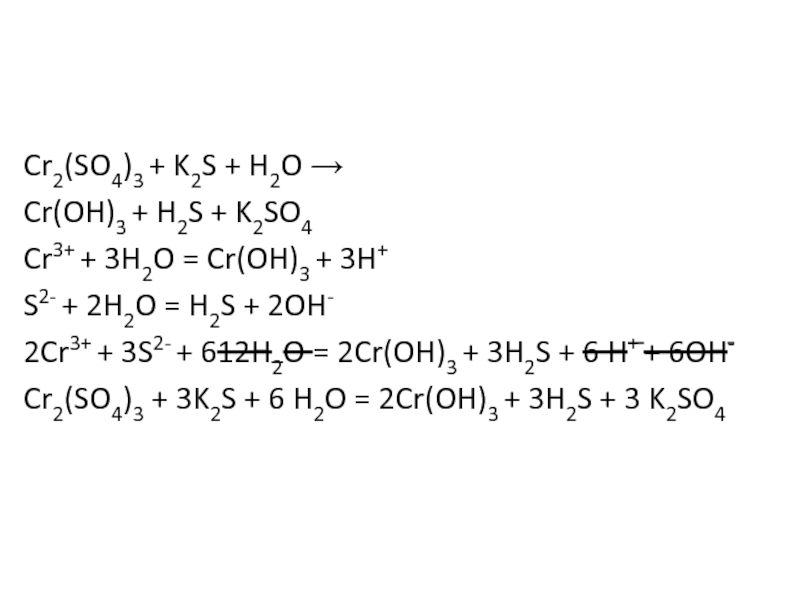
 Нагревая 2мг глицерина с небольшим количеством (NH 4) 2 Cr 2 O 7 с последующим добавлением спирта, после фильтрования получается ярко-зеленый раствор, который при добавлении кислоты становится желтым, а в нейтральной или щелочной среде становится зеленым.
Нагревая 2мг глицерина с небольшим количеством (NH 4) 2 Cr 2 O 7 с последующим добавлением спирта, после фильтрования получается ярко-зеленый раствор, который при добавлении кислоты становится желтым, а в нейтральной или щелочной среде становится зеленым.
 J. Hazard Mater. 264: 490-497.
J. Hazard Mater. 264: 490-497. Попробуйте другой браузер, если вы подозреваете это.
Попробуйте другой браузер, если вы подозреваете это. ч.недостатки:
ч.недостатки: