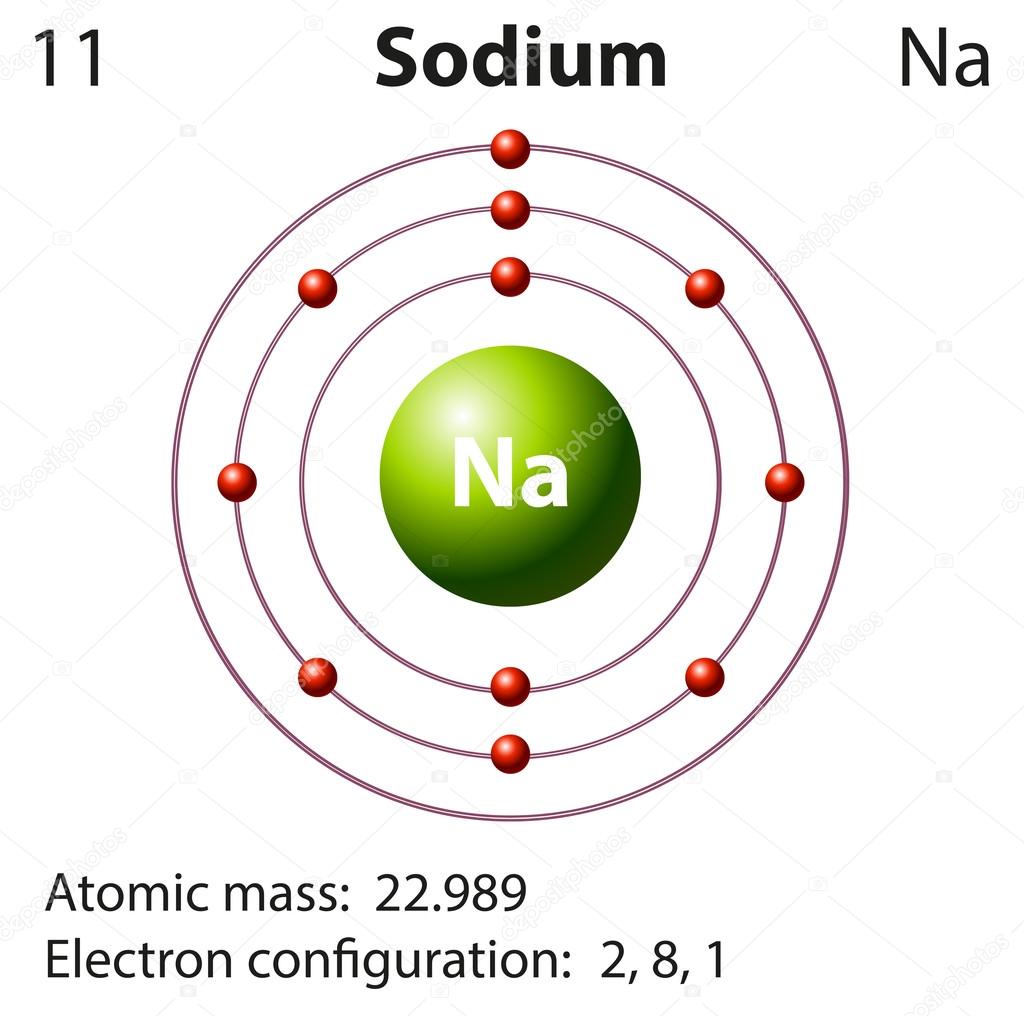
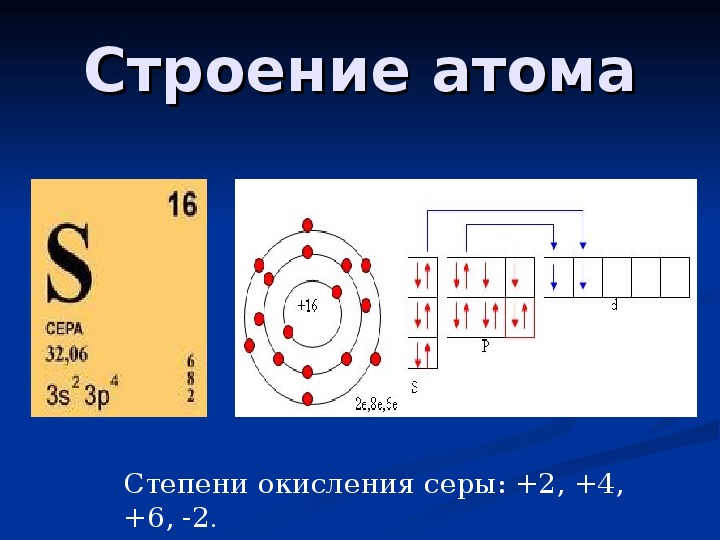
Строение атома
Дидактический материал
Тренировочные тесты ЕГЭ по химии
Строение электронных оболочек атомов элементов первых четырех периодов: s- и p- и d- элементы. Электронная конфигурация атома. Основное и возбужденное состояние атома.
Для решение задания А1 нужно знать как находить
количество протонов, электронов в атоме и ионе, знать как распределяются электроны по электронным уровням и подуровням, уметь записывать электронную конфигурацию атома и иона, находить количество неспаренных электронов в атоме и ионе, знать как связана электронная конфигурация и валентность химического элемента
1. Количество электронов в атоме равно
1) | числу протонов |
2) | числу нейтронов |
3) | числу энергетических уровней |
4) | относительной атомной массе |
2 . Ион, в составе которого 16 протонов и 18 электронов, имеет заряд
Ион, в составе которого 16 протонов и 18 электронов, имеет заряд
1) +4 2) -2 3) +2 4) -4
3. Внешний энергетический уровень атома элемента, образующего высший оксид состава ЭОз, имеет формулу
1) ns2np1 2) ns2nр2 3) nз2nр3 4) ns2nр4
4. Конфигурация внешнего электронного слоя атома серы в невозбужденном состоянии
1) 4s2 2) 3s23р6 3) 3s 23р4 4) 4s24р4
5. Электронную конфигурацию 1s22s22p63s23p64s1 в основном состоянии имеет атом
1) лития
2) натрия
3) калия
4) кальция
6. Восьмиэлектронную внешнюю оболочку имеет ион
1) Р3+ 2) S2- 3) С15+ 4) Fe2+
7. Двухэлектронную внешнюю оболочку имеет ион
Двухэлектронную внешнюю оболочку имеет ион
1) S6+ 2) S2- 3) Вг5+ 4) Sn4+
8. Число электронов в ионе железа Fe2+ равно
1) 54 2) 28 3) 58 4) 24
9. Электронная конфигурация 1s22s22p63s23p6 соответствует иону
1) Sn2+ 2) S2- 3) Cr3+ 4) Fe2+
10. В основном состоянии три неспаренных электрона имеет атом
1) кремния
2) фосфора
3) серы
4) хлора
11. Элемент с электронной конфигурацией внешнего уровня … 3s23p3 образует водородное соединение состава
1) ЭН4 2) ЭН 3) ЭН3 4) ЭН2
12.
1) Сl— 2) N3- 3) Br— 4) О2-
13. Электронная конфигурация Is22s22p6 соответствует иону
1) А13+ 2) Fe3+ 3) Zn2+ 4) Cr3+
14. Одинаковую электронную конфигурацию внешнего уровня имеют Са2+ и
1) К+ 2) Аr 3) Ва 4) F—
15. Атом металла, высший оксид которого Ме2О3, имеет электронную формулу внешнего энергетического уровня
1) ns2пр1 2) ns2пр2 3) ns
16. Элемент, которому соответствует высший оксид состава R2O7 имеет электронную конфигурацию внешнего уровня:
Элемент, которому соответствует высший оксид состава R2O7 имеет электронную конфигурацию внешнего уровня:
1) ns2np3 2)ns2np5 3) ns2np1 4) ns2np2
17. Высший оксид состава R2O7 образует химический элемент, в атоме которого заполнение электронами энергетических уровней соответствует ряду чисел:
1) 2, 8, 1 2) 2, 8, 7 3) 2, 8, 8, 1 4) 2, 5
18. У атома серы число электронов на внешнем энергетическом уровне и заряд ядра равны соответственно
1)4 и + 16 2)6 и + 32 3)6 и + 16 4)4 и + 32
19. Число валентных электронов у марганца равно
1) 1 2) 3 3) 5 4) 7
20. Одинаковое электронное строение имеют частицы
1) Na0 и Na+ 2) Na0 и K0 3) Na+ и F— 4) Cr2+ и Сr3+
21. Высший оксид состава ЭО3 образует элемент с электронной конфигурацией внешнего электронного слоя
Высший оксид состава ЭО3 образует элемент с электронной конфигурацией внешнего электронного слоя
1) ns2np1 2) ns2np3 3) ns2np4 4) ns2np6
22. Число энергетических слоев и число электронов во внешнем энергетическом слое атомов мышьяка равны соответственно
1) | 4, 6 |
2) | 2, 5 |
3) | 3, 7 |
4) | 4, 5 |
23 Иону Al3+ отвечает электронная конфигурация:
1) 1s22s22p6; 2) 1s22s22p63s1; 3) 1s22s22p63s23p1 4) Is22s22p63s23p64s1
24. Иону Zn2+ отвечает электронная конфигурация:
Иону Zn2+ отвечает электронная конфигурация:
1) 1s 22s22p63s23p63d84s2 2) 1s22s22p63s23p63d104s24p6 3 ) 1s22s22p63s23p63d10 4) Is22s22p63s23p64s1
25. Химическому элементу соответствует летучее водородное соединение состава RH3. Электронная конфигурация внешнего уровня этого элемента
1) | 3s23p1 |
2) | 3s23p2 |
3) | 3s23p |
4) | 3s23p5 |
26.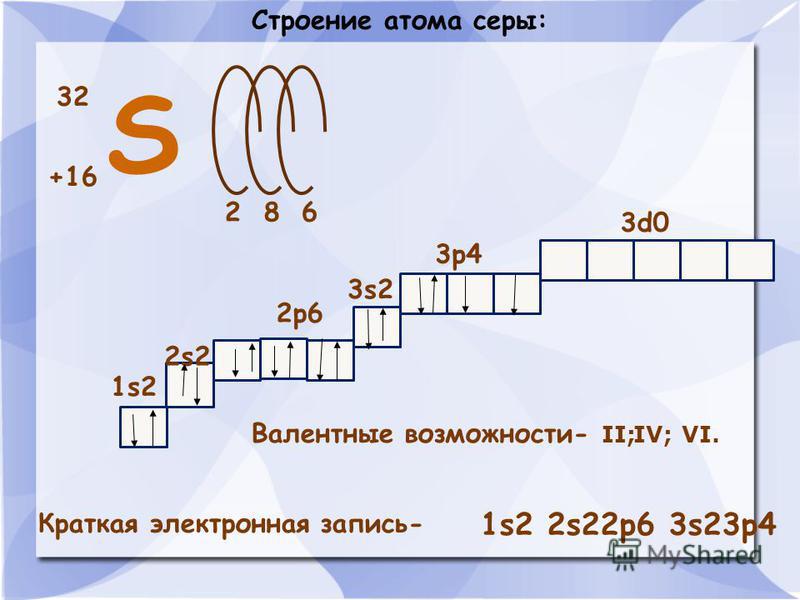 Атомы серы и кислорода имеют
Атомы серы и кислорода имеют
1) | одинаковое число электронных слоев |
2) | одинаковое число электронов внешнего электронного слоя |
3) | одинаковое число протонов в ядре |
4) | одинаковые радиусы |
27. Электронная конфигурация атома фтора
1) | 1s22s22p5 |
2) | 1s22s22p4 |
3) | 1s22s22p6 |
4) | 1s22s22p3 |
28. Сколько неспаренных электронов имеет атом углерода в состоянии sp3-гибридизации?
Сколько неспаренных электронов имеет атом углерода в состоянии sp3-гибридизации?
29. У атома хлора на третьем электронном уровне имеется одна s-орбиталь, три p-орбитали и пять d-орбиталей. Максимальная валентность хлора равна
1) | четырем |
2) | семи |
3) | восьми |
4) | девяти |
30. Элемент, электронная конфигурация атома которого 1s22s22p63s23p2 образует водородное соединение
1) СН4 2) SiH4 3) H2O 4) H2S
31.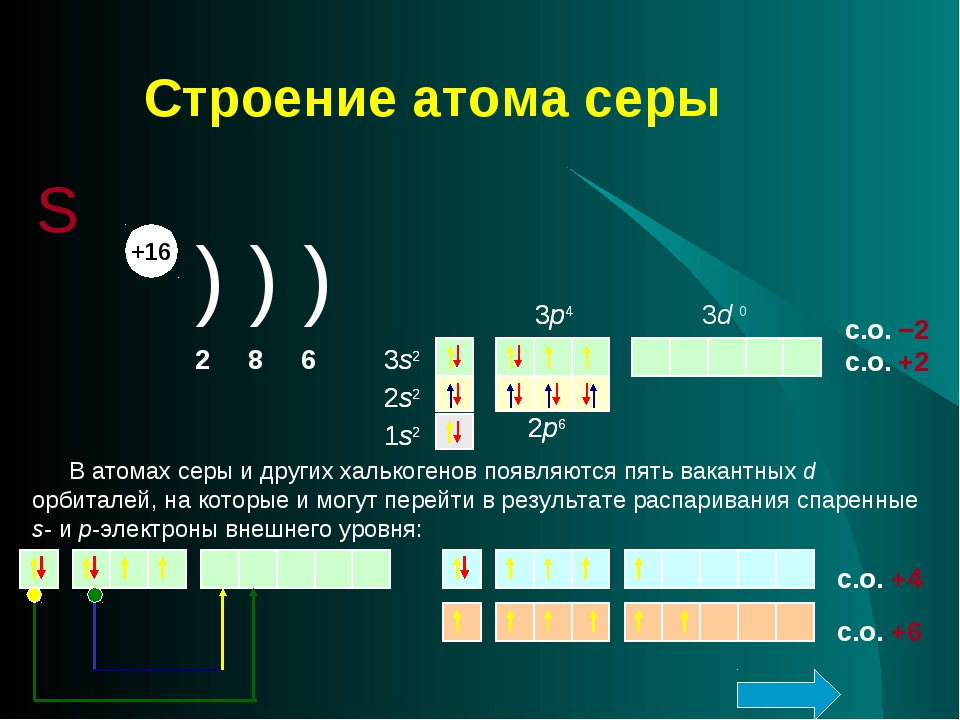 Какую электронную конфигурацию внешнего уровня имеют атомы IVA группы?
Какую электронную конфигурацию внешнего уровня имеют атомы IVA группы?
1) ns2np5 2) ns2np2 3) ns2np4 2) ns2np6
32. Одинаковое число валентных электронов имеют атомы калия и
1) углерода 2) магния 3) фосфора 4) натрия
Ответы: 1-1, 2-2,3-4,4-3,5-3,6-2,7-3,8-4,9-2, 10-2, 11-3, 12-1, 13-1, 14-1, 15-1, 16-2, 17-2, 18-3, 19-4, 20-3, 21-3, 22-4, 23-1, 24-3, 25-4, 26-2, 27-1, 28-4, 29-2, 30-2, 31-2, 32-4.
Задания группы А. Строение атома. на Сёзнайке.ру
1. Заряд ядра атома железа равен:
1)+8; 2)+56; 3)+26; 4)+16.
1. (3). Заряд ядра соответствует порядковому номеру химического элемента периодической системы, взятому со знаком «+»
2.Электронная конфигурация атома германия:
1)1s22s22p63s23p63d64s24p6;
2)1s22s22p63s23p63d64s24p2;
3)1s22s22p63s23p63d104s24p2;
4)1s22s22p63s23p63d104p4
2. (3) Германий является p-элементом, на 4p-подуровне у него 2 электрона (второй p-элемент 4 периода), у p-элементов полностью заполнены предвнешний d-подуровень, в данном случае 3d-подуровень (10 электронов)и заполнен внешний s-подуровень 4s2
(3) Германий является p-элементом, на 4p-подуровне у него 2 электрона (второй p-элемент 4 периода), у p-элементов полностью заполнены предвнешний d-подуровень, в данном случае 3d-подуровень (10 электронов)и заполнен внешний s-подуровень 4s2
3) Электронную конфигурацию, идеентичную конфигурации атома аргона, имеет ион:
1)Na+; 2)Cu2+; 3)S2-; 4)F—
3.(3). У аргона 18 электронов, они распределены по слоям:2,8,8. У атома серы 16 электронов:2,8,6. У иона S2- число электронов равно 18, за счёт присоединения 2 электронов на внешний электронный слой.
4) Общее число электронов у иона Mn2+:
1)23; 2)25; 3)27; 4) 55.
4. (1).В атоме марганца 25 электронов (число соответствует порядковому номеру химического элемента в периодической системе). Атом марганца превратился в ион Mn2+ за счёт отдачи 2 электронов.
5) Ядро атома4019 К содержит:
1) 19p и 19n;
2) 40p и 19n;
3) 19p и 40n;
4) 19p и 21n.
5. (4). Число протонов соответствует порядковому номеру-19, число нейтронов можно найти вычтя из атомной массы порядковый номер 40-19=21
6) Наименьший радиус имеет атом:
1) S; 2)Al; 3)Cl; 4)Ar.
6. (4). Все элементы находятся в одном периоде, а атомные радиусы уменьшаются слева направо. Правее всех в периодической системе находится Ar.
7) Наименьший радиус имеет ион:
1)Mg2+;2)S2-; 3)Al3+; 4)Cl—.
7. (3). Все ионы образованы элементами одного периода. Наименьший радиус будет иметь ион Al3+(он принимает конфигурацию инертного газа неона, также как и Mg2+) за счёт более сильного электростатического взаимодействия ядра с электронами( избыточный положительный заряд +3)
8)Наибольший радиус имеет атом:
1)Ba; 2)Mg; 3)Ca; 4)Sr.
8.(1). Все элементы находятся в одной группе, следовательно, число электронных слоёв разное. Чем их больше, тем больше радиус атома. У бария-6. (Число слоёв соответствует номеру периода в котором расположен элемент).
У бария-6. (Число слоёв соответствует номеру периода в котором расположен элемент).
9.Электронную конфигурацию внешнего электронного слоя 3s23p6 имеют соответственно атом и ионы:
1)Ar0, Cl—, S2-;
2)Kr0, K+, Ca2+;
3)Ne0, Cl—, Ca2+;
4)Ar0, Cl-, Ba2+.
9.(1). У всех заполнен внешний слой до 8 электронов (s и p-подуровни).
10.Число d-электронов у атома серы в максимально возбуждённом состоянии равно:
1)1; 2)2; 3)4; 4)6.
10.(2).Электронная конфигурация третьего слоя серы в невозбуждённом состоянии имеет вид:
В возбуждённом состоянии один из спаренных электронов с 3s и 3p- подуровня переходит переходит на 3d-подуровень:
11. Распределение электронов в нормальном состоянии в атоме серы по энергетическим уровням соответствует ряду цифр:
1)2,8,6;
2)2,8,8;
3)6,8,8;
4)2,8,2,4.
11. (1).
12. Наибольшую электроотрицательность имеет атом:
1) кислорода; 2) серы; 3)селена;4)теллура.
12. (1). Все элементы находятся в одной группе периодической системы. Электроотрицательность сверху вниз уменьшается, т.е. чем выше химический элемент в группе. тем выше электроотрицательность.
13. Элементы расположены в порядке убывания восстановительных свойств:
1)Li, Na, K, Rb;
2)Rb, K, Na, Li;
3)Rb, K, Li, Na;
4)Mg, K, Na, Li;
13. (2). Все элементы расположены в одной группе, а восстановительные свойства сверху вниз по периодической системе возрастают
14.Атому фосфора в возбуждённом состоянии соответствует электронная конфигурация внешнего электронного уровня:
1)3s23p3; 2)3s13p33d1;3)3s13p23d2; 4)3s13p13d3
14.(2).
15.Чему равно число электронов в атоме кислорода:
1)2; 2)6; 3)8; 4)10.
15.(3).Число электронов в атоме соответствует порядковому номеру химического элемента в периодической системы, порядковый номер кислорода-8.
16. Валентные возможности атома хлора в нормальном и возбуждённом состоянии:
1)1, 2, 3, 4; 2)1,2,5,7; 3)1,3,5,7; 4)3,4,5,7.
16.(3).
1)1, 2, 3, 4; 2)1,2,5,7; 3)1,3,5,7; 4)3,4,5,7.
17. Какова наивысшая валентность атома серы:
1)2; 2)3; 3)4; 4)6.
17. (4).Сера находится в VI группе, следовательно, высшая валентность равна 6.
18.Распределение электронов по энергетическим уровням в ионе Fe3+соответствует ряду чисел:
1)2,8,12,2;
2)2,8,13,0;
3)2,8,11,2;
4)2,8,10,3.
18.(2). В атоме железа распределение электронов следующее: 2,8,14,2. В ионе железа Fe3+ в отличии от атома электронов на 3 меньше. Атом железа их отдал с четвёртого слоя 2, и с третьего-1.
1)2,8,12,2;
2)2,8,13,0;
3)2,8,11,2;
4)2,8,10,3.
19. Электронная конфигурация 1s22s22p63s23p6 соответствует частице:
Электронная конфигурация 1s22s22p63s23p6 соответствует частице:
1) Li+; 2)K+; 3)Cs+; 4)Na+.
19. (2). В данной конфигурации 1s22s22p63s23p6 18 электронов, а так как все ионы имеют заряд+1, следовательно, в атоме должно быть 19 электронов. Этим атомом является калий.
1) Li+; 2)K+; 3)Cs+; 4)Na+.
20.Число энергетических уровней и число внешних электронов атома фосфора равны соответственно:
1)3,5;
2)5,3;
3)3,3;
4)3,4.
20. (1).Фосфор находится в третьем периоде, следовательно, число слоёв равно 3, и в главной подгруппе пятой группы , значит, число внешних электронов равно 5.
1)3,5;
2)5,3;
3)3,3;
4)3,4.
21.Число электронов на внешнем электронном уровне в атоме алюминия:
1)1; 2)2; 3)3; 4)4.
21. (3).
(3).
22.Два электронных слоя имеются у элементов:
1)Li,Na,K;
2)Na,Mg,Al;
3)Na,Mg,B;
4)B;C;N.
22.(4).Два электронных слоя будет у элементов, находящихся во втором периоде, это B;C;N.
23.d-элементами являются:
1) алюминий, бор, фосфор;
2)кремний, фосфор, сера;
3)титан, ванадий, хром;
4)магний, скандий, германий.
23.(3).
Электронные конфигурации атомов | Задачи 183
Задача 183.
Среди приведенных ниже электронных конфигураций указать невозможные и объяснить причину невозможности их реализации: а) 1р3 б) 3p6 в) 3s2; г) 2s2; д) 2d5; е) 5d2; ж) 3f12; з) 2р4 и) 3p7.
Решение:
а) Электронная конфигурация 1p3 не реализуется, потому что первый энергетический уровень (n = 1 ) содержит только s-подуровень. Максимальное число электронов на каждом энергетическом уровне равно 2n2, где n — главное квантовое число. Так на первом энергетическом уровне (n = 1) может находиться максимальное число электронов 2(2 .12 = 2). Следовательно, не только неправильно указан подуровень, но общее число электронов.
Так на первом энергетическом уровне (n = 1) может находиться максимальное число электронов 2(2 .12 = 2). Следовательно, не только неправильно указан подуровень, но общее число электронов.
б) 3p6 – электронная конфигурация возможна, потому что на третьем энергетическом уровне содержатся s-, p- и d-подуровни. На p-подуровне содержится три атомные орбитали, а в каждой орбитали, согласно правилу Хунда, может находиться максимальное число электронов равное двум. Поэтому на 3p-подуровне может максимально находиться шесть электронов (3 . 2 = 6).
в) Электронная конфигурация 3s2 верна, потому что на третьем энергетическом уровне (n = 3) находятся s-, p- и d-подуровни. Согласно правилу Хунда, на s-подуровне, состоящем из одной атомной орбитали, может находиться максимальное число электронов равное двум.
г) Электронная конфигурация 2s2 реализуется, потому что на втором энергетическом уровне (n = 2) содержатся s- и p-подуровни, и на s-подуровне, в его единственной атомной орбитали, может содержаться максимальное число электронов равное двум.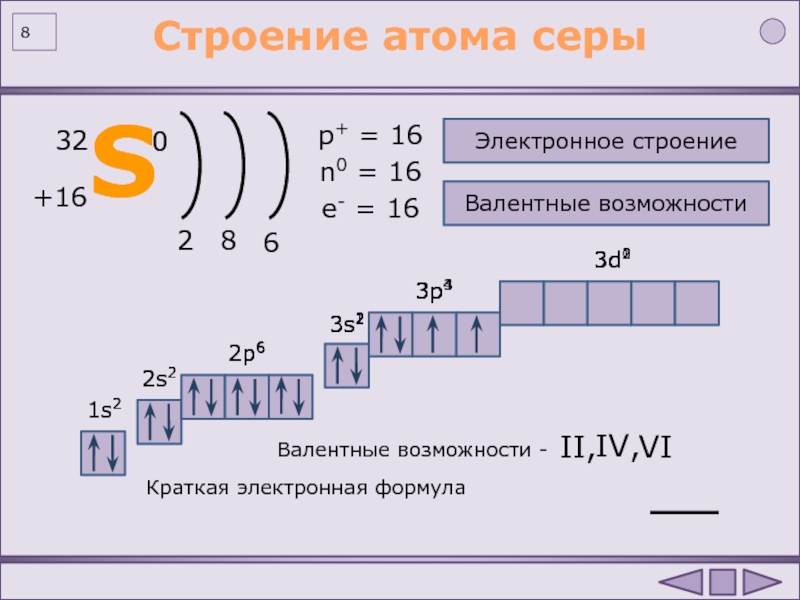
д) Электронная конфигурация 2d5 не реализуется, потому что во втором энергетическом уровне (n = 2) d-подуровень не содержится, в этом слое расположены только s- и p-подуровни.
е) Электронная конфигурация 5d2 реализуется, потому что на пятом энергетическом уровне (n = 5) содержатся s-, p- d- и f-подуровни. Подуровень d содержит пять атомных орбиталей, в которых может находиться максимальное число электронов равное десяти (5 . 2 = 10). Запись 5d2 означает, что на 5d-подуровне содержится два неспаренных электрона.
ж) Электронная конфигурация 3f12 не реализуется, потому что на третьем энергетическом уровне (n = 3) могут находиться только s-, p- и d-подуровни.
з) Электронная конфигурация 2p4 реализуется, потому что на втором энергетическом уровне (n = 2) могут находиться только s- и p-подуровни. Подуровень p состоит из трёх атомных орбиталей, на которых, согласно правилу Хунда, может находиться до шести электронов.
и) Электронная конфигурация 3p7 не реализуется, потому что на p-подуровне, состоящем из трёх атомных орбиталей, согласно правилу Хунда, максимальное число электронов равно 6.
Задача 184.
Сколько вакантных Зd-орбиталей имеют возбужденные атомы: а) С1; б) V; в) Мn?
Решение:
а) электронная конфигурация атома хлора имеет вид: …3s23p53d0. Графическое заполнение валентного энергетического слоя атома хлора можно представить следующей схемой:
Таким образом, внешний энергетический уровень атома хлора имеет свободные орбитали на 3d-подуровне, что позволяет электронам переходить в возбуждённое состояние (перемещаться на более высокие свободные орбитали). У атома хлора возможно три состояния перемещения электронов на более высокие свободные орбитали, электроны с s- и p-подуровней переходят на 3d-подуровень:
1) При затрате некоторой энергии один из 3p-электронов атома хлора может быть переведён на вакантную 3d-орбиталь, при этом энергия атома возрастает, так что возникающая электронная конфигурация (1s22s22p63s23p43d1) соответствует одному из возбуждённых состояний атома хлора. Графически это можно представить схемой:
Графически это можно представить схемой:
В данном случае 3d-подуровень содержит четыре вакантные орбитали возбуждённого атома хлора.
2) При затрате некоторой энергии два из 3p-электронов атома хлора могут быть переведены на вакантные 3d-орбитали, при этом энергия атома возрастает, так что возникает электронная конфигурация (1s22s22p63s23p33d2), которая соответствует одному из возбуждённых состояний атома хлора. Графически это можно представить схемой:
В таком возбуждённом состоянии атом хлора содержит три вакантные 3d-орбитали.
3) При затрате некоторой энергии один из 3s- и два 3p-электронов могут быть переведены на свободные 3d-орбитали, при этом энергия атома возрастает, так что возникающая конфигурация (1s22s22p63s13p33d3) также соответствует одному из возможных состояний хлора:
б) Электронная конфигурация валентного энергетического уровня атома ванадия имеет вид: …3d34s2. Графическая схема заполнения электронами имеет вид:
Графическая схема заполнения электронами имеет вид:
В возбуждённом состоянии атома ванадия один 4s-электрон может быть переведён на свободную 3d-орбиталь, так что возникающая электронная конфигурация валентного уровня (3d44s1) соответствует возбуждённому состоянию атома ванадия, что можно представить в виде схемы:
При возбуждении атома ванадия остаётся вакантной одна 3d-орбиталь.
в) Электронная конфигурация валентного энергетического уровня атома марганца имеет вид: …3d54s2. Графическая схема заполнения электронами имеет вид:
При возбуждении атома марганца один s-электрон переходит на 3d-орбиталь, при этом получается электронная конфигурация валентного уровня (3d64s1) соответствует возбуждённому состоянию атома марганца, что можно представить в виде схемы:
Из схемы вытекает, что при возбуждении атома марганца свободных d-орбиталей нет, так как на 3d-подуровне распределяются два спаренных электрона и четыре неспаренных. Таким образом, атом марганца ни в основном, ни в возбуждённом состоянии не имеет свободных d-орбиталей.
Таким образом, атом марганца ни в основном, ни в возбуждённом состоянии не имеет свободных d-орбиталей.
Задача 185.
Сколько неспаренных электронов содержат невозбужденные атомы: а) В; б) S; в) Аs; г) Сг; д) Нg; е) Еu?
Решение:
а) Электронная формула атома бора 1s22s22p1. Валентность орбитали в этом атоме являются орбитали внешнего (второго) электронного, т.е. 2s-, 2p-орбитали. Графическая схема заполнения электронами этих орбиталей имеет следующий вид:
Следовательно, атом бора содержит один неспаренный 2p-электрон.
б) Электронная конфигурация валентного электронного слоя атома серы имеет вид: …2s22p4. Графическая схема заполнения электронами этого слоя имеет следующий вид:
Следовательно, атом серы в стационарном состоянии содержит два неспаренных электрона -, 2p-подуровне.
в) Электронная конфигурация валентного электронного слоя атома мышьяка имеет вид: …4s24p3. Графическая схема распределения валентных электронов имеет следующий вид:
Графическая схема распределения валентных электронов имеет следующий вид:
Таким образом, атом мышьяка имеет три неспаренных электрона на 4p-подуровне.
г) Электронная конфигурация валентного электронного слоя атома хрома имеет вид: …3d5 4s1. Графическая схема заполнения электронами этого слоя имеет следующий вид:
Следовательно, атом хрома в стационарном состоянии содержит шесть неспаренных электронов, из которых пять на 3d-подуровне и один на 4s-подуровне.
д) Электронная конфигурация валентного электронного слоя атома ртути имеет вид: … 6s26p0. Графическая схема заполнения электронами этого слоя имеет следующий вид:
Атом ртути не содержит ни одного неспаренного электрона.
е) Электронная конфигурация валентного электронного слоя атома европия имеет вид: …4f7 6s2. Графическая схема заполнения электронами этого слоя имеет следующий вид:
Таким образом, атом европия содержит семь неспаренных 4f-электронов.
Ответ: а) 1; б) 2; в) 3; г) 6; д) 0; е) 7.
Задача 186.
Составить электронно-графические схемы ионов Ее2+ и Ее3+. Чем можно объяснить особую устойчивость электронной конфигурации иона Ее3+?
Решение:
Электронная формула атома железа имеет вид: 1s22s22p63s23p63d64s2. Графическая схема размещения электронов в квантовых ячейках атома железа будет иметь следующий вид:
При отдаче двух 4s-электронов атомом железа образуется ион Ее2+, графическая схема размещения электронов в котором будет иметь вид:
При отдаче трёх электронов (двух 4s- и одного 3d) атомом железа образуется ион Ее3+, графическая схема размещения электронов в котором будет иметь вид:
Таким образом, на внешнем энергетическом уровне иона Ее2+ содержится два 3s-, шесть 3p- и шесть 3d-электронов. Причём на 3d-подуровне содержатся четыре неспаренных и два спаренных электрона. Ион Ее3+ отличается от Ее2+ тем, что содержит на 3d-подуровне на один электрон меньше, и все они неспаренные, такая система 3d-подуровня является энергетически более устойчивой. Электростатическое взаимодействие между ядром и электронной плотностью у иона Ее3+ больше, чем у иона Ее2+.
Причём на 3d-подуровне содержатся четыре неспаренных и два спаренных электрона. Ион Ее3+ отличается от Ее2+ тем, что содержит на 3d-подуровне на один электрон меньше, и все они неспаренные, такая система 3d-подуровня является энергетически более устойчивой. Электростатическое взаимодействие между ядром и электронной плотностью у иона Ее3+ больше, чем у иона Ее2+.
Задача 187.
Указать особенности электронных конфигураций меди и хрома. Сколько 4s-электронов содержат невозбужденные атомы этих элементов?
Решение:
Так как число электронов в атоме элемента равно его порядковому номеру, то общее число электронов в атоме меди и хрома соответственно равно 29 и 24.
Последовательность заполнения энергетических уровней и подуровней в атоме элемента определяется правилами Клечковского, согласно которым электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией (меньшая сумма n + l). Порядок заполнения подуровней определяется правилом Хунда. Согласно правилу Хунда, минимальной энергии атома соответствует такое распределение электронов по атомным орбиталям данного подуровня, при котором абсолютное значение суммарного спина атома максимально.
Порядок заполнения подуровней определяется правилом Хунда. Согласно правилу Хунда, минимальной энергии атома соответствует такое распределение электронов по атомным орбиталям данного подуровня, при котором абсолютное значение суммарного спина атома максимально.
Электронные формулы атомов хрома и меди можно выразить следующим образом:
Экспериментально установлено, что на внешнем энергетическом уровне у хрома и меди находится по одному электрону. Объясняется это тем, что произошёл «провал» одного 4s-электрона у атомов хрома и меди на 3d-подуровень. Происходит это потому, что энергетически выгодным состоянием является состояние атома, когда при четырёх неспаренных электронах на 3d-подуровне происходит заполнение пятой свободной атомной орбитали. Поэтому электронная формула атома хрома имеет следующий вид: 1s22s22p63s23p63d54s1.
У атома меди все атомные орбитали 3d-подуровня заполнены, причём четыре полностью, а на пятой находится один неспаренный электрон. Такая система 3d-подуровня, состоящая из девяти электронов является энергетически неустойчивой, и поэтому происходит «провал электрона с 4s-орбитали на 3d-орбиталь. Электронную формулу атома меди можно теперь представить следующим образом: 1s22s22p63s23p63d104s1.
Такая система 3d-подуровня, состоящая из девяти электронов является энергетически неустойчивой, и поэтому происходит «провал электрона с 4s-орбитали на 3d-орбиталь. Электронную формулу атома меди можно теперь представить следующим образом: 1s22s22p63s23p63d104s1.
Таким образом, атомы хрома и меди на внешних энергетических уровнях содержат по одному 4-электрону. Графические схемы распределения электронов по квантовым ячейкам у атомов хрома и меди в стационарном состоянии будут иметь следующий вид:
A 1 Строение электронных оболочек атомов элементов первых четырех периодов S — p — и d -элементы Электронная конфигурация атома Основное и возбужденное состояние атомов 1
A1
Строение
электронных оболочек атомов элементов
первых четырех периодов:S-, p—
и d-элементы.
Электронная конфигурация атома. Основное
и возбужденное состояние атомов.
1.Число электронов в ионе Са2+ равно
1. 18 2. 20 3. 22 4. 40
2. Изотопами являются
1. S2- и S6+ 2. фосфор красный и фосфор белый 3. 1Н и 2Н 4. 40К и 40Аr
3. Электронная конфигурация 1S22S22p6
1. атому фтора 2. оксид-иону 3. атому натрия 4. сульфид-иону
4.К s-элементам относится каждый из элементов:
1. натрий и алюминий 2. калий и аргон 3. барий и гелий 4. кальций и хлор
5. Число протонов в ядре атома изотопа 32Р:
1. 15 2. 17 3. 31 4. 32
6. Изотопами являются:
1. алмаз и фуллерен 2. кислород и озон 3. водород-3 и гелий-3 4. дейтерий и тритий
7. К s-элементам не относится:
1. сера 2. гелий 3. водород 4. кальций
кальций
8. Электронную конфигурацию 1S22S2 имеет
1. атом гелия Не 2. катион лития Li+ 3. катион азота N3+ 4. анион углерода С2-
9. Электронная конфигурация 1S22S22p63S23p6 отвечает
1.атому аргона и атому хлора 2. атому аргона и атому калия
3. сульфид-иону и катиону лития 4. атому аргона и хлорид-иону
10. Одинаковую электронную конфигурвцию имеют частицы
1. Cl u Ar 2. Cl— u Ar 3. Cl— u F— 4. Na+ u Ar
11. Число электронов в ионе Fe2+ равно
1.54 2. 28 3. 58 4. 24
12. В ядре атома изотопа кальция-40 число нейтронов
1.меньше числа протонов 2.равно числу протонов 3.больше числа протонов 4. любое
13. В ядре атома изотопа титан-48 число нейтронов равно
1. 26 2.32 3. 40 4. 48
26 2.32 3. 40 4. 48
14.Элемент мышьяк относится к
1. s-элементам 2.р-элементам 3.d-элементам 4. переходным элементам
15. Заполнение электронами s-подуровня происходит у атома элемента
1. кремния 2. кальция 3. кобальт 4.цинк
16. Электронная формула 1S22S22p63S23p64S1 отвечает атому элемента
1. сера 2. бром 3.калий 4. марганец
17. Атому элемента фосфор отвечает электронная формула
1.1S22S22p63S23p2 2. 1S22S22p63S23p3 3. 1S22S22p63S23p4 4. 1S22S22p63S23p5
18. Электронная формула 1S22S22p63S23p6 относится к катиону Э2+ элемента
1. титан 2. марганец 3. железо 4.
кальций
титан 2. марганец 3. железо 4.
кальций
19. . Электронная формула 1S22S22p63S23p6 отвечает аниону Э2- элемента
1. углерод 2. хлор 3. сера 4. мышьяк
20. В основном состоянии атом элемента германий имеет число неспаренных электронов, равное
1. 1 2. 2 3. 3 4. 4
21. В возбужденном состоянии атом элемента алюминий имеет число неспаренных электронов, равное
1. 1 2. 2 3. 3 4.4
22. Число протонов, нейтронов и электронов изотопа 90Sr соответсвенно равно
1. 38, 90, 38 2. 38, 52, 38 3. 90, 52, 38 4. 38, 52,90
23. Инертный газ, имеющий такую же электронную конфигурацию, что и ион Са2+
1. Не 2. Ne 3. Xe 4. Ar
24.Ионы, имеющие такую же электронную конфигурацию, что и атом Ar
1. К+и
S2- 2. K+ u Na+ 3. Al3+ u S2- 4. Na+ u Al3+
K+ u Na+ 3. Al3+ u S2- 4. Na+ u Al3+
25. Число неспаренных электронов в атоме мышьяка в невозбужденном состоянии
1. 5 2. 3 3. 2 4. 4
26. Суммарное число электронов в частице NO2—
1. 22 2. 23 3. 24 4. 25
27. Атом элемента имеет электронную конфигурацию 1S22S22p63S23p64S23d5. Номер периода, номер группы, максимальная степень окисления данного элемента соответственно равны
1. 7, 4, +4 2. 3, 5, +5 3. 4, 7, +2 4. 4, 7, +7
28.Состав ядер изотопов 12С и 13С соответственно равен
1. 12p+6n u 13p+7n 2. 12p+12n u 13p+13n
3. 6p+12n u 6p+13n 4. 6p+6n u 6p+7n
29. Элемент образует высший оксид состава
R2O7 и не образует летучее водородное
соединение. Электронная формула валентных
электронов данного элемента
Электронная формула валентных
электронов данного элемента
1. 3S23d5 2. 3d54S2 3. 4S24p5 4. 3S23p5
30. Элемент, имеющий электронную конфигурацию 1S22S22p63S23p64S23d10, образует оксид и гидроксид, имеющие свойства
1. оксид – амфотерные, гидроксид – основные
2. оба амфотерные
3. оксид – основные, гидроксид – амфотерные
4. оба основные
31. Число энергетических уровней и число внешних электронов атома хлора равны соответственно
1. 4 и 6 2. 2 и 5 3. 3 и 7 4. 4 и 5
32. Число энергетических уровней и число внешних электронов атома азота равны соответственно
1. 2 и 3 2. 2 и 5 3. 3 и 7 4. 3 и 5
33. Восьмиэлектронную внешнюю оболочку имеет ион
1. S4+ 2. S2- 3. Br5+ 4. Sn2+
S2- 3. Br5+ 4. Sn2+
34. Какую электронную конфигурацию атома имеет химический элемент, формула высшего оксида которого R2O5
1. 1S22S22p63S1 2. 1S22S22p63S23p64S2
3. 1S22S22p63S23p5 4. 1S22S22p3
35. Число электронов в атоме аргона равно числу электронов в ионе
1. S2- 2. Al3+ 3. Na+ 4. F—
36. Химический элемент расположен в IV периоде, IA группе. Распределению электронов в атоме этого элемента соответствует ряд чисел:
1. 2, 8, 8, 2 2. 2, 8, 18, 1 3. 2, 8, 8, 1 4. 2, 8, 18, 2
37. Наименьшее число нейтронов содержится в атоме
1. Са 2. Br 3. C 4. Kr
38. Наибольшее число нейтронов содержится
в атоме
Наибольшее число нейтронов содержится
в атоме
1. азота 2. калия 3. мышьяка 4. цинка
39. Ион, в составе которого 16 протонов и 18 электронов, имеет заряд
1. +4 2. -2 3. +2 4. -4
40. Элемент, атом которого содержит 17 протонов, называется
1. кальций 2. рубидий 3. селен 4.хлор
41. Одинаковое число протонов и нейтронов содержится в атоме
1. железа-56 2. иода-127 3. кобальта-59 4. углерода-12
42. Электронную конфигурацию 1S22S22p63S23p63d1 имеет ион
1. Ca2+ 3. Al3+ 4. K+ 4. Sc2+
А1(1)
1. К s-элементам относится каждый из элементов:
1. натрий и алюминий 2. калий и аргон 3. барий и гелий 4. кальций и хлор
2. Элемент
образует высший оксид состава R2O7 и не образует летучее водородное
соединение. Электронная формула валентных
электронов данного элемента
Электронная формула валентных
электронов данного элемента
1. 3S23d5 2. 3d54S2 3. 4S24p5 4. 3S23p5
3. Электронная конфигурация хлорид-иона такая же, как и электронная конфигурация
1) оксид-иона 2) Fe2+ 3) атома брома 4) сульфид-иона
4. Электронную конфигурацию 1S2 имеет
1)анион углерода С2- 2)катион водорода Н+ 3)катион азота N3+ 4)анион водорода Н—
5. Электронная конфигурация сульфид-иона такая же, как и электронная конфигурация
1) оксид-иона 2) иона Fe2+ 3) атома брома 4) хлорид-иона
6. Одинаковую электронную конфигурацию имеют фосфид-ион и атом
1) хлора 2) неона 3) аргона 4) мышьяка
7. Электронная конфигурация [Ne] 3S23p4 отвечает частицам:
1.
Cl7+ u
Р— 2.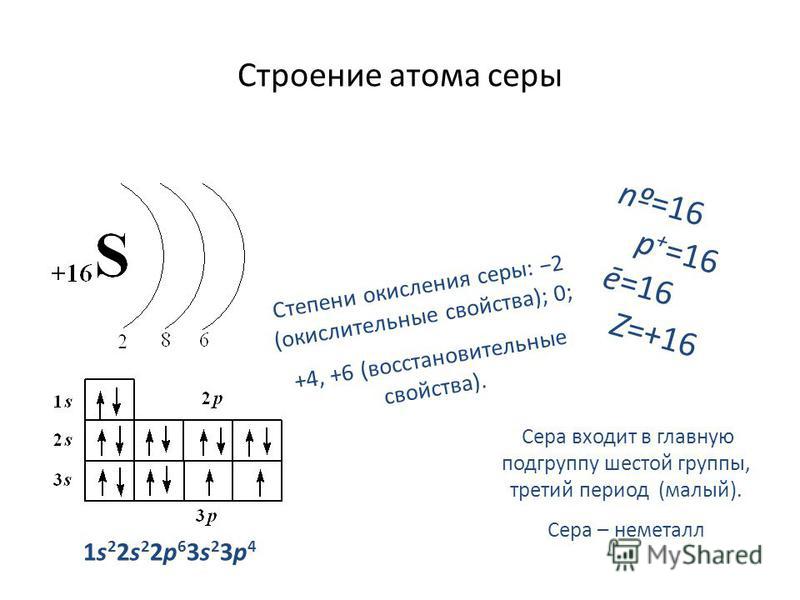 Р3- u Si4+ 3. Cl— u S
4. Cl+ u
S
Р3- u Si4+ 3. Cl— u S
4. Cl+ u
S
6. Электронная конфигурация 1S22S22p6
1. Cl7+ 3. Ca2+ 4. Fe3+ 4. Si4-
8. Электронная конфигурация 1S22S22p6 отвечает
1) атому фтора 2) фторид-иону 3) атому серы 4) сульфид-иону
9. Одинаковы электронные конфигурации:
1) атома натрия и катиона натрия
2) атома калия и атома аргона
3) гидрид-иона и атома гелия
4) сульфид-иона и атома хлора
10. Одинаковую электронную конфигурацию имеют частицы
1) Ca и Sc 2) Cl— и Sc3+ 3) Cl— и F— 4) K+ и Ne
11. Одинакова электронная конфигурация ионов
1) Na+ u F— 2) Mg2+ u Cl— 3) Cl— u Na+ 4) N5+ u N3-
12. Электронная конфигурация иона S6+
Электронная конфигурация иона S6+
1) S22S22p6 3) 1S22S22p63S23p4
2) 1S22S22p63S23p6 4) 1S22S22p63S2
13. Электронная конфигурация иона S6+
1.1S22S22p6 2. 1S22S22p63S23p6 3. 1S22S22p63S23p4 4. 1S22S22p63S2
14. Одинаковую электронную конфигурацию имеют фосфид-ион и атом
1) хлора 2) неона 3) аргона 4) мышьяка
15. Одинаковое число электронов содержат частицы
1) Al3+ и N3– 2) Ca+ и Cl– 3) S0 и Cl– 4) N3– и P3–
16) Элемент, электронная конфигурация атома которого 1S22S22p63S23p2 , образует водородное соединение
1) CH4 2) SiH4 3) H2O 4) H2S
17) Как катион, так и анион имеют электронную конфигурацию 1S22S22p6 в соединении
1) CaO 2) Na2S 3) AlF3 4) LiCl
18) Заряд ядра атома и число неспаренных электронов у атома серы в основном состоянии
1) +6 и 16 2) +16 и 4 3) +16 и 6 4) +16 и 2
19) Число электронов у иона Cr2+ равно
1) 24 2) 22 3) 52 4) 28
20) Наименьший радиус имеет атом с электронной конфигурацией
1) 1S22S22p63S23p1 2) 1S22S22p63S23p3 3) 1S22S22p63S23p2 4) 1S22S22p63S23p4
21) Одинаковое число протонов и нейтронов содержится в атоме
1)железа-56 2) углерода-14 3) титана-48 4) азота-14
22) Какую электронную конфигурацию имеет атом наиболее активного металла?
1)
…. 3d14S2 2) ….3d24S2 3) ….4S2 4) ….3d34S2
3d14S2 2) ….3d24S2 3) ….4S2 4) ….3d34S2
23) Наибольшую окислительную способность имеет элемент с электронной конфигурацией
1) 1S22S22p5 2) 1S22S22p63S23p63d104S24р5
3) 1S22S22p63S23p63d104S24р64d105S25Sp5 4) 1S22S22p63S23p5
24) Какую электронную конфигурацию имеет атом наиболее активного металла?
1) ….2S1 2) ….4S1 3) ….3S23p1 4) ….3S1
25) Наиболее активный неметалл имеет электронную конфигурацию
1) 1S22S22p63S23p3 2) 1S22S22p63S23p6 3) 1S22S22p63S23p4 4) 1S22S22p63S23p5
26) Какое число нейтронов в ионе Zn2+ у одного из изотопов цинка с
массовым числом 70?
1) 35 2) 40 3) 70 4) 30
27) Электронную конфигурацию 1S22S22p63S23p6 имеет
1) K+ 2) O2– 3) S0 4) K0
28) В атоме хрома число свободных 3d- орбиталей равно
1) 1 2) 2 3) 3 4) 0
29) Число электронов на внешнем энергетическом уровне атома серы в возбужденном состоянии равно
1) 6 2) 3 3) 5 4) 2
30) Какая электронная конфигурация внешнего энергетического уровня соответствует атому элемента IVА группы?
1) 3S23p2 2) 3S23p6 3) 4S23d2 4) 2S22p4
31) Электронная конфигурация1S22S22p63S23p63d104S1 соответствует атому
1) K 2) Cu 3) Zn 4) Ca
32) Элемент, электронная конфигурация которого 1S22S22p63S23p3 , образует водородное соединение
1) CH4 2) SiH4 3) H2O 4) PH3
33) Сходную конфигурацию внешнего энергетического уровня имеют атомы азота и
1) углерода 2) фосфора 3) магния 4) кислорода
34) Электронная конфигурация1S22S22p63S23p63d104S1 соответствует частице
1)Ca2+ 2) Al3+ 3) K0 S2–
35)
Химическому элементу соответствует
высший оксид состава R2O. Электронная конфигурация внешнего
энергетического уровня атома этого
элемента
Электронная конфигурация внешнего
энергетического уровня атома этого
элемента
1) nS2 2) nS1 3) nS2np1 4) nS2np2
36) Число энергетических слоев и число электронов во внешнем энергетическом слое атома хрома равны соответственно
1) 4, 2 2) 4, 1 3) 4, 6 4) 4, 5
37) Число электронов на внешнем энергетическом уровне атома углерода в вожбужденном состоянии
1) 2 2) 4 3) 3 4) 6
38) Атому с наибольшим радиусом соответствует электронная конфигурация
1) 1S22S22p63S23p1 2) 1S22S22p4 3) 1S22S22p63S23p5 4) 1S22S22p2
39) Наибольший радиус имеет ион
1) Rb+ 2) Sr2+ 3) Te2– 4) I–
40) Атому неметалла с наибольшим радиусом соответствует электронная конфигурация
1) 1S22S22p63S23p1 2) 1S22S22p4 3) 1S22S22p63S23p5 4) 1S22S22p2
41) Наименьший радиус имеет ион
1) Cl– 2) Mg2+ 3) S2– 4) Ca2+
Сера
Электронное строение атома.
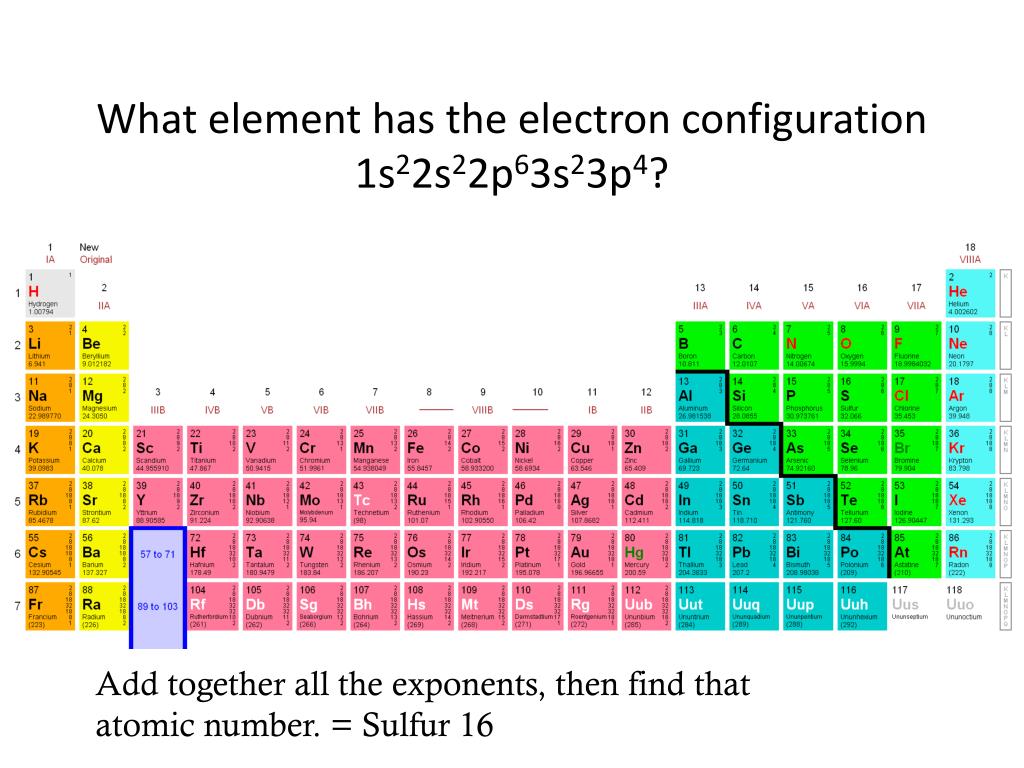
Сера относится к элементу, находящемуся в VI-й группе главной подгруппы периодической системы Д.И.Менделеева. Его электронная конфигурация атома 1s22s22p63s23p4.
Нахождение в природе.
В обычных условиях сера представляет собой лёгкие, жёлтые кристаллы, нерастворимые в воде, но хорошо растворимые в сероуглероде. Кристаллическая решётка серы – молекулярная, в узлах которой находится циклическая молекула S8. Сера имеет ряд аллотропных модификаций.
Вышеуказанная форма серы называется моноклинной серой, при охлаждении которой переходит в устойчивые кристаллы ромбической серы.
Если расплавленную серу влить в холодную воду, то образуется ещё одна аллотропная модификация – пластическая сера. Температура кипения серы +445оС. В парах расплавленной серы содержатся молекулы S8, S6, S4, S2.
В природе сера встречается в трёх формах:
1) Самородная сера
2) Сульфидная сера:
FeS2 – серный или железный колчедан, пирит.
CuS – медный блеск.
CuFeS2 – халькопирит или медный колчедан.
PbS – свинцовый блеск.
ZnS – цинковая обманка.
HgS – киноварь.
3) Сульфатная сера:
CaSO4x2h3O – гипс.
CaSO4xh3O – алебастр.
Na2SO4x10h3O – глауберова соль.
MgSO4x 7h3O – горькая соль.
Химические свойства.
1. Свойства простого вещества.
Сера может проявлять как окислительные, так и восстановительные свойства. Окислителем сера является в первую очередь по отношению к металлам:
S + 2Na = Na2S
S + Ca = CaS
3S +2Al = Al2S3
В качестве окислителя сера проявляет свои свойства и при взаимодействии с неметаллами:
S + h3 = h3S
3S + 2P = P2S3
2S + C = CS2
Однако с неметаллами, имеющими электроотрицательность бóльшую, чем у серы, она реагирует в качестве восстановителя:
S +3F2 = SF6
S + Cl2 = SCl2
Сера реагирует со сложными веществами, как правило, окислителями. Причём азотная кислота окисляет её до серной кислоты:
Причём азотная кислота окисляет её до серной кислоты:
S + 6HNO3 = h3SO4 + 6NO2 + 2h3O
Другие окислители окисляют серу до степени окисления (+4):
S + 2h3SO4 = 3SO2 + 2h3O
3S + 2KClO3 = 3SO2 + 2KCl
По механизму реакции ДИСПРОПОРЦИОНИРОВАНИЯ сера реагирует с щелочами. В процессе этой реакции образуются соединения серы (-2) и (+4):
3S + 6KOH = K2SO3 + 2K2S + 3h3O
Непосредственно с водой сера не реагирует, однако при нагревании подвергается дисмутации в атмосфере водяного пара.
Сера может быть получена в процессе реакций:
SO2 + 2CO = S + 2CO2
Na2S2O3 + 2HCl = S + SO2 + 2NaCl + h3O
2. Соединения серы (-2).
У серы в степени окисления (-2) соединения называются сульфидами. Это бинарные соединения, в которых одним из элементов является металл: Na2S, ZnS, Al2S3, PbS2 и др.
Соединение серы (-2) с водородом называется сероводород – h3S. Сероводород – газ без цвета, неприятного запаха, тяжелее воздуха, очень ядовит, мало растворим в воде. Сероводород можно получить различными способами. Oбычно, в лаборатории, сероводород получают, действуя на сульфиды сильными кислотами:
Сероводород – газ без цвета, неприятного запаха, тяжелее воздуха, очень ядовит, мало растворим в воде. Сероводород можно получить различными способами. Oбычно, в лаборатории, сероводород получают, действуя на сульфиды сильными кислотами:
FeS + 2HCl = FeCl2 + h3S
Для сероводорода и его солей характерны восстановительные свойства:
h3S + SO2 = 3S + 2h3O
В указанной реакции сера образуется по механизму конпропорционирования ( из двух атомов серы, имеющих различные степени окисления (-2) и (+4) образуется соединение серы со степенью окисления (0).
SO2 + 2CO = S + 2CO2
Na2S2O3 + 2HCl = S + SO2 + 2NaCl + h3O
В лаборатории сероводород получают:
FeS + 2HCl = FeCl2 + h3S
При сгорании в кислороде он образует различные продукты:
2h3S + O2 = 2h3O + 2S (недостаток кислорода)
2h3S + 3O2 = 2h3O + 2SO2 (избыток кислорода)
Cероводород легко окисляется галогенами, оксидом серы, хлоридом железа (III):
h3S + Cl2 = 2HCl + S
2h3S + SO2 = 2h3O + 3S
h3S + 2FeCl3 = 2FeCl2 + S + 2HCl
На воздухе сероводород окисляет серебро, чем и объясняется почернение серебряных изделий со временем:
2h3S + 4Ag + O2 = 2Ag2S + 2h3O
Водные растворы сероводорода являются слабой кислотой.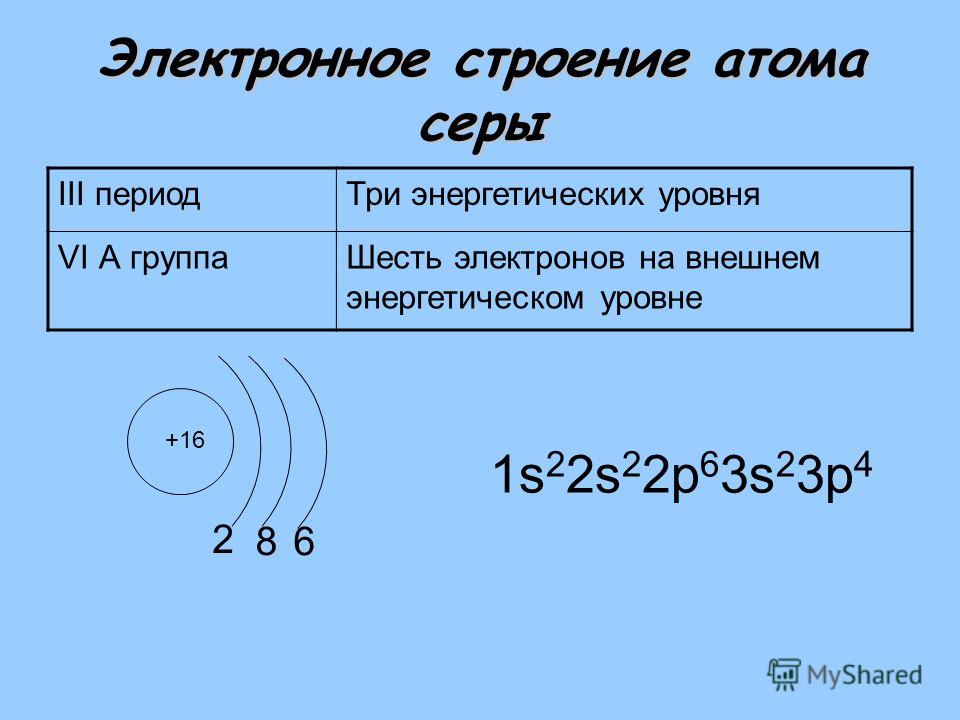 Диссоциирует в две стадии, образует два типа солей: гидросульфиды и сульфиды:
Диссоциирует в две стадии, образует два типа солей: гидросульфиды и сульфиды:
h3S ↔ HS-1 + H+
HS-1 ↔ H+ + S-2
Сульфиды большинства металлов нерастворимы и имеют различную окраску. Это является фактором, благодаря которому можно распознавать те или иные катионы в растворах:
Чёрные – HgS, Ag2S, PbS, CuS, FeS, NiS;
Коричневые – SnS, Bi2S3;
Оранжевые – Sb2S3, Sb2S5;
Жёлтые – As2S3, As2S5, SnS2, CdS;
Розовые — MnS
Белые – ZnS, Al2S3, BaS, CaS;
Cульфиды в водной среде проявляют восстановительные свойства, обычно окисляясь до серы:
3h3S + 2KMnO4 = 3S + 2MnO2 + 2KOH + 2h3O
h3S + 2HNO3 = S + 2NO2 + 2h3O
3h3S + 2FeCl3 = S + FeS + 6HCl
h3S + J2 = S + 2HJ
При взаимодействии с более сильными окислителями сульфиды окисляются до соединений со степенью окисления (+6):
h3S + 4h3O + Cl2 = h3SO4 + 8HCl
MnS + 3HNO3 = MnSO4 + 8NO2 + 4h3O
PbS + 4h3O2 = PbSO4 + 4h3O
3. Соединение серы (+4).
Соединение серы (+4).
Из соединений серы со степенью окисления (+4) наиболее характерны оксид серы (SO2) или сернистый газ и сернистая кислота (h3SO3) и её соли. Оксид серы представляет собой газ с резким запахом, бесцветный, тяжелее воздуха, хорошо растворяется в воде. Получают при неполном горении сероводорода или при окислении сульфидов. В лаборатории его получают при взаимодействии меди с концентрированной серной кислотой:
Cu + h3SO4 = CuSO4 + SO2 + h3O
Na2SO3 + 2HCl = 2NaCl + SO2 + h3O
Для оксида серы (+4) характерны как окислительные:
SO2 + h3S = 3S + 2h3O
так и восстановительные свойства:
2SO2 + O2 = 2SO3
2SO2 + 2h3O + Br2 = h3SO4 + 2HBr
SO2 + Cl2 = SO2Cl2
SO2 + 2HNO3 = h3SO4 + 2NO2
Оксид серы (+4) – типичный кислотный оксид, он реагирует с основания-ми с образованием солей, с водой образует сернистую кислоту:
SO2 + 2NaOH = Na2SO4 + h3O
SO2 + h3O = h3SO3
Сернистая кислота – слабая кислота, диссоциирует в две стадии, образует два типа солей: кислые — гидросульфитыи средние —сульфиты :
h3SO3 ↔ HSO3— + H+
HSO3—↔ SO32- + H+
Соли сернистой кислоты неустойчивы, разлагаются при действии более сильных кислот и при нагревании:
Na2SO3 + HNO3 = 2NaNO3 + SO2 + h3O
K2SO3 = K2O + SO2
В растворах сульфит-ионы проявляют чаще всего восстановительные свойства:
Na2SO3 + 2KOH + KMnO4 = Na2SO4 + 2K2MnO4 + h3O
4. Соединения серы (+6)
Соединения серы (+6)
Из соединений серы в степени окисления (+6) наиболее характерны оксид серы — SO3 или серный ангидрид и h3SO4 — cерная кислота. SO3 — бесцветный газ с характерным резким запахом, тяжелее воздуха, хорошо растворим в воде.
Оксид серы (+6) получают окислением оксида серы (+4) в присутствии катализатора и высоком давлении:
2SO2 + O2 = 2SO3
SO3 + h3O = h3SO4
Оксид серы (+6) является сильным окислителем:
SO3 + 2KJ = J2 + K2SO3
SO3 + h3S = 4SO2 + h3O2
5SO3 + 2P = P2O5 + 5SO2
Кроме того, он проявляет кислотные свойства, так как является кислотным оксидом:
SO3 + ZnO = ZnSO4
SO3 + KOH = KHSO4
SO3 + 2KOH = K2SO4 + h3O
Серная кислота, её соли.
Серная кислота представляет собой бесцветную маслообразную жидкость, максимальная плотность которой 1,84 г/мл. Исходным сырьём для получения серной кислоты является серный колчедан или пирит:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Далее, под воздействием катализатора — V2O5 происходит окисление оксида серы (+4) до оксида серы (+6):
2SO2 + O2 = 2SO3
Полученная безводная серная кислота называется олеум, т.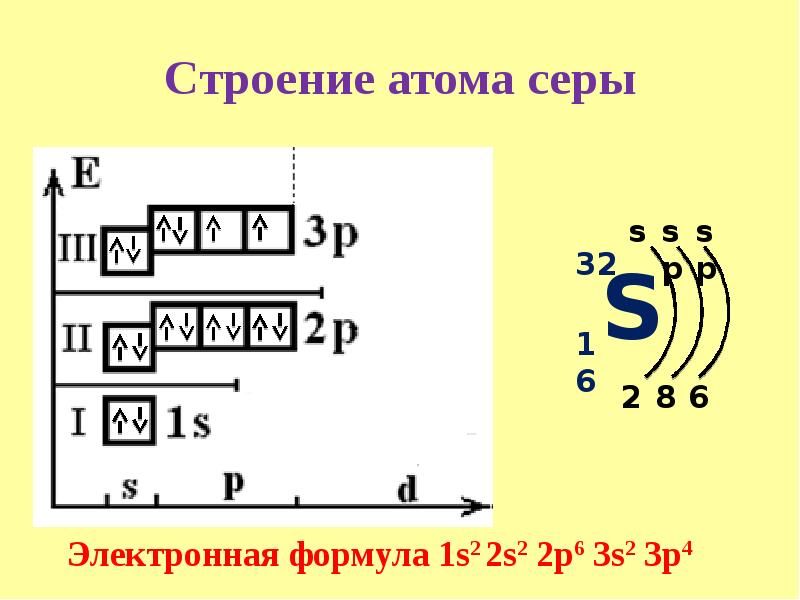 к. в действительности, оксид серы (+4) растворяют в 98%-ной серной кислоте.
к. в действительности, оксид серы (+4) растворяют в 98%-ной серной кислоте.
SO3 + h3O = h3SO4
Концентрированная серная кислота проявляет сильное водоотнимающее действие. Это свойство положено в основу многочисленных химических процессов, особенно в органической химии (получение спиртов, простых и сложных эфиров, альдегидов и т.д.). Концентрированная серная кислота является сильным окислителем. Например, при взаимодействии с просты-ми веществами, она окисляет их до кислот или оксидов:
2P + 5h3SO4 = 2h4PO4 + 5SO2 + 2h3O
C + h3SO4 = 2SO2 + CO2 + 2h3O
При обычной температуре она окисляет галогенводороды и сероводород:
h3SO4 + 8HJ = 4J2 + h3S + 4h3O
h3SO4 + 2HBr = Br2 + SO2 + 2h3O
h3SO4 + h3S = S + SO2 + 2h3O
Серная кислота термически устойчива и не летуча, поэтому способна вытеснять другие кислоты из их солей:
h3SO4 + KClO3 = KHSO4 + HClO4
Cерная кислота диссоциирует в две стадии, образует два типа солей:
кислые – гидросульфатыи средние – сульфаты:
h3SO4 ↔ HSO4— + H+
HSO4— ↔ SO42— + H+
Серная кислота проявляет свойства, характерные для остальных кислот: она реагирует с металлами, оксидами металлов, гидроксидами, солями слабых кислот. Качественной реакцией на сульфат-ионы в растворах является взаимодействие её с ионами бария Ва2+, в результате чего выпадает белый осадок:
Качественной реакцией на сульфат-ионы в растворах является взаимодействие её с ионами бария Ва2+, в результате чего выпадает белый осадок:
Ba2+ + SO42- = BaSO4
При прокаливании сульфаты разлагаются на различные классы соединений в зависимости от металла, входящего в состав соли. Сульфаты щелочных металлов плавятся без разложения. Сульфаты металлов средней активности разлагаются на соответствующие оксиды:
ZnSO4 = ZnO + SO3
Сульфат железа (II) разлагается по механизму внутримолекулярной ОВР:
4FeSO4 = 2Fe2O3 + 4SO2 + O2
Сульфаты наиболее тяжёлых или малоактивных металлов разлагаются с образованием простых веществ – металла и кислорода:
HgSO4 = Hg + SO2 + O2
Некоторые сульфаты, являясь окислителями, реагируют с простыми веществами:
CaSO4 + C = CaO + SO2 + CO
BaSO4 + 4C = BaS + 4CO
Большое значение в промышленности, лабораторных исследованиях имеет взаимодействие серной кислоты с металлами. Эта тема заслуживает особого внимания, т.к. образуются различные продукты реакции в зависимости от положения реагируемого металла в ряду напряжений, степени разбавленности кислоты, температуры, катализаторов.
Эта тема заслуживает особого внимания, т.к. образуются различные продукты реакции в зависимости от положения реагируемого металла в ряду напряжений, степени разбавленности кислоты, температуры, катализаторов.
Разбавленная серная кислота с металлами, стоящими в ряду активности до водорода, при обычной температуре образует соль и водород:
h3SO4 + Zn = ZnSO4 + h3
Разбавленная кислота не реагирует с металлами, стоящими в ряду активности после водорода (медь, серебро, ртуть), но концентрированная кислота образует с ними соль, оксид серы (+4) и воду:
h3SO4 + Cu = CuSO4 + SO2 + h3O
Такие же продукты реакции концентрированная серная кислота образует при взаимодействии с металлами, стоящими в ряду активности до водорода:
2h3SO4 + Zn = ZnSO4 + SO2 + 2h3O
Однако, концентрированная серная кислота реагирует не со всеми металлами. Алюминий, железо, свинец и олово она пассивирует с образованием на их поверхности тонких оксидных плёнок, предотвращающих дальнейшее растворение металла:
h3SO4 + Al = Al2O3 + SO2 + h3O
Активные щелочные и щелочноземельные металлы могут образовывать с разбавленной кислотой не только водород. Например, магний с очень разбавленной серной кислотой на холоду образует соль, серу и воду:
Например, магний с очень разбавленной серной кислотой на холоду образует соль, серу и воду:
h3SO4 + Mg = MgSO4 + S + h3O
Натрий при обычной температуре с очень разбавленной серной кислотой образует соль, серу и воду:
h3SO4 + Na = Na2SO4 + S + h3O,
а при охлаждении образует сероводород:
h3SO4 + Na = Na2SO4 + Н2S + h3O
Соли серной кислоты находят большое применение в промышленности, сельском хозяйстве, в быту.
Na2SO4x 10h3O – глауберова соль, применяется в медицине в качестве слабительного,
(Nh5)2SO4 – азотное удобрение для сельского хозяйства,
CaSO4 – безводный гипс, применяется в строительстве.
CaSO4x 2h3O – водный гипс,
2CaSO4 xh3O – алебастр, продукт получения гипса,
MgSO4 – горькая соль, применяется в медицине как слабительное и гипотензивное средство,
BaSO4 – баритова каша, средство, применяемое как рентгеноконтрастное средство.
CuSO4 x 5h3O – медный купорос, применяется в строительстве,
FeSO4x 7h3O – железный купорос,
ZnSO4 x 7h3O – цинковый купорос,
KАl(SO4)2 x 12h3O – алюмокалиевые квасцы.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Тематические тесты по темам «Строение атома. Периодический закон и система»
Тема «1. «Строение атома»
Строение электронных оболочек атомов элементов первых четырех периодов: s- и p- и d- элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов
1. Количество электронов в атоме равно
1)
числу протонов
2)
числу нейтронов
3)
числу энергетических уровней
4)
относительной атомной массе
2 . Ион, в составе которого 16 протонов и 18 электронов, имеет заряд
1) +4 2) -2 3) +2 4) -4
3. Внешний энергетический уровень атома элемента, образующего высший оксид состава ЭОз, имеет формулу
1) ns2np1 2) ns2nр2 3) nз2nр3 4) ns2nр4
4. Конфигурация внешнего электронного слоя атома серы в невозбужденном состоянии
Конфигурация внешнего электронного слоя атома серы в невозбужденном состоянии
1) 4s2 2) 3s23р6 3) 3s23р4 4) 4s24р4
5. Электронную конфигурацию 1s22s22p63s23p64s1 в основном состоянии имеет атом
1) лития
2) натрия
3) калия
4) кальция
6.восьмиэлектронную внешнюю оболочку имеет ион
1) Р3+ 2) S2- 3) С15+ 4) Fe2+
7. Двухэлектронную внешнюю оболочку имеет ион
1) S6+ 2) S2- 3) Вг5+ 4) Sn4+
8. Число электронов в ионе железа Fe2+ равно
1) 54 2) 28 3) 58 4) 24
9. Электронная конфигурация Is22s22p63s23p6 соответствует иону
1) Sn2+ 2) S2- 3) Cr3+ 4) Fe2+
10. В основном состоянии три неспаренных электрона имеет атом
1) кремния
2) фосфора
3) серы
4) хлора
11. Элемент с электронной конфигурацией внешнего уровня … 3s23p3 образует водородное соединение состава
1) ЭН4 2) ЭН 3) ЭН3 4) ЭН2
12. Электронная конфигурация Is22s22p63s23p6 соответствует иону
1) Сl- 2) N3- 3) Br- 4) О2-
13. Электронная конфигурация Is22s22p6 соответствует иону
Электронная конфигурация Is22s22p6 соответствует иону
1) А13+ 2) Fe3+ 3) Zn2+ 4) Cr3+
14. Одинаковую электронную конфигурацию внешнего уровня имеют Са2+ и
1) К+ 2) Аr 3) Ва 4) F-
15. Атом металла, высший оксид которого Ме2О3, имеет электронную формулу внешнего энергетического уровня
1) ns2пр1 2) ns2пр2 3) ns2np3 4) ns2nps
16. Элемент, которому соответствует высший оксид состава R2O7 имеет электронную конфигурацию внешнего уровня:
1) ns2np3 2)ns2np5 3) ns2np1 4) ns2np2
17. Высший оксид состава R2O7 образует химический элемент, в атоме которого заполнение электронами энергетических уровней соответствует ряду чисел:
1) 2, 8, 1 2) 2, 8, 7 3) 2, 8, 8, 1 4) 2, 5
18. У атома серы число электронов на внешнем энергетическом уровне и заряд ядра равны соответственно
1)4 и + 16 2)6 и + 32 3)6 и + 16 4)4 и + 32
19. Число валентных электронов у марганца равно
1) 1 2) 3 3) 5 4) 7
20. Одинаковое электронное строение имеют частицы
Одинаковое электронное строение имеют частицы
1) Na0 и Na+ 2) Na0 и K0 3) Na+ и F- 4) Cr2+ и Сr3+
21. Высший оксид состава ЭО3 образует элемент с электронной конфигурацией внешнего электронного слоя
1) ns2np1 2) ns2np3 3) ns2np4 4) ns2np6
22. Число энергетических слоев и число электронов во внешнем энергетическом слое атомов мышьяка равны соответственно
1)
4, 6
2)
2, 5
3)
3, 7
4)
4, 5
23 Иону Al3+ отвечает электронная конфигурация:
1) 1s22s22p6; 2) 1s22s22p63s1; 3) 1s22s22p63s23p1 4) Is22s22p63s23p64s1
24. Иону Zn2+ отвечает электронная конфигурация:
1) 1s22s22p63s23p63d84s2 2) 1s22s22p63s23p63d104s24p6 3 ) 1s22s22p63s23p63d10 4) Is22s22p63s23p64s1
25. Химическому элементу соответствует летучее водородное соединение состава Rh4. Электронная конфигурация внешнего уровня этого элемента
1)
3s23p1
2)
3s23p2
3)
3s23p3
4)
3s23p5
26. Атомы серы и кислорода имеют
Атомы серы и кислорода имеют
1)
одинаковое число электронных слоев
2)
одинаковое число электронов внешнего электронного слоя
3)
одинаковое число протонов в ядре
4)
одинаковые радиусы
27. Электронная конфигурация атома фтора
1)
1s22s22p5
2)
1s22s22p4
3)
1s22s22p6
4)
1s22s22p3
28. Сколько неспаренных электронов имеет атом углерода в состоянии sp3-гибридизации?
1)
1
2)
2
3)
3
4)
4
29. У атома хлора на третьем электронном уровне имеется одна s-орбиталь, три p-орбитали и пять d-орбиталей. Максимальная валентность хлора равна
1)
четырем
2)
семи
3)
восьми
4)
девяти
30. Элемент, электронная конфигурация атома которого 1s22s22p63s23p2 образует водородное соединение
1) СН4 2) Sih5 3) h3O 4) h3S
Тема №2 Периодический закон и система»
Закономерности изменения химических свойств элементов и их соединений по периодам и группам.
1. В ряду Na —>Mg —>Al —>Si
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) уменьшается высшая степень окисления элементов
4) ослабевают металлические свойства элементов
2. У элементов подгруппы углерода с увеличением атомного номера уменьшается
1) атомный радиус
2) заряд ядра атома
3) число валентных электронов в атомах
4) электроотрицательность
3. В ряду элементов азот — кислород — фтор возрастает
1) валентность по водороду
2) число энергетических уровней
3) число внешних электронов
4) число неспаренных электронов
4. В ряду химических элементов бор — углерод — азот возрастает
1) способность атома отдавать электроны
2) высшая степень окисления
3) низшая степень окисления
4) радиус атома
5. Какой элемент имеет более выраженные неметаллические свойства, чем кремний?
1) углерод 2) германий 3) алюминий 4) бор
6. С ростом заряда ядра атомов кислотные свойства оксидов в ряду
С ростом заряда ядра атомов кислотные свойства оксидов в ряду
N2O5 —> P2O5 —> As2O5 —> Sb2O5
1) ослабевают
2) усиливаются
3) не изменяются
4) изменяются периодически
7. В порядке возрастания неметаллических свойств элементы расположены в ряду:
1) O,N,C,B
2) Cl,S,P,Si
3) C,Si,Ge,Sn
4) B,C,O,F
8. В порядке усиления металлических свойств элементы расположены в ряду:
1) А1,Са,К 2) Ca.Ga.Fe 3) K,Al,Mg 4) Li,Be,Mg
9. В каком ряду элементы расположены в порядке возрастания их атомного радиуса?
1) Si,P, S.C1
2) O,S,Se,Te
3) At,I,Br,Cl
4) Mg,Al,Si, P
10. Какой элемент образует газообразное водородное соединен соответствующее общей формуле Rh3?
1) бор 2) калий 3) сера 4) хром
11. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) уменьшением радиуса атомов
2) увеличением числа энергетических уровней в атомах
3) уменьшением числа протонов в ядрах атомов
4) увеличением числа валентных электронов
12. В какой группе периодической системы находится элемент Э, входящий в состав кислоты НЭО4?
В какой группе периодической системы находится элемент Э, входящий в состав кислоты НЭО4?
1) IV 2) V 3) VI 4) VII
13. В ряду оксидов SiO2 — Р2О5 — SO2 — Cl2O7 кислотные свойства
1) возрастают
2) убывают
3) не изменяются
4) сначала уменьшаются, потом увеличиваются
14. В каком ряду простые вещества расположены в порядке усиления металлических свойств?
1) Mg, Ca, Ва
2) Na, Mg, A1
3) K,Ca,Fe
4) Sc, Ca, Mg
15. По периоду слева направо уменьшается(-ются)
1) атомный радиус элементов
2) число валентных электронов в атомах
3) электроотрицательность элементов
4) кислотные свойства гидроксидов
16. В порядке увеличения электроотрицательности химические элементы расположены в раду:
1) С, N, О 2) Si.Al.Mg 3) Mg,Ca, Ва 4) Р, S, Si
17. Химический элемент расположен в IV периоде, IA группе. Распределению электронов в атоме этого элемента соответствует ряд чисел:
1) 2,8,8,2
2) 2, 8, 18, 1
3) 2, 8, 8, 1
4) 2,8, 18,2
18. Электроотрицательность химических элементов с возрастанием заряда ядра атома
Электроотрицательность химических элементов с возрастанием заряда ядра атома
1) увеличивается и в периодах, и в группах
2) уменьшается и в периодах, и в группах
3) увеличивается в периодах, а в группах уменьшается
4) уменьшается в периодах, а в группах увеличивается
19. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
1) Rb,K,Na,Li
2) Na,Mg,Al, S
3) О, S, Se, Те
4) C,N, О, F
20. Среди элементов третьего периода наименьший атомный радиус имеет
1) натрий
2) алюминий
3) фосфор
4) сера
21. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) уменьшением радиуса атомов
2) увеличением числа энергетических уровней в атомах
3) уменьшением числа протонов в ядрах атомов
4) увеличением числа валентных электронов
22. По периоду слева направо уменьшается
1) число валентных электронов в атомах
2) атомный радиус элементов
3) электроотрицательность элементов
4) кислотность гидроксидов элементов
23. Наиболее сильное основание образует
Наиболее сильное основание образует
1) цезий 2) натрий 3} литий 4) цинк
24. Оксид с наиболее выраженными кислотными свойствами образует
1) кремний 2) фосфор 3) сера 4) хлор
25. Наиболее сильное основание образует
1) магний 2) стронций 3) барий 4) кадмий
26. Кислотный характер наиболее выражен у высшего оксида, образованного элементом:
1) Sn 2) А1 3) С 4} S
27. Кислотный характер наиболее выражен у высшего оксида, образованного
1) бериллием 2) бором 3) фосфором 4) кремнием
28. Сила бескислородных кислот неметаллов VIIА группы соответственно возрастанию заряда ядра атомов элементов
1)
увеличивается
2)
уменьшается
3)
не изменяется
4)
изменяется периодически
29. Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
1)
хлор
2)
германий
3)
мышьяк
4)
селен
30. Кислотные свойства оксидов в ряду SiO2 —> P2O5 —>SО3
Кислотные свойства оксидов в ряду SiO2 —> P2O5 —>SО3
1) ослабевают
2) усиливаются
3) не изменяются
4) изменяются периодически
31. Газообразные водородные соединения состава ЭН3 образуют
1) Be, Ca, Sr 2) P, As, Sb 3) Ga, Al, B 4) Te, S, Sc
32. В ряду элементов
Cl ® S ® P ® Si
1) уменьшается число электронных слоев в атомах
2) увеличивается число внешних электронов в а томах
3) возрастают радиус атомов
4) усиливаются неметаллические свойства
33. Неметаллические свойства наиболее выражены у
1) серы 2) кислорода 3) кремния 4) фосфора
34. Наибольший радиус имеет атом
1) олова 2} кремния 3) свинца 4} углерода
35. В ряду химических элементов
Na —>Mg —> Al —> Si
1) увеличивается число валентных электронов в атомах
2) уменьшается число электронных слоев а атомах
3) уменьшается число протонов в ядрах атомов
4) увеличиваются радиусы атомов
36. Наибольший радиус имеет атом
Наибольший радиус имеет атом
1) брома 2) мышьяка 3) бария 4) олова
37.Электронную конфигурацию 1s22s22р63.s2Зр63d1 имеет ион
1) Са2+ 2) А13+ 3) K+ 4) Sc2+
38. Какую электронную конфигурацию имеет атом наиболее активного металла?
1)
1s22s22p1
2)
1s22s22p63s1
3)
1s22s2
4)
1s22s22p63s23p1
Тема №3. Химические элементы.
1. В порядке увеличения восстановительной способности металлы расположены в ряду:
1) K,Al,Cr,Sn
2) Sn,Cr,Al,Zn
3) Sn,Ca,Al,K
4) Au,Al,Ca,Li
2. Щелочные металлы
1)являются сильными восстановителями
2) проявляют как окислительные, так и восстановительные свойства
3) легко образуют отрицательно заряженные ионы
4) легко присоединяют электроны в химических реакциях
3. В ряду элементов: натрий —>магний —>алюминий
возрастает их
1) атомный радиус
2) восстановительная способность
3) химическая активность
4) электроотрицательность
4. У магния металлические свойства выражены
У магния металлические свойства выражены
1) слабее, чем у бериллия
2) сильнее, чем у алюминия
3) сильнее, чем у кальция
4) сильнее, чем у натрия
5. В порядке уменьшения восстановительных свойств металлы расположены в ряду:
1) Al,Zn,Fe
2) Al,Na,K
3) Fе,Zn,Mg
4) Fe,Zn,Al
6. Наибольший радиус имеет атом
1) лития 2) натрия 3) кальция 4) калия
7. У элементов II А группы сверху вниз
1) уменьшаются радиусы атомов,
2) увеличивается число валентных электронов в атоме
3) увеличиваются радиусы атомов
4) уменьшается число валентных электронов в атоме
8. Сила оснований возрастает в ряду:
1) Ве(ОН)2, Mg(OH)2, Ca(OH)2
2) Ва(ОН)2, Са(ОН)2, Ве(ОН)2
3) Са(ОН)2, Mg(OH)2, Ве(ОН)2
4) Sr(OH)2, Ca(OH)2, Mg(OH)2
9. У элементов I А группы сверху вниз
1) усиливаются окислительные свойства
2) ослабевают восстановительные свойства
3) увеличиваются радиусы атомов
4) уменьшаются радиусы атомов
10. Валентные электроны наиболее легко отдают атомы
Валентные электроны наиболее легко отдают атомы
1) алюминия 2) натрия 3) бериллия 4) магния
11. Восстановительные свойства наиболее выражены у
1) алюминия 2) магния 3) натрия 4) калия
12. Для растворения как меди, так и железа, следует использовать
1) концентрированную фосфорную кислоту
2) разбавленную азотную кислоту
3) разбавленную соляную кислоту
4) раствор гидроксида калия
13. К основным гидроксидам относится каждое из двух веществ:
1) Fe(OH)3 и Си(ОН)2
2) Fe(OH)3 и Сг(ОН)2
3) Fe(OH)2 и Ca(OH)2
4) Fe(OH)3 и Сг(ОН)3
14. При нагревании меди с концентрированной серной кислотой образуется
1) оксид серы (IV)
2) водород
3) оксид серы (VI)
4) сероводород
15. Медь может вступать во взаимодействие с водным раствором
1) гидроксида натрия
2) хлорида кальция
3) нитрата цинка
4) азотной кислоты
16. Основные свойства веществ ослабевают в ряду:
Основные свойства веществ ослабевают в ряду:
1) NaОН —> КОН —>RbOH
2) А1(ОН)3 —>Mg(OH)2 —> NaOH
3) Са(ОН)2 —> Mg(OH)2 —>Be(OH)2
4) В(ОН)3 —>Ве(ОН)2 —> LiOH
17. Верны ли следующие суждения?
А. И хром, и железо образуют устойчивые оксиды в степени окисления +3.
Б. Оксид хрома (III) является амфотерным.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
18. Верны ли следующие суждения?
А. Только s-элементы содержит IA группа.
Б. Все элементы IA группы взаимодействуют с водой при комнатной температуре.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
19. Оксид хрома (VI) является
1) основным
2) кислотным
3) амфотерным
4) несолеобразующим
20. При обычных условиях практически осуществима реакция между железом и
1) серой (тв)
2) серной кислотой (конц. )
)
3) нитратом меди (II) (р-р)
4) нитратом цинка (р-р)
21. Только при нагревании с водой реагируют
1) К и Hg 2) Zn и Fe 3) Cs и Ag 4) Sr и Сu
22. Только основные свойства проявляет
1) Сr2O3 2) Сr(ОН)2 3) СrO3 4) Сr(ОН)3
23. Сильные окислительные свойства характерны для
1) оксида меди (I)
2) оксида железа (II)
3) оксида хрома (III)
4) оксида хрома (VI)
24. Верны ли следующие суждения об оксидах железа?
А. Степень окисления железа в высшем оксиде равна + 3.
Б. Высший оксид железа относится к основным оксидам.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
25. В ряду оксидов
CrO — Сr2О3 — СrОз
происходит
1) уменьшение степени окисления хрома
2) усиление восстановительных свойств
3) увеличение массовой доли хрома
4) усиление кислотных свойств
26. Оцените справедливость суждений о металлах:
Оцените справедливость суждений о металлах:
А. Чем сильнее атом удерживает валентные электроны, тем ярче
выражены металлические свойства элемента.
Б. Чем сильнее выражены металлические свойства элемента, тем
более основный характер имеет его гидроксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
27. Оцените справедливость суждений о металлах:
А. Для атомов металлов характерно малое число валентных
электронов и слабое их притяжение к ядру.
Б. Чем выше степень окисления металла в его гидроксиде, тем
более основными свойствами обладает гидроксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
28. Оцените справедливость суждений о металлах:
А. Атомы металла могут образовывать только ионные связи.
Б. Оксиды и гидроксиды металлов всегда имеют основный
характер.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
29. Верны ли следующие суждения о неметаллах?
А. В периодической системе химических элементов Д.И. Менделеева все неметаллы располагаются в главных подгруппах.
Б. Все неметаллы являются р-элементами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
30. При обычных условиях из двухатомных молекул состоят
1) гелий и аргон
2) азот и неон
3) сера и фосфор
4) водород и кислород
31. Верны ли следующие суждения о неметаллах?
А. Все неметаллы являются химически активными веществами.
Б. Неметаллы обладают только окислительными свойствами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
32. Верны ли следующие суждения о неметаллах?
А. Неметаллы образуют с щелочными металлами соединения преимущественно с ионной связью.
Б. Между собой неметаллы образуют соединения с ковалентной связью.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
33. У атомов химических элементов, расположенных в ряду: P-S-C1, увеличивается
1) радиус
2) окислительная способность
3) восстановительная способность
4) число неспаренных электронов
34. Соединения состава NaHЭO3 и NaHЭO4 может образовать
1) углерод 2) сера 3) хлор 4) фосфор
35. Наиболее сильными кислотными свойствами обладает
1) НС1О4 2) h3SO3 3) Н3РО4 4) h3SiО3
36 Соединения состава КЭО2 и КЭО3 образует элемент
1) азот 2) фосфор 3) сера 4) марганец
37. Водород проявляет окислительные свойства при реакции с
1) натрием 2) хлором 3) азотом 4) кислородом
38. Способность атомов химических элементов принимать электроны усиливается в ряду:
1)F —>O —>N
2) N —>F —>О
3) N —>O —>F
4) O —>N —>F
39. Степени окисления хлора, брома и йода в высших оксидах и водородных соединениях соответственно равны:
Степени окисления хлора, брома и йода в высших оксидах и водородных соединениях соответственно равны:
1)+1и-1 2)+7и-1 3)+7и-7 4)+5и-1
40. Сера проявляет как окислительные, так и восстановительные свойства при взаимодействии с
1) водородом и железом
2) углеродом и цинком
3) хлором и фтором
4) натрием и кислородом
41. В ряду: Si —>Р —> S —> С1
электроотрицательность элементов
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала уменьшается, потом увеличивается
42. В ряду элементов мышьяк —>селен —> бром возрастает
1) атомный радиус
2) число неспаренных электронов в атоме
3) число электронных слоев в атоме
4) электроотрицательность
43. Водородное соединение состава Н2Э2 образует
1) углерод
2) кремний
3) бор
4) азот
44. Верны ли следующие суждения о галогенах?
А. Наиболее электроотрицательным среди галогенов является иод.
Наиболее электроотрицательным среди галогенов является иод.
Б. Хлор вытесняется бромом из хлорида алюминия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
45. Кислород не реагирует с
1) водой и оксидом кальция
2) железом и оксидом фосфора (V)
3) водородом и оксидом фосфора (III)
4) сероводородом и оксидом углерода (IV)
46. Высшему гидроксиду элемента VIIA группы соответствует формула
1) Н2ЭО3 2) Н2ЭО4 3) НЭО3 4) НЭО4
47. Верны ли следующие суждения о галогенах?
А. Фтор в соединениях проявляет как положительную, так и
отрицательную степень окисления.
Б. При нормальных условиях бром и иод являются жидкостями.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
48. Водород проявляет окислительные свойства при взаимодействии с
1) натрием 2) хлором 3) азотом 4) кислородом
49. Окислительные свойства фосфор проявляет при взаимодействии с
Окислительные свойства фосфор проявляет при взаимодействии с
1) кислородом
2) магнием
3) хлором
4) серой
50. Верны ли следующие суждения о свойствах серы и хлора?
А. Максимальная валентность серы и хлора в соединениях равна номеру группы.
Б. В водородных соединениях серы и хлора связь ковалентная полярная.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
51. Фосфор проявляет окислительные свойства при реакции с
1) кальцием 2) серой 3} хлором 4) кислородом
52. При взаимодействии высшего оксида хлора с водой образуется кислота
1) НС1O 2) НС1O2 3) НСlO3 4} HClO4
53. Характерными степенями окисления хлора в его соединениях являются:
1) -1, +1, +3, +5, +7
2) — 2, +4, +6, +8
3) -3, +3, +5
4) -1, +2, +5
54. Оцените справедливость суждений о неметаллах:
А. Атомы неметалла могут участвовать в образовании как ионных,
так и ковалентных связей.
Б. Гидроксиды неметаллов имеют кислотный характер.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
55. Оцените справедливость суждений о неметаллах:
А. Чем больше заряд ядра атома, тем сильнее выражены его
неметаллические свойства.
Б. Чем сильнее выражены неметаллические свойства элемента, тем
более кислотный характер имеет его оксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
56. Оцените справедливость суждений о неметаллах:
А. В периоде с увеличением зарядов атомных ядер происходит
усиление неметаллических свойств элементов.
Б. В главной подгруппе с увеличением зарядов атомных ядер
происходит ослабление кислотных свойств гидроксидов.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
57. Кислотные свойства наиболее выражены у высшего гидроксида
Кислотные свойства наиболее выражены у высшего гидроксида
1) азота
2) фосфора
3) мышьяка
4) сурьмы
58. Только восстановительные свойства азот проявляет в соединении
1) N2
2) NНз
3) NО2
4) НNОз
59. Верны ли следующие суждения о свойствах соединений элемента, электронная конфигурация атома которого 1s22s22p6 3s2 Зр1 ?
А. Этот элемент образует гидроксид с ярко выраженными кислотными свойствами.
Б. Степень окисления этого элемента в высшем гидроксиде равна (+ 4).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Атомы и электроны, подготовка к ЕГЭ по химии
Атомно-молекулярное учение
Мы приступаем к изучению химии — мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными формулами элементов.
Атом (греч. а — отриц. частица + tomos — отдел, греч. atomos — неделимый) — электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
а — отриц. частица + tomos — отдел, греч. atomos — неделимый) — электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Протон (греч. protos — первый) — положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов элементов. Нейтрон (лат. neuter — ни тот, ни другой) — нейтральная (0) элементарная частица, присутствующая в ядрах всех химических элементов, кроме водорода.
Электрон (греч. elektron — янтарь) — стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома —
порядковый номер в таблице Менделеева — равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
Состоит из s-подуровня: одной «1s» ячейки, в которой помещаются 2 электрона (заполненный электронами — 1s2)
Состоит из s-подуровня: одной «s» ячейки (2s2) и p-подуровня: трех «p» ячеек (2p6), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s2), p-подуровня: трех «p» ячеек (3p6) и d-подуровня: пяти «d» ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s2), p-подуровня: трех «p» ячеек (4p6), d-подуровня: пяти «d» ячеек (4d10) и f-подуровня: семи «f» ячеек (4f14), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число
электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь — клеверный лист.
Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной «ячейке») не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются еще одним электроном с противоположным направлением
- Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было
бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
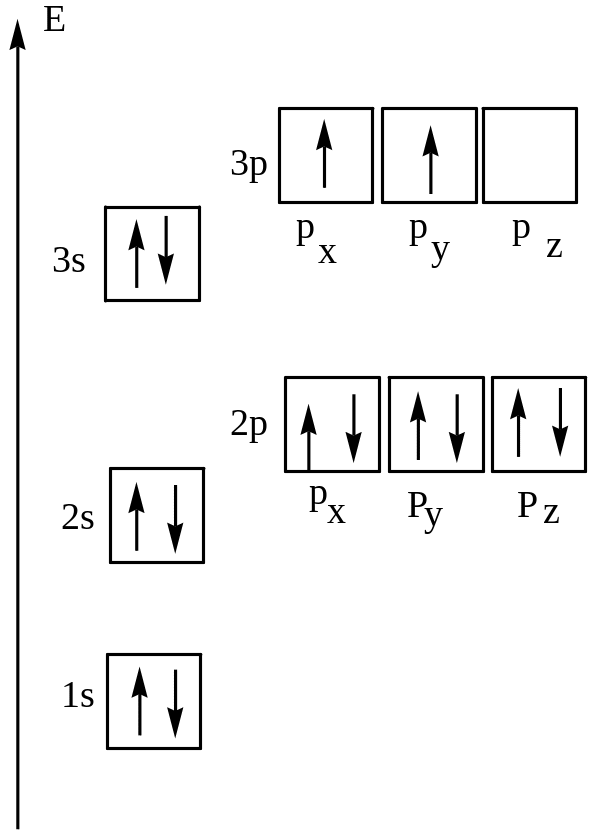
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода — 6, у серы — 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил.
А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся
одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод — 1s22s22p2
- Серы — 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне — это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод — 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью — способностью атомов образовывать определенное число химических связей.
Таким образом неспаренные валентные электроны тесно связаны с валентностью — способностью атомов образовывать определенное число химических связей.
- Углерод — 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Запишем получившиеся электронные конфигурации магния и фтора:
- Магний — 1s22s22p63s2
- Скандий — 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением — провалом электрона, которое только подтверждает общее
правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим две электронных конфигурации: первую «неправильную» (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную с учетом провала электрона.
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и сверьте с представленными ниже.
Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях.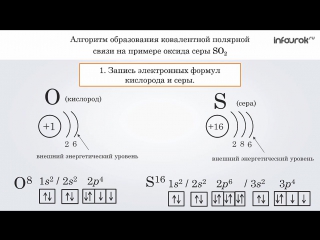 Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота, кислорода , фтора — возбужденное состояние невозможно, так как отсутствуют свободные орбитали («ячейки») — электронам некуда перескакивать, к тому же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние
связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
1.4: Электронные конфигурации и электронные орбитальные диаграммы (обзор)
Цель обучения
Рисование, интерпретация и преобразование между структурами Льюиса (Кекуле), конденсированными и линиями связи
Примечание. Обзор общей химии в разделах 1.3–1.6 интегрирован в указанную выше цель обучения по органической химии в разделах 1. 7 и 1.8.
7 и 1.8.
Электронная конфигурация атома представляет собой расположение электронов, распределенных между орбитальными оболочками и подоболочками.Обычно электронная конфигурация используется для описания орбиталей атома в его основном состоянии, но ее также можно использовать для представления атома, который ионизируется в катион или анион, компенсируя потерю или приобретение электронов в их последующих состояниях. орбитали. Многие физические и химические свойства элементов могут быть связаны с их уникальными электронными конфигурациями. Валентные электроны, электроны на самой внешней оболочке, являются определяющим фактором уникального химического состава элемента.
Введение
Перед распределением электронов атома по орбиталям необходимо ознакомиться с основными понятиями электронных конфигураций. Каждый элемент периодической таблицы состоит из атомов, которые состоят из протонов, нейтронов и электронов. Электроны обладают отрицательным зарядом и находятся вокруг ядра атома на электронных орбиталях, определяемых как объем пространства, в котором электрон может быть найден с вероятностью 95%.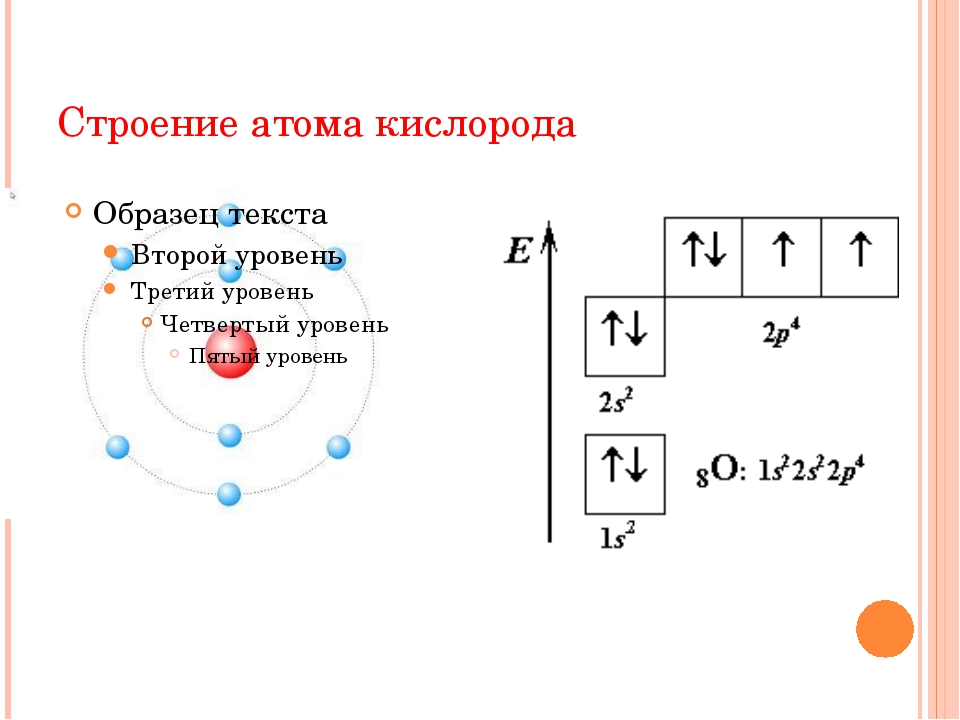 Четыре разных типа орбиталей (s, p, d и f) имеют разную форму, и одна орбиталь может содержать максимум два электрона.Орбитали p, d и f имеют разные подуровни, поэтому могут удерживать больше электронов.
Четыре разных типа орбиталей (s, p, d и f) имеют разную форму, и одна орбиталь может содержать максимум два электрона.Орбитали p, d и f имеют разные подуровни, поэтому могут удерживать больше электронов.
Как уже говорилось, электронная конфигурация каждого элемента уникальна в зависимости от его положения в периодической таблице. Энергетический уровень определяется периодом, а количество электронов определяется атомным номером элемента. Орбитали на разных энергетических уровнях похожи друг на друга, но занимают разные области в пространстве. 1s-орбиталь и 2s-орбиталь имеют характеристики s-орбитали (радиальные узлы, сферические объемные вероятности, могут содержать только два электрона и т.), но поскольку они находятся на разных энергетических уровнях, они занимают разное пространство вокруг ядра. Каждая орбиталь может быть представлена определенными блоками периодической таблицы. S-блок — это область щелочных металлов, включая гелий (группы 1 и 2), d-блок — переходные металлы (группы с 3 по 12), p-блок — основные элементы группы от 13 до 18, а f-блок — ряды лантанидов и актинидов.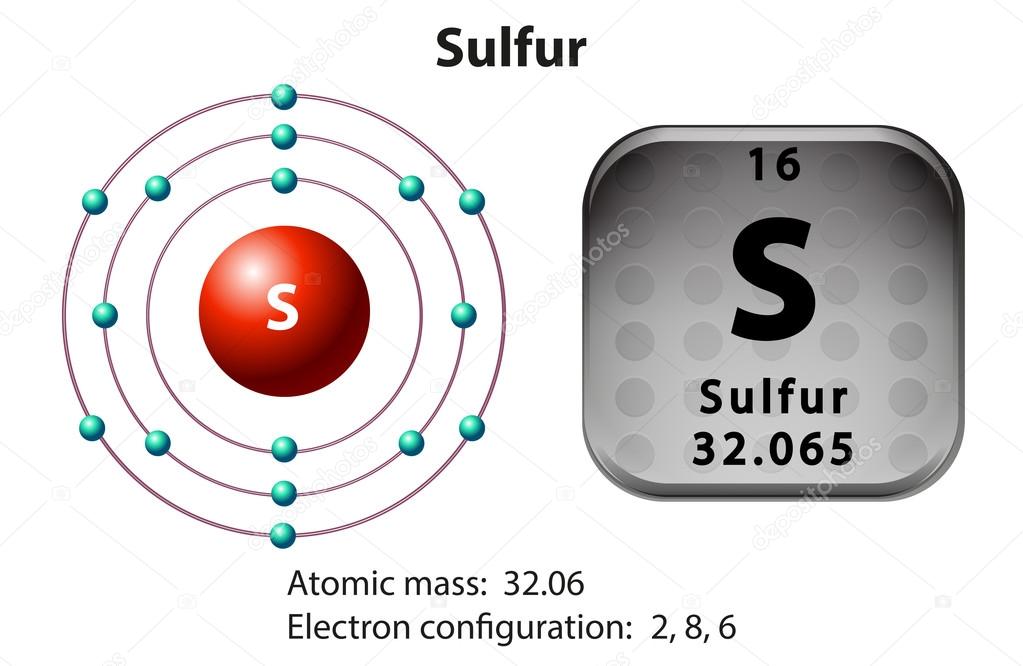
Использование периодической таблицы для определения электронных конфигураций атомов является ключевым, но также имейте в виду, что существуют определенные правила, которым необходимо следовать при назначении электронов на разные орбитали.Периодическая таблица — невероятно полезный инструмент для записи электронных конфигураций. Для получения дополнительной информации о том, как связаны электронные конфигурации и периодическая таблица, посетите модуль «Подключение электронов к периодической таблице».
Правила присвоения электронных орбиталей
Занятие орбиталей
Электроны заполняют орбитали таким образом, чтобы минимизировать энергию атома. Поэтому электроны в атоме заполняют главные энергетические уровни в порядке возрастания энергии (электроны удаляются от ядра).Порядок заполнения уровней выглядит так:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d и 7p
Один из способов запомнить эту закономерность, вероятно, самый простой, — обратиться к периодической таблице и вспомнить, куда попадает каждый орбитальный блок, чтобы логически вывести эту закономерность.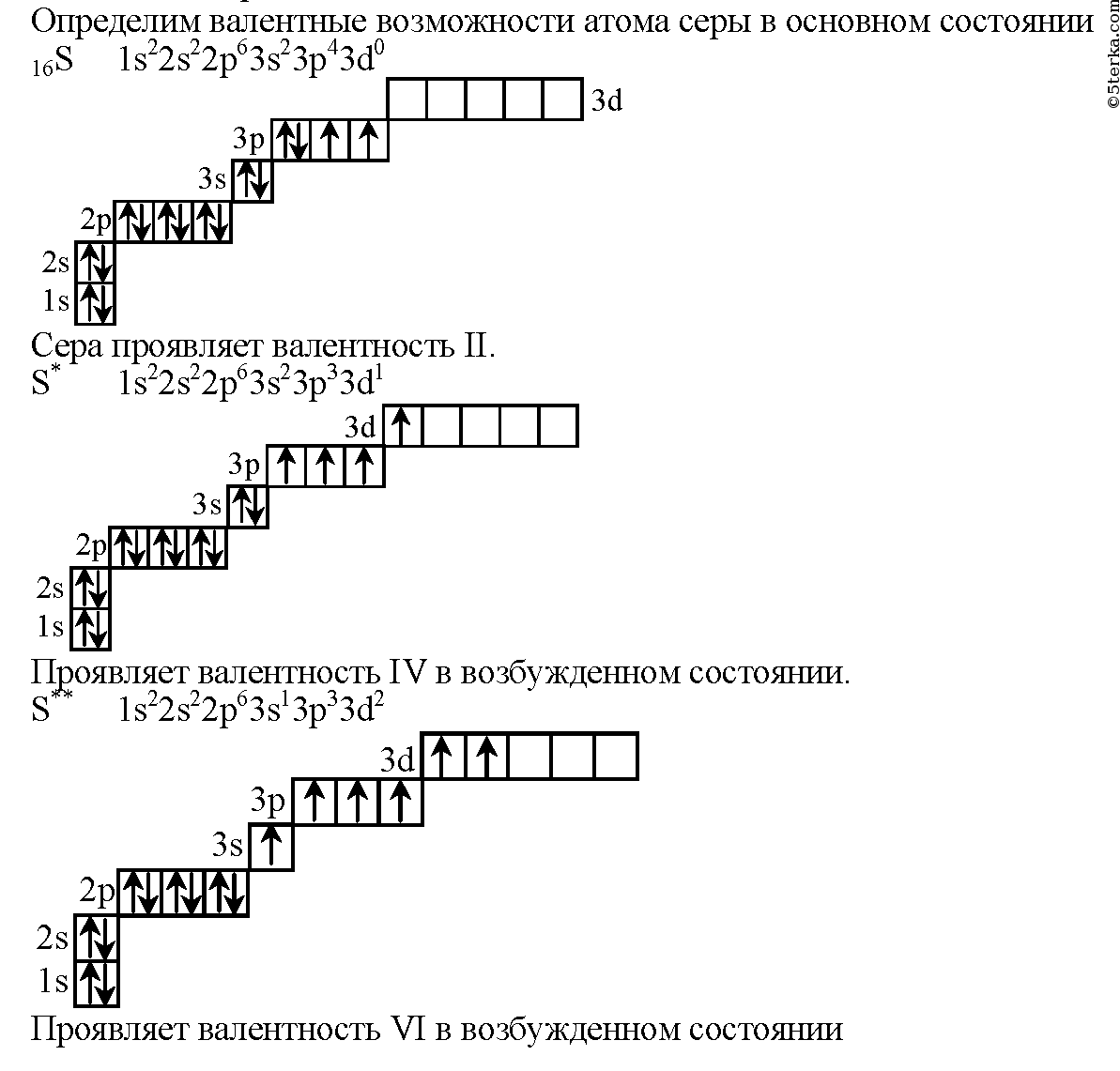 Другой способ — составить таблицу, подобную приведенной ниже, и использовать вертикальные линии, чтобы определить, какие подоболочки соответствуют друг другу.
Другой способ — составить таблицу, подобную приведенной ниже, и использовать вертикальные линии, чтобы определить, какие подоболочки соответствуют друг другу.
Принцип исключения Паули
Принцип запрета Паули гласит, что никакие два электрона не могут иметь одинаковые четыре квантовых числа.Первые три (n, l и m l ) могут быть одинаковыми, но четвертое квантовое число должно быть другим. На одной орбитали может находиться максимум два электрона, из которых должны иметь противоположных спинов; иначе у них были бы одни и те же четыре квантовых числа, что запрещено. Один электрон вращается вверх (m с = +1/2), а другой будет вращаться вниз (m с = -1/2). Это говорит нам о том, что каждая подоболочка имеет удвоенное количество электронов на орбиталь. Подоболочка s имеет 1 орбиталь, которая может содержать до 2 электронов, подоболочка p имеет 3 орбитали, которые могут содержать до 6 электронов, подоболочка d имеет 5 орбиталей, которые могут содержать до 10 электронов, а подоболочка f имеет 7 орбиталей с 14 электронами. электроны.
электроны.
Пример 1: водород и гелий
Первые три квантовых числа электрона: n=1, l=0, m l =0. Им могут соответствовать только два электрона, то есть либо m с = -1/2, либо m с = +1/2. Как мы уже знаем из наших исследований квантовых чисел и электронных орбиталей, мы можем заключить, что эти четыре квантовых числа относятся к подоболочке 1s. Если задано только одно из значений m s , то мы получим 1s 1 (обозначая водород), если даны оба, мы получим 1s 2 (обозначив гелий).Визуально это будет представлено как:
Как показано, подоболочка 1s может содержать только два электрона, и когда она заполнена, электроны имеют противоположные спины.
Правило Хунда
При назначении электронов на орбитали каждый электрон сначала заполняет все орбитали с одинаковой энергией (также называемой вырожденной), прежде чем спариться с другим электроном на наполовину заполненной орбитали. Атомы в основном состоянии имеют как можно больше неспаренных электронов. Визуализируя эти процессы, подумайте о том, как электроны ведут себя так же, как те же полюса магнита, если бы они вступили в контакт; поскольку отрицательно заряженные электроны заполняют орбитали, они сначала пытаются удалиться как можно дальше друг от друга, прежде чем им придется соединиться.
Атомы в основном состоянии имеют как можно больше неспаренных электронов. Визуализируя эти процессы, подумайте о том, как электроны ведут себя так же, как те же полюса магнита, если бы они вступили в контакт; поскольку отрицательно заряженные электроны заполняют орбитали, они сначала пытаются удалиться как можно дальше друг от друга, прежде чем им придется соединиться.
Пример 2: кислород и азот
Если мы посмотрим на правильную электронную конфигурацию атома азота (Z = 7), очень важного элемента в биологии растений: 1s 2 2s 2 2p 3
Мы можем ясно видеть, что p-орбитали заполнены наполовину, так как есть три электрона и три p-орбитали. Это связано с тем, что правило Хунда гласит, что три электрона в подоболочке 2p сначала заполнят все пустые орбитали, а затем заполнят орбитали электронами.Если мы посмотрим на элемент после азота в тот же период, кислород (Z = 8), его электронная конфигурация будет: 1s 2 2s 2 2p 4 (для атома).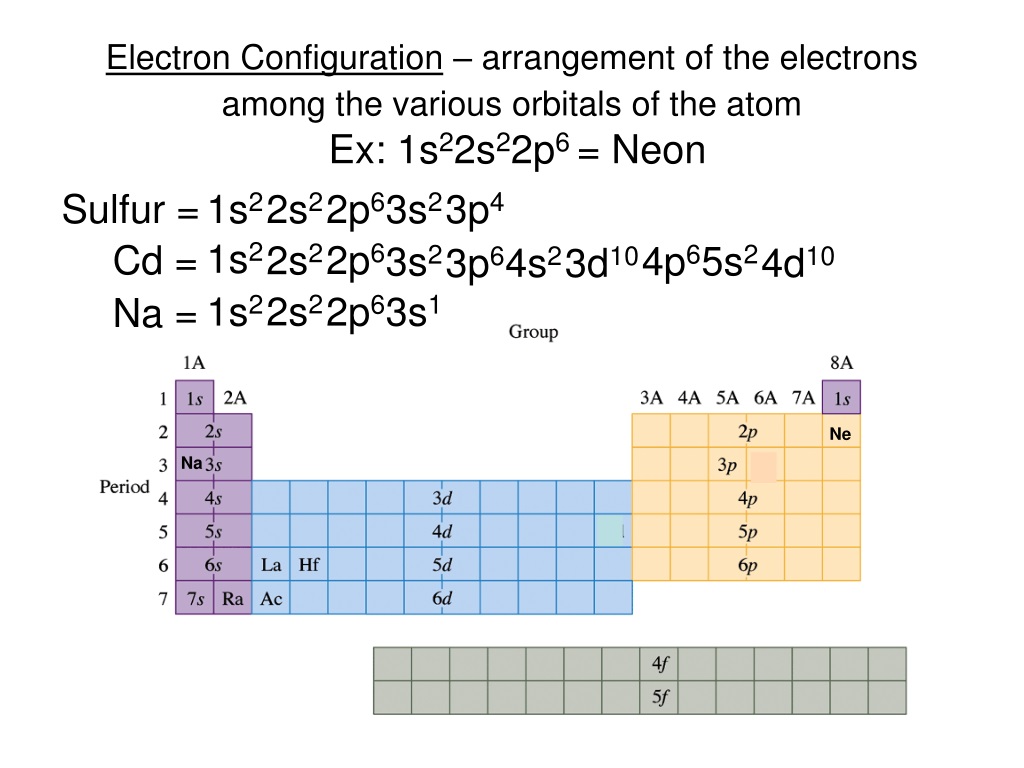
У кислорода на один электрон больше, чем у азота, и, поскольку все орбитали заполнены наполовину, электрон должен спариться.
Процесс Ауфбау
Aufbau происходит от немецкого слова «aufbauen», означающего «строить». При записи электронных конфигураций орбитали строятся от атома к атому.При записи электронной конфигурации атома орбитали заполняются в порядке возрастания атомного номера. Однако есть некоторые исключения из этого правила.
Пример 3: 3 элемента строки rd
В соответствии с закономерностью в периоде от B (Z=5) до Ne (Z=10) количество электронов увеличивается, и подоболочки заполняются. В этом примере основное внимание уделяется подоболочке p, которая заполняется от бора до неона.
- B (Z=5) конфигурация: 1s 2 2s 2 2p 1
- C (Z=6) конфигурация: 1s 2 2s 2 2p 2
- N (Z=7) конфигурация: 1s 2 2s 2 2p 3
- O (Z=8) конфигурация: 1s 2 2s 2 2p 4
- F (Z=9) конфигурация: 1s 2 2s 2 2p 5
- Ne (Z=10) конфигурация: 1s 2 2s 2 2p 6
Пример
Электронная конфигурация серы: 1s 2 2s 2 2p 6 3s 2 3p 4 и может быть представлена с помощью приведенной ниже орбитальной диаграммы.
Упражнения
Напишите электронную конфигурацию фосфора и начертите орбитальную диаграмму.
Решение:
Электронная конфигурация фосфора: 1s 2 2s 2 2p 6 3s 2 3p 3 , а орбитальная диаграмма приведена ниже.
Электрон Конфигурации атомов
Электронная конфигурация атома показывает количество электронов на каждом подуровне на каждом энергетическом уровне атома в основном состоянии.Чтобы определить электронную конфигурацию конкретного атома, начните с ядра и добавляйте электроны один за другим, пока число электронов не сравняется с числом протонов в ядре. Каждый добавленный электрон присваивается наинизшему из доступных подуровней энергии. Первым заполненным подуровнем будет подуровень 1s, затем подуровень 2s, подуровень 2p, подуровень 3s, 3p, 4s, 3d и так далее. Этот порядок трудно запомнить и часто трудно определить по диаграммам уровней энергии, таким как рис. 5.8.
5.8.
Более удобный способ запомнить порядок — использовать рисунок 5.9. Основные энергетические уровни перечислены в столбцах, начиная слева с уровня 1s. Чтобы использовать этот рисунок, читайте по диагональным линиям в направлении стрелки. Порядок суммирован под диаграммой.
| РИСУНОК 5.9 Стрелка показывает второй способ запоминания порядка заполнения подуровней. |
Атом водорода (атомный номер 1) имеет один протон и один электрон. Один электрон соответствует подуровне 1s, подуровню с самой низкой энергией на уровне с самой низкой энергией.Поэтому электронная конфигурация водорода записывается:
Для гелия (атомный номер 2), который имеет два электрона, электронная конфигурация:
Он: 1с 2
Два электрона полностью заполняют первый энергетический уровень. Поскольку ядро гелия отличается от ядра водорода, ни один из электронов гелия не будет иметь точно такую же энергию, как один электрон водорода, даже если все они находятся на подуровне 1s. Элемент литий (атомный номер 3) имеет три электрона. Чтобы записать его электронную конфигурацию, мы должны сначала определить (из рис. 5.9), что подуровень 2s является следующим по энергии после подуровня 1s. Следовательно, электронная конфигурация лития:
Элемент литий (атомный номер 3) имеет три электрона. Чтобы записать его электронную конфигурацию, мы должны сначала определить (из рис. 5.9), что подуровень 2s является следующим по энергии после подуровня 1s. Следовательно, электронная конфигурация лития:
Ли: 1 с 2 2 с 1
Бор (атомный номер 5) имеет пять электронов. Четыре электрона заполняют как 1s, так и 2s-орбитали.Пятый электрон добавляется к 2р-орбитали, следующему по энергии подуровню (рис. 5.9). Электронная конфигурация бора:
B: 1с 2 2с 2 2п 1
В таблице 5.2 показаны электронные конфигурации элементов с атомными номерами от 1 до 18. Электронные конфигурации элементов с более высокими атомными номерами можно записать, следуя диаграмме заполнения орбит на рисунке 5.9.
| Элемент | Атомный номер | Электронная конфигурация |
|---|---|---|
| водород | 1 | 1с 1 |
| гелий | 2 | 1с 2 |
| литий | 3 | 1 с 2 2 с 1 |
| бериллий | 4 | 1 с 2 2 с 2 |
| бор | 5 | 1с 2 2с 2 2п 1 |
| уголь | 6 | 1с 2 2с 2 2п 2 |
| азот | 7 | 1с 2 2с 2 2п 3 |
| кислород | 8 | 1с 2 2с 2 2п 4 |
| фтор | 9 | 1с 2 2с 2 2п 5 |
| неон | 10 | 1с 2 2с 2 2п 6 |
| натрий | 11 | 1s 2 2s 2 2p 6 3s 1 |
| магний | 12 | 1s 2 2s 2 2p 6 3s 2 |
| алюминий | 13 | 1с 2 2с 2 2п 6 3с 2 3п 1 |
| кремний | 14 | 1с 2 2с 2 2п 6 3с 2 3п 2 |
| фосфор | 15 | 1с 2 2с 2 2п 6 3с 2 3п 3 |
| сера | 16 | 1с 2 2с 2 2п 6 3с 2 3п 4 |
| хлор | 17 | 1с 2 2с 2 2п 6 3с 2 3п 5 |
| аргон | 18 | 1с 2 2с 2 2п 6 3с 2 3п 6 |
А. Блок-схемы электронной конфигурации
Блок-схемы электронной конфигурации
Если атом имеет частично заполненный подуровень, может быть важно знать, как
электроны этого подуровня распределены по орбиталям. Исследовательская работа
показал, что неспаренные электроны (один электрон на орбитали) находятся в
более низкая энергетическая конфигурация, чем у спаренных электронов (два электрона на орбитали).
Энергия электронов на подуровне была бы тогда ниже с наполовину заполненным
орбиталей, чем с некоторыми заполненными и некоторыми пустыми.Мы можем показать распределение
электронов с помощью блочных диаграмм, где каждый блок представляет
орбиталь, а стрелки внутри прямоугольников представляют электроны на этой орбитали.
Направление стрелки представляет спин электрона. (Напомним из
Раздел 5.3B, что два электрона на орбите вращаются в противоположных направлениях на
их осей.) Следовательно, если орбиталь содержит два электрона, ее ящик будет содержать
две стрелки, одна вверх, другая вниз.
Используя блочную диаграмму, мы показываем электронную конфигурацию азота как:
Обратите внимание, что электроны 2p показаны как
скорее, чем
это означало бы, что из трех p-орбиталей одна заполнена, одна заполнена наполовину и одна пуста.
электронных конфигураций
электронных конфигурацийСледующее содержание является содержанием Лекции по общей химии 26.В этой лекции мы продолжаем обсуждение квантовых чисел и их использования в электронных конфигурациях, а также связь электронной конфигурации с периодическими свойствами элементов.
Электронная конфигурация
Конфигурации электронов — это сводка того, где электроны находятся вокруг ядра. Как мы узнали ранее, каждый нейтральный атом имеет количество электронов, равное количеству его протонов. Теперь мы поместим эти электроны в такое расположение вокруг ядра, которое укажет на их энергию и форму орбитали, на которой они расположены. Вот краткое описание типов орбиталей и количества электронов, которые каждая из них может содержать:
Вот краткое описание типов орбиталей и количества электронов, которые каждая из них может содержать:
Итак, основываясь на том, что мы знаем о квантовых числах, и используя приведенную выше таблицу, вам нужно 2 электрона, чтобы заполнить s-орбиталь, 6 электронов, чтобы заполнить p-орбиталь, 10 электронов, чтобы заполнить d-орбиталь, и 14 электронов, чтобы заполнить f-орбиталь. НО то, что мы не обсуждали, так это то, как эти орбитали заполняются… порядок заполнения.
Порядок заполнения
Порядок, в котором электроны размещаются на орбиталях, основан на порядке их энергии.Это называется принципом Ауфбау. Первыми заполняются самые низкоэнергетические орбитали. Как и сами квантовые числа, этот порядок был определен расчетным путем и представлен в следующей таблице:
.или вы можете просто использовать таблицу Менделеева:
Как написать электронную конфигурацию
Символы, используемые для записи электронной конфигурации, начинаются с номера оболочки (n), за которым следует тип орбитали, и, наконец, верхний индекс указывает, сколько электронов находится на орбитали.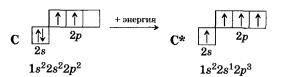
Например:
Глядя на периодическую таблицу, вы видите, что кислород имеет 8 электронов. Основываясь на приведенном выше порядке заполнения, эти 8 электронов заполнили бы следующий порядок 1s, 2s и затем 2p. Таким образом, электронная конфигурация кислорода будет O 1s 2 2s 2 2p 4 .
Особые случаи
Конфигурации ионов представляют собой частный случай электронной конфигурации, а также в первую очередь демонстрируют причину образования этих ионов.
Если вам нужно записать полную электронную конфигурацию для аниона , то вы просто добавляете дополнительные электроны, и конфигурация просто продолжается.
Например, мы знаем, что кислород всегда образует 2-ионы, когда он образует ион. Это добавит 2 электрона к его нормальной конфигурации, создав новую конфигурацию: O 2- 1s 2 2s 2 2p 6 . Следует отметить, что с 10 электронами электронная конфигурация кислорода теперь точно такая же, как у неона.Мы говорили о том, что ионы образуются, потому что они могут стать более стабильными с присоединением или потерей электронов, чтобы стать похожими на благородные газы, и теперь вы можете увидеть, как они становятся такими же.
Следует отметить, что с 10 электронами электронная конфигурация кислорода теперь точно такая же, как у неона.Мы говорили о том, что ионы образуются, потому что они могут стать более стабильными с присоединением или потерей электронов, чтобы стать похожими на благородные газы, и теперь вы можете увидеть, как они становятся такими же.
Электронные конфигурации катионов также основаны на количестве электронов, но есть небольшая разница в способе их конфигурации. Сначала вы должны написать их нормальную электронную конфигурацию, а затем, когда вы удаляете электроны, вы должны брать их с самой внешней оболочки.Обратите внимание, что это не всегда тот же способ, которым они были добавлены.
Вот пример того, что я имею в виду:
У железа есть 26 электронов, поэтому его нормальная конфигурация электронов будет: Fe 1S 2 2S 2 2P 6 3S 2 3P 6 4S 2 3D 6
Когда мы создаем ион 3+ для железа, нам нужно сначала взять электроны из самой внешней оболочки, чтобы это была оболочка 4s, а не оболочка 3d: Fe 3+ 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5
Еще одно замечание по записи электронных конфигураций: короткий путь. При написании некоторых конфигураций нижних таблиц общая конфигурация может быть довольно длинной. В этих случаях вы можете использовать предыдущий благородный газ для сокращения конфигурации, как показано ниже. Вам просто нужно закончить конфигурацию, откуда выходит благородный газ:
При написании некоторых конфигураций нижних таблиц общая конфигурация может быть довольно длинной. В этих случаях вы можете использовать предыдущий благородный газ для сокращения конфигурации, как показано ниже. Вам просто нужно закончить конфигурацию, откуда выходит благородный газ:
Исключения
Как и в случае с любой другой темой, которую мы рассмотрели на сегодняшний день, существуют исключения в порядке заполнения. Но, исходя из генерируемых электронных конфигураций, эти исключения легко понять.
В блоке d, особенно в группах, содержащих хром и медь, есть исключение в том, как они заполняются.
Вот актуальные конфигурации:
В этих столбцах 4s и 3d
Практика, практика, практика
Здесь есть множество викторин по электронным конфигурациям, с которыми вы можете попрактиковаться
Орбитальные диаграммы
Еще один способ представить порядок заполнения атома — использовать орбитальную диаграмму, которую часто называют «маленькими квадратиками»:
Прямоугольники используются для представления орбиталей и для отображения размещенных на них электронов. Порядок заполнения тот же, но, как вы можете видеть сверху, электроны помещаются в ящики по одному, прежде чем заполнить их обоими электронами. Это называется правилом Хунда: «Заполните наполовину, прежде чем заполнить полностью», и снова это правило было установлено на основе расчетов энергии, которые показали, что именно так атомы фактически распределяют свои электроны по орбиталям.
Порядок заполнения тот же, но, как вы можете видеть сверху, электроны помещаются в ящики по одному, прежде чем заполнить их обоими электронами. Это называется правилом Хунда: «Заполните наполовину, прежде чем заполнить полностью», и снова это правило было установлено на основе расчетов энергии, которые показали, что именно так атомы фактически распределяют свои электроны по орбиталям.
Периодические свойства
Одна из действительно интересных особенностей электронных конфигураций — их связь с периодической таблицей.В основном периодическая таблица была построена таким образом, чтобы элементы с одинаковыми электронными конфигурациями были выровнены в одни и те же группы (столбцы).
Периодическая таблица, показывающая последнюю заполненную орбиту для каждого элемента
Периодическая таблица, показанная выше, демонстрирует, как конфигурация каждого элемента была выровнена так, чтобы последняя заполненная орбиталь была такой же, за исключением оболочки. Причина, по которой это было сделано, заключается в том, что конфигурация элемента придает элементу его свойства, а аналогичные конфигурации дают аналогичные свойства.
Причина, по которой это было сделано, заключается в том, что конфигурация элемента придает элементу его свойства, а аналогичные конфигурации дают аналогичные свойства.
Давайте рассмотрим некоторые периодические свойства, на которые напрямую влияет электронная конфигурация:
Размер атома
Размер атомов увеличивается вниз по таблице Менделеева. Это должно быть интуитивно понятно, поскольку с каждой строкой таблицы вы добавляете оболочку (n). Что не так интуитивно понятно, так это то, почему размер уменьшается слева направо. Но опять же построение электронной конфигурации дает нам ответ.Что вы делаете, просматривая периодическую таблицу? Ответить, добавляя протоны к ядру и добавляя электроны к валентной оболочке элемента. Что не меняется, когда вы пересекаете период? Ответ: электроны внутренней оболочки. Подумайте об этом так: электроны внутренней оболочки являются защитой от притяжения ядра. Так, например, сила притяжения Sulphur будет равна Z Eff = 16 — 10 = +6 |
Электроотрицательность
Электроотрицательность может быть самым важным из периодических свойств, которые вы можете изучить и понять, так как многие другие свойства зависят от его значения.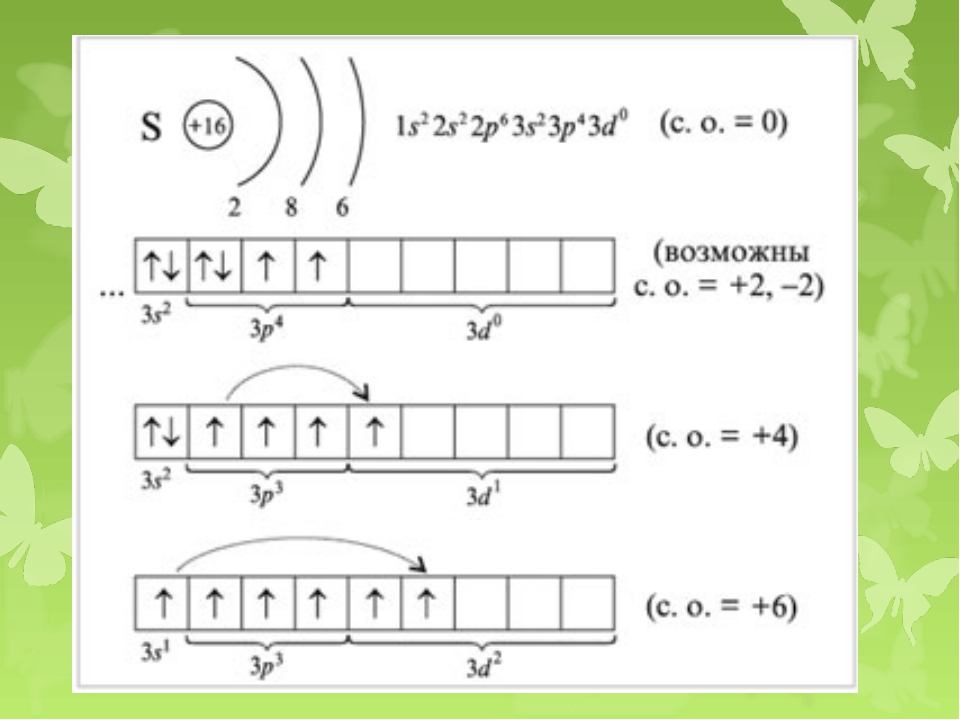 Электроотрицательность — это способность атомов притягивать к себе электроны.
Электроотрицательность — это способность атомов притягивать к себе электроны.
Электроотрицательность обычно выражается по шкале Полинга, и значения были определены экспериментально. В таблице ниже показаны значения шкалы для элементов.
Значения электроотрицательности увеличиваются слева направо и снизу вверх в периодической таблице, за исключением благородных газов. Наиболее электроотрицательным элементом является фтор.
Из этих значений электроотрицательности мы можем вывести модели двух других периодических свойств: энергии ионизации и сродства к электрону.
Энергия ионизации Энергия ионизации — это количество энергии, необходимое для отрыва электрона от атома. Все энергии ионизации являются положительными значениями, потому что все эти удаления (даже для элементов, образующих положительные ионы) требуют ввода энергии. Чем более электроотрицательный элемент, тем выше энергия ионизации. | |
Электронное сродствоЭлектронное сродство элемента — это количество энергии, полученное или высвобожденное при добавлении электрона.{4} . \begin{equation} \begin{array}{l}{\text { a. На что указывает верхний индекс } 6 \text {? }} \\ {\ текст { б. Что означает буква } s \ text {? }} \\ {\ текст { с. Что означает коэффициент 3? }}\end{массив} \end{уравнение} Стенограмма видео Объяснение решения мертво. Сера имеет атомный номер 16 и массовое число 32. Это означает, что она имеет 16 протонов, 16 электронов и 16 нейтронов в качестве атомного номера. Представляют собой количество электронов и протонов, тогда как разница между марсианским числом и атомным номером представляет собой количество нейтронов в сере.16 электронов заполняют три энергетических уровня или продают. Продайте один или K имеет два электрона. Продайте два или L имеет шесть электронов и продайте три, или M имеет шесть электронов. Атомная структура и электронная конфигурацияЕсли вы считаете, что контент, доступный с помощью Веб-сайта (как это определено в наших Условиях обслуживания), нарушает одно или более ваших авторских прав, пожалуйста, сообщите нам, предоставив письменное уведомление («Уведомление о нарушении»), содержащее в информацию, описанную ниже, назначенному агенту, указанному ниже. Если университетские наставники примут меры в ответ на ан Уведомление о нарушении, он предпримет добросовестную попытку связаться со стороной, предоставившей такой контент средства самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors. Ваше Уведомление о нарушении может быть направлено стороне, предоставившей контент, или третьим лицам, таким как
в виде
ChillingEffects. Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатов), если вы существенно искажать информацию о том, что продукт или деятельность нарушают ваши авторские права. Таким образом, если вы не уверены, что содержимое находится на Веб-сайте или на который ссылается Веб-сайт, нарушает ваши авторские права, вам следует сначала обратиться к адвокату. Чтобы подать уведомление, выполните следующие действия: Вы должны включить следующее: Физическая или электронная подпись владельца авторских прав или лица, уполномоченного действовать от его имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, как вы утверждаете, нарушает ваши авторские права, в \
достаточно подробно, чтобы преподаватели университета могли найти и точно идентифицировать этот контент; например, мы требуем
а
ссылку на конкретный вопрос (а не только название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. Отправьте жалобу нашему назначенному агенту по адресу: Чарльз Кон
Varsity Tutors LLC Или заполните форму ниже:
Произошла ошибка при настройке пользовательского файла cookie Этот сайт использует файлы cookie для повышения производительности. Настройка браузера на прием файлов cookieСуществует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
Почему этому сайту требуются файлы cookie?Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня. Что сохраняется в файле cookie?Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется. Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Сколько валентных электронов имеет сера (S)? [Валентность серы]Сера , химическое вещество элемент с символом S и атомным номером 16, является десятым и пятым по величине. общий элемент по массе во вселенной и на земле соответственно.В норме атомы серы при температуре и давлении образуют циклическую восьмиатомную молекулу (хим. формула S8). Сера является очень важным элементом с обеих точек зрения: биологической и химической. Это очень важно компонент всех живых клеток, а также является основным компонентом белков, ферментов, витамины, аминокислоты, цистеин и т. д., которые показывают его биологическую важность. Элементарная сера
используется как 85% производства короля соединений h3SO4 не только это многие крупные компании
соединения типа SO2, h3S получают с помощью элементарной серы, которая
показывает его химическое значение. Вы здесь, чтобы знаете валентные электроны атома серы, не так ли? Не волнуйся вместе с серой валентных электронов мы объясним и его валентность. Но перед этим давайте некоторые основные идеи о том, что эти два термина: Разница между Валентные электроны и валентностьВалентные электроны общее количество электронов, присутствующих на внешней оболочке атома (т.е. на самой внешней орбите). Валентные электроны нейтрального атома равны всегда определена, она не может изменяться (более или менее) ни при каких условиях для конкретного атома и может быть или не быть равным его валентности. Валентность определена
как общее количество электронов, атом может потерять, приобрести или разделить в то время
образования связи, чтобы получить стабильную электронную конфигурацию, т.е.
октет. Валентность атома может быть разной в разных соединениях или
химические реакции из-за различных условий соединения. Большую часть времени
валентность меняется/изменяется из-за изменения степеней окисления и восстановления. Сера (S) Валентность ЭлектроныЕсть четыре простые шаги, чтобы узнать валентные электроны для атома серы, которые: Шаг 1. Найдите Атомный номер Чтобы узнать атомный номер серы, мы можем использовать периодическую таблицу.С помощью периодической таблицы, мы можем легко увидеть, что атомный номер серы равен 16. Поскольку его атомный номер 16, он имеет 16 протонов, а для нейтральной серы число протонов всегда равно числу электронов, т.е. имеет 16 электронов в его ядро. Шаг 2: Напишите Электронная конфигурация Электрон конфигурация – это расположение электронов на орбиталях. Атом серы имеет в общей сложности 16 электронов, поэтому мы должны поместить 16 электронов на орбитали.То электроны будут размещены на разных орбиталях в зависимости от энергетического уровня: [1с, 2с, 2п, 3с, 3п, 4с, 3д, 4п, 5с, 4д, 5п, 6с, 4ж, 5д, 6п, 7с, 5ф]. Сейчас Серный электрон
конфигурация S (16) = 1s 2 2s 2 2p 6 3s 2 3p 4 (полный
конфигурация). = [Ne]3s²3p⁴ (сокращенная конфигурация). Шаг 3: Определите Валенс Шелл Как известно, валентную оболочку атома можно найти по наибольшему числу принципиальных квантовые числа, которые выражаются через n и [Ne]3s²3p⁴, наибольшее значение n равно 3, так что валентная оболочка серы равна 3s²3p⁴. Шаг 4: Найдите Валентные электроны Общее количество электроны, находящиеся на валентной оболочке атома, называются валентными электронами, и всего шесть электронов присутствуют в валентной оболочке серы (3s²3p⁴). Таким образом, сера имеет шесть валентных электронов. Читайте также: Валентность серы (S) Есть много
различные способы узнать валентность атома, которая отражает способность
атом для связи с другими атомами.Валентность описывает, насколько легко атом или
свободный радикал может сочетаться с другими химическими видами. Валентность атома
определяется на основе количества электронов, потерянных, полученных или разделенных с
другого атома в момент образования связи. Говорят, что атом быть стабильным, когда его самые внешние оболочки имеют восемь электронов (кроме H и He). Если общее количество электронов на самых внешних оболочках составляет от одного до четырех, атом имеет положительную валентность, и если электронов от четырех до восьми, валентность рассчитывается путем вычитания из восьми, и валентность будет равна нулю.Атомы наличие четырех крайних электронов имеет как положительную, так и отрицательную валентность, и атомы, имеющие восемь крайних электронов, валентность будет равна нулю (т.е. благородному газы). Элементы, такие как сера может достичь стабильного состояния (ближайшая конфигурация инертного газа: Ar), получив 2 электроны. Так что валентность серы равна 2, .Математически электронная конфигурация серы 2, 8, 6. А как мы знаем, если электроны в самая внешняя оболочка превышает 4, ее следует вычесть из 8.Итак, Электрон Конфигурация серы (S) = 2, 8, 6 Мы можем видеть внешний
большая часть оболочки серы имеет 6 электронов, поэтому ее нужно вычесть из 8. 8 – 6 = 2 Вот почему валентность серы 2. Примечание: Обычно сера имеет стабильную степень окисления -2 в большинстве соединений, но она варьируется от от -2 до +6 в разных соединениях из-за разной стабильности связи и формирование. Не путайте с -2 или еще с чем-то положительным или отрицательным знаки, это просто степень окисления, которая может варьироваться от соединения к соединению.Но его валентность всегда равна 2 в любом случае. В другом смысле атом серы может образовывать максимум 2 ковалентные связи в химической связи (например: CS2, h3S и др.), и что такое валентность, максимальная способность к образованию связей с атомами во время химических реакций. Мы также можем найти валентность серы с помощью таблицы Менделеева. Так как сера принадлежит группа 16 (6A или VIA) вместе с кислородом (O), мышьяком (As) и селеном (Se), теллуром (Te), полоний (Po) и ливерморий (Lv).Элементы этой группы также называются халькогенами. Все эти элементы имеют валентность 2, . |
 2 Электронные конфигурации первых 18 элементов
2 Электронные конфигурации первых 18 элементов Когда вы пересекаете период и увеличиваете количество протонов в ядре, вы увеличиваете его притяжение, но поскольку вы только добавляете электроны в новую оболочку, экран не увеличивается, а остается неизменным на всем протяжении.Это означает, что притяжение электронов, добавляемых к валентной оболочке, неуклонно увеличивается на всем протяжении. Что произойдет, если вы потянете электроны сильнее? Ну, они приближаются к ядру и размер атома уменьшается. Эффект притяжения ядра на электроны, добавляемые через период, называется эффективным зарядом ядра и рассчитывается как Z Eff = #протонов — Ядро # Электронов.
Когда вы пересекаете период и увеличиваете количество протонов в ядре, вы увеличиваете его притяжение, но поскольку вы только добавляете электроны в новую оболочку, экран не увеличивается, а остается неизменным на всем протяжении.Это означает, что притяжение электронов, добавляемых к валентной оболочке, неуклонно увеличивается на всем протяжении. Что произойдет, если вы потянете электроны сильнее? Ну, они приближаются к ядру и размер атома уменьшается. Эффект притяжения ядра на электроны, добавляемые через период, называется эффективным зарядом ядра и рассчитывается как Z Eff = #протонов — Ядро # Электронов. 
 Электронная конфигурация серы один, как нам два p шесть, три года два и три p. Четыре. Теперь мы подошли к решению для части A. Здесь, в соответствии с электронной конфигурацией атома серы, нижний индекс шесть означает, что шесть электронов присутствуют на орбитали P вне второй части B. Буква относится к орбитали с нулевым угловым моментом. квантовое число, равное нулю.Энергия вне s-орбитали меньше, чем у соответствующего типа внеорбитальной s-орбитали, имеет немного меньшую энергию, чем у соответствующих P D F и G-орбиталей для части, см. коэффициент. Три. Обратитесь к энергетическому уровню или ячейке с главным Квантом номер три. Это равный палец, который является равным пальцем. Три. Так что это было объяснение. Ответ. Давайте посмотрим еще раз. Сера имеет атомный номер 16. Массовое число 32. Это означает, что она имеет 16 протонов, 16 электронов и 16 нейтронов.Поскольку атомный номер представляет собой количество электронов и протонов, тогда как разница между номером мечети и атомным номером представляет собой количество нейтронов в сере.
Электронная конфигурация серы один, как нам два p шесть, три года два и три p. Четыре. Теперь мы подошли к решению для части A. Здесь, в соответствии с электронной конфигурацией атома серы, нижний индекс шесть означает, что шесть электронов присутствуют на орбитали P вне второй части B. Буква относится к орбитали с нулевым угловым моментом. квантовое число, равное нулю.Энергия вне s-орбитали меньше, чем у соответствующего типа внеорбитальной s-орбитали, имеет немного меньшую энергию, чем у соответствующих P D F и G-орбиталей для части, см. коэффициент. Три. Обратитесь к энергетическому уровню или ячейке с главным Квантом номер три. Это равный палец, который является равным пальцем. Три. Так что это было объяснение. Ответ. Давайте посмотрим еще раз. Сера имеет атомный номер 16. Массовое число 32. Это означает, что она имеет 16 протонов, 16 электронов и 16 нейтронов.Поскольку атомный номер представляет собой количество электронов и протонов, тогда как разница между номером мечети и атомным номером представляет собой количество нейтронов в сере.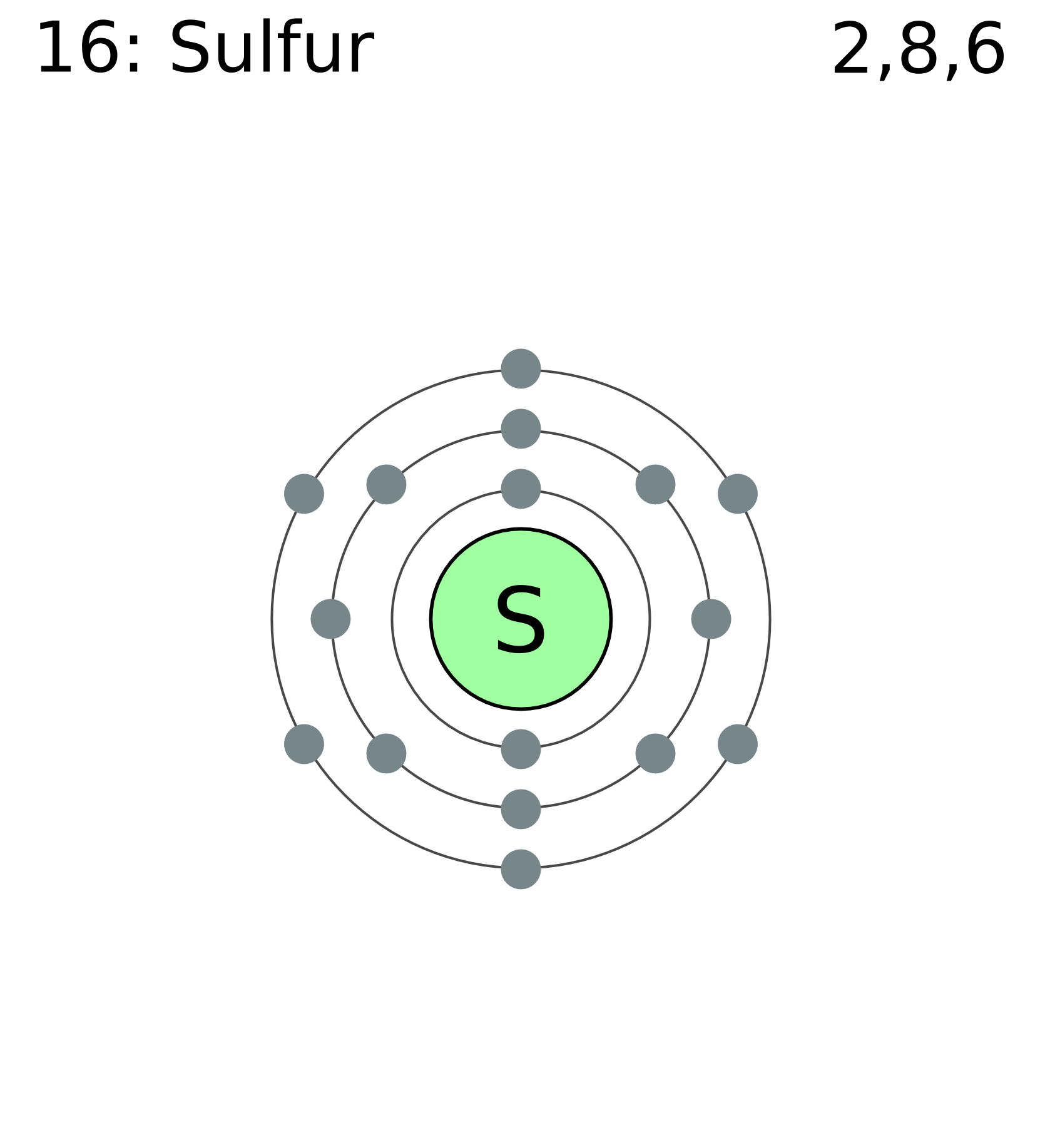 16 электронов заполняют три энергетических уровня или продают. Продайте один или K имеет два электрона. Продайте два или L имеет шесть электронов и продайте три, или M имеет шесть электронов. Конфигурация Die Elektronik серы составляет от одного до двух лет до двух и трех лет до двух и трех лет. Четыре для этого решения от варианта, что для части А, которая в соответствии с конфигурацией электронов от атома серы индекс шесть представляют долг.Шесть электронов присутствуют на P-орбиталях второй ячейки. Для части B. Буква относится к орбитали с нулевым квантовым числом углового момента, которое равно нулю. Энергия off s орбитали меньше, чем у off соответствующего типа off орбиталь, так как орбитальные стрелки имеют несколько меньшую энергию, чем соответствующие P. D f и G орбитали для партии с коэффициентом три реки на энергетический уровень, от клетки с главной Квант номер три, который равен трем и равен трем. Итак, это полное объяснение решения в деталях.Пожалуйста, пройдите через это.
16 электронов заполняют три энергетических уровня или продают. Продайте один или K имеет два электрона. Продайте два или L имеет шесть электронов и продайте три, или M имеет шесть электронов. Конфигурация Die Elektronik серы составляет от одного до двух лет до двух и трех лет до двух и трех лет. Четыре для этого решения от варианта, что для части А, которая в соответствии с конфигурацией электронов от атома серы индекс шесть представляют долг.Шесть электронов присутствуют на P-орбиталях второй ячейки. Для части B. Буква относится к орбитали с нулевым квантовым числом углового момента, которое равно нулю. Энергия off s орбитали меньше, чем у off соответствующего типа off орбиталь, так как орбитальные стрелки имеют несколько меньшую энергию, чем соответствующие P. D f и G орбитали для партии с коэффициентом три реки на энергетический уровень, от клетки с главной Квант номер три, который равен трем и равен трем. Итак, это полное объяснение решения в деталях.Пожалуйста, пройдите через это. Благодарим Вас за отправку исправленного варианта.
Благодарим Вас за отправку исправленного варианта. org.
org.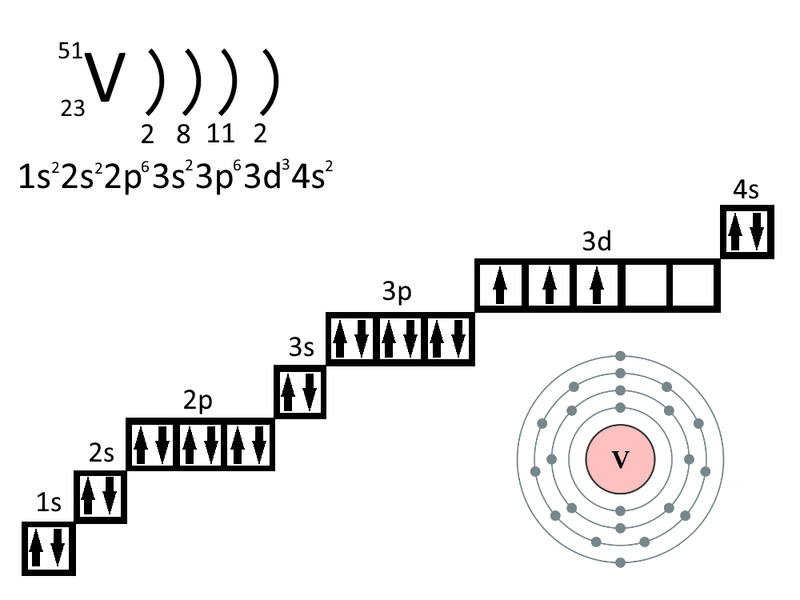 д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Заявление от вас: (а) что вы добросовестно полагаете, что использование контента, который, как вы утверждаете, нарушает
ваши авторские права не разрешены законом или владельцем авторских прав или его агентом; б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владельцем авторских прав, либо лицом, уполномоченным действовать от их имени.
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Заявление от вас: (а) что вы добросовестно полагаете, что использование контента, который, как вы утверждаете, нарушает
ваши авторские права не разрешены законом или владельцем авторских прав или его агентом; б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владельцем авторских прав, либо лицом, уполномоченным действовать от их имени.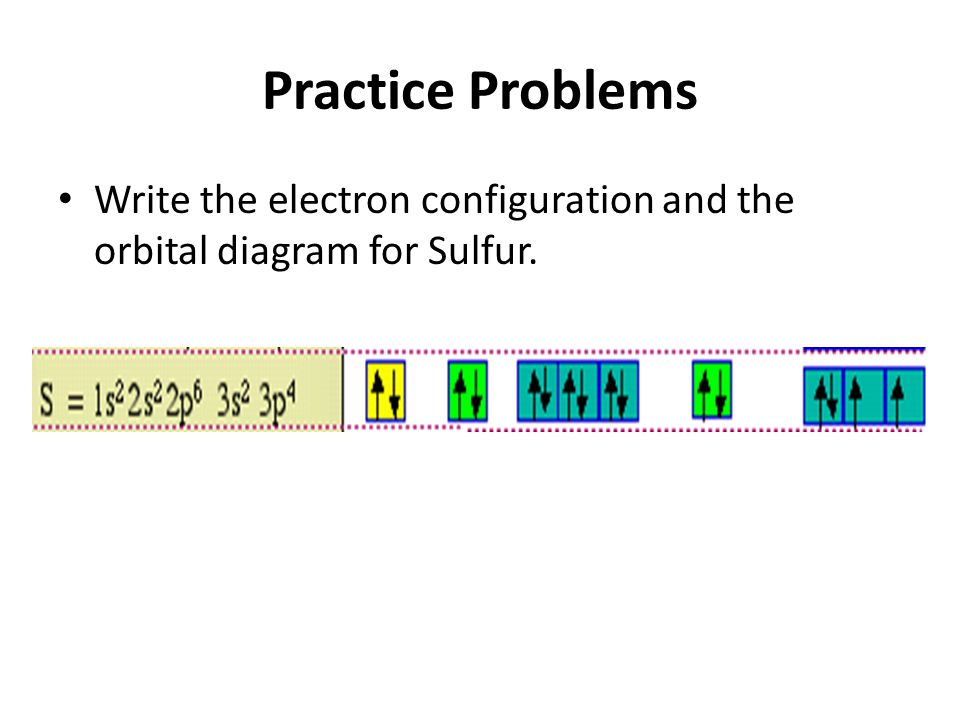 Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.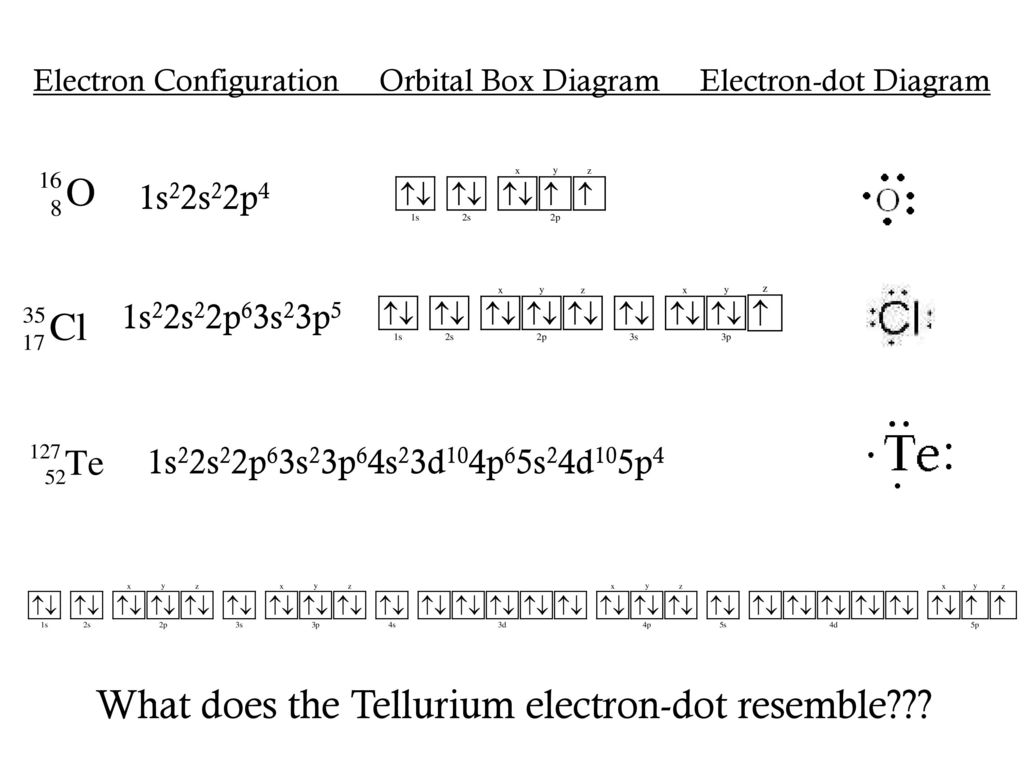
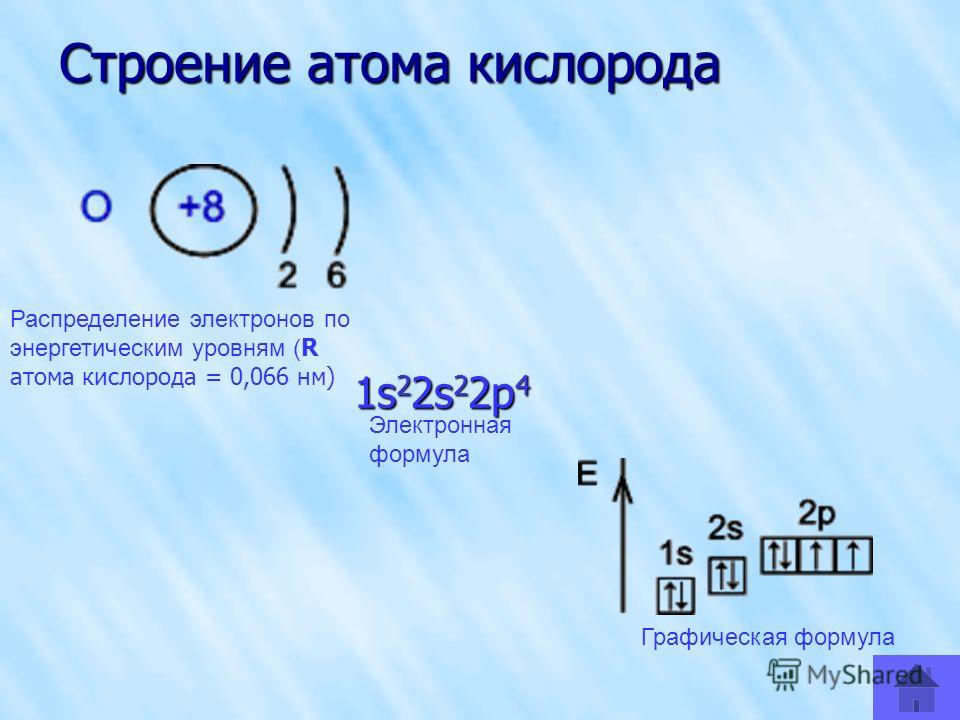 Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.