Латинские названия химических элементов — произношение на русском языке
Чтобы понимать, как правильно произносить названия химических элементов таблицы Менделеева, необходимо выучить несколько важных правил:
1. Химические элементы в периодической таблице обозначаемые одной буквой, читаются по первой букве из латинского названия, например, химический элемент «Углерод», химический знак которого буква «С», значит и читаться будет по этой букве, а именно «Це».
Исключением в данном правиле являются химические элементы: Бор (B), Фтор (F), Калий (K) и Йод (I), которые соответствуют названию химического элемента на русском языке.
2. Некоторые химические элементы, обозначаемые двумя буквами, читаются в соответствии с названием химического элемента на латинском языке, например, неорганическое вещество сульфат серебра AgSO4, читается как: «аргентум эс о 4».
3. Несмотря на огромное количество химических элементов, запомнить правильное произношение не сложно, потому как большинство из них произносятся также, как и пишется на русском языке, за исключением 16 элементов, которые приведены в таблице ниже. Таблицу можно скачать и сохранить как памятку.
Таблица исключений с правильным произношением химических элементов на русском языке
| АТОМНЫЙ НОМЕР |
РУССКОЕ НАЗВАНИЕ ХИМИЧЕСКОГО ЭЛЕМЕНТА
|
ХИМИЧЕСКИЙ ЗНАК | ПРОИЗНОШЕНИЕ НА РУССКОМ ЯЗЫКЕ |
| 1 | Водород | H | Аш |
| 6 | Углерод | C | Це |
| 7 | Азот | N | Эн |
| 8 | Кислород | O | О |
| 14 | Кремний | Si | Силициум |
| 15 | Фосфор | P | Пэ |
| 16 | Сера | S | Эс |
| 26 | Железо |
Fe | Феррум |
| 29 | Медь | Cu | Купрум |
| 33 | Мышьяк | As | Арсеникум |
| 47 | Серебро | Ag | Аргентум |
| 50 | Олово | Sn | Станум |
| 51 | Сурьма | Sb | Стибиум |
| 79 | Золото | Au | Аурум |
| 80 | Ртуть | Hg | Гидраргирум |
| 82 | Свинец | Pb | Плюмбум |
Примечание: произношение остальных химических элементов соответствует названию элементов на русском языке (пример: аргон произносится как аргон, хром произносится как хром и т. д.) д.) |
|||
Скачать таблицу в хорошем качестве по ссылке: скачать таблицу
В таблице ниже описаны произношения всех известных на данный момент химических элементов.
Полная таблица латинских названий химических элементов с произношением на русском языке
(расположение слоев в порядке заполнения подуровней)
| Атомный номер | Русское название химического элемента | Латинское название химического элемента | Химический знак | Произношение на русском языке |
| 1 | водород | hydrogenium | H | аш |
| 2 | гелий | helium | He | гелий |
| 2 период химических элементов | ||||
| 3 | литий | lithium | Li | литий |
| 4 | бериллий | beryllium | Be | бериллий |
| 5 | бор | borium | B | бор |
| 6 | углерод | carboneum | C | це |
| 7 | азот | nitrogenium | N | эн |
| 8 | кислород | oxygenium | O | о |
| 9 | фтор | fluorum | F | фтор |
| 10 | неон | neon | Ne | неон |
| 3 период химических элементов |
||||
| 11 | натрий | natrium | Na | натрий |
| 12 | магний | magnesium | Mg | магний |
| 13 | алюминий | aluminium | Al | алюминий |
| 14 | кремний | silicium | Si | силициум |
| 15 | фосфор | phosphorus | P | пэ |
| 16 | сера | sulfur | S | эс |
| 17 | хлор | clorum | Cl | хлор |
| 18 | аргон | argon | Ar | аргон |
| 4 период химических элементов | ||||
| 19 | калий | kalium | K | калий |
| 20 | кальций | calcium | Ca | кальций |
| 21 | скандий | scandium | Sc | скандий |
| 22 | титан | titanium | Ti | титан |
| 23 | ванадий | vanadium | V | ванадий |
| 24 | хром | chromium | Cr | хром |
| 25 | марганец | manganum | Mn | марганец |
| 26 | железо | ferrum | Fe | феррум |
| 27 | кобальт | cobaltum | Co | кобальт |
| 28 | никель | niccolum | Ni | никель |
| 29 | медь | cuprum | Cu | купрум |
| 30 | цинк | zincum | Zn | цинк |
| 31 | галий | gallium | Ga | галий |
| 32 | германий | germanium | Ge | германий |
| 33 | мышьяк | arsenicum | As | арсеникум |
| 34 | селен | selenium | Se | селен |
| 35 | бром | bromum | Br | бром |
| 36 | криптон | krypton | Kr | криптон |
| 5 период химических элементов | ||||
| 37 | рубидий | rubidium | Rb | рубидий |
| 38 | стронций | strontium | Sr | стронций |
| 39 | иттрий | yttrium | Y | иттрий |
| 40 | цирконий | zirconium | Zr | цирконий |
| 41 | ниобий | niobium | Nb | ниобий |
| 42 | молибден | molybdaenum | Mo | молибден |
| 43 | технеций | technetium | Tc | технеций |
| 44 | рутений | ruthenium | Ru | рутений |
| 45 | родий | rhodium | Rh | родий |
| 46 | палладий | palladium | Pd | палладий |
| 47 | серебро | argentum | Ag | аргентум |
| 48 | кадмий | cadmium | Cd | кадмий |
| 49 | индий | indium | In | индий |
| 50 | олово | stannum | Sn | станум |
| 51 | сурьма | stibium | Sb | стибиум |
| 52 | теллур | tellurium | Te | теллур |
| 53 | йод | iodum | I | йод |
| 54 | ксенон | xenon | Xe | ксенон |
| 6 период химических элементов | ||||
| 55 | цезий | ceslum | Cs | цезий |
| 56 | барий | barlum | Ba | барий |
| 57 | лантан | lanthanum | La | лантан |
| 58 | церий | cerium | Ce | церий |
| 59 | празеодим | praseodymium | Pr | празеодим |
| 60 | неодим | neodymium | Nd | неодим |
| 61 | прометий | promethium | Pm | прометий |
| 62 | самарий | samarium | Sm | самарий |
| 63 | европий | europium | Eu | эвропий |
| 64 | гадолиний | gadolinium | Gd | гадолиний |
| 65 | тербий | terbium | Tb | тербий |
| 66 | диспрозий | dysprosium | Dy | диспрозий |
| 67 | гольмий | holmium | Ho | гольмий |
| 68 | эрбий | erbium | Er | эрбий |
| 69 | тулий | thulium | Tm | тулий |
| 70 | иттербий | ytterbium | Yb | иттербий |
| 71 | лютеций | lutetium | Lu | лютеций |
| 72 | гафний | hafnium | Hf | гафний |
| 73 | тантал | tantalum | Ta | тантал |
| 74 | вольфрам | wolframium | W | вольфрам |
| 75 | рений | rhenium | Re | рений |
| 76 | осмий | osmium | Os | осмий |
| 77 | иридий | iridium | Ir | иридий |
| 78 | платина | platinum | Pt | платины |
| 79 | золото | aurum | Au | аурум |
| 80 | ртуть | hydrargyrum | Hg | гидраргирум |
| 81 | таллий | thallium | Tl | таллий |
| 82 | свинец | plumbum | Pb | плюмбум |
| 83 | висмут | bismuthum | Bi | висмут |
| 84 | полоний | polonium | Po | полоний |
| 85 | астат | astatium | At | астата |
| 86 | радон | radon | Rn | радон |
| 7 период химических элементов | ||||
| 87 | франций | francium | Fr | франций |
| 88 | радий | radium | Ra | радий |
| 89 | актиний | actinium | Ac | актиний |
| 90 | торий | thorium | Th | торий |
| 91 | протактиний | protactinium | Pa | протактиний |
| 92 | урана | uranium | U | уран |
| 93 | нептуний | neptunium | Np | нептуний |
| 94 | плутоний | plutonium | Pu | плутоний |
| 95 | америций | americium | Am | америций |
| 96 | кюрий | curium | Cm | кюрий |
| 97 | берклий | berkelium | Bk | берклий |
| 98 | калифорний | californium | Cf | калифорний |
| 99 | эйнштейний | einsteinium | Es | эйнштейний |
| 100 | фермий | fermium | Fm | фермий |
| 101 | менделеевий | mendelevium | Md | менделеевий |
| 102 | нобелий | nobelium | No | нобелий |
| 103 | лоуренсий | lawrencium | Lr | лоуренсий |
| 104 | резерфордий | rutherfordium | Rf | резерфордий |
| 105 | дубний | dubnium | Db | дубний |
| 106 | сиборгий | seaborgium | Sg | сиборгий |
| 107 | борий | bohrium | Bh | борий |
| 108 | хассий | hassium | Hs | хассий |
| 109 | мейтнерий | meitnerium | Mt | мейтнерий |
| 110 | Дармштадтий (Унуннилий) | Darmstadtium (Ununnilium) | Ds (Uun) | дармштадий |
| 111 | Рентгений (Унунуний) | Roentgenium (Unununium) | Rg (Uuu) | рентгений |
| 112 | Коперниций (Унунбий) | Copernicium (Ununbium) | Cn (Uub) | коперниций |
| 113 | Нихоний (Унунтрий) | Nihonium (Ununtrium) | Nt (Unt) | нихоний |
| 114 | Флеровий (Унунквадий) | Flerovium (Ununquadium) | Fl (Uuq) | флеровий |
| 115 | Московий (Унунпентий) | Moscovium (Ununpentium) | Mc (Uup) | московий |
| 116 | Ливерморий (Унунгексий) | Livermorium (Ununhexium) | Lv (Uuh) | ливерморий |
| 117 | Теннессин (Унунсептий) | Tennessine (Ununseptium) | Тc (Uus) | теннессин |
| 118 | Оганесон (Унуноктий) | Oganesson (Ununoctium) | Og (Uuo) | оганесон |
| 8 период химических элементов | ||||
| 119 | унуненний | ununnenium | Uue | |
| 120 | унбинилий | unbinilium | Ubn | |
| 121 | унбиуний | unbiunium | Ubu | |
| 122 | унбибий | unbibium | Ubb | |
| 123 | унбитрий | unbitrium | Ubt | |
| 124 | унбиквадий | unbiquadium | Ubq | |
| 125 | унбипентий | unbipentium | Ubp | |
| 126 | унбигексий | unbihexium | Ubh | |
Периодическая система химических элементов (таблица Менделеева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). Всего предложено несколько сотен вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Открытие, сделанное Русским химиком Менделеевым, сыграло (безусловно) наиболее важную роль в развитии науки, а именно в развитии атомно-молекулярного учения. Это открытие позволило получить наиболее понятные, и простые в изучении, представления о простых и сложных химических соединениях. Только благодаря таблице мы имеем те понятия об элементах, которыми пользуемся в современном мире. В ХХ веке проявилась прогнозирующая роль периодической системы при оценке химических свойств, трансурановых элементов, показанная еще создателем таблицы.
Это открытие позволило получить наиболее понятные, и простые в изучении, представления о простых и сложных химических соединениях. Только благодаря таблице мы имеем те понятия об элементах, которыми пользуемся в современном мире. В ХХ веке проявилась прогнозирующая роль периодической системы при оценке химических свойств, трансурановых элементов, показанная еще создателем таблицы.
Разработанная в ХIХ веке, периодическая таблица Менделеева в интересах науки химии, дала готовую систематизацию типов атомов, для развития ФИЗИКИ в ХХ веке (физика атома и ядра атома). В начале ХХ века, ученые физики, путем исследований установили, что порядковый номер, (он же атомный), есть и мера электрического заряда атомного ядра этого элемента. А номер периода (т.е. горизонтального ряда), определяет число электронных оболочек атома. Так же выяснилось, что номер вертикального ряда таблицы определяет квантовую структуру внешней оболочки элемента, (этим самым, элементы одного ряда, обязаны сходством химических свойств).
Открытие Русского ученого, ознаменовало собой, новую эру в истории мировой науки, это открытие позволило не только совершить огромный скачек в химии, но так же было бесценно для ряда других направлений науки. Таблица Менделеева дала стройную систему сведений об элементах, на основе её, появилась возможность делать научные выводы, и даже предвидеть некоторые открытия.
Таблица МенделееваОдна из особенностей периодической таблицы Менделеева, состоит в том, что группа (колонка в таблице), имеет более существенные выражения периодической тенденции, чем для периодов или блоков. В наше время, теория квантовой механики и атомной структуры объясняет групповую сущность элементов тем, что они имеют одинаковые электронные конфигурации валентных оболочек, и как следствие, элементы которые находятся в пределах одой колонки, располагают очень схожими, (одинаковыми), особенностями электронной конфигурации, со схожими химическими особенностями. Так же наблюдается явная тенденция стабильного изменения свойств по мере возрастания атомной массы. Надо заметить, что в некоторых областях периодической таблицы, (к примеру, в блоках D и F), сходства горизонтальные, более заметны, чем вертикальные.
Надо заметить, что в некоторых областях периодической таблицы, (к примеру, в блоках D и F), сходства горизонтальные, более заметны, чем вертикальные.
Таблица Менделеева содержит группы, которым присваиваются порядковые номера от 1 до 18 (с лева, на право), согласно международной системе именования групп. В былое время, для идентификации групп, использовались римские цифры. В Америке существовала практика ставить после римской цифры, литер «А» при расположении группы в блоках S и P, или литер «В» — для групп находящихся в блоке D. Идентификаторы, применявшиеся в то время, это то же самое, что и последняя цифра современных указателей в наше время (на пример наименование IVB, соответствует элементам 4 группы в наше время, а IVA — это 14 группа элементов). В Европейских странах того времени, использовалась похожая система, но тут, литера «А» относилась к группам до 10, а литера «В» — после 10 включительно. Но группы 8,9,10 имели идентификатор VIII, как одна тройная группа. Эти названия групп закончили свое существование после того как в 1988 году вступила в силу, новая система нотации ИЮПАК, которой пользуются и сейчас.
Многие группы получили несистематические названия травиального характера, (к примеру — «щелочноземельные металлы», или «галогены», и другие подобные названия). Таких названий не получили группы с 3 по 14, из за того что они в меньшей степени схожи между собой и имеют меньшее соответствие вертикальным закономерностям, их обычно, называют либо по номеру, либо по названию первого элемента группы (титановая, кобальтовая и тому подобно).
Химические элементы относящиеся к одной группе таблицы Менделеева проявляют определенные тенденции по электроотрицательности, атомному радиусу и энергии ионизации. В одной группе, по направлению сверху вниз, радиус атома возрастает, по мере заполнения энергетических уровней, удаляются, от ядра, валентные электроны элемента, при этом снижается энергия ионизации и ослабевают связи в атоме, что упрощает изъятие электронов. Снижается, так же, электроотрицательность, это следствие того, что возрастает расстояние между ядром и валентными электронами. Но из этих закономерностей так же есть исключения, на пример электроотрицательность возрастает, вместо того чтобы убывать, в группе 11, в направлении сверху вниз. В таблице Менделеева есть строка, которая называется «Период».
Но из этих закономерностей так же есть исключения, на пример электроотрицательность возрастает, вместо того чтобы убывать, в группе 11, в направлении сверху вниз. В таблице Менделеева есть строка, которая называется «Период».
Среди групп, есть и такие у которых более значимыми являются горизонтальные направления (в отличии от других, у которых большее значение имеют вертикальные направления), к таким группам относится блок F, в котором лантаноиды и актиноиды формируют две важные горизонтальные последовательности.
Элементы показывают определенные закономерности в отношении атомного радиуса, электроотрицательности, энергии ионизации, и в энергии сродства к электрону. Из-за того, что у каждого следующего элемента количество заряженных частиц возрастает, а электроны притягиваются к ядру, атомный радиус уменьшается в направлении слева направо, вместе с этим увеличивается энергия ионизации, при возрастании связи в атоме — возрастает сложность изъятия электрона. Металлам, расположенным в левой части таблицы, характерен меньший показатель энергии сродства к электрону, и соответственно, в правой части показатель энергии сродства к электрону, у не металлов, этот показатель больше, (не считая благородных газов).
Разные области периодической таблицы Менделеева, в зависимости от того на какой оболочке атома, находится последний электрон, и в виду значимости электронной оболочки, принято описывать как блоки.
В S-блок, входит две первые группы элементов, (щелочные и щелочноземельные металлы, водород и гелий).
В P-блок, входят шест последних групп, с 13 по 18 (согласно ИЮПАК, или по системе принятой в Америке — с IIIA до VIIIA), этот блок так же включает в себя все металлоиды.
Блок — D, группы с 3 по 12 (ИЮПАК, или с IIIB до IIB по-американски), в этот блок включены все переходные металлы.
Блок — F, обычно выносится за пределы периодической таблицы, и включает в себя лантаноиды и актиноиды.
Открытие Дмитрием Менделеевым периодической таблицы химических элементов в марте 1869 года стало настоящим прорывом в химии. Российскому ученому удалось систематизировать знания о химических элементах и представить их в виде таблицы, которую и сейчас обязательно изучают школьники на уроках химии. Периодическая таблица стала фундаментом для бурного развития этой сложной и интересной науки, а история ее открытия окутана легендами и мифами. Для всех увлекающихся наукой будет интересно узнать правду о том, как Менделеев открыл таблицу периодических элементов.
Периодическая таблица стала фундаментом для бурного развития этой сложной и интересной науки, а история ее открытия окутана легендами и мифами. Для всех увлекающихся наукой будет интересно узнать правду о том, как Менделеев открыл таблицу периодических элементов.
История таблицы Менделеева: как все начиналось
Попытки классифицировать и систематизировать известные химические элементы предпринимались задолго до Дмитрия Менделеева. Свои системы элементов предлагали такие известные ученые, как Деберейнер, Ньюлендс, Мейер и другие. Однако из-за нехватки данных о химических элементах и их правильных атомных массах предложенные системы были не совсем достоверными.
История открытия таблицы Менделеева начинается в 1869 году, когда российский ученый на заседании Русского химического общества рассказал своим коллегам о сделанном им открытии. В предложенной ученым таблице химические элементы располагались в зависимости от их свойств, обеспечивающихся величиной их молекулярной массы.
Интересной особенностью таблицы Менделеева было также наличие пустых клеток, которые в будущем были заполнены открытыми химическими элементами, предсказанными ученым (германий, галлий, скандий). После открытия периодической таблицы в нее много раз вносились добавления и поправки. Совместно с шотландским химиком Уильямом Рамзаем Менделеев добавил в таблицу группу инертных газов (нулевую группу).
В дальнейшем история периодической таблицы Менделеева была напрямую связана с открытиями в другой науке – физике. Работа над таблицей периодических элементов продолжается до сих пор, и современные ученые добавляют новые химические элементы по мере их открытия. Значение периодической системы Дмитрия Менделеева сложно переоценить, так как благодаря ей:
- Систематизировались знания о свойствах уже открытых химических элементов;
- Появилась возможность прогнозирования открытия новых химических элементов;
- Начали развиваться такие разделы физики, как физика атома и физика ядра;
Существует множество вариантов изображения химических элементов согласно периодическому закону, однако наиболее известный и распространенный вариант – это привычная для каждого таблица Менделеева.
Мифы и факты о создании периодической таблицы
Самым распространенным заблуждением в истории открытия таблицы Менделеева является то, что ученый увидел ее во сне. На самом деле сам Дмитрий Менделеев опроверг этот миф и заявил, что размышлял над периодическим законом на протяжении многих лет. Чтобы систематизировать химические элементы он выписывал каждый из них на отдельную карточку и многократно комбинировал их между собой, расставляя в ряды в зависимости от их схожих свойств.
Миф о «вещем» сне ученого можно объяснить тем, что Менделеев работал над систематизацией химических элементов сутками напролет, прерываясь на непродолжительный сон. Однако только упорный труд и природный талант ученого дал долгожданный результат и обеспечил Дмитрию Менделееву всемирную известность.
Многих учащихся в школе, а иногда и в университете, заставляютзаучивать или хотя бы примерно ориентироваться в таблице Менделеева. Для этого человек должен не только иметь хорошую память, но и логически мыслить, связывая элементы в отдельные группы и классы. Изучение таблицы легче всего дается тем людям, которые постоянно поддерживают мозг в тонусе, проходя тренинги на BrainApps.
Изучение таблицы легче всего дается тем людям, которые постоянно поддерживают мозг в тонусе, проходя тренинги на BrainApps.
Одной из самых популярных таблиц в мире является таблица Менделеева. В каждой ячейке вписаны названия химических элементов. Для ее разработки было приложено много усилий. Ведь это не просто список веществ. Они упорядочены согласно своим свойствам и особенностям. А сколько элементов в таблице Менделеева мы сейчас и узнаем.
История создания таблицыМенделеев не был первым ученым, который решил структурировать элементы. Пытались многие. Вот только никто не мог сопоставить все в одной слаженной таблице. Датой открытия периодического закона мы можем назвать 17 февраля 1869 года. В этот день Менделеев показал свое творение – целую систему элементов, упорядоченных на основе атомного веса и химических особенностях.
Стоит отметить, что гениальная мысль не пришла ученому в один удачный вечер во время работы. Он действительно трудился около 20 лет. Снова и снова перебирал карточки с элементами, изучал их характеристики. В это же время трудились и другие ученые.
Снова и снова перебирал карточки с элементами, изучал их характеристики. В это же время трудились и другие ученые.
Химик Канниццаро предложил от своего имени теорию атомного веса. Он утверждал, что именно эти данные могут построить все вещества в нужном порядке. Дальше ученые Шантуркуа и Ньюлендс, работая в разных точках мира, пришли к умозаключению, что размещая элементы по атомному весу, они начинают дополнительно объединяться и по другим свойствам.
В 1869 году вместе с Менделеевым были представлены другие примеры таблиц. Но сегодня мы даже не помним имена их авторов. Почему так? Все дело в превосходстве ученого над своими конкурентами:
- Таблица имела большее количество открытых элементов, чем у других.
- Если какой-то элемент не подходил по атомному весу, ученый помещал его на основе других свойств. И это было правильным решением.
- В таблице было много пустых мест. Менделеев сделал пропуски осознано, забрав тем самым частичку славы тех, кто в будущем найдет эти элементы.
 Он даже дал описание некоторых еще неведомых веществ.
Он даже дал описание некоторых еще неведомых веществ.
Самое главное достижение в том, что эта таблица неразрушима. Она создано так гениально, что любые открытия в будущем будут ее только дополнять.
Сколько элементов в таблице МенделееваКаждый человек хотя бы раз в жизни видел эту таблицу. Но вот назвать точное количество веществ сложно. Правильных ответов может быть два: 118 и 126. Сейчас мы разберемся, почему так.
В природе люди обнаружили 94 элемента. Они ничего с ними не делали. Только изучали их свойства и особенности. Большая часть из них была в первоначальной периодической таблице.
Другие 24 элемента были созданы в лабораториях. Всего получается 118 штук. Еще 8 элементов являются лишь гипотетическими вариантами. Их пытаются изобрести или получить. Так что на сегодняшний день и вариант с 118 элементами, и с 126 элементами можно смело называть.
- Ученый был семнадцатым ребенком в семье. Восемь из них погибли еще в раннем возрасте.
 Отец рано ушел из жизни. Но мать продолжала бороться за будущее своих детей, так что смогла пристроить их в хорошие учебные заведения.
Отец рано ушел из жизни. Но мать продолжала бороться за будущее своих детей, так что смогла пристроить их в хорошие учебные заведения. - Всегда отстаивал свое мнение. Был уважаемым педагогом в университетах Одессы, Симферополя и Санкт-Петербурга.
- Он никогда не изобретал водку. Алкогольный напиток был создан задолго до ученого. Но его докторская была посвящена спирту, отсюда и развилась легенда.
- Периодическая система никогда не снилась Менделееву. Она стала результатом тяжелой работы.
- Он любил делать чемоданы. И довел свое хобби до высокого уровня мастерства.
- За всю свою жизнь Менделеев 3 раза мог получить Нобелевскую премию. Но все закончилось лишь номинациями.
- Многих это удивит, то работы в области химии занимают лишь 10% всех занятий ученого. Также он изучал аэростаты и кораблестроение.
Таблица Менделеева – это удивительная система всех элементов, которые когда-либо были обнаружены людьми. Она делится на ряды и столбцы, чтобы упростить изучение всех элементов.
P.S. Статья — Сколько элементов в таблице Менделеева, опубликована в рубрике — .
Таблица Менделеева является одним из величайших открытий человечества, позволившим упорядочить знания об окружающем мире и открыть новые химические элементы . Она является необходимой для школьников, а так же для всех, кто интересуется химией. Кроме того, данная схема является незаменимой и в других областях науки.
Данная схема содержит все известные человеку элементы, причем они группируются в зависимости от атомной массы и порядкового номера . Эти характеристики влияют на свойства элементов. Всего в коротком варианте таблицы имеется 8 групп, элементы, входящие в одну группу, обладают весьма сходными свойствами. Первая группа содержит водород, литий, калий, медь, латинское произношение на русском которой купрум. А так же аргентум — серебро, цезий, золото — аурум и франций. Во второй группе расположены бериллий, магний, кальций, цинк, за ними идут стронций, кадмий, барий, заканчивается группа ртутью и радием.
В состав третьей группы вошли бор, алюминий, скандий, галлий, потом следуют иттрий, индий, лантан, завершается группа таллием и актинием. Четвертая группа начинается с углерода, кремния, титана, продолжается германием, цирконием, оловом и завершается гафнием, свинцом и резерфордием. В пятой группе имеются такие элементы, как азот, фосфор, ванадий, ниже расположены мышьяк, ниобий, сурьма, потом идут тантал висмут и завершает группу дубний. Шестая начинается с кислорода, за которым лежат сера, хром, селен, потом следуют молибден, теллур, далее вольфрам, полоний и сиборгий.
В седьмой группе первый элемент – фтор, потом следует хлор, марганец, бром, технеций, за ним находится йод, потом рений, астат и борий. Последняя группа является самой многочисленной . В нее входят такие газы, как гелий, неон, аргон, криптон, ксенон и радон. Так же к данной группе относятся металлы железо, кобальт, никель, родий, палладий, рутений, осмий, иридий, платина. Далее идут ханний и мейтнерий. Отдельно расположены элементы, которые образуют ряд актиноидов и ряд лантаноидов . Они обладают сходными свойствами с лантаном и актинием.
Отдельно расположены элементы, которые образуют ряд актиноидов и ряд лантаноидов . Они обладают сходными свойствами с лантаном и актинием.
Данная схема включает в себя все виды элементов, которые делятся на 2 большие группы – металлы и неметаллы , обладающие разными свойствами. Как определить принадлежность элемента к той или иной группе, поможет условная линия, которую необходимо провести от бора к астату. Следует помнить, что такую линию можно провести только в полной версии таблицы. Все элементы, которые находятся выше этой линии, и располагаются в главных подгруппах считаются неметаллами. А которые ниже, в главных подгруппах – металлами. Так же металлами являются вещества, находящиеся в побочных подгруппах . Существуют специальные картинки и фото, на которых можно детально ознакомиться с положением этих элементов. Стоит отметить, что те элементы, которые находятся на этой линии, проявляют одинаково свойства и металлов и неметаллов.
Отдельный список составляют и амфотерные элементы, которые обладают двойственными свойствами и могут образовывать в результате реакций 2 вида соединений. При этом у них проявляются одинаково как основные, так и кислотные свойства . Преобладание тех или иных свойств зависит от условий реакции и веществ, с которыми амфотерный элемент реагирует.
При этом у них проявляются одинаково как основные, так и кислотные свойства . Преобладание тех или иных свойств зависит от условий реакции и веществ, с которыми амфотерный элемент реагирует.
Стоит отметить, что данная схема в традиционном исполнении хорошего качества является цветной. При этом разными цветами для удобства ориентирования обозначаются главные и побочные подгруппы . А так же элементы группируются в зависимости от схожести их свойств.
Однако в настоящее время наряду с цветной схемой очень распространенной является периодическая таблица Менделеева черно белая. Такой ее вид используется для черно-белой печати. Несмотря на кажущуюся сложность, работать с ней так же удобно, если учесть некоторые нюансы. Так, отличить главную подгруппу от побочной в таком случае можно по отличиям в оттенках, которые хорошо заметны. К тому же в цветном варианте элементы с наличием электронов на разных слоях обозначаются разными цветами .
Стоит отметить, что в одноцветном исполнении ориентироваться по схеме не очень трудно. Для этого будет достаточно информации, указанной в каждой отдельной клеточке элемента.
Для этого будет достаточно информации, указанной в каждой отдельной клеточке элемента.
Егэ сегодня является основным видом испытания по окончанию школы, а значит, подготовке к нему необходимо уделять особое внимание. Поэтому при выборе итогового экзамена по химии , необходимо обратить внимание на материалы, которые могут помочь в его сдаче. Как правило, школьникам на экзамене разрешено пользоваться некоторыми таблицами, в частности, таблицей Менделеева в хорошем качестве. Поэтому, чтобы она принесла на испытаниях только пользу, следует заблаговременно уделить внимание ее строению и изучению свойств элементов, а так же их последовательности. Необходимо научиться, так же пользоваться и черно-белой версией таблицы , чтобы на экзамене не столкнуться с некоторыми трудностями.
Помимо основной таблицы, характеризующей свойства элементов и их зависимость от атомной массы, существуют и другие схемы, которые могут оказать помощь при изучении химии. Например, существуют таблицы растворимости и электроотрицательности веществ . По первой можно определить, насколько растворимо то или иное соединение в воде при обычной температуре. При этом по горизонтали располагаются анионы – отрицательно заряженные ионы, а по вертикали – катионы, то есть положительно заряженные ионы. Чтобы узнать степень растворимости того, или иного соединения, необходимо по таблице найти его составляющие. И на месте их пересечения будет нужное обозначение.
Например, существуют таблицы растворимости и электроотрицательности веществ . По первой можно определить, насколько растворимо то или иное соединение в воде при обычной температуре. При этом по горизонтали располагаются анионы – отрицательно заряженные ионы, а по вертикали – катионы, то есть положительно заряженные ионы. Чтобы узнать степень растворимости того, или иного соединения, необходимо по таблице найти его составляющие. И на месте их пересечения будет нужное обозначение.
Если это буква «р», то вещество полностью растворимо в воде в нормальных условиях. При наличии буквы «м» — вещество малорастворимое, а при наличии буквы «н» — оно почти не растворяется. Если стоит знак «+», — соединение не образует осадок и без остатка реагирует с растворителем. Если присутствует знак «-», это означает, что такого вещества не существует. Иногда так же в таблице можно увидеть знак «?», тогда это обозначает, что степень растворимости этого соединения доподлинно не известна. Электроотрицательность элементов может варьироваться от 1 до 8, для определения этого параметра так же существует специальная таблица.
Еще одна полезная таблица – ряд активности металлов. В нем располагаются все металлы по увеличении степени электрохимического потенциала. Начинается ряд напряжения металлов с лития, заканчивается золотом. Считается, что чем левее занимает место в данном ряду металл, тем он более активен в химических реакциях. Таким образом, самым активным металлом считается металл щелочного типа литий. В списке элементов ближе к концу так же присутствует водород. Считается, что металлы, которые расположены после него, являются практически неактивными. Среди них такие элементы, как медь, ртуть, серебро, платина и золото.
Таблица Менделеева картинки в хорошем качестве
Данная схема является одним из крупнейших достижений в области химии. При этом существует немало видов этой таблицы – короткий вариант, длинный, а так же сверхдлинный. Самой распространенной является короткая таблица, так же часто встречается и длинная версия схемы. Стоит отметить, что короткая версия схемы в настоящее время не рекомендуется ИЮПАК для использования.
Всего было разработано больше сотни видов таблицы , отличающихся представлением, формой и графическим представлением. Они используются в разных областях науки, либо совсем не применяются. В настоящее время новые конфигурации схемы продолжают разрабатываться исследователями. В качестве основного варианта используется либо короткая, либо длинная схема в отличном качестве.
Тот, кто гасит свет. Фейнманий и глубины таблицы Менделеева / Хабр
Попробуйте почитайте англоязычные источники по истории химии и поищите в них упоминание таблицы Менделеева. Вы будете удивлены, но все-таки убедитесь, что такая формулировка тщательно избегается. Настойчиво и как-то политкорректно пишут о «периодической системе элементов». С упоминанием не только Менделеева, но и всех причастных, акцентируя роль Мейера, Деберейнера и Шанкуртуа с не меньшим пафосом, чем определяющую роль открытия второго фронта на заключительном этапе Второй мировой войны.
Отдавая должное уважаемым западным партнерам Менделеева и лично Роберту Бунзену, у которого Дмитрий Иванович учился в 1859-1861, отметим, что Менделеев вошел в историю науки не как классификатор известного, подобно Линнею, а как визионер, сумевший спрогнозировать еще не открытые элементы и, что более важно в контексте этой статьи – правильно расположить йод и теллур, несмотря на то, что теллур тяжелее йода.
В настоящее время таблицу Менделеева замыкает оганессон (Og) № 118. Он расположен ровно под радоном (№ 86) и, по логике Менделеева, должен представлять собой благородный газ, так как замыкает седьмой период. Но с завершением этого самого удивительного, эфемерного и взрывоопасного периода, вместившего в себя уран, плутоний, менделевий, флеровий и оганессон, вновь актуализируются вопросы: а где заканчивается таблица Менделеева? И до самого ли ее предела соблюдается периодический закон? Удивительно, но впервые ответ на этот вопрос довольно уверенно дал еще Ричард Фейнман.
При этом он опирался на традиционную модель атома, предложенную Бором. Как известно, в модели Бора ядро атома окружено облаком электронов, и электроны обращаются вокруг ядра лишь по строго определенным разрешенным орбитам. Электрон не может занимать промежуточную орбиту, но может переходить с одной разрешенной орбиты на другую. Такой переход происходит мгновенно с излучением или поглощением кванта энергии и называется «квантовый скачок».
Скорость электрона в конкретном квантовом состоянии вычисляется по следующей формуле
,
где Z – атомный номер, соответствующий количеству протонов в ядре атома и, соответственно, количеству электронов, обращающихся вокруг нейтрального атома. Здесь же n – это квантовое состояние электрона, а — постоянная тонкой структуры. Постоянная тонкой структуры вычисляется по формуле
,
где e – элементарный заряд, h – постоянная Планка, а e0 – диэлектрическая постоянная, также именуемая свободной проницаемостью вакуума.
Соответственно, чем дальше от ядра находится внешняя электронная оболочка атома, тем выше скорость движущегося по ней электрона. Ричард Фейнман вычислил, что при Z = 137 скорость электрона будет чуть ниже, чем скорость света. Если следовать этой логике, элемент с атомным номером 138 существовать не может; в противном случае, его крайний электрон превысил бы скорость света.
Резерфордий и беззаконие
Тем не менее, на практике все оказывается сложнее. Во-первых, в ядрах тяжелых и сверхтяжелых элементов начинают проявляться релятивистские эффекты. Расчеты, прогнозирующие, где может закончиться таблица Менделеева, основаны на теории относительности. При увеличении ядра в нем становится все больше протонов, а значит, возрастает и сила притяжения, воздействующая на электроны. Соответственно, скорость крайних электронов растет, все существеннее приближаясь к скорости света. При таких скоростях электроны становятся «релятивистскими», и свойства этих элементов не вполне объяснимы одним лишь положением элемента в таблице. Некоторые из подобных эффектов заметны невооруженным глазом. Так, в атомах золота электроны обращаются вокруг ядра со скоростью примерно вдвое меньше световой. Из-за этого очертания орбиталей изменяются так, что золото поглощает голубую часть видимого спектра, а остальные фотоны от него отражаются. Мы наблюдаем белый свет минус сине-фиолетовую составляющую, и в результате золото приобретает характерный желто-рыжий блеск, которым выделяется на фоне окружающих его серебристых металлов.
Во-первых, в ядрах тяжелых и сверхтяжелых элементов начинают проявляться релятивистские эффекты. Расчеты, прогнозирующие, где может закончиться таблица Менделеева, основаны на теории относительности. При увеличении ядра в нем становится все больше протонов, а значит, возрастает и сила притяжения, воздействующая на электроны. Соответственно, скорость крайних электронов растет, все существеннее приближаясь к скорости света. При таких скоростях электроны становятся «релятивистскими», и свойства этих элементов не вполне объяснимы одним лишь положением элемента в таблице. Некоторые из подобных эффектов заметны невооруженным глазом. Так, в атомах золота электроны обращаются вокруг ядра со скоростью примерно вдвое меньше световой. Из-за этого очертания орбиталей изменяются так, что золото поглощает голубую часть видимого спектра, а остальные фотоны от него отражаются. Мы наблюдаем белый свет минус сине-фиолетовую составляющую, и в результате золото приобретает характерный желто-рыжий блеск, которым выделяется на фоне окружающих его серебристых металлов.
Еще в 1990-е были поставлены первые эксперименты, показавшие, что резерфордий (104) и дубний (105) проявляют не те свойства, что положены им в соответствии с позициями в периодической системе. Согласно периодическому закону, они должны напоминать по свойствам те элементы, что расположены прямо над ними, соответственно, гафний и тантал. На самом же деле, резерфордий реагирует подобно плутонию, расположенному довольно далеко от него, а дубний – как протактиний. С другой стороны, сиборгий (106) и борий (107) следуют закону, выведенному Менделеевым.
Дальше – больше. Оказывается, рентгений (111) сближается по свойствам с астатом, а не с золотом, а коперниций (112) тяготеет по свойствам к благородным газам, даже сильнее, чем оганессон (118). Вероятно, теннессин (117) по свойствам скорее похож на галлий, а нихоний (113) сравним со щелочными металлами. Все эти аномалии связаны со все более выраженным проявлением релятивистских эффектов в сверхкрупных атомах.
Немного о корпускулярно-волновом дуализме
Боровская модель атома в той трактовке, согласно которой таблицу должен замыкать элемент № 137, также не вполне соответствует реальному положению вещей. Предмет квантовой физики гораздо сложнее, чем предмет классической; как правило, квантовые феномены не имеют наглядного аналога на макроуровне. Например, в соответствии с законами классической физики, электроны, обращающиеся вокруг ядра, обязаны падать на ядро, а атомы – схлопываться.
Предмет квантовой физики гораздо сложнее, чем предмет классической; как правило, квантовые феномены не имеют наглядного аналога на макроуровне. Например, в соответствии с законами классической физики, электроны, обращающиеся вокруг ядра, обязаны падать на ядро, а атомы – схлопываться.
Казалось бы, само существование атома является опровержением законов физики. Но на самом деле все иначе. Классические законы непоколебимы, но электроны не падают на ядро, поскольку, строго говоря, электрон – не частица. Электрон подчиняется корпускулярно-волновому дуализму, то есть, одновременно проявляет черты частицы и волны, и поэтому не падает на ядро. Тем не менее, даже с учетом корпускулярно-волнового дуализма скорость электрона не может превышать скорость света в вакууме.
Мистер Фейнман собственной персоной
Ричард Фейнман считал, что при атомном числе более Z =137 нейтральный атом существовать не может. Дело в том, что, согласно релятивистскому уравнению Дирака, при больших значениях Z основное энергетическое состояние электрона, ближайшего к ядру, будет выражаться мнимым числом. Однако, такая аргументация предполагает, что ядро является точечным. Если же допустить, что ядро имеет пусть минимальный, но не нулевой физический размер, то таблица Менделеева должна продолжаться до
Однако, такая аргументация предполагает, что ядро является точечным. Если же допустить, что ядро имеет пусть минимальный, но не нулевой физический размер, то таблица Менделеева должна продолжаться до Z≈173.
Что дальше
Считается, что для
Z≈ 173 1s-подоболочка под действием электрического поля ядра «погружается» в отрицательный континуум (
море Дирака), что приводит к спонтанному рождению электрон-позитронных пар и, как следствие, к отсутствию нейтральных атомов выше элемента Ust (Унсепттрий) с
Z= 173. Атомы с
Z > Zcr173 называются
суперкритическимиатомами. Предполагается также, что элементы с
Z > Zcrмогут существовать только в качестве ионов.
Суперкритические атомы не могут быть полностью ионизированы, поскольку на их первой электронной оболочке будет бурно происходить спонтанное рождение пар, при котором из моря Дирака всплывают электрон и позитрон, причем, электрон вплетается в атом, а позитрон улетает. Правда, поле сильного взаимодействия, окружающее атомное ядро, очень короткодействующее, так что принцип запрета Паули не допускает дальнейшего спонтанного рождения пар после заполнения тех оболочек, что погружены в море Дирака. Элементы 173–184 названы слабо суперкритическими атомами, поскольку у них в море Дирака погружена только оболочка
Правда, поле сильного взаимодействия, окружающее атомное ядро, очень короткодействующее, так что принцип запрета Паули не допускает дальнейшего спонтанного рождения пар после заполнения тех оболочек, что погружены в море Дирака. Элементы 173–184 названы слабо суперкритическими атомами, поскольку у них в море Дирака погружена только оболочка 1s; предполагается, что оболочка 2p1/2 будет полностью заполняться около элемента 185, а оболочка 2s – около элемента 245. Пока не удалось экспериментально добиться спонтанного рождения пар, пытаясь собрать суперкритические заряды путем столкновения тяжелых ядер (например, свинца с ураном, что могло бы дать Z = 174; урана с ураном, что дает Z = 184 и урана с калифорнием, что дает Z = 190). Возможно, в финале таблицы Менделеева ключевую роль будет играть ядерная нестабильность, а не нестабильность электронных оболочек.
Наконец, предполагается, что в регионе за Z > 300 может скрываться целый континент стабильности, состоящий из гипотетической кварковой материи (она же – квантово-хромодинамическая материя). Такая материя может состоять из свободных верхних и нижних кварков, а не из кварков, связанных в протоны и нейтроны. Предполагается, что это основное состояние барионной материи, обладающей большей энергией связи на барион, чем ядерная материя. Если такое состояние вещества реально, то, возможно, синтезировать его можно в ходе термоядерных реакций обычных сверхтяжелых ядер. Продукты таких реакций, благодаря высокой энергии связи, должны вполне преодолевать кулоновский барьер.
Такая материя может состоять из свободных верхних и нижних кварков, а не из кварков, связанных в протоны и нейтроны. Предполагается, что это основное состояние барионной материи, обладающей большей энергией связи на барион, чем ядерная материя. Если такое состояние вещества реально, то, возможно, синтезировать его можно в ходе термоядерных реакций обычных сверхтяжелых ядер. Продукты таких реакций, благодаря высокой энергии связи, должны вполне преодолевать кулоновский барьер.
Пока все это теория, и мы, повторимся, успели заполнить лишь 7-й период таблицы Менделеева к 150-летию открытия Периодического Закона (1869-2019). Так или иначе, период полураспада новых тяжелых элементов стремительно сокращается; если у резерфордия-267 он составляет около 1,3 часов, то у рентгения-282 – всего 2,1 минуты, а у оганессона исчисляется сотнями микросекунд. Таким образом, финал близок, а за ним может открыться сиквел или режиссерская версия материального мира. Путь туда лежит через субсветовые орбитали фейнмания.
Периодическая система элементов. Периоды, группы, подгруппы. Периодический закон и его обоснование реферат по химии
Сочинский Государственный Университет туризма и курортного дела в г. Нижний Новгород Реферат Дисциплина: «Общая химия» Тема: «Периодическая система элементов. Периоды, группы, подгруппы. Периодический закон и его обоснование» Выполнил: студент гр. А 33 – 09 Филиппова А.С. Проверил: ______________ Нижний Новгород 2009 2. Основная часть 2.1 История открытия периодического закона и периодической системы химических элементов Утверждение атомно-молекулярной теории на рубеже XIIX – XIX веков сопровождалось бурным ростом числа известных химических элементов. Только за первое десятилетие 19 века было открыто 14 новых элементов. Рекордсменом среди первооткрывателей оказался английский химик Гемфри Деви , который за один год с помощью электролиза получил 6 новых простых веществ (натрий, калий, магний, кальций, барий, стронций). А к 1830 году число известных элементов достигло 55. Существование такого количества элементов, разнородных по своим свойствам, озадачивало химиков и требовало упорядочения и систематизации элементов. Многие учёные занимались поисками закономерностей в списке элементов и добивались определённого прогресса. Можно выделить три наиболее значительные работы, которые оспаривали приоритет открытия периодического закона у Д.И. Менделеева. В 1860 году состоялся первый Международный химический конгресс, после которого стало ясно, что основной характеристикой химического элемента является его атомный вес. Французский учёный Б. де Шанкуртуа в 1862 году впервые расположил элементы в порядке возрастания атомных весов и разместил их по спирали вокруг цилиндра. Каждый виток спирали содержал 16 элементов, сходные элементы, как правило, попадали в вертикальные столбцы, хотя были отмечены и значительные расхождения. Работа де Шанкуртуа осталась незамеченной, но выдвинутая им идея сортировки элементов в порядке возрастания атомных весов оказалась плодотворной.
Существование такого количества элементов, разнородных по своим свойствам, озадачивало химиков и требовало упорядочения и систематизации элементов. Многие учёные занимались поисками закономерностей в списке элементов и добивались определённого прогресса. Можно выделить три наиболее значительные работы, которые оспаривали приоритет открытия периодического закона у Д.И. Менделеева. В 1860 году состоялся первый Международный химический конгресс, после которого стало ясно, что основной характеристикой химического элемента является его атомный вес. Французский учёный Б. де Шанкуртуа в 1862 году впервые расположил элементы в порядке возрастания атомных весов и разместил их по спирали вокруг цилиндра. Каждый виток спирали содержал 16 элементов, сходные элементы, как правило, попадали в вертикальные столбцы, хотя были отмечены и значительные расхождения. Работа де Шанкуртуа осталась незамеченной, но выдвинутая им идея сортировки элементов в порядке возрастания атомных весов оказалась плодотворной. И двумя годами позже, руководствуясь этой идеей, английский химик Джон Ньюлендс разместил элементы в виде таблицы и заметил, что свойства элементов периодически повторяются через каждые семь номеров. Например, хлор по свойствам похож на фтор, калий – на натрий, селен – на серу и т.д. Данную закономерность Ньюлендс назвал «законом октав», практически опередив понятие периода. Но Ньюлендс настаивал на том, что длина периода (равная семи) является неизменной, поэтому его таблица содержит не только правильные закономерности, но и случайные пары (кобальт – хлор, железо – сера и углерод – ртуть). А вот немецкий учёный Лотар Мейер в 1870 году построил график зависимости атомного объёма элементов от их атомного веса и обнаружил отчётливую периодическую зависимость, причём длина периода не совпадала с законом октав и была переменной величиной. Во всех этих работах много общего. Де Шанкуртуа, Ньюлендс и Мейер открыли проявление периодичности изменения свойств элементов в зависимости от их атомного веса.
И двумя годами позже, руководствуясь этой идеей, английский химик Джон Ньюлендс разместил элементы в виде таблицы и заметил, что свойства элементов периодически повторяются через каждые семь номеров. Например, хлор по свойствам похож на фтор, калий – на натрий, селен – на серу и т.д. Данную закономерность Ньюлендс назвал «законом октав», практически опередив понятие периода. Но Ньюлендс настаивал на том, что длина периода (равная семи) является неизменной, поэтому его таблица содержит не только правильные закономерности, но и случайные пары (кобальт – хлор, железо – сера и углерод – ртуть). А вот немецкий учёный Лотар Мейер в 1870 году построил график зависимости атомного объёма элементов от их атомного веса и обнаружил отчётливую периодическую зависимость, причём длина периода не совпадала с законом октав и была переменной величиной. Во всех этих работах много общего. Де Шанкуртуа, Ньюлендс и Мейер открыли проявление периодичности изменения свойств элементов в зависимости от их атомного веса. Но они не смогли создать единую периодическую систему всех элементов, поскольку в открытых ими закономерностях многие элементы не находили своего места. Никаких серьёзных выводов из своих наблюдений этим учёным так же сделать не удалось, хотя они чувствовали, что многочисленные соотношения между атомными весами элементов являются проявлением какого-то общего закона. Этот общий закон был открыт великим русским химиком Дмитрием Ивановичем Менделеевым в 1869 году. Менделеев сформулировал периодический закон в виде следующих основных положений: 1. Элементы, расположенные по величине атомного веса, представляют явственную периодичность свойств. 2. Должно ожидать открытия ещё многих неизвестных простых тел, например, сходных с Al и Si элементов с атомным весом 65 – 75. современным, разбитые на 12 рядов. Теперь каждый период начинается активным щелочным металлом и заканчивается типичным неметаллом галогеном. Второй вариант системы дал возможность Менделееву предсказать существование не 4, а 12 элементов и, бросая вызов учёному миру, с изумительной точностью описал свойства трёх неизвестных элементов, которые он назвал экабор (эка на санскрите означает «одно и то же»), экаалюминий и экасилиций.
Но они не смогли создать единую периодическую систему всех элементов, поскольку в открытых ими закономерностях многие элементы не находили своего места. Никаких серьёзных выводов из своих наблюдений этим учёным так же сделать не удалось, хотя они чувствовали, что многочисленные соотношения между атомными весами элементов являются проявлением какого-то общего закона. Этот общий закон был открыт великим русским химиком Дмитрием Ивановичем Менделеевым в 1869 году. Менделеев сформулировал периодический закон в виде следующих основных положений: 1. Элементы, расположенные по величине атомного веса, представляют явственную периодичность свойств. 2. Должно ожидать открытия ещё многих неизвестных простых тел, например, сходных с Al и Si элементов с атомным весом 65 – 75. современным, разбитые на 12 рядов. Теперь каждый период начинается активным щелочным металлом и заканчивается типичным неметаллом галогеном. Второй вариант системы дал возможность Менделееву предсказать существование не 4, а 12 элементов и, бросая вызов учёному миру, с изумительной точностью описал свойства трёх неизвестных элементов, которые он назвал экабор (эка на санскрите означает «одно и то же»), экаалюминий и экасилиций. Современные названия их Se, Ga, Ge. Учёный мир Запада в начале отнёсся к Менделеевской системе и его предсказаниям скептически, но всё изменилось, когда в 1875 году французский химик П. Лекок де Буабодран, исследуя спектры цинковой руды, обнаружил следы нового элемента, который он назвал галлием в честь своей родины (Галлия – древнеримское название Франции). Учёному удалось выделить этот элемент в чистом виде и изучить его свойства. А Менделеев увидел, что свойства галлия совпадают со свойствами предсказанного им экаалюминия, и сообщил Лекок де Буабодрану, что тот неверно измерил плотность галлия, которая должна быть равна 5,9-6,0 г/см3 вместо 4,7 г/см3. И действительно, более аккуратные измерения привели к правильному значению 5,904 г/см3. В 1879 году шведский химик Л. Нильсон при разделении редкоземельных элементов, полученных из минерала гадолинита, выделил новый элемент и назвал его скандием. Это оказывается предсказанный Менделеевым экабор. Окончательного признания периодический закон Д.
Современные названия их Se, Ga, Ge. Учёный мир Запада в начале отнёсся к Менделеевской системе и его предсказаниям скептически, но всё изменилось, когда в 1875 году французский химик П. Лекок де Буабодран, исследуя спектры цинковой руды, обнаружил следы нового элемента, который он назвал галлием в честь своей родины (Галлия – древнеримское название Франции). Учёному удалось выделить этот элемент в чистом виде и изучить его свойства. А Менделеев увидел, что свойства галлия совпадают со свойствами предсказанного им экаалюминия, и сообщил Лекок де Буабодрану, что тот неверно измерил плотность галлия, которая должна быть равна 5,9-6,0 г/см3 вместо 4,7 г/см3. И действительно, более аккуратные измерения привели к правильному значению 5,904 г/см3. В 1879 году шведский химик Л. Нильсон при разделении редкоземельных элементов, полученных из минерала гадолинита, выделил новый элемент и назвал его скандием. Это оказывается предсказанный Менделеевым экабор. Окончательного признания периодический закон Д. И. Менделеева добился после 1886 года, когда немецкий химик К. Винклер, анализируя серебряную руду, получил элемент, который он назвал германием. Это оказывается экасицилий. 2.2 Периодический закон и периодическая система химических элементов Периодический закон – один из важнейших законов химии. Менделеев считал, что главной характеристикой элемента является его атомная масса. Поэтому он расположил все элементы в один ряд в порядке увеличения их атомной массы. Если рассмотреть ряд элементов от Li до F, то можно увидеть, что металлические свойства элементов ослабляются, а неметаллические свойства усиливаются. Аналогично изменяются и свойства элементов в ряду от Na до Cl. Следующий знак К, как Li и Na, является типичным металлом. Высшая валентность элементов увеличивается от I y Li до V y N (кислород и фтор имеют постоянную валентность, соответственно II и I) и от I y Na до VII y Cl. Следующий элемент К, как Li и Na, имеет валентность I. В ряду оксидов от Li2O до N2O5 и гидроксидов от LiОН до HNO3 основные свойства ослабляются, а кислотные свойства усиливаются.
И. Менделеева добился после 1886 года, когда немецкий химик К. Винклер, анализируя серебряную руду, получил элемент, который он назвал германием. Это оказывается экасицилий. 2.2 Периодический закон и периодическая система химических элементов Периодический закон – один из важнейших законов химии. Менделеев считал, что главной характеристикой элемента является его атомная масса. Поэтому он расположил все элементы в один ряд в порядке увеличения их атомной массы. Если рассмотреть ряд элементов от Li до F, то можно увидеть, что металлические свойства элементов ослабляются, а неметаллические свойства усиливаются. Аналогично изменяются и свойства элементов в ряду от Na до Cl. Следующий знак К, как Li и Na, является типичным металлом. Высшая валентность элементов увеличивается от I y Li до V y N (кислород и фтор имеют постоянную валентность, соответственно II и I) и от I y Na до VII y Cl. Следующий элемент К, как Li и Na, имеет валентность I. В ряду оксидов от Li2O до N2O5 и гидроксидов от LiОН до HNO3 основные свойства ослабляются, а кислотные свойства усиливаются. Аналогично изменяются свойства оксидов в ряду от Na2O и NaOH до Cl2O7 и HClO4. Оксид калия К2О, как и оксиды лития и натрия Li2O и Na2O, является основным оксидом, а гидроксид калия КОН, как и гидроксиды лития и натрия LiOH и NaOH, является типичным основанием. Аналогично изменяются формы и свойства неметаллов от Ch5 до HF и от Sih5 до HCl. Такой характер свойств элементов и их соединений, какой наблюдается при увеличении атомной массы элементов, называется периодическим изменением. Свойства всех химических элементов при увеличении атомной массы изменяются периодически. Это периодическое изменение называется периодической зависимостью свойств элементов и их соединений от величины атомной массы. Поэтому Д.И. Менделеев сформулировал открытый им закон так: • Свойства элементов, а так же формы и свойства соединений элементов находятся в периодической зависимости от величины атомной массы элементов. Менделеев расположил периоды элементов друг под другом и в результате составил периодическую систему элементов.
Аналогично изменяются свойства оксидов в ряду от Na2O и NaOH до Cl2O7 и HClO4. Оксид калия К2О, как и оксиды лития и натрия Li2O и Na2O, является основным оксидом, а гидроксид калия КОН, как и гидроксиды лития и натрия LiOH и NaOH, является типичным основанием. Аналогично изменяются формы и свойства неметаллов от Ch5 до HF и от Sih5 до HCl. Такой характер свойств элементов и их соединений, какой наблюдается при увеличении атомной массы элементов, называется периодическим изменением. Свойства всех химических элементов при увеличении атомной массы изменяются периодически. Это периодическое изменение называется периодической зависимостью свойств элементов и их соединений от величины атомной массы. Поэтому Д.И. Менделеев сформулировал открытый им закон так: • Свойства элементов, а так же формы и свойства соединений элементов находятся в периодической зависимости от величины атомной массы элементов. Менделеев расположил периоды элементов друг под другом и в результате составил периодическую систему элементов. Он говорил, что таблица элементов – плод не только его собственного труда, но и усилий многих химиков, среди которых он особо отмечал «укрепителей периодического закона», открывших предсказанные им элементы. Для создания современной таблицы потребовалась напряженная многолетняя работа тысяч и тысяч химиков и физиков. Если бы Менделеев был сейчас жив, он, глядя на современную таблицу элементов, вполне мог бы повторить слова английского химика Дж.У.Меллора, автора классической 16- томной энциклопедии по неорганической и теоретической химии. Закончив в 1937, после 15-летней работы, свой труд, он написал с признательностью на титульном листе: «Посвящается рядовым огромной армии химиков. Их имена забыты, их работы остались»… Периодическая система – это классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона. На октябрь 2009 года известно 117 химических элементов (с порядковыми номерами с 1 по 116 и 118), из них 94 обнаружены в природе (некоторые — лишь в следовых количествах).
Он говорил, что таблица элементов – плод не только его собственного труда, но и усилий многих химиков, среди которых он особо отмечал «укрепителей периодического закона», открывших предсказанные им элементы. Для создания современной таблицы потребовалась напряженная многолетняя работа тысяч и тысяч химиков и физиков. Если бы Менделеев был сейчас жив, он, глядя на современную таблицу элементов, вполне мог бы повторить слова английского химика Дж.У.Меллора, автора классической 16- томной энциклопедии по неорганической и теоретической химии. Закончив в 1937, после 15-летней работы, свой труд, он написал с признательностью на титульном листе: «Посвящается рядовым огромной армии химиков. Их имена забыты, их работы остались»… Периодическая система – это классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона. На октябрь 2009 года известно 117 химических элементов (с порядковыми номерами с 1 по 116 и 118), из них 94 обнаружены в природе (некоторые — лишь в следовых количествах). Остальные23 получены искусственно в результате ядерных реакций – это процесс превращения Горизонтальные ряды элементов, в пределах которых свойства элементов изменяются последовательно, Менделеев назвал периодами (начинаются щелочным металлом (Li, Na, K, Rb, Cs, Fr) и заканчиваются благородным газом (He, Ne, Ar, Kr, Xe, Rn)). Исключения: первый период, который начинается водородом и седьмой период, который является незавершённым. Периоды разделяются на малые и большие. Малые периоды состоят из одного горизонтального ряда. Первый, второй и третий периоды являются малыми, в них находится 2 элемента (1-й период) или 8 элементов (2-й, 3-й периоды). Большие периоды состоят из двух горизонтальных рядов. Четвёртый, пятый и шестой периоды являются большими, в них находятся 18 элементов (4-й, 5-й периоды) или 32 элемента (6-й, 7-й период). Верхние ряды больших периодов называются чётными, нижние ряды – нечётными. В шестом периоде лантаноиды и в седьмом периоде актиноиды располагаются в нижней части периодической системы.
Остальные23 получены искусственно в результате ядерных реакций – это процесс превращения Горизонтальные ряды элементов, в пределах которых свойства элементов изменяются последовательно, Менделеев назвал периодами (начинаются щелочным металлом (Li, Na, K, Rb, Cs, Fr) и заканчиваются благородным газом (He, Ne, Ar, Kr, Xe, Rn)). Исключения: первый период, который начинается водородом и седьмой период, который является незавершённым. Периоды разделяются на малые и большие. Малые периоды состоят из одного горизонтального ряда. Первый, второй и третий периоды являются малыми, в них находится 2 элемента (1-й период) или 8 элементов (2-й, 3-й периоды). Большие периоды состоят из двух горизонтальных рядов. Четвёртый, пятый и шестой периоды являются большими, в них находятся 18 элементов (4-й, 5-й периоды) или 32 элемента (6-й, 7-й период). Верхние ряды больших периодов называются чётными, нижние ряды – нечётными. В шестом периоде лантаноиды и в седьмом периоде актиноиды располагаются в нижней части периодической системы. В каждом периоде слева направо металлические свойства элементов ослабевают, а неметаллические свойства усиливаются. В чётных рядах больших периодов находятся только металлы. В результате в таблице имеется 7 периодов, 10 рядов и 8 вертикальных столбцов, названных группами – это совокупность элементов, которые имеют одинаковую высшую валентность в оксидах и в других соединениях. Эта валентность равна номеру группы. Исключения: Номер группы Элемент Высшая валентность I Cu Ag Au II III III VI O II VII H F I I В VIII группе только Ru и Os имеют высшую валентность VIII. Группы — вертикальные последовательности элементов, они нумеруется римской цифрой от I до VIII и русскими буквами А и Б. Каждая группа состоит из двух подгрупп: главной и побочной. Главная подгруппа – А, содержит элементы малых и больших периодов. Побочная подгруппа – В, содержит элементы только больших периодов. В них входят элементы периодов, начиная с четвёртого. В главных подгруппах сверху вниз металлические свойства усиливаются, а не металлические свойства ослабляются.
В каждом периоде слева направо металлические свойства элементов ослабевают, а неметаллические свойства усиливаются. В чётных рядах больших периодов находятся только металлы. В результате в таблице имеется 7 периодов, 10 рядов и 8 вертикальных столбцов, названных группами – это совокупность элементов, которые имеют одинаковую высшую валентность в оксидах и в других соединениях. Эта валентность равна номеру группы. Исключения: Номер группы Элемент Высшая валентность I Cu Ag Au II III III VI O II VII H F I I В VIII группе только Ru и Os имеют высшую валентность VIII. Группы — вертикальные последовательности элементов, они нумеруется римской цифрой от I до VIII и русскими буквами А и Б. Каждая группа состоит из двух подгрупп: главной и побочной. Главная подгруппа – А, содержит элементы малых и больших периодов. Побочная подгруппа – В, содержит элементы только больших периодов. В них входят элементы периодов, начиная с четвёртого. В главных подгруппах сверху вниз металлические свойства усиливаются, а не металлические свойства ослабляются. Все элементы побочных подгрупп являются металлами. 2.4 Периодический закон и его обоснование Периодический закон позволил привести в систему и обобщить огромный объем научной информации в химии. Эту функцию закона принято называть интегративной. Особо четко она проявляется в структурировании научного и учебного материала химии. Академик А. Е. Ферсман говорил, что система объединила всю химию в рамки единой пространственной, хронологической, генетической, энергетической связи. Интегративная роль Периодического закона проявилась и в том, что некоторые данные об элементах, якобы выпадавшие из общих закономерностей, были проверены и уточнены как самим автором, так и его последователями. Так случилось с характеристиками бериллия. До работы Менделеева его считали трехвалентным аналогом алюминия из-за их так называемого диагонального сходства. Таким образом, во втором периоде оказывалось два трехвалентных элемента и ни одного двухвалентного. Именно на этой стадии Менделеев заподозрил ошибку в исследованиях свойств бериллия, он нашел работу российского химика Авдеева, утверждавшего, что бериллий двухвалентен и имеет атомный вес 9.
Все элементы побочных подгрупп являются металлами. 2.4 Периодический закон и его обоснование Периодический закон позволил привести в систему и обобщить огромный объем научной информации в химии. Эту функцию закона принято называть интегративной. Особо четко она проявляется в структурировании научного и учебного материала химии. Академик А. Е. Ферсман говорил, что система объединила всю химию в рамки единой пространственной, хронологической, генетической, энергетической связи. Интегративная роль Периодического закона проявилась и в том, что некоторые данные об элементах, якобы выпадавшие из общих закономерностей, были проверены и уточнены как самим автором, так и его последователями. Так случилось с характеристиками бериллия. До работы Менделеева его считали трехвалентным аналогом алюминия из-за их так называемого диагонального сходства. Таким образом, во втором периоде оказывалось два трехвалентных элемента и ни одного двухвалентного. Именно на этой стадии Менделеев заподозрил ошибку в исследованиях свойств бериллия, он нашел работу российского химика Авдеева, утверждавшего, что бериллий двухвалентен и имеет атомный вес 9. Работа Авдеева оставалась не замеченной ученым миром, автор рано скончался, по-видимому, получив отравление чрезвычайно ядовитыми бериллиевыми соединениями. Результаты исследования Авдеева утвердились в науке благодаря Периодическому закону. Такие изменения и уточнения значений и атомных весов, и валентностей были сделаны Менделеевым еще для девяти элементов (In, V, Th, U, La, Ce и трех других лантаноидов). Еще у десяти элементов были исправлены только атомные веса. И все эти уточнения впоследствии были подтверждены экспериментально. об этом сказал так: «Особенно существенно отметить, что элемент 101 назван в честь великого русского химика Д. И. Менделеева американскими учеными, которые всегда считали его пионером в химии». 3. Выводы Открытие периодического закона и разработка периодической системы химических элементов Д.И. Менделеевым явились вершиной развития химии ХIX века, стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях.
Работа Авдеева оставалась не замеченной ученым миром, автор рано скончался, по-видимому, получив отравление чрезвычайно ядовитыми бериллиевыми соединениями. Результаты исследования Авдеева утвердились в науке благодаря Периодическому закону. Такие изменения и уточнения значений и атомных весов, и валентностей были сделаны Менделеевым еще для девяти элементов (In, V, Th, U, La, Ce и трех других лантаноидов). Еще у десяти элементов были исправлены только атомные веса. И все эти уточнения впоследствии были подтверждены экспериментально. об этом сказал так: «Особенно существенно отметить, что элемент 101 назван в честь великого русского химика Д. И. Менделеева американскими учеными, которые всегда считали его пионером в химии». 3. Выводы Открытие периодического закона и разработка периодической системы химических элементов Д.И. Менделеевым явились вершиной развития химии ХIX века, стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях. Обширная сумма знаний о свойствах 63 элементов, известных к тому времени, была приведена в стройный порядок. Так же можно сказать, что периодический закон является началом эпохи современной химии. Изучение строения атомов вскрывает физический смысл периодического закона и объясняет закономерности изменения свойств элементов в периодах и в группах периодической системы. Знание строения атомов явилось необходимым для понимания причин образования химической связи, а природа химической связи в молекулах определила свойства веществ. Периодическую систему по праву называют «компасом для исследователя, путеводной нитью в области химии, физики, минералогии, технике, таблицей истории и мироздания». Академик Ферсман неоднократно подчёркивал, что периодический закон помогает поискам и разведке полезных ископаемых, так как место химического элемента в периодической системе тесно связано с местом того же элемента в самой природе, его реальным местом нахождением. Возможность предсказания свойств элементов и их соединений по положению элемента в периодической системе широко использовалась и используется в различных областях промышленности техники для решения разнообразных проблем, связанных с созданием новых материалов с определёнными, заранее заданными свойствами.
Обширная сумма знаний о свойствах 63 элементов, известных к тому времени, была приведена в стройный порядок. Так же можно сказать, что периодический закон является началом эпохи современной химии. Изучение строения атомов вскрывает физический смысл периодического закона и объясняет закономерности изменения свойств элементов в периодах и в группах периодической системы. Знание строения атомов явилось необходимым для понимания причин образования химической связи, а природа химической связи в молекулах определила свойства веществ. Периодическую систему по праву называют «компасом для исследователя, путеводной нитью в области химии, физики, минералогии, технике, таблицей истории и мироздания». Академик Ферсман неоднократно подчёркивал, что периодический закон помогает поискам и разведке полезных ископаемых, так как место химического элемента в периодической системе тесно связано с местом того же элемента в самой природе, его реальным местом нахождением. Возможность предсказания свойств элементов и их соединений по положению элемента в периодической системе широко использовалась и используется в различных областях промышленности техники для решения разнообразных проблем, связанных с созданием новых материалов с определёнными, заранее заданными свойствами. Таким образом: появление периодической системы открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях появилась стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть. Периодический закон и сделанные на его основе открытия в различных областях естествознания и техники являются величайшим триумфом человеческого разума, свидетельством всё более глубокого проникновения в самые сокровенные тайны природы, успешного преобразования природы на благо человека. «Редко бывает, чтобы научное открытие оказалось чем-то совершенно неожиданным, почти всегда оно предчувствуется, однако последующим поколениям, которые пользуются апробированными ответами на все вопросы, часто нелегко оценить, каких трудностей это стоило их предшественникам». Д.И. Менделеев.
Таким образом: появление периодической системы открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях появилась стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть. Периодический закон и сделанные на его основе открытия в различных областях естествознания и техники являются величайшим триумфом человеческого разума, свидетельством всё более глубокого проникновения в самые сокровенные тайны природы, успешного преобразования природы на благо человека. «Редко бывает, чтобы научное открытие оказалось чем-то совершенно неожиданным, почти всегда оно предчувствуется, однако последующим поколениям, которые пользуются апробированными ответами на все вопросы, часто нелегко оценить, каких трудностей это стоило их предшественникам». Д.И. Менделеев.
Система химических элементов Д. И. Менделеева
Урок посвящен знакомству с историей открытия Периодического закона и изучению структуры Периодической системы химических элементов. Периодическая таблица содержит в себе огромное количество информации о химических элементах. На этом уроке вы научитесь определять по положению элемента в таблице Д.И. Менделеева его принадлежность к металлам или неметаллам, его высшую и низшую валентность.
Периодическая таблица содержит в себе огромное количество информации о химических элементах. На этом уроке вы научитесь определять по положению элемента в таблице Д.И. Менделеева его принадлежность к металлам или неметаллам, его высшую и низшую валентность.
I. Д. И. Менделеев
Еще алхимики пытались найти закон природы, на основе которого можно было бы систематизировать химические элементы. Но им недоставало надежных и подробных сведений об элементах. К середине XIX в. знаний о химических элементах стало достаточно, а число элементов возросло настолько, что в науке возникла естественная потребность в их классификации. Первые попытки классификации элементов на металлы и неметаллы оказались несостоятельными. Предшественники Д.И.Менделеева (И. В. Деберейнер, Дж. А. Ньюлендс, Л. Ю. Мейер) многое сделали для подготовки открытия периодического закона, но не смогли постичь истину. Дмитрий Иванович установил связь между массой элементов и их свойствами.
Дмитрий Иванович родился в г. Тобольске. Он был семнадцатым ребенком в семье. Закончив в родном городе гимназию, Дмитрий Иванович поступил в Санкт-Петербурге в Главный педагогический институт, после окончания которого с золотой медалью уехал на два года в научную командировку за границу. После возвращения его пригласили в Петербургский университет. Приступая к чтению лекций по химии, Менделеев не нашел ничего, что можно было бы рекомендовать студентам в качестве учебного пособия. И он решил написать новую книгу – «Основы химии».
Тобольске. Он был семнадцатым ребенком в семье. Закончив в родном городе гимназию, Дмитрий Иванович поступил в Санкт-Петербурге в Главный педагогический институт, после окончания которого с золотой медалью уехал на два года в научную командировку за границу. После возвращения его пригласили в Петербургский университет. Приступая к чтению лекций по химии, Менделеев не нашел ничего, что можно было бы рекомендовать студентам в качестве учебного пособия. И он решил написать новую книгу – «Основы химии».
Открытию периодического закона предшествовало 15 лет напряженной работы. 1 марта 1869 г. Дмитрий Иванович предполагал выехать из Петербурга в губернии по делам.
Видео-фильм о Д.И. Менделееве
II. Открытие Периодического закона
Периодический закон был открыт на основе характеристики атома – относительной атомной массы.
Менделеев расположил химические элементы в порядке возрастания их атомных масс и заметил, что свойства элементов повторяются через определенный промежуток – период, Дмитрий Иванович расположил периоды друг под другом. , так, чтобы сходные элементы располагались друг под другом – на одной вертикали, так была построена периодическая система элементов.
, так, чтобы сходные элементы располагались друг под другом – на одной вертикали, так была построена периодическая система элементов.
1 марта 1869г. Формулировка периодического закона Д.И. Менделеева.
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
К сожалению, сторонников периодического закона сначала было очень мало, даже среди русских ученых. Противников – много, особенно в Германии и Англии.
Открытие периодического закона – это блестящий образец научного предвидения: в 1870 г. Дмитрий Иванович предсказал существование трех еще неизвестных тогда элементов, которые назвал экасилицием, экаалюминием и экабором. Он сумел правильно предсказать и важнейшие свойства новых элементов. И вот через 5 лет, в 1875 г., французский ученый П.Э. Лекок де Буабодран, ничего не знавший о работах Дмитрия Ивановича, открыл новый металл, назвав его галлием. По ряду свойств и способу открытия галлий совпадал с экаалюминием, предсказанным Менделеевым. Но его вес оказался меньше предсказанного. Несмотря на это, Дмитрий Иванович послал во Францию письмо, настаивая на своем предсказании.
По ряду свойств и способу открытия галлий совпадал с экаалюминием, предсказанным Менделеевым. Но его вес оказался меньше предсказанного. Несмотря на это, Дмитрий Иванович послал во Францию письмо, настаивая на своем предсказании.
Ученый мир был ошеломлен тем, что предсказание Менделеевым свойств экаалюминияоказалось таким точным. С этого момента периодический закон начинает утверждаться в химии.
В 1879 г. Л. Нильсон в Швеции открыл скандий, в котором воплотился предсказанный Дмитрием Ивановичем экабор.
В 1886 г. К. Винклер в Германии открыл германий, который оказался экасилицием.
Но гениальность Дмитрия Ивановича Менделеева и его открытия — не только эти предсказания!
В четырёх местах периодической системы Д. И. Менделеев расположил элементы не в порядке возрастания атомных масс:
Ar – K, Co – Ni, Te – I, Th — Pa
Ещё в конце 19 века Д.И. Менделеев писал, что, по-видимому, атом состоит из других более мелких частиц. После его смерти в 1907 г. было доказано, что атом состоит из элементарных частиц. Теория строения атома подтвердила правоту Менделеева, перестановки данных элементов не в соответствии с ростом атомных масс полностью оправданы.
После его смерти в 1907 г. было доказано, что атом состоит из элементарных частиц. Теория строения атома подтвердила правоту Менделеева, перестановки данных элементов не в соответствии с ростом атомных масс полностью оправданы.
Современная формулировка периодического закона.
Свойства химических элементов и их соединений находятся в периодической зависимости от величины заряда ядер их атомов, выражающейся в периодической повторяемости структуры внешней валентной электронной оболочки.
И вот спустя более 130 лет после открытия периодического закона мы можем вернуться к словам Дмитрия Ивановича, взятым в качестве девиза нашего урока: «Периодическому закону будущее не грозит разрушением, а только надстройка и развитие обещаются». Сколько химических элементов открыто на данный момент? И это далеко не предел.
III. Периодическая система химических элементов
Графическим изображением периодического закона является периодическая система химических элементов. Это краткий конспект всей химии элементов и их соединений.
Это краткий конспект всей химии элементов и их соединений.
Изменения свойств в периодической системе с ростом величины атомных весов в периоде (слева направо):
1. Металлические свойства уменьшаются
2. Неметаллические свойства возрастают
3. Валентность элементов в формулах высших оксидов возрастает от I до VII, а в формулах летучих водородных соединений уменьшается от IV до I.
Основные принципы построения периодической системы
|
Признак сравнения |
Д.И.Менделеев |
|
Как устанавливается последовательность элементов по номерам? (что положено в основу п.с.?) |
Элементы расставлены в порядке увеличения их относительных атомных масс. При этом есть исключения. Ar – K, Co – Ni, Te – I, Th — Pa |
|
Принцип объединения элементов в группы. |
Качественный признак. Сходство свойств простых веществ и однотипных сложных. |
|
Принцип объединения элементов в периоды. |
Совокупность элементов по мере роста относительной атомной массы от одного щелочного металла до другого. |
На сегодняшний день открыто 118 химических элементов, каждый из которых занял свою ячейку в Периодической системе. Новые открываемые элементы имеют большую относительную атомную массу, чем уже известные и попадают в конец таблицы. В настоящее время используются длинная и короткая формы периодических таблиц.
В ячейке таблицы записывается символ химического элемента, его название и порядковый номер, значение относительной атомной массы.
Рис. Информация о химическом элементе кислороде
При изучении школьного курса химии, как правило, пользуются короткой формой Периодической таблицы. Она содержит 8 вертикальных столбцов (групп), которые нумеруются римскими цифрами. Каждая группа включает в себя главную (А) и побочную (В) подгруппы.
У элементов главных подгрупп высшая валентность, как правило, равна номеру группы. Одними из исключений этого правила являются кислород (его валентность всегда равна II) и фтор (высшая валентность которого – I).
С помощью Периодической таблицы можно определить и низшую валентность элемента. Для этого из 8 (максимального числа групп) надо вычесть номер группы, в которой находится элемент. Например, высшая валентность фосфора равна V (т. к. фосфор находится в V группе), а низшая равна III. Только это правило применимо для элементов главных подгрупп V–VII групп.
Горизонтальные ряды химических элементов в Периодической таблице называются периодами. Пока их 7. Первые три периода называют малыми (первый период содержит всего 2 хим. элемента, а 2 и 3 – по 8 элементов). Периоды 4, 5, 6, 7 называются большими.
По положению элемента в Периодической системе можно определить его принадлежность к металлам или неметаллам. Для этого в короткой форме таблицы нужно провести диагональ от бериллия к астату. Элементы главных подгрупп, находящиеся выше этой диагонали (плюс водород), относятся к неметаллам. Все остальные элементы – металлы. Инертные газы He, Ne, Ar, Kr, Xe, Rn не относят ни к металлам, ни к неметаллам.
В длинной форме таблицы можно провести диагональ от бора к астату. Все элементы, которые находятся ниже этой диагонали, образуют простые вещества металлы.
Рис. Длинная форма периодической системы химических элементов
По положению элемента в периодической системе можно получить информацию о его высшем оксиде и гидроксиде. У неметаллов высший оксид и гидроксид имеют кислотный характер, у металлов – основный, у переходных металлов оксид и гидроксид, как правило, амфотерные (см. рис.).
У неметаллов высший оксид и гидроксид имеют кислотный характер, у металлов – основный, у переходных металлов оксид и гидроксид, как правило, амфотерные (см. рис.).
Рис. Связь свойств элементов и образованных ими соединений
IV. Значение Периодического закона
Смотрите фильм: “Периодический закон Менделеева”
V. Тренажеры
Тренажёр №1 «Периодический закон и Периодическая система элементов Д. И. Менделеева»
Тренажёр №2. «Закономерности изменения свойств атомов элементов в периодах и группах Периодической системы элементов Д. И. Менделеева»
Тренажёр №3. «Периодический закон Д.И.Менделеева»
ЦОРы
Фильм оД. И. Менделееве
И. Менделееве
Видео фильм:“Периодический закон Менделеева”
Научные труды Д. И. Менделеева
Интересные ссылки о Д. И. Менделееве
Статья: С. И. Левченков “Краткий очерк истории химии: ПЗ и ПСХЭ”
Периодический закон Д. И. Менделеева
Принцип исключения Паули – обзор
Атомная структура и спектры
Для сильного поглощения электромагнитного излучения низкое энергетическое состояние атома аналита должно быть сильно заселено и должны соблюдаться все правила выбора. Для проверки этих критериев необходимо знать оба энергетических состояния, участвующих в переходе атома. Верхнее энергетическое состояние известно не для всех элементов, но даже в таких случаях можно сделать важные выводы из спектрального члена нижнего энергетического состояния, которым обычно является основное состояние атомов. Поэтому будет обсуждаться вывод электронной конфигурации атомов.
Поэтому будет обсуждаться вывод электронной конфигурации атомов.
Распределение электронов в атоме регулируется двумя принципами построения атома:
- (a)
Орбитали (энергетические уровни) заполняются в порядке возрастания орбитальной энергии.
- (б)
Все электроны в атоме должны находиться в разных микросостояниях, т. е. электроны должны быть различимы хотя бы по одному из своих квантовых чисел (принцип исключения Паули).
Главное квантовое число n определяет оболочку, в которой находится электрон; максимальное число электронов, находящихся в оболочке, равно 2 n 2 . Внутри оболочки электроны находятся на орбиталях различной симметрии, описываемых квантовым числом углового момента l , которое может принимать значения 0, 1, 2,…, n . На одной орбитали может находиться до двух электронов с противоположными спинами. Каждый из электронов характеризуется внутренним квантовым числом j , которое может принимать значения l±1/2.
Общие принципы построения атома (а) и (б) дополняются правилами, зависящими от магнитного и химического поведения элементов:
- (в)
Особая стабильность электронной конфигурации благородных (инертные) газы позволяют разделить электроны на две основные группы: остовные электроны, присутствующие в оболочке благородного газа, и валентные электроны, присутствующие в подоболочках. Электроны остова не участвуют в химических реакциях и не вносят вклад в генерацию спектроскопических термов, а это означает, что выяснение электронных конфигураций значительно упрощается, т.е.g.,
Se0:1s22s22p63s23p64s23d104p4=Ar4s23d104p4
- (d)
Особая устойчивость полузаполненных и полностью заполненных подоболочек d и f имеет следствием то, что конфигурации, предсказанные по правилам (a) и (b ) только менее стабильны, чем конфигурация, предсказанная дополнительным правилом (d):
CR0 =
= Ar4s13D5 = AR3D54S1
CU0 = Ar4s23D9 = Ar4s13D10 = AR3D104S1
GD0 = XE6S24F8 = XE6S24F75D1 = Xe4F75D16S2
после применения принципов построения атома и дополнительных правил (в) и (г) полученная конфигурация часто не содержит подоболочек в порядке возрастания главного квантового числа. Стандартизация легко достигается путем изменения положения подоболочек в записанных конфигурациях. Физико-химическая причина естественного порядка главного квантового числа n заключается в том, что электроны с более высокими значениями n ионизируются первыми.
Стандартизация легко достигается путем изменения положения подоболочек в записанных конфигурациях. Физико-химическая причина естественного порядка главного квантового числа n заключается в том, что электроны с более высокими значениями n ионизируются первыми.
Для выяснения спектроскопических членов, принадлежащих данной электронной конфигурации, первым шагом является установление электронной конфигурации с использованием принципов построения атома (a), (b) и дополнительных правил (c), (d) .Количество допустимых по Паули комбинаций N мс (количество микросостояний) также должно быть рассчитано, чтобы можно было проверить корректность полученных термов. Для подоболочки, частично заполненной электронами, N мс определяется выражениями:
[1]Nms(nlN)=1×2×⋯×4l+2(1×2×⋯×N)(1 ×2×⋯×(〈4l+2〉−N)) for1≤N≤4l+1
, где N — число электронов на орбиталях.
[2]Nms(nl4l+2)=1 для полностью заполненных оболочек
Если присутствует более одной частично заполненной подоболочки, произведение значений N мс , рассчитанных для всех этих подоболочек, дает число микросостояний конфигурация:
[3]Nms(nlN,n′l′N′,…)=Nms(nlN)×Nms(n′l′N′)×Nms(…)
Примером является возбужденная конфигурация Be,…, Ba (s 1 p 1 ):
Nms=1×21×1×1×2×⋯×61×1×2×⋯×5=2×6=12
Другой Примером является наземная конфигурация Gd (6s 2 4f 7 5d 1 ):
Нмс=1×1×2×⋯×141×2×⋯×7×1×2×⋯×7× 1×2×⋯×101×1×2×⋯×9=1×3432×10=34 320
Эти примеры ясно показывают, что количество микросостояний мало для нескольких валентных электронов в подоболочках s и p, но становится больше для большего количества электронов в подоболочках d и f.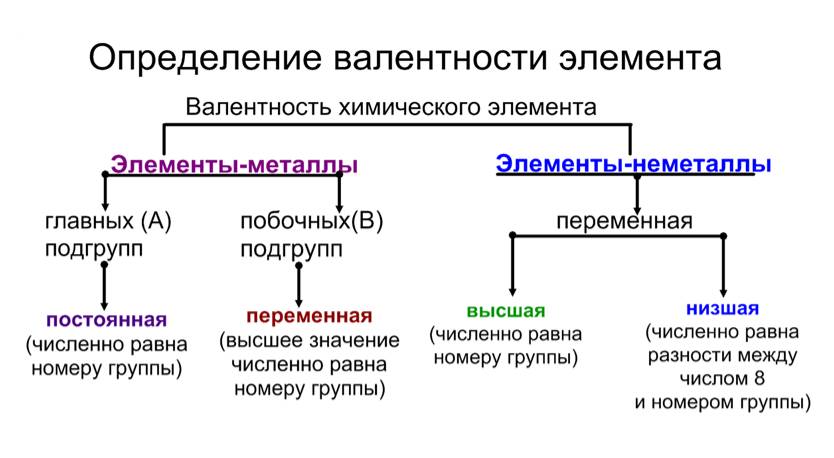
В таблице 1 перечислены электронные конфигурации и некоторые связанные свойства элементов. В подборке элементов были обнаружены два критерия:
Таблица 1. Некоторые спектрохимические характеристики элементов
| Z 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 3 | LI | 1S 2 2S 1 | 2 | 5.392 | 3.46 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | [Он] | [он] 2S 2 | 1 | 9.322 | 4.51 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 | B | [HE] 2S 2 2P 1 | 6 | 8.298 | 8.38 | 9.38 | 11 | Na | 2 | 2 | 5. 139 139 | 2,65 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 12 | MG[NE] 3 2 | 1 | 7.646 | 3.76 | 58 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 13 | AL | [NE] 3S 2 3P 1 | 65.986 | 5.31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 14 | SI[NE] 3S 2 3P 2 | 15 | 8.151 | 8.29 | 9.29||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
9| P | | 20 | 10.49 | 6.21 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 19 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 19 | К | [Ar]4s 1 | 2 | 4.341 | 2.89 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9 | CA | [AR] 4S 2 | 11 | 6.113 | 4.17 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 21 | SC | [AR] 3D 1 4S 2 | 10 | 6.54 | 7.54 | 7. 06 06 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 22 | Ti | 45 | 6.82 | 6.97 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 23 | V | [Ar]3d 3 4s 2 | 120 | 6.74 | 4.45 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 24 | CR | [AR] 3D 5 4S 1 | 5046.766 | 4.45 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MN | [AR] 3D 5 4S 2 | 252 | 7.435 | 4.18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
29| 2 4s 2 | 210 | 7.870 | 4.05 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 27 | Co | [Ar]3d 7 4s 2 | 240 | 7.86 | 3.99 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 28 | NI | [AR] 3D 8 4s 2 | 445 | 7. 635 635 | 3.96 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 29 | CU | [AR] 3D 10 4S 2 | 2 | 7.726 | 2,726 | 30153 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 30 | Zn | [AR] 3D 10 4S 2 | 21 | 9.394 | 9.394 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 31 | Ga | [Ar]3d 10 4s 2 4p 1 | 6 | 5.999 | 3.66 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| GE | [AR] 3D 2 4P 2 2 | 15 | 7.899 | 6.83 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 33 | Как | [AR 3D 10 4S 2 4P 2 4P 3 | 9 | 9.81 | 4.99 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 34 | SE | [AR] 3D 10 4S 2 4P 4 | 15 | 9. 752 752 | 4.82 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 37 | RB | [KR] 5S 1 | 2 | 4.177 | 2,65 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 38 | SR | [KR] 5S 2 | 1 | 5.695 | 4,41 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 39 | Y | [KR] 4D 1 5S 2 | 210 | 6.38 | 7.46 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 40 | ZR | [KR] 4D 2 5с 2 | 45 | 6.84 | 8.04 | 8.04 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 41 | NB | [KR] 4D 4 5S 420 | 420 | 6.88 | 80157 | 42 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 42 | MO | [KR] 4D 5 5S 1 | 504 | 7.099 | 7.099 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 43 | TC | 7.28 | — | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 44 | 44 | Ru | [Kr]4d 7 5s 1 | 240 | 7. 37 37 | 5.48 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| [KR] 4D 8 5s | 4.46 | 4.20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 46 | PD[KR] 4D 10 | 1 | 8.34 | 8.34 | 9.95 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 47 | AG | [KR] 4D 10 5S 1 | 2 | 7.576 | 2.28 | | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 48 | CD | [Kr]4d 10 5s 2 | 1 | 8.993 | 29 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 49 | в | [KR] 4D 10 5S 2 5P 1 | 65.786 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 50 | Sn | [KR] 4D 10 5S 2 5S 2 5S 2 | 15 | 7.344 | 7.344 | 5.51 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 51 | SB | [KR] 4D 10 5S 2 5P 3 | 20 | 8. 641 641 | 4.50 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 52 | TE | [KR] 4D 2 5P 4 | 9.009 | 3.90 | | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 55 | CS | [XE 6s 1 | 2 | 3.894 | 3.31 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 56 | BA | [XE] 6S 2 | 1 | 5.212 9 | 6.21 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 57 | LA | [Xe]5d 1 6s 2 | 10 | 5.577 | 8.28 | 8.28 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 59 | PR | [XE] 4F 3 6s 2 | 3645.42 | 7.82 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 60153 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 60158 | ND | [XE] 4F 4 6s 2 | 1001 | 5.49 | 7.29 | 62 | SM | [XE] 4F 6 6S 2 | 3003 | 5.63 | 5. 85 85 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 63 | 63 | 63 | Eu | [Xe]4f 7 6s 2 | 3432 | 5.67 | 4.99 | 999 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 64 | GD | [XE] 4F 7 5D 1 6S 2 | 34320 | 6.14 | 7.46 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 65 | TB | [XE ] 4F 9 6s 2 | 2002 | 5.85 | 7.39 | 9.39 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 66 | DY | [XE] 4F | 1001 | 5.93 | 6.29 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 67 | Ho | [Xe]4f 11 6s 2 | 364 | 6.02 | 6.33 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 68 | ER | [XE] 4F 12 6S 2 | 9191 | 6.10 | 6.37 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 69 | TM | [XE] 4F 13 6s 2 | 14 | 6. 18 18 | 5.20 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 70153 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 70158 | [XE] 4F 9 6s 2 | 2 | 1 | 6.254 | 4.12 | 91 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 71 | Lu | [Xe]4f 14 5d 1 6s 2 | 10 | 5.426 | 7.03 | 9.03 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 72 | HF | [XE] 4F 14 5D 2 6S 2 | 445 | 7.0 | 8.31 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 73 | TA | [XE ] 4F 14 5d 3 6s 2 | 120 | 7.89 | 8.28 | | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 74 | W | [XE] 4F 14 5D 4 6S 2 | 210 | 7.98 | 60158 | 6.96 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RE | [XE] 4F 14 5D 5 6S 2 | 252 | 7.88 | 6.50 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 76 | OS | [XE ] 4F 14 5D 6 6s 2 | 210 | 80158 | 6. 20 20 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 77 | IR | [XE] 4F 14 5D 7 6S 2 | 120 | 9.1 | 4.30 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 78 | PT | [XE] 4F 14 5D 9 6S 1 | 20 | 9.0 | 4,09 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 79 | AU | [XE ] 4F 14 5D 10 6S 10 6S 1 | 2 | 9.225 | 9.225 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 80158 | HG | [XE] 4F 14 5D 10 6S 2 | 1 | 10.44 | 2.29 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 81 | TL | [XE] 4F 14 5D 10 6s 2 6P 1 | 66.1016 | — | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 82 | PB | [XE] 4F 14 5D 14 6S 2 6P 2 | 215 | 7.416 | 3.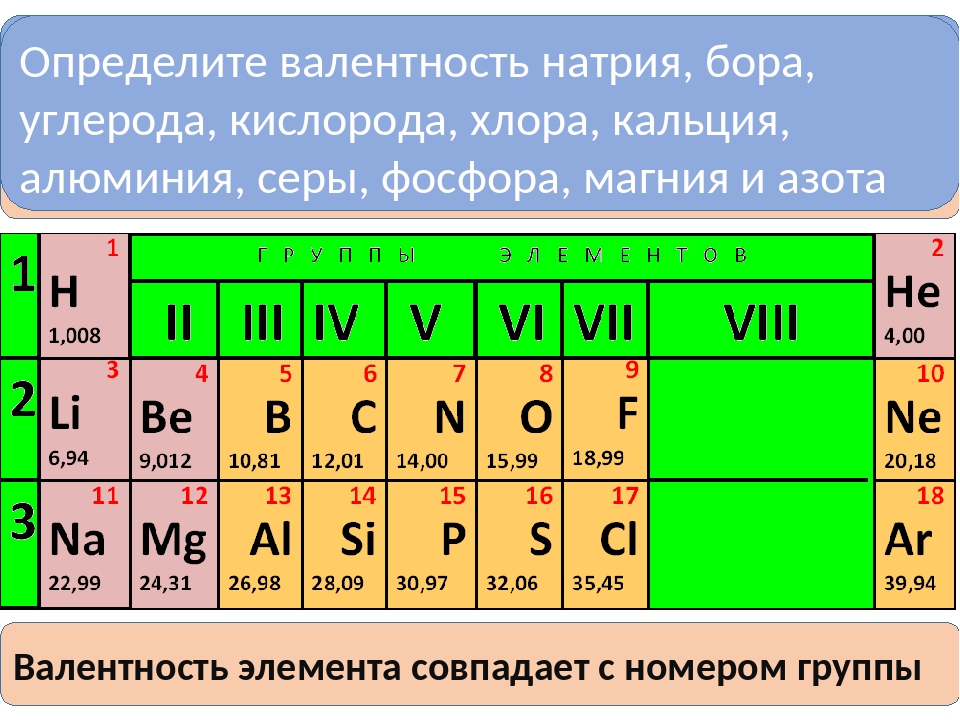 96 96 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 83 | BI | [XE] 4F 14 5D 10 6s 2 6p 3 | 20 | 7.289 | 3.50 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 92 | U | [RN] 5F 3 6D 1 7S 1 | 3640— | — | 7.87 |
Элементы с резонансными линиями между 193,70 нм. (As) и 852,11 мМ (Cs) и характеристические концентрации c 1% <100 мг л -1 . Z — число электронов, N мс — число микросостояний, E 1 — энергия первой ионизации, D 0 — энергия диссоциации связи монооксида соответствующего МО.
- (a)
Резонансная линия, т. е. линия перехода между основным состоянием и низшим возбужденным состоянием, должна находиться в спектральном диапазоне стандартных атомно-абсорбционных спектрометров (190–860 нм).

- (b)
Характеристическая концентрация, т. е. концентрация, обеспечивающая 1% абсорбцию (или 0,0044 абсорбции), должна быть ниже 100 мг л -1 .
Энергии возбуждения инертных газов, галогенов и серы настолько велики, что соответствующие резонансные линии находятся в области вакуумного ультрафиолета (УФ), где интенсивно поглощается кислород.В некоторых случаях это неспецифическое поглощение можно уменьшить с помощью защитного газа (например, Ar или N 2 ).
Элементы могут быть классифицированы на четыре спектрохимические группы на основе E 1 и D E 1 ≥7,0 и D 0 ≤4.2; (б) E 1 ≤7,0 и D 0 ≤4,2; (в) E 1 ≤7,0 и D 0 ≥4.2, г – E 1 ≥7,0 и D 0 ≥4,2.
Число микросостояний N мс , возникающих в результате соответствующей электронной конфигурации, колеблется от единицы для электронных конфигураций с закрытыми валентными оболочками до 34320 для Gd. N мс может служить мерой сложности спектров атомного поглощения (и излучения). Элемент с большим количеством микросостояний также имеет большое количество спектроскопических термов и атомных линий из-за множества возможных комбинаций термов.
N мс может служить мерой сложности спектров атомного поглощения (и излучения). Элемент с большим количеством микросостояний также имеет большое количество спектроскопических термов и атомных линий из-за множества возможных комбинаций термов.
По правилам отбора допускаются переходы, при которых квантовое число момента импульса l увеличивается на единицу, а главное квантовое число может измениться на любую величину. Разрешенные переходы электронов могут быть составлены в ряды термов, в которых главное квантовое число n предшествует символу терма как числу. Ряды, в которых л =0, 1, 2, 3, обозначаются буквами с, р, д, ф. За счет спина электронов и связанного с ним магнитного поля происходит расщепление энергетических уровней, описываемое внутренним квантовым числом j , что приводит к тонкой мультиплетной структуре спектральных линий.
Энергетические уровни могут поглощать только строго определенное количество энергии, т.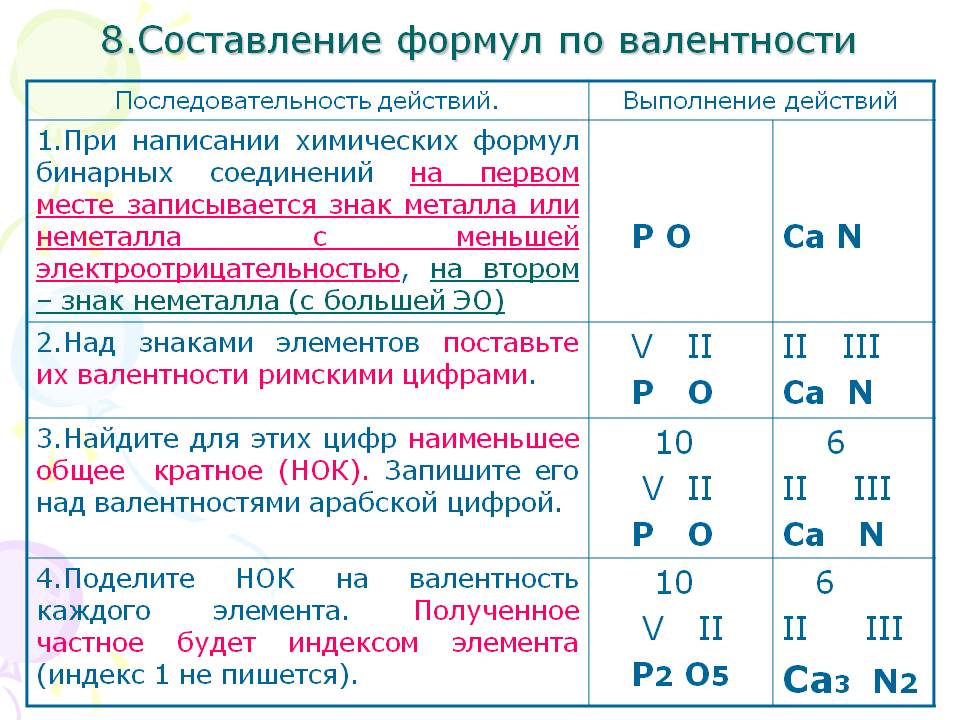 е. они квантуются в соответствии с правилами симметрии. Наиболее стабильной электронной конфигурацией атома с наименьшей энергией является основное состояние. Например, электронная конфигурация атома натрия: 1s 2 2s 2 2p 6 3s 1 (основное состояние с энергией E 0 ). Переход между 3s-орбиталью и р-орбиталью может быть осуществлен за счет поглощения света определенной длины волны, как показано на диаграмме частичного члена (Гротриана) натрия, показанной на рисунке 1.Ради ясности многие из переходов верхнего состояния опущены.
е. они квантуются в соответствии с правилами симметрии. Наиболее стабильной электронной конфигурацией атома с наименьшей энергией является основное состояние. Например, электронная конфигурация атома натрия: 1s 2 2s 2 2p 6 3s 1 (основное состояние с энергией E 0 ). Переход между 3s-орбиталью и р-орбиталью может быть осуществлен за счет поглощения света определенной длины волны, как показано на диаграмме частичного члена (Гротриана) натрия, показанной на рисунке 1.Ради ясности многие из переходов верхнего состояния опущены.
Рис. 1. Частичная диаграмма Гротриана для натрия. (Перепечатано из Robinson JW (1990) Atomic Absorbment Spectroscopy , любезно предоставлено Marcel Dekker Inc.)
Линии поглощения, обусловленные переходом между основным состоянием и нижним возбужденным состоянием атома, называются резонансными линиями. Иногда в ААС используются чередующиеся линии, чтобы расширить рабочий диапазон до более высоких концентраций или избежать спектральных помех (редко в ААС).
Для реализации первого перехода 3s→3p частота падающего света ( ν 1 ) должна соответствовать:
ν1=E1*−E0h
где E1* — энергия первого возбужденного состояния , E 0 — энергия основного состояния, h — постоянная Планка.
Интенсивность падающего света уменьшится, так как часть его будет поглощена атомами. Электрон находится в возбужденном состоянии E1* всего от 10 −7 до 10 −9 с, после чего возвращается в свое стабильное основное состояние, испуская лучистую энергию той же частоты ν 1 .
13.9 Принцип исключения Паули
Оболочки и подоболочки
Из-за принципа запрета Паули только водород и гелий могут иметь все свои электроны в состоянии n=1n=1 размера 12{n=1} {}. Литий — см. периодическую таблицу — имеет три электрона, поэтому один из них должен находиться на уровне n=2n=2 размера 12{n=2} {}. Это приводит к концепции оболочек и наполнения оболочек. По мере увеличения числа электронов мы переходим от водорода к гелию, литию, бериллию, бору и т. д. и видим, что существуют пределы числа электронов для каждого значения n.н. size 12{n} {} Более высокие значения оболочки nn size 12{n} {} соответствуют более высоким энергиям, и они могут допускать больше электронов из-за различных комбинаций l,ml,l,ml, size 12{l, m rSub { size 8{l} } } {} и msms size 12{m rSub { size 8{s} } } {}, которые возможны. Таким образом, каждое значение главного квантового числа nn размера 12{n} {} соответствует атомной оболочке, в которую может попасть ограниченное число электронов. Оболочки и количество электронов в них определяют физические и химические свойства атомов, поскольку именно внешние электроны больше всего взаимодействуют с чем-либо вне атома.
По мере увеличения числа электронов мы переходим от водорода к гелию, литию, бериллию, бору и т. д. и видим, что существуют пределы числа электронов для каждого значения n.н. size 12{n} {} Более высокие значения оболочки nn size 12{n} {} соответствуют более высоким энергиям, и они могут допускать больше электронов из-за различных комбинаций l,ml,l,ml, size 12{l, m rSub { size 8{l} } } {} и msms size 12{m rSub { size 8{s} } } {}, которые возможны. Таким образом, каждое значение главного квантового числа nn размера 12{n} {} соответствует атомной оболочке, в которую может попасть ограниченное число электронов. Оболочки и количество электронов в них определяют физические и химические свойства атомов, поскольку именно внешние электроны больше всего взаимодействуют с чем-либо вне атома.
Вероятностные облака электронов с наименьшим значением ll размера 12{l} {} находятся ближе всего к ядру и, таким образом, более тесно связаны. Таким образом, когда оболочки заполняются, они начинаются с l=0,l=0, размера 12{l=0} {} и переходят к l=1,l=1, размера 12{l=1} {} и так далее. Таким образом, каждое значение размера ll 12{l} {} соответствует подоболочке.
Таким образом, каждое значение размера ll 12{l} {} соответствует подоболочке.
В приведенной ниже таблице перечислены символы, традиционно используемые для обозначения оболочек и подоболочек.
| Корпус | Подоболочка | |
|---|---|---|
| nn размер 12{n} {} | ll размер 12{l} {} | Символ |
| 1 | 0 | размер сс 12 {s} {} |
| 2 | 1 | размер стр. 12 {p} {} |
| 3 | 2 | дд размер 12{д} {} |
| 4 | 3 | размер ff 12 {f} {} |
| 5 | 4 | gg размер 12 {г} {} |
| 5 | чч размер 12{ч} {} | |
| 6 | ii размер 12{i} {} | |
Таблица 13. 2 Символы оболочки и подоболочки
2 Символы оболочки и подоболочки
Для обозначения оболочек и подоболочек мы пишем nlnl size 12{ ital «nl»} {} с цифрой для nn size 12{n} {} и буквой для l.l. size 12{l} {} Например, электрон в состоянии n=1n=1 size 12{n=1} {} должен иметь l=0,l=0, размер 12{l=1} {} и обозначается как электрон размером 1s1s 12{1s}{}. Два электрона в состоянии n=1n=1 size 12{n=1} {} обозначаются как 1s2.1s2. size 12{1s rSup { size 8{2} } } {} Другим примером является электрон в состоянии n=2n=2 size 12{n=2} {} с l=1,l=1, size 12{l =1} {} записывается как 2p.2п. size 12{2p} {} Случай трех электронов с этими квантовыми числами записывается как 2p3.2p3. size 12{2p rSup { size 8{3} } } {} Это обозначение, называемое спектроскопическим обозначением, обобщено, как показано на рис. 13.60.
Подсчитав количество возможных комбинаций квантовых чисел, допускаемых принципом исключения, мы можем определить, сколько электронов требуется для заполнения каждой подоболочки и оболочки.
Пример 13.4. Сколько электронов может быть в этой оболочке?
Перечислите все возможные наборы квантовых чисел для оболочки n=2n=2 размера 12{n=2} {} и определите количество электронов, которые могут находиться в оболочке и каждой из ее подоболочек.
Стратегия
Учитывая n=2n=2 размер 12{n=2} {} для оболочки, правила квантовых чисел ограничивают размер ll 12{l} {} равным 0 или 1. Таким образом, оболочка имеет две подоболочки, помеченные размером 2s2s 12{2s} {} и 2p,2p, размер 12{2p} {} Поскольку подоболочка самого низкого размера ll 12{l} {} заполняется первой, мы начинаем с возможностей подоболочки 2s2s размера 12{2s} {}, а затем продолжаем с подоболочкой размера 2p2p 12{2p} {}.
Решение
Удобно перечислить возможные квантовые числа в таблице, как показано ниже.
Обсуждение
Трудно составлять подобную таблицу каждый раз, когда мы хотим знать, сколько электронов может находиться в оболочке или подоболочке.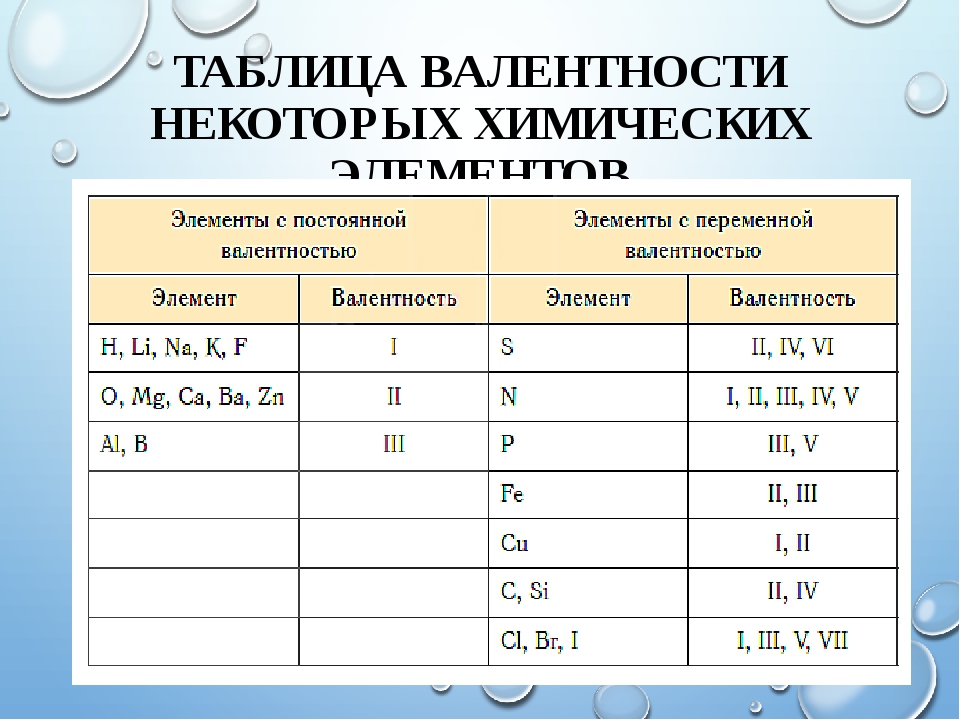 Существуют общие правила, которые легко применять, как мы сейчас увидим.
Существуют общие правила, которые легко применять, как мы сейчас увидим.
Число электронов, которые могут находиться в подоболочке, полностью зависит от значения l.l. size 12{l} {} Когда известен ll size 12{l} {}, существует фиксированное число значений ml,ml, size 12{m rSub { size 8{l} } } {}, каждое из которых может имеют два значения для ms.РС. size 12{m rSub { size 8{s} } } {} Во-первых, поскольку mlml size 12{m rSub { size 8{l} } } {} идет от −l−l size 12{-l} {} до l с шагом один, есть 2l+12l+1 размер 12{2l+1} {} вариантов. Это число умножается на два, поскольку каждый электрон может вращаться как вверх, так и вниз. Таким образом, максимальное число электронов, которые могут находиться в подоболочке , составляет 22l+1,22l+1. size 12{2 left (2l+1 right )} {}
Например, подоболочка 2s2s size 12{2s} {} в примере 13.4 имеет максимум два электрона, так как 22l+1=20+1=222l+1=20+1=2 размер 12{2 слева (2l+1 справа)=2 слева (0+1 справа)=2 } {} для этой подоболочки. Точно так же подоболочка 2p2p размером 12{2p}{} имеет максимум шесть электронов, поскольку 22l+1=22+1=6,22l+1=22+1=6. размер 12{2 слева (2l+1 справа)=2 слева (2+1 справа)=6} {} Для оболочки максимальное число — это сумма того, что может поместиться в подоболочках. Немного алгебры показывает, что максимальное число электронов, которое может находиться в оболочке , равно 2n2,2n2. size 12{2n rSup { size 8{2} } } {}
Точно так же подоболочка 2p2p размером 12{2p}{} имеет максимум шесть электронов, поскольку 22l+1=22+1=6,22l+1=22+1=6. размер 12{2 слева (2l+1 справа)=2 слева (2+1 справа)=6} {} Для оболочки максимальное число — это сумма того, что может поместиться в подоболочках. Немного алгебры показывает, что максимальное число электронов, которое может находиться в оболочке , равно 2n2,2n2. size 12{2n rSup { size 8{2} } } {}
Например, для первой оболочки n=1,n=1 размер 12{n=1} {} и, следовательно, 2n2=2.2n2=2. size 12{2n rSup { size 8{2} } =2} {} Мы уже видели, что только два электрона могут находиться в оболочке n=1n=1 размера 12{n=1} {}. Аналогично, для второй оболочки n=2,n=2, размер 12{n=2} {} и, следовательно, 2n2=8,2n2=8. size 12{2n rSup { size 8{2} } =8} {} Как показано в примере 13.4, общее количество электронов в оболочке n=2n=2 size 12{n=2} {} равно восьми.
Пример 13.5 Подоболочки и итоги для n=3n=3 размера 12{n=3} {}
Сколько субоболочек находится в оболочке n=3n=3 размера 12{n=3} {}? Определите каждую подоболочку, рассчитайте максимальное количество электронов, которые поместятся в каждую, и убедитесь, что общее количество равно 2n2. 2н2. размер 12{2n rSup { размер 8{2} } } {}
2н2. размер 12{2n rSup { размер 8{2} } } {}
Стратегия
Подоболочки определяются значением l;l; size 12{l} {} таким образом, мы сначала определяем, какие значения ll size 12{ ital «ls»} {} допустимы, а затем применяем уравнение максимальное число электронов, которое может находиться в подоболочке =22l+1 =22l+1 size 12{2 left (2l+1 right )} {} , чтобы найти количество электронов в каждой подоболочке.
Решение
Поскольку n=3,n=3, размер 12{n=3} {}, мы знаем, что ll может быть 0, 1, 0, 1 или 2;2; таким образом, есть три возможных подоболочки.В стандартной нотации они обозначаются как подоболочки 3s, 3s, 3p, 3p и 3d3d размера 12{3d} {}. Мы уже видели, что два электрона могут находиться в состоянии ss, а шесть — в состоянии pp size 12{p} {} , но воспользуемся уравнением максимальное число электронов, которое может находиться в подоболочке = 22l+122l +1 размер 12{2 слева (2l+1 справа)} {} для расчета максимального числа в каждом:
13,55 3 с имеет л знак равно 0 ; таким образом, 2 2л + 1 знак равно 2 0 + 1 знак равно 2 3 п имеет л знак равно 1; таким образом, 2 2л + 1 знак равно 2 2 + 1 знак равно 6 3 д имеет л знак равно 2; таким образом, 2 2л + 1 знак равно 2 4 + 1 знак равно 10 Всего знак равно 18 ( в н знак равно 3 оболочки ). 3
с
имеет
л
знак равно
0
;
таким образом,
2
2л
+
1
знак равно
2
0
+
1
знак равно
2
3
п
имеет
л
знак равно
1; таким образом, 2
2л
+
1
знак равно
2
2
+
1
знак равно
6
3
д
имеет
л
знак равно
2; таким образом, 2
2л
+
1
знак равно
2
4
+
1
знак равно
10
Всего
знак равно
18
(
в
н
знак равно
3 оболочки
).
3
с
имеет
л
знак равно
0
;
таким образом,
2
2л
+
1
знак равно
2
0
+
1
знак равно
2
3
п
имеет
л
знак равно
1; таким образом, 2
2л
+
1
знак равно
2
2
+
1
знак равно
6
3
д
имеет
л
знак равно
2; таким образом, 2
2л
+
1
знак равно
2
4
+
1
знак равно
10
Всего
знак равно
18
(
в
н
знак равно
3 оболочки
).
Уравнение максимальное количество электронов, которые могут быть в оболочке = 2n22n2 размер 12{2n rSup { размер 8{2} } } {} дает максимальное число в n=3n=3 размер 12{n=3} {} оболочка должна быть
13,56 Максимальное количество электронов = 2n2 = 232 = 29 = 18. Максимальное количество электронов = 2n2 = 232 = 29 = 18.Обсуждение
Таким образом, общее число электронов в трех возможных подоболочках совпадает с формулой 2n2,2n2. size 12{2n rSup { size 8{2} } } {} В стандартной спектроскопической нотации заполненная оболочка n=3n=3 размера 12{n=3} {} обозначается как 3s23p63d10.3с23п63д10. размер 12{3s rSup { размер 8{2} } 3p rSup { размер 8{6} } 3d rSup { размер 8{«10»} } } {} Оболочки не заполняются простым способом. Прежде чем оболочка n=3n=3 размера 12{n=3} {} полностью заполнится, например, мы начинаем находить электроны в оболочке n=4n=4 размера 12{n=4} {}.
Принцип исключения Паули – объяснение, пример, применение
Принцип исключения Паули в химии позволяет нам понять расположение электронов в атомах и молекулах и, таким образом, дает объяснение классификации элементов в современной периодической таблице.
Этот принцип был сформулирован в 1925 году австрийским физиком Вольфгангом Паули .
ПринципПринцип формулируется следующим образом:
В одном атоме никакие два электрона не могут иметь одинаковых набора или одинаковые квантовых числа .
Другими словами, каждый электрон должен иметь свое уникальное состояние.
Принцип запрета Паули, однако, применим не только к электронам, но и к фермионам, или частицам с полуцелым спином.
ПримерВозьмем нейтральный нобелевский газ, атом гелия. Атом гелия имеет 2 связанных электрона, и они занимают крайнюю внешнюю оболочку с противоположными спинами.
Каждый электрон имеет n = 1, l = 0, m l = 0,
Спиновый момент каждого электрона разный. У одного электрона m с = -½, а у другого m с = ½.
Приложения- Принцип исключения Паули используется для описания электронной конфигурации химических элементов и того, как они участвуют в химической связи.

- Этот принцип также используется при определении современной периодической таблицы .
- Помимо химии, принцип запрета Паули является фундаментальным принципом квантовой механики .
- Также используется в астрофизике .
Квантовые числа — это значения, описывающие состояние электрона.
Включает следующее:
n — главное квантовое число; говорит о положении электронов в оболочках.
l – Орбитальный угловой момент; определяет форму орбитали.
m l – Магнитное квантовое число; показывает количество орбиталей и их ориентацию.
м с – квантовое число спина; определяет направление спина электрона.
Принцип гласит, что никакие два электрона в одном и том же атоме не могут иметь одинаковые значения для всех квантовых чисел.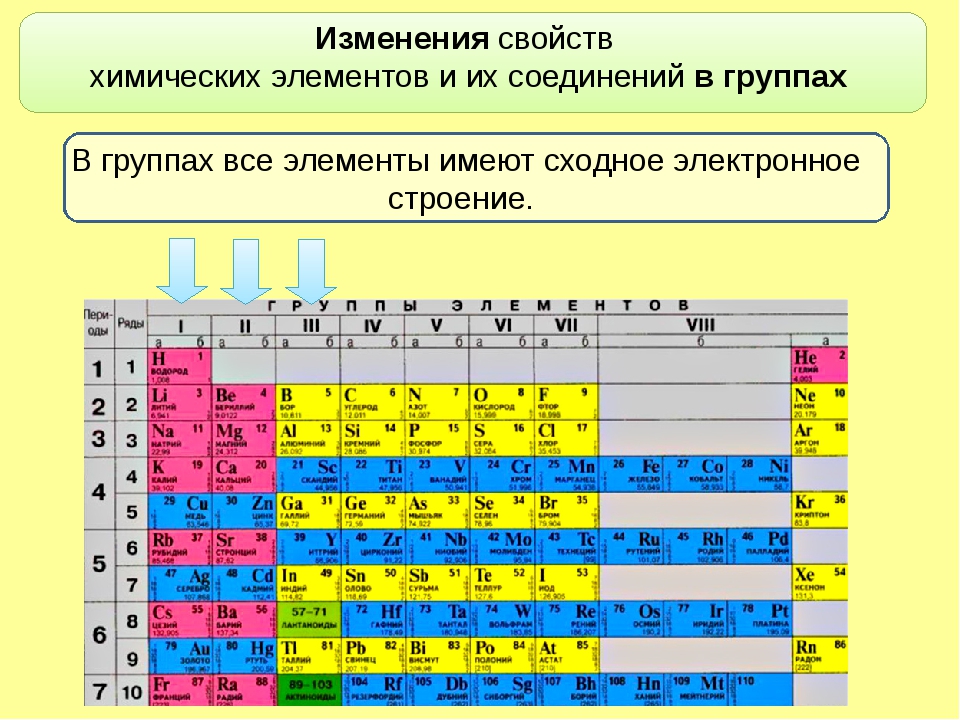
Похожие темы:
Глава 88.1 Спин электрона и принцип запрета Паули
- Определение электронной конфигурации и орбитальной диаграммы.
- Сформулируйте принцип запрета Паули.
- Применить принцип запрета Паули. (пример 8.1)
8.2 Принцип построения и периодическая таблица
- Определение принципа построения.
- Дайте определение ядра благородного газа, ядра псевдоблагородного газа и валентного электрона.
- Определите элемент основной группы и переходный элемент (d-блок и f-блок).
8.3 Запись электронных конфигураций с использованием периодической таблицы
- Определите конфигурацию атома, используя принцип построения. (пример 8.2)
- Определите конфигурацию атома, используя период и номера групп. (пример 8.
 3)
3)
8.4 Орбитальные диаграммы атомов; Правило Хунда
- Государственная гонда.
- Примените правило Хунда. (Пример 8.4)
- Дайте определение парамагнитному веществу, и диамагнитному веществу.
8.5 Предсказания Менделеева из периодической таблицы
- Опишите, как Менделеев предсказал свойства неоткрытых элементов.
8.6 Некоторые периодические свойства
- Сформулируйте периодический закон.
- Укажите общие периодические тенденции изменения размеров атомных радиусов.
- Определить эффективный ядерный заряд.
- Определение относительных размеров атомов по периодическим трендам. (пример 8.5)
- Укажите общие периодические тенденции энергии ионизации.
- Определите первую энергию ионизации.
- Определение относительных энергий ионизации по периодическим трендам.
 (пример 8.6)
(пример 8.6) - Определить сродство к электрону.
- Укажите общую общую тенденцию сродства к электрону за любой период.
8.7 Периодичность в элементах основной группы
- Дайте определение основного оксида, кислотного оксида и амфотерного оксида.
- Укажите основную группу, соответствующую щелочному металлу, щелочноземельному металлу, халькогену, галогену и благородному газу.
- Опишите изменение металлического/неметаллического характера (или реакционной способности) при прохождении через любую основную группу элементов.
Принцип исключения Паули: заявление, примеры и диаграммы
Что такое принцип исключения Паули
Состояние, в котором электрон находится на атомной орбитали, обозначается набором четырех квантовых чисел – главного квантового числа (n), азимутального квантового числа (l), магнитного квантового числа (m l ) и спинового квантового числа. (м с ).Принцип запрета Паули гласит, что никакие два электрона не могут иметь одинаковый набор квантовых чисел.
(м с ).Принцип запрета Паули гласит, что никакие два электрона не могут иметь одинаковый набор квантовых чисел.
Согласно правилу Хунда, каждая орбиталь подоболочки атома может иметь максимум два электрона. Два электрона имеют одинаковые n, l и m l квантовые числа. Однако они отличаются значениями m s . Один электрон имеет m s = +1/2 и находится в состоянии «спин вверх». Другой электрон имеет m s = -1/2 и находится в состоянии «спин вниз». Эти два электрона с противоположными спинами называются парами [1-5] .
Принцип исключения ПаулиОткрытие принципа запрета Паули приписывают австрийскому физику и лауреату Нобелевской премии Вольфгангу Паули. Он сформулировал этот принцип в 1925 г. для электронов и распространил его на другие элементарные частицы в 1940 г.
Примеры
Простейшим примером принципа запрета Паули является атом гелия с двумя электронами на его 1s-орбитали. Первые три квантовых числа таковы: n = 1, l = 0 и m l = 0. Следовательно, два электрона имеют спиновые квантовые числа: m s = +1/2 и m s = -1. /2 [1-4] .
Первые три квантовых числа таковы: n = 1, l = 0 и m l = 0. Следовательно, два электрона имеют спиновые квантовые числа: m s = +1/2 и m s = -1. /2 [1-4] .
Точно так же электронные спины кислорода, фтора и неона показаны ниже.
Пример принципа исключения Паулиприложений
Принцип запрета Паули применяется к набору фундаментальных частиц, называемых фермионами, которые имеют полуцелый спин (S = 1/2, 3/2, 5/2…). Эти частицы не нарушают принцип. С другой стороны, это не относится к бозонам с целочисленным спином (S = 1,2,3…). Принцип Паули применим и к атомам с полуцелым спином.Например, гелий-3 имеет спин +1/2.
Принцип запрета Паули может объяснить структуру электронной оболочки атомов и электронную конфигурацию элементов. Он может объяснить, как атомы образуют химические связи и как различаются химические свойства элементов. Правило Хунда использует принцип Паули для заполнения электронами различных энергетических подуровней, тем самым создавая элементы таблицы Менделеева.
Кроме того, этот принцип применим к квантовой механике и астрофизике.В квантовой механике принцип запрета Паули утверждает, что фермионы должны иметь антисимметричную волновую функцию, в отличие от бозонов, которые имеют симметричные волновые функции [1-3] .
Каталожные номера
- Chem.libretexts.org
- Courses.lumenlearning.com
- Openstax.org
- Chemicool.com
- Thoughtco.com
Этот месяц в истории физики
Январь 1925: Вольфганг Паули провозглашает принцип исключения
1925 год был важным годом для квантовой физики, начиная с января, когда Вольфганг Паули провозгласил принцип исключения.Этот хорошо известный принцип, утверждающий, что никакие две идентичные фермионные частицы не могут находиться в одном и том же квантовом состоянии, впервые обеспечил теоретическую основу для структуры периодической таблицы элементов.Вольфганг Паули |
Вольфганг Паули родился в Вене в 1900 году, в том же году, когда родилась сама квантовая механика, когда Планк объявил об идее квантов энергии.
 Отец Паули был врачом и профессором химии Венского университета, а его крестным отцом был Эрнест Мах.Будучи юным вундеркиндом, когда ему было скучно на уроках, Паули читал статьи Эйнштейна по теории относительности. К 20 годам Паули, в то время ученик Арнольда Зоммерфельда в Мюнхенском университете, опубликовал статьи по теории относительности и написал энциклопедическую статью по теории относительности, которая произвела большое впечатление на других физиков, включая самого Альберта Эйнштейна. Изучив классическую механику и теорию относительности, Паули был сбит с толку квантовой механикой после того, как Зоммерфельд познакомил его с ней, и сначала он нашел предмет довольно запутанным.
Отец Паули был врачом и профессором химии Венского университета, а его крестным отцом был Эрнест Мах.Будучи юным вундеркиндом, когда ему было скучно на уроках, Паули читал статьи Эйнштейна по теории относительности. К 20 годам Паули, в то время ученик Арнольда Зоммерфельда в Мюнхенском университете, опубликовал статьи по теории относительности и написал энциклопедическую статью по теории относительности, которая произвела большое впечатление на других физиков, включая самого Альберта Эйнштейна. Изучив классическую механику и теорию относительности, Паули был сбит с толку квантовой механикой после того, как Зоммерфельд познакомил его с ней, и сначала он нашел предмет довольно запутанным. Возможно, из-за его гениальности профессора и коллеги Паули терпели некоторые из его наиболее раздражающих привычек, таких как его привычка очень поздно ложиться спать и редко появляться на лекциях до полудня. Кроме того, он был чрезвычайно критичен и известен тем, что высмеивал менее чем последовательную работу своих коллег, называя ее «даже не неправильной».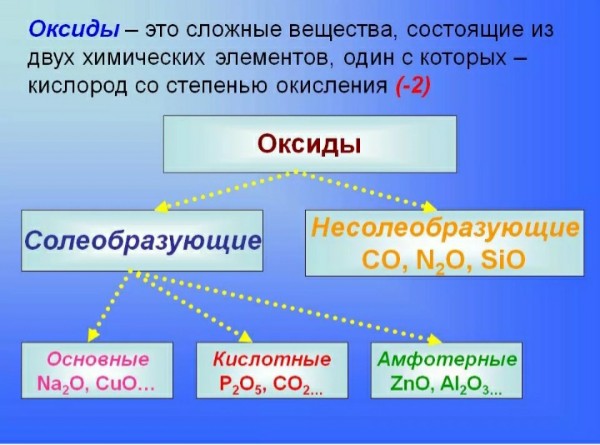 Его склонность к критике часто побуждала других разъяснять свои идеи. Паули также обладал такой удивительной склонностью к несчастным случаям, что ученые начали верить, что даже его приближение к чьей-то лаборатории означает гибель эксперимента.
Его склонность к критике часто побуждала других разъяснять свои идеи. Паули также обладал такой удивительной склонностью к несчастным случаям, что ученые начали верить, что даже его приближение к чьей-то лаборатории означает гибель эксперимента.
Получив докторскую степень в 1921 г. и проведя некоторое время в Геттингене, а затем в Копенгагене, Паули в 1923 г. поступил на работу в Гамбургский университет. структура раковины не изучена. В 1913 году Бор предположил, что электроны могут занимать только определенные квантованные орбитали, но, казалось, не было причин, по которым все электроны в атоме не могли бы просто скопиться в единственном состоянии с наинизшей энергией.Не было убедительного объяснения строения периодической таблицы. Паули также недавно работал над объяснением аномального эффекта Зеемана (следствие вращения электрона) и был убежден, что эти две проблемы каким-то образом связаны.
В конце 1924 года Паули совершил большой прорыв, предложив идею добавления четвертого квантового числа к трем, которые тогда использовались для описания квантового состояния электрона. Первые три квантовых числа имели физический смысл, поскольку относились к движению электрона вокруг ядра.Паули назвал свое новое квантовое свойство электрона «двузначностью, не поддающейся классическому описанию». Вскоре после внесения этого предложения Паули понял, что оно может привести к решению проблемы замкнутых орбиталей.
Первые три квантовых числа имели физический смысл, поскольку относились к движению электрона вокруг ядра.Паули назвал свое новое квантовое свойство электрона «двузначностью, не поддающейся классическому описанию». Вскоре после внесения этого предложения Паули понял, что оно может привести к решению проблемы замкнутых орбиталей.
Затем, в январе 1925 года, он провозгласил принцип исключения, утверждая, что никакие два электрона в атоме не могут находиться в состоянии с одинаковыми значениями четырех квантовых чисел. Каждый электрон должен был находиться в своем уникальном состоянии. Другие возможности исключены.
Предложенное Паули четвертое квантовое число озадачило физиков того времени, потому что никто не мог объяснить его физическое значение.Сам Паули был обеспокоен этой идеей. Паули также беспокоил тот факт, что он не мог дать никакого логического объяснения принципу запрета или вывести его из других законов квантовой механики, и он остался недоволен этой проблемой. Тем не менее принцип сработал — он объяснил структуру периодической таблицы и необходим для объяснения других свойств материи.
Тем не менее принцип сработал — он объяснил структуру периодической таблицы и необходим для объяснения других свойств материи.
Позже, в 1925 году, Сэмюэл Гоудсмит и Джордж Уленбек, вдохновленные работой Паули, интерпретировали четвертое квантовое число как спин электрона.Первоначально Паули применил принцип исключения для объяснения электронов в атомах, но позже он был распространен на любую систему фермионов, имеющих половинный спин, но не на бозоны, имеющие целочисленный спин.
Через два года после того, как Паули провозгласил свой принцип запрета, новая квантовая механика получила развитие благодаря гейзенберговской формулировке матричной механики и волновой механике Шрёдингера, основанной на идее де Бройля о том, что материя может обладать волнообразными свойствами.
В 1928 году Паули переехал в Цюрих.Он провел время во время Второй мировой войны в Соединенных Штатах и вернулся в Цюрих после войны. В 1931 году Паули предложил существование новой частицы, нейтрино, как решение проблемы очевидного отсутствия сохранения энергии при бета-распаде. После своих многочисленных исследовательских достижений большую часть своих последних лет он провел, размышляя об истории и философии науки.
После своих многочисленных исследовательских достижений большую часть своих последних лет он провел, размышляя об истории и философии науки.
Паули всегда настаивал на ясном и связном объяснении явления, всегда стремился найти как интуитивное понимание эксперимента, так и строгую математическую схему.Макс Борн однажды заметил: «Я знал, что он гений, сравнимый только с самим Эйнштейном. Но это был совершенно другой тип человека, который, на мой взгляд, не достиг величия Эйнштейна». В 1945 году Паули был удостоен Нобелевской премии за открытие принципа исключения. Он умер в 1958 году.
Определение принципа запрета Паули
Химическое определение принципа исключения Паули
Принцип запрета Паули гласит, что каждый электрон должен находиться в своем уникальном состоянии.Другими словами, никакие электроны в атоме не могут иметь идентичный набор квантовых чисел.
Принцип запрета Паули лежит в основе химии, помогая объяснить расположение электронов в атомах и молекулах и помогая рационализировать закономерности в периодической таблице.
В химии принцип запрета Паули применяется исключительно к электронам, которые мы собираемся обсудить.
Вольфганг Паули получил Нобелевскую премию по физике 1945 года за свое открытие применительно к электронам.
Позднее было обнаружено, что принцип запрета Паули имеет более широкое значение, о котором мы упомянем в конце этой страницы.
Четыре квантовых числа
Каждый электрон в атоме может быть полностью определен четырьмя квантовыми числами:
• n: главное квантовое число
• l: квантовое число орбитального углового момента
• m l : магнитное квантовое число
• m s : спиновое квантовое число
Пример принципа запрета Паули
Рассмотрим электронную конфигурацию аргона:
1s 2 2s 2 2p 6 3s 2 3p 6
Принцип исключения утверждает, что каждый электрон в атоме аргона находится в уникальном состоянии.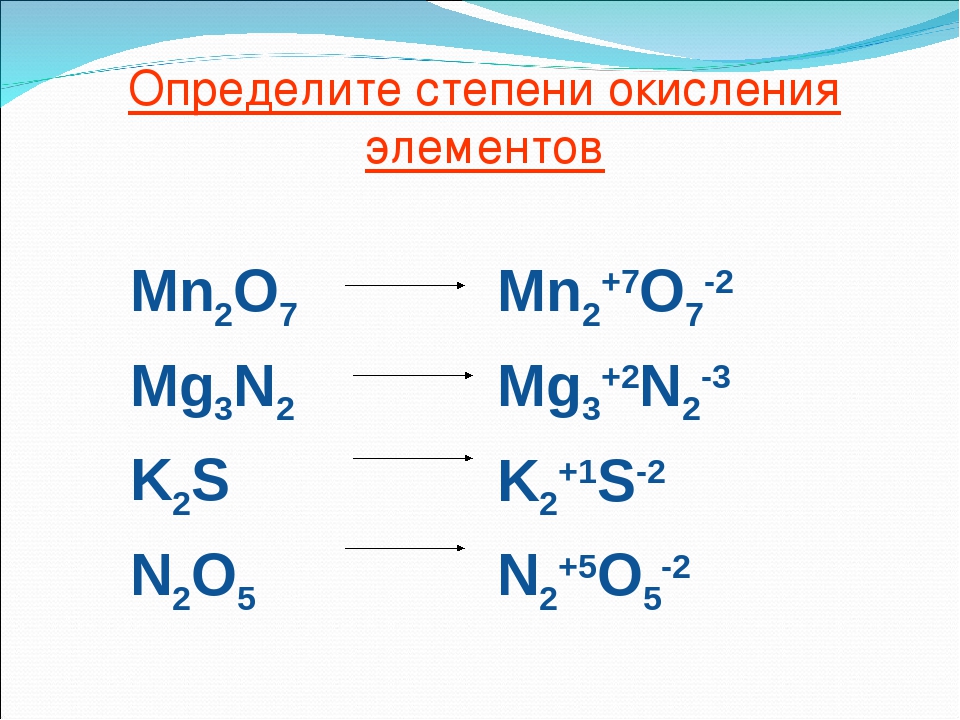
На уровне 1s могут разместиться два электрона с одинаковыми n, l и m l квантовыми числами. Пара электронов аргона на 1s-орбитали удовлетворяет принципу исключения, потому что они имеют противоположные спины, что означает, что они имеют разные спиновые квантовые числа, m s . Один спин +½, другой -½. (Вместо того, чтобы говорить +½ или -½, часто говорят, что электроны имеют спин вверх или вниз.)
Электроны 2s-уровня имеют главное квантовое число, отличное от электронов на 1s-орбитали.Пара 2s электронов отличается друг от друга, потому что они имеют противоположные спины.
Электроны 2p-уровня имеют другой орбитальный угловой момент, чем те, что находятся на s-орбиталях, поэтому буква p, а не s.
Есть три p-орбитали с одинаковой энергией: p x , p y и p z .
Эти орбитали отличаются друг от друга, потому что имеют разную ориентацию в пространстве. На каждой из орбиталей p x , p y и p z может разместиться пара электронов с противоположными спинами.
На каждой из орбиталей p x , p y и p z может разместиться пара электронов с противоположными спинами.
Уровень 3s повышается до более высокого главного квантового числа; на этой орбитали находится пара электронов с противоположными спинами.
Описание уровня 3p похоже на описание уровня 2p, но главное квантовое число выше: 3p находится при более высокой энергии, чем 2p.
Общее определение принципа исключения Паули
Электроны принадлежат к широкому классу субатомных частиц, называемых фермионами. Фермионы имеют спиновые квантовые числа с полуцелыми значениями.
Кварки (верхние и нижние) и лептоны (электроны, электронные нейтрино, мюоны, мюонные нейтрино, тау- и тау-нейтрино) — все это фермионы.
Все фермионы и частицы, производные от фермионов, такие как протоны и нейтроны, подчиняются статистике Ферми-Дирака; это включает соблюдение принципа исключения Паули.
 Периодическая система химических элементов Д.И.Менделеева
Периодическая система химических элементов Д.И.Менделеева Исключение составил лишь франзуский химик Александр Эмиль Шанкуртуа, он попытался расположить все элементы в трёхмерной модели по винтовой линии, но его работа не была признана научным сообществом, а модель получилась громоздкая и неудобная.
Исключение составил лишь франзуский химик Александр Эмиль Шанкуртуа, он попытался расположить все элементы в трёхмерной модели по винтовой линии, но его работа не была признана научным сообществом, а модель получилась громоздкая и неудобная. Во первых, группы и периоды поменяны местами: группы по горизонтали, периоды по вертикали, а во-вторых, самих групп в нём как-то многовато — девятнадцать, вместо принятых на сегодня восемнадцати.
Во первых, группы и периоды поменяны местами: группы по горизонтали, периоды по вертикали, а во-вторых, самих групп в нём как-то многовато — девятнадцать, вместо принятых на сегодня восемнадцати.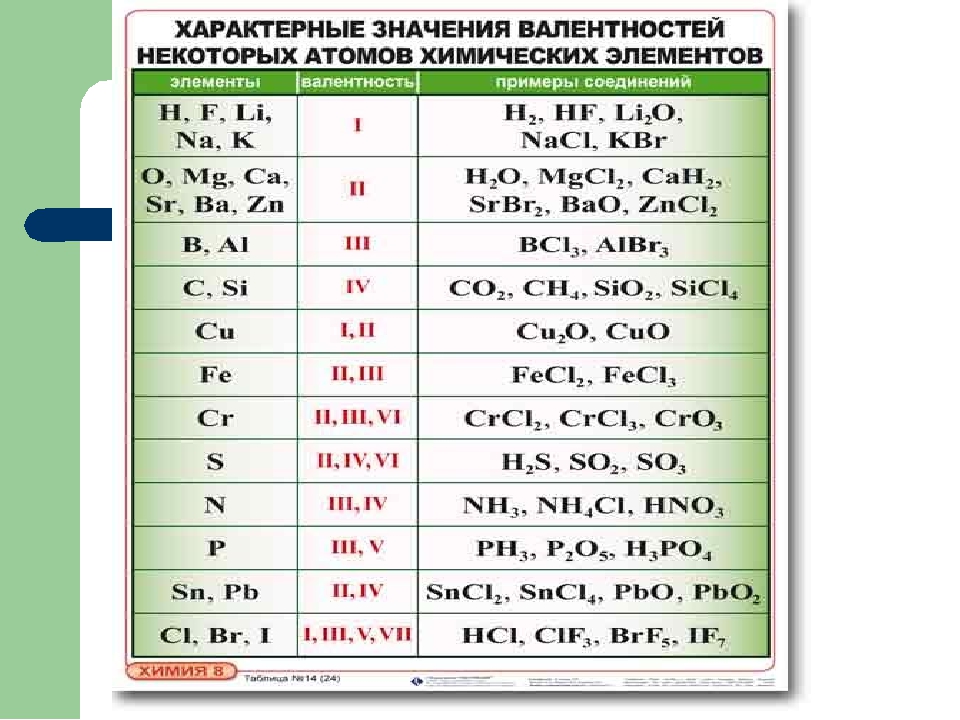
 После определения зарядов атомных ядер всех, известных на тот момент, элементов, выяснилось, что в периодической системе они располагаются в соответствии с зарядом ядра. А периодический закон приобрёл новый смысл, теперь он стал звучать так:
После определения зарядов атомных ядер всех, известных на тот момент, элементов, выяснилось, что в периодической системе они располагаются в соответствии с зарядом ядра. А периодический закон приобрёл новый смысл, теперь он стал звучать так:
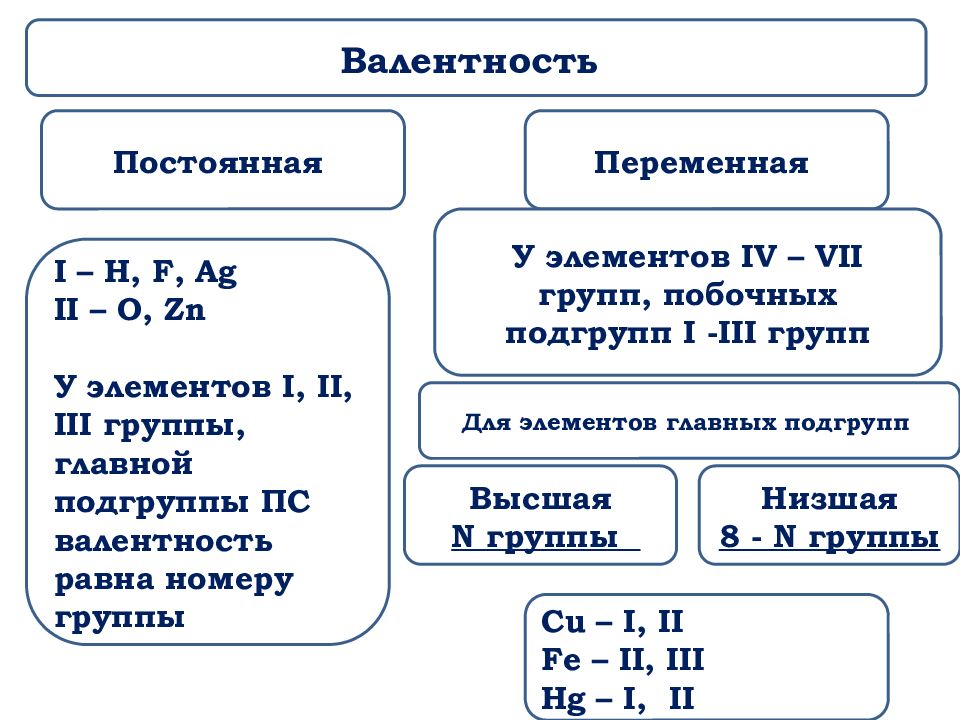 Давайте взглянем на него.
Давайте взглянем на него.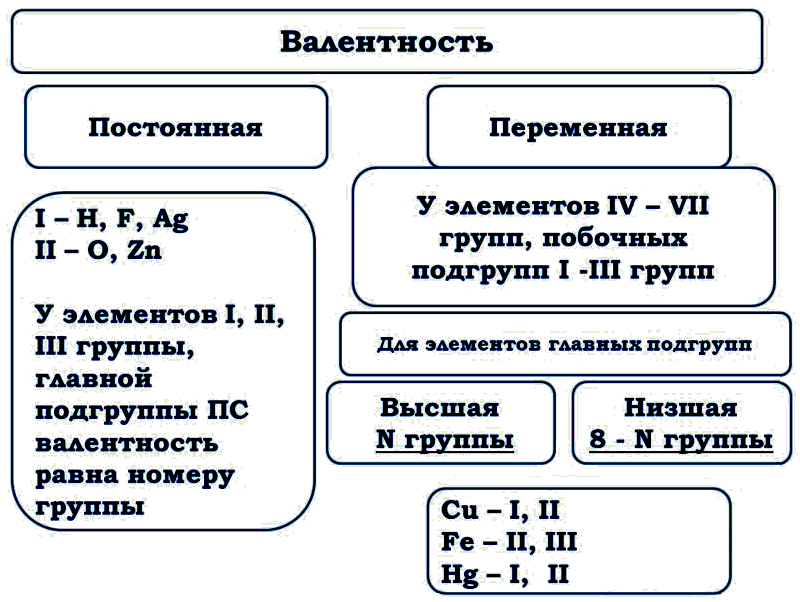 Таким образом, вся таблица разбита на следующие блоки: s-блок, на котором заполняются s-электроны, d-блок, p-блок и f-блок, с заполнением d, p, и f-электронов соответственно.
Таким образом, вся таблица разбита на следующие блоки: s-блок, на котором заполняются s-электроны, d-блок, p-блок и f-блок, с заполнением d, p, и f-электронов соответственно. Элементы его составляющие придётся вынести вниз таблицы, подобно лантаноидам или актиноидам, либо расширить эту таблицу ещё в два раза, так что она перестанет помещаться на лист формата A4. Здесь я приведу лишь ссылку на википедию (см. Расширенная периодическая система) и не буду лишний раз повторять описание этого варианта. Кому станет интересно — сможет пройти по ссылке и ознакомиться.
Элементы его составляющие придётся вынести вниз таблицы, подобно лантаноидам или актиноидам, либо расширить эту таблицу ещё в два раза, так что она перестанет помещаться на лист формата A4. Здесь я приведу лишь ссылку на википедию (см. Расширенная периодическая система) и не буду лишний раз повторять описание этого варианта. Кому станет интересно — сможет пройти по ссылке и ознакомиться.
 Он даже дал описание некоторых еще неведомых веществ.
Он даже дал описание некоторых еще неведомых веществ. Отец рано ушел из жизни. Но мать продолжала бороться за будущее своих детей, так что смогла пристроить их в хорошие учебные заведения.
Отец рано ушел из жизни. Но мать продолжала бороться за будущее своих детей, так что смогла пристроить их в хорошие учебные заведения.

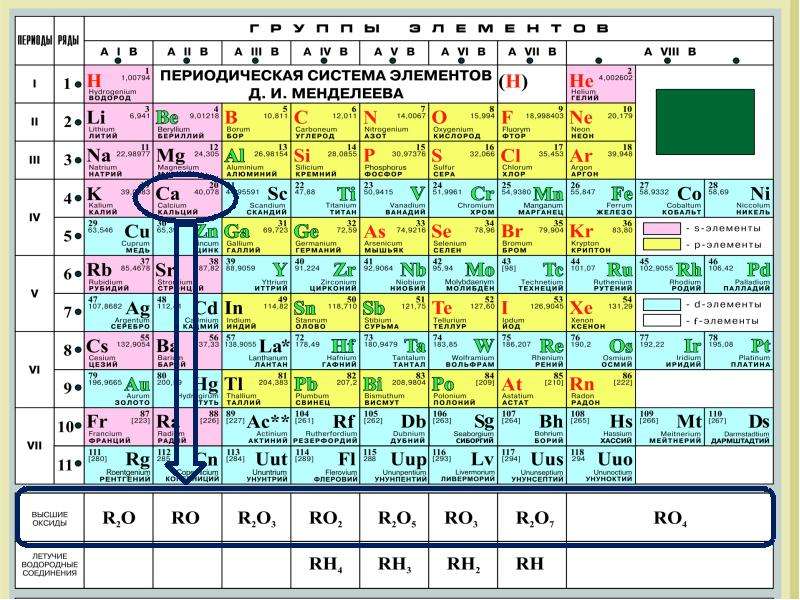
 3)
3)  (пример 8.6)
(пример 8.6)