Получение хлора и щелочи методом электролиза
Методом электролиза солевого раствора (раствор NaCl или KCl) производятся каустик или едкое кали (раствор NaOH или KOH), хлор (Cl2) и водород (h3). Электролиз проходит на современных мембранных ячейках, в соответствии с выводами документа BREF (Best Available Technique Reference Document) в отношении хлорно-щелочной промышленности.
Сырье и продукция
Сырьем для получения хлора и щелочи методом электролиза служат соль (NaCl или KCl) и вода (h3O). Соль получают из морской воды (морская соль NaCl), месторождений минерального сырья (каменная соль NaCl или KCl) или методом выпаривания (вакуумная соль NaCl или KCl).
Первичные продукты электролиза по мембранной технологии – это NaOH (щелочь 32%) или KOH (щелочь 29 — 32 %), газообразные водород и хлор.
Первичные продукты могут быть превращены в пригодные для хранения товарные продукты:
- соляная кислота (HCl 32 % — 36 %)
- натровый щелок 50 % / едкое кали 50%
-
жидкий хлор:
-
с возможностью хранения при низком давлении, например: -34°C / 1 бар (абс.
 ) или
) или - с возможностью хранения при высоком давлении, например: +20°C / 6,8 бар (абс.)
-
с возможностью хранения при низком давлении, например: -34°C / 1 бар (абс.
Хлор в качестве сухого или компримированного газа может быть также отведен по трубопроводу непосредственно на дальнейшую переработку.
Поскольку большие объемы этих продуктов используются в качестве базовых химикатов для самых различных химических продуктов, установки по производству хлора и щелочи работают преимущественно в комплексе со следующими отраслями промышленности:
- химическая промышленность
- целлюлозно-бумажная промышленность, для снабжения её отбеливателями
- промышленность с большим потреблением хлора, например, нефтехимия и производство пластмасс (например, ВХМ, ТДИ, МДИ, трихлорметан, эпихлоргидрин)
- промышленность с большим потреблением натрового щелока, как например, электролиз алюминия, фармацевтическая промышленность
Технология и электролизеры
Могут быть предложены электролизеры ведущих мировых производителей, что дает возможность учитывать специфические требования наших заказчиков.
Технология
Комплектная установка для получения хлора и щелочи состоит из следующих
технологических узлов:
- Растворение соли (каменная, выварочная или морская соль)
- Первичная очистка рассола
- Тонкая очистка рассола
- Мембранный электролиз с трансформаторно-выпрямительным блоком
- Обработка католита и водорода
- Обработка анолита и хлор-газа
- Сушка, компримирование, сжижение и хранение хлора
- Выпаривание щелочи, включая отгрузку
- В виде опции: чешуирование или гранулирование NaOH (KOH), расфасовка и отгрузка
- Система абсорбции хлора, аварийная абсорбция, с получением гипохлорита в виде опции
- Синтез соляной кислоты (HCl)
Преимущества
- Низкое энергопотребление
- Окружающая среда не загрязняется амальгамой или асбестом
- Высокая чистота продукта
- Простота в работе и управлении
- Низкие капитальные и эксплуатационные затраты
Здесь Вы найдете информацию о реализованных нами проектах.
Фосфатаза щелочная общая
Щелочная фосфатаза – группа ферментов, содержащихся практически во всех тканях организма, с преимущественной локализацией в печени, костях и плаценте. Фосфатазы в клетках участвуют в реакциях отщепления остатка фосфорной кислоты от ее органических соединений. Активность общей щелочной фосфатазы повышается при целом ряде заболеваний, сопровождающихся повреждением ткани печени, костей, почек и других органов.
Синонимы русские
Фосфатаза щелочная.
Синонимы английские
ALK PHOS, ALP, ALKP, alkaline phosphatase.
Метод исследования
Кинетический колориметрический метод.
Единицы измерения
Ед/л (единица на литр).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 12 часов перед исследованием.

- Исключить физическое и эмоциональное перенапряжение за 30 минут до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Щелочная фосфатаза – фермент, который находится в клетках печени и желчевыводящих путей и является катализатором определенных биохимических реакций в этих клетках (в кровеносном русле он не работает). При разрушении этих клеток их содержимое попадает в кровь. В норме часть клеток обновляется, поэтому в крови обнаруживается определенная активность щелочной фосфатазы. Если гибнет много клеток, она может повышаться очень значительно.
Желчь образуется в клетках печени и выделяется по системе внутрипеченочных желчевыводящих канальцев. Они затем объединяются в печеночные протоки, которые выходят за пределы печени и образуют общий желчный проток, впадающий в тонкий кишечник.
Желчь необходима для всасывания жиров, поступающих с пищей. Также посредством желчи выделяются некоторые лекарственные вещества.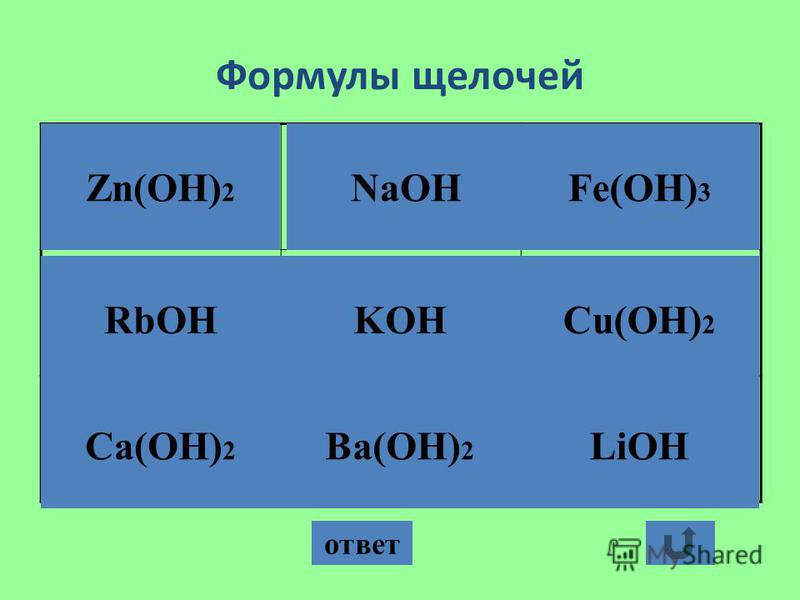
Активность щелочной фосфатазы сильно увеличивается при препятствиях оттоку желчи, например камнях в желчных протоках. Такой застой желчи называется холестазом.
В костях щелочная фосфатаза образуется в специальных клетках – остеобластах, которые играют важную роль в формировании и обновлении костной ткани. Чем выше активность остеобластов, тем выше активность щелочной фосфатазы в крови, поэтому у детей и лиц, перенесших переломы костей, активность щелочной фосфатазы на высоком уровне.
Щелочная фосфатаза также содержится в клетках кишечника и плаценты.
Для чего используется исследование?
Обычно данный тест назначают для выявления заболеваний печени или костей. Кроме того, щелочная фосфатаза повышается при болезнях, затрагивающих желчные ходы, поэтому такой анализ помогает подтвердить закупорку желчевыводящих путей при камнях в желчных протоках или опухолях поджелудочной железы.
Тест на щелочную фосфатазу, а также гамма-глутамилтрансферазу проводится для того, чтобы диагностировать заболевания, поражающие желчевыводящие пути: первичный билиарный цирроз и первичный склерозирующий холангит.
Любые состояния, которые связаны с ростом костей или повышенной активностью костных клеток, повышают активность щелочной фосфатазы. Поэтому анализ на щелочную фосфатазу может использоваться, например, для того, чтобы определить, что произошло распространение опухоли за пределы первичного очага – в кости.
Повторное назначение щелочной фосфатазы используется для контроля за активностью заболеваний, при которых она повышена, или для оценки эффективности лечения.
Когда назначается исследование?
Тест на щелочную фосфатазу может являться частью стандартных диагностических панелей, которые используются при плановых медицинских осмотрах и при подготовке пациента к хирургическому вмешательству. Обычно он также входит в «печеночные пробы», используемые для оценки функции печени.
Это исследование проводят при жалобах пациента на слабость, усталость, потерю аппетита, тошноту, рвоту, боли в животе (особенно в правом подреберье), желтуху, потемнение мочи или осветление кала, кожный зуд.
Кроме того, анализ назначается при симптомах поражений костей: болях в костях, их деформации, частых переломах.
Что означают результаты?
Референсные значения
|
Возраст, пол |
Референсные значения |
|
|
83 — 248 Ед/л |
||
|
15 дней – 1 год |
122 – 469 Ед/л |
|
|
1-10 лет |
142 — 335 Ед/л |
|
|
10-13 лет |
129 — 417 Ед/л |
|
|
13-15 лет |
женский |
57 — 254 Ед/л |
|
мужской |
116 — 468 Ед/л |
|
|
15-17 лет |
женский |
50 — 117 Ед/л |
|
мужской |
82 — 331 Ед/л |
|
|
17-19 лет |
женский |
45 — 87 Ед/л |
|
мужской |
55 — 149 Ед/л |
|
|
> 19 лет |
женский |
35 — 105 Ед/л |
|
мужской |
40 — 130 Ед/л |
|
Если показатели, полученные в результате других анализов, таких как тест на билирубин, аланинаминотрансферазу (АЛТ), аспартатаминотрансферазу (АСТ), тоже повышены, то увеличение активности щелочной фосфатазы в крови, возможно, связано с повреждением печени. Если изменены уровни кальция и фосфора, наиболее вероятная причина повышения щелочной фосфатазы – патология костной ткани.Повышение активности щелочной фосфатазы почти всегда означает поражение или вовлечение в патологический процесс печени, желчевыводящих путей или костей.
Если изменены уровни кальция и фосфора, наиболее вероятная причина повышения щелочной фосфатазы – патология костной ткани.Повышение активности щелочной фосфатазы почти всегда означает поражение или вовлечение в патологический процесс печени, желчевыводящих путей или костей.
Повышенные активности гамма-глутамилтранспептидазы (ГГТ) и 5-нуклеотидазы указывают на то, что повышение ЩФ обусловлено повреждением желчевыводящих путей.
Причины повышения активности щелочной фосфатазы
1. Поражение печени и желчевыводящих путей.
- Механическая желтуха, связанная с непроходимостью желчевыводящих протоков.
- Камни желчных протоков, рубцы желчных протоков после хирургических вмешательств.
- Опухоли желчных протоков.
- Рак головки поджелудочной железы, рак желудка при механическом сдавливании общего желчного протока, через который желчь попадает в 12-перстную кишку.
- Рак печени, метастазы опухолей других органов в печень.

- Цирроз печени – патологический процесс, в ходе которого происходит замещение нормальной печеночной ткани рубцовой, что угнетает все функции печени.
- Гепатит любого происхождения (обычно ЩФ из-за него становится в 3 раза больше нормы).
- Инфекционный мононуклеоз – острая вирусная инфекция, проявляющаяся повышением температуры, воспалением зева и увеличением лимфоузлов. При этом в патологический процесс часто вовлекается печень.
- Первичный билиарный цирроз и первичный склерозирующий холангит – это редкие заболевания, которые встречаются у взрослых людей и связаны с аутоиммунным повреждением желчных ходов. Сопровождаются крайне высокой активностью щелочной фосфатазы и гамма-глутамилтрансферазы.
2. Поражение костей.
- Особенно высокая активность ЩФ (15-20 норм) отмечается при болезни Педжета. Это заболевание, которое сопровождается патологическим ростом костей и нарушением их структуры в определенных местах.
- Остеосаркома.

- Метастазы других опухолей в кости.
- Остеомаляция – размягчение костей, вызванное недостатком кальция.
3. Другие причины.
- Гиперпаратиреоз – гормональное заболевание, связанное с избыточным образованием паратгормона околощитовидными железами, что приводит к вымыванию кальция из костей.
- Инфаркт миокарда.
- Язвенный колит, перфорация кишечника (так как щелочная фосфатаза содержится в том числе и в клетках кишечника).
Причины понижения активности щелочной фосфатазы
- Тяжелая анемия.
- Массивные переливания крови.
- Гипотиреоз – состояние, при котором снижена функция щитовидной железы.
- Недостаток магния и цинка.
- Гипофосфатазия – редкое врождённое заболевание, приводящее к размягчению костей.
- Выраженное снижение щелочной фосфатазы у беременных – признак недостаточности плаценты.
Что может влиять на результат?
- При беременности в норме активность щелочной фосфатазы повышена, так как она содержится в плаценте.

- Временное повышение активности ЩФ отмечается после переломов.
- У детей и юношей активность ЩФ выше, чем у взрослых, так у них происходит рост костей.
- Аспирин, парацетамол, аллопуринол, антибиотики и ряд других лекарств способны повышать активность щелочной фосфатазы.
- Прием оральных контрацептивов иногда приводит к снижению активности щелочной фосфатазы.
- Активность щелочной фосфатазы может быть завышенной, если кровь после взятия охлаждалась.
Растворы щелочей
Приблизительные растворы. Наиболее употребительными растворами щелочей в лабораторной практике являются растворы едкого натра NaOH. Растворы едкого кали KOH готовят редко, растворы же аммиака почти всегда покупают готовыми.
Едкий натр (или едкое кали) имеется в продаже в виде препаратов: технического, чистого и химически чистого. Разница между ними состоит в процентном содержании NaOH (или KOH)1 а следовательно, и примесей. Технический * NaOH содержит значительные количества NaCl, Na2CO3, Na2SiO3, Fe2O3 и т. д. Чистый реактив содержит минимальное количество этих примесей, а хими- » чески чистый реактив содержит только следы их.
Разница между ними состоит в процентном содержании NaOH (или KOH)1 а следовательно, и примесей. Технический * NaOH содержит значительные количества NaCl, Na2CO3, Na2SiO3, Fe2O3 и т. д. Чистый реактив содержит минимальное количество этих примесей, а хими- » чески чистый реактив содержит только следы их.
Технический едкий натр продают отлитым в железные бочки, чистый — пластинчатыми кусками, а химически чистый —в виде палочек или таблеток.
При растворении щелочи происходит сильное разогревание, в особенности в тех местах, где лежат куски ее. Чтобы растворение шло быстрее, раствор следует все время перемешивать стеклянной палочкой.
Применять стеклянную посуду при растворении щелочи не рекомендуется, потому что она может легко разбиться и работающий может пострадать, так как концентрированный раствор щелочи разъедает кожу, обувь и одежду. Если приходится готовить малые количества щелочи, то можно растворять ее и в стеклянной посуде.
Куски щелочи голыми руками брать нельзя, их следует брать тигельными щипцами, специальным пинцетом или в крайнем случае руками, но обязательно в резиновых перчатках.
Вначале рекомендуется готовить концентрированные растворы щелочи плотности 1,35—1,45 г/см3, т. е. 32— 40%-ные. В подобных концентрированных растворах
* В технике едкий натр часто называют каустической содой.
щелочи многие примеси не растворяются и при отстаивании раствора оседают на дно. Отстаивание концентрированного раствора щелочи продолжается несколько дней (не меньше двух) *. Отстоявшийся раствор осторожно сливают, лучше всего сифоном, в другой сосуд, а осадок выбрасывают или употребляют для мытья посуды.
Если в лаборатории приходится часто и в больших количествах готовить растворы щелочи, то применяют следующий прием. Сначала полностью растворяют щелочь в фарфоровой чашке, и когда раствор немного остынет (до 40—50° С), его через воронку сливают в стеклянную бутыль подходящей емкости. Бутыль хорошо закрывают резиновой пробкой, снабженной отверстием, в которое вставляют хлоркальциевую трубку, наполненную натронной известью (для поглощения двуокиси углерода). Когда щелочь отстоится и на дне образуется резко отграниченный слой осадка (в 1—2 см от дна), верхний слой раствора сливают в другую бутыль. В резиновую пробку последней вставляют две трубки, одна из которых должна входить приблизительно на 1/3 высоты бутыли, а другая должна быть на 1—2 см ниже пробки (рис. 350).
Когда щелочь отстоится и на дне образуется резко отграниченный слой осадка (в 1—2 см от дна), верхний слой раствора сливают в другую бутыль. В резиновую пробку последней вставляют две трубки, одна из которых должна входить приблизительно на 1/3 высоты бутыли, а другая должна быть на 1—2 см ниже пробки (рис. 350).
На наружный конец длинной стеклянной трубки насаживают резиновую трубку со стеклянным концом, который опускают в бутыль с отстоявшейся щелочью. Нижний конец этой трубки следует изогнуть так, как показано на рис. 350. Такой конец препятствует захвату осадка со дна бутыли даже в том случае, если конец трубки коснется осадка. Короткую трубку соединяют с вакуум-насосом. Включив насос, отстоявшийся раствор быстро и безопасно перекачивают в другую бутыль. При Переливании щелочи нужно следить, чтобы трубка, опущенная в сосуд с отстоявшейся щелочью, не поднимала осадок со дна. Поэтому ее в начале переливания держат достаточно высоко над осадком, постепенно опуская к концу переливания.
После этого определяют ареометром плотность раствора и по таблице находят процентное содержание щелочи. Если нужно приготовить более разбавленный раствор, то разбавление проводят, применяя описанные выше способы расчета.
* Естественно, что раствор едкого натра должен отстаиваться без доступа к нему двуокиси углерода. Концентрированные растворы щелочей сильно выщелачивают стекло бутылей, поэтому внутренняячасть бутыли должна быть покрыта парафином или смесью церезина и вазелина или же сплавом парафина с полиэтиленом (см. гл. 3 «Пробки и обращение с ними»).
Для покрытия стенок бутыли парафином несколько кусков его помещают внутрь бутыли и последнюю нагревают в сушильном шкафу или же над электрической плитой или газовой горелкой (осторожно) до 60—8O0C Когда парафин расплавится, бутыль поворачивают и распределяют расплавленную массу тонким слоем по всей внутренней поверхности.
Парафиновый или церезиновый слой можно нанести, применяя раствор этих веществ в авиационном бензине. Парафин вначале растворяют в бензине, полученный раствор наливают в бутыль, которая должна быть покрыта внутри парафином. Стенки бутыли обмывают внесенным раствором парафина, медленно поворачивая ее «о оси в горизонтальном положении. Когда на стекле образуется парафиновая пленка, бутыль продувают воздухом до полного вытеснения паров бензина. Затем бутыль один-два раза споласкивают водой. Только после этого ее можно заполнять щелочью или другой жидкостью.
Парафин вначале растворяют в бензине, полученный раствор наливают в бутыль, которая должна быть покрыта внутри парафином. Стенки бутыли обмывают внесенным раствором парафина, медленно поворачивая ее «о оси в горизонтальном положении. Когда на стекле образуется парафиновая пленка, бутыль продувают воздухом до полного вытеснения паров бензина. Затем бутыль один-два раза споласкивают водой. Только после этого ее можно заполнять щелочью или другой жидкостью.
Обработка бутылей для хранения щелочей особенно важна для аналитических лабораторий, так как предотвращает загрязнение титрованных растворов продуктами выщелачивания стекла.
Точные растворы. Приготовление точных растворов отличается тем, что для них берут химически чистую щелочь, растворяют ее, как указано выше, и определяют содержание щелочи титрованием точным раствором кислоты.
Титр раствора щекочи (т. е. точную концентрацию раствора) лучше всего устанавливать по раствору щавелевой кислоты (C2h3O4 •2h3O)*.
Продажную щавелевую кислоту следует один-два раза перекристаллизовывать и только после этого применять для приготовления точного раствора. Это двухосновная кислота и,следовательно, ее эквивалентный вес равен половине молекулярного. Так как последний равен 126,0665, то эквивалентный вес ее будет:
Приготовляя 0,1 и. раствор NaOH, мы должны иметь раствор щавелевой кислоты такой же нормальности, для чего на 1 л раствора ее нужно взять:
Но для установки титра такое количество раствора не нужно; достаточно приготовить 100 мл или максимум 250 мл. Для этого на аналитических весах отвешивают около 0,63 г (для 100 мл) перекристаллизованной щавелевой кислоты с точностью до четвертого десятичного знака.
Начинающие работники при взятии навесок для установки титра часто стараются отвесить точно указанное в руководстве количество вещества (в нашем случае 0,6303 г). Этого делать ни в коем случае не надо,так как такое отвешивание неминуемо требует многократных от-
* Так как едкий натр легко поглощает двуокись углерода, то в щелочи всегда присутствует углекислый натрий. Приготовив раствор едкого натра, обязательно устанавливают его концентрацию путем титрования растворов точных навесок органической кислоты, как, например, щавелевая, яблочная и др. Поэтому нет необходимости разбавлять концентрированный раствор в мерной колбе с доведением уровня раствора точно до метки; можно, перелив его в ту бутыль, где он будет храниться, добавить воду мерным цилиндром. Следует иметь в виду, что при приготовлении растворов едких щелочей основное внимание должно быть уделено защите растворов от двуокиси углерода воздуха. Всякое сокращение операций, при которых раствор может соприкасаться с воздухом, весьма желательно, сыпаний и досыпаний вещества в тару. В результате часть вещества попадает на чашки весов и на наружную стенку тары и точно отвешенное количество вещества не удастся полностью перенести в мерную колбу. Поэтому приготовленный раствор будет неточным. Наконец, очень многие вещества изменяются на воздухе (теряют кристаллизационную воду или, как говорят, «выветриваются», поглощают из воздуха двуокись углерода и т.
Приготовив раствор едкого натра, обязательно устанавливают его концентрацию путем титрования растворов точных навесок органической кислоты, как, например, щавелевая, яблочная и др. Поэтому нет необходимости разбавлять концентрированный раствор в мерной колбе с доведением уровня раствора точно до метки; можно, перелив его в ту бутыль, где он будет храниться, добавить воду мерным цилиндром. Следует иметь в виду, что при приготовлении растворов едких щелочей основное внимание должно быть уделено защите растворов от двуокиси углерода воздуха. Всякое сокращение операций, при которых раствор может соприкасаться с воздухом, весьма желательно, сыпаний и досыпаний вещества в тару. В результате часть вещества попадает на чашки весов и на наружную стенку тары и точно отвешенное количество вещества не удастся полностью перенести в мерную колбу. Поэтому приготовленный раствор будет неточным. Наконец, очень многие вещества изменяются на воздухе (теряют кристаллизационную воду или, как говорят, «выветриваются», поглощают из воздуха двуокись углерода и т. д.). Следовательно, чем дольше продолжается взвешивание; тем больше возможность загрязнения вещества. Поэтому сначала на технохимических весах берут навеску, сходя-> щуюся с требуемой в двух первых десятичных знаках, а затем на аналитических весах определяют точную массу. Навеску растворяют в соответствующем объеме растворителя.
д.). Следовательно, чем дольше продолжается взвешивание; тем больше возможность загрязнения вещества. Поэтому сначала на технохимических весах берут навеску, сходя-> щуюся с требуемой в двух первых десятичных знаках, а затем на аналитических весах определяют точную массу. Навеску растворяют в соответствующем объеме растворителя.
Зная массу взятого вещества и объем раствора, легко вычислить его точную концентрацию, которая в нашем случае будет равна не 0,1 н., а немного меньше. При таком способе несколько усложняется расчет, но достигается большая точность и значительная экономия времени.
Когда раствор будет готов, берут из него пипеткой 20 мл, переносят в коническую колбу, добавляют несколько капель фенолфталеина и титруют приготовленным раствором щелочи до появления слабого розового окрашивания.
Пример. На титрование израсходовано 22,05 мл раствора щелочи Вычислить его титр и нормальность.
Щавелевой кислоты было взято 0,6223 г вместо теоретически рассчитанного количества 0. 6303 г. Следовательно, концентрация раствора ее не точно 0,1 н., а равна
6303 г. Следовательно, концентрация раствора ее не точно 0,1 н., а равна
Чтобы вычислить нормальность раствора щелочи, следует воспользоваться соотношением N[Vi = /V2-V2, т. е. произведение объема на нормальность известного раствора равно произведению объема на нормальность неизвестного раствора. В нашем случае известным является раствор щавелевой кислоты, следовательно
Нормальность раствора щелочи равна 0,08955.
Чтобы вычислить титр, или содержание NaOH в 1 мл раствора, следует нормальность умножить на грамм-эквивалент щелочи и полученное произведение разделить на 1000. Тогда титр раствора щелочи будет:
В тех случаях, когда требуются особо чистые растворы едкого натра, их готовят или из спиртовых растворов NaOH, или из амальгамы натрия.
Металлический натрий растворяют в максимально обезвоженном этиловом спирте. Спиртовый раствор готовят приблизительно 5%-ным. Небольшой стакан, наполненный до половины и не больше чем на 3U его объема чистым керосином или лигроином, тарируют на техно-химических весгГх дробью или гирьками. Из банки, в которой хранится металлический натрий под керосином или лигроином, берут пинцетом или ножом кусочки натрия и, обрезав наружные корки ножом, переносят в тарированный стакан, отвешивая нужное количество. При этой операции гири и тару ставят на левую чашку весов, а стакан с керосином — на правую чашку. *
Из банки, в которой хранится металлический натрий под керосином или лигроином, берут пинцетом или ножом кусочки натрия и, обрезав наружные корки ножом, переносят в тарированный стакан, отвешивая нужное количество. При этой операции гири и тару ставят на левую чашку весов, а стакан с керосином — на правую чашку. *
Иногда вместо металлического натрия применяют металлический калий или растворяют в спирте гидроокись натрия или калия. Следует помнить, что растворимость при 28° С в этиловом спирте NaOH меньше, чем растворимость КОН, почти вдвое (соответственно 14,7 г/100 г и 27,9 г/100 г).
Спиртовые растворы щелочей обычно имеют слабожелтую окраску, вызываемую осмолепием при действии щелочи на примеси, особенно непредельных соединений, которые могут присутствовать в спирте.
Для приготовления бесцветных растворов КОН, не желтеющих и не темнеющих при употреблении и хранении, рекомендован следующий прием. Около 5 мл бу-тилата алюминия прибавляют при перемешивании к 1 л этилового спирта при температуре около 20° С. Этой смеси дают стоять несколько недель, но не меньше месяца, после чего спирт осторожно сливают (лучше всего с применением сифона для декантации) и добавляют к нему требуемое количество КОН. Бутилат алюминия вызывает выпадение в осадок всех примесей, от которых зависит пожелтение или даже потемнение спиртовых растворов щелочей.
Этой смеси дают стоять несколько недель, но не меньше месяца, после чего спирт осторожно сливают (лучше всего с применением сифона для декантации) и добавляют к нему требуемое количество КОН. Бутилат алюминия вызывает выпадение в осадок всех примесей, от которых зависит пожелтение или даже потемнение спиртовых растворов щелочей.
Для получения раствора NaOH можно пользоваться также амальгамой натрия. Для ее приготовления отвешивают 2,5 г металлического натрия и 100 г ртути. Ртуть наливают в пробирку, последнюю помещают в стакан, поставленный в фарфоровую чашку. Предварительно заготавливают несколько стеклянных палочек с оттянутым концом (длина палочек 35—40 см). На палочку надевают кусок асбеста так, чтобы при опускании палочки пробирка закрывалась асбестом. При шэмощи этой палочки вынимают из керосина кусочек металлического натрия величиной с горошину, быстро вытирают его фильтровальной бумагой и вносят в ртуть. Следует учитывать, что при этом возможна легкая вспышка. Постепенно вносят в ртуть весь металлический натрий. Получаемая амальгама (раствор металла в ртути) должна быть жидкой, но она может постепенно затвердеть. Жидкую амальгаму выливают в сосуд с водой, предварительно освобожденной от двуокиси углерода. Сосуд следует снабдить отводной трубкой с клапаном Бунзена. Если амальгама затвердеет, пробирку нужно разбить и кусочки амальгамы поместить в воду, не содержащую двуокиси углерода. Через два дня раствор едкого натра сливают со ртути и устанавливают его нормальность, как описано выше.
Получаемая амальгама (раствор металла в ртути) должна быть жидкой, но она может постепенно затвердеть. Жидкую амальгаму выливают в сосуд с водой, предварительно освобожденной от двуокиси углерода. Сосуд следует снабдить отводной трубкой с клапаном Бунзена. Если амальгама затвердеет, пробирку нужно разбить и кусочки амальгамы поместить в воду, не содержащую двуокиси углерода. Через два дня раствор едкого натра сливают со ртути и устанавливают его нормальность, как описано выше.
О приготовлении растворов, титр которых устанавливают по определяемому веществу, см. выше.
Для приготовления точных растворов щелочей используют также ионообменный способ. Аниониты могут быть применены для очистки растворов едкого натра и едкого кали от карбонатов и для приготовления точных растворов едкого натра и едкого кали, исходя из точных навесок хлористого натрия или хлористого калия.
Если нужно отделить только карбонаты и не загрязнять раствор ионами хлора, первые порции раствора, прошедшего через колонку в Cl-форме, отбрасывают до тех пор, пока хлорид-ион не перестанет обнаруживаться в пробе раствора.
Насыщенный карбонат-ионами анионит можно снова перевести в С1-форму обычным приемом, т. е. пропуская через колонку с соляной кислотой, затем колонку хорошо промывают водой.
Для получения точного раствора’ едкого натра или едкого кали рассчитанную навеску хлористого натрия или хлористого калия, отвешенную на аналитических весах, растворяют в дистиллированной или деминерализованной воде и полученный раствор пропускают через хро-матографическую колонку, наполненную анио-нитом в ОН-форме. Из колонки будет вытекать раствор щелочи рассчитанной концентрации.
Точные растворы NaOH или KOH лучше всего сохранять в полиэтиленовой посуде, на которую щелочи не действуют, или в стеклянной посуде парафинированной внутри.
К оглавлению
см. также
- Основные понятия о растворах
- Классификация растворов
- Концентрация растворов
- Техника приготовления растворов
- Расчеты при приготовлении водных растворов
- Растворы солей
- Растворы щелочей
- Растворы кислот
- Фиксаналы
- Некоторые замечания о титровании и точных растворах
- Расчеты при титровании с помощью весовых бюреток
- Рациональные величины
- Растворение жидкостей
- Растворение газов
- Индикаторы
- Автоматическое титрование
- Неводные растворы
- Растворение в органических растворителях
- Обесцвечивание растворов
Рубрика: Интересное от МеталлЭкспортПром Доступность и широкое использование растворов кислот, оснований и солей в промышленном производстве приводят к усилению внимания в вопросах безопасности. Гидроксид натрия – едкая щелочьЕдкий натр, как сильное основание, в воде хорошо растворим. Имеет большое значение герметичная тара, в которой реализуется и покупается щелочь. Попадание воздуха и паров воды вызывает растворение, затем образование твердой белой нерастворимой массы. В современной промышленности электролизом раствора поваренной соли получают едкую щелочь. Этот метод вытеснил известковый и ферритный способы, которые требуют значительных расходов энергии. Широкое использование гидроокиси натрия основано на разнообразных химических свойствах этого вещества. Пищевая добавка Е524 на основе едкого натра необходима в производстве маргарина, некоторых молочных продуктов, а также шоколада, карамелей, желе и джемов. В хлебопечении добавка применяется для получения коричневатой хрустящей корочки на хлебобулочных изделиях. Участники этих и других производств не должны забывать, что растворимые гидроксиды токсичны, они разъедают слизистые оболочки, кожные покровы. При этом, отмечается плохое заживление таких химических ожогов, попадание вещества в глаза может привести к потере зрение. В любом случае, попавшую на кожу или в глаза едкую щелочь следует смыть проточной водой. Проводят работу с едкой щелочью (тут подробнее о ней) в очках, надев защитную спецодежду. Разноликий триполифосфат натрия (формула Na5P3O10)Триполифосфат (в отличие от нитратов и некоторых других солей), и сам не горит, и горение не поддерживает. Различные классификаторы относят это соединение к IV классу опасности – малоопасным и безопасным веществам. Триполифосфат используется в тех отраслях, где есть опасность коррозии металлов, он является ингибитором коррозии. Особенно важны подобные свойства при хранении и перекачивании химических соединений, токсичных жидкостей. Исключительно важную роль в профилактике травм и ожогов для людей, работающих с химическими веществами, имеет санитарное просвещение. Это четкое соблюдение правил ТБ на предприятиях и в быту, аккуратное обращение и безопасное хранение едких щелочей, токсичных веществ, контроль и учет их расходования. Теплообменные аппараты холодильных установокПокупка трубопроводной арматурыИнтересное на сайте
У нас вы можете заказать ремонт кранового редуктора. Отличного вам настроения и хороших заказов у ооо «металлэкспортпром» челябинск!
|
Определение нормальности щелочи — Справочник химика 21
Опыт 1. Определение концентрации раствора щелочи титрованием. Этим методом определяют концентрацию раствора любой щелочи. Для работы необходимо иметь раствор сильной кислоты, нормальная концентрация которой определена с точностью до 0,01 н. Во время определения концентрации протекает реакция нейтрализации. Для того чтобы зафиксировать момент нейтрализации, прибегают к помощи индикаторов. Наиболее часто для определения концентрации щелочи или кислоты пользуются индикаторами метиловым оранжевым и фенолфталеином. [c.102]
Для того чтобы зафиксировать момент нейтрализации, прибегают к помощи индикаторов. Наиболее часто для определения концентрации щелочи или кислоты пользуются индикаторами метиловым оранжевым и фенолфталеином. [c.102]
ОПРЕДЕЛЕНИЕ НОРМАЛЬНОСТИ РАСТВОРА ЩЕЛОЧИ [c.248]
Назвать основные установочные вещества для определения нормальности а) кислоты б) щелочи. [c.82]
Нормальная концентрация. Нормальностью раствора называется число, показывающее, сколько грамм-эквивалентов растворенного вещества содержится в I л раствора. Задачи на определение нормальности раствора решают так же, как и предыдущую, но вместо молекулярной массы растворенного вещества берут его грамм-эквива-лент. Выражая концентрацию раствора в г-экв/л, необходимо правильно вычислять эквивалент, так как он может быть различным у одного и того же вещества в зависимости от реакции, в которую оно вступает. Так, чтобы найти эквивалент азотной кислоты в реакции его со щелочью, нужно молекулярную массу разделить на единицу Э = М/ (так как реакция сводится только к взаимодействию одного однозарядного иона водорода с ионом гидроксила). Если же азотная кислота действует как окислитель, восстанавливаясь До N0, то азот в ней меняет степень окисления от 4-5 до +2 за счет присоединения трех электронов. В этом случае эквивалент азотной кислоты будет равен /з молекулярной массы [c.15]
Так, чтобы найти эквивалент азотной кислоты в реакции его со щелочью, нужно молекулярную массу разделить на единицу Э = М/ (так как реакция сводится только к взаимодействию одного однозарядного иона водорода с ионом гидроксила). Если же азотная кислота действует как окислитель, восстанавливаясь До N0, то азот в ней меняет степень окисления от 4-5 до +2 за счет присоединения трех электронов. В этом случае эквивалент азотной кислоты будет равен /з молекулярной массы [c.15]
Определение вед т теми же способами, какими велась установка нормальности щелочи по щавелевой кислоте, и результаты вычисляют также уже известными приемами. [c.135]
Определение нормальности щелочи по рабочему раствору кислоты [c.255]
Определение концентрации рабочего раствора по другому рабочему титрованному раствору. Лучше всего каждый рабочий раствор устанавливать по отдельному исходному веществу. Однако для проверки правильности определения концентрации целесообразно проверить результаты путем титрования одного рабочего раствора другим. Так, например, нормальность раствора соляной кислоты обычно устанавливают по исходному веществу — буре раствор едкой щелочи мож ю установить по дру. ому исходному веществу —щавелевой кислоте. Тем не меиее исходные вещества (или одно нз них) могут быть недостаточно чистыми. Поэтому следует оттитровать иепосредстзенно раствор едкой щелочи раствором соляной кислоты. Если теперь результаты сойдутся с найденными ранее, установку нормальности можно считать вполне надежной. Действительно, очень мало вероятно, чтобы состав двух различных исходных веществ в одинаковой степени отклонялся от соответствующей формулы. [c.289]
Так, например, нормальность раствора соляной кислоты обычно устанавливают по исходному веществу — буре раствор едкой щелочи мож ю установить по дру. ому исходному веществу —щавелевой кислоте. Тем не меиее исходные вещества (или одно нз них) могут быть недостаточно чистыми. Поэтому следует оттитровать иепосредстзенно раствор едкой щелочи раствором соляной кислоты. Если теперь результаты сойдутся с найденными ранее, установку нормальности можно считать вполне надежной. Действительно, очень мало вероятно, чтобы состав двух различных исходных веществ в одинаковой степени отклонялся от соответствующей формулы. [c.289]
Определение нормальности щелочи [c.254]
Определение нормальности щелочи по щавелевой кислоте [c.254]
Процесс титрования состоит в том, что к определенному, точно отмеренному объему щелочи (или кислоты) постепенно прибавляют из бюретки титрованный раствор кислоты (или щелочи).
 до достижения эквивалентного количества, которое определяется с помощью соответствующего индикатора. Понятие титрованный раствор означает, что концентрация этого раствора (титр или нормальность) была предварительно установлена с определенной степенью точности. [c.17]
до достижения эквивалентного количества, которое определяется с помощью соответствующего индикатора. Понятие титрованный раствор означает, что концентрация этого раствора (титр или нормальность) была предварительно установлена с определенной степенью точности. [c.17]Определение нормальности щелочи по стандартному раствору кислоты. Наливают из бюретки в коническую колбу определенный объем титрованного раствора кислоты (20—25 мл), прибавляют одну каплю метилового оранжевого и титруют кислоту раствором щелочи до появления неисчезающей желтоватой окраски. [c.290]
Определение нормальности щелочи. …….. [c.382]
Определение нормальности раствора жидкого стекла заключается в определении в нем содержания щелочи, которое устанавливают титрованием раствора кислотой в присутствии метилоранжа в качестве индикатора. [c.154]
Вытеснение водорода применяется для определения мольных масс эквивалентов тех элементов, которые в виде простого вещества (металла) способны вытеснять водород из растворов кислот и щелочей. При этом следует помнить, что мольная масса эквивалента водорода соответствует его объему в 11200 мл при нормальных условиях, т. е. 1,008 г водорода. [c.109]
При этом следует помнить, что мольная масса эквивалента водорода соответствует его объему в 11200 мл при нормальных условиях, т. е. 1,008 г водорода. [c.109]
Определение нормальности неизвестного раствора с помощью титрованного раствора называют титрованием. Для этого определенное количество раствора, например щелочи, неизвестной нормальности вливают в стаканчик и добавляют несколько капель индикатора (лакмуса или др.). Стаканчик помещают под бюретку с титрованным раствором кислоты, налитым до пулевого деления (рис. 29). [c.75]
В тех случаях, когда препарат плохо и не вполне растворяется в воде, прибавляют сначала определенное количество нормальной щелочи для полного растворения теобромина, а затем уже производят титрование, как приведено выше. Прибавленное количество щелочи укажет, сколько миллилитров нормальной соляной кислоты надо при вычислении отнять от затраченного количества. [c.452]
Можно поступать следущим образом. Точно 20 мл кислоты, плотность которой должна быть точно известна, наливают из точно градуированной пипетки со стеклянным краном в большое количество дистиллированной воды, переливают в мерную колбу и доводят до 1000 мл, причем перечисляют миллилитры кислоты в граммы. Определенную часть раствора титруют нормальной щелочью. При отвешивании или отмеривании слишком малых количеств сильно дымящей кислоты потери, происходящие вследствие улетучивания кислоты во время этих операций, могут уже заметно понизить точность. На это следует также обращать внимание, когда вливают в дистиллированную воду небольшое количество кислоты из капельной пипетки, взвешивают пипетку вторично и титруют раствор. Определив содержание азотистой кислоты, пересчитывают на ННОд и для получения действительного содержания азотной кислоты [c.552]
Точно 20 мл кислоты, плотность которой должна быть точно известна, наливают из точно градуированной пипетки со стеклянным краном в большое количество дистиллированной воды, переливают в мерную колбу и доводят до 1000 мл, причем перечисляют миллилитры кислоты в граммы. Определенную часть раствора титруют нормальной щелочью. При отвешивании или отмеривании слишком малых количеств сильно дымящей кислоты потери, происходящие вследствие улетучивания кислоты во время этих операций, могут уже заметно понизить точность. На это следует также обращать внимание, когда вливают в дистиллированную воду небольшое количество кислоты из капельной пипетки, взвешивают пипетку вторично и титруют раствор. Определив содержание азотистой кислоты, пересчитывают на ННОд и для получения действительного содержания азотной кислоты [c.552]
Определение содержания алкилсерных кислот методом осаждения в виде бариевой соли дает неудовлетворительные результаты [114]. Окисление кислого сульфата перманганатом калия тоже не пригодно для количественного определения. Содержание кислого сульфата можно установить, применяя осаждение алкилсерной кислоты в виде бензидиновой соли и экстракцию ее из сернокислого бензидина горячим спиртом с последующим титрованием нормальной щелочью. Следует отметить, однако, что [c.21]
Содержание кислого сульфата можно установить, применяя осаждение алкилсерной кислоты в виде бензидиновой соли и экстракцию ее из сернокислого бензидина горячим спиртом с последующим титрованием нормальной щелочью. Следует отметить, однако, что [c.21]
Баритовый раствор, выделяющий осадок углекислого бария при действии углекислоты воздуха, можно применять лишь приняв все возможные предосторожности против этой реакции. Его трудно довести до определенной нормальности и еще труднее удержать последнюю неизменной, поэтому этот раствор всегда применяют, пользуясь коэффициентом пересчета. Несмотря на эти недостатки в определенных случаях раствор едкого барита имеет ряд преимуществ, например, прежде всего при титровании слабых кислот с фенолфталеином, когда он лучше всего пригоден, так как он, в противоположность растворам едкого натра и кали, может быть легко получен относительно свободным от углекислоты. Если же СО попадает в баритовый раствор, то титр его меняется вдвое больше, чем при растворах едких щелочей (см. стр. 357 и сл.). Там, где необходимо титровать с метилоранжем, применять баритовый раствор не имеет смысла. [c.391]
стр. 357 и сл.). Там, где необходимо титровать с метилоранжем, применять баритовый раствор не имеет смысла. [c.391]
Реактивы, используемые в качественном полумикроанализе, за редкими исключениями, должны иметь квалификацию чистый для анализа (ч. д. а.) или химически чистый (х. ч.). Из них приготовляют растворы с определенной нормальностью. Нормальная концентрация показывает число грамм-эквивалентов кислоты, основания или соли, содержащихся в 1 уг раствора. При полумикроанализе чаще всего употребляют 0,5 н. растворы солей и 2 н. растворы щелочей и кислот. Все неорганические вещества растворяют в дистиллированной воде. Лишь некоторые органические реагенты растворяют в этиловом спирте или ацетоне, так как они нерастворимы в воде. [c.35]
В лабораторной и технологической практике выбор способа выражения концентрации определяется не только удобством дальнейших расчетов, но и допускаемой погрешностью.
 Так, концентрацию раствора НС1, предназначенного для точных определений концентрации щелочей, лучше всего выразить в единицах нормальности и дать ее с относительной точностью порядка 0,2—0,3%. Если же соляная кислота используется для создания не очень строго обозначенной кислой среды при проведении анализа или синтеза, то ее концентрацию достаточно выразить с помощью плотности раствора. Последняя определяется ареометром (рис. 1), шкала которого позволяет определить плотность обычно с точностью до 0,005 г/см , что соответствует погрешности примерно в 1%- [c.11]
Так, концентрацию раствора НС1, предназначенного для точных определений концентрации щелочей, лучше всего выразить в единицах нормальности и дать ее с относительной точностью порядка 0,2—0,3%. Если же соляная кислота используется для создания не очень строго обозначенной кислой среды при проведении анализа или синтеза, то ее концентрацию достаточно выразить с помощью плотности раствора. Последняя определяется ареометром (рис. 1), шкала которого позволяет определить плотность обычно с точностью до 0,005 г/см , что соответствует погрешности примерно в 1%- [c.11] Реактивы, используемые в качественном полумикроанализе, за редкими исключениями, должны иметь квалификацию чистый для анализа (ч. д. а.) или химически чистый (х. ч.). Из них приготовляют растворы определенной нормальности. Нормальность показывает число грамм-эквивалентов кислоты, основания или соли, содержащихся в 1 л раствора. При полумикроанализе чаще всего употребляют 0,5н. растворы солей и 2 н. растворы щелочей и кислот. Все неорганические [c.98]
Все неорганические [c.98]
Концентрация растворов, приготовленных из навески таких веществ, будет лишь приблизительной. Точную концентрацию такого раствора определяют исходя не из массы отвешенного вещества, а на основании результатов титрования приготовленного раствора другим раствором известной концентрации. Например, для определения концентрации раствора NaOH можно использовать точные навески х. ч. щавелевой или янтарной кислоты. Взяв на аналитических весах точную навеску соответствующей кислоты, ее тщательно переносят в мерную колбу и раствор разбавляют водой до метки. Раствор хорошо перемешивают, берут пипеткой часть его и титруют раствором NaOH, концентрация которого известна лишь приблизительно, в присутствии 2—3 капель фенолфталеина. Таким путем узнают, какой объем щелочи эквивалентен взятому объему кислоты. На основании результатов титрования вычисляют нормальность щелочи [c.231]
Было изучено также влияние на каталитическую активность различного содержания активного компонента на обработанном щелочью силикагеле.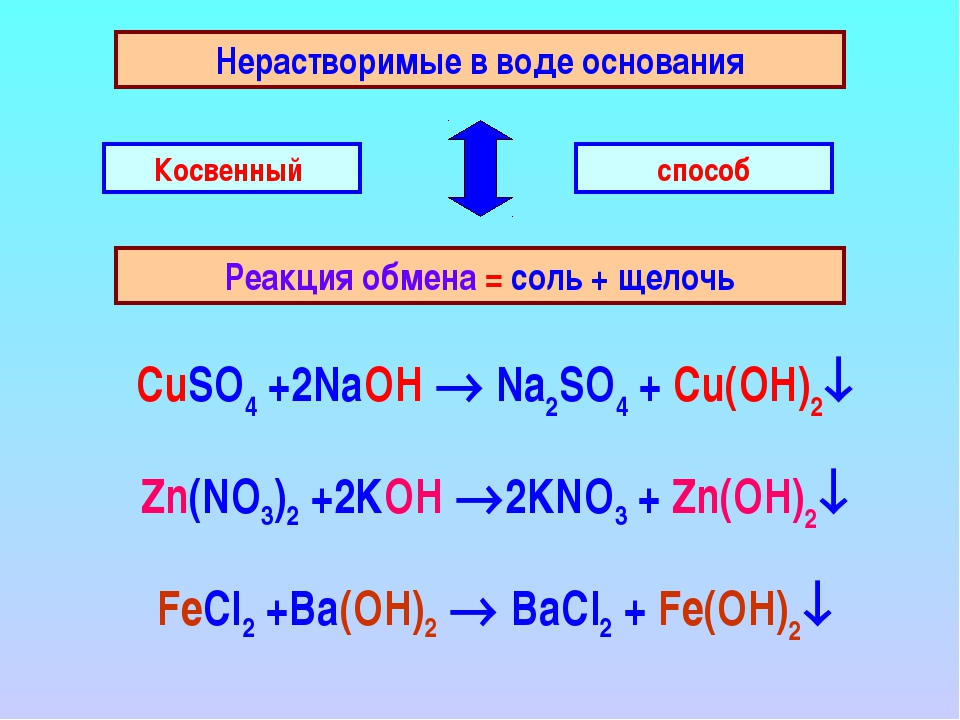 Как видно из табл. 3, увеличение содержания N10 от 1 до 5 масс, «о (образцы Л 16—18) приводит к повышению крекирующей активности катализатора (выход жидких продуктов реакции снижается от 69,2 до 64,1 масс. %). Общее содержание олефинов при этом существенно не меняется, а доля а-олефинов падает (см. рис. 4). Из этого следует, что для получения заданного содержания а-олефинов нормального строения необходимо поддерживать определенное соотношение щелочи и окиси никеля. В частности, в наших исследованиях на свежем катализаторе получен выход олефинов за проход в 33,8 масс. %, причем содержание а-олефинов составляет 55 масс. % [c.89]
Как видно из табл. 3, увеличение содержания N10 от 1 до 5 масс, «о (образцы Л 16—18) приводит к повышению крекирующей активности катализатора (выход жидких продуктов реакции снижается от 69,2 до 64,1 масс. %). Общее содержание олефинов при этом существенно не меняется, а доля а-олефинов падает (см. рис. 4). Из этого следует, что для получения заданного содержания а-олефинов нормального строения необходимо поддерживать определенное соотношение щелочи и окиси никеля. В частности, в наших исследованиях на свежем катализаторе получен выход олефинов за проход в 33,8 масс. %, причем содержание а-олефинов составляет 55 масс. % [c.89]
Измерение потенциала платины, насыщенной водородом, является удобным способом определения активности ионов водорода в окружающей ее жидкости и на этом основана так называемая. шкала pH . Если активность водородных ионов в данной жидкости равняется 10″> N, то значение pH этой жидкости выражается через п. pH кислот с нормальной активностью ионов водорода равно нулю, а в более концентрированных кислотах является отрицательной величиной. Нейтральные растворы с активностью ионов водорода около 10 имеют потенциал 7 (—0,058) = — 0,406 V по нормальной водородной шкале, а величина pH равна 7,0. Нормальные щелочи с активностью ионов водорода около 10 i N дают потенциал 14-(—0,058)=—0,812 V в единицах этой же шкалы и имеют значение pH = 14,0. Эта шкала особенно полезна для определения характера естественных вод. Кислые воды болотистых озер имеют низкие значения (5,0 или даже ниже) такие же, примерно, значения имеют кислые дождевые воды (около 6,0). Вода из большинства водопроводов имеет более высокие значения (часто между 7,0 и 8,0). Природа органических коллоидов также меняется вместе с величиной pH. Многие из этих веществ (например, желатин) имеют амфотерный характер, и в кислых растворах коллоидная частица является катионом и движется к катоду, тогда как в щелочных растворах она является анионом и движется к аноду. При некоторых определенных значениях pH она не движется ни по одному из этих направлений, и частицы, не имея заряда, проявляют склонность собираться в более крупные агрегаты.
Нейтральные растворы с активностью ионов водорода около 10 имеют потенциал 7 (—0,058) = — 0,406 V по нормальной водородной шкале, а величина pH равна 7,0. Нормальные щелочи с активностью ионов водорода около 10 i N дают потенциал 14-(—0,058)=—0,812 V в единицах этой же шкалы и имеют значение pH = 14,0. Эта шкала особенно полезна для определения характера естественных вод. Кислые воды болотистых озер имеют низкие значения (5,0 или даже ниже) такие же, примерно, значения имеют кислые дождевые воды (около 6,0). Вода из большинства водопроводов имеет более высокие значения (часто между 7,0 и 8,0). Природа органических коллоидов также меняется вместе с величиной pH. Многие из этих веществ (например, желатин) имеют амфотерный характер, и в кислых растворах коллоидная частица является катионом и движется к катоду, тогда как в щелочных растворах она является анионом и движется к аноду. При некоторых определенных значениях pH она не движется ни по одному из этих направлений, и частицы, не имея заряда, проявляют склонность собираться в более крупные агрегаты. Таким образом именно по соседству с этой изо-электри-ческой точкой коллоидные частицы находятся в незаряженном состоянии, что способствует собиранию их в хлопья. [c.337]
Таким образом именно по соседству с этой изо-электри-ческой точкой коллоидные частицы находятся в незаряженном состоянии, что способствует собиранию их в хлопья. [c.337]
В последнее время Петровым предложен другой способ определения самих сульфогсислот. Навеска в 5—Ю г контакта растворяется в 20—25 см воды и 5 спирта, затем нейтрализуется в присутствии фенолфталеина нормальной щелочью, и смесь три раза экстра- [c.326]
Приготовление раствора серной кислоты и определение его нормальности. Определение нормальности раствора серной кислоты основано на реакции нейтрализации между приготовленным раствором Н2504, нормальность которого необходимо определить, и раствором щелочи известной концентрации (нормальности). Окончание реакции нейтрализации определяют при помощи одного из индикаторов, сведения о которых приведены ниже. [c.82]
Раствор щелочи готовят следующим образом. Взвесив порцию щелочи, необходимую для получения раствора определенной нормальности (обычно для титрования готовят 0,1н растворы), высыпают ее в мерную колбу емкостью 1 л, ранее заполненную приблизительно 0,5 л дистиллированной воды.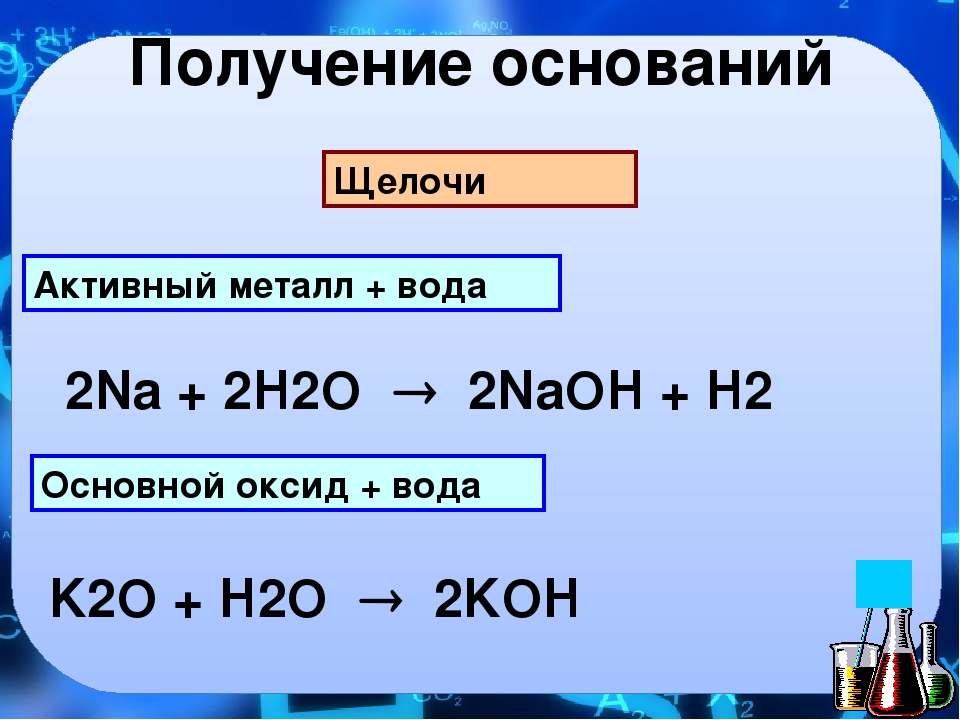 После ристворения щелочи и понижения температуры раствора до комнатной, колбу доливают дистиллированной водой до метки, соответствующей 1 л. Растворы щелочей не подлежат длительному хранению из-за взаимодействия щелочи со стеклом колбы и углекислым газом, поступающим из воздуха. [c.20]
После ристворения щелочи и понижения температуры раствора до комнатной, колбу доливают дистиллированной водой до метки, соответствующей 1 л. Растворы щелочей не подлежат длительному хранению из-за взаимодействия щелочи со стеклом колбы и углекислым газом, поступающим из воздуха. [c.20]
Так, Штыренковым [20] предложена эмпирическая формула для определения силикатного модуля натриевых жидких стекол п=55,16(е—1 —2,28, где е — плотность раствора силиката натрия N — нормальность щелочи в этом растворе, определенная — титрованием. На рис. 24 представлены в качестве примера для системы КгО—5Юг—НгО графики, позволяющие по плотности и содержанию КгО или ЗЮг определить модуль раствора, или наоборот. Графики, предназначенные для работы, делают более крупными и наносят на них более частую сетку. Для определения плотности в технических целях используют наборы ареометров. [c.44]
Навеска удобрения Навеска растворена в объеме воды (мл) Взято испытуемого раствора для определения (мл) Навеска удобрения, соответствующая раствору, взятому на определение (г) Пошло на растворение осадка 0,3265-нормальной щелочи (мл) Поправка к титру 0,3265-нормальной и16Л0ЧИ [c.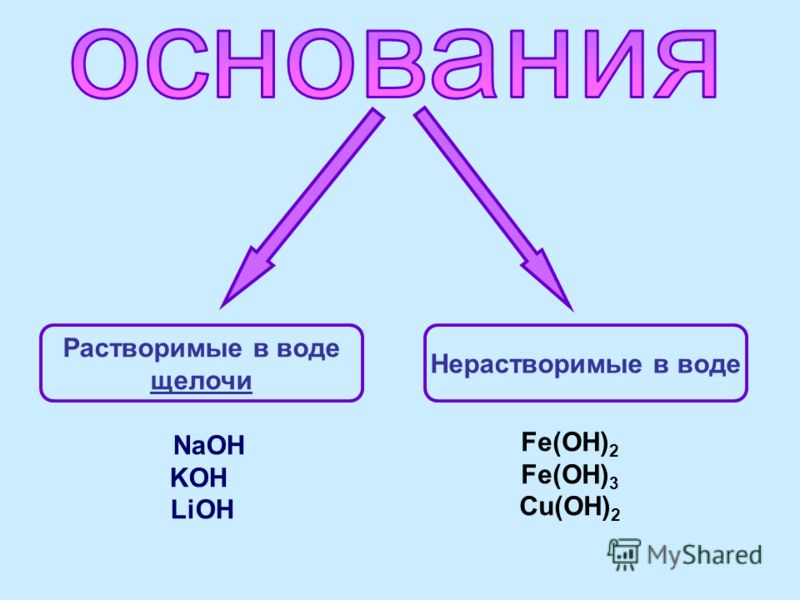 169]
169]
Водные растворы сернистой кислоты. Определение свободной сернистой кислоты, а также связанной в виде бисульфита может быть произведено ацидиметрически, путем титрования нормальной щелочью, при чем следует иметь в виду, что из обычных индикаторов лакмус совершенно не применим, фенолфталеин дает красную окраску при образовании средней соли Na SOg, и метилоранж дает желтую окраску при образовании кислой соли NaHSOg (см, т. I, в. 1, стр, 351 там же и другие методы). [c.87]
Точность метода. Относительные ошибки определений при кондуктометрическом титровании индивидуальных электролитов без термостатирования составляют 1%, а при титровании смесей обычно не превышают 2%. Как и при других титрометрических методах анализа, большое значение имеет правильная стандартизация рабочего раствора. Например, при определении содержания сильных кислот и кислот средней силы установку стандартных растворов оснований проводят по метиловому оранжевому, а при титровании слабых кислот — по фенолфталеину. При определении содержания солей слабых оснований необходимо использовать нормальность щелочи, соответствующую содержанию в ней только NaOH. [c.69]
При определении содержания солей слабых оснований необходимо использовать нормальность щелочи, соответствующую содержанию в ней только NaOH. [c.69]
По Кисслингу 50 г исследуемого масла и 50 см спиртовой щелочи (100 см 50%-го спирта и 7,5 г едкого натра) нагреваются в течение 5 минут при взбалтывании до 80°. Щелочь при этом растворяет кислотные примеси. Отделив спиртовый слой, уже хорошо отстоявшийся, при помопщ делительной воронки, его подкисляют соляной кислотой с прибавкой бензола для растворения смолистых частей. Этот бензол после отгонки оставляет взвешиваемое затем 1 5личество веществ кислого или по крайней ме ре растворимого в щелочах характера. Простое смоляное число, или, как его называет Кисслинг, коксовое смоляное число , определяется после того, как обработкой спиртовой щелочью масло освобождено от кислых смолистых частей. Для этого навеску масла (около 50 г) обрабатывают нефтяным эфиром (нормальным бензином), нерастворимые примеси отфильтровываются, промываются на фильтре тем же нeфтiftIым эфиром и взвешиваются. Как и в общем случае определения асфальта, качество бензина имеет существенное значение в нем безусловно не должно быть примеси ароматических углеводородов. По варианту того же способа, предложенному Крамером (67), смолистость определяется после исчерпывающего окисления примесей масла, способных окисляться, воздухом. Для этого Крамер берет 150 г масла в конической колбе, емкостью на 400 см , затем Б масло пропускается струя кислорода (или воздуха) в течение 70 час., со скоростью в 2 пузырька в секунду. При этом масло нагревается на масляной бане до 120° 50 г обработанного таким образом продукта еще 20 мин. нагреваются в колбе с обратным холодильником, после предварительного взбалтывания с 50 см спиртовой щелочи (состав как и у Кисслинга). После нагревания снимают холодильник, пять минут встряхивают смесь, дают отстояться и ио возможности весь спиртовый раствор отделяют помощью делительной воронки. Этот раствор экстрагируют затем 30 сл нефтяного эфира, подкисляют остаток соляной кислотой и экстрагируют раствор бензолом.
Как и в общем случае определения асфальта, качество бензина имеет существенное значение в нем безусловно не должно быть примеси ароматических углеводородов. По варианту того же способа, предложенному Крамером (67), смолистость определяется после исчерпывающего окисления примесей масла, способных окисляться, воздухом. Для этого Крамер берет 150 г масла в конической колбе, емкостью на 400 см , затем Б масло пропускается струя кислорода (или воздуха) в течение 70 час., со скоростью в 2 пузырька в секунду. При этом масло нагревается на масляной бане до 120° 50 г обработанного таким образом продукта еще 20 мин. нагреваются в колбе с обратным холодильником, после предварительного взбалтывания с 50 см спиртовой щелочи (состав как и у Кисслинга). После нагревания снимают холодильник, пять минут встряхивают смесь, дают отстояться и ио возможности весь спиртовый раствор отделяют помощью делительной воронки. Этот раствор экстрагируют затем 30 сл нефтяного эфира, подкисляют остаток соляной кислотой и экстрагируют раствор бензолом.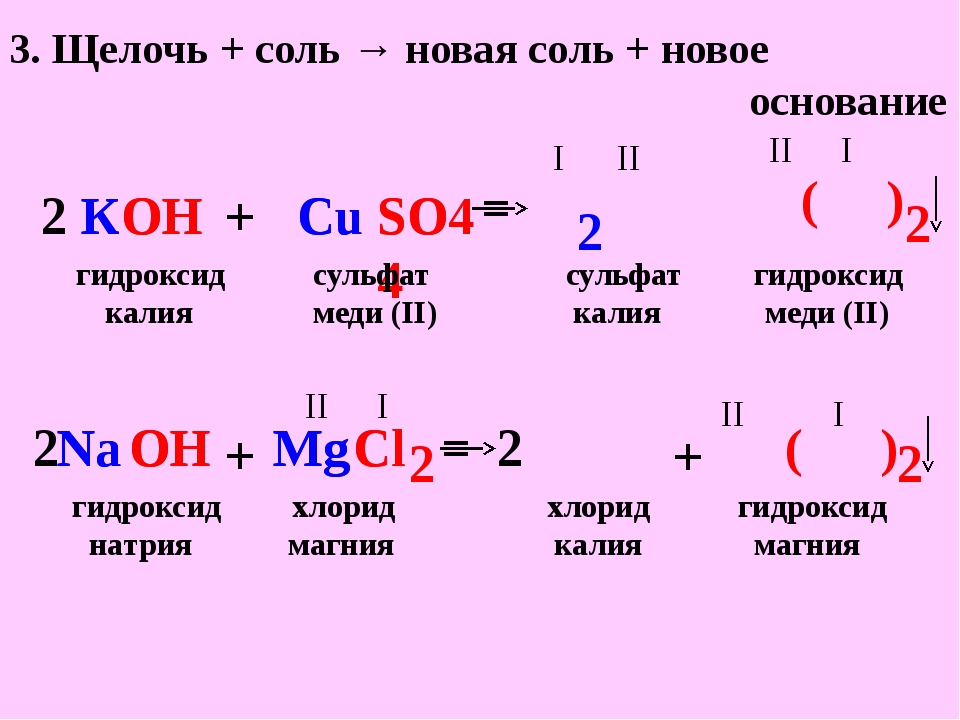 [c.295]
[c.295]
Установлено, что каждому виду сырья соответствует определенный уровень содержания солей, выше которого коксоотло-жение в печи резко усиливается. Этот уровень необходимо знать для того, чтобы поддерживать рациональный тепловой режим в печи. Так, для установки коксования нормальная работа печи достигается при переработке гудрона с содержанием солей 0,05—0,07 кг/м (50—70 мг/л), который получают из мангыш-лакской нефти, обессоленной до 0,015—0,025 кг/м (15— 20 мг/л). Замечено также, что при термической переработке нефтяных остатков вредное влияние, аналогичное солям, оказывает кальцинированная сода (щелочь), применяемая на АВТ для нейтрализации кислых соединений. [c.273]
При рассмотрении условий титрования углекислого натрия было показано, что при нейтрализации по фенолфталеину Na O, реагирует с кислотой не полностью. Таким образом, если нормальность рабочего раствора целочи устанавливают, как обычно (по НС1 или по H OJ, с метилоранжевым, а затем этот раствор щелочи применяют для определения слабой кислоты с фенолфталеином, результаты получаются неправильньши. Для избежания этой ошибки применяют различные методы. Проще всего непосредственно перед определением слабой кислоты отобрать пипеткой 25 мл 0,1 н. соляной кислоты и оттитровать ее данным рабочим раствором едкой щелочи в присутствии фенолфталеина. На основании результатов этого титрования вычисляют нормальность раствора едкой щелочи (по фенолфталеину) для вычисления содержания слабой кислоты пользуются этим коэффициентом нормальности. [c.340]
Для избежания этой ошибки применяют различные методы. Проще всего непосредственно перед определением слабой кислоты отобрать пипеткой 25 мл 0,1 н. соляной кислоты и оттитровать ее данным рабочим раствором едкой щелочи в присутствии фенолфталеина. На основании результатов этого титрования вычисляют нормальность раствора едкой щелочи (по фенолфталеину) для вычисления содержания слабой кислоты пользуются этим коэффициентом нормальности. [c.340]
Ионы водорода и гидроксида — Кислоты и основания — National 5 Chemistry Revision
Кислые и щелочные растворы могут проводить электричество, потому что в них есть ионы, которые могут нести заряд.
Посмотрите на формулы этих кислот. Все они содержат ионы H + .
| Кислотное название | Формула | Ionic Formula |
|---|---|---|
| HCL | HCL $0.$2.$1″> + (AQ) CL — (AQ) | |
| Сернальная кислота | H 2 SO 4 4 | 2H + (AQ) SO 4 2- (AQ) |
| азотная кислота | HNO 3 | H + (AQ) № 3 — (водн.) |
При разбавлении кислоты концентрация ионов H + снижается, а pH увеличивается до 7.
Посмотрите на формулы этих щелочей. Все они содержат ионы ОН pcqkmovbhm.0.0.0.1:0.1.0.$0.$1.$5.$1″> — .
| alkali имя | Формула | Ionic Formula | |
|---|---|---|---|
| pcqkmovbhm.0.0.0.1:0.1.0.$0.$1.$6.$2.$0.$0″> натрия | NAOH | NA + (AQ) OH — (AQ) | |
| CALIC HYDROXIDE | CA (OH) 2 | CA 2+ (AQ) 2OH | pcqkmovbhm.0.0.0.1:0.1.0.$0.$1.$2.$1.$0.$0″>0 — (AQ) |
| 5 гидроксид лития | LIOH | LI + (AQ) OH — (AQ) |
Чем концентрированнее кислота или щелочь, тем лучше они проводят ток.При разбавлении щелочи концентрация ионов ОН — уменьшается, а рН уменьшается до 7.
щелочь | химическое соединение | Britannica
щелочь , любой из растворимых гидроксидов щелочных металлов — т. е. литий, натрий, калий, рубидий и цезий. Щелочи — это сильные основания, которые окрашивают лакмусовую бумагу из красной в синюю; они реагируют с кислотами с образованием нейтральных солей; и они едкие и в концентрированной форме разъедают органические ткани.Термин щелочь применяется также к растворимым гидроксидам таких щелочноземельных металлов, как кальций, стронций и барий, а также к гидроксиду аммония. Первоначально этот термин применялся к золе сожженных натрий- или калийсодержащих растений, из которой можно было выщелачивать оксиды натрия и калия.
е. литий, натрий, калий, рубидий и цезий. Щелочи — это сильные основания, которые окрашивают лакмусовую бумагу из красной в синюю; они реагируют с кислотами с образованием нейтральных солей; и они едкие и в концентрированной форме разъедают органические ткани.Термин щелочь применяется также к растворимым гидроксидам таких щелочноземельных металлов, как кальций, стронций и барий, а также к гидроксиду аммония. Первоначально этот термин применялся к золе сожженных натрий- или калийсодержащих растений, из которой можно было выщелачивать оксиды натрия и калия.
Производство технической щелочи обычно относится к производству кальцинированной соды (Na 2 CO 3 ; карбонат натрия) и едкого натра (NaOH; гидроксид натрия).Другие промышленные щелочи включают гидроксид калия, поташ и щелочь. Производство широкого спектра товаров народного потребления зависит от использования щелочи на той или иной стадии. Кальцинированная сода и каустическая сода необходимы для производства стекла, мыла, различных химикатов, вискозы и целлофана, бумаги и целлюлозы, чистящих и моющих средств, текстиля, смягчителей воды, некоторых металлов (особенно алюминия), бикарбоната соды, бензина и других материалов. производные нефти.
производные нефти.
Викторина Британника
Наука: правда или вымысел?
Вас увлекает физика? Устали от геологии? С помощью этих вопросов отделите научный факт от вымысла.
Люди веками использовали щелочь, получая ее сначала из выщелачиваний (водных растворов) некоторых пустынных земель. В конце 18 века основным источником щелочи стало выщелачивание древесной золы или золы морских водорослей. В 1775 году Французская академия наук предложила денежные премии за новые методы производства щелочи. Премия за кальцинированную соду была присуждена французу Николя Леблану, который в 1791 году запатентовал процесс превращения поваренной соли (хлорида натрия) в карбонат натрия.Процесс Леблана доминировал в мировом производстве до конца 19 века, но после Первой мировой войны он был полностью вытеснен другим процессом конверсии соли, усовершенствованным в 1860-х годах Эрнестом Сольвеем из Бельгии. В конце 19 века появились электролитические методы производства едкого натра, и их значение быстро росло.
В конце 19 века появились электролитические методы производства едкого натра, и их значение быстро росло.
В Solvay, или аммиачно-содовом процессе ( q.v. ) производства кальцинированной соды, поваренная соль в виде крепкого рассола подвергается химической обработке для удаления примесей кальция и магния, а затем насыщается рециркулирующим газообразным аммиаком в колоннах.Аммонизированный рассол затем карбонизируется с использованием газообразного диоксида углерода при умеренном давлении в колонне другого типа. Эти два процесса дают бикарбонат аммония и хлорид натрия, двойное разложение которых дает желаемый бикарбонат натрия, а также хлорид аммония. Затем бикарбонат натрия нагревают, чтобы разложить его до желаемого карбоната натрия. Аммиак, участвующий в процессе, почти полностью извлекается путем обработки хлорида аммония известью с получением аммиака и хлорида кальция.Восстановленный аммиак затем повторно используется в уже описанных процессах.
Электролитическое производство едкого натра включает электролиз сильного солевого раствора в электролизере. (Электролиз — это расщепление соединения в растворе на составные части с помощью электрического тока, чтобы вызвать химическое изменение.) Электролиз хлорида натрия дает хлор и либо гидроксид натрия, либо металлический натрий. Гидроксид натрия в некоторых случаях конкурирует с карбонатом натрия в тех же областях применения, и в любом случае они взаимопреобразовываются с помощью довольно простых процессов.Хлорид натрия можно превратить в щелочь с помощью любого из двух процессов, разница между которыми заключается в том, что аммиачно-содовый процесс дает хлор в форме хлорида кальция, соединения небольшой экономической ценности, в то время как электролитические процессы производят элементарный хлор. , который имеет бесчисленное количество применений в химической промышленности. По этой причине аммиачно-содовый процесс, вытеснивший процесс Леблана, оказался вытесненным, старые аммиачно-содовые заводы продолжают работать очень эффективно, в то время как новые заводы используют электролитические процессы.
(Электролиз — это расщепление соединения в растворе на составные части с помощью электрического тока, чтобы вызвать химическое изменение.) Электролиз хлорида натрия дает хлор и либо гидроксид натрия, либо металлический натрий. Гидроксид натрия в некоторых случаях конкурирует с карбонатом натрия в тех же областях применения, и в любом случае они взаимопреобразовываются с помощью довольно простых процессов.Хлорид натрия можно превратить в щелочь с помощью любого из двух процессов, разница между которыми заключается в том, что аммиачно-содовый процесс дает хлор в форме хлорида кальция, соединения небольшой экономической ценности, в то время как электролитические процессы производят элементарный хлор. , который имеет бесчисленное количество применений в химической промышленности. По этой причине аммиачно-содовый процесс, вытеснивший процесс Леблана, оказался вытесненным, старые аммиачно-содовые заводы продолжают работать очень эффективно, в то время как новые заводы используют электролитические процессы.
В нескольких местах в мире имеются значительные запасы минеральной формы кальцинированной соды, известной как природная щелочь. Минерал обычно встречается в виде сесквикарбоната натрия, или трона (Na 2 CO 3 · NaHCO 3 · 2H 2 O). Соединенные Штаты производят большую часть мировой природной щелочи из обширных месторождений троны в подземных шахтах в Вайоминге и из высохших дна озер в Калифорнии.
12.2: Группа IA – Щелочные металлы
Li, Na, K, Rb и Cs – все элементы группы IA, также известные как щелочные металлы.Седьмой член группы, франций (Fr), является радиоактивным и настолько редким, что в любой данный момент на Земле может существовать только 20 атомов Fr [1] . Термин щелочь происходит от арабского слова, означающего «зола». Соединения калия, а также других щелочных металлов были получены из древесной золы ранними химиками. Все щелочные металлы мягкие и, кроме желтого Cs, имеют серебристо-серый цвет.
Литий, натрий, калий, рубидий и цезий имеют множество других общих свойств.Все они твердые при 0°C и плавятся при температуре ниже 200°C. Каждый из них обладает металлическими свойствами, такими как хорошая тепло- и электропроводность, ковкость (способность сбиваться в листы) и пластичность (способность вытягиваться в проволоку). Высокая теплопроводность и относительно низкая температура плавления (для металла) натрия делают его идеальным теплоносителем. Он используется для охлаждения некоторых типов ядерных реакторов (жидкометаллические реакторы на быстрых нейтронах, ЖМБР) и по этой причине для охлаждения клапанов мощных автомобильных двигателей.
Некоторые общие свойства щелочных металлов приведены в таблице ниже. Все эти атомы металлов содержат единственный электрон вне конфигурации благородного газа, поэтому валентный электрон хорошо защищен от ядерного заряда, а атомные радиусы относительно велики. Большой объем каждого атома приводит к низкой плотности — достаточно малой, чтобы Li, Na и K плавали на поверхности воды, реагируя с ней.
Атомы не имеют сильного притяжения к единственному валентному электрону, поэтому он легко теряется (малая первая энергия ионизации) из +1-иона.Поскольку они легко отдают электроны таким образом, все щелочные металлы являются сильными восстановителями. Они достаточно реакционноспособны, даже восстанавливают воду.
Слабое притяжение валентного электрона также приводит к слабой металлической связи, потому что именно притяжение между ядрами и многочисленными валентными электронами удерживает атомы металла вместе. Слабая металлическая связь приводит к низким температурам плавления, особенно для более крупных атомов в нижней части группы. Cs, например, плавится чуть выше комнатной температуры.Слабая металлическая связь также объясняет тот факт, что все эти металлы довольно мягкие.
То, что химия щелочных металлов ограничивается степенью окисления +1, подтверждается большими энергиями вторичной ионизации. Удалить первый электрон с большой диффузной орбитали легко, но удалить второй электрон из октета в ионе M + слишком сложно для любого окислителя.
Два других элемента находятся в группе IA. Водород, хотя многие из его соединений имеют формулы, подобные щелочным металлам, является неметаллом и почти уникален по своему химическому поведению.Поэтому его обычно не включают в эту группу. Франций (Fr) довольно радиоактивен, и для изучения доступны лишь небольшие его количества; поэтому его тоже обычно опускают. Однако его свойства подобны свойствам Cs и других щелочных металлов.
Химические реакции и соединения
Элемент лития бурно и впечатляюще сочетается с водой, как показано в этом видео:
Выделяется газообразный водород, который перемещает металлический литий по воде во время реакции.Если избыток воды испаряется, остается соединение гидроксида лития (LiOH). LiOH визуализируется с помощью индикатора фенолфталеина, который становится розовым при образовании основания LiOH. Таким образом, уравнение этой реакции имеет вид
. \[\text{2Li}(s) + \text{2H}_\text{2}\text{O}(l) \rightarrow \text{2LiOH}(водн.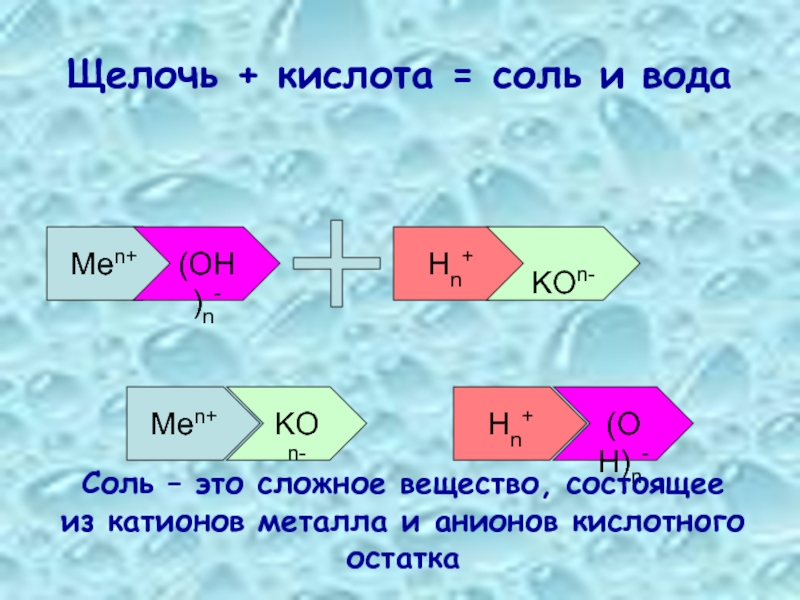 ) + \text{H}_\text {2}(г)\]
) + \text{H}_\text {2}(г)\]
Элементы натрий, калий, рубидий и цезий также бурно соединяются с водой с образованием гидроксидов. Уравнения их реакций
\[\text{2Na}(s) + \text{2H}_\text{2}\text{O}(l) \rightarrow \text{2NaOH}(водн.) + \text{H}_\text {2}(г)\]
\[\text{2K}(s) + \text{2H}_\text{2}\text{O}(l) \rightarrow \text{2KOH}(aq) + \text{H}_\text {2}(г)\]
\[\text{2Rb}(s) + \text{2H}_\text{2}\text{O}(l) \rightarrow \text{2RbOH}(aq) + \text{H}_\text {2}(г)\]
\[\text{2Cs}(s) + \text{2H}_\text{2}\text{O}(l) \rightarrow \text{2CsOH}(водн.) + \text{H}_\text {2}(г)\]
Поскольку все щелочные металлы реагируют с водой одинаково, можно записать общее уравнение :
\[\text{2M}(s) + \text{2H}_\text{2}\text{O}(l) \rightarrow \text{2MOH}(aq) + \text{H}_\text {2}(г)\]
с M = K, Li, Na, Rb или Cs.
Символ М представляет любой из пяти элементов.
Помимо своего поведения при добавлении в воду, щелочные металлы непосредственно реагируют со многими элементами. Все быстро соединяется с кислородом воздуха, образуя белый оксид:
Все быстро соединяется с кислородом воздуха, образуя белый оксид:
\[\text{4M}(s) + \text{O}_2(g) \rightarrow \text{2M}_2 \text{O}(s)\]
с M = Li, Na, K, Rb или Cs
(Li 2 O — оксид лития, Na 2 O — оксид натрия и т. д.)
Все, кроме лития, далее реагируют с образованием желтых пероксидов, M 2 O 2 :
\[\text{2M}_2 \text{O}(s) + \text{O}_2(g) \rightarrow \text{2M}_2 \text{O}_2(s)\] M = Na, K, Rb или Cs
(Na 2 O 2 – пероксид натрия и т.д.)
Калий, рубидий и цезий достаточно реакционноспособны, чтобы могли образовываться желтые супероксиды (общая формула которых MO 2 ):
\[\text{2M}_2 \text{O}_2(s) + \text{O}_2(g) \rightarrow \text{2MO}_2(s)\]
с M = K, Rb или Cs
Если поверхность образца щелочного металла не очистить, она будет казаться белой или серой, а не иметь серебристый металлический блеск. Это связано с оксидным, пероксидным или супероксидным покрытием, которое образуется после нескольких секунд пребывания на воздухе. В следующем видеоролике показано, как свежесрезанный кусок лития блестит, но тускнеет до серого при воздействии кислорода воздуха. Видео также акцентирует внимание на другом важном свойстве щелочных металлов: они мягкие и легко режутся по сравнению с другими металлами.
В следующем видеоролике показано, как свежесрезанный кусок лития блестит, но тускнеет до серого при воздействии кислорода воздуха. Видео также акцентирует внимание на другом важном свойстве щелочных металлов: они мягкие и легко режутся по сравнению с другими металлами.
Тускло-серый окисленный цилиндр из металлического лития разрезается, обнажая блестящую серебристую поверхность. Через 1 минуту поверхность потускнела, а через 10 минут поверхность среза вернулась к тускло-серому цвету остальной части металлического лития. Поскольку щелочным металлом является литий, единственная реакция с кислородом:
\[\text{4Li}(s) + \text{O}_2(g) \rightarrow \text{2Li}_2\text{O}(s)\]
Щелочь также напрямую соединяется с газообразным водородом с образованием соединений, известных как гидриды, MH:
\[\text{2M}(s) + \text{H}_2(g) \rightarrow \text{2MH}(s)\]
с M = Li, Na, K, Rb или Cs
Реагируют с серой с образованием сульфидов, M 2 S:
\[\text{2M}(s) + \text{S}(g) \rightarrow \text{M}_2\text{S}(s)\]
с M = Li, Na, K, Rb или Cs
Все эти оксиды, гидриды, гидроксиды и сульфиды растворяются в воде с образованием основных растворов, и эти соединения относятся к числу сильных оснований. {-} + \текст{3O}_2(г)\]
{-} + \текст{3O}_2(г)\]
Оба последних уравнения описывают как окислительно-восстановительные, так и кислотно-щелочные процессы, что можно подтвердить, присвоив степени окисления. Ионы пероксида и супероксида содержат атомы О в необычных (для О) степенях окисления –1 и –½:
Поэтому диспропорционирование (одновременное окисление и восстановление) O 2 2– или O 2 – до более распространенных степеней окисления 0 (в O 2 ) и –91 2 (в 7 OH – ) возможно.
Щелочные металлы также реагируют непосредственно с галогенами, например с хлором, образуя хлориды,
\[\text{2M}(s) + \text{Cl}_2(g) \rightarrow \text{2MCl}(s)\] M = Li, Na, K, Rb или Cs
Ниже приведен пример реакции Na с Cl 2
Кусок металлического натрия добавляют в колбу с газообразным хлором. Сначала никакой реакции не происходит, но когда добавляется капля воды, натрий и хлор вступают в реакцию, бурно воспламеняясь и выделяя столько тепла, что на дне колбы необходим песок, чтобы поглотить тепло и предотвратить растрескивание стекла. Это уравнение для этой реакции:
Это уравнение для этой реакции:\[\text{2Na}(тв) + \text{Cl}_2(г) \rightarrow \text{2NaCl}(тв)\]
с фтором с образованием фторидов, MF:
\[\text{2M}(s) + \text{F}_2(g) \rightarrow \text{2MF}(s)\] M = Li, Na, K, Rb или Cs
и с бромом с образованием бромидов, MBr:
\[\text{2M}(s) + \text{Br}_2(g) \rightarrow \text{2MBr}(s)\] M = Li, Na, K, Rb или Cs
Ниже приведен пример реакции K с Br 2
В этом видео калий, хранящийся в инертном минеральном масле из-за его высокой реакционной способности, помещают в стакан с жидким бромом после удаления защитного слоя минерального масла.Калий бурно реагирует с бромом. Контейнер накрывают в течение всего процесса, чтобы предотвратить попадание реагентов и продуктов в окружающую среду. Химическое уравнение этой реакции:
\[\text{2K}(s) + \text{Br}_2(g) \rightarrow \text{2KBr}(s)\]
Натрий и калий довольно распространены, занимая шестое и седьмое место среди всех элементов земной коры, но другие щелочные металлы встречаются редко. Ионы натрия и калия являются компонентами многочисленных силикатных кристаллических решеток, наблюдаемых в земной коре, но, поскольку большинство их соединений растворимы в воде, они также являются важными составляющими морской воды и подземных отложений рассола.Хлорид натрия, получаемый из таких рассолов, является главным коммерческим источником натрия, тогда как калий можно получать из руд сильвита (KCl) или карналлита (KCl•MgCl 2 • 6H 2 O).
Ионы натрия и калия являются компонентами многочисленных силикатных кристаллических решеток, наблюдаемых в земной коре, но, поскольку большинство их соединений растворимы в воде, они также являются важными составляющими морской воды и подземных отложений рассола.Хлорид натрия, получаемый из таких рассолов, является главным коммерческим источником натрия, тогда как калий можно получать из руд сильвита (KCl) или карналлита (KCl•MgCl 2 • 6H 2 O).
Ионы натрия (Na + ) и калия (K + ) необходимы для живых систем. Na + является основным катионом в жидкостях, окружающих клетки, тогда как K + наиболее важен внутри клеток. Na + участвует в сокращении мышц, а K + и Na + играют роль в передаче нервных импульсов.К более важен для растений, чем натрий, и это один из трех элементов (К, Р, N), которые должны входить в состав удобрений для поддержания высоких урожаев. K особенно много содержится в деревьях — древесная зола от кухонных костров (поташ) была основным источником этого элемента еще столетие назад, и она до сих пор является хорошим удобрением для вашего сада. Древесная зола содержит смесь оксида калия и карбоната калия, последний образуется в результате соединения K 2 O с CO 2 , образующегося при соединении C в древесине с O 2 :
Древесная зола содержит смесь оксида калия и карбоната калия, последний образуется в результате соединения K 2 O с CO 2 , образующегося при соединении C в древесине с O 2 :
\[\text{K}_2\text{O} + \text{CO}_2 \rightarrow \text{K}_2\text{CO}_3\]
90 134 Соединения Na коммерчески получают из рассола или морской воды.{-}(водн.)\]Более подробно этот процесс описан в разделе об электрохимических элементах, но из уравнения видно, что электрический ток окисляет Cl – до Cl 2 и восстанавливает H 2 O до H 2 . NaOH ( aq ) используется в качестве сильного основания во многих промышленных процессах для производства мыла, вискозы, целлофана, бумаги, красителей и многих других продуктов. Щелок также используется в домашних очистителях канализации. С ним нужно обращаться осторожно, потому что он сильно щелочной, очень едкий и может сильно обжечь кожу.{-}(водн.)\]
Процесс Сольве представляет собой кислотно-щелочную реакцию в сочетании с осаждением. Ангидрид кислоты CO 2 реагирует с H 2 O с образованием H 2 CO 3 . Эта слабая кислота отдает протон NH 3 , давая NH 4 + и HCO 3 – , а последний ион осаждается с Na + . Слабоосновной гидрокарбонат натрия, полученный в процессе Solvay, может быть очищен для использования в качестве антацида (бикарбонат соды), но большая его часть превращается в карбонат натрия (кальцинированная сода) при нагревании:
Ангидрид кислоты CO 2 реагирует с H 2 O с образованием H 2 CO 3 . Эта слабая кислота отдает протон NH 3 , давая NH 4 + и HCO 3 – , а последний ион осаждается с Na + . Слабоосновной гидрокарбонат натрия, полученный в процессе Solvay, может быть очищен для использования в качестве антацида (бикарбонат соды), но большая его часть превращается в карбонат натрия (кальцинированная сода) при нагревании:
\[\text{2NaHCO}_3(s) \xrightarrow{\Delta} \text{Na}_2\text{CO}_3(s) + \text{H}_2\text{O}(g) + \ текст {СО}_2(г)\]
(Δ в этом уравнении указывает на нагрев реагента.) Карбонат натрия (Na 2 CO 3 ) используется в производстве стекла и бумаги, а также в некоторых моющих средствах. Однако ион карбоната является довольно сильным основанием, и моющие средства, содержащие Na 2 CO 3 (стиральная сода), вызвали серьезные химические ожоги у некоторых маленьких детей, которые из любопытства съели их.
Содержание щелочей – обзор
4.9.5 Щелочи и сульфаты
Сырая клинкерная мука различается по содержанию щелочи и по соотношению двух основных щелочей, натрия и калия.Щелочные источники включают топливо, в основном уголь, и сланцы. Сам по себе известняк обычно содержит мало щелочи, хотя содержание в нем глины может способствовать щелочности. Глинистые компоненты сланцев и углей проявляют сильное геохимическое родство: и те, и другие обычно имеют очень изменчивые модели отношений Na/K.
Циркуляции многих элементов способствуют циклы, включающие транспортировку определенных элементов или комбинаций элементов. Поток твердого материала через печь противоположен направлению потока газа; это сделано преднамеренно, чтобы облегчить тепловую экономию за счет использования горячего газа из зоны горения для нагрева поступающего сырья.Однако это способствует формированию замкнутых циклов. В главе 2 обсуждались различные часто встречающиеся циклы летучих веществ. Сера вводится в топливо, особенно при использовании угля или нефти, а также в сырье. Рециркуляция щелочесодержащей печной и рукавной пыли приводит к увеличению количества щелочи, циркулирующей в печи. Все второстепенные элементы, вводимые в печь, неизбежно должны появляться в твердых или газообразных выбросах или в обоих, так что щелочь частично появляется в клинкере; частично в печной пыли.Часть удаляется в виде пыли в электрофильтрах. Сера частично появляется в газообразных выбросах, в основном в виде SO 2 , и частично в клинкере и пыли.
Рециркуляция щелочесодержащей печной и рукавной пыли приводит к увеличению количества щелочи, циркулирующей в печи. Все второстепенные элементы, вводимые в печь, неизбежно должны появляться в твердых или газообразных выбросах или в обоих, так что щелочь частично появляется в клинкере; частично в печной пыли.Часть удаляется в виде пыли в электрофильтрах. Сера частично появляется в газообразных выбросах, в основном в виде SO 2 , и частично в клинкере и пыли.
Внутри печи существует уникальная связь между щелочами и серой. Хотя «Na 2 O» и «K 2 O» могут присутствовать в печных газах в виде очень сложной смеси веществ, давление паров соответствующих веществ, переносящих щелочь и серу, сопоставимо по величине, с В результате кажется, что они движутся вместе.Впечатление о парном цикле усиливается наблюдением, что сульфаты щелочных металлов могут конденсироваться в определенных точках печи. Понимание роли щелочей важно по двум причинам. Во-первых, давление окружающей среды означает, что меньшее количество щелочи может выделяться в виде пыли, дымовых газов и т. д., что при прочих равных условиях означает относительно большее количество клинкера. Во-вторых, чтобы избежать реакции щелочь-заполнитель, производители цемента стремятся производить низкощелочные цементы.
д., что при прочих равных условиях означает относительно большее количество клинкера. Во-вторых, чтобы избежать реакции щелочь-заполнитель, производители цемента стремятся производить низкощелочные цементы.
Две щелочи — Na 2 O и K 2 O — часто обрабатывают вместе, хотя они часто демонстрируют значительные различия в поведении.Например, натрий в клинкере преимущественно концентрируется в фазе С 3 А, тогда как калий преимущественно, хотя и слабо, фракционируется в белите. Однако важным моментом сходства между двумя щелочами является то, что они предпочитают сочетаться с сульфатом и, кроме того, сульфаты щелочи должны быть несколько летучими в печи. Форма, в которой щелочи удерживаются в клинкере, важна по нескольким причинам. Во-первых, он регулирует скорость выделения щелочи на ранних стадиях гидратации цемента, а во-вторых, в сочетании с сульфатом влияет на доступность и выделение сульфата на ранних стадиях гидратации.
Часть щелочи, введенной в печь, участвует в цикле испарения и конденсации. В основе этого процесса лежит давление паров самих сульфатов. Данные по давлению паров были получены на самосогласованной основе 56 для соответствующих сульфатсодержащих фаз; они показаны на рис. 4.25. Как и следовало ожидать, величина давления паров сульфата быстро увеличивается с повышением температуры; log P против л/т для каждого из основных твердых веществ дает ряд практически прямолинейных графиков, хотя и с несколько отличающимся наклоном.Существуют два механизма разложения сульфата испарением; процесс может быть как конгруэнтным, так и неконгруэнтным. Некоторые виды сульфатов, например K 2 SO 4 и Na 2 SO 4 , испаряются конгруэнтно; то есть они полностью испаряются, не оставляя твердого остатка. Неконгруэнтное испарение, как это происходит с CaSO 4 , оставляет твердый остаток, в данном случае CaO. Поскольку некоторые из сульфатных фаз остаются стабильными вплоть до зоны обжига, неконгруэнтное разложение является потенциальным механизмом, при котором свободная известь может образовываться относительно поздно в цикле клинкерования (рис.
В основе этого процесса лежит давление паров самих сульфатов. Данные по давлению паров были получены на самосогласованной основе 56 для соответствующих сульфатсодержащих фаз; они показаны на рис. 4.25. Как и следовало ожидать, величина давления паров сульфата быстро увеличивается с повышением температуры; log P против л/т для каждого из основных твердых веществ дает ряд практически прямолинейных графиков, хотя и с несколько отличающимся наклоном.Существуют два механизма разложения сульфата испарением; процесс может быть как конгруэнтным, так и неконгруэнтным. Некоторые виды сульфатов, например K 2 SO 4 и Na 2 SO 4 , испаряются конгруэнтно; то есть они полностью испаряются, не оставляя твердого остатка. Неконгруэнтное испарение, как это происходит с CaSO 4 , оставляет твердый остаток, в данном случае CaO. Поскольку некоторые из сульфатных фаз остаются стабильными вплоть до зоны обжига, неконгруэнтное разложение является потенциальным механизмом, при котором свободная известь может образовываться относительно поздно в цикле клинкерования (рис. 4.26).
4.26).
Рис. 4.25. Давление паров некоторых сульфатов, связанное с обжигом цемента.
(На основе: Gang-Soon C, Glasser FP. Цикл серы в цементных печах: давление паров и стабильность твердой фазы сульфатных фаз. Cem Concr Res 1988; 18 (3):367–74; рис. 5.12 из Hewlett PC Химия цемента и бетона Ли 4-е изд., Оксфорд: Butterworth-Heinemann, 1998.)Рис. Стабилизация твердых растворов типа Ca 3 SiO 5 путем совместного замещения Si на Al и O на F.
(На основе: Shame EG, Glasser FP. Синтез и свойства стабильных твердых растворов Ca 3 SiO 5 , приготовленных при температуре от 1050°C до 1250°C. Brit Ceram Soc Trans J 1987; 86 :13 –7; рис. 5.13 из Hewlett PC. Химия цемента и бетона Леа . 4-е изд. Oxford: Butterworth-Heinemann, 1998.) При нормальном времени пребывания клинкера в печи кинетика испарения становится значимой только когда давление пара, log P , становится больше 10 − 2 –10 − 3 бар. В более высоком температурном режиме, необходимом для достижения этих давлений паров, крутой наклон кривых давления паров для сульфоалюмината кальция и сульфосиликатов указывает на их быстро снижающуюся стабильность. Таким образом, сульфосиликат кальция становится нестабильным по отношению к CaSO 4 и Ca 2 SiO 4 в зоне обжига и обычно не выдерживает самых высоких достигнутых температур. Следует также отметить, что при фиксированной температуре давление паров K-содержащих частиц всегда выше, чем у соответствующих Na-содержащих частиц.
В более высоком температурном режиме, необходимом для достижения этих давлений паров, крутой наклон кривых давления паров для сульфоалюмината кальция и сульфосиликатов указывает на их быстро снижающуюся стабильность. Таким образом, сульфосиликат кальция становится нестабильным по отношению к CaSO 4 и Ca 2 SiO 4 в зоне обжига и обычно не выдерживает самых высоких достигнутых температур. Следует также отметить, что при фиксированной температуре давление паров K-содержащих частиц всегда выше, чем у соответствующих Na-содержащих частиц.
Точно так же, как может происходить испарение, реакции конденсации могут привести к удалению сульфатов щелочных металлов из потоков охлаждающего пара. Каждый вид имеет «точку росы» (аналогичную точке росы воды), превышение которой приводит к конденсации. Однако природа паров в печи сложна. В то время как обычная роса (вода) подразумевает равновесие между одним молекулярным видом в двух состояниях (пар, жидкость), ситуация в печи более сложная.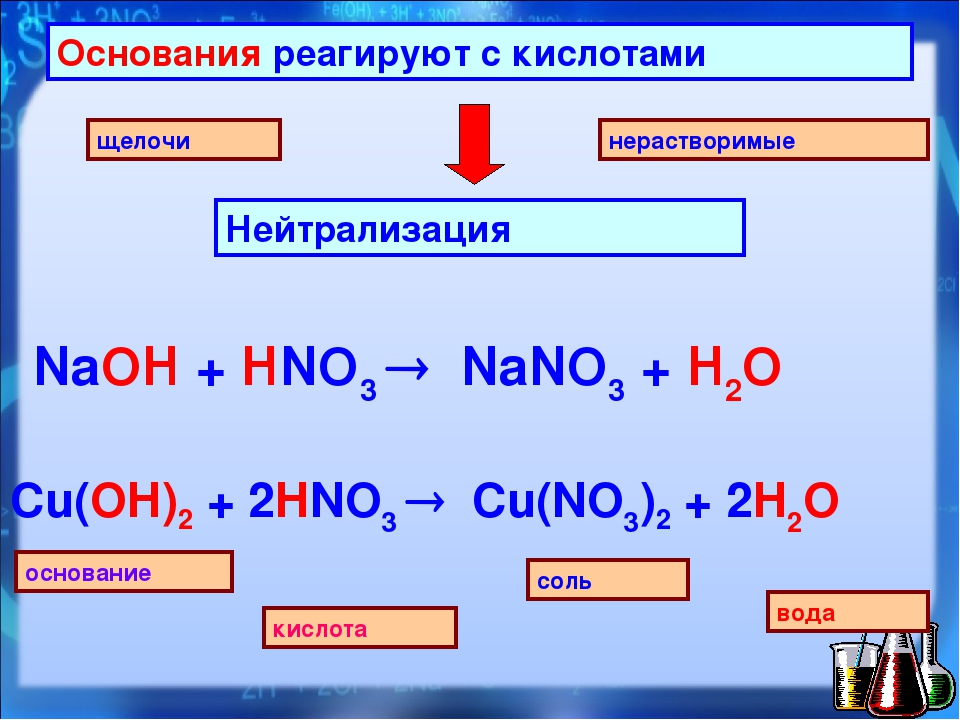 Водяной пар, CO 2 и O 2 , вероятно, взаимодействуют со щелочами и оксидами серы: NaOH и KOH, вероятно, являются важными парами.Тем не менее, реакция между сложными частицами, присутствующими в горячем паре, по-видимому, протекает быстро, в результате чего жидкие и твердые сульфаты быстро преобразуются путем конденсации в соответствующих точках цикла охлаждения.
Водяной пар, CO 2 и O 2 , вероятно, взаимодействуют со щелочами и оксидами серы: NaOH и KOH, вероятно, являются важными парами.Тем не менее, реакция между сложными частицами, присутствующими в горячем паре, по-видимому, протекает быстро, в результате чего жидкие и твердые сульфаты быстро преобразуются путем конденсации в соответствующих точках цикла охлаждения.
При образовании конденсата конденсат может быть жидким или твердым. Исходный конденсат также может быть неустойчивым; например, расплав K 2 SO 4 , конденсируясь на клинкерном зерне, может подвергаться вторичной реакции с известью или силикатами кальция с образованием лангбейнита кальция CaK 2 (SO 4 ) 2 .Из-за низкого давления пара СаО кальций не переносится в потоке пара, поэтому лангбейнит кальция не может быть первичным конденсатом.
Баланс между сульфатом, транспортируемым паром, и сульфатом, транспортируемым в твердом клинкере, по-видимому, является переменным, частично зависящим от механической структуры формирующегося клинкера. В некоторых случаях твердые или расплавленные сульфаты физически захватываются клинкером и, таким образом, механически предотвращаются от испарения.Поведение замкнутых сульфатных расплавов и их взаимодействие с силикатными расплавами при 1350°С изучали в герметичных тиглях. 57 В этих экспериментах было приготовлено и измельчено стекло, имеющее эвтектический состав C–A–F–S, указанный Леа и Паркером, 48 . Навески стекла смешивали с CaK 2 (SO 4 ) 2 , K 2 SO 4 и Na 2 SO 4 и герметизировали в капсулах с силикагелем в течение 1 ч, 1350°С.Произошла обширная смешиваемость жидкостей, одна жидкость содержала большую часть силиката, а другая большую часть сульфата. Было видно, что после закалки две жидкости подверглись чистому физическому разделению, при этом менее плотный сульфатный расплав плавал на более плотном силикатном, и эти две жидкости можно было выбрать вручную для анализа.
В некоторых случаях твердые или расплавленные сульфаты физически захватываются клинкером и, таким образом, механически предотвращаются от испарения.Поведение замкнутых сульфатных расплавов и их взаимодействие с силикатными расплавами при 1350°С изучали в герметичных тиглях. 57 В этих экспериментах было приготовлено и измельчено стекло, имеющее эвтектический состав C–A–F–S, указанный Леа и Паркером, 48 . Навески стекла смешивали с CaK 2 (SO 4 ) 2 , K 2 SO 4 и Na 2 SO 4 и герметизировали в капсулах с силикагелем в течение 1 ч, 1350°С.Произошла обширная смешиваемость жидкостей, одна жидкость содержала большую часть силиката, а другая большую часть сульфата. Было видно, что после закалки две жидкости подверглись чистому физическому разделению, при этом менее плотный сульфатный расплав плавал на более плотном силикатном, и эти две жидкости можно было выбрать вручную для анализа. Al 2 O 3 , Fe 2 O 3 и SiO 2 оказались практически нерастворимыми в сульфатном расплаве, SO 3 – в силикатном расплаве, а щелочь и кальций – фракционированы. между двумя несмешивающимися жидкостями.
Al 2 O 3 , Fe 2 O 3 и SiO 2 оказались практически нерастворимыми в сульфатном расплаве, SO 3 – в силикатном расплаве, а щелочь и кальций – фракционированы. между двумя несмешивающимися жидкостями.
Таким образом, высокое давление паров сульфатов щелочных металлов приводит к испарению этих компонентов с конденсацией в более холодных зонах. Однако испарение не является полным; некоторые сульфаты могут быть механически заключены и захвачены клинкером. Они будут сохраняться в горячей зоне, где происходит несмешиваемость между обычным расплавом клинкера и расплавленными сульфатами. Примечательно, что там, где при контакте с C 3 S расплавы сульфатов сохраняются при температуре < 1250°C, этот расплав служит мощным катализатором локального разложения алита.Этот механизм разложения C 3 S может быть ответственным за ассоциацию свободной извести с сульфатами, что иногда наблюдается при микроскопии клинкера.
При более низких температурах, когда все фазы твердые, закономерности стабильного сосуществования силикатной, алюминатной и сульфатной фаз показаны в таблице 4.20. C 3 S не является стабильной фазой при температуре < 1250°C, поэтому она не показана в наборах. Разделение фаз на две колонки сделано для облегчения сравнения: сульфаты, показанные в правой части таблицы, могут сосуществовать с более знакомыми клинкерными минералами, показанными в левой части.
Таблица 4.20. Совместимые фазы в системе CAO-AL 2 O 3 -SIO 2 -CASO 2 -KASO 4 -K 2 -K 2 SO 4 на ≤ 1250 ° C
| Оксид, силикат и алюминат ( Ферритовый) | сульфат (ы) | ||
|---|---|---|---|
| фазовые сборочки определенно расположен | I | C 2 S, C 3 A | Cal3 A K 2 Так 4 | 7II | 9 S, C 2 S, C 3 A Cal, K 2 So 4
| III | CAO, C 2 S, C 3 CAL | 5 CALpcqkmovbhm.0.0.0.1:0.1.0.$0.$1.$2.$2.$2.$2″>7 | |
| CSL, C 5 S 2 S | V | CAO, C 2 S, C 3 A | Кал, C 5 S 2 90 037 S | 7VI | 5 C 2 S, C 3 a 5 Cal, C 5 S 2 S 77VII | C 2 S, C 3 | Cal, C 5 S 2 S, C 4 S, C 4 S | S S 7
| 7 VIII | C 2 S, C 3 A | Cal, C 4 A 3 S | pcqkmovbhm.0.0.0.1:0.1.0.$0.$1.$2.$2.$2.$2″>7 | IX | 5 C 2 S 5 Cal, C 5 S 2 S, C 4 A 3 S7 | x | C 3 A | 5 CAL) C 5 S 2 S, C 2 S, C 4 A 4 A 3 S S 7 7Фазовые сборки считаются стабильными | CAO, C 2 S, C 3 A, C 4 AF | Cal, K 2 SO 4 |
| XII | CAO, C 2 A, C 3 A, C 4 A, C 4 AF | Cal, C 5 S 2 S | pcqkmovbhm.0.0.0.1:0.1.0.$0.$1.$2.$2.$2.$2″>7 | 7 XIII | C 2 SC 3 A, C 4 AF | 9C 5 S 2 S, C 4 A A 3 S |
Примечание: для удобства фазовый состав феррита обозначен C 4 AF, хотя его точное соотношение A/F не определено.
Квантово-химические расчетные исследования для микроскопического понимания механизма удерживания радиоизотопов Cs и других щелочных металлов в лишайниках
Мы оцениваем стабильность комплексов катионов цезия (Cs) и других щелочных металлов метаболитов лишайников как в газовой, так и в водной фазах, чтобы обсудить, почему лишайники могут сохранять радиоактивный Cs в слоевищах в течение нескольких лет. Мы сосредоточимся на щавелевой кислоте, (+)-усниновой кислоте, атранорине, леканоровой кислоте и протоцетрариновой кислоте, которые являются общими метаболитами различных лишайников, в том числе, e.g., Flavoparmelia caperata и Parmotrema tinctorum, содержащие цезий, в Фукусиме, Япония. Выполняя квантово-химические расчеты, их энергии газофазного комплексообразования и свободные энергии комплексообразования водного раствора с катионами щелочных металлов вычисляются для их нейтрального и депротонированного случаев. Следовательно, обнаружено, что все молекулы энергетически благоприятствуют катионным комплексообразованиям, и порядок предпочтения следующий: Li[Формула: см. текст]Na[Формула: см. текст]K[Формула: см. текст]Rb[Формула: см. текст]Cs[Формула: см. текст] текст] для всех условий, что указывает на отсутствие специфической селективности по Cs, но на сильное связывание со всеми катионами щелочных металлов.Сравнивая стабильность комплексообразования среди этих метаболитов, было обнаружено, что леканориновая и протоцетрариновая кислоты, наблюдаемые в мозговом слое, сохраняют более высокое сродство в их нейтральном случае, в то время как (+)-усниновая кислота и атранорин в верхней коре проявляют довольно сильное сродство только в депротонированных случаях за счет образования стабильных шести кольцо атомов, содержащее щелочной катион, хелатированный двумя атомами кислорода.
Мы сосредоточимся на щавелевой кислоте, (+)-усниновой кислоте, атранорине, леканоровой кислоте и протоцетрариновой кислоте, которые являются общими метаболитами различных лишайников, в том числе, e.g., Flavoparmelia caperata и Parmotrema tinctorum, содержащие цезий, в Фукусиме, Япония. Выполняя квантово-химические расчеты, их энергии газофазного комплексообразования и свободные энергии комплексообразования водного раствора с катионами щелочных металлов вычисляются для их нейтрального и депротонированного случаев. Следовательно, обнаружено, что все молекулы энергетически благоприятствуют катионным комплексообразованиям, и порядок предпочтения следующий: Li[Формула: см. текст]Na[Формула: см. текст]K[Формула: см. текст]Rb[Формула: см. текст]Cs[Формула: см. текст] текст] для всех условий, что указывает на отсутствие специфической селективности по Cs, но на сильное связывание со всеми катионами щелочных металлов.Сравнивая стабильность комплексообразования среди этих метаболитов, было обнаружено, что леканориновая и протоцетрариновая кислоты, наблюдаемые в мозговом слое, сохраняют более высокое сродство в их нейтральном случае, в то время как (+)-усниновая кислота и атранорин в верхней коре проявляют довольно сильное сродство только в депротонированных случаях за счет образования стабильных шести кольцо атомов, содержащее щелочной катион, хелатированный двумя атомами кислорода. Эти результаты свидетельствуют о том, что медуллярный слой может улавливать все катионы щелочных металлов в широком диапазоне рН, близком к физиологическому, в то время как верхний слой коры может эффективно блокировать проникновение ионов металлов при увеличении металлического стресса.Такие выводы подчеркивают физиологическую роль метаболитов, такую как блокирование миграции катионов металлов во внутриклеточные ткани, и объясняют долгосрочное удержание катионов щелочных металлов, включая Cs, в лишайниках, содержащих достаточное количество таких метаболитов для их связывания.
Эти результаты свидетельствуют о том, что медуллярный слой может улавливать все катионы щелочных металлов в широком диапазоне рН, близком к физиологическому, в то время как верхний слой коры может эффективно блокировать проникновение ионов металлов при увеличении металлического стресса.Такие выводы подчеркивают физиологическую роль метаболитов, такую как блокирование миграции катионов металлов во внутриклеточные ткани, и объясняют долгосрочное удержание катионов щелочных металлов, включая Cs, в лишайниках, содержащих достаточное количество таких метаболитов для их связывания.
Части периодической таблицы
Группа 2A (или IIA ) периодической таблицы являются щелочными
земные металлы : бериллий (Be), магний (Mg), кальций (Ca),
стронций (Sr), барий (Ba) и радий (Ra).Они тяжелее и
менее реакционноспособны, чем щелочные металлы группы 1А. Имя приходит
от того, что оксиды этих металлов давали основные растворы
при растворении в воде и оставались твердыми при температурах
доступны древним алхимикам. Как и элементы группы 1А,
Щелочноземельные металлы слишком реакционноспособны, чтобы их можно было найти в природе. элементарная форма.
Как и элементы группы 1А,
Щелочноземельные металлы слишком реакционноспособны, чтобы их можно было найти в природе. элементарная форма.
Щелочноземельные металлы имеют два валентных электрона на орбиталях с наивысшей энергией. ( нс 2 ).Они меньше, чем щелочные металлы тот же период и, следовательно, имеют более высокие энергии ионизации. В большинстве случаев щелочноземельные металлы ионизируются. для формирования заряда 2+.
Щелочноземельные металлы имеют гораздо более высокую температуру плавления, чем щелочные металлы: бериллий плавится при 1287С, магний при 649С, кальций при 839С, стронций при 768°С, барий при 727°С и радий при 700°С. Они есть более твердые металлы, чем элементы группы 1А, но мягкие и легкие по сравнению со многими переходными металлами.
Соли металлов 2А группы менее растворимы в воде, чем соли
Группа 1А из-за более высокой плотности заряда на катионах 2+;
тем не менее, многие соли группы 2А, по крайней мере, умеренно растворимы. Некоторые соли группы 2А прочно связываются с молекулами воды и кристаллизуются в виде 90–175 гидратов 90–176 ;
среди них английская соль, MgSO 4 7H 2 O и гипс,
CaSO 4 2H 2 О.
Некоторые соли группы 2А прочно связываются с молекулами воды и кристаллизуются в виде 90–175 гидратов 90–176 ;
среди них английская соль, MgSO 4 7H 2 O и гипс,
CaSO 4 2H 2 О.
Бериллий (Be, Z=4).
Бериллий — серебристо-белый мягкий металл. Его название происходит от греческое слово, обозначающее минерал берилл, beryllo . Он находится в земной коры с концентрацией 2,6 промилле, что делает ее 47-й по величине обильный элемент. Первичные руды бериллия берилл [алюмосиликат бериллия, Be 3 Al 2 (SiO 3 ) 6 ] и бертрандит [гидроксид силиката бериллия, Be 4 Si 2 O 7 (OH) 2 ]. Бериллы драгоценного качества включают изумруды и аквамарины; зеленый цвет этих драгоценных камней происходит из следовых количеств хрома.
Из-за небольшого размера и высокой плотности заряда бериллиевые связи
через ковалентную связь вместо ионной связи. Элементаль
бериллий очень инертен по отношению к воздуху и воде даже при высоких температурах.
температуры.
Элементаль
бериллий очень инертен по отношению к воздуху и воде даже при высоких температурах.
температуры.
Бериллий используется для изготовления окон для рентгеновских трубок (это прозрачен для рентгеновских лучей) и используется в сплавах с другими металлами, такими как медь и никель для изготовления искробезопасных инструментов и часовых пружин. Бериллий также используется в корпусах ядерного оружия и в атомной промышленности. электростанции из-за его способности отражать нейтроны. Бериллий накапливается в костях; Длительное воздействие бериллия приводит к воспаление в легких и одышка (состояние, называемое бериллиозом).
Магний (Mg, Z=12).
Магний — относительно мягкий металл серебристо-белого цвета. Название элемента происходит от
Магнезия, район в Фессалии в центральной Греции.Он находится в
земная кора с концентрацией 2,3%, что делает ее 7-й по величине
обильный элемент. Большое количество магния также содержится в
полезных ископаемых в мантии Земли. Получают из морской воды, карналита
[MgKCl 3 6H 2 O], доломит
[смесь карбонатов кальция и магния, CaMg(CO 3 ) 2 ],
и магнезит [карбонат магния, MgCO 3 ].
Получают из морской воды, карналита
[MgKCl 3 6H 2 O], доломит
[смесь карбонатов кальция и магния, CaMg(CO 3 ) 2 ],
и магнезит [карбонат магния, MgCO 3 ].
Магний, легированный алюминием и следами других металлов, используется в автомобилестроение и авиастроение; магниевые сплавы также используются в других легкие устройства, такие как лестницы, камеры, велосипедные рамы, жесткий диск приводы и т.д.Магний легче окисляется, чем железо, и используется в жертвенных анодах для защиты железных труб и других структуры, которые легко подвергаются коррозии.
Магний горит на воздухе ярко
белое пламя,
и используется в фейерверках и зажигательных бомбах. (Это было
используется в одноразовых лампах-вспышках, но это использование было вытеснено другими
виды освещения.) Магниевые костры очень трудно зажечь
наружу, так как даже в отсутствие воздуха горящий магний вступает в реакцию с
азот с образованием нитрида магния (Mg 3 N 2 ) и
с водой для получения гидроксида магния и газообразного водорода.
Магний содержится в ряде известных соединений. Магний оксид MgO используется в огнеупорных кирпичах, способных выдерживать высокие температуры в каминах и печах (магниевый оксид плавится при 2800 С). Гептагидрат сульфата магния, MgSO 4 7H 2 O, более известная как английская соль, является миорелаксант и мягкое слабительное. Гидроксид магния, Mg(OH) 2 , также известный как молоко магнезии, является слабительным и антацидом. («Молоко» в «молоке магнезии» относится к тому факту, что, поскольку магний гидроксид плохо растворяется в воде, имеет тенденцию образовывать известковую, белую суспензия, похожая на молоко, но со значительно физиологические эффекты.)
Зеленые растения содержат молекулу под названием хлорофилл, состоящий из плоского кольца атомов углерода и азота
с большим открытым пространством посередине, в котором связан ион магния,
удерживается на месте атомами азота. То
молекула хлорофилла поглощает солнечный свет, и в процессе
фотосинтеза, энергия света превращается в химическую
энергии, которую завод может использовать для питания множества процессов.
То
молекула хлорофилла поглощает солнечный свет, и в процессе
фотосинтеза, энергия света превращается в химическую
энергии, которую завод может использовать для питания множества процессов.
В органической химии магний реагирует с бромалканами. (углеводороды, содержащие бромуглеродные связи) с образованием магнийорганических соединений известны как реактивы Гриньяра (в честь их первооткрывателя Виктора Гриньяр, получивший Нобелевскую премию по химии в 1912 г.).Эти соединения чрезвычайно полезны при формировании новый углерод-углерод связи и часто используются в синтезе органических соединений. Известно, что реактивы Гриньяра чувствительны к воде, поэтому необходимо соблюдать осторожность. удостовериться, что аппарат, в котором идет реакция, проведено очень сухо.
Кальций (Ca, Z=20).
Кальций — относительно мягкий металл серебристого цвета. Название элемента происходит от
Латинское слово, обозначающее известь, calx . Он находится в
земная кора с концентрацией 4,1%, что делает ее пятой по величине
обильный элемент. Основными источниками кальция являются кальцит и известняк.
[карбонат кальция, CaCO 3 ], ангидрит [кальций
сульфат, CaSO 4 ], гипс [дигидрат сульфата кальция,
CaSO 4 2H 2 O],
и доломит [смесь карбонатов кальция и магния, CaMg(CO 3 ) 2 ].
Он находится в
земная кора с концентрацией 4,1%, что делает ее пятой по величине
обильный элемент. Основными источниками кальция являются кальцит и известняк.
[карбонат кальция, CaCO 3 ], ангидрит [кальций
сульфат, CaSO 4 ], гипс [дигидрат сульфата кальция,
CaSO 4 2H 2 O],
и доломит [смесь карбонатов кальция и магния, CaMg(CO 3 ) 2 ].
Соли кальция образуют твердые части тела большинства живых существ. существ, из раковин морских организмов и кораллов кораллов рифы (в виде кальция карбонат, CaCO 3 ) к костям и зубам наземных существ (в виде гидроксиапатита кристаллы, Ca 3 (PO 4 ) 2 ] 3 Ca(OH) 2 ).
Поскольку кальций образует такие твердые минералы, он полезен в строительстве.
материалов, таких как гипс, раствор и цемент. Раствор изготавливается из оксида кальция CaO, также известного как известь или негашеная известь. При взаимодействии оксида кальция с водой образуется гидроксид кальция.
Ca(OH) 2 или гашеная известь, которая поглощает углекислый газ из
на воздухе и постепенно образует карбонат кальция CaCO 3 .
Известь, нагретая водородом, горящим в кислороде, горит ярко-белым цветом.
свет, который можно сфокусировать в узкий пучок, видимый на большой
расстояния.Такое освещение использовалось на маяках, в
съемки, а в театрах производить прожекторы (оставляя актера «в
в центре внимания»).
При взаимодействии оксида кальция с водой образуется гидроксид кальция.
Ca(OH) 2 или гашеная известь, которая поглощает углекислый газ из
на воздухе и постепенно образует карбонат кальция CaCO 3 .
Известь, нагретая водородом, горящим в кислороде, горит ярко-белым цветом.
свет, который можно сфокусировать в узкий пучок, видимый на большой
расстояния.Такое освещение использовалось на маяках, в
съемки, а в театрах производить прожекторы (оставляя актера «в
в центре внимания»).
Хлорид кальция расплывается (он поглощает достаточное количество воды из воздух, который он растворяет в растворе), и используется для удаления влаги с воздуха в сырых подвалах. (Потребуется более сильный человек что я не могу назвать только что открытую коробку с хлоридом кальция, не вел себя должным образом как «несовершеннолетний распутник».»)
«Жесткая вода» содержит растворенные минералы, имеющие 2+ или 3+ заряда,
такие как кальций и магний; эти соли вызывают некоторые мыла и
моющие средства, выпадающие в осадок в виде «мыльной пены»; эти минералы осаждаются
со временем образует «накипь» в воде
обогреватели и кастрюли. Кальций можно удалить водой
умягчители, которые обменивают ионы кальция на ионы натрия, которые имеют
1+ заряжается и не выпадает в осадок.
Кальций можно удалить водой
умягчители, которые обменивают ионы кальция на ионы натрия, которые имеют
1+ заряжается и не выпадает в осадок.
Стронций (Sr, Z=38).
Стронций — блестящий, относительно мягкий металл. Название элемента происходит от Стронтиан — город в Шотландии, где добывали минерал стронтианит. открыт, из которого впервые был выделен стронций. Он находится в земная кора с концентрацией 370 частей на миллион, что делает ее 16-й по величине обильный элемент. Встречается в рудах целестита [стронция сульфат, SrSO 4 ] и стронцианит [карбонат стронция, SrCO 3 ].
Соли стронция при нагревании окрашиваются в ярко-красный цвет.
по этой причине используется в фейерверках и сигнальных ракетах. Радиоактивный
стронций-90 (бета-излучатель) образуется при ядерных взрывах; поскольку
он химически похож на кальций, он включается в кости
у людей, подвергающихся его воздействию. Стронций-90 является бета-излучателем,
и препятствует выработке эритроцитов.
Стронций-90 является бета-излучателем,
и препятствует выработке эритроцитов.
Барий (Ba, Z=56).
Барий — блестящий мягкий металл. Название элемента происходит от греческое слово барыс , что означает «тяжелый», по отношению к высокая плотность некоторых минералов бария. Он находится в земная кора с концентрацией 500 частей на миллион, что делает ее 14-й по величине обильный элемент. Встречается в баритовых рудах [сульфат бария, BaSO 4 ] и витерит [карбонат бария, BaCO 3 ].
Барий был обнаружен в 1500-х годов в виде «болонских камней» (теперь известных как бариевые сульфат, BaSO 4 ), обнаруженный недалеко от Болоньи, Италия. Эти камни светились в присутствии света, а также при нагревании. Соли бария при нагревании окрашиваются в зеленый цвет и используются в фейерверки (в виде нитрата бария, Ba(NO 3 ) 2 ).
Сульфат бария, BaSO 4 , ядовит, но это так. нерастворимым, что он проходит через тело до любого поглощения
может иметь место барий.Используется в диагностике некоторых
проблемы с кишечником в виде «бариевых клизм»: сульфат бария
непрозрачен для рентгеновских лучей и может быть использован для рентгенографии пищеварительного тракта.
тракт.
нерастворимым, что он проходит через тело до любого поглощения
может иметь место барий.Используется в диагностике некоторых
проблемы с кишечником в виде «бариевых клизм»: сульфат бария
непрозрачен для рентгеновских лучей и может быть использован для рентгенографии пищеварительного тракта.
тракт.
Радий (Ra, Z=88).
Радий — мягкий, блестящий, радиоактивный металл. Название элемента произошло от латинского слова «луч», радиус , из-за его способность светиться в темноте слабым голубым светом.Он находится в земной коры с концентрацией 0,6 ppt (частей на триллион), что делает ее 84-й самый распространенный элемент. Он содержится в следовых количествах в урановых руд, но коммерчески используемый радий легче получить из отработавшее ядерное топливо.
Радий был обнаружен
Пьером и Марией Кюри в 1898 году; они извлекли миллиграмм радия
из трех тонн урановой руды. Радий производится в
радиоактивный распад урана-235, урана-238, тория-232 и
плутоний-241. После его открытия и до опасностей
радиация была понята, радий использовался во многих шарлатанских лекарствах и
патентованные лекарства. Радий использовался для изготовления часов, светящихся в темноте.
лица в начале 1900-х годов; альфа-частицы, испускаемые радием
ударил частицы сульфида цинка, заставив их светиться, но был остановлен
по корпусу часов по стеклу циферблата. Многие из
рабочие, расписывавшие эти циферблаты, заболели или умерли от
лучевая болезнь.
После его открытия и до опасностей
радиация была понята, радий использовался во многих шарлатанских лекарствах и
патентованные лекарства. Радий использовался для изготовления часов, светящихся в темноте.
лица в начале 1900-х годов; альфа-частицы, испускаемые радием
ударил частицы сульфида цинка, заставив их светиться, но был остановлен
по корпусу часов по стеклу циферблата. Многие из
рабочие, расписывавшие эти циферблаты, заболели или умерли от
лучевая болезнь.
Каталожные номера
Джон Эмсли, Элементы , 3-е издание. Оксфорд: Clarendon Press, 1998.
.Джон Эмсли, Строительные блоки природы: Путеводитель по элементам от А до Я . Оксфорд: Оксфордский университет Пресс, 2001.
Дэвид Л. Хейзерман, Исследование Химические элементы и их соединения . Нью-Йорк: TAB Книги, 1992.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie.Чтобы это исправить, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.
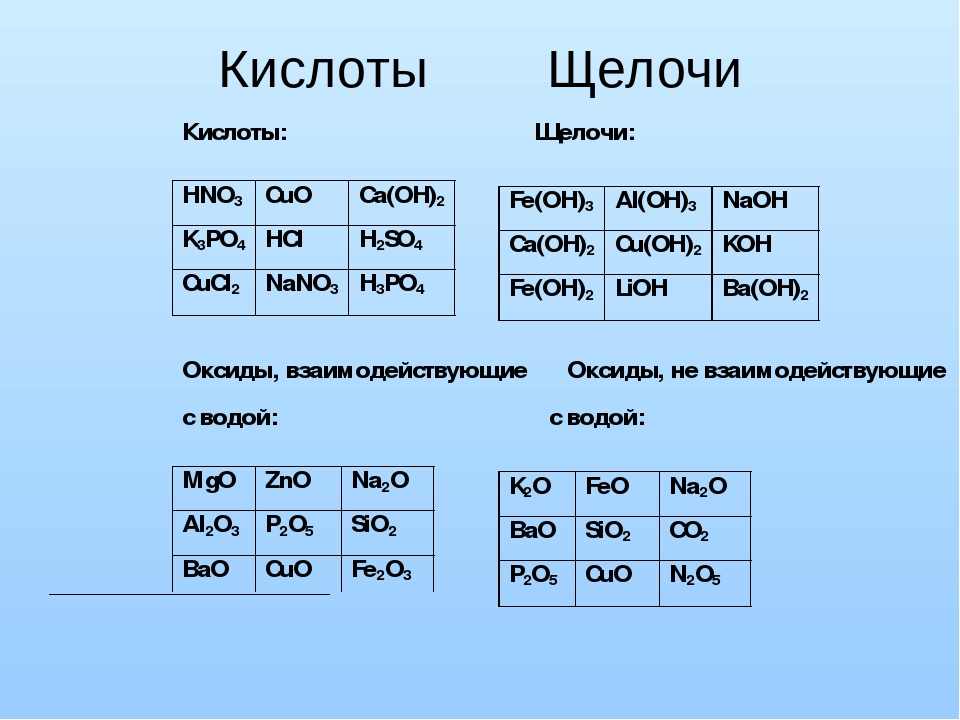 ) или
) или


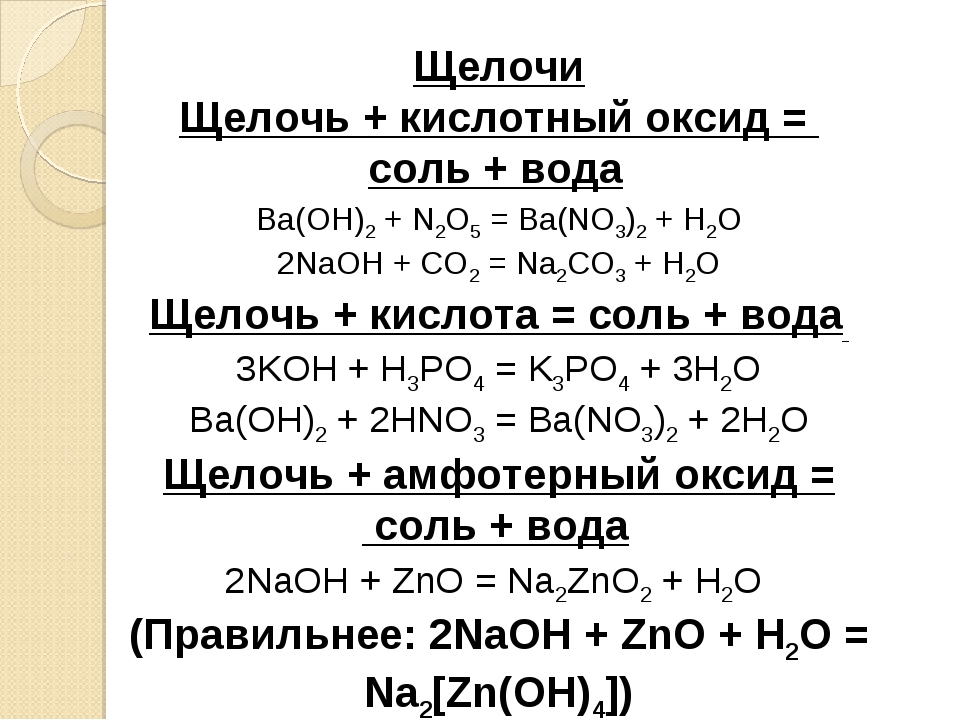
 Приготовление раствора едкого натра в промышленности и быту, раствора извести в строительстве нередко сопровождается ожогами. В быту (по данным медицинской литературы) отравления щелочами наиболее распространены.
Приготовление раствора едкого натра в промышленности и быту, раствора извести в строительстве нередко сопровождается ожогами. В быту (по данным медицинской литературы) отравления щелочами наиболее распространены. Помимо этого, Е524 расходуется на рафинирование растительных масел.
Помимо этого, Е524 расходуется на рафинирование растительных масел. Химические насосы, применяемые в лакокрасочной, целлюлозно-бумажной, сахарной и нефтехимической отрасли, нуждаются в надежной защите от коррозии. Применение триполифосфата для защиты химических насосов от коррозии – это не все полезные свойства вещества. Триполифосфат натрия, формула которого содержит фосфор, обладает способностью связывать катионы щелочноземельных металлов, уменьшая с жесткость воды. Триполифосфат не токсичное вещество, но требуется внимательного и осторожного обращения. Например, его концентрация в воздухе, превышающая ПДК, может при вдыхании пыли вызывать повреждение слизистых оболочек, а также дыхательных путей. При попадании порошка триполифосфата на кожу или в глаза рекомендуется смыть его проточной водой.
Химические насосы, применяемые в лакокрасочной, целлюлозно-бумажной, сахарной и нефтехимической отрасли, нуждаются в надежной защите от коррозии. Применение триполифосфата для защиты химических насосов от коррозии – это не все полезные свойства вещества. Триполифосфат натрия, формула которого содержит фосфор, обладает способностью связывать катионы щелочноземельных металлов, уменьшая с жесткость воды. Триполифосфат не токсичное вещество, но требуется внимательного и осторожного обращения. Например, его концентрация в воздухе, превышающая ПДК, может при вдыхании пыли вызывать повреждение слизистых оболочек, а также дыхательных путей. При попадании порошка триполифосфата на кожу или в глаза рекомендуется смыть его проточной водой.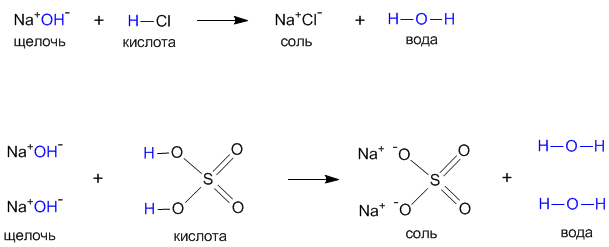 На современных производствах не меньшее внимание уделяется изучению способов оказания первой помощи. Сотрудников обучают методам помощи при химических ожогах и травмах, связанных с химическим производством.
На современных производствах не меньшее внимание уделяется изучению способов оказания первой помощи. Сотрудников обучают методам помощи при химических ожогах и травмах, связанных с химическим производством.