Оксид серы(IV), сернистая кислота, сульфиты — урок. Химия, 8–9 класс.
Оксид серы(\(IV\))
Сернистый газ, или оксид серы(IV), образуется при сгорании серы, сероводорода или обжиге сульфидов:
4FeS2+11O2=2Fe2O3+8SO2↑.
При обычных условиях это бесцветный газ с характерным запахом. Ядовит.
Сернистый газ хорошо растворяется в воде — в \(1\) объёме воды при \(0\) °С может раствориться до \(80\) объёмов сернистого газа, а при комнатной температуре — до \(40\) объёмов. При этом происходит реакция с водой, и образуется сернистая кислота:
SO2+h3O⇄h3SO3.
Оксид серы(\(IV\)) проявляет и другие свойства кислотных оксидов: реагирует со щелочами, основными оксидами c образованием солей:
SO2+2NaOH=Na2SO3+h3O.
Степень окисления серы в оксиде — \(+4\). Это промежуточное значение, поэтому в окислительно-восстановительных реакциях он может быть и окислителем, и восстановителем. Так, свойства восстановителя проявляются в реакции с кислородом:
2S+4O2+O2⇄t,k2S+6O3.
Свойства окислителя сернистый газ проявляет в реакции с сероводородом:
S+4O2+2h3S−2=3S0+2h3O.
Оксид серы(\(IV\)) выделяется в атмосферу при сжигании разных видов топлива и загрязняет её.
Рис. \(1\). Загрязнение воздуха
Сернистая кислота и её соли
Сернистая кислота h3SO3 представляет собой водный раствор оксида серы(\(IV\)) и в свободном состоянии не выделена. Это слабая двухосновная кислота, которая образует два ряда солей. Средние её соли называются сульфитами (Na2SO3,CaSO3), а кислые — гидросульфитами (NaHSO3,Ca(HSO3)2).
Средние её соли называются сульфитами (Na2SO3,CaSO3), а кислые — гидросульфитами (NaHSO3,Ca(HSO3)2).
Сернистая кислота и её соли, так же как и оксид серы(\(IV\)), в окислительно-восстановительных реакциях проявляют двойственные свойства — могут быть и окислителями, и восстановителями.
Сернистый газ уничтожает микроорганизмы, поэтому применяется для дезинфекции помещений, оборудования. Используется он как отбеливающее средство в производстве бумаги, тканей. Для отбеливания используются и соли: сульфит и гидросульфит натрия.
Источники:
Рис. 1. Загрязнение воздуха
https://cdn.pixabay.com/photo/2020/03/07/21/59/power-station-4911010_960_720.jpg
Соединения серы: формулы, свойства и примеры
Сера
В свободном состоянии сера – твердое кристаллическое вещество желтого цвета. Для серы характерно явление аллотропии, т. е. существование в виде нескольких простых веществ – аллотропных модификаций. Аллотропные модификации серы – ромбическая (наиболее устойчивая), моноклинная и пластическая. Молекулы серы в ромбической модификации состоят из 8-ми атомов.
е. существование в виде нескольких простых веществ – аллотропных модификаций. Аллотропные модификации серы – ромбическая (наиболее устойчивая), моноклинная и пластическая. Молекулы серы в ромбической модификации состоят из 8-ми атомов.
Сера относится к семейству p-элементов. Электронная конфигурация серы [Ne]3s23p4. Для серы характерно наличие трех степеней окисления «-2», «+4» и «+6».
Для получения серы используют реакцию Вакенродера (1) или получают ее неполным окислением сероводорода (2):
2H2S + SO2 = 3S↓ + 2H2O (1)
H2S + O2 = 2S↓ + 2H
Из-за наличия нескольких степеней окисления сера способна проявлять и окислительные (в реакциях с металлами) и восстановительные (в реакциях с сильными окислителями) свойства:
Fe +S = FeS
Fe0 -2e = Fe2+ — процесс окисления (восстановитель)
S0 +2e = S2- — процесс восстановления (окислитель)
S + O2 = SO2
S0 – 4e = S4+ — процесс окисления (восстановитель)
O20 + 2e = 2O2- — процесс восстановления (окислитель)
Сера взаимодействует с концентрированными растворами кислот (растворяется в них) и со щелочами (диспропорционирует):
S +2H2SO4 = 3SO2 + 2H 2O
3S + NaOH = K2SO3 + 2K2S + 3H2O
Сероводород.
 Сероводородная кислота. Сульфиды
Сероводородная кислота. СульфидыПри нагревании серы с водородом происходит обратимая реакция в результате которой выделяется сероводород – бесцветный газ с запахом тухлых яиц, ядовитый и плохо растворимый в воде:
S + H2 ↔H2S ↑
Однако, выход сероводорода в этой реакции невелик и для его получения чаще всего используют реакцию действия разбавленных кислот на сульфиды (соли сероводородной кислоты):
FeS + 2HCl = FeCl2 + H2S ↑
Водный раствор сероводорода – очень слабая кислота, диссоциация которой протекает в две ступени:
H2S↔H+ + HS—
HS— ↔ H+ + S2-
В связи с этим, для сероводородной кислоты характерна способность к образованию солей двух видов – средних – сульфидов (кислотный остаток — S
Сероводородная кислота – сильный восстановитель, т.к. сера, входящая в состав этого вещества, находится в низшей степени окисления и способна повысить её до «+4» или «+6», поэтому состав продуктов реакции определяется силой и количеством окислителя:
H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl
H2S + 3H2SO4=4SO2 + 4H2O
H2S + 4Br2 = S + 3HBr
Для сульфидов, как для солей образованных слабой кислотой, характерна способность к гидролизу. Сульфиды металлов, стоящих в ряду активности левее железа, растворимы в сильных кислотах:
ZnS + H2SO4 = ZnSO4 + H2S ↑
Качественной реакцией на H2S и растворимые в воде сульфиды является:
H2S + Pb(NO3)2 = PbS↓ + 2HNO3
S2- + Pb2+ = PbS↓ (осадок черного цвета)
Оксид серы (IV).
 Сернистая кислота
Сернистая кислотаВ степени окисления «+4» сера образует оксид, которому соответствует кислота. Оксид серы (IV) представляет собой газообразное вещество (сернистый газ) без цвета, но обладающее резким запахом, хорошо растворимое в воде.
Выделяют промышленные и лабораторные способы получения оксида серы (IV). Так, в промышленности (1), его получают при обжиге сульфидов, а в лаборатории (2) – при действии сильных кислот на сульфиты:
4FeS2 + 11O2 =2Fe2O3 + 8SO2↑ (1)
Na2SO3 + 2HCl = 2NaCl + SO2↑ + H2O (2)
В водном растворе оксида серы (IV) возможно одновременное существование нескольких химических равновесий:
H2O + SO2 ↔ H2SO3 ↔H+ + HSO3— ↔ 2H+ + SO32-
Образующаяся в результате сернистая кислота (H2SO3) является двухосновной, поэтому способна к образованию двух типов солей – средних
— сульфитов (кислотный остаток SO32) и кислых — гидросульфитов (кислотный остаток HSO2—).
Ca(OH)2 + SO2 = CaSO3↓ + H2O (1)
Na2SO3 + Cl2 + H2O = Na2SO4 + 2HCl (2)
SO2 + C= S↓ + CO2↑ (3)
Качественная реакция на SO2 и сульфиты – обесцвечивание раствора перманганата калия:
5SO2 + 2KMnO4 + 2H2O = 2H2SO4 + K2SO4 + MnSO4
Оксид серы (VI). Серная кислота
Оксид серы (VI) представляет собой бесцветную жидкость, которую получают окислением оксида серы (IV) кислородом в присутствии катализатора (V
2SO2 + O2 ↔ 2SO3
Оксид серы (VI) хорошо растворим в воде (образуется серная кислота) и в 100%-ной серной кислоте (образуется олеум):
SO3 + H2O = H2SO4
Серная кислота представляет собой тяжелую вязкую жидкость, которая хорошо смешивается с водой в любых отношениях. Водный раствор серной кислоты – сильная кислота. Поскольку H2SO4 двухосновная кислота, она способна образовывать два типа солей – средние – сульфаты (кислотный остаток SO42-) и кислые – гидросульфиты (кислотный остаток HSO4—).
Водный раствор серной кислоты – сильная кислота. Поскольку H2SO4 двухосновная кислота, она способна образовывать два типа солей – средние – сульфаты (кислотный остаток SO42-) и кислые – гидросульфиты (кислотный остаток HSO4—).
При взаимодействии с металлами (как, стоящими в ряду активности до водорода, так и после него) серная кислота восстанавливается до оксида серы (IV):
Zn + H2SO4 = ZnSO4 + SO2↑ +2H2O
Cu +2H2SO4= CuSO4 + SO2↑ +2H2O
Разбавленная серная кислота окисляет только металлы, стоящими в ряду активности до водорода:
Zn + H2SO4 = ZnSO4 + H2↑
Качественной реакцией на серную кислоту и растворимые сульфаты является образование осадка сульфата бария – осадка белого цвета, нерастворимого в щелочах и кислотах:
Ba2+ + SO42- = BaSO4↓
Примеры решения задач
Объявления о защитах диссертаций,Диссертационный совет
21. 09.2020
09.2020
Защита диссертации: 02.12.2020
08.06.2020
Бычков Алексей Леонидович Диссертация «Механохимическая обработка природных полимеров и её технологическое применение» на соискание ученой степени доктора химических наукЗащита диссертации: 23.09.2020
08.06.2020
Мищенко Ксения Владимировна Диссертация «Синтез и термические превращения формиатов и оксокарбоната висмута с получением металлического висмута и его оксидов» на соискание ученой степени кандидата химических наук.
Защита диссертации: 16.09.2020
04.10.2019
Ухина Арина Викторовна Диссертация «Структурно-морфологические особенности формирования металл-алмазных композиций» на соискание ученой степени кандидата химических наук.Защита диссертации: 18.12.2019
19.08.2019
Семыкина Дарья Олеговна Диссертация «Cтруктурно-морфологические и электрохимические свойства натрий/литий ванадий-содержащих электродных материалов для натрий/литий-ионных аккумуляторов» на соискание ученой степени кандидата химических наук.Защита диссертации: 27.11.2019
15.10.2018
Тяпкин Павел Юрьевич Диссертация «Нанокомпозиты на основе оксидов железа, синтезированных в порах мезопористого диоксида кремния» на соискание ученой степени кандидата химических наук. 12.2018
12.201808.10.2018
Скрипкина Татьяна Сергеевна Диссертация «Механохимическая модификация структуры гуминовых кислот для получения комплексных сорбентов» на соискание ученой степени кандидата химических наук.Защита диссертации: 19.12.2018 в 10:00
08.10.2018
Подгорбунских Екатерина Михайловна Диссертация «Исследование механоферментативных превращений полимеров трудноперерабатываемого растительного сырья» на соискание ученой степени кандидата химических наук.Защита диссертации: 19.12.2018 в 12:00
03.10.2018
Шубникова Елена Викторовна Диссертация «Структура и кислородная проницаемость оксидов со смешанной проводимостьюSr1-yBayCo0.8-xFe0.2MxO3-δ (M=W, Mо)» на соискание ученой степени кандидата химических наук.

Защита диссертации: 05.12.2018
26.09.2018
Лозанов Виктор Васильевич Диссертация «Синтез и физико-химическое исследование тугоплавких соединений, образующихся в системах на основе гафния, тантала и иридия» на соискание ученой степени кандидата химических наук.Защита диссертации: 12.12.2018
03.05.2017
Прокип Владислав Эдвардович Диссертация «Физико-химическое исследование германатов гафния» на соискание ученой степени кандидата химических наук.Защита диссертации: 05.07.2017 в 10:00
01.02.2017
Пестерева Наталья Николаевна Диссертация «Процессы переноса вдоль границы раздела фаз MeWO4|WO3 и физико-химические свойства композитов MeWO4-WO3 (Me = Ca, Sr, Ba)» на соискание ученой степени кандидата химических наук.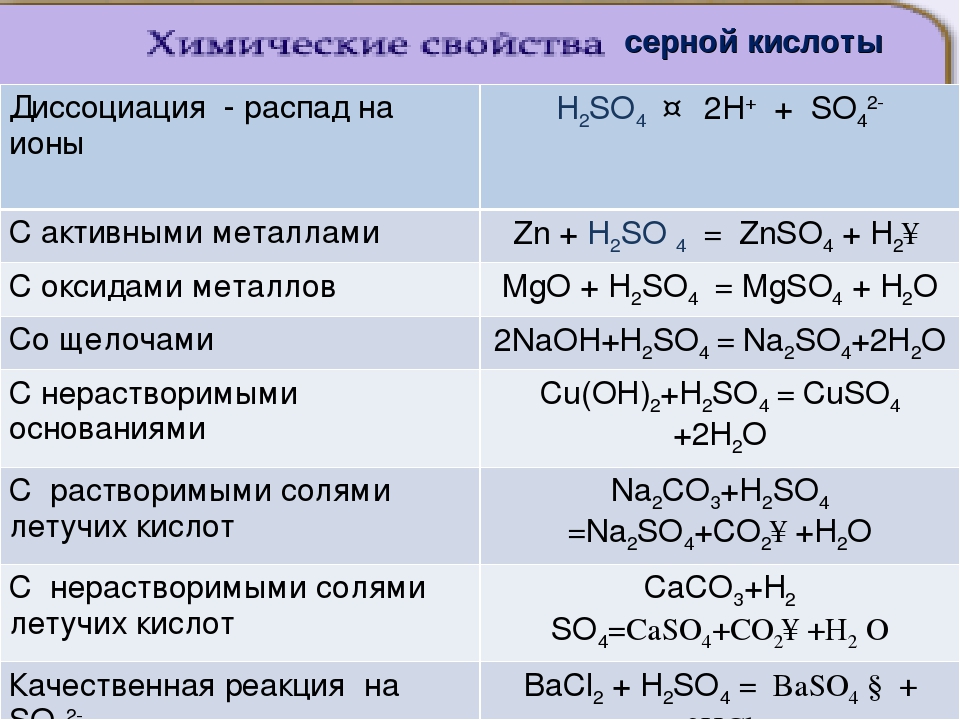
Защита диссертации: 05.04.2017 в 10:00
27.12.2016
Попов Михаил Петрович Диссертация «Изучение влияния модификации вольфрамом на функциональные свойства перовскита состава Ba0.5Sr0.5Co0.8Fe0.2O3-δ» на соискание ученой степени кандидата химических наук.Защита диссертации: 01.03.2017 в 10:00
10.08.2016
Подгорнова Ольга Андреевна Диссертация «Синтез, структура и электрохимические свойства катодных материалов на основе LiCoPO4» на соискание ученой степени кандидата химических наук.Защита диссертации: 12.10.2016 в 10:00
22.04.2016
Рыбин Вячеслав Андреевич Диссертация «Физико-химическое исследование базальтового волокна с защитными щелочестойкими покрытиями» на соискание ученой степени кандидата химических наук.
Защита диссертации: 22.06.2016 в 10:00
23.10.2015
Архипов Сергей Григорьевич Диссертация «Получение сокристаллов и солей аминокислот с органическими кислотами и сравнение их структуры и свойств со структурами и свойствами исходных компонентов» на соискание ученой степени кандидата химических наук.Защита диссертации: 24.12.2015 в 10:00
Сероводород h3S — Что такое Сероводород h3S?
Бесцветный газ с неприятным запахом тухлых яиц. Также является побочным продуктом нефтепереработки
Сероводород (сернистый водород, сульфид водорода, дигидросульфид) H2S — самое активное из серосодержащих соединений.
В нормальных условиях — бесцветный газ с неприятным запахом тухлых яиц.
Газ — потому что атомы водорода в молекуле не образуют прочных водородных связей, в отличие от молекул воды,.
Растворим в воде (в 1V H2O растворяется 3V H2S при н.у.), растворяется в этаноле.
Растворимость H2S в углеводородной фазе выше, чем в водной, коэффициент распределения H2S между фазами зависит в 1ю очередь от состава углеводородной фазы: в бензоле — 5 9 — 6 0; в керосине — 2 4 — 2 5; в легкой нефти — 1,5 — 1,75.
Взрывоопасен в смеси с воздухом в диапазоне 4 — 45% об.
Вызывает сильную коррозию металлов.
Также является продуктом нефтепереработки.
Используется в химической промышленности в оргсинтезе для получения тиофена и меркаптанов, получения серы, серной кислоты, сульфидов.
В медицине используется в сероводородных ваннах.
Сероводород — токсичный газ 3 класса опасности, действующий непосредственно на нервную систему.
Сероводород притупляет обонятельный нерв и интоксикация может произойти внезапно.
Ощутимый запах — при концентрации H2S 1,4 — 2,3 мг/м3, значительный запах — 4 мг/м3, тяжелый запах — от 7 мг/м3.
Острое отравление наступает уже при концентрациях 0,2 — 0,3 мг/л, концентрация более 1 мг/л ( 0,1% концентрация газа в воздухе) — смертельна для человека.
Признаки сильного отравления сероводородом: отек легких, судороги, паралич нервов, последующая кома.
Если в содержится от 0,02% H2S, то ощущается головокружение, головная боль, тошнота и довольно скорое привыкание к запаху тухлых яиц.
При хроническом отравлении ухудшается зрение, поражается слизистая оболочка глаза, вероятен конъюнктивит, светобоязнь.
При отравлении H2S, нужно срочно выйти на свежий воздух, принять сердечные и дыхательные аналептики, препараты железа, глюкозу, витамины.
Предельно-допустимая концентрация (ПДК) H2S в воздухе в рабочей зоне — 10 мг/м3 (ГН 2. 2.5.1313-03 Предельно допустимые концентрации вредных веществ в воздухе рабочей зоны), в смеси с углеводородами — 3 мг/м3.
2.5.1313-03 Предельно допустимые концентрации вредных веществ в воздухе рабочей зоны), в смеси с углеводородами — 3 мг/м3.
ПДК H2S в воздухе населенных мест- 0,008 мг/м3 (ГН 2.1.6.1338-03 Предельно допустимые концентрации загрязняющих веществ в атмосферном воздухе населенных мест).
Получение H2S:
— реакция взаимодействия разбавленных кислот с сульфидами
— реакция взаимодействия сульфида алюминия с водой
— сплавление парафина с серой.
В природе встречается довольно редко в составе попутного нефтяного газа (ПНГ), природного газа, вулканического газа, в растворенном виде в природных водах.
К примеру, в Черном море слои воды, расположенные глубже 150 -200 м содержат растворенный H2S.
Содержится в сырой нефти.
Образуется при гниении белков, содержащих в составе серосодержащие аминокислоты метионин или цистеин.
Кишечные газы человека и животных тоже содержат H2S. Чуть — чуть, но малоприятно.
Урок 11. сера. серовород. сульфиды. — Химия — 9 класс
Сера – элемент VI группы главной подгруппы, 3 периода периодической системы химических элементов Д.И. Менделеева, называемые халькогенами. Рассмотрим особенности строения атома серы. Заряд ядра серы + 16. Так как она находится в третьем периоде, то у нее содержится три энергетических уровня. На первом уровне 2 электрона, на втором 8, на третьем 6. Электронная формула 1s2, 2s2, 2p6, 3s2, 3p4. Как видно из электронно-графической схемы у атома серы до заполнения подуровня не хватает двух электронов, следовательно, она может их принимать, проявляя окислительные свойства. Ввиду того, что у атома серы имеется пустой d-подуровень, то в возбужденном состоянии электроны с s и p подуровня могут переходить на d-подуровень. В таком состоянии сера может отдавать другим атомам либо 4, либо 6 электронов, проявляя восстановительные свойства.
Для серы характерно явление аллотропии. Аллотропные модификации серы – кристаллическая сера: твердое вещество желтого цвета и пластическая сера. При нагревании кристаллическая сера, молекулы которой представляют собой восьмичленные кольца, сначала превращается в легкоподвижную жидкость, затем густеет и при 444 ºС закипает. Если кипящую серу вылить в воду – она превращается в пластическую серу, которая, в свою очередь, при хранении на воздухе превращается назад в кристаллическую.
Сера может проявлять как окислительные, так и восстановительные свойства. Окислительные свойства серы выражены слабее, чем у кислорода. Как окислитель сера взаимодействует с металлами, образуя сульфиды. Например, при взаимодействии серы с натрием образуется сульфид натрия. Сера принимает два электрона от атомов серы, переходя в степень окисления -2. Также сера проявляет окислительные свойства при взаимодействии с водородом. Реакция протекает при нагревании, образуется сероводород. Окислительные свойства серы, а именно её способность взаимодействовать при комнатной температуре с ртутью, применяется для обезвреживания разлитой ртути.
Восстановительные свойства сера проявляет в реакциях кислородом, галогенами и некоторыми сложными веществами. Например, при взаимодействии серы с кислородом образуется оксид серы четыре, а при взаимодействии серы с фтором образуется фторид серы шесть. Из сложных веществ сера может, например, реагировать с концентрированной серной кислотой, переходя в оксид серы четыре. Восстановительные свойства серы применяются в изготовлении пороха, производстве спичек, производстве серной кислоты.
В природе сера находится в идее сульфидов, в самородном виде в виде сульфатов.
Водородное соединение серы – сероводород- бесцветный, ядовитый газ с запахом тухлых яиц. В низких концентрациях используется в медицинских целях. В лабораторных условиях можно получать путем взаимодействия сульфидов с разбавленными кислотами, например, при реакции сульфида цинка с разбавленной соляной кислотой
Так как сера в сероводороде находится в минимальной степени окисления, то сероводород проявляет восстановительные свойства. Например, сероводород горит на воздухе, причем в избытке кислорода образуется оксид серы четыре, а при недостатке кислорода – сера. Также сероводород может взаимодействовать с галогенами, например, с бромом.
Например, сероводород горит на воздухе, причем в избытке кислорода образуется оксид серы четыре, а при недостатке кислорода – сера. Также сероводород может взаимодействовать с галогенами, например, с бромом.
Водный раствор сероводорода обладает кислотными свойствами. Поэтому сероводород может взаимодействовать с щелочами, образуя средние соли – сульфиды или кислые соли – гидросульфиды. Качественная реакция на сульфид-ионы – это реакция с нитратом меди (II) или нитратом свинца (II) при этом выпадает осадок черного цвета.
Сера. Описание, свойства, происхождение и применение минерала
- Главная
- Другое
- Сера. Описание, свойства, происхождение и применение минерала
НОВОСТИ ГОРНОДОБЫВАЮЩЕЙ ОТРАСЛИ
Сера — минерал из класса самородных элементов. Сера представляет собой пример хорошо выраженного энантиоморфного полиморфизма. В природе образует 2 полиморфные модификации: a-сера ромбическая и b-сера моноклинная. При атмосферном давлении и температуре 95,6°С a-сера переходит в b-серу. Сера жизненно необходима для роста растений и животных, она входит в состав живых организмов и продуктов их разложения, ее много, например, в яйцах, капусте, хрене, чесноке, горчице, луке, волосах, шерсти и т.д. Она присутствует также в углях и нефти.
- Структура
- Свойства
- Морфология
- Происхождение
- Применение
- Классификация
- Физические свойства
- Оптические свойства
- Кристаллографические свойства
СТРУКТУРА
Кристаллическая структура и две сингонии серы
Самородная сера обычно представлена a-серой, которая кристаллизуется в ромбической сингонии, ромбо-дипирамидальный вид симметрии. Кристаллическая сера имеет две модификации; одну из них, ромбическую, получают из раствора серы в сероуглероде (CS2) испарением растворителя при комнатной температуре. При этом образуются ромбовидные просвечивающие кристаллы светложелтого цвета, легко растворимые в CS2. Эта модификация устойчива до 96° С, при более высокой температуре стабильна моноклинная форма. При естественном охлаждении расплавленной серы в цилиндрических тиглях вырастают крупные кристаллы ромбической модификации с искаженной формой (октаэдры, у которых частично «срезаны» углы или грани). Такой материал в промышленности называется комовая сера. Моноклинная модификация серы представляет собой длинные прозрачные темножелтые игольчатые кристаллы, также растворимые в CS2. При охлаждении моноклинной серы ниже 96° С образуется более стабильная желтая ромбическая сера.
СВОЙСТВА
Самородная сера
Самородная сера жёлтого цвета, при наличии примесей — жёлто-коричневая, оранжевая, бурая до чёрной; содержит включения битумов, карбонатов, сульфатов, глины. Кристаллы чистой серы прозрачны или полупрозрачны, сплошные массы просвечивают в краях. Блеск смолистый до жирного. Твердость 1-2, спайности нет, излом раковистый. Плотность 2,05 -2,08 г/см3, хрупкая. Легко растворима в канадском бальзаме, в скипидаре и керосине. В HCl и h3SO4 нерастворима. HNO3 и царская водка окисляют серу, превращая её в h3SO4. Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов.
Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую). Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами.
Плавление серы сопровождается заметным увеличением объёма (примерно 15 %). Расплавленная сера представляет собой жёлтую легкоподвижную жидкость, которая выше 160 °C превращается в очень вязкую тёмно-коричневую массу. Наибольшую вязкость расплав серы приобретает при температуре 190 °C; дальнейшее повышение температуры сопровождается уменьшением вязкости и выше 300 °C расплавленная сера снова становится подвижной. Это связано с тем, что при нагревании серы она постепенно полимеризуется, увеличивая длину цепочки с повышением температуры. При нагревании серы свыше 190 °C полимерные звенья начинают рушиться.
Сера может служить простейшим примером электрета. При трении сера приобретает сильный отрицательный заряд.
МОРФОЛОГИЯ
Самородная сера
Образует усечённо-дипирамидальные, реже дипирамидальные, пинакоидальные или толстопризматические кристаллы, а также плотные скрытокристаллические, сливные, зернистые, реже тонковолокнистые агрегаты. Главные формы на кристаллах: дипирамиды (111) и (113), призмы (011) и (101), пинакоид (001). Также сростки и друзы кристаллов, скелетные кристаллы, псевдосталактиты, порошковатые и землистые массы, налёты и примазки. Для кристаллов характерны множественные параллельные срастания.
ПРОИСХОЖДЕНИЕ
Самородная сера
Сера образуется при вулканических извержениях, при выветривании сульфидов, при разложении гипсоносных осадочных толщ, а также в связи с деятельностью бактерий. Главные типы месторождений самородной серы — вулканогенные и экзогенные (хемогенно-осадочные). Экзогенные месторождения преобладают; они связаны с гипсо-ангидритами, которые под воздействием выделений углеводородов и сероводорода восстанавливаются и замещаются серно-кальцитовыми рудами. Такой инфильтрационно-метасоматический генезис имеют все крупнейшие месторождения. Самородная сера часто образуется (кроме крупных cкоплений) в результате окисления h3S. Геохимические процессы её образования существенно активизируются микроорганизмами (сульфатредуцирующими и тионовыми бактериями). Сопутствующие минералы — кальцит, арагонит, гипс, ангидрит, целестин, иногда битумы. Среди вулканогенных месторождений самородной серы главное значение имеют гидротермально-метасоматические (например, в Японии), образованные сероносными кварцитами и опалитами, и вулканогенно-осадочные сероносные илы кратерных озёр. Образуется также при фумарольной деятельности. Образуясь в условиях земной поверхности, самородная сера является всё же не очень устойчивой и, постепенно окисляясь, даёт начало сульфатам, гл. образом гипсу.
Используется в производстве серной кислоты (около 50% добываемого количества). В 1890 г. Герман Фраш предложил плавить серу под землёй и извлекать на поверхность через скважины, и в настоящее время месторождения серы разрабатывают главным образом путём выплавки самородной серы из пластов под землёй непосредственно в местах её залегания. Сера также в больших количествах содержится в природном газе (в виде сероводорода и сернистого ангидрида), при добыче газа она откладывается на стенках труб, выводя их из строя, поэтому её улавливают из газа как можно быстрее после добычи.
ПРИМЕНЕНИЕ
Сера входит в состав спичечной головки
Примерно половина производимой серы используется в производстве серной кислоты. Серу применяют для вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона. Сера находит применение для производства пиротехнических составов, ранее использовалась в производстве пороха, применяется для производства спичек.
Сера (англ. Sulphur) — S
| Молекулярный вес | 32.06 г/моль |
| Происхождение названия | Латинское sulfur (происходящее из эллинизированного написания этимологического sulpur), предположительно, восходит к индоевропейскому корню *swelp — «гореть» |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
| Strunz (8-ое издание) | 1/B.03-10 |
| Nickel-Strunz (10-ое издание) | 1.CC.05 |
| Dana (7-ое издание) | 1.3.4.1 |
| Dana (8-ое издание) | 1.3.5.1 |
| Hey’s CIM Ref. | 1.51 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | жёлтый, серно-жёлтый, коричневато- или зеленовато-жёлтый, оранжевый, белый |
| Цвет черты | бесцветный |
| Прозрачность | прозрачный, полупрозрачный |
| Блеск | смоляной, жирный |
| Спайность | несовершенная по {001}, {110} и {111} |
| Твердость (шкала Мооса) | 1.5 — 2.5 |
| Излом | неровный, раковистый |
| Прочность | очень хрупкая |
| Отдельность | отдельность по {111} |
| Плотность (измеренная) | 2.07 г/см3 |
| Радиоактивность (GRapi) | 0 |
ОПТИЧЕСКИЕ СВОЙСТВА
| Тип | двухосный (+) |
| Показатели преломления | nα = 1.958 nβ = 2.038 nγ = 2.245 |
| Максимальное двулучепреломление | δ = 0.287 |
| Оптический рельеф | очень высокий |
| Плеохроизм | видимый |
| Рассеивание | относительно слабое r<v |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | mmm (2/m 2/m 2/m) — ромбо-дипирамидальный |
| Пространственная группа | Fddd |
| Сингония | Ромбическая (орторомбическая) |
| Параметры ячейки | a = 10.468Å, b = 12.870Å, c = 24.49Å |
| Двойникование | Двойники по {101}, {011}, {110} довольно редки |
33799 ПРИСОЕДИНЯЙТЕСЬ К НАМ В СОЦСЕТЯХ:
Сера. Химия серы и ее соединений
1. Положение серы в периодической системе химических элементов
2. Электронное строение атома серы
3. Физические свойства и нахождение в природе
4. Соединения серы
5. Способы получения
6. Химические свойства
6.1. Взаимодействие с простыми веществами
6.1.1. Взаимодействие с кислородом
6.1.2. Взаимодействие с галогенами
6.1.3. Взаимодействие с серой и фосфором
6.1.4. Взаимодействие с металлами
6.1.5. Взаимодействие с водородом
6.2. Взаимодействие со сложными веществами
6.2.1. Взаимодействие с окислителями
6.2.2. Взаимодействие с щелочами
Сероводород
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Кислотные свойства
3.2. Взаимодействие с кислородом
3.3. Восстановительные свойства
3.4. Взаимодействие с солями тяжелых металлов
Сульфиды
Способы получения сульфидов
Химические свойства сульфидов
Оксиды серы
1. Оксид серы (IV)
2. Оксид серы (VI)
Серная кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Диссоциация серной кислоты
3.2. Основные свойства серной кислоты
3.3. Взаимодействие с солями более слабых кислот
3.4. Разложение при нагревании
3.5. Взаимодействие с солями
3.6. Качественная реакция на сульфат-ионы
3.7. Окислительные свойства серной кислоты
Сернистая кислота
Соли серной кислоты – сульфаты
Сера
Положение в периодической системе химических элементов
Сера расположена в главной подгруппе VI группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение серы
Электронная конфигурация серы в основном состоянии:
Атом серы содержит на внешнем энергетическом уровне 2 неспаренных электрона и две неподеленные электронные пары в основном энергетическом состоянии. Следовательно, атом серы может образовывать 2 связи по обменному механизму, как и кислород. Однако, в отличие от кислорода, за счет вакантной 3d орбитали атом серы может переходить в возбужденные энергетические состояния. Электронная конфигурация серы в первом возбужденном состоянии:
Электронная конфигурация серы во втором возбужденном состоянии:
Таким образом, максимальная валентность серы в соединениях равна VI (в отличие от кислорода). Также для серы характерна валентность — IV.
Степени окисления атома серы – от -2 до +4. Характерные степени окисления -2, 0, +4, +6.
Физические свойства и нахождение в природе
Сера образует различные простые вещества (аллотропные модификации).
Наиболее устойчивая модификация серы – ромбическая сера S8. Это хрупкое вещество желтого цвета.
Моноклинная сера – это аллотропная модификация серы, в которой атомы соединены в циклы в виде «короны». Это твердое вещество, состоящее из темно-желтых игл, устойчивое при температуре более 96оС, а при обычной температуре превращающееся в ромбическую серу.
Пластическая сера – это вещество, состоящее из длинных полимерных цепей. Коричневая резиноподобная аморфная масса, нерастворимая в воде.
В природе сера встречается:
- в самородном виде;
- в составе сульфидов (сульфид цинка ZnS, пирит FeS2, сульфид ртути HgS — киноварь и др.)
- в составе сульфатов (CaSO4·2H2O гипс, Na2SO4·10H2O — глауберова соль)
Соединения серы
Типичные соединения серы:
| Степень окисления | Типичные соединения |
| +6 | Оксид серы(VI) SO3 Серная кислота H2SO4 Сульфаты MeSO4 Галогенангидриды: SО2Cl2 |
| +4 | Оксид серы (IV) SO2 Сернистая кислота H2SO3 Сульфиты MeSO3 Гидросульфиты MeHSO3 Галогенангидриды: SOCl2 |
| –2 | Сероводород H2S Сульфиды металлов MeS |
Способы получения серы
1. В промышленных масштабах серу получают открытым способом на месторождениях самородной серы, либо из вулканов. Из серной руды серу получают также пароводяными, фильтрационными, термическими, центрифугальными и экстракционными методами. Пароводяной метод — это выплавление из руды с помощью водяного пара.
2. Способ получения серы в лаборатории – неполное окисление сероводорода.
2H2S + O2 → 2S + 2H2O
3. Еще один способ получения серы – взаимодействие сероводорода с оксидом серы (IV):
2H2S + SO2 → 3S + 2H2O
Химические свойства серы
В нормальных условиях химическая активность серы невелика: при нагревании сера активна, и может быть как окислителем, так и восстановителем.
1. Сера проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому сера реагирует с металлами и неметаллами.
1.1. При горении серы на воздухе образуется оксид серы (IV):
S + O2 → SO2
1.2. При взаимодействии серы с галогенами (со всеми, кроме йода) образуются галогениды серы:
S + Cl2 → SCl2 (S2Cl2)
S + 3F2 → SF6
1.3. При взаимодействии фосфора и углерода с серой образуются сульфиды фосфора и сероуглерод:
2P + 3S → P2S3
2P + 5S → P2S5
2S + C → CS2
1.4. При взаимодействии с металлами сера проявляет свойства окислителя, продукты реакции называют сульфидами. С щелочными металлами сера реагирует без нагревания, а с остальными металлами (кроме золота и платины) – только при нагревании.
Например, железо и ртуть реагируют с серой с образованием сульфидов железа (II) и ртути:
S + Fe → FeS
S + Hg → HgS
Еще пример: алюминий взаимодействует с серой с образованием сульфида алюминия:
3S + 2Al → Al2S3
1.5. С водородом сера взаимодействует при нагревании с образованием сероводорода:
S + H2 → H2S
2. Со сложными веществами сера реагирует, также проявляя окислительные и восстановительные свойства. Сера диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями сера окисляется до оксида серы (IV) или до серной кислоты (если реакция протекает в растворе).
Например, азотная кислота окисляет серу до серной кислоты:
S + 6HNO3 → H2SO4 + 6NO2 + 2H2O
Серная кислота также окисляет серу. Но, поскольку S+6 не может окислить серу же до степени окисления +6, образуется оксид серы (IV):
S + 2H2SO4 → 3SO2 + 2H2O
Соединения хлора, например, бертолетова соль, также окисляют серу до +4:
S + 2KClO3 → 3SO2 + 2KCl
Взаимодействие серы с сульфитами (при кипячении) приводит к образованию тиосульфатов:
S + Na2SO3 → Na2S2O3
2.2. При растворении в щелочах сера диспропорционирует до сульфита и сульфида.
Например, сера реагирует с гидроксидом натрия:
S + NaOH → Na2SO3 + Na2S + H2O
При взаимодействии с перегретым паром сера диспропорционирует:
S + H2O (пар) → 2H2S + SO2
Сероводород
Строение молекулы и физические свойства
Сероводород H2S – это бинарное соединение водорода с серой, относится к летучим водородным соединениям. Следовательно, сероводород бесцветный ядовитый газ, с запахом тухлых яиц. Образуется при гниении. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода похожа на структуру воды — уголковая молекула. Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1о.
Способы получения сероводорода
В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например, при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
S + H2 → H2S
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например, сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
2H2S + O2 → 2S + 2H2O
В избытке кислорода:
2H2S + 3O2 → 2SO2 + 2H2O
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Например, азотная кислота окисляет сероводород до молекулярной серы:
H2S + 2HNO3(конц.) → S + 2NO2 + 2H2O
При кипячении сера окисляется до серной кислоты:
H2S + 8HNO3(конц.) → H2SO4 + 8NO2 + 4H2O
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например, оксид серы (IV) окисляет сероводород:
2H2S + SO2 → 3S + 2H2O
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
3H2S + K2Cr2O7 + 4H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 7H2O
2H2S + 4Ag + O2 → 2Ag2S + 2H2O
Серная кислота окисляет сероводород либо до молекулярной серы:
H2S + H2SO4(конц.) → S + SO2 + 2H2O
Либо до оксида серы (IV):
H2S + 3H2SO4(конц.) → 4SO2 + 4H2O
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов: меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например, сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
H2S + Pb(NO3)2 → PbS + 2HNO3
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Сульфиды
Сульфиды – это бинарные соединения серы и металлов или некоторых неметаллов, соли сероводородной кислоты.
По растворимости в воде и кислотах сульфиды разделяют на растворимые в воде, нерастворимые в воде, но растворимые в минеральных кислотах, нерастворимые ни в воде, ни в минеральных кислотах, гидролизуемые водой.
| Растворимые в воде | Нерастворимые в воде, но растворимые в минеральных кислотах | Нерастворимые ни в воде, ни в минеральных кислотах (только в азотной и серной конц.) | Разлагаемые водой, в растворе не существуют |
| Сульфиды щелочных металлов и аммония | Сульфиды прочих металлов, расположенных до железа в ряду активности. Белые и цветные сульфиды (ZnS, MnS, FeS, CdS) | Черные сульфиды (CuS, HgS, PbS, Ag2S, NiS, CoS) | Сульфиды трехвалентных металлов (алюминия и хрома (III)) |
| Реагируют с минеральными кислотами с образованием сероводорода | Не реагируют с минеральными кислотами, сероводород получить напрямую нельзя | Разлагаются водой
| |
| ZnS + 2HCl → ZnCl2 + H2S | Al2S3 + 6H2O → 2Al(OH)3 + 3H2S | ||
Способы получения сульфидов
1. Сульфиды получают при взаимодействии серы с металлами. При этом сера проявляет свойства окислителя.
Например, сера взаимодействует с магнием и кальцием:
S + Mg → MgS
S + Ca → CaS
Сера взаимодействует с натрием:
S + 2Na → Na2S
2. Растворимые сульфиды можно получить при взаимодействии сероводорода и щелочей.
Например, гидроксида калия с сероводородом:
H2S + 2KOH → K2S + 2H2O
3. Нерастворимые сульфиды получают взаимодействием растворимых сульфидов с солями (любые сульфиды) или взаимодействием сероводорода с солями (только черные сульфиды).
Например, при взаимодействии нитрата меди и сероводорода:
Pb(NO3)2 + Н2S → 2НNO3 + PbS
Еще пример: взаимодействие сульфата цинка с сульфидом натрия:
ZnSO4 + Na2S → Na2SO4 + ZnS
Химические свойства сульфидов
1. Растворимые сульфиды гидролизуются по аниону, среда водных растворов сульфидов щелочная:
K2S + H2O ⇄ KHS + KOH
S2– + H2O ⇄ HS– + OH–
2. Сульфиды металлов, расположенных в ряду напряжений левее железа (включительно), растворяются в сильных минеральных кислотах.
Например, сульфид кальция растворяется в соляной кислоте:
CaS + 2HCl → CaCl2 + H2S
А сульфид никеля, например, не растворяется:
NiS + HСl ≠
3. Нерастворимые сульфиды растворяются в концентрированной азотной кислоте или концентрированной серной кислоте. При этом сера окисляется либо до простого вещества, либо до сульфата.
Например, сульфид меди (II) растворяется в горячей концентрированной азотной кислоте:
CuS + 8HNO3 → CuSO4 + 8NO2 + 4H2O
или горячей концентрированной серной кислоте:
CuS + 4H2SO4(конц. гор.) → CuSO4 + 4SO2 + 4H2O
4. Сульфиды проявляют восстановительные свойства и окисляются пероксидом водорода, хлором и другими окислителями.
Например, сульфид свинца (II) окисляется пероксидом водорода до сульфата свинца (II):
PbS + 4H2O2 → PbSO4 + 4H2O
Еще пример: сульфид меди (II) окисляется хлором:
СuS + Cl2 → CuCl2 + S
5. Сульфиды горят (обжиг сульфидов). При этом образуются оксиды металла и серы (IV).
Например, сульфид меди (II) окисляется кислородом до оксида меди (II) и оксида серы (IV):
2CuS + 3O2 → 2CuO + 2SO2
Аналогично сульфид хрома (III) и сульфид цинка:
2Cr2S3 + 9O2 → 2Cr2O3 + 6SO2
2ZnS + 3O2 → 2SO2 + ZnO
6. Реакции сульфидов с растворимыми солями свинца, серебра, меди используют как качественные на ион S2−.
Сульфиды свинца, серебра и меди — черные осадки, нерастворимые в воде и минеральных кислотах:
Na2S + Pb(NO3)2 → PbS↓ + 2NaNO3
Na2S + 2AgNO3 → Ag2S↓ + 2NaNO3
Na2S + Cu(NO3)2 → CuS↓ + 2NaNO3
7. Сульфиды трехвалентных металлов (алюминия и хрома) разлагаются водой (необратимый гидролиз).
Например, сульфид алюминия разлагается до гидроксида алюминия и сероводорода:
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S
Разложение происходит и взаимодействии солей трехвалентных металлов с сульфидами щелочных металлов.
Например, сульфид натрия реагирует с хлоридом алюминия в растворе. Но сульфид алюминия не образуется, а сразу же необратимо гидролизуется (разлагается) водой:
3Na2S + 2AlCl3 + 6H2O → 2Al(OH)3 + 3H2S + 6NaCl
Оксиды серы
| Оксиды серы | Цвет | Фаза | Характер оксида |
| SO2 Оксид сера (IV), сернистый газ | бесцветный | газ | кислотный |
| SO3 Оксид серы (VI), серный ангидрид | бесцветный | жидкость | кислотный |
Оксид серы (IV)
Оксид серы (IV) – это кислотный оксид. Бесцветный газ с резким запахом, хорошо растворимый в воде.
Cпособы получения оксида серы (IV):
1. Сжигание серы на воздухе:
S + O2 → SO2
2. Горение сульфидов и сероводорода:
2H2S + 3O2 → 2SO2 + 2H2O
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например, сульфит натрия взаимодействует с серной кислотой:
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
4. Обработка концентрированной серной кислотой неактивных металлов.
Например, взаимодействие меди с концентрированной серной кислотой:
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Химические свойства оксида серы (IV):
Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя.
1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов.
Например, оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2 + 2NaOH(изб) → Na2SO3 + H2O
SO2(изб) + NaOH → NaHSO3
Еще пример: оксид серы (IV) реагирует с основным оксидом натрия:
SO2 + Na2O → Na2SO3
2. При взаимодействии с водой SO2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
SO2 + H2O ↔ H2SO3
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например, оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
2SO2 + O2 ↔ 2SO3
Сернистый ангидрид обесцвечивает бромную воду:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Азотная кислота очень легко окисляет сернистый газ:
SO2 + 2HNO3 → H2SO4 + 2NO2
Озон также окисляет оксид серы (IV):
SO2 + O3 → SO3 + O2
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
5SO2 + 2H2O + 2KMnO4 → 2H2SO4 + 2MnSO4 + K2SO4
Оксид свинца (IV) также окисляет сернистый газ:
SO2 + PbO2 → PbSO4
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например, при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
SO2 + 2Н2S → 3S + 2H2O
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
SO2 + С → S + СO2
Оксид серы (VI)
Оксид серы (VI) – это кислотный оксид. При обычных условиях – бесцветная ядовитая жидкость. На воздухе «дымит», сильно поглощает влагу.
Способы получения. Оксид серы (VI) получают каталитическим окислением оксида серы (IV) кислородом.
2SO2 + O2 ↔ 2SO3
Сернистый газ окисляют и другие окислители, например, озон или оксид азота (IV):
SO2 + O3 → SO3 + O2
SO2 + NO2 → SO3 + NO
Еще один способ получения оксида серы (VI) – разложение сульфата железа (III):
Fe2(SO4)3 → Fe2O3 + 3SO3
Химические свойства оксида серы (VI)
1. Оксид серы (VI) активно поглощает влагу и реагирует с водой с образованием серной кислоты:
SO3 + H2O → H2SO4
2. Серный ангидрид является типичным кислотным оксидом, взаимодействует с щелочами и основными оксидами.
Например, оксид серы (VI) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
SO3 + 2NaOH(избыток) → Na2SO4 + H2O
SO3 + NaOH(избыток) → NaHSO4
Еще пример: оксид серы (VI) взаимодействует с оксидом оксидом (при сплавлении):
SO3 + MgO → MgSO4
3. Серный ангидрид – очень сильный окислитель, так как сера в нем имеет максимальную степень окисления (+6). Он энергично взаимодействует с такими восстановителями, как иодид калия, сероводород или фосфор:
SO3 + 2KI → I2 + K2SO3
3SO3 + H2S → 4SO2 + H2O
5SO3 + 2P → P2O5 + 5SO2
4. Растворяется в концентрированной серной кислоте, образуя олеум – раствор SO3 в H2SO4.
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравненяи реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800оС |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. nSO3 + H2SO4 → H2SO4·nSO3 Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота.
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
H2SO4 ⇄ H+ + HSO4–
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4– ⇄ H+ + SO42–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, серная кислота взаимодействует с оксидом магния:
H2SO4 + MgO → MgSO4 + H2O
Еще пример: при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
H2SO4 + КОН → KHSО4 + H2O
H2SO4 + 2КОН → К2SО4 + 2H2O
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3H2SO4 + 2Al(OH)3 → Al2(SO4)3 + 6H2O
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например, серная кислота взаимодействует с гидрокарбонатом натрия:
Н2SO4 + 2NaHCO3 → Na2SO4 + CO2 + H2O
Или с силикатом натрия:
H2SO4 + Na2SiO3 → Na2SO4 + H2SiO3
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
NaNO3(тв.) + H2SO4 → NaHSO4 + HNO3
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например, хлорида натрия:
NaCl(тв.) + H2SO4 → NaHSO4 + HCl
4. Также серная кислота вступает в обменные реакции с солями.
Например, серная кислота взаимодействует с хлоридом бария:
H2SO4 + BaCl2 → BaSO4 + 2HCl
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например, серная кислота реагирует с железом. При этом образуется сульфат железа (II):
H2SO4(разб.) + Fe → FeSO4 + H2
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
H2SO4 + NH3 → NH4HSO4
Концентрированная серная кислота является сильным окислителем. При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
6H2SO4(конц.) + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
6H2SO4(конц.) + 2Al → Al2(SO4)3 + 3SO2 + 6H2O
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
2H2SO4(конц.) + Cu → CuSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + Hg → HgSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + 2Ag → Ag2SO4 + SO2↑+ 2H2O
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
3Mg + 4H2SO4 → 3MgSO4 + S + 4H2O
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
5H2SO4(конц.) + 4Zn → 4ZnSO4 + H2S↑ + 4H2O
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например, концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
5H2SO4(конц.) + 2P → 2H3PO4 + 5SO2↑ + 2H2O
2H2SO4(конц.) + С → СО2↑ + 2SO2↑ + 2H2O
2H2SO4(конц.) + S → 3SO2 ↑ + 2H2O
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
3H2SO4(конц.) + 2KBr → Br2↓ + SO2↑ + 2KHSO4 + 2H2O
5H2SO4(конц.) + 8KI → 4I2↓ + H2S↑ + K2SO4 + 4H2O
H2SO4(конц.) + 3H2S → 4S↓ + 4H2O
Сернистая кислота
Сернистая кислота H2SO3 – это двухосновная кислородсодержащая кислота. При нормальных условиях — неустойчивое вещество, которое распадается на диоксид серы и воду.
Валентность серы в сернистой кислоте равна IV, а степень окисления +4.
Химические свойства
1. Сернистая кислота H2SO3 в водном растворе – двухосновная кислота средней силы. Частично диссоциирует по двум ступеням:
H2SO3 ↔ HSO3– + H+
HSO3– ↔ SO32– + H+
2. Сернистая кислота самопроизвольно распадается на диоксид серы и воду:
H2SO3 ↔ SO2 + H2O
Соли серной кислоты – сульфаты
Серная кислота образует два типа солей: средние – сульфаты, кислые – гидросульфаты.
1. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
2. Сульфаты таких металлов, как медь Cu, алюминий Al, цинк Zn, хром Cr, железо (II) Fe подвергаются термическому разложению на оксид металла, диоксид серы SO2 и кислород O2;
2CuSO4 → 2CuO + SO2 + O2 (SO3)
2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2
2ZnSO4 → 2ZnO + SO2 + O2
2Cr2(SO4)3 → 2Cr2O3 + 6SO2 + 3O2
При разложении сульфата железа (II) в FeSO4 Fe (II) окисляется до Fe (III)
4FeSO4 → 2Fe2O3 + 4SO2 + O2
Сульфаты самых тяжелых металлов разлагаются до металла.
3. За счет серы со степенью окисления +6 сульфаты проявляют окислительные свойства и могут взаимодействовать с восстановителями.
Например, сульфат кальция при сплавлении реагирует с углеродом с образованием сульфида кальция и угарного газа:
CaSO4 + 4C → CaS + 4CO
4. Многие средние сульфаты образуют устойчивые кристаллогидраты:
Na2SO4 ∙ 10H2O − глауберова соль
CaSO4 ∙ 2H2O − гипс
CuSO4 ∙ 5H2O − медный купорос
FeSO4 ∙ 7H2O − железный купорос
ZnSO4 ∙ 7H2O − цинковый купорос
Na2CO3 ∙ 10H2O − кристаллическая сода
Сероводород — h3S — Экологические системы побережья Мексиканского залива
Что такое сероводород?
Сероводород — это химическое соединение с химической формулой H 2 S. Это означает, что он состоит из двух атомов водорода и одного сульфида. Это бесцветный газ с очевидной идентификационной характеристикой; у него отчетливый запах тухлого яйца. Немного плотнее воздуха, он может быть невероятно взрывоопасным. При горении кислородом сероводород горит синим цветом с образованием диоксида серы и воды.Он несколько растворим в воде и действует как слабая кислота.
Другие названия сероводорода включают:
- Моносульфид дигидрогена
- Сероводород
- Канализационный газ
- Сульфан
- Сероводород
- Сероводород
- Сероводород
- Гидрид серы
- Сероводородная кислота
- Гидротионовая кислота
- Кислота тиогидроксидная
- Кислота сероводородная
Где находится сероводород?
Как и многие другие опасные загрязнители воздуха, сероводород образуется при разложении органических веществ, например растений или животных.Он также выделяется с отходами жизнедеятельности человека и животных, а также со сточными водами и навозом. Еще один распространенный и несколько печально известный источник этого пахучего газа — природные серные источники в качестве природного газа.
Сероводород также является обычным побочным продуктом во многих процессах промышленного производства и нефтепереработки, таких как нефть, целлюлоза и бумага, текстиль и упаковка пищевых продуктов.
Почему сероводород вызывает беспокойство?
Сероводород — невероятно опасный загрязнитель воздуха.Он очень коррозионный и может разрушить металлы, включая нержавеющую сталь, если не удалить его должным образом. Для большинства процессов борьбы с выбросами удаление H 2 S является самым первым шагом. Этот шаг необходимо выполнить, чтобы избежать разрушения другого оборудования, включая технологии борьбы с выбросами. Помимо того, что он легко воспламеняется и взрывоопасен, он очень опасен для здоровья человека. Продолжительное воздействие, даже в очень низких концентрациях, может вызвать серьезную тошноту, головные боли и раздражение глаз. Потеря аппетита и усталость также являются частыми последствиями воздействия низкой концентрации, а также расстройства пищеварения и раздражения.Более серьезные последствия, которые возникают при более высоких концентрациях, включают потерю сознания, необратимое повреждение глаз, респираторные проблемы, инфекции и отек легких.
При достаточно высоких концентрациях, таких как 500-700 частей на миллион, воздействие может почти мгновенно привести к смерти. Было несколько случаев, когда с сероводородом не обращались должным образом на заводах, и заводские рабочие умирали.
Как мы лечим сероводород?
A SO 2 Блок закалки кислого газа водой и скруббер предназначен для удаления образующегося при термическом окислении SO 2 .Можно удалить до 99% SO 2 .
Секция адиабатического охлаждения охлаждает выхлопные газы окислителя до температуры ниже 180 ° F. Рециркуляционный насос (ы) подает воду в охлаждающую жидкость через распылительные коллекторы, а не испаренная вода поступает в рециркуляционный отстойник. Приблизительно 50% кислого газа очищается в секции резкого охлаждения.
В мокром скруббере вода или промывочная жидкость — это среда, которая удаляет загрязняющие вещества из грязных поступающих потоков. Загрязненный воздух поступает в нижнюю часть противоточного вертикального скруббера с насадочной колонной, а вода и щелочной раствор распыляются в верхней части башни.Кислые газы поглощаются раствором, когда воздух проходит вверх по колонне. Перед выходом из колонны скруббера воздух проходит через секцию туманоуловителя для удаления захваченной воды. Когда вода рециркулирует, добавление пресной воды необходимо для удаления накапливающихся загрязняющих веществ и для компенсации потерь от испарения. Пресная вода может добавляться в резервуар для рециркуляции либо непрерывно, либо периодически.
Гидроксид натрия добавляется в рециркулирующую воду для нейтрализации адсорбированного SO 2 .Скорость добавления гидроксида натрия контролируется анализатором pH и подается дозирующим насосом.
Реакция SO 2 с каустиком дает смешанный раствор сульфита натрия (Na 2 SO 3 ) и бисульфита натрия (NaHSO 3 ), как показано следующими реакциями:
SO 2 + NaOH = NaHSO 3
NaHSO 3 + NaOH = Na 2 SO 3 + H 2 O
Относительные количества двух побочных продуктов, образующихся в скруббере, будут варьироваться в зависимости от рабочего заданного значения pH.
Посредством последовательной установки двухступенчатого скруббера заданное значение pH на Этапе 1 минимизируется (pH ≥ 7), так что образующийся побочный продукт будет в основном солью NaOH 1: 1 с SO 2 (бисульфит натрия), а не чем соль 2: 1 (сульфит натрия). Это сведет к минимуму расход NaOH. Это достигается за счет использования 1-й башни скруббера в качестве установленной рабочей лошади для удаления SO 2 . Независимо от концентрации SO 2 , первая колонна должна быть настроена для работы в непрерывном режиме для удаления большей части SO 2 , конвертируемого в вышестоящий RTO.2-я башня, которая включает в себя те же приборы, что и 1-я башня, должна действовать как полировщик для 1-й башни и позволять точную настройку оборудования для достижения более стабильного сброса сточных вод.
Существуют различные варианты очистки сточных вод. Лучший выбор будет зависеть от сайта.
Один из вариантов — это то, что делают большинство очистных установок SO 2 . Они обрабатывают сточные воды с неприятным запахом, отправляя их в большие бассейны для аэрации, где продувка охлаждается и разбавляется достаточно, чтобы подавить ее запах, а воздух пропускается через жидкость достаточно долго, чтобы преобразовать почти все NaHSO 3 и Na 2 SO 3 в сульфат натрия.
NaHSO 3 + Na 2 SO 3 + NaOH + O 2 = 2 Na 2 SO 4 + H 2 O
Только тогда сточные воды будут безопасно сбрасываться.
Дополнительные статьи в серии GCES «Снижение уровня опасных загрязнителей воздуха» включают:
Часть 1: BTEX — это аббревиатура, обозначающая бензол, толуол, этилбензол и ксилолы.
Часть 2: Снижение уровня хлора
Часть 3: NOx — это группа химических соединений, загрязняющих воздух, оксидов азота.
Часть 4: Свинец также известен (ошибочно) как ртуть, потому что они часто встречаются вместе
Часть 5: Промышленные скрубберы для очистки аммиака
Часть 6: SOx, соединения молекул серы и кислорода, включая моноксид серы, диоксид серы и триоксид серы
Часть 7: Углеводороды — метан, этан, пропан, бутан, пентан, гексан
Часть 8: Метил меркаптан — метилмеркаптан, также известный как метантиол
Часть 9: H 2 S — Сильнокоррозийный сероводород
Часть 10: Диметилсульфид — Метилтиометан
Часть 11: Серная кислота — H 2 SO 4
Часть 12: Оксид этилена — EtO
Часть 13: ПФАС как новые источники загрязнения
Что такое сульфид серебра? — Химическая формула и применение
Сульфид серебра
Серебро — это металлический элемент, который обычно теряет один электрон, чтобы стать положительно заряженным ионом Ag + 1. Атому серы нужны два электрона, чтобы заполнить его валентную электронную оболочку. Оболочка валентных электронов является самой внешней частью электронного облака атома. Когда атом серы получает два электрона, он становится отрицательно заряженным ионом S + 2.Сера может получить эти два электрона от двух атомов серебра. После того, как происходит перенос электронов, два иона слипаются, образуя ионное соединение Ag2 S.
Образование сульфида серебра
Давайте вернемся к потускневшему серебру. В воздухе содержатся небольшие следы газообразного сероводорода от гниющих растений и туш животных. Поскольку столовое серебро используется для употребления в пищу, есть смысл в том, что продукты, содержащие серу, могут вызвать потускнение, если столовое серебро не очищено должным образом. Обычные продукты, содержащие серу, — это яйца, майонез и горчица.В основном ваши ингредиенты для бутербродов с яичным салатом! В результате реакции образуется сульфид серебра:
2Ag (s) + h3 S (g) → Ag2 S (s) + h3 (g)
Удаление потускнения сульфида серебра
Ранее на уроке мы обсуждали полировку серебра с помощью протирочных составов. . Это тяжелая работа, и серебро удаляется вместе с сульфидом серебра. Сульфид серебра также можно удалить химическим способом. Серебро занимает последнее место в списке химически активных металлов, а алюминий довольно реакционноспособен, поэтому алюминий будет реагировать с сульфидом серебра, образуя сульфид алюминия и чистое серебро.
3Ag2 S (s) + 2Al (s) → 6Ag (s) + Al2 S3 (s)
До этого момента мы обсуждали, что сульфид серебра больше раздражает, чем полезное соединение. Посмотрим, есть ли у него какое-нибудь полезное применение.
Применение сульфида серебра
Ионы серебра обладают антибактериальными свойствами, но соединения сульфида серебра используются нечасто. Сульфид серебра используется в исследованиях и в мембранных сенсорах в фармацевтике, но других применений этого соединения не так много.
Краткое содержание урока
Сульфид серебра — это ионное соединение, образованное между ионами серебра и серы. Серебро отдает один электрон, чтобы стать ионом серебра Ag + 1. Сера требует двух электронов, чтобы заполнить ее валентную оболочку , которая является внешней частью электронного облака. Когда атом серы забирает эти два электрона, он становится ионом серы S-2 с названием сульфид. Ион серебра и сульфид-ион слипаются, образуя сульфид серебра Ag2S.
Сульфид серебра образуется, когда элементарное серебро реагирует с газообразным сероводородом, который присутствует в воздухе.Сероводород образуется при разложении растений и животных.
Сульфид серебра обычно представляет собой соединение, которое не имеет большого количества полезных применений. Он присутствует на любых серебряных предметах в виде черного налета и может быть удален физически, протерев его или посредством химической реакции с алюминием.
Тиолы и сульфиды — Chemistry LibreTexts
Цели
После заполнения этого раздела вы сможете:
- Номенклатура и реакционная способность
- написать название тиола по ИЮПАК, учитывая его Kekulé, сокращенную или сокращенную структуру.
- изобразите структуру тиола, учитывая его название IUPAC.
- напишите уравнение, представляющее образование тиола в результате реакции гидросульфид-аниона с алкилгалогенидом.
- напишите уравнение, иллюстрирующее получение тиола реакцией тиомочевины с алкилгалогенидом.
- напишите уравнение, чтобы показать взаимное превращение тиолов в дисульфиды.
- Напишите название сульфида, учитывая его структуру.
- нарисуйте структуру сульфида в соответствии с его названием.
- запишите уравнение, показывающее, как сульфид может быть получен реакцией тиолат-аниона с алкилгалогенидом.
- идентифицируют продукт реакции данного галогенида алкила с данным анионом тиолата.
- определяет реагенты, необходимые для получения данного сульфида.
- напишите уравнение, чтобы проиллюстрировать образование соли триалкилсульфония из сульфида и алкилгалогенида.
Ключевые термины
- дисульфид
- группа меркапто
- (органический) сульфид
- сульфон
- сульфоксид
- тиол
- тиолат анион
- Ион триалкилсульфония (соль триалкилсульфония)
Учебные заметки
Химию серосодержащих органических соединений часто исключают из вводных курсов органической химии. Однако мы включили небольшой раздел об этих соединениях не ради увеличения количества материала, который нужно переваривать, а потому, что большую часть химии этих веществ можно предсказать, зная об их кислородсодержащих аналогах.Тиол — это соединение, которое содержит функциональную группу SH. Сама группа -SH называется меркаптогруппой. Дисульфид — это соединение, содержащее -S-S- связь. (Органические) сульфиды имеют структуру R-S-R ‘и, следовательно, являются серными аналогами простых эфиров. Номенклатуру сульфидов можно легко понять, если разбираться в номенклатуре соответствующих эфиров. Обратите внимание, что термин «тио» также используется в неорганической химии. Например, SO 4 2- — это сульфат-ион; в то время как S 2 O 3 2-, в котором один из атомов кислорода сульфат-иона заменен на атом серы, называется тиосульфатом.Тиолат-анионы, RS-, аналогичны алкокси-анионам, RO-. Тиолат-анионы являются лучшими нуклеофилами, чем алкокси-анионы (см. Раздел 11.5, страницы 389–394 учебника). Если вам сложно понять, почему образуются ионы триалкилсульфония, подумайте о них как о чем-то похожем на ионы гидроксония, которые образуются при протонировании воды:
Позже мы увидим примеры ионов тетраалкиламмония, R 4 N + , которые снова можно рассматривать как похожие на ионы гидроксония.сульфоксиды и сульфоны получают окислением органических сульфидов. Вам не нужно запоминать методы, использованные для проведения этих окислений.
В таблице 18.1 ниже представлено быстрое сравнение кислородсодержащих и серосодержащих органических соединений.
Степени окисления соединений серы
Кислород принимает только две степени окисления в своих органических соединениях (–1 в пероксидах и –2 в других соединениях). С другой стороны, сера находится в степенях окисления от –2 до +6, как показано в следующей таблице (некоторые простые неорганические соединения показаны оранжевым цветом).
Тиолы
Тиолы, которые также называют меркаптанами, аналогичны спиртам. Они названы аналогично спиртам, за исключением того, что вместо -ol используется суффикс -тиол . Сама по себе группа -SH называется меркаптогруппой.
Тиолы обычно получают с использованием гидросульфид-аниона (-SH) в качестве нуклеофила в реакции S N 2 с алкилгалогенидами.
Проблема этой реакции состоит в том, что тиоловый продукт может подвергаться второй реакции S N 2 с дополнительным алкилгалогенидом с образованием сульфидного побочного продукта.Эту проблему можно решить, используя тиомочевину (NH 2 ) 2 C = S в качестве нуклеофила. В результате реакции сначала получают соль алкилизотиомочевины и промежуточное соединение. Затем эту соль гидролизуют реакцией с водным основанием.
Дисульфиды
Окисление тиолов и других соединений серы изменяет степень окисления серы, а не углерода. Мы видим некоторые типичные примеры окисления серы в следующих примерах. В первом случае мягкое окисление превращает тиолы в дисуфиды.Эквивалентное окисление спиртов до пероксидов обычно не наблюдается. Причины такого разного поведения определить нетрудно. Одинарная связь S – S почти в два раза прочнее, чем связь O – O в пероксидах, а связь O – H более чем на 25 ккал / моль прочнее, чем связь S – H. Таким образом, термодинамика отдает предпочтение образованию дисульфида, а не пероксида.
Дисульфидные мостики в белках
Дисульфидные (сера-сера) связи между двумя остатками цистеина являются неотъемлемым компонентом трехмерной структуры многих белков.Взаимное превращение тиолов в дисульфидные группы представляет собой окислительно-восстановительную реакцию: тиол находится в восстановленном состоянии, а дисульфид — в окисленном состоянии.
Обратите внимание, что в окисленном (дисульфидном) состоянии каждый атом серы потерял связь с водородом и приобрел связь с серой — вот почему состояние дисульфида считается окисленным по сравнению с состоянием тиола.
Редокс-агент, который опосредует образование и разрушение дисульфидных мостиков в большинстве белков, — это глутатион, универсальный кофермент, который мы уже встречали ранее в другом контексте (раздел 14.2А). Напомним, что важной функциональной группой в глутатионе является тиол, выделенный синим на рисунке ниже. В своей восстановленной (свободный тиол) форме глутатион обозначается сокращенно GSH.
В окисленной форме глутатион существует в виде димера двух молекул, связанных дисульфидной группой, и обозначается сокращенно «GSSG».
Новый дисульфид в белке образуется в результате реакции «дисульфидного обмена» с GSSH, процесса, который можно описать как комбинацию двух атак, подобных S N 2.Конечным результатом является то, что новый дисульфид цистеина-цистеина образуется за счет дисульфида в GSSG.
В своем восстановленном (тиол) состоянии глутатион может восстанавливать дисульфидные мостики в белках посредством обратной реакции, описанной выше.
Дисульфидные мостики существуют по большей части только в белках, расположенных вне клетки. Внутри клетки цистеины сохраняются в своем восстановленном состоянии (свободный тиол) за счет высокой внутриклеточной концентрации GSH, который, в свою очередь, поддерживается в восстановленном состоянии (т.е.GSH, а не GSSG) с помощью флавин-зависимого фермента, называемого глутатионредуктазой.
Дисульфидные мостики в белках также могут быть напрямую восстановлены другим флавин-зависимым ферментом, называемым тиоредоксином. В обоих случаях NADPH является конечным донором электронов, восстанавливая FAD обратно до FADH 2 в каждом каталитическом цикле.
В биохимической лаборатории белки часто поддерживают в их восстановленном состоянии (свободный тиол) путем инкубации в буфере, содержащем избыточную концентрацию b-меркаптоэтанола (BME) или дитиотреитола (DTT).Эти восстановители действуют аналогично GSH, за исключением того, что DTT, поскольку он имеет две тиоловые группы, образует внутримолекулярный дисульфид в его окисленной форме.
Сульфиды
Серные аналоги эфиров называются сульфидами . Химическое поведение сульфидов во многих важных отношениях отличается от поведения простых эфиров. Поскольку сероводород (H 2 S) является гораздо более сильной кислотой, чем вода (более чем в десять миллионов раз), мы ожидаем и обнаруживаем, что тиолы являются более сильными кислотами, чем эквивалентные спирты и фенолы.Основания тиолатных конъюгатов легко образуются и оказались отличными нуклеофилами в реакциях S N 2 алкилгалогенидов и тозилатов.
R – S (-) Na (+) + (CH 3 ) 2 CH – Br (CH 3 ) 2 CH – S – R + Na (+) Br (-)
Хотя основность эфиров примерно в сто раз выше, чем у эквивалентных сульфидов, нуклеофильность серы намного выше, чем у кислорода, что приводит к ряду интересных и полезных электрофильных замещений серы, которые обычно не наблюдаются для кислорода.Сульфиды, например, реагируют с алкилгалогенидами с образованием солей тройного сульфония (уравнение №1) таким же образом, как 3º-амины алкилируются до солей четвертичного аммония. Хотя эквивалентные оксониевые соли простых эфиров известны, их получают только в экстремальных условиях, и они обладают исключительно реакционной способностью.
сульфидов названы по тем же правилам, что и простые эфиры, за исключением того, что сульфид используется вместо эфира . Для более сложных веществ вместо алкокси используется алкилтио.
SAM метилтрансферазы
Наиболее распространенным примером ионов сульфония в живом организме является реакция S-аденозилметионина. Некоторые из наиболее важных примеров реакций S N 2 в биохимии — это реакции, катализируемые S-аденозилметионин (SAM) -зависимыми ферментами метилтрансферазы. Мы уже видели в главе 6 и снова в главе 8, как метильная группа передается в реакции S N 2 от SAM к аминогруппе на нуклеотидном основании аденозина:
( нуклеиновых кислот Res . 2000 , 28 , 3950).
Другая SAM-зависимая реакция метилирования катализируется ферментом под названием катехол-O-метилтрансфераза. Субстрат здесь — адреналин, также известный как адреналин.
Обратите внимание, что в этом примере атакующий нуклеофил представляет собой спирт, а не амин (поэтому фермент называется О-метилтрансферазой). В обоих случаях, однако, основная боковая цепь аминокислоты располагается в активном сайте как раз в нужном месте, чтобы депротонировать нуклеофильную группу при ее атаке, увеличивая ее нуклеофильность.Электрофилом в обеих реакциях является метильный углерод, поэтому существует небольшое стерическое препятствие для замедления нуклеофильной атаки. Метилуглерод является электрофильным, потому что он связан с положительно заряженной серой, которая является мощной электроноакцепторной группой. Положительный заряд серы также делает ее отличной уходящей группой, поскольку полученный продукт будет нейтральным и очень стабильным сульфидом. В общем, в обеих реакциях мы имеем достаточно хороший нуклеофил, бедный электронами, беспрепятственный электрофил и отличную уходящую группу.
Поскольку электрофильный углерод в этих реакциях представляет собой метильный углерод, ступенчатый механизм, подобный S N 1, крайне маловероятен: метилкарбокатион имеет очень высокую энергию и поэтому не является разумным промежуточным продуктом для предложения. Мы можем с уверенностью предсказать, что это реакция S N 2. Происходит ли эта реакция S N 2, как и ожидалось, с инверсией стереохимии? Конечно, электрофильный метильный углерод в этих реакциях является ахиральным, поэтому инверсия не очевидна.Чтобы продемонстрировать инверсию, был проведен следующий эксперимент с катехол-O-метилтрансферазой:
Здесь метильная группа SAM была сделана хиральной за счет включения изотопов водорода трития ( 3 H, T) и дейтерия ( 2 H, D). Исследователи определили, что реакция произошла с инверсией конфигурации, как и ожидалось для смещения S N 2 ( J. Biol. Chem . 1980, 255 , 9124).
Сульфиды легко окисляются. При реакции сульфида с перекисью водорода H 2 O 2 при комнатной температуре образуется сульфоксид (R 2 SO). Окисление можно продолжить реакцией с пероксикислотой с образованием сульфона (R 2 SO 2 )
Типичным примером сульфоксида является растворитель диметилсульфоксид (ДМСО). ДМСО — полярный апротонный растворитель.
Рисунок AB16.3. ДМСО — очень полярный апротонный растворитель.
Сера — Информация об элементе, свойства и использование
Расшифровка:
Химия в ее элементе: сера
(Promo)
Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Привет, на этой неделе вонючие отложения, скунсы и запах ада. Все они начинаются с буквы S, как и элемент этой недели. Вот Стив Майлон.
Стив Майлон
«Как пахло?» Это был единственный вопрос, который мне нужно было задать своему коллеге-геологу об отложениях, которые она пыталась понять. Запах осадка многое говорит о химическом составе, лежащем в основе.Густые черные бескислородные отложения могут сопровождаться гнилостным запахом, характерным только для восстановленной серы.
Может быть, поэтому сера имеет такую плохую репутацию. Мой сын полгода не ел яйца, когда почувствовал запах своего первого тухлого яйца. В Библии кажется, что всякий раз, когда что-то случается или вот-вот должно произойти, горящая сера изображена на картинке:
Например,
В Бытие мы слышим: «Господь пролил дождем горящую серу на Содом и Гоморру»
А в Откровении мы читаем, что грешники найдут свое место в огненном озере из горящей серы.»
Странно то, что в обоих случаях мы не должны ожидать образования чего-либо неприятного запаха. Когда сера горит на воздухе, она обычно образует двуокись серы или трехокись серы, последний из которых не имеет запаха [исправлено из аудиозаписи подкаста файл, в котором говорится, что диоксид серы не имеет запаха]. Эти соединения могут дополнительно окисляться и выпадать в виде серной или сернистой кислоты. Это механизм кислотных дождей, которые опустошили леса на северо-востоке Соединенных Штатов, как угли, богатые серой. сгорели для выработки электроэнергии в штатах Среднего Запада и унесены преобладающими ветрами на восток, где выплескивается серная кислота, вызывая всевозможные экологические проблемы.
Кроме того, сочетание горящего угля и тумана создает смог во многих промышленных городах, вызывая респираторные заболевания у местных жителей. Здесь также виноваты диоксид серы и серная кислота. Но опять же, эта форма серы не имеет запаха.
Так что, если говорят, что ад или дьявол «пахнет серой», может быть, это не так уж и плохо.
Но уменьшите серу, отдав ей пару электронов, и ее запах будет безошибочным. Требование восстановления серы до сульфида явно потеряно при переводе.
Ад, пахнущий сероводородом или любым количеством сероорганических соединений, совсем не будет хорошим местом. Органические сульфидные соединения, известные как тиолы или меркаптаны, так плохо пахнут, что их обычно добавляют в природный газ без запаха в очень небольших количествах, чтобы служить «сигнализатором запаха» в случае утечки в трубопроводе природного газа. Скунсы используют неприятный запах бутил-селеномеркаптана как средство защиты от врагов. И лично для меня наихудшая химия происходит, когда восстановленная сера придает неприятный (вонючий) привкус бутылкам с вином или пивом.-приведены, чтобы испортить приятную ночь в городе или послеобеденное время в местном пабе.
Итак, откуда берется «запах ада» в бескислородных отложениях. Интересно, что некоторые бактерии эволюционировали, чтобы использовать окисленную серу, сульфат, в качестве акцептора электронов во время дыхания. Подобно тому, как люди превращают элементарный кислород в воду, эти бактерии восстанавливают сульфат до сероводорода — они явно не обращают внимания на запах.
Запах — не единственный интересный химический состав, который сопровождает восстановленную серу.Глубокий черный цвет, связанный с бескислородными отложениями, является результатом низкой растворимости большинства сульфидов металлов. Восстановление сульфата до сульфида обычно сопровождает осаждение пирита (сульфида железа), киновари (сульфида ртути), галенита (сульфида свинца) и многих других минералов. Эти сульфиды металлов стали важным промышленным источником многих из этих важных металлов.
Промышленность — это то место, где вы почти наверняка найдете серу или, что более важно, серную кислоту, которая используется в различных процессах, от производства удобрений до нефтепереработки.На самом деле серная кислота считается самым производимым химическим веществом в промышленно развитом мире. Представьте, что элемент с такой адской репутацией стал одним из самых важных.
А некоторые даже предполагают, что сера может спасти планету. Биогенное соединение диметилсульфид (ДМС) образуется в результате расщепления диметилсуфоноприопоната, осмотического регулирующего соединения, вырабатываемого планктоном в океане. 12) серы.DMS окисляется до SO2 и, наконец, до частиц серной кислоты, которые могут действовать как ядра конденсации облаков, образуя облака, которые имеют общий охлаждающий эффект для планеты.
Представьте себе более высокие температуры, сопровождаемые большей биологической активностью, что приводит к большему выбросу DMS в атмосферу. Образовавшееся облако может охладить нагреющуюся планету. Это похоже на то, как планктон раскрывает зонтик, частично состоящий из серы. Из символа проклятия в спасителя … что за поворот !!.
Крис Смит
Стив Майлон нюхает вонючую историю Sulphur. К счастью, элемент на следующей неделе намного менее пахучий.
Джон Эмсли
История его открытия началась, когда Рэлей обнаружил, что азот, извлеченный из воздуха, имеет более высокую плотность, чем полученный при разложении аммиака. Разница была небольшой, но реальной. Рамзи написал Рэли, предлагая поискать более тяжелый газ в азоте, полученном из воздуха, в то время как Рэли должен искать более легкий газ из аммиака.Рамзи удалил весь азот из своего образца, многократно пропуская его над нагретым магнием. Ему оставили один процент, который не вступил в реакцию, и он обнаружил, что он плотнее азота. В его атомном спектре появились новые красные и зеленые линии, подтверждающие, что это новый элемент.
Крис Смит
И этот новый элемент был аргоном, прозванным ленивым элементом, потому что первоначально ученые думали, что он ни с чем не будет реагировать. Теперь мы знаем, что это неправда, и Джон Эмсли будет здесь, чтобы раскрыть секреты аргона в программе «Химия в ее элементе» на следующей неделе. Надеюсь, вы присоединитесь к нам.Я Крис Смит, спасибо за внимание и до свидания.
(промо)
(конец промо)
Превращение H 2 S в сульфановую серу
В недавно опубликованной обзорной статье (передача сигналов h3S посредством сульфгидратации белка и не только. Nature Rev.Мол. Cell Biol. 13 , 499–507 (2012)) 1 , Пол и Снайдер используют термин «сульфгидратация» для определения модификации белка с участием сероводорода (H 2 S), в которой «сульфгидрильная группа реакционноспособного Cys преобразован в группу -SSH ». Подразумеваемая реакция:
Эта презентация связана с двумя научными проблемами: терминология не соответствует правилам химической номенклатуры; и подразумеваемая реакция не может произойти.
Согласно Сборнику химической терминологии ИЮПАК, 2005 г., «гидратация» означает введение молекулы воды.Следовательно, термин сульфгидратация подразумевает введение атома серы вместе с молекулой воды, что не имеет предполагаемого значения. Сульфгидрилирование, которое относится к введению сульфгидрильной (SH) группы, также не подходит, поскольку группа SH уже присутствует в белке до того, как произойдет модификация. Реакция, описываемая приведенным выше уравнением, включает введение атома серы, поэтому правильным термином для этой реакции является «сульфирование».
Реакция, описываемая этим уравнением, невозможна, потому что две группы SH не могут реагировать друг с другом таким образом.Более того, система не сбалансирована по атомам, так как не учитываются два атома водорода. Реальная реакция в этом случае:
Это настоящая реакция сульфирования, потому что ее можно рассматривать как суммирование двух реакций: реакция H 2 S с кислородом с образованием сульфановой серы; и включение сульфановой серы в SH-группу белка с помощью хорошо задокументированного механизма с участием тиосульфоксидного промежуточного соединения 2 .
Теоретически группа SH остатка Cys белка также может быть модифицирована до персульфида (SSH) за счет восстановления дисульфидной связи:
Однако, как обсуждалось ранее 2,3 , эта реакция невозможна in vivo поскольку H 2 S не обладает достаточной восстанавливающей способностью, и его концентрация in vivo слишком мала для достижения такого снижения.
Понятно, что Пол и Снайдер намеревались описать превращение сероводорода в сульфановую серу. Однако они не описали вероятный механизм, который приводится в этой переписке.
Информация об авторе
Принадлежности
Джон И. Тухи работает в Cytoregulation Research, Элгин, Онтарио, Канада. [email protected]
Джон И. Тухи
Этические декларации
Конкурирующие интересы
Автор заявляет об отсутствии конкурирующих финансовых интересов.
Об этой статье
Цитируйте эту статью
Toohey, J. Превращение H 2 S в сульфановую серу. Nat Rev Mol Cell Biol 13, 803 (2012). https://doi.org/10.1038/nrm3391-c1
Ссылка для скачивания
Сульфид — Энциклопедия Нового Света
Эта минеральная форма сульфида свинца называется галенитом.Термин сульфид (сульфид в британском английском) относится к нескольким типам химических соединений, содержащих серу с наименьшей степенью окисления -2.
Формально «сульфид» — это дианион S 2-, который существует в сильнощелочных водных растворах, образованных из H 2 S или солей щелочных металлов, таких как Li 2 S, Na 2 S и K 2 S. Сульфид является исключительно основным и, с pK a больше 14, он не существует в заметных концентрациях даже в сильно щелочной воде, поскольку не обнаруживается при pH ниже ~ 15 (8 M NaOH). Вместо этого сульфид соединяется с протонами с образованием HS —, который по-разному называют ионом сероводорода , ионом, ионом гидросульфида , ионом сульфгидрила или ионом бисульфида .При еще более низких значениях pH (ниже 7) HS — преобразуется в H 2 S, сероводород. Таким образом, точные формы серы, полученные при растворении сульфидных солей, зависят от pH конечного раствора.
Водные растворы катионов переходных металлов реагируют с источниками сульфидов (H 2 S, NaSH, Na 2 S) с осаждением твердых сульфидов. Такие неорганические сульфиды обычно имеют очень низкую растворимость в воде, и многие из них связаны с минералами. Одним из известных примеров является ярко-желтый вид CdS или «желтый кадмий».«Черный налет, образованный на стерлинговом серебре, представляет собой Ag 2 S. Такие частицы иногда называют солями. На самом деле связь в сульфидах переходных металлов является сильно ковалентной, что приводит к их полупроводниковым свойствам, которые, в свою очередь, связаны с практическое применение многих сульфидных материалов.
В органической химии «сульфид» обычно относится к связи C-S-C, хотя термин тиоэфир менее неоднозначен. Например, диметилсульфид простого тиоэфира представляет собой CH 3 -S-CH 3 .Полифениленсульфид (см. Ниже) имеет эмпирическую формулу C 6 H 4 S. Иногда термин сульфид относится к молекулам, содержащим функциональную группу -SH. Например, метилсульфид может означать CH 3 -SH. Предпочтительным дескриптором для таких SH-содержащих соединений является тиол или меркаптан, то есть метантиол или метилмеркаптан.
Путаница возникает из-за разных значений термина «дисульфид». Дисульфид молибдена состоит из отдельных сульфидных центров в ассоциации с молибденом в формальной степени окисления 4+.С другой стороны, дисульфид железа состоит из S 2 2- или S — -S — в сочетании с железом в формальной степени окисления 2+. Диметилдисульфид имеет связность CH 3 -S-S-CH 3 , тогда как сероуглерод не имеет связей S-S, будучи S = C = S.
Примеры
использует
- Сульфид кадмия (CdS) может использоваться в фотоэлементах.
- Полисульфид кальция («известковая сера») — традиционный фунгицид в садоводстве.
- Дисульфид углерода (CS 2 ) иногда используется в качестве растворителя в промышленной химии.
- Сульфид свинца (PbS) используется в инфракрасных датчиках.
- Дисульфид молибдена (MoS 2 ), минерал молибденит, используется в качестве катализатора для удаления серы из ископаемого топлива.
- Сульфид серебра (Ag 2 S) образуется на серебряных электрических контактах, работающих в атмосфере, богатой сероводородом.
- Сульфид натрия (Na 2 S) является важным промышленным химическим веществом, используемым в производстве крафт-бумаги, красок, дубления кожи, переработки сырой нефти, обработки загрязнений тяжелыми металлами и др.
- Сульфид цинка (ZnS) используется для изготовления линз и других оптических устройств в инфракрасной части спектра.
- Сульфид цинка с примесью меди используется для изготовления фотолюминесцентных лент для аварийного освещения и светящихся циферблатов часов.
- Некоторые сульфиды металлов используются в качестве пигментов в технике, хотя их использование несколько сократилось из-за их токсичности. Сульфидные пигменты включают кадмий, ртуть и мышьяк.
- Полифениленсульфид — это полимер, обычно называемый сульфаром.Его повторяющиеся звенья связаны вместе сульфидными (тиоэфирными) связями.
Естественное происхождение
Многие руды важных металлов представляют собой сульфиды. К значительным сульфидным минералам относятся:
Безопасность
Многие сульфиды металлов настолько нерастворимы, что, вероятно, не очень токсичны. Некоторые сульфиды металлов при воздействии сильной минеральной кислоты, в том числе желудочной кислоты, выделяют токсичный сероводород.
Органические сульфиды легко воспламеняются. Когда горит сульфид, пары обычно содержат токсичный газообразный диоксид серы (SO 2 ).
Сероводород, некоторые его соли и почти все органические сульфиды имеют сильный и зловонный запах, так как они выделяются при гниении биомассы. В частности, наиболее сильно пахнущими веществами являются меркаптаны.
Список литературы
- Коттон, Ф. Альберт и Джеффри Уилкинсон. 1980. Продвинутая неорганическая химия . 4-е изд. Нью-Йорк: Вили. ISBN 0471027758.
- McMurry, J. and R.C. Фэй. 2004. Химия . 4-е изд. Река Аппер Сэдл, штат Нью-Джерси: Prentice Hall.ISBN 0131402080.
См. Также
Кредиты
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников New World Encyclopedia, , так и на самоотверженных добровольцев Фонда Викимедиа.Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в энциклопедию Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Химия кислорода и серы
Химия кислорода и сера
Химия Кислород
Кислород — самый распространенный элемент на этой планете.В земная кора на 46,6% состоит из кислорода по весу, океаны — на 86%. кислород по весу, а атмосфера составляет 21% кислорода по объему. В название кислород происходит от греческого слова oxys , «кислота» и gennan , чтобы образовать или генерировать ». Таким образом, кислород буквально означает« кислота ». бывшее «. Это имя было введено Лавуазье, который заметил это соединения, богатые кислородом, такие как SO 2 и P 4 O 10 , растворяются в воде с образованием кислот.
Электронная конфигурация атома кислорода [He] 2 с 2 2 p 4 предполагает, что нейтральные атомы кислорода могут получить октет валентных электронов, разделив две пары электроны с образованием двойной связи O = O, как показано на рисунке ниже.
Согласно этой структуре Льюиса, все электроны в O 2 молекулы парные. Следовательно, соединение должно быть диамагнитным он должен отталкиваться магнитное поле.Экспериментально О 2 оказывается парамагнитным это притягивается к магнитному полю. Это можно объяснить, если предположить что есть два неспаренных электрона в * разрыхляющей связке молекулярные орбитали молекулы O 2 .
| На этой фотографии видно, что жидкость O 2 настолько сильно притягивается магнитным полем, что преодолеть разрыв между полюсами подковообразного магнита. |
При температурах ниже -183 o C, O 2 конденсируется с образованием жидкости характерного светло-голубого цвета который возникает в результате поглощения света с длиной волны 630 нм. Это поглощение не наблюдается в газовой фазе и относительно слабый даже в жидкости, потому что для этого требуется три тела сталкиваются две молекулы O 2 и фотон одновременно, что является очень редким явлением даже в жидкая фаза.
Химия Озон
Молекула O 2 — не единственная элементарная форма кислород. При наличии молнии или другого источника искра, O 2 молекул диссоциируют с образованием атомов кислорода.
| искра | |||
| O 2 ( г ) | 2 O ( г ) |
Эти атомы O могут реагировать с молекулами O 2 с образованием озон, О 3 ,
| O 2 ( г ) | + | O ( г ) | O 3 ( г ) |
, структура Льюиса которого показана на рисунке ниже.
Кислород (O 2 ) и озон (O 3 ) являются примерами из аллотропов (от греческого значения «в другой способ «). По определению, аллотропы разные формы элемента. Потому что у них разные структуры, аллотропы обладают разными химическими и физическими свойствами (см. Таблица ниже).
Свойства аллотропов кислорода
| Кислород (O 2 ) | Озон (O 3 ) | |||
| Температура плавления | -218.75 o С | -192,5 o С | ||
| Температура кипения | -182.96 или С | -110,5 o С | ||
| Плотность (при 20 o C) | 1,331 г / л | 1.998 г / л | ||
| Порядок облигаций O-O | 2 | 1,5 | ||
| Длина соединения O-O | 0,1207 нм | 0,1278 нм |
Озон — нестабильное соединение с резким резким запахом, медленно разлагается до кислорода.
| 3 O 3 ( г ) | 3 O 2 ( г ) |
При низких концентрациях озон может быть относительно приятным.(В характерный запах чистоты, связанный с летними грозами, из-за образования небольших количеств O 3 .)
Воздействие O 3 при более высоких концентрациях приводит к кашель, учащенное сердцебиение, боль в груди и общие телесная боль. При концентрациях выше 1 ppm озон токсичен.
Одним из характерных свойств озона является его способность поглощать излучение в ультрафиолетовой части спектра ( > 300 нм), тем самым обеспечивая фильтр, защищающий нас от воздействие высокоэнергетического ультрафиолетового излучения солнца.Мы сможем понять важность этого фильтра, если подумаем о что происходит, когда наша кожа поглощает солнечное излучение.
Электромагнитное излучение в инфракрасном, видимом и низкоэнергетические участки ультрафиолетового спектра (<300 нм) несет достаточно энергии, чтобы возбудить электрон в молекуле в орбиталь с более высокой энергией. Этот электрон в конечном итоге возвращается в орбитали, с которой он был возбужден, и энергия передается на окружающие ткани в виде тепла.Любой, у кого есть пострадавшие от солнечных ожогов могут оценить болезненные последствия чрезмерного количества этого излучения.
Излучение в высокоэнергетической части ультрафиолета спектр (300 нм) при поглощении оказывает другое действие. Это излучение несет достаточно энергии, чтобы ионизировать атомы или молекулы. Ионы, образующиеся в этих реакциях, имеют нечетное число электронов и чрезвычайно реактивны. Они могут вызвать постоянное повреждают клеточную ткань и вызывают процессы, которые в конечном итоге привести к раку кожи.Относительно небольшое количество этого излучения поэтому может оказывать сильное воздействие на живые ткани.
В 1974 г. Молина и Роуленд указали, что хлорфторуглероды, такие как CFCl 3 и CF 2 Cl 2 , которые использовались в качестве хладагентов и пропеллентов в аэрозолях банки начали накапливаться в атмосфере. в стратосферы, на высотах от 10 до 50 км над земной поверхность, хлорфторуглероды разлагаются с образованием атомов Cl и оксиды хлора, такие как ClO, когда они поглощают солнечный свет.Атомы Cl и молекулы ClO имеют нечетное количество электронов, как показано на рисунок ниже.
В результате эти вещества необычно реакционноспособны. в атмосфере, они реагируют с озоном или с атомами кислорода, которые необходимы для образования озона.
| Класс | + | О 3 | ClO | + | О 2 | |
| ClO | + | O | Класс | + | О 2 |
Молина и Роуленд предположили, что эти вещества могут в конечном итоге разрушить озоновый щит в стратосфере, с опасные последствия для биологических систем, которые могут быть подвергается повышенному воздействию ультрафиолетового излучения высокой энергии.
Кислород как Окислитель
Фтор — единственный элемент, который более электроотрицателен, чем кислород. В результате кислород приобретает электроны практически во всех химические реакции. Каждая молекула O 2 должна получить четыре электронов, чтобы удовлетворить октеты двух атомов кислорода без обмен электронами, как показано на рисунке ниже.
Таким образом, кислород окисляет металлы с образованием солей, в которых атомы кислорода формально присутствуют в виде ионов O 2-.Ржавчина образуется, например, когда железо реагирует с кислородом в присутствии воды с образованием соли, формально содержащей Fe 3+ и ионов O 2-, в среднем три молекулы воды координирована с каждым ионом Fe 3+ в этом твердом теле.
| H 2 O | |||||
| 4 Fe ( s ) | + | 3 O 2 ( г ) | 2 Fe 2 O 3 ( s ) 3 H 2 O |
Кислород также окисляет неметаллы, такие как углерод, с образованием ковалентные соединения, в которых кислород формально окисляется количество -2.
| С ( с ) | + | O 2 ( г ) | CO 2 ( г ) |
Кислород — прекрасный пример окислителя потому что он увеличивает степень окисления практически любого вещества с которой он реагирует. В ходе своих реакций кислород уменьшенный. Таким образом, вещества, с которыми он вступает в реакцию, уменьшают агенты .
Пероксиды
Требуется четыре электрона, чтобы восстановить молекулу O 2 до пара ионов O 2-. Если реакция прекращается после O 2 молекула получила только два электрона, O 2 2- ион, показанный на рисунке ниже.
У этого иона на два электрона больше, чем у нейтрального O 2 молекула, что означает, что атомы кислорода должны иметь только одну одна пара связывающих электронов для достижения октета валентности электроны.Ион O 2 2- называется пероксидом . ион, потому что соединения, содержащие этот ион, необычайно богаты кислород. Это не просто оксиды, это (гипер) пероксиды.
Самый простой способ приготовить перекись — провести реакцию натрия или металлический барий с кислородом.
| 2 Na ( с ) | + | O 2 ( г ) | Na 2 O 2 ( s ) | ||
| Ba ( s ) | + | O 2 ( г ) | BaO 2 ( с ) |
Когда эти пероксиды вступают в реакцию с сильной кислотой, перекись водорода (H 2 O 2 ).
| BaO 2 ( с ) | + | 2 ч + ( водн. ) | Ba 2+ ( водн. ) | + | H 2 O 2 ( водн. ) |
Структура Льюиса перекиси водорода содержит O-O одинарная связь, как показано на рисунке ниже.
Теория VSEPR предсказывает, что геометрия вокруг каждого кислорода атом в H 2 O 2 должен быть изогнут. Но это теория не может предсказать, должны ли четыре атома находиться в в той же плоскости или следует визуализировать молекулу лежащей в двух пересекающихся плоскостях. Экспериментально определенная Структура H 2 O 2 показана на рисунке ниже.
Валентный угол H-O-O в этой молекуле лишь немного больше чем угол между парой соседних 2 p атомных орбитали на атоме кислорода, а угол между плоскостями образующие молекулу немного больше тетраэдрической угол.
Степень окисления атомов кислорода в перекиси водорода равно -1. H 2 O 2 , следовательно, может действовать как окислитель и захватить еще два электрона, чтобы сформировать пару гидроксид-ионы, в которых кислород имеет степень окисления -2.
| H 2 O 2 | + | 2 e — | 2 ОН — |
Или он может действовать как восстанавливающий агент и потерять пару электронов с образованием молекулы O 2 .
| H 2 O 2 | О 2 | + | 2 ч + | + | 2 e — |
Реакции, в которых соединение одновременно подвергается обоим окисление и восстановление называются диспропорционированием реакция . Продукты диспропорционирования H 2 O 2 кислород и вода.
| 2 H 2 O 2 ( водн. ) | O 2 ( г ) | + | 2 H 2 O ( л ) |
Диспропорционирование H 2 O 2 является экзотермическая реакция.
| 2 H 2 O 2 ( водн. ) | O 2 ( г ) | + | 2 H 2 O ( л ) | H o = -94.6 кДж / моль H 2 O |
Эта реакция является относительно медленной, однако в отсутствие катализатор, например пыль или металлическая поверхность. Основные виды использования H 2 O 2 связаны с его окислительной способностью. Используется в разбавленных (3%) растворах как дезинфицирующее средство. В большем концентрированные растворы (30%), используется как отбеливающий агент для волосы, мех, кожа или древесная масса, из которой делают бумагу.В очень концентрированные растворы, H 2 O 2 было использовано в качестве ракетного топлива из-за легкости, с которой оно разлагается на дать О 2 .
Методы Подготовка O 2
Небольшие количества газа O 2 можно приготовить в количество способов.
1. Разложив разбавленный раствор перекиси водорода с помощью пыль или металлическая поверхность в качестве катализатора.
| 2 H 2 O 2 ( водн. ) | O 2 ( г ) | + | 2 H 2 O ( л ) |
2. Путем реакции перекиси водорода с сильным окислителем. агент, такой как перманганат-ион, MnO 4 —.
| 5 H 2 O 2 ( водн. ) | + | 2 MnO 4 — ( водн. ) | + | 6 часов + ( водн. ) | 2 Mn 2+ ( водн. ) | + | 5 O 2 ( г ) | + | 8 H 2 O ( л ) |
3.Путем пропускания электрического тока через воду.
| электролизный | ||||
| 2 H 2 O ( л ) | 2 H 2 ( г ) | + | O 2 ( г ) |
4.При нагревании хлората калия (KClO 3 ) в наличие катализатора до его разложения.
| MnO 2 | ||||
| 2 KClO 3 ( с ) | 2 KCl ( с ) | + | 3 O 2 ( г ) |
Химия Сера
Поскольку сера находится непосредственно под кислородом в периодической таблице, эти элементы имеют похожие электронные конфигурации.Как результат, сера образует множество соединений, являющихся аналогами кислородных соединений, как показано в таблице ниже. Примеры в этой таблице показывают, как префикс thio — может использоваться для обозначения соединений, в которых сера заменяет атом кислорода. Тиоцианат (SCN —) ион, например, является серосодержащим аналогом цианата (OCN — ) ион.
Кислородные соединения и их серные аналоги
| Кислородные соединения | Соединения серы | |
| Na 2 O (оксид натрия) | Na 2 S (сульфид натрия) | |
| H 2 O (вода) | H 2 S (сероводород) | |
| O 3 (озон) | SO 2 (диоксид серы) | |
| CO 2 (диоксид углерода) | CS 2 (сероуглерод) | |
| OCN — (цианат) | SCN — (тиоцианат) | |
| OC (NH 2 ) 2 (мочевина) | SC (NH 2 ) 2 (тиомочевина) |
Существует четыре основных различия между химическим составом сера и кислород.
1. Двойные связи O = O намного прочнее двойных связей S = S.
2. Одинарные связи S-S почти вдвое прочнее одинарных O-O. облигации.
3. Сера ( EN = 2,58) гораздо менее электроотрицательна. чем кислород ( EN = 3,44).
4. Сера может расширять свою валентную оболочку, удерживая более восьми электроны, а кислород — нет.
Эти, казалось бы, незначительные различия имеют важные последствия. для химии этих элементов.
Эффект Различия в силе связей X-X и X = X
Радиус атома серы примерно на 60% больше, чем у атома серы. атом кислорода.
В результате атомам серы труднее подойти близко достаточно вместе, чтобы образовать узы. S = S двойные связи, следовательно, намного слабее, чем двойные связи O = O.
Двойные связи между серой и атомами кислорода или углерода могут быть обнаружен в таких соединениях, как SO 2 и CS 2 (см. рисунок ниже).Но эти двойные связи намного слабее, чем эквивалентные двойные связи с атомами кислорода в O 3 или CO 2 . Энтальпия диссоциации связи для двойной связи C = S составляет 477 кДж / моль, например, тогда как энтальпия диссоциации связи для Двойная связь C = O составляет 745 кДж / моль.
Элементарный кислород состоит из молекул O 2 , в которых каждый атом завершает свой октет валентных электронов, разделяя два пары электронов с одним соседним атомом.Потому что сера не образует прочных двойных связей S = S, элементарная сера обычно состоит из циклических S 8 молекул, в которых каждый атом завершает свой октет, образуя одинарные связи с двумя соседними атомов, как показано на рисунке ниже.
S 8 молекул могут упаковываться, образуя более одной кристалл. Наиболее устойчивая форма серы состоит из орторомбической кристаллы S 8 молекул, которые часто встречаются вблизи вулканы.Если эти кристаллы нагреть до плавления и расплавленная сера затем охлаждается, аллотроп серы, состоящий из моноклинных кристаллов S 8 молекул составляет сформирован. Эти моноклинные кристаллы медленно трансформируются. в более стабильную орторомбическую структуру за период время.
Склонность элемента к образованию связей с самим собой называется цепью (от латинского catena , «цепочка»). Так как сера образует необычно прочные одинарные связи S-S, лучше при катенация, чем любой элемент, кроме углерода.В результате ромбические и моноклинные формы серы — не единственные аллотропы элемента. Также существуют аллотропы серы, которые различаются размером молекул, образующих кристалл. Циклический молекулы, содержащие 6, 7, 8, 10 и 12 атомов серы, являются известен.
Сера плавится при 119,25 o C с образованием желтой жидкости. которая менее вязкая, чем вода. Если эту жидкость нагреть до 159 o C, превращается в темно-красную жидкость, которую невозможно вылить из ее контейнер.Вязкость этой темно-красной жидкости в 2000 раз. больше, чем у расплавленной серы, потому что циклический S 8 молекулы открываются и соединяются вместе, образуя длинные цепочки из около 100 000 атомов серы.
Когда сера реагирует с активным металлом, она может образовывать сульфид-ион, S 2-.
| 16 К ( с ) | + | S 8 ( S ) | 8 К 2 S ( s ) |
Однако это не единственный продукт, который можно получить.А может быть произведено множество полисульфид-ионов с зарядом -2 которые различаются количеством атомов серы в цепи.
Эффект Различия электроотрицательностей серы и кислорода
Поскольку сера гораздо менее электроотрицательна, чем кислород, она с большей вероятностью будет образовывать соединения, в которых он имеет положительный степень окисления (см. таблицу ниже).
Общие числа окисления для серы
| Окисление Число | Примеры | |
| -2 | Na 2 S, H 2 S | |
| -1 | Na 2 S 2 , H 2 S 2 | |
| 0 | S 8 | |
| +1 | S 2 Класс 2 | |
| +2 | S 2 O 3 2- | |
| +2 1 / 2 | S 4 O 6 2- | |
| +3 | S 2 O 4 2- | |
| +4 | SF 4 , SO 2 , H 2 SO 3 , СО 3 2- | |
| +5 | S 2 O 6 2- | |
| +6 | SF 6 , SO 3 , H 2 SO 4 , СО 4 2- |
Теоретически сера может реагировать с кислородом с образованием либо SO 2 или SO 3 , чьи структуры Льюиса приведены на рисунке ниже.
| СО 2 | |
| СО 3 |
На практике сжигание соединений серы дает SO 2 , независимо от того, сжигается ли сера или ее соединение.
| S 8 ( S ) | + | 8 О 2 ( г ) | 8 SO 2 ( г ) | |||
| CS 2 ( л ) | + | 3 O 2 ( г ) | CO 2 ( г ) | + | 2 SO 2 ( г ) | |
| 3 FeS 2 ( с ) | + | 8 О 2 ( г ) | Fe 3 O 4 ( s ) | + | 6 SO 2 ( г ) |
Хотя образующийся в этих реакциях SO 2 должен реагирует с O 2 с образованием SO 3 , скорость этого реакция очень медленная.Скорость конвертации SO 2 в SO 3 можно значительно увеличить, добавив соответствующий катализатор.
| В 2 О 5 / К 2 О | ||
| 2 SO 2 ( г ) | 2 SO 3 ( г ) |
Огромное количество SO 2 производится промышленностью каждый год, а затем конвертируется в SO 3 , который можно использовать для производства серной кислоты, H 2 SO 4 .Теоретически, серную кислоту можно получить путем растворения газа SO 3 в вода.
| SO 3 ( г ) | + | H 2 O ( л ) | H 2 SO 4 ( водн. ) |
На практике это неудобно. Вместо этого SO 3 абсорбируется 98% H 2 SO 4 , где он реагирует с водой для образования дополнительного H 2 SO 4 молекулы.Затем при необходимости добавляют воду, чтобы концентрация этого раствора от 96% до 98% H 2 SO 4 по весу.
Серная кислота на сегодняшний день является наиболее важным промышленным продуктом. химический. Утверждалось даже, что существует прямая соотношение между количеством серной кислоты в стране потребляет и его уровень жизни. Более 50% ежегодно производимая серная кислота используется для производства удобрений. В остальное используется для изготовления бумаги, синтетических волокон и текстиля, инсектициды, моющие средства, кормовые добавки, красители, лекарства, антифриз, краски и эмали, линолеум, синтетический каучук, печатные краски, целлофан, фотопленка, взрывчатые вещества, автомобильные аккумуляторы и металлы, такие как магний, алюминий, железо и сталь.
Серная кислота диссоциирует в воде с образованием HSO 4 — ион, известный как гидросульфатный или бисульфатный ион.
| H 2 SO 4 ( водн. ) | H + ( водн. ) | + | HSO 4 — ( водн. ) |
10% этих ионов сульфата водорода диссоциируют с образованием SO 4 2-, или сульфат-ион.
| HSO 4 — ( водн. ) | H + ( водн. ) | + | СО 4 2- ( водн. ) |
Различные соли могут быть образованы путем замены H + ионы в серной кислоте с положительно заряженными ионами, такие как Ионы Na + или K + .
| NaHSO 4 | = | гидросульфат натрия |
| Na 2 SO 4 | = | натрия сульфат |
Двуокись серы растворяется в воде с образованием серной кислоты.
| SO 2 ( г ) | + | H 2 O ( л ) | H 2 SO 3 ( водн. ) |
Сернистая кислота не так сильно диссоциирует в воде как серную кислоту, но еще можно заменить H + ионы в H 2 SO 3 с положительными ионами с образованием соли.
| NaHSO 3 | = | гидросульфит натрия |
| Na 2 SO 3 | = | натрия сульфит |
Серная кислота и сернистая кислота являются примерами класса соединений, известных как оксикислоты , потому что они буквально кислоты, содержащие кислород. Потому что они отрицательные ионы (или анионы), содержащие кислород, SO 3 2- и ионы SO 4 2- известны как оксианионы .Льюисовские структуры некоторых оксидов серы, образующих оксикислоты или оксианионы приведены в таблице ниже.
Один из этих оксианионов заслуживает особого упоминания. Этот ион, который известен как ион тиосульфата, образуется в результате реакции между серой и ионом сульфита (SO 3 2-).
| 8 SO 3 2- ( водн. ) | + | S 8 ( S ) | 8 S 2 O 3 2- ( водн. ) | |
Эффект Различия в способности серы и кислорода расширять свои Валанс Шелл
Электронные конфигурации кислорода и серы обычно написано следующим образом.
| O | = | [He] 2 с 2 2 с 4 | |
| S | = | [Ne] 3 с 2 3 с 4 |
Хотя это обозначение показывает сходство между конфигурации двух элементов, он скрывает важную разница, которая позволяет сере расширять свою валентную оболочку, чтобы удерживать более восьми электронов.
Кислород реагирует с фтором с образованием OF 2 .
| O 2 ( г ) | + | 2 ф. 2 ( г ) | 2 ИЗ 2 ( г ) |
Реакция останавливается на этом этапе, потому что кислород может удерживать только восемь электронов в валентной оболочке, как показано на рисунке ниже.
Сера реагирует с фтором с образованием SF 4 и SF 6 , показано на рисунке ниже, потому что сера может расширять свою валентность оболочка для хранения 10 или даже 12 электронов.
| S 8 ( S ) | + | 16 F 2 ( г ) | 8 SF 4 ( г ) | |
| S 8 ( S ) | + | 24 F 2 ( г ) | 8 SF 6 ( г ) |
.