Энергетика химических реакций | Задачи 293
Задача 293.
Определить образования этилена, используя следующие данные:
Решение:
Обозначим искомую величину [ (С2Н4)] за x. Для расчета (С2Н4) используем уравнение из следствия закона Гесса:
Ответ: 52,4 кДж/моль.
Задача 294.
Сравнить реакции восстановления оксида железа (III) различными восстановителями при 298 К:
Решение:
По табличным данным стандартные энтальпии образования Fe2O3(к), Н2O(г) и СО(г) соответственно равны -822,2, -241,8, -110,5 и -393,5 кДж/моль (стандартные энтальпии образования простых веществ принято считать равными нулю). Для расчета используем уравнение из следствия закона Гесса:
Тогда

Задача 295.
Найти массу метана, при полном сгорании которой (с образованием жидкой воды) выделяется теплота, достаточная для нагревания 100 г воды от 20 до 30°С. Мольную теплоемкость воды принять равной 75,3Дж/(моль . К).
Решение:
Мольная теплоёмкость (CM) – это количество теплоты, необходимое для нагревания одного киломоля вещества на один градус. Находим количество теплоты необходимое для нагревания 100 г воды от 200С до 300С по формуле:
Табличные данные стандартных энтальпий образования СН4(г), Н2О(ж) и СО2(г) соответственно равны -74,9, -285,8 и -393,5кДж/моль. Стандартные энтальпии простых веществ принято считать равными нулю.
CH4(г) + 2О2(г) = СО2(г) + 2Н2О(ж)
Стандартную энтальпию реакции рассчитаем, используя уравнение из следствия закона Гесса:
Тогда
Теперь, учитывая, что при сгорании 1 моля метана выделяется 890,2 кДж теплоты, рассчитаем его массу, которая необходима для выделения 4,18 кДж теплоты из пропорции:
Ответ: 0,075г.
Задача 296.
Вычислить образования MgСО3(к.) при 298 К, пользуясь следующими данными:
Решение:
Обозначим искомую величину через x, запишем термохимическое уравнение образования MgCO3 из простых веществ:
Затем запишем уравнения реакций образования CO2
Из уравнений (1), (2) и (3) можно получить уравнение (4). Для этого нужно из уравнения (1) вычесть сумму уравнения (2) и ½ уравнения (3), получим:
Подставляя значения энтальпий образования веществ, находим искомую величину:
Ответ: -1113 кДж/моль.
Задача 297.
Исходя из образования Н2О(г) и следующих данных:
вычислить реакции:
FeO(к) + Н2(г) = Fe(к) + Н2О(г) (3)
Решение:
Так как оксид железа (II) при взаимодействии с оксидом углерода (II) образует железо и оксид углерода (IV), то значение можно вычислить, если из 1/2 второго уравнения вычесть первое уравнение, получим:
Тогда можно найти согласно следствию закона из Гесса:
Ответ: 23,0 кДж.
Задача по химии №472
Решение.
1. В химической реакции, протекающей по уравнению:
Fe2O3(к)+3Н2(г) = 2Fe(к) + 3Н2О (г)
Тепловой эффект реакции (∆Нх.р.), исходя из следствия закона Гесса, равен сумме теплот образования ∆Нобр. продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции.
∆Нх.р.= ∑Нобр.прод. — ∑Нобр.исх.
∆Нх.р.= (2 ∆Н°Fe(к) +3∆Н°Н2О (г)) – (∆Н° Fe2O3(к) + 3 ∆Н°Н2г)
— теплоты образования простых веществ условно приняты равными нулю;
— теплота образования Н2О (г) равна -241.83 (по табл. №5)
— теплота образования Fe2O3(к) равна -822.10 (см.табл.№5)
Исходя из указанных данных:
∆Нх.р.= 3(-241.83) – (-822.10) = -725.49 – (-822.10) = 96.61 кДж
Ответ: ∆Нх.р.= 96.61 кДж

2. Изменение энтропии продуктов химической реакции, протекающей по уравнению
Fe2O3(к)+3Н2(г) = 2Fe(к) + 3Н2О (г),
Рассчитывается по формуле:
∆Sх.р.= ∑Sпрод. — ∑Sисх.
∆Sх.р.= (2 ∆S°Fe(к) +3∆S°Н2О (г)) – (∆S° Fe2O3(к) + 3 ∆S°Н2г), где:
∆S°Fe(к)= 27.2 Дж/(моль*К)
∆S°Н2О (г))= 188.72 Дж/(моль*К)
∆S° Fe2O3(к) = 89.96 Дж/(моль*К)
∆S° O/h3(г) = 130.59 Дж/(моль*К)
(данные из табл.7)
С учетом этих данных:
∆Sх.р.= (2*27.2 +3*188.72) – (89.96+3*130.59) = 620.56-481.73 = 138.83 Дж/(моль*К)
Ответ: ∆Sх.р.= 138.83 Дж/(моль*К)
Убыль энергии Гиббса ∆G°х.р. в химической реакции
Fe2O3(к)+3Н2(г) = 2Fe(к) + 3Н2О (г)
вычисляем по формуле:
∆G°х.
 р = ∆Н° — Т*∆S°
р = ∆Н° — Т*∆S°∆G°х.р = 96.61 – 298*0.13883 = 96.61-41.37 = +55.24кДж
Ответ: ∆G°х.р = +55.24кДж
Т.к. ∆G°х.р. > 0, то реакция при стандартных условиях невозможна; при этих условиях пойдет обратная реакция — окисление железа (коррозия).
Определяем температуру, при которой ∆G°х.р.= 0
∆Н = Т*∆S, отсюда Т = ∆Н/∆S = 96.61/0.13883 = 695.9°К,
отсюда находим убыль энергии при 500°К :
∆G500 =96.61-500*0.13883 кДж = +27.19 кДж
Таким образом, ∆G при температуре 500°К составляет +27.19 кДж,
При температуре 2000°К находим ∆G2000 аналогично:
∆G2000 = 96.61 – 2000*0.13883 = 96.61 -277.66 = — 181.кДж
∆G2000 = — 181.кДж
∆G2000 <0, значит при температуре 2000°К реакция возможна.
Примечание:
Поскольку изначальная температура, при которой начинается реакция по уравнению
Fe2O3(к)+3Н2(г) = 2Fe(к) + 3Н2О (г),
из вышеприведенных расчетов равна 695. 9°К, то путем сравнения температур можно сразу определить, что при температуре 500°К реакция не пойдет, а при температуре выше 695.9, т.е. при 2000°К пойдет с получением продуктов согласно уравнению.
9°К, то путем сравнения температур можно сразу определить, что при температуре 500°К реакция не пойдет, а при температуре выше 695.9, т.е. при 2000°К пойдет с получением продуктов согласно уравнению.
Лекция 2
План
1. Основные законы термохимии.
2. Термохимические расчеты при стандартной температуре.
3. Понятие теплоёмкости и расчет тепловых эффектов химических процессов при различных температурах.
Основные законы термохимии были сформулированы до то того, как сформировалась термодинамика как наука на основе анализа калориметрических измерений. В свете I первого начала термодинамики они являются его следствием.
В конце XVIII века был сформирован закон Лапласа, который говорит о том, что тепловые эффекты образования сложного вещества и его разложения равны по величине, но противоположны по знаку.
На основе экспериментальных
данных Г. И. Гесс и 40-х годах XIX века сформулировал закон,
который получил название закон Гесса,
который звучит так:
И. Гесс и 40-х годах XIX века сформулировал закон,
который получил название закон Гесса,
который звучит так:
Тепловой эффект химической реакции, протекающий при постоянном давлении или объём, не зависит от пути реакции, а определяется только состоянием реагентов и продуктов реакции.
Этот закон фактически
является следствием I начала термодинамики (уравнение 1.5), поэтому он
является строгим законом. В термохимии различают экзотермические и эндотермические процессы. Причем экзотермические процессы
отрицательны, а эндотермические
– положительны. Для облегчения сравнения энтальпий реакций в термодинамике
вводятся понятия «стандартного
состояния». В настоящее время стандартное состояние определено следующим
образом. Стандартное состояние – это состояние чистого вещества при давлении
1бар (=105 Па) и заданной температуре. Если чистое вещество является газом, то за его
стандартное состояние при давлении 1 бар, обладающее свойствами бесконечно
разряженного газа. Если химическая реакция протекает между компонентами,
состоящими в стандартном взятии ,то изменение
энтальпии, при протекании этой реакции при температуре T обозначается ∆rHo T.
Если чистое вещество является газом, то за его
стандартное состояние при давлении 1 бар, обладающее свойствами бесконечно
разряженного газа. Если химическая реакция протекает между компонентами,
состоящими в стандартном взятии ,то изменение
энтальпии, при протекании этой реакции при температуре T обозначается ∆rHo T.
В уравнениях реакций при термохимических расчетах указываются не только формулы веществ, но и их агрегатные состояния.
Термохимические расчеты проводятся на основании следствий из закона Гесса.
Следствие. Стандартная энтальпия химической реакции
∑iνiAi=∑νjBj
Равна разности стандартных !!!!!!! образования продуктов реакций и реагентов (с учетом стехиометрических коэффициентов):
∆rHo
Для этих расчетов
экспериментальных данных определяются стандартные энтальпии образования веществ
∆fHo T.
Стандартной энтальпией образования вещества при заданной температуре называют энтальпию реакции образования одного моля этого вещества из элементов (в виде простых веществ), находящихся в наиболее устойчивом стандартном состоянии. В соответствии с этим определением энтальпии образование всех наиболее устойчивых простых веществ в стандартном состоянии равна 0 при любой температуре.
В термохимии и химической термодинамике введено понятие стандартного условия, в котором зафиксирована стандартная термохимическая температура (296,15 К) табулированы в справочниках. Следует отметить, что понятие «энтальпия образования» распространено не только на обычные вещества, но и на ионы в растворах. Так для водных растворов принято соглашение, что энтальпия образования иона водорода в бесконечно разбавленном водном растворе тождественно равна 0:
∆f Ho T(H+8p—p∞H2O)≡0
В термохимии и термодинамике
органических соединений основным экспериментальным методом определения энтальпий
образования является бомбовая калориметрия. Большинство органических соединений
могут быть качественно окислены до CO2(г) и H2O(ж), поэтому для расчета тепловых
эффектов органических реакций можно исходить из энтальпий сгорания.
Большинство органических соединений
могут быть качественно окислены до CO2(г) и H2O(ж), поэтому для расчета тепловых
эффектов органических реакций можно исходить из энтальпий сгорания.
Для расчетов на основании энтальпий сгорания можно воспользоваться следующим следствием из закона Гесса.
Следствие 2Стандартная энтальпия реакции ∑iνiAi=∑νjBj равна разности энтальпий сгорания реагентов и продуктов реакции(с учетом стереохимических коэффициентов):
∆rHo=∑iνi∆c Ho T(Hi)- ∑jνj∆cHo T(Bj)
Однако следует отметить, что это следствие в
настоящее время практически не применяется. Энтальпии сгорания, как правило,
пересчитываются, и приводится значение энтальпий образования. Этот пересчет легко
осуществить. Действительно, энтальпия сгорания вещества с брутто-формулой СaHbOcNd соответствует тепловому
эффекту процесса:
Энтальпии сгорания, как правило,
пересчитываются, и приводится значение энтальпий образования. Этот пересчет легко
осуществить. Действительно, энтальпия сгорания вещества с брутто-формулой СaHbOcNd соответствует тепловому
эффекту процесса:
СaHbOcNd +(a+b/4-c)O2=aCO2(г)+b/2H2O(ж)+d/2N2(г)
Совершено, очевидно, что:
∆cHo(СaHbOcNd)+ ∆f Ho(СaHbOcNd)= a∆f Ho(СO2)+b/2∆f Ho(H2O(ж))
При расчете тепловых эффектов
процессов в газовой среде и отсутствии экспериментальных данных по
энтальпиям образования энтальпии
химических реакций определяются как разности энергий разрываемых химических
связей и вновь образующихся. Это еще одно из следствий
из закона Гесса..
Это еще одно из следствий
из закона Гесса..
Понятие теплоемкости
Если к системе, находящейся при температуре T1подвести энергию в форме теплоты, то она нагреется и приобретет температуру T2 ,Количество теплоты, которое необходимо затратить при нагревании системы на 1К называется теплоемкостью:
Cx=Qx:(T2-T1)
По уравнению находится средняя теплоемкость в интервале температур T2 и T1. Поскольку Q не является функцией состояния то, очевидно, и теплоемкость тоже не является функцией состояния системы, а зависит от пути процесса. Теплоемкость является сложной функцией температуры, поэтому она определяется как предел уравнения при убывании интервала T2—T1:
Qx δQx (2-3)
Cx=limT2-T1→0 T2-T1 = dT
При нагревании системы при постоянном объеме, если система не производит никакой работы δQv = dU, поэтому:
δH (2-4)
Cv = (δT)v
Если единственным видом работы, которую производит система, является работа расширения, то δQp = dH:
δH (2-4)
Cp = (δT)p
Если U и H отнести к 1 молю чистого
вещества, то по уравнения (2-3) и (2-4) получаем мольные теплоемкости.
Зависимость тепловых эффектов от температуры.
Уравнение Кирхгофа.
Согласно закону Гесса можно вычислить тепловой эффект реакции при той температуре, при которой известны энтальпии образования (обычно 298.15 К). В термодинамических расчетах важно знать тепловой эффект при температуре, при которой проводится сам процесс.
Запишем вновь уравнение реакции:
∑iνiAi=∑νjBj
Обозначим Hi и Hj – энтальпии i-го реагента и j-го продукта, отнесенную к 1 молю вещества. Общее применение энтальпии при температуре T в этом случае можно записать:
∆rHo(T) =∑νjBj -∑iνiAi (2-5)
Если уравнение (2-5) продифференцировать по температуре при p=const, то получим:
∂ ∂Hj ∂Hi
∂T [∆rHo(T)]p=∑j νj(∂T)p -∑i νi(∂T)p
Или
∂
∂T [∆rHo(T)]p=∑νjCpj -∑iνiCpi (2-6)
Выражение ∑νjCpj -∑iνiCpi принято
записывать в виде ∆Cp. Следует также ожидать, что изменение давления слабо
влияет на тепловой эффект, поэтому частную производную можно заменить полной:
Следует также ожидать, что изменение давления слабо
влияет на тепловой эффект, поэтому частную производную можно заменить полной:
d
dT [∆rHo(T)] = ∆Cp (2-7’)
Аналогично, для процессов, протекающих при постоянном объеме можно получить выражение:
d
dT [∆rHo(T)] = ∆Cv (2-7’)
Уравнения (2-7) и (2-7’) впервые были получены Кирхгофом. Исходя из этих уравнений, можно рассчитать тепловой эффект при любой температуре, проинтегрировав их. так из (2-7) следует:
∆rHo(T) T2
∫ [∆rHo(T)] = ∫ ∆CpdT
∆rHo(T1) T1
Или
T2
∆rHo(T) = ∆rHo(T1) +∫ ∆CpdT (2-8)
T1, где T1 298,15 К.
В соответствии с уравнением (2-8) можно рассчитать ∆rHo(T) , если имеются данные для Cp. Наиболее простой путь расчета основан на данных средних теплоемкостей.В этом случае ∆Cp=const,а уравнение (2-8) можно записать.
∆Ho(T) =∆rHo(T) (298.15 K)+ ∆Cp(T—298.15 K) (2-8’)
Более точно значение можно получить исходя из температурных зависимостей теплоемкости от температуры приводится в виде степенных рядов вида:
Cp=a+bT+C’T-2
Cp=a+bT+CT2 (2-9)
где a,b,c,c’ – эмпирические константы.
Очевидно, что: ∆Cp =∆a+∆bT+∆C’T-2+∆CT2 (2-9’)
После интегрирования (2-8), подставив (2-9’), получаем выражение зависимости теплового эффекта от температуры:
∆rHo(T) = ∆rHo(298) +∆a(T-298)+ ∆b/2(T2-2982)-
— ∆C’(1/T-1/298)+ ∆c/3(T3-2983) (2-8’’)
Вычисление по уравнению (2-8’’) довольно громоздко,
поэтому в современных справочниках широко представлены
высокотемпературные оставляющие [Ho(T)— Ho(298)] веществ. По сути это
изменения энтальпии вещества при нагревании его от 298.15К
до T.
По сути это
изменения энтальпии вещества при нагревании его от 298.15К
до T.
T
[Ho(T)- Ho(298)]= ∫CpdT (2-10)
298
Выражение для расчета ∆rHo(T)=f(T) на основе высокотемпературных составляющих легко получить путем простых преобразований:
∆rHo(T) = ∆rHo(298) + [∆r Ho(T)— ∆r Ho(298)] = ∆rHo(298) +
+∆r[Ho(T)— Ho(298)] (2-11)
Первое слагаемое в уравнении (2-11) может рассчитано по закону Гесса, а второе слагаемое, очевидно определяется из соотношения:
∆r[Ho(T)- Ho(298)] =∑j νj[Ho(T)- Ho(298)]j -∑i νi[Ho(T)- Ho(298)]i
Возобновляется запись на вакцинацию от COVID-19 для сотрудников и студентов на территории университета С целью предотвращения распространения коронавирусной инфекции и согласно методическим рекомендациям Минобрнауки России в НГАСУ (Сибстрин) продолжает работать мобильный пункт вакцинации от COVID-19 для сотрудников и студентов университета. Услуга доступна гражданам РФ.
Всем желающим пройти вакцинацию необходимо заполнить форму регистрации:
После заполнения формы в течение нескольких дней с вами свяжутся по телефону, указанному в заявке, и сообщат о дате и времени вакцинации.
Вакцинироваться от COVID-19 можно будет на территории НГАСУ (Сибстрин) в медицинском пункте университета (здание общежития №1) вакцинами Гам-Ковид-Вак (Спутник V) либо Спутник Лайт.
Дополнительная информация по тел. (383) 266 09 74 Услуга доступна гражданам РФ.
Всем желающим пройти вакцинацию необходимо заполнить форму регистрации:
После заполнения формы в течение нескольких дней с вами свяжутся по телефону, указанному в заявке, и сообщат о дате и времени вакцинации.
Вакцинироваться от COVID-19 можно будет на территории НГАСУ (Сибстрин) в медицинском пункте университета (здание общежития №1) вакцинами Гам-Ковид-Вак (Спутник V) либо Спутник Лайт.
Дополнительная информация по тел. (383) 266 09 74 |
31 января институт строительства совместно с РАНОЦ проведут семинар «Научные направления кафедры Строительной механики» 31 января 2022 года (понедельник) в НГАСУ (Сибстрин) состоится заседание открытого научного семинара института строительства и Регионального академического научно-образовательного центра РААСН (РАНОЦ). Приглашаем всех заинтересованных в развитии научного пространства университета! Повестка семинара: «Научные направления кафедры строительной механики». В обзорном докладе будут представлены научные направления, в рамках которых ведут исследования сотрудники кафедры Строительной механики НГАСУ (Сибстрин).
Докладчики: к.т.н., доц. Адегова Л.А., ст. преп. Вешкин М.С., к.т.н., проф. Себешев В.Г., д.т.н., проф. Лихачёв А.В., к.т.н., доц. Табанюхова М.В.
Научный семинар может быть полезен настоящим и будущим магистрантам и аспирантам, а также ученым, ведущим изыскания в рамках механики деформируемого твёрдого тела.
Семинар начнется в 14.10
Место проведения: ауд. 416 В обзорном докладе будут представлены научные направления, в рамках которых ведут исследования сотрудники кафедры Строительной механики НГАСУ (Сибстрин).
Докладчики: к.т.н., доц. Адегова Л.А., ст. преп. Вешкин М.С., к.т.н., проф. Себешев В.Г., д.т.н., проф. Лихачёв А.В., к.т.н., доц. Табанюхова М.В.
Научный семинар может быть полезен настоящим и будущим магистрантам и аспирантам, а также ученым, ведущим изыскания в рамках механики деформируемого твёрдого тела.
Семинар начнется в 14.10
Место проведения: ауд. 416 |
Онлайн-квиз ко Дню студента от ОСО НГАСУ (Сибстрин) Сегодня одна из самых замечательных дат — Татьянин день, праздник российского студенчества. Мы чествуем всех, не делая различий между физиками и лириками, будущими военными и врачами, учителями и инженерами. Кто был студентом, тот сполна ощутил счастье беззаботной юности. Нет в жизни более яркой и неповторимой поры, чем студенчество. Новые знания, новые друзья, новые мечты — все это навсегда останется с вами, в ваших душах и сердцах. Где бы вы потом ни жили, чем бы ни занимались, вы будете вспоминать и необыкновенное везение, когда удалось сдать зачёт преподавателю, которого увидел первый раз, и научный азарт, позволивший сделать важное открытие при написании простой курсовой. Цените это замечательное время, любите его, наслаждайтесь им! Приглашаем вас принять участие в СМЕШНОМ, ИНТЕРЕСНОМ И ПРАЗДНИЧНОМ квизе!
Правила КВИЗА: нужно правильно ответить на все вопросы и быть внимательным, потому что ответ не всегда очевиден
Пройти тест можно только сегодня и до 23:59:00 по Новосибирскому времени, поэтому поспешите! Нет в жизни более яркой и неповторимой поры, чем студенчество. Новые знания, новые друзья, новые мечты — все это навсегда останется с вами, в ваших душах и сердцах. Где бы вы потом ни жили, чем бы ни занимались, вы будете вспоминать и необыкновенное везение, когда удалось сдать зачёт преподавателю, которого увидел первый раз, и научный азарт, позволивший сделать важное открытие при написании простой курсовой. Цените это замечательное время, любите его, наслаждайтесь им! Приглашаем вас принять участие в СМЕШНОМ, ИНТЕРЕСНОМ И ПРАЗДНИЧНОМ квизе!
Правила КВИЗА: нужно правильно ответить на все вопросы и быть внимательным, потому что ответ не всегда очевиден
Пройти тест можно только сегодня и до 23:59:00 по Новосибирскому времени, поэтому поспешите! |
| 1. Термохимия – это: | |
| а) раздел химии, изучающий тепловые эффекты химических реакций и фазовых превращений | б) раздел химии, изучающий кинетические закономерности реакции |
| в) раздел химии, изучающий таутомерные и изомерные превращения органических соединений | г) раздел химии, изучающий неорганические кристаллы |
2. Величина,
характеризующая состояние термодинамического (теплового) равновесия
макроскопической системы, – это: Величина,
характеризующая состояние термодинамического (теплового) равновесия
макроскопической системы, – это: | |
| б) температура | |
| г) концентрация | |
| 3. Тепловой эффект реакции окисления кислородом элементов, входящих в состав вещества, до образования высших оксидов называется: | |
| а) теплотой сгорания этого вещества; | б) теплотой возгонки этого вещества |
| в) теплотой адсорбции этого вещества | г) теплотой десорбции этого вещества |
| 4. Согласно правилу Вант-Гоффа при повышении температуры на 10 К скорость многих реакций: | |
| а) увеличивается в 2–4 раза; | б) увеличивается в 5–10 раз |
| в) уменьшается в 2–4 раза; | г) уменьшается в 5–10 раз |
5. Выберите верное
утверждение: Выберите верное
утверждение: | |
| а) адсорбция – экзотермический процесс; | б) адсорбция увеличивается с увеличением температуры |
| в) адсорбция уменьшается с увеличением концентрации адсорбирующихся веществ | г) адсорбция – эндотермический процесс |
| 6. Выберите верное утверждение: | |
| а) частицы, энергия которых ниже энергии активации, называют активными; | б) с увеличением энергии активации уменьшается доля активных молекул |
| в) с увеличением энергии активации увеличивается скорость реакции | г) все вышеперечисленные утверждения верны |
| 7. Полная энергия системы определяется: | |
| а) запасом ее внутренней энергии; | б) запасом ее потенциальной энергии |
| в) запасом произведения внутренней, кинетической и потенциальной энергий | г) запасом ее кинетической энергии |
8. Сумма коэффициентов
продуктов реакции йодоводородной кислоты с хромовой кислотой равна: Сумма коэффициентов
продуктов реакции йодоводородной кислоты с хромовой кислотой равна: | |
| 9. При взаимодействии хлорида аммония и амида калия исходные реагенты выступают соответственно в таком качестве: | |
| а) оба – кислоты; | б) основания и кислоты |
| в) кислоты и основания | г) оба – основания |
| 10. Если поршень закреплен неподвижно (при постоянном объеме), то сообщенная системе теплота полностью идет на: | |
| а) увеличение запаса внутренней энергии; | б) уменьшение запаса внутренней энергии |
| в) уменьшение запаса кинетической энергии | г) уменьшение запаса потенциальной энергии |
Тепловые эффекты химических реакций — Энциклопедия по машиностроению XXL
Полученное линейное уравнение позволяет произвести качественную оценку влияния теплового эффекта химической реакции на температурное состояние исследуемой системы. [c.67]
[c.67]Тепловые эффекты химических реакций изменяются с изменением температуры. Закон изменения теплового эффекта в зависимости от температуры определяется уравнением [c.298]
Изменение теплового эффекта химической реакции с изменением температуры может быть определено по формуле (301) [c.308]
Тепловой эффект химической реакции Q — энергия, вьщеляемая или поглощаемая в ходе реакции. [c.215]
Размерность и единица теплового эффекта химической реакции [c.215]
Изменение внутренней энергии Ux — lJi равно тепловому эффекту химической реакции в элементе (если бы элемент не производил работу) Uj—Ui —qe —тепловой эффект, отнесенный к прошедшему заряду), так что Qi=ei-qe. При адиабатной работе 2—3 э. д. с. элемента уменьшится на dS% изменится и температура. Пропуская потом ток через элемент от внешнего источника, завершим этот цикл Карно. Работа за цикл равна площади цикла edS, поэтому
[c.337]
Работа за цикл равна площади цикла edS, поэтому
[c.337]
В 1748 г. М. В. Ломоносов в письме к Эйлеру, высказывая мысль о законе сохранения вещества и распространения его на движение материи, писал Тело, которое своим толчком возбуждает другое тело к движению, столько же теряет от своего движения, сколько сообщает другому . В 1755 г. Французская Академия наук раз и навсегда объявила, что не будет больше принимать каких-либо проектов вечного двигателя. В 1840 г. Г. Г. Гесс сформулировал закон о независимости теплового эффекта химических реакций от промежуточных реакций. В 1842—1850 гг. многие исследователи (Майер, Джоуль и др.) пришли к открытию принципа эквивалентности теплоты и работы. [c.30]
Калориметрическим путем можно определить количество теплоты, полученное (отданное) телом, тепловые эффекты химических реакций, эффекта реакций горения топлив, тепловые эффекты фазовых переходов и т. д. [c.30]
ТЕПЛОВЫЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ
[c. 217]
217]
Полная теплоемкость, учитывающая тепловые эффекты химических, реакций, определяется из соотношения [c.234]
Для развития теории металлургических процессов многое сделал русский акад. Г. И. Гесс (1802—1850). Им установлены важнейшие законы термохимии, в частности весьма важный для объяснения металлургических процессов (закон Гесса), согласно которому тепловой эффект химических реакций не зависит от промежуточных стадий, а определяется лишь начальным и конечным состояниями системы. [c.40]
Приведенная выше измерительная компенсационная схема переменного тока используется в целом ряде советских моделей газоанализаторов, в частности в термомагнитных газоанализаторах и в газоанализаторах, основанных на измерении теплового эффекта химических реакций. [c.369]
Уменьшение внутренней энергии 1 — Uj называется тепловым эффектом химической реакции. Тепловой эффект реакции слагается из выделенной при реакции теплоты и внешней работы. При обратимых процессах получается максимальная работа, и реакция сопровождается минимальным выделением тепла
[c.174]
При обратимых процессах получается максимальная работа, и реакция сопровождается минимальным выделением тепла
[c.174]
Закон Гесса. Тепловой эффект химической реакции при постоянном давлении остается постоянным независимо от того, протекает ли реакция в одну стадию или в несколько последовательных стадий. При помощи закона Гесса можно рассчитывать тепловые эффекты реакций в тех случаях, когда их нельзя измерять непосредственно. [c.366]
Хотя в принципе можно говорить о разности энтальпий различных веществ при температуре О К применительно, например, к анализу тепловых эффектов химических реакций, протекающих при температуре абсолютного нуля. [c.162]
Из закона Гесса следует, что тепловой эффект химической реакции при постоянном объеме V или давлении Р зависит лишь от начального и конечного состояния вещества и не зависит от того пути, по которому систему переводят из одного состояния в другое. Этот закон был открыт. Гессом раньше, чем было получено уравнение первого закона термодинамики. Закон Гесса получается, как частный случай, из первого закона термодинамики. Количественное выражение первого закона термодинамики по (4,4) имеет вид
[c.44]
Гессом раньше, чем было получено уравнение первого закона термодинамики. Закон Гесса получается, как частный случай, из первого закона термодинамики. Количественное выражение первого закона термодинамики по (4,4) имеет вид
[c.44]
Экспериментальные данные по тепловым эффектам химических реакций обычно приводятся к стандартным условиям—давлению 760 мм рт. ст. и температуре 25 °С. Зная стандартный тепловой эффект реакции Qo. значение его при любой другой температуре t может быть найдено по формуле [c.268]
Тепловые эффекты химических реакции и. химическое равновесие. . 259 Литература…………….,261 [c.176]
ТЕПЛОВЫЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИИ [c.259]
ТЕПЛОВЫЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ И ХИМИЧЕСКОЕ РАВНОВЕСИЕ [c.259]
С учетом приведенных представлений о тепловых эффектах химической реакции — для случая, когда под процессом подразумевается химическая реакция и состояния начала (индекс /) и конца процесса (индекс 2) соответствуют состояниям системы до реакции и после реакции — уравнения (11-22) и (11-23) могут быть представлены в следующем виде
[c. 226]
226]
Это важное уравнение, связывающее между собой величины теплового эффекта химической реакции, протекающей в гальваническом элементе, и э. д. с. этого элемента, называется уравне-. наем Гельмгольца. Из сравнения этого уравнения с (11-32) [с учетом при этом (11-33)] очевидно, что уравнение Гельмгольца для гальванического элемента является частным случаем уравнения Гиббса—Гельмгольца (11-32). [c.228]
Уравнение Гельмгольца позволяет решить важную задачу измерения величины теплового эффекта химической реакции без использования калориметрических методов. Если рассматриваемая химическая реакция может быть использована для создания гальванического элемента, то, измерив э. д. с. этого элемента S в функции температуры (при неизменном атмосферном давлении), можно по этим данньШ с помощью уравнения (11-48) вычислить величину теплового эффекта реакции Qp. Поскольку в процессе измерений величины э. д. с. используются прецизионные потенциометрические методы, то точность этих измерений весьма высока. Результаты расчета величины Qp по уравнению (11-48) хорошо согласуются с прямыми измерениями Qp в трудоемких термохимических экспериментах, выполняемых калориметрическими методами.
[c.229]
Результаты расчета величины Qp по уравнению (11-48) хорошо согласуются с прямыми измерениями Qp в трудоемких термохимических экспериментах, выполняемых калориметрическими методами.
[c.229]
Суммарный тепловой эффект экзотермических и эндотермических реакций определяется по количеству образующихся веществ, которое принимается по материальному балансу процесса и удельным значениям теплового эффекта реакции для каждого вещества. Данные по тепловым эффектам химических реакций приведены в разд. [c.691]
Термохимический метод. Метод позволяет измерять тепловой эффект химической реакции, протекающей на поверхности нагревателя из каталитически активного материала. [c.87]
Существуют два подхода к расчету КПД топливного элемента. По одному из них под КПД понимают отношение максимальной работы, полученной в ТЭ, к подведенной к нему энергии, т е. к тепловому эффекту химической реакции. Такой КПД называют термическим
[c. 531]
531]
Тепловой эффект химической реакции (образования, растворения, горения, фазовых превращений и т. д.) джоуль J Дж [c.89]
Пользуясь уравнением первого начала термодинамики, установить прави.ю Гесса тепловой эффект химической реакции, протекающей или при постоянном объеме К, или при постояппол) давлении р, не зависит оуп промежуточ- [c.46]
Формула (9.18) отражает одну из основных особенностей теплообмена химически реагирующей газовой смеси в явном виде. Из формулы видно, что теплота, переданная в процессе теплоотдачи, определяется разностью полных энтальпий, от вывод можно истолковать следующим образом. Если частица инертного теплоносителя с температурой Tf достигла стенки с температурой то переданная стенке теплота определяется разностью энтальпий, которая пропорциональна разности температур. В химически реагирующем газе изменение температуры частицы означает не только измененне ее энтальпии.
 Из-за изменения условии химического равновесия в частице произойдут химические реакции с поглощением или выделением теплоты. Переданная частицей теплота определится изменением ее энтальпии и тепловым эффектом химической реакции, т. е, изменением полной энтальпии.
[c.364]
Из-за изменения условии химического равновесия в частице произойдут химические реакции с поглощением или выделением теплоты. Переданная частицей теплота определится изменением ее энтальпии и тепловым эффектом химической реакции, т. е, изменением полной энтальпии.
[c.364]Открытие первого, второго и третьего начал термодинамики. Основателями первого начала термэдинамиин счигакэтся Майер, Джоуль, Гельмгольц, а само открытие первого начала термодинамики относится к 40-м годам XIX в. Однако еще задолго до этого Ломоносов, исходя из своих изысканий по теории теплоты и горения, сформулировал объединенный закон сохранения материи и движения, из которого вытекал закон сохранения энергии. Важную роль сыграли также терм Jxкмичe киe исследования Гесса и открытый им закон независимости суммарного теплового эффекта химической реакции от пути и последовательности осуществления составляющих реакций. Об этих исследованиях Планк позже писал, что убеждающая справедливость этого положения происходит вне сомнения от идеи, что теплота не мо жет быть получена из ничего. [c.153]
[c.153]
В 1840 г. русский ученый Г. И. Гесс сформулировал закон о независимости теплового эффекта химических реакций от промежуточных или от последовательности этих реакций. Это означает, что алгебраическая сумма тепловых эффектов некоторого ряда последовательных химических реакций равна сумме тепловых эффектов любого другого ряда химических реакций, если начальные и конечные состояния системы одинаковы в условиях равенства их термодинамических путей процесса (р = 1с1ет либо ц = 1с1ет). [c.30]
Тепловым эффектом химической реакции называют гумму теплоты, поглощенной системой, и всех видов работь над ней, кроме работы внешнего давления, причем вeли ины отнесены к одинаковой температуре начального и конечного состояний системы. [c.66]
Сравнивая формулу (2.195) и аналитическое решение уравнения теплопро-ВОДНОС1И (2.200), можно сделать заключение, что выражение в скобках (2.200) отражает влияние слагаемого в (2. 193). Значение величины существенно только при расчете кинетики тепловыделений, но может не учитываться при расчете теплового эффекта реакции. В самом деле, тепловой эффект химической реакции может быть рассчитан интегрированием по формуле
[c.111]
193). Значение величины существенно только при расчете кинетики тепловыделений, но может не учитываться при расчете теплового эффекта реакции. В самом деле, тепловой эффект химической реакции может быть рассчитан интегрированием по формуле
[c.111]
Энергия активации Е — наименьщая энергия (для газовых смесей 85 — 170 МДж/кмоль), которой должны обладать молеку.ты в момент столкновения, чтобы быть способными к химическому взаимодействию. Разность энергий активации прямой и обратной реакции составляет тепловой эффект химической реакции. [c.144]
Это значение бьшо притшто как не подлежащее дальнейшему уточнению, как бы ни уточнялись калориметрические измерения. Определяемая этим соотношением калория получила название международной, в отли ше от термохимической, использовавшейся при определении теплового эффекта химических реакций 1 кал (термо-хим.) = 4,1840 Дж. [c.150]
На ряде примеров Л. В. Писаржевский показал, что растворитель может влиять не только на величину константы равновесия, но и на знак теплового эффекта химической реакции, т. е. в различных растворителях реакция может изменять направление.
[c.174]
е. в различных растворителях реакция может изменять направление.
[c.174]
Методы расчета констант скоростей (Кдп, Кги) и равновесия Ксь Ксп) замороженных теплоемкостей компонентов (срь), тепловых эффектов химических реакций (С2р1, (Зрп), а также параметров, учитывающих отклонение термодинамических свойств от идеального газового состояния АН, уи, 1см), для рассматриваемого теплоносителя изложены в справочнике [4.2]. [c.122]
Тепло — Эквивалент механический 51 Теплваое излучение 182, 227 Тепловое расширение 15 Тепловой пограничный слой 682 Тепловой поток 183 Тепловой эквивалент работы 51 Тепловой эффект химических реакций 174 [c.732]
V — onst или Р = onst величины SQy и bQp являются полными дифференциалами, что и утверждает закон Гесса. Закон Гесса широко используется при термохимических расчетах. Он позволяет определять тепловые эффекты реакций вычислительным путем. Тепловые эффекты химической реакции зависят от температуры, при которой протекает реакция. Поэтому табличные данные для тепловых эффектов и других термодинамических функций принято относить к температуре 25° С. Специальные стандартные таблицы позволяют легко подсчитать тепловой эффект химической реакции, если известны теплоты образования всех участвующих в ней веществ.
[c.45]
Поэтому табличные данные для тепловых эффектов и других термодинамических функций принято относить к температуре 25° С. Специальные стандартные таблицы позволяют легко подсчитать тепловой эффект химической реакции, если известны теплоты образования всех участвующих в ней веществ.
[c.45]
Величина (Змакс называется тепловым эффектом химической реакции. Таким образом, под тепловым эффектом химической реакции понимается количество тепла, выделяющегося или поглощаемого в условиях, когда обеспечено, с о-п ервых, постоянство температуры реагирующей системы и, во-вторых, отсутствие полезной работы. Тепловые эффекты экзотермических реакций положительны, а эндотермических — отрицательны. [c.262]
особенности расчета, уравнение Кирхгофа в термодинамике
Что такое тепловой эффект химической реакции
В процессе химических реакций может выделяться или поглощаться тепло.
ОпределениеЭкзотермическими реакциями называют процессы, в результате которых выделяется теплота, обозначаемая параметром «+».
Эндотермическими реакциями являются нормальные процессы, сопровождающиеся поглощением теплоты. В этом случае теплота Q обозначается со знаком «-».
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
ОпределениеТепловым эффектом химической реакции называют изменение внутренней энергии системы, что является результатом химической реакции и трансформации исходных веществ или реагентов в продукты реакции в количествах, которые соответствуют формуле химической реакции.
Химические реакции сопровождаются некоторыми численными закономерностями. С их помощью можно определить знак, которому соответствует тепловой эффект. К данным закономерностям относят:
- Экзотермические реакции, протекающие самопроизвольно, запускаются с помощью инициации, включая нагрев и другие действия. Примером таких процессов является произвольное горение угля после поджига: \(C+O_{2} = CO_{2} + Q\)
- Устойчивые вещества образуются из простых веществ в результате экзотермических реакций, а реакции разложения обычно являются эндотермическими.
 Примером является распад нитрата калия, сопровождающийся поглощением тепла: \(2KNO_{3}\rightarrow 2KNO_{2} + O_{2}-Q\)
Примером является распад нитрата калия, сопровождающийся поглощением тепла: \(2KNO_{3}\rightarrow 2KNO_{2} + O_{2}-Q\) - Более устойчивые вещества образуются из менее устойчивых, как правило, в процессе экзотермических реакций. Справедливо и обратное утверждение: более устойчивые вещества образуются из менее устойчивых, тепло при этом поглощается. Устойчивость определяют приблизительно, исходя из активности и стабильности вещества в обычных условиях. В привычном мире нас окружают в большинстве своем относительно устойчивые вещества. В качестве примера можно рассмотреть процесс горения аммиака, при котором активные неустойчивые вещества взаимодействуют между собой, что сопровождается образованием устойчивых веществ, а именно, азота и воды. Экзотермическая реакция будет записана в таком виде: \(4NH_{2} + 3O_{2} \rightarrow 2N_{2} + 6H_{2}O + Q\)
Обозначить количество теплоты можно буквой Q. Величина измеряется в кДж (килоджоули) или Дж (джоули). Теплота, которая выделяется во время реакции, пропорциональна количеству вещества, с помощью которого запущена реакция. {0}_{f}}_{r}\)
{0}_{f}}_{r}\)
Термохимические эффекты включают в химические реакции.
ОпределениеТермохимическими уравнениями являются химическими уравнениями с указанием количества теплоты, которая выделилась или была поглощена.
Если реакция сопровождается выделением теплоты во внешнюю среду, и тепловой эффект характеризуется отрицательным значением, то такая реакция относится к экзотермическому типу. При наблюдении положительного теплового эффекта и поглощения тепла реакции называют эндотермическими. Тепловой эффект, как правило, относится к одному молю прореагировавшего исходного вещества с максимальным стехиометрическим коэффициентом.
При известных мольных теплоемкостях веществ, которые участвуют в реакции, можно определить, какова температурная зависимость энтальпии реакции. Если температура от Т1 до Т2 увеличивается, то изменение энтальпии реакции необходимо рассчитывать, согласно закону Кирхгофа. {2}{\Delta C_{p}(T_{\varphi },T_{2})d(T)}\)
{2}{\Delta C_{p}(T_{\varphi },T_{2})d(T)}\)
где \(\Delta C_{p}(T_{1},T_{\varphi })\) является изменением теплоемкости в температурном интервале от Т1 до фазового перехода, \(\Delta C_{p}(T_{\varphi },T_{2})\) представляет изменение теплоемкости в температурном интервале от фазового перехода до конечных показателей, \(T_{\varphi }\) является температурой фазового перехода.
Закон Кирхгофа для теплового эффекта, уравнение
ОпределениеЗакон Кирхгофа: температурный коэффициент теплового эффекта химической реакции определен изменением теплоемкостью системы в процессе реакции.
С помощью уравнения Кирхгофа, которое вытекает из вышеизложенной закономерности, выполняют расчет теплового эффекта при разных температурных показателях. В дифференциальной форме закон записан таким образом:
\(\left(\frac{d(\Delta _{r}H)}{dT} \right)_{p}=\Delta _{r}C_{p}\)
\(\left(\frac{d(\Delta _{r}U)}{dT} \right)_{V}=\Delta _{r}C_{V}\)
В форме интеграла закон Кирхгофа обладает следующим видом:
\(\Delta _{r}H_{T_{2}}=\Delta H_{T_{1}}+\int_{T_{1}}^{T_{2}}{\Delta _{r}C_{p}(T)dT}\)
\(\Delta _{r}U_{T_{2}}=\Delta U_{T_{1}}+\int_{T_{1}}^{T_{2}}{\Delta _{r}C_{V}(T)dT}\)
где \(C_{p}\) и \(C_{V}\) являются изобарной и изохорной теплоемкостью; \(\Delta _{r}C_{V}\) представляет собой разницу изохорных теплоемкостей продуктов реакции и исходных веществ; \(\Delta _{r}C_{p}\) — разность изобарных теплоёмкостей продуктов реакции и исходных веществ; соответствующими тепловыми эффектами являются \(\Delta _{r}H\) и \(\Delta _{r}U. \)
\)
Если разность Т2-Т1 не отличается большими значениями, то \(\Delta _{r}C_{p}=const\) и \(\Delta _{r}C_{V}=const\)
В этом случае интегральная форма уравнения будет записана в таком виде:
\(\Delta _{r}H_{T_{2}}=\Delta H_{T_{1}}+\Delta _{r}C_{p}(T_{2}-T_{1})\)
\(\Delta _{r}U_{T_{2}}=\Delta U_{T_{1}}+\Delta _{r}C_{V}(T_{2}-T_{1})\)
Если разница между температурами достаточно большая, то требуется учитывать такие температурные зависимости теплоемкостей:
\(\Delta _{r}C_{p}=f(T)\)
\(\Delta _{r}C_{V}=f(T)\)
Термохимическое уравнение, как делать расчеты
При решении задач по термохимии использую термохимические уравнения. В данных формулах записывают реакции с количеством тепла, которое выделилось в процессе реакции на число моль вещества в соответствии с коэффициентами в уравнении.
В качестве примера можно рассмотреть термохимическое уравнение, соответствующее процессу сгорания водорода:
\(2H_{2}+O_{2}=2H_{2}O+ 484\) кДж,
Данная формула демонстрирует высвобождение 484 кДж тепла в процессе сгорания 2 моль водорода, 1 моль кислорода.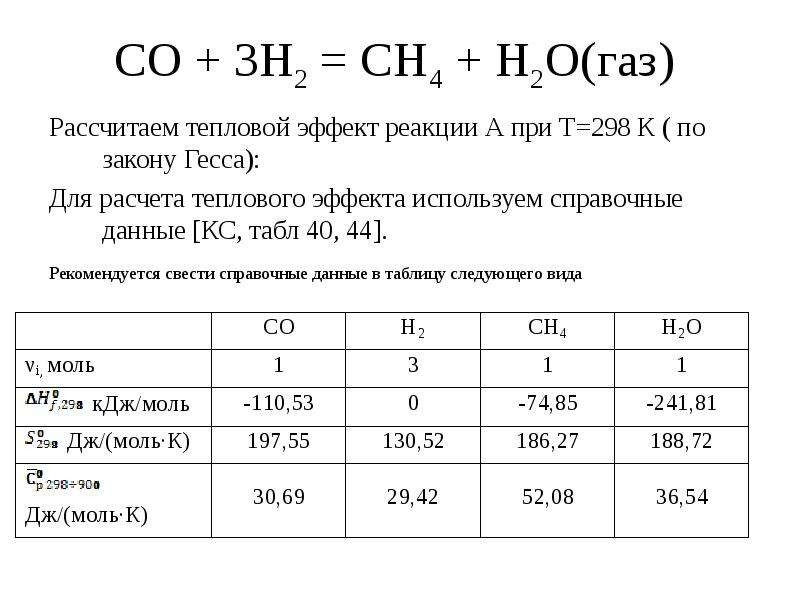 Следует отметить образование 2 моль воды, что сопровождается выделение 484 кДж тепла.
Следует отметить образование 2 моль воды, что сопровождается выделение 484 кДж тепла.
Теплотой образования вещества называют количество теплоты, которое выделяется при формировании 1 моль данного вещества из простых веществ.
Наглядным примером является процесс сгорания алюминия, представить который можно таким образом:
\(2Al+\frac{3}{2}O_{2} \rightarrow Al_{2}O_{3}+1675\) кДж
Теплота, которая выделяется при образовании оксида алюминия, составляет 1675 кДж/моль. Записать термохимическую формулу, исключая дробные коэффициенты, можно в таком виде:
\(4Al+3O_{2} \rightarrow 2Al2O_{3} + 3350\) кДж
Теплота, которая характерна для образования оксида алюминия, составит 1675 кДж/моль. Это объясняется с помощью теплового эффекта образования 2 моль оксида алюминия, который учтен в термохимическом уравнении.
ОпределениеТеплотой сгорания вещества называют количество тепла, которое выделяется в процессе горения 1 моль данного вещества.
Примером такого явления служит горение метана:
\(CH_{4} + 2O_{2} \rightarrow CO_{2} + 2H_{2}O + 802\) кДж
В этом случае теплота сгорания метана составит 802 кДж/моль.
Примеры решения задач
Задача 1
По итогу реакции, термическая формула которой записана таким образом:
\(N_{2}+O_{2}\rightarrow2NO-180\)
образовано 98 л (н.у.) оксида азота (II). Требуется определить количество теплоты, затраченное на эту реакцию в кДж. Искомое значение можно записать с точностью до целых.
Решение
Согласно термическому уравнению, для образования 2 моль оксида азота (II) необходимо затратить 180 кДж тепла. 2 моль оксида азота при н.у. в объеме составляют 44.8 л. Для поиска решения целесообразно воспользоваться простой пропорцией:
- получить 44,8 л оксида азота (II) можно с помощью 180 кДж тепла;
- для образования 98 л оксида азота требуется х кДж теплоты.

Таким образом:
х = 180 * 98 / 44.8 = 393.75 кДж.
Если округлить значение до целых, то Q = 394 кДж.
Ответ: количество теплоты, которое потратили на реакцию, составляет 394 кДж.
Задача 2
По итогам реакции, термохимическая формула которой имеет вид:
\(2H_{2}+O_{2}=2H_{2}O+ 484\) кДж
было высвобождено 1452 кДж тепла. Требуется найти массу выделившейся в процессе реакции воды в граммах. Запись числа рекомендуется округлить до целых.
Решение
Согласно термохимическому уравнению, в процессе образования 2 моль воды будет образовано 484 кДж тепла. Масса 2 моль воды составляет 36 грамм. Простая пропорция:
- во время формирования 36 грамм воды будет выделено 484 кДж тепла;
- в процессе образования х грамм воды высвободится 1452 кДж теплоты.
В таком случае:
х = 1452 * 36 / 484 = 108 г.
\(m(H_{2}O)=108\) г.
Ответ: в процессе реакции будет выделено 108 грамм воды.
Задача 3
Во время реакции, которая характеризуется следующим термохимическим уравнением:
\(S+O_{2}=SO_{2}+ 296\) кДж
было затрачено 80 грамм серы. Требуется рассчитать количество теплоты, выделяющееся во время реакции в кДж. Конечный результат допускается округлить до целых.
Решение
Исходя из термохимического уравнения, в процессе сгорания 1 моль серы будет выделено 296 кДж теплоты. Масса 1 моль серы составляет 32 грамма. Для расчетов можно записать простую пропорцию:
- сгорание 32 грамм серы сопровождается выделением 296 кДж теплоты;
- сгорание 80 грамм серы сопровождается выделением х кДж теплоты.
Таким образом:
х = 80 * 296 / 32 = 740 кДж
Q = 740 кДж.
Ответ: во время химической реакции будет образовано 740 кДж теплоты.
\ominus_f\; (реагенты)\] Поскольку энтальпия является функцией состояния, теплота реакции зависит только от конечного и начального состояний, а не от пути, по которому идет реакция. Например, реакция \( A \rightarrow B\) проходит через промежуточные стадии (то есть \(C \rightarrow D\)), но A и B остаются неизменными.
Например, реакция \( A \rightarrow B\) проходит через промежуточные стадии (то есть \(C \rightarrow D\)), но A и B остаются неизменными.
Таким образом, можно измерить энтальпию реакции как сумму ΔH трех реакций, применяя закон Гесса.
Пример \(\PageIndex{1}\): сжигание ацетилена
Рассчитать изменение энтальпии сгорания ацетилена (\(\ce{C2h3}\))
Раствор
1) Первый шаг – убедиться, что уравнение сбалансировано и правильно.Помните, что для сжигания углеводородов требуется кислород, и в результате образуется углекислый газ и вода.
\[\ce{2C2h3(г) + 5O2(г) -> 4CO2(г) + 2h3O(г)}\]
2) Затем найдите таблицу стандартных энтальпий образования, чтобы найти значения компонентов реакции (таблица 7.2, текст Петруччи)
3) Сначала найдите энтальпии продуктов:
ΔHº f CO 2 = -393,5 кДж/моль
Умножьте это значение на стехиометрический коэффициент, который в данном случае равен 4 молям.
v p ΔH º f CO 2 = 4 моль (-393,5 кДж/моль)
= -1574 кДж
ΔH º f H 2 O = -241,8 кДж/моль
Стехиометрический коэффициент этого соединения равен 2 моль. Итак,
v p ΔH º f H 2 O = 2 моль (-241,8 кДж/моль)
= -483,6 кДж
Теперь сложите эти два значения, чтобы получить сумму произведений
Сумма произведений (Σ v p ΔHº f (произведения)) = (-1574 кДж) + (-483.6 кДж) = -2057,6 кДж
Теперь найдите энтальпии реагентов:
ΔHº f C 2 H 2 = +227 кДж/моль
Умножьте это значение на стехиометрический коэффициент, который в данном случае равен 2 молям.
v p ΔHº f C 2 H 2 = 2 моль (+227 кДж/моль)
= +454 кДж
ΔHº f O 2 = 0,00 кДж/моль
Стехиометрический коэффициент этого соединения равен 5 моль. Итак,
Итак,
v p ΔHº f O 2 = 5 моль (0,00 кДж/моль)
= 0,00 кДж
Сложите эти два значения, чтобы получить сумму реагентов
Сумма реагентов (Δ v r ΔHº f (реагентов)) = (+454 кДж) + (0,00 кДж) = +454 кДж
Сумма реагентов и продуктов теперь может быть подставлена в формулу:
ΔHº = Δ v p ΔHº f (продукты) — ? v r ΔHº f (реагенты)
= -2057.6 кДж — +454 кДж
= -2511,6 кДж
Стехиометрические расчеты с использованием энтальпии — Введение в химию — 1-е канадское издание
- Выполнение стехиометрических расчетов с использованием изменений энергии из термохимических уравнений.
В главе 5 «Стехиометрия и моль» мы связывали количества одного вещества с другим в химическом уравнении, выполняя вычисления, в которых использовалось сбалансированное химическое уравнение; сбалансированное химическое уравнение обеспечило эквивалентности, которые мы использовали для построения коэффициентов преобразования. Например, обратите внимание на следующее сбалансированное химическое уравнение:
Например, обратите внимание на следующее сбалансированное химическое уравнение:
В этом уравнении мы признаем следующие эквивалентности:
Где ⇔ — математический символ «эквивалентен». Однако в нашем термохимическом уравнении есть другая величина — изменение энергии:
.Это новое количество позволяет нам добавить еще одну эквивалентность в наш список:
То есть теперь мы можем добавить к эквивалентностям количество энергии — изменение энтальпии сбалансированной химической реакции.Эту эквивалентность также можно использовать для построения коэффициентов преобразования, чтобы мы могли связать изменение энтальпии с количеством веществ, прореагировавших или образовавшихся.
Обратите внимание, что эти эквивалентности решают проблему. Когда указывается количество энергии для сбалансированной химической реакции, к какому количеству реагентов или продуктов оно относится? Ответ заключается в том, что это относится к количеству молей вещества, на что указывает его коэффициент в сбалансированной химической реакции. Так, 2 моля H 2 относятся к -570 кДж, а 1 моль O 2 — к -570 кДж.Вот почему единицей изменения энергии является кДж, а не кДж/моль.
Так, 2 моля H 2 относятся к -570 кДж, а 1 моль O 2 — к -570 кДж.Вот почему единицей изменения энергии является кДж, а не кДж/моль.
Например, рассмотрим следующее термохимическое уравнение:
Эквивалентности для этого термохимического уравнения:
Предположим, мы спросили, сколько энергии выделяется при реакции 8,22 моль H 2 . Мы построили бы коэффициент преобразования между числом молей H 2 и выделяемой энергией, -184,6 кДж:
Знак минус означает, что выделяется столько энергии.
Определите, сколько энергии выделяется при реакции 222,4 г N 2 по следующему термохимическому уравнению:
Решение
Сбалансированное термохимическое уравнение связывает изменение энергии с молями, а не с граммами, поэтому мы сначала преобразуем количество N 2 в моли, а затем используем термохимическое уравнение для определения изменения энергии:
Определите, сколько тепла выделяется при реакции 1,00 г H 2 по следующему термохимическому уравнению:
Ответить
−15. 1 кДж
1 кДж
Как и в случае любой стехиометрической величины, мы можем начать с энергии и определить количество, а не наоборот.
Определите, какая масса NO может быть получена при подаче 558 кДж энергии, учитывая следующее термохимическое уравнение:
Решение
На этот раз мы начнем с количества энергии:
Учитывая следующее уравнение, сколько граммов N 2 вступит в реакцию, если будет подведено 100,0 кДж энергии?
Ответить
15.5 г
Одна очень энергичная реакция называется термитной реакцией . Его классическими реагентами являются металлический алюминий и оксид железа (III); реакция дает металлическое железо и оксид алюминия:
При правильном проведении реакции выделяется столько энергии, что железо превращается в жидкость . (Железо обычно плавится при температуре 1536 °C.) При правильном направлении жидкое железо может заполнить пространство между двумя или более металлическими частями и, после быстрого охлаждения, может сварить металлические части вместе.
Термитные реакции используются для этой цели и сегодня. В гражданских целях они используются для повторной сварки сломанных осей локомотивов, которые нелегко снять для ремонта. Они используются для сварки железнодорожных путей. Термитные реакции также можно использовать для разделения тонких кусков металла, если по какой-либо причине горелка не работает.
Рисунок 7.2 «Термитная реакция». Небольшой глиняный горшок содержит термитную смесь. На фотографии он реагирует при высокой температуре и в конечном итоге выделит расплавленный металл, который соединится с железнодорожными путями под ним.Термитные реакции также используются в военных целях. Термитные смеси часто используют с дополнительными компонентами в качестве зажигательных устройств — устройств, поджигающих огонь. Термитные реакции также полезны для вывода из строя вражеского оружия: артиллерийское орудие не работает так хорошо, когда в его стволе проплавлена дыра из-за термитной реакции!
- Изменение энергии химической реакции можно использовать в расчетах стехиометрии.

- Напишите эквивалентности, которые подразумевает это сбалансированное термохимическое уравнение:
- Запишите эквивалентности, которые подразумевает это сбалансированное термохимическое уравнение:
- Сколько килоджоулей выделяется при 17.8 моль CH 4 (г) реагируют по следующему уравнению?
- Сколько килоджоулей поглощается, когда 0,772 моль N 2 (г) реагирует по следующему уравнению?
- Сколько килоджоулей поглощается при образовании 23,09 моль C 6 H 6 (л) по следующему уравнению?
- Сколько килоджоулей выделяется, когда 8,32 моля Mg реагируют по следующему уравнению?
- Глюкоза (C 6 H 12 O 6 ) является основным топливом, метаболизируемым в клетках животных.Сколько энергии выделяется, когда 100,0 г C 6 H 12 O 6 реагируют по следующему уравнению?
- Сколько энергии выделяется при производстве 288 г Fe при выполнении следующего термохимического уравнения?
- Сколько энергии поглощается при взаимодействии 85,2 г CO 2 по следующему термохимическому уравнению?
- Сколько энергии поглощается при взаимодействии 55,9 г Na + (водн.
 ) по следующему термохимическому уравнению?
) по следующему термохимическому уравнению? - NaHCO 3 разлагается при нагревании.Какая масса NaHCO 3 разлагается под действием 256 кДж в следующем термохимическом уравнении?
- HgO разлагается при нагревании. Какую массу O 2 можно получить с помощью 100,0 кДж в следующем термохимическом уравнении?
- Какая масса SO 3 необходима для получения 1566 кДж в следующем термохимическом уравнении?
- Какая масса HBr образуется при выделении 553 кДж энергии в следующем термохимическом уравнении?
- 1 моль PCl 3 ⇔ 1 моль Cl 2 ⇔ 1 моль PCl 5 ⇔ -87.9 кДж 90 158
- 15 800 кДж
- 1130 кДж
- 1554 кДж
- 548 кДж
- 470 г
- 6,60 × 10 2 г
Атрибуция СМИ
Расчет изменения тепловой энергии: формула и примеры — видео и расшифровка урока
Тепловая энергия
Если тепло – это передача тепловой энергии, то что такое тепловая энергия? Тепловая энергия — это кинетическая энергия атомов или молекул, составляющих вещество. Эти атомы и молекулы движутся, вращаясь, вибрируя, а в случае жидкостей и газов даже перемещаясь. Энергия движения, вообще говоря, есть кинетическая энергия. Когда крошечные частицы, атомы и молекулы выполняют эту кинетическую энергию или движение, мы называем это тепловой энергией.
Эти атомы и молекулы движутся, вращаясь, вибрируя, а в случае жидкостей и газов даже перемещаясь. Энергия движения, вообще говоря, есть кинетическая энергия. Когда крошечные частицы, атомы и молекулы выполняют эту кинетическую энергию или движение, мы называем это тепловой энергией.
Температурная шкала Кельвина
Слово «тепловая энергия», вероятно, звучит для вас очень похоже на слово «термометр». Если да, то хорошо! температура вещества, измеренная термометром, на самом деле представляет собой среднюю тепловую энергию атомов или молекул в веществе.Вот почему температурная шкала Кельвина так полезна. При 0 Кельвина в веществе нет ни кинетической энергии, ни движения атомов. По температурной шкале Кельвинов по мере повышения температуры от нуля увеличивается движение и увеличивается тепловая энергия. Температуры можно легко преобразовать из градусов Цельсия в кельвины, используя это соотношение.
Удельная теплоемкость
При повышении температуры тепловая энергия вещества увеличивается. Обратное тоже верно. При понижении температуры тепловая энергия вещества уменьшается. Передаваемое тепло, q , можно рассчитать как:
Обратное тоже верно. При понижении температуры тепловая энергия вещества уменьшается. Передаваемое тепло, q , можно рассчитать как:
В этом уравнении Cp — удельная теплоемкость вещества, m — масса, а ΔT — изменение температуры. Всегда рассчитывайте изменение температуры, вычитая начальную температуру из конечной температуры, Tf — Ti.Если тепло передается веществу, тепловая энергия вещества увеличивается, и поэтому q будет положительным. Если теплота будет передаваться из системы, то тепловая энергия вещества уменьшится и q будет отрицательным.
Удельная теплоемкость — это константа, определяющая, сколько энергии необходимо затратить на один грамм вещества, чтобы повысить его температуру на один градус Цельсия. Это также можно рассматривать как повышение его на один градус Кельвина, потому что размер градуса в обеих этих шкалах эквивалентен.Эту константу можно измерить или найти в справочниках для каждой фазы каждого вещества. Приятно отметить, что разные фазы одного и того же вещества имеют разную теплоемкость. Например, удельная теплоемкость льда отличается от удельной теплоемкости жидкой воды.
Приятно отметить, что разные фазы одного и того же вещества имеют разную теплоемкость. Например, удельная теплоемкость льда отличается от удельной теплоемкости жидкой воды.
В этой таблице показаны удельные теплоемкости некоторых распространенных веществ.
| Вещество | Удельная теплоемкость (Дж/кг °C) |
|---|---|
| азот (газ) | 1040 |
| кислород (газ) | 918 |
| вода (газ) | 3985 |
| спирт этиловый (жидкий) | 2440 |
| вода (жидкая) | 4182 |
| стекло (пирекс, твердое) | 753 |
| золото (сплошное) | 129 |
| железо (твердое) | 449 |
| вода (твердая) | 2093 |
Обратите внимание, что при использовании в расчетах удельных теплоемкостей вещество должно оставаться в одной и той же фазе. Фазовые переходы действительно вызывают передачу тепла, но рассчитываются по-другому.
Фазовые переходы действительно вызывают передачу тепла, но рассчитываются по-другому.
Примеры расчетов
Рассмотрим несколько примеров.
Пример 1
Золотое кольцо весом 5,0 грамм лежит на солнце. Кольцо поглощает 20 Дж тепловой энергии. Предполагая, что кольцо начинается при температуре 30°C, какой будет конечная температура кольца после поглощения этой энергии?
Сначала подставьте все известные значения в уравнение. Поскольку удельная теплоемкость выражается в джоулях на килограмм на градус Цельсия, нам также потребуется преобразовать нашу массу 5.0 граммов в килограммы, а также. Удельная теплоемкость золота указана в таблице.
Упрощая, мы можем решить для конечной температуры,
Пример 2
Один грамм неизвестного вещества теряет 11,2 Дж тепловой энергии при охлаждении с 90°С до 65°С. Какова удельная теплоемкость неизвестного вещества?
Какова удельная теплоемкость неизвестного вещества?
Во-первых, мы алгебраически изолируем C, удельную теплоемкость неизвестной величины.
Мы подставим наши известные значения, не забывая конвертировать нашу массу в один грамм в килограммы.
Из таблицы мы теперь знаем, что это вещество должно быть железом!
Краткое содержание урока
Давайте повторим. Теплота, q , является мерой тепловой энергии, передаваемой веществу и от него. Наиболее распространенными единицами энергии являются калории и джоули. Тепловая энергия — это кинетическое движение атомов или молекул в веществе. температура вещества есть средняя тепловая энергия. На температурной шкале Кельвинов °, ноль Кельвина — это точка, в которой прекращается всякое движение и вещество не имеет ни теплоты, ни тепловой энергии. Удельная теплоемкость — это константа, определяющая, сколько энергии необходимо затратить на один грамм вещества, чтобы повысить его температуру на один градус Цельсия. Теплоту можно рассчитать для одной фазы вещества, изменяющей температуру, используя это уравнение:
Удельная теплоемкость — это константа, определяющая, сколько энергии необходимо затратить на один грамм вещества, чтобы повысить его температуру на один градус Цельсия. Теплоту можно рассчитать для одной фазы вещества, изменяющей температуру, используя это уравнение:
Учебное пособие по химии теплоты реакции
Ключевые понятия
- Энтальпия реакции (теплота реакции) – это тепло, выделяющееся или поглощаемое при протекании химической реакции.
При экзотермической реакции выделяется тепло, температура реакционной смеси повышается.
Эндотермическая реакция поглощает тепло, температура реакционной смеси снижается.
- Единицами энтальпии реакции или теплоты реакции являются кДж моль -1 для определенного реагента или продукта.
- Энтальпия реакции (теплота реакции) для реакции нейтрализации известна как энтальпия нейтрализации (теплота нейтрализации).

- Энтальпия реакции (теплота реакции) растворенного вещества, растворяющегося в растворителе, известна как энтальпия растворения (теплота растворения).
- Энтальпия реакции (теплота реакции) для реакции осаждения известна как энтальпия осаждения (теплота осаждения).
- Энтальпию реакции (теплоту реакции) можно измерить экспериментально с помощью калориметра.
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Экспериментальное измерение энтальпии (теплоты) реакции
Чашка из пенополистирола (пенополистирол или чашка из пенополистирола™) может использоваться в качестве калориметра, как показано на диаграмме справа, поскольку пенополистирол является хорошим изолятором и предотвратит потерю тепла реакции или тепла из окружающей среды. попадание в реакционную смесь. 1
- Известное количество реагента помещают в хорошо изолированный сосуд (например, чашку из пенополистирола, то есть чашку из пенополистирола™).

- Записывается начальная температура этого реагента, T i .
- Добавляют известное количество второго реагента, сосуд закрывают крышкой и перемешивают реакционную смесь.
- Регистрируют конечную температуру реакционной смеси, T f .
- Рассчитывается тепловыделение или поглощение (теплоизменение) q в джоулях (Дж) для реакции:
изменение теплоты = масса × удельная теплоемкость × изменение температуры
q = m × c г × ΔT
- Рассчитывается изменение энтальпии, ΔH, в кДж на моль данного реагента для реакции:
ΔH = теплопередача/1000 ÷ моль
ΔH = q/1000 ÷ n
Примечание:
⚛ экзотермические реакции: ΔH отрицательное
⚛ эндотермические реакции: ΔH положительный
Общие предположения для реакционных смесей, состоящих из водных растворов:
- плотность водных растворов предполагается такой же, как для воды, 1 г мл -1 при 25°C
пример:
Говорят, что 100 мл водного раствора имеют массу 100 г.
- принята аддитивность объемов реагентов в растворе
пример:
100 мл «реагента a (водн.) » + 200 мл «реагента b (водн.) » = 300 мл «водного раствора» - Удельная теплоемкость реакционной смеси принимается такой же, как у воды,
, то есть:
удельная теплоемкость = 4.184 JK -1 г -1 = 4,184 Дж°C -1 г -1 - Тепло не теряется и не поглощается окружающей средой.
Обычно расчет выделяемой или поглощаемой теплоты q для реакции водных растворов измеряется в джоулях (Дж):
q = (масса в граммах «реагента а» + масса в граммах «реагента b») × 4,184 × (T конечная — T исходная )
Энтальпия реакции (теплота реакции), ΔH, в кДж моль -1 :
ΔH = q/1000 ÷ моль реагента
⚛ Для реакции с выделением тепла, экзотермической реакции, ΔH отрицательно.
⚛ Для реакции с поглощением тепла, эндотермической реакции, ΔH положителен.
Энтальпия раствора (теплота раствора) Пример
В эксперименте 1,2 г гранул гидроксида натрия, NaOH (s) , растворяли в 100 мл воды при 25°C.
Температура воды поднялась до 27,5°С.
Рассчитайте изменение энтальпии (теплоты раствора) реакции в кДж моль -1 растворенного вещества.
- Рассчитайте тепла, выделяемого , q, в джоулях (Дж) по реакции:
q = масса (воды) × удельная теплоемкость (вода) × изменение температуры (раствор)
q = m( H 2 O(l) ) × c г ( H 2 O(l) ) × (T f — T i )
q = 100 × 4,184 × (27,5 — 25) = 1046 Дж - Рассчитайте количество молей растворенного вещества (NaOH (s) ):
моль = масса ÷ молярная масса
моль (NaOH) = 1.2 ÷ (22,99 + 16,00 + 1,008)
н (NaOH) = 0,030 моль - Рассчитайте изменение энтальпии, ΔH, в кДж моль -1 растворенного вещества:
ΔH = -q/1000 ÷ n(растворенное вещество) = -1046/1000 ÷ 0,030 = -35 кДж моль -1
ΔH отрицательно, поскольку реакция является экзотермической (выделяется энергия, вызывающая повышение температуры раствора) .
Более подробное руководство см. в руководстве по нагреванию раствора
.Энтальпия нейтрализации (теплота нейтрализации) Пример
В эксперименте по определению изменения энтальпии ΔH реакции нейтрализации:
NaOH (водн.) + HCl (водн.) → NaCl (водн.) + H 2 O (л)
Были получены следующие результаты:
| Масса 100 мл 0.50 моль л -1 HCl | = м и | = 100 г |
| Масса 100 мл 0,50 моль л -1 NaOH | = м б | = 100 г |
| Начальная температура | = Т и | = 20,1°С |
| Конечная температура | = Т ф | = 23.4°С |
| Удельная теплоемкость растворов | = с г | = 4,184 Дж°С -1 г -1 |
Рассчитайте изменение энтальпии, ΔH, в кДж моль -1 воды, образовавшейся в результате реакции.
- Рассчитайте тепла, выделяемого , q, в джоулях (Дж) в результате реакции нейтрализации:
q = масса (реакционная смесь) × удельная теплоемкость (вода) × изменение температуры (раствор)
q = (m a + m b ) × c g × (T f — T i )
д = (100 + 100) × 4.184 × (23,4–20,1)
= 200 × 4,184 × 3,3
= 2761,44 Дж - Рассчитайте количество молей реагентов:
моль = молярность × объем
моль (NaOH) = 0,50 моль
л -1× (100 × 10 -3 )л= 0,05 моль
моль (HCl) = 0,50 мольл -1× (100 × 10 -3 )л= 0,05 мольNaOH (водн.) и HCl (водн.) находятся в молярном соотношении 1:1, что является точным стехиометрическим соотношением, как показано уравнением нейтрализации.
0,05 моль NaOH (водн.) реагирует с 0,05 моль HCl (водн. ) с образованием 0,05 моль воды.
) с образованием 0,05 моль воды. - Рассчитайте энтальпию (теплоту) реакции, ΔH, в кДж моль -1
Поскольку реагенты находятся в стехиометрическом соотношении 1:1, 0,05 моль NaOH (водн.) реагирует с 0,05 моль HCl (водн.) с образованием 0,05 моль воды,
молей (H 2 O (l) ) = n(H 2 O (l) ) = 0,05 мольΔH = -q/1000 ÷ n(H 2 O (l) )
= -2761.44/1000 ÷ 0,05
= -55,2 кДж моль -1
ΔH имеет отрицательное значение, поскольку реакция является экзотермической.
Более подробное руководство см. в руководстве «Тепло нейтрализации»
.Энтальпия осаждения (теплота осаждения) Пример
50 мл 0,20 моль L -1 раствор нитрата свинца(II), Pb(NO 3 ) 2(aq) , при 19,6°C добавляли к 30 мл раствора, содержащего избыток йодида калия, KI (водный) также в 19.6°С.
Растворы реагировали с образованием желтого осадка йодида свинца(II), PbI 2(s) , и температура реакционной смеси повышалась до 22,2°C.
Pb(NO 3 ) 2(водн.) + 2KI (водн.) → PbI 2(s) + 2KNO 3(водн.)
Рассчитайте изменение энтальпии на моль йодида свинца(II), осажденного в результате реакции.
- Рассчитайте тепла, выделяемого , q, в джоулях (Дж) по реакции осаждения:
q = масса × удельная теплоемкость × изменение температуры
q = [m Pb(NO 3 ) 2(водн.) + m KI (водн.) ] × c г × (T f 6 T—
—
д = [50 + 30] × 4.184 × (22,2–19,6)
= 870,27 Дж - Рассчитайте количество молей указанных частиц, n(PbI 2(s) ):
Из уравнения 1 моль Pb(NO 3 ) 2(водн.) реагирует с избытком KI (водн.) с образованием 1 моль PbI 2(s)
моль Pb(NO 3 ) 2(водн. ) = моль PbI 2(т)
) = моль PbI 2(т) n(Pb(NO 3 ) 2(водн.) ) = n(PbI 2(s) )
n (Pb (NO 3 ) 2 (водн.) ) = молярность × объем
n = моли (Pb (NO 3 ) 2 (водн.) )
= моли (PbI 2(s) )
= 0.20 × 50 × 10 -3
= 0,010 моль - Рассчитайте энтальпию осаждения (теплоту осаждения), ΔH, в кДж моль -1 PbI 2(s) :
ΔH = -q/1000 ÷ n
ΔH = -0,870/1000 ÷ 0,010
= -87 кДж моль -1
ΔH имеет отрицательное значение, поскольку реакция является экзотермической (выделяется энергия, вызывающая повышение температуры).
Сноски
1.Альтернативный метод определения теплоты реакции (энтальпии реакции) для реагентов в растворе описан в руководстве по калориметру.
Уравнение Аррениуса – обзор
3.7.2.1.1 Теория переходного состояния
Сила ТПФ хорошо известна. Однако до сих пор мы в основном концентрировались на оценке глобальных минимумов энергии соединения с использованием этого метода, который относится к расчетам, выполненным при 0 К. Однако 0 К слишком холодны для протекания реакций.Основная задача оценки скорости реакции с использованием подходов из первых принципов состоит в том, чтобы создать точную многомерную ППЭ, построенную из минимумов энергии. Чтобы проиллюстрировать методологию оценки скорости реакции с помощью TST, мы продемонстрировали пример, заимствованный из Sholl and Steckel (2011): Адсорбция атома Ag на поверхности Cu ( x – y ).
Однако до сих пор мы в основном концентрировались на оценке глобальных минимумов энергии соединения с использованием этого метода, который относится к расчетам, выполненным при 0 К. Однако 0 К слишком холодны для протекания реакций.Основная задача оценки скорости реакции с использованием подходов из первых принципов состоит в том, чтобы создать точную многомерную ППЭ, построенную из минимумов энергии. Чтобы проиллюстрировать методологию оценки скорости реакции с помощью TST, мы продемонстрировали пример, заимствованный из Sholl and Steckel (2011): Адсорбция атома Ag на поверхности Cu ( x – y ).
Представим себе набор атомов Cu в плоскости x – y . Зафиксируем положение ( x,y ) атома Ag в плоскости x – y и позволим ему двигаться по плоскости z , релаксируя атомы Cu в плоскости x – плоскость y для минимизации энергии атома Ag.Аналогичным образом позвольте атому Ag сканировать всю плоскость x – y , покрытую атомами Cu, и выполните минимизацию энергии в каждой точке, как указано выше. Такой подход приведет к созданию двумерной PES, как показано на рисунке 3.18. На этом рисунке четырехкратные участки являются единственными минимумами энергии на поверхности x – y . Узлы моста между двумя четырехкратными узлами являются седловыми точками первого порядка на энергетической поверхности, а узлы на вершине являются седловыми точками второго порядка.Седловые точки первого порядка — это мост между двумя четырехмерными сайтами.
Такой подход приведет к созданию двумерной PES, как показано на рисунке 3.18. На этом рисунке четырехкратные участки являются единственными минимумами энергии на поверхности x – y . Узлы моста между двумя четырехкратными узлами являются седловыми точками первого порядка на энергетической поверхности, а узлы на вершине являются седловыми точками второго порядка.Седловые точки первого порядка — это мост между двумя четырехмерными сайтами.
Рисунок 3.18. Иллюстрация двумерной поверхности потенциальной энергии (Sholl and Steckel, 2011).
MEP определяется как путь между двумя локальными минимумами через седловую точку первого порядка. Это представление является очень упрощенной версией реального процесса адсорбции. Он не рассматривает, например, обмен энергией между атомами Ag и Cu. Но если учесть это, шансы, что атом Ag при комнатной температуре примерно равен 0.Тепловая энергия 0,13 эВ может преодолеть энергетический барьер примерно в 0,36 эВ (рис. 3.19), что значительно возрастает. TST способен обеспечить скорость перехода из состояния A в состояние B через заданный энергетический барьер. Его можно рассчитать следующим образом:
TST способен обеспечить скорость перехода из состояния A в состояние B через заданный энергетический барьер. Его можно рассчитать следующим образом:
Рисунок 3.19. Энергии Ag, рассчитанные с помощью DFT, движущегося по пути минимальной энергии между двумя четырехкратными узлами на Cu (плоскость x – y ) (Sholl and Steckel, 2011).
кА→B=12[средняя тепловая скорость][вероятность нахождения атомаx#]
, где x # — точка переходного состояния.Включение коэффициента 0,5 учитывает тот факт, что из переходного состояния активирующий комплекс может перейти либо к образованию продуктов, либо к преобразованию реагентов. Поскольку эта книга больше ориентирована на приложения, а не на математические основы различных теорий, мы пропустим часть более подробного изучения вывода уравнений теории переходного состояния и просто заявим, что можно показать, что
kA→B=ϑexp (−E#−EAkBT)
, где ϑ — частота колебаний, E # — энергия в переходном состоянии #, а E A — минимум энергии в состоянии A .
Обратите внимание, что уравнение принимает форму хорошо известного выражения Аррениуса для химической скорости. В то время как точное вычисление предэкспоненциального фактора ϑ можно выполнить, выполнив расчеты ДПФ, можно безопасно использовать типичные значения где-то между 10 12 –10 13 с –1 без проведения каких-либо экспериментов или расчетов. Обратите внимание, что полученное выше уравнение для адсорбции атомов Ag на поверхности Cu (плоскость x – y ) рассматривает только одномерный МЭП.Это было сделано, естественно, для простоты иллюстрации, которую он предлагает. В реальном сценарии скорость реакции, вывод которой можно найти в другом месте (Sholl and Steckel, 2011), может быть выражена как
кА→B=ϑ1Xϑ2X…XϑNϑ1#Xϑ2#X…XϑN−1#exp(−E# −EAkBT)
Это уравнение основано на MEP путем включения вкладов от других траекторий с более высокой энергией. В частности, переходное состояние с N степенями свободы характеризуется ( N – 1) реальной и одной мнимой колебательными модами, тогда как локальные минимумы имеют N действительных колебательных мод.
В то время как скорость реакции может быть достаточно точно оценена с помощью теории переходного состояния, основная проблема такого подхода состоит в том, чтобы правильно определить местонахождение переходного состояния в многомерном ППЭ. Это значительно сложнее, чем нахождение локальных минимумов энергии (Sholl, Steckel, 2011). Достаточные условия для точки переходного состояния:
- 1.
Строго одна мнимая частота нормальной формы колебаний
- 2.
Конфигурация является критической точкой на поверхности энергии
9148 Ранее определение переходных состояний было непростым делом, и, учитывая его важность, для решения этой проблемы было разработано несколько численных методов.Как правило, при определении наилучшего подходящего метода для обнаружения переходного состояния следует иметь в виду следующие два критерия:- 1.
Расчеты DFT с плоской волной не предоставляют информацию о второй производной от поверхности энергии.

- 2.
Принимая во внимание вычислительные затраты, выбранный метод должен сходиться к одной точке перехода после небольшого числа итераций.
- 1.
Метод эластичной ленты
- 2.
Метод эластичной ленты сдвига (NEB)
- ΔHfus — энтальпия плавления — количество тепла, необходимое для превращения твердого тела в жидкое
- ΔHvap — энтальпия парообразования — количество теплоты, необходимое для превращения жидкости в газ
- ΔHsub — энтальпия сублимации — теплота, необходимая для превращения твердого вещества в газ
Несколько подходов, которые обычно применяются для определения переходных состояний:
Описанные выше методы основаны на выборке пути перехода. Другим подходом, состоящим из группы методов, являются псевдо-методы Ньютона-Рафсона (Cerjan and Miller, 1981; Baker and Gill, 1988; Banerjee et al., 1985), которые все похожи на алгоритм Cerjan-Miller (Cerjan и Миллер, 1981). Детали математической основы этих методов и алгоритмов не представляют здесь особого интереса, учитывая объем книги.Вместо этого давайте искать инструменты, доступные для реализации этих методов в реальной жизненной ситуации.
С точки зрения применения теории переходного состояния и ее применимости как к моно-, так и к бимолекулярным реакциям, насколько известно авторам, на сегодняшний день доступно несколько программ. Такие программы, как POLYRATE, TheRate и KisTHelP, используют теорию переходного состояния для оценки зависящей от температуры константы скорости при определенном давлении как для мономолекулярных, так и для бимолекулярных реакций. KisTHelP (Reinisch et al., 2012) представляет собой кинетический и термодинамический кросс-платформенный пакет с открытым исходным кодом, который, помимо других молекулярных и реакционных свойств, также может оценивать кинетические коэффициенты скорости из теории переходного состояния. KisTHelP написан на Java, что делает его независимым от платформы, и предназначен для выполнения статистических механических расчетов данных, полученных из квантово-химических расчетов ab initio. Программа также включает одномерные квантово-механические эффекты или эффекты туннелирования на движение координат реакции с помощью мультипликативного коэффициента передачи.На рисунке 3.20 показан снимок экрана из расчета KisTHelp бимолекулярной реакции с использованием как теории переходного состояния (TST с эффектом туннелирования и без него), так и теории вариационного переходного состояния (VTST с эффектом туннелирования и без него).
Такие программы, как POLYRATE, TheRate и KisTHelP, используют теорию переходного состояния для оценки зависящей от температуры константы скорости при определенном давлении как для мономолекулярных, так и для бимолекулярных реакций. KisTHelP (Reinisch et al., 2012) представляет собой кинетический и термодинамический кросс-платформенный пакет с открытым исходным кодом, который, помимо других молекулярных и реакционных свойств, также может оценивать кинетические коэффициенты скорости из теории переходного состояния. KisTHelP написан на Java, что делает его независимым от платформы, и предназначен для выполнения статистических механических расчетов данных, полученных из квантово-химических расчетов ab initio. Программа также включает одномерные квантово-механические эффекты или эффекты туннелирования на движение координат реакции с помощью мультипликативного коэффициента передачи.На рисунке 3.20 показан снимок экрана из расчета KisTHelp бимолекулярной реакции с использованием как теории переходного состояния (TST с эффектом туннелирования и без него), так и теории вариационного переходного состояния (VTST с эффектом туннелирования и без него).
Рисунок 3.20. Логарифмическое представление констант скорости, рассчитанное с использованием четырех уровней теории (TST, VTST, TST/туннелирование, VTST/туннелирование) в KisTHelP (Reinisch et al., 2012).
POLYRATE (Steckler et al., 1995; Zheng et al.), написанная на FORTRAN, представляет собой еще одну полезную и мощную программу для расчета скоростей химических реакций на основе вариационной и традиционной теории переходного состояния, многомерных полуклассических приближений для туннелирования и неклассическое отражение.Как и KisTHelP, он совместим с некоторыми другими известными приложениями для квантово-химических расчетов, такими как Gaussian, NWChem и Gamess. Поверхности потенциальной энергии, с которыми имеет дело POLYRATE, могут быть либо аналитическими функциями, либо релевантной информацией в выбранных точках.
TheRate (Duncan et al., 1998) — еще одна компьютерная прикладная программа, которая использует информацию о PES, полученную из ab initio молекулярных орбиталей или DFT, для расчета скорости реакции с использованием вариационной и традиционной теории переходного состояния. Как и в упомянутых выше программах, в этой программе также доступна опция включения туннельных поправок. Эта программа на основе Java может быть связана с файлом Gaussian, и запрос на взаимодействие с другими пакетами электронной структуры возможен, связавшись с авторами. В программе представлены методы, называемые методом фокусировки и процедурой интерполяции энергии. Техника фокусировки сводит к минимуму количество вычислений Гессе, разумно требуя больше вокруг критических точек для переходных состояний и меньше в других местах.Метод интерполяции энергии позволяет реализовать относительно менее ресурсоемкий метод, такой как DFT, для расчета гессиана и оптимальной молекулярной геометрии. В статье (Duncan et al., 1998) реализация программы иллюстрируется применением ее к реакции:
Как и в упомянутых выше программах, в этой программе также доступна опция включения туннельных поправок. Эта программа на основе Java может быть связана с файлом Gaussian, и запрос на взаимодействие с другими пакетами электронной структуры возможен, связавшись с авторами. В программе представлены методы, называемые методом фокусировки и процедурой интерполяции энергии. Техника фокусировки сводит к минимуму количество вычислений Гессе, разумно требуя больше вокруг критических точек для переходных состояний и меньше в других местах.Метод интерполяции энергии позволяет реализовать относительно менее ресурсоемкий метод, такой как DFT, для расчета гессиана и оптимальной молекулярной геометрии. В статье (Duncan et al., 1998) реализация программы иллюстрируется применением ее к реакции:
Ch5+↔HCh4+h3
Кроме того, OpenSOAMS (Reinisch) и GPOP (Miyoshi) — две другие компьютерные программы. можно использовать для оценки скорости реакции и константы скорости реакции на основе квантово-химических расчетов и теории переходного состояния.
Все вышеупомянутые программы также могут быть использованы для оценки скоростей реакций путем применения теории RRKM (Wieder and Marcus, 2004), модификации теории RRK путем включения теории переходного состояния.
Свободная энергия Гиббса
Чтобы реакция была возможной, значение ΔG должно быть меньше 0. С точки зрения математики, это возможно, если:
ΔG < 0
Поскольку ΔG = ΔH — TΔS, это означает, что для возможной реакции:
ΔH — TΔS < 0
Если вы знаете значения для ΔH и ΔS, то вы можете вычислить значение T, которое сделает это выражение меньше 0.
В случае мы смотрим на
ΔH = +178 кДж моль -1 и
ΔS = +0,1604 кДж К -1 моль -1
Подставляя эти значения в выражение ΔH — TΔS < 0, получаем
178 — Т х 0,1604 < 0
Вы можете обращаться со знаком «меньше чем» так же, как со знаком равенства, и, таким образом, перестановка этого дает:
178 < Т х 0,1604
178 / 0,1604 < Т
1110 < Т
Странный взгляд на это, конечно («1110 меньше T. «). Но это все равно, что сказать, что Т должно быть больше 1110 К.
«). Но это все равно, что сказать, что Т должно быть больше 1110 К.
Определение влияния температуры без проведения расчетов
Посмотрите еще раз на уравнение:
ΔG = ΔH — TΔS
Помните, что для того, чтобы реакция была возможной, ΔG должно быть отрицательным.
ΔH может быть отрицательным (экзотермическая реакция) или положительным (эндотермическая реакция). Точно так же ΔS может быть как положительным, так и отрицательным.
Возможны четыре комбинации знаков ΔH и ΔS.Я хочу посмотреть на них по очереди.
Где ΔH отрицательное, а ΔS положительное
В уравнении ΔG = ΔH — TΔS:
ΔH отрицателен. T∆S положительный, а значит -T∆S отрицательный.
Оба члена отрицательны независимо от температуры, поэтому ΔG также должен быть отрицательным. Реакция возможна при всех температурах.
Где ΔH положительное, а ΔS отрицательное
В уравнении ΔG = ΔH — TΔS:
ΔH положительный. T∆S отрицательный, поэтому -T∆S положительный.
T∆S отрицательный, поэтому -T∆S положительный.
Оба члена положительны независимо от температуры, поэтому ΔG также должна быть положительной. Реакция невозможна ни при какой температуре.
Где ΔH положительное и ΔS положительное
В уравнении ΔG = ΔH — TΔS:
ΔH положительный. T∆S положительный, а значит -T∆S отрицательный.
Теперь повышение температуры изменит ситуацию. При более высоких температурах -T∆S становится все более и более отрицательным и в конечном итоге перевешивает влияние ∆H.
Реакция невозможна при низких температурах, но если ее нагреть, будет температура, при которой она возможна, потому что ΔG становится отрицательным.
Разложение карбоната кальция относится к подобному случаю, и мы сделали три вычисления вокруг него.
Где ΔH отрицательное и ΔS отрицательное
В уравнении ΔG = ΔH — TΔS:
ΔH отрицателен. T∆S отрицательный, поэтому -T∆S положительный.
Опять будет температурный эффект. По мере повышения температуры -T∆S становится все более и более положительным и в конечном итоге перевешивает влияние ∆H.
При низких температурах ΔG будет отрицательным из-за влияния отрицательного ΔH, но при повышении температуры влияние положительного -TΔS в конечном итоге перевесит это. Тогда значение ΔG станет положительным, и реакция больше не будет возможной.
Вкратце
На самом деле я бы не советовал вам изучать это — это слишком запутанно.Убедитесь, что вы понимаете это, чтобы, когда возникнет вопрос, вы могли решить его в то время.
Вам следует по возможности практиковаться, находя вопросы из прошлых работ у ваших экзаменаторов, тщательно сверяя их со схемами выставления оценок и отчетами экзаменаторов, если они доступны. Таким образом, вы получите представление о том, что они считают важным.
Но не так уж сложно составить себе вопросы, которые помогут вам пройти всю тему. Выберите простую реакцию, в которой вы можете найти значения энтропии для всех участников.Используйте справочник, если он у вас есть, или найдите аналогичную информацию в Интернете и избегайте всего, что связано с решениями.
Выберите простую реакцию, в которой вы можете найти значения энтропии для всех участников.Используйте справочник, если он у вас есть, или найдите аналогичную информацию в Интернете и избегайте всего, что связано с решениями.
Используйте энтальпии образования для расчета изменения энтальпии реакции. (Например, если вы используете реакции горения, вы можете просто посмотреть энтальпию сгорания, чтобы избавить себя от хлопот!)
Затем определите изменение энтропии в ходе реакции. Решите, как температура повлияет на возможность реакции, а затем вычислите значения ΔG при различных температурах, чтобы убедиться, что вы правы.(При выполнении этих расчетов не забудьте скорректировать значение изменения энтропии с джоулей на кДж!)
CHM1045 Лекция по энтальпии
CHM1045 Лекция по энтальпииЭнтальпия
Нижеследующее является содержанием лекции 23 по общей химии. В этой лекции мы далее обсудим энтальпию и представим ее расчет с использованием теплоты образования и закона Гесса.
Подробнее об энтальпии
Как мы определили это в предыдущей лекции, энтальпия является мерой тепла, полученного или потерянного системой при постоянном давлении.Это также функция состояния, то есть ее значение связано только с текущим состоянием. Таким образом, изменение энтальпии определяется начальным и конечным количеством тепла, и не имеет значения, как проходил процесс между этими двумя точками. Мы говорим, что значение «независимо от пути»
Дополнительные свойства энтальпии:
1.Энтальпия является экстенсивным свойством. Величина ΔH зависит от количества израсходованных реагентов.Удвоение количества реагентов удваивает количество энтальпии.
2. Обращение химической реакции приводит к той же самой величине энтальпии, но с противоположным знаком.
3. Изменение энтальпии реакции зависит от состояния реагентов и продуктов.
Состояния (например, g, l, s или aq) должны быть указаны.
Пример задачи с использованием значения энтальпии:
CH 4 (г) + 2O 2 (г) -> CO 2 (г) + 2H 2 O(г) ΔH = -802 кДж
Учитывая приведенное выше термохимическое уравнение для сжигания метана, сколько тепловой энергии выделяется при 4.5 грамм метана сжигается (в системе постоянного давления)?
Сначала определите количество молей метана: 4,5 г x 1 моль/16 г метана = 0,28125 моль Ch5
Затем умножьте количество молей на известное количество энтальпии на моль: 0,28125 * -802 кДж = -225,56 кДж или -2,3e2 кДж
Обратите внимание, что единицы измерения энтальпии в реакции отображаются только как кДж, а не кДж/моль. Это отсутствие единицы на моль довольно распространено, но считается, что единица на моль присутствует, даже если она не написана, что-то вроде коэффициента 1 в сбалансированной химической реакции. Глядя на приведенную выше реакцию, вы можете видеть, что значение энтальпии реакции указано для 1 моля метана или 2 молей кислорода или 1 моля углекислого газа и т. д.
Глядя на приведенную выше реакцию, вы можете видеть, что значение энтальпии реакции указано для 1 моля метана или 2 молей кислорода или 1 моля углекислого газа и т. д.
Значения энтальпии
Значения энтальпии для многих веществ уже определены экспериментально и легко доступны в таблицах физических констант. Значения обычно берутся в так называемом «стандартном состоянии». Это наиболее стабильное состояние вещества при давлении 1 атм и заданной температуре, обычно 25 o С и концентрации 1М для всех веществ в растворе.
Стандартное термодинамическое состояние определено таким образом, чтобы разные ученые могли сравнивать результаты
Стандартная энтальпия реакции — ΔH o Rxn — изменение энтальпии при стандартных условиях 1 атм и 298,15 К.
Будьте осторожны, не путайте «Стандартное состояние» с STP, так как это два разных состояния.
Существует также много других типов энтальпий:
Энтальпии физического изменения
Одной из наиболее часто используемых энтальпий является энтальпия образования. Стандартная энтальпия образования (ΔH o F ) представляет собой изменение теплоты, возникающее в результате образования одного моля соединения из его элементов (в наиболее стабильной/природной форме) при давлении 1 атм. Стандартная энтальпия образования любого элемента в его наиболее стабильной форме равна нулю.
Стандартная энтальпия образования (ΔH o F ) представляет собой изменение теплоты, возникающее в результате образования одного моля соединения из его элементов (в наиболее стабильной/природной форме) при давлении 1 атм. Стандартная энтальпия образования любого элемента в его наиболее стабильной форме равна нулю.
Обратите внимание, что элементы в их наиболее стабильной или естественной элементарной форме имеют ΔH o F , равную нулю, в то время как те формы, которые не являются стабильными или требуют процесса для образования, имеют значение ΔH o F .
Стандартная энтальпия реакции
Стандартная энтальпия реакции (ΔH o Rxn ) представляет собой энтальпию реакции, проводимой при 1 атм. Мы уже изучили один процесс, с помощью которого мы можем вычислить энтальпию реакции в калориметрии. Есть два других метода, которые мы сейчас изучим:
1) Теплота реакции стандартных теплот образования
2) Теплота реакции из расчета закона Гесса
Расчет теплоты реакции по стандартной теплоте образования основан на следующих уравнениях:
Теплота реакции может быть рассчитана по теплотам образования каждой молекулы в реакции. Приведенное выше уравнение показывает, что значение ΔH o Rxn рассчитывается как сумма молей продуктов, умноженных на их значения ΔH o F , минус сумма молей реагентов, умноженных на их ΔH . o F значений.
Приведенное выше уравнение показывает, что значение ΔH o Rxn рассчитывается как сумма молей продуктов, умноженных на их значения ΔH o F , минус сумма молей реагентов, умноженных на их ΔH . o F значений.
Закон Гесса: когда реагенты превращаются в продукты, изменение энтальпии одинаково независимо от того, протекает ли реакция в одну стадию или в несколько стадий. Помните, что энтальпия — это функция состояния.Неважно, как вы туда доберетесь, важно, где вы начнете и где закончите.
Вот пример выполнения такого расчета:
Третий процесс, с помощью которого можно рассчитать теплоту реакции, — это использование процесса, называемого законом Гесса. Другой способ сформулировать закон Гесса: изменение энтальпии общего процесса представляет собой сумму изменений энтальпии его отдельных стадий.
Процесс, необходимый для ответа на приведенный выше вопрос, основан на том принципе, что если вы добавляете два или более уравнений, чтобы получить новое уравнение, вы должны добавить ΔH, чтобы получить ΔH для нового уравнения.
Несколько правил, прежде чем мы начнем:
1) Если вы умножаете уравнение на значение, чтобы получить число молей, соответствующее необходимой реакции, вы должны умножить ΔH на то же значение.
2) Если вы перевернете реакцию, чтобы получить молекулу на правильной стороне, соответствующей необходимой реакции, вы измените знак значения ΔH для этой реакции.
«Целевая» реакция S (т) + 3/2 O 2 (г) → SO 3 (г) ΔH = ?
В двух приведенных реакциях сера находится в уравнении 1 и имеет правильную форму, поэтому мы просто копируем это уравнение как есть. Второе уравнение содержит необходимый нам триоксид серы, но в неправильном количестве. Поскольку в уравнении два, нам придется разделить все уравнение на два, чтобы привести его к правильной форме, не забыв также сократить значение энтальпии вдвое:
Второе уравнение содержит необходимый нам триоксид серы, но в неправильном количестве. Поскольку в уравнении два, нам придется разделить все уравнение на два, чтобы привести его к правильной форме, не забыв также сократить значение энтальпии вдвое:
S (т) + O 2 (ж) → SO 2 (г) H 1 = -296,0 кДж
1/2(2 SO 2 (г) + O 2 (г) → 2SO 3 (г) H 2 = -198,2 кДж)
После деления два уравнения можно сложить.Мы можем отменить все, что появляется в обеих частях уравнения в равных количествах:
. S (т) + O 2 (ж) → SO 2 (г) H 1 = -296,0 кДж
SO 2 (ж) +1/2 O 2 (ж) → SO 3 (ж) H 2 = -99,1 кДж
S (т) + 3/2 O 2 (г) → SO 3 (г) ΔH = -395,1 кДж
Вот веб-сайт с множеством практических тестов по всем трем типам расчета энтальпии: Здесь
В заключение, на данный момент мы изучили 3 способа расчета теплоты реакции:
Примерно через месяц, когда мы научимся рисовать структуры Льюиса, вы изучите 4-й метод, использующий значения энергии связи.
 Примером является распад нитрата калия, сопровождающийся поглощением тепла: \(2KNO_{3}\rightarrow 2KNO_{2} + O_{2}-Q\)
Примером является распад нитрата калия, сопровождающийся поглощением тепла: \(2KNO_{3}\rightarrow 2KNO_{2} + O_{2}-Q\)

 ) по следующему термохимическому уравнению?
) по следующему термохимическому уравнению?



 ) с образованием 0,05 моль воды.
) с образованием 0,05 моль воды. ) = моль PbI 2(т)
) = моль PbI 2(т) 
 Состояния (например, g, l, s или aq) должны быть указаны.
Состояния (например, g, l, s или aq) должны быть указаны.