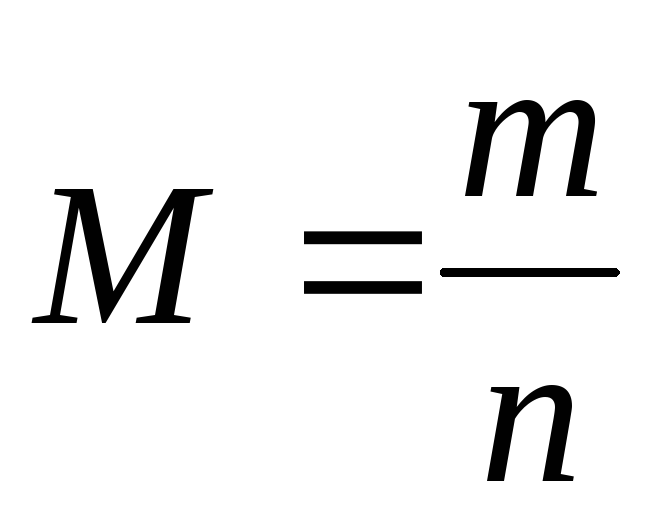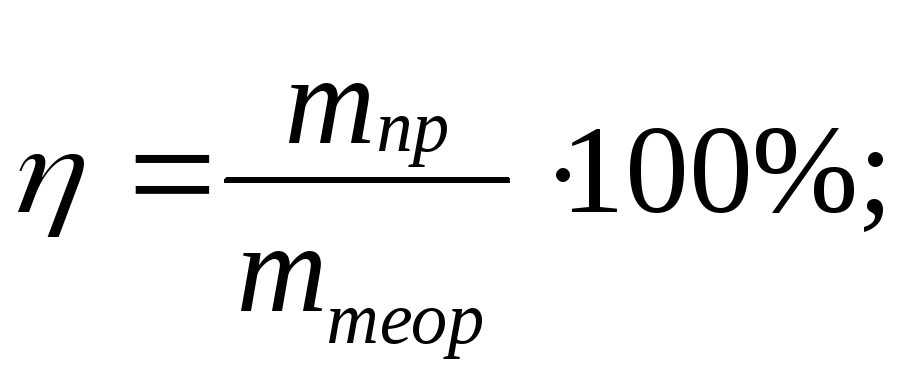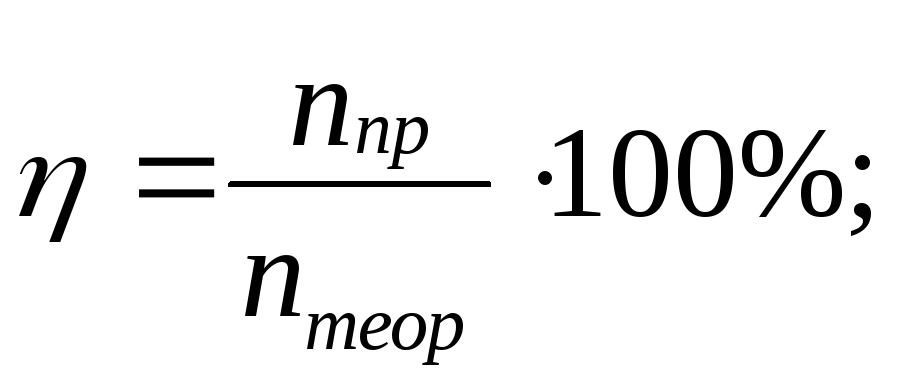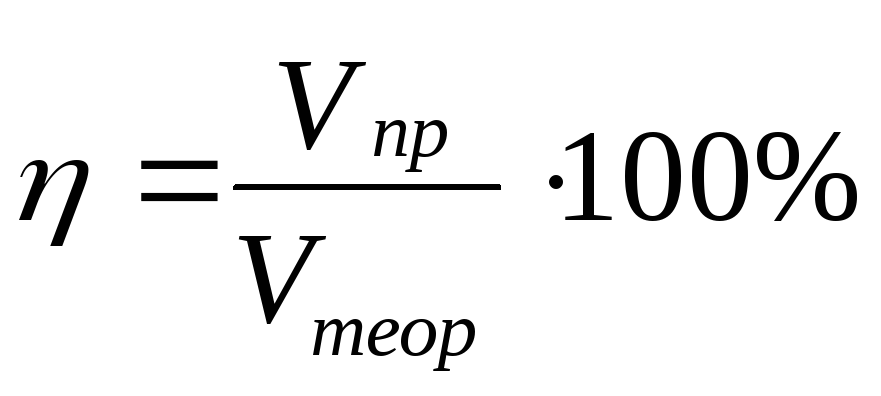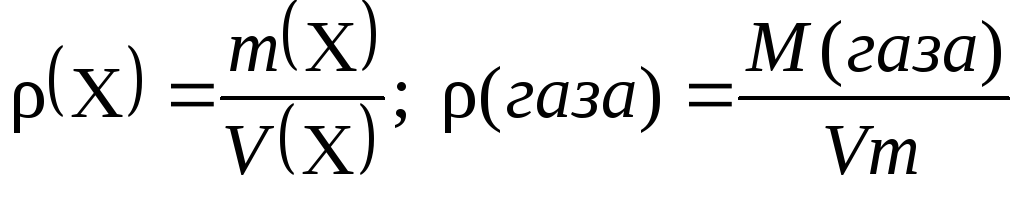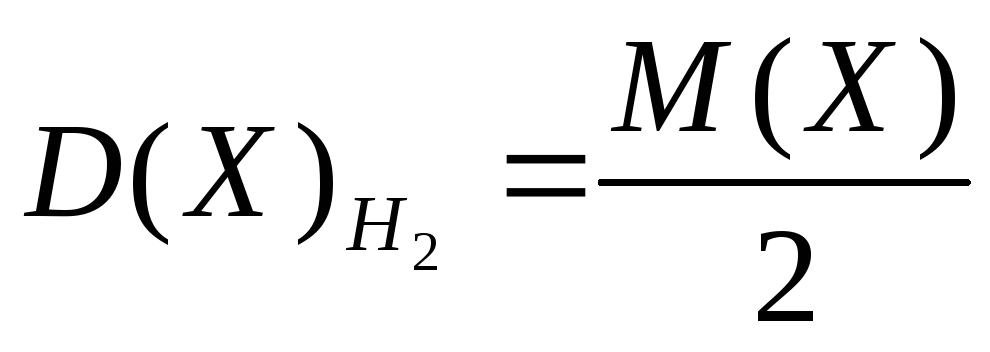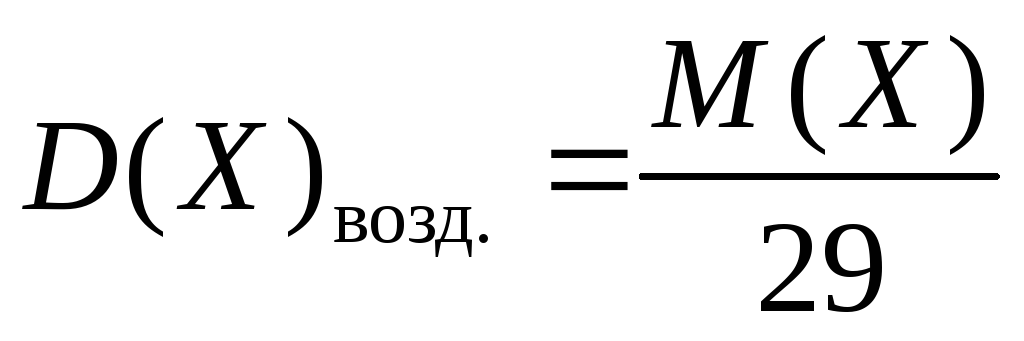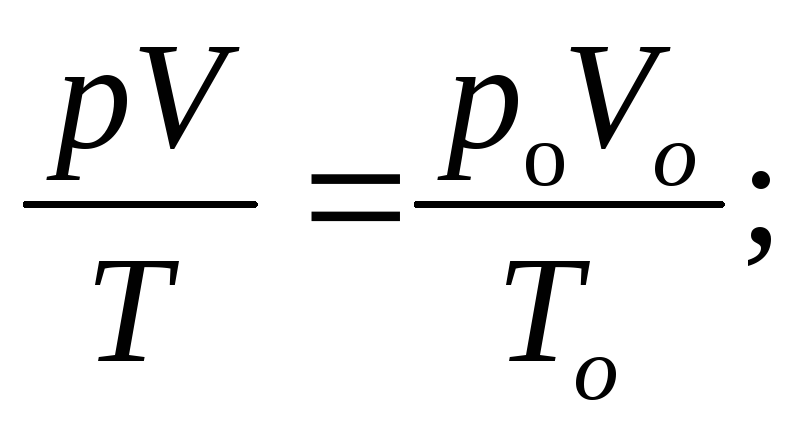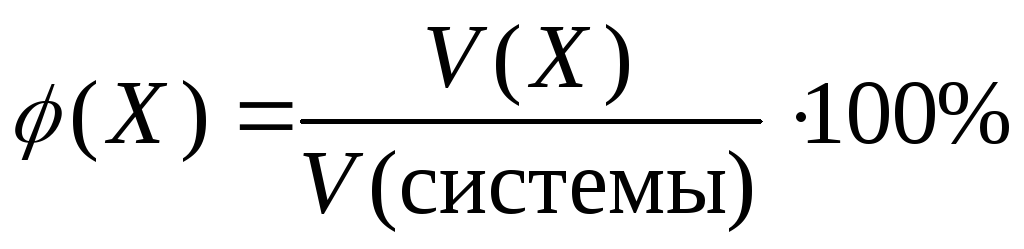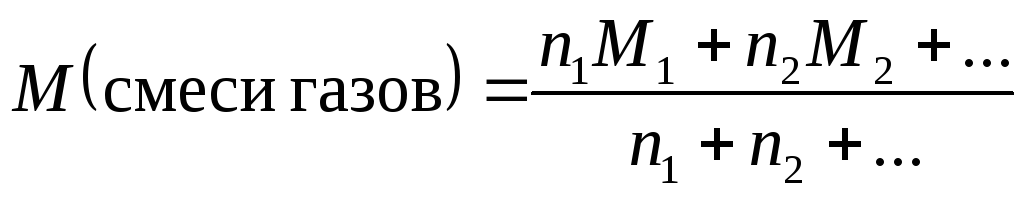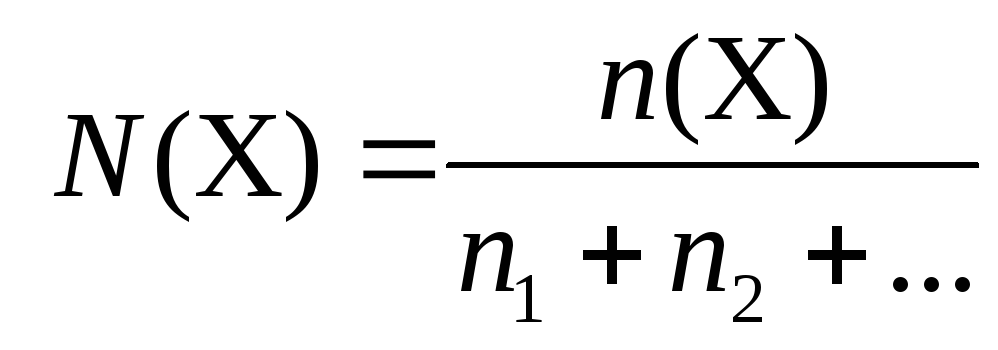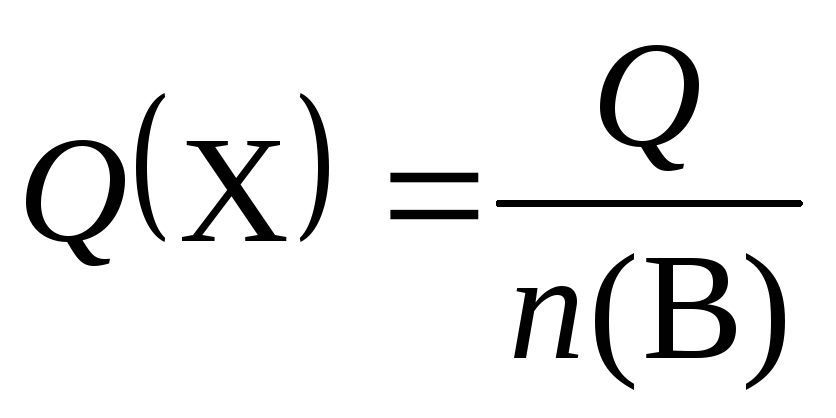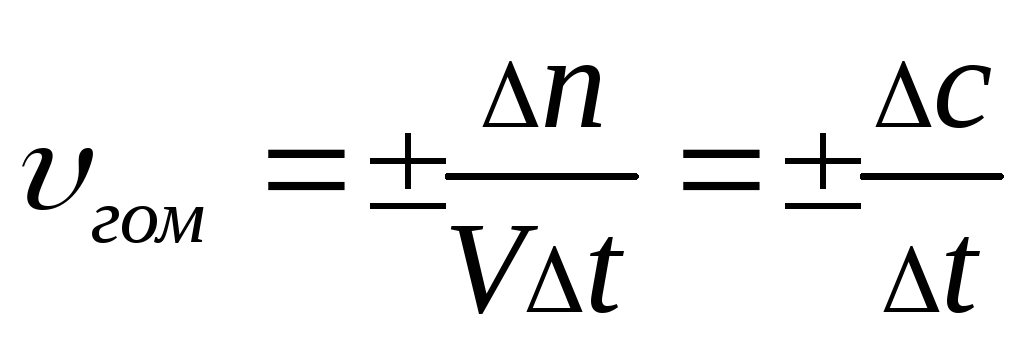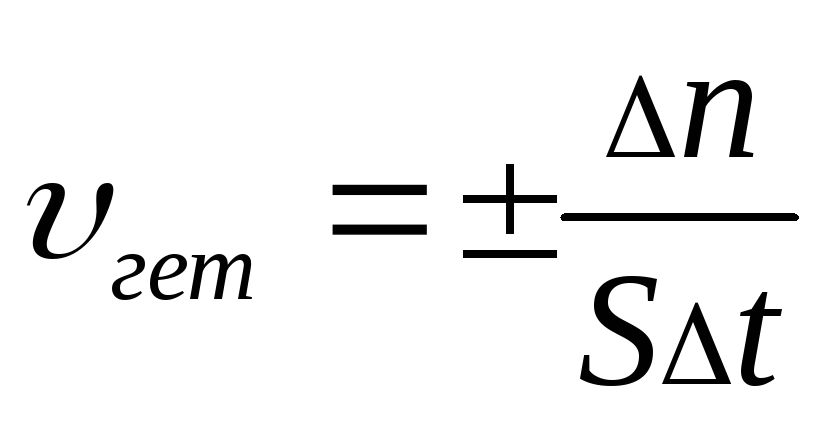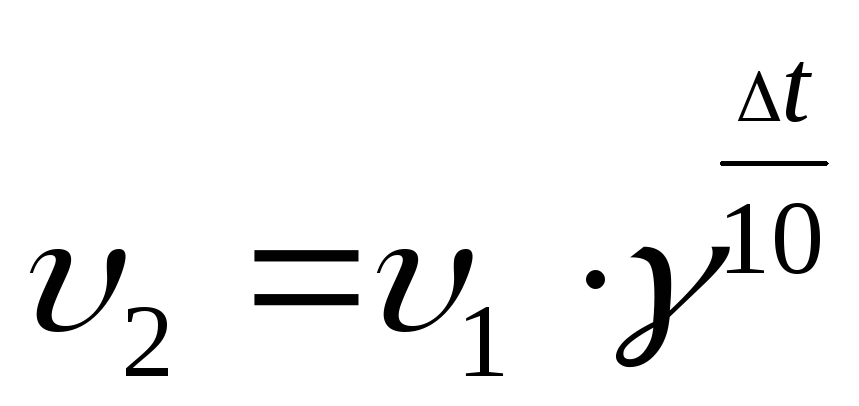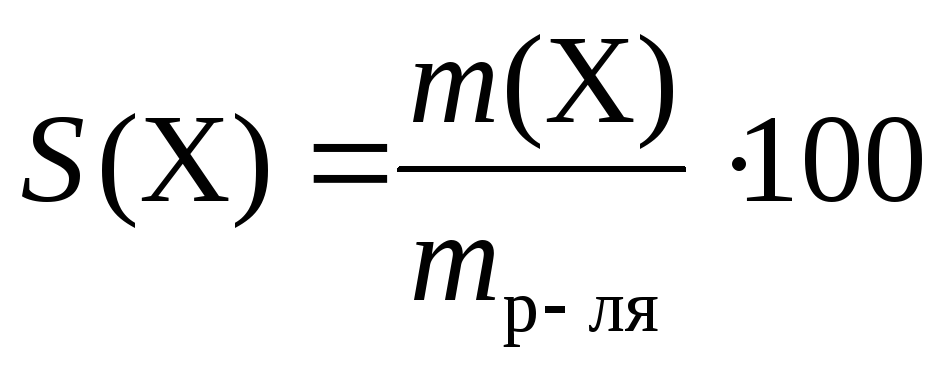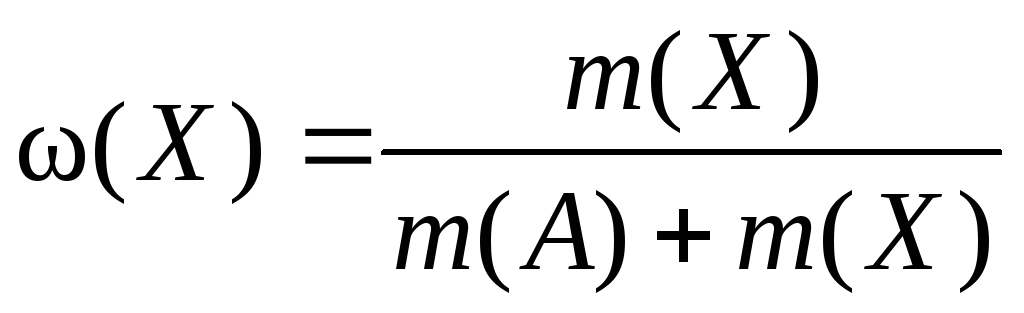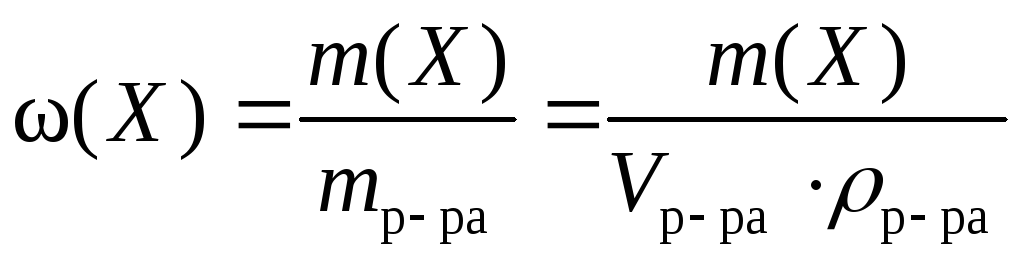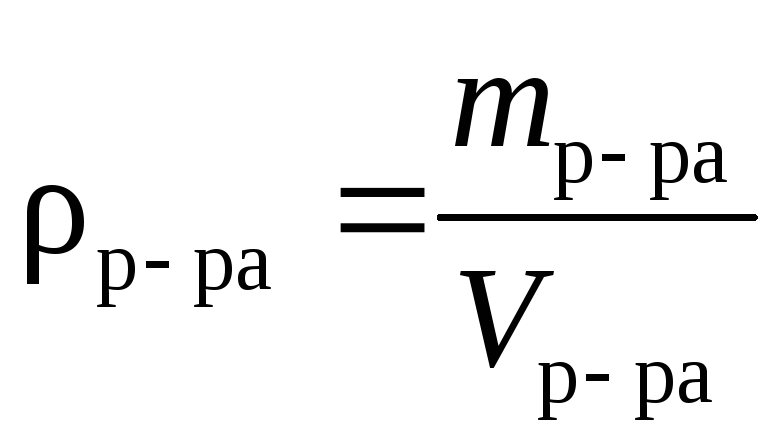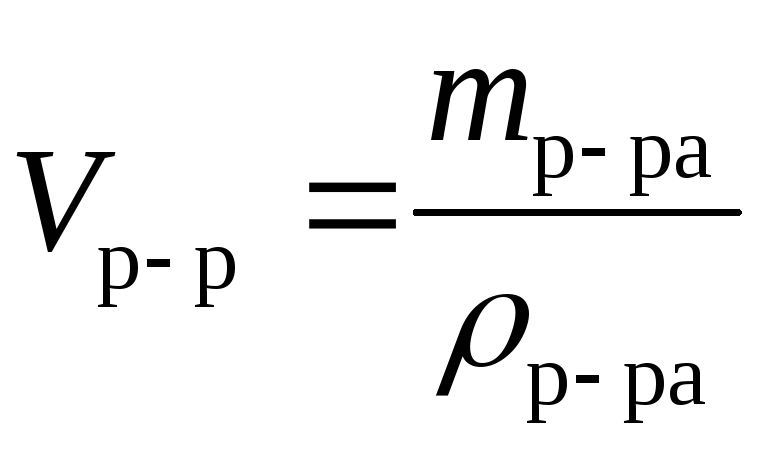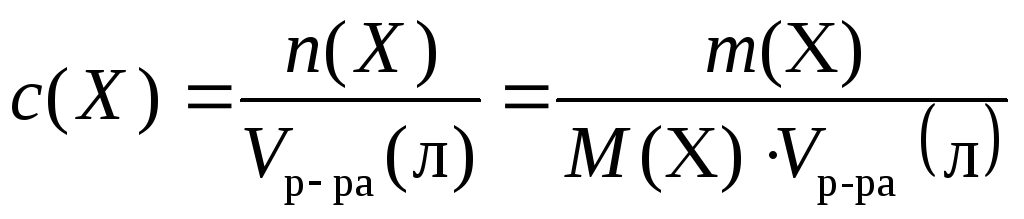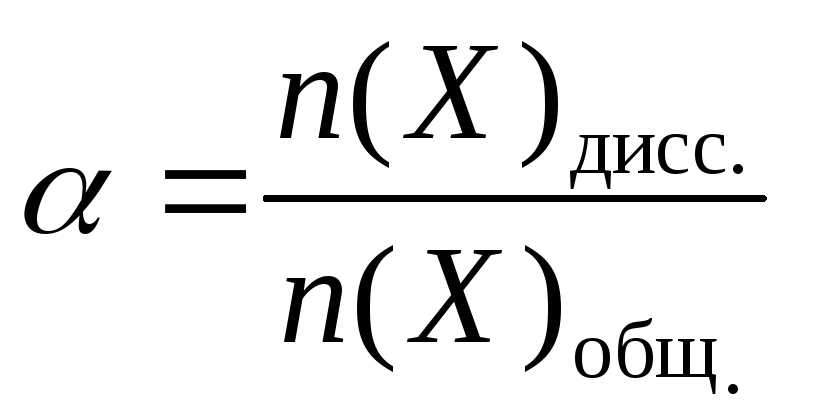Памятка по химии «Формулы для решения задач» (8 класс)
Формулы для решения задач по химии.
1.Вычисление относительной молекулярной массы вещества:
Mr (H2SO4)=Ar(H)∙2+Ar(S)+Ar(O)∙4=98
2.Вычисление массовой доли элемента в веществе:
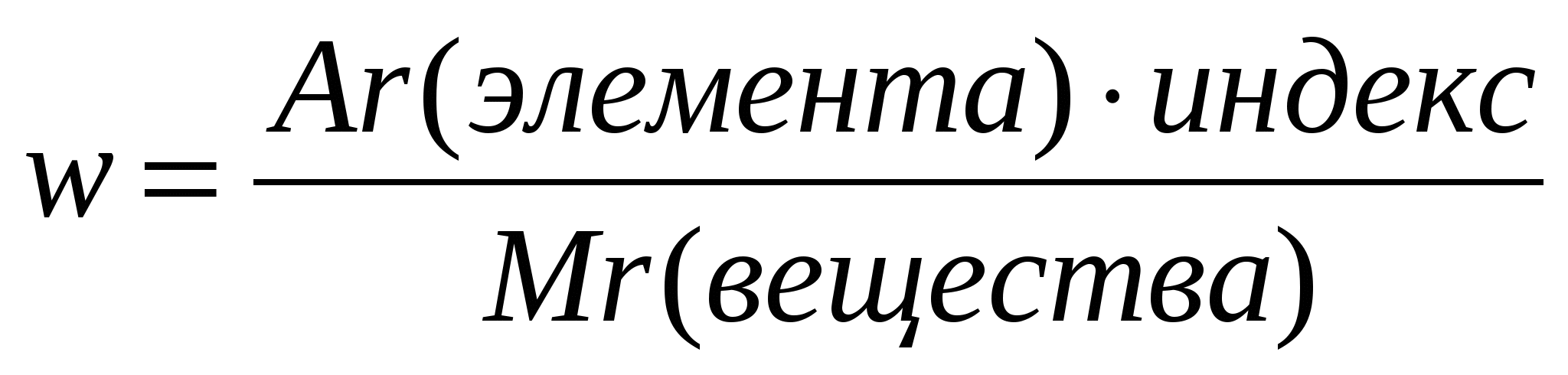
3.Выведение молекулярной формулы вещества:
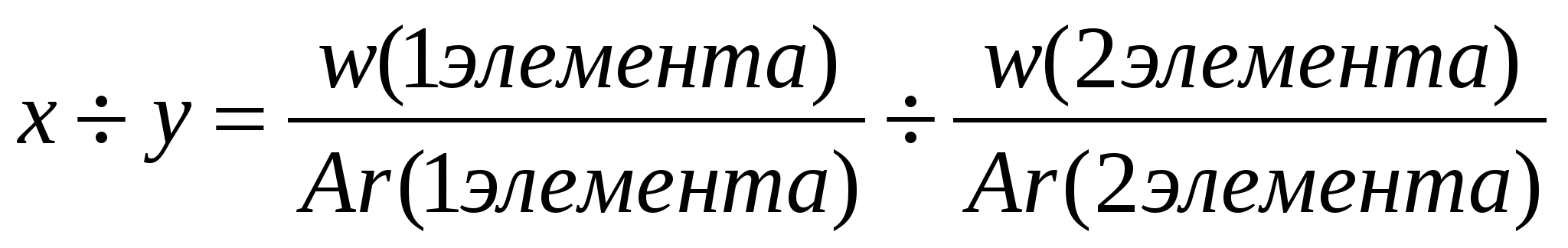
4.Вычисление количества вещества:
а.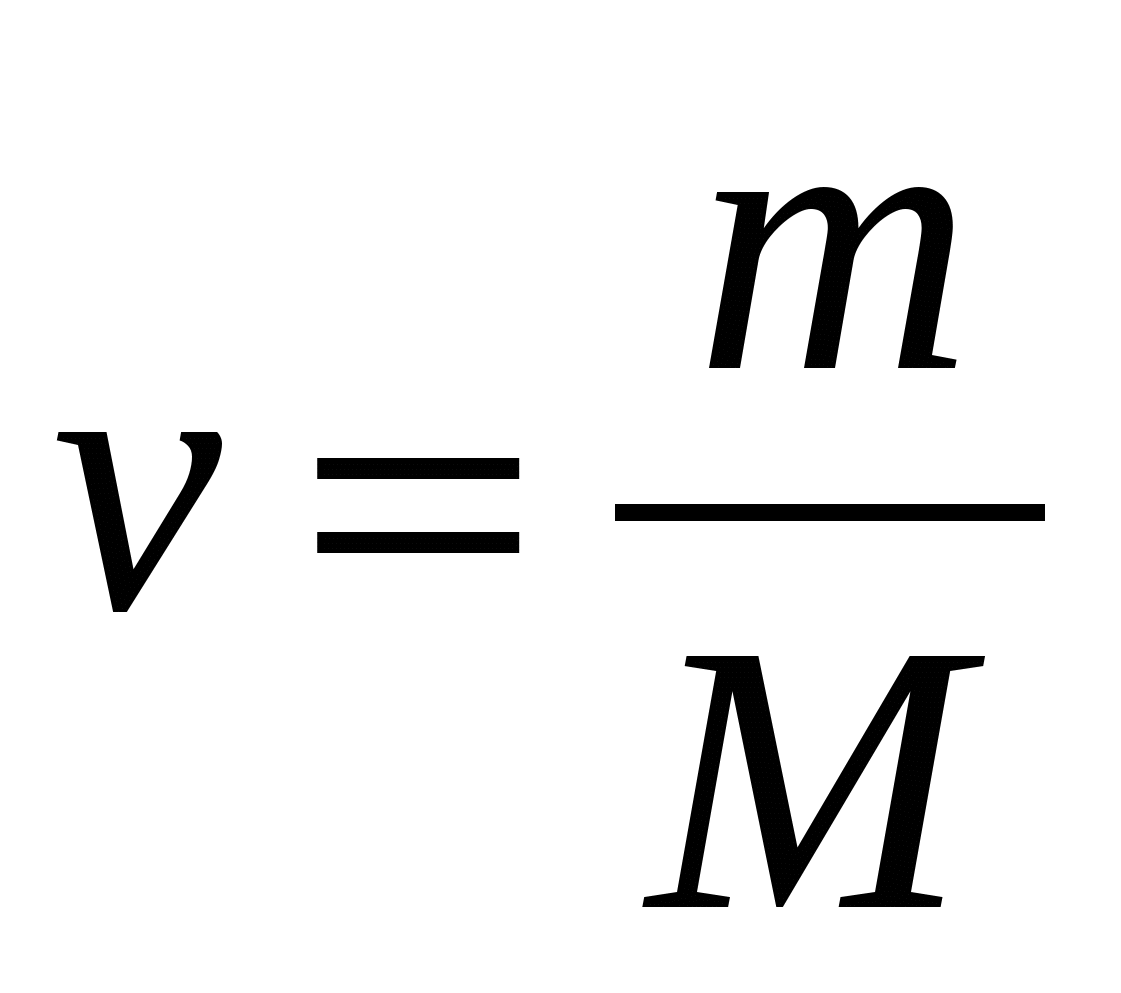
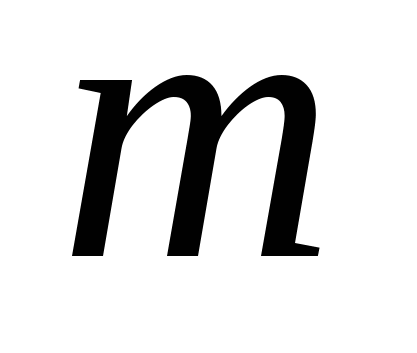
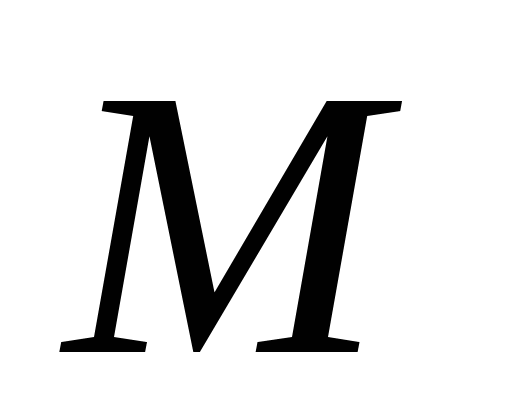 -молярная масса (грамм/моль)
-молярная масса (грамм/моль)
б. только для газообразных веществ при нормальных условиях ( 00 С, 750 мм. рт. ст.)
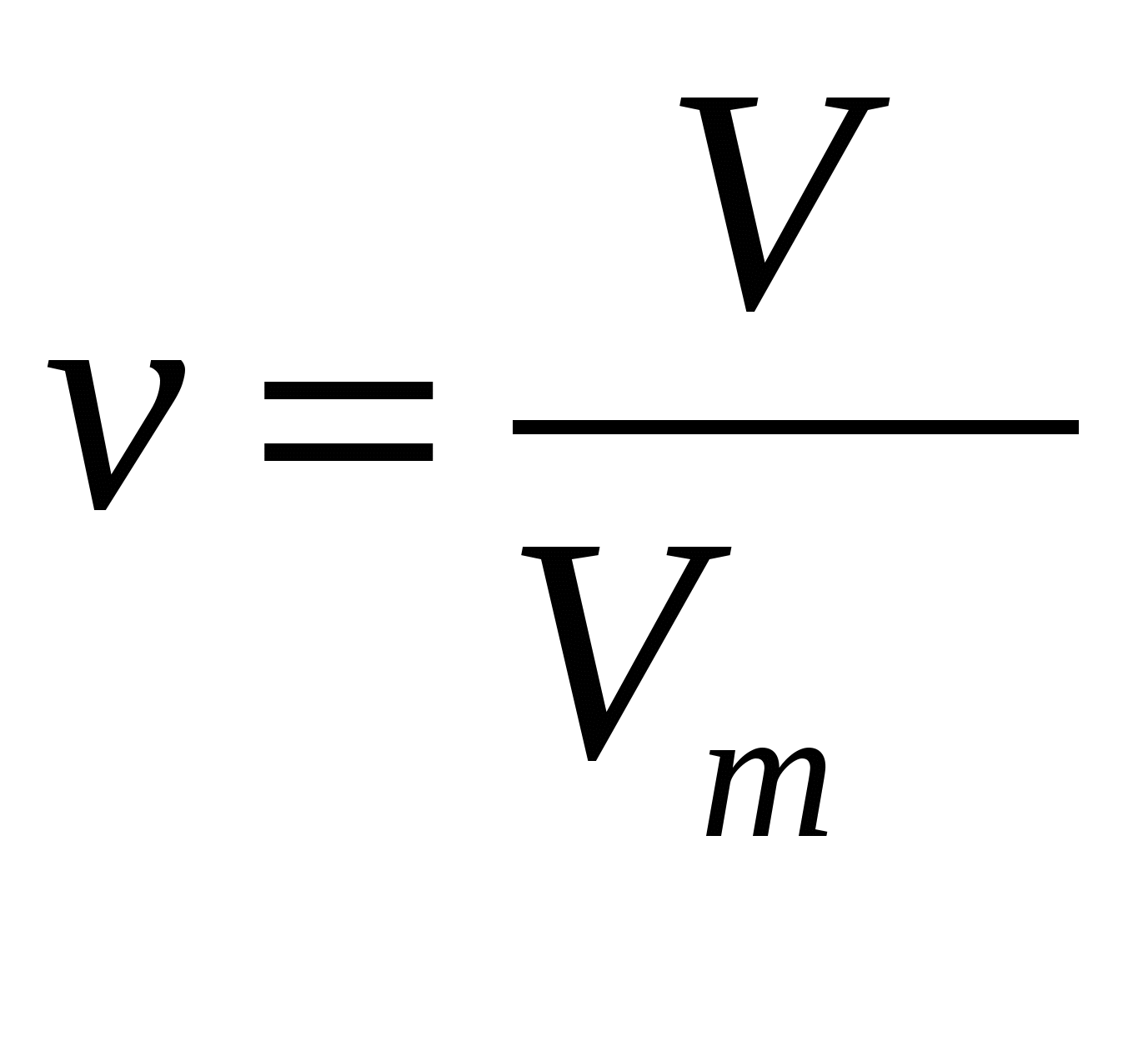
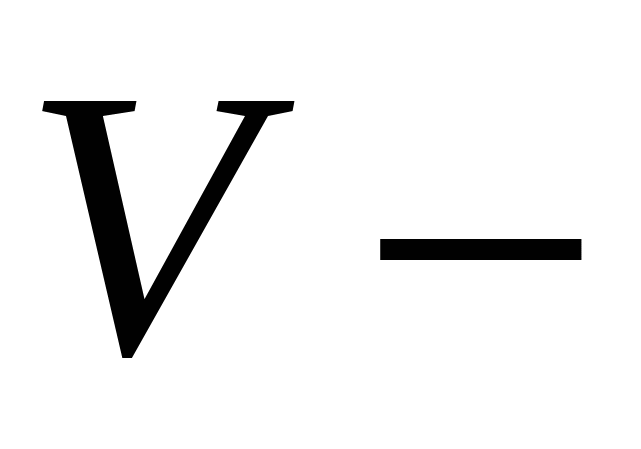 объем (литр)
объем (литр)
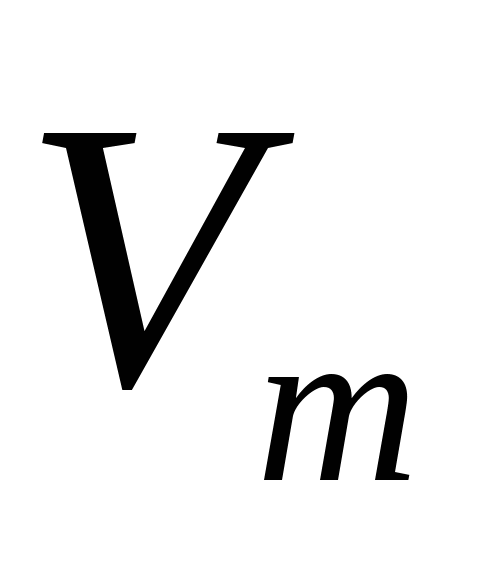 -молярный объем (литр/моль)
-молярный объем (литр/моль)
в. 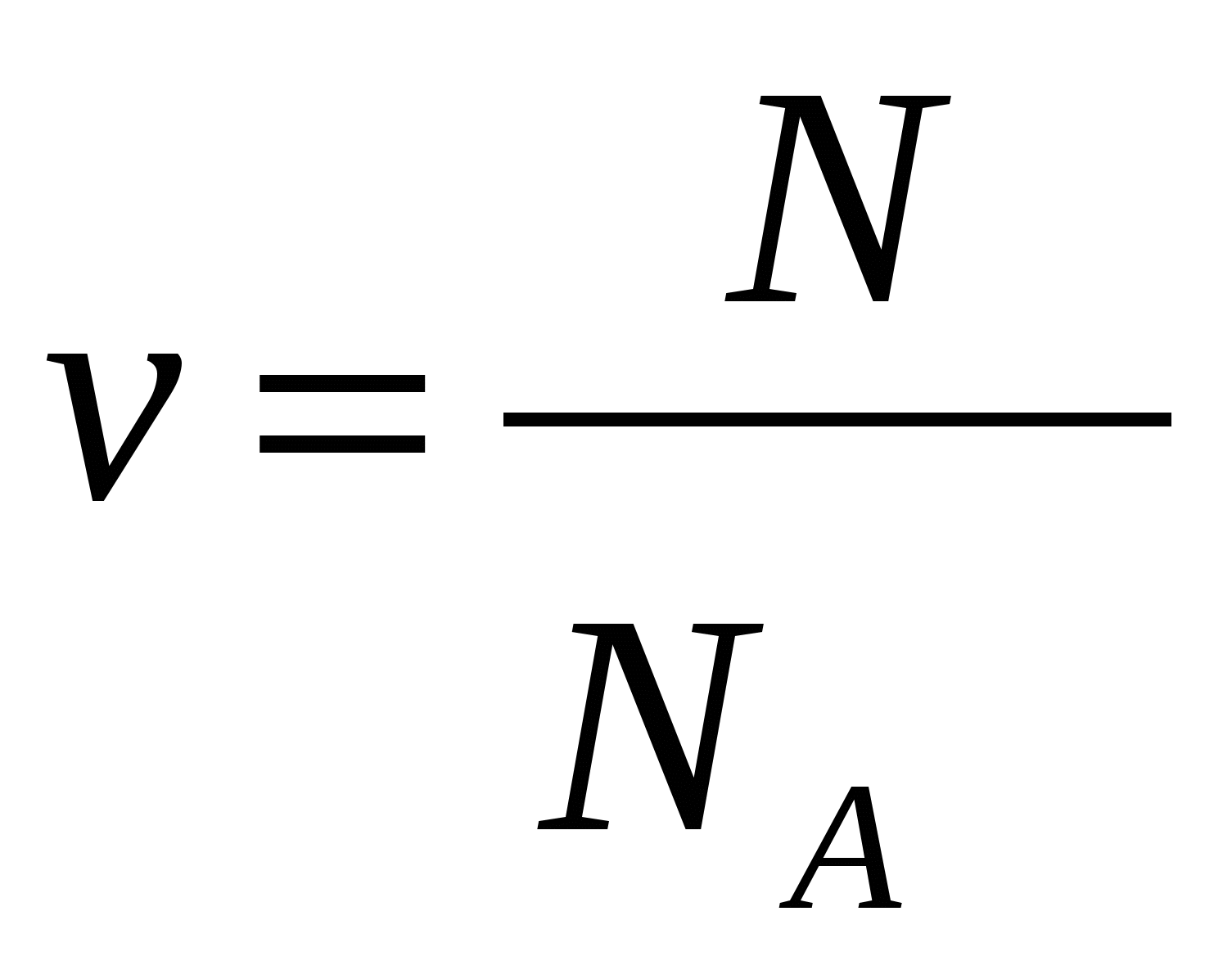
 -число частиц
-число частиц
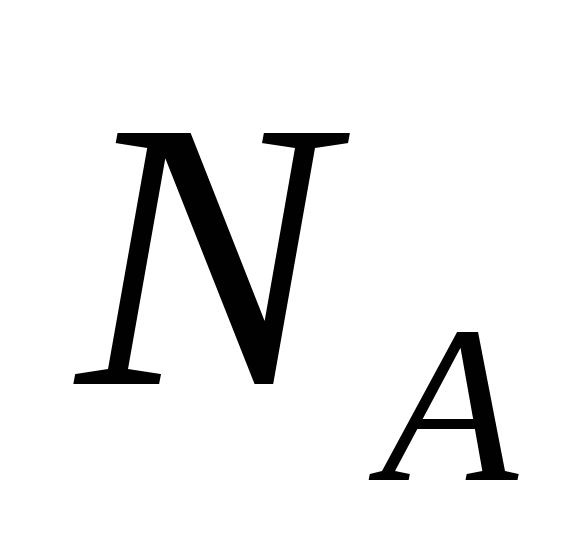 — постоянная Авогадро 6 ∙ 1023
— постоянная Авогадро 6 ∙ 1023
5.Массовая доля растворенного вещества:


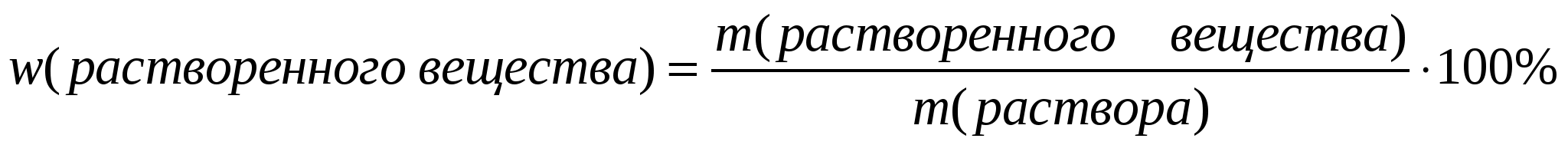
6.Вычисление массы:
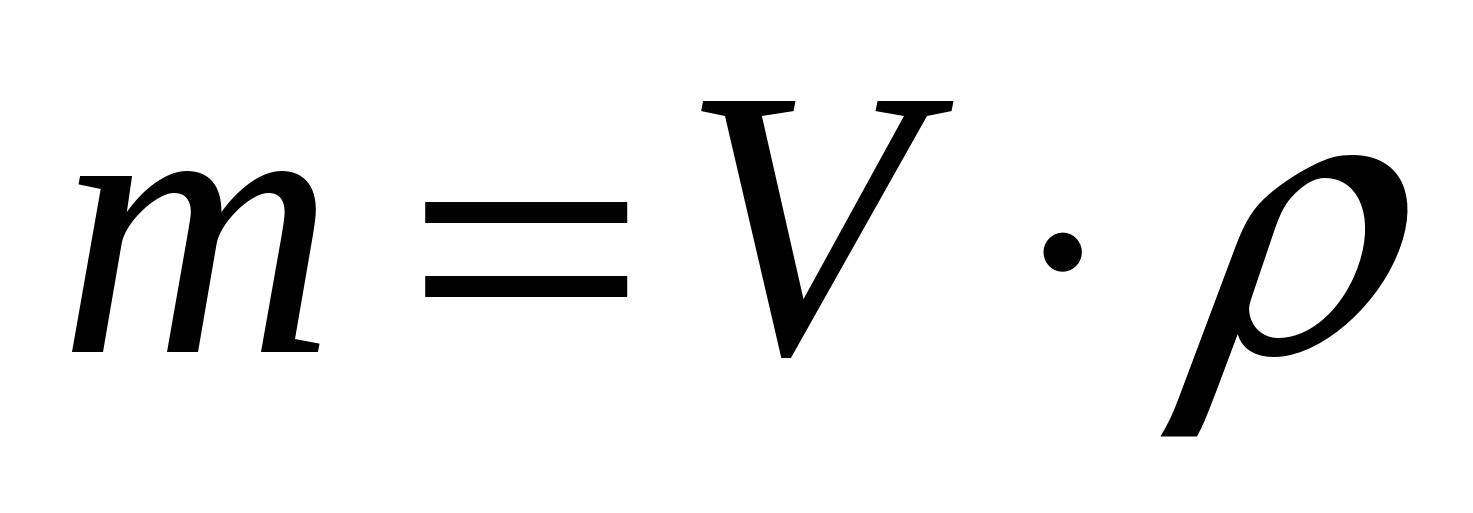
7.Вычисление относительной плотности газов:
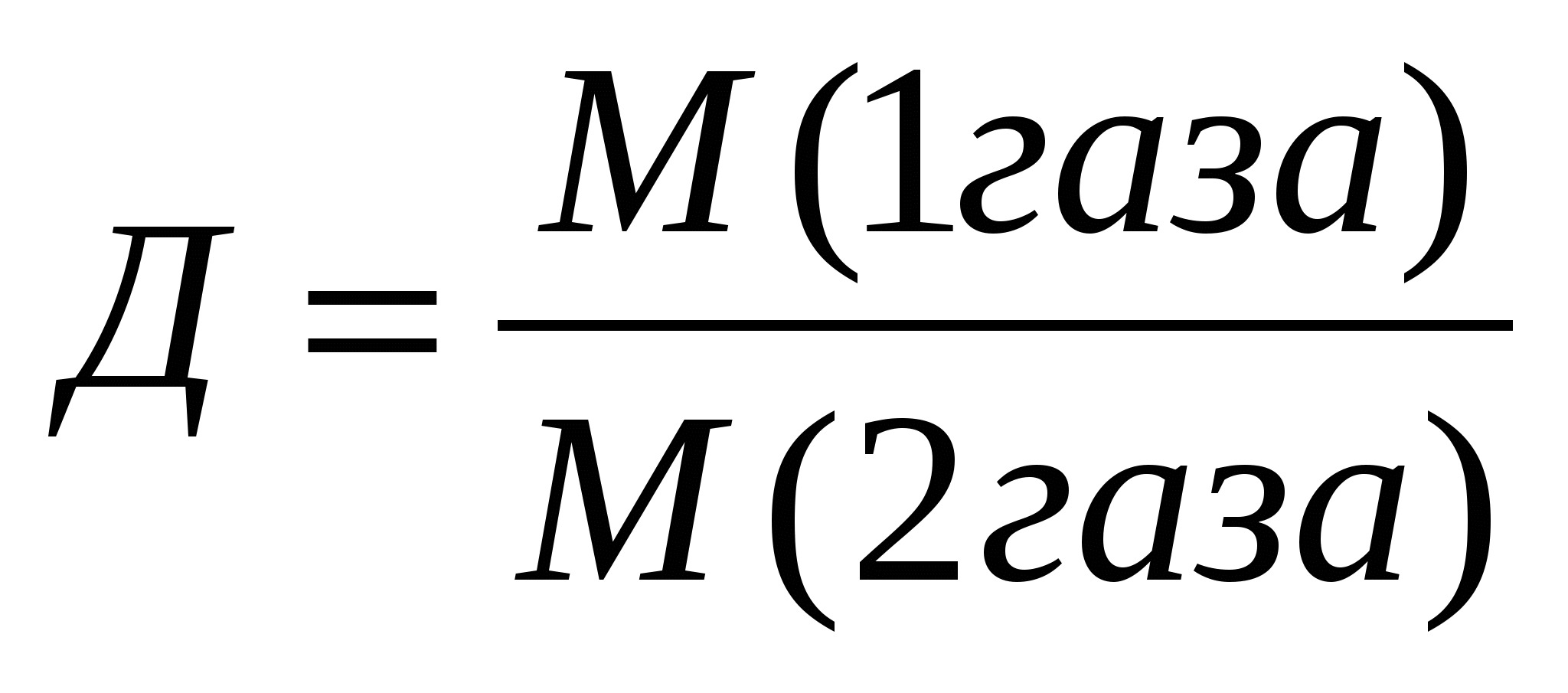
8.Вычисление выхода продукта (%) от теоретически возможного:
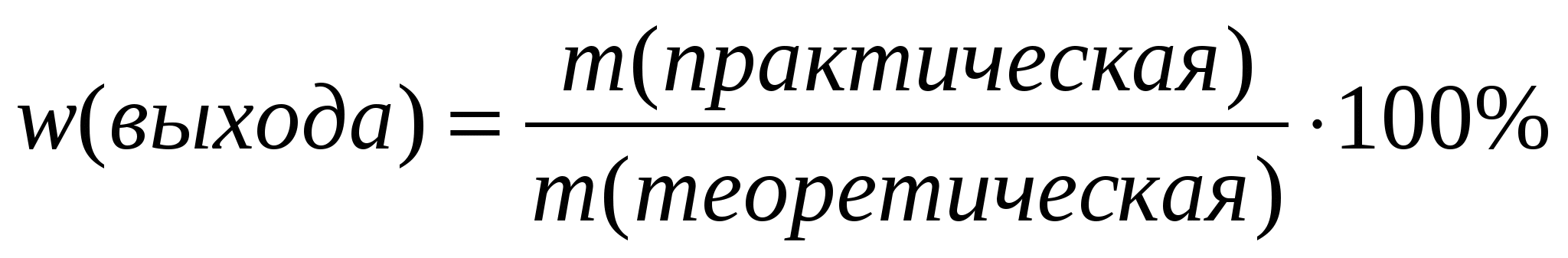
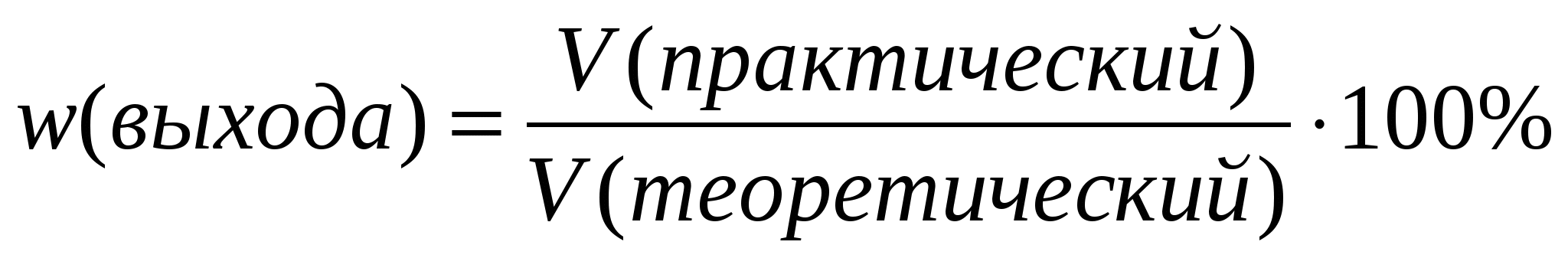
infourok.ru
Формулы для решения задач по химии ЕГЭ 2020 / Блог
Формулы для расчета:
- v — количества моль, моль
- m — масса, г
- M — молярная масса, г/моль
- C — концентрация, моль/л
- N — количество атомов, молекул
- NA — число Авогадро
- V — объем, л
- Vm — молярный объем = 22,4 л/моль
- p — плотность
- D — относительная плотность
Число Авогадро NA
1 моль = 6,02 · 1023 частиц
Закон Авогадро: 1 моль идеального газа при нормальных условиях имеет один и тот же объём Vm = 22,413 996(39) л
Количество вещества n (моль)
n=m/Mr
n=V/22.4 (л/моль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n • 22.4 (л/моль)
Масса
- m = v ⋅ M
- m = N/NA⋅ M
- m = V : Vm⋅ M
- m = C ⋅ M ⋅ V
Количество вещества
- v = m : M
- v = V : Vm
- v = N : NA
Объем
- V = v⋅Vm
- V = m : M ⋅ Vm
- V = m : P
Число частиц
- N0 = m/m0
- N0 = v ⋅ NA
- N0 = m/M ⋅ NA
- N0 = V/Vm⋅ NA
Молярный объем
- Vm = V : v
- Vm = V ⋅ M : m
- Vm = M : p
Молярная масса
Относительная молекулярная масса
- Mr = 2Dh3
- Mr =32DO2
- Mr = 29Dвозд
Решай с ответами:
bingoschool.ru
Научиться решать задачи по химии легко: следуем инструкции
У громоздких формул есть смысл
Задачи по химии делятся на несколько разных видов: на составление уравнения химической реакции, на анализ растворов веществ, на определение массы или плотности. Способы их записи и решения различаются. Многие хотели бы научиться с легкостью читать условные обозначения в химии, и кому-то это покажется недостижимым мастерством. Но все дело как раз в том, что символы и формулы ученые придумали, чтобы как можно удобнее записать свои представления о химических процессах. Поэтому за символами нужно научиться видеть конкретную информацию о веществах и их характеристиках.
Возможно даже нелишним будет узнать, кто, когда и при каких обстоятельствах ввел то или иное обозначение.
Возьмем понятие «количество вещества». Оно очень важно для решения расчетных задач по уравнениям химических реакций. Эту особую единицу измерения не нужно путать с массой. Под ней понимают количество структурных элементов (атомов, молекул или ионов). Никогда не говорят: «здесь количество вещества 4 молекулы», потому что измеряют его в молях. В международной системе единиц СИ количество вещества принято обозначать буквой
Проверяем свою готовность к задаче
Прежде чем приступать к решению задач, нужно быть уверенным, что ты выучил основные термины. Кроме уже рассмотренного количества вещества, нужно знать, что такое масса, молярная масса, постоянная Авогадро, массовая доля, выход продукта, стехиометрический коэффициент, и так далее.
Знать Таблицу химических элементов — это почти то же самое, что и выучить таблицу умножения в математике и склонения в русском языке. Нет, зубрить список элементов не нужно, потому что таблица всегда может быть перед глазами, даже на ОГЭ и ЕГЭ. Но нужно уметь с ней работать, знать общие принципы построения этой таблицы. А затем станет ясно, как структура таблицы и свойства элементов зависят друг от друга. Например, в таблице Менделеева содержится такая важная справочная информация, как атомная масса элементов. Обратите внимание: знание атомной массы элементов нам пригодится для решения задачи, приведенной ниже!
Самые важные формулы, которые нужно запомнить:
- Формула расчета массовой доли в растворе (ω) очень простая и содержится уже в самом определении. Массовая доля — это отношение массы (m) растворенного вещества к общей массе раствора. Если требуется ответ в процентах, то тогда так:
- Масса вещества это произведение количества вещества на молярную массу.
- Формула объема газа при нормальных условиях.
- Формула плотности
Из этих формул можно вывести другие формулы. Ниже мы для примера определим массу растворенного вещества исходя из массовой доли.
Теперь можно приступать
Когда ты удостоверился, что азы усвоены, можно решать задачи на растворы, смеси и все остальные. Решение задачи выстраивается пошагово. Например, определим массу гидроксида натрия, необходимого для полной нейтрализации 1000 г 49% раствора серной кислоты.
- Пишем условие в следующем виде:
ω(h3SO4) = 49%
m(NaOH) = ?
- Какую формулу для чего использовать.
m(h3SO4) = m р-ра * ω(h3SO4)/100% = 1000 г * 49%/100% = 490 г
Как масса серной кислоты поможет найти массу гидроксида натрия? Если посмотреть на формулу поиска массы, то ответ очевиден. Нужно найти количество вещества гидроксида натрия, которое можно узнать по уравнению реакции нейтрализации.
- Используем уравнение реакции
x моль
2NaOH + h3SO4 = Na2SO4 + 2h3O
2 моль 1 моль
Количество вещества серной кислоты мы можем узнать, так как уже выяснили ее массу, а молярная масса легко вычисляется как сумма атомных масс, входящих в состав молекулы.
x моль 5 моль 2NaOH + h3SO4 = Na2SO4 + 2h3O
2 моль 1 моль
Зная по уравнению реакции, что количества вещества гидроксида натрия в два раза больше, чем у серной кислоты, мы вывели значение n(NaOH) = 10 моль.
Осталось только найти массу вещества NaOH.
m(NaOH) = 10 моль * 40г/моль = 400г.
Это и есть ответ.
Иногда в ходе работы с задачами придется возвращаться к учебнику и повторять пройденный материал. В этом нет ничего страшного, рано или поздно знания закрепятся. Рекомендуем использовать приложение “ХиШник”, в котором решение задач сопровождается решениями и подсказками. Записывать решения и уравнения реакций удобнее сначала в специальном редакторе, который снабжен всплывающими подсказками. После тренировки в “ХиШнике” обязательно получится решать задачи вручную и без подсказок. Так или иначе, полученные теоретические знания обязательно закрепятся на практике, и решать задачи по химии будет легко и интересно.
Теперь вы знаете, что научиться решать задачи по химии несложно: достаточно просто следовать инструкциям.
hishnik-school.ru
Основные формулы для решения задач
Величина и ее размерность | Соотношение |
Атомная масса элемента Х (относительная) | 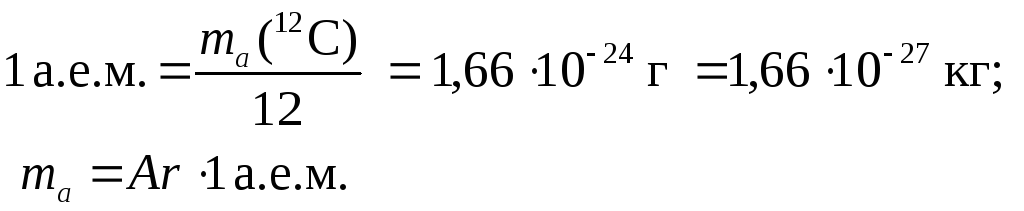 |
Порядковый номер элемента | Z = N(е–) = N(р+) |
Массовая доля элемента Э в веществе Х, в долях единицы, в %) | |
Количество вещества Х, моль | |
Количество вещества газа, моль | н.у. – р = 101 325 Па, Т = 273 К |
Молярная масса вещества Х, г/моль, кг/моль | |
Масса вещества X, г, кг | m(X) = n(X)M(X) |
Молярный объем газа, л/моль, м3/моль | Vm = 22,4 л/моль при н.у. |
Объем газа, м3 | V = Vm×n |
Выход продукта | |
Плотность вещества Х, г/л, г/мл, кг/м3 | |
Плотность газообразного вещества Х по водороду | |
Плотность газообразного вещества Х по воздуху | М(воздуха) = 29 г/моль |
Объединенный газовый закон | |
Уравнение Менделеева-Клапейрона | PV = nRT, R = 8,314 Дж/моль×К |
Объемная доля газообразного вещества в смеси газов, в долях единицы или в % | |
Молярная масса смеси газов | |
Молярная доля вещества (Х) в смеси | |
Количество теплоты, Дж, кДж | Q = n(X)Q(X) |
Тепловой эффект реакции | Q =–H |
Теплота образования вещества Х, Дж/моль, кДж/моль | |
Скорость химической реакции (моль/лсек) | |
Закон действия масс (для простой реакции) | aA + вB = сС + dD u = kс a(A)с в(B) |
Правило Вант-Гоффа | |
Растворимость вещества (Х) (г/100 г растворителя) | |
Массовая доля вещества Х в смеси А + Х, в долях единицы, в % | |
Масса раствора, г, кг | m(р-р) = m(X) + m(H2O) m(р-р) = V(р-р)(р-р) |
Массовая доля растворенного вещества в растворе, в долях единицы, в % | |
Плотность раствора | |
Объем раствора, см3, л, м3 | |
Молярная концентрация, моль/л | |
Степень диссоциации электролита (Х), в долях единицы или % | |
Ионное произведение воды | K(H2O) = [H+][OH–] |
Водородный показатель | рН = –lg[H+] |
Рекомендуемая литература
Основная:
Кузнецова Н.Е. и др. Химия. 8 кл-10 кл.. – М.: Вентана-Граф, 2005-2007.
Кузнецова Н.Е., Литвинова Т.Н., Левкин А.Н. Химия.11 класс в 2-х частях, 2005-2007 гг.
Егоров А.С. Химия. Новое учебное пособие для подготовки в вузы. Ростов н/Д: Феникс, 2004.– 640 с.
Егоров а.С. Химия: современный курс для подготовки к егэ. Ростов н/д: Феникс, 2011. (2012)– 699 с.
Егоров А.С. Самоучитель по решению химических задач. – Ростов-на-Дону: Феникс, 2000.– 352 с.
Химия/пособие-репетитор для поступающих в вузы. Ростов-н/Д, Феникс, 2005– 536 с.
Хомченко Г.П.,Хомченко И.Г. Задачи по химии для поступающих в вузы. М.: Высшая школа. 2007.–302с.
Дополнительная:
Врублевский А.И. Учебно-тренировочные материалы для подготовки к централизованному тестированию по химии/ А.И. Врублевский –Мн.: ООО «Юнипресс», 2004.– 368 с.
Врублевский А.И. 1000 задач по химии с цепочками превращений и контрольными тестами для школьников и абитуриентов.– Мн.: ООО «Юнипресс», 2003.– 400 с.
Егоров А.С. Все типы расчетных задач по химии для подготовки к ЕГЭ.–Ростов н/Д: Феникс, 2003.–320с.
Егоров А.С., Аминова Г.Х. Типовые задания и упражнения для подготовки к экзамену по химии. – Ростов н/Д: Феникс, 2005.– 448 с.
Единый государственный экзамен 2007. Химия. Учебно-тренировочные материалы для подготовки учащихся/ФИПИ – М.: Интеллект-Центр, 2007.– 272 с.
ЕГЭ-2011. Химия. Учебно-тренировочный комплект под ред. А.А. Кавериной.– М.: Национальное образование, 2011.
Единственные реальные варианты заданий для подготовки к единому государственному экзамену. ЕГЭ.2007. Химия/В.Ю. Мишина, Е.Н. Стрельникова. М.: Федеральный центр тестирования, 2007.–151с.
Каверина А.А. Оптимальный банк заданий для подготовки учащихся. Единый государственный экзамен 2012.Химия. Учебное пособие./ А.А. Каверина, Д.Ю. Добротин, Ю.Н. Медведев, М.Г. Снастина.– М.: Интеллект-Центр, 2012.– 256 с.
Литвинова Т.Н., Выскубова Н.К., Ажипа Л.Т., Соловьева М.В. Тестовые задания в дополнение к контрольным работам для слушателей 10-месячных заочных подготовительных курсов (методические указания). Краснодар, 2004. – С. 18 – 70.
Литвинова Т.Н. Химия. ЕГЭ-2011. Тренировочные тесты. Ростов н/Д: Феникс, 2011.– 349 с.
Литвинова Т.Н. Химия. Тесты к ЕГЭ. Ростов н/Д.: Феникс, 2012. — 284 с.
Литвинова Т.Н. Химия. Законы, свойства элементов и их соединений. Ростов н/Д.: Феникс, 2012. — 156 с.
Литвинова Т.Н., Мельникова Е.Д., Соловьева М.В., Ажипа Л.Т., Выскубова Н.К. Химия в задачах для поступающих в вузы.– М.: ООО «Изд-во Оникс»: ООО «Изд-во «Мир и образование», 2009.– 832 с.
Учебно-методический комплекс по химии для учащихся медико-биологических классов под ред. Т.Н.Литвиновой.– Краснодар.: КГМУ, – 2008.
Химия. ЕГЭ–2008. Вступительные испытания, учебно-методическое пособие / под ред. В.Н. Доронькина. – Ростов н/Д: Легион, 2008.– 271 с
Список сайтов по химии:
1. Alhimik. http://www.alhimik.ru
2. Химия для всех. Электронный справочник за полный курс химии.
http://www.informika.ru/text/database/chemy/START.html
3. Школьная химия – справочник. http://www.schoolchemistry.by.ru
4. Репетитор по химии. http://www. chemistry.nm.ru
Интернет-ресурсы
Alhimik. http://www.alhimik.ru
Химия для всех. Электронный справочник за полный курс химии.
http://www.informika.ru/text/database/chemy/START.html
Школьная химия – справочник. http://www.schoolchemistry.by.ru
http://www.classchem.narod.ru
Репетитор по химии. http://www. chemistry.nm.ru
http://www.alleng.ru/edu/chem.htm — образовательные ресурсы Интернета по химии
http://schoolchemistry.by.ru/ — школьная химия. На этом сайте есть возможность пройти On-line тестирование по разным темам, а также демонстрационные варианты Единого Государственного Экзамена
Химия и жизнь–ХХ1 век: научно-популярный журнал. http://www.hij.ru
studfile.net
Типовые задачи по химии за курс 8 класса
Решение типовых задач
Моль. Молярная масса
Задача 1.
Определите кол-во в-ва атомного кислорода в оксиде меди (II) массой 159 г.
Ответ: 2моль
Задача 2.
Вычислите, какое кол-во в-ва карбоната кальция заключается в 80 г карбоната кальция.
Ответ: 0,8 моль
Задача 3.
Определите массу 3 моль нитрата кальция
Ответ: 492 г.
Задача 4.
Относительная атомная масса ртути равна 201. Определите массу одного атома ртути в граммах
Ответ: г.
Задача 5.
Вычислите, сколько молекул содержится в 34 г аммиака? Какова масса одной молекулы.
Ответ:
Химические формулы и расчеты по ним
Задача 1.
Напишите формулы соединений с водородом следующих элементов: азота, кремния, серы, брома
Задача 2.
Напишите формулы соединений с кислородом следующих элементов: Серебра(1), магния(2), фосфора(5), кремния(4), алюминия(3), марганца(7), серы(6), осмия(8)
Задача 3.
Рассчитайте массовую долю и в процентах по массе каждого элемента в сульфате аммония.
Задача 4.
Какая масса кальция потребуется для получения 148 г гидроксида кальция?
Задача 5.
Определите массовую долю кристаллизационной воды в медном купоросе?
Нахождение формулы вещества по результатам анализа
Задача 1.
Массовая доля серы в оксиде равна 40%. Определите формулу оксида.
Задача 2.
Состав оксида элемента выражается простейшей формулой ЭО2. Известно, что для получения оксида массой 22,2 г потребовался элемент массой 15,8 г. Какой элемент образует оксид?
Задача 3.
Вещество содержит 7,7% водорода и 92,3% углерода. Определите формулу этого в-ва, если его молярная масса составляет 26г/моль
Газовые законы. Молярный объем газа
Задача 1.
Какую массу будет иметь N2 объемом 60 л при н.у.?
Задача 2.
Определим массу и объем, занимаемый при н.у. молекулами кислорода
Задача 3.
Какой объем занимает при н.у. углекислый газ массой 22 г?
Задача 4.
Какой объем займет при температуре 20 и давлении 25 кПа аммиак массой 51 г.
Задача 5.
Относительная плотность галогеноводорода по воздуху равна 1,26. Определите плотность этого газа по водороду и назовите его
Задача 6.
Плотность газа по водороду 16. Определите плотность газа по воздуху
Задача 7.
Давление водяного пара при 25 составляет 3173 Па. Сколько молекул содержится в 1 мл этого пара?
Расчеты по химическим уравнениям
Задача 1.
Сколько граммов воды образуется при а) 10 г окиси мели б) 10 г CuO
Задача 2.
Определите массу брома, которая потребуется для получения бромида алюминия массой 53,4 г.
Задача 3.
Рассчитайте объем водорода, который выделится при растворении цинка массой 6,5 г в избытке соляной кислоты (н.у.)
Задача 4.
Вычислите объем оксида серы (6), который надо взять для реакции с кислородом, чтобы получить оксид серы (6) массой 20 г. Массовая доля выхода продукта равна 80%. Объем рассчитайте при н.у.
Задача 5.
Смесь медных и магниевых опилок массой 4,5 г обработали раствором соляной кислоты. В результате реакции выделился водород объемом 1,68 л (н.у.) Вычислите массовую долю меди в смеси.
Задача 6.
К раствору, содержащему 43,6 г нитрата серебра пропустили хлороводород объемом 5л. Выпавший осадок отделили, высушили и взвесили, его масса составила 29 г. Определите выход соли, выпавшей в осадок.
Задача 7.
К раствору, содержащему хлорид бария массой 41,6 г, прилили раствор, содержащий 35 г сульфата натрия. Рассчитайте массу полученного осадка.
infourok.ru
Конспект «Решение 25 типовых задач по химии (8-11кл)»
Решение 25 типовых задач по химии (8-11 классы)
Ключевые слова: решение 25 типовых задач по химии, определение массы, доли, числа,
1 Определение относительной молекулярной массы Мг
Задача Какова относительная молекулярная масса Мг нитробензола С6Н5NO2? Какова молекулярная масса этого вещества в а.е.м.?

2 Определение массовой доли элемента в соединении
Задача Какова масса в граммах 1 атома 131I ?

3 Определение числа молекул в порции вещества
Задача Сколько молекул воды содержится в 1 капле воды массой 0,03 г?

4 Определение массы атома в граммах
Задача Какова массовая доля фосфора в фосфате кальция Са3(РO4)2 ?

Ответ: ω = 0.2 или 20%
5 Определение молярной массы
Задача Какова молярная масса вещества, если масса 2.5 моль этого вещества равна 250 г?

6 Определение массового отношения элементов в соединении
Задача Каково массовое отношение углерода, водорода и кислорода в глюкозе С6Н1206 ?

7 Определение объема, который занимает порция газа при н.у.
Задача Какой объем (н.у.) занимают 66 г С02?

8 Определение теплового эффекта реакции
Задача Молярная теплота сгорания угля на воздухе 393.5 кДж/моль. Сколько теплоты выделится при полном сгорании 1 кг угля?

9 Определение максимального выхода продукта реакции
Задача Сколько максимально литров (н.у.) водорода можно получить, используя 45.5 г цинка и избыток соляной кислоты?

10 Определение реального выхода продукта реакции
Задача При прокаливании 15,8 г перманганата калия КМnО4 получено 0,896 л (н.у.) кислорода. Каков выход кислорода в данном случае?

11 Определение выхода продукта по стехиометрическим соотношениям
Задача Сколько граммов азотной кислоты HNO3 максимально можно получить из 44.8 л (н.у.) азота?

12 Определение содержания основного компонента (или содержания примеси) в исходном веществе
Задача Каково содержание (в процентах) СаСО3 в образце известняка, при длительном прокаливании 400 г которого получено 78,4 л С02 (н.у.)?

13 Определение выхода реакции, когда одно из исходных веществ взято в избытке
Задача Сколько граммов поваренной соли NaCI можно получить, если смешать два раствора, один из которых содержит 29,2 г HCI, а другой 44 г NaOH?

14 Определение состава газовой смеси (в объемных процентах)
Задача 20 л (н.у.) аммиака пропустили через нагретую до 350°С трубку с железным катализатором. Объем полученной газовой смеси (н.у.) равен 25 л. Каков состав полученной газовой смеси (в объемных процентах) ?

15 Определение объема газа, расходуемого на проведение реакции с другими газами
Задача Какой минимальный объем кислорода, содержащего 10 объемн. % озона, необходим для полного сжигания 4 л пропана С3Н8 ?

16 Определение молекулярной формулы вещества по относительной плотности его паров
Задача Относительная плотность паров углеводорода по воздуху 2,69. Массовая доля водорода в соединении 7,69%. Какова молекулярная формула углеводорода?

17 Определение состава газовой смеси
Задача Относительная плотность 30 л смеси метана СН4 и азота N2 по гелию равна 5. Сколько литров метана и азота взято для приготовления смеси?

18 Определение состава солей в растворе
Задача В растворе смешали 9,8 г H2S04 и 6,5 г NaOH. Какие соли и в каких количествах образовались?

19 Приготовление раствора с заданной массовой долей растворенного вещества
Задача Сколько граммов сахарозы надо растворить в 250 г воды, чтобы получить раствор с массовой долей сахарозы 0,3 (30%)?

20 Приготовление раствора с заданной массовой долей растворенного вещества
Задача : Сколько граммов медного купороса CuS04 • 5Н20 надо добавить к 300 г 2%-го раствора сульфата меди, чтобы получить 5%-ный раствор ?

21 Приготовление раствора с заданной массовой долей растворенного вещества
Задача Сколько миллилитров воды нужно добавить к 100 мл 30%-го раствора соляной кислоты с плотностью 1,15 г/мл, чтобы получить раствор с массовой долей НCl 5%?

22 Приготовление раствора с заданной массовой долей растворенного вещества
Задача Сколько граммов ВаО надо добавить к 100 г воды, чтобы получить 5%-ный раствор?

23 Приготовление раствора с заданной молярной концентрацией
Задача Сколько граммов сульфата натрия Na2S04* 10Н20 необходимо для приготовления 0,5 л раствора с молярной концентрацией 0,02 моль/л?

24 Определение формулы органического вещества по данным о массе продуктов реакции
Задача При полном сгорании 6,0 г органического вещества получено 8,8 г С02 и 3.6 г воды. Плотность паров органического вещества по водороду равна 30. Какова молекулярная формула вещества?

25 Определение молекулярной формулы органического вещества по данным о продукте реакции
Задача При обработке 14,8 г одноосновной карбоновой кислоты избытком цинка получено 2,24 л водорода. Какова молекулярная формула кислоты?

Автор задач: С.С.Бердоносов
Решение 25 типовых задач по химии. Выберите дальнейшие действия:
uchitel.pro
Формулы по химии 8-9 класс
Соотношение некоторых физико-химических величин и их единиц
Величина, её обозначение
Единицы величины
Основная
В 1000 раз большая
В 1000 раз меньшая
Масса, m
г
кг
мг
Количество вещества, n
моль
кмоль
ммоль
Молярная масса, M
г/моль
кг/кмоль
мг/ммоль
M=Mr
Число частиц, N
Молекул, атомов, ионов
Число молекул в единице количества вещества – постоянная Авагадро, NA
6▪1023(в 1 моль) молекул/моль
6▪1026 (в 1 моль) молекул/кмоль
6▪1020 (в 1 моль) молекул/ммоль
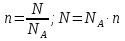
Объём газа, V
л (дм3)
м3
мл (мм3)
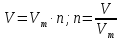
Молярный объём газа, Vm
л/моль (22,4 л/моль при н.у.)
м3/кмоль (22,4 м3/кмоль при н.у.)
мл/ммоль (22,4 мл/ммоль при н.у.)
Массовая доля, ω
Объёмная доля, φ
Массовая доля Элемента, ω (Э)
Выражают в долях и %
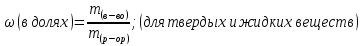
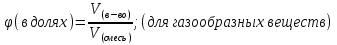
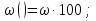
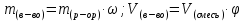
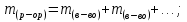
ω (Э, в долях) = 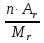 ; n – число атомов, Аr – атомная масса, Mr – молекулярная масса
; n – число атомов, Аr – атомная масса, Mr – молекулярная масса
Выход продукта реакции от теоретически возможного, W
W = Vпракт : Vтеор, Vпракт = W ▪ Vтеор
W = mпракт : mтеор, mпракт = W ▪ mтеор
infourok.ru
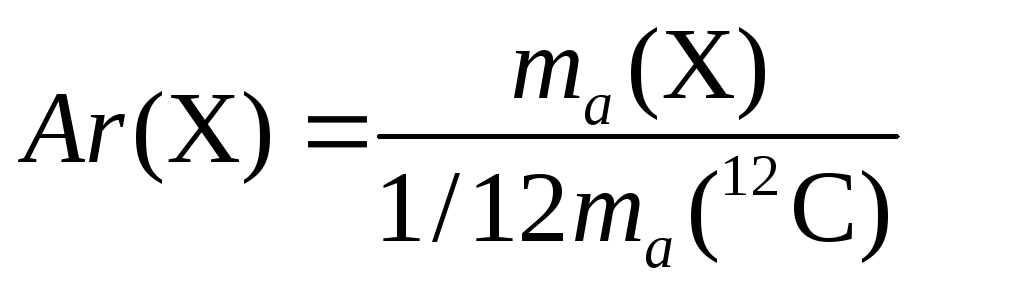
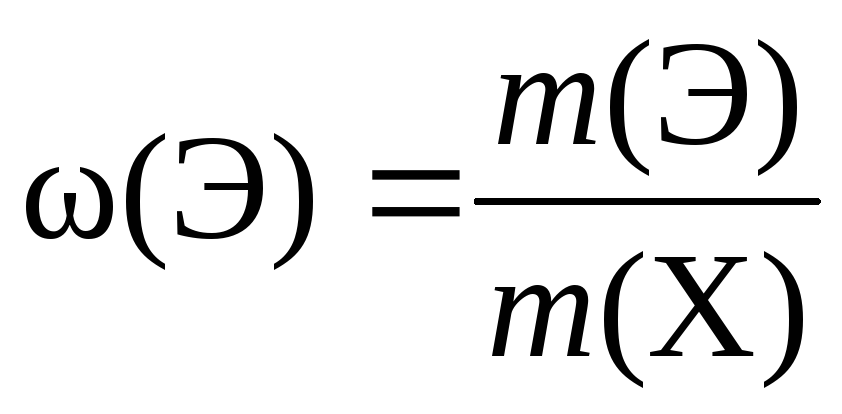
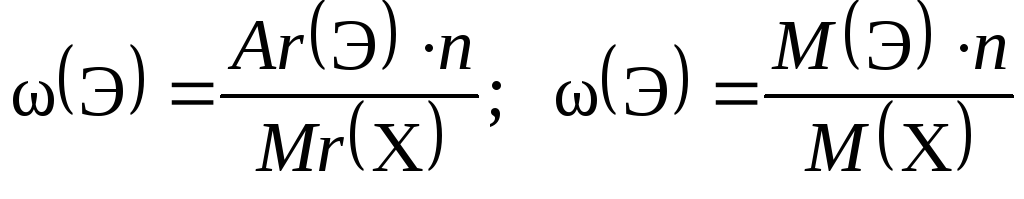
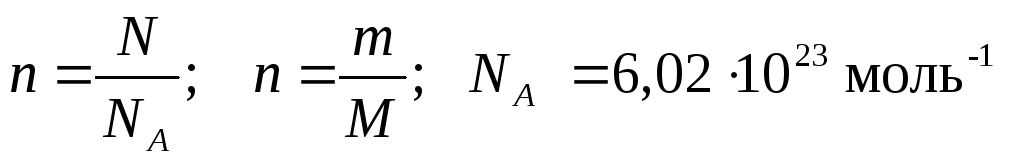
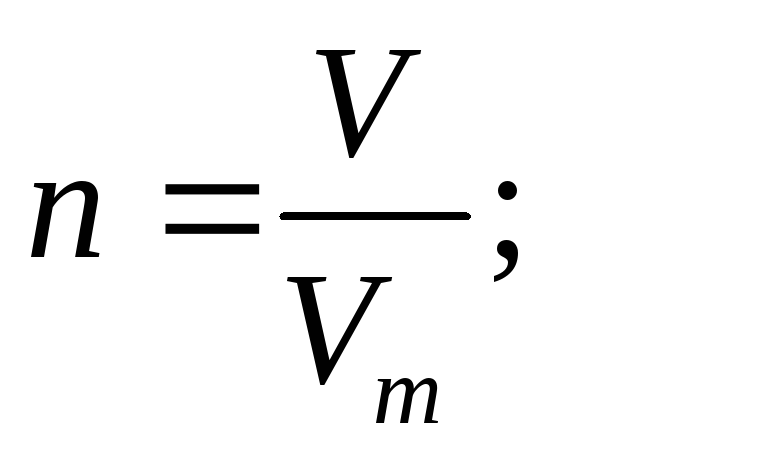 Vm = 22,4 л/моль (н.у.)
Vm = 22,4 л/моль (н.у.)